SINTESIS ZEOLIT DAN NANOKOMPOSIT ZEOLIT/TiO
2DARI ABU LAYANG DAN
WATERGLASS
SERTA UJI
ADSORPSI DAN FOTODEGRADASINYA
ADE EVAN ERVIANA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Sintesis Zeolit dan Nanokomposit Zeolit/TiO2 dari Abu Layang dan Waterglass serta Uji Adsorpsi
dan Fotodegradasinya adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, April 2013
Ade Evan Erviana
ABSTRAK
ADE EVAN ERVIANA. Sintesis Zeolit dan Nanokomposit Zeolit/TiO2 dari Abu Layang
dan Waterglass serta Uji Adsorpsi dan Fotodegradasinya. Dibimbing oleh SRI SUGIARTI
dan ETI ROHAETI.
Abu layang mengandung Si sebesar 20.74% dan Al 4.09%, sehingga memungkinkan untuk disintesis menjadi zeolit. Zeolit disintesis menggunakan metode peleburan pada suhu 550 °C, dan dilanjutkan hidrotermal pada suhu 90 °C selama 6 jam. Abu layang dilebur dengan padatan NaOH, dan waterglass dengan 5 ragam, yaitu 1.0 g diberi kode ZK1, ZK2 (1.5 g), ZK3 (2.5 g), ZK4 (5.0 g), dan ZK5 (7.5 g) pada suhu 550 °C selama 1 jam. Hasil karakterisasi menunjukkan bahwa zeolit yang dihasilkan adalah zeolit tipe P1. Zeolit ZK1 memiliki kristalinitas tertinggi (65%), sehingga komposisinya digunakan untuk menyintesis nanokomposit zeolit/TiO2. Hal ini bertujuan meningkatkan
karakter zeolit, terutama kemampuan adsorpsi-fotodegradasinya. Zeolit dan nanokomposit hasil sintesis kemudian diuji daya adsorpsinya. Hasil uji menunjukkan bahwa ZK1 memiliki kapasitas adsorpsi tertinggi, yaitu 147 mg/g. Adsorpsi dioptimisasi pada sampel ZK1 dan nanokomposit zeolit/TiO2 untuk membandingkan kemampuan adsorpsi dan
menentukan kondisi optimum. Konsentrasi optimum ZK1 ialah 400 ppm dengan bobot adsorben 0.02 g, dan waktu adsorpsi 3 jam. Nanokomposit zeolit/TiO2 memiliki
konsentrasi optimum sebesar 250 ppm, bobot adsorben 0.01 g, dan waktu adsorpsi selama 1 jam. Nanokomposit zeolit/TiO2 terbukti mampu mendegradasi biru metilena di bawah
radiasi sinar ultraviolet selama 6 jam pada =365 nm.
Kata kunci : abu layang, fotodegradasi, kapasitas adsorpsi, nanokomposit zeolit/TiO2,
zeolit.
ABSTRACT
ADE EVAN ERVIANA. Synthesis of Zeolite and Zeolite/TiO2 Nanocomposite from Fly
Ash and Waterglass and Their Adsorption and Photodegradation Tests. Supervised by SRI SUGIARTI and ETI ROHAETI.
Coal fly ash contains 20.74% Si and 4.09% Al, rendering its possibility to be synthesized to zeolite. Zeolite was synthesized by smelting at 550 °C, and continued with hydrothermal method at 90 °C for 6 hours. The weighed fly ash was melted with solid NaOH and various amounts of waterglass at 550 °C for 1 hour, which were coded ZK1 for 1.0 g of waterglass added, ZK2 (1.5 g), ZK3 (2.5 g), ZK4 (5.0 g), and ZK5 (7.5 g). The results indicated that the zeolite has the character as type P1. ZK1 zeolite had the highest crystallinity (65%), therefore it was used further to synthesize zeolit/TiO2 nanocomposite.
The nanocomposite was formed to improve the zeolite characters, especially adsorption-photodegradation capacity. The synthesized zeolite and the nanocomposite were tested for their adsorption capacities. The results showed that the ZK1 has the highest adsorption capacity, i.e. 147 mg/g. Optimization was performed on ZK1 and zeolit/TiO2
nanocomposite to compare their adsorption capacity and to determine their optimum conditions for adsorption. The optimum concentration of adsorbate that can be adsorbed by ZK1 was obtained at 400 ppm using 0.02 g adsorbent, with the adsorption time of 3 hours. Zeolite/TiO2 nanocomposite has optimum concentration of 250 ppm with the
weight of adsorbent of 0.01 g, and the adsorption time of 1 hour. The nanocomposite zeolite was able degrade methylene blue under ultraviolet radiation for 6 hours at =365 nm.
Keywords : adsorption capacity, fly ash, nanocomposite zeolite/TiO2, photodegradation,
SINTESIS ZEOLIT DAN NANOKOMPOSIT ZEOLIT/TiO
2DARI ABU LAYANG DAN
WATERGLASS
SERTA UJI
ADSORPSI DAN FOTODEGRADASINYA
ADE EVAN ERVIANA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Program Studi Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Sintesis Zeolit dan Nanokomposit Zeolit/TiO2 dari Abu Layang
dan Waterglass serta Uji Adsorpsi dan Fotodegradasinya
Nama : Ade Evan Erviana
NIM : G44080083
Disetujui oleh
Sri Sugiarti, PhD Dr Eti Rohaeti, MS
Pembimbing I Pembimbing II
Diketahui oleh
Prof Dr Ir Tun Tedja Irawadi, MS Ketua Departemen
PRAKATA
Bismillaahirrohmaanirrohiim
Alhamdulillah, puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala limpahan rahmat, hidayah, dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Sintesis Zeolit dan Nanokomposit Zeolit/TiO2 dari Abu Layang dan Waterglass serta Uji Adsorpsi dan
Fotodegradasinya”. Penelitian ini dilaksanakan dari tanggal 23 Mei 2012 sampai 9 Januari 2013 yang bertempat di Laboratorium Kimia Anorganik, Departemen Kimia, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Ibu Sri Sugiarti, Ph.D selaku pembimbing pertama dan Dr. Eti Rohaeti, MS. selaku pembimbing kedua atas semua bimbingan, dukungan, dan kerjasama yang telah diberikan kepada penulis selama penelitian dan penyusunan skripsi ini. Terima kasih kepada ayah, ibu, adik, serta keluarga atas segala doa dan kasih sayangnya. Terima kasih kepada Bapak Syawal, Bapak Sunarsa, Bapak Mulyadi, Bapak Ismail, dan Mbak Nurul yang telah membantu penulis dengan memfasilitasi penelitian di laboratorium.
Ungkapan terima kasih juga disampaikan kepada Kak Randi atas saran dan bantuannya, Nita Junitasari atas saran dan motivasinya selama ini, serta teman-teman kimia 45 yang telah meluangkan waktunya untuk menemani penulis ketika harus mengerjakan penelitian di malam hari.
Semoga karya ilmiah ini dapat bermanfaat. Terima kasih.
Bogor, April 2013
DAFTAR ISI
DAFTAR TABEL ix
DAFTAR GAMBAR ix
DAFTAR LAMPIRAN ix
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 3
METODE 3
Waktu dan Tempat Penelitian 3
Alat dan Bahan 3
Ruang Lingkup Penelitian 3
Sintesis Zeolit 3
Sintesis Nanokomposit Zeolit/TiO2 4
Uji Adsorpsi 5
Uji Fotodegradasi 6
HASIL DAN PEMBAHASAN 6
Abu Layang, Sintesis Zeolit dan Nanokomposit Zeolit/TiO2 6
Karakteristik Zeolit dan Nanokomposit Zeolit/TiO2 8
Adsorpsi Biru Metilena oleh Zeolit dan Nanokomposit 12
Isoterm Adsorpsi Zeolit dan Nanokomposit 15
Sifat Fotokatalisis Zeolit dan Nanokomposit Zeolit/TiO2 16
SIMPULAN DAN SARAN 18
Simpulan 18
Saran 19
DAFTAR PUSTAKA 19
LAMPIRAN 21
DAFTAR TABEL
1 Kode dan komposisi pembuatan zeolit. 4
2 Puncak-puncak utama pada abu layang dan penafsirannya 7
3 Puncak-puncak utama pada zeolit hasil sintesis 10
4 Nilai linearitas isoterm adsorpsi biru metilena oleh sampel 15
5 Nilai konstanta k dan Xm dari persamaan regresi Langmuir 16
DAFTAR GAMBAR
1 Struktur umum zeolit 2
2 Perbandingan difraktogram abu layang awal, kalsinasi, dan aktivasi 7
3 Perbandingan difraktogram ZK1, ZK3, dan ZK5 10
4 Perbandingan difraktogram ZK1 dan nanokomposit zeolit/TiO2 11
5 Morfologi permukaan (a) ZK1, (b) nanokomposit zeolit/TiO2 perbesaran
2500x, dan (c) zeolit P1 literatur 12
6 Perbandingan kapasitas adsorpsi ZK1, ZK3, ZK5, dan nanokomposit 13
7 Hasil pengujian bobot adsorben optimum ZK1 dan nanokomposit 14
8 Hasil pengujian waktu adsorpsi optimum ZK1 dan nanokomposit 14
9 Spektrum uji fotodegradasi tanpa penyinaran: BM (T1), BM+TiO2 (T2),
BM+ZK1 (T3), dan BM+NC (T4) 17
10 Spektrum uji fotodegradasi dengan penyinaran: BM (U1), BM+TiO2
(U2), BM+ZK1 (U3), dan BM+NC (U4) 17
11 (a) Endapan hasil fotodegradasi tanpa penyinaran, dan (b) Endapan hasil
fotodegradasi dengan penyinaran 18
DAFTAR LAMPIRAN
1 Bagan alir penelitian 21
2 Data SEM-EDX abu layang awal 22
3 Data SEM-EDX abu layang kalsinasi 23
4 Difraktogram sinar-X dan kristalinitas abu layang 24
5 Difraktogram standar Zeolit P1 berdasarkan JCPDS No. 39-0219 25 6 Difraktogram sinar-X dan kristalinitas dari zeolit dan nanokomposit
zeolit/TiO2 26
7 Data SEM-EDX ZK1 27
8 Data SEM-EDX nanokomposit zeolit/TiO2 28
9 Difraktogram dan kristalinitas ZK2 29
10 Uji adsorpsi zeolit dan nanokomposit zeolit/TiO2 hasil sintesis 30
11 Optimisasi bobot adsorben ZK1 dan nanokomposit zeolit/TiO2 34
12 Optimisasi waktu adsorpsi ZK1 dan nanokomposit zeolit/TiO2 36
PENDAHULUAN
Latar Belakang
Saat ini jumlah limbah abu layang batu bara (fly ash) yang dihasilkan dari proses pembakaran batu bara di Pembangkit Listrik Tenaga Uap (PLTU) sangat besar, termasuk di Indonesia. PLTU penghasil limbah abu layang batu bara di Indonesia adalah PLTU Paiton (Jawa Timur), PLTU Suralaya (Banten), dan PLTU Bukit Tinggi (Sumatera). Tahun 1996 PLTU Paiton dan Suralaya menghasilkan limbah abu layang batu bara sebesar hampir 1 juta ton/tahun (Mufrodi et al. 2010). Hasil penelitian tersebut menandakan bahwa semakin lama limbah abu layang ini semakin besar dan akan menimbulkan dampak pencemaran yang cukup berbahaya, sehingga diperlukan solusi yang tepat untuk mengatasinya.
Hasil analisis mineral abu layang dari pembangkit listrik Eddystone menunjukkan bahwa abu layang mengandung 65.42% SiO2, 28.23% Al2O3, 2.14%
Fe2O3, 0.64% Na2O, 0.26% K2O, 1.72% CaO, dan lainnya (Ti, Mg, P, oksida S)
sebesar 1.59%. Keberadaan komponen silika dan alumina memungkinkan abu layang untuk dapat disintesis menjadi material yang strukturnya mirip dengan zeolit (Chang dan Shih 1998). Adanya kemiripan komponen kimia antara abu layang dengan zeolit telah mendorong para peneliti untuk memanfaatkan abu layang sebagai bahan dasar sintesis zeolit.
Sintesis zeolit dari abu layang telah dilakukan dengan beberapa metode dan menghasilkan tipe zeolit yang berbeda-beda. Berdasarkan hasil penelitian Chang dan Shih (1998), zeolit P akan terbentuk dengan komposisi bobot abu layang/NaOH sebesar 1/1.2, suhu peleburan 550 °C, waktu penuaan pada suhu 90 °C selama 4 hari. Zeolit P akan terbentuk dengan proses peleburan dengan NaOH dan dengan perlakuan termal yang tinggi. Perlakuan termal yang rendah (60 °C) akan menghasilkan zeolit tipe Faujasit. Alasan terbentuknya zeolit P pada suhu tinggi dan zeolit Faujasit pada suhu rendah diduga berhubungan dengan proses kinetika reaksi. Zeolit P memiliki termodinamika yang lebih stabil dan memiliki bentuk yang stabil pada suhu tinggi. Penelitian ini menggunakan metode peleburan dengan NaOH dan reaksi hidrotermal (90 °C) untuk mendapatkan zeolit dengan kualitas yang baik. Selain itu, ditambahkan juga waterglass sebagai sumber silika lain untuk meningkatkan nisbah Si/Al zeolit hasil sintesis, sehingga dapat mengubah sifat zeolit menjadi kurang bersifat hidrofilik yang akan meningkatkan kemampuan adsorpsi zeolit terhadap senyawa yang bersifat nonpolar.
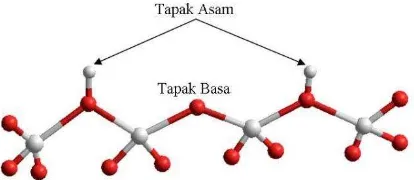
Zeolit adalah material kristal silika-alumina yang memiliki struktur penataan polimer tiga dimensi yang terdiri dari unit-unit tetrahedral SiO4 dan AlO4 yang
2
Gambar 1 Struktur umum zeolit
Zeolit merupakan adsorben yang sering digunakan untuk menghilangkan zat warna. Zeolit yang dihasilkan pada penelitian ini diaplikasikan sebagai adsorben untuk menghilangkan zat warna melalui metode adsorpsi. Zat warna yang digunakan, yaitu biru metilena. Biru metilena merupakan zat warna tekstil yang dapat mencemari lingkungan. Metode adsorpsi ternyata kurang efektif karena zat warna yang diadsorpsi tersebut akan terakumulasi di dalam adsorben yang pada akhirnya akan menimbulkan persoalan baru, seperti dihasilkannya fase baru yang mengandung polutan yang lebih terkonsentrasi, sehingga perlu dicari alternatif yang lebih efektif. Adsorpsi-fotodegradasi merupakan metode alternatif yang dapat digunakan untuk penanggulangan sebagian besar polutan zat warna.
Hediana (2011) telah berhasil menyintesis nanokomposit sodalit/TiO2 yang
memiliki kemampuan adsorpsi-fotodegradasi. Selain itu, nanokomposit sodalit/TiO2 yang dihasilkan ternyata memiliki kapasitas adsorpsi yang lebih besar
dibandingkan dengan sodalit. Nanokomposit adalah suatu bahan yang dibuat dari penggabungan antara dua komponen berbeda yang salah satu atau keduanya berskala ≤ 10-9 m atau setara dengan ukuran atom dan molekul. Titanium dioksida (TiO2) diketahui dapat mendegradasi limbah organik menjadi senyawa-senyawa
yang lebih ramah lingkungan, seperti H2O dan CO2 (Hagfeld dan Gratzel 1995).
Dengan demikian, nanokomposit zeolit/TiO2 yang disintesis diharapkan akan
memiliki kemampuan adsorpsi-fotodegradasi.
Tujuan Penelitian
Penelitian bertujuan menyintesis zeolit dan nanokomposit zeolit/TiO2 dari
abu layang dan waterglass, mempelajari karakteristik dari abu layang, zeolit, dan nanokomposit zeolit/TiO2 hasil sintesis menggunakan XRD dan SEM-EDX.
Selanjutnya menganalisis kapasitas adsorpsi dan isoterm adsorpsi dari zeolit dan nanokomposit zeolit/TiO2, serta melihat kemampuan nanokomposit zeolit/TiO2
Manfaat Penelitian
Penelitian ini memberikan informasi kemungkinan pemanfaatan limbah abu layang menjadi lebih bernilai ekonomis, yaitu zeolit dan nanokomposit zeolit/TiO2.
METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan dari tanggal 23 Mei 2012 sampai tanggal 9 Januari 2013 di Laboratorium Kimia Anorganik, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Alat dan Bahan
Analisis produk-produk hasil penelitian ini dilakukan menggunakan spektrofotometer UV-Vis UV 1700 Pharmaspec, difraktometer sinar-X Shimadzu XRD-7000 Maxima, dan SEM-EDX Bruker. Bahan-bahan yang digunakan adalah abu layang dari PLTU Suralaya-Banten, waterglass, padatan NaOH, HCl 3M, TiO2, dan biru metilena.
Ruang Lingkup Penelitian
Penelitian ini meliputi 5 tahapan percobaan (Lampiran 1), yaitu (1) penyiapan abu layang sebagai reagen bagi sintesis zeolit, diantaranya kalsinasi dan aktivasi, (2) sintesis zeolit dengan 5 ragam penambahan waterglass, yaitu 1.0, 1.5, 2.5, 5.0, dan 7.5 g, (3) sintesis nanokomposit zeolit/TiO2 berdasarkan komposisi
pembuatan zeolit yang memiliki kristalinitas tertinggi, (4) uji adsorpsi terhadap biru metilena dilakukan terhadap zeolit dan nanokomposit zeolit/TiO2 hasil sintesis
dan optimisasi adsorpsi 3 parameter adsorpsi, yaitu ragam konsentrasi, ragam bobot, dan ragam waktu adsorpsi dilakukan terhadap zeolit dengan kristalinitas tertinggi dan nanokomposit zeolit/TiO2, (5) uji fotodegradasi biru metilena
dilakukan terhadap zeolit dengan kristalinitas tertinggi dan nanokomposit zeolit/TiO2.
Sintesis Zeolit
4
dipanaskan di ruang asam selama 1 jam. Nisbah NaOH terhadap abu layang berdasarkan bobotnya adalah 1.2.
Abu layang yang sudah dikalsinasi dan diaktivasi kemudian dicampurkan dengan padatan NaOH dan waterglass dengan beberapa ragam bobot, seperti yang ditampilkan pada Tabel 1. Setiap campuran tersebut kemudian dipanaskan dalam tanur pada suhu 550 °C selama 1 jam. Campuran leburan yang dihasilkan kemudian didinginkan sampai suhu kamar, dimasukan ke dalam gelas piala, dan ditambah 50 mL aquades, lalu diaduk menggunakan pengaduk magnetik selama 18 jam. Tahap ini disebut proses penuaan. Setelah proses penuaan, campuran dimasukan ke dalam botol polipropilena dan dilanjutkan dengan proses hidrotermal pada suhu 90 °C selama 6 jam. Setelah itu, sampel dibilas dengan aquades hingga filtrat pencucian netral dan dikeringkan pada suhu 60 °C. Produk padatan yang diperoleh dikarakterisasi menggunakan XRD dengan kondisi operasi: atom target Cu, =1.5406, voltase 40 kV, arus 30 mA, dan daerah sudut
difraksi (2θ)μ 5-60°, serta SEM-EDX.
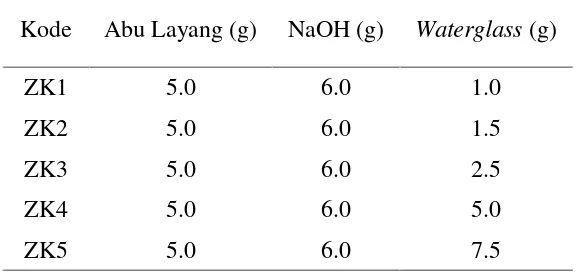
Tabel 1 Kode dan komposisi pembuatan zeolit
Kode Abu Layang (g) NaOH (g) Waterglass (g)
Keterangan: ZK1 = Zeolit Komposisi 1
Sintesis Nanokomposit Zeolit/TiO2
Nanokomposit zeolit/TiO2 dibuat dengan perbandingan 85% abu layang dan
15% TiO2 dari total bobot 5.0 g. Sampel abu layang ditimbang sebanyak 4.25 g,
lalu dimasukkan ke cawan porselen dan dikalsinasi pada suhu 800 °C selama 2 jam. Setelah dikalsinasi, sampel abu layang ditambah 100 mL HCl 3M kemudian dipanaskan di ruang asam selama 1 jam, lalu dicampurkan dengan 6.0 g padatan NaOH dan 1.0 g waterglass. Campuran tersebut kemudian dimasukan ke dalam tanur pada suhu 550 °C selama 1 jam. Campuran leburan yang dihasilkan kemudian didinginkan sampai suhu kamar, dimasukan ke dalam gelas piala, ditambah TiO2 sebanyak 0.75 g, dan ditambah 50 mL aquades, lalu diaduk
5
operasi: atom target Cu, =1.5406, voltase 40 kV, arus 30 mA, dan daerah sudut
difraksi (2θ)μ 5-60°, serta SEM-EDX.
Uji Adsorpsi (Modifikasi Hediana 2011)
Pembuatan Kurva Standar Biru Metilena
Larutan biru metilena dibuat pada berbagai konsentrasi, yaitu 0.5, 1.0, 1.5, 2.0, 2.5, dan 3.0 mg/L, kemudian diukur serapannya pada panjang gelombang 664.00 nm. Setelah itu, dibuat kurva hubungan antara konsentrasi dengan absorbans dan ditentukan persamaan linear. Persamaan linear ini digunakan untuk menghitung konsentrasi biru metilena pada filtrat setelah pengocokan biru metilena dalam zeolit dan nanokomposit zeolit/TiO2 hasil sintesis.
Penentuan Kapasitas Adsorpsi Biru Metilena
Larutan biru metilena dengan konsentrasi 100, 150, 200, 250, 300, 350, 400, 450, dan 500 mg/L sebanyak 15 mL disiapkan pada sembilan botol vial yang masing-masing telah diisi 20 mg zeolit atau nanokomposit zeolit/TiO2, kemudian
dikocok dengan shaker selama 2 jam. Setelah itu, campuran dipisahkan dengan sentrifusa, kemudian dilakukan pengukuran konsentrasi filtrat biru metilena pada panjang gelombang 664.00 nm. Kapasitas adsorpsi dihitung dengan persamaan berikut:
Keterangan:
Q = Kapasitas adsorpsi (mg/g)
V = Volume larutan (L)
Co = Konsentrasi awal (ppm)
Ca = Konsentrasi akhir (ppm)
m = Massa adsorben (g)
Penentuan Bobot Optimum untuk Adsorpsi
Sampel zeolit dengan kristalinitas tertinggi atau nanokomposit zeolit/TiO2
Penentuan Waktu Adsorpsi Optimum untuk Adsorpsi
Sampel zeolit dengan kristalinitas tertinggi atau nanokomposit zeolit/TiO2
ditimbang sesuai dengan bobot optimum yang diperoleh, kemudian ditambah 15 mL larutan biru metilena dengan konsentrasi optimum yang diperoleh. Setelah itu, campuran dikocok dengan shaker dengan waktu 1, 2, 3, 4, dan 5 jam, kemudian campuran dipisahkan dengan sentrifusa dan konsentrasi filtrat biru metilena diukur pada panjang gelombang 664.00 nm.
Uji Fotodegradasi (Hediana 2011)
Sampel zeolit dengan kristalinitas tertinggi, TiO2, dan nanokomposit
zeolit/TiO2 ditimbang sebanyak 100 mg, ditambah 15 mL larutan biru metilena
dengan konsentrasi 12.5 mg/L, kemudian diradiasi lampu UV pada panjang gelombang 365 nm selama 6 jam. Selain itu, disiapkan juga sampel tanpa diradiasi lampu UV (sampel disimpan di tempat gelap selama 6 jam) sebagai kontrol. Sampel tanpa diradiasi lampu UV diasumsikan tidak akan terjadi reaksi fotolisis pada biru metilena dan hanya berlangsung adsorpsi. Setelah perlakuan selama 6 jam, endapan dan filtratnya dipisahkan. Filtrat kemudian dipayar serapan maksimumnya dengan spektrofotometer UV-Vis pada panjang gelombang 200 sampai 700 nm dan dilakukan pengamatan secara visual terhadap endapan yang dihasilkan.
HASIL DAN PEMBAHASAN
Abu Layang, Sintesis Zeolit dan Nanokomposit Zeolit/TiO2
Bahan baku sintesis zeolit dan nanokomposit zeolit/TiO2 dalam penelitian
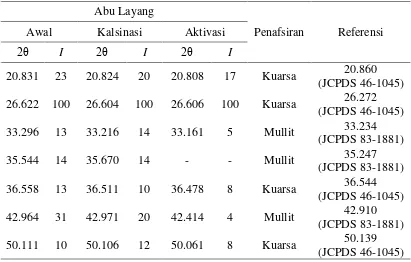
ini adalah abu layang dan waterglass. Hasil karakterisasi menggunakan SEM-EDX menunjukkan bahwa abu layang awal memiliki kadar Si sebesar 20.74% dan Al sebesar 4.09% (Lampiran 2). Hal ini terlihat dari difraktogram abu layang yang menunjukkan adanya senyawa silikon dan aluminium, yaitu terlihat puncak senyawaan kuarsa (SiO2) pada 2θ sekitar 20.831, 26.622, 36.558, 50.111 (Gambar
2) mengacu pada JCPDS No. 46-1045 (Tabel 2) dan mineral mullit (3Al2O3·2SiO2) ditandai dengan munculnya puncak pada sudut sekitar 33.296,
35.544, 42.964 mengacu pada JCPDS No. 83-1881 (Tabel 2), dan senyawa lain yang bersifat amorf. Proses kalsinasi abu layang bertujuan menghilangkan pengotor yang belum terbakar. Proses kalsinasi menyebabkan intensitas puncak kuarsa (SiO2) dan mullit (3Al2O3·2SiO2) menjadi meningkat (Gambar 2). Hasil
7
(Lampiran 4). Semakin meningkatnya kristalinitas disebabkan hilangnya pengotor-pengotor yang ada pada abu layang setelah proses kalsinasi.
Proses aktivasi abu layang bertujuan untuk melarutkan pengotor serta mengaktivasi zeolit dan meningkatkan daya jerap zeolit. Proses aktivasi dengan HCl 3M mengakibatkan terlarutnya komponen-komponen pengotor berupa logam. Terlarutnya logam pengotor mengakibatkan turunnya kristalinitas abu layang aktivasi menjadi 55.53% (Lampiran 4). Aktivasi juga menyebabkan semakin tingginya puncak kuarsa (SiO2) dan berkurangnya puncak mullit (3Al2O3·2SiO2)
(Gambar 2).
Gambar 2 Perbandingan difraktogram abu layang awal, kalsinasi, dan aktivasi
Tabel 2 Puncak-puncak utama abu layang dan penafsirannya Abu Layang
Penafsiran Referensi
Awal Kalsinasi Aktivasi
2θ I 2θ I 2θ I
20.831 23 20.824 20 20.808 17 Kuarsa 20.860
(JCPDS 46-1045)
26.622 100 26.604 100 26.606 100 Kuarsa 26.272
(JCPDS 46-1045)
33.296 13 33.216 14 33.161 5 Mullit 33.234
(JCPDS 83-1881)
35.544 14 35.670 14 - - Mullit 35.247
(JCPDS 83-1881)
36.558 13 36.511 10 36.478 8 Kuarsa 36.544
(JCPDS 46-1045)
42.964 31 42.971 20 42.414 4 Mullit 42.910
(JCPDS 83-1881)
50.111 10 50.106 12 50.061 8 Kuarsa 50.139
8
Proses peleburan bertujuan memudahkan abu layang, waterglass, dan padatan NaOH bereaksi. NaOH berperan sebagai aktivator selama peleburan untuk membentuk larutan silikat dan garam aluminium, serta berperan lebih jauh dalam pembentukan zeolit selama proses hidrotermal. Kation Na+ berperan penting dalam menstabilkan muatan pada struktur zeolit (Ojha et al. 2004). Adanya penambahan NaOH menyebabkan pH lebih dari 6, pada kondisi ini akan terbentuk anion Al(OH4)- atau AlO2- yang merupakan anion pembentuk zeolit yang berasal dari
sumber alumina. Apabila larutan dalam keadaan asam, maka spesies yang dominan adalah [Al(H2O)6]3+ yang akan menghambat pembentukan kerangka
aluminosilikat dari zeolit. Kerangka zeolit juga dipengaruhi oleh keberadaan anion dari silikat. Ketika pH lebih dari 12, maka akan terbentuk ion Si(OH)4- yang
merupakan ion utama dalam pembentukan kerangka zeolit (Hamdan 1992). Reaksi umum dalam proses sintesis zeolit (Ojha et al. 2004) :
NaOH + xAl2O3·ySiO2 Na2SiO3 + Na2AlO2
NaOH (aq) + Na2Al(OH)4 (aq) + Na2SiO3 (aq)
[Nax(AlO2)y(SiO2)z·NaOH·H2O] (gel) Nap[(AlO2)p(SiO2)q]·H2O
Proses penuaan berperan dalam proses pembentukan inti kristal zeolit, sedangkan proses hidrotermal berperan dalam proses kristalisasi zeolit. Pencucian zeolit hasil hidrotermal dengan aquades hingga pH netral bertujuan menghilangkan sisa NaOH yang tidak bereaksi serta menghilangkan material pengotor lain selain zeolit.
Bahan baku pembuatan nanokomposit zeolit/TiO2 menggunakan abu layang
dengan waterglass yang ditambah dengan TiO2. TiO2 dicampurkan pada saat
proses penuaan, sehingga tercampur secara sempurna dengan abu layang dan
waterglass. Tujuan penambahan TiO2, yaitu terbentuknya rongga baru yang
disebabkan adanya molekul TiO2 yang dapat menyelinap diantara struktur zeolit,
sehingga permukaan sisi aktif zeolit lebih besar dan diharapkan nanokomposit yang terbentuk memiliki kemampuan adsorpsi-fotodegradasi. Titanium oksida paling banyak digunakan sebagai material fotokatalis karena paling stabil, tahan terhadap korosi, memiliki sifat ampifilik, dan harganya relatif murah (Fatimah dan Wijaya 2005). TiO2 mampu mendegradasi limbah berupa zat warna.
Karakteristik Zeolit dan Nanokomposit Zeolit/TiO2
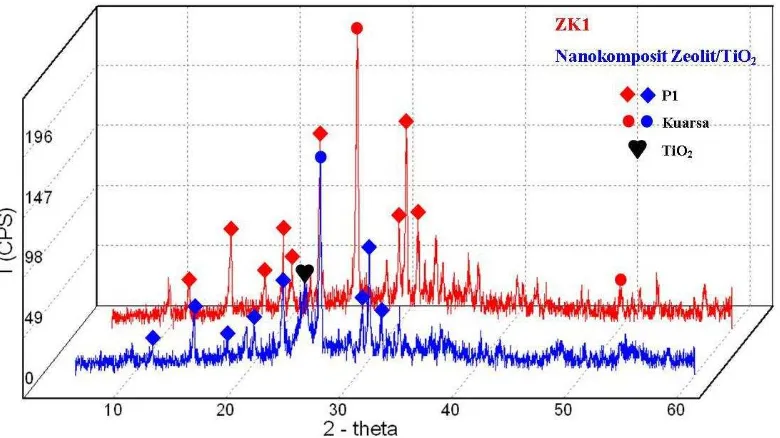
Difraktometer sinar-X merupakan salah satu alat yang dapat mengidentifikasi tingkat kristalinitas suatu bahan (WL. dan WH. Bragg 1993). Hasil karakterisasi sampel zeolit sintesis ZK1 menunjukkan bahwa jumlah puncak yang muncul lebih banyak dibandingkan dengan puncak pada abu layang, sehingga membuktikan bahwa telah terjadi reaksi pembentukan zeolit (Gambar 3). Puncak kuarsa (SiO2) masih terlihat pada difraktogram yang ditunjukkan dengan
adanya puncak di sekitar 2θ 20.808, 51.061, dan intensitas kuarsa yang paling
tinggi yaitu pada 2θ 26.606. Masih terlihatnya puncak-puncak kuarsa (SiO2) pada
difraktogram disebabkan kuarsa (SiO2) sulit bereaksi dan struktur kristalinnya
9
merupakan zeolit tipe P1 (Na6Al6Si10O32·12H2O) berdasarkan JCPDS no 39-0219
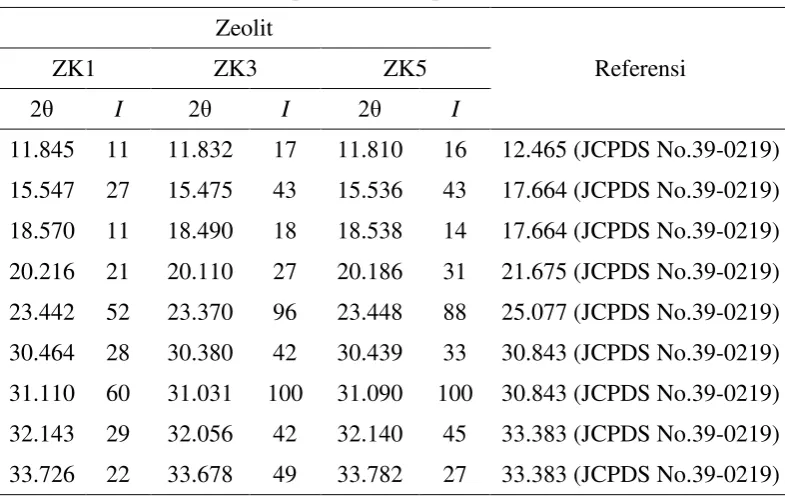
yang menunjukkan adanya pola difraktogram yang sama dengan standar Zeolit P1 (Tabel 3, Lampiran 5). Kristalinitas yang dimiliki oleh sampel zeolit ZK1, yaitu sebesar 64.68% (Lampiran 6).
Sampel zeolit ZK3 menunjukkan difraktogram yang hampir sama dengan sampel zeolit ZK1. Berdasarkan difraktogram tersebut sampel zeolit ZK3 juga menunjukkan pola difraksi yang sama dan memiliki karakteristik yang sama, yaitu zeolit P1 (Na6Al6Si10O32·12H2O) mengacu pada JCPDS no 39-0219 (Tabel 3,
Lampiran 5). Kristalinitas sampel zeolit ZK3, yaitu sebesar 53.59% ditampilkan pada Lampiran 6. Kristalinitas ZK3 lebih kecil dibandingkan dengan ZK1 disebabkan fase kristalin pada ZK3 lebih sedikit dibandingkan dengan fase amorf dan diduga penambahan waterglass yang lebih banyak dibandingkan ZK1 juga mempengaruhi turunnya kristalinitas zeolit ZK3.
Puncak-puncak yang muncul pada difraktogram sampel ZK5 hampir sama dengan ZK1 dan ZK3, sehingga ketiga sampel tersebut memiliki karakteristik dan tipe zeolit yang sama, yaitu zeolit tipe P1 (Na6Al6Si10O32·12H2O) berdasarkan
JCPDS no 39-0219 (Tabel 3, Lampiran 5). ZK5 memiliki kristalinitas yang paling rendah dibandingkan zeolit ZK1 dan ZK3, yaitu sebesar 37.58% (Lampiran 6). Hal ini menunjukkan bahwa penambahan waterglass dapat mempengaruhi kristalinitas zeolit, penambahan waterglass yang berlebihan akan menurunkan kristalinitas zeolit. Adanya pergeseran puncak-puncak utama pada ZK1, ZK3, dan ZK5 jika dibandingkan terhadap difraktogram standar Zeolit P1 diduga disebabkan masih adanya pengotor pada zeolit hasil sintesis (Tabel 3). Kristalinitas yang tinggi pada sampel ZK1 menjadi pertimbangan dalam pemilihan komposisi untuk sintesis nanokomposit zeolit/TiO2. Kristalinitas yang tinggi diharapkan dapat membentuk
kerangka nanokomposit zeolit/TiO2 yang kuat dan dapat meningkatkan kapasitas
adsorpsi dari nanokomposit zeolit/TiO2.
Zeolit hasil sintesis yang didapatkan ialah Zeolit P1, sedangkan Ojha et al.
10
Gambar 3 Perbandingan difraktogram ZK1, ZK3, dan ZK5
Tabel 3 Puncak-puncak utama pada zeolit hasil sintesis Zeolit
Referensi
ZK1 ZK3 ZK5
2θ I 2θ I 2θ I
11.845 11 11.832 17 11.810 16 12.465 (JCPDS No.39-0219)
15.547 27 15.475 43 15.536 43 17.664 (JCPDS No.39-0219)
18.570 11 18.490 18 18.538 14 17.664 (JCPDS No.39-0219)
20.216 21 20.110 27 20.186 31 21.675 (JCPDS No.39-0219)
23.442 52 23.370 96 23.448 88 25.077 (JCPDS No.39-0219)
30.464 28 30.380 42 30.439 33 30.843 (JCPDS No.39-0219)
31.110 60 31.031 100 31.090 100 30.843 (JCPDS No.39-0219)
32.143 29 32.056 42 32.140 45 33.383 (JCPDS No.39-0219)
33.726 22 33.678 49 33.782 27 33.383 (JCPDS No.39-0219)
Difraktogram hasil XRD nanokomposit zeolit/TiO2 menunjukkan pola
difraksi yang hampir sama dengan ZK1, akan tetapi terdapat puncak TiO2 di sekitar 2θ 25.345 (Gambar 4). Hal ini menunjukkan bahwa interkalasi TiO2 pada
struktur zeolit berhasil, serta mengindikasikan bahwa senyawa nanokomposit yang diinginkan telah terbentuk. Kristalinitas nanokomposit zeolit/TiO2 memiliki nilai
11
dibandingkan dengan ZK1 (64.68%). Hal ini menunjukkan fase amorf dari nanokomposit zeolit/TiO2 lebih besar dibandingkan dengan fase kristalinnya.
Gambar 4 Perbandingan difraktogram ZK1 dan nanokomposit zeolit/TiO2
ZK1 memiliki tekstur permukaan yang sedikit kasar seperti adanya butiran-butiran kecil yang menempel, berbentuk bulat (Gambar 5a). Ukuran partikel diduga sekitar 3.0 m dan terlihat seragam. Hasil analisis menggunakan SEM-EDX menunjukkan bahwa ZK1 memiliki rasio Si/Al sebesar 1.4 (Lampiran 7). Tekstur permukaan nanokomposit zeolit/TiO2 lebih kasar dibandingkan ZK1,
terlihat butiran-butiran kecil yang menempel lebih banyak (Gambar 5b). Hal ini diduga disebabkan adanya TiO2 yang membentuk agregat dalam nanokomposit
zeolit/TiO2. Apabila dibandingkan hasil SEM ZK1 dan nanokomposit zeolit/TiO2
dengan literatur, maka hasil SEM menunjukkan bahwa ZK1 dan nanokomposit zeolit/TiO2 adalah zeolit tipe P1 (Na6Al6Si10O32·12H2O) (Gambar 5). Berdasarkan
hasil analisis SEM-EDX, nanokomposit zeolit/TiO2 memiliki rasio Si/Al sebesar
1.4 dengan kadar Titanium sebesar 3.39% (Lampiran 8). Rasio Si/Al yang didapatkan merupakan rasio total, namun karena yang terbentuk adalah zeolit P1, seharusnya rasio Si/Al yang didapatkan lebih besar dari rasio Si/Al total. Hal ini menunjukkan bahwa pada kondisi reaksi ini kuarsa (SiO2) lebih mudah larut
12
(a) (b)
(c)
Gambar 5 Morfologi permukaan (a) ZK1, (b) nanokomposit zeolit/TiO2
perbesaran 2500x, dan (c) zeolit P1 literatur
Sampel ZK2 memiliki difraktogram yang hampir sama (Lampiran 9) dengan difraktogram ZK1, dan kristalinitas yang dihasilkan pun tidak berbeda jauh dengan kristalinitas ZK1, yaitu sebesar 63.63%. Berdasarkan puncak-puncak dengan intensitas tertinggi pada difraktogram ZK2 dan kemiripan difraktogram dengan ZK1, maka ZK2 termasuk zeolit tipe P1 mengacu pada JCPDS no 39-0219. Sampel ZK4 tidak dikarakterisasi menggunakan XRD dengan pertimbangan bahwa zeolit yang terbentuk diduga akan memiliki difraktogram yang hampir mirip dengan ZK3 dan ZK5 jika dilihat dari penambahan waterglass yang digunakan. Data yang diperoleh untuk sampel ZK4 ialah data rendemen sebesar 4.01 g. Berdasarkan pertimbangan di atas, maka sampel ZK2 dan ZK4 tidak dilakukan uji adsorpsi.
Adsorpsi Biru Metilena oleh Zeolit dan Nanokomposit
13
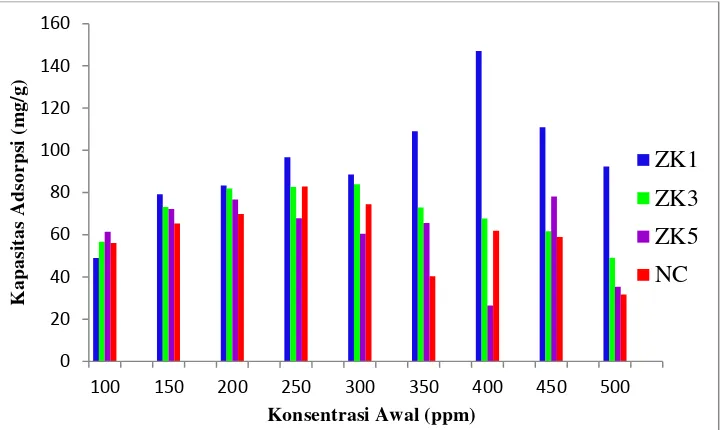
Lampiran 10). Konsentrasi 300 ppm dianggap optimum karena pada konsentrasi biru metilena 100-250 ppm mengalami kenaikan dan puncaknya pada 300 ppm memiliki kapasitas adsorpsi yang paling tinggi. Ketika konsentrasi biru metilena lebih dari 300 ppm diduga telah terjadi desorpsi, sehingga kapasitas adsorpsi menurun. Begitu juga dengan ZK5, diduga mengalami proses desorpsi biru metilena yang menyebabkan kapasitas adsorpsinya menurun, sehingga tapak aktif zeolit baru terisi penuh ketika konsentrasi 450 ppm.
Sampel ZK1 memiliki kapasitas adsorpsi paling tinggi, yaitu 147.13 mg/g dengan konsentrasi biru metilena optimum 400 ppm (Gambar 6, Lampiran 10). Kapasitas adsorpsi sampel ZK1 tertinggi jika dibandingkan dengan sampel lainnya. Kapasitas adsorpsi nanokomposit zeolit/TiO2 lebih kecil dibandingkan
ZK1, yaitu 82.85 mg/g dengan konsentrasi optimum 250 ppm (Gambar 6, Lampiran 10). Hal ini menunjukkan bahwa daya jerap ZK1 terhadap biru metilena lebih besar dibandingkan daya jerap nanokomposit zeolit/TiO2. Kapasitas adsorpsi
nanokomposit zeolit/TiO2 yang lebih kecil disebabkan kurang sempurnanya proses
interkalasi TiO2 diantara struktur zeolit, sehingga tidak membentuk pori yang lebih
besar yang dapat meningkatkan sisi aktif nanokomposit zeolit/TiO2. Selain itu,
diduga bahwa kurang sempurnanya interkalasi TiO2 telah menyebabkan penurunan
luas permukaan karena adanya agregasi TiO2, sehingga menutupi pori-pori
nanokomposit zeolit/TiO2 (Fatimah dan Wijaya 2005).
Gambar 6 Perbandingan kapasitas adsorpsi ZK1, ZK3, ZK5, dan nanokomposit
Hasil pengukuran sampel ZK1 dan nanokomposit zeolit/TiO2 menunjukkan
bahwa adsorpsi mencapai optimum dengan bobot masing-masing sebesar 20 mg dan 10 mg (Gambar 7, Lampiran 11). Kenaikan bobot setelah 20 mg untuk ZK1
100 150 200 250 300 350 400 450 500
14
Gambar 7 Hasil pengujian bobot adsorben optimum ZK1 dan nanokomposit
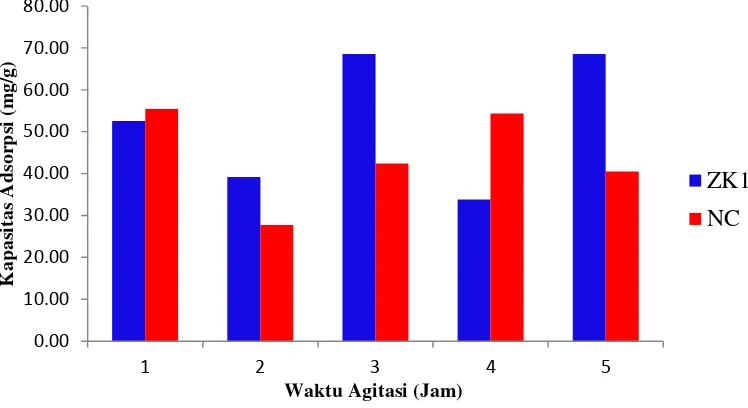
Hasil pengukuran waktu adsorpsi optimum pada ZK1 dan nanokomposit zeolit/TiO2 menunjukkan bahwa waktu adsorpsi yang berlebih dapat menyebabkan
molekul adsorbat yang terikat pada adsorben terlepas kembali, sehingga bisa menurunkan efektivitas adsorpsi. Waktu adsorpsi yang lebih lama tidak selalu diikuti dengan kenaikan kapasitas adsorpsi. Waktu adsorpsi optimum untuk sampel ZK1, yaitu selama 3 jam dan nanokomposit zeolit/TiO2 selama 1 jam
(Gambar 8, Lampiran 12). Waktu adsorpsi nanokomposit zeolit/TiO2 yang lebih
kecil, menunjukkan bahwa tapak aktif terisi lebih cepat oleh biru metilena, sehingga diduga pori yang terbentuk lebih kecil dibandingkan dengan pori-pori ZK1. Menurut Fatimah dan Wijaya (2005), diduga terjadi agregasi TiO2 pada
permukaan padatan, sehingga dapat menutupi pori-pori pada nanokomposit zeolit/TiO2. Nilai kapasitas adsorpsi dari sampel ZK1 dan nanokomposit
zeolit/TiO2 cenderung fluktuasi seiring dengan bertambahnya waktu adsorpsi.
Gambar 8 Hasil pengujian waktu adsorpsi optimum ZK1 dan nanokomposit
0.00
0.01 0.02 0.03 0.04 0.05 0.06
15
Isoterm Adsrorpsi Zeolit dan Nanokomposit
Tipe isoterm adsorpsi dapat digunakan untuk mempelajari mekanisme penjerapan. Adsorpsi fase cair-padat pada umumnya mengacu pada jenis isoterm Langmuir dan Freundlich (Atkins 1999). Isoterm adsorpsi adalah hubungan yang menunjukkan distribusi adsorben antara fase teradsorpsi pada permukaan adsorben dengan fase ruah saat kesetimbangan pada temperatur tertentu. Penelitian ini termasuk jenis adsorpsi fase cair-padat, sehingga adsorpsinya diuji dengan persamaan isoterm Langmuir dan Freundlich.
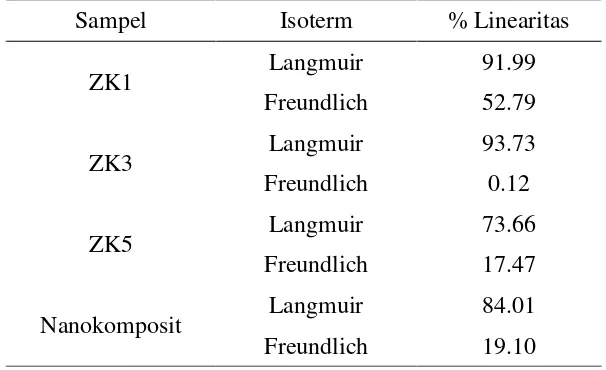
Berdasarkan kelinieritasannya, adsorpsi biru metilena oleh sampel zeolit maupun nanokomposit zeolit/TiO2 mengikuti tipe Isoterm Langmuir yang
ditunjukkan pada Tabel 4 (Lampiran 13). Hal ini berarti permukaan zeolit maupun nanokomposit zeolit/TiO2 bersifat homogen, sehingga proses adsorpsi terjadi
melalui mekanisme yang sama dan membentuk satu lapisan tunggal (monolayer) saat adsorpsi maksimum.
Tabel 4 Nilai linearitas isoterm adsorpsi biru metilena oleh sampel
Sampel Isoterm % Linearitas
ZK1 Langmuir 91.99
Nanokomposit Langmuir 84.01
Freundlich 19.10
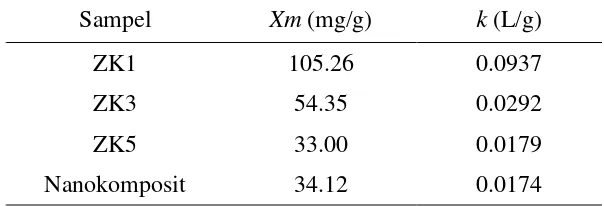
Berdasarkan tipe adsorpsi yang diperoleh yaitu Isoterm Langmuir, maka dapat ditentukan nilai Xm dan k dari persamaan regresi Langmuir masing-masing sampel (Tabel 5). Nilai Xm menggambarkan jumlah adsorbat yang dijerap oleh permukaan adsorben. Nilai k merupakan konstanta yang bertambah dengan kenaikan ukuran molekuler yang menunjukkan kekuatan ikatan molekul adsorbat pada permukaan adsorben. Hasil pengujian menunjukkan bahwa nilai Xm yang paling besar, yaitu ZK1. Hal ini berbanding lurus dengan kapasitas adsorpsinya yang tinggi. Semakin tinggi nilai Xm, maka kapasitas adsorpsinya semakin tinggi pula, serta semakin banyak jumlah biru metilena yang dijerap oleh sampel. Molekul biru metilena lebih kuat terikat pada sampel ZK1 dibandingkan dengan sampel zeolit lain dan nanokomposit zeolit/TiO2. Apabila dibandingkan dengan
nanokomposit zeolit/TiO2, perbedaan nilai k ini dapat disebabkan adanya TiO2
yang terikat pada nanokomposit zeolit/TiO2, sehingga menyebabkan interaksi
antara biru metilena dengan nanokomposit zeolit/TiO2 berkurang (Widiyanti
16
Nanokomposit 34.12 0.0174
Sifat Fotokatalisis Zeolit dan Nanokomposit Zeolit/TiO2
Hasil pengukuran spektrum dari larutan biru metilena (T1) dan sisa pengocokkan dengan TiO2 (T2) (Gambar 9) serta larutan biru metilena setelah
penyinaran (U1) (Gambar 10) menunjukkan karakteristik puncak khas dari biru metilena, yaitu pada =664 nm. Hal ini menunjukkan bahwa tidak terjadi proses adsorpsi dan fotodegradasi karena masih adanya kandungan biru metilena pada filtrat. Spektrum U2 (filtrat pengocokan biru metilena dengan TiO2 dan penyinaran
UV) memperlihatkan adanya penurunan intensitas puncak serapan pada =664 nm, artinya telah terjadi proses fotodegradasi biru metilena oleh TiO2 dengan bantuan
sinar ultraviolet.
Mekanisme fotodegradasi diawali dengan adanya loncatan elektron dari pita valensi ke vita konduksi pada logam semikonduktor, jika dikenai energi foton. Loncatan elektron ini menyebabkan timbulnya lubang elektron yang dapat
berinteraksi dengan air membentuk radikal hidroksida (•OH) yang merupakan
oksidator kuat. Elektron pada pita konduksi akan bereaksi dengan oksigen di
lingkungan menghasilkan radikal superoksida (•O2-) yang bersifat sebagai
reduktor. Radikal bersifat aktif dan dapat terus terbentuk sehingga bereaksi dan menguraikan senyawa organik target (Fatimah dan Wijaya 2005). Mekanisme reaksi yang terjadi pada proses fotodegradasi dengan TiO2 adalah sebagai berikut:
TiO2 + UV → TiO2 (e- + h-)
TiO2 (h+) + H2O → TiO2 + HO* + H
TiO2 (e-) + O2 → TiO2 + O2
-Dye + O2-* → Produk degradasi
Berdasarkan spektrum T3 dan U3 terlihat bahwa puncak khas dari biru metilena hilang, begitu juga dengan spektrum T4 dan U4. Hilangnya puncak khas
biru metilena pada =664 nm menunjukkan bahwa kandungan biru metilena dalam
filtrat sudah tidak ada. Hilangnya biru metilena pada spektrum tanpa penyinaran dan dengan penyinaran ultraviolet menunjukkan bahwa proses adsorpsi oleh ZK1 dan nanokomposit zeolit/TiO2 sangat tinggi, sehingga proses terjadinya
fotodegradasi sulit diamati melalui perubahan spekrum UV-Vis. Selanjutnya untuk mengetahui terjadinya proses fotodegradasi pada sampel ZK1 dan nanokomposit zeolit/TiO2 dilakukan dengan mengamati endapan yang dihasilkan, seperti yang
17
Gambar 9 Spektrum uji fotodegradasi tanpa penyinaran: BM (T1), BM+TiO2 (T2),
BM+ZK1 (T3), dan BM+NC (T4)
Gambar 10 Spektrum uji fotodegradasi dengan penyinaran: BM (U1), BM+TiO2
(U2), BM+ZK1 (U3), dan BM+NC (U4)
Perubahan warna pada endapan (adsorben) setelah pengocokkan merupakan salah satu indikator terjadinya fotodegradasi. Endapan berwarna biru menunjukkan bahwa pada sistem hanya terjadi proses adsorpsi, sedangkan bila endapan berwarna putih, maka pada sistem tidak terjadi adsorpsi atau terjadi proses adsorpsi yang diikuti fotodegradasi. Endapan ZK1 dan nanokomposit zeolit/TiO2
tanpa penyinaran ultraviolet terlihat memiliki warna biru yang sangat pekat (Gambar 11a). Hal ini menunjukkan bahwa pada sistem hanya terjadi proses adsorpsi biru metilena. Hasil uji fotodegradasi dengan penyinaran menunjukkan bahwa endapan TiO2 berwarna putih (Gambar 11b). Hal ini membuktikan bahwa
(Gambar 11), sehingga ZK1 dinyatakan hanya mengalami proses adsorpsi tanpa adanya fotodegradasi. Endapan nanokomposit zeolit/TiO2 dengan penyinaran
ultraviolet (Gambar 11b) berwarna biru lebih pudar dibandingkan endapan nanokomposit zeolit/TiO2 tanpa penyinaran (Gambar 11a), sehingga diduga
perubahan warna tersebut menunjukkan bahwa nanokomposit zeolit/TiO2 memiliki
kemampuan adsorpsi sekaligus mendegradasi biru metilena menjadi senyawa yang lebih sederhana.
(a)
(b)
Gambar 11 (a) Endapan hasil fotodegradasi tanpa penyinaran dan (b) Endapan hasil fotodegradasi dengan penyinaran
SIMPULAN DAN SARAN
Simpulan
Hasil karakterisasi menunjukkan bahwa zeolit hasil sintesis dengan komposisi abu layang 5.0 g, NaOH 6.0 g, dan penambahan waterglass sebanyak 1.0, 2.5, dan 7.5 g adalah zeolit P1. Zeolit dengan kristalinitas paling tinggi (65%) diperoleh pada penambahan waterglass sebanyak 1.0 g (ZK1). Nanokomposit zeolit/TiO2 berhasil disintesis pada komposisi abu layang 4.25 g, NaOH 6.0 g,
waterglass 1.0 g, dan TiO2 0.75 g. Adsorpsi terhadap biru metilena oleh ZK1
diperoleh pada kondisi optimum konsentrasi sebesar 400 ppm, bobot adsorben 0.02 g, dan waktu adsorpsi selama 3 jam, sedangkan nanokomposit zeolit/TiO2
selama 1 jam. Kapasitas adsorpsi terbesar dimiliki oleh sampel ZK1, yaitu sebesar 147 mg/g, sehingga ZK1 memiliki kemampuan adsorpsi yang lebih baik dibandingkan nanokomposit. Isoterm adsorpsi sampel zeolit dan nanokomposit mengikuti Isoterm Langmuir. Nanokomposit zeolit/TiO2 terbukti memiliki
kamampuan mendegradasi biru metilena di bawah radiasi sinar ultraviolet dengan panjang gelombang 365 nm selama 6 jam.
Saran
Perlu diragamkan waktu penuaan untuk melihat efek penambahan
waterglass terhadap lamanya waktu penuaan. Optimisasi adsorpsi sebaiknya menggunakan metode full factorial sehingga didapatkan hasil yang lebih efektif dan lebih terintegrasi. Selain itu, perlu dilakukan optimisasi konsentrasi, bobot, dan waktu penyinaran untuk uji fotodegradasi, sehingga hasil yang didapatkan lebih baik.
DAFTAR PUSTAKA
Atkins PW. 1999. Kimia Fisik. Irma IK, penerjemah. Jakarta (ID): Erlangga. Terjemahan dari: Physical Chemistry.
Bragg WH, Bragg WL. 1993. The reflection of X-rays by crystals. Proc R Soc Lond. 88:428-438.
Breck DW. 1974. Zeolite Molecular Sieve: Structure Chemistry and Use. New York (US): Wiley.
Chang HL, Shih WH. 1998. A general methods for the conversion of fly ash into zeolites as ion exchangers for Cesium. Ind Eng Chem Res. 37(1):71-78. Fatimah Is, Wijaya K. 2005. Sintesis TiO2/zeolit sebagai fotokatalis pada
pengolahan limbah cair industri tapioka secara adsorpsi-fotodegradasi.
Teknoin 10(4):257-267.
Hamdan H. 1992. Introduction to zeolites: synthesis, characterization, and modification. Universitas Teknologi Malaysia, Kuala Lumpur.
Hediana N. 2011. Sintesis, pencirian, dan uji fotodegrgadasi nanokomposit sodalit/TiO2 terhadap zat warna biru metilena [skripsi]. Bogor (ID): Fakultas
Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Hagfeldt A, Gratzel M. 1995. Light induced redox reactions in nanocrystalline systems. Chem. Rev. 95:49–68.
Mufrodi Z, Sutrisno B, Hidayat A. 2010. Modifikasi limbah abu layang sebagai material baru adsorben. Di dalam: Pengembangan Teknologi Kimia untuk Pengolahan Sumber Daya Alam Indonesia. Prosiding Seminar Nasional
Teknik Kimia “Kejuangan”; Yogyakarta, 26 Januari 2010.
20
Conference; Pretoria, 19-23 Oktober 2009. Pretoria: Document Transformation Technologies cc. hlm 680-687.
Ojha K, Narayan CP, Amar NS. 2004. Zeolite from fly ash: Synthesis and characterization. Bull Master Sci. 6(27):555-564.
Rongsayamanont C, Sopajaree K. 1997. Modification of synthetic zeolite pellets from lignite fly ash A: the pelletization. Di dalam: World of Coal Ash (WOCA), Northern Kentucky, 7-10 Mei 2007. Northern Kentucky (US):
World of Coal Ash (WOCA).
Widiyanti E. 2011. Sintesis nanokomposit alofan/TiO2 dan uji fotodegradasi pada
21
Lampiran 1 Bagan alir penelitian.
Abu Layang
Sintesis nanokomposit zeolit/TiO2 (85% abu layang dan 15% TiO2 dari bobot total 5.0 g)
Karakterisasi dengan XRD dan SEM-EDX
Karakterisasi dengan XRD dan SEM-EDX
Sintesis Zeolit
22
23
24
Lampiran 4 Difraktogram sinar-X dan kristalinitas abu layang.
(a)
(b)
(c)
Keterangan:
25
26
Lampiran 6 Difraktogram sinar-X dan kristalinitas dari zeolit dan nanokomposit zeolit/TiO2.
(a)
(b)
(c)
(d)
Keterangan: (a). ZK1 (b). ZK3 (c). ZK5
27
28
29
Lampiran 9 Difraktogram dan kristalinitas ZK2
Difraktogram ZK2
30
Lampiran 10 Uji adsorpsi zeolit dan nanokomposit zeolit/TiO2 hasil sintesis.
a. ZK1
Ca = Konsentrasi akhir (ppm)
31
Ca = Konsentrasi akhir (ppm)
32
Ca = Konsentrasi akhir (ppm)
33
Ca = Konsentrasi akhir (ppm)
34
Lampiran 11 Optimisasi bobot adsorben ZK1 dan nanokomposit zeolit/TiO2.
a. ZK1
Ca = Konsentrasi akhir (ppm)
35
Ca = Konsentrasi akhir (ppm)
36
Lampiran 12 Optimisasi waktu adsorpsi ZK1 dan nanokomposit zeolit/TiO2.
a. ZK1
Ca = Konsentrasi akhir (ppm)
37 *Persamaan garis kurva standar biru metilena untuk waktu agitasi 4 jam:
y = 0.0964x – 0.0141 ; R2 = 0.9987
Ca = Konsentrasi akhir (ppm)
38
Lampiran 13 Isoterm adsorpsi zeolit dan nanokomposit zeolit/TiO2 hasil sintesis
a. ZK1
Cawal *Cakhir Cteradsorpsi m Isoterm Langmuir Isoterm Freundlich
39
Lampiran 13 Lanjutan
Persamaan garis Isoterm Langmuir yang dihasilkan: y = 0.0095x + 0.1014 dengan R2 = 0.9199. Maka dari persamaan:
,
diperoleh nilai Xm = 105.2632 dan k = 0.0937
b. ZK3
Cawal *Cakhir Cteradsorpsi M Isoterm Langmuir Isoterm Freundlich
(mg/L) (mg/L) (mg/L) (g) x* (g) x/m
0.00 0.50 1.00 1.50 2.00 2.50 3.00
40
Lampiran 13 Lanjutan
Persamaan garis Isoterm Langmuir yang dihasilkan: y = 0.0184x – 0.6306 dengan R2 = 0.9373. Maka dari persamaan:
0.00 100.00 200.00 300.00 400.00 500.00
c/(
0.00 0.50 1.00 1.50 2.00 2.50 3.00
41
Lampiran 13 Lanjutan
c. ZK5
Cawal *Cakhir Cteradsorpsi m Isoterm Langmuir Isoterm Freundlich
(mg/L) (mg/L) (mg/L) (g) x* (g) x/m
0.00 100.00 200.00 300.00 400.00 500.00
42
Lampiran 13 Lanjutan
Persamaan garis Isoterm Langmuir yang dihasilkan: y = 0.0303x – 1.6953 dengan R2 = 0.7366. Maka dari persamaan:
,
diperoleh nilai Xm = 33.0033 dan k = 0.0179
d. Nanokomposit zeolit/TiO2
Cawal *Cakhir Cteradsorpsi m Isoterm Langmuir Isoterm Freundlich
(mg/L) (mg/L) (mg/L) (g) x* (g) x/m
0.00 0.50 1.00 1.50 2.00 2.50 3.00
43
Lampiran 13 Lanjutan
Persamaan garis Isoterm Langmuir yang dihasilkan: y = 0.0293x + 1.6849 dengan R2 = 0.8401 Maka dari persamaan:
0.00 100.00 200.00 300.00 400.00 500.00
C
0.00 0.50 1.00 1.50 2.00 2.50 3.00
RIWAYAT HIDUP
Penulis dilahirkan di Majalengka pada tanggal 26 Agustus 1989 dari pasangan Bapak Suha dan Ibu Suwanti. Penulis adalah anak pertama dari dua bersaudara. Tahun 2008 penulis lulus dari SMA Negeri 1 Majalengka dan pada tahun yang sama penulis lolos seleksi masuk Institut Pertanian Bogor melalui jalur Undangan Saringan Masuk IPB (USMI) dan diterima di Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.