FAK
Lact
KULTAS M
tobacillus
LAI
DEPA
MATEMAT
INSTITU
delbrueck
ITA NUR
ARTEMEN
TIKA DAN
UT PERTA
BOGO
2012
kii
subsp.
RJANNAH
N BIOKIM
ILMU PEN
ANIAN BO
OR
2
bulgaricu
H
MIA
NGETAHU
OGOR
us
ABSTRAK
LAITA NURJANNAH. Tetes Tebu sebagai Alternatif Sumber Karbon untuk
Produksi Asam Laktat oleh
Lactobacillus delbrueckii
subsp
. bulgaricus.
Dibimbing oleh SURYANI dan SUMINAR SETIATI ACHMADI.
Production by
Lactobacillus delbrueckii
subsp.
bulgaricus
. Supervised by
SURYANI and SUMINAR SETIATI ACHMADI.
TETES TEBU SEBAGAI ALTERNATIF SUMBER KARBON
UNTUK PRODUKSI ASAM LAKTAT OLEH
Lactobacillus delbrueckii
subsp.
bulgaricus
LAITA NURJANNAH
G84080030
Skripsi
sebagai salah satu syarat memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
NIM
: G84080030
Disetujui
Komisi Pembimbing
Dr. Suryani, SP, M.Sc.
Ketua
Prof. Suminar Setiati Achmadi, PhD.
Anggota
Diketahui
Dr.Ir. I Made Artika, M.App.Sc
Ketua Departemen Biokimia
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segala
rahmat, berkah, dan karunia-Nya sehingga penulis dapat menyelesaikan penelitian
dan penulisan skripsi ini. Shalawat serta salam semoga tercurah kepada Nabi
Muhammad SAW, keluarga, sahabat, dan para pengikutnya hingga akhir zaman.
Penelitian ini berjudul Tetes Tebu sebagai Alternatif Sumber Karbon untuk
Produksi Asam Laktat oleh
Lactobacillus delbrueckii
subsp.
bulgaricus.
Kegiatan
penelitian yang merupakan salah satu syarat memperoleh gelar Sarjana Sains pada
Departemen Biokimia ini dilakukan dari bulan Januari hingga April 2012,
bertempat di Laboratorium Departemen Biokimia, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Dr. Suryani, M.Sc sebagai dosen
pembimbing utama dan Prof. Suminar Setiati Achmadi, PhD. sebagai
pembimbing kedua yang banyak memberi bimbingan dan arahan kepada penulis
dalam melakukan penulisan dan penelitian. Ucapan terima kasih juga penulis
sampaikan kepada teman-teman Biokimia dan semua teknisi laboratorium yang
telah membantu dalam melakukan penelitian. Tak lupa penulis sampaikan juga
terima kasih juga kepada ayah, ibu, dan seluruh keluarga yang senantiasa memberi
dukungan serta doa. Semoga hasil penelitian ini dapat memberi manfaat bagi
kemajuan ilmu pengetahuan.
Bogor, April 2012
28 Januari 1989 dari ayah bernama Yayan Suhyar Rukmana dan ibu bernama
Rumsiti Ratnawati. Penulis merupakan anak tunggal.
Pendidikan penulis dimulai dari SDN Ibu Dewi VI, kemudian melanjutkan
pendidikan ke jenjang Sekolah Menengah Pertama di SMP Negeri 1 Cianjur.
Tahun 2008 penulis menyelesaikan pendidikan Sekolah Menengah Atas di SMA
Negeri 1 Cianjur dan pada tahun yang sama lolos seleksi masuk IPB melalui jalur
USMI. Penulis mengambil mayor Biokimia, di Departemen Biokimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor (IPB).
Selama mengikuti perkuliahan penulis aktif dalam kegiatan organisasi
kemahasiswaan di IPB dan organisasi mahasiswa daerah, diantaranya menjadi
anggota UKM Forces (Forum for Scientific Studies) pada tahun 2008-2012,
anggota UKM IAAS (International Association of Students in Agricultural and
Related Sciences) pada tahun 2008-2012, Sekretaris Himpunan Mahasiswa
Cianjur pada tahun 2009, Badan Pengawas Himpunan Mahasiswa Biokimia pada
tahun 2009, dan Ketua Green Environment Biochemist Community pada tahun
2010.
Penulis juga pernah aktif dalam beberapa kepanitiaan seperti panitia IAAS
Olympic 2008 dan 2009, Lomba Karya Ilmiah Populer 2009, Round Table
Discussion 2009, Masa Perkenalan Kampus Mahasiswa Biokimia 2010, dan
Sikrab Endorfin 2012. Pada tahun 2011 penulis melakukan praktik lapangan di
Laboratorium Rekayasa Protein dan Bioproses, Pusat Penelitian
Bioteknologi-LIPI Jalan Raya Bogor KM.46, Cibinong 16911 Bogor dengan judul “Isolasi
Plasmid pPICZ
α
-B dan pAF-ScFv-101 untuk Ekspresi Protein Rekombinan pada
Pichia pastoris”
.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ...
1
TINJAUAN PUSTAKA
Lactobacillus delbrueckii
subsp.
bulgaricus
... 1
Tetes Tebu ... 2
Fermentasi Asam Laktat ...
3
Faktor-Faktor yang Mempengaruhi Pertumbuhan Mikrob ... 3
Asam Laktat ... 4
Kromatografi Cair Kinerja Tinggi ... 5
BAHAN DAN METODE
Alat dan Bahan.... ...
5
Metode ...
6
HASIL DAN PEMBAHASAN
Hasil Hidrolisis, Uji Kualitatif Gula Pereduksi, dan Gula Total
Tetes Tebu .... ...
7
Penentuan Kurva Pertumbuhan
L. delbrueckii
subsp
. bulgaricus
...
8
Pola Penurunan Gula Sisa selama Fermentasi ... 10
Pola Produksi Kadar Asam Laktat dan Penurunan pH selama Fermentasi 11
Ekstraksi dan Analisis Kualitatif Asam Laktat dengan KCKT ... 12
SIMPULAN DAN SARAN
Simpulan
...
12
Saran ... 12
DAFTAR PUSTAKA ... 12
1
Lactobacillus delbrueckii
subsp.
bulgaricus
...
2
2
Struktur kimia asam laktat ...
4
3
Uji Selliwanof, uji Barfoed, dan uji Benedict ...
8
4
Kurva pertumbuhan
L.delbrueckii
subsp.
bulgaricus
dalam MRS cair dan
media MRS cair yang ditambah 0.5% tetes tebu pada suhu 42°C dan
agitasi 150 rpm ...
9
5
Hubungan kurva pertumbuhan bakteri (media MRS cair yang ditambah
0.5% tetes tebu) dengan kadar asam laktat ... 9
6
Pola penurunan gula sisa selama fermentasi dalam MRS
cair yang ditambah
0.5% tetes tebu pada suhu 42°C dan agitasi 150 rpm ... 10
7
Hubungan antara kadar asam laktat dengan gula total sisa selama
fermentasi pada media yang ditambahkan 0.5% tetes tebu, suhu 42 °C
dan agitasi 150 rpm ... 10
8
Hubungan antara kadar asam laktat dengan nilai pH selama fermentasi ... 12
DAFTAR LAMPIRAN
Halaman
1
Strategi penelitian ... 16
2
Analisis gula total tetes tebu ... 17
3
Diagram alir proses produksi asam laktat ... 18
1
PENDAHULUAN
Asam laktat merupakan senyawa antara yang penting dan memiliki potensi besar untuk aplikasi produk baru seperti plastik ramah lingkungan atau plastik biodegradabel (PLA), bahan polimer untuk aplikasi bidang farmasi dan kedokteran, serta mengatur pertumbuhan tanaman (Koesnandar 2004).
Asam laktat dibutuhkan pada industri pembuatan plastik biodegradabel. Pembuatan plastik yang biodegradabel sangat diperlukan untuk mengurangi pencemaran lingkungan, terlebih lagi dengan adanya peningkatan sampah plastik. Fakta lain juga menyebutkan bahwa setiap tahun penduduk dunia menggunakan 500 miliar kantong plastik. Perhitungan statistika menunjukkan bahwa dihasilkan satu juta kantong plastik tiap menitnya. Sampah plastik dari sektor pertanian telah mencapai 100 juta ton, sehingga tidak tertutup kemungkinan bahwa bumi akan terbungkus sampah plastik sebanyak sepuluh kali lipat (Toshi 2003). Kini, kesadaran penduduk dunia pada lingkungan semakin meningkat seiring meningkatnya masalah lingkungan yang timbul akibat kegiatan manusia sehari-hari. Salah satu sumber indikator tersebut adalah meningkatnya jumlah produk bioplastik dari tahun ke tahun. Data dari Badan Pusat Statistik (BPS) yang dikutip oleh Pranamuda (2001) menyebutkan bahwa produksi bioplastik diproyeksikan akan mencapai 1200000 ton atau menjadi 1/10 dari total produksi bahan plastik pada tahun 2010. Jumlah ini meningkat seribu kali dari produksi bioplastik pada tahun 1999, yaitu 2500 ton atau 1/10000 kali dari produksi bahan plastik.
Perkembangan ilmu pengetahuan dan teknologi menghasilkan bahan-bahan plastik yang bersifat biodegradabel seperti kolagen, kasein, protein dan lipid yang berasal dari hewan dan tumbuhan (Utari et al. 2008). Akan tetapi, bahan yang paling potensial adalah plastik yang berbahan poliasam laktat atau PLA (polylactic acid ) (Darni 2008). Penggunaan PLA tidak hanya terbatas pada bahan pembuatan bioplastik, tetapi PLA dapat dikembangkan sebagai bahan penyalut atau pengungkung obat (Robbani 2004; Lu & Chen 2004), industri medis, dan industri tekstil. Substrat untuk pembuatan plastik PLA dengan menggunakan mikrob paling banyak terbuat dari jagung, singkong, dan sagu. Namun, bahan-bahan tersebut termasuk bahan pangan pokok. Oleh sebab itu, sangat diperlukan substrat alternatif untuk produksi asam laktat
yang bukan termasuk bahan pangan dan tidak mengganggu lingkungan.
Tetes tebu merupakan hasil samping industri gula yang mengandung senyawa nitrogen, unsur mikro, dan kandungan gula yang cukup tinggi terutama kandungan sukrosa 30-40%, glukosa 4-9%, dan fruktosa 5-12% sehingga sangat cocok menjadi sumber karbon untuk fermentasi asam laktat (Hidayat et al. 2006). Tetes tebu memiliki ketersediaan yang tinggi dan harganya murah. Oleh karena itu, produksi asam laktat dengan penambahan tetes tebu pada fermentasi bakteri Lactobacillus delbrueckii subsp. bulgaricus ini dapat menjadi salah cara untuk memanfaatkan hasil samping industri gula, selain untuk mengurangi penggunaan bahan pangan dalam produksi asam laktat.
Penelitian ini bertujuan memanfaatkan tetes tebu sebagai alternatif substrat yang berharga murah dalam produksi asam laktat dengan bantuan bakteri L. delbrueckii subsp. bulgaricus. Hipotesis dari penelitian ini adalah tetes tebu dapat menjadi alternatif substrat dalam produksi asam laktat secara fermentasi dengan bantuan L. delbrueckii subsp. bulgaricus. Manfaat dari penelitian ini adalah tetes tebu dapat digunakan sebagai alternatif substrat untuk produksi asam laktat yang dihasilkan dari fermentasi L. delbrueckii subsp. bulgaricus sebagai bahan dasar untuk pembuatan polylactic acid (PLA) yang ramah lingkungan.
TINJAUAN PUSTAKA
Lactobacillus delbrueckii subsp. bulgaricus
Bakteri asam laktat termasuk ke dalam bakteri Gram positif, non-spora, berbentuk batang atau kokus. Kelompok bakteri ini mampu memfermentasi karbohidrat untuk menghasilkan asam laktat sebagai produk utama atau asam laktat dengan produk samping lainnya, seperti asam asetat, etanol, karbondioksida, dan asam format. Berdasarkan ketentuan komposisi basa dalam DNA bakteri, kelompok bakteri asam laktat terbagi dalam dua kelompok yaitu Clostridium dan Actynomyces. Anggota Clostridium adalah Genus Lactobacillus, Lactococus, Leuconostoc, Enterococcus, Pediococcus, dan Carnobacterium. Anggota Actynomyces adalah Bifidobectarium (Suskovic et al. 2001).
homofermentatif hanya menghasilkan asam laktat sebagai produk akhir metabolisme glukosa dengan menggunakan jalur EMP. Bakteri heterofermentatif akan menghasilkan asam laktat, karbondioksida, dan etanol melalui jalur fosfoketolase (Hidayat et al. 2006).
Bakteri L. delbrueckii subsp. bulgaricus yang digunakan dalam penelitian ini merupakan salah satu spesies bakteri yang termasuk dalam golongan bakteri asam laktat. Bakteri ini ditemukan pertama kali oleh seorang doktor asal Bulgaria, Stamen Grigorov pada tahun 1905. L. delbrueckii subsp. bulgaricus (Gambar 1) merupakan bakteri yang memiliki genus terbesar dalam kelompok bakteri asam laktat dengan hampir 80 spesies yang berbeda. Bakteri ini berbentuk batang panjang serta bersifat anaerob fakultatif dan katalase negatif (Prescott et al. 2002). Bakteri ini termasuk kelompok bakteri yang bersifat non patogen. Strain Lactobacillus diketahui mampu menghasilkan senyawa bacteoricin yang mampu bersifat bakterisidal terhadap mikroorganisme lain (Laverenz et al. 2006). Suhu optimum pertumbuhan bakteri ini adalah 42°C-45°C. Menurut Dumbrepatil et al. (2007), suhu optimum bakteri ini berada pada 42°C
.
Bakteri L. delbrueckii subsp. bulgaricus menghasilkan asam laktat yang dapat menurunkan pH media fermentasi sehingga mengakibatkan terhambatnya pertumbuhan bakteri penggangu baik bakteri Gram positif maupun bakteri Gram negatif (Cabo et al. 2002).Gambar 1 Lactobacillus delbrueckii subsp. bulgaricus (Gesciova et al. 2002)
Tetes Tebu (Molasses)
Tebu merupakan salah satu komoditas unggulan tanaman perkebunan yang banyak dimanfaatkan di industri pangan (Rao et al. 2006). Tetes tebu merupakan hasil samping industri gula yang mengandung senyawa nitrogen, unsur pertumbuhan, dan kandungan gula yang cukup tinggi. Sumber tetes tebu berasal dari tebu dan bit. Dari kedua sumber tersebut akan didapatkan tetes tebu yang berbeda sifat dan pengolahannya. Tetes tebu
kaya akan biotin, asam pantotenat, tiamin, fosfor, dan sulfur. Selain itu juga mengandung gula yang terdiri dari sukrosa 30-40%, glukosa 4-9%, dan fruktosa 5-12% (Tabel 1) (Hidayat et al. 2006).
Tetes tebu digunakan secara luas sebagai sumber karbon untuk denitrifikasi, fermentasi anaerobik, pengolahan limbah aerobik, dan diaplikasikan pada budidaya perairan (Burford et al. 2003; Jimenez et al. 2004; Quan et al. 2005).
Tetes tebu berbeda dengan bahan baku umum yang digunakan dalam produksi alkohol seperti jagung dan kentang. Bahan tersebut mengandung karbohidrat yang disimpan sebagai pati sehingga harus mengalami perlakuan awal misalnya dengan menambahkan enzim untuk menghidrolisis pati menjadi gula yang dapat difermentasi. Sebaliknya, karbohidrat dalam tetes tebu telah siap digunakan untuk fermentasi tanpa perlakuan pendahuluan karena sudah berbentuk gula (Hidayat et al. 2006).
Selain itu, tetes tebu merupakan sumber daya alam yang melimpah. Hal ini didukung dengan luas lahan perkebunan tebu yang terus meningkat dari tahun ke tahun untuk digunakan dalam produksi gula. Pada tahun 2009 areal perkebunan tebu di Indonesia mencapai 473 ribu ha atau naik 2.9% dibanding pada tahun 2008 yang hanya mencapai 460 ha. Sejalan dengan meningkatnya areal perkebunan tebu, maka produksi pun meningkat dengan pertumbuhan sekitar 2.8% (2.85 juta ton) pada tahun 2009. Selain itu, dalam rangka memenuhi kebutuhan gula nasional dari dalam negeri, pemerintah menetapkan akan memperluas areal tanaman tebu hingga 150000 ha pada 2010 dengan tahap awal seluas 41705 ha (ICN 2010).
Tabel 1 Komposisi kimiawi tetes tebu Unsur Kisaran (%)
Air 17-25
Sukrosa 30-40 Dektrosa (glukosa) 4-9 Laevulosa (fruktosa) 5-12 Bahan pereduksi lain 1-5 Karbohidrat lain 2-5
Abu 7-15
3
Pada tahun 2011, menurut salah satu BUMN Perkebunan, PT Perkebunan Nusantara X (PTPN X) menyebutkan bahwa produksi tetes tebu yang berasal dari industri gula yang tersebar di daerah Jawa Timur mencapai 310.67 ton. Hasil ini menunjukkan bahwa ketersediaan tetes tebu di Indonesia sudah terjamin. Selain itu, tetes tebu juga memiliki harga yang murah.
Fermentasi Asam Laktat
Fermentasi adalah suatu proses perubahan-perubahan kimia dalam suatu substrat organik yang berlangsung karena aksi kalisator-kalisator biokimia, yaitu enzim yang dihasilkan oleh mikrob-mikrob hidup tertentu. Faktor-faktor yang penting dalam fermentasi adalah medium, garam, keasaman, kultur, dan waktu. Parameter penting lainnya dalam proses fermentasi adalah pH, suhu, tekanan, dan agitasi (Sodegard & Stolt 2002). Proses fermentasi bersifat sederhana namun harus teliti sehingga flavor, tekstur, aroma, dan karakteristik lainnya dapat terbentuk dengan baik(Hidayat et al. 2006)
Industri fermentasi dimulai sebelum tahun 1900, yaitu dengan dimulainya alkohol dan vinegar. Di Arab, produksi skala besar dimulai tahun 1700. Pengembangan proses dengan menggunakan termometer dimulai tahun 1757 dan pemindahan panas pada tahun 1801.
Produksi asam laktat di dunia mencapai 80000 ton sekitar 90% di antaranya dihasilkan oleh bakteri asam laktat melalui fermentasi dan sisanya dihasilkan secara sintesis dengan menghidrolisis laktonitril (Hidayat et al. 2006). Produksi asam laktat dapat dilakukan melalui proses curah (batch) maupun sinambung. Fermentasi dilakukan dengan menggunakan gula 5% dan sumber nitrogen sebagai nutrien. Rendemen asam laktat diperoleh sebanyak 90-99% setelah fermentasi dua hari. Pada fermentasi sinambung dengan menggunakan media yang sama lebih menguntungkan karena menghasilkan produktivitas yang lebih tinggi jika dibandingkan dengan proses fermentasi secara curah (Sodegard & Stolt 2002).
Proses produksi asam laktat harus memperhatikan kurva pertumbuhan mikrob, sehingga pertumbuhan mikrob terbagi atas empat fase, yaitu lag, log, stationer, dan kematian. Fase lag ditandai dengan perubahan jumlah sel yang sangat kecil karena pada fase ini sel tidak langsung berproduksi dalam media baru. Pada fase ini, pembelahan sel yang terjadi sangat kecil. Selama fase ini
sel-sel tidak aktif dan mengalami aktivitas berbagai metabolik, khususnya sintesis enzim dan berbagai molekul. Fase log merupakan fase ketika sel-sel mikrob mulai membelah dan memasuki masa pertumbuhan konstan yang mengikuti kurva logaritmik, serta terjadinya aktivitas metabolik yang paling aktif. Namun, selama fase ini mikrob sangat sensitif terhadap kondisi lingkungan yang merugikan, seperti radiasi dan beberapa antimikrob. Fase ini dapat digunakan untuk menentukan waktu inkubasi mikrob ketika akan ditumbuhkan dalam media fermentasi. Fase stationer ditandai dengan pertumbuhan sel yang berjalan lambat. Jumlah mikrob yang mati seimbang dengan jumlah sel yang hidup sehingga populasi pada fase ini menjadi stabil. Aktivitas metabolik yang terjadi pada pada fase ini juga berjalan dengan lambat. Hal ini diakibatkan ketersediaan nutrisi yang tidak memadai dan akumulasi produk limbah. Pertumbuhan ini disebut pertumbuhan tersembunyi (cryptic). Apabila inkubasi masih berlangsung setelah fase stasioner dan sel masih hidup serta bermetabolisme maka sel lambat laun akan mati. Fase pertumbuhan terakhir adalah fase kematian. Jumlah kematian pada fase ini melebihi jumlah sel yang masih hidup karena nutrisi sudah hampir habis. Fase ini berlanjut hingga jumlah sel hidup terus berkurang untuk sebagian kecil dari jumlah pada fase sebelumnya atau hingga kematian pada semua sel (Tortora et al. 2006). Pertumbuhan mikrob dapat diukur dengan beberapa cara yaitu dengan menghitung jumlah sel dan massa sel. Pengukuran jumlah sel dilakukan dengan cara perhitungan mikroskopik langsung (Petroof-Hausser, hemasitometer), menghitung sel yang hidup (hitung cawan), filtrasi, dan mengukur kemungkinan jumlah sel yang ada secara statistik (Most Probable Number). Pengukuran massa sel meliputi pengukuran berat sel kering, kekeruhan (turbiditas), pengukuran aktivitas metabolisme (Tortora et al. 2006).
Faktor-Faktor yang Mempengaruhi Pertumbuhan Mikrob
Kegiatan mikrob dipengaruhi oleh faktor-faktor lingkungan. Faktor-faktor-faktor lingkungan yang sering mempengaruhi pertumbuhan mirob adalah faktor abiotik dan biotik. Faktor abiotik yaitu suhu, kelembapan, pH, dan komposisi medium.
luas. Suhu pertumbuhan dibagi dalam 3 tingkatan yaitu suhu minimum, maksimum, dan optimum. Suhu minimum adalah suhu yang paling rendah, namun kehidupan mikrob masih dapat berlangsung. Suhu maksimun adalah suhu teritinggi yang masih dapat menumbuhkan mikrob tetapi pada tingkat kegiatan fisiologi yang paling rendah. Selain itu, suhu optimum adalah suhu yang paling baik untuk kehidupan mikrob.
Berdasarkan suhu pertumbuhannya, mikrob dapat dibedakan menjadi 3 golongan, yaitu psikrofil, mesofil, dan termofil. Mikroba psikrofil/kriofil dapat pada tumbuh pada suhu antara 0 °C sampai 30 °C, dengan suhu optimum 15 °C. Mikrob golongan psikrofil tumbuh di tempat-tempat dingin, baik di daratan maupun lautan. Mikrob golongan mesofil mempunyai suhu optimum antara 25°C -37°C, dengan suhu minimum 15 °C dan suhu maksimum antara 45 °C -55 °C. Mikrob ini banyak hidup dalam saluran pencernaan, tanah, dan perairan. Mikrob golongan termofil mempunyai suhu pertumbuhan antara 40°C -75 °C dengan suhu optimum 55 °C-60 °C (Hidayat et al. 2006).
Selain suhu, pH merupakan salah satu faktor penting dalam pertumbuhan mikrob. Setiap organisme mempunyai kisaran pH yang diperlukan untuk menunjang pertumbuhan terutama pada pH optimum. Pada media fermentasi, pH dapat berubah selama pertumbuhan berlangsung sebagai akibat reaksi metabolisme yang mengkonsumsi atau menghasilkan substansi asam atau basa (Sunatmo 2009).
Komposisi medium juga merupakan faktor yang penting dalam pertumbuhan mikrob. Sebagian besar prokariot membutuhkan senyawa karbon organik sebagai sumber karbon. Selain itu, mineral penting yang dibutuhkan mikrob diantaranya magnesium, natrium, dan besi (Sunatmo 2009).
Asam Laktat
Asam laktat (2-hydroxypropanoic acid) yang biasa disebut sebagai asam susu adalah salah satu bahan kimia yang berperan penting dalam industri biokimia. Asam laktat pertama kali berhasil diisolasi oleh ahli kimia Swedia, Carl Wilhelm Schele pada tahun 1780. Asam laktat mempunyai rumus kimia C3H6O3, termasuk keluarga asam hidroksi propionat dengan rumus molekul CH3CHOHCOOH. Asam laktat dalam larutan akan kehilangan satu proton dari gugus asam dan menghasilkan ion laktat CH3CH(OH)COO-.
Asam laktat larut dalam air dan etanol serta bersifat higroskopik (Riekri 2010).
Asam laktat merupakan senyawa natural yang dapat diproduksi oleh manusia, hewan, tumbuhan, dan mikroorganisme. Asam laktat memiliki dua bentuk isomer optik yaitu L-asam laktat dan D-L-asam laktat (Gambar 2). Asam laktat juga merupakan bentuk umum dalam metabolisme pada manusia, hewan, dan mikroorganisme. Bakteri dapat memproduksi asam laktat dalam dua bentuk (D- dan L-asam laktat) (Mirdamadi et al. 2002).
Reaksi dasar proses sintesis asam laktat secara kimiawi adalah mengubah laktonitril (asetaldehida sianohidrin) menjadi asam laktat. Beberapa metode kimia yang memungkinkan sintesis asam laktat adalah degradasi gula dengan alkali seperti kapur atau NaOH, interaksi asetaldehida dan karbonmonoksida pada suhu dan tekanan yang tinggi, dan hidrolisa dari asam α -kloropropionat (Aulana 2005).
Perbedaan produksi asam laktat secara kimia dengan fermentasi antara lain: yang pertama, sintesis kimia menggunakan senyawa beracun seperti hidrogen sianida sedangkan secara fermentasi, lebih ramah lingkungan; secara kimia produk yang dihasilkan merupakan campuran bentuk L -dan D-asam laktat sedangkan secara fermentasi produk yang dihasilkan bisa dalam bentuk L-, D-, atau DL- tergantung dari strain mikrob yang digunakan; sintesis kimia menggunakan bahan baku tidak bisa diperbaharui sedangkan secara fermentasi bahan bakunya dapat diperbaharui; produksi secara kimia memiliki kondisi ekstrim (temperatur tinggi dan tekanan) sedangkan secara fermentasi prosesnya dalam kondisi sedang (lebih hemat energi).
Saat ini, sekitar 85% kebutuhan asam laktat adalah untuk aplikasi di bidang pangan, antara lain sebagai pengasam makanan (food acidulan), pemberi rasa, penstabil pH, dan antimikrob (Koesnandar 2004). Kebutuhan asam laktat di Indonesia belum begitu besar yaitu sekitar 1 juta ton yang dipenuhi melalui impor dari negara-negara seperti Belanda, Amerika Serikat, dan Jerman.
D (-) asam laktat L(+) asam laktat Gambar 2 Struktur asam laktat (Takeuchi
5
Kebutuhan asam laktat dunia dilaporkan terus-menerus meningkat baik dari segi jumlah maupun dari segi volume penjualan. Asam laktat merupakan senyawa antara yang penting dan memiliki potensi besar untuk aplikasi produk baru seperti plastik ramah lingkungan atau plastik biodegradable (PLA), bahan polimer, aplikasi bidang farmasi dan kedokteran, pelarut alami dalam aplikasi proses pengemasan makanan, pemberi elastis (ester laktat dan turunan laktat), serta mengatur pertumbuhan tanaman asam (oligo(L-laktat) (Koesnandar 2004). Asam laktat juga mempunyai beberapa karakteristik di antaranya titik leleh yang rendah, kalor pembakaran yang tinggi, dan bobot molekul sebesar 90.08 (Tabel 2).
Tabel 2 Ciri-ciri fisik asam laktat Karakteristik Nilai Bobot molekul 90.08 Titik leleh 16.8 0C
Titik asap 82 0C pada 0.5 mmHg 122 0C pada 14 mmHg Tetapan disosiasi 1.37 x 104
Kalor pembakaran 1361 kJ/mol Kalor jenis 190 J/mol e/0C Narayan et al. 2004
Kromatografi Cair Kinerja Tinggi (KCKT)
Kromatografi cair kinerja tinggi (KCKT) atau High Performance Liquid Chromatography (HPLC) merupakan suatu teknik kromatografi dengan fase gerak cairan dan fase diam cairan atau padat. Kelebihannya jika dibandingkan dengan metode lain adalah mampu memisahkan molekul-molekul dari suatu campuran, kecepatan analisis dengan kepekaan tinggi, dan dapat digunakan bermacam-macam detektor. KCKT terdiri pompa, injektor, kolom, dan detektor (Putra 2004). Analisis asam laktat menggunakan KCKT sangat diperlukan karena kepekaannya tinggi sehingga dapat mendeteksi adanya asam laktat pada hasil fermentasi.
Pada kromatografi cair komposisi fase gerak adalah salah satu dari variable yang mempengaruhi pemisahan. Fase gerak yang disukai dalam KCKT adalah murni atau tidak mengandung kontaminan, tidak bereaksi dengan wadah, sesuai dengan detektor dan melarutkan sampel (Putra 2004).
Jumlah bahan yang dimasukkan ke dalam kolom KCKT biasanya sangat sedikit, namun sistem detektor memiliki kepekaan yang cukup tinggi dan stabil terhadap respon dari setiap bahan yang diuji pada konsentrasi
rendah dalam efluen. Umumnya, detektor bervariasi berdasarkan pada panjang gelombang ultraviolet sampai sinar tampak, seperti pada spektrofotometer. Detektor tersebut mampu mengukur absorban dari 190 nm, dan sensitivitasnya sampai skala 0.001 unit. Detektor mempunyai fasilitas untuk mencatat setiap absorban spektrum analat untuk membantu identifikasi (Bintang 2010).
Detektor flouresen sangat penting dalam HPLC karena sensitif, tetapi relatif terbatas pada beberapa komponen yang berflouresensi. Detektor electrochemical bersifat selektif untuk senyawa elektro aktif dan berpotensi memiliki sensitivitas yang tinggi. Kedua detektor di atas memiliki prinsip yang sama (Bintang 2010)
Kolom yang digunakan pada penelitian ini adalah kolom C18. Fase gerak yang digunakan adalah metanol/air (20:80, v/v). Analisis asam laktat digunakan untuk memastikan bahwa asam yang dihasilkan pada fermentasi adalah asam laktat (Zhuo et al. 2011). Analsisi kualitatif ini sangat penting untuk dilakukan untuk mendukung data penelitian.
BAHAN DAN METODE
Alat dan Bahan
Bahan yang digunakan pada penelitian ini adalah tetes tebu yang berasal dari pabrik pakan Indofeed yang bertempat di Jalan Sholeh Iskandar, Bogor. Bahan ini digunakan sebagai sumber karbon utama. Mikrob yang digunakan adalah Lactobacillus delbrueckii subsp. bulgaricus yang berasal dari koleksi kultur laboratorium Mikrobiologi, LIPI Cibinong, yang merupakan isolat lokal.
Bahan lainnya yang digunakan adalah media Mann Rogose and Sharp cair (MRS cair). Komposisi media MRS cair per 1000 ml terdiri dari 20 g glukosa, leb.lemco 8 g, ekstrak khamir 4 g, pepton 10 g, Na-asetat 5 g, (NH4)2PO4 2 g, MgSO4.7H2O 0.2 g, MnSO4.4H2O 0.04 g, K2HPO4 2 g, dan Tween 80 1 mL. Selain itu, digunakan pula NaOH 0.1131 N, NaOH 0.1037 N, CaCO3, fenol 5%, indikator phenolphthalein (pp), spiritus, alkohol 70%, H2SO4 20%, H2SO4 absolut, metanol, asam laktat pro analisis, dan akuades.
Alat-alat yang digunakan pada penelitian adalah autoklaf, sentrifus, pH-meter, spektrofotometer, evaporator vakum, HPLC (High Performance Liquid Chromatography), timbangan analitik, jarum ose, pipet mikro, pipet Mohr, gelas ukur, sudip, batang pengaduk, hot plate, waterbath shaker
incubator, oven, penangas Bunsen, tabung Eppendorf, labu Erlenmeyer, dan gelas piala.
Metode
Penelitian terdiri atas beberapa tahapan yaitu hidrolisis dan detoksifikasi tetes tebu, uji kualitatif gula pereduksi tetes tebu, analisis gula total tetes tebu, penentuan kurva pertumbuhan Lactobacillus delbrueckii subsp. bulgaricus, analisis penurunan gula sisa selama fermentasi, analisis kadar asam laktat, analisis pola penurunan pH selama fermentasi, produksi dan ekstraksi asam laktat, analisis kualitatif asam laktat dengan menggunakan KCKT.
Hidrolisis dan Detoksifikasi Tetes Tebu, Uji Kualitatif Gula Pereduksi Tetes Tebu, dan Analisis Gula Total Tetes Tebu (Bintang 2010)
Sebanyak 500 mL tetes tebu dimasukkan ke dalam gelas piala. Lalu, ditambahkan 10 mL H2SO4 20%. Setelah itu, dimasukkan ke dalam penangas air selama 15 menit. Lalu didinginkan perlahan-lahan. Setelah itu, dilakukan detoksifikasi dengan 1% arang aktif. Selanjutnya dilakukan uji kualitatif gula pereduksi dengan metode uji Benedict, uji Seliwanoff, dan uji Barfoed. Sebanyak 3 mL pereaksi Seliwanoff dimasukkan ke dalam tabung reaksi. Selanjutnya, ditambahkan 3 tetes tebu dan diletakkan di dalam penangas air dan diamati perubahannya. Sebanyak 3 mL pereaksi Barfoed ditambahkan pada 2 mL air tebu dan diletakkan dalam penangas air selama 1 menit. Setelah itu diamati dengan seksama. Sebanyak 5 mL pereaksi Benedict ditambahkan pada 8 tetes air tebu dan disimpan dalam penangas air selama 3 menit, didinginkan, dan diamati. Setelah itu dilakukan analisis gula total tetes tebu. Metode yang digunakan adalah metode asam fenol sulfat. Pembuatan kurva standar dilakukan terlebih dahulu dengan membuat larutan standar pada berbagai konsentrasi yaitu 0, 25, 50, 75, 100, 125, 150, dan 200 ppm. Sampel tetes tebu dipipet sebanyak 0.5 mL ke dalam tabung reaksi dan ditambahkan 0.5 mL fenol 5% dan divorteks. Kemudian, sampel ditambahkan 2.5 mL H2SO4 pekat secara hati-hati melalui dinding tabung dan didiamkan selama 10 menit dalam air. Kemudian divorteks dan didiamkan kembali selama 20 menit. Setelah dingin diukur nilai absorbansnya dengan spektrofotometer pada panjang gelombang 490 nm. Nilai absorbans yang diperoleh kemudian dimasukkan pada
perhitungan hasil kurva standar. Larutan blanko yang digunakan adalah akuades yang diberi perlakuan sama seperti sampel.
Penentuan Kurva Pertumbuhan L.
delbrueckii subsp. bulgaricus (MRS, MRS yang ditambah 0.5% tetes tebu) (Aulana 2005)
Pada penelitian ini, tahapan awal untuk penentuan kurva pertumbuhan bakteri adalah peremajaan bakteri Lactobacillus delbrueckii subsp. bulgaricus pada 25 mL media MRS cair pada suhu 42 0C dan agitasi 150 rpm pada waterbath shaker selama 48 jam. Selanjutnya, sebanyak 10 mL media MRS dipipet ke dalam 16 tabung reaksi. Percobaan dilakukan sebanyak dua kali pengulangan. Masing-masing ulangan sebanyak 8 tabung yang terdiri atas waktu inkubasi 0, 2, 4, 8, 16, 32, 48, dan 64 jam.Lalu disterilisasi dengan autoklaf pada suhu 1210C selama 15 menit. Sebanyak 1% inokulum bakteri ditambahkan pada tabung-tabung reaksi yang berisi media MRS cair. Kemudian, tabung-tabung reaksi tersebut diinkubasi ke dalam waterbath shaker dengan suhu 420C dan agitasi sebesar 150 rpm sesuai label yang terdapat pada tabung. Kultur bakteri tersebut kemudian diukur absorbansinya pada panjang gelombang 620 nm. Penentuan kurva pertumbuhan bakteri juga dilakukan pada media MRS cair yang ditambahkan 0.5% dan 1 % tetes tebu dengan konsentrasi 100 g/L.
Analisis Pola Penurunan Gula Sisa selama Fermentasi (Bintang 2010)
Larutan fermentasi hasil penentuan kurva pertumbuhan L. delbrueckii subsp. bulgaricus dengan penambahan 0.5% tetes tebu pada media MRS disentrifugasi dengan kecepatan 5000 rpm selama 10 menit. Supernatan tersebut digunakan untuk analisis total gula yang ada pada media. Sebelum dianalisis, supernatan diencerkan terlebih dahulu dengan akuades hingga mencapai konsentrasi pada kisaran konsentrasi kurva standar (berwarma bening). Selanjutnya, sebanyak 1 mL supernatan dipipet dan ditambahkan KOH 4 N sampai pH netral. Metode yang digunakan sama dengan metode yang dilakukan pada analisis total gula tetes tebu pada penelitian sebelumnya (Bintang 2010).
7
Sebanyak 1 mL supernatan hasil fermentasi dilarutkan dengan akuades menjadi 25 mL di dalam labu Erlenmeyer. Larutan ditambahkan 2-3 tetes indikator phenolftalein lalu dititrasi dengan larutan NaOH 0.1131 N yang telah distandarisasi dengan larutan asam oksalat 0.1 N. Titik akhir titrasi tercapai saat muncul warna merah muda yang pertama. Perhitungan jumlah persen asam laktat dilakukan dengan menggunakan rumus berikut:
Asam laktat (%)= V1×N×BE×FP×100%
V2×1000
V1: Volume NaOH 0.1131 N yang telah distandarisasi
N : Normalitas NaOH hasil standarisasi BE: Bobot ekuivalen asam laktat (90.08
g/ekuivalen) FP: Faktor pengenceran
V2: Jumlah sampel yang dititrasi (mL)
Setelah itu, dilakukan analisis pola penurunan pH selama fermentasi. Alat pH meter dikalibrasi terlebih dahulu dengan buffer pH 7.00 dan buffer pH 4.00. Tahapan kalibrasi pH adalah elektroda pH meter dibilas terlebih dahulu dengan akuades, dikeringkan dengan tissue, dicelup ke dalam buffer pH, dan ditunggu sampai layar menunjukkan nilai pH sesuai dengan buffer yang digunakan. Selanjutnya, sebanyak 5 mL supernatan diletakkan di dalam gelas piala kemudian diukur pH-nya secara duplo.
Ekstraksi dan Analisis Kualitatif Asam Laktat dengan KCKT (Zhuo et al. 2011; Sikder et al. 2012)
Sebanyak 500 mL media MRS cair dan 10 mL tetes tebu 100 g/L disterilisasi dengan autoklaf pada suhu 121 0C selama15 menit. Selanjutnya media MRS cair dan 10 mL tetes tebu dicampur dalam keadaan steril. Kemudian ditambahkan 1% inokulum dari bakteri L. delbrueckii subsp. bulgaricus yang sudah diremajakan pada media yang telah dicampur tersebut. Sampel diinkubasi dalam waterbath shaker pada suhu 420C dan agitasi 150 rpm selama 24 jam. Setelah 24 jam, sampel disentrifugasi dengan kecepatan 5000 rpm selama 10 menit. Supernatan dan pelet dipisahkan. Peletnya kemudian dikeringkan pada suhu 50°C. Supernatannya digunakan untuk tahap ekstraksi.
Tahapan awal ekstraksi yaitu supernatan hasil fermentasi terlebih dahulu disaring
dengan menggunakan membran saring berukuran 0.45 µm dan 0.22 µm. Setelah disaring, supernatan dievaporasi. Kemudian dilanjutkan dengan analisis HPLC menggunakan kolom C18 (4.6 *150 MM, 5 µ m). Fase gerak yang digunakan adalah metanol/air (20:80, v/v), kecepatan alirnya 0.5 mL min-1, panjang gelombang yang digunakan adalah 210 nm, dan sampel yang diinjeksikan sebesar 10 µL. Detektor yang digunakan adalah detektor A. Selanjutnya, pH dan kadar asam laktat supernatan hasil fermentasi dihitung, metode yang digunakan untuk penentuan kadar asam laktat yaitu metode titrasi dengan menggunakan NaOH 0.1037 N yang telah distandarisasi asam oksalat 0.1 N.
HASIL DAN PEMBAHASAN
Hasil Hidrolisis dan Detoksifikasi Tetes Tebu, Uji Kualitatif Gula Pereduksi, dan Gula Total Tetes Tebu Hasil Hidrolisis dengan Asam Sulfat
Uji gula pereduksi secara kualitatif didahului dengan hidrolisis dan detoksikasi tetes tebu. Hidrolisis tetes tebu menggunakan asam yaitu H2SO4 20%. Hidrolisis ini bertujuan menghidrolisis sukrosa menjadi glukosa dan fruktosa agar lebih mudah digunakan oleh bakteri. Selain itu, detoksikasi bertujuan menghilangkan residu senyawa toksik berupa hidroksil metil furfural (HMF) yang akan menghambat pertumbuhan mikrob dan aktivitas fermentasi Lactobacillus delbrueckii subsp. bulgaricus (Carvalho et al. 2002; Rao et al. 2006). Detoksikasi tetes tebu menggunakan 1% arang aktif (Yuliatun & Kurniawan 2008).
Di samping itu, uji kualitatif gula pereduksi tetes tebu penting dilakukan untuk memastikan tetes tebu dapat digunakan sebagai substrat utama dalam fermentasi asam laktat yang menggunakan salah satu bakteri asam laktat yaitu Lactobacillus delbrueckii subsp. bulgaricus. Metode uji kualitatif yang digunakan adalah uji Benedict, uji Selliwanof, dan uji Barfoed. Uji Benedict digunakan untuk mengetahui kandungan gula pereduksi pada tetes tebu. Uji Barfoed digunakan untuk membedakan disakarida pereduksi dengan monosakarida pereduksi pada tetes tebu. Uji Selliwanof digunakan untuk memastikan bahwa tetes tebu mengandung ketosa. Semua uji tersebut menunjukkan hasil yang positif (Gambar 3). Uji gula pereduksi menunjukkan bahwa tetes tebu mengandung glukosa dan fruktosa. Hasil ini sesuai dengan Hidayat et al. (2006), yang menyatakan bahwa tetes tebu
mengandung sukrosa 30-40%, glukosa 4-9%, dan fruktosa 5-12%.
Reagen Selliwanof terdiri atas 0.5% resorsinol dan 5 N HCl. Reaksi positif terjadi apabila terbentuk warna merah. HCl akan mengubah heksosa menjadi hidroksi metal furfural yang kemudian akan bereaksi dengan resorsinol membentuk kompleks yang berwarna merah.
Uji Benedict berisi larutan alkali. Larutan alkali dari tembaga direduksi oleh gula yang mengandung gugus aldehida atau keton bebas dengan membentuk kupro oksida berwarna. Larutan Benedict mengandung kupri sulfat, natrium karbonat, dan natrium sitrat. Uji Benedict dilakukan pada suasana basa yang menyebabkan transformasi isomerik. Pada suasana basa, reduksi ion Cu2+dari CuSO4 oleh gula pereduksi akan berlangsung dengan cepat dan membentuk Cu2O yang merupakan endapan merah bata. Pereaksi Benedict terdiri atas larutan Cu2+dalam suasana basa kuat.
Uji Barfoed mengandung kupri asetat yang dilarutkan dalam akuades dan ditambahkan dengan asam laktat. Pereaksi Barfoed dalam suasana asam akan direduksi lebih cepat oleh gula pereduksi monosakarida daripada disakarida dan menghasilkan Cu2O (kupro oksida) berwarna merah bata (Bintang 2010).
(1) (2) (3)
Gambar 3 Hasil uji kualitatif gula pereduksi. pada tetes tebu. (1) Uji Selliwanoff (2) Uji Barfoed (3) Uji Benedict.
Metode yang digunakan untuk menganalisis gula total tetes tebu adalah metode fenol sulfat. Metode asam fenol sulfat disebut juga dengan metode TS (total sugar). Metode ini dapat mengukur dua molekul gula pereduksi. Gula sederhana, oligosakarida, dan turunannya dapat dideteksi dengan fenol dalam asam sulfat yang pekat yang akan menghasilkan warna jingga kekuningan yang stabil (Taiyeb et al. 2011).
Metode fenol sulfat mampu mendeteksi dua gula pereduksi karena sukrosa yang ada dihidrolisis dahulu menjadi dua molekul glukosa sehingga dapat mengetahui gula
pereduksi total. Serapan dibaca pada panjang gelombang 490 nm. Dengan cara ini didapatkan konsentrasi gula tetes tebu sebesar 1090 g/L. Hasil ini menunjukkan bahwa gula total yang dimiliki tetes tebu lebih besar dibandingkan dengan gula total hidrolisat pati sagu yaitu sebesar 435.83 g/L (Aulana 2005). Larutan standar glukosa yang digunakan adalah 0, 25, 50, 75, 100, 125, dan 150 ppm. Hasil pengukuran gula total menunjukkan bahwa tetes tebu memiliki kandungan gula yang tinggi sehingga dapat digunakan sebagai karbon utama dalam fermentasi asam laktat dengan bantuan Lactobacillus delbrueckii subsp. bulgaricus. Menurut Hidayat et al. (2006) tetes tebu memiliki kandungan gula yang cukup tinggi yaitu sebesar 62%.
Penentuan Kurva Pertumbuhan L.
delbrueckii subsp. bulgaricus
Pola pertumbuhan dibuat untuk menetapkan kondisi optimum pertumbuhan bakteri. Sel bakteri ditumbuhkan dalam media MRS cair dan MRS cair yang ditambahkan 0.5% tetes tebu. Pemberian tetes tebu sebesar 0.5% dilakukan berdasarkan perhitungan konsentrasi gula yang mampu digunakan untuk pertumbuhan bakteri. Berdasarkan percobaan pendahuluan, penggunaan tetes tebu sebesar 1% menyebabkan bakteri tidak dapat tumbuh dengan optimum akibat media fermentasi yang terlalu pekat oleh cairan gula. Selanjutnya, media fermentasi diukur secara turbidimetri dengan menggunakan spektrofotometer pada panjang gelombang 620 nm. Pengukuran sel bakteri dengan dengan spektofotmeter bertujuan untuk mengukur tingkat kekeruhan yang berbanding lurus dengan waktu inkubasi dalam bentuk absorban. Cahaya yang dibiaskan oleh sumber cahaya akan diserap oleh sel sehingga semakin tinggi pertumbuhan sel akan memberikan nilai absorban yang lebih besar. Absorban kemudian dikonversi menjadi nilai optical density (OD).
9
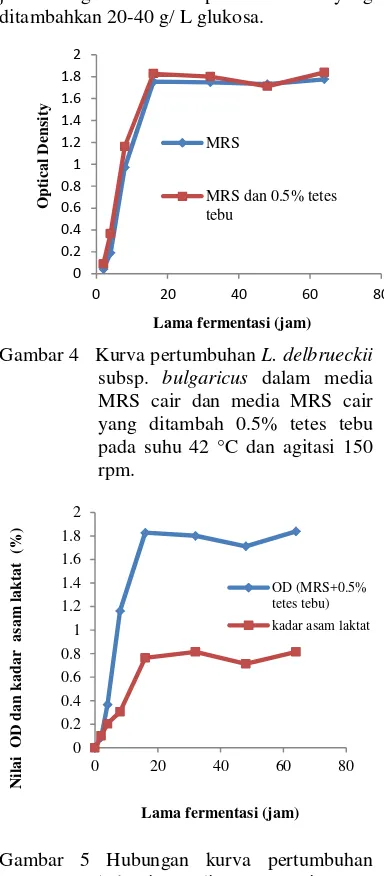
Pada jam ke-2 dan jam ke-4 pertumbuhan biomassa sel terdeteksi nilai OD 0.04 menjadi 0.19 untuk sel bakteri yang terdapat pada media MRS cair. Nilai OD 0.09 menjadi 0.37 untuk sel bakteri yang terdapat pada media MRS cair yang telah ditambahkan 0.5% tetes tebu (Gambar 4). Pertumbuhan bakteri pada kedua media itu berbeda. Hal ini terjadi karena adanya tetes tebu yang menjadi penambah sumber karbon yang digunakan sebagai sumber energi dalam pembelahan sel. Hasil ini menunjukkan bahwa bakteri dapat beradaptasi dengan baik pada media yang diberi tetes tebu. Hasil pengamatan pada jam ke-2 dan jam ke-4 menunjukkan bahwa sel bakteri berada dalam fase lag. Pertumbuhan biomassa sel pada fase lag cenderung lambat karena adanya adaptasi terhadap media. Pada fase ini tidak terjadi kenaikan jumlah sel, namun ukuran sel mengalami peningkatan.
Fase ekponensial terjadi pada jam ke-4 sampai jam ke-16, sel menggunakan sumber karbon dan bahan-bahan lainnya yang terdapat dalam media untuk tumbuh. Pada fase ini terjadi peningkatan atau penggandaan populasi sel bakteri.Nilai OD pada media MRS cair mencapai 1.75, sedangkan pada media MRS cair yang ditambah 0.5% tetes tebu nilai OD mencapai 1.83.Peningkatan sel bakteri terjadi akibat adanya pembelahan biner sel yang meningkatkan jumlah sel hidup.
Kurva pertumbuhan menunjukkan bahwa pertumbuhan sel bakteri melambat (fase stastioner) pada jam ke-16 hingga jam ke-64). Pada fase ini fungsi sel masih berlangsung seperti metabolisme energi dan proses biosintesis. Fase ini juga memperlihatkan keseimbangan antara jumlah sel yang tumbuh dan yang mati (Sunatmo 2009).
Berdasarkan kurva pertumbuhan yang didapat, terdapat perbedaan peningkatan pertumbuhan bakteri pada media MRS dan MRS yang ditambah 0.5% tetes tebu. Bakteri yang ditumbuhkan pada media MRS yang ditambahkan 0.5% tetes tebu memiliki peningkatan pertumbuhan sekitar 35% dibandingkan dengan bakteri yang ditumbuhkan pada media MRS cair.
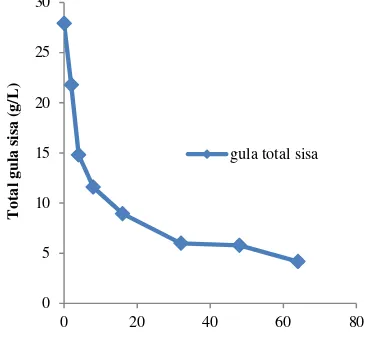
Selain itu, berdasarkan hubungan kurva pertumbuhan bakteri pada suhu 42 °C dan agitasi 150 rpm dan kadar asam laktat, maka lamanya fermentasi untuk produksi dilakukan di antara selang waktu 16-32 jam. Pada selang waktu tersebut terjadi peningkatan pertumbuhan bakteri yang maksimun. Selain itu, dari data pola produksi asam laktat pun
menunjukkan bahwa produksi asam laktat maksimum terjadi pada selang waktu 16-32 jam (Gambar 5), sehingga fermentasi dilakukan selama 24 jam. Fermentasi yang dilakukan di atas 24 jam menyebabkan pertumbuhan bakteri sudah memasuki fase stationer yang mendekati fase kematian karena substrat sudah mulai habis. Hal tersebut merangsang enzim-enzim yang berperan untuk pembentukan metabolit sekunder yaitu bacteriocin. Hal ini sesuai dengan penelitian yang dilakukan Todorov dan Dicks (2007), menyebutkan bahwa antivitas antibakteri berupa bacteriocin yang dihasilkan oleh Lactobacillus pentosus ST712BZ optimum setelah lama fermentasi 24 jam dengan media pertumbuhan yang ditambahkan 20-40 g/ L glukosa.
Gambar 4 Kurva pertumbuhan L. delbrueckii subsp. bulgaricus dalam media MRS cair dan media MRS cair yang ditambah 0.5% tetes tebu pada suhu 42 °C dan agitasi 150 rpm.
Gambar 5 Hubungan kurva pertumbuhan bakteri (media MRS cair yang ditambah 0.5% tetes tebu) dengan kadar asam laktat
0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 1.8 2
0 20 40 60 80
O p ti c a l D e n si ty
Lama fermentasi (jam)
MRS
MRS dan 0.5% tetes tebu 0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 1.8 2
0 20 40 60 80
N il a i O D d a n k a d a r a sa m l a k ta t ( % )
Lama fermentasi (jam)
Kurva pertumbuhan menunjukkan bahwa bakteri dapat tumbuh pada media MRS cair yang ditambahkan 0.5% tetes tebu, sehingga terbukti dapat digunakan sebagai sumber karbon pada fermentasi asam laktat. Hal ini juga diperkuat dengan adanya hubungan yang berbanding lurus antara kurva pertumbuhan bakteri dengan kadar asam laktat. Semakin tinggi jumlah sel bakteri, maka semakin tinggi pula kadar asam laktat. Peningkatan kadar asam laktat sekitar 44% seiring dengan bertambahnya jumlah sel bakteri. Oleh karena itu, tetes tebu dapat menjadi alternatif substrat yang potensial.
Pola Penurunan Gula Sisa selama
Fermentasi
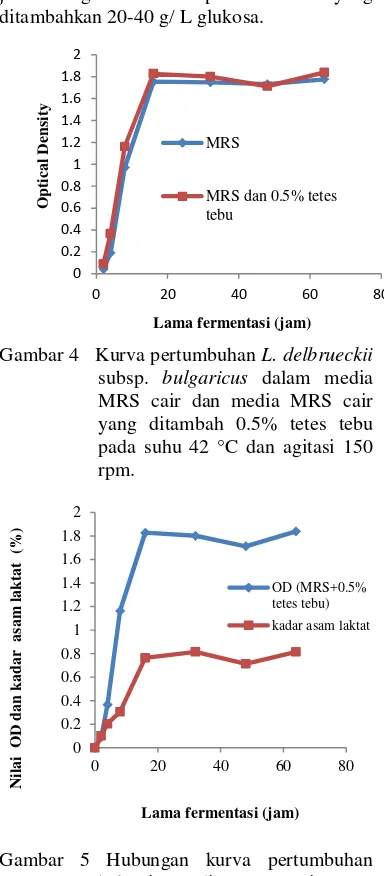
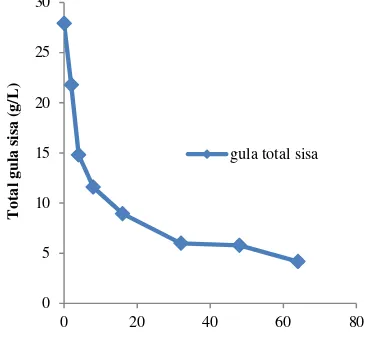
Selama fermentasi, mikrob akan mengkonversi substrat berupa sumber karbon menjadi biomassa sel dan produk yang ditandai dengan menurunnya konsentrasi sumber karbon dalam media. Perhitungan sisa total gula selama fermentasi dilakukan untuk mengetahui gula total yang tersisa pada larutan media fermentasi, sehingga dapat menggambarkan konsumsi gula oleh bakteri L. delbrueckii subsp. bulgaricus.
Perhitungan sisa gula total pada jam ke-2, 4, 8, 16, 32, 48, dan 64 jam. Hasilnya menunjukkan bahwa dari jam ke-0 sampai dengan jam ke-64 terjadi penurunan gula dari 27.92 g/L menjadi 4.16 g/L, sehingga pada jam ke-64 gula telah dikonsumsi sebesar 85% (Gambar 6). Penurunan gula sisa tertinggi terjadi pada selang waktu 2-4 jam karena bakteri berada pada fase lag, fase bakteri membutuhkan energi untuk pertumbuhan sel. Tingginya gula yang dikonsumsi oleh bakteri menunjukkan bahwa bakteri hidup dalam media gula yang cocok bagi pertumbuhannya. Sumber karbon dalam MRS cair adalah glukosa murni ditambah tetes tebu yang telah dihidrolisis.
Penurunan gula total dalam larutan media berlangsung dengan laju yang tinggi pada jam ke-0 hingga jam ke-64 disebabkan karena Lactobacillus delbrueckii subsp. bulgaricus dapat dengan mudah mengkonsumsi gula-gula sederhana dalam media. Semakin tinggi konsentrasi gula total semakin banyak subsrat (sumber karbon) yang dapat digunakan oleh bakteri. Dengan demikian bakteri mempunyai sumber karbon yang berlimpah sehingga akan memperpanjang fase eksponensial. Namun, jika pemecahan substrat secara berlebihan terus berlangsung, maka akan menyebabkan terakumulasinya asam laktat secara berlebihan pada media fermentasi sehingga akan
menghambat pertumbuhan mikrob (Mirdamadi et al. 2002). Maka pemberian substrat yang berlebihan dapat dicegah dengan menggunakan konsentrasi substrat secara tepat. Pada penelitian ini, kadar asam laktat yang dihasilkan berbanding terbalik dengan gula total sisa pada fermentasi (Gambar 7).
Gambar 6 Pola penurunan gula sisa selama fermentasi dalam MRS cair yang ditambah 0.5% tetes tebu pada suhu 42°C dan agitasi 150 rpm
Gambar 7 Hubungan antara kadar asam laktat dengan gula total sisa selama fermentasi pada media yang ditambahkan 0.5% tetes tebu suhu 42 °C dan agitasi 150 rpm
0 5 10 15 20 25 30
0 20 40 60 80
T o ta l g u la s is a ( g /L )
Lama fermentasi (jam)
gula total sisa
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9
0 20 40 60 80
K a d a r a sa m l a k ta t (% ) d a n t o ta l g u la s is a ( g /L )
Lama fermentasi (jam)
kadar asam laktat
11
Penelitian yang dilakukan oleh Petry et al. (2000), menyebutkan bahwa Lactobacillus bulgaricus hanya dapat memanfaatkan glukosa sebanyak 2.0-3.5 g/ L dalam fase eksponensial dan 8.0 g/ L pada fase stasioner karena bakteri memerlukan banyak energi untuk mengubah substrat menjadi produk metabolit yang dapat mematikan bakteri penggangu. Pada penelitian ini, gula yang berasal dari tetes tebu dapat digunakan sebagai sumber karbon bagi bakteri. Hal ini terjadi karena bakteri dapat beradaptasi dengan baik pada media yang diberi 0.5% tetes tebu yang diambil dari tetes tebu yang berkonsentrasi 100 g/L. Pernyataan ini diperkuat dengan adanya kurva antara kadar asam laktat dan gula total sisa menunjukkan hubungan yang berbanding terbalik. Semakin tinggi kadar asam laktat, maka semakin rendah gula total sisa pada cairan fermentasi.
Pola Produksi Kadar Asam Laktat dan Pola Penurunan pH selama Fermentasi
Komposisi media fermentasi yang digunakan untuk produksi asam laktat akan berpengaruh terhadap kinerja sel. Unsur-unsur dalam media produksi meliputi ekstrak khamir, garam-garam mineral, dan glukosa. Glukosa pada media digunakan sebagai sumber karbon, sedangkan ekstrak khamir digunakan sebagai sumber nitrogen. Garam-garam mineral dalam penelitian ini adalah MgSO4.7H2O dan K2HPO4. Beberapa logam dan mineral berpengaruh pada pertumbuhan sel dan fermentasi. Salah satunya adalah magnesium. Ion magnesium adalah esensial untuk produksi enzim dan berperan sebagai aktivator untuk beberapa enzim (Birch et al. 2003). Nutrisi lengkap yang terkandung dalam media produksi ini bertujuan agar sel dapat tumbuh dengan optimum sehingga dapat menghasilkan kadar asam laktat yang tinggi. Perhitungan kadar asam laktat dilakukan untuk mengetahui kadar asam laktat yang dihasilkan pada saat fermentasi oleh bakteri Lactobacillus delbrueckii subsp. bulgaricus.
Selain itu, lama fermentasi juga berpengaruh terhadap pembentukan total asam, karena semakin lama fermentasi, bakteri Lactobacillus delbrueckii subsp. bulgaricus mengalami peningkatan jumlah sel sehingga menghasilkan asam laktat semakin banyak (Astawan 2008). Berdasarkan kurva pertumbuhan bakteri, maka waktu yang digunakan untuk melakukan produksi asam laktat adalah selama 24 jam.
Pada penelitian ini asam laktat diukur melalui metode titrasi. Total asam secara tidak
langsung menunjukkan asam laktat yang dihasilkan. Metode titrasi hanya mengukur titik ekuivalen nilai pH, dimana asam yang terbentuk selama proses fermentasi akan dinetralkan dengan basa (NaOH) sebagai peniternya, sehingga konsentrasi asam laktat yang sebenarnya tidak dapat diketahui dan membutuhkan analisis lain yang lebih spesifik seperti KCKT. Titrasi asam basa merupakan metode yang sudah banyak digunakan oleh para peneliti sebelumnya. Metode ini mudah digunakan, harganya murah, serta mudah ditemukan di laboratorium.
Perhitungan kadar asam laktat pada jam ke-2, 4, 8, 16, 32, 48, dan 64 jam. Pada rentang jam ke-16 sampai jam ke-64 dihasilkan asam laktat sebesar 0.7641%-0.8150%. Asam laktat total yang dihasilkan yaitu sebesar 0.1019%-0.8150%. Hasil ini mendekati Standar Nasional Indonesia untuk produksi asam laktat dari hasil fermentasi (1992) yaitu 0.5%-2%.
Selain itu, perhitungan nilai derajat keasaman yang bertujuan untuk mengetahui nilai pH yang nilainya akan berbanding terbalik dengan kadar asam laktat dalam larutan fermentasi. Semakin tinggi kadar asam laktat maka pH larutan fermentasi akan semakin rendah (Gambar 8). Kadar asam laktat tertinggi terjadi pada selang waktu 16-32 jam sesuai dengan penurunan pH pada larutan fermentasi.
Pada penelitian ini nilai pH sangat berkaitan dengan kadar asam laktat. Asam laktat merupakan salah satu metabolit primer yang dihasilkan dalam proses fermentasi. Penurunan nilai pH menunjukkan pembentukan asam organik akibat metabolisme mikrob. Hal ini didukung dengan pernyataan Sunatmo (2009), bahwa pada media fermentasi, pH dapat berubah selama pertumbuhan berlangsung sebagai akibat reaksi metabolisme yang mengkonsumsi atau menghasilkan substansi asam atau basa. Bakteri Lactobacillus delbrueckii subsp. bulgaricus merupakan bakteri asam laktat yang bersifat homofermentatif (Hidayat et al. 2006), sehingga sangat cocok digunakan sebagai bakteri penghasil asam laktat.
12
akan berpengaruh terhadap produksi asam laktat. Adanya akumulasi asam laktat menyebabkan penurunan pH. Asam laktat yang tinggi dan pH yang rendah mempunyai fungsi sebagai antibakteri yaitu menghambat pertumbuhan bakteri patogen.
Perhitungan derajat keasamaan (pH) dilakukan pada jam ke-0, 2, 4, 8, 16, 32, 48, dan 64 jam. Hasilnya menunjukkan bahwa pH pada jam ke-0 sebesar 5.915 dan pH pada jam ke 64 sebesar 3.895 (Gambar 8). Hasil ini sesuai dengan pernyataan bahwa pola pembentukan asam total sebanding dengan pembentukan asam laktat. Kadar asam laktat tertinggi terjadi pada selang waktu 16-64 jam yaitu dari 0.7132-0.8150. Berdasarkan hasil tersebut, nilai asam total yang terbentuk selama fermentasi meningkat dengan bertambahnya waktu fermentasi.
Gambar 8 Hubungan antara kadar asam laktat dengan nilai pH selama fermentasi
Hasil Ekstraksi dan Analisis Kualitatif Asam Laktat dengan KCKT
Asam laktat yang dihasilkan oleh Lactobacillus delbrueckii subsp. bulgaricus dalam larutan media fermentasi disaring dengan membran filtrasi berukuran 0.45 µm dan 0.22 µm (Sikder et al. 2012). Penyaringan ini bertujuan untuk memisahkan bakteri dan khamir dari larutan hasil fermentasi. Penelitian ini menggunakan media 500 mL media MRS yang ditambah 0.5% tetes tebu. Inokulum bakteri yang digunakan sebanyak 1%. Fermentasi asam laktat dilakukan selama 24 jam sesuai dengan hasil penelitian sebelumnya yang menunjukkan bahwa kadar asam laktat yang tertinggi terdapat pada selang waktu antara 16-32 jam. Selanjutnya, dilakukan filtrasi untuk memisahkan bakteri dan evaporasi untuk memekatkan asam laktat.
Hasil penelitian menunjukkan bahwa pada fermentasi selama 24 jam, biomassa sel kering yang dihasilkan sebesar 0.002 g/L, sampel mempunyai pH sebesar 4.0, dan asam laktat yang dihasilkan sebesar 2.80% (28 g/L). Hasil ini didapat setelah dilakukan filtrasi dan pemekatan sebesar 50%. Asam laktat yang dihasilkan dari proses ini lebih besar daripada asam laktat yang dihasilkan dari fermentasi dengan media hidrolisat pati sagu yang sebesar 1.244%. (Aulana 2005). Analisis HPLC menunjukkan bahwa asam yang dihasilkan adalah asam laktat (Lampiran 4). Hal ini dapat dilihat dari waktu retensi yang sama antara larutan standar asam laktat dengan sampel. Kromatogram sampel menunjukkan bahwa sampel belum 100% murni asam laktat. Oleh karena itu, sangat diperlukan metode yang efektif untuk pemurnian asam laktat yang berasal dari hasil fermentasi.
SIMPULAN
Tetes tebu dapat digunakan sebagai salah satu alternatif sumber karbon untuk produksi asam laktat oleh Lactobacillus delbrueckii subsp. bulgaricus dengan konsentrasi gula total 1090 g/ L. Lactobacillus delbrueckii subsp. bulgaricus memiliki pertumbuhan yang optimum pada suhu 42 °C dengan kecepatan agitasi 150 rpm. Produksi asam laktat oleh L. delbrueckii subsp. bulgaricus dengan 0.5% tetes tebu sebagai sumber karbon pada media MRS (27.92 g/L) mencapai optimum pada jam ke-24 dengan kadar asam laktat sebesar 2.800% dan biomassa sel kering sebesar 0.002 g/ L serta pH media fermentasi sebesar 4.0. Analisis kualitatif dengan menggunakan KCKT menunjukkan bahwa asam laktat adalah produk yang dihasilkan dari proses fermentasi.
SARAN
Perlu dilakukan optimasi konsentrasi tetes tebu untuk produksi asam laktat oleh Lactobacillus delbrueckii subsp bulgaricus. Selain itu, perlu dilakukan pemurnian lanjutan untuk memperoleh asam laktat yang murni sebagai hasil fermentasi sehingga asam laktat dapat digunakan sebagai bahan dasar pembuatan PLA.
DAFTAR PUSTAKA
AOAC. 1998. Official Method of Analysis of The Association of Official Analytical Chemist. Washington. 0 1 2 3 4 5 6 7
0 20 40 60 80
n il a i p H d a n a sa m l a k ta t (% )
Lama fermentasi (jam)
kadar asam laktat
13
Astawan M. 2008. Brem. [terhubung berkala].http://cyberned.cbn.net [29 April 2012].
Aulana LN. 2005. Pemanfaatan hidrolisat pati sagu untuk produksi asam laktat oleh Lactobacillus casei FNCC 266. [Skripsi]. Bogor: Institut Pertanian Bogor.
Bintang M. 2010. Biokimia Teknik Penelitian. Jakarta: Erlangga.
Birch RM, Ciani M, Walker GM. 2003. Magnesium, calcium, and fermentative metabolismin wine yeast. J Wine Res 14: 3-15.
Burtord MA, Thompson PJ, Malntosh RP, Bauman RH, Pearson DC. 2003. Nutrient and microbial dynamics in high-intensity. Zeroexchange Shrimp Ponds in Belize. Aquaculture 219 (1-4):393-411.
Cabo ML, Braber AF, Koenreaad PM. 2002. Apparent antifungal activity of several lactic acid bacteria againts Penicillium discolor is due to to acetic acid in the medium. Journal of Food Protection 65:1309-1316.
Carvalho W et al. 2002. Use of immobilized candida yeast cell for xylitol production from sugarcane bagasse hydrolisate. Applied Biochem and Biotechnology 98:489-496.
Darni Y, Chici A, Ismiyati D. 2008. Sintesa bioplastik dari pisang dan gelatin dengan palsticizer gliserol. Di dalam: Prosiding Seminar Nasional Sains dan Teknologi-II2008. Lampung: Univeritas Lampung.
Dumbrepatil A, Adsul M, Chaudari S, Khire J, Gokhale D. 2008. Utilization of molasses sugar for lactic acid production by Lactobacillus delbrueckii subsp. bulgaricus mutant Uc-3 in batch fermentation. Applied and Evironmental Microbiology 77(1):333-335.
Gesciova J, Bury D, Jelen P. 2002. Methods for discruption of microbial cells for potential use in the dairy industri. International Dairy Journal 12(6):541-553.
Hidayat N, Padaga MC, Suhartini S. 2006. Mikrobiologi Industri. Yogyakarta: Andi Offset.
[ICN] Indonesia Commercial Newslatter. 2010. Pengembangan perkebunan tebu menuju swasembada gula. [terhubung
berkala]http://www.datacon.co.id[20 Desember 2011].
Jimenez AM, Borja R, Martin A. 2004. A comparative kinetic evaluation of the anaerobic digestion of untreated molases and molases previously fermented with Penicillium decumbens in batch reactors. Biochemical Engineering Journal 18 (2):121-132.
Jumbho J. 2011. Asam laktat. [terhubung berkala
]
http://modernjumb.blogspot.com/s earch/label/Asam%20laktat [3 Juli 2012 ].Koesnandar. 2004. Penelitian dan pengembangan asam laktat di Indonesia. Simposium asam laktat: Peluang dan aplikasi di industri. 20 April 2004. Jakarta: Badan Pengkajian dan Penerapan Teknologi .
Laverentz B et al. 2006. Biocontrol of the food-borne pathogens Listeria monocytogenes and Salmonella enterica serovar poona on fresh-cut apples with naturally occuring bacterial and yeast antagonist. Appllied and Environmental Microbiology p:1854-1857
Lu Y, Chen SC. 2004. Micro and nanofabrication of biodegradable polymers for drug delivery. Advanced Drug Delivery Reviews 56:1621-1633.
Mirdamadi SH et al. 2002. Comparison of lactic acid isomers produced by fungal and bacterial strains. Iran Biomedic Journal 6 (2):69-75.
Narayan N, Pradip KR, Aradhana S. 2004. L (-) lactid acid fermentation and its product polymerization. Elect Biotechnol 7:167-168.
Petry S, Furlan S, Crepeau MJ, Cerning J, Desmazeud M. 2000. Factors affecting exocelluler polysaccharide production by lactobacillus delbrueckii subsp. bulgaricus grown in a chemically defined medium. Applied and Environmental Microbiology 66 (8):3427-3431.
Pranamuda H. 2001. Bahan Bioplastik Berbahan Baku Pati Tropis. Jakarta: BPPT.
Prescott AM, Harley JP, Aklein D. 2002. Microbiology. New York: McGraw-Hill.
Putra EDL. 2004. Kromatografi cair kinerja tinggi dalam bidang farmasi. [skripsi]. Medan: Fakultas Farmasi, Universitas Sumatra Medan.
Quan ZX, Jin YS, Yin CR, Lee JJ, Lee ST. 2005. Hydrolyzed molases as an external carbon source in biological nitrogen removal. Bioresource Technology 96 (15):1690-1695.
Rao RS, Jyothi CP, Prakasham RS, Sarma PN, Rao LV. 2006. Xylitol production form corn fiber and sugarcane bagasse hydrolisate by Candida tropicalis. Bioresource Technology 97:1974-1978.
Riekri. 2010. Produksi PLA dan pengembangannya. [terhubung berkala] http://riekonaicha.co.cc [9 Desember 2011].
Robbani MN. 2004. Biodegradasi struktur dan morfologi mikrosfer polilaktat [skripsi]. Bogor: Departemen Kimia, Institut Pertanian Bogor.
Sikder J, Roy M, Dey P, Pal P. 2012. Techno-economic analysis of membrane-integrated bioreactor system for production of lactic acid from sugarcane juice. Biochemical Engineering Journal 63:81.87.
Sodegard A, Stolt M. 2002. Properties of lactic acid based polymer and their correlation with composition. Programme Polymer Science 27: 1123-1163.
Sunatmo TI. 2009. Mikrobiologi Esensial. Jakarta: Ardy Agency.
Surono IS. 2004. Probiotik, Susu Fermentasi, dan Kesehatan. Jakarta: TRICK.
Suskovic J, Blazenka K, Jandraka G, Sreeko M. 2001. Role of lactic acid bacteria and Bifidobacteria in symbiotic effect. Food Technology and Biotechnology 39:227-235.
Taiyeb M et al. 2011. Penuntun Praktikum Analisis Gizi Pangan. Makassar: Laboratorium Biologi FMIPA UNM.
Takeuchi Y. Struktur senyawa karbon. 2008.[terhubung berkala]http//:chem-is-try.org[3 Juli 2012].
Todorov SD, Dicks LMT. 2007. Bacteriocin production by Lactobacillus pentosus ST712BZ isolated from boza. Brazilian Journal of Microbiology 38:1.
Tortora GJ, Funke BR, Case CL. 2006. Microbiology: an Introduction 9th ed. San Fransisco: Pearson Education.
Toshi. 2003. Fakta mengenai plastik. [terhubung berkala]http://jakartahijau.blog spot.com [6November 2011].
Utari SM, Darni Y, Utami H. 2008. Pemanfaatan agar-agar Gracilarna cornonapifolia dan kitosan untuk pembuatan bioplastik dengan gliserol sebagai plasticizer. Di dalam: Prosiding Seminar Nasional Sains dan Teknologi-II 2008. Lampung: Universitas Lampung.
Yuliatun S, Kurniawan Y. 2008. Detoksifikasi ampas tebu sebagai perlakuan pendahuluan substrat fermentasi bioetanol. MPG 44 (4):249-258.
15
Lampiran 1 Strategi penelitian
Ekstraksi dengan mikrofiltrasi dan analisis
kualitatif asam laktat dengan KCKT
Analisis kadar asam laktat (%)
Analisis pola penurunan pH selama fermentasi
Produksi asam laktat
Persiapan alat dan bahan
Proses hidrolisis dan detoksifikasi tetes tebu
Analisis gula total tetes tebu
Pembuatan kurva pertumbuhan
L. delbrueckii
subsp.bulgaricus
17
Lampiran 2 Analisis gula total tetes tebu
Analisis kadar gula total dengan metode fenol sulfat (Bintang 2010)
a.
Pembuatan Kurva Standar
Larutan gula standar dengan konsentrasi gula 0, 25, 50, 75, 100, 125, dan
150 ppm diambil 0.5 mL. Masing-masing dimasukkan ke dalam tabung
reaksi dan ditambahkan 0.5 mL larutan fenol 5%, lalu divorteks.
Selanjutnya, ditambahkan 2.5 mL larutan asam sulfat pekat dengan cepat
dan divorteks. Kemudian didinginkan pada suhu kamar. Larutan diukur
absorbansinya pada panjang gelombang 490 nm.
b.
Penetapan Konsentrasi Gula Total pada Sampel
Penetapan konsentrasi gula total pada sampel dilakukan seperti pada
penetapan kurva standar kemudian ditentukan total gula sampel sebagai
glukosa
Gambar Kurva standar glukosa
Tabel Hasil analisis gula total tetes tebu dengan 9000 kali pengenceran.
Contoh perhitungan:
Absorbasi rataan -0.004=0.005x
x= a *9000/1000 g/L
y = 0.0057x + 0.0046 R² = 0.9983
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1
0 20 40 60 80 100 120 140 160
A
b
so
rb
an
si
Konsentrasi (ppm)
No Sampel Ulangan 1
Ulangan 2
Rataan Ulangan 1(blanko)
Ulangan 2(blanko)
rataan Y=0.005x+0.004 Kadar Gula (g/L)
a b
Lampiran 3 Diagram alir proses produksi asam laktat oleh bakteri
L. delbrueckii
subsp.
bulgaricus
Kultur murni
L. delbrueckii
subsp.
bulgaricus
Peremajaan dalam media
MRS selama 48 jam dalam
suhu 42
°C dan agitasi 150
rpm,
Inokulasikan (1%) ke dalam Labu
Erlenmeyer yang berisi 500 ml
medium
MRS
cair yang telah
ditambahkan 0.5% tetes tebu.
Inkubasi dalam
waterbath shaker
dengan agitasi 150 rpm, suhu 42
°C
selama 2, 4, 8, 16, 32, 48, dan 64 jam
Analisis hasil fermentasi
yang meliputi pH, bobot sel
kering, asam total, gula
total, dan analisa KCKT
19
Produksi Asam Laktat oleh
Lactobacillus delbrueckii
subsp
. bulgaricus.
Dibimbing oleh SURYANI dan SUMINAR SETIATI ACHMADI.
ABSTRACT
LAITA NURJANNAH. Molasses as an Alternative Carbon Source in Lactic Acid
Production by
Lactobacillus delbrueckii
subsp.
bulgaricus
. Supervised by
SURYANI and SUMINAR SETIATI ACHMADI.
PENDAHULUAN
Asam laktat merupakan senyawa antara yang penting dan memiliki potensi besar untuk aplikasi produk baru seperti plastik ramah lingkungan atau plastik biodegradabel (PLA), bahan polimer untuk aplikasi bidang farmasi dan kedokteran, serta mengatur pertumbuhan tanaman (Koesnandar 2004).
Asam laktat dibutuhkan pada industri pembuatan plastik biodegradabel. Pembuatan plastik yang biodegradabel sangat diperlukan untuk mengurangi pencemaran lingkungan, terlebih lagi dengan adanya peningkatan sampah plastik. Fakta lain juga menyebutkan bahwa setiap tahun penduduk dunia menggunakan 500 miliar kantong plastik. Perhitungan statistika menunjukkan bahwa dihasilkan satu juta kantong plastik tiap menitnya. Sampah plastik dari sektor pertanian telah mencapai 100 juta ton, sehingga tidak tertutup kemungkinan bahwa bumi akan terbungkus sampah plastik sebanyak sepuluh kali lipat (Toshi 2003). Kini, kesadaran penduduk dunia pada lingkungan semakin meningkat seiring meningkatnya masalah lingkungan yang timbul akibat kegiatan manusia sehari-hari. Salah satu sumber indikator tersebut adalah meningkatnya jumlah produk bioplastik dari tahun ke tahun. Data dari Badan Pusat Statistik (BPS) yang dikutip oleh Pranamuda (2001) menyebutkan bahwa produksi bioplastik diproyeksikan akan mencapai 1200000 ton atau menjadi 1/10 dari total produksi bahan plastik pada tahun 2010. Jumlah ini meningkat seribu kali dari produksi bioplastik pada tahun 1999, yaitu 2500 ton atau 1/10000 kali dari produksi bahan plastik.
Perkembangan ilmu pengetahuan dan teknologi menghasilkan bahan-bahan plastik yang bersifat biodegradabel seperti kolagen, kasein, protein dan lipid yang berasal dari hewan dan tumbuhan (Utari et al. 2008). Akan tetapi, bahan yang paling potensial adalah plastik yang berbahan poliasam laktat atau PLA (polylactic acid ) (Darni 2008). Penggunaan PLA tidak hanya terbatas pada bahan pembuatan bioplastik, tetapi PLA dapat dikembangkan sebagai bahan penyalut atau pengungkung obat (Robbani 2004; Lu & Chen 2004), industri medis, dan industri tekstil. Substrat untuk pembuatan plastik PLA dengan menggunakan mikrob paling banyak terbuat dari jagung, singkong, dan sagu. Nam