Lampiran. 1. Alat dan Bahan Penelitian
Tube racks Microtubes
Micropipette Microtips
Vortex Centrifuge
Lampiran 1. Lanjutan
Komputer GelDoc (UV Transilluminator)
Freezer Qubit 2.0 fluorometri (invitrogen)
Cetakan agar Hot Plate
Lampiran 1. Lanjutan
Embrio Larva
kit ekstraksi DNA Qubit dsDNA HS Assay Kit
kit ekstraksi RNA (Tri Reagent) Kit sintesis DNA
Lampiran 2. Dokumentasi Kegiatan Penelitian
Proses pengambilan sampel embrio dan larva (collecting sample)
Proses Ekstraksi DNA dan RNA
Proses pencampuran sampel dengan reagent menggunakan vortex
Lampiran 2. Lanjutan
Cek konsentrasi genom
Amplifikasi DNA melalui PCR
Proses elektroforesis
Lampiran 3. Perhitungan volume reagent dan amplifikasi PCR Perhitungan volume reagent PCR
Bahan (Reagent)
Volume (µL)
Volume (µL) Nuklease Free Water (NFW) 3,5 µL x 15 52,5 µL
Master Mix 12,5 µL x 15 187,5 µL
Primer Forward 2 µL x 15 30 µL
Primer Reverse 2 µL x 15 30 µL
Total 300 µL / 15 = 20 µL
Template (Sampel) @5 µL
Total volume 25 µL/ sampel
Tahapan amplifikasi PCR
Tahapan Suhu
(oC)
Waktu Jumlah Siklus
Pre Denaturation 95 3 menit 1 kali
Denaturation 94 30 detik 35 kali
Annealing 55 1 menit 35 kali
Extension 72 1 menit 35 kali
Lampiran 4. Data konsentrasi genom DNA embrio dan larva Transgenik F3 Konsentrasi DNA Genom Embrio
Lampiran 4. Lanjutan
Konsentrasi DNA Genom Larva
Lampiran 5. Data konsentrasi genom RNA embrio dan larva Transgenik F3 Konsentrasi RNA Genom Embrio
Lampiran 5. Lanjutan
Konsentrasi RNA Genom Larva
DAFTAR PUSTAKA
Akinwole, A.O., A.F. Bankola., A.B. Dauda dan O.E. Saliu. 2014. Growth and Survival of Clarias Gariepinus (Burchell 1822) Fingerlings Cultured at Different Stocking Densities in Igboora, Oyo State, Nigeria. Journal of Agriculture and Biodiversity Research. 3(4): 58-60.
Alimuddin., G. Yoshizaki., O. Carman dan K. Sumantadinata. 2003. Aplikasi Transfer Gen Dalam Akuakultur. Jurnal Akuakultur Indonesia. 2(1): 41-50.
Alimuddin., L.I. Purwanti., M.H.F. Ath-thar., C. Muluk., O. Carman dan K. Sumantadinata. 2008. Aktivitas Promoter B-actin Ikan Medaka Jepang (Oryzias latipes) pada Ikan Mas (Cyprinus carpio). Jurnal Natur Indonesia. 11(2): 70-77.
Aris, M., Sukenda., E. Harris., M.F. Sukadi dan M. Yuhana. 2013. Identifikasi molekular bakteri patogen dan desain primer PCR (Molecular identification of pathogenic bacteria and PCR specific primer design). Jurnal Budidaya Perairan. 1(3): 43-50.
Bayer, T.A dan J.A. Campos-Ortega. 1992. A Transgene Containing Lacz is Expressed In Primary Sensory Neurons In Zebrafish. Journal of Development. 115: 421-426.
Beardmore, J.A dan J.S. Porter. 2003. Genetically Modified Organisms and Aquaculture. FAO Fisheries Circular. No. 989. Rome. 35p.
Badan Penelitian dan Pengembangan Kelautan dan Perikanan. 2012. Pembentukan Strain Ikan Lele Cepat Tumbuh. Kementrian Kelautan dan Perikanan.
Canosa, L.F., J.P. Chang dan R.E. Peter. Neuroendocrine Control of Growth Hormone in Fish. General and Comparative Endocrinology. 151: 1-26. Chapman dan Hall. 1995. Molecular Genetics in Fisheries. T J Press (Padstow)
Ltd. London
Cheng, C.A., K.L. Lu., E.L. Lau., T.Y. Yang., C.Y. Lee., J.L. Wu dan C.Y. Chang. 2002. Growth Promotion in Ayu (Plecoglossus altivelis) by Gene Transfer of The Rainbow Trout Growth Hormone Gene. Journal of Zoological Studies. 41(3): 303-310.
Devlin, R.H., T.Y. Yesaki., C.A. Biagi., E.M. Donaldson., P. Swanson dan W-K. Chan. 1994. Extraordinary Salmon Growth. Jurnal of Nature. 371: 209– 210.
Devlin, R.H., T.Y.Yesaki., E.M. Donalson dan C.L. Hew. Transmission and Phenotypic Effects of an Antifreeze/GH Gene Construct in Coho Salmon (Oncorhynchus kisutch). Journal of Aquaculture. 137: 161-169.
Dewi, R.R.S.P.S., H. Marnis., R. Suprapto dan N. Syawalia. 2013. Produksi Ikan Lele Cepat Tumbuh Generasi F-0 Menggunakan Metode Transgenesis. Jurnal Riset Akuakultur. 8(2): 173-180.
Ding, Y.E., Z.Z. Yan dan S.Y. Hua. 2015. Fish Genome Manipulation and Directional Breeding. Journal of Sciences China Life Sci. 58: 170-177 Dunham, R.A., G. Warr., A. Nichols., P.L. Duncan., B. Argue., D. Middleton dan
Z. Liu. 2002. Enhanced Bacterial Disease Resistance of Transgenic Channel Catfish (Ictalarus punctatus) Possessing Cecropin Genes. Journal of Marine Biotechnology. 4: 338-344.
Du, S.J., Z. Gong., G.L. Fletcher., M.A. Shears., M.J. King., D.R. Idler dan C.L. Hew. 1992. Growth Enhancement In Transgenic Atlantic SalmonBy The Use of An “All Fish” Chimeric Growth Hormone Gene Construct. Journal Nature Biotecthnology. 10: 176-181
Faqih, A. R. 2011. Penurunan Motilitas dan Daya Fertilitas Sperma Ikan Lele Dumbo (Clarias spp) Pasca Perlakuan Stress Kejutan Listrik. Journal of Exp. Life Science. 1(2) : 56-110.
Fletcher, G.L dan P.L. Davies. 1991. Transgenic Fish For Aquaculture. Journal of Genetic Engineering. 13: 331-370
Gabriel, U.U., G.N.O. Ezeri dan O.O. Opabunmi. 2004. Influence of Sex, Source, Health Status and Acclimation on the Haematology of Clarias Gariepinus (Burch,1822). African Journal of Biotechnology. 3(9): 463-467.
Garlagher, S.R. 2004. Quantitation of DNA and RNA with Absorption and Fluorescence Spectroscopy. Current Protocols in Molecular Biology. A.3D.1-A.3D.12
Hew, C.L dan G.L. Fletcher. 2001. The Role of Aquatic Biotechnology in Aquaculture. Journal of Aquaculture. 197: 191-204.
Huang, C.J., T.S. Jou., Y.L. Ho., W.H. Lee., Y.T. Jeng., F.J. Hsieh dan H.J. Tsai. 2005. Conditional Expression of a MyocardiumSpecific Transgene in Zebrafish Transgenic Lines. Journal of Developmental Dynamics. 233: 1294-1303.
Hulata, G. 2001. Genetic Manipulations in Aquaculture: A Review of Stock Improvement by Classical and Modern Technologies. Journal of Genetica. 111: 155-173.
Inoue, K., S. Yamashita., J-i. Hata., S. Kabeno. S. Asada., E. Nagahisa dan T. Fujita. Elecctroporation as A New Technique For Producing Transgenic Fish. Journal of Cell Differentiation and Development. 29: 123-128.
Iyengar, A., F. Muller dan MacLean. 1996. Regulation and expression of transgenes in fish. Journal of Transgenic Research. 5: 147-166.
Kinoshita, M., M. Yamauchi., M. Sasanuma., Y. Ishikawa., T. Osada., K. Inoue., Y. Wakamatsu dan K. Ozato. 2003. A Transgene and Its Expression Profile are Stably Transmitted to Offspring in Transgenic Medaka Generated by the Particle Gun Method. Journal of Zoological Science. 20: 869-875
Kobayashi, S., Alimuddin., T. Morita., M. Miwa., J. Lu., M. Endo., T. Takeuchi dan G. Yoshizaki. 2007. Transgenic Nile Tilapia (Oreochromis niloticus) Over-expressing Growth Hormone Show Reduced Ammonia Excretion. Journal of Aquaculture. 270: 427-435.
Kottelat, M., A.J. Whitten., S.N. Kartikasari dan S. Wirjoatmojo. 1993. Freshwater Fishes of Western Indonesia and Sulawesi. Barkeley Book. Pte Ltd, Terrer Road. Singapore.
Liu, Z.J dan J.F. Cordes. 2004. DNA Marker Technologies and Their Applications in Aquaculture Genetics. Journal of Aquaculture. 238: 1-37.
Liu, Z., B. Moav., A.J. Faraz., K.S. Guise., A.R. Kapuscinski dan P.B. Hackett. 1990. Functional Analysis of Elements Affecting Expression of the β-Actin Gene of Carp. Journal of Molecular and Cellular Biology. 10(7): 3432-3440.
Lu, Y., J.M. Thomson., H.Y.F. Wong., S.M. Hammond dan B.L.M. Hogan. 2007. Lu, J.K., B.H. Fu., J.L.Wu dan T.T. Chen. 2002. Production of Transgenic Silver Sea Bream (Sparus sarba) by Different Gene Transfer Methods. Journal of Marine Biotechnology. 4: 328–337.
Siam Pada Ikan Lele Afrika (Clarias gariepinus) Transgenik F-2. Jurnal Riset Akuakultur. 9(2): 179-190
Marnis, H., B. Iswanto., R. Suprapto dan Imron. 2013. Expression of Growth Hormone (PhGH) Gene and Analysis of Insuline-Like Growth Factor I (IGF-I) Production In African Catfish (Clarias gariepinus) Transgenic F-1. Journal of Indonesian Aquaculture. 8(2): 113-119.
Martinez, R., A. Arenal., M.P. Estrada., F. Herrera., V. Huerta., J. Vazquez., T. Sanchez dan J.D.L. Fuente. 2000. Mendelian Transmission, Transgene Dosage and Growth Phenotype in Transgenic Tilapia (Oreochromis Hornorum) Showing Ectopic Expression of Homologous Growth Hormone. Journal of Aquaculture. 173: 271-283.
Melamed, P., Z. Gong., G. Fletcher dan C.L. Hew. 2002. The Potential Impact of Modern Biotechnology on Fish Aquaculture. Journal of Aquaculture. 204: 255-269
Murakami, Y., K. Motohashi., K. Yano., K. Ikebukuro., K. Yokoyama., E. Tamiya dan I. Karube. 1994. Micromachined Electroporation System For Transgenic Fish. Journal of Biotechnology. 34: 35-42.
Nam, Y.K., C.H. Noh dan D.S. Kim. 1998. Transmission And Expression of An Integrated Reporter Construct In Three Generations of Transgenic Mud Loach (Misgurnus mizolepis). Journal of Aquaculture. 172: 229-245. Noer, A.S dan M. Gustiananda. 2007. PCR Tanpa Isolasi DNA dari Sel Epitel
Rongga Mulut. JMS. 2(1): 35-45
Ono, H., E. Hirose., K. Miyazaki., H. Yamamoto dan J. Matsumoto. 1997. Transgenic Medaka Fish Bearing the Mouse Tyrosinase Gene: Expression and Transmission of the Transgene Following Electroporation of the Orange-Colored Variant. Journal of Pigment Cell Research. 10: 168-175 Parenrengi, A., Alimuddin., Sukenda., K. Sumantadinata dan A. Tenriulo. 2009.
Karakteristik Sekuen cDNA Pengkode Gen Anti Virus dari Udang Windu, Penaeus monodon. Jurnal Riset Akuakultur. 4(1): 1-13.
Pharmawati, M. 2009. Optimalisasi Ekstraksi DNA dan PCR-RAPD pada Grevillea spp. (Proteaceae). Jurnal Biologi. 13(1): 12-16
Reinecke, M., B.T. Bjornsson., W.W. Dickhoff., S.D. McCormick., I. Navarro., D.M. Power dan J. Gutierrez. 2005. Growth Hormone and Insulin-Like Growth Factors in Fish: Where We Are and Where To Go. General and Comparative Endocrinology. 142: 20-24.
Restu, M., Mukrimin dan Gusmiaty. 2012. Optimalisasi Teknik Ekstraksi dan Isolasi DNA Tanaman Suren (Toona Sureni Merr.) untuk Analisis Keragaman Genetik berdasarkan Random Amplified Polymorphic DNA (RAPD). Jurnal Natur Indonesia 14(2): 138-142.
Sambrook, J dan Russel, D.W. 2001. Molecular Cloning A Laboratory manual. Cold Spring Harbor Laboratory press. Cold Spring Harbor NY USA
Subyakto, S., G. Triastutik., Rustidja., K. Sumantadinata., Alimuddin., M.S. Jati., I. Faizal dan R.S. Allah. 2010. Penggunaan Metode Mikroinjeksi dan Elektroporasi Dalam Transfer Gen Hormon Pertumbuhan (GH) Pada Ikan Kerapu Tikus (Cromileptes altivelis). Jurnal Omni-Akuatika. 9(10): 1-8 Tanaka, M dan M. Kinoshita. 2001. Recent Progress in the Generation of
Transgenic Medaka (Oryzias latipes). Journal of Zoological Science. 18: 615-622.
Ulufayo, M. 2009. Haematological Characteristics of Clarias Gariepinus (Burchell 1822) Juveniles Exposed to Derris Elliptica Root Powder. African Journal of Food Agriculture Nutrition and Development. 9(3): 920-933
Vitule, J.R.S., S.C. Umbria dan J.M.R. Aranha. 2006. Introduction of the African Catfish (Clarias gariepinus) (BURCHELL, 1822) Into Southern Brazil. Journal of Biological Invasions. 8: 677-681.
Wei, H dan Z.Z. Yan. 2010. Integration Mechanisms of Transgenes and Population Fitness of GH Transgenic Fish. Journal of Science China Life Sciences. 53(4): 401-408.
Xie, Y., D. Liu., J. Zou., G. Li dan Z. Zhu. 1993. Gene Transfer Via Electroporation in Fish. Journal of Aquaculture. 111: 207-213.
Yalcin, S., K. Solak dan I. Akyurt. 2001. Certain Reproductive Characteristics of the Catfish (Clarias gariepinus Burchell, 1822) Living in the River Asi, Turkey. Turkey Journal Zoologycal. 25: 453-460.
Yazawa, R., I. Hirono dan T. Aoki. 2005. Characterization of Promoter Activities of Four Different Japanese Flounder Promoters in Transgenic Zebrafish . Journal of Marine Biotechnology. 7: 625-633.
Yuwono, T. 2006. Teori dan Aplikasi Polymerase Chain Reaction. ANDI OFFSET. Yogyakarta.
Zhu, Z., G. Li., L. He dan S. Chen. 1985. Novel Gene Transfer Into The Fertilized Eggs Of Gold Fish (Carassius Auratus L. 1758). Journal of ichthyology. 1: 31-34.
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Februari sampai dengan April 2015 di Balai Penelitian Pemuliaan Ikan Sukamandi, Subang, Jawa Barat. Dokumentasi seluruh rangkaian kegiatan yang dilaksanakan di unit pembenihan ikan lele dan laboratorium genetik secara ringkas ditampilkan pada Lampiran 2.
Alat dan Bahan
Alat dan bahan yang digunakan sesuai dengan prosedur kerja dalam penelitian ini adalah sebagai berikut:
Ekstraksi DNA
Alat yang digunakan dalam ekstraksi DNA adalah micropipette (Thermo scientific), microtips, microtube, vortex maximix II (Thermoline), inkubator, centrifuge sorvall (Thermmo), Centrifuge HM-150IV (HM), Multy Block Heater (Lab-Line), chiller on ice (IsoFreeze), Chiller template (IsoFreeze), collection tube, GeneJET Genomic DNA Purification Column, tubes rack (eppendorf), timer, spidol, alat bedah, gloves, penggerus, pinset, kalkulator, masker.
Bahan yang digunakan dalam ekstraksi DNA adalah embrio dan larva ikan lele transgenik F3 (pooling), embrio dan larva ikan lele non transgenik (pooling), kit ekstraksi DNA (GeneJet Genomic DNA Purification kit, Thermo Scientific), Nuclease Free Water, sodium hipochlorit 1%, tisu.
Ekstraksi RNA
centrifuge sorvall (Thermmo), Centrifuge HM-150IV (HM), chiller on ice (IsoFreeze), Chiller template (IsoFreeze), collection tube, GeneJET Genomic DNA Purification Column, tubes rack (eppendorf), timer, spidol, alat bedah, gloves, penggerus, pinset, kalkulator, masker.
Bahan yang digunakan dalam ekstraksi RNA adalah embrio dan larva ikan lele transgenik F3 (pooling), embrio dan larva ikan lele non transgenik (pooling), kit ekstraksi RNA (Tri Reagent-RNA/DNA/Protein Isolation Reagent), Nuclease Free Water, sodium hipochlorit 1%, tisu.
Cek Genom
Alat yang digunakan dalam cek genom adalah Qubit 2.0 fluorometri (invitrogen), beaker glass (Pyrex), gelas ukur (Iwaki Pyrex), timbangan analitik (AND), aluminium foil, hot plate (Wise stir), stirrer, micropipette (Thermo Scientific), microtips, cetakan agar 30 mL, cetakan agar 60 mL, Mini Horizontal Elektroforesis (Cleaver scientific ltd), Mini Horizontal Elektroforesis (BIO-RAD), Gel Doc (UVP), komputer, kamera digital, micropipette (Thermo scientific), microtips, microtube, tubes rack (eppendorf), kalkulator, masker.
Bahan yang digunakan dalam cek genom adalah Qubit dsDNA HS Assay Kit (100 Assays), DNA Tempelate, Nuclease Free Water (Thermo scientific), 10X Tris-Acetate-EDTA (TAE) BUFFER (Ultra Pure Grade) (Vivantis), Akuades, agarose (vivantis), gel agarose 2%, Amplikon, Marker 100-3000 bp (Vivantis), loading dye (Vivantis), tisu.
Amplifikasi PCR
(IsoFreeze), tubes rack (eppendorf), micropipette (Thermo Scientific), microtube, pinset, spidol, gloves, masker.
Bahan yang digunakan dalam amplifikasi PCR adalah DNA template, Nuclease Free Water (Thermo Scientific), FastStart PCR Master Mix (Roche), primer forward yaitu ACT 107-F (5’- GTG TGT GAC GCT GGA CCA ACT – 3’), primer reverse yaitu PhGH2-R (5’-CGA TAA GCA CGC CGA TGC CCA TTT-3’) (Marnis et al., 2014). Primer β-actin yaitu bact-F (5’-TAT GAA GGT TAT GCT CTG CCC-3’) dan bact-R (5’-CAT ACC CAG GAA AGA TGG CTG-3’) (Dewi et al., 2013), sodium hipochlorit 1%, tisu.
Sintesis DNA (cDNA)
Alat yang digunakan dalam sintesis DNA (cDNA) adalah micropipette (Thermo Scientific), microtips, microtube, vortex maximix II (Thermoline), chiller on ice (IsoFreeze), chiller template (IsoFreeze), multy Block Heater (Lab-line), inkubator, kalkulator, masker, gloves.
Bahan yang digunakan dalam sintesis DNA (cDNA) adalah kit Ready-To-Go You-Prime First Strand Beads (GE Healthcare), Transcriptor First Strand cDNA Synthesis kit (Roche) yaitu Transcriptor Enzyme Mix (Roche), Transcriptor RT Reaction Buffer (Roche), Protector RNA Inhibitor (Roche), Deoxynucleotide Mix (Roche) dan Transcriptor RV Transcriptase (Roche), DNA tempelate, Water Biological Moleculer (Thermo Scientific), 5x Reaction Buffer, RNA HS Buffer, sodium hipochlorit 1%.
Elektroforesis
(Wise stir), stirrer, micropipette (Thermo Scientific), microtips, cetakan agar 30 mL, cetakan agar 60 mL, chiller on ice (IsoFreeze), chiller template (IsoFreeze), tubes rack (eppendorf), Mini Horizontal Elektroforesis (Cleaver scientific ltd), Mini Horizontal Elektroforesis (BIO-RAD), Gel Doc (UVP), komputer, kamera digital, Laboratory film (Parafilm), gloves, gunting, masker dan alat tulis.
Bahan yang digunakan dalam elektroforesis adalah 10X Tris-Acetate-EDTA (TAE) BUFFER (Ultra Pure Grade) (Vivantis), Akuades, agarose (vivantis), gel agarose 2%, Amplikon, Marker 100-3000 bp (Vivantis), loading dye (Vivantis), tisu.
Prosedur Penelitian
Ikan Sampel
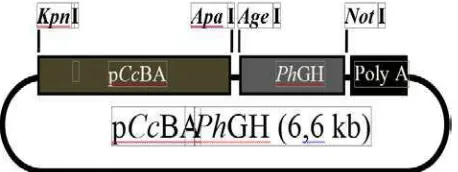
Hewan uji yang digunakan dalam penelitian ini adalah embrio dan larva yang berasal dari perkawinan silang antara sesama induk ikan lele dumbo transgenik F2 dan sesama induk ikan lele dumbo non-transgenik. Induk ikan lele dumbo transgenik F2 yang digunakan adalah yang membawa kontstruksi transgen pCcBA-PhGH. Adapun konstruksi transgen tersebut dapat dilihat pada Gambar 2.
Gambar 2. Peta konstruksi gen pCcBA-PhGH (6,6 kb). pCcBA= promoter β- aktin ikan mas. PhGH= gen hormon pertumbuhan ikan patin siam. PolyA= poliadenilasi pada vektor pEGFP-N1. KpnI, ApaI, AgeI, NotI= enzim restriksi (Dewi et al., 2013).
Deteksi PhGH Pada Ikan Lele Transgenik F3
1. Ekstraksi DNA Embrio dan Larva
Deteksi transgen dilakukan pada 30 embrio dan 20 ekor larva dari masing-masing perkawinan silang induk ikan lele transgenik F2 dan non-transgenik. Sampel embrio dan larva masing-masing digerus (pooling) menjadi satu. DNA genom masing-masing sampel diekstraksi menggunakan kit ekstraksi DNA (GeneJet Genomic DNA Purification, Thermo Scientific) sesuai dengan petunjuk penggunaan.
kuantitas genom dengan menggunakan elektroforesis dan Qubit 2.0 fluorometri (invitrogen).
2. Cek Genom Hasil Ekstraksi DNA Embrio dan Larva
Cek kuantitas dan kualitas genom dilakukan menggunakan alat Qubit 2.0 fluorometri (invitrogen) dengan metode spektrofotometer fluorescent dan kit (Qubit dsDNA HS Assay Kit, 100 Assays). Pengkuran konsentrasi dilakukan dengan pengenceran sampel 10x yang diencerkan dengan TE buffer 1x. Kemudian sampel yang telah diencerkan dimasukkan ke dalam reagent standar dye. Untuk melihat kualitas DNA maka selanjutnya genom dielektroforesis menggunakan gel agarose 2% dan pewarna DNA yaitu gel red (nucleid acid strain).
3. Amplifikasi PCR (Polymerase Chain Reaction)
Amplifikasi PCR pada DNA genom hasil ekstraksi dilakukan menggunakan fast start PCR master kit (Roche, Germany) dengan volume akhir sesuai standar PCR yaitu 25 µL. Komposisi bahan yang digunakan untuk amplifikasi PCR yaitu Nuclease Free Water, Master mix ( kit fast start PCR ) (10 pmol/µL), primer forward (ACT 107), primer reverse (PhGH2). Perhitungan volume reagent dan komposisi PCR dapat dilihat pada Lampiran 3.
rantai DNA (extention) pada suhu 720C selama 1 menit dengan masing-masing tahap sebanyak 35 siklus. Selanjutnya final extention PCR pada suhu 720C selama 10 menit. Hasil PCR (amplikon) dielektroforesis dengan menggunakan gel agarose 2%. Saat elektroforesis digunakan marker 100-3000 bp (vivantis) dan volume amplikon sebanyak 10 µL dicampurkan dengan loading dye sebanyak 2 µL, kemudian dielektroforesis menggunakan gel agarose (vivantis) 2 % dalam TAE Buffer 1x yang diberi pewarna DNA yaitu gel red (Nulceid acid strain). Hasil elektroforesis divisualisasi menggunakan Gel Doc (UV Transilluminator).
Analisis ekspresi transgen PhGH
Analisis ekspresi gen PhGH menggunakan metode Reverse Transcriptase Polymerase Chain Reaction (RT-PCR).
1. Ekstraksi RNA
Total RNA diekstraksi dari embrio dan larva (pooling). Sampel diekstraksi dengan menggunakan kit ekstraksi RNA (Tri Reagent Molecular Research Center, Inc., Cincinnati, OH, USA) sesuai dengan petunjuk penggunaan.
Prinsip kerja ekstraksi RNA secara ringkas terdiri dari homogenisasi (homogenization), pemisahan RNA (phase separation), pengendapan RNA (RNA precipitation), pencucian RNA (RNA wash), solubilisasi RNA (RNA solubilization). Untuk melihat keberhasilan ektrasi RNA maka dilakukan pengecekan kualitas dan kuantitas genom dengan menggunakan elektroforesis dan Qubit 2.0 fluorometri (invitrogen).
2. Cek Genom RNA
dan kit (Qubit dsDNA HS Assay Kit, 100 Assays). Pengkuran konsentrasi dilakukan dengan pengenceran sampel 50x yang diencerkan dengan TE buffer 1x. Kemudian sampel yang telah diencerkan dimasukkan ke dalam reagent standar dye. Untuk Melihat kualitas RNA maka selanjutnya genom dielektroforesis dengan menggunakan gel agarose 2%, marker 100-3000 bp (vivantis) dan pewarna yaitu gel red (nucleid acid strain).
3. Sintesis DNA (cDNA) Hasil Ekstraksi RNA
Amplifikasi cDNA dilakukan dengan menggunakan metode Reverse Transcriptase Polymerase Chain Reaction (RT-PCR) dan kit Ready-To-Go You-Prime First Strand Beads (GE Healthcare). Tahapan prosedur tersebut secara ringkas yaitu total RNA dimasukkan ke dalam sebuah tube yang baru sebesar 5 µL (100 ng (down to 1 fg)), kemudian ditambahkan Oligo dt sebesar 1 µM dan Nuclease Free Water sebanyak 3 µL. Kemudian sampel diinkubasi selama 30 menit pada suhu 550C. Setelah itu, sampel ditambahkan Transcriptor RT Reaction Buffer sebanyak 4 µL, Protector RNA Inhibitor sebanyak 0,5 µL, dntp (Deoxynucleotide Mix) sebanyak 2 µL dan Transcriptor RV transcriptase sebanyak 0,5 µL. Sampel diinkubasi pada suhu 850C selama 5 menit. Kemudian sampel dapat langsung dirunning PCR ataupun disimpan pada suhu -25 – 40C.
4. Amplifikasi PCR (Polymerase Chain Reaction)
PCR dilakukan untuk mengamplifikasi primer ACT 107-F (5’- GTG TGT GAC GCT GGA CCA ACT – 3’) dan PhGH2-R (5'CGA TAA GCA CGC CGA TGC CCA TTT-3 ') (Marnis et al., 2014) dengan ukuran fragmen 1500-bp dan primer β-actin yaitu bact-F (5’-TAT GAA GGT TAT GCT CTG CCC-3’) dan bact-R (5’-CAT ACC CAG GAA AGA TGG CTG-3’) (Dewi et al., 2013) dengan ukuran fragmen 300-bp.
Proses PCR dilakukan dengan tahapan persiapan enzim (pre-denaturation) pada suhu 950C selama 3 menit, tahap denaturasi (denaturation) pada suhu 940C selama 30 detik, tahap penepelan primer (annealing) pada suhu 600C selama 1 menit, tahap pemanjangan rantai DNA (extention) pada suhu 720C selama 1 menit dengan masing-masing tahap sebanyak 35 siklus. Selanjutnya final extention PCR pada suhu 720C selama 10 menit. Hasil PCR (amplikon) dielektroforesis dengan Marker 100-3000 bp (vivantis) dan volume amplikon sebanyak 10 µL dicampurkan dengan loading dye sebanyak 2 µL, kemudian di-running menggunakan gel agarose (vivantis) 2 % dalam TAE Buffer 1x yang diberi pewarna DNA yaitu gel red (Nulceid acid strain) dan di-running selama 50 menit dengan tegangan 100 volt. Kemudian hasil elektroforesis divisualisasi menggunakan Gel Doc (UV Transilluminator).
Analisis Data
HASIL DAN PEMBAHASAN
Hasil
Deteksi Transgen (PhGH) Pada Embrio dan Larva Lele Transgenik F3
Deteksi transgen (PhGH) dilakukan pada embrio dan larva ikan lele transgenik F3 dan non-transgenik (pooling).
Kualitas dan kuantitas genom DNA Embrio dan Larva
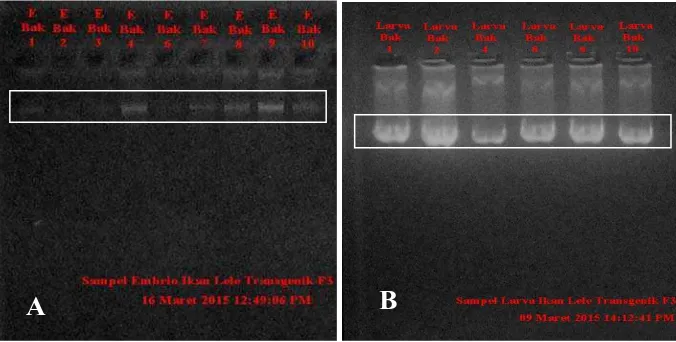
Cek kualitas genom DNA dilakukan melalui elektroforesis dengan menggunakan loading dye sebagai pemberat dan pewarna molekul DNA. Hasil elektroforesis pada genom embrio dan larva menunjukkan bahwa ekstraksi DNA berhasil dilakukan, dimana semua genom sampel muncul dengan ketebalan pita DNA yang berbeda (Gambar 3).
Gambar 3. A = genom DNA Embrio. B = genom DNA larva
Cek kuantitas DNA dilakukan untuk mengukur konsentrasi genom hasil ekstraksi dengan kemurnian berkisar antara 1,8–2,0. Konsentrasi DNA mempengaruhi ketebalan pita DNA melalui elektroforesis. Berdasarkan cek Qubit fluorometri (invitrogen) yang terdapat pada Lampiran 4, maka diperoleh beberapa data konsentrasi DNA embrio dan larva pada tabel berikut :
Tabel 1. Cek Konsentrasi DNA pada Beberapa Genom Embrio Ikan Lele Transgenik F3
Sampel Rata-rata konsentrasi (ng/mL) Kemurnian (Absorban 280/260)
Tabel 1 menunjukkan jumlah konsentrasi sampel DNA hasil ekstraksi embrio dan larva, dimana jumlah rata-rata konsentrasi tertinggi yaitu pada sampel larva 2 dengan rata-rata 86160 ng/mL dan rata-rata terendah yaitu pada sampel embrio 1 dengan rata-rata 1494 ng/mL.
Hasil Deteksi Transgen (PhGH) Pada Ikan Lele Transgenik F3
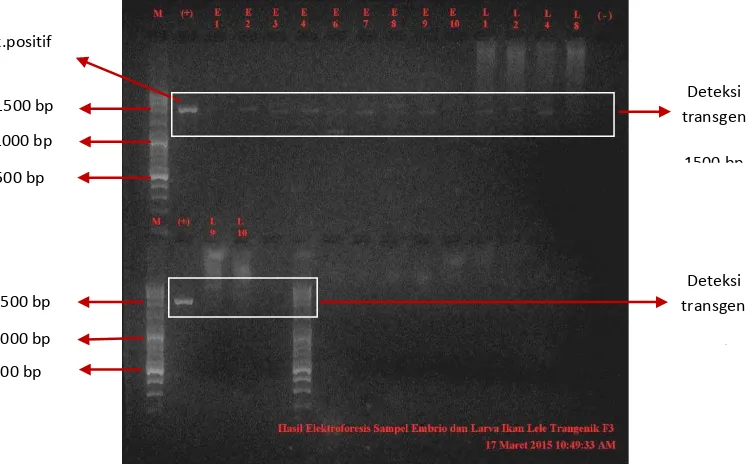
Hasil penelitian menunjukkan bahwa transgen dapat terdeteksi pada beberapa embrio dan larva pada ikan lele transgenik F3 dengan ukuran fragmen sebesar 1500 bp, sementara pada ikan non-transgenik tidak terdeteksi (Gambar 4).
Analisis ekspresi Transgen (PhGH) Pada Embrio dan Larva Lele Dumbo Transgenik F3
Analisis ekspresi transgen (PhGH) dilakukan pada embrio dan larva ikan lele transgenik F3 dan non-transgenik (pooling).
Kualitas dan kuantitas genom RNA Embrio dan Larva
Cek kualitas genom RNA dilakukan melalui elektroforesis dengan menggunakan loading dye sebagai pemberat dan pewarna molekul RNA. Hasil elektroforesis menunjukkan bahwa ekstraksi RNA berhasil dilakukan, dimana genom sampel muncul dengan ketebalan pita RNA yang berbeda dan terdapat dua baris pita RNA dengan ukuran 18S rRNA dan 28S rRNA (Gambar 5).
Gambar 5. Genom RNA embrio dan larva ikan lele Transgenik F3. M adalah marker DNA (100-3000 bp) (Vivantis). E = embrio. L = larva. Ukuran fragmen = 18S rRNA dan 28S rRNA.
Cek kuantitas RNA dilakukan untuk mengukur konsentrasi genom hasil ekstraksi RNA dengan kemurnian berkisar antara 1,8–2,0. Berdasarkan cek Qubit fluorometri (invitrogen) yang terdapat pada Lampiran 5, maka diperoleh data konsentrasi RNA embrio dan larva pada tabel berikut :
100 bp
Genom RNA
1500 bp Genom RNA
800 b 1500 bp
1000 bp
Tabel 2. Cek Konsentrasi RNA Genom Embrio Ikan Lele Transgenik F3 Sampel Rata-rata konsentrasi (ng/mL) Kemurnian
(Absorban 280/260)
Embrio Larva
1 1792000 ± 53572,38 1111000 ± 42485,29
1,8 – 2,0 2 1410000 ± 64420,49 960000 ± 51478,15
3 2201000 ± 105261,57 1112000 ± 28853,07 4 1190000 ± 41683,33 1665000 ± 47565,74 5 1537000 ± 47775,51 1235000 ± 32015,62 6 2040000 ± 68282,50 1360000 ± 23184,04
Tabel 2 menunjukkan jumlah rata-rata tertinggi konsentrasi RNA yaitu pada sampel embrio 3 dengan rata-rata konsentrasi sebesar 2201000 ng/mL dan rata-rata terendah yaitu pada sampel larva 2 dengan rata-rata konsentrasi sebesar 1190000 ng/mL.
Hasil ekspresi Transgen (PhGH) Pada Ikan Lele Transgenik F3
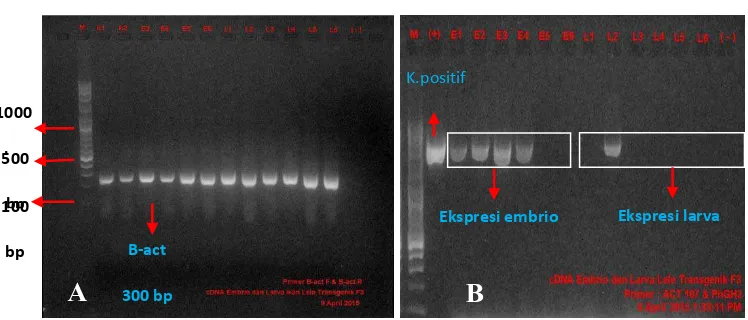
Transgen dapat terekspresi pada beberapa embrio dan larva pada populasi ikan lele transgenik F3, sementara pada ikan non-transgenik tidak terekspresi. Hasil ekspresi transgen dibandingkan dengan gen β-actin sebagai internal kontrol (Gambar 6).
Gambar 6. Ekspresi transgen pada embrio dan larva ikan lele dumbo transgenik
F3. A = amplifikasi primer β-aktin. B = amplifikasi primer ACT 107
Pembahasan
Deteksi Transgen (PhGH) Pada Embrio dan Larva Ikan Lele dumbo Transgenik F3
Kualitas dan kuantitas genom DNA Embrio dan Larva
Hasil penelitian menunjukkan ekstraksi DNA dari sampel embrio dan larva (pooling) berhasil dilakukan dengan menggunakan kit ekstraksi DNA (GeneJet Genomic DNA Purification, Thermo Scientific). Hal tersebut dibuktikan dari hasil cek genom melalui elektroforesis dimana semua genom muncul dengan memiliki ketebalan pita DNA yang berbeda.
Hasil elektroforesis menunjukkan pita DNA pada sampel embrio lebih tipis dibandingkan dengan pita DNA pada sampel larva. Adanya perbedaan pada ketebalan pita DNA tersebut terjadi karena perbedaan jumlah konsentrasi DNA hasil ekstraksi, dimana jumlah konsentrasi DNA pada sampel larva lebih tinggi dibanding DNA sampel embrio. Noer dan Marsia. (2007) melaporkan bahwa semakin besar konsentrasi templat akan semakin terang dan tebal pita DNA yang dihasilkan, namun konsentrasi templat yang terlalu tinggi juga akan mengakibatkan terbentuknya pita yang smear, sebaliknya konsentrasi templat terlalu rendah akan menyebabkan terbentuknya pita yang terlalu tipis untuk dapat dideteksi dengan cara elektroforesis gel agarosa. Restu dkk. (2012) menambahkan bahwa produk ekstraksi DNA yang berkualitas baik ditunjukkan dengan pita DNA yang terlihat tebal dan bersih serta pita DNA yang menyala.
baik berkisar antara 1,8-2. Rasio 1,8-1,9 dan 1,9-2,0 menunjukkan persiapan yang sangat murni dari masing-masing DNA dan RNA.
Kemurnian DNA didapatkan dengan Absorbance 280/260. Menurut Gallagher. (2004), penyerapan sampel diukur pada beberapa panjang gelombang yang berbeda untuk menilai kemurnian dan konsentrasi asam nukleat. Pengukuran kuantitatif untuk Absorban 260 relatif murni pada persiapan asam nukleat dalam jumlah mikrogram. Pembacaan absorbansi tidak bisa membedakan antara DNA dan RNA. Namun, rasio Absorban 260 nm dan 280 nm dapat digunakan sebagai indikator kemurnian asam nukleat. Kontaminan pada 280 nm (misalnya protein) akan menurunkan rasio ini. Absorbansi pada 230 nm mencerminkan kontaminasi sampel oleh fenol atau urea, sedangkan absorbansi pada 325 nm menunjukkan kontaminasi oleh partikulat dan cuvettes kotor. Penghamburan cahaya pada 325 nm dapat diperbesar 5 kali lipat pada 260 nm.
Hasil Deteksi Transgen (PhGH) Pada Ikan Lele Transgenik F3
ikan medaka transgenik diwariskan dengan stabil pada generasi F1 hingga generasi F4 sesuai dengan kaidah Mendel. Hasil penelitian yang sama juga dilaporkan oleh Martinez dkk., (1999), dimana hasil penelitian menunjukkan bahwa transgen ditransmisikan pada generasi F1 hingga F4 dengan stabil sesuai kaidah Mendel.
Namun hasil penelitian menunjukkan bahwa tidak semua embrio dan larva ikan lele dumbo transgenik membawa transgen. Hal ini terjadi karena embrio dan larva dihasilkan dari induk ikan lele dumbo transgenik F2 yang bersifat heterozigot. Hal ini sesuai dengan hukum Mendel, dimana apabila suatu spesies dikawinkan antara sesama spesies dengan kromosom heterozigot, maka keturunan yang dihasilkan terdapat 25 % normal. Apabila perkawinan dilakukan antara spesies yang bersifat heterozigot dengan spesies normal, maka akan menghasilkan 50 % keturunan normal.
Analisis ekspresi Transgen (PhGH) Pada Embrio dan Larva Ikan Lele Transgenik F3
Kualitas dan kuantitas genom RNA Embrio dan Larva Ikan Lele Dumbo Transgenik F3
Menurut Sambrook dan Russel. (2001) bahwa kualitas 28S rRNA dan 18S rRNA pada prokariota mencerminkan kualitas mRNA.
Kualitas genom RNA tersebut didukung oleh kuantitasnya yang diukur dengan Qubit fluorometri (invitrogen). Hasil pengukuran konsentrasi RNA menunjukkan bahwa semua sampel mempunyai kemurnian 1,8 – 2,0. Hal ini membuktikan bahwa kualitas semua genom RNA sampel bagus.
Hasil ekspresi Transgen (PhGH) Pada Ikan Lele Transgenik F3
Analisis ekspresi transgen dilakukan dengan tujuan untuk mengetahui apakah transgen (PCcBA-PhGH) pada ikan lele transgenik F3 terdeteksi dan terekspresi. Hasil penelitian menunjukkan bahwa transgen dapat terekspresi pada beberapa embrio dan larva. Hal tersebut diketahui melalui amplifikasi primer β -actin yang dibandingkan dengan hasil amplifikasi primer ACT107 dan PhGH2. Hasil penelitian yang sama juga dilaporkan oleh Marnis dkk., (2013 dan 2014), dimana transgen PhGH terekspresi pada embrio dan larva ikan lele dumbo transgenik F1 dan F2.
ikan mas mampu mengendalikan ekspresi gen PhGH pada ikan lele dan telah terjadi over ekspresi gen PhGH yang berpotensi meningkatkan pertumbuhan ikan lele dumbo transgenik hingga hampir dua kali lipat dari ikan lele non-transgenik.
Hasil penelitian menunjukkan bahwa transgen (PhGH) terekspresi pada beberapa keturunan ikan lele transgenik F3. Hal yang sama didapatkan dalam penelitian Huang dkk., (2005), dimana transgen (GFP) dapat terekspresi pada generasi F3 ikan zebra transgenik (Danio rerio). Hal ini mengindikasikan bahwa transgen masih stabil ditransmisikan hingga pada generasi ikan lele transgenik F3.
Namun hasil penelitian menunjukkan bahwa transgen hanya dapat terekspresi pada beberapa sampel embrio dan larva ikan lele dumbo transgenik F3. Hal ini terjadi karena sifat heterozigot dari induk ikan lele transgenik F2, dimana kemungkinan beberapa keturunan yang dihasilkan tidak membawa transgen pada jaringan tubuhnya seperti yang telah dijelaskan pada hasil deteksi transgen, dengan demikian transgen juga kemungkinan tidak terekspresi.
KESIMPULAN DAN SARAN
Kesimpulan
1. Transgen (PhGH) terdeteksi pada ikan lele dumbo (Clarias gariepinus) transgenik F3 dalam populasi heterozigot.
2. Transgen (PhGH) terekspresi pada beberapa ikan lele dumbo (Clarias gariepinus) transgenik F3.
Saran
TINJAUAN PUSTAKA
Perkembangan Teknologi Molekuler Dalam Akuakultur
Saat ini keamanan pangan telah menjadi isu hangat di masyarakat baik di dalam maupun di luar negeri. Produksi akuakultur diharapkan dapat ditingkatkan beberapa kali lipat untuk memenuhi kebutuhan pangan berupa ikan dimasa-masa mendatang akibat peningkatan populasi manusia. Intensitas dan kapasitas produksi diharapkan meningkat dengan menggunakan pendekatan bioteknologi. Salah satu teknik modern yang diduga akan menjadi sarana yang berguna dalam pengembangan akuakultur adalah teknologi transfer gen. Teknik ini telah diaplikasikan pada spesies yang memiliki nilai ekonomis (Alimuddin dkk., 2003).
Untuk meningkatkan keberlanjutan budidaya, umumnya dilakukan pembiakan secara selektif untuk mengembangkan strain yang tampil baik di penangkaran. Sayangnya, keberlanjutan berbagai sektor industri secara negatif dipengaruhi oleh inbreeding, wabah penyakit, produksi rendah dan kualitas daging yang rendah. Untuk mengatasi masalah tersebut dilakukan pengembangan strain ikan berkualitas tinggi yang memiliki tingkat pertumbuhan yang tinggi, tahan terhadap penyakit dan memiliki nilai gizi tinggi (Ding dkk., 2015).
akuakultur. Termasuk peningkatan kebutuhan produksi pangan secara global, penemuan dan pengembangan sumber daya alam yang baru serta kesadaran akan penurunan keanekaragaman hayati dan efek merugikan masyarakat modern terhadap lingkungan (Melamed dkk., 2002).
Biologi dan Taksonomi Ikan Lele Dumbo (Clarias gariepinus)
Menurut Kottelat dkk., (1993), klasifikasi dari ikan lele dumbo adalah sebagai berikut:
Kingdom : Animalia Filum : Chordata Kelas : Pisces Ordo : Ostariophysi Family : Clariidae Genus : Clarias
Spesies : Clarias gariepinus
Clarias gariepinus didistribusikan secara luas di Afrika dan asia. Habitat utamanya adalah danau yang tenang, sungai dan rawa-rawa di daerah yang banjir secara musiman. Di alam ikan ini bersifat omnivora, makan bahan tanaman, plankton, anthropods, moluska, ikan, reptil dan amfibi (Vitule dkk, 2006).
mereka memiliki organ pernapasan aksesori, terdiri dari ruang udara yang berisi berisi dua struktur arborescent terletak di busur branchial keempat, yang dilindungi oleh tulang rawan dan ditutupi oleh jaringan vaskuler yang dapat menyerap oksigen langsung dari atmosfer. Spesies ikan ini memungkinkan mereka mentolerir kondisi air yang buruk di mana spesies ikan budidaya lainnya tidak dapat bertahan hidup (Ulufayo, 2009).
Pertumbuhan dan kelangsungan hidup ikan budidaya tergantung pada padat tebar, bibit lele dumbo cenderung tampil lebih baik di kepadatan penebaran 425 ikan per m dibandingkan dengan padat tebar tinggi 850 dan 1.275 ikan per m, oleh karena itu mungkin tidak menguntungkan untuk benih stok C. gariepinus pada kepadatan tebar sangat tinggi (Akinwole dkk, 2014).
Kombinasi faktor fisik, kimia dan faktor biologis, seperti perubahan tingkat air, kimia, pH, suhu, kejelasan dan kecepatan aliran, peningkatan jumlah tanaman marjinal, perubahan kimia terkait dan akses ke daerah pemijahan yang cocok merupakan penentu untuk memicu pemijahan lele (Yalcin dkk, 2001).
Sumber ikan (liar atau kolam), jenis kelamin, masa aklimatisasi dapat mengerahkan beberapa pengaruh terhadap beberapa karakteristik hematologis Clarias gariepinus sehingga perlu untuk memperhitungkan faktor-faktor tersebut dalam penilaian dan pelaporan indeks hematologis (Gabriel dkk, 2004).
Teknologi Transgenesis
intensif diselidiki di tahun 1970-an dan 1980-an di beberapa spesies dan masih sedang disempurnakan. Hal ini mulai mempengaruhi industri selama tahun 1980an. Teknik molekuler (penanda DNA dan manipulasi gen) secara intensif diselidiki sejak pertengahan 1980-an dan kemudian mencapai aplikasi pertama pada pertengahan 1990-an (Hulata, 2001).
Transgenesis merupakan teknik rekayasa genetik dengan cara mengintroduksi gen pengode karakter unik yang dapat memberikan nilai tambah bagi organisme target (Alimuddin dkk., 2008). Sebagai contoh, transfer gen pengode hormon pertumbuhan (growth hormone, GH) untuk meningkatkan laju pertumbuhan ikan coho salmon (Onconhyncus kisutch) hingga beberapa kali lipat (Devlin dkk, 1994), gen cecropin terhadap channel catfish (Ictalarus punctatus) (Dunham, 2002) atau lisozim terhadap ikan zebra (Brachydanio rerio) (Yazawa dkk, 2005) untuk meningkatkan resistensi terhadap bakteri pathogen, dan protein antibeku (antifreeze protein) terhadap ikan atlantic salmon (Salmo salar) (Du dkk., 1992) dan ikan coho salmon (Oncorhyncus kisutch) (Devlin dkk., 1995) untuk meningkatkan daya tahan terhadap suhu dingin.
Saat ini memungkinkan untuk memperkenalkan setiap gen asing yang menarik ke dalam genom tanaman dan hewan melalui teknologi transfer gen. Ketika gen terintegrasi, diwariskan dan diekspresikan maka organisme transgenik tersebut memperoleh genotipe baru dan fenotipe tergantung pada sifat dan kekhasan dari gen yang diintroduksikan serta kekuatan dari promotor untuk mendorong ekspresi dari gen tersebut (Hew dan Garth, 2001).
organisme hasil rekayasa genetika atau GMO dalam beberapa kasus dikombinasikan dengan bentuk-bentuk perbaikan genetik menawarkan peluang yang cukup besar untuk lebih efisien dan lebih efektif dalam budidaya di berbagai spesies (Beardmore dan Joanne, 2003).
Pengembangan dan penerapan teknologi penanda DNA sudah digunakan dalam bidang lain seperti sistematika molekuler, genetika populasi, biologi evolusi, ekologi molekuler, genetika konservasi, dan pemantauan keamanan makanan laut. Hal tersebut pasti akan berdampak pada industri akuakultur dengan cara yang tak terduga. Studi populasi dan genetika konservasi mengubah peran penting bidang pembenihan dan budidaya yang dijalankan untuk pembesaran dan pemulihan stok ikan liar (Liu dan Cordes, 2004).
Budidaya merupakan salah satu industri yang paling cepat berkembang di seluruh dunia pertanian. Salah satu faktor yang paling penting untuk budidaya berkelanjutan adalah pengembangan strain budaya berkinerja tinggi. Manipulasi genom menawarkan metode yang kuat untuk mencapai pemuliaan ikan secara cepat dan terarah yaitu metode pemuliaan ikan dengan berbasis teknologi transgenik. Metode ini menawarkan peningkatan efisiensi, presisi dan prediktabilitas dalam perbaikan genetik atas metode tradisional serta kemungkinan akan memainkan peran utama di masa pembiakan genetik pada ikan (Ding dkk., 2015).
dengan baik. Oleh karena itu, pertumbuhan ikan transgenik yang ditingkatkan mungkin dapat menjadi hewan transgenik yang dikomersialkan untuk produksi pangan (Zhong dkk., 2012).
Teknologi transgenik dapat digunakan dala berbagai bidang dan fungsi antara lain untuk meningkatkan laju pertumbuhan ikan, kontrol kematangan seksual, kemandulan dan diferensiasi seks, meningkatkan kelangsungan hidup dengan meningkatkan ketahanan terhadap penyakit terhadap patogen, beradaptasi dengan lingkungan yang ekstrim seperti tahan terhadap suhu dingin, mengubah karakteristik biokimia dari dalam daging untuk meningkatkan kualitas gizi dan mengubah jalur biokimia atau metabolik untuk meningkatkan pemanfaatan pangan (Hew dan Garth, 2001).
Kekuatan yang mendorong dalam penerapan teknologi transgenik pada ikan adalah keinginan untuk menghasilkan induk yang secara genetik unggul untuk produksi pangan. Kemajuan dalam penerapan teknologi transgenik terhadap ikan budidaya sudah sangat cepat. Potensi ekonomi yang menguntungkan dari teknologi transgenik tersebut terhadap bidang budidaya sangatlah penting. Isolasi dan konstruksi gen untuk sifat yang diinginkan dan mentransfer gen tersebut ke dalam tubuh induk dapat memberikan lompatan atau kelebihan dibanding seleksi dan pemuliaan metode tradisional. Selain itu, sifat-sifat baru tidak muncul dalam genom dapat ditransfer dari spesies tertentu, sehingga memungkinkan produksi fenotipe baru (Fletcher dan Peter, 1991).
strain budidaya. Lebih penting lagi, proses ini didasarkan pada perbaikan DNA homologi yang terarah, sehingga tidak membawa elemen DNA asing, melainkan memodifikasi DNA endogen itu sendiri. Oleh karena itu, bila dikombinasikan dengan manipulasi PGC (primordial germ cell) spesifik dan teknik manipulasi genom konvensional (seperti manipulasi poliploidi), teknik ini harus membuat pembudidayaan ikan (dan hewan lainnya) menjadi lebih efisien, lebih tepat dan lebih dapat diprediksi (Ding dkk,. 2015).
Pengembangan penanda genetik berbasis DNA memiliki dampak revolusioner pada genetika hewan. Secara teori penanda DNA digunakan untuk mengamati dan memanfaatkan variasi genetik di seluruh genom. Penanda genetik populer di masyarakat akuakultur termasuk allozymes, DNA mitokondria, RFLP, RAPD, AFLP, mikrosatelit, SNP, dan EST marker. Penerapan penanda DNA telah memungkinkan suatu kemajuan yang pesat dalam penyelidikan variabilitas genetik dan inbreeding dalam bidang budidaya, pemilihan induk, spesies dan identifikasi strain serta pembangunan peta genetik dengan resolusi tinggi untuk spesies akuakultur (Liu dan Cordes, 2004).
Teknik Transfer Gen
genom menyediakan alat yang sangat besar yang berharga untuk pembibitan ikan. Dalam waktu dekat, pengenalan editing genom dalam pembudidayaan ikan konvensional akan memungkinkan peneliti untuk secara langsung dan tepat meningkatkan sifat-sifat tertentu tanpa mempengaruhi sifat-sifat lainnya. Karena pendekatan ini tidak lagi menggunakan fragmen gen eksogen, melainkan memodifikasi informasi genetik itu sendiri sehingga layak untuk memainkan peran utama dalam masa depan pemuliaan genetik ikan dan pengembangbiakan hewan lain (Ding dkk., 2015).
Penggunaan teknologi transgenesis di Indonesia untuk memproduksi ikan lele tumbuh cepat dimulai sejak tahun 2008. Ada dua teknik dalam transfer gen yaitu dengan teknik elektroforasi dan mikroinjeksi. Penggunaan metode mikroinjeksi pada embrio ikan lele memiliki kelemahan antara lain yaitu memerlukan tingkat keterampilan yang tinggi dalam aplikasinya, telur yang diinjeksi seringkali pecah dan menempel pada jarum mikroinjeksi, dan jumlah embrio yang berhasil menetas dan hidup sampai menjadi dewasa sangat rendah dibandingkan dengan jumlah telur yang dihasilkan ikan lele sehingga peluang mendapatkan induk ikan lele yang mampu mentransmisikan transgen pada anakannya sangat rendah (Dewi dkk., 2013).
Penggunaan teknik elektroforasi dibandingkan dengan mikro injeksi, teknik transfer gen melalui elektroforasi dengan menggunakan media sperma relatif lebih mudah dan efisien, karena ribuan telur dapat diproses dalam waktu bersamaan dengan menggunakan teknik fertilisasi buatan (Cheng dkk., 2002).
ikan transgenik. Hasil percobaan menggunakan teknik ini mendukung keyakinan bahwa strain ekonomis penting ikan dapat dikembangkan menggunakan transfer gen. Cara ini terlalu memakan waktu dan membutuhkan tenaga kerja yang intensif untuk digunakan dalam menghasilkan sejumlah besar ikan. Saat ini juga telah banyak delakukan transfer gen dengan menggunakan media sperma dan metode elektroforasi (Xie dkk, 1993). Elektroporasi merupakan alternatif yang meredakan banyak masalah ini dan memiliki potensi untuk melakukan transfer gen lebih efisien (Hostetler dkk., 2003).
Beberapa penelitian pembentukan strain ikan transgenik telah berhasil dilakukan pada ikan dengan menggunakan beberapa metode yaitu ikan kerapu tikus (Cromileptes Altivelis) transgenik dengan metode elektroporasi dan mikroinjeksi (Subyakto dkk., 2010), ikan medaka (Oryzias latipes) transgenik dengan metode particle gun (Kinoshita dkk., 2003) dan ikan kakap silver (Sparus sarba ) transgenik dengan metode transfeksi (Lu dkk., 2002).
Sperma memiliki kelebihan dalam bertindak sebagai media transfer gen, karena sperma menggunakan vektor alami dalam mentransfer gen. Sel sperma telah digunakan sebagai vektor transfer gen pada ikan. Masuknya konstruksi gen ke dalam sperma dapat dipermudah dengan penggunaan elektroporator dan efektifitas transfer gen dengan elektroporasi sperma sangat dipengaruhi kondisi listrik dan parameter biologi (Faqih, 2011).
terdapat individu ikan lele dengan bobot hampir duakali lipat dibandingkan bobot rata-rata populasi ikan lele normal (non transgenik) (Dewi dkk., 2013).
Sekali gen asing terintegrasi ke dalam genom resipien, gen tersebut akan diwariskan ke keturunannya melalui germ line. Sebagai contoh, tingkat pertumbuhan dapat dipercepat dengan mengintroduksi gen yang mengkodekan hormon pertumbuhan yang mensintesa peptida hormon pertumbuhan dalam jumlah yang besar dan daya tahan terhadap suhu dingin dapat diperoleh dengan memasukkan gen yang mengkodekan protein antibeku (antifreeze protein) dari ikan yang hidup di temperatur subzero (Alimuddin dkk., 2003).
Lebih dari 35 jenis spesies ikan yang berbeda telah digunakan dalam studi transfer gen sejak ikan transgenik pertama kali dibentuk. Keturunan ikan transgenik telah dihasilkan dengan memanfaatkan hormon pertumbuhan (GH) yang ditransmisikan melalui beberapa germ-line (Wei dan Zhu, 2010). Lokalisai produk gen memiliki fungsi yang kritis, sehingga kontrol lokasi transgen merupakan teknik penting dalam studi transgenik (Tanaka dan Masato, 2001).
Hormon Pertumbuhan (GH)
GH adalah salah satu dari beberapa gen yang saat ini digunakan dalam pemuliaan ikan transgenik (Wei dan Zhu, 2010). Gen pengontrol hormon pertumbuhan (growth hormone, GH) merupakan gen target yang paling banyak digunakan dalam transgenik ikan. Introduksi gen hormon pertumbuhan (GH) pada ikan telah berhasil diaplikasikan dalam rangka peningkatan kecepatan pertumbuhan (Parenrengi dkk., 2009).
aksinya dengan mengikat reseptor pass-transmembran tunggal dan reseptor GH (GHR) pada jaringan target (Reinecke dkk., 2005).
Sifat biologis hormon pertumbuhan (GH) adalah pleiotropic, menggambarkan pertumbuhan, mobilisasi energi, perkembangan gonad, nafsu makan dan perilaku sosial. Dengan demikian, pengaturan jaringan untuk GH bersifat kompleks dan mencakup banyak endokrin dan faktor lingkungan yang sesuai untuk keadaan fisiologis yang beragam dimana GH terlibat. Pada ikan, kontrol neuroendokrin GH bersifat multifaktorial dengan beberapa inhibitor dan stimulator sekresi hipofisis GH (Canosa dkk., 2006).
Sifat biologis GH tidak hanya untuk mengendalikan pertumbuhan tetapi juga perkembangan gonad. GH merupakan faktor penting dalam perkembangan seksual dari berbagai spesies. Dalam ikan mas betina, penerapan berbagai konsentrasi steroid yang berbeda pada kultur primer sel hipofisis menyebabkan pelepasan GH. Intinya, mempelajari sifat-sifat perkembangan reproduksi dan gonad dari GH ikan transgenik memberikan parameter fisik populasi untuk mengevaluasi keamanan lingkungan. GH Ikan transgenik menyediakan sebuah sistem yang berguna untuk mempelajari mekanisme interaksi antara somatotropic dan sumbu gonadotropic ikan (Wei dan Zhu, 2010).
Ikan Lele Transgenik
latipes) (Inoue dkk., 1990; Murakami dkk., 1994; Ono dkk., 1997), ikan kerapu tikus (Cromileptes Altivelis) (Subyakto dkk., 2010), ikan lele dumbo (Clarias gariepinus) (Dewi dkk., 2013).
Proses dari produksi hewan transgenik terdiri atas beberapa tahapan secara ringkas yaitu identifikasi gen yang diinginkan (gen target), isolasi gen target, amplifikasi gen target untuk memproduksi beberapa kopi, penggabungan gen target dengan promoter yang tepat dan sekuens poly serta insersi kedalam plasmid, multiplikasi plasma di dalam bakteri dan recovery konstruksi kloning untuk injeksi, transfer konstruksi kedalam jaringan resipien, integrasi gen kedalam jaringan resipien, ekspresi gen pada genom resipien, dan pewarisan gen pada generasi selanjutnya (Beardmore dan Porter, 2003).
Pembentukan strain ikan lele C.gariepinus cepat tumbuh dilakukan melalui program seleksi dan transgenesis. Program seleksi dilakukan pada karakter pertumbuhan menggunakan metode seleksi individu, dengan target peningkatan laju pertumbuhan 30% dan tingkat inbreeding rendah. Transgenesis dilakukan melalui penyisipan gen pengkode hormon pertumbuhan ikan patin siam (PhGH) menggunakan metode elektroporasi dengan media transfer sperma dengan target peningkatan laju pertumbuhan 100% dan FCR rendah (Badan Penelitian dan Pengembangan Kelautan dan Perikanan Kementerian Kelautan dan Perikanan, 2012).
Pembentukan strain ikan lele tumbuh cepat generasi F0 dilakukan dengan
menunjukkan bahwa gen PhGH mampu terinsersi dan terekspresi pada ikan lele dumbo generasi F0 (Dewi dkk., 2013).
Deteksi Transgen
DNA mreupakan sebuah polimer panjang yang tidak bercabang yang terdiri dari empat subunit yang berbeda yaitu deoksiribonukleotida yang mengandung adenin basa nitrogen (A), sitosin (C), guanin (G) dan timin (T). Basa nitrogen dapat dibagi menjadi dua kategori kimia yaitu A dan G merupakan purin, T dan C adalah pirimidin. Subunit biasanya disebut sebagai nukleotida, asam nukleat atau pasangan basa (basa dalam kasus DNA untai tunggal). Setiap nukleotida mengandung gula pentosa (5-carbon-ring) dan basa nitrogen. Kelima (5-prime atau 5 ') karbon dari ring pentosa terhubung ke ketiga (3-prime, atau 3') karbon dari ring pentosa berikutnya melalui gugus fosfat dan basa nitrogen tetap keluar dari gula phosphate. Orientasi 5 '/ 3' ini menunjukkan polaritas sepanjang untai DNA, dimana semua nukleotida dalam untai yang sama diatur dengan cara yang sama. Dengan konvensi urutan DNA dibaca dari 5 'ke 3' sehubungan dengan polaritas untai. Sebuah molekul DNA terdiri dari dua untai nukleotida terikat bersama oleh ikatan hidrogen (Chapman dan Hall, 1995).
Ekspresi Transgen
mengembangkan promoter/enhanser yang baik diperlukan suatu metode yang sederhana dan cepat untuk mendeteksi ekspresi gen (Alimuddin dkk., 2003).
Modifikasi gen endogen melalui rekombinasi homolog (penargetan gen) pada ikan akan menjadi alat yang sangat ampuh untuk pemuliaan genetik dan studi dasar ekspresi gen dan untuk memahami fungsi dari produk gen (Yoshizaki dkk., 2000). Pembentukan metode untuk mengintroduksikan gen eksogen ke dalam suatu organisme untuk menurunkan gen eksogen ke generasi selanjutnya dan untuk mengarahkan ekspresi yang sesuai dari gen eksogen adalah salah satu kriteria dasar dan sangat diperlukan untuk suatu organisme (Tanaka dkk Kinoshita, 2001).
Mekanisme gen eksogen diintegrasikan ke dalam genom inang telah menjadi topik utama penelitian transgenik. Studi sebelumnya menunjukkan bahwa transgen terintegrasi secara acak dan beragam ke dalam ikan. Jumlah susunan salinan transgen memberikan pengaruh represif pada ekspresi. Beberapa penelitian melaporkan penurunan pada level ekspresi per copy melalui peningkatan jumlah copy, sementara dengan penurunan jumlah copy menghasilkan peningkatan pada ekspresi transgen (Wei dan Zhu, 2010).
Ekspresi gen asing atau transgen yang diintroduksi adalah dikontrol oleh
suatu urutan DNA yang disebut promoter. Kemampuan promoter dalam mengendalikan ekspresi gen asing yang diintroduksi merupakan salah satu faktor penentu keberhasilan transgenesis. Jenis promoter yang digunakan akan menentukan letak, waktu dan tingkat ekspresi transgen. Dalam hubungannya dengan tempat aktivitasnya, promoter dapat dibedakan menjadi promoter yang aktif di mana-mana (ubiquitous), dan promoter yang aktif pada jaringan tertentu seperti hanya aktif di hati, otak atau di gonad saja. Hal lain yang diduga menyebabkan tingginya ekspresi transgen adalah terekspresinya plasmid-plasmid DNA, tetapi seiring dengan fase perkembangan larva, plasmid-plasmid DNA tersebut ikut terdegradasi (Alimuddin dkk., 2008).
Ekspresi transgen b-aktin pada ikan mas (Cyprinus carpio) masih tetap terlihat pada larva, sekitar 71,61% ± 6,76% larva mengekspresikan transgen, tetapi ekspresi tersebut tidak spesifik pada suatu organ, karena promoter b-aktin memiliki sifat yang dapat aktif pada semua jaringan/ sel otot (Alimuddin et al., 2008). Gen b-actin yang berasal dari ikan mas dikendalikan oleh beberapa unsur regulasi. Unsur promotor proksimal mengarahkan tingkat ekspresi yang cukup tinggi, sehingga dapat digunakan dalam transfer gen pada ikan (Liu dkk., 1990).
Gen b-actin merupakan protein yang melimpah di hampir semua semua tipe sel, menunjukkan bahwa promoter ini sangat aktif dan serbaguna. Pada beberapa jenis ikan, ekspresi terdapat juga dikulit, insang dan jaringan peripheral (sekeliling tubuh) lainnya (Alimuddin dkk., 2003).
aktin diekspresikan dalam seluruh jaringan, gen aktin individu menunjukkan spesifitas jaringan dan perkembangan dalam ekspresinya. Gen b-aktin dinyatakan dalam jenis sel tertentu, mungkin karena perbedaan pengikatan faktor transkripsi untuk elemen regulasi gen (Liu dkk., 1990).
Introduksi gen pengkode karakter yang diharapkan ke ikan harus bisa ditranskripsi dan ditranslasi secara akurat dalam ikan resipien. Namun demikian, pengontrolan ekspresi gen pada ikan masih belum banyak diketahui sebagai akibat dari belum banyaknya gen ikan yang diklon dibandingkan dengan vertebrata tingkat tinggi. Oleh karena itu, umumnya peneliti menggunakan promoter/enhanser yang diperoleh dari vertebrata lainnya atau dari virus yang menginfeksinya (Alimuddin dkk., 2003).
PCR dan analisis sekuensing menunjukkan bahwa gen asing yang terintegrasi dalam ikan mas transgenik adalah head-to-head dan head-to-tail. Transgen diekpresikan tergantung pada jumlah salinan transgen. Semakin sedikit jumlah salinan transgen terintegrasi di kromosom inang, maka semakin tinggi efisiensi ekspresi transgen. Jumlah salinan transgen yang rendah juga akan mengakibatkan transmisi transgen tetap stabil pada germ-line melalui generasi yang berbeda. Namun, ukuran hewan transgenik tidak berkorelasi dengan baik dengan jumlah salinan transgen (Wei dan Zhu, 2010).
saat ikan transgenik diproduksi dengan metode konvensional. Membentuk generasi ikan transgenik yang stabil dengan sifat yang diinginkan untuk budidaya merupakan tugas yang sulit. Dengan demikian, target dan kontrol ekspresi transgen dalam ikan telah menjadi fokus penelitian dalam beberapa tahun terakhir (Wei dan Zhu, 2010).
Ekstraksi DNA/RNA
Ekstraksi DNA merupakan prosedur rutin dalam analisis molekuler. Jumlah dan kualitas DNA hasil ekstraksi bervariasi tergantung dari spesies yang digunakan sehingga mempengaruhi analisis lebih lanjut seperti hibridisasi DNA, pemotongan DNA dengan enzim restriksi maupun analisis dengan Polymerase Chain Reaction (PCR) (Pharmawati, 2009).
Ekstraksi untuk mendapatkan DNA berkualitas tinggi merupakan satu kaidah dasar yang harus dipenuhi dalam analisis molekuler. Masalah-masalah dalam ekstraksi DNA masih merupakan hal penting yang perlu diatasi (Restu, 2012).
Amplifikasi PCR (Polymerase Chain Reaction)
yang digunakan, yaitu suatu sekuen oligonukleotida pendek yang berfungsi mengawali sintesis rantai DNA dalam reaksi berantai polimerase (Yuwono, 2006).
Primer PCR merupakan oligonukleotida yang berperan sebagai inisiasi amplifikasi molekul DNA. Dengan keberadaan primer PCR tersebut, maka gen target akan teramplifikasi sepanjang reaksi PCR berlangsung. Untuk merancang primer spesifik tersebut diperlukan data sekuen gen yang menyandikan protein sejenis dengan fragmen yang akan diamplifikasi melalui PCR (Aris dkk., 2013).
Empat komponen utama pada proses PCR adalah (1) DNA cetakan yaitu fragmen DNA yang akan dilipatgandakan, (2) oligonukleotida primer yaitu suatu sekuen oligonukleotida pendek (15-25 basa nukleotida) yang digunakan untuk mengawali sintesis rantai DNA, (3) deoksiribonukleotida trifosfat (dNTP) yaitu terdiri atas dATP, dTCP, dGTP, dTTP dan (4) enzim DNA polimerase yaitu enzim yang melakukan katalis reaksi sintesis rantai DNA. Komponen lain yang juga penting adalah senyawa buffer (Yuwono, 2006).
efisiensinya akan menurun. Reaksi tersebut diulangi sampai 25-30 siklus sehingga pada akhir siklus akan didapatkan molekul-molekul DNA rantai ganda dalam jumlah yang lebih banyak. Banyaknya siklus amplifikasi yang digunakan tergantung dari jumlah konsentrasi DNA target di dalam campuran reaksi (Yuwono, 2006).
Pada umumnya PCR dilakukan dengan mengulangi siklus pelipatgandaan sebanyak 20-30 siklus. Akan tetapi, banyaknya siklus yang diperlukan tergantung terutama pada konsentrasi awal molekul DNA target yang akan dilipatgandakan. Siklus yang terlalu banyak justru akan meningkatkan konsentrasi produk yang tidak spesifik, sedangkan siklus yang terlalu sedikit akan mengurangi kuantitas produk yang diharapkan (Yuwono, 2006).
Oleh karena PCR tidak dapat dilakukan dengan menggunakan RNA sebagai cetakan maka terlebih dahulu dilakukan proses transkripsi balik (reverse transcription) terhadap molekul mRNA sehingga diperoleh molekul cDNA (complementary DNA). Molekul cDNA tersebut kemudian digunakan sebagai cetakan dalam proses PCR. Teknik RT-PCR ini sangat berguna untuk mendeteksi ekspresi gen, untuk amplifikasi RNA sebelum dilakukan kloning dan analisis, maupun untuk diagnosis agensia infektif maupun penyakit genetik. Teknik RT-PCR memerlukan enzim transkriptase balik (reverse transcriptase). Enzim transkriptase balik adalah enzim DNA polimerase yang menggunakan molekul RNA sebagai cetakan untuk mensintesis molekul DNA (cDNA) yang komplementer dengan molekul RNA tersebut (Yuwono, 2006).
PENDAHULUAN
Latar Belakang
Ketersediaan induk unggul dalam bidang akuakultur merupakan hal yang sangat pokok dalam menunjang keberlanjutan kegiatan budidaya dan hasil produksi untuk dapat memenuhi kebutuhan manusia akan konsumsi ikan yang merupakan salah satu penyumbang protein hewani bagi manusia. Sehingga untuk memenuhi kebutuhan tersebut, maka produksi dalam kegiatan perikanan harus terus ditingkatkan melalui ketersediaan benih unggul maupun induk unggul.
Menurut Dewi dkk. (2013) produk perikanan tersebut dapat diperoleh dengan beberapa kegiatan diantaranya menggunakan metode seleksi induk, hibridasi, poliploidasi dan transgenesis melalui teknologi rekayasa genetika.
Perkembangan teknologi molekuler dalam bidang akuakultur saat ini telah banyak dilakukan melalui teknik rekayasa genetika dengan memanfaatkan hormon tertentu yang diisolasi spesies ikan lain yang memiliki keunggulan tertentu dan kemudian diintroduksikan pada hewan target, sehingga ikan target mengalami beberapa perubahan pada karakteristiknya sesuai dengan keunggulan gen target yang diintroduksikan.
Penelitian ikan transgenik dengan mentransfer gen hormon pertumbuhan pada beberapa ikan budidaya telah berkembang dengan baik dan diharapkan pertumbuhannya lebih cepat dan dapat diproduksi untuk produk pangan komersial (Marnis dkk., 2014). Dengan demikian teknologi transgenesis tersebut dapat dijadikan suatu strategi untuk memenuhi kebutuhan akan produksi perikanan.
Menurut Marnis dkk., (2014) dalam pembentukan strain ikan transgenik, transgen yang ditransfer pada jaringan ikan target harus dapat terdeteksi dan terintegrasi pada germline dan ditransmisikan pada keturunan selanjutnya. Namun meskipun transgen dapat terintegrasi ke dalam semua jaringan tubuh ikan target, namun transgen tersebut kemungkinan tidak terekspresi di seluruh jaringan tubuh ikan (Marnis dkk., 2013). Maka diharapkan transgen tidak hanya dapat ditransmisikan namun juga dapat terekspresi pada keturunan selanjutnya.
Penelitian tentang deteksi dan ekspresi transgen pada beberapa spesies ikan transgenik telah dilakukan yaitu pada ikan zebra (Brachydanio rerio) (Bayer dan Jose, 1992), ikan nila (Oreochromis niloticus) (Kobayashi dkk., 2007), ikan medaka (Oryzias latipes) (Chong dan Vielkind, 1989) dan mud loach (Misgurnus mizolepis) transgenik (Nam dkk., 1999). Hasil penelitian menunjukkan bahwa transgen dapat terdeteksi dan terekspresi pada keturunan selanjutnya.
Rumusan Masalah
Program transgenesis pada ikan lele dumbo (Clarias gariepinus) diawali pada tahun 2011 dengan pembentukan populasi induk pembentuk (founder) F0
ikan lele dumbo transgenik melalui elektroporasi sperma (Dewi dkk., 2013) dan dilanjutkan dengan pembentukan populasi heterozigot pada tahun 2012 (F1) dan pembentukan populasi F2 pada tahun 2013 serta pembentukan populasi ikan lele yang positif membawa transgen secara homozigot pada tahun 2014 (Marnis dkk., 2014). Dalam penelitian sebelumnya telah dihasilkan ikan lele transgenik F1 dan
F2, dimana hasil penelitian menunjukkan gen PhGH terdeteksi dan terekspresi.
Dengan demikian, maka diperlukan suatu kajian untuk mengetahui apakah gen hormon pertumbuhan tersebut masih dapat terdeteksi dan terekspresi pada keturunan selanjutnya.
Berdasarkan hal tersebut, dirumuskan beberapa permasalahan sebagai berikut : 1. Apakah gen hormon pertumbuhan (PhGH) terdeteksi pada ikan lele dumbo
(Clarias gariepinus) transgenik F3?.
2. Apakah gen hormon pertumbuhan (PhGH) terekspresi pada ikan lele dumbo (Clarias gariepinus) transgenik F3?
Kerangka Pemikiran
serta dalam proses pemeliharaannya membutuhkan waktu yang relatif lebih singkat dibandingkan dengan pemeliharaan spesies ikan non-transgenik (normal).
Dalam penelitian sebelumnya telah dihasilkan stain ikan lele dumbo transgenik dengan mentransfer gen hormon pertumbuhan (PhGH) sehingga memiliki kecepatan pertumbuhan lebih tinggi dibanding ikan lele dumbo non-transgenik (Dewi dkk., 2013). Namun demikian, perlu dilakukan suatu kajian untuk mengetahui sifat pewarisan transgen yang diintroduksikan pada ikan lele dumbo transgenik tersebut, dengan asumsi apakah transgen dapat diturunkan pada generasi selanjutnya. Marnis dkk. (2013; 2014) melaporkan bahwa gen PhGH terdeteksi dan terekspresi pada generasi F1 dan F2. Oleh karena itu perlu dilakukan deteksi dan analisis terhadap ekspresi transgen (PhGH) lebih lanjut pada keturunan selanjutnya yaitu F3 untuk mengetahui sifat pewarisan gen hormon pertumbuhan tersebut, apakah masih dapat terdeteksi dan terekspresi. Secara ringkas kerangka pemikiran penelitian dapat dilihat pada Gambar 1.
Gambar 1. Kerangka Pemikiran Penelitian Peningkatan Kecepatan
Pertumbuhan (Transgenesis) Peningkatan Produksi
Budidaya Ikan Lele
Ikan Lele Transgenik
Ekspresi Transgen Deteksi Transgen
Tujuan Penelitian
1. Untuk mendeteksi gen hormon pertumbuhan (PhGH) pada ikan lele dumbo (Clarias gariepinus) transgenik F3.
2. Untuk mengetahui apakah gen hormon pertumbuhan (PhGH) terekspresi pada ikan lele dumbo (Clarias gariepinus) transgenik F3.
Manfaat Penelitian
1. Memberikan data dan informasi ilmiah mengenai deteksi dan ekspresi transgen (PhGH) pada ikan lele transgenik F3.
i
ABSTRAK
FERY JAKSEN SIHOTANG. Deteksi dan Analisis Ekspresi Transgen (PhGH) Pada Ikan Lele Dumbo (Clarias gariepinus) Transgenik F3. Di bawah bimbingan BUDI UTOMO, INDRA LESMANA dan HURIA MARNIS.
Ikan transgenik merupakan suatu spesies ikan yang mengalami perubahan struktur genetik yang diintroduksikan dari organisme lain sehingga mengubah fungsi genetiknya sesuai dengan gen yang diintroduksikan. Salah satu hal yang mendukung berkembangnya pembentukan strain ikan transgenik adalah kemampuan dari individu transgenik tersebut untuk mewariskan transgen pada generasi selanjutnya, sehingga sifat genetik gen target tetap stabil pada keturunan yang dihasilkan. Penelitian ini bertujuan untuk mendeteksi dan mengetahui ekspresi gen hormon pertumbuhan (PhGH) pada ikan lele dumbo (Clarias gariepinus) transgenik F3 yang dihasilkan dari generasi F2. Deteksi transgen dilakukan pada embrio dan larva ikan lele transgenik F3 menggunakan metode PCR dengan primer ACT 107 dan PhGH2. Ekspresi transgen dianalisis dengan menggunakan metode reverse transcriptase polymerase chain reaction (RT-PCR) dengan primer β-actin dan ACT 107 serta PhGH2. Hasil penelitian menunjukkan bahwa transgen terdeteksi pada beberapa embrio dan larva dengan ukuran fragmen 1500 bp. Amplifikasi primer β-actin dibandingkan dengan primer ACT 107 dan PhGH2 menunjukkan bahwa transgen dapat terekspresi pada beberapa embrio dan larva dengan ukuran fragmen 1500 bp.
ii
ABSTRACT
FERY JAKSEN SIHOTANG. Detection and Analysis Expression of transgene (PhGH) In Dumbo Catfish (Clarias gariepinus) Transgenic F3. Under supervision by BUDI UTOMO, INDRA LESMANA and HURIA MARNIS.
DETEKSI DAN ANALISIS EKSPRESI TRANSGEN (PhGH)
PADA IKAN LELE DUMBO (Clarias gariepinus)
TRANSGENIK F3
FERY JAKSEN SIHOTANG
110302045
PROGRAM STUDI MANAJEMEN SUMBERDAYA PERAIRAN
FAKULTAS PERTANIAN
DETEKSI DAN ANALISIS EKSPRESI TRANSGEN (PhGH)
PADA IKAN LELE DUMBO (Clarias gariepinus)
TRANSGENIK F3
SKRIPSI
FERY JAKSEN SIHOTANG
110302045
PROGRAM STUDI MANAJEMEN SUMBERDAYA PERAIRAN
FAKULTAS PERTANIAN
DETEKSI DAN ANALISIS EKSPRESI TRANSGEN (PhGH)
PADA IKAN LELE DUMBO (Clarias gariepinus)
TRANSGENIK F3
SKRIPSI
Oleh:
FERY JAKSEN SIHOTANG 110302045
Skripsi Sebagai Satu Diantara Beberapa Syarat untuk Memperoleh Gelar Sarjana Perikanan di Program Studi Manajemen Sumberdaya Perairan,
Fakultas Pertanian Universitas Sumatera Utara, Medan
PROGRAM STUDI MANAJEMEN SUMBERDAYA PERAIRAN FAKULTAS PERTANIAN
LEMBAR PENGESAHAN
Judul Penelitian : Deteksi dan Analisis Ekspresi Transgen (PhGH) Pada Ikan Lele Dumbo (Clarias gariepinus) Transgenik F3
Nama : Fery Jaksen Sihotang
NIM : 110302045
Program Studi : Manajemen Sumberdaya Perairan
Disetujui Oleh Komisi Pembimbing
Dr. Budi Utomo, SP., MP Ketua
Indra Lesmana, S.Pi., M.Si Huria Marnis, S.Pi., M.Si
Anggota Anggota
Mengetahui
Dr. Ir. Yunasfi, M.Si
i
ABSTRAK
FERY JAKSEN SIHOTANG. Deteksi dan Analisis Ekspresi Transgen (PhGH) Pada Ikan Lele Dumbo (Clarias gariepinus) Transgenik F3. Di bawah bimbingan BUDI UTOMO, INDRA LESMANA dan HURIA MARNIS.
Ikan transgenik merupakan suatu spesies ikan yang mengalami perubahan struktur genetik yang diintroduksikan dari organisme lain sehingga mengubah fungsi genetiknya sesuai dengan gen yang diintroduksikan. Salah satu hal yang mendukung berkembangnya pembentukan strain ikan transgenik adalah kemampuan dari individu transgenik tersebut untuk mewariskan transgen pada generasi selanjutnya, sehingga sifat genetik gen target tetap stabil pada keturunan yang dihasilkan. Penelitian ini bertujuan untuk mendeteksi dan mengetahui ekspresi gen hormon pertumbuhan (PhGH) pada ikan lele dumbo (Clarias gariepinus) transgenik F3 yang dihasilkan dari generasi F2. Deteksi transgen dilakukan pada embrio dan larva ikan lele transgenik F3 menggunakan metode PCR dengan primer ACT 107 dan PhGH2. Ekspresi transgen dianalisis dengan menggunakan metode reverse transcriptase polymerase chain reaction (RT-PCR) dengan primer β-actin dan ACT 107 serta PhGH2. Hasil penelitian menunjukkan bahwa transgen terdeteksi pada beberapa embrio dan larva dengan ukuran fragmen 1500 bp. Amplifikasi primer β-actin dibandingkan dengan primer ACT 107 dan PhGH2 menunjukkan bahwa transgen dapat terekspresi pada beberapa embrio dan larva dengan ukuran fragmen 1500 bp.
ii
ABSTRACT
FERY JAKSEN SIHOTANG. Detection and Analysis Expression of transgene (PhGH) In Dumbo Catfish (Clarias gariepinus) Transgenic F3. Under supervision by BUDI UTOMO, INDRA LESMANA and HURIA MARNIS.