Lampiran 2. Tumbuhan segar, daun segar, simplisia dan serbuk simplisia daun bangun-bangun Plectranhus amboinicus (Lour.)
Tumbuhan Daun Bangun-Bangun (Plectranthus amboinicus (Lour.) Spreng)
Lampiran 2. (lanjutan)
Simplisia Daun Bangun-Bangun
Lampiran 3. Mikroskopik Serbuk Daun Bangun-Bangun (Plectranthus
amboinicus (Lour.) Spreang) Perbesaran 10x40
Keterangan:
a. Kristal kalsium oksalat berbentuk prisma b. Rambut penutup uniseluler
c. Rambut kelenjar berbentuk glandular d. Pembuluh kayu berbentuk spiral e. Stomata berbentuk diasitik
A
B
D C
Lampiran 4. Bagan Kerja Pembuatan Simplisia Daun Bangun-Bangun
Dibersihkan dari pengotor Dicuci dengan air mengalir Ditiriskan
Ditimbang
Dikeringkan didalam lemari pengering dengan suhu 40-50 0C
Ditimbang
Dihaluskan dengan menggunakan blender Daun Bangun-bangun
Berat Basah 9000 g
Berat Kering 900 g
Lampiran 5. Perhitungan Hasil Karakteristik Simplisia
Perhitungan Kadar Air Simplisia Daun Bangun-Bangun (Plectranthus amboinicus
(Lour.) Spreng)
% kadar air = Volumeair (mL)
Beratsampel (g) x 100%
No. Berat sampel (g) Volume awal (mL) Volume akhir (mL)
1. 5,011 1,7 2,1
2. 5,007 2,1 2,5
3. 5,025 2,5 2,9
1. % kadar air = 2,10-1,70 (mL)
5,011 (g) x 100% = 7,98% 2. % kadar air = 2,50-2,10 (mL)
5,007 (g) x 100% = 7,98%
3. % kadar air = 2,90-2,50 (mL)
5,025 (g) x 100% = 6,96%
% rata-rata kadar air = 7,98% + 7,98% + 6,96%
Lampiran 6. Bagan Ekstraksi Serbuk Simplisia Secara Maserasi
900 g serbuk simplisia daun bangun-bangun
Maserat
Ditambahkan etilasetat hingga diperoleh 100 bagian
Dibiarkan selama 2 hari terlindung dari cahaya
Dienaptuangkan dan disaring Dimaserasi dengan 75 bagian n-heksana
Dibiarkan selama 5 hari terlindungi dari cahaya sambil sesekali diaduk
Disaring
Ampas
Ditambahkan n-heksana hingga diperoleh 100 bagian
Dibiarkan selama 2 hari terlindung dari cahaya Dienaptuangkan dan di saring
Maserat Ampas
Dimaserasi dengan 75 bagian etilasetat
Dibiarkan selama 5 hari terlindung dari cahaya sambil sesekali diaduk Disaring
Maserat Ampas
Maserat Ampas
Dikumpulkan maserat Dipekatkan dengan rotary evaporatory
Lampiran 7. Bagan Pembuatan Fraksinasi Etilasetat Daun Bangun-Bangun
Plectranthus amboinicus (Lour.) Spreang Dengan Metode
Kromatografi Cair Vakum (KCV)
Ditambahkan dengan silikagel 10 g sedikit demi sedikit
Diaduk hingga homogen
Dimasukkan ke dalam kolom dan di bagian atasnya di tutup dengan kertas saring
Difraksinasi dengan KCV dengan fase diam silikagel 60H dan fase gerak dengan gradien kepolaran yang meningkat yaitu berturut-turut
n-heksana: etilasetat (100:0), (90:10), (80:20), (70:30), (60:40), (50:50), (40:60), (30:70), (20:80), (10:90), (0:100) dan etilasetat : metanol (80:20), (60:40), (40:60), (20:80) dan (0:100).
Masing-masing fraksi dimonitor komponen kimianya dengan KLT menggunakan fase diam silikagel GF254 dan fase gerak n-heksana :
etilasetat (7:3)
Fraksi yang memiliki profil KLT yang sama digabung
Keterangan : * uji BSLT
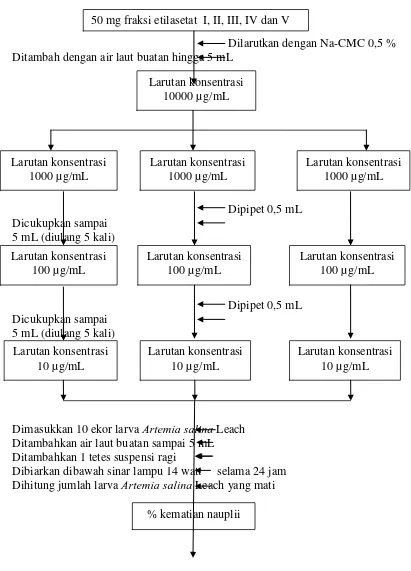
Lampiran 8. Bangan Pembuatan Air Laut Buatan
2 g ekstrak etilasetat
Dilarutkan terlebih dahulu dalam beakerglass
Dimasukkan dalam labu tentukur 1000 mL Ditambahkan air suling sampai 1000 mL
Lampiran 9. Bagan Pengujian Sitotoksik
38 gram garam non-yodium
Dilarutkan dengan Na-CMC 0,5 % Ditambah dengan air laut buatan hingga 5 mL
Dipipet 0,5 mL
Dimasukkan 10 ekor larva Artemia salina Leach Ditambahkan air laut buatan sampai 5 mL Ditambahkan 1 tetes suspensi ragi
Dibiarkan dibawah sinar lampu 14 watt selama 24 jam Dihitung jumlah larva Artemia salina Leach yang mati
Lampiran 10. Perhitungan Persentase Kematian Nauplii
Perhitungan LC50 fraksi etilasetat I
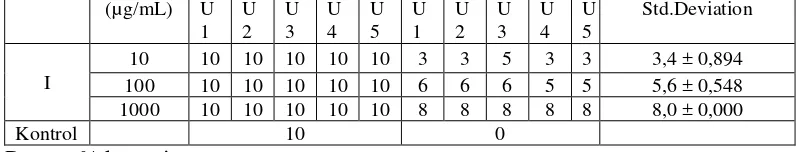
Tabel 1. Hasil pengujian BSLT fraksi etilasetat I
(µg/mL) U
Tes = Jumlah kematian nauplii larutan uji Kontrol = Jumlah kematian nauplii larutan kontrol Total = Jumlah nauplii yang digunakan
% kematian (10 µg/mL) =3,4−0 Tabel 2. Perhitungan persamaan garis linier.
X
Perhitungan LC50 dengan nilai Y adalah 50 Y = ax + b
50 = 23 X + 10,667 X = 1,71013
Lampiran 10. (lanjutan)
Perhitungan LC50 fraksi etilasetat II
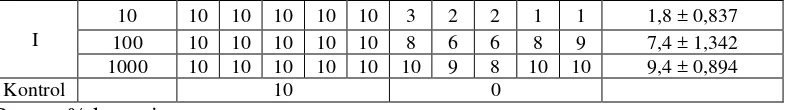
Tabel 3. Hasil pengujian BSLT fraksi etilasetat II
Fraksi Kons. (µg/mL)
Hidup awal Jumlah mati Rata-rata ±
I
Tes = Jumlah kematian nauplii larutan uji Kontrol = Jumlah kematian nauplii larutan kontrol Total = Jumlah nauplii yang digunakan
% kematian (10 µg/mL) =1,8−0 Tabel 4. Perhitungan persamaan garis linier.
X
Y = ax + b 50 = 38 X - 14 X = 1,68421
Lampiran 10. (lanjutan)
Perhitungan LC50 fraksi etilasetat III
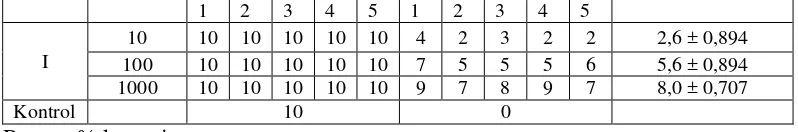
Tabel 5. Hasil pengujian BSLT fraksi etilasetat III
Fraksi Kons. (µg/mL)
Hidup awal Jumlah mati Rata-rata ±
Std.Deviation
1 2 3 4 5 1 2 3 4 5
Tes = Jumlah kematian nauplii larutan uji Kontrol = Jumlah kematian nauplii larutan kontrol Total = Jumlah nauplii yang digunakan
% kematian (10 µg/mL) =2,2−0 Tabel 6. Perhitungan persamaan garis linier.
X
Perhitungan LC50 dengan nilai Y adalah 50 : Y = ax + b
50 = 33 X -7,33 X = 1,73736
Lampiran 10. (lanjutan)
Perhitungan LC50 fraksi etilasetat IV
Tabel 7. Hasil pengujian BSLT fraksi etilasetat IV
Fraksi Kons. (µg/mL)
Hidup awal Jumlah mati Rata-rata ±
Std.Deviation
1 2 3 4 5 1 2 3 4 5
Tes = Jumlah kematian nauplii larutan uji Kontrol = Jumlah kematian nauplii larutan kontrol Total = Jumlah nauplii yang digunakan
% kematian (10 µg/mL) =2,6−0 Tabel 8. Perhitungan persamaan garis linier.
Perhitungan LC50 dengan nilai Y adalah 50 : Y = ax + b
50 = 26 X + 1,33 X = 1,87192
Lampiran 10. (lanjutan)
Perhitungan LC50 fraksi etilasetat V
Tabel 9. Hasil pengujian BSLT fraksi etilasetat V
(µg/mL) U
Tes = Jumlah kematian nauplii larutan uji Kontrol = Jumlah kematian nauplii larutan kontrol Total = Jumlah nauplii yang digunakan
% kematian (10 µg/mL) =0,6−0 Tabel 10. Perhitungan persamaan garis linier.
X
Perhitungan LC50 dengan nilai Y adalah 50 : Y = ax + b
Lampiran 11 Perhitungan Statistik Fraksi Etilasetat I Descriptives
JumlahKematianNauplii
N Mean
Test of Homogeneity of Variances
Post Hoc Tests *. The mean difference is significant at the 0.05
level.
Means for groups in homogeneous subsets are displayed.
Perhitungan Statistik Fraksi Etilasetat II
Test of Homogeneity of Variances
Post Hoc Tests
Multiple Comparisons
Dependent Variable: Jumlah Kematian Nauplii
(I) konsentrasi *. The mean difference is significant at the 0.05level.
Homogeneous Subsets
Means for groups in homogeneous subsets are displayed.
Perhitungan Statistik Fraksi Etilasetat III Descriptives
JumlahKematianNauplii
N Mean
Test of Homogeneity of Variances
Post Hoc Tests
Multiple Comparisons
Dependent Variable: Jumlah Kematian Nauplii
(I) *. The mean difference is significant at the 0.05 level.
Homogeneous Subsets
Means for groups in homogeneous subsets are displayed.
Perhitungan Statistik Fraksi Etilasetat IV
Test of Homogeneity of Variances
Post Hoc Tests
Multiple Comparisons
Dependent Variable:Jumlah Kematian Nauplii
(I) *. The mean difference is significant at the 0.05
level.
Means for groups in homogeneous subsets are displayed.
Perhitungan Statistik Fraksi Etilasetat V Descriptives
Jumlah Kematian Nauplii
N Mean
Std. Deviation
Std. Error
95% Confidence Interval for Mean
Minimum Maximum Lower
Bound
Upper Bound
10 µg/ml 5 .60 .548 .245 -.08 1.28 0 1 100 µg/ml 5 6.40 1.673 .748 4.32 8.48 4 8 1000 µg/ml 5 7.20 1.095 .490 5.84 8.56 6 9 Total 15 4.73 3.240 .836 2.94 6.53 0 9
Test of Homogeneity of Variances
Jumlah Kematian Nauplii Levene
Statistic df1 df2 Sig.
Post Hoc Tests
Multiple Comparisons
Dependent Variable:Jumlah Kematian Nauplii
(I) *. The mean difference is significant at the 0.05 level.
Homogeneous Subsets
Data Statistik
Fraksi Etilasetat Daun Bangun-Bangun I
Confidence Limits
Probabil ity
95% Confidence Limits for Konsentrasi
Data Statistik
Fraksi Etilasetat Daun Bangun-Bangun II
Confidence Limits
Probabil ity
95% Confidence Limits for konsentrasi
Data Statistik
Fraksi Etilasetat Daun Bangun-Bangun III
Confidence Limits
Probabil ity
95% Confidence Limits for konsentrasi
Data Statistik
Fraksi Etilasetat Daun Bangun-Bangun IV
Confidence Limits
Proba
bility
95% Confidence Limits for konsentrasi
95% Confidence Limits for
Data Statistik
Fraksi Etilasetat Daun Bangun-Bangun V
Confidence Limits
Proba bility
95% Confidence Limits for konsentrasi
DAFTAR PUSTAKA
Anderson. J. E. (1991). A Blind Comparison of Simple Bench-Top Bioassays and Human Tumour Cell Cytotoxities as Antitumor Prescreens. Phytochem. J Anal. Vol. 2: 107-111.
Arbiastuti, Y., dan Muflihati. (2008). Isolasi dan Uji Aktivitas Kandungan Kimia Bioaktif dari Biji Duku (Lasium domesticum Corr). Jurnal Penelitian Universitas Tanjung Pura. 10(2): 74.
Bactiar, Y. (2003). Menghasilkan Pakan Alami Untuk Ikan Hias. Depok: Agromedia Pustaka. Halaman 17-18.
Bhattacharjee, P. (2010). Phytochemical and Pharmacologycal Investigation of Different Parts of Coleus amboinicus (Lour). Disertasi. National College of Pharmacy. Balaraj Urs Road, Shimoga. Halaman 65.
Cahyadi, R. (2009). Uji Toksisitas Akut Ekstrak Etanol Buah Pare (Momordica charantia L,) terhadap Larva Artemia salina Leach dengan Metode Brine Shrimp Lethality Test. Skripsi. Semarang: Fakultas Kedokteran Universitas Diponegoro. Halaman 33.
Carballo, JH., Hernandez-Inda, ZL., Perez, P., dan Garcia-Gravalos, MD. (2002).
A Comparison Between Two Brine Shrime Assays to Detect IN Vitro Cytotoxicity in Marine Natural Products. BMC Biotechnol 2 : 17.
Depkes, RI. (1979). Materia Medika Indonesia.Jilid III. Jakarta: Direktorat Jenderal Pengawas Obat dan Makanan. Halaman 159, 167-171.
Depkes, RI. (1989). Materia Medika Indonesia. Jilid V. Jakarta: Direktorat Jendral Pengawasan Obat dan Makanan. Halaman 151-154.
Depkes, RI. (1995). Materia Medika Indonesia. Jilid VI. Jakarta: Departemen Kesehatan RI. Halaman 300-304, 306.
Depkes, RI. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Jakarta: Departemen Kesehatan RI. Halaman 1-11.
Fanani, R. (2009). Uji Toksisitas Akut Ekstrak Etanol Daun Dewandaru (Eugenia uniflora L,) Per Oral Pada Tikus Sprague Dawley. Skripsi. Surakarta: Fakultas Farmasi Universitas Muhammadiyah Surakarta. Halaman 93. Gritter, R.J., Bobbitt, J., dan Schwarting, A.E. (1991). Pengantar Kromatografi.
Harbone, J. B. (1987). Metode Fitokimia Penuntun Cara Modern Menganalisis Tumbuhan. Penerjemah: Kosasih Padmawinata dan Iwang Soediro. Edisi II. Bandung: ITB. Halaman 102-103, 147-149, 234.
Hariana, H. A. (2008). Tumbuhan Obat dan Khasiatnya. Jakarta: Penebar Swadaya. Halaman 96.
Hasibuan, P. (2012). Aktivitas Antioksidan dan Antikanker Ekstrak Daun Bangun-Bangun (Plectranthus amboinicus (Lour.) Spreng) Terhadap Kanker Payudara Secara In vitro dan In vivo Test. Disertasi.Medan: Fakultas Farmasi Sumatera Utara Medan. Halaman 50.
Hostettmann, K., Hostettmann, M., dan Marston, A. (1995). Cara Kromatografi Preperatif: Penggunaan pada Isolasi Senyawa Alam. Penerjemah: Kosasih Padmawinata. Bandung: ITB. Halaman 9-12, 33-34.
Hodgson, E. (2004). A Text Of Modern Toxicology. Third Edition. United States of America: A John Willey & Sons, Inc., Publication. Halaman 4.
Inayah, Ningsih dan Kustono. (2012). Uji Toksisitas dan Identifikasi Awal Golongan Senyawa Aktif Ekstrak Etanol dan N- Heksana Teripang Pasir (Holothuria scabra) Kering Pantai Kenjeran Surabaya. Alchemy. Vol. 2 No. 1. Halaman 92- 100.
Kaliappan, N.D., dan Viswanathan, P.K. (2008). Pharmacognostical Studies on The Leaves of Plectranthus amboinicus (Lour) Spreng. Journal of Medical Research. 2(3): 182-184.
Kemala, S. (2012). Efek Toksisitas Akut Ekstrak Etanol dan Fraksi Daun Bangun-Bangun (Plectranthus amboinicus (Lour.) Spreng) Terhadap Larva Artemia salina Leach dengan Metode Brine Shrimp Lethality Test (BSLT). Skripsi. Medan: Fakultas Farmasi Sumatera Utara Medan. Halaman 45-53.
Kurniawan, H. (2012). Uji Toksisitas Akut Ekstrak Metanol Daun Kesum (Polygonum minus Huds)Terhadap LarvaArtemia salina Leachdengan MetodeBrine Shrimp Lethality Test (BSLT). Skripsi. Program Studi FarmasiFakultas Kedokteran dan Ilmu Kesehatan. Pontianak : Universitas Tanjungpura. Halaman 38-42.
Lenny dan Fitrya. (2006). Uji Aktivitas Antikanker Secara In Vitro dengan Sel Murine P-388 Senyawa Flavonoid dari Etilasetat Akar Tumbuhan Tunjuk Langit (Helmynthostachi zeylanica (Linn) Hook). Jurnal Penelitian Sains Volume 12 Nomor I (C) 12106.Palembang : Universitas Sriwijaya. Halaman 33.
Ma’at, S. (1999). Pengujian Bioaktivitas Tanaman Obat Sebagai Antikanker.
McLaughlin, J.L., and Lingling L., R. (1998). The Use Of Biological Assays To Evaluate Botanicals. Drug Information Journal.Volume 32. Pages 514. Meyer, B.N., Ferrigni, N.R., Putnam, J.E., Jacobsen, L.B., Nichols, D.E., dan
McLaughlin, J.L. (1982). Brine Shrimp, A Convenient General Bioassay for Active Plant Constituens. Journal of Plant Medical Research. 45(5) 31-35.
Mutia, D. (2010). Uji Toksisitas Akut Ekstrak Etanol Buah Anggur (Vitis Vinifera)
Terhadap Larva Artemia salina Leach Dengan Metode Brine Shrimp Lethality Test (BSLT). Karya Tulis Ilmiah. Program Pendidikan Sarjana Kedokteran, Fakultas Kedokteran Diponegoro, Semarang. Halaman 13. Noerdin, D. (1985). Elusidasi Struktur Organik Dengan Cara Spektroskopi Ultra
Lembayung dan Inframerah. Bandung: Penerbit Angkasa. Halaman 88. Pandey, B. P. (2003). A Text Book of Botany Angiosperms Taxonomy, Anatomy,
Embryology (Including Tissue Culture And Economic Botany). New Delhi: S. Chand & Company LTD. Halaman 349.
Rohman, dan Gandjar. (2007). Kimia Farmasi Analisis. Yogyakarta: Pustaka Pelajar. Halaman 46-47.
Runia, Y. A. (2008). Faktor-Faktor Yang Berhubungan Dengan Keracunan Pestisida Organofosfat, Karbamat dan Kejadian Anemia Pada Petani Hortikultura di Desa Tejosari Kecamatan Ngablak Kabupaten Magelang.
Tesis. Semarang: Universitas Diponegoro. Halaman 46.
Rout, O.P., Rout, K.K., Acharya, R., dan Mishra, S.K. (2010). Preliminary Pharmacognostical and Phytochemical evaluation of Coleus aromaticus
Benth. Leaf. International Jurnal of Pharma World Research. 1(4):2-4. Sahgal G., Ramanathan, S., Sasidharan S., Mordin M.N., Ismail S., dan Mansor
S.M. (2010). Brine Shrimp Lethality and Acute Oral Toxicity Studies on Swietenia mahagoni (Linn.) Jacq. Seed Methanolic Extract. Diakses 21 Mei 2012. An International Quarterly Published Online Research Journal. Santosa, C.M., dan Hertiani, T. (2005). Kandungan Senyawa kimia dan Efek
Ekstrak Air Daun Bangun-Bangun (Coleus amboinicus, L.) pada Aktivitas Fagositosis Netrofil Tikus Putih (Rattus norvegicus). Majalah Farmasi Indonesia. 16(3): 141-148.
Sastrohamidjojo, H. (1991). Kromatografi. Yogyakarta: Penerbit Liberty. Halaman 22-36.
BAB III
METODE PENELITIAN
Penelitian ini dilakukan dengan menggunakan metode eksperimental. Uji sitotoksik fraksi etilasetat dilakukan dengan metode Brine Shrimp Lethality Test
denganmenggunakan larva Artemia salina Leach. Parameter yang diukur adalah nilai LC50 (Lethal Concentration 50). Tahapan penelitian meliputi penyiapan bahan
tumbuhan, pemeriksaan karakteristik daun bangun-bangun, pembuatan simplisia, pembuatan ekstrak, analisis KLT, pembuatan fraksinasi dengan metode KCV pengujian efek sitotoksik fraksi etilasetat daun bangun-bangun (Plectranthus amboinicus (Lour.) mengggunakan larva udang Artemia salina Leach. Penelitian ini dilakukan di Laboratorium Farmakognosi Fakultas Farmasi Universitas Sumatera Utara.
3.1 Alat
3.2 Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah daun bangun-bangun (Plectranthus amboinicus (Lour.), telur Artemia salina Leach, garam tidak beriodium, Na-CMC (Natrium-Carboxy Methyl Cellulose) dan air suling. Bahan kimia yang digunakan kecuali dinyatakan lain berkualitas pro analisa yaitu etilasetat (destilasi), n-heksana (destilasi),etilasetat, n-heksana, kloralhidrat dan toluen.
3.3 Penyiapan Bahan Tanaman
Penyiapan bahan tanaman meliputi pengambilan bahan dan identifikasi daun bangun-bangun (Plectranthus amboinicus (Lour) Spreng.
3.3.1 Pengambilan Bahan Tanaman
Pengambilan bahan tanaman dilakukan secara purposif yaitu tanpa membandingkan dengan tanaman yang sama dari daerah lain. Bahan tanaman yang digunakan adalah daun bangun-bangun yang berwarna hijau dan masih segar, yang diperoleh dari Kecamatan Beringin, Pematang Siantar, Provinsi Sumatera Utara.
3.3.2 Identifikasi Tanaman
Identifikasi tanaman dilakukan di Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor.
3.4 Hewan Percobaan
Hewan percobaan yang digunakan pada penelitian ini adalah larva udang
3.5 Pembuatan Pereaksi
Larutan Kloralhidrat: Sebanyak 50 g kloralhidrat ditimbang, dilarutkan dalam 20 ml air suling (Depkes RI., 1995).
3.6 Pemeriksaan Karakteristik Daun Bangun-Bangun
Pemeriksaan karakteristik daun bangun-bangun meliputi pemeriksaan makroskopik dan mikroskopik, penetapan kadar air.
3.6.1 Pemeriksaan Makroskopik
Pemeriksaan makroskopik dilakukan terhadap daun bangun-bangun dengan cara mengamati warna, bentuk, ukuran dan tekstur dari simplisia.
3.6.2 Pemeriksaan Mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia daun bangun-bangun. Serbuk simplisia ditaburkan di atas objek glass yang telah ditetesi dengan larutan kloralhidrat dan ditutup dengan kaca penutup, kemudian diamati di bawah mikroskop.
3.6.3 Penetapan Kadar Air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen) (WHO,1998).
Cara kerja : 1. Penjenuhan Toluen
Sebanyak 200 mL toluen dan 2 mL air suling dimasukkan ke dalam labu alas bulat, didestilasi selama 2 jam. Kemudian toluen didinginkan selama 30 menit dan volume air pada tabung penerima dibaca dengan 0,05 mL.
2. Penetapan Kadar Air Simplisia
labu yang berisi toluen tersebut, lalu dipanaskan hati-hati selama 15 menit. Setelah toluen mendidih, kecepatan tetesan diatur lebih kurang 2 tetesan perdetik, sampai sebagian air terdestilasi, kemudian kecepatan destilasi dinaikkan hingga 4 tetes perdetik. Setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluen. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan dingin sampai suhu kamar. Setelah air dan toluen memisah sempurna, volume air dibaca dengan ketelitian 0,05 mL. Selisih kedua volume air dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa.
3.7 Pembuatan Simplisia
Pembuatan simplisia dilakukan dengan cara daun daun bangun-bangun (Plectranthus amboinicus (Lour.) Spreng) yang telah dikumpulkan, dibersihkan dari pengotor yang melekat, lalu dicuci bersih dengan air sampai bersih dan ditiriskan. Bahan tanaman dikeringkan dengan cara diangin-anginkan terlebih dahulu, kemudian dikeringkan didalam lemari pengering sampai simplisia rapuh ketika diremas. Kemudian diblender sampai menjadi serbuk dan disimpan dalam wadah plastik yang tertutup rapat. Serbuk ditimbang diperoleh berat kering 900 g.
3.8 Pembuatan Ekstrak Daun Bangun-Bangun
diserkai, ampas diperas dan dicuci dengan cairan penyari secukupnya hingga diperoleh 100 bagian. Sari dipindahkan kedalam bejana tertutup, dibiarkan ditempat sejuk dan terlindung dari cahaya selama 2 hari. Dienaptuangkan dan disaring. Ampas kemudian diangin-anginkan dimasukkan kembali kedalam sebuah bejana dituangi dengan 75 bagian cairan penyari (etilasetat), ditutup dan dibiarkan selama 5 hari terlindungi dari cahaya, sambil sering diaduk. Selama 5 hari diserkai, ampas diperas dan dicuci dengan cairan penyari secukupnya hingga diperoleh 100 bagian. Sari dipindahkan kedalam bejana tertutup, dibiarkan ditempat sejuk dan terlindung dari cahaya selama 2 hari. Dienaptuangkan dan disaring. Maserat kemudian disuling dan diuapkan dengan tekanan rendah pada suhu tidak lebih dari 500C menggunakan rotary evaporator sehingga diperoleh ekstrak kental etilasetat (Depkes RI., 1995).
3.9 Kromatografi Lapis Tipis
Fase gerak terbaik adalah fase gerak yang dapat menghasilkan bercak paling banyak yang digunakan untuk fase gerak pada kromatografi kolom. Hasil ekstrak etilasetat dilakukan analisis secara KLT menggunakan fase diam silika gel GF254 dan fase gerak campuran n-heksana-etilasetat dengan perbandingan (100:0),
(90:10), (80:20), (70:30), (60:40), (50:50), (40:60), (30:70), sebagai penampak bercak digunakan sinar UV dengan panjang gelombang 366 nm dan 254 nm dan diamati bercak flouresensi yang timbul.
Cara Kerja :
dikeluarkan dan dikeringkan, plat diamati dibawah sinar UV dengan panjang gelombang 366 nm.
3.10 Pembuatan Fraksi Ekstrak Etilasetat
Ekstrak etilasetat difraksinasi menggunakan KCV dengan fase diam silikagel 60H fase gerak dengan gradien kepolaran yang meningkat yaitu n -heksana : etilasetat dengan perbandingan (100:0), (90:10), (80:20), (70:30), (60:40), (50:50), (40:60), (30:70), (20:80), (10:100), (0:100) dan etilasetat : metanol (80:20), (60:40), (40:60), (20:80), (0:100).
Cara kerja :
Kolom yang digunakan adalah corong Buchner kaca masir, kedalam corong Buchner kaca masir dimasukkan silikagel 60 H yang dikemas dalam keadaan kering. Lalu diatasnya ditutup kembali dengan kertas saring. Alat vakum dihidupkan untuk memperoleh kerapatan yang maksimum. Kemudian cuplikan yang telah dicampur dengan silika gel 60H diletakkan pada bagian atas kolom yang disebar secara merata, lalu diatasnya diletakkan kertas saring. Alat vakum dihidupkan kembali. Sampel dielusi dengan pelarut mulai dari kepolaran rendah lalu kepolaran ditingkatkan perlahan-lahan dan dihisap sampai kering pada setiap pengumpulan fraksi. Fraksi etilasetat yang diperoleh dari 16 landaian fase gerak dan dikelompokkan menjadi 5 fraksi etilaseat berdasarkan bercak noda yang sama.
3.11 Uji Sitotoksik
Uji sitotoksik dilakukan terhadap fraksi etilasetat menggunakan larva Artemia
Air laut buatan disiapkan dengan melarutkan 38 g garam tidak beriodium dengan air suling dicukupkan hingga 1 L kemudian disaring (Meyer, et al., 1982). Bejana penetasan disekat menjadi dua bagian, yaitu bagian yang besar dan bagian yang kecil, lalu diberi lubang pada sekatnya. Air laut buatan dimasukkan ke dalam bejana, telur Artemia salina Leach ditaburkan ke dalam bagian yang kecil kemudian bagian atasnya ditutup dengan aluminium foil sedangkan bagian yang besar dibiarkan terbuka menghadap lampu selama 48 jam, telur akan menetas menjadi larva dan siap digunakan untuk hewan uji.
Sebanyak 0,5 g Na-CMC ditaburkan dalam lumpang yang berisi ±20 mL air suling panas, didiamkan selama 15 menit lalu digerus hingga diperoleh massa yang transparan, lalu digerus sampai homogen, diencerkan dengan air suling, dihomogenkan dan dimasukkan ke labu tentukur 100 mL, dicukupkan volumenya dengan air suling hingga 100 mL.
µg/mL. Kontrol dibuat dengan menambahkan Na-CMC 0,5% ke dalam vial sesuai jumlah yang digunakan untuk melarutkan fraksi, kemudian cukupkan dengan air laut buatan sampai 5 mL. Lalu ditambahkan 10 ekor larva Artemia salina Leach ke dalam masing-masing vial yang telah berisi larutan uji dan kontrol. Tambahkan 1 tetes suspensi ragi (3 mg dalam 5 mL air laut buatan) sebagai makanannya kemudian semua vial diletakkan dibawah cahaya lampu. Pengamatan dilakukan setelah 24 jam dan dihitung jumlah persentase kematian larva tiap dosis dan kontrol. Data dihitung menggunakan rumus Abbott :
Kematian = tes−kontro l
kontrol x 100 %.
(Meyer, et al., 1982)
Data dianalisis dengan analisis variansi ANOVA menggunakan program SPSS versi 17 untuk melihat ada tidaknya perbedaan dari setiap konsentrasi pada tiap larutan uji terhadap jumlah kematian nauplii, untuk mengetahui konsentrasi mana yang memiliki efek yang sama atau berbeda antara satu konsentrasi dengan konsentrasi yang lain dalam satu larutan dilakukan uji Post Hoc Tuckey dan untuk menentukan LC50 digunakananalisis Probit. Perhitungan LC50 fraksi etilasetat I, II,
BAB IV
HASIL DAN PEMBAHASAN
4.1 Identifikasi Tanaman
Identifikasi sampel dilakukan di Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor. Hasil identifikasi menunjukkan bahwa sampel termasuk suku Lamiaceae, spesies Plectranthus amboinicus, (Lour) Spreng. Hasil dapat dilihat padaLampiran 1, halaman 41.
4.2 Karakteristik Simplisia
Hasil pemeriksaan karakterisasi simplisia daun bangun-bangun diperoleh kadar air 7,64%, kadar ini memenuhi syarat menurut Materia Medika Indonesia Edisi V secara umum yaitu kadar air daun jika tidak dinyatakan lain adalah kurang dari 10%. Kadar air yang berlebihan dapat mempercepat pertumbuhan mikroorganisme dan hidrolisis senyawa kimia. Hasil perhitungan kadar air dapat di lihat pada Lampiran 5, halaman 46. Senyawa-senyawa yang terkandung di dalam daun bangun-bangun adalah flavonoid, glikosida, triterpenoid/steroid (Hasibuan, 2012).
4.3 Ekstraksi
Ekstraksi serbuk simplisia dilakukan secara maserasi dengan menggunakan pelarut n-heksan dan kemudian dilanjutkan dengan menggunakan pelarut etilasetat diperoleh ekstrak kental etilasetat 26,565 g.
4.4 Hasil Analisis Ekstrak Etilasetat Dengan Cara KLT
Hasil KLT ekstrak etilasetat Plectranthus amboinicus (Lour.) Spreng menggunakan fase diam silika gel GF254 diperoleh fase gerak yang memisahkan
bp
tp
Gambar 4.1 Kromatogram dari EEDBB Dengan Fase Gerak n-heksana-
etilasetat Penampak Bercak UV 366 nm.
Keterangan: Fase diam silika gel GF 256 dan fase gerak n-heksana-etilasetat, tp=titik penotolan, bp= batas pengembangan.
Tabel 4.1 Nilai Noda Kromatogram Lapis Tipis Ekstrak Etilasetat dari Daun Bangun-Bangun Dengan Fase Gerak yang Berbeda.
Kromatografi Fase gerak (n-heksana-etilasetat) Harga Rf
I 8:2 0,1466; 0,2133; 0,2933;
0,36; 0,5066
II 7:3 0,4933; 0,5733; 0,6667;
0,7733; 0,84; 0,8667
III 6:4 0,44; 0,72; 0,8; 0,84
IV 5:5 0,6; 0,8667; 0,9733
V 4:6 0,7467; 0,9066
VI 3:7 0,84; 0,9066
4.5 Hasil FEDBB Secara Kromatografi Cair Vakum (KCV)
200 ml. Hasil fraksinasi diperoleh 16 fraksi. Masing-masing fraksi dimonitor komponen kimianya dengan menggunakan fase gerak n-heksana : etilasetat 7 : 3. Fraksi yang memiliki profil yang sama digabungkan hingga diperoleh 5 fraksi yaitu fraksi I (vial 1), fraksi II (vial 2-3), fraksi III (vial 4-7), fraksi IV (vial 8-13), fraksi V (vial 14-16). Hasil fraksi etilasetat I = 1, 246 g, fraksi etilasetat II = 1,925 g, fraksi etilasetat III = 2,746 g, fraksi etilasetat IV = 5,351, fraksi etilasetat V = 1,366 g. Masing-masing fraksi yang diperoleh diuji sitotoksiknya dengan menggunakan metode BSLT. Hasil kromatogram fraksi KCV ekstrak etilasetat ditunjukkan pada Gambar 4.2 berikut ini:
bp
tp
Gambar 4.2 Kromatogram dari FEDBB dengan Fase Gerak n
-heksana-etilasetat Penampak Bercak UV 366 nm.
Keterangan: Fase diam silika gel GF 256 fase gerak n-heksana-etilasetat 7:3, tp= titik penotolan, bp= batas pengembangan
FEDBB I = n-heksana-etilasetat (100:0)
FEDBB II = n-heksana-etilasetat (90:10 dan 80:20)
FEDBB III = n-heksana-etilasetat (70:30; 60:40; 50:50; 40:60) FEDBB IV = n-heksana-etilasetat (30:70; 20:80; 10:90; 0:100)
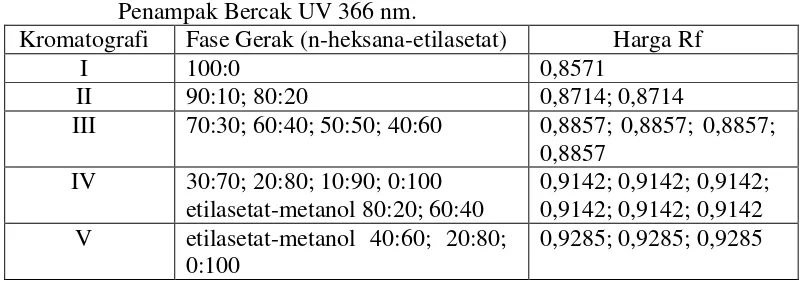
Tabel 4.2 Nilai Noda Kromatografi Lapis Tipis Fraksi Etilasetat dari Daun Bangun-Bangun Dengan Fase Gerak n-heksana-etilasetat 70:30 Penampak Bercak UV 366 nm.
Kromatografi Fase Gerak (n-heksana-etilasetat) Harga Rf
I 100:0 0,8571
II 90:10; 80:20 0,8714; 0,8714
III 70:30; 60:40; 50:50; 40:60 0,8857; 0,8857; 0,8857; 0,8857
IV 30:70; 20:80; 10:90; 0:100 etilasetat-metanol 80:20; 60:40
0,9142; 0,9142; 0,9142; 0,9142; 0,9142; 0,9142 V etilasetat-metanol 40:60; 20:80;
0:100
0,9285; 0,9285; 0,9285
4.6Hasil Uji Efek SitotoksikFraksi Etilasetat
Brine Shrimp Lethalty Test (BSLT ) adalah salah satu metode uji toksisitas untuk menguji bahan-bahan yang bersifat sitotoksik. Uji toksisitas dengan metode BSLT ini merupakan uji toksisitas akut, yaitu efek toksik dari suatu senyawa ditentukan dalam waktu singkat setelah pemberian dosis uji. Pengujian menggunakan Brine Shrimp Lethalty Test (BSLT) diterapkan dengan menentukan nilai Lethal Concentration 50% (LC50) setelah perlakuan 24 jam. Nilai LC50
merupakan angka yang menunjukkan konsentrasi suatu bahan penyebab kematian sebesar 50% dari jumlah hewan uji (Wibowo, 2013). Prosedurnya dengan menentukan nilai LC50 dari aktivitas komponen aktif tanaman terhadap larva Artemia salina Leach. Suatu ekstrak dikatakan toksik berdasarkan metode BSLT jika nilai LC50< 1000 µg/mL (Meyer, et al., 1982). Larva yang digunakan untuk
Apabila suatu ekstrak tanaman bersifat toksik menurut nilai LC50 dengan
metode BSLT, maka tanaman tersebut dapat dikembangkan sebagai obat anti kanker (Cahyadi, 2009; Kurniawan, 2011). Namun, bila tidak bersifat toksik maka tanaman tersebut dapat diteliti kembali untuk mengetahui khasiat lainnya dengan menggunakan hewan coba lain yang lebih besar dari larva udang Artemia salina
seperti mencit dan tikus secara in vivo (Cahyadi, 2009; Mutia, 2010). Kematian larva Artemia salina Leach berhubungan dengan konsentrasi dan senyawa-senyawa yang terkandung didalam larutan uji (Cahyadi, 2009; Mutia, 2010). Adapun hasil perhitungan jumlah kematian nauplii dalam penelitian ini dapat dilihat pada Tabel 4.3 berikut:
Tabel 4.3 Hasil Uji Sitotoksik Fraksi Etilasetat Daun Bangun-Bangun (FEDBB) Sampel Kons (µg/mL) Log.
Kons
Rata- rata
kematian % kematian Fraksi etil
Uji sitotoksik terhadap Artemia salina Leach dengan fraksi etilasetat dilakukan sebanyak 5 kali pengulangan pada masing-masing konsentrasi yaitu 10 µg/mL, 100 µg/mL dan 1000 µg/mL.
jumlah kematian nauplii. Hasil analisis dapat dilihat pada Lampiran 11, halaman 61. Mengetahui konsentrasi mana yang memiliki efek yang sama atau berbeda antara satu konsentrasi dengan konsentrasi yang lain dalam satu larutan uji dilakukan uji Post Hoc Tuckey untuk semua larutan uji. Hasil uji Post Hoc Tuckey pada fraksi etilasetat I menunjukkan bahwa jumlah kematian nauplii pada konsentrasi 10 µg/mL dan 100 µg/mL tidak signifikan. Sedangkan pada konsentrasi 1000 µg/mL jumlah kematian nauplii memiliki nilai yang signfikan (p < 005) artinya pada konsentrasi 1000 µg/mL fraksi etilasetat daun bangun-bangun dapat memberikan efek sitotoksik terhadap larva Artemia salina Leach yang lebih tinggi dibandingkan pada konsentrasi 10 µg/mL dan 100 µg/mL.
Berdasarkan hasil analisis probit hasil pengujian sitotoksik larutan uji terhadap nauplii Artemia salina Leach dapat dilihat pada Tabel 4.4 berikut:
Tabel 4.4. Hasil Pengukuran LC50 dengan Metode BSLT
No Ekstrak LC50 (µg/mL) Fraksi Etilasetat V
49,431 42,955 51,050 72,945 130,617
Berdasarkan hasil uji sitotoksik kelima fraksi etilasetat tersebut mempunyai aktivitas toksisitas yang signifikan terdapat pada fraksi II. Hasil ini menunjukkan bahwa pada konsentrasi tersebut fraksi sudah dapat mematikan 50% larva
Artemia salina Leach. Dari masing-masing fraksi sampel yang memiliki aktivitas yang terbaik pada fraksi II dengan nilai LC50 42,955 µg/mL dengan eluen H:E (9
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
a. fraksi etilasetat daun bangun-bangun memiliki efek toksik terhadap larva
Artemia salina Leach yang ditunjukkan dengan nilai LC50 49,431 µg/mL
fraksi etilasetat daun bangun-bangun I, nilai LC50 42,955 µg/mL fraksi
etilasetat daun bangun-bangun II, nilai LC50 51,050 µg/mL fraksi etilasetat
daun bangun-bangun III, nilai LC50 72,945 µg/mL fraksi etilasetat daun
bangun-bangun IV, nilai LC50 130,617 µg/mL fraksi etilasetat daun
bangun-bangun V.
b. fraksi etilasetat daun bangun-banguun II merupakan fraksi yang paling toksik terhadap larva Artemia salina Leach karena mempunyai nilai LC50
yang paling rendah diantara fraksi yang lain yaitu 42,955 µg/mL.
5.2 Saran
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Daun Bangun-Bangun
Daun bangun-bangun merupakan tanaman daerah tropis yang daunnya memiliki aroma tertentu sehingga dikenal sebagai tanaman aromatik. Tanaman ini banyak ditemukan di India, Ceylon dan Afrika Selatan, memiliki bunga yang bentuknya tajam dan mengandung minyak atsiri sehingga disebut juga Coleus aromaticus (Kaliappan, et al., 2008).
2.1.1 Sistematika Tanaman
Menurut Pandey (2003), sistematika tanaman bangun-bangun adalah sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta Kelas : Dicotyledoneae Ordo : Solanales Famili : Lamiaceae Genus : Plectranthus
Spesies : Plectranthus amboinicus (Lour.) Spreng
2.1.2 Nama Lokal
2.1.3 Nama Asing
Inggris: Caraway seed atau cemin. Cina: Panling moung (Hariana, 2008).
2.1.4 Morfologi Tanaman
Daun bangun-bangun memiliki ciri-ciri dauntunggal, berwarna hijau, helaian daun berbentuk bundar telur, kadang-kadang agak membundar, panjang helaian daun 3,5 cm sampai 6 cm, lebar 2,5 cm, pinggir daun beringgit atau agak berombak, tangkai daun panjang 1,5 cm sampai 3 cm,tulang daun menyirip. Pada keadaan segar helaian daun tebal, sangat berdaging dan berair, tulang daun bercabang-cabang dan menonjol sehingga membentuk bangunan menyerupai jala, permukaan atas berbingkul-bingkul, berwarna hijau muda, permukaan bawah berambut halus berwarna putih. Pada keadaan kering helaian daun tipis dan sangat berkerut, permukaan atas kasar, warna coklat sampai coklat tua, permukaan bawah berwarna lebih muda dari permukaan atas, tulang daun kurang menonjol, pada kedua permukaan terdapat rambut halus berwarna putih (Depkes RI., 1989).
2.1.5 Khasiat Tanaman
Daun bangun-bangun berkhasiat sebagai antioksidan, antitumor, antimutagenik, mengobati brokitis, asma, diare, epilepsi, demam, batuk, sakit kepala, dispepsia, batu ginjal, disentri (Rout, et al., 2010), malaria, obat cacing (Kaliappan, et al., 2008), obat luka, sariawan (Depkes RI., 1989), mencegah kanker, antivertigo, meningkatkan total volume ASI (Santosa dan Hertiani, 2005).
2.1.6 Kandungan Kimia
beta karotin, niasin, karvakrol, kalsium, asam-asam lemak, asam oksalat dan serat (Santosa dan Hertiani, 2005).
2.2 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair. Senyawa aktif yang terdapat dalam berbagai simplisia dapat digolongkan ke dalam golongan minyak atsiri, alkohol, flavonoid dan lain-lain. Setelah diketahui senyawa aktif yang terkandung oleh simplisia, akan mempermudah pemilihan pelarut dan cara ekstraksi yang tepat. (Depkes RI., 2000).
2.3 Metode-Metode Ekstraksi
Ekstraksi dengan menggunakan pelarut terdiri dari 2 cara, yaitu: 1. Cara Dingin
Ekstraksi menggunakan pelarut dengan cara dingin terdiri dari:
i. Maserasi adalah proses penyarian simplisia dengan menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan.
2. Cara Panas
Ekstraksi dengan menggunakan pelarut dengan cara panas terdiri dari:
i. Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik.
ii. Sokletasi adalah ekstraksi menggunakan pelarut yang selalu baru yang umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik. iii. Digesti adalah proses penyarian dengan pengadukan kontinu pada
temperatur yang lebih tinggi dari temperatur ruangan, yaitu secara umum dilakukan pada temperatur 40-500C.
iv. Infundasi adalah proses penyarian dengan menggunakan pelarut air pada temperatur 900C selama 15 menit.
v. Dekoktasi adalah proses penyarian dengan menggunakan pelarut air pada temperatur 900C selama 30 menit.
2.4 Kromatografi
1. Fase gerak zat cair-fase diam padat: -Kromatografi lapis tipis
-Kromatografi penukar ion 2. Fase gerak gas-fase diam padat:
-Kromatografi gas padat
3. Fase gerak zat cair-fase diam zat cair: -Kromatografi cair kinerja tinggi 4. Fase gerak gas-fase diam zat cair:
-Kromatografi gas cair -Kromatografi kolom kapiler
Pemisahan dan pemurnian kandungan tumbuhan dilakukan dengan menggunakan salah satu atau gabungan dari beberapa teknik tersebut dan dapat digunakan pada skala mikro maupun makro (Harbone, 1987).
Kromatografi Lapis Tipis
Cara yang paling sederhana untuk mendeteksi bercak hasil pemisahan untuk senyawa yang tak berwarna dilakukan pengamatan dengan sinar ultraviolet. Beberapa senyawa organik bersinar atau berflourosensi jika disinari sinar ultarviolet gelombang pendek (254 nm) atau gelombang panjang (366 nm). Jika dengan cara itu senyawa tidak dapat dideteksi maka harus dicoba disemprot dengan pereaksi yang membuat bercak tersebut tampak yaitu pertama tanpa pemanasan kemudian bila perlu dengan pemanasan (Gritter, et al., 1991; Stahl, 1985; Gandjar dan Rohman, 2007).
a. Fase diam (lapisan penyerap)
Pada kromatografi lapis tipis, fase diam berupa lapisan tipis yang terdiri atas bahan padat yang dilapiskan pada permukaan penyangga datar yang biasanya terbuat dari kaca, dapat pula terbuat dari plat polimer atau logam. Lapisan melekat pada permukaan dengan bantuan bahan pengikat, biasanya kalsium sulfat atau amilum (pati). Penyerap yang umum dipakai untuk kromatografi lapis tipis adalah silika gel, alumina, kieselgur dan selulosa (Gritter, et al., 1991).
KLT dalam hal efisiensi dan resolusinya (Sastrohamidjojo, 1985; Gandjar dan Rohman 2007).
b. Fase Gerak (Pelarut Pengembang)
Fase gerak ialah medium angkut yang terdiri atas satu atau beberapa pelarut. Jika diperlukan sistem pelarut multi komponen, harus berupa suatu campuran sesederhana mungkin yang terdiri atas maksimum tiga komponen (Stahl, 1985). Sistem yang paling sederhana ialah campuran 2 pelarut organik karena daya elusi campuran kedua pelarut mudah diatur sedemikian rupa sehingga pemisahan dapat terjadi secara optimal (Gandjar dan Rohman, 2007).
Pemisahan senyawa organik selalu menggunakan pelarut campur. Tujuan menggunakan pelarut campur adalah untuk memperoleh pemisahan senyawa yang baik. Kombinasi pelarut adalah berdasarkan atas polaritas masing-masig pelarut, sehingga dengan demikian diperoleh pengembang yang cocok. Pelarut pengembang yang akan digunakan dalam kromatografi lapis tipis antara lain: n-heksana, karbontetraklorida, benzene, kloroform, eter, etilasetat, piridian, aseton, etanol, methanol dan air (Gritter, et al., 1991).
c. Harga Rf (Retordation Factor)
Mengidentifikasi noda-noda dalam kromatografi sangat lazim menggunakan harga Rf (Retordation Factor) yang didefinisikan sebagai:
Rf=
Jarak titik pusat bercak dari titik awaljarak garis depan pelarut dari titik awal
Harga Rf beragam mulai dari 0 sampai 1. Faktor-faktor yang mempengaruhi harga Rf (Sastrohamidjojo, 1985):
a. Struktur kimia dari senyawa yang sedang dipisahkan b. Sifat penjerap
d. Pelarut dan derajat kemurniannya
e. Derajat kejenuhan uap pengembang dalam bejana f. Teknik percobaan
g. Jumlah cuplikan yang digunakan h. Suhu
i. Kesetimbangan
2.5 Kromatografi Cair Vakum
Cara ini pertama kali dipublikasikan oleh Coll, dkk pada tahun 1977 dengan menggunakan corong Buchner kaca masir atau kolom pendek untuk mengisolasi diterpena sembrenoida dari terumbu karang Australia. Kolom kromatografi dikemas kering dalam keadaan vakum agar diperoleh kerapatan kemasan maksimum. Vakum dihentikan, pelarut yang kepolarannya rendah dituangkan ke permukaan penjerap lalu divakumkan lagi. Kolom dihisap sampai kering dan sekarang siap dipakai (Hostettmann, et al., 1995).
Sampel dilarutkan dalam pelarut yang cocok, dimasukkan langsung pada bagian atas kolom atau pada lapisan penjerap dan dihisap perlahan-lahan kedalam kemasan dengan menvakumkannya. Kolom dielusi dengan campuran pelarut yang cocok, mulai dari pelarut yang kepolarannya ditingkatkan perlahan-lahan, kolom dihisap sampai kering pada setiap pengumpulan fraksi. Oleh karena itu kromatografi cair vakum menggunakan tekanan rendah untuk meningkatkan laju aliran fase gerak (Hostettmann, et al., 1995).
2.6Spektrofotometri
(elektromagnetik) untuk mengukur konsentrasi analit yang tidak diketahui (Supratman, 2010).
Spektrofotometri Ultraviolet
Spektrum ultraviolet adalah suatu gambaran yang menyatakan hubungan antara panjang gelombang atau frekuensi serapan terhadap intensitas serapan (transmitasi atau adsorbansi) (Sastrohamidjojo, 1985). Apabila suatu molekul menyerap radiasi ultraviolet, di dalam molekul tersebut terjadi perpindahan tingkat energi elektron-elektron ikatan pada orbital molekul yang paling luar dari tingkat energi yang lebih rendah ke tingkat energi yang paling tinggi (Noerdin, 1985). Kenyataannya, spektrum UV-Vis yang merupakan korelasi antara absorbansi dan panjang gelombang bukan merupakan suatu pita spektrum. Terbentuknya pita spektrum tersebut disebabkan oleh terjadinya eksitasi elektronik lebih dari satu macam pada gugus molekul yang sangat kompleks (Gandjar dan Rohman, 2007).
2.7 Artemia salina Leach
2.7.1 Klasifikasi Artemia salina Leach
Menurut Arbiastutie dan Muflihati (2008) klasifikasi dari Artemia salina Leach adalah sebagai berikut:
Filum : Arthropoda Kelas : Crustacea Subkelas : Branchiopoda Ordo : Anostraca Famili : Artemidae Genus : Artemia
Spesies : Artemia salina Leach.
2.7.2 Siklus Pertumbuhan Artemia salina Leach
Gambar 2.1 Siklus Pertumbuhan Artemia salina Leach
biseksual terdiri atas jenis jantan dan betina yang melakukan perkawinan, yang kemudian menghasilkan embrio (Bachtiar, 2003).
Daur hidup artemia mengalami beberapa fase sebagai berikut:
- Fase kista (telur) adalah suatu kondisi istirahat pada hewan crustacea tingkat rendah seperti artemia. Ketika diredam ke dalam air laut, kista atau telur akan menyerap air (hidrasi). Akibatnya, di dalam kista terjadi proses metabolisme embrio yang aktif. Berselang 24-48 jam kemudian cangkang kista akan pecah dan muncul embrio yang masih terbungkus oleh selaput penetasan.
- Fase nauplius adalah larva stadium tingkat pertama dari artemia. Embrio yang masih terbungkus selaput penetasan akan berkembang menjadi organisme baru yang dapat berenang bebas di perairan. Fase ini diawali oleh pecahnya selaput penetasan yang masih membungkus embrio (nauplius). Larva ini berwarna jingga kecoklatan karena membawa kuning telur yang melekat pada tubuhnya. Panjang tubuh nauplius 0,4-0,7 mm dengan berat 15-20 µg.
- Fase dewasa adalah kondisi nauplius yang telah berkembang menjadi artemia dewasa. Ciri artemia dewasa adalah terdapat sepasang mata majemuk dan antena sensor pada kepala serta memiliki saluran pencernaan. Tubuh artemia dewasa dapat mencapai 1-2 cm dan beratnya sekitar 10 mg (Bachtiar, 2003).
2.8 Uji Sitotoksik
farmakologi sering menggunakan uji aktivitas dengan biaya yang mahal. Hambatan biaya ini mempengaruhi kegiatan farmakologis. Oleh karena itu dibutuhkan suatu uji aktivitas secara umum sederhana, mudah dan murah namun dapat dipercaya dan dapat mendeteksi adanya senyawa yang mempunyai aktivitas biologi secara luas yang terdapat pada ekstrak, fraksi dan isolat.
Mengetahui suatu senyawa memilik potensi sebagai senyawa bioaktif hasil dari uji hayati tersebut dihitung menggunakan LC50 (Lethal Concentration 50). LC50 adalah konsentrasi zat kimia yang terdapat di udara atau air yang dapat
membunuh 50% hewan/organisme uji dalam satuan ppm (part per million). Tujuan penggunaan LC50 adalah untuk mengetahui apakah kandungan kimia
tersebut dapat membahayakan manusia (Arbiastuti dan Muflihati, 2008).
Menurut Meyer, et al., (1982), jika ekstrak mempunyai nilai LC50< 1000
µg/mL maka ekstrak tersebut bersifat toksik pada Artemia salina Leach.
Menurut Anderson (1991) tingkat nilai toksisitas LC50 berdasarkan sifat
ketoksikannya adalah sebagai berikut:
a. Nilai LC50≤ 250 µg/mL bersifat sangat toksik.
b. Nilai LC50 250-500 µg/mL bersifat toksik.
c. Nilai LC50 500-750 µg/mL bersifat sedang.
d. Nilai LC50 750-1000 µg/mL bersifat tidak toksik.
Menurut Arbiastuti dan Muflihati (2008), menyatakan pembagian nilai LC50 untuk ekstrak dan senyawa murni yang berpotensi sebagai senyawa bioaktif
adalah sebagai berikut:
a. Nilai LC50 ≤ 30 µg/mL memiliki potensi aktivitas sebagai anti tumor atau
kanker yang bersifat sitotoksik.
c. Nilai LC50 antara 200-1000 µg/mL memiliki potensi sebagai pestisida.
Semakin kecil nilai LC50 yang dimiliki ekstrak tanaman maka akan semakin
berpotensi untuk memiliki aktivitas biologi atau efek farmakologi.
Toksisitas dibedakan menjadi toksisitas akut, kronik dan sub kronik (Runia, 2008; Fanani, 2009). Suatu senyawa kimia dikatakan bersifat “racun akut’’ jika dapat menimbulkan efek racun dalam jangka waktu singkat. Suatu senyawa kimia disebut bersifat “racun kronik” jika menimbulkan efek racun dalam jangka waktu panjang (kontak yang berulang-ulang dalam jumlah yang sedikit). Ada tiga cara utama bagi senyawa kimia untuk dapat memasuki tubuh, yaitu melalui paru-paru (pernafasan), mulut dan kulit. Melalui ketiga rute tersebut, senyawa yang bersifat racun dapat masuk ke aliran darah dan kemudian terbawa ke jaringan tubuh lainnya. Perhatian utama dalam toksisitas adalah kuantitas/ dosis senyawa tersebut. Sebagian besar senyawa yang berada dalam bentuk murninya memiliki sifat racun (toksik) (Hudgson, 2004; Tridiyani, 2011). Manfaat dari pengukuran toksisitas adalah dapat digunakan sebagai skrining ekstrak tumbuhan untuk kepentingan pengobatan, menilai potensi dan efek bahaya dari pestisida baru dan menilai toksisitas yang mungkin ditimbulkan oleh sumber polusi (Hendrawati, 2009).
Beberapa uji pendahuluan untuk pencarian obat kanker yang memenuhi syarat-syarat di atas antara lain: Brine Shrimp Lethality Test (BSLT), Metode Potato Disk, Uji terhadap Lemna minor L. dan Uji terhadap cell line (McLaughlin, 1998).
2.8.1 Metode Potato Disk (menghambat tumor crown gall)
Terdapat kesamaan antara mekanisme terjadinya tumor pada tumbuhan dan pada hewan, senyawa yang dapat menghambat pertumbuhan tumor pada tumbuhan juga dapat berfungsi sebagai antitumor pada hewan. Uji ini merupakan uji pendahuluan yang sederhana untuk menentukan senyawa antikanker dari bahan alami. Penghambatan pertumbuhan crown gall tumor pada potato disk oleh ekstrak bahan alami tersebut aktif (McLaughlin, 1998).
2.8.2 Brine Shrimp Lethality Test
Senyawa bioaktif hampir selalu toksik pada dosis tinggi. Oleh karena itu daya bunuh in vivo dari senyawa terhadap organisme hewan dapat digunakan untuk menapis ekstrak tumbuhan yang mempunyai bioaktivitas dan juga untuk memonitor fraksi bioaktif selama fraksinasi dan pemurniaan. Salah satu organisme yang sangat sesuai untuk hewan uji tersebut adalah udang laut. Brine shrimp lethality test atau yang dikenal dengan istilah BSLT sudah digunakan untuk berbagai sistem bioassay yaitu untuk menganalisa residu pestisida, mikotoksin, polutan pada air sungai, anastetik dan toksin dinoflagelata senyawa yang berupa morfin. Dalam fraksinasi yang diarahkan dengan bioassay, metode brine shrimp test telah digunakan untuk memonitor fraksi aktif mikotoksin dan antibiotik pada ekstrak jamur (Meyer, et al., 1982).
untuk mendeteksi senyawa-senyawa yang memiliki aktivitas biologi (McLaughlin, 1998).
2.8.3 Uji Terhadap Lemman minor L.
Lemman minor L. adalah tumbuhan monokotilyang hidup di daerah perairan. Pada kondisi normal, kondisi ini secara langsung menghasilkan anak daun. Jika ekstrak bahan alami dapat menghambat pertumbuhan dari anak daun tumbuhan Lemman minor L., maka ekstrak bahan alami tersebut dikatakan aktif (McLaughlin, 1998).
2.8.4 Uji Terhadap Cell line
BAB I
PENDAHULUAN
1.1 Latar Belakang
Kanker merupakan pertumbuhan dan perkembangan sel yang tidak terkontrol yang terjadi di dalam tubuh. Usaha terapi kanker hingga saat ini belum mencapai hasil yang memuaskan. Pengobatan kanker dapat dilakukan dengan pembedahan, kemoterapi maupun dengan radiasi. Pengobatan dengan kemoterapi dan radiasi seringkali kurang selektif dan tidak dapat menghilangkan kanker tersebut sedangkan pembedahan tidak efektif untuk kanker yang telah metastatis. Usaha yang dapat ditempuh untuk menemukan obat kanker adalah dengan menggali sumber obat nabati. Banyak penelitian yang dilakukan untuk mencari senyawa antikaker baru dengan harapan sifat yang lebih baik (Matt, 1999).
biologik, misalnya obat malaria, obat cacing, hepatoprotektif, bronkhitis, asma, diare, epilepsi, demam, batuk, sakit kepala, gangguan pencernaan, antioksidan, antitumor, antimikroba (Kaliappan, et al., 2008; Rout, et al., 2010); sakit gigi, (Chandrappan, et al., 2010); obat luka, sariawan (Depkes RI., 1989).
Penelitian yang telah dilakukan Cristine dan Siti (2004) tentang efek ekstrak air daun bangun-bangun pada aktivitas limfosit tikus putih, menunjukkan bahwa ekstrak air daun bangun-bangun mampu meningkatkan sitotoksitas limfosit, yang bermanfaat untuk perlawanan tubuh terhadap agen penyakit yang datang. Hasibuan (2012) menunjukkan bahwa daun bangun-bangun bersifat sangat toksik terhadap kanker payudara secara in vitro dan in vivo . Kemala (2012) juga melaporkan bahwa fraksi etilasetat dari crude ekstrak etanol daun bangun-bangun memiliki aktivitas toksik (nilai LC50 145,114 µg/mL) disebabkan
oleh adanya senyawa flavonoid. Flavonoid merupakan senyawa yang banyak terkandung di dalam daun bangun-bangun yang dipercaya berfungsi sebagai antioksidan. Mengkonsumsi sayuran yang mengandung antioksidan tinggi dapat mengurangi risiko terkena kanker (Lenny, 2006).
Uji pendahuluan toksisitas digunakan untuk skrining awal senyawa sitotoksik (antikanker). Prinsip suatu tanaman dapat digunakan sebagai antikanker yaitu bila tanaman tersebut mengandung senyawa sitotoksik. Brine Shrimp Test
tahun dalam studi toksikologi (Meyer, et al., 1982). Parameter yang diamati pada metode ini adalah nilai LC50, semakin kecil nilai LC50 yang dimiliki ekstrak maka
akan semakin toksik (Inayah, dkk., 2012). Penelitian ini merupakan penelitian pendahuluan dalam rangka menemukan senyawa sitotoksik dan diharapkan dalam pengembangan selanjutnya dapat digunakan sebagai obat antikanker.
Berdasarkan uraian di atas, maka peneliti melakukan uji sitotoksik fraksi etilasetat daun bangun-bangun terhadap Artemia salina Leach dengan metode
Brine Shrimp Lethality Test (BSLT).
1.2 Perumusan Masalah
Berdasarkan uraian latar belakang di atas, dapat dirumuskan permasalahan
dalam penelitian adalah:
a. apakah fraksi etilasetat daun bangun-bangun memiliki efek sitotoksik terhadap
larva Artemia salina Leach?
b. fraksi etilasetat manakah dari daun bangun-bangun yang paling sitotoksik
terhadap larva Artemia salina Leach?
1.3 Hipotesis
Berdasarkan rumusan masalah di atas, maka hipotesis dari penelitian ini sebagai berikut:
a. fraksi daun bangun-bangun memiliki efek sitotoksik terhadap larva Artemia salina Leach.
1.4 Tujuan Penelitian
Adapun tujuan penelitian ini adalah untuk mengetahui:
a. efek sitotoksik fraksi daun bangun-bangun terhadap larva Artemia salina Leach b. fraksi etilasetat mana yang paling sitotoksik terhadap larva Artemia salina
Leach.
1.5 Manfaat Penelitian
Adapun manfaat dalam penelitian ini adalah:
a. memberikan informasi tentang efek sitotoksik fraksi etilasetat daun bangun-bangun.
b. memberikan informasi awal tentang daun bangun-bangun (Plectranthus amboinicus (Lour.) Spreng) sebagai kemopreventif.
1.6 Kerangka Pikir Penelitian
Adapun kerangka pikir penelitian dapat dilihat pada Gambar 1.1:
Variabel Bebas Variabel Terikat Parameter
UJI SITOTOKSIK FRAKSI ETILASETAT
DAUN BANGUN-BANGUN (Plectranthus amboinicus (Lour.) Spreng TERHADAP LARVA Artemiasalina Leach DENGAN METODE
Brine Shrimp Lethality Test
ABSTRAK
Latar Belakang: Daun bangun-bangun (Plectranthus amboinicus (Lour.)
Spreng) merupakan salah satu tanaman yang berpotensi untuk dikembangkan sebagai agen kemopreventif kanker.
Tujuan: Penelitian ini bertujuan untuk mengetahui efek sitotoksik fraksi
etilasetat daun bangun-bangun (FEDBB) terhadap larva Artemia salina Leach.
Metode: Penelitian eksperimentalini menggunakan 800 ekor larva udang
(Artemia salina Leach) yang dibagi menjadi 1 kelompok kontrol negatif dan 5 kelompok kontrol positif konsentrasi 10 µg/mL; 100 µg/mL dan 1000 µg/mL fraksi etilasetat masing-masing terdiri dari 10 ekor larva dengan replikasi 5 kali. Data hasil penelitian dianalisis secara ANAVA (analisis variansi) menggunakan program SPSS (Statistical Product and Service Solution) versi 17.
Hasil:Hasil pengujian efek sitotoksik fraksi etilasetat secara berturut-turut adalah fraksi etilasetat I nilai LC50 49,431 µg/mL, fraksi etilasetat II nilai LC50
42,955 µg/mL, fraksi etilasetat III nilai LC50 51,050 µg/mL, fraksi etilasetat IV
nilai LC50 72,945 µg/mL, fraksi etilasetat V nilai LC50 130,617 µg/mL.
Kesimpulan: Fraksi etilasetat II merupakan fraksi yang paling toksik terhadap larva Artemia salina Leach karena mempunyai nilai LC50 yang paling rendah
diantara fraksi yang lain yaitu 42,955 µg/mL.
CYTOTOXIC EFFECT OF ETHYLACETATE FRACTION OF BANGUN-BANGUN (Plectranthus amboinicus (Lour.) Spreng) LEAVES
ON Atremia salina Leach LARVA BY USING BRINE SHRIMP
LETHALITY METHOD
ABSTRACT
Background: Bangun-Bangun leaves (Plectranthus amboinicus (Lour.) Spreng is one of the plants that have the potential to be developed as a cancer chemopreventive agent.
The Purpose: The aim of the study were to find out the cytotoxic effect of ethylacetate fraction bangun-bangun leaves (FEDBB) on Artemia salina Leach larvae.
Methods: This experimental study using 800 Artemia salina Leach larvae were divided into one control group negative 1 and 5 positive control group concentration10 µg/mL; 100 µg/mL dan 1000 µg/mL of ethylacetate fraction each consisting of 10 larvae with replication 5.The study cytotoxic effects of ethylacetate fraction of bangun-bangun leaves were done on Artemia salina Leach larvae using Brine Shrimp Lethality Test (BSLT) method. Data was analyzed by ANOVA SPSS versi 17 analysis.
Result: Results of testing the cytotoxic effects of ethylacetate fraction in a row ethylacetate fraction I LC50 49.431 µg/mL, ethylacetate fraction II LC50 42.955
µg/mL, ethylacetate fraction III LC50 51.050 µg/mL, ethylacetate fraction IV LC50
72.945 µg/mL, ethylacetate fraction V LC50 130.617 µg/mL.
Conclusion: The ethylacetate fraction II had the most toxic on Artemia salina
Leach larvae because of the lowest LC50 42.955 µg/mL.
UJI SITOTOKSIK FRAKSI ETILASETAT
DAUN BANGUN-BANGUN (Plectranthus amboinicus (Lour.)
TERHADAP LARVA Artemia salina Leach DENGAN METODE
BRINE SHRIMP LETHALITY TEST
SKRIPSI
OLEH:
E. ROSLINA PARDEDE
NIM 121524009
PROGRAM STUDI EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
UJI SITOTOKSIK FRAKSI ETILASETAT
DAUN BANGUN-BANGUN (Plectranthus amboinicus (Lour.)
TERHADAP LARVA Artemia salina Leach DENGAN METODE
BRINE SHRIMP LETHALITY TEST
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Faramsi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
E. ROSLINA PARDEDE
NIM 121524009
PROGRAM STUDI EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
UJI SITOTOKSIK FRAKSI ETILASETAT
DAUN BANGUN-BANGUN (Plectranthus amboinicus (Lour.)
TERHADAP LARVA Artemia salina Leach DENGAN METODE
BRINE SHRIMP LETHALITY TEST (BSLT)
OLEH :
E. ROSLINA PARDEDE NIM 121524009
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada tanggal: 23 Maret 2016
Medan, April 2016 Fakultas Farmasi
Universitas Sumatera Utara Pejabat Dekan,
Dr. Masfria, M.S., Apt. NIP 195707231986012001 Disetujui Oleh:
Pembimbing I, Panitia Penguji,
Dr. Poppy A. Z. Hsb., S.Si., M. Si., Apt. Dr. Masfria, M.S., Apt. NIP 197506102005012003 NIP 195707231986012001
Pembimbing II, Dr. Poppy A. Z. Hsb., S.Si., M. Si., Apt NIP 195707321986012001
Dr. Panal Sitorus, M. Si., Apt Popi Patilaya, S. Si., M.Sc., Apt NIP 195310301980031002 NIP 197812052010121004
KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Esa yang telah memberikan karunia yang berlimpah sehingga penulis dapat menyelesaikan penyusunan skripsi yang berjudul ’’Uji Sitotoksik Fraksi Etilasetat Daun Bangun-Bangun (Plectranthus amboinicus (Lour.) terhadap Larva Artemia salina Leach dengan Metode Brine Shrimp Lethality Test (BSLT)”.Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera Utara.
Penulis juga mempersembahkan rasa terima kasih yang tak terhingga kepada keluarga tercinta, Ayahanda M. Pardede (alm) dan Ibunda E. Sirait, kepada abang Andi Sinaga atas limpahan kasih sayang, semangat dan doa yang tak ternilai dengan apa pun. Penulis juga mengucapkan terima kasih kepada sahabat-sahabat terdekat terutama Siti, Falah, Melva, bang Deni, yang telah banyak membantu serta teman-teman mahasiswa/i Ekstensi Farmasi Stambuk 2012 yang selalu mendoakan dan memberi semangat yang tiada henti.
Penulis menyadari sepenuhnya bahwa penulisan skripsi ini masih belum sempurna, oleh karena itu penulis mengharapkan saran dan kritik yang membangun demi kesempurnaan skripsi ini. Akhir kata penulis berharap semoga skripsi ini bermanfaat bagi ilmu pengetahuan khususnya di bidang farmasi.
Medan,Maret2016 Penulis,
E. Roslina Pardede
SURAT PERNYATAAN TIDAK PLAGIAT
Saya yang bertandatangan dibawah ini:
Nama : E. Roslina Pardede
Nomor Induk Mahasiswa : 121524009
Program Studi : Ekstensi Sarjana Farmasi
Judul Skripsi : Uji Sitotoksik Fraksi Etilasetat Daun Bangun-Bangun (Plectranthus amboinicus (Lour.) Terhadap Larva Artemia salina Leach Dengan Metode Brine Shrimp Lethality Test (BSLT) Dengan ini menyatakan bahwa skripsi ini ditulis berdasarkan data dari hasil pekerjaan yang saya lakukan sendiri, dan belum pernah di ajukan oleh orang lain untuk memperoleh gelar kesarjanaan di perguruan tinggi lain, dan bukan plagiat karena kutipan yang ditulis telah disebutkan sumbernya di dalam daftar pustaka. Apabila dikemudian hari ada pengaduan dari pihak lain karena di dalam skripsi ini ditemukan plagiat karena kesalahan saya sendiri, maka saya bersedia menerima sanksi apapun oleh Program Studi Farmasi Fakultas Universitas Sumatera Utara, dan bukan menjadi tanggungjawab pembimbing.
Demikian surat pernyataan ini saya perbuat dengan sebenarnya untuk dapat digunakan jika diperlukan sebagaimana mestinya.
Medan, 23 Maret 2016 Yang membuat pernyataan,
UJI SITOTOKSIK FRAKSI ETILASETAT
DAUN BANGUN-BANGUN (Plectranthus amboinicus (Lour.) Spreng TERHADAP LARVA Artemiasalina Leach DENGAN METODE
Brine Shrimp Lethality Test
ABSTRAK
Latar Belakang: Daun bangun-bangun (Plectranthus amboinicus (Lour.)
Spreng) merupakan salah satu tanaman yang berpotensi untuk dikembangkan sebagai agen kemopreventif kanker.
Tujuan: Penelitian ini bertujuan untuk mengetahui efek sitotoksik fraksi
etilasetat daun bangun-bangun (FEDBB) terhadap larva Artemia salina Leach.
Metode: Penelitian eksperimentalini menggunakan 800 ekor larva udang
(Artemia salina Leach) yang dibagi menjadi 1 kelompok kontrol negatif dan 5 kelompok kontrol positif konsentrasi 10 µg/mL; 100 µg/mL dan 1000 µg/mL fraksi etilasetat masing-masing terdiri dari 10 ekor larva dengan replikasi 5 kali. Data hasil penelitian dianalisis secara ANAVA (analisis variansi) menggunakan program SPSS (Statistical Product and Service Solution) versi 17.
Hasil:Hasil pengujian efek sitotoksik fraksi etilasetat secara berturut-turut adalah fraksi etilasetat I nilai LC50 49,431 µg/mL, fraksi etilasetat II nilai LC50
42,955 µg/mL, fraksi etilasetat III nilai LC50 51,050 µg/mL, fraksi etilasetat IV
nilai LC50 72,945 µg/mL, fraksi etilasetat V nilai LC50 130,617 µg/mL.
Kesimpulan: Fraksi etilasetat II merupakan fraksi yang paling toksik terhadap larva Artemia salina Leach karena mempunyai nilai LC50 yang paling rendah
diantara fraksi yang lain yaitu 42,955 µg/mL.
CYTOTOXIC EFFECT OF ETHYLACETATE FRACTION OF BANGUN-BANGUN (Plectranthus amboinicus (Lour.) Spreng) LEAVES
ON Atremia salina Leach LARVA BY USING BRINE SHRIMP
LETHALITY METHOD
ABSTRACT
Background: Bangun-Bangun leaves (Plectranthus amboinicus (Lour.) Spreng is one of the plants that have the potential to be developed as a cancer chemopreventive agent.
The Purpose: The aim of the study were to find out the cytotoxic effect of ethylacetate fraction bangun-bangun leaves (FEDBB) on Artemia salina Leach larvae.
Methods: This experimental study using 800 Artemia salina Leach larvae were divided into one control group negative 1 and 5 positive control group concentration10 µg/mL; 100 µg/mL dan 1000 µg/mL of ethylacetate fraction each consisting of 10 larvae with replication 5.The study cytotoxic effects of ethylacetate fraction of bangun-bangun leaves were done on Artemia salina Leach larvae using Brine Shrimp Lethality Test (BSLT) method. Data was analyzed by ANOVA SPSS versi 17 analysis.
Result: Results of testing the cytotoxic effects of ethylacetate fraction in a row ethylacetate fraction I LC50 49.431 µg/mL, ethylacetate fraction II LC50 42.955
µg/mL, ethylacetate fraction III LC50 51.050 µg/mL, ethylacetate fraction IV LC50
72.945 µg/mL, ethylacetate fraction V LC50 130.617 µg/mL.
Conclusion: The ethylacetate fraction II had the most toxic on Artemia salina
Leach larvae because of the lowest LC50 42.955 µg/mL.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN PENGESAHAN ... ii
KATA PENGANTAR ... iv
SURAT PERNYATAAN TIDAK PLAGIAT ... vi
ABSTRAK ... vii
ABSTRACT ... viii
DAFTAR ISI ... ix
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 4
1.6 Kerangka Pikir Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Uraian Tumbuhan ... 5
2.1.1 Sistematika Tumbuhan... 5
2.1.2 Nama Lokal ... 5
2.1.3 Nama Asing ... 6