PREPARASI DAN KARAKTERISASI NANOKATALIS S/TiO2 SERTA UJI AKTIVITASNYA UNTUK FOTODEGRADASI METANIL YELLOW
(Skripsi)
Oleh
DANI AGUS SETIAWAN
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
ABSTRACT
PREPARATION AND CHARACTERISATION OF S/TiO2 NANOCATALYST AND ITS ACTIVITY TEST FOR METHANYL
YELLOW PHOTODEGRADATION
by
Dani Agus Setiawan
This study was carrried out to investigate the application of simultaneous sol-gel and sonication for preparation of S/TiO2 nanocatalysts and application of
the catalysts for photodegradation of methanyl yellow in water. The catalyst was characterized using XRD, SEM, and TEM techniques, revealing the existense of anatase phase. The surface of the sample is characterized by the presence of particle in the form of rectangular and bar of diffrent sizes, with the particle size in the range of 6-8 nm. Degradation test demonstrated the degradation of methanyl yellow up to 77,5% using UV irradiation and 86% using sunlight were achieved.
ABSTRAK
PREPARASI DAN KARAKTERISASI NANOKATALIS S/TiO2 SERTA UJI AKTIVITASNYA UNTUK FOTODEGRADASI METANIL YELLOW
Oleh
Dani Agus Setiawan
Penelitian ini dilakukan untuk mengetahui aplikasi dari sol-gel dan sonofikasi secara simultan untuk preparasi dari nanokatalis S/TiO2 dan aplikasinya untuk
fotodegradasi zat warna metanil kuning dalam air. Nanokatalis S/TiO2
dikarakterisasi menggunakan XRD, SEM, dan TEM menunjukkan fasa kristalin anatase. Permukaan sampel dikarakterisasi dengan kehadiran partikel seperti batang-batang berbentuk persegi panjang dengan ukuran yang
berbeda, dengan ukuran partikel antara 6-8 nm. Uji degradasi menunjukkan degradasi dari metanil kuning hingga 77,5% menggunakan sinar UV dan 86% menggunakan sinar matahari.
PREPARASI DAN KARAKTERISASI NANOKATALIS S/TiO
2SERTA UJI AKTIVITASNYA UNTUK FOTODEGRADASI METANIL
YELLOW
Oleh
Dani Agus Setiawan
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA SAINS
Pada Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
RIWAYAT HIDUP
Penulis dilahirkan di Bandar Lampung pada tanggal 14 Agustus
1991, anak ke tiga dari tiga bersaudara, yang merupakan buah
kasih dari pasangan Ayahanda Faisal S.T dan Ibunda Entin
Supartini.
Penulis menyelesaikan pendidikan Sekolah Dasar di SD Negeri 1 Pasir Gintung
2003, Sekolah Menengah Pertama (SMP) Negeri 10 Bandar Lampung pada tahun
2006, dan Sekolah Menengah Teknologi Industri (SMTI) Bandar Lampung pada
tahun 2009. Penulis diterima sebagai mahasiswa Jurusan Kimia Fakultas
Matematika dan Ilmu Pengetahuan Alam Universitas Lampung pada tahun 2009
melalui jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN).
Selama menjadi mahasiswa, penulis pernah aktif dalam organisasi kemahasiswaan
Rohani Islam (ROIS) FMIPA periode 2009-2010, organisasi Himpunan
Mahasiswa Kimia (HIMAKI) periode 2009-2010 sebagai anggota Kader Muda
HIMAKI (KAMI), periode 2010-2011 sebagai anggota Bidang Sosial Masyarakat
HIMAKI, periode 2011-2012 sebagai Ketua Bidang Kaderisasi dan
praktikum Kimia Dasar periode 2011 – 2012 , 2012-2013, 2013-2014 untuk
mahasiswa Jurusan Agro Eko Teknologi (AET) FP dan asisten Kimia Fisika
periode 2013 – 2014 untuk Jurusan Kimia FMIPA dan periode 2014 – 2015 untuk
Jurusan Kimia FMIPA.
Pada bulan Januari 2014 penulis menyelesaikan Praktik Kerja Lapangan di
Laboratorium Biomassa dengan judul ‘’ Metode Frezee Drying Untuk
Seseorang yang optimis akan melihat adanya
kesempatan dalam setiap malapetaka, sedangkan orang
pesimis melihat malapetaka dalam setiap kesempatan
(Muhammad SAW).
Perjuangan seseorang dimulai dari niat, tekad, dan
nekad.
Berhentilah mengkhawatirkan masa depan, syukurilah
hari ini, dan hiduplah dengan sebaik baiknya.
Jangan menutup mata kita, walaupun hanya dengan
daun yang kecil. Jangan menutupi hati kita dengan
sebuah pikiran buruk, walau hanya seujung kuku
(Ustadz Musyaffa Ad Dariny).
“Ilmu tidak akan mungkin didapatkan kecuali dengan
kita meluangkan waktu “ (Imam Al
-Baihaqi).
“
Try to become not a man of success, but try rather to
become a man of value”
(Albert Einstein).
“Do just once what people say you can’t do, and you’ll never
pay attention to their limitation again” (Muhammad
Yusry Ahmadhani).
Dengan menyebut nama Allah yang maha pengasih lagi maha penyayang dan
dengan segala rasa syukur kepada Allah SWT, aku persembahkan karya ku ini
untuk :
Papah dan Mamah tersayang, yang senantiasa mendo’akan, mendukung,
memberi semangat, dan kegigihan serta perjuangan dan pengorbanan Mamah
dan Papah untuk ku sampai bisa seperti ini semoga kasih sayang dan
lindungan Allah SWT tak lepas dari kalian.
Abang dan Mbak ku tersayang Suhendra dan Rita Suzanna, keponakanku
tersayang Aqila dan Qei, serta seluruh keluarga besar ku yang tidak dapat
ku sebutkan satu persatu yang senantiasa mendoa’kan, mendukung dan
memberi semangat, tanpa kalian aku tak akan pernah meraih semua ini.
Almamater tercinta Universitas Lampung.
Guru-guru yang telah menjadi pembangkit semangatku.
SANWACANA
Alhamdulillahi robbil’alamin. Segala puji dan syukur hanya milik Allah SWT,
Dzat yang senantiasa menganugerahkan ilmu pengetahuan kepada manusia
dengan perantara kalam, sehingga atas kehendak dan izin-Nya penulis dapat
menyelesaikan skripsi dengan judul ʻ ʻ Preparasi dan Karakterisasi
Nanokatalis S/TiO2 Serta Uji Aktivitasnya Untuk Fotodegradasi Metanil Yellow
’’ dengan baik. Shalawat serta salam semoga selalu tercurah kepada Nabi
Muhammad SAW beserta keluarga, sahabat serta pengikutnya yang setia hingga
Yaumil Akhir. Amin.
Skripsi ini disusun sebagai salah satu syarat untuk mendapatkan gelar Sarjana
Sains pada Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam,
Universitas Lampung. Tidak sedikit kendala yang dihadapi penulis dalam
pelaksanaan serta dalam penulisan skripsi ini, tapi Alhamdulillah, Allah
menunjukkan kemurahan-Nya melalui orang-orang yang dipercaya untuk
membantu penulis, sehingga kendala tersebut dapat ditaklukkan. Dalam
1. Papah dan Mamah, yang memberikan pendidikan pertama di dunia ini, motivasi, pengorbanan, serta do’a yang tiada henti-hentinya demi kelancaran
penulis dalam menuntut ilmu.
2. Bapak Dr. Rudy TM Situmeang, M.Sc., selaku pembimbing utama, guru,
rekan, sekaligus ayah bagi penulis yang dengan sabar memberikan bimbingan
dan dukungan kepada penulis.
3. Bapak Posman Manurung, Ph.D., selaku pembimbing II penulis, atas saran,
motivasi, masukan dan diskusi-diskusinya hingga selesainya skripsi ini.
4. Bapak Prof. Wasinton Simanjuntak, Ph.D., selaku pembahas, atas semua
kritik, saran dan masukan kepada penulis dalam menyelesaikan skripsi ini.
5. Bapak Dr. Suripto Dwi Yuwono, M.T., selaku Ketua Jurusan Kimia Fakultas
Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
6. Bapak Prof. Suharso, Ph.D., selaku Dekan Fakultas Matematika dan Ilmu
Pengetahua Alam Universitas Lampung.
7. Bapak Diky Hidayat, M.Si., selaku pembimbing Akademik yang telah
memberikan motivasi dan arahan selama masa kuliah.
8. Segenap staf pengajar dan karyawan Jurusan Kimia Fakultas Matematika dan
Ilmu Pengetahuan Alam Universitas Lampung.
9. Keluarga besar penulis yang selalu memberikan saran, motivasi, dukungan,
keceriaan dan canda tawa yang tercipta selama ini.
10. Sahabat-sahabat terbaik ku, Rian Alfian S.T., Rian Hidayat Amd (jablay),
Dedi Susanto (Datuk maringgi), Ahmad Zubaidi (beben), Yahya Ariyanta
S.Si, (kiyai gading), M.Mustaqim (P.K), M.Yusry Ahmadhani (Omes), Rio
11. Teman-teman Chemistry_09 (Chemilan) : Kimia Fisik : Nurjannah, S.Si.,
Luh Gede Rai Putri, S.Si., Juwita, S.Si., Ruth Meta Megawati, S.Si., Indah
R.N, S.Si., Delphiana Sidabalok, S.Si., Organik : Resca Ridhatama, S.Si.,
Neneg Suryani, S.Si., Teta Paresta, S.Si., Mardiah, S.Si., Aribowo, Lia
Apriani. Anorganik : Khoirul Umam, S.Si., Dwi yanto, S.Si., M.Fadly, S.Si.,
Sherly Nurimani, S.Si., Siska Dwi Ariyani, S.Si., Rina,S.Si., Mersi, S.Si.
Analitik : Ignatius Sandy Elen, S.Si., Delviana, S.Si., Purna Firdaus, S.Si.,
Suparno, Stefhani Oktaviani, S.Si., Tiurma nainggolan, S.Si. Biokimia :
Yahya Ariyanta, S.Si., Riski Yuliandri, S.Si., Tyas Rosawinda, S.Si., Fatma
Timur, S.Si., Miftahul jannah, S.Si., Fitri yanti, S.Si.
12. Catalyst Crew : Kak Sephtian Tyo, S.Si., yang telah banyak memberi
masukan, saran, semangat, motivasi dan diskusi-diskusinya kepada penulis,
Kak Sobari, S.Si., yang belum sempat membantu kerja dalam penelitian
penulis, Lolita jangan menyerah pada penelitian kamu, terus semangat dan
rajin diskusi di lab ajak adik-adiknya, lanjutkan perjuangan. Yuda, Fatma,
Eva, jangan malas ke lab untuk diskusi tentang riset. Febi dan Ana harus
banyak belajar sama kakak-kakanya jangan malu bertanya.
13. Teman-teman Kimia angkatan 2010, 2011, 2012, 2013, dan 2014.
14. Teman-teman lab Biomassa dan lab Anorganik-Fisik Universitas Lampung.
15. Teman-teman Kontrakan Meong Gedee.
16. Semua pihak yang telah membantu dan mendukung penulis dalam
penyusunan skripsi ini.
Penulis berharap semoga Allah SWT mencatat dan membalas semua kebaikan
skripsi ini masih sangat jauh dari kesempurnaan, namun demikian penulis
berharap semoga skripsi yang sangat sederhana ini dapat bermanfaat dan memiliki
nilai guna khususnya bagi rekan-rekan mahasiswa dan pembaca pada umumnya.
Amin.
Bandar Lampung, Juni 2015
DAFTAR ISI
2. Analisis Morfologi Permukaan Katalis ... 19
3. Transmission Electron Microscopy (TEM) ... 21
4. Spektrofotometri UV-Vis ... 24
III.METODELOGI PENELITIAN ... 27
A. Tempat dan Waktu Penelitian ... 27
b. Analisis Morfologi Permukaan Katalis ... 29
3. Uji Aktivitas Fotokatalitik ... 30
a. Preparasi Sampel ... 30
ii
4. Analisis Spektrofotometri UV-Vis ... 31
a. Kalibrasi Alat Spektrofotometer UV-Vis ... 31
b. Pembuatan Larutan Standar ... 31
c. Menentukan Panjang Gelombang Maksimum (λmaks) serta Konsentrasi Metanil Yellow Terdegradasi ... 31
IV.HASIL DAN PEMBAHASAN ... 33
A. Preparasi Nanokatalis S/TiO2 ... 33
B. Karakterisasi Nanokatalis ... 35
1. Analisis Morfologi Permukaan ... 35
a. Analisis Scaning Electron Microscopy (SEM) ... 35
b. Analisis Transmission Electron Microscopy (TEM) ... 36
2. Analisis Struktur Kristal ... 37
C. Uji Aktivitas Fotokatalitik ... 42
V. SIMPULAN DAN SARAN ... 51
A. Simpulan ... 51
B. Saran ... 52
DAFTAR PUSTAKA ... 53
DAFTAR TABEL
Tabel Halaman
1. Data metanil yellow ... 5
2. Sifat fisika TiO2 ... 8
3. Ukuran rata-rata partikel S/TiO2 dengan variasi konsentrasi dopan S ... 37
4. Puncak-puncak representatif masing-masing difraktogram acuan untuk
senyawa TiO2 ... 38
5. Puncak-puncak representatif nanokatalis S/TiO2 ... 39
6. Pencocokan puncak-puncak presentatif nanokatalis S/TiO2 ... 39
7. Penurunan nilai absorbansi metanil yellow oleh katalis S/TiO2 dengan sinar
lampu UV ... 44
8. Penurunan nilai absorbansi metanil yellow oleh katalis S/TiO2 dengan sinar
matahari ... 44
DAFTAR GAMBAR
Gambar Halaman
1. Struktur kimia metanil yellow ... 6
2. Struktur anatase TiO2 ... 10
3. Struktur rutil TiO2 ... 10
4. Mekanisme fotokatalis TiO2 ... 13
5. Mekanisme difraksi pada suatu bidang kristal ... 17
6. Difraktogram nanokristal TiO2 ... 18
7. Difraktogram standar TiO2 PDF 21-1272 ... 19
8. Skema kerja SEM ... 20
9. Mikrograf SEM TiO2 ... 21
10. Skema kerja TEM ... 22
11. Hasil TEM TiO2 ... 23
12. Skema kerja spektrofotometer UV-Vis ... 26
13. Gel katalis S/TiO2 ... 34
14. Padatan S/TiO2 setelah proses kalsinasi ... 34
15. Mikrograf SEM katalis S/TiO2 ... 35
v
17. Difraktogram nanokatalis S/TiO2 ... 38
18. Hasil penghalusan katalis S/TiO2 dengan H2SO4 1M ... 41
19. Hubungan absorbansi terhadap waktu (menit) untuk sinar lampu UV
selama 50 menit ... 43
20. Hubungan absorbansi terhadap waktu (menit) untuk sinar matahari
selama 50 menit ... 43
21. Warna sampel hasil fotodegradasi 0-50 menit (a) untuk sinar lampu UV,
(b) untuk sinar matahari ... 45
22. Kurva standar larutan metanil yellow ... 46
23. Hubungan antara waktu (menit) terhadap persentase degradasi (%) metanil
yellow untuk sinar lampu UV... 47 24. Hubungan antara waktu (menit) terhadap penurunan konsentrasi (ppm)
metanil yellow untuk sinar lampu UV... 47
25. Hubungan antara waktu (menit) terhadap persentase degradasi (%) metanil
yellow untuk sinar matahari ... 48 26. Hubungan antara waktu (menit) terhadap penurunan konsentrasi (ppm)
I. PENDAHULUAN
A.Latar Belakang
Industrialisasi yang berkembang cepat tentunya mendorong peningkatan
perekonomian masyarakat, namun juga berdampak pada peningkatan jumlah
limbah industri yang menjadi salah satu permasalahan utama bagi lingkungan.
Salah satu contoh senyawa yang berbahaya bagi lingkungan adalah metanil
yellow. Metanil yellow adalah zat warna yang merupakan senyawa kimia golongan azo aromatik, berbentuk serbuk, berwarna kuning kecokelatan yang
bersifat karsinogenik yang digunakan dalam industri tekstil (Sleiman dkk., 2007).
Metanil yellow juga merupakan pewarna sintetik yang sering digunakan pada
jajanan pasar dan makanan ringan. Metanil yellow digunakan pada proses
pencelupan pada industri tekstil dan limbahnya langsung dibuang ke selokan atau
sungai dengan jumlah sekitar 60 - 70% tanpa diolah terlebih dahulu. Air selokan
menjadi berwarna dan merubah kualitas air selokan atau air sungai sehingga tidak
sesuai peruntukannya.
Berbagai penanganan limbah telah banyak dilakukan, teknologi pengolahan
limbah cair berwarna yang digunakan di industri pada umumnya, lebih banyak
2
filtrasi membran, destruksi secara elektrokimia, iradiasi, penukar ion, ozonasi, dan
adsorpsi (Banat et al., 1996). Metode tersebut memang efektif menghilangkan
warna, namun terdapat pula beberapa kelemahan, diantaranya adalah penggunaan
bahan kimia yang terlalu banyak dan terbentuknya sludge yang dapat menjadi
limbah B3 (bahan berbahaya dan beracun). Oleh karena itu, diperlukan alternatif
baru untuk mengolah limbah cair indutri berwarna yang lebih efektif dalam
mendegradasi polutan organik dan zat warna (Renita et al., 2004).
Menyikapi hal tersebut, degradasi polutan organik dan zat warna terus
dikembangkan, salah satunya dengan reaksi fotokatalis. Fotokatalis pada
permukaan TiO2 merupakan salah satu metode alternatif untuk proses
fotodegradasi. Karena sifatnya yang memiliki tingkat kestabilan dan kereaktifan
yang tinggi bila terkena cahaya, maka TiO2 menjadi salah satu fotokatalis yang
banyak digunakan hingga dikenal sebagai fotokatalis yang ramah lingkungan
(Arif et al; Fatimah, 2005; Rong et al., 2006).
Fotokatalis oleh semikonduktor TiO2 sangat menjanjikan untuk pengurangan
bahaya polutan lingkungan, terutama untuk degradasi bahan organik. Namun,
fotokatalis TiO2 belum diaplikasikan secara luas di bidang pengendalian
pencemaran lingkungan, karena energi band-gap masih relatif besar (3,2 eV)
(Hoffmann et al., 1995). Banyak peneliti telah melakukan usaha modifikasi
matriks fotokatalis TiO2, di antara usaha yang dilakukan adalah dengan
menambahkan logam seperti (Cu, Co, Ni, Cr, Mn, Mo, Nb, Fe, Ru, Au, Ag, Pt),
3
modifikasi yang telah dilakukan, banyak didapatkan hasil yang positif yaitu
band-gap M-TiO2 menyempit atau mengecil (Asashi et al., 2001) . Dengan demikian
penyerapan cahaya dapat meluas ke spektrum cahaya tampak.
Menurut Justicia (2002), modifikasi fotokatalis secara umum, menunjukkan
bahwa penyerapan lemah di daerah cahaya tampak dan tidak bekerja secara
efektif. Namun, penyempitan Band-gap oleh doping nonlogam (N, C, S dan F)
pada TiO2 ternyata menghasilkan katalis dengan aktivitas katalitik yang tinggi di
bawah sinar cahaya tampak. Contoh modifikasi matriks TiO2 seperti N/TiO2
untuk degradasi ethylene glycol dalam acetonitrile, di peroleh hasil tingkat
kerugian menurun sebanyak 0,04 µM/sec (Tachikawa et al., 2006), serta degradasi
dengan C/TiO2 juga menurunkan tingkat kerugian quinoline sebesar 0,05 µM/sec
(Liu et al., 2007). Dengan peningkatan aktivitas katalitik, para peneliti
memfokuskan risetnya pada modifikasi matriks TiO2 dengan dopan non-logam
seperti N/TiO2 untuk degradasi ethylene glycol dalam acetonitrile (Tachikawa et
al., 2006).
Pada penelitian sebelumnya, Ohno et al., (2004) melakukan modifikasi matriks
TiO2 dengan sulfur, ternyata memberikan absorpsivitas yang lebih kuat/baik pada
daerah tampak di bandingkan dopan N, C, dan I. Selain itu, ukuran kristal
berperan penting pada aktifitas di cahaya-tampak (Ihara et al., 2003). Hasil yang
diperoleh pada pada penelitian tersebut, fotodegradasi senyawa fenol pada daerah
cahaya-tampak mencapai 100%, sedangkan jika menggunakan katalis TiO2 hanya
4
Berdasarkan refrensi tersebut, maka pada penelitian ini akan dilakukan reaksi
fotodegradasi senyawa metanil yellow dengan fotokatalis S/TiO2.
B.Tujuan Penelitian
Mendapatkan nano-fotokatalis S/TiO2 dan menguji aktifitasnya untuk
fotodegradasi metanil yellow dan melihat pengaruh doping sulfur (S) dalam
aktifitas fotokatalitiknya.
C.Manfaat Penelitian
Memberi gambaran tentang penggunaan nano-fotokatalis S/TiO2 pada reaksi
fotodegradasi metanil yellow yang merupakan penanganan pada pencemaran
II. TINJAUAN PUSTAKA
A.Metanil Yellow
Zat warna sintetis dalam makanan menurut Joint FAO/WHO Expert Commitee on
Food Additives (JECFA) dapat digolongkan dalam beberapa kelas yaitu azo, triaril metana, quinolin, xantin, dan indigoid. Metanil yellow termasuk dalam zat warna
sintetis golongan azo yang telah dilarang digunakan pada pangan. Pada umumnya,
pewarna sintetis azo bersifat lebih stabil daripada kebanyakan pewarna alami.
Pewarna azo stabil dalam berbagai rentang pH, stabil pada pemanasan, dan tidak
memudar bila terpapar cahaya atau oksigen. Hal tersebut menyebabkan pewarna
azo dapat digunakan pada hampir semua jenis pangan. Salah satu kekurangan
pewarna azo adalah sifatnya yang tidak larut dalam minyak atau lemak. Sifat-sifat
dari metanil yellow dapat dilihat pada Tabel 2.1.
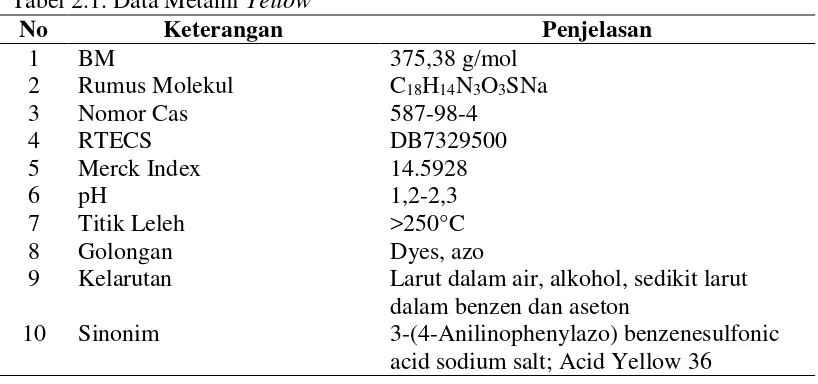
Tabel 2.1. Data Metanil Yellow
No Keterangan Penjelasan
1 BM 375,38 g/mol
9 Kelarutan Larut dalam air, alkohol, sedikit larut dalam benzen dan aseton
6
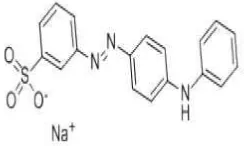
Zat warna sintetis yang memiliki rumus kimia C18H14N3O3SNa dengan
penampakan fisik berwarna orange sampai kuning tersebut memiliki struktur
seperti Gambar 2.1.
Gambar 2.1. Struktur Kimia Metanil Yellow
B.Nanokatalis
Nanokatalis didefinisikan sebagai partikulat yang terdispersi atau partikel-partikel
padatan dengan ukuran partikel berkisar 10 – 100 nm (Mohanraj and Chen, 2006).
Nanokatalis telah banyak menarik peneliti karena material nanokatalis
menunjukkan sifat fisika dan kimia yang berbeda dari bulk materialnya, sifat-sifat
tersebut seperti kekuatan mekanik, elektronik, magnetik, kestabilan termal,
katalitik dan optik (Mahaleh et al., 2008). Ada dua hal utama yang membuat
nanokatalis berbeda dengan material sejenis dalam ukuran besar (bulk) yaitu: (a)
karena ukurannya yang kecil, nanokatalis memiliki nilai perbandingan antara luas
permukaan dan volume yang lebih besar jika dibandingkan dengan partikel sejenis
dalam ukuran besar. Ini membuat nanokatalis bersifat lebih reaktif. Reaktivitas
material ditentukan oleh atom-atom di permukaan, karena hanya atom-atom
tersebut yang bersentuhan langsung dengan material lain; (b) ketika ukuran
partikel menuju orde nanometer, hukum fisika yang berlaku lebih didominasi oleh
7
nanokatalis dibandingkan partikel sejenis dalam keadaan bulk (Abdullah dkk.,
2008).
Nanokatalis memiliki aktivitas yang lebih baik sebagai katalis karena material
nanokatalis memiliki permukaan yang luas dan rasio-rasio atom yang tersebar
secara merata pada permukaannya. Sifat ini menguntungkan untuk transfer massa
di dalam pori-pori dan juga menyumbangkan antar muka yang besar untuk
reaksi-reaksi adsorpsi dan katalitik (Widegren et al., 2003). Selain itu nanokatalis telah
banyak dimanfaatkan sebagai katalis untuk menghasilkan bahan bakar dan zat
kimia serta menangani pencemaran lingkungan (Sietsma et al., 2007).
Banyak metode yang telah dikembangkan untuk sintesis nanokatalis, seperti
metode pemanasan sederhana dalam larutan polimer (Abdullah dkk, 2008),
metode pembakaran (combustion), metode sintesis koloid (Soderlind, 2008),
metode kopresipitasi (Pinna, 1998), dan metode sol-gel (Ismunandar, 2006).
C.Titanium Dioksida
TiO2 adalah salah satu material yang banyak diteliti karena sifatnya yang menarik.
Meskipun telah ditemukan lebih dari 200 tahun yang lalu dan telah diteliti sejak
85 tahun yang lalu namun hingga kini penelitian tentang TiO2 masih aktif dan
tetap dikembangkan. Titanium oksida atau yang lebih sering disebut titania adalah
kelompok (IV) oksida yang merupakan semikonduktor dengan celah band-gap 3,0
8
Secara kimia titanium dioksida dituliskan dengan lambang TiO2. Senyawa ini
biasa digunakan sebagai pigmen pada cat tembok (Braun et al., 1992), tabir surya
(Zallen and Moret, 2006), pasta gigi (Yuan and Chen, 2005), solar sel, sensor,
perangkat memori serta sebagai fotokatalisis.
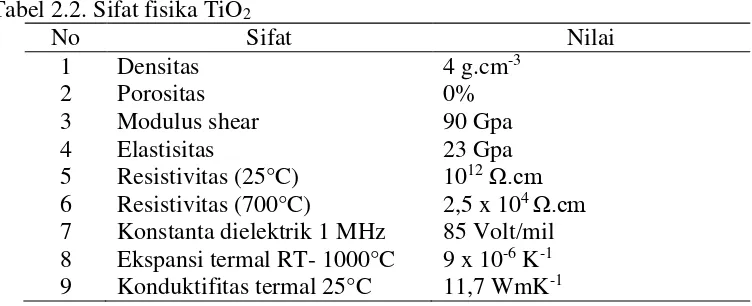
Secara fisika titanium memiliki sifat seperti yang ditunjukkan pada Tabel 2.2.
Titanium massa jenis yang rendah, tahan karat, memiliki biokompabilitas yang
tinggi dengan tubuh (Supriyanto dkk., 2007) sehingga dapat digunakan sebgai
produk implan dalam tubuh. Kristal TiO2 bersifat asam dan tidak larut dalam air,
asam klorida, asam sulfat encer dan alkohol namun larut dalan asam sulfat pekat
dan asam flourida.
Tabel 2.2. Sifat fisika TiO2
No Sifat Nilai
7 Konstanta dielektrik 1 MHz 85 Volt/mil 8 Ekspansi termal RT- 1000°C 9 x 10-6 K-1
9 Konduktifitas termal 25°C 11,7 WmK-1
D.Struktur Kristal TiO2
TiO2 dibuat dari ilmenite dan rutil, yang menghasilkan dua bentuk altropi atau
bentuk struktur kristal yang berbeda dari unsur yang sama, yaitu anatase dan rutil.
TiO2 memiliki tiga fasa polymorpik yaitu rutil (tetragonal, 4,120 g/cm3), anatase
9
dan rutil memiliki struktur kristal tetragonal, namun memiliki perbedaan grup
ruang (space group). Anatase memiliki grup ruang IA1/amd dengan empat unit
dalam satu unit sel dan rutil memiliki P42/mnm dengan unit TiO2 dalam satu unit
sel (Zhang et al., 2000).
Pada proses fotokatalisis fasa rutil maupun anatase dapat digunakan namun dalam
aplikasinya anatase memiliki potensi yang paling besar untuk digunakan sebagai
fotokatalisis (Tanaka et al., 1991) karena memiliki struktur kisi yang sesuai
dengan aktivitas fotokatalisis yang tinggi. Struktur rutil lebih stabil pada suhu
tinggi sedangkan anatase pada suhu rendah. Struktur rutil dan anatase dapat
digambarkan dengan TiO6 oktahedra, dimana setiap ion Ti4+ dikelilingi oleh enam
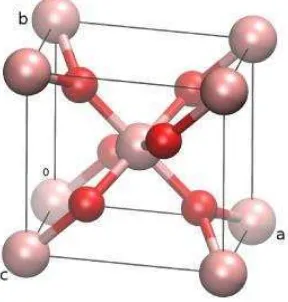
ion O2-. Struktur anatase dan rutil digambarkan pada Gambar 2.2 dan 2.3.
Perbedaan dari kedua struktur kristalin terletak pada distorsi struktur
oktahedronnya. Pada rutil, struktur oktahedronnya sedikit distorsi orthorombik.
Sementara anatase, distorsi jauh lebih besar, sehingga strukturnya kurang simetris
dibandingkan orthorombik. Jarak antara Ti-Ti lebih besar pada anatase, yaitu 3,79
Å dan 3,4 Å, sementara pada rutil adalah 3,57 Å dan 2,96 Å, jarak Ti-O lebih
10
Gambar 2.2. Struktur anatase TiO2 (Howard et al., 1992). Pemodelan kristal
menggunakan Ball and Stick Beta 8.1 (BS) (Kang and Ozawa, 2004).
Gambar 2.3. Struktur rutil TiO2 (Kennedy and Stampe, 1991). Pemodelan kristal
menggunakan Ball and Stick Beta 8.1 (BS) (Kang and Ozawa, 2004).
Untuk beberapa aplikasi struktur lebih banyak digunakan daripada anatase karena
memiliki sifat fisik yang unik misalnya berkilau, keras dan tahan terhadap korosi.
Sel satuan pada rutil adalah tetragonal dengan atom-atom logam terletak pada
sudut-sudutnya. Struktur rutil dari TiO2 pada umumnya dapat digambarkan
sebagai suatu distorsi barisan oksida heksagonal tertutup dengan setengah dari
11
struktur orthorombik, yang memilik simetri yang polimorf (memiliki struktur
kristal yang tidak teratur) dan akan berubah menjadi fasa rutil pada temperatur
sekitar 750°C (Chen et al., 2008).
Fasa brookite sangat jarang terjadi dalam fasa TiO2, fasa brookite terjadi pada
temperatur 200°C dengan densitas sebesar 4,133 g/cm3 dan memiliki empat
molekul titania dengan unsur titanium memiliki empat ion positif serta dua ion
begatif dari oksigen. Fasa brookite memiliki kesetabilan pada temperatur 200°C
sampai 400°C, dan fasa ini tidak terbentuk sama sekali pada selang temperatur
600°C sampai 800°C (Bakardjieva et al., 2006). Dalam skala nanometer, brookite
dapat digunakan sebagai lapisan tipis dengan mengabsorbsi energi foton dari
suatu cahaya. Dengan demikian akan mempercepat peristiwa fotolistrik dengan
celah terlarang 3,5 eV untuk satu molekul titania sehingga fasa ini juga baik
digunakan sebagai fotokatalisis.
E.Fotokatalis TiO2
Fotokatalis merupakan kombinasi antara proses fotokimia dengan proses katalitik
dimana diperlukan cahaya dan katalis untuk dapat melangsungkan atau
mempercepat transformasi kimia (Linsebigler et al., 1995). Fotokatalis merupakan
suatu proses dimana suatu substansi tertentu berperan dalam meningkatkan
kecepatan dari transformasi kimia. Substansi ini disebut dengan katalis dimana
substansi ini tidak dihasilkan maupun dikonsumsi dalam suatu reaksi melainkan
substansi ini meningkatkan kecepatan dari reaksi. Sehingga dapat dikatakan
12
mengaktivasi substansi tertentu (katalis) yang dapat meningkatkan kecepatan dari
reaksi kimia dimana substansi ini tidak dihasilkan maupun dikonsumsi dalam
suatu reaksi dan fotokatalis merupakan substansi yang dapat meningkatkan
kecepatan suatu reaksi kimia menggunakan irridiasi dengan cahaya (Satterfield,
1991). Adapun fotokatalis terbagi menjadi dua yaitu:
a. Fotokatalis heterogen, melibatkan katalis yang berbeda fasa dengan
medium reaktan. Konsep degradasi fotokatalitiknya adalah iradiasi
padatan semikonduktor yang stabil untuk menstimulus reaksi antaar fasa
permukaan padat atau larutan. Karena fotokatalis heterogen ini berbeda
fasa dengan medium reaktannya maka zat padatnya tidak berubah dan
dapat diambil lagi setelah beberapa kali reaksi redoks.
b. Fotokatalis homogen, melibatkan katalis yang berbeda dalam fasa yang
sama dengan medium reaktannya. Untuk fotokatalis homogen ini, interaksi
antara foton dan spesi pengabsorbsi (senyawa koordinasi dari logam
transisi, zat warna organik), substrat (kontaminan) dan cahaya akan
menyebabkan terjadinya perubahan substrat. Proses fotokatalitik seperti ini
terjadi dengan bantuan zat pengoksidasi seperti ozon (O3) dan hidrogen
peroksida (H2O2).
Titanium dioksida adalah material yang dikenal luas sebagai fotokatalisis
didasarkan pada sifat semikonduktornya. Selain itu, diantara oksida logam yang
lain, titanium dioksida dikenal tidak beracun (non toxic), memiliki stabilitas
termal cukup tinggi, dan kemampuannya yang dapat dipergunakaan berulang kali
tanpa kehilangan sifat katalitiknya, dapat menyerap cahaya ultraviolet dengan
13
termasuk zat organik yang sulit terurai dan secara umum TiO2 memiliki aktivitas
fotokatalisis yang lebih tinggi daripada fotokatalisis lain seperti ZnO, CdS, WO2,
dan SnO2 (Okamoto et al., 1985).
Sifat fotokatalitik titanium dioksida pertama kali ditemukan oleh Akira fujishime
pada tahun 1967 dan diterbitkan pada tahun 1972 (Fujishime et al., 2000).
Titanium dioksida memiliki potensi untuk digunakan dalam produksi energi
sebagai fotokatalis, dapat melakukan hidrolisis yaitu mencegah air menjadi
hidrogen dan oksigen. Dalam proses fotokatalis, semikonduktor TiO2
membutuhkan serapan energi yang lebih besar dari selang energinya. Aktifitas
fotokatalis ini membutuhkan penyerapan sinar ultraviolet (UV) untuk membentuk
dua pasangan elektron dan lubang (hole). Fotokatalis TiO2 dapat menjadi
fotodegradasi yang baik untuk penetrasi limbah, seperti penumbuhan bakteri
eschericha coli melalui bantuan sinar fotokatalis yang telah berhasil dilakukan dan
hasilnya bakteri tersebut mati (Sunada et al., 2003). TiO2 mampu memacu reaksi
oksidasi pada polutan dalam limbah hingga terurai. Gambar 2.4 berikut adalah
mekanisme dari reaksi fotokatalis.
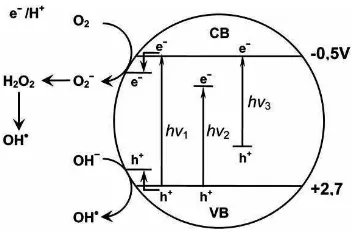
Gambar 2.4. Mekanisme fotokatalis TiO2 : hν1: TiO2 murni; hν2: TiO2 doping
14
Mekanisme fotokatalitik dimulai oleh penyerapan foton hf1 dengan energi yang
sama atau lebih besar dari celah pita TiO2 (3,3 eV untuk fase anatase)
menghasilkan pasangan lubang elektron pada permukaan nanopartikel TiO2.
Sebuah elektron dipindahkan ke pita konduksi (CB) sementara lubang positif
terbentuk di pita valensi (VB). Kondisi Elektron dan lubang bisa bergabung
kembali dan menghilangkan masuknya energi sebagai panas, terperangkap dalam
keadaan permukaan yang metastabil, atau bereaksi dengan donor elektron dan
akseptor elektron yang teradsorpsi pada permukaan semikonduktor. Setelah
bereaksi dengan air, lubang ini dapat menghasilkan OH radikal dengan potensial
oksidasi redoks yang tinggi. Tergantung pada tepat kondisi, lubang, OH radikal,
O2 -, H2O2 dan O2 sendiri dapat memainkan peran penting dalam mekanisme
reaksi fotokatalitik. Aktifitas fotokatalitik cahaya tampak doping non logam pada
TiO2 dapat dijelaskan bahwa tingkat energi baru dihasilkan di celah pita TiO2
dengan dispersi nanopartikel logam dalam matrix TiO2. Seperti ditunjukkan dalam
Gambar 2.4 elektron dapat tereksitasi ke pita konduksi TiO2 oleh foton dengan
energi yang sama dengan hf2. Keuntungan tambahan dari logam transisi doping
adalah penangkapan elektron ditingkatkan untuk menghambat rekombinasi lubang
elektron selama iradiasi. Penurunan hasil rekombinasi pembawa muatan dapat
meningkatkan aktifitas fotokatalitiknya.
F. Preparasi fotokatalis TiO2
Teknik preparasi mempunyai peranan penting dalam menentukan jenis kristal
15
Adapun metode yang dapat digunakan untuk membuat koloid TiO2 di antaranya
(Jiang,D, 2004) :
1. Kondensasi gas inert
2. Sintesis nyala dengan oksidasi TiCl4
3. Sintesis oksidasi hidrotermal dari logam Ti
4. Metode sol-gel
Metode sol-gel adalah metode pengendapan hidrolitik dari titanium oksida atau
garam titanium. Metode ini banyak digunakan karena peralatan yang dibutuhkan
cukup sederhana, biayanya murah dan mudah untuk merubah sifat fisik dari TiO2
yang dimmobilisasi. Metode ini merupakan salah satu wet method karena pada
prosesnya melibatkan larutan sebagai medianya. Pada metode sol-gel, sesuai
dengan namanya larutan mengalami perubahan fase menjadi sol (koloid yang
mempunyai padatan tersuspensi dalam larutannya) dan kemudian menjadi gel
(koloid tetapi mempunyai fraksi solid yang lebih besar dari pada sol). Material
yang digunakan dalam proses sol-gel biasanya adalah garam logam anorganik
atau campuran logam organik misalnya alkosida logam.
Metode sol-gel dapat digunakan untuk preparasi lapisan tipis atau immobilisasi
TiO2 diatas bahan penyangga. Pada teknik ini, TiO2 diimmobilisasi pada substrat
bersamaan dengan reaksi pembentukkannya dari senyawa prekursor. Senyawa
prekursor dilarutkan dalam pelarut organik membentuk sol, kemudian didoping
dengan penambah sumber sulfur yang selanjutnya dihidrolisis perlahan untuk
memperoleh gel. Gel lalu dilapiskan pada permukaan substrat sebelum hidrolisis
16
G.Karakterisasi Katalis
Karakterisasi adalah hal yang sangat penting dalam bidang katalisis. Beberapa
metode seperti difraksi, spektroskopi, dan mikroskopi memberikan kemudahan
dalam menyelidiki sifat-sifat suatu katalis, sehingga diharapkan kita dapat
mendapatkan pemahaman yang lebih baik tentang katalis agar kita dapat
meningkatkan atau mendesain suatu katalis yang memiliki aktivitas yang lebih
baik (Chorkendorf and Niemantsverdriet, 2003).
1. Analisis Struktur Kristal
Keberadaan atau terbentuknya katalis S/TiO2 dalam bentuk amorf dan kristal
dapat diidentifikasi menggunakan metode difraksi sinar-X (XRD), karena metode
XRD didasarkan pada fakta bahwa pola difraksi sinar-X untuk masing-masing
material kristalin adalah karakteristik. Dengan demikian, bila pencocokan yang
tepat dapat dilakukan antara pola difraksi sinar-X dari sampel yang tidak diketahui
dengan sampel yang telah diketahui, maka identitas dari sampel yang tidak
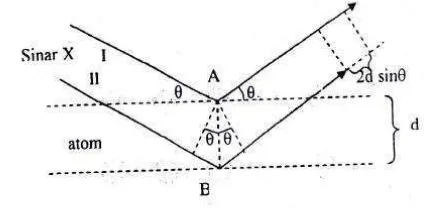
diketahui itu dapat diketahui (Skoog dan Leary, 1992). Gambar 2.5 berikut
merupakan mekanisme sinar datang dan sinar refleksi dari sinar-X pada suatu
17
Gambar 2.5. Mekanisme difraksi pada suatu bidang kristal (Beiser, 1995)
Pada Gambar 2.5 diatas suatu berkas sinar-X dengan panjang gelombang λ jatuh pada kristal dengan sudut θ terhadap permukaan bidang kristal yang jaraknya
adalah d. Seberkas sinar pertama (I) yang mengenai atom A pada bidang pertama
dan sinar kedua (II) yang mengenai atom B pada bidang berikutnya
mengakibatkan masing-masing atom menghambur dalam arah rambang.
Interferensi konstruktif hanya terjadi antara sinar terhambur sejajar dan beda jarak jalannya tepat λ, 2λ, 3λ, dan seterusnya. Jadi beda jarak harus nλ, dengan n adalah
bilangan bulat. Kondisi ini dirumuskan oleh Bragg dalam bentuk persamaan yang
dikenal sebagai hukum Bragg.
n
d.sin 2
Dimana d adalah jarak antar dua bidang kisi, θadalah sudut antara sinar datang
dengan bidang normal, n adalah bilangan bulat, dan λadalah panjang gelombang
18
Berdasarkan persamaan Bragg, jika seberkas sinar-X dijatuhkan pada sampel
kristal, maka bidang kristal itu akan membiaskan sinar-X yang memiliki panjang
gelombang yang sama dengan jarak antar kisi dalam kristal tersebut. Sinar yang
dibiaskan akan ditangkap oleh detektor, kemudian diterjemahkan sebagai puncak
difraksi. Semakin banyak bidang kristal yang sama terdapat dalam sampel,
semakin kuat intensitas pembiasan yang dihasilkan. Tiap puncak yang muncul
pada pola XRD mewakili satu puncak bidang kristal yang memiliki orientasi
tertentu dalam sumbu tiga dimensi (Auda, 2009).
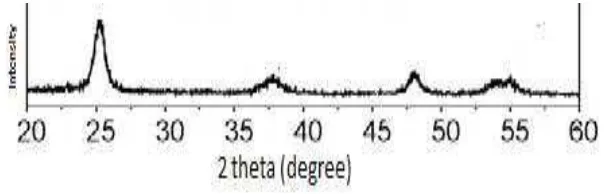
Dari Gambar 2.5 di atas, akan didapatkan difraktogram XRD. Gambar 2.6 berikut
adalah contoh difraktogram XRD TiO2 yang dibuat dengan menggunakan metode
hidrolisis katalis asam (Liu et al., 2007).
Gambar 2.6. Difraktogram nanokristal TiO2 (Liu et al., 2007).
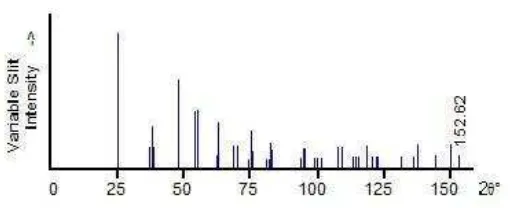
Difraktogram diatas diinterpretasikan melalui pencocokan dengan difraktogram
standar. Gambar 2.7 berikut difraktogram standar yang digunakan dalam
19
Gambar 2.7. Difraktogram standar TiO2 PDF 21-1272 (PCPDFwin, 1997)
Dari Gambar 2.7 diatas, puncak-puncak yang mewakili TiO2terdapat pada 2θ
25,281°; 48,049°; 53,890°; dan 55,060°.
2. Analisis Morfologi Permukaan Katalis
Interaksi antara gas dan permukaan material dan reaksi-reaksi pada permukaan
material memiliki peran yang sangat penting dalam bidang katalisis. Siklus awal
katalsis diawali dengan adsorpsi molekul reaktan pada permukaan katalis. Oleh
karena itu kita perlu untuk mempelajari morfologi permukaan dari katalis
(Chorkendorff and Niemantsverdriet, 2003). Untuk mempelajari morfologi
permukaan katalis dapat menggunakan instrumentasi SEM (Ertl et al., 2000).
SEM merupakan metode untuk menggambarkan permukaan suatu bahan dengan
resolusi yang tinggi. Resolusi yang tinggi pada SEM dihasilkan dari penggunaan
elektron dalam menggambarkan permukaan bahan. Resolusi yang dihasilkan juga
jauh lebih tinggi dibandingkan dengan mikroskop cahaya (0,1 – 0,2 nm untuk
SEM dan 200 nm untuk mikroskop cahaya) (Hanke, 2001). Skema kerja dari SEM
20
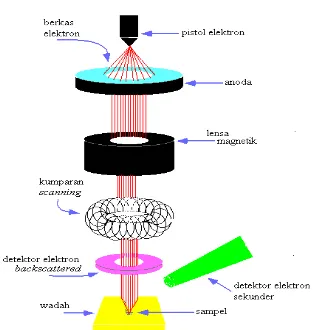
Gambar 2.8. Skema kerja dari SEM.
Dari Gambar 2.8 di atas, sebuah pistol elektron memproduksi berkas elektron dan
dipercepat di anoda. Lensa magnetik kemudian memfokuskan elektron menuju
sampel. Berkas elektron yang terfokus memindai (scan) keseluruhan sampel
dengan diarahkan oleh kumparan pemindai. Ketika elektron mengenai sampel,
maka sampel akan mengeluarkan elektron yang baru yang akan diterima oleh
detektor (Hanke, 2001).
Gambar yang dihasilkan SEM, dibentuk dari elektron sekunder yang dipantulkan
sampel pada peristiwa penembakan berkas elektron dari alat. Permukaan yang
lebih tinggi akan memberikan warna yang lebih cerah daripada permukaan yang
lebih rendah, ini diakibatkan oleh lebih banyaknya elektron sekunder yang
dibebaskan menuju detektor (Ertl et al., 2000). Gambar 2.9 berikut ini adalah
21
Gambar 2.9. Mikrograf SEM dari TiO2 (Liu et al., 2007).
Dari Gambar 2.9 di atas, dapat dilihat bahwa TiO2 yang disintesis secara
keseluruhan memiliki morfologi permukaan yang seragam dengan bentuk partikel
tetragonal.
3. Transmission Electron Microscopy (TEM)
TEM memiliki fungsi untuk analisis morfologi, struktur kristal, dan komposisi
spesimen. Tem menyediakan resolusi lebih tinggi dibandingkan SEM, dan dapat
memudahkan analisis ukuran atom (dalam jangkauan nanometer) menggunakan
energi berkas electron sekitar 60 sampai 350 eV. TEM cocok untuk menjadi
teknik pencitraan resolusi atomik. Informasi struktural diperoleh dengan
22
Gambar 2.10. Skema kerja dari TEM
Prinsip kerja TEM dimulai dari sumber emisi (pistol elektron) yaitu tungsten
filament dan sumber lanthanum hexaboride (LaB6). Dengan menghubungkan pistol ini dengan sumber tegangan tinggi (biasanya ~ 100-300 kV) pistol akan
mulai memancarkan elektron baik dengan termionik maupun emisi medan
elektron ke sistem vakum. ekstraksi ini biasanya dibantu dengan menggunakan
silinder Wehnelt. Interaksi elektron dengan medan magnet akan menyebabkan
elektron bergerak sesuai dengan aturan tangan kanan, sehingga memungkinkan
elektromagnet untuk memanipulasi berkas elektron. Penggunaan medan magnet
akan membentuk sebuah lensa magnetik dengan kekuatan fokus variabel yang
baik. Selain itu, medan elektrostatik dapat menyebabkan elektron didefleksikan
melalui sudut yang konstan. Dua pasang defleksi yang berlawanan arah dengan
intermediete gap akan membentuk arah elektron yang menuju lensa.
Berbeda dengan mikroskop optik yang lensanya bisa langsung difungsikan, optik
23
Lensa TEM memungkinkan adanya konvergensi, dengan sudut konvergensi yang
sesuai variabel parameter, TEM berkemampuan untuk mengubah perbesaran
dengan cara memodifikasi jumlah arus yang mengalir melalui kumparan, lensa
quadrupole atau lensa hexapole.
Biasanya TEM terdiri dari tiga tahap lensing. Tiga tahapan itu adalah lensa
kondensor, lensa objektif, dan lensa proyektor. Lensa kondensor bertanggung
jawab untuk pembentukan balok primer, sedangkan fokus lensa objektif datang
melalui sampel itu sendiri (dalam STEM mode pemindaian, ada juga lensa
objektif atas sampel untuk membuat konvergen insiden berkas elektron). Lensa
proyektor digunakan untuk memperluas sinar ke layar fosfor atau perangkat
pencitraan lain, seperti film. Pembesaran TEM berasal dari rasio jarak antara
spesimen dan lensa objektif. Selain itu, lensa Quad dan hexapole digunakan untuk
koreksi distorsi balok asimetris, yang dikenal sebagai astigmatisme (Jie et al.,
2003). Gambar 2.11 berikut ini merupakan contoh dari hasil pengukuran TEM
untuk TiO2.
24
4. Spektrofotometri UV-Vis
Spektrofotometri Sinar Tampak (UV-Vis) adalah pengukuran energi cahaya oleh
suatu sistem kimia pada panjang gelombang tertentu (Day, 2002). Sinar
ultraviolet (UV) mempunyai panjang gelombang antara 200-400 nm, dan sinar
tampak (visible) mempunyai panjang gelombang 400-750 nm. Pengukuran
menggunakan spektrofotometer melibatkan energi elektronik yang cukup besar
pada molekul yang dianalisis, sehingga spektrofotometer UV-Vis lebih banyak
dipakai untuk analisis kuantitatif dibandingkan kualitatif. Konsentrasi dari analit
di dalam larutan sampel bisa ditentukan dengan mengukur absorbansi sinar oleh
sampel pada panjang gelombang tertentu dengan menggunakan hukum
Lambert-Beer (Rohman, 2007).
Hukum Lambert-Beer menyatakan hubungan linieritas antara absorbansi dengan
konsentrasi larutan analit dan berbanding terbalik dengan transmitan. Dalam
hukum Lambert-Beer terdapat beberapa batasan, yaitu:
a. Sinar yang digunakan dianggap monokromatis.
b. Penyerapan terjadi dalam suatu volume yang mempunyai penampang yang
sama.
c. Senyawa yang menyerap dalam larutan tersebut tidak tergantung terhadap
yang lain dalam larutan tersebut.
d. Tidak terjadi fluorensensi atau fosforisensi.
25
Hukum Lambert-Beer dinyatakan dalam rumus sebagai berikut:
A= E.b.c
dimana:
A = absorbansi
E= absorptivitas molar
b = tebal kuvet (cm)
c = konsentrasi
Adapun prinsip kerja spektrofotometer UV-Vis yaitu cahaya yang berasal dari
lampu deuterium maupun wolfram yang bersifat polikromatis diteruskan melalui
lensa menuju ke monokromator pada spektrofotometer dan filter cahaya pada
fotometer. Monokromator kemudian akan mengubah cahaya polikromatis
menjadi cahaya monokromatis (tunggal). Berkas-berkas cahaya dengan panjang
tertentu kemudian akan dilewatkan pada sampel yang mengandung suatu zat
dalam konsentrasi tertentu. Oleh karena itu, terdapat cahaya yang diserap
(diabsorbsi) dan ada pula yang dilewatkan. Cahaya yang dilewatkan ini kemudian
diterima oleh detektor. Detektor kemudian akan menghitung cahaya yang
diterima dan mengetahui cahaya yang diserap oleh sampel. Cahaya yang diserap
sebanding dengan konsentrasi zat yang terkandung dalam sampel sehingga akan
diketahui konsentrasi zat dalam sampel secara kuantitatif dengan membandingkan
absorbansi sampel dan kurva standar. Skema kerja dari spektrofotometer UV-Vis
26
III. METODELOGI PENELITIAN
A. Tempat dan Waktu Penelitian
Penelitian ini telah dilakukan di Laboratorium Kimia Anorganik-Fisik Jurusan
Kimia FMIPA Universitas Lampung. Analisis Difraksi Sinar-X, SEM dan TEM
dilakukan di Universitas Gajah Mada (UGM). Penelitian ini dilakukan dari bulan
Agustus 2014 sampai dengan bulan Maret 2015.
B. Alat dan Bahan
Peralatan yang digunakan dalam penelitian ini antara lain, pengaduk magnetik,
furnace Lenton 3508, neraca analitik, difraktometer sinar-X, SEM JEOL
JSM-6510la, TEM, Spektrofotometer UV-Vis, desikator dan peralatan gelas laboratorium.
Bahan-bahan kimia yang digunakan dalam penelitian ini antara lain, titanium
28
C. Prosedur Kerja
1. Pembuatan Nanokatalis S/TiO2
Pembuatan nanokatalis S/TiO2 dilakukan dengan cara menimbang tween_80
sebanyak 5 gr di dalam wadah botol. Kemudian ditambahkan Isopropanol
sebanyak 50 mL dan diaduk selama 10 menit sampai larutan homogen. Setelah itu
ditambahkan Ti-isopropoxide 97% ke dalam larutan homogen tersebut sebanyak
3,5 mL, dan diaduk kembali selama 20 menit sampai larutan benar-benar
homogen. Kemudian ke dalam larutan homogen tersebut ditambahkan H2SO4 1M
dengan berbagai variasi (0,57; 1,14; 2,85; 5,70; dan 11,41 gr), setelah itu diaduk
selama 12 jam. Lalu larutan homogen tersebut dikeringkan dalam oven dengan
dua tahap yaitu, tahap pertama untuk menghilangkan larutan isopropanol dengan
suhu 70-80°C selama 24 jam dan tahap kedua untuk menghilangkan asam oleat
yang terkandung dalam tween_80 dengan suhu 110-120°C sampai terbentuk
serbuk. Lalu dilakukan kalsinasi secara bertahap sampai suhu 400°C.
2. Karakterisasi Katalis
a. Analisis Struktur Kristal
Analisis struktur kristal dilakukan menggunakan instrumentasi difraksi sinar-X.
Prosedur analisis ini disesuaikan dengan penelitian yang telah dilakukan oleh
Maiti et al., (1973). Analisis dilakukan menggunakan radiasi CuKα (1,5425 Å),
tabung sinar-X dioperasikan pada 40 kV dan 200 mA. Rentang difraksi yang
diukur (2θ) dalam rentang 15 – 70o, dengan scan step size 0,05o/menit.
29
metode Search Match dengan standar file data yang terdapat dalam program
PCPDF 1997 (Drbohlavova et al., 2009).
b. Analisis Morfologi Permukaan Katalis
1. Analisis morfologi permukaan katalis dilakukan menggunakanSEM 0,1 g
sampel katalis yang akan dianalisis ditempatkan pada wadah sampel yang
mengandung sticking tape tembaga, kemudian sampel dilapisi lapisan tipis
emas atau bahan yang besifat konduktor lainnya (Drbohlavova et al., 2009).
Kemudian sampel tersebut diberikan berkas elektron. Berkas elektron akan
dipantulkan oleh sampel untuk kemudian ditangkap detektor membentuk foto
(Hanke, 2001).
2. Analisis morfologi nanokatalis dilakukan menggunakan TEM. Tahapan
persiapan sampel adalah sebagai berikut.
a. Sampel dipotong dengan ukuran 3 mm dan ketebalan 100 µm.
b. Sampel digerinda tengahnya sampai ketebalan 20 µm.
c. Sampel ditembakkan dengan ion argon sampai berlubang.
d. Elektron ditembakkan, berkas yang menembus sampel akan dibaca
oleh detektor dan diolah menjadi gambar (Bendersky and Gayle,
30
3. Uji Aktifitas Fotokatalitik
a. Preparasi Sampel
Dalam penelitian ini digunakan katalis S/TiO2 sebanyak 0,08 gr dan metanil
yellow 100 ppm sebanyak 300 mL.
b. Reaksi fotokatalitik
Uji aktifitas fotokatalitik pada nanokatalis S/TiO2 dilakukan terhadap senyawa
metanil yellow dengan mencampurkan sebanyak 0,08 gram nanokatalis S/TiO2 ke
dalam 300 mL metanil yellow dengan konsentrasi 100 ppm ke dalam gelas kimia,
kemudian dihomogenkan. Setelah itu campuran tersebut dipipet sebanyak 20 mL
dengan berbagai variasi waktu yaitu (0; 10; 20; 30; 50 menit) yang telah disinari
oleh lampu UV dengan jarak 30 cm. Setelah itu di uji dengan spektrofotometri
UV-Vis untuk melihat laju absorbansi dari metanil yellow.
Kemudian pada reaksi fotokatalitik untuk cahaya tampak, sebanyak 0,08 gr katalis
S/TiO2 dimasukkan kedalam 300 mL metanil yellow 100 ppm dalam gelas kimia.
Kemudian dihomogenkan, setelah itu campuran tersebut diletakkan dibawah sinar
matahari pada rentang waktu pukul 11.00 WIB – 13.00 WIB. Kemudian
campuran tersebut dipipet sebanyak 20 mL dengan berbagai variasi waktu yaitu
(0; 10; 20; 30; 50 menit) dan di uji dengan spektrofotometri UV-Vis untuk
31
4. Analisis dengan Spektrofotometri UV-Vis
a. Kalibrasi Alat Spektrofotometer UV-Vis
Menyalakan alat spektrofotometer selama +15 menit untuk menstabilkan
sumber cahaya dan fotodetektor. Lalu siapkan larutan blangko (aquades),
masukkan ke dalam kuvet yang telah dibersihkan sebelumnya dengan
menggunakan tisue. Pilih menu aplikasi wavelength scan. Kemudian
kalibrasi dengan menggunakan larutan blangko (minimal 2 kali dengan
menekan tombol autozerro). Setting nilai absorbansi = 0, setting nilai
transmitansi = 100 % (artinya larutan tidak mengabsorpsi cahaya yang
diberikan).
b. Pembuatan larutan standar
Membuat larutan standar metanil yellow dengan konsentrasi 0; 20; 40; 60;
80; 100 ppm.
c. Menentukan panjang gelombang maximum (maks) serta konsentrasi metanil yellow terdegradasi :
Pertama di tentukan range panjang gelombang yang akan digunakan
(untuk sampel yang berwarna, gunakan rentangpanjang gelombang 350 –
800 nm). Masukan masing-masing larutan standar ke dalam kuvet yang
kering dan bersih dan di lakukan scaning panjang gelombang maksimum
32
yang menghasilkan absorbansi paling besar atau paling tinggi disebut
maks), dan membuat grafik hubungan antara nilai absorbansi sebagai
fungsi panjang gelombang. Kemudian mengukur absorbansi terdegradasi
yang akan ditentukan konsentrasi nya, lalu setelah di dapatkan
absorbansinya, nilai absorbansinya dimasukkan pada grafik standar yang
telah di buat sebelumnya. Kemudian konsentrasi terdegradasi dapat di
V. SIMPULAN DAN SARAN
A. Simpulan
Berdasarkan data-data yang didapat dari penelitian ini maka dapat diambil
kesimpulan bahwa:
1. Katalis yang disintesis menggunakan metode sol-gel dan sonofikasi secara
simultan dengan dopan S adalah S/TiO2 anatase
2. Hasil analisis TEM menunjukkan bahwa katalis S/TiO2 memiliki ukuran
kristal dalam rentang 6-8 nm
3. Secara umum katalis S/TiO2 aktif dalam fotokatalisisdan selektif terhadap
fotodegradasi zat warna.
4. Hasil analisis menggunakan spektofotometer UV-Vis menyatakan bahwa
fotodegradasi zat warna metanil yellow menggunakan katalis S/TiO2 lebih
baik dilakukan dengan disinari matahari dibandingkan dengan disinari
lampu UV, hal ini didasari dengan hasil uji pada sinar matahari dapat
52
B. Saran
Berdasarkan penelitian yang telah dilakukan, pada penelitian selanjutnya perlu
disarankan untuk:
1. Melakukan preparasi katalis TiO2 dengan dopan logam yang lain.
DAFTAR PUSTAKA
Abdullah, M., Yudistira V., Nirmin, dan Khairurrijal. 2008. Sintesis Nanomaterial. Jurnal Nanosains dan Nanoteknologi. 1, p. 33 – 36.
Afrozi, A,S. 2010. Sintesis Dan Karakterisasi Katalis Nanokomposit Berbasis Titania Untuk Produksi Hidrogen Dari Gliserol Dan Air. Tugas Akhir Tidak Diterbitkan. Program Studi Teknik Kimia UI.
Arif, Syukri, Safni, dan Roza, P. 2007. Degradasi Senyawa Rodamin B Secara Sonolisis dengan Penambahan TiO2 Hasil Sintesis Melalui Proses
Sol-Gel. Jurnal Riset Kimia, Vol. 1.1. p. 64-69.
Asahi R, Morikawa T, Ohwaki T, Aoki K, Taga Y. 2001. Visible-light photocatalysis in nitrogen-doped titanium dioxide. Science. 293 : 269-271.
.Auda, H. Y. 2009. Spektroskopi Difraksi Sinar-X (X-ray Difraction/XRD). Fakultas Teknik Universitas Sebelas Maret. P. 1-3.
Azkia, A.L., Akmal, M., Pepi, H.Y. 2015. Degradasi Senyawa Metanil Yellow Secara Fotokatalitik Menggunakan TiO2 dan HNO3. Jurnal Riset
Kimia, Vol. 1.1. p. 33
Banat, I.M., P. Nigam, D. Singh, dan R. Marchant. Microbial Decolorization of Textile-Dye Containing Affluents: a Review. Bioresource Technology, 58:217-227 (1996).
Bendersky, L. A. and F. W. Gayle.2001. Electron diffraction using transmission electron microscopy. National Institute of Standards and Technology. Gaithersburg. MD 20899-8554.
Braun, J. H., Andrejs and Marganski, R. 1992. TiO2 Pigment Technology: a
54
Chen, Z., Meng, H., Xing., G, Yuan, H., Zhao, F., Liu, R. 2008. Age-Related Differences in Pulmonary and Cardiovascular Responses to SiO2
Nanoparticle Inhalation: Nanotoxicity has Susceptible Population. Environmental Science and Technology, Vol. 42. P. 8985-8992. Chorkendroff, I. and J. W. Niemantsverdriet. 2003. Concept of Modern Catalysis
and Kinetics. Wiley-VCH GmbH & Co. New York, Vol. 1. p. 2 – 4.
Drbohlavova, J., R. Hrdy, V. Adam, R. Kizek, O. Schneeweiss, and J. Hubalek. 2009. Preparation and Properties of Various Magnetic Nanoparticles. Sensors, 9, p. 2352 - 2362.
E.M. Rockafellow, X. Fang, B.G. Trewyn, K. Schmidt-Rohr, S. Jenks William. 2009. Chem. Mater. Vol. 21. P. 1187–1197
Ertl, G., H. Knözinger, and J. Weitkamp. 2000. Handbook of Heterogeneous Catalysis. Wiley-VCH GmbH & Co. New York, Vol. 3. p. 4 – 6.
Fatimah, I. Dan Wijaya, K., 2005. Sintesis TiO2/Zeolit sebagai Fotokatalis pada
Pengolahan Limbah Cair Industri Tapioka Secara Adsorbsi-Fotodegradasi. Jurnal Teknologi Industri, Vol. 10. 4. P. 257-267. Fujishime, A., Rao, N and Tryk, D. 2000. Titanium Dioxide Photocatalysis.
Journal Photochemistry Photobiology C, Vol. 1.1. p. 1-21.
H. Liu, A. Imanishi, Y. Nakato, J. 2008. Phys. Chemistry. Vol. 111, p. 8603–8610 Hanke, L. D. 2001. Materials Evaluation and Engineering Inc. Plymouth,
Handbook of Analytical Methods for Materials. p. 35 – 38. Hennek, and Matthew. Nitrogen-Doped Titanium Dioxide: An Overview of
Function and Introduction to Applications, 2007.
Hoffman, M., Martin, S., Choi, W and Bahnemann, D. 1995. Environmental Application of Semiconductor Photocatalysis, Chemical Reviews, Vol. 95. P. 69-96.
Howard, C. J., Sabine, T. M., and Dicson, F., 1991. Structure and termal pharameters for rutile and Anatase. Acta Crystallographica, 4B. pages 462-468.
Hunter, B. A. 2001. Rietveld Analysis Using a Visual Interface. ANSTO Neutron Scattering. PMB 1, Menai, N.S.W. 2234. Australia. Page 1.
Ismunandar. 2006. Padatan Oksida Logam: Struktur, Sintesis, dan Sifat-sifatnya. Penerbit ITB. Bandung. Indonesia. p. 8 - 23.
Jiang, D., 2004. Studies of Photocatalytic Processes at Nanoporous TiO2 Film
55
a Novel Methodology for Rapid Determination of Chemical Oxygen Demand, Griffith University. P. 13-15
Jie, Wei, Li Yubao. 2003. Tissue engineering scaffold material of nano-apatite crystals and polyamide composite. European Polymer Journal, Vol. 40. p. 509–515,
Justicia, P. Ordejon, G. Canto. 2002. Designed self-doped titanium oxide thin films for efficient visible-light photocatalysis. Adv. Mater. Vol. 14. P .1399–1402.
Linsebigler, A.L., Guangquan, L., dan Yates, J.T., 1995. Photocatalysis on TiO2
Surface : Principles, Mechanism and Selected Result,Chem. Rev, Vol. 95, p. 735-758.
Mahaleh, Y. Bahari Molla., S. K. Sadrnezhaad, and D. Hosseini. 2008. NiO Nanoparticles Synthesis by Chemical Precipitation and Effect of Applied Surfactant on Distribution of Particle Size. Hindawi Publishing Corporation Journal of Nanomaterials. p. 4.
Maiti, G. C., M. L. Kundu, S. K. Ghosh, and B. K. Banerjee. 1973. Cyrstallite Size Measurements and Phase Transformation of Fe2O3, Cr2O3 and
Fe2O3- Cr2O3 System by X-Ray Difraction Method. Physical
Research Wing. Fertilizer Corporation of India Limited. p. 496 – 505.
Manurung, Renita., Hasibuan, Rosdanelli., Irvan., Perombakan Zat Warna Azo Reaktif Secara Anaerob–Aerob, e-USU Repository Universitas Sumatera Utara (2004).
Mohanraj, V. J., and Y. Chen. 2006. Nanoparticles – A Review. Tropical Journal of Pharmaceutical Research. 5, p. 561 - 573.
Okamoto, K., Yamamoto, Y., Tanaka, M and Itaya, A. 1985. Heterogeneous Photocatalytic Decomposition of Phenol Over TiO2 Powder, Bulletin
of the Chemical Society of Japan, Vol. 58. P. 2015-2022. Ozawa,T.C and Kang, S.J. 2004. Balls and Sticks:Easy–to Use Structure
Visualisasi and Animation Creating Program. J Appl.Cryst. Vol. 37. Page. 679
Pinna, F., 1998. Supported Metal Catalyst Preparation. Catalysis Today. Vol. 41, p. 129 - 137.
Rohman, A. (2007). Kimia Farmasi Analisis. Cetakan I. Yogyakarta. Penerbit Pustaka Pelajar. P. 255.
56
Satterfield, C. N. (1991) Heterogenous Catalys in Industrial Practice (2nd ed). New York: Mc Graw-Hill, Inc. P. 18
Sietsma, J. R. A., J. D. Meeldijk, J. P. den Breejen, M. Versluijs-Helder, A. J. van Dillen, P. E. de Jongh, and K. P. de Jong. 2007. The Preparation of Supported NiO and Co3O4 Nanoparticles by the Nitric Oxide
Controlled Thermal Decomposition of Nitrates. Angew. Chem. Int. Ed. Vol.46. p. 4547 - 4549.
Skoog, D. A., dan Leary, J. J. 1992. Principle of Instrument Analysis 4th Ed. Saunders College Pub. P. 81
Sleiman, M., Daniel, V., Corinne, F., dan Jean-Marc, C. 2007. Photocatalytic degradation of azo dye Metanil yellow: Optimization and kinetic modeling using a chemometric approach. Applied Catalysis B: Environmental. 77 (1-2) : 1-11
Soderlind, F. 2008. Colloidal Synthesis of Metal Oxide Nanocrystals and Thin Films. Dissertation. Linkoping, Sweden. Linkoping University. P. 6-7 Sufida A. 2014. Recovery Limbah B3. Limbah Washing Percetakan. P. 2
Supriyanto, H. 2007. Pelapisan Nanomaterial TiO2 Fasa Anatase pada Nilon
Menggunakan Bahan Perekat Aica Aibon dan Aplikasinya sebagai Fotokatalis. Jurnal Nanosains dan Nanoteknologi Edisi Khusus, ISSN. 1997-088V.
T. Ihara, M. Miyoshi, Y. Iriyama. 2003. Visible-light-active titanium oxide photocatalyst realized by an oxygen-deficient structure and by nitrogen doping. Appl. Catal. B: Environ. Vol. 42. P. 403–409.
T. Ohno, M. Akiyoshi, T. Umebayashi. 2004. Preparation of S-doped TiO2
photocatalysts and their photocatalytic activities. Appl. Catal. A: Gen. Vol. 265, p. 115–123.
T. Tachikawa, Y. Takai, S. Tojo, M. Fujitsuka, H. Irie, K. Hashimoto, T. Majima. 2006. Phys. Chemistry. Vol. 110. P. 13158–13165.
Tanaka, K., Capule, M and Hisanaga, T. 1991. Effect of Crystallinity of TiO2 on
its Photocatalytic Action. Chemical Physics Letters, Vol. 187. p. 73-76.
57
Widihati, G. A., Ni Putu Diantariani, P. N., dan Nikmah, F.Y., 2011.
Fotodegradasi Metilen Biru dengan Sinar UV dan Katalis Al2O3.
Jurnal Kimia. Vol 5. p.31-42.
Young, R. A,. 1993. The Rietveld Method. International Union of Crystallography, Oxford University Press.
Yu.H., Li, X.J., Zheng, S.J., & Xu, W.2006. Photocatalytic activity
of TiO2 thin film non-uniformly doped by Ni. Material chemistry and Physics 97: 59-63.
Yuan, A., Chen, H., Hu, S. 2005. Fabrication of TiO2 Nanoparticles/Surfactant
Polymer Complex Film on Glassy Carbon Electrode and its Application to Sensing Trace Popamine. Materials Science and Engineering C, Vol. 25. P. 479-485.
Zallen, R and Moret, M. 2006. The Optical Absorption Edge of Brookite TiO2.
Solid State Communication, Vol. 137. P. 154-157. Zhang, Z., and Banfield, F. 2000. Understanding Polymorphic Phase
Transformation Behavior During Growth of Nanocrystalline Aggregates: Insights from TiO2. Journal Physic Chemistry B, Vol.