INDUKSI OVULASI DAN DERAJAT PENETASAN TELUR
IKAN HIKE (Labeobarbus longipinnis) DALAM PENANGKARAN
MENGGUNAKAN GnRH ANALOG
ERMA NAJMIYATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI TESIS
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis “Induksi Ovulasi dan Derajat Penetasan Telur Ikan Hike (Labeobarbus longipinnis) Dalam Penangkaran Menggunakan GnRH Analog” adalah karya saya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Februari 2009
ABSTRACT
ERMA NAJMIYATI. Ovulation induction and egg hachtability of hike fish (Labeobarbus longipinnis) with gonadothropin releasing hormone analogue (GnRHa) in ex situ cnservation pond. Conducted by TUTY L. YUSUF and ETTY RIANI.
Hike fish is an indigenous fish to Majalengka Regency, West Java, and their natural habitat is water territory of Prabu Siliwangi, Pajajar Village, Rajagaluh Subdistrict. The population of hike fishes has decreased due to the decreasing water debit in their natural habitat. In the prelimanary study conducted by the author, Hike fish was classified as Labeobarbus longipinnis, that has a flat and elongated body shape with pattern of blackish color scales in mediolateral body. Male has a more streamline body shape compared to female. It is observed that hike fishes live in water territory in the forest area with clear, low temperature and high dissolved oxygen water and they live in the bottom of stoney water. Regarding the ex situ conservation by breeding was conducted by ovulation induction with gonadothropin releasing hormone analogue (GnRHa) to produce the best ovulation and best egg quality to obtain optimum egg hatchability. The research was conducted in breeding pond in Kumbung Village, Rajagaluh Subdistrict, Majalengka Regency in April - August 2007 and February to June 2008. Females reaching post vitellogenic phase in gonad development, were injected intramuscularly with GnRHa at the doses of 8, 10 or 12µg/kgBW. The research using Completely Randomized Design and the obtained data were stastitically analyzed to find the effect of treatments and followed by Tukey’s test if significant different between treatments were found. The results indicated that the induction with GnRHa 8-12µg/kgBW resulted in the ovulation of hike fish and the hatching of eggs to larvas, latent period of 18.75 - 33.5hours, somatic gonad index of 10.34 – 12.14%, fecundity of 604 – 806eggs, egg diameter of 1.78 – 1.91mm, egg fertility of 44.0 – 83.0% and hatchability of 9.0 – 21.5%. Treatment with GnRHa at 12µg/kgBW resulted in the best results, especially to latent period and hatchabilty. Unsuccesful ovulation in females given with 8 or 10µg/kgBW GnRHa were caused by follicle atresia due to too small doses of hormone and due to the difference between water quality in the breeding habitat and in natural habitat, especially in hardness and water turbidity. The low hatchability are correlated with the COD increase during hatchability preparation in aquaria. It is suggested to conduct research on induction ovulation using a higher doses of GnRHa to obtain its optimum dose.
RINGKASAN
ERMA NAJMIYATI. Induksi Ovulasi dan Derajat Penetasan Telur Ikan Hike (Labeobarbus longipinnis) Dalam Penangkaran Menggunakan GnRH Analog. Dibimbing oleh TUTY L. YUSUF dan ETTY RIANI.
Ikan hike merupakan ikan indigenous dari Kabupaten Majalengka, Jawa Barat, tepatnya hidup di kawasan perairan Prabu Siliwangi, Desa Pajajar, Kecamatan Rajagaluh. Populasi ikan hike telah mengalami penurunan yang diakibatkan oleh perubahan habitat yaitu menurunnya debit air sehingga menyebabkan turunnya ketinggian genangan air pada habitat alami tersebut. Penelitian pendahuluan yang dilakukan oleh penulis mengungkapkan bahwa secara taksonomi ikan hike teridentifikasi sebagai Labeobarbus longipinnis. Ikan hike memiliki bentuk tubuh panjang dengan adanya pola sisik berwarna hitam pada bagian medio-lateral tubuh. Karakterisasi habitat alami ikan hike adalah perairan dalam kawasan hutan, airnya jernih berarus, bersuhu rendah, mengandung oksigen terlarut yang tinggi dan dasar perairan berbatu.
Dalam rangka konservasi ikan hike secara eks situ melalui penangkaran, telah dilakukan induksi ovulasi menggunakan gonadothropin releasing hormone analogue (GnRHa). Penggunaan GnRHa bertujuan menghasilkan ovulasi serta kualitas telur terbaik sehingga memberikan derajat penetasan telur yang optimum. Penelitian dilakukan pada kolam penangkaran di Desa Kumbung, Kecamatan Rajagaluh, Kabupaten Majalengka dari April-Agustus 2007 dan Pebruari-Juni 2008. Perlakuan diberikan terhadap ikan hike betina yang telah memasuki fase perkembangan gonad postvitelogenesis dengan injeksi GnRHa pada dosis 8, 10 atau 12 µg/kg berat badan secara intra muscular. Penelitian didesain dengan Rancangan Acak Lengkap dan data yang diperoleh dianalisis dengan sidik ragam untuk mengetahui pengaruh perlakuan. Selanjutnya jika terdapat perbedaan yang nyata antar perlakuan (P<0,05) dilanjutkan dengan uji lanjut Tukey’s
Hasil menunjukkan bahwa induksi GnRHa dengan dosis 8-12 µg/kg berat badan menghasilkan ovulasi pada ikan hike diikuti dengan keberhasilan telurnya menetas menghasilkan larva. Sedangkan terhadap parameter lain diperoleh hasil yaitu masa laten 18.75-33.5 jam, indek gonad somatik 10.34-12.14%, fekunditas 604-806 butir telur, diameter telur 1.78-1.91 mm, derajat terbuahi telur 44.0-83.0% dan derajat tetas telur 9.0-21.5%. Pada kisaran hasil tersebut, perlakuan induksi GnRHa pada dosis 12µg/kg berat badan memberikan hasil yang nyata lebih baik dibandingkan dengan perlakuan dosis 8 atau 10 µg/kg berat badan, khususnya pada parameter pangamatan masa laten dan derajat telur terbuahi.
© Hak cipta dilindungi Institut Pertanian Bogor, tahun 2009
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar terhadap IPB. 2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya
INDUKSI OVULASI DAN DERAJAT PENETASAN TELUR
IKAN HIKE (Labeobarbus longipinnis) DALAM PENANGKARAN
MENGGUNAKAN GnRH ANALOG
ERMA NAJMIYATI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Biologi Reproduksi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Tesis :Induksi Ovulasi dan Derajat Penetasan Telur Ikan Hike (Labeobarbus longipinnis) Dalam Penangkaran Menggunakan GnRH Analog
Nama : Erma Najmiyati Nomor Pokok : B051050041
Disetujui Komisi Pembimbing
Prof.Dr.drh. Tuty L. Yusuf, MS. Ketua
Dr.Ir. Etty Riani, MS. Anggota
Diketahui
Ketua Program Studi
Dr.drh. Iman Supriatna
Dekan Sekolah Pascasarjana IPB
Prof.Dr.Ir. Khairil Anwar Notodipuro, MS
KATA PENGANTAR
Puji dan syukur hanyalah milik Allah semata. Alhamdulillah Arrahman Arrahim, segala puji bagi Allah Yang Maha Pengasih dan Maha Penyayang. Hanya berkat ridlo-Nya, tesis dengan judul “Induksi Ovulasi dan Derajat Tetas Telur Ikan Hike (Labeobarbus longipinnis) dalam Penangkaran Menggunakan GnRH Analog” ini selesai disusun. Tesis ini merupakan salah satu syarat menyelesaikan pendidikan Program Magister Sains pada Program Studi Biologi Reproduksi, Sekolah Pascasarjana Institut Pertanian Bogor.
Hingga selesainya penyusunan tesis ini, penulis telah mendapat bantuan dari berbagai pihak. Pada kesempatan ini penulis menghaturkan terimakasih dengan segenap hormat kepada Komisi Pembimbing, Prof. Dr. drh. Tuty L.Yusuf, MS sebagai Pembimbing Ketua dan Dr. Ir. Etty Riani, MS sebagai Pembimbing Anggota, atas kemurahan waktu, kesempatan, perhatian dan bimbingannya. Terimakasih juga kepada Dr. drh. Amrozi, sebagai penguji luar komisi atas masukannya untuk perbaikan tesis ini.
Terimakasih dan penghargaan juga penulis sampaikan kepada Dra. Titiresmi, MS, Kepala Balai Teknologi Lingkungan, BPPT yang telah memberi ijin sekolah bagi penulis. Kiranya kebaikan senantiasa menyertai Dr.drh.Yanuarso Eddy Hedianto, MAgr dan Dr.drh.Umi Cahyaningsih, MS serta Esi Lisyastuti, SPt. sebagai balasan Allah atas doa, dukungan dan bantuannya kepada penulis dengan tanpa henti.
Penulis juga mengucapkan terimakasih kepada rekan-rekan seangkatan di BRP: Luh De, Roza, Pak Yan, Pak Madi dan terutama Pak Hurip yang sungguh telah banyak memberikan kesiapan untuk direpoti. Secara khusus penulis menyampaikan terimakasih untuk suami, ibu dan anak-anak qurratu ayyuni Nabiel dan Najmu atas doa dan limpahan cintanya
Penulis menyadari bahwa tesis ini masih jauh dari sempurna, namun penulis berharap tesis ini dapat memberi manfaat bagi para pembaca dan pecinta ilmu. Sekiranya ada masukan yang konstruktif, penulis berterimaksih untuk menerimanya.
RIWAYAT HIDUP
Penulis lahir di Welahan, Kabupaten Jepara, Jawa Tengah pada tanggal 28 Agustus 1969. Penulis merupakan anak keempat dari lima bersaudara dari pasangan Bapak Imron Syakur (alm) dan Ibu Zainab Achmad.
Pendidikan SD dan SMP diselasaikan di Jepara, masing-masing pada SDN 1 Welahan (1981) dan SMPN 1 Pecangaan (1984). Kemudian penulis meneruskan pendidikan lanjut di SMAN 1 Kudus (1987). Tahun 1988 penulis menempuh pendidikan tinggi di Fakultas Kedokteran Hewan IPB untuk mendapatkan gelar sarjana (1992) dan pendidikan profesi dokter hewan diselesaikan dari perguruan tinggi yang sama pada tahun 1994.
DAFTAR ISI
Pertumbuhan dan Perkembangan Gonad Ikan Betina ... 8
Mekanisme Reproduksi Hormonal pada Ikan Betina ... 14
Induksi Ovulasi Menggunakan GnRHa ... 16
Kualitas Telur ... 18
Indeks Gonad Somatik dan Fekunditas ... 42
Diameter Telur ... 46
Derajat Telur Terfertilisasi dan Derajat Tetas Telur ... 48
SIMPULAN DAN SARAN ... 63
Simpulan ... 63
Saran ... 64
DAFTAR PUSTAKA ... 65
DAFTAR TABEL
Halaman 1. Jumlah ikan percobaan dan perlakuan ... 28 2. Persentase keberhasilan ovulasi dengan induksi GnRHa ... 37 3. Nilai rataan lama masa laten, indeks gonad somatik, fekunditas, diameter
telur, derajat telur terbuahi dan derajat tetas telur ikan hike setelah
DAFTAR GAMBAR
Halaman 1. Induk Tor tambroides dengan bobot mencapai 20 kg pada kolam
pemeliharaan di Sarawak, Malaysia ... 8
2. Skematik terjadinya ovulasi telur oleh interaksi berbagai faktor ... 12
3. Skema garis besar mekanisme reproduksi hormonal ikan ... 14
4. Skematik penghambatan kerja dopamin ... 17
5. Bagan alir tahapan kegiatan dalam penelitian ... 29
6. Ikan hike (Labeobarbus longipinnis), fauna indigenous Majalengka ... 33
7. Ikan hike muda, warna sisik tubuh kuning keperakan ... 34
8. Bentuk tubuh pada ikan dewasa, jantan (bawah) lebih langsing daripada betina (atas) ... 34
9. Habitat asal ikan hike, perairan dengan beberapa sumber mata air dikelilingi hutan ... 36
10. Makroskopik telur ikan hike yang berhasil ovulasi ... 38
11. Makroskopik ovarium ikan hike yang tidak berhasil ovulasi ... 38
12. Histogram nilai rataan masa laten ikan hike setelah pemberian GnRHa ... 40
13. Skematik pematangan oosit ikan hingga terjadi ovulasi ... 41
14. Histogram nilai rataan IGS ikan hike setelah pemberian GnRHa ... 43
15. Histogram nilai rataan fekunditas ikan hike setelah pemberian GnRHa ... 43
16. Gambaran histologi ovarium ikan ike dengan 3 tingkat ukuran oosit ... 45
17. Histogram nilai rataan diameter telur ikan hike setelah pemberian GnRHa .... 46
18. Histogram derajat terbuahi telur ikan hike setelah induksi GnRHa ... 49
19. Gambaran mikroskopik telur ikan hike fertil, posisi inti sel di tepi dan warna lebih terang ... 49
20.Gambaran mikroskopik telur ikan hike setelah terfertilisasi ... 50
21. Histogram derajat tetas telur ikan hike setelah induksi GnRHa ... 51
22. Gambaran histologi ovarium ikan hike yang tidak berhasil mengovulasikan telur ... 52
DAFTAR LAMPIRAN
PENDAHULUAN
Latar Belakang
Ikan hike adalah nama lokal untuk spesies ikan liar endemik yang hidup pada perairan kawasan Pesanggrahan Prabu Siliwangi, Desa Pajajar, Kecamatan Rajagaluh, Kabupaten Majalengka yang berlokasi di kaki Gunung Ciremai. Berdasarkan penelitian pendahuluan oleh penulis, teridentifikasi bahwa secara taksonomis ikan hike memiliki nama Labeobarbus longipinnis. Ikan hike memiliki ciri spesifik yaitu tubuh pipih memanjang, sisik berwarna kuning dengan pola garis berwarna kehitaman pada sisik bagian medio-lateral tubuh.
Ikan marga Labeobarbus atau Tor tersebar di Asia Tenggara dan terdapat beberapa jenis yang ditemukan di perairan Indonesia yakni Labeobarbus tambroides, L. soro (ikan soro/batak), L. douronensis (ikan semah) dan L. tambra (ikan tambra) dan L. longipinnis. Kottelat et al. (1993) menegaskan bahwa ikan marga Labeoeobarbus pada umumnya merupakan jenis yang terancam punah, karena kerusakan hutan atau penangkapan yang berlebihan. Beberapa jenis ikan batak bahkan saat ini telah digolongkan sebagai ikan langka dan dimasukkan dalam jenis ikan terancam punah yang diterbitkan oleh IUCN tahun 1990. Penebangan hutan membawa akibat terhadap habitat ikan sebagaimana dilaporkan bahwa ikan marga Labeobarbus memiliki habitat spesifik pada perairan bagian hulu sungai di daerah perbukitan, terdapat arus air yang cukup kuat, warna air jernih, kandungan oksigen cukup tinggi, suhu air sejuk dan dasar perairan berbatu (Kiat 2004, Nontji 1992).
permasalahan di atas, telah menyebabkan populasi spesies ini pada habitat aslinya terus menurun.
Menurut Kottelat et al. (1993), genus Tor termasuk jenis ikan terancam punah yang disebabkan oleh kerusakan hutan dan penangkapan berlebih. Misalnya Tor putitora, ikan tersebut merupakan spesies mayor dalam perikanan komersial di India pada tahun 1960-an awal tetapi sekarang tergolong spesies yang terancam karena dampak degradasi lingkungan dan penangkapan berlebihan (Shrestha 2005). Hal yang serupa terjadi dengan genus Tor di Indonesia seperti yang dikemukakan oleh Gaffar et al. (1991) bahwa keberadaan spesies Tor di Jawa dan Sumatra sudah sangat kritis. Handoko dan Sihotang dalam Primack et al. (1998) menyebut bahwa secara umum ancaman yang sangat serius terhadap keberadaan ikan tambra adalah karena penurunan kualitas habitatnya.
Penangkapan berlebihan terhadap spesies Tor umumnya berlatar belakang alasan ekonomi karena harga ikan tersebut sangat tinggi yang diakibatkan oleh tingginya permintaan masyarakat karena daging ikannya terkenal lezat. Haryono (2006) menyatakan bahwa ikan semah memiliki nilai ekonomi tinggi seperti yang terjadi pada masyarakat Sumatra Selatan bahwa ikan semah yang mencapai ukuran satu kg biasanya dihidangkan pada acara tertentu yang prestisius, atau yang terjadi pada sebagian Masyarakat Batak bahwa ikan soro menjadi bagian penting pada upacara-upacara adat.
Kelestarian suatu spesies, terutama spesies liar yang telah mengalami penurunan populasi seperti halnya ikan hike sangat ditentukan oleh keadaan reproduksinya. Konservasi spesies di Indonesia dilakukan melalui pelestarian pada habitat aslinya dan program penangkaran. Penangkaran sebagai bagian upaya konservasi, dilakukan melalui pemeliharaan spesies secara eks situ dengan memperhatikan karakteristik habitat asal. Khususnya untuk konservasi spesies ikan, terdapat potensi yang sangat besar untuk dibudidayakan.
Ikan mengalami proses pematangan gonad, ovulasi dan pemijahan karena faktor lingkungan dan hormonal. Keadaan lingkungan seperti suhu, pH dan kualitas air maupun ketersediaan pakan secara alami berperan besar dalam memberikan stimulasi terhadap susunan syaraf pusat agar terjadi proses pematangan gonad. Ikan pada habitat alami akan mengalami proses perkembangan dan pematangan telur secara siklik setelah umur ikan mencapai dewasa dan berlangsung secara periodik karena pengaturan hormon-hormon reproduksi. Hal demikian tidak terjadi pada ikan-ikan liar yang dipelihara dalam habitat buatan (kolam penangkaran), karena kurangnya sekresi LH dari kelenjar hipofisisnya. Keadaan ini berakibat pada terganggunya proses pematangan akhir oosit (FOM/final oocyte maturation), ovulasi, spermiasi dan pemijahan. Oleh karena itu diperlukan intervensi hormon eksogen untuk menambah kecukupan LH akibat defisiensi peran lingkungan pada ikan hike yang dipelihara dalam kolam penangkaran.
Diantara preparat hormon eksogen, analog gonadotropin releasing hormone (GnRHa) dapat digunakan untuk menginduksi ovulasi. Mekanisme kerjanya adalah merangsang sekresi gonadotropin oleh kelenjar hipofisis. Selanjutnya hormon gonadotropin yakni GTH II atau luteinizing hormone (LH) akan menstimulasi gonad dengan pengaturan hormon steroid untuk terjadinya ovulasi. Kecukupan hormon dalam bentuk dosis hormon yang diinduksikan penting untuk menghasilkan ovulasi sekaligus dengan jumlah kualitas telur yang baik agar dapat meningkatkan perolehan larva yang berkualitas.
hike yang dilanjutkan dengan percobaan penetasan larvanya. Sejalan dengan itu juga akan diamati masa laten yang dibutuhkan untuk terjadinya ovulasi, indeks gonad somatik, angka fekunditas dan derajat terbuahi telur ikan hike. Lebih lanjut hasil penelitian ini diharapkan dapat memberikan kontribusi bagi upaya pembangunan suatu sistem pelestarian, penangkaran atau domestikasi yang tepat untuk ikan hike.
Kerangka Pemikiran
Penangkaran dapat dilakukan pada semua umur ikan. Namun penangkaran ikan pada usia dewasa (induk) akan memberikan lebih banyak hasil jika dilanjutkan hingga pemijahan dan penetasan larva. Untuk keperluan tersebut maka induk yang layak dipijahkan adalah induk yang telah melewati fase pembentukan kuning telur (fase vitelogenesis) atau memasuki fase dorman. Apabila rangsangan diberikan setelah saat fase vitelogenesis atau dorman, akan menyebabkan pematangan oosit, ovulasi (pecahnya folikel) dan oviposisi. Tetapi kondisi lingkungan pada habitat penangkaran seringkali kurang sesuai seperti habitat asli sehingga kurang memenuhi faktor stimulasi lingkungan terhadap otak sebagai pemicu awal berjalannya proses pematangan telur dalam sistem reproduksi ikan. .
Manipulasi hormon yang diaplikasikan untuk menambah kecukupan LH akibat defisiensi peran lingkungan pada ikan hike yang dipelihara dalam kolam penangkaran pada penelitian ini adalah dengan induksi analog GnRH (GnRHa). Pemberian GnRHa dilakukan melalui injeksi intra muskular dalam 2 tahap dengan jarak waktu injeksi 12 jam mengingat kerja hormon membutuhkan waktu paruh sekitar 5 jam. Injeksi GnRHa setengah dosis yang pertama dimaksudkan untuk menyerentakkan kematangan sel telur secara sempurna. Berikutnya injeksi GnRHa setengah dosis yang kedua dimaksudkan untuk pelepasan sel telur dari ovarium.
merupakan hormon penginduksi pematangan oosit tahap akhir serta ovulasi disertai peningkatan jumlah telur yang terovulasi dan kualitas telur yang baik. Selanjutnya kualitas telur yang baik akan meningkatkan jumlah perolehan larva berkualitas baik yang akan berguna untuk penangkaran lebih lanjut.
Tujuan Penelitian
Secara umum penelitian ini mempelajari karakter reproduksi ikan hike (Labeobarbus longipinnis) betina yang dipelihara dalam kolam penangkaran dengan melakukan injeksi preparat analog gonadotropin releasing hormone maka secara rinci, tujuan penelitian ini adalah :
1. Mengetahui karakter habitat asal ikan sebagai dasar referensi pemeliharaan ikan hike pada kolam penangkaran.
2. Menentukan dosis GnRHa yang mampu menghasilkan ovulasi dan kualitas telur terbaik pada induk ikan hike postvitellogenic.
3. Mengetahui beberapa karakter reproduksi ikan hike betina setelah induksi GnRHa, berkaitan dengan masa laten, indeks gonad somatik dan angka fekunditas serta melihat keberhasilan pembuahan dan penetasan telur ikan.
Manfaat Penelitian
Hipotesis
Hipotesis yang dikemukakan dalam penelitian ini adalah bahwa dengan injeksi analog gonadotropin releasing hormone (GnRHa) :
1. Maka akan terjadi ovulasi pada ikan hike betina yang telah memasuki fase telur postvitellogenic.
2. Dalam dosis yang tepat akan meningkatkan kualitas telur ikan hike.
TINJAUAN PUSTAKA
Ikan Genus Labeobarbus
Haryono (2006) mengemukakan bahwa di seluruh dunia terdapat 20 jenis kerabat ikan tambra (genus Labeobarbus atau Tor) yang empat jenis diantaranya telah ditemukan di perairan Indonesia yakni Tor tambroides, Tor soro (ikan batak), Tor douronensis (ikan semah) dan Tor tambra (ikan tambra). Sementara Saanin (1984) menyebutkan bahwa selain keempat spesies tersebut, ditemukan pula Labeobarbus longipinnis yang memiliki nama lokal ikan pidjen.
Kottelat et al. (1993) telah merevisi nama genus Labeobarbus menjadi Tor tetapi tidak terdapat pentelaan terhadap L. longipinnis. Secara morfologis Saanin (1984) menyebutkan bahwa genus Labeobarbus memiliki ciri jari-jari sirip punggung yang licin, kepala tidak berkerucut, antara garis rusuk dan sirip punggung terdapat tiga setengah baris sisik.
Menurut Shrestha (2005), genus Tor atau Labeobarbus memiliki wilayah penyebaran di kawasan Trans Himalaya (Pakistan, Nepal, India dan Myanmar) dan di kawasan Asia Tenggara seperti Thailand, Laos, Kamboja, Vietnam, Malaysia, Kalimantan, Sumatra dan Jawa. Haryono (2006) mengemukakan bahwa di Indonesia, spesies Tor diantaranya ditemukan di perairan hulu Kalimantan Tengah yakni T. tambroides sedang T. soro dan T. douronensis ditemukan di Sumatra dan Jawa. Di Kabupaten Kuningan, ditemukan spesies Tor dengan nama lokal ikan dewa.
Di Malaysia, telah dilaporkan keberhasilan pembiakan beberapa spesies ikan liar asal sungai yang telah menurun populasinya dan memiliki harga mahal termasuk genus Tor, yaitu ikan semah dan emparau (De Silva et al. 2004). Sedangkan di India, Pandey et al. (1998) telah berhasil melakukan pemijahan secara buatan untuk Tor putitora. Lalu Shrestha (2002) menyebutkan bahwa telah diuji pemeliharaan spesies Tor putitora dan Tor tor pada kolam-kolam penangkaran yang memiliki air bersirkulasi terbuka di Wilayah Nepal (India).
De Silva et al. (2004) juga melaporkan bahwa di Serawak, Malaysia, telah berhasil ditangkarkan beberapa spesies ikan sungai yang telah menurun populasinya di alam dan memiliki harga mahal termasuk ikan mahseer dari spesies T. tambroides dan T. duoronensis. Kedua spesies Tor tersebut ditangkarkan selain karena alasan konservasi juga karena dianggap bernilai ekonomi tinggi serta memiliki ukuran tubuh besar (Gambar 1).
Gambar 1 Induk Tor tambroides dengan bobot mencapai 20 kg pada kolam pemeliharaan di Sarawak, Malaysia (De Silva et al. 2004)
Pertumbuhan dan Perkembangan Gonad Ikan Betina
Pada ovarium ikan, terdapat bakal sel telur yang dilindungi suatu jaringan pengikat yang bagian luarnya dilapisi peritoneum dan bagian dalamnya dilapisi epitelium. Sebagian dari sel-sel epitelium akan membesar, berisi nukleus dan kemudian butiran ini kelak akan menjadi telur. Selama perkembangannya, ukuran oosit akan bervariasi. Pada tahap perkembangan awal, oogonia terlihat masih sangat kecil, berbentuk bulat dengan inti sel yang sangat besar dibandingkan dengan sitoplasmanya. Oogonia terlihat berkelompok tapi kadang-kadang ada juga yang berbentuk tunggal.
Pada kebanyakan spesies non mamalia, oosit mencapai ukuran akhir selama vitelogenesis dan memulai tahap pematangan serta ovulasi bila ada stimulasi hormonal yang cukup. Nagahama (1987a) memaparkan bahwa perubahan pada oosit dikendalikan oleh sistem syaraf pusat sebagai respon terhadap perubahan lingkungan dengan peran tiga mediator utama yaitu gonadotropin (GTH), MIH (maturation inducing hormone) dan MPF (maturation promoting factor). Sinyal lingkungan yang ditangkap oleh sistem syaraf kemudian direspon oleh hipotalamus dengan mensekresikan gonadotropin releasing hormone (GnRH) yang menstimulasi pelepasan gonadotropin pituitari baik GTH I atau FSH maupun GTH II (LH). Menurut Yaron (1995), kedua substansi gonadotropin bekerja menstimulasi sekresi estradiol dari folikel, akan tetapi GTH II lebih poten menstimulasi sekresi 17,20-P dari folikel postvitelogenik. Pengaruh umpan balik seks steroid juga digunakan pada tingkat hipofisis dan otak untuk memungkinkan terjadinya integrasi dengan isyarat lingkungan untuk merangsang terjadinya peningkatan GTH II preovulasi. Peran utama yang mengatur sekresi GTH II dari hipofisis pada ikan adalah GnRH dalam bentuk [Trp7, Leu8]-GnRH.
- Fase kromatin nukleolus, ditandai dengan adanya sebuah nukleus yang terlihat kompak dengan satu nukleolus yang relatif besar, ukuran folikel relatif kecil dengan sitoplasma terpulas zat warna dengan kuat mencirikan ovarium masih belum berkembang.
- Fase perinuklear, ditandai adanya nukleus dan beberapa nukleoli kecil pada tepi nukleoplasma.
- Fase kortikal alveoli, ditandai adanya butir-butir lipid di sekitar vesikula germinalis dengan ukuran oosit lebih besar.
- Fase vitelogenik, ditandai dengan dipenuhinya ruang sitoplasmik oleh butiran-butiran lemak.
Sementara itu berkaitan dengan periode waktu pemijahan, Wallace dan Selman (1981) membedakan ovarium menjadi 3 tipe, yaitu (1) sinkronisme total yaitu seluruh oosit berada pada tingkat perkembangan atau stadia yang sama, (2) sinkronisme per grup yaitu sedikitnya terdapat 2 populasi oosit yang berada dalam stadia yang sama dan (3) asinkronisme yaitu oosit pada ovarium terdiri dari semua stadia. Berdasarkan hal tersebut, lamanya jangka pemijahan pada ikan dapat diduga dari ukuran diameter telur. Jika waktu pemijahan pendek, semua telur matang yang terdapat dalam ovarium berukuran sama. Tetapi bila waktu pemijahan pada kisaran waktu yang lama maka ukuran telur yang berada dalam ovarium berbeda-beda.
Butir-butir lemak ini selanjutnya akan bertambah besar pada vitelogenesis yang diawali dengan pembentukan vakuola-vakuola yang kemudian diikuti dengan munculnya globula kuning telur, bersamaan dengan itu oosit membengkak secara menyolok. Kuning telur pada ikan terdiri atas fosfoprotein dan lipoprotein yang dihasilkan oleh hati kemudian disalurkan ke dalam peredaran darah. Pembesaran oosit disebabkan terutama oleh penimbunan kuning telur. Pada kebanyakan ikan, kuning telur merupakan komponen penting oosit ikan teleostei.
Fenomena penimbunan material kuning telur oleh oosit ikan dibagi menjadi dua fase, yakni sintesis kuning telur di dalam oosit atau vitelogenesis endogen dan penimbunan prekursor (bahan pembentuk) kuning telur yang disintesis di luar oosit atau vitelogenesis eksogen (Matty 1985). Gelembung kuning telur positif-PAS (mukopolisakarida atau glikoprotein) umumnya merupakan struktur yang pertama muncul dalam sitoplasma oosit selama pertumbuhan sekunder oosit, dan pertama kali muncul di zona terluar dan zona midkortikal pada oosit. Ketika vitelogenesis berlangsung, sebagian besar sitoplasma telur matang ditempati oleh banyak gelembung kuning telur yang padat dengan asam lemak dan dikelilingi oleh selapis membran pembatas. Selama tahap akhir vitelogenesis, globula kuning telur akan bergabung satu sama lain membentuk masa tunggal kuning telur.
Woynarovich dan Horvath (1980) menyatakan bahwa pada saat menjelang ovulasi akan terjadi peningkatan diameter oosit karena pengisian oleh massa kuning telur yang homogen akibat adanya peningkatan kadar estrogen dan vitelogenin. Selanjutnya dinyatakan bahwa induk yang pantas dipijahkan adalah induk yang telah melewati fase pembentukan kuning telur (fase vitelogenesis) dan masuk ke fase dorman (istirahat). Fase pembentukan kuning telur dimulai sejak terjadinya penumpukan bahan-bahan kuning telur da!am sel telur dan berakhir setelah sel telur mencapai ukuran tertentu atau nukleolus tertarik ke tengah nukleus. Setelah fase pembentukan kuning telur berakhir, sel telur tidak mengalami perubahan bentuk selama beberapa saat, yang disebut fase istirahat.
pada saat pematangan oosit, ovulasi (pecahnya folikel) dan oviposisi (Lam 1985). Sebaliknya bilamana kondisi lingkungan tidak cocok dan rangsangan tidak tersedia pada fase dorman tersebut maka oosit akan mengalami degenerasi lalu diserap kembali oleh lapisan folikel melalui atresia (Suyanto 1986). Faktor-faktor eksternal lain yang menyebabkan terjadinya atresia adalah ketersediaan pakan (Bagenal 1978), sedangkan faktor internal adalah umur telur.
Yaron (1995) menyatakan bahwa secara hormonal, akhir proses vitelogenesis berpuncak pada pembentukan 17α-hydroxyprogesteron yang terjadi pada sel teka. Steroid ini akan berdifusi ke dalam sel granulosa dan dikonversi menjadi 17α, 20β -dyhidroxy-4-pregnen-3-one, yang merupakan hormon penginduksi maturasi (MIH) pada kebanyakan spesies ikan (Nagahama 1987b). Maka setelah oosit melewati fase vitelogenesis masih diperlukan berbagai faktor lain agar folikel mencapai tahap pematangan akhir dan terjadi ovulasi. Brooks et al. (1997) merangkumnya seperti terlihat pada Gambar 2.
Seperti pada kebanyakan vertebrata, oosit ikan yang sudah mencapai pematangan tahap akhir belum dapat dibuahi dan harus mencapai tahap akhir penyelesaian pembelahan meiotik dan perubahan struktur oosit. Proses tersebut meliputi GVBD, kondensasi kromosom, pembentukan spindel meiotik pertama, pelepasan polar bodi pertama dan pembentukan mikrofil sebagai saluran masuknya spermatozoa ketika terjadi fertilisasi (Nagahama 1987b).
Hoar (1972) menyatakan bahwa selama proses vitelogenesis juga terjadi penambahan ketebalan pada zona radiata, perkembangan retikulum endoplasma di dalam granulosa dan sel-sel teka. Tahap berikutnya dari perkembangan telur atau tahap pematangan adalah tahap pergerakan inti ke bagian tepi dan akhirnya melebur membentuk pronukleus dan badan polar I. Inti bergerak mendekati mikropil pada kutub animal telur untuk memudahkan terjadinya pembuahan.
Selama tahap vitelogenesis dan pematangan gonad akan dihasilkan peningkatan volume granula kuning telur dan meningkatnya ukuran oosit. Maka nilai-nilai yang berkaitan dengan TKG (tingkat kematangan gonad), IGS (indeks gonad somatik) dan GVBD seringkali dijadikan sebagai indikator terhadap kematangan oosit akibat berkumpulnya butiran kuning telur atau lempengan lipid yang kemudian diikuti dengan migrasi inti. Semakin bertambah tingkat kematangan gonad, telur yang ada dalam gonad akan semakin besar (Hoar 1972).
Menurut Effendie (2002), pertumbuhan bobot gonad ikan betina pada stadium matang gonad dapat mencapai 10-25 persen dari bobot tubuh. Tyler dan Sumpter (1996) menyebutkan bahwa sifat reproduksi ikan menentukan pola perkembangan ovarium. Pada ikan dengan tipe pemijahan sinkronous, IGS berkisar antara 18-25% bahkan kadang mencapai 40%, seperti pada Anguilla japonica. Sedangkan pada ikan dengan tipe pemijahan asinkronous, angka IGS lebih rendah daripada ikan dengan tipe pemijahan sinkronous.
masih dengan spesies L. douronensis dalam ukuran panjang ikan antara 10,5-17,1 cm memiliki kisaran IGS 0,11-0,58.
Mekanisme Reproduksi Hormonal pada Ikan Betina
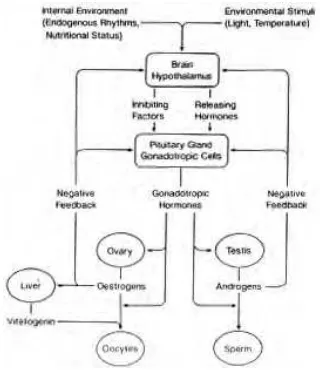
Pematangan gonad dan ovulasi pada ikan merupakan suatu proses di bawah kendali kerja hormon-hormon. Secara umum mekanisme kerja hormon untuk perkembangan dan pematangan gonad merupakan suatu rangkaian. Yaron (1995) menyatakan bahwa hormon-hormon yang terlibat dalam reproduksi ikan berasal dari tiga bagian utama, yaitu (1) hipotalamus, (2) hipofisis dan (3) gonadotropin. Secara ringkas, mekanisme hormonal untuk pengaturan sistem reproduksi ini dapat dilihat pada Gambar 3.
Rangsangan untuk mensintesis hormon GnRH (gonadotropin releasing hormone) diterima oleh hipotalamus dari otak (susunan syaraf pusat) melalui reseptor-reseptor yang menerima rangsangan dari luar atau lingkungan. Reseptor penginderaan merupakan penerima rangsangan tersebut, seperti visual untuk fotoperiod dan lawan jenis, kemoreseptor untuk suhu, metabolit dan sebagainya. Stimulasi oleh adanya pelepasan GnRH dari hipotalamus menyebabkan kelenjar hipofisis mensekresikan gonadotropin (GTH) untuk dialirkan ke dalam darah. Selain GnRH yang bersifat memacu, dalam hipotalamus juga dikeluarkan subtansi penghambat pelepasan GTH yaitu dopamin.
Hormon gonadotropin sebagai produk hipofisis yang dialirkan lewat darah, dalam kadar tertentu akan merangsang pertumbuhan dan kematangan gonad akhir melalui stimulasi dan sintesis hormon-hormon steroid dalam ovarium. Pada spesies ikan, hormon gonadotropin terdiri dua macam yaitu GTH I dan GTH II yang berbeda dalam senyawa glikoproteinnya. GTH I berperan dalam perkembangan gonad sedangkan GTH II berperan dalam pematangan gonad dan pemijahan. Pada ikan salmon, penelitian terhadap GTH II menunjukkan perannya pada pematangan tahap akhir dan ovulasi serta spermiasi seperti peran LH pada mamalia (Tyler 1991). Sedangkan GTH I secara in vitro menunjukkan perannya pada saat steroidogenesis dan mempengaruhi penyerapan prekursor kuning telur vitelogenin pada ikan salmon (Tyler et al. 1997). Pada ikan jantan, steroid adalah testoteron yang mengontrol pematangan spermaozoa, diproduksi oleh sel Leydig pada testis. Sedangkan pada ikan betina, hormon steroid yang berpengaruh langsung terhadap pematangan sel telur dikenal sebagai hormon estrogen dan disekresi oleh sel intersitial folikel di ovarium. Sedangkan progesteron yang dikenal sebagai steroid yang dihasilkan oleh sel perifer dari ovarium, pengaruhnya hanya pada pematangan akhir oosit saja (Yaron 1995).
di kelenjar hipofisis. Selanjutnya kelenjar hipofisis akan melepaskan hormon GTH I yang bekerja di lapisan teka pada oosit (Yaron 1995).
Akibat kerja hormon GTH I pada ovarium, lapisan teka akan mensintesis testosteron. Selanjutnya pada lapisan granulosa, testosteron akan diubah menjadi estradiol-17β oleh enzim aromatase. Estradiol-17β akan merangsang hati untuk mensintesis vitelogenin yang merupakan bakal kuning telur. Melalui aliran darah, vitelogenin akan diserap secara selektif oleh lapisan folikel oosit. Proses inilah yang dikenal dengan vitelogenesis, sedangkan proses selanjutnya adalah pematangan akhir yang di dalamnya terjadi pergerakan inti telur ke tepi atau germinal vesicle breakdown (GVBD) dan ovulasi yang ditandai dengan pecahnya lapisan folikel dan keluarnya telur ke dalam rongga ovari (Yaron 1995).
Induksi Ovulasi Menggunakan GnRHa
Terdapat banyak ikan budidaya yang tidak mampu memijah secara spontan di dalam kolam budidaya karena kurangnya sekresi gonadotropin II (LH) dari kelenjar hipofisisnya. Keadaan ini berakibat terganggunya proses pematangan akhir oosit (FOM/ final oocyte maturation), ovulasi, spermiasi dan pemijahan. Hal yang serupa juga terjadi pada ikan yang dipelihara untuk penangkaran. Ikan-ikan tersebut membutuhkan induktor hormon dari eksternal untuk menambah kecukupan LHRH-nya yang secara alami telah terganggu oleh mekanisme introduksi budidaya (Zairin 2006).
Dalam rangka mencukupi kadar LHRH atau GnRH maka ovulasi pada ikan-ikan yang diintrodusir atau sedang dalam proses penangkaran, dilakukan dengan induksi menggunakan hormon eksogen yang cukup efektif untuk menginduksi pematangan oosit dan ovulasi pada ikan. Akan tetapi karena secara komparatif dibutuhkan dosis LHRH yang besar dan injeksi yang lebih frekuen dalam penggunaanya, maka kemudian disintesa analog LHRH (LHRHa) atau analog GnRH (GnRHa) untuk menggantikan LHRH atau GnRH.
dalam bentuk [Trp7, Leu8]-GnRH (salmon GnRH atau sGNRH) yang digunakan untuk memudahkan pekerjaan pemijahan (Nagahama, 1987b). Preparat GnRH analog berperan seperti LHRH untuk merangsang hipofisis agar melepaskan gonadotropin. Gonadotropin yang disekresikan akan mencapai gonad sebagai target organ untuk mempercepat terjadinya pematangan oosit pada induk.
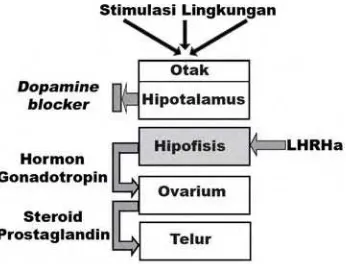
Ovaprim merupakan salah satu preparat komersial yang isinya merupakan kombinasi dari analog salmon gonadotropin releasing hormone (s-GnRHa) dan anti dopamin. Setiap 1 ml ovaprim mengandung 20 µg sGnRH-a (D-Arg6, Trip7, Leu8, Pro9-NET) – LHRH dan 10 mg anti dopamin. Hormon ini telah ditemukan sejak tahun 1980-an yang dapat disimpan dalam suhu kamar dalam jangka waktu melebihi setahun dan dapat digunakan secara langsung.
Analog GnRH dalam ovaprim merupakan hormon sintetis analog dengan gonadotropin ikan salmon yang terdapat hampir pada seluruh jenis ikan. Di samping itu, kandungan antidopamin (dopamine blocker) dalam ovaprim juga akan berperan menghambat kerja dopamin. Secara alami dopamin menghambat kerja gonadotropin sehingga dengan memberikan antagonis dopamin maka peranan dopamin akan terhenti dan sekresi gonadotropin tetap meningkat setelah pemberian GnRHa. Pada beberapa spesies ikan, dopamin ditemukan menghambat pelepasan hormon gonadotropin oleh hipofisis sehingga terjadi penghambatan respon positif hipofisis terhadap injeksi GnRH analog. Guna mengurangi penghambatan dopamin, beberapa preparat digunakan dengan fungsi mampu bekerja sebagai dopamine blocker seperti domperidon, haloperidol dan metoclopromid (Rottman et al. 1991).
Berdasarkan gambar di atas juga diketahui bahwa selain GTH II, prostaglandin juga berperan dalam ovulasi. Sebagaimana yang dikemukakan oleh Syarial (1988) bahwa prostaglandin diketahui merupakan mediator kerja pecahnya folikel (ovulasi) pada ikan. Mekanisme kerja hormon dalam terjadinya ovulasi dikemukakan oleh Tang dan Affandi (2000) bahwa prostagladin bersama dengan hormon LH akan mempertinggi aktivitas enzim proteolitik di folikel sehingga akan menstimulasi inti sel telur yang berada di tengah untuk bergerak ke pinggir dan selanjutnya melebur menuju kutub animal, yang berarti telur siap diovulasikan.
Brzuska (2006) menyatakan bahwa pemijahan buatan pada ikan mas dengan perlakuan GnRHa dan dopamineblocker memberikan persentase hasil pemijahan yang baik. Pandey et al. (1998) berhasil menginduksi pemijahan ikan mahseer Tor putitora dengan tingkat fertilisasi 70-80% dan tingkat penetasan 60-65%.
Dosis GnRHa yang digunakan untuk memijahkan ikan umumnya adalah 10µg per kg berat badan. Dalam sediaan cair, khususnya penggunaan ovaprim, dosis yang dipakai untuk merangsang ovulasi pada ikan betina adalah 0,5 ml/kg bobot tubuh sedangkan untuk merangsang spermiasi pada ikan jantan adalah 0,10-0,20 ml/kg bobot tubuh (Pandey et al. 1998). Ompok bimaculatus, satu spesies terancam punah di India juga telah berhasil dibiakkan dalam habitat penangkaran dengan injeksi ovaprim (Sridhar et al. 1998).
Kualitas Telur
terjadi peningkatan produksi prostaglandin (hormon induktor ovulasi) pada ikan yellow perch ketika dipaparkan dengan MIH (17α, 20β-dyhidroxy-4-pregnen-3-one).
Definisi kualitas telur yang umum digunakan adalah kemampuan telur untuk menghasilkan benih yang baik. Potensi telur untuk menghasilkan benih yang baik ditentukan oleh beberapa faktor, yakni faktor fisik, genetik dan kimia selama terjadi proses perkembangan telur. Jika satu dari faktor esensial ini tidak ada maka telur tidak berkembang dalam beberapa stadia.
Menurut Brooks et al. (1997), kualitas telur ikan sangat bervariasi tergantung dari faktor-faktor yang mempengaruhinya. Sedikitnya terdapat 2 faktor yang mempengaruhi kualitas telur, yakni faktor intrinsik telur dan faktor lingkungan yang memberikan pengaruh selama telur difertilisasi hingga menetas. Komponen penting yang mempengaruhi kualitas telur diantaranya adalah keadaan endokrin pada induk selama pertumbuhan oosit di dalam ovarium, diet dan nutrisi induk yang langsung berhubungan dengan oosit dan keadaan fisiko-kimia air selama telur diinkubasikan serta pengaruh genetik induk. Bahkan aspek genetik induk juga berpengaruh terhadap fekunditas.
Menurut Bromage et al. (1992), kualitas telur yang baik digambarkan dengan rendahnya tingkat mortalitas pada saat fertilisasi, penetasan dan first feeding. Selanjutnya Kjorsvik et al. (1990) menyebut bahwa penampilan zona pelucida, bentuk telur, transparansi dan distribusi globul minyak merupakan hal-hal yang berhubungan dengan kualitas telur.
Sedangkan ukuran ruang perivitelin menentukan ukuran sel telur setelah kontak dengan air.
Telur yang belum dibuahi bagian luarnya dilapisi oleh selaput yang dinamakan selaput kapsul atau khorion. Di bawah khorion terdapat selaput yang kedua dinamakan selaput vitelin. Selaput yang mengelilingi plasma telur dinamakan selaput plasma. Ketiga selaput ini semuanya menempel satu sama lain dan tidak terdapat ruang diantaranya. Lapisan vitelin pada ikan mas mempunyai ukuran ketebalan 10.0-10.2 μm dan mempunyai struktur yang komplek dan terdiri dari empat lapisan yang penamaannya berbeda berdasarkan penemu (Linhart et al. 1995). Lapisan bagian luar terdiri 2 bagian berdasarkan perbedaan sitokimia. Selanjutnya dikatakan bahwa kedua lapisan ini kaya akan protein.
Selama oogenesis kuning telur mengakumulasi sejumlah besar granula kuning telur dan lipid yang terisi pada bagian tengah. Diameter granula berkisar antara 6-24 μm. Jumlah dan distribusi dari lemak (butir lemak) sangat bervariasi dengan diameter 1-1.5 μm (Linhart et al. 1995). Distribusi dari butir-butir lemak ini juga menjadi parameter kualitas telur. Selama oogenesis, salah satu yang paling menyolok adalah pembentukan sebuah zona tebal yang sangat berdiferensiasi yang terdiri dari membran telur, membran vitelin, zona radiata, zona pelusida dan terletak diantara lapisan-lapisan granulosa dan oosit. Bergantung pada spesies dan tahap pertumbuhan oosit, membran telur bervariasi dalam hal ketebalan. Tebalnya 7-8 μm pada oosit ikan mas koki dan sekitar 30 μm pada rainbow trout (Kjorsvik et al. 1990) .
Perubahan morfologi yang dialami membran mencerminkan adaptasi terhadap berbagai kondisi ekologi. Membran telur ini banyak mengandung protein dan karbohidrat. Belum dapat dipisahkan apakah asal membran ini dari oosit atau dari sel folikel atau dari kedua-duanya. Pada oosit kuda laut, Hippocampus erectus dan ikan pipa Syngnathus fuscus, membran dibentuk oleh oosit, sehingga diklasifikasikan sebagai selubung primer (Nagahama 1983).
dan ini menjadi dasar untuk perkembangan embrio selanjutnya. Kerusakan pada sel ini akan mempengaruhi perkembangan akhir dari embrio, dan akhirnya akan terjadi kerusakan pada salah satu sel dalam perkembangannya. Pengamatan juga termasuk melihat simetri pembelahan awal serta banyaknya embrio dan larva yang cacat.
Ukuran telur juga menjadi parameter dalam penentuan kualitas telur. Ukuran telur dapat dinyatakan dalam banyak cara. Diameter tunggal yang biasa digunakan, tetapi diameter terpanjang juga kadang-kadang digunakan. Selain itu panjang telur dan lebar telur juga digunakan. Ukuran-ukuran telur yang lain mencakup volume telur, bobot basah dan bobot kering. Dari segi energetika istilah terbaik untuk ukuran telur adalah kandungan energi per telur atau joule per telur. Kalori telur menunjukkan jumlah energi yang tersedia bagi embrio untuk berkembangan. Ukuran telur berkorelasi dengan ukuran larva. Larva yang besar lebih tahan tanpa pakan dibandingkan dengan larva berukuran kecil yang dipijahkan dari telur kecil. Hubungan positif antara ukuran larva dan ukuran telur telah dilaporkan untuk Salmo salar, Onchorhynchus mykiss, Onchorhynchus keta, dan Clupea harengus (Kamler 1992). Keuntungan ukuran awal yang dimiliki larva yang menetas dari telur besar dapat kurang berarti selama perkembangan selanjutnya, atau bahkan hilang. Pada Salmo salar keuntungan ini hilang setelah 5 minggu pertama pertumbuhan; pada Oncorhynchus mykiss keuntungan ini hilang setelah 16 minggu (Kamler 1992).
Kemampuan larva yang kecil untuk bertumbuh sehingga mempunyai kecepatan yang sama dengan larva yang lebih besar sangat penting untuk tujuan komersial. Potensi yang sangat penting adalah menemukan kelangsungan hidup telur dan larva tidak dipengaruhi oleh ukuran telur (Kjorsvik et al. 1990).
Hardjamulia dalam Emmawati et al. (2005) menyebutkan bahwa diameter telur ikan mas dari 4 strian yang ditemukan di Indonesia sangat bervariasi, dari yang paling kecil yakni strain Sinyonya 0,13 mm dan yang terbesar strain Majalaya 0,9-1,6 mm. Rai et al. (2006) menyebutkan bahwa ikan spesies mahseer yakni Tor putitora yang dipelihara dalam kolam penangkaran di Nepal memiliki diameter telur 2,8-3,02 mm. Hardjamulia et al. (1995) menyatakan bahwa pada pemeliharaan keramba jaring apung, ikan semah (Tor douronensis) memiliki telur matang dengan diameter sekitar 2,5 mm. Sementara hasil pengamatan Rupawan et al. (1999) terhadap ikan semah hasil penangkapan dari Jambi dengan tingkat kematangan gonad IV memiliki dimeter telur 2,16-3,18 mm.
Pembuahan dan Penetasan Telur
Pembuahan atau fertilisasi merupakan asosiasi gamet, dimana asosiasi ini merupakan mata rantai awal dan sangat penting pada proses fertilisasi. Rasio pembuahan sering digunakan sebagai parameter untuk mendeteksi kualitas telur. Penggabungan gamet biasanya disertai dengan pengaktifan telur. Selama fertilisasi dan pengaktifan, telur-telur ikan teleostei mengalami reaksi kortikal. Kortikal alveoli melebur, melepaskan cairan koloids, dan selanjutnya memulai pembentukan ruang periviteline (Yamamoto dalam Kjorsvik et al. 1990). Kortikal alveoli muncul setelah terjadinya fertilisasi dan reaksi kortikal yang tidak lengkap menunjukkan kualitas telur yang jelek. Beberapa hal yang mempengaruhi pembuahan adalah berat telur ketika terjadi pembengkakan oleh air, pH cairan ovari, dan konsentrasi protein (Lahnsteiner et al. 2001).
sempit sehingga diameter telur tidak berkembang (Kjorsvik et al. 1984). Pengerasan korion telur selama proses aktivasi akibat dari reaksi enzim. Telur yang kualitasnya bagus memiliki korion yang keras. Selain hal-hal di atas parameter lain yang dapat juga menjadi patokan kualitas telur adalah transparansi telur dan distribusi butiran lemak (Mc. Evoy 1984). Kualitas telur yang baik umumnya transparan dan jelas kelihatan serta pembelahan awal yang simetris.
Menurut Lagler et al. (1972), selama pembuahan, penetrasi akan menghasilkan (1) masuknya spermatozoa melalui perubahan kondisi di dalam sel telur, (2) penggabungan materi inti spermatozoa dan sel telur, (3) pembelahan dari satu sel zigot menjadi suatu embrio yang memiliki banyak sel dan (4) organisasi dari multi seluler menjadi organ dan sistem yang memberi bentuk dan fungsi pada embrio. Sumantadinata 1983 menyatakan bahwa setelah memasuki telur, inti spermatozoa mulai membesar dan kromosom mengalami perubahan sehingga memungkinkan untuk bersatu dengan kromosom dari sel telur sebagai fase awal pembelahan. Selanjutnya perkembangan embrio terus terjadi dari mulai terjadinya pembuahan hingga ikan mendapatkan makanan dari luar. Perkembangan tersebut dibedakan menjadi periode telur dimana terjadi perkembangan di dalam membran dan periode pra larva yaitu perkembangan terjadi di luar membran.
Effendie (2002) menyebutkan bahwa pembuahan ikan teleos pada umumnya bersifat monospermik. Pada proses pembuahan, hanya kepala spermatozoa yang dapat masuk ke dalam sel telur sedangkan ekor spermatozoa tertinggal di luar. Sitoplasma dan khorion merenggang dan terbentuk semacam sumbat yang segera menutupi mikrofil untuk menghalangi masuknya spermatozoa yang lain.
Kjorsvik et al. (1990) menyebutkan bahwa pada beberapa penelitian terhadap ikan liar, didapati perbedaan kualitas telur antar musim. Tingkat penetasan telur dari ikan liar juga sangat rendah dikarenakan sulitnya mendapatkan perlakuan kultur yang tepat, terutama pada ikan laut liar.
Effendie (2002) menyebutkan bahwa waktu pengeraman adalah saat setelah terjadinya pembuahan hingga telur menetas. Selama waktu tersebut terjadi proses pembentukan embrio. Pada saat penetasan, yang dikeluarkan terlebih dahulu dari cangkang telur adalah bagian ekor embrio. Sedangkan bagian yang paling terakhir keluar adalah bagian kepala karena ukurannya paling besar dibanding bagian tubuh lainnya. Selanjutnya embrio yang keluar dari cangkang telur akan memasuki stadia pra larva dengan ciri masih memiliki kuning telur, tubuh transparan dengan sirip dada dan sirip ekor yang masih belum sempurna.
Menurut Blaxter (1969) penetasan terjadi karena menurunnya kekerasan khorion yang disebabkan oleh substansi enzim khorionase yang bersifat mereduksi. Di samping itu dapat pula disebabkan oleh gerakan-gerakan akibat peningkatan suhu, intensitas cahaya atau penyerapan tekanan oksigen. Menurut Woynarovich dan Hovarth (1980) larva yang baru menetas akan menggerakkan bagian ekor ke kiri dan ke kanan dengan gerakan lambat dan lebih banyak istirahat karena tidak dapat mempertahankan keseimbangan untuk posisi tegak. Perkembangan embrio dipengaruhi oleh banyaknya kuning telur. Lama pengeraman telur ikan tergantung pada spesies dan beberapa faktor luar. Menurut Effendie (2002) faktor luar yang terutama mempengaruhi pengeraman telur adalah suhu air. Sedangkan Kjorsvik et al. (1990) menyatakan bahwa masalah lain yang penting dalam pembenihan adalah kontaminasi bakteri selama fase pengeraman.
MATERI DAN METODE PENELITIAN
Waktu dan Lokasi Penelitian
Penelitian ini dilakukan dalam dua tahap. Penelitian tahap pertama merupakan penelitian pendahuluan untuk mengetahui sifat-sifat ikan secara biologik dan pengamatan habitat, dilakukkan pada bulan Mei dan Agustus 2006 di habitat alami ikan hike yaitu kawasan perairan Prabu Siliwangi, Desa Pajajar Kecamatan Rajagaluh, Kabupaten Majalengka. Selain itu juga dilakukan identifikasi taksonomi ikan hike yang dilakukan di Laboratorium Ichtiologi, Fakultas Perikanan dan Ilmu Kelautan (FPIK) IPB. Analisis kualitas air dilakukan di Laboratorium Analitik, Balai Teknologi Lingkungan Badan Pengkajian dan Penerapan Teknologi (BTL-BPPT). Identifikasi plankton dilakukan di Laboratorium Planktonologi FPIK IPB.
Penelitian tahap kedua merupakan kegiatan utama penelitian ini, yaitu induksi ovulasi serta penetasan telur ikan hike. Kegiatan tersebut mengambil lokasi di Desa Kumbung, Kecamatan Rajagaluh, Kabupaten Majalengka dari akhir Maret sampai Juni 2007 dan dilanjutkan pada Maret sampai Juni 2008. Pada periode tersebut juga dilakukan analisis kualitas air dan identifikasi plankton sebagaimana telah dilakukan pada tahap penelitian pendahuluan.
Materi Penelitian Ikan Percobaan
perut, perut cukup terasa lunak ketika diraba dan diperoleh telur pada saat dilakukan kateterisasi.
Pakan Ikan dan Hormon
Pakan ikan yang digunakan adalah pakan komersial memiliki kandungan protein kasar 35% (Hardjamulia et al. 1999, Gaffar et al. 1991) dengan nama dagang Atlas. Preparat gonadotropin yang digunakan adalah sediaan komersial dengan nama dagang ovaprim (Syndel International Inc.) yang mengandung analog salmon Gonadotropin Releasing Hormone (sGnRH-a) dan domperidon. Setiap ml ovaprim mengandung 20 µg sGnRH-a (D-Arg6, Trp7, Leu8, Pro9-NET)-LHRH dengan 10 mg domperidon (Pandey et al. 1998)
Larutan Pengencer
Larutan pengencer yang digunakan untuk pengenceran semen dan fertilisasi buatan adalah larutan Tris-glisin yang mengandung 45 mM NaCl, 5 mM KCl, Tris 2.5 mM dan glisin 19 mM, pH 8 (Billard et al. 1995).
Metode Penelitian
Pemeriksaan Air pada Habitat Asal Ikan Hike
Pengamatan pada habitat alami meliputi pemeriksaan keadaan air. Pada penelitian ini, pemeriksaan berkaitan dengan beberapa sifat fisik-kimia dan biologi (identifikasi plankton). Parameter fisik-kimia air meliputi DO (disolved oxygen/oksigen terlarut), COD (chemical oxygen demand), BOD (biologycal oxygen demand), kekeruhan, kesadahan, pH dan temperatur air. Pemeriksaan pH dan temperatur air dilakukan langsung pada lokasi sampling. Sedangkan pemeriksaan DO, COD, BOD, kekeruhan dan kesadahan dilakukan di laboratorium.
Persiapan Kolam Penangkaran
Sungai Cipadung yang berasal dari mata air di kawasan Pesanggrahan Prabu Siliwangi. Kolam berdinding semen berukuran panjang lebar dan tinggi 2x1.5x1.5 m3, diisi air yang mengalir dengan ketinggian air sekitar 70 cm, bagian dasar kolam dilapisi kerikil dan batuan besar sedang bagian atasnya ditutup dengan jaring.
Induksi Hormon
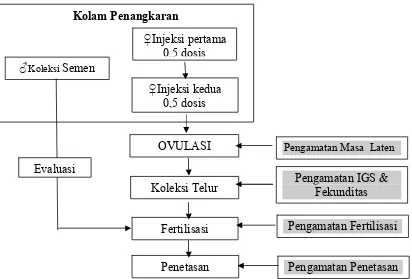
Perlakuan induksi dibagi dalam 3 kelompok dengan masing-masing perlakuan terdiri 4 ekor betina. Setiap kelompok diberi perlakuan injeksi ovaprim, masing-masing dengan dosis 8, 10 dan 12 µg sGnRHa/kg bobot badan (intramuscular pada otot di bawah sirip punggung). Injeksi diberikan 2 kali, injeksi pertama menggunakan setengah dosis perlakuan, dilakukan pada petang hari jam 17.00-18.00 kemudian 12 jam berikutnya diberikan injeksi yang kedua dengan setengah dosis hormon sisanya.
Tabel 1 Jumlah ikan percobaan dan perlakuan Jumlah ikan Dosis GnRHa
(/kg berat badan)
4 8 µg
4 10 µg
4 12 µg
Gambar 5 Bagan alir tahapan kegiatan dalam penelitian Koleksi Telur
Apabila pengamatan telah menunjukkan tanda-tanda ikan ovulasi yaitu tingkat hiperemia, pembengkakan lubang genital yang kuat dan palpasi abdominal caudal yang lunak maka segera dilakukan koleksi telur. Koleksi telur dari setiap ikan pada masing-masing perlakuan dengan cara stripping. Untuk keperluan ini, ikan terlebih dahulu dikeringkan dengan kain bersih dan lubang genitalnya dikeringkan dengan menggunakan kertas tissu. Selanjutnya dilakukan pengeluaran telur dari ovarium dengan cara mengurut bagian perut secara perlahan hingga telur keluar melalui lubang genital. Telur yang keluar ditampung dalam wadah plastik dan diukur volumenya untuk keperluan fertilisasi.
Koleksi Semen
Koleksi semen dilakukan dengan cara stripping seperti pada koleksi telur. Semen yang terkoleksi disedot dengan spuit berskala untuk mengetahui volumenya. Sebelum digunakan untuk fertilisasi, dilakukan pengamatan mikroskopis terhadap
motilitas untuk menentukan kelayakan penggunaannya. Hanya semen segar yang memiliki motilitas 80% atau lebih yang digunakan untuk kegiatan fertilisasi.
Fertilisasi
Fertilisasi dengan cara menempatkan telur dari setiap ikan yang telah diukur volumenya pada wadah plastik. Ke dalam wadah plastik, dilakukan penambahan semen yang telah diencerkan 1000 kali dalam jumlah yang setara dengan volume telur yang diperoleh (Billard et al. 1995). Selanjutnya telur dan semen dicampurkan dengann diaduk secara perlahan selama 3 menit menggunakan bulu ayam.
Penetasan Larva
Telur yang sudah difertilisasi ditempatkan pada wadah inkubasi yang beraerasi dan bersuhu 22oC hingga menetas. Setiap ulangan menempati 1 wadah inkubasi. Untuk keperluan ini digunakan wadah plastik berukuran 20 x 10 x 40 cm3 yang diisi dengan air yang telah diinapkan dan diaerasi semalam, sebanyak 2/3 volume akuarium. Sebelum digunakan, wadah inkubasi dan perlengkapannya didesinfeksi dengan metilen biru.
Parameter yang Diamati Masa Laten
Masa laten dihitung sejak dilakukan injeksi hormon yang kedua hingga terjadinya ovulasi. Jika secara visual sudah terlihat hiperemia dan pembukaan pada lubang genital, dilakukan pengurutan abdomen setiap 30 menit untuk melihat terdapatnya ovulasi. Kejadian ovulasi ditandai dengan diperolehnya telur yang sudah bercerai berai pada saat stripping.
Indek Gonad Somatik
dinyatakan dengan B1 dan sesudah telur dikoleksi dinyatakan dengan B0 dibagi dengan bobot ikan setelah koleksi (B0), maka angka IGS yang dinyatakan dalam persen dihitung sebagai berikut:
% B = B1-B0 x100%.
B0 Fekunditas
Fekunditas dihitung secara mutlak berdasarkan jumlah telur yang diperoleh dari ovulasi masing-masing induk. Jumlah telur dinyatakan dalam jumlah butir.
Diameter Telur
Pengamatan kualitas oosit dilakukan terhadap telur yang terkoleksi melalui stripping. Telur yang diamati dari setiap induk berjumlah 50 butir. Pengamatan menggunakan mikroskop lensa objektif 4x dan lensa okuler 10x. Selain ukuran diameter telur, diamati juga keseragaman ukuran telur, keutuhan lapis membran dan bermigrasinya inti oosit mendekati lubang mikropil (Yueh dan Chang 2000).
Derajat Telur Terbuahi
Tingkatan telur yang berhasil dibuahi dihitung dalam waktu 15 menit setelah dilakukan fertilisasi buatan. Caranya dengan mengambil secara acak 50 butir telur dan dilihat secara mikroskopis (pembesaran 40 kali) untuk mengetahui terjadi atau tidaknya fertilisasi. Telur yang telah dibuahi akan tampak bening dengan kemunculan badan polar II. Persentase atau tingkat telur terfertilisasi dihitung berdasarkan jumlah telur (F0) yang berhasil dibuahi (F1) dibagi jumlah total telur (F0) dikalikan 100%, sebagai berikut
% F = F1 x100%.
F0
Derajat Penetasan Telur
dalam wadah inkubasi yang berbeda. Persentase penetasan dihitung secara langsung berdasarkan jumlah telur yang tidak berhasil menetas (T1) dibagi dengan jumlah telur awal (T0) dikalikan 100%, sebagai berikut:
% T = T1 x100%.
T0
Rancangan Penelitian dan Analisis Data
Penelitian pendahuluan untuk identifikasi ikan, identifikasi plankton dan pengamatan habitat dilakukan secara deskriptif. Sedangkan penelitian utama dilakukan menggunakan Rancangan Acak Lengkap dengan 3 perlakuan dan 4 ulangan yaitu:
1. Perlakuan injeksi sGnRH-a 8 µg per kg bobot badan. 2. Perlakuan injeksi sGnRH-a 10 µg per kg bobot badan. 3. Perlakuan injeksi sGnRH-a 12 µg per kg bobot badan.
Data yang diperoleh pada penelitian inti kemudian dianalisis dengan sidik ragam untuk mengetahui pengaruh perlakuan. Jika terdapat perbedaan yang nyata antar perlakuan (P<0.05) dilanjutkan dengan uji Tukey’s (Steel dan Torrie 1993) menggunakan rumus persamaan sebagai berikut :
W = ±
q
k,v,n/2 Sy √ (1/n +1/n)√2
Sy = √RJKgalat v = N-k Keterangan:
W = rentang signifikan terkecil k = jumlah perlakuan
v = db galat
n = jumlah ulangan tiap perlakuan
q = rentang yang diperoleh dari tabel rentang N = jumlah data
HASIL DAN PEMBAHASAN Ikan Hike
Berdasarkan penelitian pendahuluan yang dilakukan oleh penulis, diperoleh hasil bahwa ikan hike memiliki gambaran morfologi yang mirip dengan ikan mas (Gambar 6). HAsil identifikasi terhadap ikan hike terlihat bahwa secara taksonomi ikan hike mempunyai nama spesies Labeobarbus longipinnis. Secara rinci ikan hike yang digunakan dalam penelitian ini diklasifikasikan sebagai berikut:
Kelas : Teleostei
Ordo : Cypriniformes
Sub ordo : Cyprinoidea
Famili : Cyprinidae
Sub famili : Cyprininae
Genus : Labeobarbus (Tor) Spesies : Labeobarbus longipinnis
spesies lainnya yaitu bibir tidak berkeping dan sirip dubur lebih tinggi daripada sirip punggung.
Secara morfologis ikan hike memiliki tubuh pipih memanjang (stream line) dengan warna kuning keperakan pada ikan muda dan berangsur-angsur menjadi kuning kehijauan pada ikan dewasa (Gambar 7 dan 8). Bentuk tubuh pada ikan betina lebih lebar dibandingkan dengan ikan jantan. Ciri spesifik lainnya adalah adanya pola garis berwarna kehitaman pada sisik bagian medio-lateral tubuh yang semakin nyata pada ikan dewasa.
Gambar 7 Ikan hike muda, warna sisik tubuh kuning keperakan
Gambar 8 Bentuk tubuh pada ikan dewasa, jantan (bawah) lebih langsing daripada betina (atas)
yang ditandai dengan diperolehnya semen berwarna putih pada saat dilakukan stripping serta ditemukan sel-sel spermatozoa pada saat pemeriksaan semen secara mikroskopis. Sedangkan dari hasil pemancingan yang dilakukan pada bulan Mei 2007 diperoleh ikan hike betina yang memiliki tingkat kematangan gonad pada fase postvitellogenetic pada ikan dengan ukuran panjang tubuh 27 cm dan bobot badan 186 gram.
Ikan hike mempunyai gerakan yang sangat agresif, yang tampak pada saat ikan mengejar mangsa atau menghindar dari ancaman, kadangkala meloncat melintasi permukaan air. Mengingat sifat gerakan ikan hike sangat agresif maka penangkapan ikan lebih cocok jika menggunakan pancing. Ikan dengan ukuran besar relatif senang bersembungi di balik batu-batu sementara yang berukuran kecil sering terlihat melalui permukaan air yang jernih dan berarus. Ikan hike termasuk pemakan segala (omnivora). Bahkan pada penangkapan dengan cara pancing berhasil menangkap ikan hike dengan menggunakan berbagai umpan (cacing, pelet ikan dan kerupuk). Ikan hike termasuk golongan ikan yang lebih aktif di malam hari (nocturnal), sehingga pemancingan lebih berhasil apabila dilakukan mulai petang hingga pagi hari. Sifat ikan dewasa yang lebih menyukai bersembunyi di balik batuan juga menunjukkan bahwa ikan hike kurang menyukai perairan yang banyak cahaya.
Kualitas Air
Gambar 9 Habitat asal ikan hike, perairan dengan beberapa sumber mata air dikelilingi hutan
Berdasarkan hasil pemeriksaan air pada kawasan habitat ikan didapatkan parameter biologis lainnya yaitu terdapat plankton yang berfungsi sebagai pakan alami. Dari pengamatan terhadap plankton terlihat bahwa terdapat keragaman beberapa famili dengan genus sebagai berikut:
Bacillariophyceae: Synedra sp Navicula sp Chlorophyceae:
Spirogyra sp Cyanophyta:
Lyngbya sp Algae:
Pinnularia sp Tribonema sp
Ulothrix sp
mutu air yang baik yaitu klasifikasi dan kriteria air kelas I. Hal ini mengacu pada PP no 82 tahun 2001 pasal 8 tentang Pengelolaan Lingkungan Hidup, Klasifikasi dan Kriteria Mutu Air, ditetapkan bahwa mutu air kelas I yaitu air dapat digunakan untuk bahan baku air minum atau peruntukan lainnya yang mempersyaratkan mutu air yang sama. Keadaan air dari mata air yang demikian dimanfaatkan oleh masyarakat sebagai sumber air untuk kebutuhan rumah tangga termasuk memasak dan air minum. Beberapa desa di Kecamatan Rajagaluh mendapatkan suplai air dari mata air yang bersumber dari kawasan Pesanggrahan Prabu Siliwangi. Sedangkan air yang masuk dalam aliran Sungai Cipadung dimanfaatkan oleh masyarakat diantaranya untuk kegiatan perikanan.
Keberhasilan Ovulasi
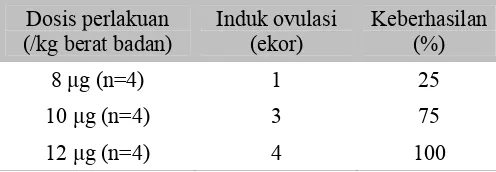
Pada penelitian percobaan ovulasi didapatkan hasil bahwa induksi ovulasi ikan hike (Labeobarbus longipinnis) dengan perlakuan pemberian gonadotropin releasing hormone analog (GnRHa) pada dosis 8 μg, 10 μg dan 12 μg per kg tidak mengakibatkan seluruh ikan berovulasi. Keberhasilan ovulasi dari masing-masing perlakuan tersaji pada Tabel 2. Induksi dengan dosis 8 μg/kg berat badan hanya menghasilkan satu ekor dari 4 ekor ikan induk yang diinduksi. Demikian pula halnya dengan dosis 10 μg/kg berat badan, tidak berhasil mengovulasikan seluruh induk, dalam hal ini dari 4 induk yang mendapat perlakuan hanya 3 induk yang dapat berovulasi. Pada perlakuan GnRHa dengan dosis 12 μg/kg berat badan, semua induk berhasil melakukan ovulasi. Adapun gambaran makroskopik telur ikan hike yang berhasil ovulasi dapat dilihat pada Gambar 10. Sedangkan yang tidak berhasil ovulasi dapat dilihat pada Gambar 11.
Tabel 2 Persentase keberhasilan ovulasi dengan induksi GnRHa
Gambar 10 Makroskopik telur ikan hike yang berhasil ovulasi
Gambar 11 Makroskopik ovarium ikan hike yang tidak berhasil ovulasi
Ketidakberhasilan ovulasi pada sebagian induk ini akan mempengaruhi penampilan reproduksi lainnya. Artinya, tidak terovulasikannya telur mengakibatkan tidak dimungkinkan pengamatan dan pengambilan data berikutnya yaitu masa laten, indeks gonad somatik (IGS), fekunditas, diameter telur, derajat terbuahi telur dan derajat tetas telur ikan hike. Sementara itu dari ikan hike yang berhasil ovulasi, diperoleh telur yang dapat difertilisasi dan menetas menghasilkan larva.
Pada penelitian ini juga terlihat bahwa perlakuan induksi GnRHa hanya berpengaruh terhadap masa laten dan derajat telur terbuahi, sedangkan terhadap keempat penampilan reproduksi lainnya yaitu indeks gonad somatik (IGS), fekunditas, diameter telur dan derajat tetas telur tidak memberikan pengaruh yang nyata (Tabel 3). Tabel 3 Nilai rataan lama masa laten, indeks gonad somatik, fekunditas, diameter
Masa Laten
Respon ikan setelah induksi GnRHa terhadap kecepatan masa laten dapat dilihat pada Tabel 3. Masa laten tercepat diperoleh pada perlakuan pemberian GnRHa dosis 12 μg/kg bobot badan, yaitu dengan rataan 18,75 jam. Pada dosis tersebut seluruh betina yang diinduksi berhasil melakukan ovulasi. Masa laten tercepat berikutnya adalah pada perlakuan GnRHa dosis 10 μg/kg bobot badan dengan rata-rata masa laten 21 jam. Dari 4 ekor induk yang diinduksi dengan dosis tersebut terdapat 1 ekor induk yang tidak memberikan respon yang nyata, yang terlihat dari ikan yang diberi perlakuan tidak berhasil melakukan ovulasi. Perlakuan yang membutuhkan masa laten paling lama adalah induk yang diinduksi GnRHa pada dosis 8 μg/kg bobot badan, namun hanya 1 ekor induk yang menghasilkan ovulasi yaitu dengan masa laten 33,50 jam.
Gambar 12 Histogram nilai rataan masa laten ikan hike setelah pemberian GnRHa Berdasarkan hasil penelitian ini diketahui bahwa masa laten yang dibutuhkan untuk mencapai ovulasi dari telur postvitellogenic berbeda-beda antar perlakuan dan penelitian ini menunjukkan bahwa semakin meningkat dosis GnRHa yang diinduksikan (dari 8,10 dan 12 µg/kg berat badan) menghasilkan masa laten yang lebih singkat. Berdasarkan analisis sidik ragam menunjukkan bahwa terdapat pengaruh induksi terhadap masa laten, dan dari uji lanjut Tukey diketahui bahwa terdapat pengaruh yang berbeda sangat nyata atau nyata diantara kelompok perlakuan dosis. Hasil perbandingan masa laten pada penelitian ini memperlihatkan bahwa masa laten yang terpanjang dengan masa laten tersingkat, terdapat selisih rata-rata 14,75 jam untuk perlakuan dosis induksi GnRH 8 dan 12 µg/kg berat badan.
kematangan oosit tahap akhir serta pecahnya folikel (ovulasi) melalui perannya dalam menstimulasi sekresi 17,20-P dari folikel postvitellogenic.
Masa laten yang dihitung dalam penelitian ini adalah jarak waktu dari dilakukannya induksi GnRHa yang kedua hingga terjadinya ovulasi yang dideteksi melalui keberhasilan koleksi telur. Masa laten merupakan masa yang dibutuhkan agar terjadi ovulasi dari telur yang sudah matang. Dalam setiap proses perkembangan secara biologi termasuk oosit ikan, perkembangan antara satu fase ke fase yang berikutnya membutuhkan waktu tertentu. Kejadian ovulasi telur dalam penelitian ini berlangsung setelah adanya pematangan oosit, seperti dijelaskan oleh Brooks et al. (2003) bahwa pada oosit yang telah matang, sitoplasma akan menjadi bening, oil droplet bergabung menjadi satu dan berukuran besar serta terjadi breakdown germinal vesikel (Gambar 13). Lebih lanjut, Nagahama (1987b) menambahkan pernyataan bahwa proses pematangan telur disertai dengan kondensasi kromosom, pembentukan spindel meiotik pertama, pelepasan polar bodi pertama dan pembentukan mikrofil sebagai saluran masuknya spermatozoa ketika terjadi fertilisasi.
Gambar 13 Skematik pematangan oosit ikan hingga terjadi ovulasi (Brooks et al. 2003)
ml/kg berat badan yaitu 24 jam setelah injkesi (Pandey et al. 1998). Demikian juga terhadap hasil penelitian De Siva et al. (2004) untuk Tor duoronensis yang memiliki masa laten 23-53 jam pasca injeksi ovaprim 0,2 ml/kg berat badan. Perbedaan masa laten selain ditentukan oleh dosis hormon penginduksi, juga sangat ditentukan oleh cara pemberian dan sediaan preparat hormon. Pada pemberian hormon dalam sediaan terlarut lemak umumnya bahkan tidak dilakukan penghitungan masa laten karena pelepasan hormon terjadi secara perlahan dan ovulasi terjadi dalam waktu yang lama setelah perlakuan.
Indeks Gonad Somatik dan Fekunditas
Hasil pengamatan terhadap rataan indeks gonad somatik secara keseluruhan berkisar antara 10,34%-12,14% (Tabel 3). Nilai rataan indeks gonad somatik tertinggi diperoleh pada ikan yang diinduksi GnRHa dengan dosis 12 μg/kg berat badan, yaitu sebesar 12.14%, yang diikuti oleh dosis induksi 10 μg/kg berat badan dengan rataan indeks gonad somatik sebesar 11,15%. Nilai rataan IGS terendah ditunjukkan pada perlakuan induksi GnRHa dengan dosis 8 μg/kg berat badan yaitu sebesar 10,34%. Berdasarkan analisis sidik ragam, perlakuan tidak memberikan pengaruh terhadap indeks gonad somatik ikan hike. Untuk lebih jelasnya pengaruh perlakuan terhadap nilai rataan indeks gonad somatik ikan hike dapat dilihat pada Gambar 14.
Gambar 14 Histogram nilai rataan IGS ikan hike setelah pemberian GnRHa