EKSPRESI GEN AROMATASE, NISBAH KELAMIN JANTAN,
DAN KINERJA BUDIDAYA IKAN NILA YANG DIRENDAM
HORMON
17α
-METILTESTOSTERON
PADA SUHU 36 °C
AGUNG LUTHFI FAUZAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul “Ekspresi Gen Aromatase, Nisbah Kelamin Jantan, dan Kinerja Budidaya Ikan Nila yang Direndam Hormon 17α-Metiltestosteron pada Suhu 36 °C” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2016
Agung Luthfi Fauzan
RINGKASAN
AGUNG LUTHFI FAUZAN. Ekspresi Gen Aromatase, Nisbah Kelamin Jantan, dan Kinerja Budidaya Ikan Nila yang Direndam Hormon 17α-Metiltestosteron pada Suhu 36 °C. Dibimbing oleh DINAR TRI SOELISTYOWATI dan ALIMUDDIN.
Ikan nila merupakan salah satu ikan konsumsi unggulan air tawar yang dibudidayakan secara intensif di Indonesia sejak tahun 2000. Ikan nila jantan tumbuh hampir dua kali lipat dibandingkan ikan nila betina dan cepat matang gonad. Kematangan dini pada ikan nila berakibat menghambat pertumbuhan, karena energi yang digunakan untuk pertumbuhan sel somatik sebagian terbagi untuk perkembangan dan kematangan gonad. Budidaya ikan nila jantan tunggal kelamin (monoseks) potensial dapat meningkatkan produksi dibandingkan dengan populasi campuran. Produksi monoseks jantan dapat diperoleh dengan teknologi maskulinisasi (sex reversal) pada masa sebelum terjadi diferensiasi kelamin.
Metode maskulinisasi pada pengarahan diferensiasi kelamin jantan dilakukan dengan menambahkan hormon steroid eksogenous berupa androgen. Hormon androgen yang telah banyak digunakan adalah 17α-metiltestosteron (MT).
Diferensiasi kelamin pada ikan dikendalikan oleh gen yang menghasilkan enzim aromatase yaitu enzim sitokrom P-450 yang mengkatalis perubahan androgen menjadi estrogen. Aktivitas enzim aromatase terbatas pada daerah dengan target estradiol dan berfungsi untuk mengatur jenis kelamin, reproduksi dan tingkah laku. Aktivitas enzim aromatase berkorelasi dengan struktur gonad, yakni pada larva dengan ekspresi gen aromatase rendah mengarah pada terbentuknya testis, sedangkan ekspresi gen dengan aktivitas aromatase tinggi akan mengarah pada terbentuknya ovari. Analisis ekspresi gen aromatase dapat menjelaskan mekanisme diferensiasi kelamin dan maskulinisasi pada ikan. Tujuan dari penelitian ini adalah 1) menganalisis ekspresi gen aromatase tipe otak pada ikan nila yang direndam hormon MT pada suhu 36 °C, 2) Mengevaluasi nisbah kelamin jantan, laju pertumbuhan spesifik, kelangsungan hidup dan biomassa ikan nila setelah direndam satu dan dua kali perendaman hormon MT dosis 2 mg/L selama 4 jam pada suhu 36 °C.
Penelitian ini menggunakan rancangan acak lengkap terdiri atas perlakuan dosis MT 2 mg/L pada suhu 36 °C dengan satu kali perendaman (larva umur 10 hari) dan dua kali perendaman (larva umur 10 dan 13 hari) dibandingkan dengan kontrol tanpa MT pada suhu ruang (24-26 °C). Masing-masing perlakuan diulang sebanyak 3 kali. Perendaman dilakukan selama 4 jam pada larva umur 10 hari setelah penetasan (perendaman ke-1) dan pada hari ke-13 setelah penetasan (perendaman ke-2) dengan kepadatan 250 ekor/L per ulangan perlakuan. Selanjutnya ikan dipelihara selama dua bulan, pada bulan pertama ikan dipelihara di akuarium dan bulan kedua dalam hapa (2x1x1 m3) di kolam tanah. Pakan dengan kadar protein 40% diberikan tiga kali dalam sehari secara at satiation.
Analisis ekspresi gen aromatase dilakukan sebelum perendaman, pascarendam satu kali (larva umur 10 hari), pascarendam dua kali (larva umur 13 hari), dan ikan umur 60 hari. Jaringan yang dianalisis pada larva adalah bagian kepala hingga setengah tubuh, sedangkan pada ikan umur 60 hari adalah jaringan gonad. Ekspresi gen aromatase dianalisis menggunakan metode PCR semi-kuantitatif (sqRT-PCR).
Hasil penelitian menunjukkan bahwa perendaman satu kali MT dosis 2 mg/L selama 4 jam pada suhu 36 °C menghasilkan lebih banyak ikan nila jantan. Tingkat ekspresi gen aromatase tipe otak pada perendaman satu kali adalah lebih rendah pada umur 10 hari, dan meningkat secara signifikan pada hari ke-13 dibandingkan dengan kontrol (perendaman pada suhu ruang tanpa MT). Perendaman larva menggunakan MT dan suhu tidak berpengaruh nyata terhadap kelangsungan hidup. Ikan nila hasil perendaman larva menggunakan MT pada suhu 36 °C memiliki laju pertumbuhan spesifik dan biomassa lebih tinggi dibandingkan kontrol. Dengan demikian, pengarahan kelamin jantan ikan nila efektif dapat dilakukan dengan perendaman satu kali selama 4 jam pada larva yang belum terdiferensiasi menggunakan MT dosis 2 mg/L pada suhu 36 °C. Perbedaan ekspresi gen aromatase mengindikasikan peran gen tersebut dalam maskulinisasi ikan nila. Selanjutnya, jumlah ikan jantan yang lebih banyak pada perlakuan MT terbukti meningkatkan produksi (biomassa).
Kata kunci: ekspresi gen aromatase, Oreochromis niloticus, maskulinisasi, suhu,
SUMMARY
AGUNG LUTHFI FAUZAN. Aromatase Gene Expression, Male Ratio, and Culture Performance of Nile tilapia Immersed in Water 36 °C Containing 17α -Methyltestosterone. Supervised by DINAR TRI SOELISTYOWATI and ALIMUDDIN.
Tilapia is one of the famous freshwater fish, which cultivated intensively in Indonesia since 2000. Male tilapia has growth and gonadal maturation faster than female tilapia. Early maturation inhibits growth of tilapia, on the other hand, energy will be used for gonadal growth. Monosex male tilapia population has potential increasing production than female population. Monosex male population production can be obtained by the technology of masculinization (sex reversal) at the period before differentiation occured. Masculinization can be conducted by adding exogenous steroid hormone such as androgen. The androgen hormone
17α-methyltestosterone (MT) has commonly been used in fish farming.
Sex differentiation is controlled by a gene encoding aromatase enzyme. The aromatase enzyme is a cytochrome P-450 catalyzing changes in androgen to estrogen. Aromatase enzyme activity confined to the target with estradiol and serves to regulate the sex, reproduction and behavior. Aromatase enzyme activity has been correlated with gonadal structure. Aromatase gene expression with low expression level leads to testes and with high expression leads to ovary. Aromatase gene analysis can explain the mechanism of sex differentiation and sex determination in fish. The purpose of this research were 1) to analyze the aromatase brain-type gene expression on tilapia by immersion of MT hormone at a temperature of 36 °C, 2) to evaluate the male ratio, growth, survival, and changed every two days (80% water aquarium).
The result showed that higher monosex male fish production was obtained by once immersion of MT at 36 °C water temperature. At this treatment, gene expression level of aromatase brain-type was lower at day 10, and increased significantly at day 13 compared to control (immersion at room temperature without MT). Immersion using MT and 36 °C water temperature has no significant effect on the survival. While the specific growth rate and fish biomass showed significantly higher than control. Thus, monosex male tilapia can be produced by once immersion of undifferentiated larvae in 36 °C temperature of water containing MT. Aromatase gene expression differences was indicated the role of these genes in masculinization of tilapia. Furthermore, the large number of male in MT treatment will increase yield production (biomass).
Keywords: aromatase gene expression, Oreochromis niloticus, masculinization,
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
Pada
Program Studi Ilmu Akuakultur
EKSPRESI GEN AROMATASE, NISBAH KELAMIN JANTAN,
DAN KINERJA BUDIDAYA IKAN NILA YANG DIRENDAM
HORMON
17α
-METILTESTOSTERON
PADA SUHU 36 °C
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas
segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan pada bulan Desember 2015 sampai dengan Mei 2016 yang bertempat di Balai Besar Perikanan Budidaya Air Tawar Sukabumi Jawa Barat adalah maskulinisasi, dengan judul penelitian yaitu
“Ekspresi gen aromatase, nisbah kelamin jantan, dan kinerja budidaya ikan nila yang direndam hormon 17α-metiltestosteron pada suhu 36 °C”.
Terima kasih penulis ucapkan kepada Dr Dinar Tri Soelistyowati dan Dr Alimuddin selaku pembimbing selayaknya orang tua yang telah banyak memberikan arahan dan masukan baik teknis maupun non-teknis kepada penulis sehingga karya ilmiah ini dapat diselesaikan. Terima kasih juga penulis ucapkan kepada Dr Tatag Budiardi selaku dosen penguji luar komisi pada ujian tesis atas segala saran yang diberikan sehingga karya ilmiah ini menjadi lebih baik.
Penulis juga mengucapkan terima kasih kepada Balai Besar Perikanan Budidaya Air Tawar Sukabumi yang telah mendukung secara langsung penelitian dan penulisan karya ilmiah ini. Selain itu, penghargaan penulis sampaikan kepada seluruh dosen Program Studi Ilmu Akuakultur Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor yang telah memberikan bimbingan dan saran kepada penulis. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini dapat bermanfaat.
Bogor, Oktober 2016
DAFTAR ISI
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN viii
1 PENDAHULUAN 1
Latar belakang 1
Rumusan masalah 2
Tujuan penelitian 2
Hipotesis 2
2 METODE 2
Perlakuan maskulinisasi 2
Analisis ekspresi gen aromatase 3
Identifikasi jenis kelamin 3
Analisis kualitas air 4
Parameter uji 4
Nisbah kelamin jantan 4
Laju pertumbuhan spesifik 4
Kelangsungan hidup 5
Biomassa ikan 5
Analisis data 5
3 HASIL DAN PEMBAHASAN 5
Hasil 5
Ekspresi gen aromatase 5
Nisbah kelamin jantan 6
Laju pertumbuhan spesifik 7
Kelangsungan hidup 7
Biomassa ikan 8
Pembahasan 8
4 SIMPULAN DAN SARAN 10
Simpulan 10
Saran 11
DAFTAR PUSTAKA 11
LAMPIRAN 14
DAFTAR GAMBAR
1. Ekspresi gen aromatase tipe otak dan β-aktin 6
2. Tingkat ekspresi gen aromatase tipe otak ikan nila hasil perendaman
MT pada suhu 36 °C 6
3. Nisbah kelamin jantan ikan nila hasil perendaman MT pada suhu 36 °C 7 4. Laju pertumbuhan spesifik ikan nila hasil perendaman MT pada suhu 36 °C 7 5. Kelangsungan hidup ikan nila hasil perendaman MT pada suhu 36 °C 8 6. Biomassa ikan nila hasil perendaman MT pada suhu 36 °C 8
DAFTAR LAMPIRAN
1. Analisis statistik perendaman larva dengan MT pada suhu 36 °C 15
1
1 PENDAHULUAN
Latar belakang
Ikan nila merupakan salah satu ikan konsumsi unggulan air tawar yang dibudidayakan secara intensif di Indonesia sejak tahun 2000. Ikan nila jantan tumbuh hampir dua kali lipat lebih cepat dibandingkan ikan nila betina dan cepat matang gonad (Popma dan Masser 1999). Kematangan dini pada ikan nila berakibat menghambat pertumbuhan (Mair et al. 1995), karena energi yang
digunakan untuk pertumbuhan sel somatik sebagian terbagi untuk perkembangan dan kematangan gonad. Ikan nila Sultana merupakan varietas ikan nila terbaru singkatan dari Seleksi Unggul Salabintana, ikan nila ini memiliki beberapa keunggulan dari nila-nila lainnya seperti daya tahan tubuh yang bagus, telurnya yang lebih banyak bisa menghasilkan 1000-2000 butir per induk betina, dan pertumbuhannya yang cukup cepat. Ikan nila Sultana merupakan perkawinan silang dari 10 strain ikan nila yang ada di Indonesia. Nila Sultana dikembangkan Balai Besar Pengembangan Budidaya Air Tawar (BBPBAT) Sukabumi sejak 2001 lalu. Varietas nila ini mendapat pengakuan dari KKP dengan keluarnya Keputusan Menteri Kelautan dan Perikanan Nomor KEP.28/MEN/2012 tentang Pelepasan Ikan Nila Sultana pada 7 Juni 2012.
Budidaya ikan nila jantan tunggal kelamin (monoseks) potensial dapat meningkatkan produksi biomassa dibandingkan dengan populasi campuran. Produksi monoseks jantan dapat diperoleh dengan teknologi maskulinisasi (sex reversal) pada masa sebelum diferensiasi kelamin (Yamamoto 1969). Metode
maskulinisasi pada pengarahan diferensiasi kelamin jantan dilakukan dengan menambahkan hormon steroid eksogenous berupa androgen. Hormon androgen yang telah banyak digunakan adalah 17α-metiltestosteron (MT) (Yamazaki 1983). Beberapa penelitian sebelumnya menunjukkan bahwa pemberian MT mampu mengarahkan perkembangan gonad dan menghasilkan 100% jantan pada dosis 50 mg/kg dan 98% jantan pada dosis 60 mg/kg melalui pakan (Zairin 2002). Induksi MT melalui perendaman larva umur 10 hari dan 13 hari setelah fertilisasi menggunakan MT dosis 100 µg/L selama 3 jam menghasilkan ikan jantan 73% dan 83%, sedangkan perendaman larva ikan nila umur 14 hari setelah fertilisasi pada dosis 200 µg/L menghasilkan 73% jantan, 1800 µg/L MT selama 4 jam menghasilkan ikan jantan 91,6% (Wasserman dan Afonso 2003). Tessema et al.
2006 melakukan maskulinisasi ikan nila melalui perendaman larva umur 10 hari pascatetas pada suhu 36 °C selama 10 hari dengan kepadatan larva 100 ekor/perlakuan menghasilkan nisbah kelamin jantan 86%.
Diferensiasi kelamin pada ikan dikendalikan oleh gen yang menghasilkan enzim aromatase yaitu enzim sitokrom P-450 yang mengkatalis perubahan androgen menjadi estrogen. Aktivitas enzim aromatase terbatas pada daerah dengan target estradiol dan berfungsi untuk mengatur jenis kelamin, reproduksi dan tingkah laku (Callard et al. 2001). Pada ikan teleost ada dua isoform dari gen
aromatase, yaitu tipe ovari (Cyp19a) dan tipe otak (Cyp19b), ang meng ode an dua stru tural protein ang berbeda aitu P 50arom dan P 50arom Piferrer dan la que 200 . Tipe ovari berperan dalam memulai, menjaga atau mempercepat diferensiasi ovarium (Kwon et al. 2001), sedangkan tipe otak
2
2000). Aktivitas enzim aromatase berkorelasi dengan struktur gonad, yakni pada larva dengan ekspresi gen aromatase rendah mengarah pada terbentuknya testis, sedangkan ekspresi gen dengan aktivitas aromatase tinggi akan mengarah pada terbentuknya ovari (Sever et al. 1999). Analisis ekspresi gen aromatase dapat
menjelaskan mekanisme seks diferensiasi dan maskulinisasi pada ikan.
Rumusan masalah
Produktivitas budidaya ikan nila populasi campuran tidak optimal karena kematangan dini menyebabkan pengalihan sebagian energi pertumbuhan ke reproduksi (perkembangan dan pematangan gonad). Budidaya monoseks ikan nila jantan potensial dikembangkan. Ikan nila jantan tumbuh hampir dua kali lipat dibandingkan nila betina, sehingga budidaya monoseks jantan dapat memaksimalkan produksi biomassa. Maskulinisasi untuk pengarahan kelamin fungsional betina menjadi jantan pada masa sebelum diferensiasi kelamin dapat dilakukan dengan pemberian androgen berupa MT. Efektivitas pemberian MT dosis rendah yang dikombinasikan dengan suhu 36 °C melalui perendaman larva dan waktu yang singkat diharapkan dapat menekan ekspresi gen aromatase dan menghasilkan ikan nila monoseks jantan.
Tujuan penelitian
Tujuan dari penelitian ini adalah 1) menganalisis ekspresi gen aromatase tipe otak pada ikan nila yang direndam hormon MT pada suhu 36 °C, 2) Mengevaluasi nisbah kelamin jantan, laju pertumbuhan spesifik, kelangsungan hidup dan biomassa ikan nila setelah direndam satu dan dua kali perendaman hormon MT dosis 2 mg/L selama 4 jam pada suhu 36 °C.
Hipotesis
Maskulinisasi dengan kombinasi MT dan suhu 36 °C melalui perendaman larva dapat mempengaruhi ekspresi gen aromatase, nisbah kelamin jantan, pertumbuhan, kelangsungan hidup, dan biomassa ikan.
2
METODE
Perlakuan maskulinisasi
3
setiap 2 hari sebanyak 80%. Pengukuran bobot tubuh dilakukan setiap dua minggu sekali, pada akhir pemeliharaan dilakukan pengamatan gonad dengan metode histologi menggunakan pewarnaan hematoxilin-eosin. Pengamatan nisbah kelamin jantan, kelangsungan hidup, dan biomassa ikan dilakukan pada akhir pemeliharaan.
Analisis ekspresi gen aromatase
Analisis ekspresi gen aromatase tipe otak dilakukan sebelum, pascarendam satu kali (larva umur 10 hari), pascarendam dua kali (larva umur 13 hari), dan ikan umur 60 hari. Jaringan yang dianalisis pada larva adalah bagian kepala hingga setengah tubuh, sedangkan pada ikan umur 60 hari adalah jaringan gonad. Ekspresi gen aromatase dianalisis menggunakan metode sqRT-PCR. RNA total diekstraksi dari kepala hingga setengah tubuh dari 10 ekor larva, sedangkan pada ikan berumur dua bulan adalah jaringan gonad dari 5 ekor ikan, masing-masing sampel uji dibuat dua kali ulangan (duplo). RNA total diekstraksi dengan menggunakan miRNeasy Mini Kit (QIAGEN) sesuai prosedur dalam manual. Pelet RNA dilarut an dengan 30 μL DEPC 0,1%. Sintesis cDNA komplementer dilakukan dengan High Capacity cDNA Reverse Trancriptase Kit (Applied Biosystems). Konsentrasi RNA dibuat 3 μg dalam 30 μL DEPC, emudian dihomogenasi dengan vorteks dengan kecepatan rendah. Tabung mikro (RNA) dimasukkan ke inkubator suhu 65 °C selama 10 menit, selanjutnya tabung mikro dimasukkan ke dalam es selama 2 menit. Selanjutnya RNA dimasukkan ke dalam tabung first strand reaction mix beads yang berisi dua bola putih. Primer oligo
Primer didesain dengan menggunakan program Primer-BLAST (basic local alignment search tool) yaitu tiArm2-F (5’-TAGGCACAGCCAGCAACTAC-3’)
dan tiArm2-R 5’-TGGAGGAGACGCAAACATCC-3’ dengan ode a ses:
XM005450809 untuk tipe otak, sebagai kontrol internal digunakan β-aktin. Kondisi PCR yang digunakan untuk amplifikasi aromatase tipe otak, yaitu pre-denaturasi 94 °C selama 3 menit, 35 siklus pada pre-denaturasi 94 °C selama 30 detik,
annealing 59 °C selama 30 detik dan ekstensi 72 °C selama 30 detik, serta
ekstensi akhir 72 °C selama 3 menit (Heriyati 2012). Hasil PCR diseparasi menggunakan elektroforesis dengan gel agarosa 1%. DNA divisualisasi dengan pewarna GelredTM menggunakan cahaya ultraviolet. Kemudian hasil amplifikasi diolah menggunakan software ImageJ dan dibandingkan dengan β-aktin sebagai
kontrol internal loading saat sintesis cDNA.
Identifikasi jenis kelamin
4
Analisis kualitas air
Parameter kualitas air yang diukur adalah pH, suhu, DO, dan amonia. Pengukuran kualitas air dilakukan pada saat pemeliharaan ikan di akuarium dan hapa. Sampel air yang diukur yaitu air akuarium dan kolam pemeliharaan. pH diukur menggunakan pH meter, suhu dan DO diukur menggunakan alat DO meter, dan amonia diukur menggunakan metode titrasi. Nilai suhu dan pH selama pemeliharaan perlakuan dan kontrol berada pada kisaran yang dapat ditoleransi oleh ikan nila, yaitu suhu air hatchery 24 - 26 °C dan pH 6,5 - 7,5 (Tabel 1). Kondisi ini masih termasuk dalam kisaran optimum untuk ikan nila (Popma dan Masser 1999) bahwa kisaran nilai pH untuk ikan nila adalah 6,5 – 8,5 dan suhu 25 - 30 °C.
Tabel 1. Kualitas air selama pemeliharaan larva dengan MT pada suhu 36 °C
Parameter Hasil Tinjauan pustaka (KepMen KKP 2012)
Nisbah kelamin jantan merupakan jumlah ikan jantan dibandingkan dengan jumlah ikan secara keseluruhan. Nisbah kelamin jantan dihitung dengan menggunakan rumus:
Analisis laju pertumbuhan spesifik dihitung menggunakan rumus (Huisman 1987):
LPS(%)= [t√wt/wo-1]x100 Keterangan:
LPS = laju pertumbuhan spesifik (%) wt = bobot rata-rata pada saat t (g)
5
Kelangsungan hidup
Kelangsungan hidup merupakan jumlah ikan yang hidup pada akhir pemeliharaan dibandingkan dengan jumlah ikan pada awal pemeliharaan. Kelangsungan hidup dapat dihitung dengan rumus (Huisman 1987):
KH(%)= [Nt/No]x100
Keterangan:
KH = kelangsungan hidup(%)
Nt = jumlah ikan pada akhir pemeliharaan (ekor)
No = jumlah ikan pawa awal pemeliharaaan (ekor)
Biomassa ikan
Biomassa ikan merupakan bobot ikan total pada akhir pemeliharaan hasil dari perkalian bobot rata-rata ikan dengan jumlah total ikan hidup. Biomassa ikan dapat dihitung dengan menggunakan rumus:
Biomassa (g) = w x Nt (Huisman 1987) Keterangan:
Biomassa = bobot biomassa ikan (g) w = bobot rata-rata ikan (g) Nt = jumlah ikan total (ekor)
Analisis data
Data nisbah kelamin jantan, laju pertumbuhan spesifik, kelangsungan hidup, dan biomassa ikan dianalisis ragam dengan menggunakan program SPSS versi 22 dengan diuji lanjut Duncan dengan tingkat kepercayaan 95%. Tingkat ekspresi gen aromatase dianalisis secara semi-kuantitatif menggunakan software
ImageJ, kemudian diuji statistik dengan SPSS versi 22 dengan diuji lanjut Duncan
dengan tingkat kepercayaan 95%.
3 HASIL DAN PEMBAHASAN
Hasil
Ekspresi gen aromatase
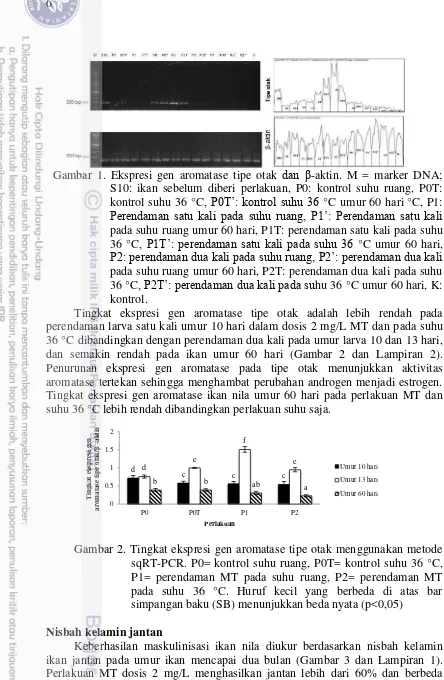
Hasil analisis sqRT-PCR ekspresi gen aromatase (Gambar 1) menggambarkan tingkat ekspresi aromatase tipe otak dan β-aktin (sebagai kontrol internal loading saat sintesis cDNA). Tingkat ekspresi aromatase dapat dilihat dari
perbedaan rasio luas area ekspresi gen aromatase antara hasil analisis sqRT-PCR
6
Gambar 1. Ekspresi gen aromatase tipe otak dan β-aktin. M = marker DNA; S10: ikan sebelum diberi perlakuan, P0: kontrol suhu ruang, P0T: kontrol suhu 36 °C, P0T’: ontrol suhu 3 °C umur 60 hari°C, P1:
Perendaman satu ali pada suhu ruang, P1’: Perendaman satu ali
pada suhu ruang umur 60 hari, P1T: perendaman satu kali pada suhu 36 °C, P1T’: perendaman satu ali pada suhu 3 °C umur 60 hari,
P2: perendaman dua ali pada suhu ruang, P2’: perendaman dua ali
pada suhu ruang umur 60 hari, P2T: perendaman dua kali pada suhu 36 °C, P2T’: perendaman dua ali pada suhu 36 °C umur 60 hari, K: kontrol.
Tingkat ekspresi gen aromatase tipe otak adalah lebih rendah pada perendaman larva satu kali umur 10 hari dalam dosis 2 mg/L MT dan pada suhu 36 °C dibandingkan dengan perendaman dua kali pada umur larva 10 dan 13 hari, dan semakin rendah pada ikan umur 60 hari (Gambar 2 dan Lampiran 2). Penurunan ekspresi gen aromatase pada tipe otak menunjukkan aktivitas aromatase tertekan sehingga menghambat perubahan androgen menjadi estrogen. Tingkat ekspresi gen aromatase ikan nila umur 60 hari pada perlakuan MT dan suhu 36 °C lebih rendah dibandingkan perlakuan suhu saja.
Gambar 2. Tingkat ekspresi gen aromatase tipe otak menggunakan metode sqRT-PCR. P0= kontrol suhu ruang, P0T= kontrol suhu 36 °C, P1= perendaman MT pada suhu ruang, P2= perendaman MT pada suhu 36 °C. Huruf kecil yang berbeda di atas bar simpangan baku (SB) menunjukkan beda nyata (p<0,05)
Nisbah kelamin jantan
7
dibandingkan dengan suhu ruang yaitu berkisar 70-80%. Perendaman satu kali dan dua kali pada suhu 36 °C tidak berbeda nyata.
Gambar 3. Nisbah kelamin jantan ikan nila hasil perendaman MTpada suhu 36 °C. P0= kontrol suhu ruang dan 36 °C, P1= perendaman satu kali MT pada suhu ruang dan 36 °C, dan P2= perendaman dua kali MT pada suhu ruang dan 36 °C. Huruf kecil yang berbeda di atas bar SB menunjukkan beda nyata (p<0,05).
Laju pertumbuhan spesifik
Laju pertumbuhan spesifik pada perlakuan perendaman dua kali dalam MT dosis 2 mg/L pada suhu 36 °C dan suhu ruang lebih tinggi dibandingkan dengan perendaman satu kali (Gambar 4 dan Lampiran 1), yaitu berkisar antara 6,67±0,01% sampai 6,86±0,04% dibandingkan dengan 6,59±0,00% (kontrol suhu ruang) untuk suhu ruang dan 6,85±0,00% sampai 6,91±0,01% dibandingkan dengan6,54±0,00% (kontrol suhu 36 °C) untuk suhu 36 °C.
Gambar 4. Laju pertumbuhan spesifik ikan nila hasil perendaman MTpada suhu 36 °C. P0= kontrol suhu ruang dan 36 °C, P1= perendaman satu kali MT pada suhu ruang dan 36 °C, dan P2= perendaman dua kali MT pada suhu ruang dan 36 °C. Huruf kecil yang berbeda di atas bar SB menunjukkan beda nyata (p<0,05)
Kelangsungan hidup
Perendaman larva satu dan dua kali menggunakan kombinasi MT dosis 2 mg/L pada suhu 36 °C tidak berbeda nyata dengan kontrol pada suhu 36 °C, namun lebih tinggi dibandingkan kontrol pada suhu ruang yang menunjukkan
8
tidak berbeda nyata dengan perendaman satu kali (Gambar 5 dan Lampiran 1), yaitu mencapai 90%.
Gambar 5. Kelangsungan hidup ikan nila hasil perendaman MT pada suhu 36 °C. P0= kontrol suhu ruang dan 36 °C, P1= perendaman satu kali MT pada suhu ruang dan 36 °C, dan P2= perendaman dua kali MT pada suhu ruang dan 36 °C. Huruf kecil yang berbeda di atas bar SB menunjukkan beda nyata (p<0,05)
Biomassa ikan
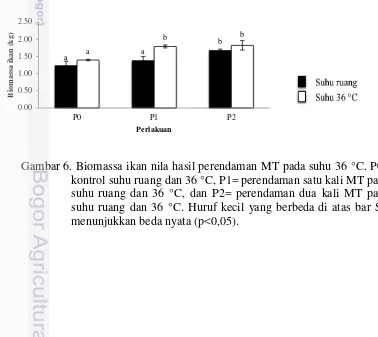
Biomassa ikan pada perlakuan perendaman satu dalam MT dosis 2 mg/L pada suhu 36 °C menghasilkan biomassa yang lebih tinggi dibandingkan suhu ruang dan tidak berbeda nyata dengan perendaman dua kali pada suhu ruang dan 36 °C (Gambar 6 dan Lampiran 1), yaitu perlakuan perendaman menggunakan MT dan suhu ruang berkisar antara 1,38±0,12 kg sampai 1,67±0,04 kg dibandingkan dengan 1,23±0,13 kg (kontrol suhu ruang) dan perlakuan perendaman MT dan suhu 36 °C berkisar 1,79±0,04 kg sampai 1,82±0,14 kg dibandingkan dengan 1,39±0,02 kg (kontrol suhu 36 °C). Pada suhu ruang perendaman dua kali menghasilkan biomassa yang lebih tinggi dibandingkan dengan perendaman satu kali pada larva umur 10 hari.
9
Pembahasan
Tingkat ekspresi gen aromatase menunjukkan aktivitas aromatase tipe otak tertekan pada perlakuan perendaman satu kali selama 4 jam pada larva umur 10 hari pada suhu 36 °C. Namun, hasil analisis perendaman dua kali (umur larva 10 dan 13 hari) tingkat ekspresi gen aromatase meningkat sedangkan pada ikan umur 60 hari ekspresi gen aromatase kembali menurun. Hal ini dapat diduga berkaitan dengan proses diferensiasi ikan menjadi jantan. Perendaman larva satu kali selama 4 jam menggunakan MT dosis 2 mg/L pada suhu 36 °C menunjukkan efektif menekan tingkat ekspresi gen aromatase dibandingkan dengan perendaman dua kali.
Penghambatan aromatase bisa dikarenakan oleh faktor fisik, seperti suhu (Kitano et al. 2000, D’cottae et al. 2001), senyawa kimia steroid dan non-steroid
yang telah mencapai tingkat tertentu dalam keberhasilan maskulinisasi ikan (Seralini dan Moslemi 2001). Hal ini dapat dianggap bahwa penghambatan aromatase oleh faktor fisik dan kimia bisa meniru efek pembalikan kelamin oleh pemberian androgen pada beberapa spesies ikan (Kwon et al. 2000). Pandit et al.
(2015) menyatakan bahwa ikan steril atau mandul dapat diproduksi secara permanen akibat dari perlakuan suhu 37 °C selama 45-60 hari perendaman sebagai suhu yang optimal untuk sterilisasi. Mekanismenya akibat stres panas yaitu dapat mempengaruhi kelangsungan hidup sel germinal pada proses embriogenesis.
Navarro-Martin et al. (2011) menyatakan bahwa paparan suhu dapat
menekan ekspresi cyp19a. Mekanisme pengaruh dari suhu tinggi pada proses maskulinisasi adalah penghambatan ekspresi cyp19a dan aktivitas enzimatik. Dengan demikian, ekspresi cyp19a merupakan kunci dalam respon rasio jenis kelamin pengaruh suhu pada ikan. Pada ikan zebra (Danio rerio), suhu tinggi (35
°C dan 37 °C) membunuh sel germinal pada betina pada tahap awal oocite (Uchida et al. 2004). Pada ikan nila, perendaman suhu tinggi (32 - 35 °C)
signifikan mengurangi jumlah sel germinal (Alvarenga dan França 2009).
Nisbah kelamin jantan pada perlakuan perendaman satu dan dua kali menggunakan MT dosis 2 mg/L pada suhu ruang berkisar 60,89±1,92% sampai 66,67±3,33%, sedangkan pada kontrol suhu ruang 43,33±3,33%. Persentase nisbah kelamin jantan perlakuan perendaman satu dan dua kali menggunakan MT pada suhu 36 °C berkisar 73,33±3,33% sampai 82,22±5,09% lebih tinggi dibandingkan 45,56±5,09% pada kontrol. Maskulinisasi dengan pendekatan hormonal menggunakan bahan aktif steroid alami yang berasal dari resin lebah melalui pakan buatan pada ikan guppy (Poecilia reticulata Peters) dengan dosis
3,0 mL/kg pakan dengan masa perlakuan 4 minggu dan masa pemeliharaan 12 minggu menghasilkan nisbah kelamin jantan sebesar 69,7% dibandingkan kontrol 50,0% (Soelistyowati et al. 2010). Brodie (1991) menyatakan bahwa sel yang
memproduksi aromatase pada genotip betina (XX) mulai aktif pada hari ke-7 pascatetas dan akan terekspresi pada hari ke 10-14 sebelum berdiferensiasi menjadi ovari. Enzim aromatase akan mengkatalis reaksi androgen menjadi estrogen dan mengarahkan penentuan kelaminnya pada fase tertentu. Azaza et al.
10
hidup 60 - 81%, sedangkan nisbah kelamin jantan dari ikan yang dipelihara pada suhu 22 °C, 26 °C, 30 °C, dan 34 °C tidak berbeda nyata.
Popma dan Masser (1999) menyatakan bahwa ikan nila jantan tumbuh 2 kali lebih cepat dibandingkan ikan betina. Laju pertumbuhan spesifik ikan nila menunjukkan perbedaan nyata dalam penelitian ini diduga karena masa pemeliharaannya sudah mencapai 75 hari sehingga ekspresi fenotipe pertumbuhan pada ikan jantan sesuai perkembangan karakter seksual sekundernya (Rutten 2005).
Perlakuan dengan MT dosis 2 mg/L selama 4 jam pada suhu 36 °C melalui perendaman satu dan dua kali tidak mempengaruhi kelangsungan hidup ikan nila. Hal ini mengindikasikan bahwa perendaman dengan dosis 2 mg/L MT selama 4 jam dan suhu 36 °C tidak berdampak negatif pada larva maupun pemeliharaan pascarendam. Menurut Zairin (2002), penggunaan hormon perangsang untuk pengarahan kelamin jantan dapat digunakan hingga dosis tertentu sesuai dengan spesies ikan target, namun bila terjadi overdosis hormon bisa berdampak pada kematian, individu interseks atau perkembangan gonad terhambat hingga steril.
Varadaraj dan Pandian (1991) membandingkan kinerja budidaya beberapa strain berbeda Oreochromis niloticus dan menemukan semua strain perlakuan
perendaman MT menghasilkan ukuran ikan lebih besar dari ikan seks campuran. Peningkatan pertumbuhan ikan akibat perendaman menggunakan MT dapat meningkatkan aktivitas proteolitik di usus pada kasus ikan mas untuk peningkatan laju pertumbuhan. Selain itu, perendaman menggunakan MT dapat merangsang tiroid dan fungsi internal serta sekresi insulin dari sel B pankreas ikan (Ajiboye et al. 2015). Steroid androgenik dapat membantu pelepasan hormon pertumbuhan
dari hipofisis somatotrops ikan. Steroid anabolik berpotensi menjadi senyawa bermanfaat dalam budidaya ikan karena mampu meningkatkan bobot ikan dan deposisi otot ikan perlakuan (Ajiboye et al. 2015).
Keberhasilan maskulinisasi ikan nila salah satunya dipengaruhi kepadatan ikan nila pada saat perendaman dengan kombinasi MT dan suhu 36 °C, sehingga kepadatan optimal ikan nila perlu dikaji lebih dalam lagi, misalnya dilakukan peningkatan kepadatan 500 ekor/L, 750 ekor/L, dan 1000 ekor/L. Sehingga perendaman larva dengan kombinasi MT dan 36 °C lebih efektif dan efisien dalam produksi ikan jantan monoseks. Selain itu, pengendalian suhu yang optimal pascarendam dengan kombinasi MT dan 36 °C perlu dikaji lebih dalam, hal ini terkait dengan pengaruh suhu tinggi terhadap diferensiasi ikan nila menjadi jantan fungsional.
4 SIMPULAN DAN SARAN
Simpulan
11
Saran
Perlu kajian mengenai penentuan kepadatan larva ikan nila yang optimal pada saat dilakukan perendaman dengan MT serta pengendalian suhu pemeliharaan yang optimal.
DAFTAR PUSTAKA
Alvarenga ÉRD, França LRD. 2009. Effects of different temperatures on testis structure and function, with emphasis on somatic cells, in sexually mature Nile tilapia Oreochromis niloticus. Biol. Reprod. 80: 537–544.
Ajiboye OO, Okonji VA, Yakubu AF. 2015. Effect of testosterone-induced sex reversal on the sex ratio, growth enhancement and survival of Nile tilapia
Oreochromis niloticus fed coppens and farm produced feed in a semi
flow-through culture system. Fish Aquac J 6: 123.
Azaza MS, Dhraïef, MN, Kraïem MM. 2008. Effects of water temperature on growth and sex ratio of juvenile Nile tilapia Oreochromis niloticus
(Linnaeus) reared in geothermal waters in southern Tunisia. J. Therm. Biolog. 33: 98–105.
Brodie A. 1991. Aromatase and its inhibitors: An overview. J. Steroid Biochem. Mol. Biolog. 40:225-261.
Callard GV, Tchoudakova AV, Kishida M, Wood E. 2001. Differential tissue distribution, developmental programming, estrogen regulation andpromoter characteristics of genes in teleost fish. J. Steroid Biochem. Mol. Biolog. 79:
305-314.
Dean W. 2004. Chrysin: is it an effective aromatase inhibitor? Vitamin Research
News.18: 4.
D’cottae H, Fostier , Guiguen Y, Govoroun . 2001. romatase pla s a e role
during normal and temperature-induced sex differentiation of tilapia
Oreochromis niloticus. Mol. Rep. Develop. 276: 265-276.
Fujaya Y. 2004. Fisiologi Ikan Dasar Pengembangan Teknik Perikanan. Jakarta:
Rineka Putra.
Gale WL, Fitzpatrick MS, Lucerro M, Contreras-Sanchez WM, Schreck CB. 1999. Masculinization of Nile tilapia Oreochromis niloticus by immersion
in androgens. Aquaculture. 178: 349-357.
Guerrero RD, Shelton WL. 1974. An aceto-carmine squash technique for sexing juvenile fishes. The Progressive Fish-Culturist. 36: 56.
Heriyati E. 2012. Sex reversal ikan nila menggunakan madu dan analisis gen aromatase [tesis]. Bogor (ID): Institut Pertanian Bogor.
Huisman EA. 1987. Principle of Fish Production. Department of Fish Culture and
Fisheries. Netherlands: Wageningen Agricultural University.
Ijiri S, Hiroyo K, Tohru K, De-Shou W, Fumie S, Bindhu P, Masaru N, Y Nagahama. 2008. Sexual dimorphic expression of genes in gonads during early differentiation of a teleost fish, the Nile tilapia Oreochromis niloticus. Biol. Reprod. 78: 333–341.
12
Kitano T, Takamune K, Nagahama Y, Abe S. 2000. Aromatase inhibitor and 17α -methyltestosterone cause sex-reversal from genetical females to phenotypic males and suppression of P450 aromatase gene expression in Japanese flounder Paralichthys olivaceus. Mol. Rep. Develop. 56: 1-5.
Kwon YJ, Haghpanah V, Kogson-Hurtado LM, McAndrew BJ, Penman DJ. 2000. Masculinization of genetic female Nile tilapia Oreochromis niloticus by
dietry administration of an aromatase inhibitor during sexual differentiation.
J. Exp. Zoolog. 287: 46-53.
Kwon JY, Mcandrew BJ, Penman DJ. 2001. Cloning of brain aromatase gene and expression of brain and ovarian aromatase genes during sexual differentiation in genetic male and female Nile tilapia Oreochromis niloticus. Mol. Rep. Develop. 59: 359-370.
Mair GC, Abucay JS, Beardmore JA, Skibinski DOF. 1995. Growth performance trials of genetically male tilapia (GMT) derived from YY-males in
Oreochromis niloticus on station comparisons with mixed sex and sex
reversed male populations. Aquaculture 137: 1-4.
Matty AJ. 1985. Fish endocrinology. USA: Timber Press Portland.
Melo AC, Ramsdell JS. 2001. Sexual dimorphism of brain aromatase activity in medaka: induction of a female phenotype by estradiol. Environ. Health. Perspect. 109: 257-264.
Navarro-Martin L, in as , ibas L, D a N, Gutie rre . 2011. DNA methylation of the gonadal aromatase promoter is involved in temperature-dependent sex ratio shifts in the European sea bass. PLoS Genet. 7(12):
e1002447.
Pandit NP, Bhandari RK, Kobayasi Y, Nakamura M. 2015. High temperature-induced sterility in the female Nile tilapia, Oreochromis niloticus. Gen. Comp. Endocrinol. 213: 110-117
Piferrer F, la que . 200 . Aromatase distribution and regulation in fish.
Springer Science Business Media BV: 1-12
Popma T, Masser M. 1999. Tilapia life history and biology. Southern Regional
Aquaculture Center Publication. 283 p.
Rutten MJM. 2005. Breeding for improved production of tilapia. [Disertasi]. Netherlands: University of Wageningen.
Seralini GE, Moslemi S. 2001. Aromatase inhibitors: past, present and future.
Mol. Cell. Endocrinol. 178:117-131.
Sever DM, Halliday T, Waight V, Brown J, Davies HA, Moriarty EC. 1999. Sperm storage in female of the smoth new Triturus vulgaris L.:
ultrastructure of the spemathecal during the breeding season. J. Exp. Zoolog.
283: 51-70.
Silverin B, Baillien M, Foidart A, Balthazart J. 2000. Distribution of aromatase activity in the brain and peripheral tissues of passerine and nonpasserine avian species. Gen. Comp. Endocrinolog. 117: 34–53.
Soelistyowati DT, Martati E, dan Arfah H. 2007. Efektivitas madu terhadap pengarahan kelamin ikan gapi Poecilia reticulata Peters. JAI. 6(2): 155-160.
13
Varadaraj K, Pandian TJ. 1991. Effect of solubilizing 17α-methyltestosterone in three different solvents on sex reversal of Mozambique tilapia. The Progressive Fish-Culturist. 53: 67-71.
Wassermann GJ, Afonso LOB. 2003. Sex reversal in Nile tilapia Oreochromis niloticus Linnaeus by andogren immersion. Aquaculture Research. 34:
65-71.
Yamamoto TO. 1969. Sex differentiation. In: Fish Physiology. Academic Press,
New York. Vol 3: 117-175.
Yamazaki F. 1983. Sex control and manipulation in fish. Aquaculture 33: 329-
354.
Zairin MJr. 2002. Sex Reversal: Memproduksi Benih Ikan Jantan atau Betina.
14
15
Lampiran 1. Analisis statistik perendaman larva dengan MT pada suhu 36 °C
16
Uji Homogenitas
Statistik Levene dB1 dB2 Sig.
Jantan 0.666 5 12 0.656
LPS 4.966 5 12 0.011
KH 2.338 5 12 0.106
Biomassa 2.291 5 12 0.111
ANOVA
Jumlah Kuadrat dB
Kuadrat
Tengah F Sig. Jantan Perlakuan 3561.12 5 712.22 48.06 0.00
Sisa 177.82 12 14.81 Total 3738.94 17
LPS Perlakuan 0.36 5 0.07 257.54 0.00 Sisa 0.00 12 0.00
Total 0.36 17
KH Perlakuan 360.34 5 72.06 2.25 0.11 Sisa 384.07 12 32.00
Total 744.41 17
Biomassa Perlakuan 799586.94 5 159917.38 17.29 0.00 Sisa 110929.84 12 9244.15
22
Biomassa ikan
Perlakuan
N
Nilai α = 0.05
1 2 3
Duncana P0 3 1288.47
P1 3 1374.18
P0T 3 1394.87
P1T 3 1670.04
P2 3 1786.92 1786.92
P2T 3 1819.83
23
Lampiran 2. Analisis statistik tingkat ekspresi gen aromatase tipe otak
25
Perbandingan Perlakuan
28
Ekspresi gen aromatase tipe ota
Perlakuan
N
Nilai α = 0.05
1 2 3 4 5 6 7
Duncana P2’’ 2 0.22
P1’’ 2 0.31 0.31
P0T’’ 2 0.38
P0’’ 2 0.39
P2 2 0.54
P1 2 0.55
P0T 2 0.57
P0 2 0.72
P0’ 2 0.76
P2’ 2 0.95
P0T’ 2 1.00
P1’ 2 1.50
29
RIWAYAT HIDUP
Penulis dilahirkan di Situbondo pada tanggal 15 Juni 1988, merupakan anak pertama dari empat bersaudara pasangan Bapak Sunardi, S.Pd., MM. dan Ibu Hartati Sutji Rahayu, S.Pd. Tahun 2006 penulis menyelesaikan pendidikan sekolah menengah atas di SMU Darul Ulum 2 BPPT Peterongan Jombang Jawa Timur. Pendidikan sarjana ditempuh di Program Studi Teknologi dan Manajemen Perikanan Budidaya Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor dan lulus pada tahun 2010. Pada tahun 2014 penulis mendapatkan kesempatan untuk melanjutkan studi pada program Magister Sains (S2) Mayor Ilmu Akuakultur Sekolah Pascasarjana Institut Pertanian Bogor. Karya ilmiah dengan judul Ekspresi Gen Aromatase, Rasio Kelamin, dan Kinerja Budidaya Ikan Nila yang Direndam Hormon 17α-Metiltestosteron pada Suhu 36 °C merupakan karya penulis yang telah diterima (accepted) pada Jurnal