ANALISIS EKSPRESI GEN AROMATASE
PADA SEKS REVERSAL IKAN NILA
Oreochromis niloticus
UPMAL DESWIRA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Analisis Ekspresi Gen Aromatase pada Seks Reversal Ikan Nila Oreochromis niloticus adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2015
Upmal Deswira
RINGKASAN
UPMAL DESWIRA. Analisis Ekspresi Gen Aromatase pada Seks Reversal Ikan Nila Oreochromis niloticus. Dibimbing oleh AGUS OMAN SUDRAJAT dan DINAR TRI SOELISTYOWATI.
Seks reversal merupakan suatu teknik pengalihan kelamin menjadi jantan atau betina. Seks reversal dilakukan sebelum dan atau pada saat fase deferensiasi kelamin, sehingga perkembangan kelamin bisa diarahkan. Penelitian ini bertujuan mengevaluasi mekanisme seks reversal ikan nila pada penggunaan aromatase
inhibitor (AI), madu, dan pestisida melalui perendaman embrio ikan nila fase bintik mata berdasarkan ekspresi gen aromatase dan rasio kelamin. Aromatase P450 (P450arom, CYP19) adalah produk dari gen aromatase dan merupakan enzim terminal pada jalur biosintesis estrogen yang mengkatalisis pembentukan estrogen dari androgen. Estrogen sangat penting untuk perkembangan gonad dan beragam proses fisiologis lainnya, mulai dari pertumbuhan sampai dengan perilaku reproduksi. Pada ikan teleost ada dua isoform dari gen aromatase, Cyp19a/cyp19a1a/tipe ovari dan Cyp19b/cyp19a1b/tipe otak, yang mengkodekan dua struktural protein yang berbeda yaitu P450aromA dan P450aromB. Aromatase Tipe ovari berperan dalam memulai, menjaga atau mempercepat diferensiasi ovarium, sedangkan tipe otak sebagai pengendalian tingkah laku dan neuroestrogen di otak.
Embrio fase bintik mata diperoleh dari hasil pemijahan alami ikan nila nirwana berukuran 300-400g dengan perbandingan 1:1. Percobaan seks reversal dilakukan melalui perendaman embrio fase bintik mata menggunakan bahan AI (imidazole) 20 mg L-1, madu (Perhutani, bunga kelengkeng) 10 ml L-1, dan
pestisida (Decis: deltametrin 25 g L-1) 0,025 mg/L, setiap perlakuan diulang
sebanyak 3 kali. Embrio direndam dalam larutan perlakuan selama 24 jam dengan kepadatan sebanyak 80 ekor per ulangan. Perendaman dilakukan pada akuarium berukuran 20x20x20 cm (volume air 1,5 L), kemudian dipelihara dalam akuarium tersebut sampai hari ke-14. Selanjutnya larva berumur 14 hari dipindahkan ke dalam akuarium berukuran 80x40x40 cm dengan volume air 50 L, kemudian volume air ditingkatkan sampai 75 L ketika larva sudah berumur 45 hari. Kualitas air media pemeliharaan berada pada kisaran optimal, DO (6,00-8,10 ppm), pH (6,46-6,65) dan suhu (28-30oC).
pixel gen aromatase tipe ovari dengan β-actin (kontrol internal) menggunakan software UN-SCAN-IT gel 6.1.
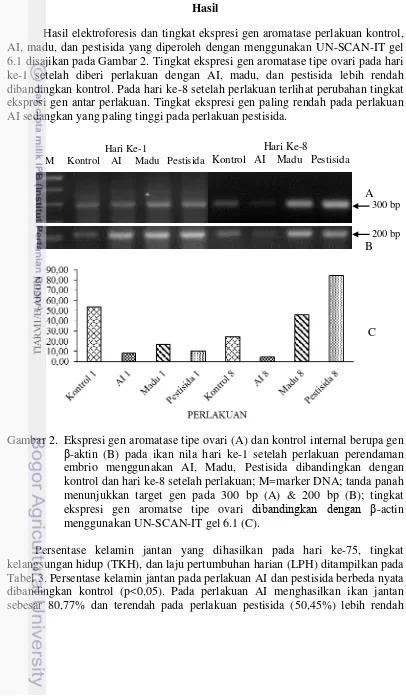
Tingkat ekspresi gen aromatase tipe ovari perlakuan AI, madu, dan pestisida pada hari 1 setelah perlakuan lebih rendah dibandingkan kontrol. Pada hari ke-8 tingkat ekspresi gen paling rendah pada perlakuan AI sedangkan yang paling tinggi pada perlakuan pestisida. Hasil ini menunjukkan adanya penghambatan terhadap ekspresi gen aromatase tipe ovari, sehingga konversi androgen ke estrogen berkurang. Kondisi ini menyebabkan konsentrasi androgen (testosteron) dalam larva ikan meningkat, sehingga menginduksi proses maskulinisasi. Sebaliknya pada perlakuan pestisida terjadi peningkatan ekspresi (enhancement) gen aromatase tipe ovari yang menyebabkan biosintesis estradiol dari androgen meningkat, yang menginduksi proses feminisasi. Hal ini menandakan bahwa terjadi proses maskulinisasi pada perlakuan AI dan feminisasi pada perlakuan pestisida yang diketahui dari persentase jantan berbeda nyata dibandingkan dengan kontrol (P<0,05). Nilai persentase jantan pada perlakuan kontrol, AI, madu, dan pestisida secara berurutan yaitu 68,32%; 80,77%; 70,93%; dan 50,45%, pelakuan madu tidak berbeda nyata dengan kontrol, sehingga dapat disimpulkan seks reversal pada ikan nila dipengaruhi oleh modulasi ekspresi gen aromatase tipe ovari. Peningkatan ekspresi gen aromatase tipe ovari menyebabkan feminisasi, sebaliknya penurunan ekspresi gen menyebabkan maskulinisasi di perkembangan awal larva ikan nila.
SUMMARY
UPMAL DESWIRA. Analysist of Aromatase Gene Expression in Tilapia
Oreochromis niloticus Sex Reversal. Supervised by AGUS OMAN SUDRAJAT and DINAR TRI SOELISTYOWATI.
Sex reversal is a sex conversion technique to be male or female. Sex reversal is carried out before and or during sex differentiation, so sex development can be controlled. This study was conducted to evaluate the mechanism of sex reversal in tilapia on the use of aromatase inhibitors (AI), honey and pesticide through immersion of eye spot embryos based on aromatase gene expression and sex ratio. Aromatase P450 (P450arom; CYP19) is a product of the aromatase gene and a terminal enzyme in the estrogen biosynthetic pathway that catalyzes the formation of estrogen from androgen. Estrogen is essential for gonad development and other diverse physiological processes, ranging from normal growth to reproductive behavior. in teleosts there are two isoforms of the aromatase gene, Cyp19a/ cyp19a1a/ovarian type and Cyp19b/cyp19a1b/brain type, which encode two structurally different proteins, P450aromA and P450aromB. Ovarian type aromatase plays an important role in initiating, maintaining or accelerating ovarian differentiation, while brain type as behaviour controller and neuroestrogen in the brain.
Eye spot embryos were obtained from natural spawning of tilapia strain nirwana sized 300-400g with 1:1 sex comparison. Sex reversal was carried out by immersion of eye spot embryos using 20 mg L-1 AI (imidazole), 10 ml L-1 honey
(Perhutani, longan flower), and 1 µL L-1 pesticide (Decis: deltamethrin 25 g L-1),
each treatment was replicated 3 times. Embryos were immersed in treatment solution for 24 hours with density of 80 individuals per replications. The immersion was carried out in aquarium sized 20x20x20 cm (1,5 L water volume), then they were reared in the aquarium until day 14. Furthermore, 14-day-larvae were moved to aquarium sized 80x40x40 cm with water volume of 50 L, then water volume was raised until 75 L when the larvae were already 45-day-old. Medium water quality was on the optimal range, DO (6,00-8,10 ppm), pH (6,46-6,65) and temperature (28-30oC).
ovarian type aromatase gene pixel with β-actin (internal control) using UN-SCAN-IT gel 6.1 software.
The level of gene expression of ovarian type aromatase in AI, honey, and pesticide treatment on day 1 after treatment were lower than control. While, on day 8 the lowest level of gene expression was on AI treatment and the highest was on pesticide treatment. The results indicated that masculinization occurred in AI treatment and feminization occurred in pesticide treatment which showed by male percentage that significantly different (P<0.05) from control. The male percentage in control, AI, honey, and pesticide were 68.32%, 80.77%, 70.93% and 50.45%, respectively, honey treatment was not significantly different from control. In conclusion sex reversal was influenced by modulation of gene expression of ovarian type aromatase. The increasing of gene expression of ovarian type aromatase caused feminization, otherwise the decreasing of gene expression caused masculinization in early development stage of tilapia larvae.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
ANALISIS EKSPRESI GEN AROMATASE
PADA SEKS REVERSAL IKAN NILA
Oreochromis niloticus
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2015
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Judul Tesis : Analisis Ekspresi Gen Aromatase pada Seks Reversal Ikan Nila
Oreochromis niloticus
Nama : Upmal Deswira NIM : C151120291
Disetujui oleh Komisi Pembimbing
Dr Ir Agus Oman Sudrajat, MSc Ketua
Dr Ir Dinar Tri Soelistyowati, DEA Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr Ir Widanarni, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah Subhanahu wa ta’ala atas segala nikmat dan karunia-Nya sehingga penulis dapat menyelesaikan studi, penelitian serta penulisan tesis dengan judul Analisis Ekspresi Gen Aromatase pada Seks Reversal Ikan Nila Oreochromis niloticus. Penelitian ini dilaksanakan pada bulan Juli sampai September 2014 bertempat di Laboratorium Lapangan Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan – Institut Pertanian Bogor (FPIK – IPB). Analisis ekspresi gen dilakukan di Laboratorium Reproduksi dan Genetika Organisme Akuatik dan histologi gonad dilakukan di Laboratorium Kesehatan Ikan Departemen Budidaya Perairan, FPIK – IPB.
Ucapan terimakasih penulis sampaikan secara khusus kepada bapak Dr Ir Agus Oman Sudrajat, MSc dan ibu Dr Ir Dinar Tri Soelistyowati, DEA selaku dosen pembimbing atas ilmu, nasehat, dan motivasi yang diberikan selama penelitian maupun dalam penyelesaian tesis ini.
Penulis juga mengucapkan terima kasih kepada kedua Orang Tua, Uni, Suami dan sahabat akuakultur 2012, keluarga Teaching Farm, Yeni, Retno, Vida, Kak Dody, Kak Yusuf, Kak Dedi, Kak Ucup, Alex, Kak Ibnu, Kak Darmawan, Kak Deny, Kak Jasmadi, Fajar, Rangga, Kak Ahya, Pak Taufik, atas semua bantuan dan semangat yang diberikan. Ucapan terima kasih juga disampaikan kepada Direktorat Perguruan Tinggi atas bantuan beasiswa selama menempuh pendidikan.
Semoga tesis ini bermanfaat dan dapat memberikan tambahan informasi.
Bogor, Juli 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
1PENDAHULUAN 7
Latar Belakang 7
Perumusan Masalah 2
Tujuan dan Manfaat 2
2METODE 3
Materi Uji 3
Perlakuan Seks Reversal 3
Analisis Ekspresi Gen Aromatase 4
Identifikasi jenis kelamin 4
Karakterisasi Truss Morfometrik 5
Parameter Uji 6
Analisis data 7
3HASIL DAN PEMBAHASAN 8
Hasil 8
Pembahasan 11
4 SIMPULAN DAN SARAN 14
Simpulan 14
Saran 14
DAFTAR PUSTAKA 15
LAMPIRAN 18
DAFTAR TABEL
1. Bahan & dosis perlakuan seks reversal 4
2. Deskripsi 21 karakter truss morfometrik yang diukur pada ikan
nila 6
3.
Persentase Jantan, Laju Pertumbuhan Harian (LPH), Tingkat Kelangsungan Hidup (TKH) ikan nila hasil perlakuan AI, madu,
dan pestisida 9
4. Hasil 21 karakter truss morfometrik 10
DAFTAR GAMBAR
1. Titik truss morfometrik pada ikan nila (Brzesky dan Doyle, 1988) 5
2.
Ekspresi gen aromatase tipe ovari (A) dan β-aktin (B) pada hari ke-1 setelah perlakuan perendaman embrio menggunakan AI, Madu, pestisida dibandingkan dengan kontrol dan hari ke-8 setelah perlakuan; M=marker DNA; tanda panah menunjukkan target gen pada 300 bp (A) & 200 bp (B); tingkat ekspresi gen
aromatse tipe ovari dibandingkan dengan β-actin menggunakan
UN-SCAN-IT gel 6.1 (C) 8
3. Hasil Asetokarmin (A) [perbesaran 200x] dan Histologi (B) [perbesaran 400x] gonad ikan nila ♂ dan ♀ umur 75 hari
1
PENDAHULUAN
Latar Belakang
Ikan nila merupakan salah satu komoditas utama hasil perikanan budidaya di Indonesia. Volume produksi ikan nila pada tahun 2011 mencapai 567.078 ton/tahun meningkat 22,16% dari tahun 2010 (Pusdatin KKP 2013). Ikan nila sangat disukai oleh pasar lokal maupun internasional. Data FAO (2012) menunjukkan permintaan di seluruh dunia terus meningkat dan pada tahun 2010 menjadi makanan favorit keempat dari produk-produk perikanan di Amerika. Ikan ini termasuk jenis ikan yang cepat matang gonad, mudah memijah dan bersifat sex dimorfisme, yaitu adanya perbedaan pertumbuhan antar jantan dan betina. Menurut Popma dan Masser (1999) ikan nila jantan memiliki laju pertumbuhan hampir dua kali lebih cepat dibandingkan dengan ikan betina, sehingga budidaya monoseks jantan lebih diinginkan.
Budidaya monoseks memiliki beberapa keunggulan diantaranya pertumbuhan cepat, mengurangi interaksi yang agresif, dan meningkatkan keseragaman ukuran saat panen (Beardmore et al. 2001). Beberapa teknik yang telah dilakukan untuk memproduksi ikan nila monoseks jantan adalah penyortiran, hibridisasi, manipulasi genetik (androgenesis, triploid, supermale), dan seks reversal. Seks reversal (teknik alih kelamin) merupakan teknik yang diterapkan dalam kegiatan budidaya karena mudah dan tidak memerlukan keahlian khusus dalam pelaksanaannya, serta tidak membutuhkan banyak fasilitas maupun tenaga kerja (Beardmore et al. 2001). Seks reversal terdiri dari maskulinisasi (menghasilkan jantan) dan feminisasi (menghasilkan betina) (Zairin 2003). Kegiatan ini dilakukan sebelum dan atau pada fase deferensiasi kelamin, sehingga perkembangan kelamin bisa diarahkan sesuai dengan tujuannya.
Banyak penelitian yang telah dilakukan untuk memperoleh populasi monoseks jantan dengan berbagai bahan, dosis, dan metode pemberian yang berbeda. Pemberian hormon steroid 17α-metiltestosteron (MT) dan aromatase
inhibitor melalui pakan (Liana 2005; Kaban 2010; Artanto 2010), perendaman (Nurlaela 2002; Sudrajat et al. 2007; Artanto 2010), madu melalui pakan (Syaifuddin 2004) atau perendaman (Martati 2006; Heriyati 2012). Penggunaan 17α-MT sudah dilarang, sedangkan perlakuan madu dan aromatase inhibitor
merupakan metode yang aman dan diperbolehkan penggunaannya. Menurut Beardmore et al. (2001) teknik perendaman merupakan teknik yang lebih baik diterapkan dalam seks reversal karena lebih efisien dari pada pemberian oral (pakan), terutama pada embrio atau tahap pasca menetas.
2
Seks reversal dapat terjadi secara alami akibat adanya pencemaran perairan yang disebabkan oleh kontaminasi limbah, misalnya limbah pertanian berupa pestisida. Beberapa hasil penelitian (Tian et al. 2012; Zhang et al. 2013) menunjukkan proses feminisasi pada ikan yang terkontaminasi pestisida. Pestisida memperkuat efek estrogenik dengan mengganggu poros reproduksi di beberapa tempat sehingga menyebabkan peningkatan kadar 17β estradiol (E2) plasma dan penurunan konsentrasi testosteron plasma (T) (Tian et al. 2012). Deltamethrin merupakan pestisida kelas kimia piretroid yang mampu menurunkan kadar testosteron plasma. Tikus jantan yang diberi deltametrin selama 65 hari dengan dosis 1 atau 2 mg/kg mengalami penurunan kadar testosteron plasma (NPIC 2010), sehingga ikan yang terpapar jenis pestisida ini diduga akan mengalami gangguan dalam proses deferensiasi kelaminnya yang mengarah pada feminisasi.
Aromatase P450 (P450arom, CYP19) adalah produk dari gen aromatase dan merupakan enzim yang terlibat dalam biosintesis estrogen yang mengkatalisis pembentukan estrogen dari androgen. Estrogen sangat penting untuk perkembangan gonad dan beragam proses fisiologis lainnya, mulai dari pertumbuhan sampai dengan perilaku reproduksi (Chang et al. 2005). Pada ikan teleost ada dua isoform dari gen aromatase, Cyp19a/cyp19a1a/tipe ovari dan Cyp19b/cyp19a1b/tipe otak, yang mengkodekan dua struktural protein yang berbeda yaitu P450aromA dan P450aromB (Piferrer dan Bla´zquez 2006). Tipe ovari berperan dalam memulai, menjaga atau mempercepat diferensiasi ovarium (Kwon et al. 2001) sedangkan tipe otak sebagai pengendalian tingkah laku dan neuroestrogen di otak (Silverin et al. 2000).
Bahan aktif yang terkandung dalam AI, madu, dan pestisida (deltametrin), diduga berpengaruh dalam proses seks reversal dengan mempengaruhi ekspresi gen aromatase tipe ovari. Penelitian ini bertujuan untuk mengevaluasi mekanisme seks reversal pada ikan nila dengan memanipulasi ekspresi gen aromatase menggunakan AI, madu, dan pestisida.
Perumusan Masalah
Seks reversal merupakan salah satu metode untuk memperoleh populasi monoseks. Aromatase inhibitor dan madu merupakan bahan yang aman penggunaannya untuk menghasilkan monoseks jantan. Kontaminasi limbah yang berasal dari pestisida dapat mengarahkan kelamin betina (feminisasi). Proses deferensiasi kelamin pada ikan dipengaruhi oleh Aromatase P450, enzim yang terlibat dalam biosintesis estrogen dari androgen, yang mengkatalisis pembentukan estrogen dari androgen. Bahan yang terkandung dalam AI, madu, dan pestisida (deltametrin) diduga akan mempengaruhi (meningkatkan, mengurangi, atau menghilangkan) ekspresi gen aromatase tipe ovari yang dibuktikan dengan persentase kelamin jantan pada akhir pemeliharaan.
Tujuan dan Manfaat
3 melalui perendaman embrio ikan nila fase bintik mata berdasarkan ekspresi gen aromatase dan rasio kelamin. Informasi ekspresi gen aromatase berguna untuk mengetahui mekanisme seks reversal (pengarahan jenis kelamin jantan atau betina) pada ikan nila.
2
METODE
Materi Uji
Embrio fase bintik mata yang digunakan untuk percobaan seks reversal diperoleh dari hasil pemijahan induk betina dan induk jantan ikan nila nirwana berukuran 300-400g dengan perbandingan 1:1. Induk dipijahkan secara alami di dalam akuarium berukuran 100x50x60 cm. Embrio fase bintik mata dipanen setelah tiga hari pasca fertilisasi. Selama pemeliharaan, induk diberi pakan dengan kadar protein 35% secara at satiation setiap pagi dan sore hari. Bahan dan dosis yang digunakan untuk perlakuan seks reversal adalah sebagai berikut, AI (imidazole) 20 mg/L, madu (Perhutani, bunga kelengkeng) 10 ml/L, dan pestisida (Decis: bahan aktif deltametrin 25 g/L)0,025 mg/L.
Perlakuan Seks Reversal
Percobaan seks reversal dilakukan melalui perendaman embrio fase bintik mata menggunakan bahan berupa AI, madu, dan pestisida (Tabel 1), setiap perlakuan diulang sebanyak 3 kali. Embrio direndam dalam larutan perlakuan sesuai dengan dosisnya selama 24 jam dengan kepadatan sebanyak 80 ekor per ulangan. Perendaman dilakukan pada akuarium berukuran 20x20x20 cm (volume air 1,5 L), kemudian dipelihara dalam akuarium pemeliharaan sampai hari ke-14. Selanjutnya larva berumur 14 hari dipindahkan ke dalam akuarium pemeliharan berukuran 80x40x40 cm dengan volume air 50 L, kemudian volume air ditingkatkan sampai 75 L ketika larva sudah berumur 45 hari. Untuk menjaga kualitas air setiap akuarium dilengkapi dengan aerasi, filter, dan heater akuarium, serta dilakukan pergantian air sebanyak 75% setiap dua hari. Kualitas air media pemeliharaan berada pada kisaran yg optimal untuk pertumbuhan ikan DO (6,00-8,10 ppm), pH (6,46-6,65) dan suhu (28-30oC). Menurut Popma dan Masser
(1999) kondisi DO optimum untuk ikan nila di atas 2,5 ppm, pH 6-9, dan suhu (29-31oC).
Tabel 1. Bahan & dosis perlakuan seks reversal
No. Perlakuan Dosis Pemberian pakan ini dilakukan secara ad libitum. Pada umur 25 hari, larva diberi pakan komersial dengan kadar protein 38% yang diberikan secara at satiation
4
Analisis Ekspresi Gen Aromatase
Ekspresi gen aromatase dianalisis pada hari ke-1 dan ke-8 setelah perlakuan. Jaringan yang dianalisis pada larva berupa bagian tengah badan sampai kepala. Analisis ekpresi gen aromatase meliputi ekstraksi RNA, sintesis cDNA, dan amplifikasi gen aromatase (Sambrook dan Russell, 2001).
Ekstraksi RNA dan sintesis cDNA
Ekspresi gen aromatase dianalisis menggunakan metode RT-PCR. Sampel jaringan diambil pada waktu hari ke-1 dan ke-8 pasca perlakuan. Setiap ulangan diambil sebanyak 2 ekor untuk dilakukan ekstraksi RNA. RNA total diekstraksi menggunakan mini kit total RNA khusus untuk jaringan. Konsentrasi RNA total hasil ekstraksi diukur menggunakan NanoDrop 2000 Spectrophotometer.
Sintesis cDNA dari RNA total dilakukan menggunakan kit Ready-To-Go You-Prime First Strand Beads, FSRMB, (GE Healthcare) dengan prosedur sesuai manual. RNA total ditambahkan DEPC sampai volume total 30 μL, diinkubasi pada suhu 65oC selama 10 menit, dan kemudian disimpan di atas es (on ice).
Sampel RNA dipindahkan ke dalam tabung berisi kit FSRMB, dan ditambahkan 3
μL primer’dT3’RACE
VECT’(5’GTAATACGACTCACTATAGGGCACGCGTGG
TCGACGGCCCGGGCTGGTTTT TTTTTTTTTTTTTTT-3’) dengan konsentrasi
1 μg/3 μL. Larutan dihomogenkan, selanjutnya diinkubasi pada suhu 37oC selama
1 jam. cDNA yang terbentuk disimpan dalam freezer -20°C.
Amplifikasi gen aromatase
Primer yang digunakan mengacu pada Heriyati (2012) yang mendesain berdasarkan sekuen gen aromatase tipe ovari ikan mujair dengan no akses: AF135850. Primer tersebut adalah tiArm1-F:5’-ATGGATCTGATCTCTGCT
TGT-3’dan tiArm1-R:5’-CAAACCAAACAGAAAGAAGG-3’. Kondisi PCR
yang digunakan yaitu pre-denaturasi 94°C selama 3 menit, 35 siklus pada denaturasi 94°C selama 30 detik, annealing 54°C selama 30 detik dan ekstensi 72°C selama 30 detik, serta ekstensi akhir 72°C selama 3 menit. Hasil PCR diseparasi menggunakan elektroforesis dengan gel agarosa 2% dengan target gen 300 bp. DNA divisualisasi dengan pewarna etidium bromida menggunakan cahaya ultraviolet. Tingkat ekspresi gen diperoleh dengan membandingkan total
pixel gen aromatase tipe ovari dengan β-actin (kontrol internal) menggunakan
5
Identifikasi jenis kelamin
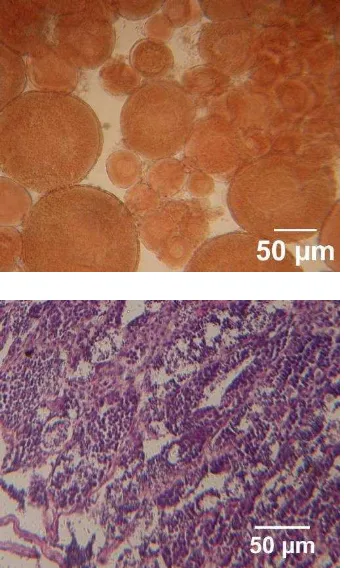
Identifikasi jenis kelamin dilakukan pada akhir pemeliharaan (75 hari) dengan menganalisis gonad menggunakan metode asetokarmin dan histologi gonad. Metode analisis asetokarmin mengikuti metode Guerrero dan Shelton (1974). Asetokarmin adalah larutan pewarna yang digunakan untuk mewarnai jaringan gonad untuk pemeriksaan dengan mikroskop. Histologi gonad menggunakan pewarnaan hematoksilin-eosin.
Karakterisasi Truss Morfometrik
Pengukuran karakter morfometrik dilakukan pada akhir pemeliharaan dengan mengambil ikan nila sebanyak 20 ekor per ulangan secara acak. Kemudian ikan dipingsankan dan diletakkan di atas kertas untuk dilakukan penitikan tanda sesuai dengan kerangka tubuh. Selanjutnya masing-masing jarak titik di seluruh badan ikan dihubungkan dan diukur dengan jangka sorong sehingga dari 10 titik diperoleh 21 karakter yang dapat dilihat pada Gambar 1. Deskripsi dari komponen titik-titik tanda disajikan pada Tabel 2.
Gambar 1. Titik truss morfometrik pada ikan nila (Brzesky dan Doyle, 1988) Tabel 2. Deskripsi 21 karakter truss morfometrik yang diukur pada ikan nila
No Bidang Truss Kode Deskripsi Jarak
1 Kepala A1 Bawah mulut - awal sirip perut
2 A2 Bawah mulut - atas mata
3 A3 Atas mata - awal sirip punggung keras
4 A4 Awal sirip perut - awal sirip punggung keras
5 A5 Awal sirip perut - atas mata
6 A6 Bawah mulut - awal sirip punggung keras
7 Tengah Tubuh B1 Awal sirip perut - awal sirip anal
8 B3 Awal sirip punggung keras - awal sirip punggung
lunak
9 B4 Awal sirip punggung lunak - awal sirip anal
10 B5 Awal sirip punggung keras - awal sirip anal
11 B6 Awal sirip punggung lunak - awal sirip perut
12 Tubuh Belakang C1 Awal sirip anal - akhir sirip anal
13 C3 Awal sirip punggung lunak - akhir sirip punggung
6
14 C4 Akhir sirip punggung lunak - akhir sirip anal
15 C5 Awal sirip punggung lunak - akhir sirip anal
16 C6 Akhir sirip punggung lunak - awal sirip anal
17 Pangkal ekor D1 Akhir sirip anal - awal sirip ekor bawah
18 D3 Akhir sirip punggung lunak - awal sirip ekor atas
19 D4 Awal sirip ekor atas - awal sirip ekor bawah
20 D5 Akhir sirip punggung lunak - awal sirip ekor bawah
21 D6 Awal sirip ekor atas – akhir sirip anal
Parameter Uji Laju pertumbuhan harian (LPH)
Nilai laju pertumbuhan harian mulai semenjak larva berumur 14 hari. Laju pertumbuhan harian ikan uji dihitung berdasarkan persamaan yang dikemukakan oleh Halver (1989), yaitu:
Keterangan:
Α = Laju pertumbuhan harian (LPH)
Wt = Rata-rata bobot individu pada akhir pemeliharaan (g) Wo = Rata-rata bobot individu pada awal pemeliharaan (g) T = Lama waktu pemeliharaan (hari)
Tingkat Kelangsungan Hidup (TKH)
Tingkat Kelangsungan Hidup (TKH) diperoleh berdasarkan persamaan berikut:
TKH = [Nt / No] x 100% Keterangan:
TKH = Tingkat Kelangsungan Hidup
Nt = Jumlah ikan pada akhir pemeliharaan No = Jumlah ikan pada awal pemeliharaan
Pertumbuhan Mutlak
Pertumbuhan mutlak ikan diperoleh dengan menggunakan persamaan berikut:
7
Keterangan: IJ = Persentase kelamin jantan (%)
Ij = Jumlah ikan jantan (ekor)
Is = Jumlah ikan keseluruhan yang diamati (ekor)
Analisis data
8
3
HASIL DAN PEMBAHASAN
Hasil
Hasil elektroforesis dan tingkat ekspresi gen aromatase perlakuan kontrol, AI, madu, dan pestisida yang diperoleh dengan menggunakan UN-SCAN-IT gel 6.1 disajikan pada Gambar 2. Tingkat ekspresi gen aromatase tipe ovari pada hari ke-1 setelah diberi perlakuan dengan AI, madu, dan pestisida lebih rendah dibandingkan kontrol. Pada hari ke-8 setelah perlakuan terlihat perubahan tingkat ekspresi gen antar perlakuan. Tingkat ekspresi gen paling rendah pada perlakuan AI sedangkan yang paling tinggi pada perlakuan pestisida.
Gambar 2. Ekspresi gen aromatase tipe ovari (A) dan kontrol internal berupa gen β-aktin (B) pada ikan nila hari ke-1 setelah perlakuan perendaman embrio menggunakan AI, Madu, Pestisida dibandingkan dengan kontrol dan hari ke-8 setelah perlakuan; M=marker DNA; tanda panah menunjukkan target gen pada 300 bp (A) & 200 bp (B); tingkat ekspresi gen aromatse tipe ovari dibandingkan dengan β-actin menggunakan UN-SCAN-IT gel 6.1 (C).
9 dibandingkan kontrol sebesar 68%. Pada perlakuan madu persentase jantan yang dihasilkan tidak berbeda nyata dengan kontrol. Nilai TKH, LPH, dan PM setiap perlakuan tidak berbeda nyata dibandingkan kontrol, yaitu berkisar 65-69% (TKH), 8-9% (LPH), serta 26-29 g (PM) (Lampiran 1).
Tabel 3. Persentase jantan, Laju pertumbuhan harian (LPH), Tingkat kelangsungan hidup (TKH), Pertumbuhan mutlak (PM) ikan nila pada perlakuan seks reversal menggunakan AI, madu, dan pestisida melalui perendaman embrio
Perlakuan Jantan (%) LPH (%) TKH (%) PM (g)
Kontrol 68,32±2,79b 8,98±0,13 68,06±8,83 29,11 ±1,92
AI 80,77±2,52a 9,10±0,13 69,29±6,97 28,03±4,23
Madu 70,93±1,24b 8,81±0,23 65,42±3,82 26,30±4,03
Pestisida 50,45±5,81c 8,81±0,35 66,67±7,11 26,41±6,05
Keterangan: Nilai yang tertera merupakan nilai rata-rata dan simpangan baku. Huruf superskrip yang berbeda pada kolom yang sama menunjukkan pengaruh perlakuan yang berbeda nyata (p<0,05).
Hasil 21 karakter truss morfometrik (Tabel 4) menunjukkan bahwa terdapat karakter pembeda hasil truss morfometrik pada ikan jantan dan betina yang tidak sama antara perlakuan dengan kontrol. Pada perlakuan AI terdapat empat buah karakter pembeda yaitu A4 (awal sirip perut - awal sirip punggung keras), A5 (awal sirip perut - atas mata), B4 (awal sirip punggung lunak - awal sirip anal), dan B5 (awal sirip punggung keras - awal sirip anal) namun karakter ini berbeda dengan kontrol yang terdapat pada A2 (bawah mulut - atas mata), C3 (awal sirip punggung lunak - akhir sirip punggung keras), dan D6 (awal sirip ekor atas – akhir sirip anal). Perlakuan pestisida hanya terdapat dua karakter pembeda yaitu pada A2 (bawah mulut - atas mata) dan A6 (bawah mulut - awal sirip punggung keras). Sedangkan pada perlakuan madu tidak terdapat karakter pembeda antara ikan jantan dan betina. Nilai rata-rata ukuran bagian tubuh karakter pembeda pada perlakuan AI memperlihatkan nilai yang lebih besar pada ikan betina dibandingkan ikan jantan. Pada kontrol ukuran A2 dan D6 lebih besar pada ikan jantan sedangkan pada ukuran C3 jantan lebih kecil. Kemudian pada perlakuan pestisida kedua karakter pembeda memiliki ukuran yang lebih besar pada ikan jantan.
Tabel 4. Perbandingan 21 karakter truss morfometrik ikan nila pada perlakuan seks reversal menggunakan AI, madu, dan pestisida melalui perendaman embrio
Karakter Kontrol AI Madu Pestisida
10
B4 35.34 ± 2.41 33.04 ± 5.39** 33.15 ± 2.83 34.68 ± 3.50
B5 52.06 ± 5.26 49.82 ± 2.77** 50.91 ± 4.60 50.34 ± 3.61
Tabel 4. Perbandingan 21 karakter truss morfometrik ikan nila pada perlakuan seks reversal menggunakan AI, madu, dan pestisida melalui perendaman embrio (Lanjutan)
Karakter Kontrol AI Madu Pestisida
B6 47.18 ± 3.27 46.21 ± 5.17 46.64 ± 4.25 45.51 ± 6.65
C1 20.48 ± 2.02 20.25 ± 2.91 20.36 ± 2.77 19.52 ± 3.05
C3 19.16 ± 2.69** 19.49 ± 2.06 19.96 ± 1.87 20.76 ± 3.42
C4 16.60 ± 1.32 15.83 ± 1.55 16.45 ± 1.59 16.53 ± 1.24
C5 29.45 ± 3.08 28.86 ± 1.92 29.45 ± 2.73 30.39 ± 1.49
C6 31.76 ± 2.11 31.44 ± 2.29 30.88 ± 1.81 31.86 ± 3.72
D1 7.83 ± 2.44 7.42 ± 2.03 8.17 ± 1.78 8.27 ± 1.60
D3 7.08 ± 2.22 6.78 ± 2.05 7.38 ± 1.70 7.48 ± 1.30
D4 15.46 ± 0.92 15.33 ± 2.22 15.68 ± 2.31 15.48 ± 0.92
D5 18.10 ± 1.13 17.56 ± 1.36 18.04 ± 1.25 18.10 ± 1.19
D6 17.31 ± 0.93* 16.45 ± 1.29 17.48 ± 2.29 17.76 ± 2.01
Keterangan: Data berupa rata-rata dari ukuran bagian dibagi panjang baku dikali 100 (cm) pada ikan jantan; * menunjukan karakter yang berbeda nyata (p<0,05); * Jantan > Betina; ** Betina > Jantan.
11 Gambar 3. Hasil Asetokarmin (A) [perbesaran 200x] dan Histologi (B)
[perbesaran 400x] gonad ikan nila ♂ dan ♀ umur 75 hari.
Pembahasan
Aktivitas aromatase berkorelasi dengan tingkat ekspresi aromatase mRNA (Chang et al, 1997). Ekspresi gen aromatase tipe ovari pada hari ke-1 setelah perendaman menunjukkan level ekspresi gen yang lebih rendah dibandingkan kontrol. Bahan aktif yang terkandung dalam AI, madu, dan pestisida mempengaruhi jumlah mRNA gen aromatase tipe ovari. Pada hari ke-8 setelah perendaman, perlakuan AI mampu menurunkan tingkat ekspresi gen aromatase tipe ovari, sebaliknya perlakuan pestisida meningkatkan ekspresi gen aromatase tipe ovari. Hasil ini menunjukkan adanya penghambatan terhadap ekspresi gen aromatase tipe ovari, sehingga konversi androgen ke estrogen berkurang. Kondisi ini menyebabkan konsentrasi androgen (testosteron) dalam larva ikan meningkat, sehingga menginduksi proses maskulinisasi. Sebaliknya pada perlakuan pestisida terjadi peningkatan ekspresi (enhancement) gen aromatase tipe ovari yang menyebabkan biosintesis estradiol dari androgen meningkat, yang menginduksi proses feminisasi. Pada ikan japanese flounder (Paralichthys olivaceus) jantan terjadi penekanan ekspresi gen aromatase selama proses deferensiasi kelamin, sebaliknya terjadi peningkatan pada kelompok betina (Kitano et al., 1999). Peningkatan ekspresi gen aromatase tipe ovari juga terjadi pada ikan zebra yang terekspos pestisida (monokrotopos 40%) (Zhang et al. 2013).
Menurut Kwon et al. (2001) tingkat ekspresi gen aromatase tipe ovari pada ikan nila betina terus meningkat pada 11 sampai 31 dpf (jumlah hari setelah fertilisasi), sedangkan pada ikan jantan mengalami penurunan, sehingga terjadi perbedaan yang signifikan antara kedua jenis kelamin. Hal ini memperlihatkan bahwa aromatase tipe ovari memainkan peran penting dalam menjaga atau mempercepat diferensiasi ovarium setelah diferensiasi seks awal. Perbedaan ekspresi gen aromatase di daerah gonad dugaan menjadi faktor dalam memulai diferensiasi seksual. Oleh karena itu gen aromatase tipe ovari memainkan peran penting dalam diferensiasi seks pada ikan nila. Peran penting ini dicapai dengan penurunan ekspresi pada jantan dan peningkatan ekspresi pada betina (Kwon et al.
2001; Wang dan Orban 2007; Blazquez et al. 2008; Injiri et al. 2008). Estrogen mungkin tidak hanya diperlukan untuk memicu diferensiasi ovarium, tetapi juga diperlukan untuk mempertahankan diferensiasi ovarium ini, dimana terjadi penurunan tajam tingkat transkrip gen ini pada hewan yang menjalani diferensiasi testis (Kitano et al. 1999; Wang dan Orban 2007; Jørgensen et al. 2008).
12
konsentrasi antara media dengan embrio (Nurlaela, 2002). Aromatase inhibitor
mampu menghambat sintesis estrogen (Brodie et al. 1999) yaitu diduga dengan menghambat transkripsi gen aromatase tipe ovari (Gambar 2) sehingga terjadi penurunan translasi enzim aromatase, akibatnya terjadi peningkatan persentase kelamin jantan (Tabel 3). Hasil penelitian Kwon et al. (2000) menyebutkan larva nila diberi pakan dengan AI pada minggu pertama (11-17 dpf) menyebabkan peningkatan persentase jantan secara signifikan. Demikian juga dengan metode perendaman, Nurlaela (2002) dan Artanto (2010) menyatakan bahwa perendaman embrio (fase bintik mata) dan larva ikan nila umur 1 hari setelah menetas dapat meningkatkan persentase kelamin jantan.
Ikan zebra yang dipelihara dalam media mengandung pestisida 0,1 mg/L (monokrotopos 40%) mengakibatkan peningkatan persentase betina sebanyak 71% dibandingkan dengan kontrol 49% (Zhang et al. 2013). Pada ikan gupi terjadi peningkatan kadar estradiol-17β secara signifikan, sehingga terjadi sintesis vitelogenin. Selain itu MCP juga menurunkan kadar testosteron, pertumbuhan testis terhambat dan penurunan jumlah sperma (Tian et al. 2012). Pada penelitian ini terjadi peningkatan persentase betina yang terlihat dari rendahnya persentase jantan (50,45%) dibandingkan dengan kontrol (68,32%). Hal ini mengindikasikan bahwa ikan yang terekspos pestisida (deltametrin) pada periode perkembangan gonad berdampak pada feminisasi.
Persentase kelamin jantan pada perlakuan madu (70,93%) tidak berbeda nyata dengan kontrol dan level ekspresi gen aromatase yang tetap tinggi pada hari ke-8 diduga akibat kandungan K dan chrysin madu yang digunakan tidak mencukupi jumlah optimal untuk terjadinya seks reversal pada ikan nila. Sumber nektar dan lama penyimpanan diduga dapat mempengaruhi konsentrasi bahan aktif yang terkandung di dalam madu. Flavonoid chrysin dapat menjadi penghambat aktivitas enzim aromatase (aromatase inhibitor) (Gambelunghe et al.
2003). Kalium dalam madu berfungsi sebagai pengarah diferensiasi kelamin ikan melalui modulasi peredaran testosteron, dan pengendalian tindakan androgen (Capelo et al. 1993).
14
4 SIMPULAN DAN SARAN
Simpulan
Seks reversal pada ikan nila dipengaruhi oleh modulasi ekspresi gen aromatase tipe ovari. Peningkatan ekspresi gen aromatase tipe ovari pada perkembangan awal ikan menyebabkan feminisasi, sebaliknya penurunan ekspresi gen menyebabkan maskulinisasi.
Saran
15
DAFTAR PUSTAKA
Artanto AW. 2010. Pengaruh pemberian aromatase inhibitor melalui perendaman larva terhadap keberhasilan sex reversal dan pertumbuhan ikan nila merah
Oreochromis Sp. [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Beardmore JA, Mair GC, Lewis RI. 2001. Monosex male production in finfish as exemplified by tilapia: applications, problems, and prospects. Aquaculture
197:283–301
Blázquez M, Gonzalez A, Papadaki M, Mylonas C, Piferrer F. 2008. Sex related changes in estrogen receptors and aromatase gene expression and enzymatic activity during early development and sex differentiation in the European sea bass (Dicentrarchus labrax). Gen. Comp. Endocrinol 158: 95–101. Brodie A. 1991. Aromatase and its Inhibitor-An Overview. J.Steroid Biochem.
Molec. Bio. 40: 255-261.
Brzeski, VJ, Doyle RW 1988. A morphometric criterion for sex discrimination in Tilapia. In The Second International Symposium on Tilapia in Aquaculture
(Pullin, R. S. V., Bhukaswan, T., Tonguthai, K. & Maclean, J. L., eds), pp. 439–444. Manila: ICLARM Conference Proceedings.
Capelo AS, Asuncion C, Francisco T, Teodomiro F, Rafael P. 1993. Potassium regulates plasma testosterone and renal ornithinedecarboxylase in mice.
Federation of European Biochemical Societies 333: 32-34.
Chang XT, Kobayashi T, Kajiura H, Nakamura M, Nagahama Y. 1997 Isolation and characterization of the cDNA encoding the tilapia (Oreochromis niloticus) cytochrome P450 aromatase (P450arom): changes in P450arom mRNA, protein and enzyme activity in ovarian follicles during oogenesis. J Mol Endocrinol 18: 57–6
Chang X, Kobayashi T, Senthilkumaran B, Kajura HK, Sudhakumari CC, Nagahama Y. 2005. Two types of aromatase with diVerent encoding genes, tissue distribution and developmental expression in Nile tilapia (Oreochromis niloticus). General and Comparative Endocrinology
141:101–115.
Devlin RH, Nagahama Y. 2002. Sex determination and sex differentiation in fish: an overview of genetic, physiological, and environmental influence.
Aquaculture, 208: 191-364.
Food and Agriculture Organization (FAO). 2012. Marked reports of tilapia. Globefish. FAO. http://www.globefish.org/tilapia-march-2012.html [21 Oktober 2013]
Gambelunghe C, Rossi R, Sommavilla M, Ferranti C, Rossi R, Ciculi C, Gizzi S, Micheletti A, Rufini S. 2003. Effects of chrysin on urinary testosterone levels in human males. J Med Food Winter; 6(4):387-90.
Guerrero RD, Shelton WL. 1974. An aceto-carmine squash technique for sexing juvenile fishes. The Progressive Fish-Culturist 36: 56.
Gunarso W. 1989. Mikroteknik. PAU Ilmu Hayat. Institut Pertanian Bogor. Bogor. Heriyati E. 2012. Sex reversal ikan nila menggunakan madu dan analisis ekspresi
gen aromatase [tesis]. Bogor (ID): Institut Pertanian Bogor.
16
early differentiation of a teleost fish, the Nile tilapia Oreochromis niloticus.
Biology of Reproduction 78: 333–341
Jørgensen A, Morthorst JE, Andersen O, Rasmussen LJ, Bjerregaard P. 2008. Expression profiles for six zebrafish genes during gonadal sex differentiation. Reprod. Biol. Endocrinol 6: 25.
Kaban IRE. 2010. Pengaruh pemberian aromatase inhibitor melalui pakan buatan terhadap keberhasilan sex reversal Ikan nila merah Oreochromis sp. [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Kitano T, Takamune K, Kobayashi T, Nagahama Y, Abe SI.1999. Suppression of P450 aromatase gene expression insex-reversed males produced by rearing genetically female larvae at a high water temperature during a period of sex diferentiation in the Japanese flounder (Paralichthys olivaceus). Journal of Molecular Endocrinology 23:167–176.
Kwon JY, Haghpanah V, Kogson-Hurtado LM, Mcandrew BJ, Penman DJ. 2000. Masculinization of genetic female nile tilapia (Oreochromis niloticus) by dietary administration of an aromatase inhibitor during sexual differentiation. Experimental zoology: 287:46–53.
Kwon JY, Mcandrew BJ, Penman DJ. 2001. Cloning of brain aromatase gene and expression of brain and ovarian aromatase genes during sexual differentiation in genetic male and female nile tilapia Oreochromis niloticus. Molecular Reproduction and Development 59: 359-370.
Liana YP. 2005. Efektifitas Aromatase Inhibitor yang Diberikan Melalui Pakan Buatan Terhadap Sex Reversal Ikan Nila Merah Oreochromis sp. [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Martati E. 2006. Efektivitas Madu Terhadap Nisbah Kelamin Ikan Gapi ( Poecilia reticulata Peters). [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Miller WR, Bartlett, Brodie AM, Brueggemeier RW, Salle E, Lonning PE, Lombart A, Maass N, Maudelonde T, Sasano H, Goss PE. 2008. Aromatase inhibitors: Are there differences between steroidal and nonsteroidal aromatase inhibitors and do they matter?. The Oncologist 13:829–837. [Diunduh 2013 April 27]. Tersedia pada: http://theon cologist.alphamedpress.org/content/13/8/829.full.
National Pesticide Information Center (NPIC). 2010. Deltamethrin Technical Fact Sheet. Oregon (US): Oregon State University.
Nurlaela. 2002. Pengaruh Aromatase Inhibitor Pada Perendaman Embrio Terhadap Nisbah Kelamin Ikan Nila Merah (Oreochromis sp.) [skripsi]
Pusdatin KKP (Pusat Data Statistik dan Informasi Kementrian Kelautan dan Perikanan). 2013. Statistik Kelautan dan Perikanan 2011. Jakarta (ID): Pusat Data Statistik dan Informasi Kementrian Kelautan dan Perikanan.
17 Strauss RE, Bookstein FL. 1982. The truss: body form reconstructions in
morphometrics. Systematic Zoology 31: 113-135.
Sudrajat AO, Astutik ID, Arfan H. 2007. Seks reversal ikan nila merah (Oreochromis sp.) melalui perendaman larva menggunakan aromatase inhibitor. Jurnal Akuakultur Indonesia 6(1): 103–108.
Syaifuddin A. 2004. Pengaruh pemberian suplemen madu pada pakan larva ikan nila (Oreochromis niloticus) GIFT terhadap rasio jenis kelaminnya [skripsi]. Malang (ID): Universitas Brawijaya.
Tian H, Yun L, Wang W, Wu P, Ru S. 2012. Exposure to monocrotophos pesticide during sexual development causes the feminization/demasculi- nization of the reproductive traits and a reduction in the reproductive success of male guppies (Poecilia reticulata). Toxicology and Applied Pharmacology 263:163–170.
Wang XG, Orban L. 2007. Anti-Mullerian hormone and 11beta-hydroxylase show reciprocal expression to that of aromatase in the transforming gonad of zebrafish males. Dev. Dyn 236: 1329–1338.
Zairin M. 2003. Endokrinologi dan perannya bagi masa depan perikanan Indonesia [Orasi Ilmiah]. Bogor (ID): Institut Pertanian Bogor.
Zhang X, Gao L, Yang K, Tian H, Wang W, Ru S. 2013. Monocrotophos pesticide modulates the expression of sexual differentiation genes and causes phenotypic feminization in zebrafish (Danio rerio). Compar ative Biochemistry and Physiology Part C: Toxicology & Pharmacology 157: 33– 40.
18
19 Lampiran 1. Analisis statistik Persentase kelamin jantan, Laju Pertumbuhan
Harian (LPH), Tingkat Kelangsungan Hidup (Sintasan) dan perumbuhan Mutlak (PM)
Test of Homogeneity of Variances
Levene Statistic df1 df2 Sig.
Jantan 2.779 3 8 .110
Lph 2.006 3 8 .192
Sintasan .758 3 8 .548
Anova
Sum of Squares Df Mean Square F Sig.
Jantan Between Groups 1438.416 3 479.472 38.841 .000
Within Groups 98.757 8 12.345
Total 1537.173 11
Lph Between Groups .184 3 .061 1.163 .382
Within Groups .421 8 .053
Total .605 11
Sintasan Between Groups 25.364 3 8.455 .176 .909
Within Groups 383.496 8 47.937
Total 408.859 11
Persentase Kelamin jantan Duncan
perlakuan N
Subset for alpha = 0.05
1 2 3
D 3 50.4467
A 3 68.3233
C 3 70.9300
B 3 80.7767
20
RIWAYAT HIDUP
Penulis dilahirkan di Desa Pamuatan, Kabupaten Sawahlunto Sijunjung, Sumatera Barat, pada tanggal 16 Desember 1989 dari pasangan Winaldi dan Irdawati Almh. Penulis merupakan anak kedua dari 2 orang bersaudara. Kakak penulis bernama Winda Prima Nisti S.Pd. Penulis menyelesaikan jenjang pendidikan sarjana di Teknologi dan Manajemen Perikanan Budidaya, Deperatemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan (FPIK), Institut Pertanian Bogor (IPB) pada tahun 2012. Kemudian penulis melanjutkan pendidikan program Magister Sains pada tahun 2012 di Sekolah Pascasarjana Program Studi Ilmu Akuakultur FPIK, IPB dengan memperoleh Beasiswa Unggulan Dikti (BU). Penelitian yang dilakukan penulis untuk menyelesaikan studi Magister Sains berjudul Analisis Ekspresi Gen Aromatase pada Seks Reversal Ikan Nila