INTRODUKSI DAN EKSPRESI GEN
HORMON PERTUMBUHAN IKAN NILA
(
Oreochromis niloticus
)
PADA IKAN LELE (
Clarias
sp)
GUSRINA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan dengan sebenar-benarnya bahwa semua pernyataan dalam disertasi saya yang berjudul :
“Introduksi dan Ekspresi Gen Hormon Pertumbuhan Ikan Nila (Oreochromis niloticus) pada Ikan Lele (Clarias sp)”
merupakan gagasan atau hasil penelitian disertasi saya sendiri, dengan pembimbingan oleh para komisi pembimbing, terkecuali yang dengan jelas ditunjukkan rujukannya. Disertasi ini belum pernah diajukan untuk memperoleh gelar pada program sejenis di perguruan tinggi lain.
Semua data dan informasi yang digunakan telah dinyatakan secara jelas dan dapat diperiksa kebenarannya.
Bogor, Agustus 2011
ABSTRACT
GUSRINA. Introduction and expression of tilapia (Oreochromis niloticus) growth hormone gene in catfish (Clarias sp). Under direction of KOMAR SUMANTADINATA, ALIMUDDIN, and UTUT WIDYASTUTI.
The gene transfer technology applied in commercially important aquatic animals is to enhance genetic quality of aquaculture broodstock. This study was conducted to introduce gene encoding growth hormone (GH) in catfish embryos to improve its growth rate. In fish, microinjection was the earliest technique developed to introduce foreign DNA into fertilized eggs. However, the opaquness, stickiness and buoyancy of the embryos, the invisibility of the pronuclei, the togness of the chorion, and the higher mortality of injected eggs make this technique time consuming and requires sophisticated skills. Electropration method is able to produce mass fish transgenic. In this study, we transferred a plasmid containing GH gene of Nile tilapia (tiGH), driven by medaka
β-actin promoter (mBP) into catfish using microinjection and electroporation methods, to obtain growth enhanced transgenic fish. The DNA solution (mBP-tiGH) used was 50 µg/ml in sterile distillated water. The parameter observed was survival rate of embryos (SRe), hatching rate (HR), and the percentage of individual carrying mBP-tiGH. Transgenic individual carrying tiGH was identified by PCR ( Polymerase Chain Reaction) method with specific primer for tiGH gene. The analysis of gene expression was conducted by RT-PCR. The results of research from 100 catfish embryos showed that control uninjected treatment was higher SRe and HR of eggs fertilized while the Sre and HR in electroporated-sperm was similar with control (SRe 98.5%; HR 91.2%). Percentage of catfish carrying tiGH gene by microinjection methods was 42.86% (12/28) while by electroporation methods was 87% and 93%. Germ line transmission of the transgene at first generation was 4.0 % - 8.33%. The growth of catfish in founder generation was not different between transgenic and nontransgenic. The growth of transgenic catfish at first generation were up to 7 fold higher compared with nontransgenic fish.
RINGKASAN
GUSRINA. Introduksi dan Ekspresi Gen Hormon Pertumbuhan Ikan Nila (Oreochromis niloticus) pada Ikan Lele (Clarias sp). Dibimbing oleh KOMAR SUMANTADINATA, ALIMUDDIN dan UTUT WIDYASTUTI.
Kementerian Kelautan Perikanan menargetkan peningkatan produksi ikan lele 50% pertahun. Salah satu cara yang dapat dilakukan untuk meningkatkan produksi adalah dengan memelihara ikan yang tumbuh cepat. Saat ini sedang dicoba suatu metode yang dapat menunjang program tersebut yaitu teknologi transgenesis. Teknologi transgenesis merupakan suatu teknik rekayasa genetik dengan cara mengintroduksi gen yang khas pada ikan untuk mendapatkan keunikan yang memiliki nilai tambah. Teknologi transfer gen telah dikembangkan untuk memperbaiki karakter kuantitatif dan kualitatif. Gen dari individu suatu spesies diisolasi, dihubungkan ke promoter (sebagai sekuens pengatur ekspresi gen atau on/off switches), diklon dan diperbanyak terutama dalam plasmid .
Aplikasi teknologi transgenik pada ikan lele di Indonesia belum dilakukan. Pada penelitian ini untuk menghasilkan ikan lele transgenik dilakukan beberapa tahapan penelitian. Tahap pertama dalam penelitian ini adalah melakukan pengujian terhadap aktivitas promoter. Promoter yang digunakan dalam pengujian ini adalah ß-aktin yang berasal dari ikan medaka yang disambungkan dengan gen penyandi protein berpendar hijau dalam konstruksi ß-aktin-GFP (mBP-GFP). Aktivitas promoter tersebut dianalisis dengan mengamati ekspresi gen penanda GFP (Green fluorescent protein) pada embrio ikan lele. Tahap kedua dalam penelitian ini adalah mengintroduksikan gen mBP-tiGH pada embrio ikan lele menggunakan metode mikroinjeksi. Tahap ketiga dalam penelitian ini adalah menganalisis ekspresi gen mBP-tiGH pada generasi founder dan generasi pertama pada ikan lele. Pada tahap terakhir dilakukan juga transfer gen menggunakan metode elektroporasi untuk menghasilkan ikan transgenik dalam jumlah banyak. Hasil penelitian ini diharapkan akan menjadi acuan dalam rangka memproduksi ikan lele transgenik yang mempunyai pertumbuhan yang lebih baik.
Pada tahap pertama digunakan konstruksi gen dalam bentuk plasmid mBA-GFP dengan konsentrasi 50 µg/ml . Konstruksi gen tersebut diinjeksikan ke dalam blastodisk embrio ikan lele fase 1 sel. Jumlah telur yang diinjeksi untuk konstruksi gen adalah sebanyak 30 embrio dan dilakukan 2 pengulangan. Telur diinkubasi pada akuarium dengan suhu air sekitar 28o
Penelitian tahap kedua dilakukan untuk mengetahui keberhasilan introduksi gen penyandi hormon pertumbuhan (Growth Hormone, GH) pada embrio ikan lele sehingga dapat memperbaiki kecepatan tumbuhnya. Gen GH dari ikan nila (tiGH) yang dikontrol oleh promoter beta-aktin (mBP) dari ikan medaka ditransfer menggunakan metode mikroinjeksi ke dalam blastodisk embrio ikan lele fase satu sel. Konsentrasi konstruksi gen mBP-tiGH yang ditransfer adalah 50 µg/ml akuabides. Parameter yang diamati meliputi derajat kelangsungan hidup embrio (DKHe), derajat penetasan (DP) dan persentase individu ikan lele yang membawa mB-tiGH. Identifikasi ikan yang membawa mB-tiGH ditentukan menggunakan metode PCR dengan primer spesifik untuk gen tiGH. Hasil penelitian dengan menggunakan metode mikroinjeksi dari 100 embrio yang diinjeksi menunjukkan bahwa nilai DKHe (97%) dan DP (94%) pada kontrol (tidak dimikroinjeksi) lebih tinggi dibandingkan dengan perlakuan mikroinjeksi (30% untuk DKHe, dan 28% DP). Ikan lele yang membawa mBP-tiGH dengan metode mikroinjeksi adalah 42,86% (12/28).
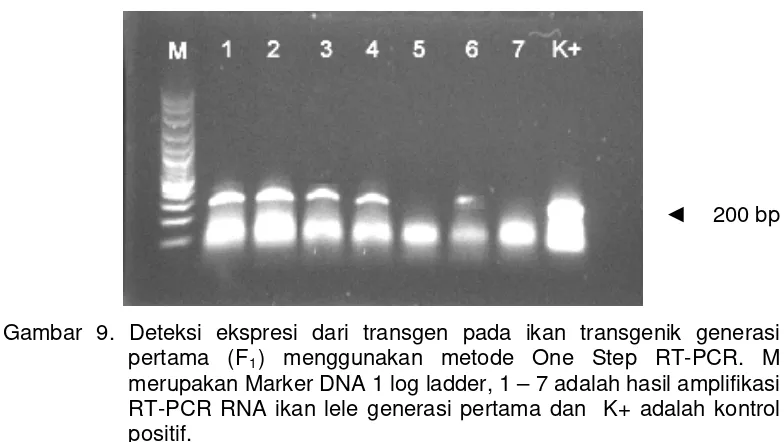
Penelitian tahap ketiga bertujuan untuk menganalisis ekspresi gen penyandi hormon pertumbuhan ikan nila (tiGH) pada ikan lele (Clarias sp) pada generasi pertama. Ikan lele transgenik founder yang diperoleh dari hasil penelitian sebelumnya dilakukan pemeliharaan sampai siap untuk dipijahkan. Setelah 12 bulan pemeliharaan dilakukan pengamatan tingkat kematangan gonad dan diperoleh 4 ekor induk ikan lele yang matang kelamin dengan jumlah jantan 3 ekor dan betina 1 ekor. Ikan lele jantan transgenik founder disilangkan dengan ikan lele betina nontransgenik, sedangkan ikan lele betina transgenik founder disilangkan dengan ikan lele jantan nontransgenik. Proses pemijahan dilakukan secara semi-buatan. Penetasan telur dan pemeliharaan larva dilakukan sesuai dengan prosedur SNI (2004). Parameter yang diamati adalah ekspresi gen secara fenotipe dan genotipe. Ekspresi gen secara fenotipe diketahui dengan mengamati pertumbuhan ikan lele, sedangkan secara genotipe adalah dengan analisa RT-PCR. Berdasarkan hasil analisis RT-PCR, terdapat 1 ekor memperlihatkan ekspresi transgen dari 9 ekor pada generasi founder, sedangkan pada generasi pertama memperlihatkan ekspresi transgen terdapat 5 ekor dari 7 ekor yang dianalisis. Hal ini memperlihatkan bahwa gen yang telah disisipkan tersebut terekspresi, walaupun tidak semua mengekspresikan transgen. Identifikasi ikan yang membawa gen mBP-tiGH ditentukan menggunakan metode PCR dengan primer spesifik untuk gen tiGH. Hasil penelitian dari 4 ekor induk lele transgenik founder hanya 2 ekor yang memijah dan diperoleh hasil pada ikan lele transgenik generasi pertama yang membawa gen mBP-tiGH adalah 8,33% (15 dari 180) dan 4,0% (6 dari 150). Pertumbuhan ikan lele pada generasi founder tidak berbeda antara transgenik dan nontransgenik. Pertumbuhan ikan lele generasi pertama (rata-rata bobot) antara transgenik dan nontransgenik berbeda nyata dengan peningkatan sampai 7 kali lipat dibandingkan dengan nontransgenik. Kesimpulan adalah bahwa gen mBP-tiGH dapat ditransmisikan pada generasi pertama dan memberikan peningkatan pertumbuhan pada benih ikan lele.
Transfer gen menggunakan elektroporasi menunjukkan bahwa nilai DKHe dan DP antara kontrol dengan perlakuan elektroporasi relatif sama 98,5% untuk DKHe, dan 91,2% DP. Ikan lele yang membawa mBP-tiGH dengan metode elektroporasi yaitu 90% lebih tinggi dibandingkan dengan mikroinjeksi. Dengan demikian metode elektroporasi dapat digunakan untuk meningkatkan jumlah ikan lele tarnsgenik yang dihasilkan.
© Hak Cipta milik IPB, tahun 2011.
Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya.
a. Pengutipan hanya untuk kepentingan pendidikan, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah
b. Pengutipan tersebut tidak merugikan kepentingan wajar IPB.
INTRODUKSI DAN EKSPRESI GEN
HORMON PERTUMBUHAN IKAN NILA
(
Oreochromis niloticus
)
PADA IKAN LELE (
Clarias
sp)
GUSRINA
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor
pada Program Studi Ilmu Perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji Ujian Tertutup : Dr. Ir. Widanarni, MSi Dr. Ir. Suharsono, DEA
Judul Disertasi : Introduksi dan Ekspresi Gen Hormon Pertumbuhan Ikan Nila (Oreochromis niloticus) pada Ikan Lele (Clarias sp)
Nama : Gusrina
NIM : C 161060121
Disetujui Komisi Pembimbing
Ketua
Prof.Dr.Ir. Komar Sumantadinata,M.Sc
Dr. Alimuddin, S.Pi, MSc
Anggota Anggota
Dr.Ir. Utut Widyastuti, M.Si
Mengetahui
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Perairan
PRAKATA
Bismillahirrahmaanirrahiim. Alhamdulillah, puji dan syukur penulis sampaikan kehadirat Alloh SWT atas segala karunia dan petunjuk-NYA, sehingga penelitian dan penulisan disertasi ini dapat diselesaikan. Solawat dan salam semoga senantiasa tercurah kepada Nabi Muhammad SAW, yang telah membawa cahaya dan petunjuk bagi kehidupan umat manusia hingga akhir zaman.
Disertasi dengan judul ”Introduksi dan Ekspresi Gen Hormon Pertumbuhan Ikan Nila (Oreochromis niloticus) pada Ikan Lele (Clarias sp)”
disusun berdasarkan penelitian-penelitian yang dilakukan di lapangan yaitu di Balai Besar Pengembangan Budidaya Ikan Air Tawar Sukabumi, Laboratorium Reproduksi dan Genetika Organisme Akuatik, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor dan Pusat Pengembangan dan Pemberdayaan Pendidik dan Tenaga Kependidikan Pertanian, Cianjur serta Loka Riset Pemuliaan dan Teknologi Perikanan Budidaya Air Tawar Sukamandi.
Dalam menyelesaikan penelitian dan penyusunan disertasi ini tidak semata didapatkan sendiri, melainkan atas kerjasama dan bantuan beberapa pihak. Oleh karena itu penulis mengucapkan terima kasih kepada:
1. Prof. Dr. Ir Komar Sumantadinata, MSc selaku Ketua Komisi Pembimbing, Dr. Alimuddin SPi, MSc dan Dr. Ir. Utut Widyastuti, MSi selaku anggota Komisi Pembimbing yang telah membimbing dan mengarahkan penulis selama melakukan studi di IPB mulai dari awal penelitian hingga akhir penyusunan disertasi ini.
2. Dr. Ir. Widanarni, MSi dan Dr. Ir. Suharsono, DEA, selaku dosen penguji luar komisi yang telah memberikan masukan dan saran pada saat sidang tertutup. 3. Prof. Dr. Ir. Ronny Rachman Noor, M.Rur.S.c dan Dr. Ir. Rudhy Gustiano, MSc selaku dosen penguji luar komisi yang telah memberikan masukan dan saran pada saat sidang terbuka.
4. Kepala Pusat Pengembangan dan Pemberdayaan Pendidik dan Tenaga Kependidikan Pertanian, Cianjur yang telah memberikan bantuan biaya pendidikan dan kesempatan tugas belajar S3 kepada penulis .
5. Kepala Balai Besar Pengembangan Budidaya Air Tawar di Sukabumi dan staf atas perijinan dan segala bantuannya.
6. Kepala Loka Riset Pemuliaan dan Teknologi Perikanan Budidaya Air Tawar di Sukamandi dan staf atas perijinan dan segala bantuannya.
7. Rasa terimakasih yang sebesar-besarnya juga penulis sampaikan kepada suami tercinta Hamdan Nasution, ananda Salma Afifah, Haristian Afif Nasution, Muhammad Farhan Nasution dan Muthiia Naziifah yang telah melengkapi dan memberikan kebahagiaan bagi kehidupan penulis serta dengan segala pengertian, pengorbanan, kesabaran dan doa yang tidak pernah terlupakan selama penulis menyelesaikan studi S3 ini.
8. Ayahanda dan Ibunda (almarhum dan almarhumah), kakak, dan adik-adikku serta Ibunda Mariah yang telah mencurahkan segala doa restu, kasih sayang, baik dukungan moril maupun materil.
9. Serta kepada semua orang yang tidak bisa disebutkan namanya satu per satu atas segala bantuan dan dukungannya.
Akhir kata, semoga disertasi ini bermanfaat bagi kepentingan penelitian dan kemajuan ilmu pengetahuan.
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 30 Oktober 1965 dari pasangan ayah Agus Syam (Almarhum) dan ibu Musripah (Almarhumah). Penulis merupakan anak kedua dari lima bersaudara. Pendidikan sarjana ditempuh pada Program Studi Budidaya Perairan, Fakultas Perikanan, Institut Pertanian Bogor, lulus tahun 1988. Pada tahun 2002 menyelesaikan pendidikan di Sekolah Pascasarjana Institut Pertanian Bogor Program Studi Ilmu Perairan. Kesempatan untuk melanjutkan ke program Doktor pada Program Studi Ilmu Perairan Sekolah Pascasarjana Institut Pertanian Bogor diperoleh pada tahun 2006. Beasiswa pendidikan Pascasarjana diperoleh dari Pusat Pengembangan dan Pemberdayaan Pendidik dan Tenaga Kependidikan Pertanian Cianjur, Direktorat Jenderal Peningkatan Mutu Pendidik dan Tenaga Kependidikan Kementerian Pendidikan Nasional.
Penulis mulai bekerja di Pusat Pengembangan dan Pemberdayaan Pendidik dan Tenaga Kependidikan Pertanian, Cianjur sebagai staf pada departemen Agribisnis Perikanan sejak tahun 1990 sampai sekarang. Jabatan fungsional Widyaiswara Muda diperoleh pada tahun 2000 dan pada tahun 2006 menjadi Widyaiswara Madya. Selama menjadi Widyaiswara pada tahun 2006 menjadi widyaiswara teladan sebagai juara pertama penulisan karya ilmiah Tingkat Nasional.
DAFTAR ISI Halaman DAFTAR TABEL... DAFTAR GAMBAR... DAFTAR LAMPIRAN... xii xiv xvi
I. PENDAHULUAN UMUM... Latar belakang... Perumusan masalah ... Tujuan dan manfaat ... Kebaruan Penelitian ...
II. AKTIVITAS PROMOTER ß-AKTIN IKAN MEDAKA PADA IKAN LELE (Clarias sp) ... Abstrak... Abstract ... Pendahuluan ... Bahan dan metode ... Hasil dan Pembahasan... Kesimpulan ...
III. TRANSFER GEN PENYANDI HORMON PERTUMBUHAN IKAN NILA (tiGH) PADA IKAN LELE (Clarias sp) DENGAN METODE MIKROINJEKSI ... Abstrak... Abstract ... Pendahuluan ... Bahan dan metode ... Hasil dan Pembahasan... Kesimpulan ...
IV. EKSPRESI GEN PENYANDI HORMON PERTUMBUHAN IKAN NILA PADA IKAN LELE (Clarias sp)... Abstrak... Abstract ... Pendahuluan ... Bahan dan metode ... Hasil dan Pembahasan... Kesimpulan ...
VI. PEMBAHASAN UMUM ...
VII. KESIMPULAN UMUM DAN SARAN... .
DAFTAR PUSTAKA...
LAMPIRAN ... 66
73
74
DAFTAR TABEL Halaman 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12.
Teknologi transfer gen GH pada berbagai jenis ikan ... Derajat kelangsungan hidup embrio (DKHe), derajat penetasan (DP) dan persentase embrio yang mengekspresikan gen GFP menggunakan konstruksi gen mBA-GFP pada ikan lele (Clarias sp) .. Derajat kelangsungan hidup embrio (DKHe), derajat penetasan (DP) dan persentase ikan lele yang membawa gen mBP-tiGH (PIMG) dengan menggunakan mikroinjeksi... ...
Transmisi gen mBP-tiGH pada generasi pertama dari induk ikan lele jantan yang berbeda...
Kriteria penilaian motilitas spermatozoa...
Motilitas dan kelangsungan hidup spermatozoa ikan lele setelah elektroporasi pada kondisi kuat medan listrik yang berbeda ...
Motilitas spermatozoa yang dielektroporasi pada beberapa tingkat kombinasi kuat medan listrik dan jumlah kejutan...
Motilitas spermatozoa ikan lele yang dielektroporasi pada beberapa tingkat kuat medan listrik dengan jumlah kejutan 3...
Motilitas spermatozoa ikan lele yang dielektroporasi pada tingkat kuat medan listrik 125 dengan beberapa jumlah kejutan...
Derajat kelangsungan hidup embrio (DKHe), derajat penetasan (DP) dan persentase ikan lele yang membawa gen mBP-tiGH (PIMG) dengan metode elektroporasi ...
SMGT pada berbagai jenis ikan...
Perbandingan derajat kelangsungan hidup embrio, derajat penetasan dan persentase individu yang membawa gen pada ikan lele dengan metode transfer gen berbeda...
DAFTAR GAMBAR Halaman 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17.
Peta konstruksi gen mBP-GFP ... Cekungan agarosa ...
Injeksi pada blastodisk embrio ikan lele fase satu sel...
Ekspresi gen GFP pada embrio ikan lele (Clarias sp) yang diinjeksi dengan mBA-GFP pada jam ke : 6,8,10,12,14,16,18 dan 20 setelah di injeksi...
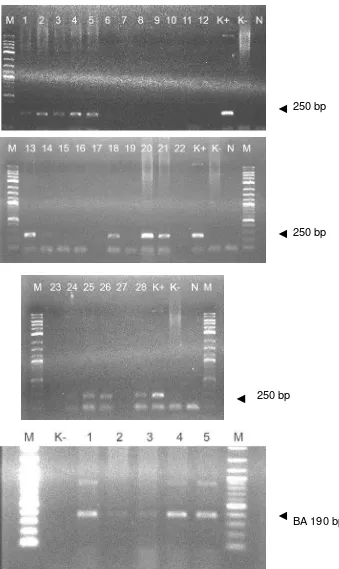
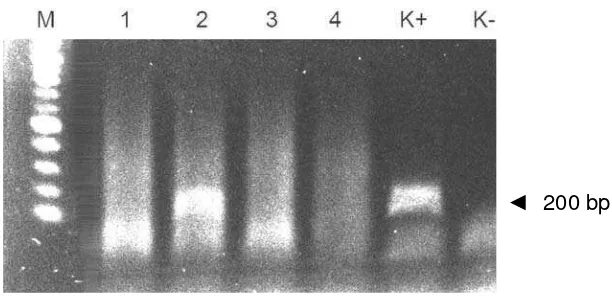
Peta konstruksi genmBP-tiGH... Deteksi insersi gen mBP-tiGH menggunakan metode PCR pada benih ikan lele umur 30 hari hasil transfer menggunakan metode mikroinjeksi...
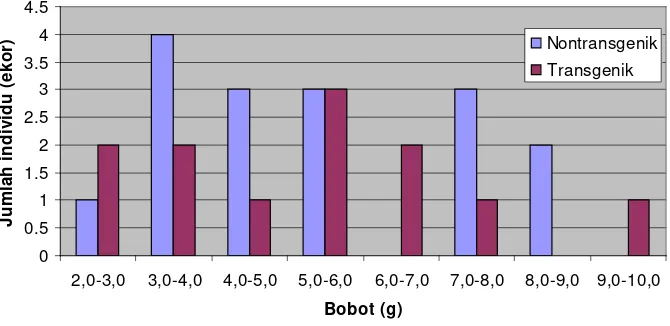
Sebaran bobot dan jumlah benih ikan lele nontransgenik dan transgenik founder pada umur 30 hari... Deteksi ekspresi dari transgenik founder menggunakan RT-PCR menggunakan cetakan cDNA...
Deteksi ekspresi dari transgen pada ikan transgenik generasi pertama (F1) menggunakan metode One Step
RT-PCR...
Sebaran distribusi bobot benih ikan lele transgenik generasi pertama umur 2 bulan...
Sebaran distribusi bobot benih ikan lele transgenik generasi pertama umur 3 bulan...
Laju pertumbuhan harian antara ikan transgenik generasi pertama dan nontransgenik...
Pertumbuhan rata-rata ikan lele transgenik dan nontransgenik generasi pertama...
Ikan transgenik generasi pertama dan nontransgenik umur 3 bulan...
Spermatozoa ikan lele yang diamati dengan pembesaran 10X40...
Derajat pembuahan telur ikan lele yang dibuahi oleh spermatozoa yang dielektroporasi pada beberapa tingkat kombinasi kuat medan listrik ...
18.
19.
20.
Deteksi insersi gen mBP-tiGH pada larva ikan lele yang baru menetas dengan metode elektroporasi...
Deteksi insersi gen mBP-tiGH pada benih ikan lele umur 90 hari dengan metode elektroporasi...
Distribusi berat individu benih ikan lele umur 30 hari hasil introduksi gen mBP-tiGH dengan konsentrasi yang berbeda...
62
63
DAFTAR LAMPIRAN
Halaman
1
2
3
4
5
Metode kultur cair perbanyakan bakteri dan isolasi plasmid DNA : mBA-tiGH dan mBA-GFP... Seperangkat alat pengamatan ekspresi gen Green Fluorescent Protein ...... Hasil analisis data bobot ikan lele ...
Sekuens gen GH Oreochromis niloticus... Alignment gen ikan nila dan ikan lele ...
82
83
84
88
I. PENDAHULUAN UMUM
Latar belakang
Produksi akuakultur setiap tahun meningkat seiring dengan meningkatnya
pertambahan penduduk di Indonesia. Pada tahun 2005 jumlah penduduk
Indonesia sebanyak 220 juta jiwa dan membutuhkan ikan sebanyak 6,3 juta ton
jika konsumsi perkapita 28,7 kg/orang/tahun. Pada tahun 2010 jumlah penduduk
Indonesia meningkat menjadi 235 juta jiwa dan membutuhkan ikan sebanyak 7,0
juta ton jika konsumsi perkapita naik menjadi 30,0 kg/orang/tahun (Dahuri 2006).
Dalam program revitalisasi Kementerian Kelautan dan Perikanan 2010-2014 ada
beberapa komoditas yang ditargetkan meningkat produksinya. Ikan lele
merupakan salah satu komoditas akuakultur yang selalu meningkat
permintaannya setiap tahun. Peningkatan produktivitas akuakultur dapat
dilakukan dengan beberapa pendekatan. Salah satu pendekatan terkini yang
diharapkan dapat meningkatkan produksi adalah teknologi trangenesis.
Teknologi transgenesis merupakan suatu teknik rekayasa genetik dengan cara
mengintroduksi gen yang khas pada ikan tertentu untuk mendapatkan keunikan
yang memiliki nilai tambah. Teknologi transgenesis ini telah diaplikasikan pada
bidang akuakultur sejak tahun 1985 di Cina dengan mengintroduksi gen
pengkode hormon pertumbuhan yang berasal dari manusia pada ikan maskoki
(Zhu et al. 1985). Sejak itu, teknologi transfer gen mulai dikembangkan di
beberapa negara dengan fokus penelitian pada transfer gen hormon
pertumbuhan. Pada penelitian selanjutnya di gunakan gen hormon pertumbuhan
(Growth Hormone /GH) dari ikan, gen anti beku, gen pengatur sintesa DHA, gen anti penyakit dan gen pengatur warna (Dunham 2004).
Introduksi gen GH pada ikan umum dilakukan oleh beberapa peneliti. Pada
beberapa jenis ikan yang diintroduksi gen GH mengalami pertumbuhan yang luar biasa dimana telah terjadi pertumbuhan 10 kali lipat pada ikan Salmon (Devlin et
al. 1994), pertumbuhan 35 kali lipat pada ikan mud loach (Nam et al. 2001), dan pertumbuhan 7 kali lipat pada ikan nila (Kobayashi et al. 2007). Peningkatan
pertumbuhan pada ikan ini dapat memberikan keuntungan pada akuakultur
karena waktu produksi menjadi lebih singkat dan meningkatkan efisiensi pakan
Tabel 1. Teknologi transfer gen GH pada berbagai jenis ikan
Jenis Ikan Konstruksi Gen Referensi
Goldfish Rainbow Trout Channel Catfish Common Carp Common Carp Pike Common Carp Channel catfish Common Carp Common Carp Nile Tilapia Atlantik Salmon Common Carp Rainbow Trout Sockeye Salmon Common Carp Nile Tilapia Rainbow Trout Mudloach Zebra Fish Ayu Fish Common Carp Coho Salmon Nile Tilapia Ikan Patin mMT-hGH SV40-hGH mMT-hGH RSV-csGH pCaβ-csGHcDNA RSV-bGH
pCaβ-csGH
RSVLTR-csGHcDNA RSV-rtGH
mMT-hGH mMT-rGH AFP-csGHcDNA pCaβ-rtGH
prtMtb-gbs-GHcDNA OnMT-GH1
pCaβ-csGHcDNA CMV-tiGH
OnMTGH Pmlβact-mlGH cβp-chrtiGH ccBA-rtGH1cDNA CA-gcGH
OnMT-GH1 mBP-tiGH pccBA-phGH
Zhu et al. (1985) Chourrout et al. (1986) Dunham et al. (1987) Zhang et al. (1990) Liu et al. (1990) Guise et al. (1992) MaClean et al. (1992) Dunham et al, (1992) Power et al. (1992) Zhu (1992)
Rahman & Maclean (1992) Du et al. (1992)
Chen et al. (1993) Cavari et al. (1993) Devlin et al (1994) Moav et al. (1995) Martinez et al. (1996) Devlin et al. (2001) Nam et al. (2001) Morales et al. (2001) Cheng et al. (2002) Gang et al. (2003) Devlin et al. (2004) Kobayashi et al. (2007) Dewi (2010)
Ket : mMT=mouse metallothionein, hGH= human growth hormone, SV40=Simian Virus 40, pCaß=plasmid carp ßactin, csGHcDNA=chinook salmon growth hormone complementary DNA, RSVLTR= Rous Sarcoma Virus Long Terminal Repeat, RSV=Rous Sarcoma Virus, bGH=bovine growth hormone, csGH=chinook salmon growth hormone, AFP= Anti Freeze Protein, rGH= rat growth hormone, rtGH= rainbow trout growth hormone, onMT= Onchorhynchus metallothionein, CMV=Cytomegalovirus, pmlßact= plasmid promoter ß actin mudloach, mlGH= mud loach growth hormone, cßp= carp ß actin promoter, chrtiGH= gen kromosom tilapia growth hormone, tiGH=tilapia growth hormone, OnMTGH= Onchorhynchus Metallothionein Growth Hormone, CA= promoter beta aktin ikan mas, gcGH= grass carp growth hormone, ccBA= cyprinus carpio beta aktin, mBP= medaka beta aktin, pccBA= plasmid Cyprinus carpio beta aktin, phGH= Pangasionodon hypophthalmus growth hormone
Aplikasi teknologi transgenesis pada ikan budidaya di Indonesia baru
diperkenalkan pada tahun 2009. Ikan lele merupakan ikan air tawar yang sangat
digemari oleh masyarakat karena dagingnya empuk dan tidak terdapat banyak
duri dalam tubuhnya. Kebutuhan ikan lele saat ini belum terpenuhi, untuk
memenuhi kebutuhan benih tersebut harus dilakukan program pembenihan ikan
lele yang intensif. Menurut Rustidja (1999) dan Dunham (2004), perbaikan mutu
ikan dapat dilakukan dengan beberapa strategi, antara lain dengan cara seleksi,
lele secara konvensional dapat dilakukan dengan selective breeding dan hibridisasi. Sedangkan perbaikan mutu ikan lele secara bioteknologi dapat
dilakukan dengan cara menerapkan teknologi transgenesis yang akan
meningkatkan pertumbuhan. Teknologi transgenesis adalah suatu proses
mengintroduksikan satu atau lebih DNA asing ke hewan uji dengan tujuan untuk
memanipulasi genotipenya kearah yang lebih baik dan selanjutnya dapat
ditransmisikan ke keturunannya (Beamont & Hoare 2003).
Menurut Hackettt (1993), ada tiga tahapan utama untuk menghasilkan ikan
transgenik yaitu (1) mempersiapkan konstruksi gen yang tersusun atas gen
penyandi protein tertentu dan elemen regulator yang mengontrol/mengendalikan
ekspresi gen, (2) mengintroduksi konstruksi gen ke dalam inti sel embrio yang
sedang berkembang supaya bisa didistribusikan ke semua jaringan tubuh ikan,
(3) mengidentifikasi individu ikan yang mengekspresikan gen asing atau transgen
karena tidak semua transgen yang ditransfer akan efektif dan tidak semua
konstruksi gen akan bekerja sesuai dengan yang diinginkan. Oleh karena itu
dalam penelitian ini dilakukan beberapa tahapan penelitian untuk memperoleh
ikan transgenik.
Tahap pertama dalam penelitian ini adalah melakukan pengujian terhadap
aktivitas promoter. Promoter yang digunakan dalam pengujian ini adalah ß-aktin
yang berasal dari ikan medaka yang disambungkan dengan gen penyandi protein
berpendar hijau dalam konstruksi ß-aktin-GFP (mBP-GFP). Aktivitas promoter
tersebut dianalisis dengan mengamati ekspresi gen penanda GFP (Green
fluorescent protein) pada embrio ikan lele. Penelitian ini dilakukan karena konstruksi gen yang di introduksikan pada embrio ikan lele pada tahap
selanjutnya menggunakan kontruksi gen mBP-tiGH dimana gen GH yang
digunakan berasal dari ikan nila dan elemen regulatornya yaitu promoter berasal
dari ikan medaka. Tahap kedua dalam penelitian ini adalah mengintroduksikan
gen mBP-tiGH pada embrio ikan lele. Metode transfer gen yang digunakan dalam penelitian ini yaitu mikroinjeksi dan elektroporasi. Tahap terakhir dalam
penelitian ini adalah menganalisis ekspresi gen mBP-tiGH pada generasi pertama hasil introduksi gen dengan metode mikroinjeksi pada ikan lele.
Dalam penelitian ini dengan perlakuan transfer gen GH diharapkan akan meningkatkan kecepatan tumbuh ikan lele sehingga waktu yang dibutuhkan
untuk memproduksi ikan lele ukuran konsumsi menjadi lebih cepat. Konstruksi
sel adalah mBP-tiGH. Konstruksi gen mBP-tiGH merupakan konstruksi gen yang dibuat oleh Kobayashi et al. (2007). Penelitian ini merupakan tahap awal
dari produksi ikan lele transgenik dan diharapkan akan memberikan efek yang
sama atau lebih tinggi seperti yang telah dilakukan pada ikan nila oleh Kobayashi
et al. (2007).
Perumusan masalah
Kebutuhan manusia akan ikan lele setiap waktu semakin meningkat seiring
kesadaran manusia untuk mengkonsumsi bahan pangan bergizi. Ikan lele
merupakan salah satu jenis ikan air tawar yang harganya relatif murah sehingga
mudah dijangkau oleh seluruh lapisan masyarakat. Pada program kerja
Kementerian Kelautan dan Perikanan pada Dirjen Perikanan Budidaya pada
tahun 2010 – 2014 ditargetkan terjadi peningkatan produksi 353% dari 5,26 juta
ton menjadi 16,89 juta ton dengan jenis komoditas adalah rumput laut, lele, patin,
bandeng, nila dan kerapu. Ikan lele termasuk salah satu komoditas yang
ditargetkan meningkat. Selama kurun waktu 2009-2014 ditargetkan kenaikan
produksi ikan lele sebesar 450% yaitu 200 ton pada tahun 2009 dan 900 ton
pada tahun 2014 (Warta Pasar Ikan, 2010). Saat ini, permasalahan utama dalam
budidaya ikan lele adalah benih sebar yang bermutu sangat rendah. Hal ini
dikarenakan induk ikan lele yang bermutu baik relatif sulit didapat. Induk ikan lele
yang unggul sesuai kriteria Standar Nasional Indonesia (SNI) harus mempunyai
berat badan lebih dari 500 gram. Untuk mencapai berat badan 500 gram saat ini
dibutuhkan waktu yang cukup lama yaitu 9 – 12 bulan, jika ketersediaan induk
tidak mencukupi maka ketersediaan benih tidak tercukupi.
Menurut Nurhidayat (2000), lele dumbo yang berasal dari Sleman,
Tulung Agung dan Bogor mempunyai stabilitas perkembangan yang rendah
akibat telah mengalami tekanan silang-dalam yang ditunjukkan dengan tingginya
nilai fluktuasi asimetri dan adanya individu yang tidak tumbuh sirip dada dan sirip
perut pada kedua sisinya (abnormal). Ikan lele yang telah mengalami tekanan
silang dalam akan mengalami pertumbuhan yang lambat. Oleh karena itu, untuk
memperbaiki karakter-karakter yang berguna bagi akuakultur seperti peningkatan
laju pertumbuhan perlu dilakukan suatu upaya agar ikan lele mempunyai
Untuk memperbaiki kecepatan tumbuh pada ikan budidaya dapat di
lakukan dengan beberapa pendekatan. Pendekatan secara genetis melalui
seleksi, perbaikan teknik budidaya dan nutrisi telah banyak dilakukan (Fjalested
et al. 2003). Pendekatan sistem endokrin untuk mengontrol pertumbuhan telah dilaporkan oleh beberapa peneliti (McLean & Devlin 2000), dan juga pendekatan
dengan pemberian hormon pertumbuhan dalam bentuk pelet implantasi telah
diaplikasikan. Dari beberapa pendekatan tersebut mempunyai beberapa
kelemahan antara lain: pendekatan genetis melalui seleksi membutuhkan waktu,
biaya dan tenaga yang banyak. Pendekatan dengan pemberian hormon melalui
implantasi membutuhkan dosis yang tepat, dalam waktu yang lama dan harus
dilakukan pada setiap siklus produksi. Saat ini suatu metode baru telah
dikembangkan yang dapat mengatasi masalah tersebut yaitu teknologi
transgenesis. Teknologi transgenesis merupakan suatu teknik rekayasa genetik
dengan cara mengintroduksi gen yang khas pada ikan tertentu untuk
mendapatkan keunikan yang memiliki nilai tambah. Teknologi transfer gen telah
dikembangkan untuk memperbaiki karakter kuantitatif dan kualitatif. Gen dari
individu suatu spesies diisolasi, dihubungkan ke promoter (sebagai sekuens
pengatur DNA atau on/off switches), diklon dan diperbanyak terutama dalam
plasmid (Dunham 2004).
Teknik transfer gen yang dapat diaplikasikan pada ikan ada beberapa
metode antara lain adalah mikroinjeksi, elektroporasi, infeksi retroviral, ballistic bombardment dan transfeksi, inkubasi sperma dengan DNA (Alimuddin et al.
2003; Dunham 2004). Dari beberapa metode tersebut yang sering diaplikasikan
adalah metode mikroinjeksi. Metode mikroinjeksi ini dikembangkan dari teknik
produksi tikus transgenik. Gen yang akan diintroduksi disuntikkan ke sel
menggunakan gelas pipet yang sangat kecil (diameter ujung jarum sekitar 0,05 –
0,15 mm). Pekerjaan ini dilakukan menggunakan mikroskop dengan bantuan
sebuah mikromanipulator pengatur gerak jarum suntik dan volume larutan DNA
yang akan disuntikkan. Mikroinjeksi harus dilakukan pada fase 1 sel untuk
mendistribusikan gen ke setiap sel yang membelah. Jika penyuntikan dilakukan
ke dalam salah satu blastomer setelah pembelahan sel, gen hanya bisa
terdistribusikan dari sel yang disuntik tadi. Tingkat kelangsungan hidup dan
persentase ikan yang membawa gen yang telah disuntikkan bervariasi
umumnya teknik ini yang digunakan. Tetapi teknik mikroinjeksi akan sangat sulit
jika diterapkan untuk memproduksi ikan transgenik secara massal dalam jumlah
yang besar. Metode ini tidak hanya membutuhkan waktu pengerjaan yang relatif
lama dan biaya laboratorium yang tinggi tetapi juga sangat dibatasi oleh jumlah
telur dan fisiologi telur ikan. Nukleus dari telur ikan sangat kecil dan sukar untuk
dilihat tanpa bantuan alat, membran telur atau korion akan mengeras segera
setelah pembuahan, mudah pecah, buram dan sebagainya (Lanes et al. 2009).
Berdasarkan hasil penelitian dengan metode mikroinjeksi memberikan hasil
introduksi gen yang relatif sedikit. Oleh karena itu dibutuhkan metode lain
sebagai alternatif dari berbagai macam problem dengan metode mikroinjeksi
yaitu elektroporasi. Metode elektroporasi sebagai solusi untuk memproduksi
transgenik secara massal, karena metode ini tidak membutuhkan waktu dan
biaya laboratorium yang mahal serta tidak membatasi fisiologis telur ikan
(Hostetler et al. 2003).
Metode elektroporasi dapat diaplikasikan pada transfer gen ikan dengan
dua cara yaitu elektroporasi pada embrio yang telah dibuahi ( Inoue et al. 1990;
Sheela et al.1999) dan elektroporasi pada sperma ( Symonds et al.1994; Tsai 2000). Menurut Tsai (2000) aplikasi elektroporasi dengan perantara sperma pada
ikan memiliki beberapa keuntungan antara lain yaitu : (1) Teknik ini merupakan
teknik transfer gen secara masal, (2) Teknik ini mampu mengatasi beberapa
kekurangan sistem transfer gen konvensional yang disebabkan karakter telur
seperti warna yang kabur/buram, menempel, melayang, pronuklei yang tidak
tampak, dan korion yang keras, (3) DNA asing harus ditransfer ke dalam nukleus,
jika telur hasil fertilisasi dielektroporasi dengan DNA asing, fragmen DNA
memiliki kesempatan yang lebih besar untuk ditransfer ke dalam beberapa
tempat selain blatodisk karena volumenya sangat kecil dalam telur hasil
fertilisasi, (4) Sperma ikan mudah ditangani karena penambahan air secara
sederhana mampu untuk mengaktifkan sperma, (5) Sperma dari hewan akuatik
dapat dikriopreservasi sehingga sperma dapat selalu tersedia untuk digunakan.
Oleh karena itu, sperma ikan dapat digunakan sebagai vektor dalam
mengintroduksi DNA asing untuk memproduksi ikan transgenik.
Dalam penelitian ini dilakukan transfer gen Growth Hormone (GH) yaitu gen pengkode hormon pertumbuhan yang berasal dari ikan nila dan promoter
ß-aktin yang berasal dari ikan medaka pada fase zigot dengan menggunakan
mampu terintegrasi dan terekspresi pada ikan lele sehingga dapat meningkatkan
pertumbuhan.
Tujuan dan manfaat
Tujuan dilakukan penelitian ini adalah untuk menghasilkan ikan lele (Clarias
sp) transgenik generasi pertama (F1
1. Menguji aktivitas promoter ß-aktin pada ikan lele
) dan menganalisis keberhasilan
transformasi DNA rekombinan pada telur ikan lele yang telah dibuahi dan
mengetahui ekspresi gen GH ikan nila (Oreochromis niloticus) pada ikan lele (Clarias sp) sehingga dapat memperbaiki kecepatan tumbuh. Secara khusus
penelitian ini bertujuan untuk :
2. Melakukan introduksi gen dengan menggunakan metode mikroinjeksi
dan elektroporasi
3. Menganalisis keberhasilan transfer gen mBP-tiGH generasi pertama hasil introduksi gen dengan metode mikroinjeksi pada ikan lele
Manfaat yang diharapkan dari hasil penelitian adalah (1) Diperoleh individu
ikan lele transgenik generasi pertama (F1) yang mempunyai pertumbuhan yang
cepat dibandingkan nontransgenik (2) Menghasilkan metode transfer gen pada
ikan lele yang dapat diadopsi untuk membuat ikan lele transgenik dengan gen
lainnya.
Kebaruan Penelitian
Kebaruan (novelty) dalam penelitian ini adalah : (1) Efektivitas metode
mikroinjeksi dan metode elektroporasi pada ikan lele (2) Keberhasilan transfer
II. AKTIVITAS PROMOTER ß-AKTIN IKAN MEDAKA PADA IKAN LELE (Clarias sp)
ABSTRAK
Promoter berperan penting dalam transgenesis sebagai pengatur ekspresi gen yang diintroduksi. Penelitian ini dilakukan untuk mengetahui aktivitas promoter β-aktin dari ikan medaka (mBP) pada ikan lele (Clarias sp.) sebagai langkah awal dalam rangka produksi ikan lele transgenik dengan karakter yang berguna bagi akuakultur. Aktivitas promoter diketahui dengan cara mengamati ekspresi gen penyandi protein berpendar hijau (green fluorescent protein, GFP) pada embrio hasil mikroinjeksi. Konstruksi gen dalam bentuk plasmid mBP-GFP dengan konsentrasi 50 µg/ml . Konstruksi gen tersebut diinjeksikan secara terpisah ke dalam blastodisk embrio ikan lele fase 1 sel. Jumlah telur yang diinjeksi untuk konstruksi gen adalah sebanyak 30 embrio dan dilakukan 2 pengulangan. Telur diinkubasi pada akuarium dengan suhu air sekitar 28oC. Ekspresi gen GFP diamati menggunakan mikroskop fluoresen (Olympus SZX 16) dimulai pada jam ke-4 setelah fertilisasi dan dilanjutkan setiap 2 jam sekali hingga ekspresi GFP tidak terdeteksi. Derajat kelangsungan hidup embrio (DKH-e) dan derajat penetasan (DP) dianalisis sebagai data pendukung. DKH-e dihitung sebelum telur menetas, sedangkan DP dihitung ketika semua telur telah menetas. Data dianalisis secara deskriptif. Hasil penelitian menunjukkan bahwa DKH-e (63,33±3,34%) dan DP (63,63± 10,03%) kontrol tidak diinjeksi lebih tinggi dibandingkan dengan perlakuan injeksi. DKH-e yang diinjeksi dengan β-aktin-GFPadalah 25,00±1,67%. Nilai DP
untuk β-aktin-GFP adalah 18,34±1,65%. Persentase embrio yang
mengekspresikan gen GFP adalah 3,3 ±0,0%. Puncak ekspresi gen GFP yang dikendalikan oleh promoter β-aktin adalah pada jam ke-10. Ekspresi gen GFP tidak tampak lagi pada saat telur menetas. Kesimpulannya adalah bahwa promoter β-aktin dari ikan medaka dapat aktif mengendalikan ekspresi gen asing pada ikan lele, sehingga promoter tersebut dapat digunakan dalam pembuatan ikan lele transgenik.
II. ACTIVITY OF MEDAKA ß-ACTIN PROMOTER IN CATFISH (Clarias sp)
ABSTRACT
Promoters play the important role in transgenesis as a gene expression regulator. This study was conducted to detect of activity ß-actin promoter from medaka fish (mBP) in catfish (Clarias sp) as beginning step in order to produce transgenic catfish with character good for aquaculture. Activity of promoter is known by analyze expression of gene encodes protein green luminescent ( Green Fluorescent Protein , GFP) in microinjected embryos. Gene construction used was in the form of plasmid mBP-GFP with concentration of 50 µg/ml and injected into blastodisk catfish embryo in 1 cell stage. Injection was performed to 30 embryos in duplicates. The injected embryos was incubated in aquaria with water temperature of 28o
Promoter merupakan sekuens DNA yang menginisiasi terjadinya proses
transkripsi (Dunham 2004), pengatur waktu, tempat, dan tingkat ekspresi suatu
gen sehingga promoter dapat dianalogikan sebagai switch suatu gen (Glick &
Pasternak, 2003). Promoter merupakan sekuen DNA yang terletak pada
bagian upstream (terminal 5’) dari kodon awal suatu gen (Hackettt 1993), yang berfungsi sebagai tempat RNA polymerase menempel dan menginisiasi
transkripsi (Glick & Pasternak 2003). Dalam transgenesis, promoter berperan
penting dalam menentukan apakah karakter yang dikodekan oleh gen yang
ditransfer atau transgen dapat diekspresikan sesuai dengan yang diharapkan.
Berbagai jenis promoter yang sudah digunakan dalam pembuatan ikan
transgenik antara lain adalah Cytomegalovirus (CMV), Rous Sarcoma Virus Long
Terminal Repeat (RSV-LTR), β-actin, Mouse Metallothionein (MT), Rainbow C. GFP gene expression was observed using fluorescent microscope at fourth hour after fertilization and continued every 2 hours. Survival rate of embryos (SRe), hatching rate (HR), and the percentage of individual which expressing GFP were analyzed as supporting data. SRe was calculated before hatching and HR was calculated at that time of all embryos hatching. Data was analyzed descriptively. The results of research showed that DKH-e (63.33 ± 3.34%) and DP (63.63 ± 10.03%) control was higher than injected. DKH-e between ß-actin GFP is 25.00 ± 1.67% and DP ß- actin GFP is 18.34 ± 1.65% . Percentage of embryos expressing GFP gene was 3,33 ± 0,0%. Highest GFP gene expression level that controlled by promoter β-actin is at the tenth hour after fertilization. GFP gene expression will no longer appear when hatching afterwards. The conclusion that promoter ß -actin from medaka can drive foreign gene expression in catfish , so that it can be used to produce transgenic catfish.
Keywords: catfish, GFP, microinjection, promoters
Trout MT, Simian Virus tipe 40 (SV-40), CMV-tk, CMV-IE, MMTV, Polyoma Viral
Promoter, Human MT, Human heat-shock protein 70 (hsp 70), carp β-actin (Dunham 2004).
Pada awal perkembangan transgenik pada ikan, peneliti umumnya
menggunakan promoter yang diperoleh dari vertebrata lain atau dari virus.
Namun, promoter tersebut memberikan ekspresi yang rendah atau tidak
menghasilkan ekspresi gen (Chourrout et al. 1990dalamAlimuddin et al. 2003).
Hasil yang negatif ini mungkin disebabkan oleh sifat sekuens promoter yang
spesifik spesies dari ikan. Beberapa promoter telah berhasil diisolasi antara lain
β-aktin dari ikan medaka (Takagi et al. 1994). Oleh karena itu pada penelitian ini akan dilakukan pengujian aktivitas promoter β-aktin yang berasal dari ikan medaka (Takagi et al. 1994).
Promoter β-aktin memiliki beberapa sifat yang terkait dengan aktivitas elemen-elemennya yaitu constitutive, ubiquitous dan house keeping (Liu et al.
1990). Constitutive berarti promoter ini mampu aktif tanpa membutuhkan faktor
pemicu seperti rangsangan hormon atau rangsangan suhu. Promoter β-aktin bersifat ubiquitous artinya dapat aktif pada semua jaringan otot. House keepingberarti promoter β-aktin dapat aktif kapan saja bila diperlukan. Promoter
β-aktin ikan medaka merupakan salah satu jenis promoter yang memiliki aktivitas tinggi pada beberapa jenis ikan, misalnya ikan medaka (Takagi et al. 1994;
Hamada et al. 1998), ikan rainbow trout (Yoshizaki 2001; Boonanuntanasam et al. 2002), ikan zebra (Alimuddin et al. 2005), ikan nila (Kobayashi et al. 2007),
ikan mas (Purwanti 2007) dan ikan lele (Ath-thar 2007).
Untuk mengetahui aktivitas promoter, diperlukan adanya gen penanda
(marker) yang disambungkan dengan promoter. Promoter dikatakan aktif apabila
gen penanda dapat terekspresi. Gen penanda yang biasa digunakan dalam
pengujian aktivitas promoter, yaitu lacZ, luciferase (luc), green fluorescent
protein (GFP), dan chloramphenicol acetyl transferase (Iyengar et al. 1996). Pada penelitian ini digunakan gen GFP. Gen GFP memiliki keunggulan yaitu
tidak memerlukan substrat tambahan untuk ekspresinya, memiliki kandungan
protein yang berpendar dan dapat divisualisasikan dengan menggunakan
mikroskop fluoresen (Chalfie et al. 1994 dalam Iyengar et al. 1996). Gen GFP diisolasi dari ubur-ubur Aequorea victoria namun ada juga yang diisolasi dari
Promoter beta aktin ikan medaka disambungkan dengan gen GFP dalam
bentuk konstruksi beta aktin-GFP (mBP-GFP) (Gambar 1). Apabila promoter ini
mampu mengendalikan ekspresi gen GFP pada ikan lele, maka diduga gen lain
yang mengkodekan karakter penting dalam budidaya ikan dapat diintroduksikan
sebagai pengganti gen GFP dalam proses transgenesis ikan lele. Ikan lele
digunakan dalam penelitian ini karena kondisi di lapangan telah terjadi
penurunan pertumbuhan (Nurhidayat 2000) dan jenis ikan ini merupakan
komoditas yang ditargetkan sebagai ikan konsumsi masyarakat pada program
kerja 2009-2014 Kementerian Kelautan dan Perikanan.
Gambar 1. Peta konstruksi gen mBP-GFP (Takagi et al. 1994)
Umumnya pengujian aktivitas promoter dilakukan dengan metode
mikroinjeksi yaitu menginjeksikan konstruksi DNA ke embrio dan mengamati
ekspresi sementara (transient expression) yang dihasilkan gen penanda (Takagi
et al. 1994; Higashijima et al. 1997; Hamada et al. 1998; Yazawa et al. 2005; Kato et al., 2007; Ath-thar 2007; Purwanti 2007). Oleh karena itu dalam penelitian
ini konstruksi DNA mBP-GFP diinjeksikan ke blastodisk embrio ikan lele fase
satu sel dengan menggunakan mikroinjektor.
Tujuan penelitian ini adalah untuk mengetahui aktivitas promoter
ß-actin-GFP (mBP-ß-actin-GFP) pada ikan lele, dengan cara mengamati ekspresi sementara
dari gen GFP sebagai penanda.
BAHAN DAN METODE
Pengadaan Embrio Ikan Lele
Embrio ikan lele fase satu sel diperoleh dengan cara pemijahan buatan.
Induk betina yang telah matang gonad disuntik ovaprim dengan dosis 0,3 ml/kg
bobot ikan, sedangkan induk jantannya menggunakan dosis 0,1 ml/kg bobot ikan.
Sekitar 12 jam pasca injeksi, dilakukan stripping pada induk betina untuk mendapatkan telur, sementara induk jantan dibedah untuk diambil spermanya.
Sperma diencerkan (0,5%) menggunakan larutan fisiologis NaCl 0,9%. Setelah
itu, telur dan sperma dicampur dalam 1 wadah dan diberi air, diaduk dengan
menggunakan bulu ayam.
Penghilangan Daya Rekat Telur
Telur ikan lele yang telah dibuahi bersifat adesif, yaitu melekat pada
substrat. Penghilangan daya rekat telur diperlukan untuk memudahkan proses
mikroinjeksi. Untuk menghilangkan daya rekat telur, setelah pembuahan, telur
direndam dengan larutan Tannin (0,5 gram Tannin/liter akuades) (Woynarovich
dan Horvath 1980) selama 3-5 detik kemudian segera dibilas dengan air bersih
sebanyak 2 kali. Telur yang telah dibuahi diambil lalu disimpan pada cekungan
agarosa (Gambar 2) untuk selanjutnya dilakukan perlakuan mikroinjeksi.
Gambar 2. Cekungan Agarosa
Cekungan (Tempat telur) Gel
Pembuatan Gel Agarosa Penahan Embrio
Pembuatan gel dilakukan pada cawan petri dengan cara membuat
larutan agarosa 2% yaitu sebanyak 0,6 gram agarosa dicampur dengan akuades
sebanyak 30 ml dan dipanaskan ke dalam microwave selama 2 menit. Setelah
suhu gel sekitar 40oC, gel dituangkan ke dalam cawan petri yang di bagian
tengahnya terdapat cetakan marmer. Cetakan marmer dipindahkan sehingga
terbentuk cekungan. Gel penahan embrio bisa digunakan beberapa kali dan
setelahnya dicuci dengan 70% etanol, kemudian dibilas dengan air destilasi.
Gel penahan embrio yang telah digunakan ditutup dengan plastik dan disimpan
pada kulkas (Meng et al. 1999).
Perbanyakan Konstruksi DNA
Bakteri Escherichia coli yang mengandung konstruksi plasmid DNA β
-aktin-GFP (mBA-GFP) Takagi et al. 1999 (Gambar 1) diperbanyak dengan
menggunakan metode kultur cair. Bakteri dikultur dalam media cair yang
mengandung Triptone 1,6%, yeast extract 1%, NaCl 0,5% dan antibiotik
kanamisin, diinkubasi menggunakan shaker dengan kecepatan 250 rpm pada
suhu 37o
Embrio ikan lele fase 1 sel dipindahkan secara perlahan pada lubang gel
penahan embrio menggunakan pipet. Jarum mikroinjeksi diatur posisinya dengan C, selama 16 – 18 jam. Plasmid DNA diisolasi menggunakan kit EZ 10
Spin column Plasmid DNA sesuai dengan prosedur dalam manual (Lampiran 1).
Konsentrasi DNA yang diperoleh adalah dihitung menggunakan mesin DNA/RNA
(Gene Quant).
Pelaksanaan Mikroinjeksi
Larutan DNA dengan konsentrasi 50 µg/ml diambil sebanyak 4 µL
menggunakan mikropipet dengan tip panjang dibagian ujungnya dan kemudian
dimasukkan ke dalam jarum mikroinjeksi. Minyak mineral ditambahkan ke dalam
jarum mikroinjeksi menggunakan jarum minyak mineral yang telah dipasang
pada needle holder. Jarum minyak mineral dilepas dan jarum mikroinjeksi yang
bantuan mikromanipulator, diposisikan pada bagian atas telur dan cairan DNA
secara perlahan diinjeksikan sekitar seperlima dari volume blastodisk. Embrio
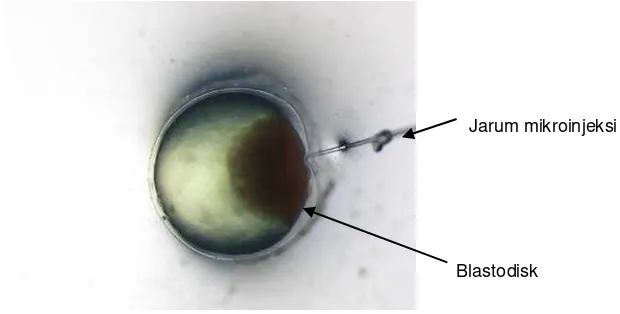
yang telah diinjeksi diinkubasi pada suhu sekitar 28˚C (Gambar 3). Konstruksi gen diinjeksikan ke embrio sebanyak 30 butir dengan ulangan 2 kali.
Jarum mikroinjeksi
Blastodisk
[image:31.595.194.504.179.336.2]
Gambar 3. Injeksi pada blastodisk embrio ikan lele fase satu sel
Pengamatan Ekspresi Gen GFP
Pengamatan ekspresi GFP dilakukan pada jam keempat setelah
pembuahan, selanjutnya setiap 2 jam sekali sampai telur menetas. Pengamatan
perkembangan embrio dan ekspresi gen GFP dilakukan dengan menggunakan
mikroskop fluoresen (Olympus SZX16) yang dilengkapi filter GFP (Olympus
SZX-GFPHQ) dan burner (Olympus U-RFL-T). Embrio dan larva difoto dengan
menggunakan kamera digital High Speed Compact Color 2 megapiksel (DP 20)
Olympus, kemudian ditransfer ke komputer yang memiliki software Olympus
DH2-BW melalui remote controller (Olympus DP-20) (Lampiran 2).
Analisis Data
Parameter yang diamati meliputi derajat kelangsungan hidup embrio
(DKH-e), derajat penetasan (DP) dan persentase embrio mengekspresikan
transgen (PEMG). DKH-e adalah persentase jumlah embrio yang hidup
dibandingkan jumlah embrio awal. Derajat penetasan adalah persentase jumlah
embrio yang menetas dari jumlah awal embrio. Persentase embrio
dalamnya terdapat ekspresi gen dibandingkan dengan jumlah total telur yang
telah diinjeksi. Data dianalisis secara deskriptif.
Derajat kelangsungan hidup embrio adalah persentase jumlah embrio
yang hidup dibandingkan jumlah embrio awal. Perhitungan dilakukan 20 jam
setelah fertilisasi, dimana embrio belum menetas dengan rumus perhitungan
sebagai berikut:
Derajat penetasan adalah persentase jumlah embrio yang menetas
dibandingkan jumlah embrio awal. Perhitungan dilakukan ketika larva telah
menetas secara keseluruhan dengan rumus perhitungan sebagai berikut :
Persentase embrio mengekspresikan gen GFP diperoleh dari
perbandingan jumlah embrio yang mengekspresikan gen GFP dengan jumlah
total embrio yang diinjeksi. Perhitungan dilakukan pada jam ke-12 dengan rumus
HASIL DAN PEMBAHASAN
Derajat kelangsungan hidup embrio (DKH-e) dan derajat penetasan (DP)
pada perlakuan injeksi memiliki nilai yang lebih rendah dibandingkan kontrol tidak
diinjeksi (Tabel 2). DKH-e yang diinjeksi dengan konstruksi gen mBP-GFP
mempunyai nilai 25,00±1,67%, sedangkan nilai DP adalah 18,34±1,65%.
Tabel 2. Derajat kelangsungan hidup embrio (DKH-e), derajat penetasan (DP) dan persentase embrio yang mengekspresikan gen GFP (PEMG) menggunakan konstruksi gen mBP-GFP pada ikan lele Clarias sp.
Perlakuan
Embrio yang Diinjeksi (butir, n=2)
DKH-e (%) DP (%)
PEMG (%)
Injeksi dengan
mBP-GFP 30 25,00 ± 1,67 18,34 ± 1,65
3,33 ± 0,0
Tidak diinjeksi 30 63,33 ± 3,34 63,63 ± 10,03 0,00 ± 0,0
Ket : mBP-GFP = medaka ß-aktin- Green Fluorescent Protein
Adanya ekspresi GFP menunjukkan bahwa promoter β-aktin ikan medaka dapat digunakan untuk membuat ikan transgenik dengan gen yang berpengaruh
terhadap akuakultur. Persentase embrio yang mengekspresikan gen GFP
(PMEG) untuk mBA-GFP adalah 3,33±0,0%.
Telur ikan lele yang digunakan saat penelitian memiliki kualitas yang
cukup bagus, dilihat dari nilai rata-rata derajat kelangsungan hidup dan derajat
penetasan kontrol cukup tinggi. Nilai derajat kelangsungan hidup dan derajat
penetasan dari perlakuan lebih rendah jika dibandingkan kontrol (tanpa
perlakuan injeksi). Hal ini mungkin disebabkan karena kerusakan yang terjadi
pada sel embrio setelah diinjeksi sehingga perkembangan embrio menjadi tidak
normal dan kemudian mengalami kematian. Selain itu, juga diduga akibat
tingginya volume larutan DNA yang diinjeksikan.
Transfer gen dengan metode mikroinjeksi umumnya membutuhkan
larutan DNA yang diinjeksikan dalam jumlah copy yang tinggi. Hal ini dilakukan untuk meningkatkan integrasi transgen ke dalam genom inang (Zbikwoska,
masuk dalam embrio, sehingga dapat mengganggu stabilitas embrio dan
menyebabkan kematian (Hackettt, 1993).
Ekspresi gen GFP yang dikendalikan oleh promoter mBP mulai terlihat
pada jam ke-4 setelah fertilisasi (embrio fase gastrula), semakin terang pada fase
gastrula dimana perisai embrio sudah mulai terbentuk (jam ke-6 setelah
fertilisasi), mencapai puncaknya pada fase organogenesis (jam ke-14 setelah
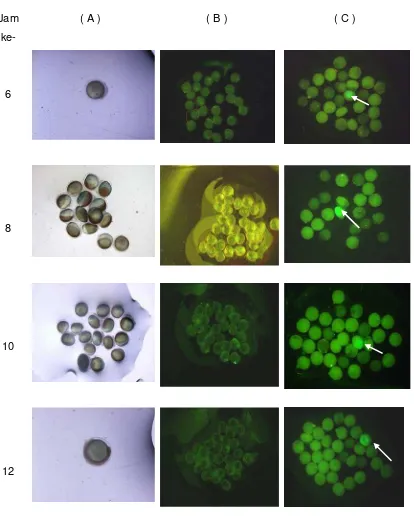
fertilisasi), dan setelah itu ekspresi gen GFP tidak terdeteksi (Gambar 4).
Berdasarkan gambar tersebut dapat dilihat perbandingan penampakan telur yang
terekspresi gen GFP (Gambar 4C) dan telur yang tidak terekspresi gen GFP
(Gambar 4B). Ekspresi gen terkuat terjadi pada saat 8 dan 10 jam setelah
diinjeksi. Pada 12, 14,16 dan 18 jam setelah diinjeksi penampakan ekspresi gen
pada embrio terlihat menunjukkan tanda penurunan dan akhirnya hilang pada
saat larva menetas.
Pada penelitian ini, ekspresi gen GFP pada telur lele dengan promoter ß-
aktin sudah mulai terlihat pada fase gastrula (jam ke-4 setelah fertilisasi),
semakin terang pada fase gastrula dimana perisai embrio sudah mulai terbentuk
(jam ke-6 setelah fertilisasi) dan mencapai puncaknya pada fase organogenesis
(jam ke-14 setelah fertilisasi), setelah itu ekspresi gen menghilang. Etkin &
Balcells (1985) dalam Winkler (1991) menyatakan bahwa ekspresi DNA asing hanya dapat dilihat pada embriogenesis awal pada fase midblastula. Pada ikan
medaka disebutkan bahwa ekspresi gen wtGFP (wild-type GFP) dan mtGFP (mutant GFP) dimulai pada fase midblastula dan ekspresi terkuat terjadi sampai
dengan fase gastrula akhir (Hamada et al. 1998). Menurut Stuart et al. (1988) ekspresi gen terkuat pada ikan zebra terjadi pada fase gastrula awal. Untuk ikan
medaka ekspresi gen terkuat terjadi pada fase gastrula (Chong & Vielkind,
1989 dalam Volckaert, 1994). Sedangkan pada ikan Loach Misgurnus sp. terjadi pada gastrula akhir (Maclean et al. 1987 dalam Volckaert, 1994). Penelitian
yang dilakukan Volckaert (1994) mendapatkan hasil bahwa pada lele
Afrika Clarias gariepinus ekspresi gen tertinggi terjadi pada fase gastrula awal
Jam
ke-
( A ) ( B ) ( C )
6
8
10
[image:35.595.105.519.73.597.2]12
Gambar 4. Ekspresi gen GFP pada embrio ikan lele (Clarias sp) yang diinjeksi dengan mBA-GFP pada jam ke : 6, 8, 10, 12, 14, 16, 18 dan 20 jam setelah diinjeksi. A : Telur diamati dengan mikroskop tanpa UV
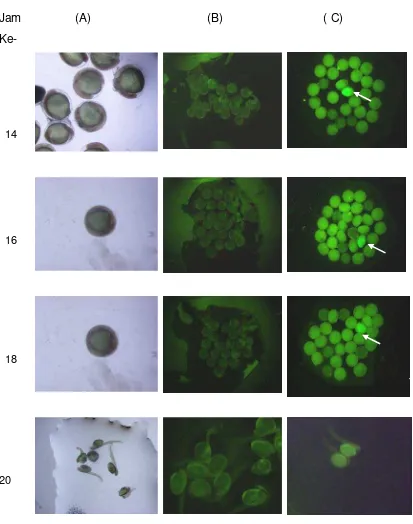
Jam (A) (B) ( C)
Ke-
14
16
18
[image:36.595.102.515.74.598.2]20
Gambar 4. Lanjutan
Pola ekspresi sementara seperti ini umumnya terjadi pada banyak
pengujian aktivitas promoter antara lain pada ikan medaka (Winkler et al. 1991; Takagi et al. 1994), ikan lele Afrika (Volckaert et al. 1994), ikan zebra (Higashijima et al. 1997), ikan kakap merah (Kato et al. 2007), ikan lele (Ath-thar,
2007), dan ikan mas (Purwanti, 2007) dengan menggunakan promoter yang
walaupun ada perbedaan waktu ekspresi gen antara satu promoter dengan
promoter lainnya pada spesies ikan yang berbeda, yaitu pada awalnya rendah,
meningkat, kemudian menurun hingga tidak terlihat lagi. Perbedaan waktu yang
terjadi diduga karena tiap embrio memiliki kemampuan berkembang yang
berbeda dimana dipengaruhi oleh laju transkripsi sel dalam embrio dan suhu
inkubasi telur. Volckaert et al. (1994) menjelaskan bahwa pola waktu ekspresi gen asing bergantung pada pola perkembangan embrio. Woynarovich & Horvath
(1980) juga menambahkan bahwa laju perkembangan embrio bergantung pada
suhu inkubasi. Hal ini dikarenakan di dalam embrio terdapat sejumlah enzim
yang berperan terhadap perkembangannya. Pada penelitian ini suhu air inkubasi
adalah sama antara yang diberi injeksi dengan kontrol.
Menurut Iyengar et al. (1996) terjadinya ekspresi sementara ini berhubungan erat dengan ketahanan dari DNA yang diinjeksikan. Tingginya
ekspresi yang terjadi pada fase gastrula adalah kemungkinan sebagai hasil dari
akumulasi DNA yang diinjeksikan yang berlanjut pada peningkatan replikasi pada
fase pembelahan (cleavage) dan akumulasi dari enzim (RNA polymerase II) yang
menyebabkan dimulainya transkripsi pada saat MBT (mid-blastula transition). Degradasi dari DNA pada saat fase lanjutan pada pembelahan sel diperkirakan
akan menyebabkan penurunan bertahap dari jumlah DNA sehingga ekspresi
akan semakin melemah. Ekspresi gen GFP mulai terlihat pada fase blastula yaitu
pada fase terbentuknya rongga yang membedakan antara kuning telur dengan
sel (Woynarovich & Horvath, 1980). Lebih lanjut dijelaskan bahwa waktu
ekspresi berhubungan erat dengan keberadaan DNA yang diinjeksikan. Puncak
ekspresi atau ekspresi terkuat yang dihasilkan dari perlakuan diduga disebabkan
oleh terjadinya replikasi DNA yang diinjeksikan di dalam embrio pada fase
perkembangan awal (Winkler et al. 1991). Peningkatan ekspresi gen yang terjadi ditambahkan oleh Iyengar et al. (1996) merupakan akumulasi dari enzim produk
transkripsi pada fase mid blastula transition. Ekspresi gen GFP melemah setelah 14 jam fertilisasi dan menghilang sebelum telur ikan lele tersebut menetas.
Perbedaan tingkat ekspresi dijelaskan oleh Dunham (2004) yaitu
disebabkan karena promoter yang diintroduksikan bukan berasal dari ikan yang
homolog. Promoter yang bukan berasal dari ikan yang homolog memiliki interaksi
antara elemen cis-regulator pada promoter dan elemen trans-regulator inang
mengakibatkan peningkatan atau penurunan tingkat transkripsi. Fletcher dan
Davies (1991) dalamAth-thar (2007) menjelaskan bahwa tingkat ekspresi yang
tinggi dipengaruhi oleh kesesuaian antara elemen cis-regulator dan
trans-regulator.
KESIMPULAN
III. TRANSFER GEN PENYANDI HORMON PERTUMBUHAN IKAN NILA (tiGH)PADA IKAN LELE (Clarias Sp) DENGAN METODE MIKROINJEKSI
ABSTRAK
Penelitian ini dilakukan untuk mengetahui keberhasilan introduksi gen penyandi hormon pertumbuhan (Growth Hormone, GH) pada embrio ikan lele sehingga dapat memperbaiki kecepatan tumbuhnya. Gen GH dari ikan nila (tiGH) yang dikontrol oleh promoter beta-aktin (mBP) dari ikan medaka ditransfer dengan metode mikroinjeksi ke dalam blastodisk embrio ikan lele fase satu sel.
Konsentrasi konstruksi gen mBP-tiGH yang ditransfer adalah 50
µg/ml. Parameter yang diamati meliputi derajat kelangsungan hidup embrio (DKHe), derajat penetasan (DP) dan persentase individu ikan lele yang membawa mBP-tiGH. DKHe dihitung sebelum telur menetas, sedangkan DP dihitung pada saat semua telur menetas. Identifikasi ikan yang membawa
mBP-tiGH ditentukan menggunakan metode PCR dengan primer spesifik untuk gen
tiGH. Hasil penelitian dengan menggunakan metode mikroinjeksi dari 100 embrio yang diinjeksi menunjukkan bahwa nilai DKHe (97%) dan DP (94%) pada kontrol (tidak dimikroinjeksi) lebih tinggi dibandingkan dengan perlakuan mikroinjeksi (30% untuk DKHe, dan 28% DP). Ikan lele yang membawa mBP-tiGH dengan metode mikroinjeksi adalah 42,86% (12/28). Kesimpulan adalah bahwa tiGH
dapat ditransfer pada benih ikan lele dengan metode mikroinjeksi.
Kata kunci : transfer gen, GH, PCR, ikan lele, mikroinjeksi.
III. TRANSFER OF GENE ENCODING TILAPIA GROWTH HORMONE (tiGH) IN CATFISH (Clarias Sp) BY MICROINJECTION METHOD
ABSTRACT
This study was conducted to determine of introducing gene encoding growth hormone (GH) in catfish embryos that can improve its growth rate. GH gene of
Nile tilapia, driven by medaka βactin promoter was injected to one cell stage of catfish embryos by microinjection method. Concentration of gene construction mBP-tiGH transfered is 50 µg/ml. The observed parameter was survival rate of embryos (SRe), hatching rate (HR), and the percentage of catfish carrier gene mBP-tiGH. SRe was counted before hatching while HR was calculated at the
time the embryos hatching. To identify fish carrier of mBP-tiGH, used PCR (Polymerase Chain Reaction) method with specific primer for tiGH gene. The
research result used microinjection method explained that from 100 injected catfish embryos, the grade of SRe (97%) and HR (94%) within non-microinjection control was higher than microinjection (at range of 30% for SRe and 28% for HR). The percentage of catfish carrying tiGH gene by microinjection methods was 42,86% (12/28). Conclusion that tiGH could be transferred in catfish by microinjection method.
Keywords : gene transfer, GH, PCR, catfish, microinjection, electroporation.
________________
PENDAHULUAN
Ikan lele merupakan salah satu jenis ikan budidaya air tawar yang menjadi
target peningkatan produksi oleh Kementerian Kelautan dan Perikanan
2009-2014. Produksi ikan lele dapat ditingkatkan dengan melakukan budidaya ikan
secara intensif. Pertumbuhan ikan lele yang dibudidayakan oleh masyarakat
telah mengalami pertumbuhan yang lambat dibandingkan pada saat pertama kali
ikan lele didatangkan ke Indonesia. Untuk memperbaiki karakter-karakter yang
berguna bagi akuakultur seperti peningkatan laju pertumbuhan maka perlu
dilakukan suatu upaya agar ikan lele mempunyai kecepatan tumbuh yang lebih
baik. Untuk memperbaiki kecepatan tumbuh pada ikan budidaya dapat dilakukan
dengan beberapa pendekatan. Pendekatan secara genetis melalui seleksi,
perbaikan teknik budidaya dan nutrisi telah banyak dilakukan (Fjalested et al. 2003). Pendekatan sistem endokrin untuk mengontrol pertumbuhan telah
dilaporkan oleh beberapa peneliti (McLean & Devlin 2000). Dari beberapa
pendekatan tersebut mempunyai beberapa kelemahan antara lain: pendekatan
genetis melalui seleksi membutuhkan waktu, biaya dan tenaga yang banyak.
Saat ini sedang dicoba suatu metode yang dapat mengatasi masalah
penurunan pertumbuhan tersebut yaitu teknologi transgenesis. Teknologi
transgenesis merupakan suatu teknik rekayasa genetik dengan cara
mengintroduksi gen yang khas pada ikan untuk mendapatkan keunikan yang
memiliki nilai tambah. Sedangkan menurut Beardmore & Porter (2003) transgenik
adalah organisme dimana DNA dari donor dimasukkan dan bergabung dengan
menggunakan teknik in vitro. Teknologi transfer gen telah dikembangkan untuk memperbaiki karakter kuantitatif dan kualitatif. Gen dari individu suatu spesies
diisolasi, dihubungkan ke promoter (sebagai sekuens pengatur DNA atau on/off switches), diklon dan diperbanyak terutama dalam plasmid (Dunham 2004).
Teknologi transfer gen pada channel catfish (Ictalurus punctatus)
berdasarkan penelitian Dunham et al. (1987) menggunakan konstruksi gen
Mouse Metallothionein-human growth hormone fusion gene (MthGHg), 20% ikan dilakukan analisis pada usia 3 minggu dan dilakukan sampling ulang pada usia 3
bulan dan hasilnya hanya sekitar 4% ikan yang mengandung MthGHg.
Berdasarkan penelitian Zhu et al. (1985) dimana hGHg dimasukkan ke dalam
germinal disc
ikan koki
dan hasilnya 75% ditransformasikan dan terjadial. (1986) melakukan injeksi dengan gen konstruk hGHg cDNA pada sitoplasma telur ikan trout yang telah dibuahi dan 33% diintegrasikan ke dalam genom pada
usia 30 hari embrio tetapi tidak menunjukkan ekspresi dan peningkatan
pertumbuhan. Smitherman et al. (1996) telah melakukan transfer gen pada
Ictalurus punctatus dan Clarias gariepinus dengan menggunakan metode
mikroinjeksi dan elektroporasi, hasilnya gen asing tersebut telah diekspresikan
dan diwariskan dimana pertumbuhan transgenik Ictalurus punctatus mengandung
gen GH salmon 20 – 40% lebih cepat dibandingkan dengan kontrol.
Menurut Beardmore & Porter (2003), transgenik dibedakan menjadi dua
tipe yaitu autotransgenik (gen asing yang diintroduksi berasal dari spesies yang
sama) dan allotransgenik (gen asing yang diintroduksi berasal dari spesies yang
berbeda). Pada penelitian ini dilakukan transfer gen yang berasal dari spesies
yang berbeda. Berdasarkan hal tersebut dilakukan penelitian yang bertujuan
untuk mengetahui tingkat keberhasilan transfer gen pertumbuhan ikan nila (tiGH)
dengan metode mikroinjeksi pada ikan lele. Diharapkan gen mBP-tiGH yang ditransfer dapat terekspresi pada embrio ikan lele.
BAHAN DAN METODE
Koleksi Gamet
Induk ikan lele dipilih dari kolam pemeliharaan di Balai Besar
Pengembangan Budidaya Air Tawar Sukabumi. Induk jantan dan betina yang
digunakan adalah induk ikan lele yang mempunyai ukuran 500 – 1000 gram
perekor. Induk diseleksi berdasarkan tingkat kematangan gonadnya. Induk ikan
lele jantan dan betina dipilih yang matang gonad dan dilakukan penyuntikan
ovaprim untuk mempercepat tingkat kematangan gonad. Induk betina yang telah
matang gonad disuntik ovaprim dengan dosis 0,3 ml/kg bobot ikan, sedangkan
induk jantannya menggunakan dosis 0,1 ml/kg bobot ikan. Setelah 8 jam
dilakukan stripping pada induk betina untuk mendapatkan telur. Induk jantan
dibedah untuk diambil spermanya. Sperma diencerkan (0,5%) menggunakan
Pembuatan Gel Agarosa Penahan Embrio
Pembuatan gel dilakukan pada cawan petri dengan cara membuat larutan
agarosa 2% yaitu sebanyak 0,6 gram agarosa dicampur dengan akuades
sebanyak 30 ml dan dipanaskan ke dalam microwave selama 2 menit. Biarkan
larutan tersebut pada suhu ruang dan jika sudah hangat dituangkan ke dalam
cawan petri yang di bagian tengahnya terdapat cetakan marmer. Setelah
agarosa membeku, cetakan marmer dipindahkan sehingga terbentuk cekungan.
Gel penahan embrio bisa digunakan beberapa kali dan setelahnya dicuci dengan
70% etanol kemudian dibilas dengan air destilasi. Gel penahan embrio yang
telah digunakan ditutup dengan plastik dan disimpan pada 4˚C (Meng et al. 1999). Gel agarose penahan embrio ini dipergunakan untuk memudahkan dalam
melakukan transfer gen dengan metode mikroinjeksi. Untuk menghilangkan daya
rekat telur yang dapat menganggu saat melakukan penyuntikan, larutan tannin
ditambahkan dengan konsentrasi 0,5 ppm selama 5 detik sambil diaduk dan
dibilas dengan air sebanyak 2 kali. Telur yang telah dibuahi diambil lalu disimpan
pada cawan petri untuk selanjutnya dilakukan perlakuan mikroinjeksi.
Perbanyakan Konstruksi Gen
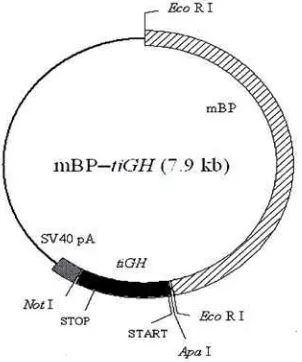
Konstruksi gen berupa plasmid mBP-tiGH berisi gen GH ikan nila
(Oreochromis niloticus) dengan promoter β-Aktin (mBP) dari ikan medaka (Oryzias latipes). Konstruksi gen yang digunakan berasal dari Kobayashi et al.
(2007) (Gambar 5).
Perbanyakan konstruksi gen dilakukan dengan menggunakan prosedur
standar (Sambrook et al. 1989). Bakteri Eschericia coli yang mengandung konstruksi plasmid mBP-tiGH diperbanyak dengan metode kultur cair . Bakteri
dipanen dan dikultur dalam media cair yang mengandung Triptone 1,6%, yeast extract 1%, NaCl 0,5%, dan antibiotik kanamisin, diinkubasi menggunakan shaker dengan kecepatan 250 rpm pada suhu 37oC, selama 16-18 jam.
Kemudian, bakteri hasil kultur dimasukkan ke dalam microtube 1,5 ml,
disentrifugasi pada kecepatan 12000 rpm selama 30 detik. Supernatan dibuang,
pelet plasmid DNA yang terbentuk diisolasi dengan kit GF-1 Plasmid DNA
extraction (Version 2.1) Vivantis (Lampiran 1). Konsentrasi larutan DNA awal
DNA untuk transfer gen dengan metode mikroinjeksi sebesar 50 µg/ml
[image:43.595.236.387.132.313.2]sedangkan dengan metode elektroporasi sebesar 65 dan 80 µg/ml.
Gambar 5. Peta konstruksi gen mBP-tiGH (Kobayashi et al. 2007)
Mikroinjeksi
Mikroinjeksi dilakukan pada embrio ikan lele fase 1 sel dengan prosedur
mengikuti Kobayashi et al. (2007). Larutan DNA yang digunakan diambil dari
larutan stok yang berisi konstruksi plasmid mBP-tiGH Kobayashi et al. (2007). Konsentrasi larutan yang digunakan sebanyak 50 µg/ml dalam akuabides.
Embrio yang telah disuntik diinkubasi pada wadah terkontrol yang terpisah dari
wadah inkubasi untuk embrio normal tanpa penyuntikan. Teknik penanganan dan
pendederan benih ikan lele sesuai standar SNI (2004). Jumlah telur yang
dimikroinjeksi sebanyak 100 butir.
Telur dipindahkan secara perlahan pada lubang gel penahan embrio
mikroinjeksi dengan menggunakan pipet. Telur yang akan dimikroinjeksi
diletakkan pada lubang gel penahan embrio ini. Jarum mikroinjeksi diatur
posisinya dengan bantuan mikromanipulator. Jarum mikroinjeksi diposisikan
pada bagian atas telur dan cairan DNA diinjeksikan dengan perlahan pada
blastodisk. Normalnya, cairan DNA yang diinjeksikan mencapai kira-kira
seperlima dari volume telur yang diinjeksi. Embrio yang telah diinjeksi
Penetasan Telur dan Pemeliharaan Larva
Telur hasil mikroinjeksi dipindahkan dalam akuarium inkubasi berukuran 80
X 60 X 40 cm yang telah diberi biru metilena, kemudian diberi aerasi sedang.
Wadah dilengkapi dengan heater agar temperat