KONSTRUKSI VEKTOR EKSPRESI GEN HORMON PERTUMBUHAN LELE DUMBO (Clarias sp.)
UNTUK PRODUKSI IKAN LELE LOKAL (Clarias batrachus) TRANSGENIK
Ibnu Dwi Buwono*)#, Nono Carsono**), Yuniar Mulyani**), dan M. Untung Kurnia*) *) Fakultas Perikanan dan Ilmu Kelautan, Universitas Padjadjaran
**) Fakultas Pertanian, Universitas Padjadjaran
(Naskah diterima: 11 April 2014; Revisi final: 26 Februari 2015; Disetujui publikasi: 11 Maret 2015)
ABSTRAK
Penelitian ini bertujuan untuk memperoleh konstruksi vektor ekspresi (pTarget) rekombinan yang mengandung sisipan gen hormon pertumbuhan ikan lele dumbo (Clarias sp.) dan promoter β-aktin ikan lele lokal (C. batrachus) dalam upaya pembuatan ikan lele lokal transgenik. Promoter β-aktin lele lokal (pCbBA) telah berhasil diisolasi dari hipofisa ikan tersebut dengan ukuran sekitar 1,7 kbp; dan memiliki elemen transkripsi CAAT box, TATA box, GC box, motif CArG, dan TGACG berdasar analisis program TF Bind. Penggantian promoter CMV (cytomegalovirus) yang terkandung dalam vektor ekspresi pTarget menggunakan dua enzim restriksi Sgf-I dan I-Ppo I, menghasilkan fragmen DNA berukuran 6.083 bp (pTarget-GH lele dumbo) sebagai produk digesti. Fragmen pTarget-GH lele dumbo yang diligasi dengan promoter β-aktin lele lokal membentuk konstruksi pTarget-pCbBA-GH lele dumbo (7.783 bp) sebagai vektor ekspresi ikan lele lokal transgenik.
KATA KUNCI: vektor ekspresi, hormon pertumbuhan, lele dumbo, lele lokal transgenik
ABSTRACT: Construct of growth hormone gene expression vector of African catfish (Clarias sp.) to produce transgenic walking catfish (Clarias batrachus). By: Ibnu Dwi Buwono, Nono Carsono, Yuniar Mulyani, and M. Untung Kurnia
This study aims to obtain an expression vector construct (pTarget) containing recombinant growth hormone gene insertion of African catfish (Clarias sp.) and β-actin promoter derived from walking catfish (Clarias batrachus) in order to produce transgenic local catfish. β-actin promoter of walking catfish (pCbBA) have been isolated from the pituitary of the fish with a size of about 1.7 kbp, and has a transcription element: CAAT box, TATA box, GC box, CArG, and TGACG motif based on analysis result of TF Bind program. Replacement of CMV (cytomegalovirus) promoter contained in the expression vector pTarget using restriction enzymes Sgf-I and I-Ppo I, obtained a product of digestion with the fragment size of 6,083 bp (pTarget-GH African catfish). pTarget-GH fragments were ligated with the African catfish β-actin promoter to arrange a construct of pTarget-pCbBA-African catfish GH (7,783 bp) as transgenic walking catfish expression vector.
KEYWORDS: expression vectors, growth hormone, African catfish, transgenic walking catfish PENDAHULUAN
Aspek penting yang menjadi kunci keberhasilan budidaya ikan (termasuk produksi induk dan benih unggul) adalah penguasaan bioteknologi pembenihan (rekayasa gen dan breeding), pakan, proteksi penyakit, dan manajemen (Chen et al., 1997). Rekayasa gen yang dimanfaatkan dalam budidaya ikan ditujukan untuk memperbaiki genetik pertumbuhan, dalam hal ini
me-ningkatkan ekspresi fenotipe pertumbuhan sebagai upaya meningkatkan produksi hasil budidaya.
Produksi ikan lele lokal (Clarias batrachus) unggul melalui program seleksi, memerlukan waktu lebih lama, lambatnya pewarisan gen terseleksi pada ke-turunan dari ikan yang diseleksi. Hal ini menjadikan pembudidaya ikan lele lokal beralih ke budidaya ikan lele dumbo (Clarias sp.), oleh karena sifat pertumbuhan lele lokal yang lambat walaupun rasa dagingnya lebih enak dibandingkan lele dumbo.
Selama dekade terakhir, spermatozoa pada ikan telah banyak diteliti peranannya dan dapat bertindak # Korespondensi: Fakultas Perikanan dan Ilmu Kelautan,
Universitas Padjadjaran. Jl. Raya Bandung Sumedang KM 21, Jatinangor 40600, Indonesia. Tel.: + (022) 7797763 E-mail: [email protected]
sebagai vektor untuk transfer gen asing dalam tek-nologi ikan transgenik yang dikenal sebagai transfer gen yang diperantarai sperma (SMGT = Sperm Medi-ated Gene Transfer) (Collares et al., 2010). Secara alami, hewan akuatik memproduksi sejumlah besar sel-sel sperma yang sangat menguntungkan bagi aplikasi teknik SMGT tersebut. Rekayasa genetika, khususnya teknologi rekombinan DNA mulai banyak diaplikasi-kan di bidang pembenihan idiaplikasi-kan guna meningkatdiaplikasi-kan pertumbuhan melalui penyisipan gen hormon per-tumbuhan tersebut ke dalam DNA genom telur atau sperma ikan.
Sejauh ini telah banyak usaha dilakukan untuk mengatur hormon-hormon pada ikan atau dengan re-kombinasi hormon dari mamalia dalam plasmid yang diintegrasikan pada genom ikan sehingga dapat mem-produksi hormon dalam jumlah banyak, meningkat-kan pertumbuhan, dan efisiensi pameningkat-kan (Chen & Powers, 1990).
Pemberian hormon pertumbuhan alami mamalia ke dalam pakan ikan maupun dengan cara perenda-man hormon tersebut ke dalam telur-telur ikan dipan-dang tidak efisien, karena setiap akan memproduksi ikan unggul, pekerjaan harus dilakukan berulang-ulang untuk maksud tersebut. Sebaliknya dengan mengin-tegrasikan gen asing yang mengekspresikan hormon pertumbuhan ke dalam inti sel ikan dan kemudian di-besarkan sampai induk lebih efisien untuk mewaris-kan sifat pertumbuhan pada keturunannya.
Perkembangan metode transfer gen secara mas-sal sangat penting, mengingat tingginya jumlah telur ikan dan fertilisasi eksternal. Teknologi DNA rekom-binan pada ikan dan sekuen-sekuen regulatorik (se-kuen promoter) telah dapat dikloning dan potensial dimanfaatkan untuk pembuatan konstruksi vektor ekspresi yang mengandung gen-gen ikan yang ber-nilai ekonomis (Muller et al., 1993; Dewi et al., 2010a). Pengujian sekuen-sekuen regulatorik yang dikloning (termasuk sekuen promoter), secara in vivo fungsional untuk mempermudah ekspresi transgen yang disi-sipkan melalui sperma untuk produksi massal ikan transgenik (Alimuddin et al., 2007; Sin et al., 1997). Produksi transgen secara stabil memerlukan waktu dari generasi ke generasi, mengingat tidak 100% transformasi gen ikan melalui elektroporasi sperma berhasil diwariskan ke telur ikan.
Penggunaan promoter β-aktin yellow catfish (Ge et al., 2012) ke dalam konstruksi vektor ekspresi rekom-binan yang mengandung gen hormon pertumbuhan (Growth Hormone /GH) lele dumbo yang ditransfer ke sperma ikan lele lokal (Clarias batrachus) melalui tek-nik SMGT ini diharapkan dapat meningkatkan eks-presi transgen tersebut dalam DNA genom larva lele, mengingat promoter β-aktin Clarias batrachus dapat
dikenali oleh elemen transkripsi dan ekspresi dalam DNA genom ikan lele lokal.
Berlandaskan uraian di atas, bahwa penelitian SMGT (mengandung sisipan gen GH lele dumbo) pa-da ikan lele lokal (Clarias batrachus) masih terbatas diterapkan, maka diperlukan penelitian perakitan konstruksi vektor ekspresi GH lele dumbo dalam upaya pembuatan ikan lele lokal transgenik.
Target penelitian yang ingin dicapai adalah pem-buatan konstruksi vektor ekspresi gen hormon per-tumbuhan ikan lele dumbo yang fungsional dapat terintegrasi dalam DNA genom sperma ikan lele lo-kal untuk tujuan produksi ikan lele lolo-kal transgenik. Tujuan umum dilakukan penelitian tersebut untuk memperbaiki sifat pertumbuhan lele lokal dari sifat pertumbuhan asalnya yang lebih meningkat dengan mentransfer GH lele dumbo ke dalam genom sperma lele lokal.
Hasil yang diharapkan dari penelitian adalah memberikan kontribusi kepada pembudidaya ikan air tawar untuk membudidayakan kembali lele lokal yang pertumbuhannya sama dengan lele dumbo se-hingga produksi meningkat dan sebagai upaya pe-nyediaan pangan nasional, serta stabilitas perikanan budidaya berkelanjutan.
BAHAN DAN METODE
Sampel yang digunakan untuk melipatgandakan fragmen DNA hormon pertumbuhan ikan lele dumbo dan DNA promoter β-aktin ikan lele lokal berasal dari hipofisa ikan tersebut. Isolasi RNA hipofisa dari ikan lele dumbo dilakukan menggunakan high pure RNA tissue kit, primer ORF-Cg-GH-F (5’-ATGGCTCGAGTTT TGGTGCTGCT-3’) dan ORF-Cg-GH-R (5’-CTACAGAGTG CAGTTGGAATCCAGGG-3’) (Zhang et al., 2009); serta
onestep RT-PCR kit (Qiagen) untuk mengamplifikasi gen hormon pertumbuhan ikan lele dumbo. Primer pBA-Cs-F (5’-GTGWGTGACGCYGGACCAAATC-3’) dan pBA-Cs-R (5’-CCATRTCRTCCCAGTTGGTSACAAT-3’) (Ge et al., 2012) digunakan untuk mengamplifikasi promoter β-aktin ikan lele lokal. Vektor pGEM-T di-gunakan untuk kloning gen hormon pertumbuhan ikan lele dumbo dan promoter β-aktin ikan lele lokal, pTARGETTM digunakan sebagai vektor ekspresi gen
hormon pertumbuhan ikan lele dumbo dan kit plas-mid genaid untuk mengisolasi promoter-promoter β -aktin ikan lele lokal dan gen hormon pertumbuhan ikan lele dumbo yang dikloning dalam bakteri Esheri-chia coli.
Perakitan Konstruksi Vektor Ekspresi pTARGET-Promoter CMV dan pTARGET-pTARGET-Promoter CbBA Transgen yang digunakan untuk produksi ikan lele lokal transgenik terbagi atas dua macam
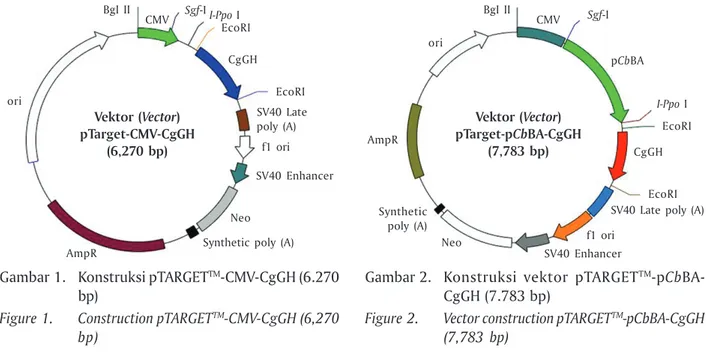
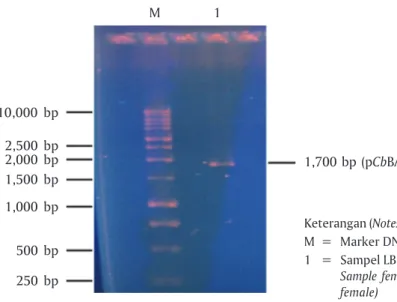
kons-truksi vektor ekspresi yaitu: (1) pTARGET-CMV-CgGH dan (2) pTARGET-pCbBA-CgGH. Konstruksi pTARGET-CMV-GH lele dumbo yang dirancang disajikan pada Gambar 1 dan konstruksi pTARGET-CbBA-GH lele dumbo disajikan pada Gambar 2, yang mengganti pro-moter CMV dengan propro-moter β-aktin Clarias batrachus
(pCbBA).
Insersi promoter β-aktin Clarias batrachus (pCbBA) ke pTARGET, dengan cara men-digesti vektor terse-but dengan enzim restriksi Sgf I dan I-Ppo I, kemudi-an disambungkkemudi-an (diligasi) dengkemudi-an sekuen promoter pCbBA. Sebelum dilakukan penyisipan promoter pCbBA, sekuen promoter tersebut dianalisis menggu-nakan program TF Bind (Transcription Factor Binding) untuk memastikan sekuen promoter tersebut telah memiliki sekuen fungsional yaitu: CAAT box, TATA box,
dan motif CArG yang penting untuk mendorong transkripsi gen GH lele dumbo yang diinsersikan da-lam konstruksi vektor pTARGETTM-CbBA-GH lele
dum-bo tersebut. Promoter CMV pada vektor pTARGETTM
diganti (replacement) dengan promoter pCbBA, dengan memotong (digesti) sekuen CMV menggunakan dua enzim restriksi (Sgf-I dan I-Ppo I) pada pTARGET untuk membuang sekuen CMV, kemudian menyisipkan pro-moter pCbBA tersebut ke dalam vektor.
Proses digesti vektor dilakukan dengan melarut-kan 5 μL pTARGET; 2 μL 10x buffer RE; 0,5 μL BSA; 1
μL enzim Sgf-I; 1 μL enzim I-Ppo I; dan 11,5 μL SDW. Reaksi digesti diinkubasi selama tiga jam pada suhu 37oC.
Proses ligasi dilakukan dengan mencampurkan 3
μL promoter pCbBA; 1 μL T4 DNA ligase 10x; 1 μL enzim T4 DNA ligase; 4 μL SDW; dan 1 μL pTARGET yang telah dipotong dengan enzim Sgf-I dan I-Ppo I. Inkubasi dilakukan selama dua jam pada suhu ruang
dan dilanjutkan semalaman pada suhu 4oC. Peta
konstruksi pTARGET-pCbBA-GH lele dumbo disajikan pada Gambar 2.
Transformasi Vektor Ekspresi Rekombinan (pTARGETTM-gen GH Lele Dumbo) pada Sel Kompeten E. coli JM 109
Setelah pembuatan vektor ekspresi rekombinan, pengerjaan selanjutnya mengkloning vektor tersebut ke dalam sel kompeten, untuk memperoleh kopi-ko-pi hormon pertumbuhan lele dumbo secara in vivo. Sebelum dilakukan proses kloning gen GH lele dum-bo, dibuat terlebih dahulu medium tumbuh sel kom-peten E. coli. Medium tumbuh yang dibutuhkan ada dua macam, yaitu: (1) medium untuk kultur cair sel kompeten, terbuat dari 40 g Circle grow broth yang dicampur dengan 1 liter milliq H2O steril, dan (2) me-dium kultur padat (solid) yang terbuat dari campuran 25 g Luria Bertani (LB) broth (LB broth) dengan 15 g
Bacto agar dalam 1 liter milliq H2O steril. Medium kul-tur padat tersebut kemudian di-plating ke dalam ca-wan petri sesuai dengan jumlah kebutuhan. Sedang-kan untuk medium kultur cair dilakuSedang-kan di dalam ta-bung reaksi dengan jumlah volume medium 5 mL dan ditambahkan ampicillin sesuai kebutuhan.
Untuk meningkatkan pertumbuhan sel, diperlu-kan medium SOC, serta untuk menginduksi koloni agar tumbuh dalam kultur padat ditambahkan IPTG dan X-gal. Seleksi koloni putih (hanya mengandung
insert ORF-Cg-GH) dilakukan dengan penambahan antibiotik ampicillin pada medium kultur tersebut.
Secara garis besar, protokol teknik kloning dan transformasi produk ligasi dalam vektor kloning dan vektor ekspresi yang ditransformasikan ke dalam sel kompeten E. coli JM 109 dipaparkan sebagai berikut;
Gambar 1. Konstruksi pTARGETTM-CMV-CgGH (6.270
bp)
Figure 1. Construction pTARGETTM-CMV-CgGH (6,270
bp)
Vektor (Vector) pTarget-CMV-CgGH
(6,270 bp)
BgI II
Synthetic poly (A) AmpR Neo ori SV40 Enhancer f1 ori CMV EcoRI CgGH EcoRI I-Ppo I Sgf-I SV40 Late poly (A)
Gambar 2. Konstruksi vektor pTARGETTM-pCb
BA-CgGH (7.783 bp)
Figure 2. Vector construction pTARGETTM-pCbBA-CgGH
(7,783 bp) BgI II EcoRI Synthetic poly (A) SV40 Enhancer Vektor (Vector) pTarget-pCbBA-CgGH (7,783 bp) Neo AmpR f1 ori
SV40 Late poly (A) EcoRI I-Ppo I CgGH pCbBA CMV Sgf-I ori
dipersiapkan dua plate LB/ampicillin/IPTG/X-gal untuk setiap reaksi ligasi. Tahap selanjutnya dilakukan sen-trifugasi tube-tube yang mengandung reaksi ligasi un-tuk mengumpulkan kandungannya pada dasar tube, kemudian ditambahkan 2 μL setiap reaksi ligasi ke mikrotube 1,5 mL steril on-ice. Segera diambil microtube-microtube beku sel kompeten JM 109 dari penyimpa-nan -80oC dan ditempatkan dalam stryrofoam berisi
timbunan es curai hingga mencair (kira-kira lima me-nit). Sel-sel dicampurkan dengan teknik flicking (men-jentik-jentikan tube dengan jari tangan). Dengan ekstra hati-hati, 50 μL sel kompeten JM 109 ditransfer ke dalam setiap tube berisi campuran reaksi ligasi yang telah dipersiapkan sebelumnya. Secara perlahan-lahan, menjentik-jentikan tube untuk mencampur dan ke-mudian segera ditempatkan on ice dalam styrofoam selama 20 menit.
Sebelum transformasi, dipersiapkan waterbath
(dengan suhu stabil 42oC), dan segera dilakukan heat
shock (kejutan panas) sel-sel kompeten yang telah campur reaksi ligasi selama 90 detik (tidak boleh di-goyang-goyang). Segera dikembalikan tube-tube ke styrofoam berisi es curai selama dua menit. Proses di-lanjutkan dengan menambahkan 950 μL medium SOC pada suhu ruang ke dalam sel-sel kompeten tersebut untuk masing tube-tube yang telah dilabel. Tahap akhir dilakukan inkubasi selama dua jam pada suhu 37oC
dengan shaking (penggoyangan) kecepatan 125 rpm menggunakan shaking waterbath.
Amplifikasi Sekuen Promoter βββββ-Aktin Lele Lokal DNA genom ikan lele lokal digunakan sebagai tem-plate untuk mengkopi sekuen promoter β-aktin lele tersebut menggunakan primer pBA-Cs-F (5’-GTGWG TGACGCYGGACCAATC-3’) dan pBA-Cs-R (5’-CCATRT CRTCCCAGTTGGTSACAAT-3’) yang dirujuk dari Ge et al. (2012).
Campuran reaksi PCR (polymerase chain reaction) dalam volume akhir 25 μL yang mengandung 12,5 μL
fast start PCR master mix (Roche); 1,5 μL pBA-Cs-F (10
μM); 1,5 μL pBA-Cs-R (10 μM); 2,5 μL DNA genom lele; dan 7 μL nuclease free water. Penggandaan sekuen pro-moter tersebut dilakukan dengan pengaturan program PCR : pra-denaturasi 95oC selama lima menit;
denatu-rasi 94oC selama satu menit; annealing 62oC selama
45 detik; ekstensi 72oC selama dua menit dengan
jumlah siklus sebanyak 30 kali replikasi dan ekstensi akhir 72oC selama sepuluh menit.
Pengerjaan dilanjutkan dengan elektroforesis pro-duk PCR di atas dalam gel agarose 1%. Kondisi elek-troforesis sebagai berikut: tegangan listrik 75 volt, waktu 90 menit, perendaman dalam ethidium bromide
selama 20 menit, dan pencucian dalam akuades steril selama 15 menit.
Sekuensing Promoter βββββ-Aktin Ikan Lele Lokal Analisis sekuen DNA promoter β-aktin lele lokal di-lakukan untuk verifikasi keberadaan elemen-elemen transkripsi yang terkandung dalam sekuen tersebut, seperti halnya yang telah dilakukan untuk analisis pro-moter grass carp (Li et al., 2007). Sekuensing dilakukan di PT Genetika Science Indonesia (1st Base Singapore)
dan sekuen tersebut diverifikasi dengan menyejajar-kan (alignment) elemen transkripsi sekuen promoter
β-aktin lele lokal (C. batrachus) dengan elemen trans-kripsi sekuen promoter β-aktin Indian catfish ( Hete-ropneustes fossilis) dan yellow catfish (Pelteobagrus ful-vidraco) yang terdapat di Bank Gen dengan program GENETYX versi 7.
HASIL DAN BAHASAN
Amplifikasi Fragmen Promoter βββββ-Aktin Lele Lo-kal
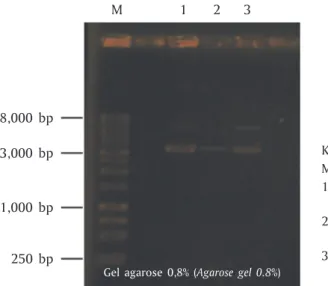
Amplifikasi sekuen promoter β-aktin lele lokal (pCbBA) dilakukan menggunakan primer pBA-Cs-F dan pBA-Cs-R merujuk hasil penelitian Ge et al. (2012). Ha-sil amplikon (produk PCR) yang telah diperoleh seki-tar 1.700 bp, dan dilanjutkan dengan mengirimkan sampel produk PCR ke jasa service sekuensing 1st Base
Singapore melalui PT Genetika Science Indonesia, Jakarta untuk meyakinkan bahwa sekuen tersebut me-rupakan sekuen promoter (menggunakan program
Promoter Scan). Gambar 3 merupakan hasil amplifikasi sekuen promoter pCbBA, dengan ukuran fragmen se-kitar 1.700 bp.
Ukuran fragmen promoter β-aktin lele lokal ini ti-dak jauh berbeda dengan ukuran fragmen promoter
β-aktin yellow catfish yang telah diteliti Ge et al. (2012) sebesar 1.617 bp. Amplifikasi pada produk PCR pro-moter β-aktin lele lokal tersebut menandakan, frag-men yang terkopi oleh primer pBA-Cs-F dan pBA-Cs-R diprediksikan merupakan sekuen promoter β-aktin lele lokal.
Verifikasi hasil sekuensing produk PCR pada Gam-bar 3 menggunakan software Promoter Scan versi 1.7 diperlukan untuk menentukan apakah sekuen tersebut mengandung CAAT box, TATA box, dan motif CArG yang diketahui penting dalam aktivitas promoter β -aktin.
Ketiga elemen transkripsi (CAAT box, motif CArG,
TATA box) pada sekuen promoter β-aktin ikan lele lo-kal β-aktin ikan lele lokal terdeteksi secara manual. Faktor transkripsi (TFIID) yang terikat dengan elemen
TATA box untuk menginisiasi transkripsi terdeteksi dengan program ProScan versi 1.7 secara on line (Gam-bar 4). Lokasi elemen CAAT box terdapat pada nuk-leotida (nt.) 22-29, motif CArG pada nt. 615-623, ele-men TATA box pada nt. 49-54, dan nt. 296-302 untuk
promoter β-aktin ikan lele lokal (C. batrachus), semen-tara pada Indian catfish (Heteropneustes fossilis, no. aksesi AY 531754), terletak pada nt. 343-347 (CAAT box), elemen CArG pada nt. 372-381, serta nt. 345-350 (elemen TATA box). Elemen transkripsi penting pro-moter β-aktin semua vertebrata direpresentasikan oleh CAAT box, motif CArG, dan TATA box yang ter-kandung dalam sekuen promoter tersebut (Hew & Fletcher, 2001). CAAT box merupakan enhancer yang diperlukan untuk meningkatkan level transkripsi, mo-tif-motif CArG terlibat dalam pengaturan transkripsi basal dan elemen TATA box berperan dalam pengaturan transkripsi gen fungsional yang terletak pada
proxi-mal promoter (Aranburu et al., 2006; Santoro & Walsh, 1991).
Elemen lain yang penting dalam penentuan situs pengikatan RNA polimerase II ketika transkripsi akan berlangsung adalah GC box (sekuen GGGCGGG) dan motif TGACG yang berperan sebagai perantara faktor hormon pertumbuhan dari hipofisa (Argenton et al., 1996) pada sekuen promoter β-aktin catfish. Hasil pen-jajaran elemen-elemen transkripsi antara promoter
β-aktin ikan lele lokal dan Indian catfish (H. fossilis) menggunakan program Genetyx versi 7.0 disajikan dalam Gambar 5. Motif TGACG pada promoter β-aktin
C. batrachus pada nt. 814-818. Keterangan (Notes):
M = Marker DNA Ladder 1 kb (Marker 1 kb DNA Ladder)
1 = Sampel LB betina (template DNA genom hipofisa lele lokal betina)
Sample female LB (genomic DNA template pituitary walking catfish female)
1,700 bp (pCbBA)
Gambar 3. Fragmen pCbBA (1.700 bp)
Figure 3. Fragment pCbBA (1,700 bp)
M 10,000 bp 1 2,500 bp 1,000 bp 500 bp 250 bp 2,000 bp 1,500 bp
Gambar 4. Motif CArG, CAAT box dan TATA box pada sekuen promoter β-aktin lele Lokal (arah forward)
Figure 4. The motive CArG, CAAT box and TATA box of the promoter sequence of β-actin walking catfish (forward direction)
Keterangan (Notes):
TATAAA = Sekuen core promoter (Promoter core sequence)
CAAT = Sekuen enhancer (Enhancer sequence)
CCAAAT = CCAAT box
CAAATTGG = Motif CArGG (CArGG
Verifikasi penjajaran elemen transkripsi antara pro-moter β-aktin ikan lele lokal dan yellow catfish ( Pelteo-bagrus fulvidraco) juga mengindikasikan keberadaan ketiga elemen transkripsi dalam promoter β-aktin ke-dua jenis catfish tersebut (Gambar 6).
Elemen CAAT box sebagai sinyal untuk faktor tran-skripsi RNA polimerase terletak di depan elemen TATA box, pada posisi nt. 35-42 untuk promoter β-aktin
C. batrachus dan posisi nt. 16-19 untuk P. fulvidraco
(Gambar 6). Motif CArG terletak pada nt. 615-623
(pro-Keterangan (Notes):
CAAT box = Sekuen conserved (Conserved sequence) GGCCAATCT (CCCCAATCT)
CArG = Sekuen conserved (Conserved sequence) CC(A/T)6GG
TATA box = Sekuen conserved (Conserved sequence) TATAAA
GC box = Sekuen conserved (Conserved sequence) GGGCGGG
TGACG = Faktor pertumbuhan dari hipofisa (Factor of pituitary growth)
Gambar 5. Penjajaran elemen transkripsi promoter β-aktin ikan lele lokal (C. batrachus) dan Indian catfish (H. fossilis)
Figure 5. Transcription element alignment β-actin promoter walking catfish (C. batrachus) and Indian catfish (H. fossilis)
moter β-aktin C. batrachus) dan terletak pada nt. 1232-1241 untuk P. fulvidraco. Boks TATA sebagai core pro-moter untuk ikan lele lokal (C. batrachus) terletak pada nt. 49-54 dan nt. 296-302, serta 472-477, sementara untuk P. fulvidraco pada posisi 78-83. Pada promoter
β-aktin C. batrachus, motif TGACG terletak nt.
814-818, sedangkan pada P. fulvidraco pada nt. 348-352.
GC box hanya terdapat pada promoter β-aktin C. bat-rachus pada posisi nt. 558-564. Berdasarkan interpres-tasi penjajaran elemen-elemen transkripsi (CAAT box, motif CArG, dan TATA box) yang terkandung dalam se-kuen promoter β-aktin ikan lele lokal dengan Indian
Gambar 6. Penjajaran elemen transkripsi promoter β-aktin ikan lele lokal (C. batrachus) dan yellow catfish (Pelteobagrus fulvidraco)
Figure 6. Transciption element alignment β-actin promoter walking catfish (C. batrachus) and yellow catfish (Pelteobagrus fulvidraco)
Keterangan (Notes):
CAAT box = Sekuen conserved (Conserved sequence) GGCCAATCT
CArG = Sekuen conserved (Conserved sequence) CC(A/T)6GG
TATA box = Sekuen conserved (Conserved sequence) TATAAA
GC box = Sekuen conserved (Conserved sequence) GGGCGGG
catfish dan yellow catfish (Gambar 5 dan 6), memperkuat keyakinan bahwa sekuen yang teramplifikasi adalah promoter β-aktin ikan lele lokal (C. batrachus).
Interaksi di antara elemen-elemen transkripsi ter-masuk motif TGACG yang terkandung dalam sekuen promoter β-aktin ketiga jenis catfish tersebut sangat dibutuhkan untuk mencapai kadar tinggi transkripsi (Fletcher & Hew, 2001).
Berdasarkan hasil pengolahan sekuen dengan pro-gram TF Bind pada sekuen pCbBA, diperoleh sekuen TATA box yang merupakan core promoter, sekuen CAAT yang mengindikasikan sekuen enhancer, sekuen CCAT
box, dan motif CArGG, sehingga terbukti bahwa se-kuen yang terkopi oleh primer pBA-Cs-F dan pBA-Cs-R adalah promoter β-aktin lele lokal.
Verifikasi Sisipan GH Lele Dumbo dalam E. coli JM 109 Pembawa pTarget Rekombinan
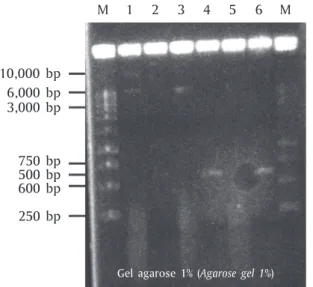
Hasil isolasi vektor rekombinan yang mengandung pTarget dengan sisipan gen GH lele dumbo, dideteksi menggunakan primer ORF-GH-F dan ORF-GH-R dan elektroforesis gel agarose 0,8%. Elektroforegram hasil deteksi tersebut disajikan pada Gambar 7.
Hasil cek elektroforesis isolasi vektor rekombinan (pTarget-GH RNA3 lele dumbo) yang disajikan pada Gambar 7, terlihat bahwa fragmen DNA vektor rekom-binan yang terdeteksi mengalami konfirmasi dalam bentuk DNA supercoiled (terdapat dua fragmen DNA pada ukuran di atas 3.000 bp dan fragmen DNA pada ukuran di bawah 8.000 bp). Bentuk DNA tersebut me-nandakan fragmen DNA vektor rekombinan (pTarget-GH RNA3 lele dumbo) masih melingkar (circular) (Alimuddin et al., 2010), dan secara teoritis hasil ini mengindikasikan bahwa klon-klon bakteri E. coli strain JM 109 dalam stok gliserol tersebut membawa
vek-tor pTarget yang mengandung sekuen penyandi GH lele dumbo.
Verifikasi keberadaan gen hormon pertumbuhan lele dumbo (GH RNA3 lele dumbo) dalam vektor pTar-get yang terkandung di dalam sel kompeten E. coli
JM 109 dapat dikonfirmasi dengan menggunakan pri-mer ORF-Cg-F dan ORF-Cg-R untuk deteksi gen GH lele dumbo. Hasil konfirmasi pTarget yang membawa gen GH tersebut ditunjukkan pada Gambar 8.
Keberadaan fragmen penyandi GH lele dumbo (sam-pel GH2 (1), GH2 (2), dan uncut vektor pTarget) terde-teksi pada Gambar 8 dengan ukuran fragmen sebesar 600 bp, yang menunjukkan bahwa sisipan gen hor-mon pertumbuhan lele dumbo terdapat dalam vektor pTarget, serta terkandung di dalam sel kompeten E. coli JM 109 (stok gliserol). Konstruksi vektor ekspresi untuk pembuatan ikan transgenik ini terdapat dalam klon-klon bakteri dengan kode sampel pTarget-GH2 (1), pTarget-GH2 (2) dan pada vektor rekombinan (pTarget-CMV-GH RNA2) yang tidak dipotong dengan restriksi EcoRI (uncut vektor). Hasil ini membuktikan bahwa konstruksi vektor ekspresi dengan promoter CMV yaitu pTarget-CMV-GH2 (1) dan pTarget-CMV-GH2 (2) untuk pembuatan ikan transgenik telah berhasil dibuat.
Klon-klon dari sampel lain (aliquot) yang diverifika-si keberadaan diverifika-sidiverifika-sipan gen GH lele dumbo dengan pri-mer ORF-Cg-F dan ORF-Cg-R juga menunjukkan hasil yang sama dengan sampel hasil isolasi vektor rekom-binan pTarget-CMV-GH RNA2 (1) dan pTarget-CMV-GH RNA2 (2) sebelumnya. Klon koloni sampel hasil isolasi pTarget-CMV-GH RNA3 (B2); pTarget-CMV-GH RNA3 (B3); pTarget-CMV-GH RNA2 (1) dan pTarget-CMV-GH RNA2 (2) yang membawa sisipan gen hormon pertumbuhan lele dumbo disajikan pada Gambar 9.
Gambar 7. Elektroforegram hasil isolasi pTarget-GH RNA3 lele dumbo
Figure 7. Electrophoregram results isolation pTarget-GH RNA3 African catfish
1 8,000 bp M 3,000 bp 1,000 bp 250 bp Keterangan (Notes):
M = Marker DNA ladder 1 kb (Marker 1 kb DNA Ladder)
1 = Hasil isolasi vektor pTarget-GH RNA3-(B)-1 (Isolation results of pTarget-GH RNA3-(B)-1 vector)
2 = Hasil isolasi vektor pTarget-GH RNA3-(B)-2 (Isolation results of pTarget-GH RNA3-(B)-2 vector)
3 = Hasil isolasi vektor pTarget-GH RNA3-(B)-3 (Isolation results of pTarget-GH RNA3-(B)-3 vector)
2 3
Hasil elektroforegram pada Gambar 9, khususnya sampel hasil isolasi pTarget-GH RNA3 (B2), pTarget-GH RNA3 (B3) dan pTarget-GH RNA3 (A1) terdapat DNA vek-tor ekspresi (pTarget) pada ukuran sekitar 6.000 bp, sesuai dengan ukuran vektor pTarget (5.670 bp) pada semua sampel tersebut (sumur ke-1, 3, dan 5) (Gambar 9) dalam bentuk DNA linier yang terkandung dalam sel kompeten E. coli JM 109 stok gliserol. Konfirmasi ini memberikan keyakinan bahwa vektor ekspresi yang dikloning dan ditransformasikan ke sel kompeten dan disimpan cukup lama dalam gliserol tersebut, memi-liki kualitas DNA vektor sangat baik (dalam keadaan utuh), dan konfirmasi sisipan gen hormon pertumbu-han lele dumbo pada masing-masing sampel tersebut terdeteksi dengan ukuran fragmen 600 bp menggu-nakan primer ORF-Cg-F dan ORF-Cg-R (sumur ke-2, 4, dan 6) (Gambar 9).
Sementara, pada sampel hasil kultur cair yaitu: pTarget-GH RNA2 (1), pTarget-GH RNA2 (2), dan uncut
pTarget-GH RNA3, fragmen DNA vektor sampel terse-but berbentuk supercoiled yang mengindikasikan DNA dalam keadaan konfirmasi dengan bentuk melingkar. Bentuk seperti ini umum dijumpai pada fragmen DNA vektor yang baru dikloning ke dalam sel kompeten dan dalam jangka tertentu akan kembali dalam ben-tuk normal (benben-tuk sirkular). Indikasi benben-tuk super-coiled ini ditunjukkan dengan munculnya pita-pita ganda di atas 6.000 bp (ukuran vektor pTarget sebesar 5.670 bp) (sumur ke-7, 8, 9, 10, 11, dan ke-12) (Gambar 9). Verifikasi sisipan GH lele dumbo dalam vektor pTarget hasil kultur cair juga diperoleh tepat dengan ukuran fragmen sebesar 600 bp (sumur ke-7, 8, 9, 10, 11, dan ke-12) (Gambar 9). Dengan demikian dalam perakitan konstruksi vektor ekspresi gen hormon pertumbuhan lele dumbo diperoleh stok konstruksi vektor sebanyak enam sampel: (pTarget-CMV-GH RNA3
(B2), pTarget-CMV-GH RNA3 (B3), pTarget-CMV-GH RNA3 (1), pTarget-CMV-GH RNA2 (1), pTarget-CMV-GH RNA2 (2), dan uncut pTarget-CMV-GH RNA3).
Digesti pTarget Rekombinan dengan Enzim Restriksi I-Ppo I
Untuk mengganti promoter CMV pada vektor eks-presi pTarget-CMV-GH lele dumbo, maka diperlukan pengerjaan pemotongan (digesti) tapak Sgf-I dan I-Ppo I pada vektor pTarget-CMV-GH lele dumbo, se-hingga sebagian fragmen promoter CMV dikeluarkan dan promoter tersebut tidak berfungsi kemudian di-sisipkan dengan fragmen promoter β-aktin lele lokal yang telah diperoleh. Penggantian promoter virus (CMV) dengan β-aktin lele lokal ini dimaksudkan untuk mem-buat konstruksi vektor ekspresi all catfish pada tata konstruksi ikan transgenik, sehingga mudah diterima oleh konsumen ikan sebagai bahan pangan dan ele-men cis-acting promoter β-aktin lele lokal mudah di-kenali oleh faktor trans-acting dari ikan sekerabat di-bandingkan yang berasal dari virus (Alam et al., 1996; Alimuddin, 2003; Ge et al., 2012).
Hasil produk digesti pTarget-CMV-GH lele dumbo dengan enzim restriksi I-Ppo I disajikan pada Gambar 10. Berdasar hasil elektroforegram Gambar 10, khusus-nya untuk sampel pTarget-ORF-GH2 (2) dan pTarget-ORF-GH3 (B2) (sumur ke-1 dan ke-2) (Gambar 10), dipe-roleh fragmen DNA berukuran sekitar 6.000 bp, yang mengindikasikan ukuran vektor rekombinan (pTarget-CMV-GH lele dumbo) sebesar 6.270 bp, sehingga pro-duk digesti dengan enzim I-Ppo I pada kedua sampel tersebut terverifikasi dengan benar.
Khusus untuk verifikasi hasil pemotongan fragmen pTarget-CMV-GH lele dumbo dengan Sgf-I dan I-Ppo I, maka hasil fragmen yang dipotong dapat dilihat pada Gambar 8. Konfirmasi pTarget pembawa GH lele dumbo
Figure 8. Confirmation pTarget carrier African catfish GH
1 10,000 bp M 2 6,000 bp 600 bp 500 bp 250 bp 3,000 bp 750 bp Keterangan (Notes):
M = Marker DNA ladder 1 kb (Marker 1 kb DNA Ladder)
1 = Sampel hasil isolasi vektor pTarget-GH3 (uncut vektor) (Sample isolation results pTarget-GH3 vector (uncut vector))
2 = PCR dari sampel hasil isolasi vektor pTarget-GH3 (uncut vektor)
PCR from samples isolation results pTarget-GH3 vector (uncut vector)
3 = Hasil isolasi vektor pTarget-GH2 (1) (Isolation results pTarget-GH2 (1) vector)
4 = PCR hasil isolasi vektor pTarget-GH2 (1) (PCR isolation results pTarget-GH2 (1) vector)
5 = Sampel hasil isolasi vektor pTarget-GH2 (2) (Samples isolation results pTarget-GH2 (2) vector)
6 = PCR sampel hasil isolasi vektor pTarget-GH2 (2) (PCR samples isolation results pTarget-GH2 (2) vector)
3 4 5 6 M
Keterangan (Note):
M = Marker DNA Ladder 1 kb (Marker 1 kb DNA Ladder) 1 = pTarget-ORF GH2 (2) (pTarget-ORF GH2 (2)) 2 = pTarget-ORF GH3 (B2) (pTarget-ORF GH3 (B2)) 3 = pTarget-ORF-GH3-A (1) (pTarget-ORF-GH3-A (1))
4 = pTarget-ORF-GH3-A (2) (pTarget-ORF-GH3-A (2)) 5 = DNA pGEM-T (Kontrol +) (pGEM-T DNA (+ Control)) 6 = DNA pGEM-T (Kontrol +) (pGEM-T DNA (+ Control)) Gambar 10. Produk digesti pTarget-CMV-GH lele dumbo dengan I-Ppo I
Figure 10. Digestion product of pTarget-CMV-GH African catfish with I-Ppo I
10,000 bp 6,000 bp 500 bp 250 bp 3,000 bp 5,000 bp 6 5 M 4 3 2 1 M
Gambar 9. Konfirmasi sisipan GH lele dumbo pada klon E. coli JM 109
Figure 9. Confirmation of African catfish GH inserts in clones of E. coli JM 109
Keterangan (Note):
M = Marker DNA ladder 1 kb (Marker 1 kb DNA Ladder)
1 = Hasil isolasi pTarget-GH3-(B2) stok gliserol (Isolation results pTarget-GH3-(B2) of gliserol stock)
2 = Konfirmasi PCR hasil isolation pTarget-GH RNA3-(B2) stok gliserol pakai primer ORF-Cg-F dan ORF-Cg-R
PCR confirmation of isolation results pTarget-GH RNA3-(B2) of glierol stock use ORF-Cg-F and ORF-Cg-R primers
3 = Hasil isolasi pTarget-GH3-(B3) stok gliserol (Isolation results pTarget-GH3-(B3) of gliserol stock)
4 = Konfirmasi PCR hasil isolasi pTarget-GH RNA3-(B3) stok gliserol pakai primer ORF-Cg-F dan ORF-Cg-R
PCR confirmation of isolation results pTarget-GHRNA3-(B3) of gliserol stock use ORF-Cg-F and ORF-Cg-R primers
5 = Hasil isolasi pTarget-GH3-(A1) stok gliserol (Isolation results pTarget-GH3-(A1) of gliserol stock)
6 = Konfirmasi PCR hasil isolasi pTarget-GH RNA3-(A1) stok gliserol pakai primer ORF-Cg-F dan ORF-Cg-R
PCR confirmation of isolation results pTarget-GH RNA3-(A1) of gliserol stock use ORF-Cg-F and ORF-Cg-R primers
7 = Uncut pTarget-GH RNA3 hasil isolasi vektor rekombinan (Isolation results uncut recombinant vector pTarget-GH RNA3)
8 = Konfirmasi PCR pTarget-GH RNA3 hasil isolasi vektor rekombinan (primer ORF-Cg-F dan ORF-Cg-R)
PCR confirmation isolation results of recombinant vector pTarget-GH RNA3 (ORF-Cg-F and ORF-Cg-R primers)
9 = Hasil isolasi pTarget-GHRNA2 (1) (Isolation results of pTarget-GH RNA2 (1))
10 = Konfirmasi PCR hasil isolasi pTarget-GH RNA2 (1) dengan primer ORF-Cg-F dan ORF-Cg-R
PCR confirmation isolation results of pTarget-GH RNA2 (1) with ORF-Cg-F and ORF-Cg-R primers
11 = Hasil isolasi pTarget-GHRNA2 (2) (Isolation results of pTarget-GH RNA2 (2))
12 = Konfirmasi PCR hasil isolasi pTarget-GHRNA2 (2) dengan primer ORF-Cg-F dan ORF-Cg-R
PCR confirmation isolation results of pTarget-GH RNA2 (2) with ORF-Cg-F and ORF-Cg-R primers
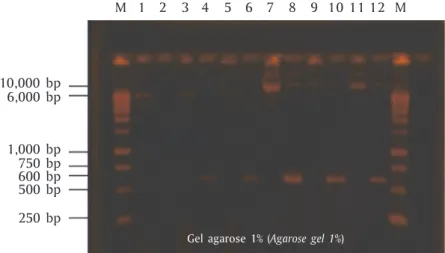
M 10,000 bp M 6,000 bp 600 bp 500 bp 250 bp 1,000 bp 750 bp 1 2 3 4 5 6 7 8 9 10 11 12
Gel agarose 1% (Agarose gel 1%)
Gambar 11. Vektor rekombinan yang hanya dipotong dengan Sgf-I pada suhu inkubasi 37oC semalaman (
over-night) berada pada ukuran sekitar 6.000 bp (sumur ke-1) (Gambar 11), sedangkan pada sumur ke-2 (Gam-bar 11), ukuran vektor rekombinan yang dipotong Sgf -I di atas 6.000 bp, yang mengindikasikan fragmen be-lum terpotong secara sempurna. Sebaliknya fragmen vektor rekombinan yang dipotong Sgf-I pada suhu in-kubasi 37oC selama tiga jam (sumur ke-3) (Gambar 11),
menunjukkan hasil potongan berkisar 6.000 bp, yang menunjukkan hasil digesti yang benar, seperti halnya pada ukuran fragmen yang ditunjukkan pada sumur ke-1 (Gambar 11). Sementara untuk vektor rekombi-nan pTarget-CMV-GH lele dumbo (ukuran 6.270 bp) yang dipotong oleh enzim I-Ppo I dan kemudian di-potong Sgf-I (sumur ke-4) (Gambar 11) dengan frag-men yang terpotong sekitar 187 bp frag-menunjukkan
ha-sil yang benar (walaupun bentuk fragmen DNA masih
supercoiled), dengan ukuran sekitar 6.083 bp (di atas 6.000 bp). Dengan demikian telah diperoleh situs re-striksi Sgf-I dan I-Ppo I pada tapak vektor rekombinan pTarget-GH lele dumbo untuk mengganti (replacement) promoter CMV dengan promoter β-aktin lele lokal pada vektor tersebut.
Pada sumur ke-1 (Gambar 11), hasil digesti vektor pTarget-GH3B2 menghasilkan fragmen linier beruku-ran sekitar 6.000 bp setelah dipotong dengan enzim
Sgf-I, dan selanjutnya gel dari fragmen linier tersebut dipurifikasi menggunakan Wizard PCR clean upkit (Pro-mega) untuk dipotong kembali menggunakan enzim restriksi lain, yaitu I-Ppo I, dalam upaya mengganti promoter CMV dengan promoter β-aktin lele lokal pa-da vektor pTarget. Formula campuran reaksi digesti
dengan enzim I-Ppo I untuk fragmen pTarget-GH3B2 (Sgf-I) yaitu: Sterile Deionized Water (SDW) sebanyak 11,5
μL; buffer RE (Restriction Enzyme) 10x sebanyak 2 μL; BSA (Bovine Serum Albumin) sebanyak 0,5 μL; DNA vek-tor (pTarget-GH3B2-Sgf-I) sebanyak 5 μL dan enzim I
-Ppo I sebanyak 1 μL. Elektroforesis gel agarose 1% ha-sil digesti vektor ekspresi rekombinan dengan I-Ppo I tersebut disajikan dalam Gambar 12.
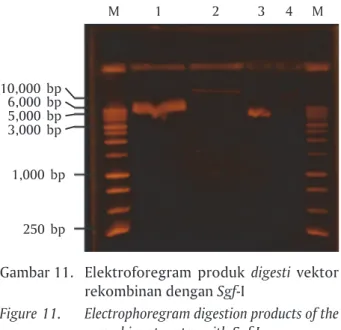
Berdasarkan ukuran DNA vektor pTarget-GH3B2 sekitar 6.270 bp yang dipotong dengan enzim Sgf-I dan I-Ppo I (sekuen vektor dibuang sekitar 187 bp), ha-sil akhir produk digesti kedua enzim restriksi yang diperoleh sebesar 6.083 bp. Ukuran fragmen linier produk digesti kedua enzim ini terdeteksi pada Gam-bar 12 (sumur ke-1, 2, dan 3) pada posisi 6.000 bp. Dengan demikian, diperoleh tiga sampel DNA vektor rekombinan, yang telah dipotong sisi restriksinya dengan enzim Sgf-I dan I-Ppo I untuk insersi sekuen promoter β-aktin lele lokal.
Gambar 11. Elektroforegram produk digesti vektor rekombinan dengan Sgf-I
Figure 11. Electrophoregram digestion products of the recombinant vector with Sgf-I
M 10,000 bp M 1 6,000 bp 1,000 bp 250 bp 5,000 bp 3,000 bp 2 3 4
Gambar 12. Produk digesti vektor rekombinan (pTarget-GH3B2) dengan Sgf-I dan I-Ppo I
Figure 12. Digestion product of recombinant vector (pTarget-GH3B2) with Sgf-I and I-Ppo I
Keterangan (Note):
M = Marker DNA Ladder 1 kb (Marker 1 kb DNA Ladder) 1 = pTarget-CMV-GH3B2 dipotong Sgf-I, lalu dipotong I-Ppo I
pTarget-CMV-GH3B2 cutting with Sgf-I and cutting with I-Ppo I
2 = pTarget-CMV-GH3B2 dipotong Sgf-I, lalu dipotong I-Ppo I
pTarget-CMV-GH3B2 cutting with Sgf-I and cutting with I-Ppo I
3 = pTarget-CMV-GH3B2 dipotong Sgf-I, lalu dipotong I-Ppo I
pTarget-CMV-GH3B2 cutting with Sgf-I and cutting with I-Ppo I
(+) = Kontrol (+) pGEM-T yang disediakan dari kit I-Ppo I
pGEM-T (+) control provided from I-Ppo I kit
M 6,000 bp M 1 1,000 bp 250 bp 3,000 bp 2 3 (+)
Ligasi Vektor Rekombinan (pTarget-GH3B2-Sgf -I-I-Ppo I) dan Promoter βββββ-Aktin Lele Lokal Produk digesti vektor rekombinan dengan enzim
Sgf-I dan I-Ppo I selanjutnya diligasikan dengan seku-en promoter β-aktin lele lokal (pCbBA) untuk meng-hasilkan konstruksi pTarget-pCbBA-GH3B2 sebagai vektor ekspresi gen hormon pertumbuhan untuk pro-duksi ikan lele lokal transgenik. Rasio vektor rekom-binan : promoter β-aktin lele lokal yang digunakan dalam campuran reaksi ligasi tersebut sebesar 1 :3. Formula reaksi ligasi sebagai berikut: T4 DNA ligase
10x buffer sebanyak 1 μL; pTarget-GH3B2 (Sgf-I-I-Ppo
I) sebanyak 1 μL; promoter β-aktin lele lokal (pCbBA) sebanyak 3 μL; enzim T4 DNA ligase sebanyak 1 μL; dan SDW sebanyak 4 μL. Selain itu, juga digunakan rasio vektor rekombinan : promoter β-aktin lele lokal sebesar 1 :2 dalam reaksi campuran ligasi tersebut.
Tahapan selanjutnya adalah pengerjaan transfor-masi hasil ligasi di atas ke dalam sel kompeten E. coli
JM 109, dengan urutan sebagai berikut: mencampur-kan 50 μL sel kompeten dengan 10 μL setiap sampel, kemudian diinkubasikan ke dalam es curai selama 30 menit. Segera dilakukan heat shock setiap sampel pada 42oC dalam waterbath selama 90 detik, kemudian
di-inkubasi kembali dalam es curai selama lima menit. Ditambahkan larutan SOC Broth sebanyak 600 μL ke dalam setiap sampel, lalu diinkubasikan pada suhu 37oC
selama 2-3 jam dengan kecepatan 150 rpm menggu-nakan shaker incubator. Selanjutnya sampel disentrifu-gasi 14.000 rpm selama satu menit, kemudian diambil produk transforman 100 μL untuk diresuspensi (meng-gunakan mikropipet) sehingga menjadi larutan sus-pensi, kemudian di-plating ke cawan petri berisi me-dium Luria Broth (LB)-agar yang sudah disuplementa-si dengan IPTG-X gal-Ampicillin. Cawan petri tersebut dibiarkan selama 15 menit pada suhu ruang, dan se-lanjutnya diinkubasi ke dalam inkubator dengan su-hu 37oC selama satu malam (overnight). Hasil
trans-formasi tersebut disajikan dalam Gambar 13, koloni putih transforman yang mengandung sekuen kons-truksi pTarget-pCbBA-GH3B2.
Keberadaan fragmen vektor ekspresi rekombinan (pTarget-pCbBA-GH3B2 berukuran 8.383 bp) terdetek-si dari haterdetek-sil elektroforeterdetek-sis gel agarose 1% dengan uku-ran sekitar 8.000 bp yang terbentuk dari gabungan pTarget-GH3B2 (Sgf-I-I-Ppo I) berukuran 6.083 bp, pro-moter β-aktin lele lokal berukuran 1.700 bp, dan GH3B2 sebesar 600 bp (Gambar 14).
Bentuk fragmen DNA gabungan pTarget-pCbBA-GH lele dumbo (7.783 bp) (Gambar 14); supercoiled yang ditampakkan dengan dengan pita ganda DNA dan terindikasi fragmen berukuran 8.000 bp sebagai representasi konstruksi vektor pTarget-promoter β -aktin lele lokal-GH lele dumbo yang mengindikasikan
Gambar 13. Koloni transforman pembawa pTarget yang mengandung promoter β-aktin lele lokal (pCbBA) dan gen hormon pertumbuhan lele dumbo (GH3B2)
Figure 13. pTarget carrier transformant colonies con-taining β-actin promoter walking catfish (pCbBA) and African catfish growth hor-mone gene (GH3B2)
Gambar 14. Konstruksi pTarget-pCbBA-GH lele dum-bo (7.783 bp)
Figure 14. pTarget-pCbBA-African catfish GH (7,783 bp) construction
Keterangan (Note):
M = Marker DNA ladder 1 kb (Marker 1 kb DNA Ladder) 1 = Konstruksi pTarget-promoter β-aktin lele lokal betina
(rasio 1: 3)-GH lele dumbo (aliquot 1) (pTarget-β-actin pro-moter female walking fish (ratio 1 : 3)- African fish GH (ali-quot 1) construction)
2 = Konstruksi pTarget-promoter β-aktin lele lokal betina (rasio 1: 3)-GH lele dumbo (aliquot 2) (pTarget-β-actin pro-moter female walking fish (ratio 1 : 3)-African fish GH (ali-quot 2) construction) M 6,000 bp 1 1,000 bp 250 bp 3,000 bp 8,000 bp M 2 3 4 5 6 7 8 9 Koloni transforman
keberhasilan ligasi promoter β-aktin lele lokal ke dalam konstruksi pTarget-GH3B2.
KESIMPULAN DAN SARAN Kesimpulan
Berdasarkan hasil penelitian, dapat disimpulkan bahwa sekuen promoter β-aktin ikan lele lokal (C. batrachus) dapat diisolasi dengan ukuran amplikon sekitar 1.700 bp dengan elemen transkripsi CAAT box,
TATA box, GC box, motif CArG, dan TGACG. Sisipan (insert) gen hormon pertumbuhan lele dumbo dari ha-sil ligasi pTarget-CMV-GH lele dumbo dan sel kom-peten yang mengandung vektor rekombinan dapat dideteksi dengan primer GH-F dan ORF-Cg-GH-R. Konstruksi pTarget-promoter β-aktin lele lokal-GH lele dumbo berhasil dibuat.
Saran
Diperlukan deteksi keberadaan sisipan promoter
β-aktin lele lokal-GH lele dumbo dalam vektor rekom-binan pTarget yang terkandung dalam sel kompeten sebelum digunakan lebih lanjut pada pengerjaan elektroporasi vektor tersebut ke dalam sel sperma lele lokal.
DAFTAR ACUAN
Alam, M.S., Lavender, F.L., Iyengar, A., Rahman, M.A., Ayad, H.H., Lathe, R., Morley, S.D., & Maclean, N. (1996). Comparison of the activity of carp and rat
β-actin gene regulatory sequences in tilapia and rainbow trout embryos. Mol. Reprod. Dev., 45, 47-122.
Alimuddin. (2003). Introduction and expression of for-eign Δ6-desaturase-like gene in a teleostean fish. The-sis. Tokyo University of Fisheries, Japan. Alimuddin, Nugrahani, W., Aliah, R.S., Sumantadinata,
K., Faizal, I., Carman, O., & Yoshizaki, G. (2007). Isolasi dan karakterisasi promoter β-aktin dari ikan kerapu bebek (Cromileptes altivelis). Jurnal Riset Akuakultur, 2(2), 199-209.
Aranburu, A., Liberg, D., Honore, B., & Leandersen, T. (2006). CArG box-binding factor-A interacts with multiple motifs in immunoglobulin promoter and has a regulated sub cellular distribution. Eur. J. Immunol., 36, 2192-2202.
Argenton, F., Bernardini, S., Puttini, S., & Bortolessi, M. (1991). A TGACG motif mediates growth-hor-mone factor-1/pituitary-transcriptional-activator-1-dependent cAMP regulation of the rainbow trout growth hormone promoter. Eur. J. Biochem., 238, 591-598.
Chen, T.T., & Powers, D.A. (1990). Transgenic fish.
Trends Biotechnol., 8, 209-215.
Collares, T., Campos, V.F., Seixas, F.K., Cavalcanti, P.V., Dellagostin, O.A., Moreira, H.L.M., & Deschamps, J.C. (2010). Transgene transmission in South American catfish (Rhamdia quelen) larvae by sperm-mediated gene transfer. J. Biosci., 35(1), 1-9. Dewi, R.R.S.P.S., Alimuddin, Sudradjat, A.O., &
Sumantadinata, K. (2010a). Optimal electropora-tion condielectropora-tion for sperm mediated gene transfer in stripped catfish (Pangasionodon hypophthalmus).
Indonesian Aquaculture Journal, 5(1), 1-10.
Ge, J., Dong, Z., Li, J., Xu, Z., Song, W., Bao, J., Liang, D., & Li, J. (2012). Isolation of yellow catfish β -actin promoter and generation of transgenic yel-low catfish expressing enhanced yelyel-low flourescent protein. Transgenic Research, 21(5), 99-1004. Li, L., Chang, M.X., & Nie, P. (2007). Molecular
clon-ing, promoter analysis and induced expression of the complement component C9 gene in the grass carp Ctenopharyngodon idella. Veterinary Immunol-ogy and ImmunopatholImmunol-ogy, 118, 270-282.
Muller, F., Zsolt, L., Laszio, V., Lazsio, M., & Laszio, O. (1993). Efficient transient expression system based on square pulse electroporation and in vivo
luciferase assay of fertilized fish eggs. Federation of European Biochemical Societies, 324(1), 27-32. Lanjutan keterangan Gambar 14 (Figure 14 note continued):
3 = Konstruksi pTarget-promoter β-aktin lele lokal betina (rasio 1: 2)-GH lele dumbo (aliquot 1) (pTarget-β-actin pro-moter female walking fish (ratio 1 : 2)-African fish GH (ali-quot 1) construction)
4 = Konstruksi pTarget-promoter β-aktin lele lokal betina (rasio 1: 2)-GH lele dumbo (aliquot 2) (pTarget-β-actin pro-moter female walking fish (ratio 1 : 2)-African fish GH (ali-quot 2) construction)
5 = Konstruksi pTarget-promoter β-aktin lele lokal (genom hipofisa-primer pBACS-F dan pBACS-R) (rasio 1:3)-GH lele dumbo (aliquot 1) (pTarget-β-actin promoter walking fish (genomic pituitary-pBACS-F and pBACS-R primers) (ratio 1: 3)-African fish GH (aliquot 1) construction)
6 = Konstruksi pTarget-promoter β-aktin lele lokal (genom hipofisa-primer pBACS-F dan pBACS-R) (rasio 1:3)-GH lele dumbo (aliquot 2) (pTarget-β-actin promoter walking fish (genomic pituitary-pBACS-F and pBACS-R primers) (ratio 1: 3)-African fish GH (aliquot 2) construction)
7 = Konstruksi pTarget-promoter β-aktin lele lokal (genom hipofisa-primer pBACS-F dan pBACS-R) (rasio 1:2)-GH lele dumbo (aliquot 1) (pTarget-β-actin promoter walking fish (genomic pituitary-pBACS-F and pBACS-R primers) (ratio 1: 2)-African fish GH (aliquot 1) construction)
8 = Konstruksi pTarget-promoter β-aktin lele lokal (genom hipofisa-primer pBACS-F dan pBACS-R) (rasio 1:2)-GH lele dumbo (aliquot 2) (pTarget-β-actin promoter walking fish (genomic pituitary-pBACS-F and pBACS-R primers) (ratio 1: 2)-African fish GH (aliquot 2) construction)
9 = Konstruksi pTarget-kontrol insert DNA kit (pTarget-insert DNA kit control construction)
Santoro, I.M., & Walsh, K. (1991). Natural and syn-thetic DNA elements with the CArG motif differ in expression and protein-binding properties. Mo-lecular and Cellular Biology, 11(12), 6296-6305.
Sin, F.Y.T. (1997). Transgenic fish. Reviews In Fish Biol-ogy And Fisheries, 7, 417-441.