PENGARUH PEMBERIAN AROMATASE INHIBITOR MELALUI
PAKAN BUATAN TERHADAP KEBERHASILAN SEX REVERSAL
IKAN NILA MERAH Oreochromis sp.
INGGRIKA REMALIA EVANGELISTA KABAN
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
2010
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul :
PENGARUH PEMBERIAN AROMATASE INHIBITOR MELALUI PAKAN BUATAN TERHADAP KEBERHASILAN SEX REVERSAL IKAN NILA MERAH Oreochromis sp.
adalah benar merupakan karya sendiri dan belum digunakan dalam bentuk apapun kepada perguruan tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Januari 2010
INGGRIKA R. E. KABAN C.14050084
RINGKASAN
INGGRIKA REMALIA EVANGELISTA KABAN. Pengaruh Pemberian
Aromatase Inhibitor Melalui Pakan Buatan terhadap Keberhasilan Sex Reversal
Ikan Nila Merah Oreochromis sp. Dibimbing oleh ODANG CARMAN dan AGUS
OMAN SUDRAJAT.
Pengarahan kelamin ikan nila merah menjadi berjenis kelamin jantan dapat dilakukan dengan menggunakan aromatase inhibitor (AI) dosis tertentu. Penelitian ini bertujuan untuk mengkaji pengaruh aromatase inhibitor yang diberikan melalui pakan buatan terhadap populasi monoseks jantan ikan nila merah Oreochromis sp.
Penelitian dilaksanakan di Balai Budidaya Air Tawar Jambi, pada bulan Maret sampai Agustus 2009. Penelitian ini menggunakan 5 perlakuan yaitu penyemprotan pakan dengan AI dosis 1.500, 1.750, dan 2.000 mg/kg pakan, serta kontrol negatif (tanpa penyemprotan) dan positif (menggunakan 17-α
methyl testosteron). Akuarium ukuran 60x50x40 cm diisi 60 ekor larva yang diberi
perlakuan selama 5 hari setelah hari kedua kuning telur habis. Larva dipelihara selama 2 minggu di dalam akuarium dan diberi pakan buatan berupa tepung, kemudian dipindahkan ke hapa ukuran 85x85x100 cm dalam kolam berukuran 30x17x1,25 m dan dipelihara selama 6 minggu dan diberi pakan sesuai feeding
rate sebelum kemudian dicek rasio jantan betinanya. Pemberian pakan dilakukan
sebanyak 3 kali sehari.
Hasil penelitian ini menunjukkan bahwa perlakuan AI 2.000 mg/kg pakan menghasilkan persentase jantan terbesar yaitu 97,0 % bila dibandingkan dengan perlakuan AI lainnya (87,7 % untuk AI dosis 1.500 mg/kg pakan dan 93,1 % untuk AI dosis 1.750 mg/kg pakan) maupun kontrol negatifnya yang hanya menghasilkan persentase jantan sebesar 64,6 %. Nilai tersebut menunjukkan bahwa perlakuan AI dosis 2.000 mg/kg pakan menghasilkan persentase jantan yang berbeda nyata dengan kontrolnya. Dosis AI 1.500 mg/kg pakan direkomendasikan sebagai dosis paling efektif untuk menggantikan hormon 17-α
PENGARUH PEMBERIAN AROMATASE INHIBITOR MELALUI
PAKAN BUATAN TERHADAP KEBERHASILAN SEX REVERSAL
IKAN NILA MERAH Oreochromis sp.
INGGRIKA REMALIA EVANGELISTA KABAN
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan
Pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
2010
Judul : Pengaruh Pemberian Aromatase Inhibitor melalui Pakan Buatan terhadap Keberhasilan Sex Reversal Ikan Nila Merah Oreochromis sp.
Nama Mahasiswa : Inggrika R. E. Kaban Nomor Pokok : C.14050084
Program Studi : Teknologi dan Manajemen Perikanan Budidaya Departemen : Budidaya Perairan
Disetujui
Komisi Pembimbing
Dr. Odang Carman Dr. Agus Oman Sudrajat Ketua Anggota
NIP. 195912221986011001 NIP. 196408131991031001
Diketahui
Dekan Fakultas Perikanan dan Ilmu Kelautan
Prof. Dr. Ir. Indra Jaya, M.Sc. NIP. 196104101986011002
KATA PENGANTAR
Puji syukur penyusun panjatkan kepada Tuhan Yesus Kristus karena dengan penyertaan-Nya penyusun dapat menyelesaikan skripsi ini dengan baik. Skripsi ini berjudul “Pengaruh Pemberian Aromatase Inhibitor melalui Pakan Buatan Terhadap Keberhasilan Sex Reversal Ikan Nila Merah Oreochromis sp.”. Penelitian ini dilakukan di Balai Budidaya Air Tawar Jambi mulai bulan Maret sampai Agustus 2009.
Penyusun mengucapkan terima kasih kepada:
1. Bapak Dr. Odang Carman selaku pembimbing I dan Bapak Dr. Agus Oman Sudrajat selaku pembimbing II atas segala bimbingan dan waktu yang disediakan bagi penulis untuk pembuatan skripsi ini.
2. Bapak Ir. Ediwarman, M. Si dan Bapak Syofan, S. ST. Pi selaku pembimbing lapangan atas bantuan dan dukungan selama pelaksanaan penelitian.
3. Bapak Kepala Balai Budidaya Air Tawar Jambi serta seluruh staf dan karyawan atas kesempatan yang diberikan untuk melakukan penelitian di balai ini, bantuan, kerjasama, persahabatan, serta nasihat-nasihat bagi penulis.
4. Seluruh staf pengajar Departemen Budidaya Perairan atas ilmu yang telah dibagikan kepada penulis, baik yang bersifat akademik maupun non-akademik.
5. Keluargaku tercinta, Popi, Momi, Tesa “KreachKreach”, dan Virgy “Urnyauww” atas kasih sayang, kekeluargaan, persahabatan, dorongan, semangat, dukungan doa, moril serta materi.
6. Ratna Dewi, Arga Wawang Artanto, Kak Demin, teman-teman BDP 42 lainnya, serta seluruh teman-teman BDP, baik kakak kelas ataupun adik kelas, atas segala bantuan, dukungan, serta kebersamaan dan persahabatannya.
Harapan penulis, semoga nantinya tulisan ini dapat bermanfaat bagi banyak orang.
Bogor, Januari 2010
DAFTAR RIWAYAT HIDUP
Penulis merupakan anak pertama dari tiga bersaudara yang dilahirkan di Medan, 14 Juli 1987, dari ayah Jamaran Kaban dan ibu Renu I. Meliala. Pendidikan formal diselesaikan tahun 1999 di SD Methodist I Medan, kemudian di SLTP St. Thomas I Medan lulus tahun 2002, dan SMU St. Thomas I Medan lulus tahun 2005. Penulis melanjutkan pendidikan tinggi ke Institut Pertanian Bogor tahun 2005 melalui Jalur Seleksi Penerimaan Mahasiswa Baru (SPMB). Setelah satu tahun mengikuti program Tingkat Persiapan Bersama (TPB), penulis mengambil Program Studi Teknologi dan Manajemen Perikanan Budidaya di Fakultas Perikanan dan Ilmu Kelautan sebagai kuliah mayor dan sebagai kuliah minornya ialah Teknologi Penangan dan Transportasi Biota Perairan.
Selama kuliah di IPB, penulis pernah aktif dalam organisasi sebagai koordinator acara Persekutuan Fakultas Persekutuan Mahasiswa Kristen (PF PMK) 2007/2008 dan anggota tetap PMK. Penulis melaksanakan Praktek Lapangan Akuakultur di Balai Budidaya Laut (BBL) Batam pada bulan Juli - Agustus 2008. Untuk menyelesaikan studi di Fakultas Perikanan dan Ilmu Kelautan, penulis melaksanakan penelitian di Balai Budidaya Air Tawar Jambi, dan menulis skripsi yang bejudul ”Pengaruh Pemberian Aromatase Inhibitor
melalui Pakan Buatan terhadap Keberhasilan Sex Reversal Ikan Nila Merah Oreochromis sp.”.
DAFTAR ISI
Halaman DAFTAR TABEL ..………...………... x DAFTAR GAMBAR .………...…... DAFTAR LAMPIRAN …….………...………... I. PENDAHULUAN ………...………...……... xi xii 1 1.1 Latar belakang ...………...………... 1 1.2 Tujuan ..………...…... 2II. TINJAUAN PUSTAKA ....………...…………... 3
2.1 Karakteristik ikan nila merah Oreochromis sp. …………...……….... 3
2.2 Diferensiasi kelamin dan sex reversal ...………...…... 5
2.3 Aromatase dan aromatase inhibitor ... 6
III. BAHAN DAN METODE ..………...………...
8
3.1 Waktu dan tempat ………....………...…….………... 8
3.2 Alat dan bahan .………..………....………... 8
3.2.1 Wadah ...………... 8 3.2.2 Alat ....………....…... 8 3.2.3 Ikan uji ...………...……….... 8 3.2.4 Methylene blue ..………...……….... 8 3.2.5 Aromatase inhibitor ...………...……….... 9 3.2.6 Pakan buatan ...…………...…...………... 9 3.2.7 Alkohol ...…...………...……….. 9 3.3 Metode penelitian .………...…....………. 9 3.3.1 Pengadaan larva ....…...………. 9 3.3.2 Rancangan perlakuan ...………... 10 3.3.3 Prosedur perlakuan ... 10
3.3.4 Pembuatan pakan perlakuan ...……….……….
11
3.3.5 Pengamatan ...…………...……….
11
3.3.5.1 Pertumbuhan ...……...…………... 11
3.3.5.2 Tingkat kelangsungan hidup ..………...……….. 11
3.3.5.3 Rasio kelamin ...………... 12
3.3.5.4 Kualitas air ...……... 12
3.3.6 Parameter yang diuji ...………...……...………...……... 12
3.3.7 Analisis data ...………...…………... 13
IV. HASIL DAN PEMBAHASAN ………...………... 14
4.1 Hasil ... 14
4.1.1 Tingkat kelangsungan hidup ikan uji selama pemberian pakan AI ... 14
4.1.2 Persentase jantan, tingkat kelangsungan hidup, dan rasio pertumbuhan spesifik ikan nila merah Oreochromis sp. selama pemeliharaan ... 15
4.1.3 Bobot dan panjang rata-rata ikan nila merah Oreochromis sp. 16 4.1.4 Data kualitas air ... 17
4.2 Pembahasan ... 18
V. KESIMPULAN DAN SARAN ..………...………... 23
5.1 Kesimpulan ... 23
5.2 Saran ... 23
DAFTAR PUSTAKA ... 24
DAFTAR TABEL
Halaman 1.
2.
Karakteristik imidazole ... Tingkat kelangsungan hidup selama 5 hari perlakuan ...
7
14 3. Persentase jantan, tingkat kelangsungan hidup, dan laju pertumbuhan
spesifik ikan nila merah selama pemeliharaan ………...
15
4. Data kualitas air di awal dan akhir perlakuan pakan dan selamaDAFTAR GAMBAR
Halaman 1.
2.
Ikan nila merah Oreochromis sp. ………....………... Perbedaan urogenital ikan nila merah jantan dan betina ...
3 5 3. Histogram tingkat kelangsungan hidup ikan nila merah Oreochromis
sp. di akhir pemberian pakan perlakuan selama 5 hari ...……... 14 4. Histogram persentase jantan ikan nila merah Oreochromis sp. di akhir
pemeliharaan ...………...…... 15 5. Histogram tingkat kelangsungan hidup ikan nila merah Oreochromis
sp. di akhir pemeliharaan ... 16 6. Histogram SGR ikan nila merah Oreochromis sp. selama pemeliharaan 16 7. Grafik bobot tubuh ikan tiap perlakuan selama pemeliharaan ... 17 8. Grafik panjang tubuh ikan tiap perlakuan selama pemeliharaan ...
DAFTAR LAMPIRAN
Halaman
1. Tingkat kelangsungan hidup ikan nila merah Oreochromis sp. ... 27
2. Persentase jantan ikan nila merah Oreochromis sp. ………... 28
3. Specific growth rate ikan nila merah Oreochromis sp. ...………... 29
4. Bobot rata-rata ikan nila merah Oreochromis sp. ... 30 5.
6. 7. 8.
Panjang rata-rata ikan nila merah Oreochromis sp. ...
Fedding rate yang digunakan selama pemeliharaan ...
Kandungan nutrisi pakan yang digunakan ... Gambar-gambar ...
31 32 33 34
I.
PENDAHULUAN
1.1 Latar belakang
Ikan nila merah, terutama dalam bentuk fillet (potongan daging tanpa tulang), sangat digemari pasar dunia. Warna dagingnya putih bersih, kenyal, dan tebal seperti daging ikan kakap merah. Selain itu, karena merupakan hasil budidaya, pasokannya bisa diperoleh setiap saat tanpa terpengaruh musim. Data Ditjen Pengolahan dan Pemasaran Hasil Perikanan (P2HP), DKP, menunjukkan peningkatan impor nila AS dalam sepuluh tahun terakhir. Impor nila AS pada tahun 2002–2006 masing-masing: 67.200 ton, 90.200 ton, 112.900 ton, 134.900 ton, dan 158.300 ton (Enny et al., 2009) dan data FAO menyebutkan bahwa total impor Amerika Serikat pada 2007 mencapai 173.760 ton (Husen, 2009) dari berbagai negara, termasuk Indonesia. Harga ikan nila merah ini pun cukup menjanjikan bagi para eksportir. Harga 1 kg fillet nila merah di pasar Amerika bisa mencapai US$ 4,5 (Anonim, 2008). Sementara target produksi nila pada tahun 2008 ialah 233.000 ton dan 337.000 ton untuk tahun 2009, maka kebutuhan benihnya masing-masing tahun adalah 1,13 miliar dan 1,63 miliar ekor (Enny et al., 2009).
Meskipun ikan nila memiliki pertumbuhan yang relatif cepat, namun usaha budidaya ikan nila merah ini sedikit terganggu oleh keadaan matang gonad yang terlalu cepat. Hal ini dapat menyebabkan terjadinya reproduksi yang tidak dikehendaki sehingga kepadatan populasi tinggi. Kepadatan populasi yang tinggi akan menyebabkan pertumbuhan ikan nila malah terhambat (Varadaraj dan Pandian, 1990). Pada ikan ini juga terdapat fenomena sexual dimorphism dimana laju pertumbuhan ikan jantan lebih baik dibandingkan betinanya sebesar dua kali lipat (Popma dan Masser, 1999). Untuk itu dianjurkan untuk memproduksi ikan nila monoseks jantan sehingga akan lebih menguntungkan.
Untuk memproduksi ikan nila monoseks jantan digunakan teknologi maskulinisasi. Pada umumnya proses maskulinisasi ini menggunakan hormon 17
-metiltestosteron, tetapi kemudian hormon ini dilarang penggunaannya di dalam Surat Keputusan Menteri Kelautan dan Perikanan No: KEP/20/MEN/2003, karena ternyata bersifat karsinogenik dan tidak ramah lingkungan (dapat menimbulkan pencemaran karena sulit terdegradasi), maka dicari bahan alternatif lainnya yang lebih ramah lingkungan serta tidak berbahaya bagi ikan konsumsi maupun konsumennya. Contreras-Sanchez dan Fitzpatrick (2001)
menyatakan bahwa residu anabolik 17 -metiltestosteron masih tertinggal pada sedimen kolam setelah tiga bulan penggunaan pada maskulinisasi benih ikan nila. Residu ini dikhawatirkan dapat menimbulkan ekspos yang tidak diharapkan pada pekerja, ikan dan organisme lain.
Aromatase inhibitor merupakan salah satu bahan alternatif pengganti
untuk proses maskulinisasi, dimana bahan ini berfungsi menghambat kerja enzim aromatase pada proses sintesis androgen menjadi estrogen selama fase diferensiasi kelamin. Dengan penghambatan tersebut diharapkan ikan yang dihasilkan berjenis kelamin jantan semua karena estrogen yang mengarahkan proses pembentukan kelamin betina itu tidak bekerja. Aromatase inhibitor juga berfungsi untuk menghambat aktivitas enzim aromatase dalam maturasi folikel dan tingkat ovulasi sehingga dapat mencegah kematangan gonad yang terlalu cepat.
Dari penelitian sebelumnya yang dilakukan oleh Liana (2005), perlakuan
aromatase inhibitor dengan dosis 1.500 mg/kg selama 5 hari menghasilkan
persentase jantan tertinggi dibanding kontrol dan dosis lainnya (500 dan 1.000 mg/l) yaitu sebesar 78,63%. Mengacu pada penelitian tersebut, maka pada penelitian ini, perlakuan selama 5 hari terhadap ikan uji diberikan peningkatan dosis menjadi 1.500, 1.750, dan 2.000 mg/kg, dengan harapan terjadinya peningkatan persentase jantan.
1.2 Tujuan
Penelitian ini bertujuan untuk mengkaji pengaruh aromatase inhibitor yang diberikan melalui pakan buatan terhadap populasi monoseks jantan ikan nila merah Oreochromis sp.
II.
TINJAUAN PUSTAKA
2.1 Karakteristik ikan nila merah Oreochromis sp.
Ikan nila merupakan ikan yang berasal dari Sungai Nil (Mesir) dan danau-danau yang berhubungan dengan aliran sungai itu. Ikan nila merah sendiri pertama kali didatangkan pada tahun 1981 ke Indonesia dari Filipina. Menurut penelitian, ikan nila merah memiliki pertumbuhan yang lebih cepat dari nila biasa/hitam. Ikan nila banyak dibudidayakan di berbagai daerah karena kemampuan adaptasinya yang bagus di berbagai jenis air, baik air tawar, payau, maupun laut. Kelebihan lainnya ialah ikan ini tahan terhadap perubahan lingkungan, bersifat omnivora, mampu mencerna makanan secara efisien, pertumbuhannya relatif cepat, dan tahan terhadap serangan penyakit (Chapman, 1992).
Nila merah merupakan hasil persilangan antara dua spesies ikan nila yang berbeda yaitu Oreochromis niloticus dan Oreochromis mossambicus (Durant et al., 1995). Klasifikasi ikan nila merah menurut Linnaeus (1758) dalam Anonim (2009) ialah sebagai berikut:
Kingdom : Animalia Filum : Chordata Kelas : Acanthoptherygii Ordo : Perciformes Famili : Cichlidae Genus : Oreochromis Spesies : Oreochromis sp.
Ikan ini termasuk jenis ikan yang memelihara telur di dalam mulutnya atau disebut juga mouth brooders. Ikan nila merah mulai memijah pada bobot 100-150 g, sepanjang tahun, setiap 1,5 bulan sekali. Induk yang paling produktif berbobot antara 500-600 g. Setiap pemijahan, ikan nila dapat menghasilkan 300-1500 butir telur. Telur yang dikeluarkan oleh nila betina akan dibuahi nila jantan pada substrat, kemudian segera diambil oleh induk betina untuk diinkubasi 6-7 hari di dalam mulutnya. Larva akan menetas di dalam mulut induk betina dan masih memiliki kuning telur. Setelah kuning telur larva habis, larva dapat berenang keluar dari mulut induk untuk mencari makanan sendiri, tetapi larva tersebut masih lemah dan masih di dalam perlindungan induk betina, sehingga ketika ada gangguan larva akan segera diserap induk betina masuk ke dalam mulutnya lagi (Hepher and Pruginin, 1981). Lingkungan optimal untuk pemeliharaan ikan ini ialah sebagai berikut, kandungan O2 3 ppm; pH 6,5-8,5; suhu 25-28 C dengan
fluktuasi suhu harian tidak lebih dari 15 C; serta kisaran salinitas 0-10 ppt (Popma and Masser, 1999).
Untuk membedakan ikan jantan dan betina dapat dilakukan dengan memperhatikan perbedaan bentuk dan sifat kelamin sekunder ikan. Ikan jantan memiliki bentuk tubuh lonjong dengan perut pipih dan dagu kemerah-merahan, warna tubuh cenderung lebih gelap, ujung sirip punggung lebih panjang dari pangkal ekor, genitalnya berupa tonjolan memanjang dan meruncing dimana pada ujungnya terdapat satu lubang pengeluaran air seni dan sperma. Pada induk jantan yang telah matang gonad, ujung-ujung sirip punggung dan ekor tampak lebih merah tua daripada warna bagian tubuh lainnya. Sedangkan ikan nila merah betina memiliki warna tubuh yang cenderung lebih cerah, gerakan yang lebih lamban, dan genitalnya berupa tonjolan membulat (Popma dan Masser, 1999).
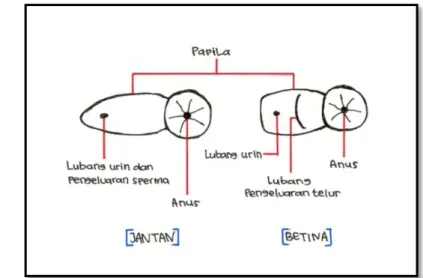
Nila dapat ditentukan jenis kelaminnya dengan mengamati genital papila yang terletak tepat di belakang anus. Pada ikan nila jantan, genital papilanya hanya memiliki satu lubang untuk pengeluaran urin dan juga sperma. Pada nila betina, telur akan keluar dari lubang yang berbeda dengan lubang pengeluaran urin. Penambahan setetes pewarna seperti methylene blue atau pewarna makanan pada daerah genital akan membantu menunjukkan papila dan bukaannya (Popma dan Masser, 1999).
Gambar 2. Perbedaan urogenital ikan nila merah jantan dan betina
2.2 Diferensiasi kelamin dan sex reversal
Jenis kelamin individu ditentukan oleh faktor genetik dan lingkungan (Silverin et al., 2000). Secara genetik, jenis kelamin ditentukan oleh kromosom yang telah terbentuk pada saat pembuahan. Proses diferensiasi kelamin merupakan proses perkembangan gonad ikan menjadi suatu jaringan yang definitif. Pada kondisi normal, individu dengan genotipe XX akan berkembang menjadi betina yang memiliki ovari, sedangkan individu dengan genotipe XY akan berkembang menjadi jantan yang memiliki testis. Tetapi dengan perlakuan menggunakan bahan-bahan tertentu, misalnya hormon, maka perkembangan gonad dengan genotipe tersebut dapat diarahkan berlawanan dengan kondisi seharusnya (Park et al., 2004). Pada kondisi ini terjadi pengarahan morfologi jenis kelamin ikan, tingkah laku, serta fungsi pada saat periode kritis dimana otak embrio yang telah terbentuk masih dalam keadaan bipotensial untuk mengarahkan jenis kelamin. Diferensiasi kelamin pada ikan nila terjadi hingga 30 hari setelah penyerapan kuning telur, atau 37 hari setelah menetas (Kwon et al., 2000).
Teknologi untuk membalikkan arah perkembangan kelamin menjadi berlawanan seperti tersebut di atas disebut dengan sex reversal. Teknik ini dilakukan pada saat dimulainya diferensiasi kelamin dan berlanjut hingga diferensiasi kelamin terjadi (Devlin, 2002). Dalam teknik ini, fenotipe ikan akan berubah, akan tetapi genotipenya akan tetap seperti semula. Teknik ini mungkin dilakukan karena pada waktu menetas, gonad ikan belum terdiferensiasi secara jelas menjadi jantan atau betina. Tujuan utama dilakukannya sex reversal ialah
untuk memperoleh populasi monoseks yang memiliki beberapa manfaat seperti pertumbuhan yang cepat, mencegah pemijahan liar, mendapatkan penampilan yang lebih baik, dan untuk menunjang genetika ikan, yaitu teknik pemurnian ras.
Salah satu bahan yang dapat digunakan untuk sex reversal ialah hormon androgen sintetik 17 -metiltestosteron yang memiliki rumus kimia C20H30O2,
berbobot molekul 302,05 (Martin, 1979). Hormon 17 -metiltestosteron telah diketahui cukup stabil dan efektif diberikan secara oral (Yamazaki, 1983). Beberapa penelitian menunjukkan bahwa pemberian hormon 17 -metiltestosteron mampu mempengaruhi perkembangan gonad beberapa ikan. Hormon ini telah terbukti mampu menghasilkan 100 % jantan pada ikan nila yang diberikan melalui pakan dengan dosis 50 mg/kg pakan serta menghasilkan 98 % ikan nila jantan yang diberikan secara oral melalui pakan dengan dosis hormon 60 mg/kg (Subagyo et al., 1992). Namun karena bersifat karsinogenik dan tidak ramah lingkungan maka perlu dicari bahan alternatif yang lain.
2.3 Aromatase dan aromatase inhibitor
Aromatase merupakan enzim kompleks Cytochrome P450 yang
bertanggungjawab pada biosintesis estrogen dan mengkonversi androgen, seperti testosteron dan antostenedione, menjadi estrogen estradiol dan estrone. Aromatase ini terdapat pada ovari, plasenta, uterus, testis, otak, dan jaringan lemak ekstraglandular (Simpson et al., 1997). Menurut Silverin et al. (2000), aktivitas aromatase terdapat di otak yang berpengaruh terhadap pengendalian tingkah laku dan terjadi pada ovari yang berpengaruh terhadap maturasi folikel dan tingkat ovulasi. Aktivitas aromatase ini tinggi pada periode kritis yang memberikan pengaruh terhadap diferensiasi kelamin.
Aromatase memegang peranan penting dalam produksi estrogen sehingga menimbulkan efek feminisasi (Smith et al., 1994). Aktivitas aromatase yang tinggi pada larva akan mengarah pada pembentukan ovari, sedangkan aktivitas aromatase yang rendah mengarah pada pembentukan testis. Selain itu peningkatan aktivitas aromatase dan sintesis estrogen selama perkembangan betina berkorelasi dengan waktu diferensiasi dari ovari (D’Cotta et al., 2001). Aromatase juga berperan dalam vitelogenesis.
Aromatase inhibitor berfungsi untuk menghambat kerja enzim aromatase
dalam sintesis estrogen, sehingga konsentrasi estrogen menurun dan mengarah pada tidak aktifnya transkripsi dari gen aromatase sebagai pengaruh umpan balik
(D’Cotta et al., 2001). Penurunan konsentrasi estrogen ini mengakibatkan perubahan penampakan hormonal dari betina menjadi menyerupai jantan (maskulinisasi) dan juga dapat menghambat vitelogenesis, sehingga mencegah pematangan gonad yang terlalu cepat.
Aromatase inhibitor menghambat aromatase dengan cara menghambat
proses transkripsi dari gen-gen aromatase yang menyebabkan tidak terbentuknya mRNA sehingga enzim aromatase menjadi tidak ada (Sever et al., 1999), atau dengan cara bersaing dengan substrat alami (testosteron) sehingga aktivitas aromatase tidak berjalan (Brodie et al., 1999).
Terdapat dua jenis aromatase inhibitor yaitu aromatase inhibitor steroid dan aromatase inhibitor non steroid. Aromatase inhibitor non steroid (imidazole) lebih efektif dalam menghambat aktivitas aromatase dibandingkan dengan
aromatase inhibitor steroid (ATD atau 4-OH-A) (Wozniac et al., 1992). Menurut
Anonim (2007), imidazole memiliki sifat biodegradable. Tabel 1. Karakteristik imidazole (Anonim 2007)
Nama Bahan Kimia Nama lain
Formula kimia Sifat fisik
Bentuk
Titik didih/titik leleh Kelarutan dalam air Toksikologi Imidazole 1,3-diaza-2,4-cyclopentadience 1,3-diazole Glyoxalin C3H4N2
Bubuk kristal berwarna putih kekuningan 256oC/89-91oC
> 10%
Non karsinogenik
Periode waktu yang paling sensitif untuk perlakuan aromatase inhibitor adalah 7-14 hari setelah menetas, tetapi masa diferensiasi ikan nila masih terjadi hingga 30 hari setelah penetasan telur (Kwon et al., 2000).
III.
BAHAN DAN METODE
3.1 Waktu dan tempat
Penelitian ini dilaksanakan pada bulan Maret sampai Agustus 2009 di Balai Budidaya Air Tawar (BBAT) Jambi.
3.2 Alat dan bahan
Alat dan bahan yang digunakan dalam pelaksanaan penelitian ini ialah sebagai berikut:
3.2.1 Wadah
Wadah yang digunakan untuk pemijahan induk adalah bak semen dengan ukuran 8x5x1 m, dan wadah untuk pemeliharaan larva uji selama pemberian AI adalah akuarium dengan ukuran 60x50x40 cm sebanyak 13 buah (2 untuk kontrol negatif, 2 untuk kontrol positif, dan masing-masing 3 akuarium untuk 3 perlakuan AI). Wadah untuk pemeliharaan ikan sampai ikan berumur 2 bulan ialah kolam dengan ukuran 30x17x1,25 m. Selain itu digunakan juga hapa dengan ukuran 85x85x100 cm sebanyak 13 buah untuk pembesaran ikan sampai mencapai ukuran yang tepat untuk bisa dilihat jenis kelaminnya secara visual.
3.2.2 Alat
Alat-alat yang digunakan selama penelitian ini adalah akuarium, sprayer, instalasi aerasi, serokan, selang sifon, sudip, sendok, nampan, botol pakan, gelas ukur, timbangan digital, ember, DO meter, pH meter, termometer, magnetic
stirrer, spektrofotometer, dan kamera digital. 3.2.3 Ikan uji
Ikan uji yang digunakan adalah ikan nila merah hasil pemijahan alami yang dipelihara mulai dari larva sampai ikan berumur 2 bulan. Ikan uji yang digunakan sebanyak 60 ekor untuk tiap perlakuan. Sedangkan induk yang dipijahkan sebanyak 60 ekor dengan perbandingan jantan berbanding betina adalah 1:3 dimana ikan betina sebanyak 45 ekor dan jantan sebanyak 15 ekor.
3.2.4 Methylene blue
Untuk mencegah larva nila merah terkena jamur, pada media pemeliharaan ditambahkan methylene blue dengan dosis 2-5 mg/l dan diaerasi kuat selama 24 jam sebelum larva dimasukkan ke dalam media tersebut. Selain itu methylene blue juga digunakan untuk membantu dan memudahkan melihat
jenis kelamin ikan nila merah uji. Dosis yang digunakan untuk keperluan ini adalah sebanyak 0,1 g/ml. Methylene blue yang digunakan berupa serbuk berwarna biru yang disimpan di dalam botol kaca di dalam lemari pendingin.
3.2.5 Aromatase inhibitor
Aromatase inhibitor yang digunakan untuk perlakuan pakan buatan
terhadap ikan uji adalah jenis imidazole yang merupakan AI jenis non steroid. Bentuk fisiknya ialah berupa serpihan bubuk berwarna putih halus. AI disimpan di dalam botol yang dimasukkan ke dalam lemari pendingin untuk menghindari kerusakan akibat terkena sinar matahari. Jumlah AI yang dibutuhkan sesuai dengan rancangan perlakuan yang ada di metode penelitian ini.
3.2.6 Pakan buatan
Pakan yang digunakan dalam perlakuan penelitian ini adalah pakan buatan berupa tepung dengan kadar protein 35%, yang diberiakan selama 2 minggu pemeliharaan di akuarium. Untuk pemeliharaan di hapa, ikan diberikan pakan pelet dengan kadar protein 30% dan ukurannya disesuaikan dengan bukaan mulut ikan sampai akhir penelitian. Pada periode 5 hari pemberian pakan AI, pakan buatan yang digunakan ialah pakan yang sesuai dengan rancangan perlakuan. Kandungan nutrisi pakan yang digunakan dapat dilihat pada Lampiran 7.
3.2.7 Alkohol
Untuk melarutkan aromatase inhibitor yang berupa padatan dibutuhkan cairan yang dapat segera kering bila disemprotkan ke pakan. Selain itu jumlah cairan tersebut harus cukup banyak untuk melarutkan bubuk AI. Untuk itu dibutuhkan alkohol 70 % sebanyak 300 ml untuk tiap kg pakan.
3.3 Metode penelitian
Adapun metode penelitian yang dilakukan pada penelitian ini ialah sebagai berikut:
3.3.1 Pengadaan larva
Larva ikan uji berasal dari hasil pemijahan secara alami induk ikan nila merah dengan perbandingan jantan dan betina 1:3 sebanyak 60 ekor. Induk nila merah yang akan dipijahkan diseleksi terlebih dahulu untuk memilih induk jantan dan betina sesuai jumlah yang diinginkan. Setelah itu induk dipindahkan dari keramba ke bak semen pemijahan induk. Induk kemudian dipelihara selama 15
hari sampai memijah, kemudian pada hari ke-15 induk nila merah dijaring dan diperiksa mulut ikan betina untuk mendapatkan larva yang masih memiliki kuning telur. Larva yang diperoleh segera dihitung dan dimasukkan ke dalam akuarium. Akuarium tersebut berisi media pemeliharaan yang telah ditambahkan methylene
blue dengan dosis sebesar 2 mg/l. Kepadatan larva dalam akuarium berukuran
60x50x40 cm adalah sebanyak 60 ekor per akuarium dengan volume air 90 liter.
3.3.2 Rancangan perlakuan
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL), yang terdiri dari tiga perlakuan dengan tiga kali ulangan. Perlakuan yang diberikan adalah perbedaan pemberian dosis aromatase inhibitor melalui pakan buatan selama 5 hari, sehari setelah kuning telurnya habis. Perlakuan yang diberikan terhadap larva ikan nila merah adalah sebagai berikut:
1) Perlakuan dengan dosis aromatase inhibitor sebanyak 0 mg/kg pakan sebagai kontrol negatif (KT)
2) Perlakuan dengan dosis aromatase inhibitor sebanyak 1.500 mg/kg pakan (AI1)
3) Perlakuan dengan dosis aromatase inhibitor sebanyak 1.750 mg/kg pakan (AI2)
4) Perlakuan dengan dosis aromatase inhibitor sebanyak 2.000 mg/kg pakan (AI3)
5) Perlakuan dengan dosis 17-metiltestosteron sebanyak 50 mg/kg pakan sebagai kontrol positf (MT)
3.3.3 Prosedur perlakuan
Larva ikan uji yang digunakan sebanyak 60 ekor tiap akuarium. Pada saat larva dikeluarkan dari mulut induk betina, larva masih memiliki kuning telur sehingga larva dibiarkan tanpa diberi pakan di dalam akuarium sampai kuning telurnya hampir habis. Setelah kuning telurnya hampir habis, larva uji diberi pakan berupa naupli artemia yang ditetaskan sebanyak 20 g siste dalam 10 liter air garam 28 ppt. Larva uji kemudian diberi pakan buatan berupa pelet tepung, sesuai dengan rancangan perlakuan, selama 5 hari dimulai pada saat larva berumur 9 hari dimana kuning telurnya habis (Tasdiq, 2005).
Pemeliharaan ikan nila merah uji dilakukan di akuarium selama 2 minggu dan diberi makan sebanyak 1 g/akuarium dengan frekuensi 3 kali sehari. Setelah periode 2 minggu di akuarium, ikan dianggap sudah cukup kuat untuk dipindahkan ke hapa, kemudian ikan dipindahkan ke hapa dan dipelihara selama
6 minggu. Pemberian pakan dilakukan rutin setiap hari dengan frekuensi 3 kali sehari sampai ikan mencapai umur 2 bulan, kecuali pada hari dimana ikan uji disampling. Ikan uji dipuasakan selama 24 jam pada hari sampling tersebut. Pemberian pakan dilakukan sesuai feeding rate selama pemeliharaan di hapa, dimana nilai feeding rate ini dapat dilihat pada Lampiran 6. Selama pemeliharaan, kualitas air dipertahankan pada kondisi optimal dan dilakukan pengecekan kualitas air yaitu DO, pH, NH3, NO2- dan suhu. Di hapa ikan
dipelihara dan diberi pakan buatan seperti biasa sampai 2 bulan sampai ikan dapat dibedakan jenis kelaminnya.
3.3.4 Pembuatan pakan perlakuan
Senyawa aromatase inhibitor dengan dosis 1.500, 1.750, dan 2.000 mg/kg pakan masing-masing dilarutkan ke dalam alkohol 70% sebanyak 300 ml.
Magnetic stirrer digunakan untuk melarutkan AI dalam cairan alkohol selama
beberapa menit sampai kedua bahan benar-benar homogen. Setelah AI sudah benar-benar larut dalam alkohol, AI dimasukkan ke dalam sprayer dan disemprotkan ke pakan yang akan digunakan untuk ikan uji, lalu diaduk hingga rata dan diangin-anginkan hingga kering.
3.3.5 Pengamatan
Parameter yang diamati adalah pertumbuhan, tingkat kelangsungan hidup, rasio kelamin, serta parameter kualitas air.
3.3.5.1 Pertumbuhan
Pertumbuhan ikan nila merah diukur dengan cara melakukan sampling setiap 14 hari sekali. Parameter yang diukur pada saat sampling ialah bobot dan panjang tubuh ikan uji. Pada awalnya ikan ditimbang secara total, kemudian diambil sebanyak 30 ekor tiap perlakuan untuk diukur bobot dan panjang tubuhnya.
3.3.5.2 Tingkat kelangsungan hidup
Tingkat kelangsungan hidup ikan dari masing-masing perlakuan diperoleh dengan cara menghitung jumlah ikan yang hidup pada akhir percobaan. Jumlah ikan yang hidup pada akhir percobaan diperoleh dengan menghitung total ikan yang tersisa di dalam hapa setelah periode pemeliharaan ikan uji selama 2 bulan berakhir.
3.3.5.3 Rasio kelamin
Pengamatan ini dilakukan dengan mengamati ciri kelamin sekunder ikan nila uji secara visual di akhir pemeliharaan. Setelah masa pemeliharaan 2 bulan, ikan dipanen dan dilihat jenis kelaminnya dengan menggunakan bantuan
methylene blue dan dihitung jumlah jantan dan betinanya.
Pemeliharaan ikan uji selama 2 bulan cukup untuk melihat jenis kelamin ikan uji namun diperlukan methylene blue untuk membantu memudahkan dalam pengamatan jenis kelamin ikan pada saat panen. Methylene blue diambil lebih kurang sebanyak 0,5 g kemudian ditambahkan air sebanyak 5 ml (0,1 g/ml). Larutan methylene blue pekat tersebut kemudian dioleskan di sepanjang daerah urogenital ikan nila uji yang dicek jenis kelaminnya. Jika setelah dioles kelihatan garis mendatar memanjang dari ujung kiri sampai ujung kanan urogenital (ikan dipegang dengan posisi kepala di atas dan ekor di bawah, posisi ventral ikan menghadap pengamat) dan bentuk papilanya membulat (seperti pada Gambar 2), maka ikan tersebut berjenis kelamin betina. Sedangkan jika setelah dioles tidak terlihat garis mendatar yang memanjang dan bentuk alat papilanya memanjang, maka ikan tersebut berjenis kelamin jantan.
3.3.5.4 Kualitas air
Parameter kualitas air yang diukur adalah DO, pH, NH3, NO2-, dan suhu,
yang dilakukan di awal dan akhir pemberian AI selama 5 hari di akuarium, serta pada saat pemeliharaan ikan uji pada hapa di kolam pemeliharaan sebanyak satu kali.
3.3.6 Parameter yang diuji
Data hasil pengamatan disajikan secara deskripsi dalam bentuk tabel dan grafik, serta dianalisis secara statistik untuk mendapatkan beda antar perlakuan. Beberapa parameter yang diuji secara statistik adalah sebagai berikut dibawah ini, sedangkan parameter pengamatan lainnya dijelaskan secara deskriptif.
1) Rasio kelamin % 100 (%) x Is Ij IJ % 100 (%) x Is Ib IB
Keterangan: IJ = Persentase ikan jantan (%) IB = Persentase ikan betina (%) Ij = Jumlah ikan jantan (ekor) Ib = Jumlah ikan betina (ekor) Is = Jumlah ikan yang diamati (ekor)
2) Tingkat kelangsungan hidup (Effendie, 1997)
% 100 (%) x No Nt SR
Keterangan: Nt = Jumlah ikan pada waktu t (ekor) No= Jumlah larva baru menetas (ekor)
3) Specific Growth Rate (Busacker et al., 1990)
%
100
1
(%)
x
Wo
Wt
SGR
t
Keterangan: Wt = Bobot rata-rata pada saat t (gr)
Wo= Bobot rata-rata pada saat tebar awal (gr) t = Lama waktu pemeliharaan
3.3.7 Analisis data
Rancangan penelitian yang digunakan adalah rancangan acak lengkap dengan 5 perlakuan. Pada tiga perlakuan AI dilakukan 3 kali ulangan pada masing-masing perlakuan, sedangkan untuk perlakuan kontrol (positif dan negatif) dilakukan sebanyak 2 kali ulangan masing-masing perlakuan. Data rasio kelamin ikan jantan, tingkat kelangsungan hidup, dan specific growth rate ikan uji dianalisa menggunakan SPSS versi 16. Jika hasilnya berbeda nyata, maka dilakukan uji lanjutan dengan menggunakan uji Duncan. Sedangkan data lainnya dianalisa secara deskriptif dan ditampilkan dalam bentuk tabel dan grafik.
IV.
HASIL DAN PEMBAHASAN
4.1 Hasil
Hasil yang diperoleh setelah melakukan penelitian ini ialah sebagai berikut:
4.1.1 Tingkat kelangsungan hidup ikan nila merah Oreochromis sp. selama pemberian pakan AI
Pemijahan induk ikan nila secara alami di kolam pemijahan menghasilkan larva dengan kualitas yang baik dan langsung diberikan penanganan yang baik sehingga mortalitasnya dapat ditekan sekecil mungkin.
Berikut ini tabel dan histogram tingkat kelangsungan hidup ikan nila merah setelah pemberian pakan perlakuan selama 5 hari dalam akuarium.
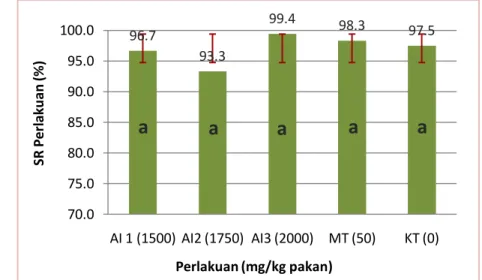
Tabel 2. Tingkat kelangsungan hidup setelah 5 hari pemberian pakan perlakuan
Perlakuan (mg/kg pakan) SR (%) AI1 (1500) 96,7 ± 2,9 a AI2 (1750) 93,3 ± 1,7 a AI3 (2000) 99,4 ± 1,0 a MT (50) 98,3 ± 2,4 a KT (0) 97,5 ± 3,5 a
Keterangan: Angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata (P>0.05); rata-rata ± St.Dev
Gambar 3. Histogram tingkat kelangsungan hidup ikan nila merah
Oreochromis sp. di akhir pemberian pakan perlakuan selama 5 hari 96.7 93.3 99.4 98.3 97.5 70.0 75.0 80.0 85.0 90.0 95.0 100.0 AI 1 (1500) AI2 (1750) AI3 (2000) MT (50) KT (0) SR P erl ak u an (% ) Perlakuan (mg/kg pakan)
a
a
a
a
a
4.1.2 Persentase jantan, tingkat kelangsungan hidup, dan laju pertumbuhan spesifik ikan nila merah Oreochromis sp. selama pemeliharaan
Nilai persentase dari ikan jantan, tingkat kelangsungan hidup, serta laju pertumbuhan spesifik selama 42 hari pemeliharaan ikan nila merah di kolam dapat dilihat pada Tabel 3 di bawah ini.
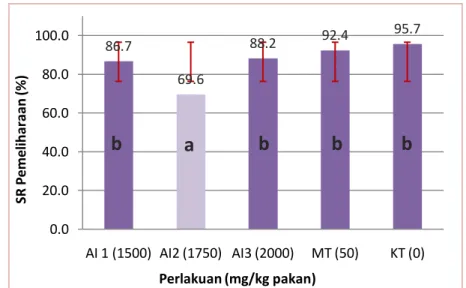
Tabel 3. Persentase jantan, tingkat kelangsungan hidup, dan laju pertumbuhan spesifik ikan nila merah selama pemeliharaan
Perlakuan (mg/kg pakan) Persentase jantan (%) SR (%) SGR (%)
AI1 (1500) 87,7 ± 5,2 b 86,7 ± 5,2 b 10,4 ± 0,3 a
AI2 (1750) 93,1 ± 3,9 b 69,6 ± 8,6 a 10,5 ± 0,3 a
AI3 (2000) 97,0 ± 2,9 b 88,2 ± 8,5 b 10,2 ± 0,2 a
MT (50) 95,5 ± 6,4 b 92,4 ± 1,0 b 10,5 ± 0,2 a
KT (0) 64,6 ± 10,8 a 95,7 ± 1,4 b 10,3 ± 0,2 a
Keterangan: Angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata (P>0.05); rata-rata ± St.Dev
Histogram persentase jantan, tingkat kelangsungan hidup, serta laju pertumbuhan spesifik ikan nila merah dapat dilihat di bawah ini.
Gambar 4. Histogram persentase jantan ikan nila merah
Oreochromis sp. di akhir pemeliharaan 87.7 93.1 97.0 95.5 64.6 0.0 20.0 40.0 60.0 80.0 100.0 AI 1 (1500) AI2 (1750) AI3 (2000) MT (50) KT (0) P e rs e n ta se Ik an Ja n ta n (% ) Perlakuan (mg/kg pakan)
b
b
b
b
a
Gambar 5. Histogram tingkat kelangsungan hidup ikan nila merah
Oreochromis sp. di akhir pemeliharaan
Gambar 6. Histogram SGR ikan nila merah Oreochromis sp. selama pemeliharaan
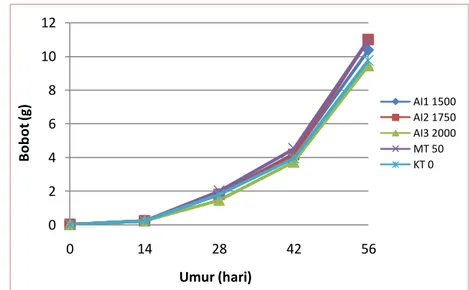
4.1.3 Bobot dan panjang tubuh ikan nila merah Oreochromis sp.
Bobot dan panjang tubuh ikan nila merah diperoleh dari sampling yang dilakukan setiap dua minggu sekali selama pemeliharaan ikan di hapa. Bobot dan panjang ikan mengalami peningkatan setiap sampling, seperti yang terlihat pada kedua grafik di bawah ini.
86.7 69.6 88.2 92.4 95.7 0.0 20.0 40.0 60.0 80.0 100.0 AI 1 (1500) AI2 (1750) AI3 (2000) MT (50) KT (0) SR P em el ih ara an (% ) Perlakuan (mg/kg pakan)
b
a
b
b
b
10.4 10.5 10.2 10.5 10.3 8.0 8.5 9.0 9.5 10.0 10.5 11.0 AI 1 (1500) AI2 (1750) AI3 (2000) MT (50) KT (0) SG R (% ) Perlakuan (mg/kg pakan)a
a
a
a
a
Gambar 7. Grafik bobot tubuh ikan tiap perlakuan selama pemeliharaan
Gambar 8. Grafik panjang tubuh ikan tiap perlakuan selama pemeliharaan
4.1.4 Data kualitas air
Uji kualitas air dilakukan terhadap media pemeliharaan ikan nila merah di akuarium pemeliharaan pada awal dan akhir pemberian pakan perlakuan. Sedangkan pada saat pemeliharaan ikan di kolam, uji kualitas air dilakukan satu kali saja. Data kualitas air dapat dilihat pada Tabel 4 di bawah.
0 2 4 6 8 10 12 0 14 28 42 56 B o b o t (g) Umur (hari) AI1 1500 AI2 1750 AI3 2000 MT 50 KT 0 3.0 4.0 5.0 6.0 7.0 8.0 9.0 10.0 28 42 56 P an ja n g (c m ) Umur (hari) AI1 1500 AI2 1750 AI3 2000 MT 50 KT 0
Tabel 4. Data kualitas air di awal dan akhir perlakuan pakan dan selama pemeliharaan
Parameter Awal pemberian
pakan perlakuan Akhir pemberian pakan perlakuan Pembesaran di kolam DO (mg/l) 4,46 4,40 4,80 pH 6,18 5,41 6,96 Amonia (mg/l) 0,02 0,64 0,52 Nitrit (mg/l) 2,00 2,00 5,00 Suhu Tmin-Tmax (ºC) 26-29 26-29 28-33
Lingkungan optimal untuk pemeliharaan ikan nila menurut Popma dan Masser (1999) adalah DO 3 ppm; pH 6,5-8,5; suhu 25-28 C dengan fluktuasi suhu harian tidak lebih dari 15 C; serta kisaran salinitas 0-10 ppt.
4.2 Pembahasan
Secara umum, selama penelitian, ikan nila merah dapat tumbuh dengan baik dan pertumbuhannya meningkat sesuai umur. Hal ini menunjukkan bahwa pakan yang diberikan dapat digunakan untuk tumbuh dan berkembang serta lingkungan pemeliharaan mendukung untuk kelangsungan hidup ikan tersebut.
Diferensiasi kelamin pada ikan nila terjadi hingga 30 hari setelah penyerapan kuning telur atau 37 hari setelah menetas, dimana periode paling sensitif untuk pengarahan jenis kelamin pada ikan ini adalah pada 7-14 hari setelah ikan menetas (Kwon et al., 2000). Di samping itu, metode pemberian, lama perlakuan, dan jenis serta dosis hormon yang digunakan juga dapat mempengaruhi keberhasilan pengarahan jenis kelamin selain jenis ikan itu sendiri.
Hormon 17-metiltestosteron telah diketahui cukup stabil dan efektif diberikan secara oral (Yamazaki, 1983). Namun karena sifatnya yang tidak ramah lingkungan maka perlu dicari bahan alternatif yang lain. Aromatase
inhibitor berfungsi untuk menghambat kerja enzim aromatase dalam sintesis
estrogen, sehingga konsentrasi estrogen menurun dan mengarah pada tidak aktifnya transkripsi dari gen aromatase sebagai pengaruh umpan balik (D’Cotta
et al., 2001). Penurunan konsentrasi estrogen ini mengakibatkan perubahan
penampakan hormonal dari betina menjadi menyerupai jantan (maskulinisasi) dan juga dapat menghambat vitelogenesis, sehingga mencegah pematangan gonad yang terlalu cepat.
Selama pemeliharaan ikan nila merah, kualitas air untuk media pemeliharaan ikan baik selama perlakuan maupun selama pembesaran masih
berada dalam kisaran yang tidak mengganggu pertumbuhan maupun tingkat kelangsungan hidup ikan nila merah. Data kualitas air yang ditampilkan pada Tabel 4 menunjukkan bahwa suhu minimal dan maksimal media pemeliharaan ikan nila merah di akuarium tidak berbeda pada saat sebelum maupun sesudah pemberian pakan AI, yaitu berkisar antara 26-29 ºC. Suhu selama pemeliharaan akuarium dapat dikatakan stabil dan masih termasuk lingkungan optimal bagi pemeliharaan ikan yaitu suhu 25-28 ºC dengan fluktuasi suhu harian tidak lebih dari 15 C (Popma and Masser, 1999). Nilai DO terukur pada akuarium pemeliharaan menurun setelah pemberian pakan AI. Hal ini disebabkan karena sebelum pemberian pakan, larva tidak melakukan aktivitas makan karena masih memiliki kuning telur, sedangkan pada saat pemberian pakan metabolismenya meningkat sehingga membutuhkan lebih banyak oksigen. Namun nilai DO terendah selama pemeliharaan (4,4 mg/l) masih merupakan lingkungan optimal bagi pemeliharaan ikan nila merah menurut Popma dan Masser (1999) yaitu ≥ 3,0 mg/l. Nilai pH media pemeliharaan pada akhir perlakuan pakan sedikit lebih rendah dari pH optimum pemeliharaan ikan nila menurut Popma dan Masser (1999) yaitu sebesar 5,41, namun nilai pH masih berada dalam batas toleransi ikan nila merah (pH 5-9) menurut Popma dan Masser (1999). Nilai nitrit selama pemeliharaan (2-5 mg/l) berada dalam batas toleransi ikan nila merah terhadap nitrit di perairan (Popma dan Masser, 1999), yaitu < 27 mg/l. Dari nilai SR pada Tabel 1 juga dapat disimpulkan bahwa nilai amonia dan nitrit terukur masih dapat ditolerir oleh ikan.
Grafik bobot (Gambar 7) dan panjang (Gambar 8) tubuh ikan menunjukkan pola yang hampir sama pada tiap perlakuan, dimana terjadi peningkatan bobot dan panjang tubuh setiap sampling. Uji anova untuk bobot (Lampiran 4) dan panjang tubuh ikan nila merah (Lampiran 5) menunjukkan nilai P>0,05 yang berarti bahwa bobot dan panjang antar perlakuan tidak berbeda nyata. Data laju pertumbuhan spesifik (SGR) yang ditunjukkan pada Tabel 2 juga memperlihatkan pola yang hampir serupa di tiap perlakuan. Laju pertumbuhan spesifik antar tiap perlakuan tidak berbeda nyata, sehingga dapat dikatakan bahwa perlakuan AI dalam penelitian ini tidak mempengaruhi laju pertumbuhan spesifik ikan nila merah. Popma dan Masser (1999) menyebutkan bahwa laju pertumbuhan ikan jantan lebih baik dibandingkan betinanya sebesar dua kali lipat. Tetapi data laju pertumbuhan spesifik pada penelitian ini menunjukkan tidak adanya perbedaan nyata antar perlakuan yang satu dengan yang lain. Hal ini
diduga karena waktu pemeliharaannya yang terlalu singkat sehingga perbedaan pertumbuhannya belum terekspresikan. Menurut penelitian yang dilakukan di Universitas Wageningen terhadap pertumbuhan ikan nila (Rutten, 2005), perbedaan laju pertumbuhan antara ikan jantan dan betina ini baru terlihat setelah jangka waktu pemeliharaan 150 hari. Ikan nila merah pada penelitian ini hanya dipelihara selama 56 hari karena memang tujuan penelitian ini tidak sampai melihat laju pertumbuhan ikan uji. Tujuan utama penelitian ini ialah melihat persentase ikan jantan, dimana dalam waktu 56 hari parameter tersebut sudah dapat diamati dengan bantuan methylene blue. Baik bobot, panjang tubuh, maupun laju pertumbuhan spesifik ikan nila perlakuan AI tidak berbeda nyata dengan kontrol positifnya, yaitu perlakuan hormon metil testosteron. Hal ini menunjukkan bahwa pemberian pakan perlakuan AI layak direkomendasikan sebagai pengganti MT yang bersifat karsinogenik karena berdasarkan data pada penelitian ini, perlakuan AI tersebut tidak menghambat laju pertumbuhan ikan nila merah.
Setelah pemberian pakan masing-masing perlakuan selama 5 hari berakhir, diperoleh nilai tingkat kelangsungan hidup ikan (Tabel 2) perlakuan AI1 tidak berbeda nyata dengan perlakuan AI2; AI3; MT dan KT. Dari nilai yang terlihat di Tabel 2 dapat dilihat bahwa perlakuan dengan dosis-dosis AI yang diberikan pada penelitian ini tidak mempengaruhi tingkat kelangsungan hidup ikan nila merah selama masa pemberian pakan perlakuan dimana nilai tingkat kelangsungan hidup berkisar di atas 93,3 % dan tidak berbeda nyata antara perlakuan yang satu dengan yang lainnya. Sedangkan pada Tabel 3 dapat dilihat bahwa nilai tingkat kelangsungan hidup perlakuan AI2 berbeda nyata dengan perlakuan lainnya. Selama pemeliharaan tidak ditemukan penyakit pada ikan dengan perlakuan AI2 maupun ikan dengan perlakuan lainnya, sehingga tidak dapat diketahui dengan pasti mengapa perlakuan AI2 memiliki nilai SR yang berbeda dengan perlakuan AI lainnya. Tetapi nilai tersebut tidak menunjukkan adanya korelasi antara nilai tingkat kelangsungan hidup dengan toksisitas yang mungkin ditimbulkan oleh peningkatan dosis AI. Kesimpulan ini diperoleh dengan melihat pola nilai sintasan pada tiap perlakuan dimana jika peningkatan dosis AI menyebabkan racun, maka seharusnya nilai tingkat kelangsungan hidup memiliki nilai yang semakin menurun seiring peningkatan dosis AI perlakuan. Dari nilai tingkat kelangsungan hidup pada Tabel 3 dapat disimpulkan bahwa selama pemeliharaan, baik manajemen lingkungan maupun pakan bisa dikatakan baik
sehingga tidak memberikan pengaruh terhadap tingkat kelangsungan hidup ikan nila merah karena nilai di Tabel 3 tersebut menunjukkan SR yang bernilai di atas 69,6 %.
Secara umum, hasil penelitian ini menunjukkan bahwa di tiap perlakuan AI yang diberikan kepada ikan nila merah, persentase rata-rata ikan jantan lebih besar daripada persentase ikan jantan perlakuan kontrol negatif (KT). Selain itu peningkatan dosis aromatase inhibitor dalam pakan mampu meningkatkan persentase ikan nila merah jantan. Perlakuan AI yang diberikan kepada ikan nila merah dapat meningkatkan persentase jantan dibandingkan dengan ikan yang tidak diberikan perlakuan (KT).
Persentase jantan tertinggi terlihat pada perlakuan AI3 yaitu sebesar 97,0 ± 2,9 % dan tidak berbeda nyata dengan persentase rata-rata jantan pada perlakuan MT; AI2; dan AI1 yaitu sebesar 95,5 ± 6,4 %; 93,1 ± 3,9 %; dan 87,7 ± 5,2 % secara bertutur-turut. Sedangkan persentase jantan terkecil terdapat pada perlakuan KT yaitu sebesar 64,6 ± 10,8 %. Persentase jantan perlakuan AI1, AI2, AI3, dan MT berbeda nyata dengan perlakuan KT. Hal ini sesuai dengan pernyataan D’Cotta et al. (2001), bahwa aromatase inhibitor berfungsi untuk menghambat kerja enzim aromatase dalam sintesis estrogen, sehingga konsentrasi estrogen menurun dan mengarah pada tidak aktifnya transkripsi dari gen aromatase sebagai pengaruh umpan balik. Aromatase yang merupakan enzim yang berperan dalam bioseintesis estrogen dihambat kerjanya dengan pemberian aromatase inhibitor dosis tertentu sehingga konsentrasi estrogen menurun dan menyebabkan transkripsi gen aromatase tidak aktif. Tidak aktifnya transkripsi gen aromatase ini menyebabkan penampakan ikan nila menjadi jantan (perubahan fenotipik). Proses ini tidak menyebabkan perubahan genotip, sehingga apabila ikan yang pada mulanya sudah memiliki gen XX, maka gennya tetap XX, meskipun demikian ikan tersebut akan memproduksi sperma. Perlakuan AI dengan dosis tersebut di atas dapat meningkatkan persentase jantan ikan nila merah bila dibandingkan dengan ikan nila merah pada perlakuan KT yang tidak diberikan pakan yang mengandung AI dosis tertentu. Pada penelitian sebelumnya, yang merupakan acuan penentuan dosis bagi penelitian ini, diperoleh hasil terbaik yaitu sebesar 78,63% jantan dengan pemberian dosis AI yang tertinggi, yaitu sebesar 1.500 mg/kg pakan (Liana, 2005). Pada penelitian ini, perlakuan selama 5 hari terhadap ikan uji diberikan peningkatan dosis menjadi 1.500, 1.750, dan 2.000 mg/kg, dengan harapan terjadinya
peningkatan persentase jantan. Dapat dilihat pada Tabel 3, dosis terendah pada penelitian ini (1500 mg/kg pakan) menghasilkan persentase jantan ikan nila sebesar 87,7%. Nilai tersebut 9,07% lebih tinggi dari penelitian sebelumnya, dengan dosis dan lama waktu perlakuan yang sama. Hal ini dikarenakan terdapatnya perbedaan lokasi penelitian antara penelitian ini dan penelitian sebelumnya. Penelitian sebelumnya dilakukan di BBAT Sukabumi, sedangkan penelitian ini dilakukan di BBAT Jambi. Perbedaan lokasi ini menyebabkan perbedaan suhu, dimana suhu di Jambi (26-33 °C) lebih tinggi daripada suhu di Sukabumi (26,5-28,5 °C). Menurut D’Cotta et al. (2001), faktor lingkungan seperti suhu juga ikut mempengaruhi proses diferensiasi kelamin, dimana suhu tinggi dapat meningkatkan persentase ikan jantan.
Perlakuan dengan dosis AI 1.500, 1.750, dan 2.000 mg/kg pakan pada penelitian ini mampu menghasilkan persentase rata-rata jantan yang tidak berbeda dengan kontrol positifnya (perlakuan MT). Oleh karena itu dapat dikatakan AI merupakan alternatif yang cocok sebagai pengganti MT dalam usaha produksi populasi monoseks jantan ikan nila merah. Dosis AI 1.500 mg/kg pakan merupakan dosis yang paling efektif untuk menggantikan MT, karena dari segi ekonomi, semakin kecil dosis yang dipakai, maka biaya yang dikeluarkan semakin kecil. Produk hasil sex reversal dengan menggunakan aromatase
inhibitor pada penelitian ini disarankan dijual sebagai bibit yang jika dipelihara
lebih lama lagi akan menunjukkan nilai laju pertumbuhan spesifik yang signifikan, sesuai penelitian Rutten (2005). Jika akan melakukan penelitian serupa, untuk memperoleh hasil pertumbuhan yang berbeda nyata, maka disarankan sebaiknya dilakukan penambahan waktu pemeliharaan ikan nila sampai minimal 150 hari.
V.
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Aromatase inhibitor dapat digunakan sebagai pengganti hormon 17 -metiltestosteron untuk produksi populasi monoseks jantan ikan nila merah, dimana pemberian aromatase inhibitor ke dalam pakan buatan dengan dosis 1.500 mg/kg pakan selama 5 hari, yang dimulai pada saat larva berumur 9 hari meningkatkan persentase jantan sebesar 23,1 % dibandingkan populasi normal dan tidak berbeda nyata dengan pemberian hormon 17-metiltestosteron.
5.2 Saran
Pemberian aromatase inhibitor ke dalam pakan buatan dengan dosis 1.500 mg/kg pakan selama 5 hari, yang dimulai pada saat larva berumur 9 hari, merupakan dosis yang efektif untuk memproduksi populasi monoseks jantan ikan nila merah.
DAFTAR PUSTAKA
Anonim. 2007. Safety data for imidazole. http://msds.chem.ox.ac.uk/IM/imidazole.html [8 Desember 2009]
Anonim. 2008. Nila Merah, Semakin Bergairah. http://www.trobos.com/show_article.php?rid=4&aid=886 [15 Februari 2009]
Anonim. 2009. Oreochromis. http://en.wikipedia.org/wiki/Oreochromis [10 Januari 2010]
Brodie A, Q. Lu, and B. Long. 1999. Aromatase and its Inhibitors. Journal of Steroid Biochemistry and Molecular Biology 69 (1999) 205±210
Busacker G. P., I. R. Adelman, and E. M. Goolish. 1990. Growth. Di dalam: Schreck C. B., Moyle P. B. (editors). Methods for Fish Biology. American Fisheries Society.
Chapman F. A. 1992. Culture of Hybrid Tilapia: A Reference Profile. Circular 1051. University of Florida. IFAS Extension.
Contreras-Sanchez W. M. and M. S. Fitzpatrick. 2001. Fate of Methyltestosterone in the Pond Environment: Impact of MT-Contaminated Soil on Tilapia Sex Differentiation. Ninth Work Plan, Effluents and Pollution Research 2C (9ER2C) Final Report.
D’Cotta H., A. Fostier, Y. Guiguen, M. Govoroun, and J.F. Baroiller. 2001. Aromatase Plays a Key Role During Normal and Temperature-Induced Sex Differentiation of Tilapia Oreochromis niloticus. Molecular
Reproduction and Development 59:265 ± 276.
Devlin R. H. and Yoshitaka N. 2002. Sex determination and sex differentiation in fish: an overview of genetic, physiological, and environmental influences. Aquaculture 208 (2002) 191–364.
Durant G. M., Maskur, and S. Hanif. 1995. Genetic Improvement of Red Tilapia Assessing the Potensial for Producing YY Male. Balai Budidaya Air Tawar, Direktorat Jenderal Perikanan, Departemen Pertanian, 17 hal. Effendie I. 1997. Biologi Perikanan. Yogyakarta: Pustaka Nusantara.
Enny P.T dan Dadang W.L. 2009. Dicari Benih Sebar Nila UNggul. http://agrina-online.com/redesign2.php?rid=7&aid=1998 [10 Desember 2009]
Hepher B. and Y. Pruginin. 1981. Commercial Fish Farming. New York: John Wiley and Sons.
Husen M. 2009. Jabar “Provinsi Tilapia” Termaju. http://cetak.kompas.com/read/xml/2009/11/06/15212961/.jabar.provinsi.til apia.termaju [10 Desember 2009]
Kwon Y. J., Haghpanah V., Kongson-Hurtado M. L., Mc Andrew J. B., and Penman J. D. 2000. Masculinization of genetic female nile tilapia (Oreochromis niloticus) by dietary administration of an aromatase inhibitor during sexual differentiation. The Journal of Experimental Zoology.
Liana Y. P. 2005. Efektifitas Aromatase Inhibitor yang Diberikan Melalui Pakan Buatan Terhadap Sex Reversal Ikan Nila Merah Oreochromis sp. Skripsi.
Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Martin C. R. 1979. Textbook of Endocrine Physiology. Oxford University Press. New York. P.228-267
Mubinun, M. Jannah, I. Minarti, B. Handoyo, dan M. Takano. 2007. Manual Produksi Induk Ikan Nila BBAT Jambi, Dirjen Budidaya, DKP dan Japan International Cooperation Agency.
Park I. S., J. H. Kim, S. H. Cho, and D. S. Kim. 2004. Sex differentiation and hormonal sex reversal in the bagrid catfish Pseudobagrus fulvidraco (Richardson). Aquaculture 232 (2004) 183-193.
Popma T. J. and Masser M. 1999. Tilapia: Life History and Biology. SRAC Publ. no. 283 4 p.
Rutten M. J. M. 2005. Breeding for improved production of Tilapia. Doctoral thesis University Wageningen.
Silverin B., M. Baillien, A. Foidart, and J. Balthazart. 2000. Distribution of Aromatase Activity in the Brain and Peripheral Tissues of Passerine and Nonpasserine Avian Species. General and Comparative Endocrinology 117, 34–53.
Simpson E. R., Mahendroo M. S., Means G. D., Hinshelhood M. W., and Michell M. D. 1997. Aromatase cytochrome P-450, the enzym responsible for biosynthetic esterogen. Endocr. Rev., 15: 342-355
Smith C. A., P. K. Elf, Lang, J. W., and J. M. P. Joss. 1994. Aromatase Enzyme Activity During Gonadal Sexual Differentiation in Alligator Embryos. Differentiation 58: 281-290
Subagyo S., Asih D., Idris, dan Jangkaru Z. 1992. Pengujian hormon dalam tablet pada pengalihan kelamin ikan nila Oreochromis niloticus Bull. Penel. Perik. Darat II no 2: 65-71
Tasdiq M. 2005. Pengaruh Pemberian Aromatase Inhibitor melalui Artemia
Artemia sp. terhadap Keberhasilan Sex Reversal pada Ikan Nila Merah Oreochromis sp. Skripsi. Departemen Budidaya Perairan. Fakultas
Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Varadaraj K. and T. J. Pandian. 1990. Production of All Female Sterile Triploid
Oreochromis mossambicus. Aquaculture 84: 117-123
Wozniac, A. S. D. Holman, and J. B. Hutchison. 1992. In Vitro Potency and Selectivity of The non Steroidal Androgen Aromatase Inhibitor CGS 16949A Compared to Steroidal Inhibitors in The Brain. J. Steroid Biochem. Mol. Biol. 43: 281-287
Yamazaki F. 1983. Sex Control and Manipulation in Fish. Aquaculture, 33:329-354
Lampiran 1. Tingkat kelangsungan hidup ikan nila merah Oreochromis sp.
Setelah pemberian pakan AI
Ulangan SR (%)
AI1 AI2 AI3 MT KT
I 95,0 93,3 98,3 100,0 100,0
II 95,0 95,0 100,0 96,7 95,0
III 100,0 91,7 100,0
Mean 96,7 93,3 99,4 98,3 97,5
StDev 2,9 1,7 1,0 2,4 3,5
Anova tingkat kelangsungan hidup setelah perlakuan
SK JK DB KT Fhit P Ftab
Perlakuan 62,57123 4 15,64281 2,970414 0,088881 3,837853
Galat 42,12963 8 5,266204
Total 104,7009 12
Selama pemeliharaan di kolam
Ulangan SR (%)
AI1 AI2 AI3 MT KT
I 80,7 76,8 79,7 91,7 96,7
II 89,5 71,9 88,3 93,1 94,7
III 90,0 60,0 96,7
Mean 86,7 69,6 88,2 92,4 95,7
StDev 5,2 8,6 8,5 1,0 1,4
Anova tingkat kelangsungan hidup selama pemeliharaan
SK JK DB KT Fhit P Ftab
Perlakuan 1090,539 4 272,6348 6,208769 0,014185 3,837853
Galat 351,2901 8 43,91126
Total 1441,829 12
Uji Duncan SR selama pemeliharaan di kolam
Perlakuan N Pasangan untuk α = 0,05
1 2 AI 1750 mg/kg 3 69,5667 AI 1500 mg/kg 3 86,7333 AI 2000 mg/kg 3 88,2333 MT 50 mg/kg 2 92,4000 AI 0 mg/kg 2 95,7000 Sig. 1,000 ,193
Lampiran 2. Persentase jantan ikan nila merah Oreochromis sp.
Ulangan Persentase Jantan (%)
AI1 AI2 AI3 MT KT
I 93,5 90,7 100,0 90,9 56,9
II 86,3 97,6 94,3 100,0 72,2
III 83,3 90,9 96,6
Mean 87,7 93,1 97,0 95,5 64,6
StDev 5,2 3,9 2,9 6,4 10,8
Anova persentase jantan
SK JK DB KT Fhit P Ftab
Perlakuan 1521,606 4 380,4015 11,70517 0,002003 3,837853
Galat 259,9888 8 32,4986
Total 1781,595 12
Uji Duncan persentase jantan
Perlakuan N Pasangan untuk α = 0,05
1 2 AI 0 mg/kg 2 64,5500 AI 1500 mg/kg 3 87,7000 AI 1750 mg/kg 3 93,0667 MT 50 mg/kg 2 95,4500 AI 2000 mg/kg 3 96,9667 Sig. 1,000 ,127
Lampiran 3. Specific growth rate ikan nila merah Oreochromis sp.
Ulangan SGR (%)
AI1 AI2 AI3 MT KT
I 10,7 10,6 10,2 10,4 10,4
II 10,4 10,8 10,1 10,7 10,2
III 10,2 10,3 10,4
Mean 10,4 10,5 10,2 10,5 10,3
StDev 0,3 0,3 0,2 0,2 0,2
Anova specific growth rate
SK JK DB KT Fhit P Ftab
Perlakuan 0,182607 4 0,045652 0,902846 0,505665 3,837853
Galat 0,404514 8 0,050564
Lampiran 4. Bobot rata-rata ikan nila merah Oreochromis sp.
Ulangan Bobot rata-rata (g)
AI1 AI2 AI3 MT KT
I 11,9 11,3 9,1 10,1 10,3
II 10,1 12,2 8,9 11,9 9,2
III 9,1 9,5 10,4
Mean 10,4 11,0 9,5 11,0 9,8
StDev 1,41 1,42 0,80 1,26 0,77
Anova bobot rata-rata
SK JK DB KT Fhit P Ftab
Perlakuan 5,124675 4 1,281169 0,894831 0,50955 3,837853
Galat 11,45395 8 1,431744
Lampiran 5. Panjang rata-rata ikan nila merah Oreochromis sp.
Ulangan Panjang rata-rata (cm)
AI1 AI2 AI3 MT KT
I 8,9 8,7 8,4 8,6 8,1
II 8,8 9,1 8,3 9,0 8,2
III 8,6 8,1 8,7
Mean 8,8 8,6 8,5 8,8 8,2
StDev 0,15 0,50 0,21 0,28 0,07
Anova panjang rata-rata
SK JK DB KT Fhit P Ftab
Perlakuan 0,618077 4 0,154519 1,70504 0,241205 3,837853
Galat 0,725 8 0,090625
Lampiran 6. Fedding rate yang digunakan selama pemeliharaan (Mubinun et al.,
2007)
Ukuran ikan Persentase pakan (%)
Dibawah 0,5 g 25,5 0,5-1,0 g 17,0 1,0-2,0 g 13,6 2,0-5,0 g 10,7 5,0-10,0 g 9,1 10-20 g 7,3 20-30 g 6,9 30-40 g 6,0 40-50 g 5,7 50-100 g 4,0 100-150 g 3,1 150-300 g 2,7 300-450 g 1,9 450-600 g 1,4 600-800 g 1,1 >800 g 0,8
Lampiran 7. Kandungan nutrisi pakan yang digunakan
Pakan tepung
Pakan pelet
Kandungan nutrisi Persentase (%)
Lemak 6
Abu 13
Protein 40
Air 11
Serat kasar 3
Kandungan nutrisi Persentase (%)
Lemak 7,13
Abu 10,5
Protein 28,29
Lampiran 8. Gambar-gambar
Akuarium pemeliharaan Bak pemijahan induk
Induk ikan nila Imidazole
Pakan buatan tepung Pakan perlakuan
Seleksi induk Penjaringan induk untuk memperoleh larva yang masih memiliki kuning telur