PENGARUH PEMBERIAN AROMATASE INHIBITOR
MELALUI PERENDAMAN LARVA TERHADAP
KEBERHASILAN SEX REVERSAL DAN PERTUMBUHAN
IKAN NILA MERAH Oreochromis sp.
ARGA WAWANG ARTANTO
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR 2010
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa Skripsi yang berjudul :
PENGARUH PEMBERIAN AROMATASE INHIBITOR MELALUI PERENDAMAN LARVA TERHADAP KEBERHASILAN SEX REVERSAL DAN PERTUMBUHAN IKAN NILA MERAH Oreochromis sp.
adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari hasil karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Skripsi ini.
Bogor, Januari 2010
ARGA WAWANG ARTANTO C14050523
RINGKASAN
ARGA WAWANG ARTANTO. Pengaruh Pemberian Aromatase Inhibitor melalui Perendaman Larva terhadap Keberhasilan Sex Reversal dan Pertumbuhan Ikan Nila Merah Oreochromis sp.. Dibimbing oleh Dr. AGUS OMAN SUDRAJAT dan PROF. Dr. KOMAR SUMANTADINATA.
Ikan nila jantan tumbuh dua kali lebih cepat dibandingkan dengan betina. Sehingga budidaya ikan nila dengan tunggal kelamin jantan (monoseks) akan lebih menguntungkan. Cara umum untuk memperoleh ikan nila monoseks jantan adalah melalui sex reversal dengan hormon 17α-metiltestosteron. Pada saat ini penggunaan hormon sintetik tersebut telah dilarang. Oleh karena itu perlu dicari alternatif lain untuk menghasilkan keturunan jantan melalui sex reversal pada ikan, khususnya ikan nila merah. Salah satu bahan alternatif yang mulai diteliti adalah aromatase inhibitor (AI). Penelitian ini bertujuan untuk mengkaji pengaruh AI jenis imidazole dalam sex reversal dengan dosis yang berbeda terhadap nisbah kelamin dan pertumbuhan ikan nila merah melalui perendaman larva umur 1 hari setelah menetas pada pemeliharaan di dalam hapa.
Penelitian dilaksanakan di Balai Budidaya Air Tawar Jambi, pada bulan April sampai Agustus 2009. Penelitian ini menggunakan 3 perlakuan AI dan 2 perlakuan kontrol yaitu perendaman AI pada larva berumur 1 hari dengan dosis 0 mg/l (kontrol negatif), 25 mg/l, 50 mg/l, 75 mg/l dan MT 5 mg/l (kontrol positif). 110 ekor larva dimasukan ke dalam akuarium perlakuan yang berisi larutan AI dan MT sesuai dosis perlakuan selama 24 jam lalu dipelihara dalam akuarium pemeliharaan selama 13 hari. Setelah itu dipindahkan ke dalam hapa sampai umur 2,5 bulan di kolam pemeliharaan
Hasil penelitian menunjukkan bahwa perendaman larva yang berumur 1 hari setelah menetas dengan larutan AI 25 mg/l, 50 mg/l, dan 75 mg/l menghasilkan ikan jantan lebih banyak dibandingkan dengan AI 0 mg/l (kontrol negatif). Tidak ada perbedaan yang signifikan antara perlakuan AI 25 mg/l, 50 mg/l, 75 mg/l, dan kontrol positif (MT), namun berbeda signifikan terhadap AI 0 mg/l (kontrol negatif) (P>0,05). Derajat kelangsungan hidup pada akhir perlakuan menunjukkan hasil yang sangat baik yaitu lebih dari 98 %. Hasil analisis menunjukkan bahwa tidak ada perbedaan yang signifikan antara semua perlakuan dan kontrol (P>0,05). Hal ini terbukti bahwa AI dan hormon MT yang diberikan melalui perendaman tidak memberikan pengaruh terhadap derajat kelangsungan hidup ikan. Banyaknya jumlah individu benih yang berkelamin jantan yang mempunyai laju pertumbuhan lebih cepat pada populasi benih yang mendapat perlakuan AI 25 mg/l, 50 mg/l, 75 mg/l, dan MT 5 mg/l (kontrol positif) menyebabkan bobot rata-rata akhir individu pada populasi ini lebih tinggi bila dibandingkan dengan populasi AI 0 mg/l (kontrol negatif) yang mempunyai individu berkelamin jantan lebih sedikit.
Pemberian AI jenis imidazole dengan dosis 25 mg/l, 50 mg/l, dan 75 mg/l meningkatkan persentase jenis kelamin jantan ikan nila merah antara 95,53% - 96,88% dan meningkatkan pertumbuhan antara 39,44 - 42,05 gram. AI efektif digunakan dalam sex reversal ikan nila merah dan sama efektifnya dengan metiltestosteron. AI jenis imidazole digunakan sebagai pengganti hormon 17α-metiltestosteron dengan dosis 25 ppm dalam maskulinisasi ikan nila merah.
PENGARUH PEMBERIAN AROMATASE INHIBITOR
MELALUI PERENDAMAN LARVA TERHADAP
KEBERHASILAN SEX REVERSAL DAN PERTUMBUHAN
IKAN NILA MERAH Oreochromis sp.
ARGA WAWANG ARTANTO
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR 2010
LEMBAR PENGESAHAAN
Judul : Pengaruh Pemberian Aromatase Inhibitor melalui Perendaman Larva terhadap Keberhasilan Sex Reversal dan Pertumbuhan Ikan Nila Merah Oreochromis sp.
Nama : Arga Wawang Artanto NRP : C14050523
Program Studi : Teknologi dan Manajemen Perikanan Budidaya Departemen : Budidaya Perairan
Disetujui Komisi Pembimbing
Pembimbing I Pembimbing II
Dr. Ir. Agus Oman Sudrajat, M.Sc Prof. Dr. Ir. Komar Sumantadinata, M.Sc NIP 196408131991031001 NIP 194507191969021001
Diketahui
Dekan Fakultas Perikanan dan Ilmu Kelautan
Prof. Dr. Ir. Indra Jaya, M.Sc NIP 196104101986011002
KATA PENGANTAR
Segala puji dan syukur bagi Allah yang telah memberikan rahmat-Nya sehingga terselesaikanlah laporan penelitian yang berjudul “Pengaruh Pemberian Aromatase Inhibitor melalui Perendaman Larva terhadap Keberhasilan Sex Reversal dan Pertumbuhan Ikan Nila Merah Oreochromis sp.”. Penulis mengucapkan terima kasih kepada:
1. Orang tua dan keluarga yang telah mendoakan serta segala dukungan dan dorongan baik materiil dan non materiil.
2. Bapak Dr. Ir. Agus Oman Sudrajat, M.Sc dan Prof. Dr. Ir. Komar Sumantadinata, M.Sc masing-masing sebagai Pembimbing Skripsi I dan II.
3. Bapak Ir. Supriyadi, M.Si selaku Kepala Balai Budidaya Air Tawar Jambi yang telah mengijinkan saya untuk melakukan penelitian di tempat tersebut.
4. Bapak Ir. Ediwarman, M.Si dan Syofan, S.St.Pi masing-masing selaku Pembimbing Laboratorium dan Lapangan.
5. Ketua Departemen Budidaya Perairan dan Program Studi Teknologi dan Manajemen Perikanan Budidaya.
6. Lesty Phytaloka yang selalu memberikan semangat kepada saya.
7. Anggota Laboratorium Nutrisi, Kesehatan, dan Lingkungan BBAT Jambi. 8. Mas Bobby, Mbak E, dan Mbak Tut yang banyak membantu saya di Jambi 9. Ratna Dewi, Inggrika R. E. Kaban, dan teman-teman yang bersama saya
melakukan penelitian di BBAT Jambi.
10. Dedi Anwar Sipayung yang telah bersedia menyediakan tempat tinggal untuk saya selama penyusunan skripsi.
11. BDP 42, rekan mahasiswa dan semua pihak lainnya yang telah banyak membantu penulis dalam menyelasaikan laporan penelitian ini.
Semoga penelitian ini dapat bermanfaat dan membawa kebaikan bagi kita semua.
Bogor, Januari 2010
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan di Kediri tanggal 14 Agustus 1988 dari ayah Wasista Sardjana dan ibu Ariani Boru Gultom. Penulis merupakan anak pertama dari dua bersaudara.
Pendidikan dasar diselesaikan pada tahun 1999 di SDS Hang Tuah IV Cipulir, Kebayoran Lama. Pendidikan lanjutan menengah pertama diselesaikan pada tahun 2002 di SMP Negeri 161 Peninggaran Jakarta dan pendidikan lanjutan menengah atas diselesaikan pada tahun 2005 di SMA Negeri 47 Tanah Kusir Jakarta. Penulis diterima sebagai mahasiswa pada Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor melalui jalur Undangan Saringan Masuk IPB (USMI) pada tahun 2005.
Selama mengikuti perkuliahan, penulis pernah menjadi anggota BEM FPIK, HIMAKUA, dan mengikuti magang di PT. Birulaut Khatulistiwa Lampung. Penulis juga melakukan penelitian sebagai tugas akhir ini di Balai Budidaya Air Tawar Jambi. Tugas akhir dalam pendidikan tinggi diselesaikan dengan menulis Skripsi yang berjudul “Pengaruh Pemberian Aromatase Inhibitor melalui Perendaman Larva terhadap Keberhasilan Sex Reversal dan Pertumbuhan Ikan Nila Merah Oreochromis sp.”.
DAFTAR ISI Halaman DAFTAR TABEL...……….... ix DAFTAR GAMBAR…...………... x DAFTAR LAMPIRAN…..……….... xi BAB I. PENDAHULUAN...……….…. 1 1.1 Latar Belakang……….…………. 1 1.2 Tujuan……….……….. 3
BAB II. TINJAUAN PUSTAKA..……… 4
2.1 Biologi Ikan……….. 4
2.2 Determinasi Seks dan Diferensiasi Seks………...…….……... 5
2.3 Sex Reversal Dan Metiltestosteron... 6
2.4 Aromatase dan Aromatase Inhibitor……….……… 6
2.5 Kualitas Air……….…….. 8
BAB III. BAHAN DAN METODE...……….……... 9
3.1 Waktu dan Tempat……….……... 9
3.2 Rancangan Percobaan……….……….. 9
3.2.1 Rancangan Perlakuan... 9
3.2.2 Prosedur Percobaan... 9
3.2.3 Parameter yang Diamati... 13
3.3 Analisis Data……….…….……... 14
BAB IV. HASIL DAN PEMBAHASAN... 15
4.1 Hasil... 16
4.2 Pembahasan... 19
BAB V. KESIMPULAN DAN SARAN... 21
5.1 Kesimpulan... 27
5.2 Saran... 27
DAFTAR PUSTAKA…...……….………. 28
DAFTAR TABEL
Halaman
1. Penelitian sebelumnya tentang sex reversal pada ikan nila dengan
aromatase inhibitor jenis imidazole... 7 2. Kisaran kualitas air media pemeliharaan ikan nila merah (Oreochromis
sp.)………...………...……... 8 3. Persentase jenis kelamin jantan rata-rata dan derajat kelangsungan hidup
(SR) rata-rata perlakuan di akuarium dan kolam pemeliharaan ikan nila merah untuk masing-masing perlakuan... 15 4. Bobot individu rata-rata akhir dan laju pertumbuhan spesifik (SGR)
rata-rata ikan nila merah masing-masing perlakuan... 14 5. Kualitas air media pemijahan induk, akuarium perlakuan perendaman,
awal penebaran di kolam dan akhir penelitian di kolam pemeliharaan
DAFTAR GAMBAR
Halaman
1. Perbedaan ikan nila jantan (kiri) dan betina (kanan)... 4 2. Pertumbuhan bobot individu rata-rata ikan nila merah di dalam hapa
pemeliharaan... 17 3. Pertumbuhan panjang rata-rata ikan nila merah di hapa pemeliharaan.. 18
DAFTAR LAMPIRAN
Halaman
1. Fedding rate yang digunakan pada penelitian selama pemeliharaan... 32
2. Analisis usaha pembenihan monoseks jantan ikan nila merah per siklus... 33
3. Analisis usaha pembenihan ikan nila merah biasa (mix culture) per siklus... 34
4. Kandungan nutrisi pakan yang digunakan selama penelitian... 35
5. Prosedur singkat maskulinisasi ikan nila merah melalui perendaman larva umur satu hari setelah menetas dengan imidazole pada larva umur 1 hari setelah menetas... 36
6. Data persentase jantan rata-rata ikan nila merah... 37
7. Data bobot individu rata-rata akhir ikan nila merah... 38
8. Data panjang rata-rata akhir ikan nila merah... 39
9. Data derajat kelangsungan hidup rata-rata ikan nila merah di akhir perlakuan... 40
10. Data derajat kelangsungan hidup rata-rata ikan nila merah di akhir penelitian... 41
11. Data laju pertumbuhan spesifik rata-rata ikan nila merah... 42
I. PENDAHULUAN
1.1 Latar Belakang
Ikan nila merah merupakan salah satu dari ikan konsumsi air tawar unggulan yang saat ini sudah dapat dibudidayakan dengan baik secara ekstensif, semi intensif, maupun intensif. Ikan ini memiliki kelebihan yang sama dengan ikan nila lainnya yaitu pertumbuhan yang cepat dan pemeliharaanya yang mudah karena ikan ini memiliki toleransi yang cukup lebar terhadap lingkungan yang buruk. Pada ikan ini terdapat perbedaan kecepatan pertumbuhan antara ikan jantan dengan ikan betina. Ikan nila jantan memiliki pertumbuhan dua kali lebih cepat dibandingkan dengan ikan betina (Popma dan Masser, 1999). Oleh karena itu budidaya ikan nila merah dengan tunggal kelamin jantan (monoseks) akan lebih menguntungkan (Lampiran 2 dan 3).
Permintaan ikan nila merah terus meningkat setiap tahunnya, tak hanya di pasar lokal, permintaan ikan nila merah ini juga terus meningkat di pasar internasional terutama Amerika dan Uni Eropa. Ikan nila merah, terutama dalam bentuk fillet (potongan daging tanpa tulang), sangat digemari di pasar dunia. Warna dagingnya yang putih bersih, kenyal, dan tebal seperti daging ikan kakap merah. Selain itu, karena merupakan hasil budidaya, pasokannya bisa diperoleh setiap saat tanpa terpengaruh oleh musim. Dari data Ditjen Pengolahan dan Pemasaran Hasil Perikanan (P2HP), Departemen Kelautan dan Perikanan, menunjukkan peningkatan impor ikan nila AS dalam sepuluh tahun terakhir. Impor ikan nila AS pada tahun 2002–2006 masing-masing sebesar 67.200 ton, 90.200 ton, 112.900 ton, 134.900 ton, dan 158.300 ton (Enny et al., 2009) dan data FAO menyebutkan bahwa total impor Amerika Serikat pada 2007 mencapai 173.760 ton dari berbagai negara, termasuk Indonesia (Husen, 2009). Harga ikan nila merah ini pun cukup menjanjikan bagi para eksportir. Harga 1 kg fillet nila merah di pasar Amerika bisa mencapai US$ 4,5. Meskipun budidaya ikan nila merah tergolong mudah, hingga saat ini Indonesia baru mampu melayani tak lebih dari 0,1 % permintaan pasar dunia akan fillet ikan nila merah. Total ekspor ikan
nila Indonesia pada tahun 2005 sebesar 151.363 ton kemudian terus naik hingga mencapai 206.904 ton pada tahun 2007 (Anonim, 2008).
Sementara target produksi nila pada tahun 2008 ialah 233.000 ton dan 337.000 ton untuk tahun 2009, maka kebutuhan benihnya masing-masing per tahun adalah 1,13 miliar dan 1,63 miliar ekor (Enny et al., 2009). Sedangkan untuk pasar lokal, harga ikan nila merah adalah sekitar Rp. 15.000.-, lebih tinggi dibanding dengan ikan nila biasa yang seharga Rp. 10.000,- – Rp. 11.000,-.
Cara umum yang dilakukan untuk memperoleh ikan nila merah berkelamin tunggal jantan (monoseks) adalah dengan menggunakan hormon steroid 17α-metiltestosteron (MT). Namun pada saat ini, penggunaan hormon sintetik tersebut pada ikan konsumsi telah dilarang sesuai dengan Surat Keputusan Menteri Departemen Kelautan dan Perikanan No: KEP.20/MEN/2003. Residu hormon steroid ini menjadi salah satu bahan yang diduga dapat menyebabkan kanker atau bersifat karsinogenik pada manusia (Phelps, 2001) dan juga sulit untuk didegradasi secara alami sehingga berpotensi menimbulkan pencemaran lingkungan (endocrine residu agent) (Contreras-Sancez, 2001). Oleh karena itu perlu dicari alternatif teknologi baru untuk menghasilkan keturunan jantan melalui sex reversal pada ikan, khususnya ikan nila merah. Salah satu bahan alternatif yang mulai diteliti adalah aromatase inhibitor (AI).
Bahan aromatase inhibitor berfungsi untuk menghambat kerja enzim aromatase pada proses sintesis androgen menjadi estrogen selama fase diferensiasi kelamin sehingga benih yang dihasilkan berkelamin jantan (Sever et al., 1999). Namun dalam penggunaan bahan ini belum ditemukan mengenai metode dan dosis yang optimal untuk menghasilkan ikan nila merah berkelamin jantan semaksimal mungkin dalam aplikasi sex reversal. Oleh karena itu perlu dilakukan penelitian mengenai penggunaan aromatase inhibitor dengan metode dan dosis yang optimal serta hasil yang maksimal.
Penelitian pemanfaatan aromatase inhibitor dalam sex reversal ikan nila merah telah dilakukan antara lain oleh Kwon et al. (2000) yang menggunakan aromatase inhibitor jenis fadrozole melalui pakan buatan dengan dosis 500 mg/kg pakan selama lima hari pada benih ikan nila merah dengan umur setelah menetas yang berbeda-beda yang menghasilkan 96% benih berkelamin jantan. Nurlaela
(2002) melakukan penelitian dengan menggunakan perendaman embrio ikan nila merah dalam larutan aromatase inhibitor jenis imidazole dengan dosis 20 mg/l selama 10 jam, menghasilkan 82,22% benih berkelamin jantan. Mengacu pada penelitian terdahulu, penelitian ini memberikan perlakuan dengan aromatase inhibitor tetapi dengan meningkatkan dosis aromatase inhibitor jenis imidazole dalam perendaman larva umur 1 hari setelah menetas dengan harapan untuk memperoleh persentase rata-rata jantan yang lebih tinggi.
1.2 Tujuan
Penelitian ini bertujuan untuk mengkaji pengaruh aromatase inhibitor jenis imidazole dalam sex reversal dengan dosis yang berbeda terhadap nisbah kelamin dan pertumbuhan ikan nila merah melalui perendaman larva umur 1 hari setelah menetas pada pemeliharaan di dalam hapa.
II. TINJAUAN PUSTAKA
2.1 Biologi Ikan
Ikan nila merah pertama kali didatangkan ke Indonesia pada tahun 1981 oleh Balai Penelitian Perikanan Air Tawar di Bogor. Ikan nila merah mulai banyak dipelihara luas di berbagai daerah sejak dilakukannya penelitian intensif pada tahun 1981. Ikan nila merah (Oreochromis sp.) merupakan hasil hibridisasi antara ikan nila O. mozambicus dengan ikan nila O. niloticus. Ikan nila merah tergolong dalam kingdom Animalia, filum Chordata, kelas Acanthoptherygii, ordo Percomorphi, famili Cichlidae, dan genus Oreochromis (Durant, 1995). Ikan ini memiliki sifat biologis yang menguntungkan diantaranya yaitu dapat memanfaatkan berbagai macam pakan alami dan memiliki pertumbuhan yang cepat. Pada ikan ini terdapat perbedaan kecepatan pertumbuhan antara ikan jantan dengan ikan betina. Ikan nila jantan memiliki pertumbuhan dua kali lebih cepat dibandingkan dengan betina Selain itu, ikan nila merah memilki toleransi yang tinggi terhadap kondisi lingkungan yang buruk (Popma dan Masser, 1999).
Bentuk ikan nila merah adalah pipih secara lateral dengan sirip punggung yang panjang dan bagian depan sirip punggung sangat tajam. Ikan ini termasuk kelompok mouth breeder dimana telur dibuahi pada substrat yang kemudian dengan segera diambil oleh induk betina untuk diinkubasi hingga beberapa hari setelah menetas di dalam mulutnya. Ikan nila merah jantan memiliki dua lubang kecil dan sempit di bawah perutnya yaitu anus dan urogenital, sedangkan ikan nila merah betina memiliki tiga lubang yaitu anus, lubang genital, dan muara ureter. Anus dapat mudah dibedakan karena bentuknya bundar (Djariah, 1996).
2.2 Determinasi dan Diferensiasi Seks
Determinasi seks digunakan untuk menggambarkan proses genetik dan lingkungan serta variabel-variabel yang mempengaruhi diferensiasi seks atau disebut juga pengendali primer yang mempengaruhi keadaan diferensiasi seks (Devlin dan Nagahama, 2002). Menurut Yatim (1986), jenis kelamin suatu individu ditentukan oleh faktor lingkungan dan genetik yaitu kromosom seks atau gonosom. Secara genetik, jenis kelamin suatu individu sudah ditetapkan pada waktu terjadinya pembuahan (Matty, 1985).
Pada saat embrio, gonad atau organ kelamin primer masih berada dalam keadaan indiferen, yaitu keadaan dimana bakat-bakat untuk menjadi jantan atau betina dalam bentuk rudimeter dan semua kelengkapan struktur-struktur jantan dan betina sudah ada, hanya menunggu perintah diferensiasi dan penekanan ke arah aspek jantan atau betina (Toelihere, 1981). Namun gonad ikan yang baru menetas belum terdeferensiasi menjadi jantan atau betina (Junior, 2002). Apabila faktor jantan lebih dominan dari faktor betina maka zigot akan berkembang menjadi jantan, demikian sebaliknya (Yamamoto, 1969). Proses determinasi dan diferensiasi seks pada ikan sangat labil dan memungkinkan untuk dimanipulasi secara ploidi, menggunakan hormon, kejutan suhu, dan faktor lingkungan lain (Pandian dan Sheela, 1995).
Diferensiasi seks adalah proses perkembangan gonad setelah seks dideterminasikan (Devlin dan Nagahama, 2002). Diferensiasi seks adalah proses perkembangan gonad ikan menjadi jaringan yang defintif. Proses ini terdiri dari serangkaian kejadian yang memungkinkan genotipe seks terekspresi menjadi fenotipe seks. Proses diferensiasi sangat dipengaruhi oleh faktor genetik dan lingkungan. Pada kondisi normal tanpa adanya gangguan, perkembangan gonad akan terjadi secara normal. Akan tetapi, apabila ada intervensi dari luar dengan bahan tertentu seperti hormon, maka perkembangan gonad dapat berlangsung berlawanan dari yang seharusnya (Junior, 2002). Pengarahan kelamin menjadi jantan atau betina fungsional dapat dilakukan pada saat gonad belum berkembang atau pada masa indiferen (Matty, 1985). Masa diferensiasi kelamin ikan nila merah berlangsung sampai dengan umur 30 hari setelah menetas (Kwon et al., 2000).
2.3 Sex Reversal dan Metiltestosteron
Sex reversal merupakan suatu teknik untuk mengubah jenis kelamin secara buatan dari ikan jantan secara genetik menjadi ikan betina secara fenotipe atau sebaliknya (Junior, 2002). Sex reversal bisa dilakukan karena pada waktu menetas gonad ikan belum berdiferensiasi secara jelas menjadi jantan atau betina. Dengan teknik sex reversal, fenotipe ikan dapat berubah, tetapi genotipenya tidak berubah (Junior, 2002). Tujuan utama dari penerapan teknik sex reversal adalah menghasilkan populasi monoseks (tunggal kelamin). Dengan membudidayakan ikan monoseks akan didapatkan berbagai manfaat antara lain mendapatkan ikan dengan pertumbuhan yang cepat, mencegah pemijahan liar, mendapatkan penampilan yang baik, dan menunjang genetika ikan (teknik pemurnian ras ikan). Beberapa jenis ikan, baik ikan konsumsi maupun ikan hias, telah berhasil diproduksi dengan teknologi sex reversal (Junior, 2002).
Androgen yang paling umum yang digunakan dalam aplikasi sex reversal untuk maskulinisasi adalah 17α-metiltestosteron (MT) yang diperkirakan efektif digunakan pada lebih dari 25 spesies yang telah diuji (Devlin dan Nagahama, 2002). 17α-metiltestosteron merupakan androgen yang paling sering dipakai untuk merubah jenis kelamin dan penggunaan hormon ini pada dosis yang berbeda akan memberikan pengaruh yang berbeda pula (Nagy, 1981). 17α-metiltestosteron merupakan hormon sintetik yang molekulnya sudah dimodifikasi agar tahan lama di dalam tubuh. Hal ini dikarenakan pada karbon ke 17 telah ditempeli gugus metil agar tahan lama (Junior, 2002).
2.4 Aromatase dan Aromatase Inhibitor
Aromatase adalah enzim kritis untuk biosintesis estradiol-17β dari testosteron (Nakamura, 2000). Menurut Brodie (1991) aromatase pada otak beberapa spesies dapat berperan mengontrol diferensiasi seks. Piferrer et al. (1994), menjelaskan bahwa pemberian hormon sintesis dan alami atau AI dapat mempengaruhi diferensiasi seks pada spesies gonokhoris dan menyebabkan sex reversal dan atau interseks. AI bekerja dengan cara menghambat produksi estradiol-17β dan peningkatan jumlah secara prematur pada plasma 17, 20 β-P ikan coho salmon (Oncorhynchus kisutch) jantan dewasa (Afonso et al., 2000).
Secara umum aromatase inhibitor menghambat aromatase melalui dua cara, yaitu dengan menghambat proses transkripsi dari gen-gen aromatase sehingga mRNA tidak terbentuk dan sebagai konsekuensinya enzim aromatase tidak ada (Sever et al., 1999) atau melalui cara bersaing dengan substrat alami (testosteron) sehingga aktivitas aromatase tidak berjalan (Brodie, 1991). Penghambatan ini dapat mengakibatkan terjadinya penurunan konsentrasi estrogen yang mengarah pada tidak aktifnya transkripsi dari gen aromatase sebagai feedback-nya (Sever, et al., 1999).
Penurunan rasio estrogen terhadap androgen mengakibatkan terjadinya perubahan penampakan hormonal dari betina menjadi menyerupai jantan atau dengan kata lain terjadi maskulinisasi karakteristik seksual sekunder (Davis et al., 1999). Aktivitas aromatase terletak di dalam otak yang berpengaruh terhadap pengendalian tingkah laku serta terjadi pada ovari yang berpengaruh tehadap maturasi folikel dan tingkat ovulasi (Silverine et al., 2000).
Tabel 1. Penelitian sebelumnya tentang sex reversal pada ikan nila dengan aromatase inhibitor jenis imidazole.
Peneliti Jenis Ukuran Sistem Budidaya
Dosis
Optimum Waktu Metode
Suhu Pemeliharaan % Jantan Nurlaela (2002) Ikan nila merah Embrio fase bintik mata
Hapa 20 mg/l 10 jam Perendaman
telur 27 o C 82,22 % Suhanti (2003) Ikan nila merah Larva umur 9-13 hari Hapa 500 mg/kg pakan 4 hari Pakan buatan 25-27 o C 74 % Astutik (2004) Ikan nila merah Larva umur 9 hari
Hapa 20 mg/l 10 jam Perendaman larva 25 o C 59,51 % Barmudi (2005) Ikan nila merah Larva umur 9-13 hari Akuarium 1500 mg/kg pakan 4 hari Pakan buatan 27-30 oC 73,09 % Lukman (2005) Ikan nila gift Larva umur 9-14 hari Hapa 1500 mg/l 5 hari Perendaman Daphnia 24-27 o C 74,54 % Liana (2005) Ikan nila merah Larva umur 9-13 hari Akuarium 1500 mg/kg pakan 4 hari Pakan buatan 26,5-28,5 o C 78,63 % Tasdiq (2005) Ikan nila merah Larva umur 9-13 hari Akuarium 1500 mg/l 4 hari Perendaman Artemia 24-30 o C 70,4 %
Aktivitas aromatase berkorelasi dengan struktur gonad. Aktivitas aromatase larva akan mengarah pada pembentukan testis, sedangkan aktivitas yang tinggi akan mengarah pada pembentukan ovari (Scholz dan Gutzeit, 2000).
Menurut Wozniak (1992), terdapat dua jenis aromatase inhibitor, yaitu aromatase inhibitor steroid dan aromatase inhibitor non steroid. Contoh dari aromatase inhibitor steroid adalah 1,4,6-androstatrien-3,17-dione (ATD) dan 4-hidroxy-androstenedione (4-OH-A), sedangkan aromatase inhibitor non steroid diantaranya imidazole (Hutchinson, 1993) dan fadrozole (Afonso, 2000). Aromatase inhibitor non steroid lebih efektif dalam menghambat aktivitas aromatase dibandingkan dengan aromatase inhibitor steroid (ATD atau 4-OH-A).
Imidazole memiliki nama lain seperti diaza-2,4-cyclopentadiene, 1,3-diazole, dan glyoxalin dengan formula kimia C3H4N2. Imidazole memiliki bentuk
berupa bubuk kristal berwarna putih kekuningan dengan titik didih dan titik leleh pada suhu 256oC dan 89-91oC. Imidazole memiliki sifat kelarutan air lebih dari 10% dan tidak bersifat karsinogenik (Anonim, 2006).
2.5 Kualitas Air
Ikan nila merah lebih memiliki toleransi yang tinggi bila dibandingkan dengan ikan-ikan air tawar pada umumnya terhadap salinitas yang tinggi, suhu yang tinggi, DO yang rendah dan konsentrasi amonia yang tinggi (Popma dan Masser, 1999).
Tabel 2. Kisaran kualitas air media pemeliharaan ikan nila merah (Oreochromis sp.) (Lin, 1995).
Parameter Satuan Nilai
Suhu : -Lethal -Optimal o C <16 ; >42 25-30 DO : -Lethal -Optimal mg/l <0,5 >2 pH : -Lethal -Optimal - <4 ;>11 6,5-8 NH3 : -Lethal -Stres mg/l >0,6 0,4
Menurut D’Cotta et al. (2001), faktor lingkungan seperti suhu juga ikut mempengaruhi proses diferensiasi kelamin, dimana suhu tinggi dapat meningkatkan persentase ikan jantan.
III. BAHAN DAN METODE
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan April sampai dengan Agustus 2009, di Laboratorium Nutrisi Ikan, Balai Budidaya Air Tawar Jambi.
3.2 Rancangan Percobaan 3.2.1 Rancangan Perlakuan
Percobaan terdiri dari tiga perlakuan AI dan dua perlakuan kontrol, masing-masing perlakuan AI diulang sebanyak empat kali, sedangkan kontrol diulang sebanyak dua kali. Pada penelitian ini digunakan aromatase inhibitor dengan nama imidazole (1,3-diaz-2,4-cyclopentadiene, Wako Pure Chemical Industries Ltd. Jepang) dan hormon 17α-metiltestosteron (MT).
Perlakuan AI dan kontrol antara lain sebagai berikut.
a. Perlakuan kontrol negatif, yaitu perendaman AI dengan dosis 0 mg/l. b. Perlakuan AI 1, yaitu perendaman AI dengan dosis 25 mg/l.
c. Perlakuan AI 2, yaitu perendaman AI dengan dosis 50 mg/l. d. Perlakuan AI 3, yaitu perendaman AI dengan dosis 75 mg/l.
e. Perlakuan kontrol positif, yaitu perendaman 17α-MT dengan dosis 5 mg/l.
3.2.2 Prosedur Percobaan
Percobaan dilakukan dalam empat tahap yaitu tahap persiapan, perlakuan, pemeliharaan, dan pengamatan.
a. Tahap Persiapan
Tahap persiapan dimulai dengan persiapan bak pemijahan ikan nila merah yang berukuran 5x8 m, yang diawali dengan penyikatan bak, pengeringan selama 1 hari, kemudian diisi air setinggi 1 meter dan diberi aerasi pada beberapa titik. Setelah bak pemijahan siap, dilakukan seleksi induk ikan nila merah jantan dengan melihat pada bagian urogenital yang sudah memerah dan bila diurut ke arah urogenital mengeluarkan cairan berwarna putih. Sedangkan induk ikan nila merah betina dengan melihat pada bagian perut yang gendut dan urogenital yang memerah.
Setelah persiapan bak pemijahan, dilakukan persiapan wadah perlakuan perendaman dan pemeliharaan larva yaitu akuarium berukuran 20x20x20 cm. Akuarium dibersihkan dengan cara menyikat seluruh permukaan akuarium dengan sikat dan sabun lalu disterilisasi dengan menggunakan kaporit sebanyak 50 ppm kemudian dibiarkan selama 1 hari. Setelah itu akuarium dibilas dengan air bersih hingga bau kaporit hilang. Selanjutnya dilakukan pengaturan akuarium beserta dengan peralatan aerasi lalu diisi air sebanyak 5 liter per akuarium untuk media perlakuan perendaman dan 10 liter untuk media pemeliharaan larva hingga umur 13 hari setelah menetas. Setelah diisi air, media perlakuan dan pemeliharaan diberi methylene blue sebanyak 2 ppm kemudian diberi aerasi kuat untuk menghilangkan methylene blue.
Pemijahan ikan nila merah dilakukan secara alami dalam bak semen dengan rasio jantan dan betina 1:3, dengan jumlah 20 ikan nila merah jantan dan 60 ikan nila merah betina, dengan kepadatan 2 ekor/m2. Bobot rata-rata induk nila merah jantan sebesar 820 g sedangkan induk nila merah betina sebesar 550 g. Setiap induk nila merah betina menghasilkan telur rata-rata sebanyak 850 butir. Ikan dibiarkan memijah secara alami dalam bak pemijahan selama 10 hari. Pemeliharaan induk dilakukan dengan pergantian air sebanyak 30 % per hari dan pemberian pakan sesuai dengan feeding rate (Lampiran 1).
Setelah memijah, telur yang sudah dierami oleh induk betina diambil kemudian dilakukan penetasan telur. Pengambilan telur dilakukan dengan menjaring semua induk ikan nila merah secara perlahan-lahan ke salah satu sisi bak, kemudian induk ikan nila merah jantan dikeluarkan dan dilakukan pembukaan mulut induk ikan nila merah betina dengan menggunakan tangan satu per satu di atas seser. Telur yang diperoleh dipindahkan ke baskom yang telah berisi air yang sebelumnya telah diberi methylene blue dengan dosis 1 ppm. Setelah dilakukan pemeliharaan telur hingga menetas, kemudian larva dipelihara hingga umur 1 hari setelah menetas.
Setelah perlakuan, dilakukan persiapan kolam pemeliharaan ikan nila merah yang berukuran 500 m2. Persiapan kolam dimulai dengan pembuangan air kolam seluruhnya ke saluran pembuangan (outlet) dengan menggunakan pompa air. Kemudian dilakukan pengambilan ikan-ikan liar yang ada di kolam.
Setelah itu dilakukan pengapuran kolam dengan dosis 1 kg/m2. Selanjutnya kolam dibiarkan selama 1 hari di bawah terik sinar matahari. Setelah dijemur selama 1 hari kolam diisi air dari saluran air primer (inlet) hingga ketinggian air 1,5 meter. Kemudian dilakukan pemasangan hapa pemeliharaan berukuran 2x1x1 m dan 1x1x1 m untuk pembesaran ikan nila merah hingga berumur 2,5 bulan.
b. Tahap Perlakuan
Perlakuan dilakukan pada larva yang berumur 1 hari setelah menetas. Penentuan larva berumur satu hari yaitu dimulai dengan pemeliharaan telur hingga menetas dan pemeliharaan larva sampai larva berumur 1 hari. Larva direndam di dalam larutan aromatase inhibitor jenis imidazole dengan dosis 0 (kontrol negatif) mg/l, 25 mg/l, 50 mg/l, 75 mg/l, dan 17α-metiltestosteron (MT) (kontrol positif) dengan dosis 5 mg/l, selama 24 jam di akuarium berukuran 20x20x20 cm dengan kepadatan 110 larva dan volume air 5 liter per akuarium. Untuk perlakuan AI, bahan imidazole langsung dilarutkan ke dalam media perendaman kemudian diaduk dengan sendok atau dengan pemberian aerasi kuat agar imidazole terlarut seluruhnya, selanjutnya larva dimasukkan dalam media untuk perlakuan perendaman. Pada perlakuan 17α-metiltestosteron (MT), bahan dilarutkan seluruhnya ke dalam alkohol 90% sebanyak 0,1 ml, kemudian larutan 17α-metiltestosteron (MT) dimasukkan ke dalam media perendaman dan diberi aerasi yang kuat hingga busa yang ditimbulkan paling sedikit atau alkohol yang ada di dalam media perendaman menguap seluruhnya ke udara. Setelah itu ikan dapat langsung dimasukkan dalam media untuk perlakuan.
c. Tahap Pemeliharaan
Setelah perlakuan perendaman, larva dipindahkan ke dalam akuarium pemeliharaan yang berukuran 20x20x20 cm sampai larva berumur 13 hari setelah menetas dengan pemberian pakan berupa Artemia (Artemia sp.) yang sudah didekapsulasi terlebih dahulu sejak umur 4-7 hari setelah menetas. Artemia (Artemia sp.) yang diberikan sebanyak 20 g per hari dan meningkat sebanyak 5 gram per harinya. Pada umur 1-3 hari setelah menetas tidak beri pakan karena masih menggunakan kuning telur sebagai sumber energinya. Kuning telur pada larva ikan nila merah habis seluruhnya pada umur 7 hari setelah menetas.
Selanjutnya larva diberi pakan pelet halus hingga berumur 13 hari sekenyangnya dengan frekuensi pemberian pakan sebanyak delapan kali sehari. Penyiponan akuarium dilakukan setiap hari dan pergantian air sebanyak 30 % setiap dua hari sekali. Setelah benih berumur 13 hari dilakukan sampling awal kemudian dibesarkan dalam hapa berukuran 1x2x1 m yang ditempatkan dalam kolam pemeliharaan berukuran 500 m2 dengan pemberian pakan pelet udang halus hingga berumur 1 bulan sesuai dengan feeding rate (Lampiran 1) dengan frekuensi pemberian pakan sebanyak enam kali sehari. Selanjutnya diberi pakan udang crumble dan pakan crumble komersil sesuai dengan feeding rate (Lampiran 1) dengan frekuensi pemberian pakan sebanyak empat kali sehari hingga umur 2,5 bulan.
d. Tahap Pengamatan
Pertama, pengamatan dilakukan dengan sampling setiap dua minggu sekali di akuarium maupun di kolam pemeliharaan. Pengukuran yang dilakukan pada saat sampling antara lain, pengukuran bobot biomassa, bobot dan panjang individu rata-rata. Kedua, pengamatan fenotipe ikan dengan cara melihat secara visual jenis kelamin ikan (sexing) yang dibantu dengan menggunakan methylene blue untuk memperjelas bentuk jenis kelamin ikan pada akhir penelitian pada saat ikan berumur 2,5 bulan. Methylene blue sebanyak 0,5 mg dilarutkan ke dalam 5 ml air kemudian dioles ke bagian urogenital ikan nila merah. Untuk ikan nila merah jantan akan terlihat dua buah lubang sedangkan pada ikan nila merah betina terlihat 3 buah lubang. Pengamatan yang terakhir adalah pengamatan kualitas air yang dilakukan pada saat pemijahan induk, perlakuan, awal penebaran di kolam dan akhir penelitian di kolam. Kualitas air yang diamati adalah suhu, amoniak, DO dan pH. Untuk mengukur suhu, alat yang digunakan adalah termometer. Alat untuk mengukur DO dan pH berturut-turut adalah DOmeter dan pHmeter. Alat untuk mengukur amoniak adalah dengan menggunakan spektrofotometer.
Parameter yang diamati pada penelitian ini adalah persentase jenis kelamin ikan (%), derajat kelangsungan hidup ikan (SR), pertumbuhan bobot individu rata-rata, pertumbuhan panjang individu rata-rata-rata, laju pertumbuhan spesifik (SGR), dan kualitas air media pemijahan induk, media perlakuan, dan media pemeliharaan ikan nila merah pada awal penebaran di kolam dan akhir penelitian.
3.2.3 Parameter yang Diamati
Parameter-parameter yang diamati pada penelitian ini antara lain sebagai berikut.
1. Persentase Jenis Kelamin Ikan Jantan IJ (%) = Ij x100%
Is
Keterangan :
IJ = persentase jenis kelamin ikan jantan (%) Ij = jumlah ikan jantan yang diperoleh (ekor). Is = jumlah ikan yang diamati (ekor).
2. Derajat Kelangsungan Hidup (SR) SR (%) = Nt x100%
No
Keterangan :
SR = derajat kelangsungan hidup (%) Nt = jumlah ikan pada waktu t (ekor) No = jumlah larva yang menetas (ekor) 3. Pertumbuhan Bobot Individu Rata-Rata
Bo Bt B
Keterangan :
ΔB = pertumbuhan bobot individu rata-rata (g) Bt = bobot rata-rata akhir (g)
Bo = bobot rata-rata awal (g)
4. Pertumbuhan Panjang Individu Rata-Rata
Po Pt P
Keterangan :
ΔP = pertumbuhan panjang individu rata-rata (g) Pt = bobot rata-rata akhir (g)
Po = bobot rata-rata awal (g) 5. Laju Pertumbuhan Spesifik (SGR)
% 100 1 = SGR t wo wt
Keterangan :
SGR = laju pertumbuhan spesifik (%) t = waktu pemeliharaan (hari) Wt = berat akhir pemeliharaan (g) Wo = berat awal pemeliharaan (g) 6. Paramater Fisika Kimia Air
Pengambilan sampel air dilakukan pada media pemijahan induk, media perlakuan perendaman, dan media pemeliharaan ikan nila merah pada awal penebaran di kolam dan akhir penelitian di kolam. Parameter yang diukur adalah suhu, DO, pH, dan amoniak dengan metode pembacaan skala.
3.3. Analisis Data
Data yang diperoleh dari hasil pengamatan disajikan dalam bentuk tabel dan grafik serta dianalisis secara statistik. Beberapa parameter yang akan dilakukan analisis data antara lain persentase jenis kelamin ikan, derajat kelangsungan hidup (SR), bobot individu rata-rata akhir, dan laju pertumbuhan spesifik (SGR). Model umum yang digunakan adalah rancangan acak lengkap, diolah dengan menggunakan program SPSS 16. Apabila hasil yang diperoleh ternyata berbeda nyata, maka akan dilakukan uji lanjut dengan menggunakan Uji Duncan. Sedangkan parameter yang lain akan dijelaskan secara deskriptif.
IV. HASIL DAN PEMBAHASAN
4.1 Hasil
Hasil yang diperoleh pada penelitian ini meliputi persentase jenis kelamin jantan rata-rata, derajat kelangsungan hidup (SR) rata-rata setelah perlakuan perendaman dan penelitian, pertumbuhan bobot individu rata-rata, pertumbuhan panjang individu rata-rata, dan laju pertumbuhan spesifik rata-rata (SGR) ikan nila merah. Hasil analisis statistik dapat dilihat pada tabel di bawah ini.
Tabel 3. Persentase jenis kelamin jantan rata-rata dan derajat kelangsungan hidup (SR) rata-rata perlakuan di akuarium dan kolam pemeliharaan ikan nila merah untuk masing-masing perlakuan.
Perlakuan % Jantan Derajat Kelangsungan Hidup (SR) Perlakuan Perendaman (%) Derajat Kelangsungan Hidup (SR) di Akhir Penelitian(%) AI 0 mg/l 59,90±3,100a 100,00±0,000a 84,55±0,000a AI 25 mg/l 95,53±0,481b 98,18±0,525a 80,91±4,098a AI 50 mg/l 96,83±1,728b 98,41±0,777a 76,59±2,787a AI 75 mg/l 96,88±0,994b 98,64±0,263a 80,00±5,049a MT 5 mg/l 96,55±1,405b 98,64±0,455a 91,36±2,275a Catatan: Angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata (P>0,05); rata-rata ± SE.
Tabel 4. Bobot individu rata-rata akhir dan laju pertumbuhan spesifik (SGR) rata-rata ikan nila merah masing-masing perlakuan.
Perlakuan Bobot Individu Rata rata Akhir (g)
Laju Pertumbuhan Spesifik (SGR) (%) AI 0 mg/l 36,38±0,500a 9,93±0,026a AI 25 mg/l 39,44±1,461ab 10,06±0,060ab AI 50 mg/l 39,28±0,986ab 10,05±0,040ab AI 75 mg/l 41,10±0,819b 10,13±0,032b MT 5 mg/l 42,05±0,450b 10,17±0,017b
Catatan: Angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata (P>0,05); rata-rata ± SE.
Hasil analisis ragam persentase jenis kelamin jantan rata-rata yang diperoleh di akhir penelitian pada umur ikan 2,5 bulan menunjukkan bahwa terjadi perbedaan yang signifikan antara perlakuan AI 25 mg/l, 50 mg/l, 75 mg/l, dan MT 5 mg/l (kontrol positif) terhadap perlakuan AI 0 mg/l (kontrol negatif) (P<0,05).
Sedangkan antara perlakuan AI 25 mg/l, 50 mg/l, 75 mg/l, dan perlakuan MT 5 mg/l (kontrol positif) tidak ada perbedaan yang nyata (P>0,05). Dari hasil analisis menunjukkan bahwa penggunaan AI pada dosis 25 mg/l, 50 mg/l, dan 75 mg/l dapat menggantikan penggunaan 17α-metiltestosteon 5 mg/l (kontrol positif) yang dapat dilihat dari nilai bobot individu rata-rata akhir, laju pertumbuhan spesifik rata-rata, derajat kelangsungan hidup rata-rata dan yang paling utama adalah nilai persentase jantan rata-rata yang relatif sama dan tidak berbeda secara signifikan (P>0,05).
Aromatase inhibitor tidak mempengaruhi derajat kelangsungan hidup setelah perlakuan. Hal ini dibuktikan pada Tabel 3 dimana derajat kelangsungan hidup rata-rata ikan nila merah yang diatas 98 % dan tidak berbeda secara signifikan antara perlakuan AI 0 mg/l, 25 mg/l, 50 mg/l, 75 mg/l, dan MT (kontrol positif) (P>0,05). Pada akhir penelitian terjadi kematian tetapi juga tidak terjadi perbedaan yang signifikan antara perlakuan AI dan MT (kontrol positif) (P>0,05). Derajat kelangsungan hidup baik setelah perlakuan maupun di akhir percobaan yang diperoleh pada semua perlakuan dan kontrol cukup tinggi yaitu lebih dari 75 %. Derajat kelangsungan hidup akhir perlakuan menunjukkan nilai yang sangat tinggi yaitu di atas 98 %. Dari hasil analisis dapat diketahui bahwa penggunaan aromatase inhibitor terbukti tidak mempengaruhi derajat kelangsungan hidup ikan uji hingga akhir penelitian (P>0,05).
Pada bobot individu rata-rata akhir terlihat perbedaan yang signifikan antara perlakuan AI 75 mg/l dan MT 5 mg/l (kontrol positif) terhadap perlakuan AI 0 mg/l (kontrol negatif) (P<0,05). Pada perlakuan AI 0 mg/l (kontrol negatif), 25 mg/l, dan 50 mg/l tidak terjadi perbedaan yang signifikan (P>0,05). Hal yang sama juga terjadi antara perlakuan AI 25 mg/l, 50 mg/l, 75 mg/l, dan MT 5 mg/l (kontrol positif) (P>0,05). Untuk laju pertumbuhan spesifik (SGR) rata-rata, terjadi perbedaan yang signifikan antara perlakuan AI 75 mg/l dan MT 5 mg/l (kontrol positif), terhadap perlakuan AI 0 mg/l (kontrol negatif) (P<0,05). Nilai SGR pada perlakuan AI 0 mg/l (kontrol negatif) tidak berbeda nyata dengan perlakuan AI 25 mg/l dan 50 mg/l (P>0,05). Hal sama juga terjadi pada perlakuan AI 25 mg/l, 50 mg/l, 75 mg/l dan MT (kontrol positif). Perlakuan aromatase inhibitor terbukti memberikan hasil yang relatif sama dengan MT (P>0,05).
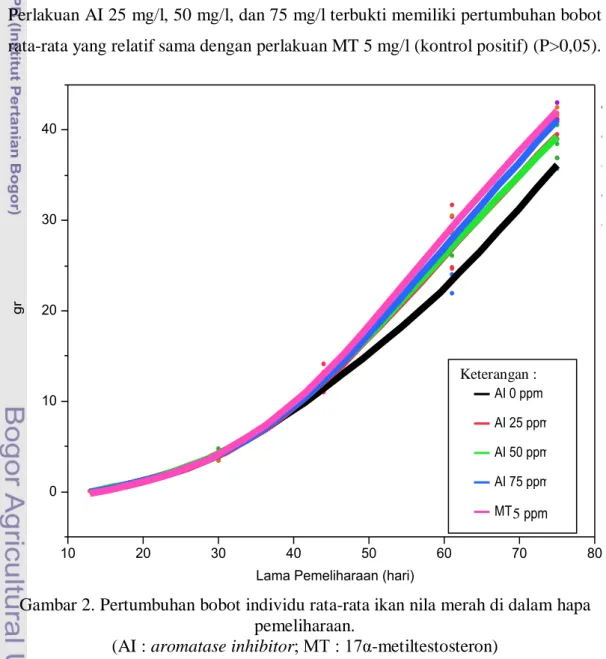
Dari Gambar 2 dapat dilihat bahwa bobot individu rata-rata akhir yang tertinggi diperoleh pada perlakuan MT 5 mg/l (kontrol positif). Sedangkan pertumbuhan bobot individu rata-rata yang terendah diperoleh pada perlakuan AI 0 mg/l (kontrol negatif). Untuk perlakuan AI 25 mg/l dan 50 mg/l mengalami petumbuhan bobot rata-rata yang relatif sama dari awal hingga akhir pemeliharaan. Untuk perlakuan AI 75 mg/l mengalami pertumbuhan bobot rata-rata yang sama dengan perlakuan AI 25 mg/l dan AI 50 mg/l sejak awal pemeliharaan, namun terjadi peningkatan pertumbuhan bobot rata-rata pada hari ke 50. Secara umum semua perlakuan dan kontrol mengalami pertumbuhan bobot rata-rata yang seragam sejak awal pemeliharaan, namun pada hari ke 40 mulai terlihat perbedaan pertumbuhan pada masing-masing perlakuan dan kontrol. Perlakuan AI 25 mg/l, 50 mg/l, dan 75 mg/l terbukti memiliki pertumbuhan bobot rata-rata yang relatif sama dengan perlakuan MT 5 mg/l (kontrol positif) (P>0,05).
Gambar 2. Pertumbuhan bobot individu rata-rata ikan nila merah di dalam hapa pemeliharaan.
(AI : aromatase inhibitor; MT : 17α-metiltestosteron)
Keterangan :
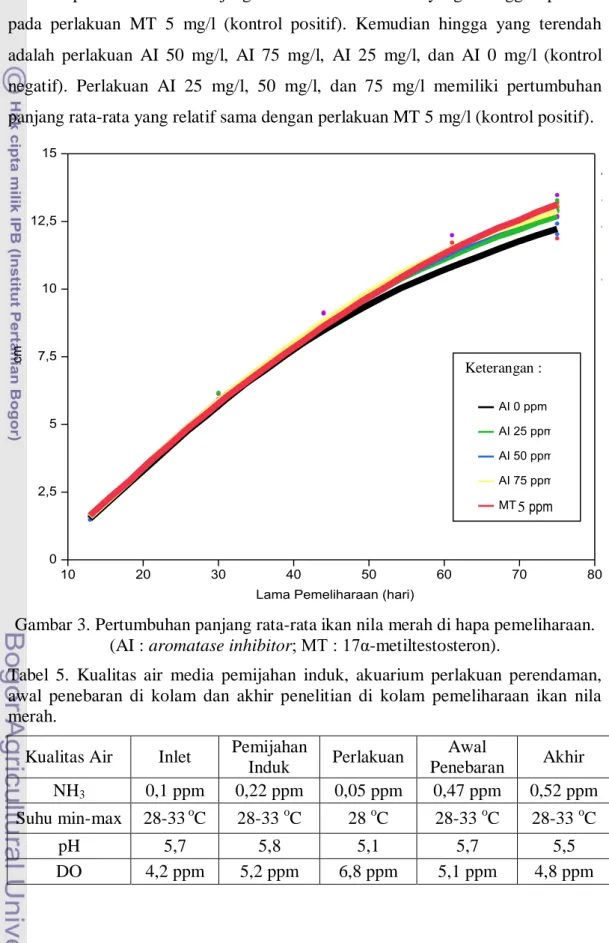
Pada Gambar 3 secara umum terlihat bahwa ikan mengalami pertumbuhan panjang individu rata-rata seiring dengan waktu pemeliharaan pada semua perlakuan dan kontrol. Ikan mulai mengalami perbedaaan pertumbuhan panjang rata-rata pada hari ke 45. Panjang individu rata-rata akhir yang tertinggi diperoleh pada perlakuan MT 5 mg/l (kontrol positif). Kemudian hingga yang terendah adalah perlakuan AI 50 mg/l, AI 75 mg/l, AI 25 mg/l, dan AI 0 mg/l (kontrol negatif). Perlakuan AI 25 mg/l, 50 mg/l, dan 75 mg/l memiliki pertumbuhan panjang rata-rata yang relatif sama dengan perlakuan MT 5 mg/l (kontrol positif).
Gambar 3. Pertumbuhan panjang rata-rata ikan nila merah di hapa pemeliharaan. (AI : aromatase inhibitor; MT : 17α-metiltestosteron).
Tabel 5. Kualitas air media pemijahan induk, akuarium perlakuan perendaman, awal penebaran di kolam dan akhir penelitian di kolam pemeliharaan ikan nila merah.
Kualitas Air Inlet Pemijahan
Induk Perlakuan Awal Penebaran Akhir NH3 0,1 ppm 0,22 ppm 0,05 ppm 0,47 ppm 0,52 ppm Suhu min-max 28-33 oC 28-33 oC 28 oC 28-33 oC 28-33 oC pH 5,7 5,8 5,1 5,7 5,5 DO 4,2 ppm 5,2 ppm 6,8 ppm 5,1 ppm 4,8 ppm Keterangan : 5 ppm
Kualitas air pada media pemijahan induk masih berada dalam toleransi induk ikan nila merah sehingga mendukung terjadinya pemijahan secara alami dan telur yang dihasilkan sangat baik dengan derajat penetasan telur diatas 90 %. Kualitas air pada media perlakuan perendaman juga masih mendukung kehidupan larva ikan nila merah umur 1 hari setelah menetas. Begitu juga kualitas air media pemeliharaan pada awal penebaran di hapa dalam kolam pemeliharaan hingga akhir penelitian masih dalam toleransi ikan nila merah. Ikan nila merah mengalami pertumbuhan yang baik dalam pertumbuhan bobot dan panjang rata-rata. Suhu air kolam yang relatif tinggi selama waktu pemeliharaan di hapa yaitu antara 28-33oC, namun masih di dalam batas ambang toleransi ikan nila merah.
3.2 Pembahasan
Pemberian aromatase inhibitor telah terbukti mempengaruhi persentase jenis kelamin jantan pada ikan nila merah, yang dapat dilihat dari peningkatan persentase jenis kelamin jantan sebesar 36,98 % yaitu dari kontrol negatif sebesar 59,9 % menjadi 96,88 % pada perlakuan AI 75 mg/l. Pemberian aromatase inhibitor juga telah terbukti pada penelitian yang dilakukan oleh Kwon (2000) yang diberikan melalui pakan yang dicampur dengan aromatase inhibitor jenis fadrozole dengan dosis 500 mg/kg pakan dengan hasil jenis kelamin jantan sebesar 96 %. Hasil peneliian Kwon (2000) hampir sama dengan hasil yang diperoleh pada penelitian ini yang menghasilkan ikan nila merah berkelamin jantan sebesar 96,88 % dengan dosis aromatase inhibitor jenis imidazole 75 mg/l. Selanjutnya adalah penelitian yang dilakukan oleh Nurlaela (2002) melalui perendaman embrio dengan aromatase inhibitor jenis imidazole dengan dosis 20 mg/l selama 10 jam pada fase bintik mata yang menghasilkan jenis kelamin jantan ikan nila merah sebesar 82,2 %. Keberhasilan diferensiasi kelamin melalui penghambatan enzim aromatase dengan aromatase inhibitor dipengaruhi oleh dosis, lama perlakuan dan waktu perlakuan (Brodie, 1991). Selain itu faktor lingkungan juga mempengaruhi keberhasilan diferensiasi kelamin. Keberhasilan maskulinisasi ikan nila merah pada penggunaan aromatase inhibitor dengan dosis 25 mg/l, 50 mg/l, dan 75 mg/l melalui perendaman larva umur satu hari setelah menetas telah melebihi persentase diatas 95 %.
Jenis kelamin ikan secara genetik telah ditentukan pada saat terjadinya pembuahan (Matty, 1985) dan ditentukan oleh faktor lingkungan dan genetik Yatim (1986). Namun gonad ikan yang baru menetas belum terdeferensiasi menjadi jantan atau betina (Junior, 2002). Apabila faktor jantan lebih dominan dari faktor betina maka zigot akan berkembang menjadi jantan, demikian pula sebaliknya (Yamamoto, 1969). Proses determinasi dan diferensiasi seks pada ikan sangat labil dan memungkinkan untuk dimanipulasi secara ploidi, menggunakan hormon, kejutan suhu, dan faktor lingkungan lainnya (Pandian dan Sheela, 1995). Proses diferensiasi sangat dipengaruhi oleh faktor genetik dan lingkungan. Pada kondisi normal tanpa adanya gangguan, perkembangan gonad akan terjadi secara normal. Akan tetapi, apabila ada intervensi dari luar dengan bahan tertentu seperti hormon, maka perkembangan gonad dapat berlangsung berlawanan dari yang seharusnya (Junior, 2002).
Lama waktu pemberian berbagai dosis aromatase inhibitor dan MT dalam penelitian ini masih sesuai dalam mempengaruhi terbentuknya kelamin jantan. Hasil penelitian menunjukkan bahwa persentase jenis kelamin jantan pada perlakuan AI 0 mg/l (kontrol negatif) sebesar 59,9 %, perlakuan MT 5 mg/l (kontrol positif) sebesar 96,55%, dan perlakuan AI 25 mg/l, 50 mg/l, dan 75 mg/l antara 95,53% sampai dengan 96,88%. Hasil analisis statistik persentase jenis kelamin jantan menunjukkan perbedaan yang signifikan antara perlakuan AI 75 mg/l dan MT 5 mg/l (kontrol positif) terhadap perlakuan AI 0 mg/l (kontrol negatif) pada taraf kepercayaan 95%, dan tidak terdapat perbedaan yang signifikan antara perlakuan AI 25 mg/l, 50 mg/l, 75 mg/l, dan MT 5 mg/l (kontrol positif). Hasil ini menerangkan bahwa pemberian aromatase inhibitor dengan dosis 25 mg/l, 50 mg/l, 75 mg/l, dan hormon MT 5 mg/l (kontrol positif) pada penelitian ini memberikan pengaruh yang siginifikan terhadap pembentukan jenis kelamin jantan ikan nila merah (P>0,05).
Dengan pemberian aromatase inhibitor pada masa diferensiasi kelamin ikan nila merah, maka akan mempengaruhi jenis kelamin ikan melalui lingkungan menjadi kelamin jantan secara fenotipe. Pemberian aromatase inhibitor pada saat ikan nila merah berumur 1 hari setelah menetas dirasa sudah sangat tepat, yang dilihat dari hasil persentase jantan yang lebih dari 95 %.
Hal ini didukung oleh Kwon et al. (2000) yang menyatakan bahwa masa diferensiasi kelamin ikan nila merah berlangsung sampai dengan umur 30 hari setelah menetas. Sehingga jika pemberian aromatase inhibitor dengan dosis yang sama dengan penelitian ini yang dilakukan pada saat semakin mendekati akhir masa diferensiasi maka akan memberikan hasil yang kurang memuaskan atau bahkan tidak berpengaruh terhadap penghambatan enzim aromatase.
Hasil yang tidak berpengaruh ini disebabkan oleh adanya aktivitas enzim aromatase yang semakin mendekati masa akhir diferensiasi kelamin semakin meningkat dan jumlahnya yang semakin banyak. Dengan meningkatnya aktivitas dan jumlah dari enzim aromatase, maka akan membutuhkan aromatase inhibitor yang lebih banyak daripada pemberian yang dilakukan pada saat umur ikan 1 hari setelah menetas.
Ikan nila merah yang genotipenya betina kemudian diberi aromatase inhibitor akan menjadi ikan nila merah jantan tanpa mengubah genotipe aslinya sehingga hanya terjadi perubahan fungsional betina menjadi jantan seperti tingkah laku, dan ciri kelamin sekunder atau terjadi maskulinisasi ciri penampakan seksual sekunder. Pemberian aromatase inhibitor akan mengakibatkan konsentrasi enzim aromatase semakin menurun sehingga terjadi penurunan rasio estrogen terhadap androgen. Penurunan rasio estrogen terhadap androgen mengakibatkan terjadinya perubahan penampakan hormonal dari betina menjadi menyerupai jantan atau dengan kata lain terjadi maskulinisasi karakteristik seksual sekunder (Davis et al., 1999).
Aromatase inhibitor dapat masuk ke dalam tubuh larva umur 1 hari setelah menetas diduga melalui proses perpindahan zat dari konsentrasi yang lebih tinggi menuju konsentrasi yang lebih rendah atau melalui proses difusi. Seperti halnya hormon 17α-metiltestosteron, aromatase inhibitor diduga masuk ke dalam plasma melalui membran sel secara difusi (Misnawati, 1997). Diduga aromatase inhibitor masuk ke dalam sel berhubungan dengan sisi aktif dari enzim dan mengikatnya sehingga sisi aktif tersebut tidak ditempati oleh substrat alaminya (Brodie, 1991). Oleh karena itu waktu untuk perlakuan aromatase inhibitor harus tepat.
Pemberian aromatase inhibitor melalui perendaman memberikan pengaruh terhadap pembentukan jenis kelamin melalui dua cara. Pertama, bahan ini menghambat proses transkripsi dari gen-gen aromatase sehingga mRNA tidak terbentuk dan sebagai konsekuensinya enzim aromatase tidak ada (Server, 1999) atau melalui cara bersaing dengan substrat alami (testosteron) sehingga aktivitas aromatase tidak berjalan (Brodie, 1991). Penghambatan ini dapat mengakibatkan terjadinya penurunan konsentrasi estrogen yang mengarah pada tidak aktifnya transkripsi dari gen aromatase sebagai feedback-nya (Sever, 1999).
Dengan membudidayakan ikan monoseks akan didapatkan berbagai manfaat antara lain mendapatkan ikan dengan pertumbuhan yang cepat dan mencegah pemijahan liar (Junior, 2002). Dalam budidaya ikan nila merah dengan sistem kelamin tunggal jantan (monoseks) jelas akan lebih menguntungkan. Dengan sistem ini akan menghindari adanya pemijahan liar pada suatu populasi ikan nila merah, sehingga energi yang dihasilkan akan digunakan seluruhnya untuk pertumbuhan secara maksimal. Pada budidaya ikan nila merah dengan sistem campuran (mix culture) akan terganggu dengan adanya pemijahan liar yang akan mengakibatkan terhambatnya pertumbuhan. Energi yang dihasilkan tidak digunakan untuk pertumbuhan secara maksimal melainkan untuk proses pematangan gonad dan memijah. Hal ini jelas akan menghambat pertumbuhan ikan nila merah. Pada ikan nila merah betina yang sudah memijah maka akan terganggu dalam proses pertumbuhannya. Hal ini disebabkan karena sifat dari ikan nila itu sendiri yaitu mengerami telurnya. Dalam proses pengeraman telur, ikan nila betina tidak makan sehingga energi yang dibutuhkan untuk metabolisme tubuh berkurang dan tidak digunakan untuk pertumbuhan melainkan untuk mengerami telur. Oleh karena itu bila membudidayakan ikan nila merah dengan sistem kelamin tunggal jantan akan lebih menguntungkan daripada budidaya ikan nila merah dengan sistem campuran (mix culture).
Derajat kelangsungan hidup merupakan salah satu hal yang sangat berpengaruh terhadap keberhasilan dan keberlanjutan suatu produksi akuakultur. Pemberian material dari luar sebagai pemacu baik untuk pertumbuhan atau manipulasi kelamin, secara langsung maupun tidak langsung dapat berpengaruh terhadap derajat kelangsungan hidup ikan.
Dalam penggunaan 17α-metiltestosteron dalam maskulinisasi ikan dengan dosis yang berlebihan akan mengakibatkan keabnormalan dan kematian ikan (Misnawati, 1997). Pada Tabel 3 menunjukkan bahwa derajat kelangsungan hidup pada akhir perlakuan menunjukkan hasil yang sangat baik yaitu lebih dari 95 %. Hasil analisis menunjukkan bahwa tidak ada perbedaan yang signifikan antara semua perlakuan AI dan kontrol (P>0,05). Sehingga penggunaan aromatase inhibitor sebagai pengganti MT terbukti cukup aman bagi ikan dan terutama manusia yang mana sifat dari aromatase inhibitor jenis imidazole ini tidak bersifat karsinogenik. Dari hasil analisis terbukti bahwa aromatase inhibitor yang diberikan melalui perendaman tidak memberikan pengaruh terhadap derajat kelangsungan hidup ikan. Hal ini sesuai dengan Kwon et al. (2000) yang menyatakan bahwa tidak ada hubungan statistik antara mortalitas dengan perlakuan pemberian aromatase inhibitor dan hormon 17α-metiltestosteron. Derajat kelangsungan hidup populasi ikan nila merah pada akhir penelitian secara umum cukup baik karena memiliki nilai lebih dari 98 %. Hasil analisis menunjukkan bahwa tidak terdapat perbedaan yang signifikan antara perlakuan AI 25 mg/l, 50 mg/l, dan 75 mg/l terhadap perlakuan MT 5 mg/l (kontrol positif) dan perlakuan AI 0 mg/l (kontrol negatif) (P>0,05).
Pada penelitian ini ikan mengalami petumbuhan bobot harian yang relatif sama dan mengalami pertumbuhan seiring dengan waktu pemeliharaan. Hal ini ditunjukkan dalam grafik pertumbuhan pada Gambar 2 yang berbentuk sigmoid yang artinya bahwa ikan mengalami pertumbuhan setiap harinya hingga akan mengalami pertumbuhan yang konstan pada waktu tertentu. Pada saat setelah perlakuan, belum memberikan pengaruh pada pertumbuhan ikan, karena ikan masih dalam proses diferensiasi kelamin. Setelah terjadi diferensiasi kelamin menjadi jantan maka terlihat pertumbuhan yang semakin meningkat. Hal ini terlihat dari hasil analisis ragam pada nilai bobot individu rata-rata akhir yang tinggi pada perlakuan AI 25 mg/l, 50 mg/l, dan 75 mg/l tidak berbeda signifikan terhadap perlakuan MT 5 mg/l (kontrol positif) (P>0,05). Untuk perlakuan AI 75 mg/l dan perlakuan MT 5 mg/l (kontrol positif) berbeda nyata dengan perlakuan AI 0 mg/l (kontrol negatif) (P<0,05). Namun perlakuan AI 25 mg/l dan 50 mg/l tidak berbeda signifikan terhadap perlakuan AI 0 mg/l (kontrol negatif) (P>0,05).
Laju pertumbuhan spsesifik yang tinggi terlihat pada perlakuan AI 25 mg/l, 50 mg/l, 75 mg/l, dan MT 5 mg/l (kontrol positif) bila dibandingkan dengan perlakuan AI 0 mg/l (kontrol negatif). Dari hasil analisis ragam diperoleh hasil yang berbeda secara signifikan antara perlakuan AI 75 mg/l maupun MT 5 mg/l (kontrol positif) terhadap perlakuan AI 0 mg/l (kontrol negatif). Namun antara perlakuan AI 25 mg/l, 50 mg/l, 75 ppm, dan MT (kontrol positif) tidak ada perbedaan yang signifikan (P>0,05).
Hal ini menunjukkan bahwa terdapat perbedaan bobot yang nyata antara populasi ikan nila yang direndam dengan AI 75 mg/l maupun MT 5 mg/l (kontrol positif) dengan AI 0 mg/l (kontrol negatif). Nisbah kelamin jantan yang berbeda nyata antara perlakuan AI 75 mg/l dan MT 5 mg/l (kontrol positif) dibandingkan dengan perlakuan AI 0 mg/l (kontrol negatif) diduga menjadi faktor penyebab terjadinya keadaan tersebut. Banyaknya jumlah individu benih yang berkelamin jantan pada populasi perlakuan AI 25 mg/l, 50 mg/l, 75 mg/l, dan MT 5 mg/l (kontrol positif) mempunyai laju pertumbuhan spesifik yang lebih cepat sehingga menyebabkan bobot individu rata-rata akhir populasi ini lebih tinggi dibandingkan dengan populasi perlakuan AI 0 mg/l (kontrol negatif) yang mempunyai individu berkelamin jantan lebih sedikit. Hal ini didukung oleh Popma dan Masser (1999) yang menyatakan bahwa ikan ini terdapat perbedaan kecepatan pertumbuhan antara ikan jantan dengan ikan betina dimana ikan nila jantan tumbuh dua kali lebih cepat dari ikan betina.
Pertumbuhan yang cepat ini juga didukung dengan parameter lingkungan seperti suhu air kolam yang menunjukkan nilai yang cukup tinggi. Hal ini dikarenakan pada masa pemeliharaan sedang berada dalam musim kemarau, dimana intensitas cahaya matahari yang diserap oleh air lebih banyak sehingga dapat meningkatkan suhu air pada siang hari. Dengan meningkatnya suhu maka metabolisme ikan juga akan meningkat, sehingga menyebabkan pakan yang diberikan lebih banyak dan menghasilkan pertumbuhan yang cepat meningkat dalam pertumbuhan bobot dan panjang. Selain itu, menurut D’Cotta et al. (2001), faktor lingkungan seperti suhu juga ikut mempengaruhi proses diferensiasi kelamin, dimana suhu tinggi dapat meningkatkan persentase ikan jantan. Sehingga dengan suhu tinggi ini juga mendukung proses maskulinisasi ikan nila merah.
Kualitas air media pemijahan induk ikan nila merah masih mendukung terjadinya pemijahan ikan nila merah secara alami dan menghasilkan telur yang sangat baik dengan derajat penetasan telur di atas 90 %. Begitu juga pada media perlakuan perendaman masih mendukung kehidupan larva ikan nila merah. Kualitas air kolam pemeliharaan pada umumnya masih layak untuk proses budidaya ikan nila merah, namun terdapat beberapa parameter saja yang kurang optimal seperti kadar amonia yang cukup tinggi namun masih dapat ditolerir oleh ikan nila merah dan tumbuh dengan baik hingga akhir penelitian.
Adanya hubungan yang tidak berbeda nyata antara perlakuan AI 25 mg/l dan 50 mg/l terhadap perlakuan AI 0 mg/l diduga karena masa pemeliharaan yang kurang lama sehingga pertumbuhan yang dihasilkan kurang terekspresikan. Menurut penelitian yang dilakukan di Universitas Wageningen terhadap pertumbuhan ikan nila (Rutten, 2005), perbedaan laju pertumbuhan antara ikan jantan dan betina ini baru terlihat setelah jangka waktu pemeliharaan 150 hari. Dengan semakin lamanya masa pemeliharaan yang dilakukan atau hingga pada proses pembesaran dengan ukuran konsumsi sekitar 200-250 g, diharapkan akan terlihat perbedaan pertumbuhan antara populasi ikan nila merah yang diberi aromatase inhibitor atau populasi ikan nila merah jantan lebih dari 95 % dengan populasi ikan nila merah normal atau campuran (mix culture).
Pada populasi ikan nila merah yang diberi aromatase inhibitor diduga akan terjadi pertumbuhan atau bobot akhir yang ingin dicapai akan akan lebih cepat sehingga waktu pemeliharaanya juga lebih cepat daripada populasi ikan nila merah normal atau campuran (mix culture). Dengan membudidayakan ikan nila merah kelamin tunggal jantan (monoseks) akan didapatkan berbagai manfaat antara lain mendapatkan ikan dengan pertumbuhan yang cepat, mencegah pemijahan liar, mendapatkan penampilan yang baik, dan menunjang genetika ikan (teknik pemurnian ras ikan) (Junior, 2002). Bila dikaitkan dengan proses produksi maka dengan pemeliharaan monoseks jantan ikan nila merah akan mempercepat waktu produksi dalam suatu proses pembesaran ikan nila merah. Dengan semakin cepat waktu produksi suatu siklus pembesaran maka akan menekan biaya produksi, sehingga lebih efisien dalam segi waktu dan biaya serta dapat mempercepat perputaran uang.
Bila dibandingkan dengan penelitian yang dilakukan oleh Kwon et al. (2000), dimana aromatase inhibitor jenis fadrozole diberikan melalui pakan dengan dengan dosis 500 mg/kg pakan dengan hasil jenis kelamin jantan sangat tinggi yaitu sebesar 96 %, maka pemberian aromatase inhibitor dalam penelitian ini yang juga mendekati 96 % pada perlakuan AI 25 mg/l selain sama efektifnya dengan MT 5 mg/l juga akan terasa lebih efisien baik dalam segi waktu dan biaya. Bila melalui pakan maka akan menambah biaya dalam bahan aromatase inhibitor itu sendiri dan memerlukan waktu perlakuan yang lebih banyak. Dengan pemberian aromatase inhibitor melalui perendaman larva umur sehari setelah menetas akan lebih memudahkan para pelaku pembudidaya ikan nila merah dalam aplikasi sex reversal ikan nila merah. Aplikasi sex reversal melalui perendaman memerlukan dosis yang lebih sedikit dan hanya diberikan sekali pada saat umur larva 1 hari setelah menetas. Sedangkan aplikasi sex reversal melalui pakan buatan seperti yang dilakukan oleh Kwon et al. (2000) jelas akan membutuhkan dosis yang lebih banyak dan memerlukan lebih banyak waktu serta bahan dalam persiapan untuk bahan perlakuan aromatase inhibitor.
Dengan semakin meningkatnya dosis perlakuan maka juga akan meningkatkan biaya yang harus dikeluarkan dalam suatu proses produksi pada aplikasi sex reversal ikan nila merah. Oleh karena itu sex reversal melalui perendaman larva umur satu hari setelah menetas dirasa akan lebih efektif dan efisien dalam segi waktu dan biaya. Dari hasil penelitian ini dapat dikatakan bahwa aromatase inhibitor jenis imidazole merupakan salah satu bahan alternatif yang cocok dan dapat digunakan sebagai pengganti hormon 17α-metiltestosteron dalam aplikasi sex reversal ikan nila merah serta usaha produksi populasi monoseks jantan ikan nila merah. Dosis AI 25 mg/l melalui perendaman merupakan metode yang paling efektif dan efisien dalam waktu dan biaya untuk menggantikan penggunaan hormon 17α-metiltestosteron. Dilihat dari segi ekonomi, semakin kecil dosis yang dipakai, maka biaya yang harus dikeluarkan juga akan semakin kecil.
Jika akan melakukan penelitian yang serupa, untuk memperoleh hasil pertumbuhan yang berbeda nyata, maka diperlukan penambahan waktu pemeliharaan ikan nila merah hingga umur ikan minimal 150 hari (Rutten, 2005).
V. KESIMPULAN DAN SARAN
5.1 Kesimpulan
Pemberian aromatase inhibitor khususnya imidazole dengan dosis 25 mg/l, 50 mg/l, dan 75 mg/l meningkatkan persentase jenis kelamin jantan ikan nila merah antara 95,53% sampai dengan 96,88% dan meningkatkan pertumbuhan antara 39,44 - 42,05 gram. Dosis aromatase inhibitor 25 mg/l, 50 mg/l, dan 75 mg/l efektif digunakan dalam sex reversal ikan nila merah dan sama efektifnya dengan 17α-metiltestosteron.
5.2 Saran
Aromatase inhibitor khususnya imidazole digunakan sebagai pengganti hormon 17α-metiltestosteron dengan dosis 25 mg/l dalam maskulinisasi ikan nila merah. Perlu dilakukan penelitian lanjutan dengan metode yang sama untuk dosis imidazole 5 mg/l, 10 mg/l, 15 mg/l, 20 mg/l, dan 25 mg/l.
DAFTAR PUSTAKA
Afonso, L. O. B., G. K. Iwarna, J. Smith, & E. M. Donaldson. 2000. Effects of the Aromatase Inhibitor Fadrozole on Reproductive Steroids and Spermiation in Male Coho Salmon (Onchorhynchus kisutch) During Sexual Maturation. Aquaculture. 188 : 175-187.
Anonim. 2006. Safety (MSDS) Data for Imidazole. http://physchem.ox.ac.uk/ MSDS/IM/imidazole.html. [12 September 2009].
Anonim. 2008. Ikan Nila Merah Semakin Bergairah. http://www.trobos.com/show_article.php?rid=4&aid=886.[24oktober 2009]. Astutik, E. D. 2004. Sex Reversal pada Ikan Nila Merah Oreochromis sp. melalui
Perendaman Larva dengan Aromatase Inhibitor. Skripsi. Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Bogor.
Barmudi, I. 2005. Efektivitas Aromatase Inhibitor terhadap Sex Reversal Ikan Nila Merah (Oreochromis sp.) dalam Suhu Media 33oC. Skripsi. Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Bogor.
Brodie, A. 1991. Aromatase and it’s Inhibitors an Overview. Journal Steroid Biochemical Molecular Biology. 40 No.1-3 : 225-261.
Contreras-Sanches, W.M. & M. S. Fitzpatrick. 2001. Fate of Methyltestosterone in Pond Environment : Impact of MT-Contaminates Soil on Tilapia Sex Differentiation.http://pdacrsp.oregonstate.edu/pubs/technical/18tchhtml/9E R2C.html. [24 Oktober 2009].
D’Cotta, H., A. Fostier, Y. Guiguen, M. Govoroun, & J.F. Baroiller. 2001. Aromatase Plays a Key Role During Normal and Temperature-Induced Sex Differentiation of Tilapia Oreochromis niloticus. Molecular Reproduction and Development. 59 : 265 - 276.
Davis, R. B., B. A. Simco, C. A. Groudie, N. C. Parker, W. Couldwell, & P. Snellgrove. 1990. Hormonal Sex Manipulation and Evidence for Female Homogamety on Channel Catfish. Genetic Component Endocrinology. 78 : 219-223.
Devlin, R. H. & Y. Nagahama. 2002. Sex Determination and Sex Diferrentiation in Fish: an Overview of Genetic, Physiological, and Environmental Influences. Aquaculture. 208 : 191-364.
Djariah, A.S. 1996. Nila Merah Pembenihan dan Pembesaran secara Intensif. Kanisius. Yogyakarta.
Durant, G. M., Maskur, & S. Hanif. 1995. Genetic Improvement of Red Tilapia Assessing the Potensial for Producing YY Male. Balai Budidaya Air Tawar, Direktorat Jenderal Perikanan, Departemen Pertanian.
Enny, P. T & Dadang W. L. 2009. Dicari Benih Sebar Nila Unggul. http://agrina-online.com/redesign2.php?rid=7&aid=1998. [10 Desember 2009].