SEX REVERSAL PADA IKAN NILA MERAH Oreochromis sp.
MELALUI PEMBERIAN PROPOLIS YANG DICAMPUR
DALAM PAKAN BUATAN
DEDI ANWAR SIPAYUNG
PROGRAM STUDI TEKNOLOGI DAN MANAJEMEN PERIKANAN BUDIDAYA DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul:
SEX REVERSAL PADA IKAN NILA MERAH Oreochromis sp. MELALUI
PEMBERIAN PROPOLIS YANG DICAMPUR DALAM PAKAN BUATAN
adalah benar merupakan karya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, April 2010
DEDI ANWAR SIPAYUNG C14053429
RINGKASAN
DEDI ANWAR SIPAYUNG. Sex Reversal pada Ikan Nila Merah Oreochromis
sp. Melalui Pemberian Propolis yang Dicampur dalam Pakan Buatan. Dibimbing oleh DINAR TRI SOELISTYOWATI dan KOMAR SUMANTADINATA.
Ikan nila merah Oreochromis sp. merupakan salah satu komoditas perikanan air tawar yang disukai masyarakat pembudidaya ikan. Dalam usaha budidaya ikan nila merah terdapat fenomena dimana laju pertumbuhan ikan jantan lebih tinggi dibandingkan dengan betina dan terlalu cepatnya ikan matang gonad (maturasi dini). Untuk mengatasi masalah tersebut, diperlukan benih monoseks jantan yaitu dengan metode sex reversal atau pengarahan kelamin. Hormon pemicu yang biasa digunakan adalah hormon steroid androgen berupa 17α-methyltestosteron yang kini sudah dilarang penggunaanya. Penggunaan bahan alami seperti propolis diharapkan dapat digunakan sebagai alternatif karena memiliki beberapa kelebihan, antara lain adalah mudah dalam penyiapan, aman untuk dikonsumsi, dan ramah lingkungan. Penelitian ini bertujuan untuk menentukan dosis propolis yang optimal untuk pengarahan kelamin jantan pada juvenil ikan nila merah melalui pencampuran dalam pakan buatan.
Penelitian ini dilaksanakan pada Juli – November 2009 bertempat di Departemen Budidaya Perairan FPIK IPB dan Loka Riset Pemuliaan dan Teknologi Budidaya Perikanan Air Tawar (LRPTBPAT) Sukamandi, Subang. Dosis propolis yang diujikan adalah 0,6 ml/kg, 1,2 ml/kg, 1,8 ml/kg, 2,4 ml/kg, dan 3,0 ml/kg, serta dosis 0 ml/kg sebagai kontrol. Pakan perlakuan dibuat dengan mencampurkan propolis sesuai dosis dalam pakan berbentuk tepung. Pakan perlakuan diberikan pada juvenil ikan nila merah selama 28 hari masa pemeliharaan di akuarium. Pasca perlakuan ikan dipelihara dalam hapa di kolam tanah selama 90 hari sampai jenis kelamin ikan sudah dapat dibedakan secara visual. Parameter penelitian yang diukur meliputi derajat kelangsungan hidup (SR), nisbah kelamin jantan, rasio konversi pakan (FCR), laju pertumbuhan harian (SGR), abnormalitas, dan kualitas air (suhu, pH, DO, dan amoniak). Rancangan percobaan yang digunakan dalam penelitian ini adalah Rancangan Acak Lengkap (RAL) dengan 6 perlakuan dan 4 ulangan. Data yang diperoleh dianalisis secara statistik menggunakan program SPSS versi 16 dan diuji lanjut dengan menggunakan Uji Duncan.
Perlakuan maskulinisasi dengan propolis meningkatkan nisbah kelamin jantan secara nyata dibanding perlakuan kontrol (tanpa propolis). Namun, antar perlakuan propolis tersebut tidak menunjukkan perbedaan yang nyata. Penggunaan propolis dalam pakan buatan sebagai bahan untuk pengarahan jenis kelamin jantan pada ikan nila merah efektif dengan tingkat keberhasilan 62.92±3.89 – 69.71±5.46 %, sedangkan pada kontrol 50.02±9.02 %. Pemberian propolis tidak mempengaruhi derajat kelangsungan hidup, abnormalitas, rasio konversi pakan, dan laju pertumbuhan harian.
SEX REVERSAL PADA IKAN NILA MERAH Oreochromis sp.
MELALUI PEMBERIAN PROPOLIS YANG DICAMPUR
DALAM PAKAN BUATAN
DEDI ANWAR SIPAYUNG
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Departemen Budidaya Perairan
Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR 2010
Judul Skripsi : Sex Reversal pada Ikan Nila Merah Oreochromis sp. Melalui Pemberian Propolis yang Dicampur dalam Pakan Buatan
Nama Mahasiswa : Dedi Anwar Sipayung
Nomor Pokok : C14053429
Program Studi : Teknologi dan Manajemen Perikanan Budidaya
Departemen : Budidaya Perairan
Disetujui, Komisi Pembimbing Pembimbing I
Dr. Dinar Tri Soelistyowati NIP. 196110161984032001
Pembimbing II
Prof. Dr. Komar Sumantadinata NIP. 194507191969021001
Diketahui,
Dekan Fakultas Perikanan dan Ilmu Kelautan
Prof. Dr. Indra Jaya NIP. 196104101986011002
KATA PENGANTAR
Puji syukur kehadirat Tuhan Yesus Kristus yang telah melimpahkan rahmat dan karunia-Nya sehingga skripsi ini dapat diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan pada Juli – November 2009 ini adalah pengembangbiakan dan genetika ikan, dengan judul “Sex Reversal pada Ikan
Nila Merah Oreochromis sp. Melalui Pemberian Propolis yang Dicampur dalam Pakan Buatan”.
Pada kesempatan ini, penulis mengucapkan terima kasih kepada:
1. Dr. Dinar Tri Soelistyowati selaku Pembimbing I sekaligus Pembimbing Akademik atas saran, bimbingan, nasihat serta dukungan selama perkuliahan dan penelitian.
2. Prof. Dr. Komar Sumantadinata selaku Pembimbing II sekaligus Kepala Laboratorium Pengembangbiakan dan Genetika Organisme Akuatik BDP atas bimbingan, nasihat dan dukungan selama penelitian.
3. Ir. Yani Hadiroseyani, MM selaku Dosen Penguji Tamu pada Ujian Akhir Skripsi atas masukan dan saran dalam perbaikan skripsi.
4. Ayah Alexius Sipayung, Ibu Bunga Ida Turnip, kakak Dewy Alfrida, Jackson Arnaldo, dan Hengky Boy, serta adik Nancy Bunga Putri atas kasih sayang, doa, serta dukungan baik moril maupun materil.
5. Dr. Alimuddin selaku Ketua Program Studi Teknologi dan Manajemen Perikanan Budidaya dan Dr. Odang Carman selaku Ketua Departemen Budidaya Perairan, serta para dosen dan staf pegawai Departemen Budidaya Perairan IPB.
6. Keluarga Besar Loka Riset Pemuliaan dan Teknologi Budidaya Perikanan Air Tawar (LRPTBPAT) Sukamandi Subang, terutama Tim Komoditas Ikan Nila 2009. Terima kasih atas bantuan, kerjasama, persahabatan, dan nasehat yang berarti bagi penulis.
7. Teman-teman BDP “aquaculture for better life”, A25 TPB „42, Astra C1-111, Marlin House, Villa Al-Boejang, Garong Community, Keluarga Mahasiswa Katholik IPB (KEMAKI), Gardu Tugu Futsal Club (GTFC) dan Yulia Triwijiwati. Terima kasih atas segala bantuan, dukungan, serta kebersamaan dan persahabatannya.
Penulis menyadari bahwa dalam penulisan skripsi ini masih terdapat kekurangan, untuk itu penulis memohon maaf. Penulis berharap semoga skripsi ini dapat bermanfaat sebagaimana mestinya.
Bogor, April 2010
Penulis
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan di Simalungun (Sumatra Utara), 7 Januari 1987 dari ayah Alexius Sipayung dan ibu Bunga Ida Turnip. Penulis merupakan anak keempat dari lima bersaudara. Pendidikan formal ditempuh penulis pada SDN 1 Terbanggi Subing, Lampung (1993-1999), SLTPN 6 Gunung Sugih, Lampung (1999-2002), dan SMUN 1 Terbanggi Besar, Lampung (2002-2005). Pada tahun 2005 penulis lulus seleksi masuk IPB melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB). Setelah satu tahun melalui program Tingkat Persiapan Bersama (TPB), penulis memilih mayor Teknologi dan Manajemen Perikanan Budidaya, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan dan minor Kewirausahaan Agribisnis, Departemen Agribisnis, Fakultas Ekonomi dan Manajemen.
Selama kuliah di IPB, penulis aktif dalam organisasi HIMAKUA (Himpunan Mahasiswa Akuakultur) sebagai Divisi Public Care Centre 2006/2007 dan Divisi Olahraga dan Seni 2007/2008. Penulis juga pernah menjadi asisten praktikum mata kuliah Dasar-dasar Genetika Ikan semester genap 2008/2009. Selain itu, penulis pernah mendapat bantuan pendanaan dalam Program Pengembangan Kewirausaahan Mahasiswa IPB 2009 dan Program Kreativitas Mahasiswa bidang Kewirausahaan DIKTI 2009.
Untuk memperdalam keahlian dalam bidang budidaya perairan, penulis melaksanakan berbagai magang dan praktek lapang. Diantaranya adalah magang di Johannes Fish Farm Ciseeng, Bogor pada 2006 dengan komoditas lobster air tawar Cherax quadricarinatus, magang di Balai Besar Budidaya Perikanan Air Payau Jepara, Jawa Tengah pada 2007 dengan komoditas polikultur (udang vaname, kerapu, rumput laut, ikan nila payau, dan kerang hijau), magang di Balai Budidaya Air Payau Situbondo, Jawa Timur pada 2008 dengan komoditas ikan kerapu bebek Cromileptes altivelis, dan Praktek Lapangan Akuakultur di PT. Tirtamutiara Makmur Situbondo, Jawa Timur pada 2008 dengan komoditas pembenihan udang vanname Litopenaeus vannamei. Tugas akhir di perguruan tinggi diselesaikan dengan menulis skripsi yang berjudul “Sex Reversal pada
Ikan Nila Merah Oreochromis sp. Melalui Pemberian Propolis yang Dicampur dalam Pakan Buatan”.
DAFTAR ISI
Halaman
KATA PENGANTAR ... v
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
I. PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan ... 2
II. TINJAUAN PUSTAKA ... 3
2.1 Biologi Ikan Nila Merah Oreochromis sp. ... 3
2.2 Determinasi Kelamin ... 4
2.3 Sex Reversal ... 5
2.4 Maskulinisasi dengan Propolis ... 7
III. BAHAN DAN METODE ... 9
3.1 Waktu dan Tempat ... 9
3.2 Metode ... 9
3.2.1 Persiapan Wadah Pemeliharaan ... 9
3.2.2 Pengadaan Ikan Uji ... 9
3.2.3 Penyiapan Pakan Perlakuan dengan Propolis ... 10
3.2.4 Percobaan Pendahuluan: Penentuan Dosis Propolis ... 11
3.2.5 Percobaan Utama: Perlakuan Maskulinisasi ... 11
3.2.6 Pengukuran Parameter Penelitian ... 12
3.3 Analisis Data ... 14
IV. HASIL DAN PEMBAHASAN ... 16
4.1 Hasil ... 16
4.1.1 Percobaan Pendahuluan ... 16
4.1.2 Percobaan Utama ... 17
4.1.2.1 Derajat Kelangsungan Hidup ... 17
4.1.2.2 Nisbah Kelamin Jantan ... 17
4.1.2.3 Abnormalitas ... 18
4.1.2.4 Rasio Konversi Pakan ... 19
4.1.2.5 Laju Pertumbuhan Spesifik ... 19
4.1.2.6 Parameter Kualitas Air ... 20
4.2 Pembahasan ... 20
V. KESIMPULAN DAN SARAN ... 24
5.1 Kesimpulan ... 24
5.2 Saran ... 24
DAFTAR PUSTAKA ... 25
DAFTAR TABEL
Halaman 1. Beberapa hasil penelitian mengenai sex reversal jantan
(maskulinisasi) pada ikan dan tingkat keberhasilannya ... 6 2. Parameter kualitas air dan waktu pengukuran ... 14 3. Kualitas air media pemeliharaan pada percobaan pendahuluan ... 16 4. Persentase ikan nila merah abnormal (%) pada perlakuan
maskulinisasi dengan propolis ... 18 5. Kualitas air pemeliharaan ikan nila merah di akuarium pada
DAFTAR GAMBAR
Halaman 1. Morfologi ikan nila merah Oreochromis sp. ... 3 2. Wadah pemeliharaan juvenil ikan nila merah selama perlakuan
dalam akuarium dan wadah pembesaran pasca perlakuan dalam
hapa di kolam tanah ... 9 3. Larva ikan nila merah berumur 5 hari ... 10 4. Pakan perlakuan berbentuk tepung dan pakan pasca perlakuan
berbentuk pellet ... 10 5. Derajat kelangsungan hidup (%) juvenil ikan nila merah pada
percobaan pendahuluan ... 16 6. Derajat kelangsungan hidup (%) juvenil ikan nila merah pada
perlakuan dan pasca perlakuan maskulinisasi dengan propolis ... 17 7. Nisbah kelamin jantan (%) ikan nila merah pada perlakuan
maskulinisasi dengan propolis ... 18 8. Ikan nila merah dengan mulut normal dan abnormal ... 19 9. Rasio konversi pakan ikan nila merah pada perlakuan
maskulinisasi dengan propolis ... 19 10. Laju pertumbuhan spesifik (%) ikan nila merah pada perlakuan
DAFTAR LAMPIRAN
Halaman 1. Skema penyiapan pakan perlakuan dengan propolis ... 29 2. Ikan nila Oreochromis sp. ... 30 3. Analisis data derajat kelangsungan hidup (%) juvenil ikan nila
merah pada penelitian pendahuluan ... 31 4. Analisis data derajat kelangsungan hidup (%) juvenil ikan nila
merah pada perlakuan maskulinisasi dengan propolis ... 32 5. Analisis data derajat kelangsungan hidup (%) ikan nila merah
pasca perlakuan maskulinisasi dengan propolis ... 33 6. Analisis data nisbah kelamin jantan (%) ikan nila merah pada
perlakuan maskulinisasi dengan propolis ... 34 7. Analisis data persentase abnormalitas (%) ikan nila merah pada
perlakuan maskulinisasi dengan propolis ... 35 8. Analisis data rasio konversi pakan ikan nila merah pada perlakuan
maskulinisasi dengan propolis ... 36 9. Analisis data laju pertumbuhan spesifik (%) ikan nila merah pada
perlakuan maskulinisasi dengan propolis ... 37 10. Data suhu harian selama perlakuan maskulinisasi ikan nila merah
dengan propolis ... 38 11. Data DO (mg/L) selama perlakuan maskulinisasi ikan nila merah
dengan propolis ...
39
12. Data pH dan NH3 (mg/L) selama perlakuan maskulinisasi ikan
nila merah dengan propolis ...
40
13. Data biomass (gram) dan jumlah pakan (gram) per sampling pada pemeliharaan pasca perlakuan maskulinisasi ikan nila merah
I. PENDAHULUAN
1.1 Latar Belakang
Ikan nila merah Oreochromis sp. merupakan salah satu komoditas ikan konsumsi air tawar unggulan dan bernilai ekonomis penting. Ikan ini disukai masyarakat karena dagingnya yang putih gempal dan warna tubuh yang menarik. Nila merah menjadi semakin populer karena penampilannya yang mirip dengan ikan kakap merah, sehingga nilainya di pasar lebih tinggi dibanding nila hitam pada umumnya. Sama seperti ikan nila lainnya, nila merah juga memiliki kelebihan yaitu pertumbuhan relatif cepat dan pemeliharaanya yang mudah karena memiliki toleransi yang cukup lebar terhadap lingkungan yang buruk (Popma dan Masser, 1999).
Dalam usaha budidaya ikan nila merah terdapat beberapa fenomena yang kerap dihadapi oleh para pembudidaya, yaitu laju pertumbuhan ikan jantan lebih tinggi dibandingkan dengan betina dan terlalu cepatnya ikan matang gonad (maturasi dini). Maturasi dini menyebabkan pertumbuhan ikan menjadi terhambat karena energi tidak hanya digunakan untuk pertumbuhan tetapi juga untuk perkembangan organ reproduksinya. Selain itu, matang gonad yang terlalu cepat menyebabkan terjadinya peningkatan kepadatan populasi yang tidak rasional karena adanya reproduksi yang tidak dikehendaki. Sistem budidaya monoseks jantan, yaitu pemeliharaan ikan nila berjenis kelamin jantan saja menjadi alternatif yang menguntungkan karena dapat menghindari maturasi dini dan meningkatkan efisiensi.
Beberapa teknik yang telah dilakukan untuk memproduksi ikan nila monoseks jantan adalah sexing manual (memisahkan secara manual jenis kelamin berdasarkan pemeriksaan visual papila genital dari ikan juvenil), persilangan antara dua spesies yang dipilih menghasilkan keturunan jantan semua, manipulasi genetik, dan sex reversal melalui pemberian hormon kelamin (Phelps dan Popma, 2000). Teknik yang telah umum dilakukan adalah dengan sex reversal dengan menggunakan hormon pemicu yaitu hormon steroid androgen berupa 17α-methyltestosterone (Arfah, 1997; Djaelani, 2007; Utomo, 2008). Namun, penggunaan hormon tersebut kini telah diketahui mempunyai beberapa
kelemahan, antara lain diduga dapat menyebabkan kanker atau bersifat karsinogenik pada manusia dan tidak ramah lingkungan (Utomo, 2008).
Bahan lain yang dianggap lebih aman sebagai perangsang hormonal untuk sex reversal (pengarahan kelamin) jantan diantaranya berasal dari bahan-bahan alami, yaitu madu dan propolis (Djaelani, 2007; Sukmara, 2007; Ukhroy, 2008). Penggunaan bahan alami memiliki beberapa kelebihan, antara lain aman untuk dikonsumsi, harga relatif murah, dan ramah lingkungan. Propolis dapat diberikan kepada juvenil ikan nila dengan cara mencampurkannya pada pakan buatan. Pemberian propolis melalui pencampuran dalam pakan dipilih karena sederhana dan mudah dalam penyiapannya.
1.2 Tujuan
Penelitian ini bertujuan untuk menentukan dosis propolis yang optimal untuk pengarahan kelamin jantan pada juvenil ikan nila merah melalui pencampuran dalam pakan buatan.
II. TINJAUAN PUSTAKA
2.1 Biologi Ikan Nila Merah Oreochromis sp.
Ikan nila merah pertama kali didatangkan ke Indonesia pada tahun 1981 oleh Balai Penelitian Perikanan Air Tawar di Bogor. Ikan ini pertama kali diproduksi di Taiwan pada akhir 1960-an, yaitu melalui persilangan antara nila Mozambik (O. mossambicus) betina berwarna kemerahan dengan nila Nil (O. niloticus) jantan berwarna normal. Strain lain nila merah dikembangkan di Florida pada 1970-an melalui persilangan nila Zanzibar (O. urolepis hornorum) betina berwarna normal dengan nila Mozambik (O. mossambicus) jantan berwarna merah keemasan. Strain ketiga nila merah dikembangkan di Israel dari nila Nil (O. niloticus) disilangkan dengan nila biru (O. aureus) yang masih liar (Popma dan Masser, 1999).
Ikan nila merah Oreochromis sp. (Gambar 1) merupakan hasil persilangan antara ikan nila O. mozambicus dengan ikan nila O. niloticus. Klasifikasi ikan nila merah adalah sebagai berikut (Romana-Eguia et al., 2004):
Kingdom : Animalia Filum : Pisces Ordo : Perchomorphi Famili : Cichlidae Genus : Oreochromis Spesies : Oreochromis sp.
Bentuk tubuh ikan nila merah pipih dengan sirip punggung yang tajam. Intensitas warna dipengaruhi oleh asal induk, tingkat kematangan gonad, dan sumber pakan. Warna dominan tubuh ikan nila merah adalah merah menyala. Struktur papila urogenital ikan nila merah menunjukkan jenis kelaminnya. Ikan jantan memiliki dua lubang kecil dan sempit di bawah perutnya yaitu anus dan urogenital, sedangkan betina memiliki tiga lubang, yaitu anus, lubang genital dan muara ureter. Anus dapat mudah dibedakan karena bentuknya bundar (Popma dan Masser, 1999).
Pada ikan nila merah, pejantan membuat sarang di dasar kolam, umumnya pada kedalaman air yang kurang dari 2 m dan dipasangkan dengan beberapa induk betina. Ikan nila termasuk kelompok mouth breeder dimana telur dibuahi pada substrat yang kemudian segera diambil oleh induk betina untuk diinkubasi hingga beberapa hari setelah menetas didalam mulutnya (Popma dan Masser, 1999).
Ikan nila merah lebih memiliki toleransi yang tinggi terhadap kondisi lingkungan yang buruk dibandingkan ikan air tawar lainnya. Ikan ini tahan terhadap kisaran salinitas yang tinggi (euryhaline), kisaran suhu yang tinggi (thermohaline), oksigen terlarut rendah, dan konsentrasi amonia tinggi. Kisaran kualitas air yang optimal untuk pemeliharaan ikan nila merah, yaitu suhu 29,4 – 31,1 oC, DO >2,0 mg/L, pH 6,0 – 9,0, dan NH3 < 0,2 mg/L. Sedangkan kualitas air
yang mematikan adalah suhu <18,3 oC dan >42,0 oC, DO <0,3 mg/L, pH <5,0 dan >10,0 serta NH3 >0,6 mg/L (Popma dan Masser, 1999).
2.2 Determinasi Kelamin
Jenis kelamin ditentukan oleh proses genetis dan dipengaruhi oleh faktor lingkungan yang mengarahkan perkembangan gonad pada masa diferensiasi kelamin. Diferensiasi kelamin adalah proses perwujudan fisik (morfologi, molekular, dan fisiologi) yang berkaitan dengan perkembangan testis atau ovari serta perbedaan seksual dari otak dan kelenjar pituitari (Devlin dan Nagahama, 2002). Dengan demikian, hal-hal yang menentukan suatu individu ikan untuk berkembang menjadi jenis kelamin jantan atau betina adalah faktor-faktor biologis yang berhubungan dengan gonad dan fungsi otak pada ikan jantan atau betina.
Proses penentuan jenis kelamin pada ikan sangat fleksibel karena lingkungan, perilaku, dan faktor fisiologi dapat mengarahkan perubahan pada perkembangan sel somatik maupun germinal (Devlin dan Nagahama, 2002). Secara genotipik, jenis kelamin ditentukan oleh persatuan kromosom kelamin jantan dan betina. Namun, secara fenotipik perkembangan kelamin jantan atau betina dipengaruhi oleh faktor lingkungan selama masa diferensiasi kelamin.
Diferensiasi kelamin pada ikan nila terjadi mulai umur 7 hari pasca menetas dan masa diferensiasi berlangsung sampai umur 37 hari setelah menetas. Suatu individu akan menjadi jantan atau betina tergantung ada tidaknya hormon testosteron pada awal perkembangannya. Bila ada testosteron maka gonad akan berdiferensiasi menjadi jantan, sebaliknya akan menjadi betina jika tidak ada testosteron (Kwon et al., 2000).
Mekanisme diferensiasi kelamin berawal dari adanya sintesa hormon steroid seiring dengan kondisi lingkungannya. Perubahan lingkungan yang terjadi akan diterima oleh indra, lalu disampaikan ke sistem syaraf pusat, setelah itu dikirim ke hipotalamus yang kemudian memerintahkan kelenjar hipofisa untuk mengeluarkan atau melepaskan hormon gonadatropin. Hormon gonadotropin ini masuk ke dalam darah dan dibawa ke gonad sebagai suatu petunjuk untuk memulai pembentukan gonad (Devlin dan Nagahama, 2002).
2.3 Sex Reversal
Secara harfiah, sex reversal dapat diartikan sebagai suatu teknologi pembalikan kelamin secara fenotipik, yaitu ikan yang berkelamin jantan secara genotipik diarahkan perkembangan gonadnya menjadi betina dan sebaliknya. Sex reversal secara buatan bisa dilakukan karena pada waktu menetas gonad ikan belum berdiferensiasi menjadi jantan atau betina. Dengan teknik sex reversal, fenotip ikan dapat berubah, tetapi genotipnya tidak berubah (Zairin, 2002).
Keberhasilan sex reversal buatan dipengaruhi oleh ketepatan
memanipulasi faktor lingkungan terhadap produksi steroid yang dikehendaki pada saat yang tepat sebelum masa diferensiasi berakhir. Metode pengarahan kelamin secara buatan dapat dilakukan dengan menambahkan hormon steroid sebagai perangsang. Misalnya, perlakuan eksogenous androgen bisa menyebabkan efek
jantan (maskulinisasi) sedangkan eksogenous estrogen menyebabkan efek betina (feminisasi). Tipe androgen yang telah banyak digunakan adalah metiltestosteron (17 -methyltestosterone) yang diketahui cukup stabil dan efektif diberikan secara oral (Yamazaki, 1983).
Beberapa penelitian sebelumnya menunjukkan bahwa pemberian hormon 17 -methyltestosterone mampu mempengaruhi perkembangan gonad kearah jantan pada beberapa jenis ikan. Hormon ini telah terbukti mampu menghasilkan 100 % jantan (50 mg/kg pakan) dan 98 % jantan (60 mg/kg pakan) pada ikan nila yang diberikan secara oral melalui pencampuran dalam pakan buatan (Zairin, 2002).
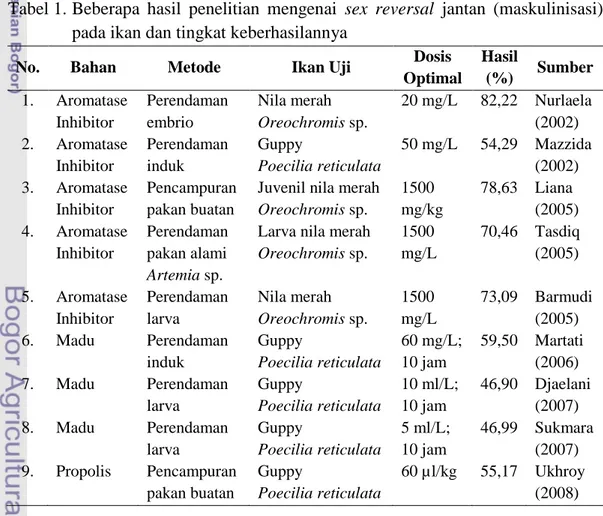
Efektivitas perubahan kelamin secara buatan sangat ditentukan oleh jenis ikan dan umurnya saat diberi perlakuan, bahan aktif steroid dan dosisnya, serta lama dan cara pemberiannya (Zairin, 2002). Beberapa jenis ikan, baik konsumsi maupun hias, telah berhasil diproduksi dengan teknologi sex reversal (Tabel 1). Tabel 1. Beberapa hasil penelitian mengenai sex reversal jantan (maskulinisasi)
pada ikan dan tingkat keberhasilannya
No. Bahan Metode Ikan Uji Dosis
Optimal Hasil (%) Sumber 1. Aromatase Inhibitor Perendaman embrio Nila merah Oreochromis sp. 20 mg/L 82,22 Nurlaela (2002) 2. Aromatase Inhibitor Perendaman induk Guppy Poecilia reticulata 50 mg/L 54,29 Mazzida (2002) 3. Aromatase Inhibitor Pencampuran pakan buatan
Juvenil nila merah Oreochromis sp. 1500 mg/kg 78,63 Liana (2005) 4. Aromatase Inhibitor Perendaman pakan alami Artemia sp.
Larva nila merah Oreochromis sp. 1500 mg/L 70,46 Tasdiq (2005) 5. Aromatase Inhibitor Perendaman larva Nila merah Oreochromis sp. 1500 mg/L 73,09 Barmudi (2005) 6. Madu Perendaman induk Guppy Poecilia reticulata 60 mg/L; 10 jam 59,50 Martati (2006) 7. Madu Perendaman larva Guppy Poecilia reticulata 10 ml/L; 10 jam 46,90 Djaelani (2007) 8. Madu Perendaman larva Guppy Poecilia reticulata 5 ml/L; 10 jam 46,99 Sukmara (2007) 9. Propolis Pencampuran pakan buatan Guppy Poecilia reticulata 60 µl/kg 55,17 Ukhroy (2008)
Pada ikan nila merah (Tabel 1), keberhasilan sex reversal tertinggi diperoleh dengan teknik perendaman embrio menggunakan bahan sintetis aromatase inhibitor (Nurlaela, 2002). Sedangkan pada ikan guppy, teknik perendaman induk dengan bahan alami madu menghasilkan nisbah kelamin jantan mendekati 60 %, demikian pula pada penggunaan propolis dengan teknik pencampuran dalam pakan (55,17 %). Keberhasilan sex reversal masih bisa ditingkatkan, terutama pada penggunaan bahan alami yang lebih aman bagi ikan dan lingkungan.
2.4 Maskulinisasi dengan Propolis
Propolis adalah sejenis balsam yang dikumpulkan oleh lebah dari tunas dan daun dari berbagai tanaman. Lebah membuat campuran balsam ini dengan bahan turunan dari pollen dan beberapa tipe enzim yang aktif yang tersimpan dalam kelenjar di bagian kepala dan thorax (Kartal et al., 2002).
Komposisi propolis terdiri dari 55 % balsam, 7,5 – 35,0 % wax (lilin), 10 % volatil oil, 5 % pollen, 5 % asam lemak, serta 4,4 – 19,0 % terpen, tanin dan bahan lainnya. Propolis sangat kaya dengan lemak, asam amino, asam organik, campuran univalen alkohol, dan trace element seperti natrium, kalium, besi, tembaga, mangan, seng, asam tannic, phyroncides, dan antibiotik. Selain itu, propolis mengandung vitamin B, vitamin E (5 – 10 %), vitamin C, dan provitamin A. Bahan aktif yang diisolasi dari propolis adalah flavonol, flavon (flavonoid), dan berbagai phenol serta aromatik. Dalam flavon inilah terdapat chrysin yang diduga berpengaruh terhadap sex reversal (Greenaway et al., 1990).
Chrysin yang memiliki struktur kimia 5,7-dihidroxyflavon merupakan salah satu jenis flavonoid yang diakui sebagai salah satu penghambat dari aromatase atau lazim disebut aromatase inhibitor (Dean, 2004). Aromatase merupakan enzim P-450 yang mengubah androgen menjadi estrogen. Aktivitas aromatase terletak di dalam otak yang berpengaruh terhadap pengendalian tingkah laku serta terjadi pada ovari yang berpengaruh tehadap maturasi folikel dan tingkat ovulasi (Silverin et al., 2000).
Aktivitas aromatase berkorelasi dengan struktur gonad. Aktivitas aromatase yang tinggi akan mengarah pada pembentukan ovari (Scholz dan
Gutzeit, 2000). Aromatase inhibitor berfungsi untuk menghambat kerja aromatase dalam sintesis estrogen, sehingga terjadi penurunan konsentrasi estrogen atau tidak aktifnya transkripsi dari gen aromatase sebagai feedback-nya (Sever et al., 1999). Aromatase inhibitor bekerja dengan mekanisme menghambat proses transkripsi gen-gen aromatase sehingga mRNA tidak terbentuk dan enzim aromatase tidak ada, juga bersaing dengan substrat alami (testosteron) sehingga aktivitas aromatase tidak berjalan (Brodie et al., 1999). Penurunan rasio estrogen terhadap androgen menyebabkan terjadinya perubahan penampakan dari ikan betina menjadi menyerupai ikan jantan atau terjadi maskulinisasi karakteristik seksual sekunder (Davis et al., 1999).
Percobaan maskulinisasi dengan propolis (60 µl/kg pakan) pada ikan guppy melalui pencampuran dalam pakan buatan (Ukhroy, 2008) dapat meningkatkan nisbah kelamin jantan hingga 55,17 %, sedangkan pada kontrol hanya 24,30 %. Pada ikan yang menyukai pakan alami, pemberian propolis dapat dilakukan dengan teknik bioenkapsulasi selama masa diferensiasi gonad. Perubahan kelamin dapat terjadi secara sempurna apabila dosis optimum yang harus diberikan bisa ditentukan dan tepat bersamaan dengan waktu terjadinya diferensiasi kelamin alami.
III. BAHAN DAN METODE
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Juli – November 2009 bertempat di Kolam Percobaan Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor selama masa perlakuan dan di kolam pembesaran Loka Riset Pemuliaan dan Teknologi Budidaya Perikanan Air Tawar (LRPTBPAT) Sukamandi, Subang selama pemeliharaan pasca perlakuan.
3.2 Metode
3.2.1 Persiapan Wadah Pemeliharaan
Wadah untuk pemeliharaan ikan pada masa perlakuan (28 hari) adalah akuarium berukuran 95,5 cm x 53,5 cm x 54,5 cm (Gambar 2, kiri). Sedangkan untuk pembesaran menggunakan hapa berukuran 2 m x 2 m x 1 m di kolam tanah berukuran 20 m x 10 m (Gambar 2, kanan). Untuk menyuplai oksigen, akuarium dilengkapi dengan aerasi sedangkan kolam tanah dilengkapi inlet dan outlet. Ikan dipelihara dalam hapa mulai umur 35 hari hingga mencapai ukuran panen.
Gambar 2. Wadah pemeliharaan juvenil ikan nila merah selama perlakuan dalam akuarium (kiri) dan wadah pembesaran pasca perlakuan dalam hapa di kolam tanah (kanan)
3.2.2 Pengadaan Ikan Uji
Ikan uji yang digunakan pada penelitian ini adalah larva ikan nila merah (Oreochromis sp.) berumur 5 hari setelah menetas dan masih memiliki kuning telur, hasil pemijahan alami dari Balai Besar Pengembangan Budidaya Air Tawar
(BBPBAT) Sukabumi, Jawa Barat (Gambar 3). Sebelum diberikan perlakuan, larva diaklimatisasi dalam akuarium selama 2 hari. Pada umur 7 hari setelah menetas ini kuning telur telah habis terserap atau disebut stadia juvenil. Setiap perlakuan terdiri dari 4 ulangan dengan padat tebar masing-masing adalah 200 ekor. Perlakuan diberikan pada juvenil dan berlangsung selama 28 hari.
Gambar 3. Larva ikan nila merah berumur 5 hari
3.2.3 Penyiapan Pakan Perlakuan dengan Propolis
Propolis yang digunakan adalah propolis komersil yang mengandung ekstrak propolis sebesar 20 %. Pakan perlakuan yang digunakan adalah pakan komersil berbentuk tepung dengan kandungan protein 40 % (Gambar 4, kiri). Sedangkan pakan untuk benih ikan pasca perlakuan (pembesaran) adalah pakan komersil berbentuk pellet dengan kandungan protein 38 % (Gambar 4, kanan).
Gambar 4. Pakan perlakuan berbentuk tepung (kiri) dan pakan pasca perlakuan berbentuk pellet (kanan)
Pakan perlakuan dibuat dengan mencampurkan propolis dalam pakan komersil berbentuk tepung secara penyemprotan (Lampiran 1). Pakan ditimbang untuk setiap perlakuan sebanyak 250 gram. Alkohol (70%) dimasukkan ke dalam botol penyemprot sebanyak 250 ml/kg pakan yang digunakan, sehingga untuk setiap perlakuan membutuhkan 62,5 ml alkohol. Propolis lalu dimasukkan dalam botol penyemprot (sprayer) sesuai dengan dosis yang digunakan. Campuran propolis dan alkohol dihomogenkan dengan menggunakan vortex. Larutan lalu disemprot merata ke atas pakan yang telah diletakkan di baki/nampan sambil diaduk hingga merata. Pakan dibiarkan hingga kering udara selama 1-2 jam, dan siap diberikan pada juvenil ikan nila merah.
3.2.4 Percobaan Pendahuluan: Penentuan Dosis Propolis
Percobaan pendahuluan ini dilakukan untuk mengetahui dosis propolis tertinggi yang masih dapat ditolerir oleh juvenil ikan nila. Pada percobaan ini, juvenil ikan nila merah sebanyak 50 ekor dipelihara dalam akuarium berukuran 30 cm x 20 cm x 20 cm, dan diberi pakan berbentuk tepung yang telah dicampur propolis dengan dosis 1,0 ml, 2,0 ml, dan 3,0 ml per kg pakan. Parameter yang diamati pada percobaan pendahuluan adalah kelangsungan hidup dan kualitas air.
Dosis propolis terendah yang diujikan saat perlakuan adalah 0,6 ml/kg. Selanjutnya, dosis ditentukan dengan kelipatan dosis terendah hingga tertinggi saat pengujian lethal dosis yaitu 3,0 ml/kg, sehingga dosis propolis yang diujikan adalah 0,6 ml/kg, 1,2 ml/kg, 1,8 ml/kg, 2,4 ml/kg, dan 3,0 ml/kg. Sebagai kontrol negatif adalah dosis 0 ml/kg pakan atau tanpa pemberian propolis dalam pakan.
3.2.5 Percobaan Utama: Perlakuan Maskulinisasi
Larva ikan nila merah mulai dipelihara saat berumur 5 hari, dan diaklimatisasi di dalam akuarium perlakuan selama 2 hari hingga menjadi juvenil. Selama proses aklimatisasi, larva diberi pakan tanpa perlakuan. Pakan perlakuan yang telah dicampur propolis diberikan pada juvenil selama 28 hari masa pemeliharaan. Pakan perlakuan diberikan secara at satiation (sekenyangnya) dengan frekuensi pemberian sebanyak tiga kali sehari, yaitu pagi hari (07.00 WIB), siang hari (12.00 WIB), dan sore hari (17.00 WIB). Untuk menjaga kualitas
air pada media pemeliharaan, setiap pagi hari dilakukan penyiponan kotoran dan pergantian air sebanyak 30 % dari volume total.
Pasca perlakuan benih ikan nila merah dipelihara dalam hapa di kolam tanah dan diberi pakan komersil tanpa campuran propolis. Pemeliharaan dilakukan selama 90 hari sampai jenis kelamin ikan sudah dapat dibedakan secara visual (Lampiran 2). Ikan nila merah jantan memiliki bentuk papila yang memanjang dan agak runcing, sedangkan pada ikan betina papilanya membulat dan lebih pendek.
3.2.6 Pengukuran Parameter Penelitian
Parameter penelitian yang diukur meliputi derajat kelangsungan hidup saat perlakuan maupun pasca perlakuan, nisbah kelamin jantan, abnormalitas, rasio konversi pakan, laju pertumbuhan spesifik, dan parameter kualitas air.
Derajat Kelangsungan Hidup (Survival Rate, SR)
Derajat kelangsungan hidup merupakan persentase jumlah ikan yang hidup pada akhir pemeliharaan dibandingkan dengan jumlah ikan pada awal pemeliharaan. Derajat kelangsungan hidup dapat dihitung dengan rumus:
%
x
No
Nt
SR (%)
100
(Huisman, 1987). Keterangan: SR = survival rate (%)No = jumlah ikan pada waktu awal pemeliharaan (ekor) Nt = jumlah ikan pada waktu akhir pemeliharaan (ekor)
Nisbah Kelamin Jantan
Nisbah kelamin jantan adalah persentase jumlah ikan jantan dibandingkan dengan jumlah ikan keseluruhan. Nisbah kelamin jantan dapat dihitung dengan menggunakan rumus:
%
x
Is
Ij
(%)
IJ
100
(Zairin, 2002).Keterangan:
IJ = Nisbah kelamin jantan (%)
Ij = Jumlah ikan jantan (ekor)
Is = Jumlah ikan keseluruhan yang diamati (ekor)
Abnormalitas
Abnormalitas merupakan persentase jumlah ikan yang abnormal secara fisik dibandingkan dengan jumlah keseluruhan ikan. Abnormalitas dapat dihitung dengan rumus:
%
x
Is
Iab
IAb (%)
100
(Zairin, 2002). Keterangan: IAb = Abnormalitas (%)Iab = Jumlah ikan abnormal yang ditemukan (ekor) Is = Jumlah ikan keseluruhan yang diamati (ekor)
Laju Pertumbuhan Spesifik (Specific Growth Rate, SGR)
Laju pertumbuhan spesifik adalah persentase pertambahan bobot harian ikan per hari selama masa pemeliharaan. Laju pertumbuhan harian dapat dihitung dengan menggunakan rumus:
%
wo
wt
α
t1
100
(Huisman, 1987). Keterangan:α = laju pertumbuhan spesifik (%)
t = lama pemeliharaan (hari)
wt = bobot rata-rata ikan pada saat akhir pemeliharaan (gram) wo = berat rata-rata ikan pada saat awal pemeliharaan (gram)
Rasio Konversi Pakan (Feed Convertion Rate, FCR)
Rasio konversi pakan (FCR) merupakan rasio jumlah satuan pakan yang dihabiskan untuk menghasilkan satuan berat ikan. Misal FCR 1,2, maka ikan
membutuhkan pakan sebanyak 1,2 kg untuk menjadi daging sebanyak 1 kg. FCR dapat dihitung dengan menggunakan rumus:
Wo
Wt
P
FCR
(Huisman, 1987).Keterangan:
FCR = feed convertion rate
P = jumlah pakan yang habis selama pemeliharaan (gram) Wt = biomass ikan pada saat akhir pemeliharaan (gram) Wo = biomass ikan pada saat awal pemeliharaan (gram)
Kualitas Air
Pengukuran parameter kualitas air dilakukan di awal perlakuan dan setiap 7 hari selama perlakuan di akuarium. Pengukuran kualitas air meliputi parameter suhu, pH, DO, dan amoniak (Tabel 2). Khusus untuk perlakuan suhu, pengukuran dilakukan setiap hari.
Tabel 2. Parameter kualitas air dan waktu pengukuran
No. Parameter Satuan Alat
Pengukur Metode
Waktu Pengukuran
1. Suhu oC DO meter Pembacaan skala Harian
2. pH – pH meter Pembacaan skala Per 7 hari
3. DO mg/L Termometer Pembacaan skala Per 7 hari
4. Amoniak mg/L Biuret Titrasi Per 7 hari
3.3 Analisis Data
Data yang diperoleh disajikan dalam bentuk tabel dan grafik serta dianalisis secara statistik menggunakan program SPSS versi 16 untuk membuktikan apakah perlakuan dosis propolis melalui pencampuran dalam pakan buatan pada juvenil ikan nila merah efektif dalam pengarahan kelamin jantan. Perbedaan antar perlakuan akan diuji lanjut dengan menggunakan Uji Duncan. Sedangkan parameter kualitas air dan pendukung lainnya dianalisi secara deskriptif.
Rancangan percobaan yang digunakan dalam penelitian ini adalah rancangan acak lengkap (RAL), dengan 6 perlakuan dan 4 ulangan. Model rancangan yang digunakan dalam penelitian ini adalah:
Yij = µ + αi + εij (Steel dan Torrie, 1991). Keterangan:
Yij = nilai pengamatan pada perlakuan ke-i dan ulangan ke-j
µ = rataan umum
αi = pengaruh perlakuan ke-i
IV. HASIL DAN PEMBAHASAN
4.1 Hasil
4.1.1 Percobaan Pendahuluan
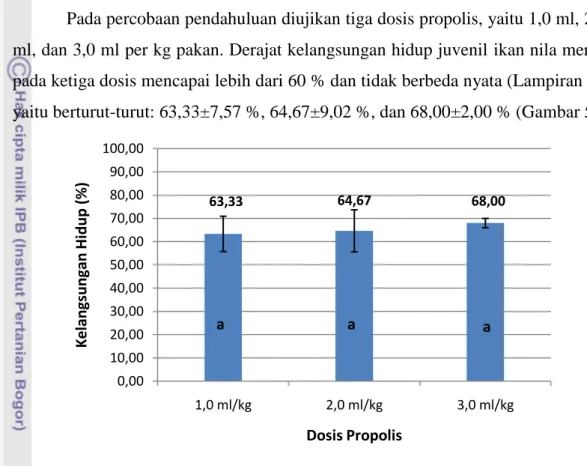
Pada percobaan pendahuluan diujikan tiga dosis propolis, yaitu 1,0 ml, 2,0 ml, dan 3,0 ml per kg pakan. Derajat kelangsungan hidup juvenil ikan nila merah pada ketiga dosis mencapai lebih dari 60 % dan tidak berbeda nyata (Lampiran 3), yaitu berturut-turut: 63,33±7,57 %, 64,67±9,02 %, dan 68,00±2,00 % (Gambar 5).
Gambar 5. Derajat kelangsungan hidup (%) juvenil ikan nila merah pada percobaan pendahuluan
Tabel 3. Kualitas air media pemeliharaan pada percobaan pendahuluan
Parameter Awal Percobaan Pendahuluan Selama Percobaan Pendahuluan Suhu (°C) 26,0 26,0 pH 7,14 6,80 – 7,35 DO (mg/L) 6,80 4,3 – 5,7 Amoniak (mg/L) 0,0016 0,0013 – 0,0117
Berdasarkan kisaran derajat kelangsungan hidup dan kualitas air pada percobaan pendahuluan (Tabel 3), maka dosis maksimal propolis yang digunakan untuk percobaan maskulinisasi adalah 3,0 ml/kg pakan. Dengan selang 0,6 ml setiap penurunan tingkat dosis, maka dosis yang diujikan adalah 0,6 ml, 1,2 ml, 1,8 ml, 2,4 ml, dan 3,0 ml/kg pakan, serta dosis 0 ml/kg pakan sebagai kontrol.
63,33 64,67 68,00 0,00 10,00 20,00 30,00 40,00 50,00 60,00 70,00 80,00 90,00 100,00 1,0 ml/kg 2,0 ml/kg 3,0 ml/kg K e la n gs u n ga n Hi d u p ( %) Dosis Propolis a a a
4.1.2 Percobaan Utama
4.1.2.1 Derajat Kelangsungan Hidup
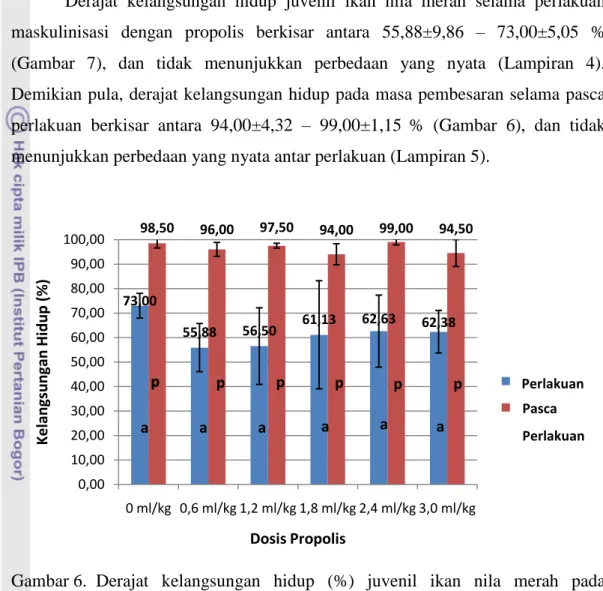
Derajat kelangsungan hidup juvenil ikan nila merah selama perlakuan maskulinisasi dengan propolis berkisar antara 55,88±9,86 – 73,00±5,05 % (Gambar 7), dan tidak menunjukkan perbedaan yang nyata (Lampiran 4). Demikian pula, derajat kelangsungan hidup pada masa pembesaran selama pasca perlakuan berkisar antara 94,00±4,32 – 99,00±1,15 % (Gambar 6), dan tidak menunjukkan perbedaan yang nyata antar perlakuan (Lampiran 5).
Gambar 6. Derajat kelangsungan hidup (%) juvenil ikan nila merah pada perlakuan dan pasca perlakuan maskulinisasi dengan propolis
4.1.2.2 Nisbah Kelamin Jantan
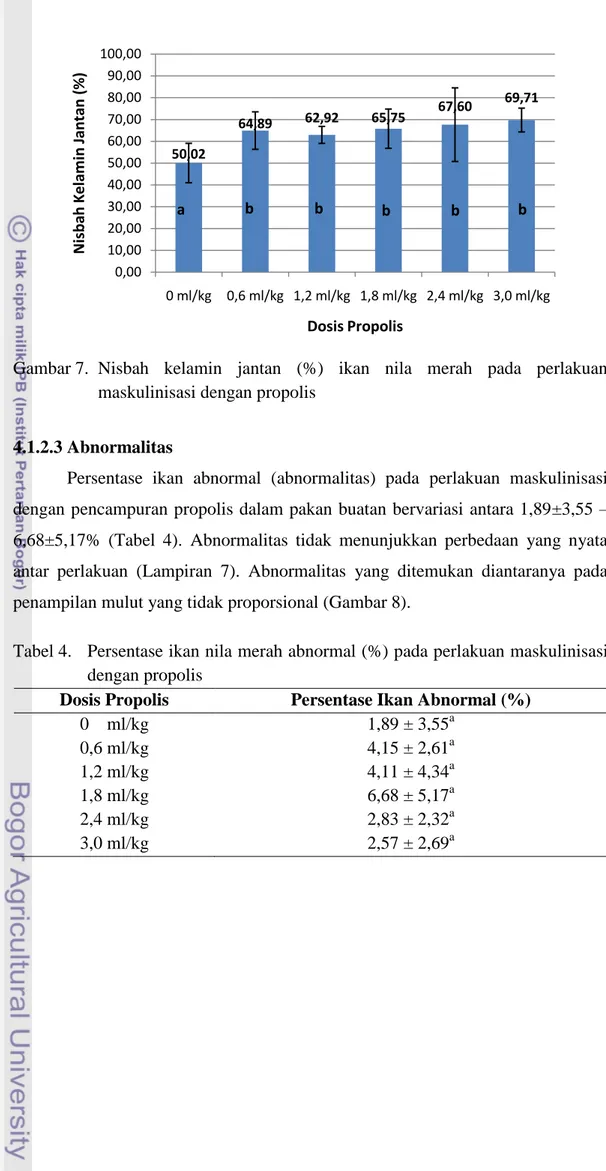
Nisbah kelamin jantan ikan nila merah yang dihasilkan melalui maskulinisasi dengan pencampuran propolis dalam pakan buatan bervariasi antara 62,92±3,89 – 69,71±5,46 %, lebih tinggi dibanding kontrol sebesar 50,02±9,02 % (Gambar 7). Persentase jantan berbeda nyata antara kontrol (0 ml/kg) dengan dosis perlakuan lainnya, namun diantara dosis 0,6 ml/kg, 1,2 ml/kg, 1,8 ml/kg, 2,4 ml/kg, dan 3,0 ml/kg tidak menunjukkan perbedaan yang nyata (Lampiran 6).
73,00 55,88 56,50 61,13 62,63 62,38 98,50 96,00 97,50 94,00 99,00 94,50 0,00 10,00 20,00 30,00 40,00 50,00 60,00 70,00 80,00 90,00 100,00 0 ml/kg 0,6 ml/kg 1,2 ml/kg 1,8 ml/kg 2,4 ml/kg 3,0 ml/kg K e la n gs u n ga n Hi d u p ( %) Dosis Propolis Perlakuan Pembesaran p a a a a a a p p p p p p Pasca Perlakuan Perlakuan
Gambar 7. Nisbah kelamin jantan (%) ikan nila merah pada perlakuan maskulinisasi dengan propolis
4.1.2.3 Abnormalitas
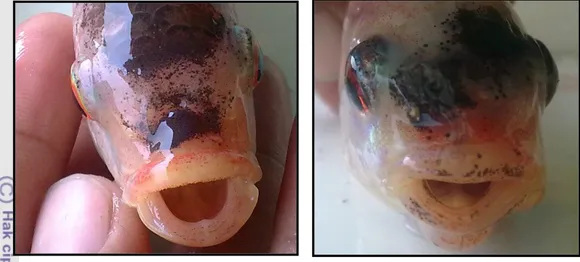
Persentase ikan abnormal (abnormalitas) pada perlakuan maskulinisasi dengan pencampuran propolis dalam pakan buatan bervariasi antara 1,89±3,55 – 6,68±5,17% (Tabel 4). Abnormalitas tidak menunjukkan perbedaan yang nyata antar perlakuan (Lampiran 7). Abnormalitas yang ditemukan diantaranya pada penampilan mulut yang tidak proporsional (Gambar 8).
Tabel 4. Persentase ikan nila merah abnormal (%) pada perlakuan maskulinisasi dengan propolis
Dosis Propolis Persentase Ikan Abnormal (%)
0 ml/kg 1,89 ± 3,55a 0,6 ml/kg 4,15 ± 2,61a 1,2 ml/kg 4,11 ± 4,34a 1,8 ml/kg 6,68 ± 5,17a 2,4 ml/kg 2,83 ± 2,32a 3,0 ml/kg 2,57 ± 2,69a 50,02 64,89 62,92 65,75 67,60 69,71 0,00 10,00 20,00 30,00 40,00 50,00 60,00 70,00 80,00 90,00 100,00 0 ml/kg 0,6 ml/kg 1,2 ml/kg 1,8 ml/kg 2,4 ml/kg 3,0 ml/kg N is b ah K el ami n J an ta n ( %) Dosis Propolis b b b b b a
Gambar 8. Ikan nila merah dengan mulut normal (kiri) dan abnormal (kanan)
4.1.2.4 Rasio Konversi Pakan
Rasio konversi pakan pada perlakuan maskulinisasi berkisar antara 1,11±0,03 – 1,22±0,13 (Gambar 9), dan tidak menunjukkan perbedaan yang nyata antar perlakuan (Lampiran 8).
Gambar 9. Rasio konversi pakan ikan nila merah pada perlakuan maskulinisasi dengan propolis
4.1.2.5 Laju Pertumbuhan Spesifik
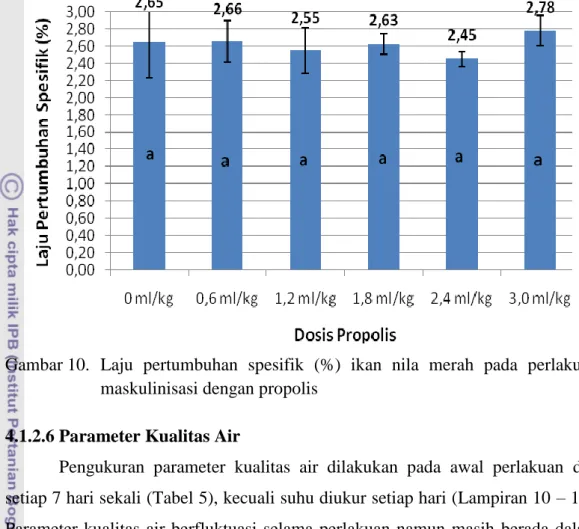
Laju pertumbuhan spesifik pada perlakuan maskulinisasi berkisar antara 2,45±0,09 – 2,78±0,17 % (Gambar 10), dan tidak menunjukkan perbedaan yang nyata antar perlakuan (Lampiran 9).
1,11 1,22 1,14 1,13 1,15 1,18 0,00 0,20 0,40 0,60 0,80 1,00 1,20 1,40 1,60 1,80 2,00 0 ml/kg 0,6 ml/kg 1,2 ml/kg 1,8 ml/kg 2,4 ml/kg 3,0 ml/kg Rasi o K o n ve rs i Pa ka n Dosis Propolis a a a a a a
Gambar 10. Laju pertumbuhan spesifik (%) ikan nila merah pada perlakuan maskulinisasi dengan propolis
4.1.2.6 Parameter Kualitas Air
Pengukuran parameter kualitas air dilakukan pada awal perlakuan dan setiap 7 hari sekali (Tabel 5), kecuali suhu diukur setiap hari (Lampiran 10 – 12). Parameter kualitas air berfluktuasi selama perlakuan namun masih berada dalam batas yang dapat ditolerir oleh juvenil ikan nila merah, yaitu: suhu 23,5 – 28,5 °C, pH 5,49 – 7,79, DO 3,7 – 7,5 mg/L, dan amoniak maksimal 0,0048 mg/L.
Tabel 5. Kualitas air pemeliharaan ikan nila merah di akuarium pada percobaan utama maskulinisasi dengan propolis
Parameter Awal Perlakuan Selama Perlakuan
Suhu (°C) 24,5 – 26,0 23,5 – 28,5
pH 7,01 5,49 – 7,79
DO (mg/L) 7,00 3,70 – 7,50
Amoniak (mg/L) 0,0010 0,0000 – 0,0048
4.2 Pembahasan
Dosis propolis tertinggi yang diujikan dalam percobaan ini (3,0 ml/kg pakan) masih bisa ditolerir oleh ikan dengan menunjukkan derajat kelangsungan hidup selama perlakuan lebih dari 60,00 %. Keberhasilan maskulinisasi jantan
tertinggi pada percobaan dosis propolis yang diberikan melalui pencampuran dalam pakan buatan mencapai 69,71 %, yaitu pada perlakuan 3,0 ml/kg pakan.
Penelitian mengenai penggunaan propolis sebagai bahan sex reversal baru pertama dilakukan oleh Ukhroy (2008), yaitu melalui metode pencampuran dalam pakan buatan yang diberikan pada induk ikan guppy (Poecilia reticulata). Dosis yang digunakan dalam penelitian tersebut adalah 0 µl/kg, 20 µl/kg, 40 µl/kg, dan 60 µl/kg dengan keberhasilan nisbah kelamin jantan tertinggi mencapai 55,17 %, sedangkan pada kontrol hanya 24,30 %. Peningkatan dosis masih mungkin dilakukan, namun overdosis dapat menyebabkan lethal (Ukhroy, 2008), interseks, dan steril atau tidak dapat berkembang biak (Zairin, 2002).
Derajat kelangsungan hidup (SR) juvenil ikan nila merah selama perlakuan maskulinisasi berkisar antara 55,88±9,86 – 73,00±5,05 %, sedangkan pasca perlakuan berkisar antara 94,00±4,32 – 99,00±1,15 %. SR antar dosis propolis tidak menunjukkan perbedaan yang nyata, baik saat pemeliharaan ikan selama perlakuan maskulinisasi di akuarium maupun saat pemeliharaan pasca perlakuan di kolam tanah. Hal ini menunjukkan bahwa pemberian propolis dalam pakan buatan pada perlakuan maskulinisasi tidak memberikan pengaruh negatif terhadap SR juvenil maupun SR benih ikan nila merah.
SR yang relatif rendah pada masa perlakuan dapat disebabkan karena juvenil belum mampu mencerna pakan buatan secara sempurna. Selain itu, frekuensi pemberian pakan juga dapat mempengaruhi karena semakin kecil ikan maka laju pengosongan lambungnya semakin cepat, sehingga perlu frekuensi pemberian pakan yang lebih dibanding ikan berukuran besar. SR yang relatif lebih tinggi pada pasca perlakuan dimungkinkan karena ikan mendapatkan pakan yang cukup dan berada pada lingkungan pemeliharaan optimal di kolam tanah.
Perlakuan maskulinisasi dengan propolis pada dosis 0,6 ml/kg, 1,2 ml/kg, 1,8 ml/kg, 2,4 ml/kg, dan 3,0 ml/kg meningkatkan nisbah kelamin jantan secara nyata. Namun, antar perlakuan propolis tersebut tidak menunjukkan perbedaan yang nyata. Hal tersebut menunjukkan bahwa penggunaan propolis dalam pakan sebagai bahan untuk pengarahan jenis kelamin jantan pada ikan nila merah terbukti efektif, dengan tingkat keberhasilan berkisar antara 62,92±3,89 – 69,71±5,46 %, sedangkan pada kontrol 50,02±9,02 %.
Kemampuan propolis dalam peningkatan nisbah kelamin ikan nila merah jantan diduga berhubungan dengan bahan aktif chrysin dalam propolis sebagai salah satu jenis flavonoid. Bahan ini diakui sebagai penghambat aromatisasi sehingga terjadi penurunan konsentrasi estrogen yang mengarahkan kelamin menjadi jantan. Hal ini sesuai dengan pernyataan Davis et al. (1999) yang mengatakan bahwa penurunan rasio estrogen terhadap androgen menyebabkan terjadinya perubahan penampakan dari ikan betina menjadi menyerupai ikan jantan atau terjadi maskulinisasi karakteristik seksual sekunder.
Pengarahan kelamin pada ikan nila merah dimungkinkan karena pada fase pertumbuhan gonad belum terjadi diferensiasi kelamin. Diferensiasi kelamin ini dipengaruhi oleh faktor genetik, faktor lingkungan, dan interaksi antara keduanya. Perlakuan maskulinisasi ini dilakukan pada juvenil ikan nila merah dan berlangsung selama 28 hari, sehingga keberhasilan pengarahan kelamin ikan diharapkan sempurna pada masa diferensiasi seks sesuai dengan kisaran waktu yang tepat, yaitu mulai umur 7 hari pasca menetas dan masa diferensiasi berlangsung sampai umur 37 hari setelah menetas (Kwon et al., 2000).
Persentase ikan abnormal (abnormalitas) pada perlakuan maskulinisasi berkisar antara 1,89±3,55 – 6,68±5,17%. Abnormalitas merupakan performa ikan yang abnormal secara fisik. Abnormalitas yang ditemukan pada penelitian ini diantaranya pada penampilan mulut dan sirip ekor yang tidak proporsional. Setelah diuji secara statistik, abnormalitas pada perlakuan maskulinisasi dengan propolis tidak menunjukkan perbedaan yang nyata antar perlakuan.
Perubahan penampilan fenotipe secara tidak normal pada suatu individu diantaranya dapat disebabkan oleh kelainan genetis sejak awal kehidupannya. Selain itu, abnormalitas juga dapat disebabkan kurangnya unsur dalam pakan dan adanya penggunaan bahan kimia, dalam hal ini adalah alkohol. Abnormalitas dapat mempengaruhi kehidupan ikan, bentuk mulut dan sirip ekor yang tidak sempurna masing-masing akan menghambat konsumsi pakan dan aktivitas berenang ikan.
Rasio konversi pakan (FCR) ikan pada pemeliharaan pasca perlakuan maskulinisasi berkisar antara 1,11±0,03 – 1,22±0,13 (Lampiran 13) dan laju pertumbuhan hariannya (SGR) adalah 2,45±0,09 – 2,78±0,17 %. FCR dan SGR
antar perlakuan tidak menunjukkan perbedaan yang nyata. Beberapa faktor yang mempengaruhi FCR antara lain adalah palatabilitas pakan, suhu lingkungan, kepadatan ikan, dan dampak positif kolam tanah yang mendukung tumbuhnya pakan alami. Laju pertumbuhan spesifik pada penelitian ini yang tidak berbeda nyata diduga karena waktu pemeliharaannya yang relatif singkat. Berdasarkan penelitian yang dilakukan di Universitas Wageningen, dikatakan bahwa perbedaan laju pertumbuhan antara ikan nila jantan dengan ikan nila betina baru terlihat setelah jangka waktu pemeliharaan 150 hari (Rutten, 2005).
Menurut Popma dan Masser (1999), kisaran kualitas air yang optimal untuk pemeliharaan ikan nila merah adalah: suhu 29,4 – 31,1 oC, DO >2,0 mg/L, pH 6,0 – 9,0, dan NH3 < 0,2 mg/L. Sedangkan kualitas air yang mematikan adalah
suhu <18,3 oC dan >42,0 oC, DO <0,3 mg/L, pH <5,0 dan >10,0 serta NH3 >0,6
mg/L (Popma dan Masser, 1999). Parameter kualitas air saat perlakuan masih berada pada kisaran suhu 23,5 – 28,5 °C, pH 5,49 – 7,79, DO 3,7 – 7,5 mg/L, dan amoniak 0 – 0,0048 mg/L. Faktor lingkungan seperti suhu, DO, pH, dan amoniak erat hubungannya dengan derajat kelangsungan hidup dan pertumbuhan ikan nila merah. Kisaran kualitas air yang termasuk optimal ini memungkinkan ikan dapat tumbuh dengan baik dan normal.
V. KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil percobaan yang telah dilakukan, dapat disimpulkan bahwa propolis efektif untuk maskulinisasi ikan nila merah dengan teknik pencampuran dalam pakan buatan. Peningkatan nisbah kelamin jantan bervariasi antara 62,92±3,89 – 69,71±5,46 %, sedangkan pada kontrol 50,02±9,02 %. Propolis juga tidak mempengaruhi kelangsungan hidup dan abnormalitas ikan nila merah.
5.2 Saran
Penggunaan dosis propolis untuk maskulinisasi ikan nila merah melalui teknik pencampuran dalam pakan buatan dapat menggunakan dosis 0,6 ml/kg pakan.
DAFTAR PUSTAKA
Arfah, H. 1997. Efektivitas Hormon 17α-Metiltestosteron dengan Metode Perendaman Induk terhadap Nisbah Kelamin dan Fertilitas Keturunan Ikan Gapi (Poecilia reticulata). [Tesis]. Program Pascasarjana, Institut Pertanian Bogor.
Barmudi, I. 2005. Efektivitas Aromatase Inhibitor terhadap Sex Reversal Ikan Nila Merah (Oreochromis sp.) dalam Suhu Media 33oC. [Skripsi]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Brodie, A., Q. Ling, and B. Long. 1999. Aromatase and Its Inhibitors. Journal of Steroid Biochemistry and Molecular Biology 69: 205-210.
Davis, R. B., B. A. Simco, C. A. Groudie, N. C. Parker, W. Couldwell, and P. Snellgrove. 1990. Hormonal Sex Manipulation and Evidence for Female
Homogamety on Channel Catfish. General and Comparative
Endocrinology 78: 218-223.
Dean, W. 2004. Chrysin: It Is An Effective Aromatase Inhibitor? Vitamin Research Products. http://www.vrp.com [16 Februari 2010].
Devlin, R. H. and Nagahama, Y. 2002. Sex Determination and Sex Differentiation in Fish: An Overview of Genetic, Physiological, and Environmental Influences. Aquaculture 208: 191-364.
Djaelani, F. 2007. Pengaruh Dosis Madu terhadap Pengarahan Kelamin Jantan pada Ikan Gapi (Poecilia reticulata Peters) dengan Metode Perendaman Larva. [Skripsi]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Greenaway, W., S. English, and F. R. Whatley. 1990. Phenolic Composition of Bud Exudates of Populus Deltoides, in Zeithschrifffur Naturforschung 45: 587-593. UK.
Huisman, E. A. 1987. Principle of Fish Production. Department of Fish Culture and Fisheries. Wageningen Agricultural University, Netherlands.
Kartal, M., S. Kaya, and S. Kurucu. 2002. GC-MS Analysis of Propolis Sample from Two Regions of Turkey. Ankara University, Faculty Pharmacy, Departement of Pharmacognosy. Turkey.
Kwon, J. Y., V Hashpanah, L. M. Hurtado, B. McAndrew, and D. Penman. 2000. Masculinization of Genetic Female Nile Tilapia (Oreochromis niloticus) by Dietary Administration of an Aromatase Inhibitor During Sexual Differentiation. Journal of Experimental Zoology 287: 46-53.
Liana, Y. P. 2005. Efektivitas Aromatase Inhibitor yang Diberikan Melalui Pakan Buatan terhadap Sex Reversal Ikan Nila Merah Oreochromis sp. [Skripsi]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Martati, E. 2006. Efektivitas Madu terhadap Nisbah Kelamin Ikan Gapi (Poecilia reticulata Peters). [Skripsi]. Program Studi Budidaya Perairan, Fakultas Perikanan, Institut Pertanian Bogor.
Mazzida, A. N. 2002. Pengaruh Aromatase Inhibitor terhadap Nisbah Kelamin Ikan Gapi (Poecilia reticulata Peters). [Skripsi]. Program Studi Budidaya Perairan, Fakultas Perikanan, Institut Pertanian Bogor.
Nurlaela. 2002. Pengaruh Dosis Aromatase Inhibitor pada Perendaman Embrio terhadap Nisbah Kelamin Ikan Nila Merah (Oreochromis sp.). [Skripsi]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Phelps, R. P. and T. J. Popma. 2000. Sex Reversal of Tilapia. Pages 34–59 in B.A. Costa-Pierce and J.E. Rakocy, eds. Tilapia Aquaculture in the Americas, Vol. 2. The World Aquaculture Society, Baton Rouge, Louisiana, United States.
Popma, T. and M. Masser. 1999. Tilapia: Life History and Biology. SRAC (Southern Regional Aquaculture Center) Publication No. 283.
Romana-Eguia, M. R. R., M. Ikeda, Z. U. Basiao, and N. Taniguchi. 2004. Genetic Diversity in Farmed Asian Nile and Red Hybrid Tilapia Stocks Evaluated from Microsatellite and Mitochondrial DNA Analysis. Aquaculture 236: 131-150.
Rutten, M. J. M. 2005. Breeding for Improved Production of Tilapia. Doctoral Thesis. University of Wageningen, Netherlands.
Scholz, S. and H. O. Gutzeit. 2000. Affect Reproduction Sexual Diferentiation and Aromatase Gene Expression of Medaka (Oryzias latipes). Aquatic Toxycology 50: 51-70.
Sever, D. M., T. Halliday, V. Waight, J. Brown, H. A. Davies, and E. C. Moriarty. 1999. Sperm Storage in Female of the Smoth New (Triturus vulgaris L.): Ultrastructure of the Spemathecal During the Breeding Season. Journal of Experimental Zoology 283: 51-70.
Silverin, B., M. Braillen, A. Folldart, and J. Balthazart. 2000. Distribution of Aromatase Activity in the Brain and Peripheral Tissue of Passerine and Non Passerine Avian Species. General and Comparative Endocrinology 117: 34-35.
Steel, R. G. D. dan J. H. Torrie. 1991. Prinsip dan Prosedur Statistika. Jakarta: Gramedia Pustaka Utama.
Sukmara. 2007. Sex Reversal pada Ikan Gapi (Poecilia reticulata Peters) secara Perendaman Larva dalam Larutan Madu 5 ml/L. [Skripsi]. Departemen Budidaya Perairan, Fakultas Perikanan, Institut Pertanian Bogor.
Tasdiq, M. 2005. Pengaruh Pemberian Aromatase Inhibitor Melalui Artemia Artemia sp. terhadap Keberhasilan Sex Reversal pada Ikan Nila Merah Oreochromis sp. [Skripsi]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Ukhroy, N. U. 2008. Efektivitas Propolis terhadap Nisbah Kelamin Ikan Guppy Poecilia reticulata. [Skripsi]. Departemen Budidaya Perairan, Fakultas Perikanan, Institut Pertanian Bogor.
Utomo, B. 2008. Efektivitas Penggunaan Aromatase Inhibitor dan Madu terhadap Nisbah Kelamin Ikan Gapi (Poecilia reticulata Peters). [Skripsi]. Program Studi Teknologi dan Manajemen Akuakultur, Fakultas Perikanan, Institut Pertanian Bogor.
Yamazaki, F. 1983. Sex Control and Manipulation in Fish. Aquaculture 33: 329-354.
Zairin, M. Jr. 2002. Sex Reversal: Memproduksi Benih Ikan Jantan atau Betina. Jakarta: Penebar Swadaya.
Lampiran 1. Skema penyiapan pakan perlakuan dengan propolis
Propolis sesuai dosis Alkohol (250 ml/kg pakan)
Masukkan ke dalam sprayer (botol semprot) ↓
Aduk hingga homogen ↓
Semprotkan pada pakan yang telah disebar di baki (nampan) sambil digoyang-goyang
↓
Aduk pakan perlahan-lahan ↓
Biarkan kering udara (1-2 jam) ↓
Lampiran 2. Ikan nila Oreochromis sp.
Morfologi ikan nila merah (Popma dan Masser, 1999)
Ikan nila jantan (kiri) dan nila betina (kanan)
Anal Spines
Dorsal Spines Dorsal Fin
Caudal Fin (Tail)
Anal Fin Pectoral Fin
Pelvic Spines Pelvic Fin
Lampiran 3. Analisis data derajat kelangsungan hidup (%) juvenil ikan nila merah pada percobaan pendahuluan
a. Derajat kelangsungan hidup
Perlakuan
Derajat Kelangsungan Hidup (%)
Rataan (%) Ulangan ke- n 1 n 2 n 3 1,0 ml/kg 36 72,00 29 58,00 30 60,00 63,33 ± 7,57a 2,0 ml/kg 37 74,00 28 56,00 32 64,00 64,67 ± 9,02a 3,0 ml/kg 33 66,00 35 70,00 34 68,00 68,00 ± 2,00a
Catatan: Angka yang diikuti huruf superscript yang sama pada kolom yang sama menunjukkan tidak berbeda nyata (P>0.05); rata-rata ± st. dev
(n: jumlah ikan hidup) b. Analisis ragam (Anova)
Sum of Squares df Mean Square F Sig.
Between Groups 34.667 2 17.333 0.364 0.709
Within Groups 285.333 6 47.556
Total 320.000 8
Kesimpulan: P>0.05 berarti perlakuan propolis tidak berpengaruh nyata terhadap derajat kelangsungan hidup juvenil ikan nila merah pada percobaan pendahuluan (penentuan dosis propolis).
Lampiran 4. Analisis data derajat kelangsungan hidup (%) juvenil ikan nila merah pada perlakuan maskulinisasi dengan propolis
a. Derajat kelangsungan hidup
Perlakuan
Derajat Kelangsungan Hidup (%)
Rataan (%) Ulangan ke-n 1 n 2 n 3 n 4 0 ml/kg 149 74,50 156 78,00 147 73,50 132 66,00 73,00 ± 5,05a 0,6 ml/kg 93 46,50 101 50,50 115 57,50 138 69,00 55,88 ± 9,86a 1,2 ml/kg 102 51,00 112 56,00 82 41,00 156 78,00 56,50 ± 15,63a 1,8 ml/kg 74 37,00 120 60,00 114 57,00 181 90,50 61,13 ± 22,08a 2,4 ml/kg 131 65,50 136 68,00 83 41,50 151 75,50 62,63 ± 14,71a 3,0 ml/kg 122 61,00 115 57,50 112 56,00 150 75,00 62,38 ± 8,67a
Catatan: Angka yang diikuti huruf superscript yang sama pada kolom yang sama menunjukkan tidak berbeda nyata (P>0.05); rata-rata ± st. dev
(n: jumlah ikan hidup) b. Analisis ragam (Anova)
Sum of Squares df Mean Square F Sig.
Between Groups 760.083 5 152.017 0.796 0.567
Within Groups 3439.250 18 191.069
Total 4199.333 23
Kesimpulan: P>0.05 berarti perlakuan propolis tidak berpengaruh nyata terhadap derajat kelangsungan hidup ikan nila merah selama perlakuan maskulinisasi dengan propolis.
Lampiran 5. Analisis data derajat kelangsungan hidup (%) ikan nila merah pasca perlakuan maskulinisasi dengan propolis
a. Derajat kelangsungan hidup
Perlakuan
Derajat Kelangsungan Hidup (%)
Rataan (%) Ulangan ke-n 1 n 2 n 3 n 4 0 ml/kg 50 100,00 48 96,00 49 98,00 50 100,00 98,50 ± 1,91a 0,6 ml/kg 46 92,00 48 96,00 49 98,00 49 98,00 96,00 ± 2,83a 1,2 ml/kg 49 98,00 48 96,00 49 98,00 49 98,00 97,50 ± 1,00a 1,8 ml/kg 45 90,00 46 92,00 50 100,00 47 94,00 94,00 ± 4,32a 2,4 ml/kg 49 98,00 49 98,00 50 100,00 50 100,00 99,00 ± 1,15a 3,0 ml/kg 44 88,00 49 98,00 50 100,00 46 92,00 94,50 ± 5,51a
Catatan: Angka yang diikuti huruf superscript yang sama pada kolom yang sama menunjukkan tidak berbeda nyata (P>0.05); rata-rata ± st. dev
(n: jumlah ikan hidup) b. Analisis ragam (Anova)
Sum of Squares df Mean Square F Sig.
Between Groups 86.833 5 17.367 1.654 0.197
Within Groups 189.000 18 10.500
Total 275.833 23
Kesimpulan: P>0.05 berarti perlakuan propolis tidak berpengaruh nyata terhadap derajat kelangsungan hidup ikan nila merah pasca perlakuan maskulinisasi dengan propolis.
Lampiran 6. Analisis data nisbah kelamin jantan (%) ikan nila merah pada perlakuan maskulinisasi dengan propolis
a. Nisbah kelamin jantan
Perlakuan
Nisbah Kelamin Jantan (%)
Rataan (%) Ulangan ke- n 1 n 2 n 3 n 4 n Stok 0 ml/kg 20 40,00 22 45,83 29 59,18 30 60,00 138 45,10 50,02 ± 9,02a 0,6 ml/kg 34 73,91 32 66,67 35 71,43 29 59,18 41 53,25 64,89 ± 8,59b 1,2 ml/kg 28 57,14 31 64,58 33 67,35 30 61,22 9 64,29 62,92 ± 3,89b 1,8 ml/kg 30 66,67 28 60,87 29 58,00 38 80,85 58 62,37 65,75 ± 9,00b 2,4 ml/kg 29 59,18 34 69,39 48 96,00 30 60,00 47 53,41 67,60 ± 16,88b 3,0 ml/kg 29 65,91 34 69,39 37 74,00 29 63,04 32 76,19 69,71 ± 5,46b
Catatan: Angka yang diikuti huruf superscript yang sama pada kolom yang sama menunjukkan tidak berbeda nyata (P>0.05); rata-rata ± st. dev
(n: jumlah ikan jantan) b. Analisis ragam (Anova)
Sum of Squares df Mean Square F Sig.
Between Groups 1143.712 5 228.742 3.018 0.030
Within Groups 1819.244 24 75.802
Total 2962.957 29
Kesimpulan: P<0.05 berarti perlakuan propolis berpengaruh nyata terhadap nisbah kelamin jantan pada perlakuan maskulinisasi dengan propolis.
c. Hasil uji lanjut Duncan
Perlakuan N Subset for alpha = 0.05
1 2 0 ml/kg 5 50.0220 1.2 ml/kg 5 62.9160 0.6 ml/kg 5 64.8880 1.8 ml/kg 5 65.7520 2.4 ml/kg 5 65.8500 3.0 ml/kg 5 69.4160 Sig. 1.000 0.302
Lampiran 7. Analisis data persentase abnormalitas (%) ikan nila merah pada perlakuan maskulinisasi dengan propolis
a. Abnormalitas antar perlakuan maskulinisasi
Perlakuan
Persentase Ikan Abnormal (%)
Rataan (%) Ulangan ke-n 1 n 2 n 3 n 4 n Stok 0 ml/kg 0 0,00 0 0,00 4 8,16 0 0,00 4 1,31 1,89 ± 3,55a 0,6 ml/kg 3 6,52 3 6,25 2 4,08 0 0,00 3 3,90 4,15 ± 2,61a 1,2 ml/kg 5 10,20 3 6,25 2 4,08 0 0,00 0 0,00 4,11 ± 4,34a 1,8 ml/kg 7 15,56 2 4,35 3 6,00 1 2,13 5 5,38 6,68 ± 5,17a 2,4 ml/kg 1 2,04 3 6,12 1 2,00 2 4,00 0 0,00 2,83 ± 2,32a 3,0 ml/kg 0 0,00 3 6,12 0 0,00 2 4,35 1 2,38 2,57 ± 2,69a
Catatan: Angka yang diikuti huruf superscript yang sama pada kolom yang sama menunjukkan tidak berbeda nyata (P>0.05); rata-rata ± st. dev
(n: jumlah ikan abnormal) b. Analisis ragam (Anova)
Sum of Squares df Mean Square F Sig.
Between Groups 72.817 5 14.563 1.125 0.374
Within Groups 310.805 24 12.950
Total 383.622 29
Kesimpulan: P>0.05 berarti perlakuan propolis tidak berpengaruh nyata terhadap abnormalitas ikan nila merah pada perlakuan maskulinisasi dengan propolis.
Lampiran 8. Analisis data rasio konversi pakan ikan nila merah pada perlakuan maskulinisasi dengan propolis
a. Rasio konversi pakan antar perlakuan maskulinisasi
Perlakuan
Rasio Konversi Pakan
Rataan Ulangan ke-n 1 n 2 n 3 n 4 0 ml/kg 50 1,15 49 1,11 49 1,09 50 1,07 1,11 ± 0,03a 0,6 ml/kg 46 1,28 49 1,36 49 1,18 49 1,07 1,22 ± 0,13a 1,2 ml/kg 49 1,22 49 1,21 49 1,06 49 1,06 1,14 ± 0,09a 1,8 ml/kg 45 1,12 50 1,13 50 1,25 47 1,02 1,13 ± 0,09a 2,4 ml/kg 49 1,15 50 1,18 50 1,17 50 1,09 1,15 ± 0,04a 3,0 ml/kg 44 1,10 50 1,19 50 1,20 46 1,21 1,18 ± 0,05a
Catatan: Angka yang diikuti huruf superscript yang sama pada kolom yang sama menunjukkan tidak berbeda nyata (P>0.05); rata-rata ± st. dev
(n: jumlah ikan) b. Analisis ragam (Anova)
Sum of Squares df Mean Square F Sig.
Between Groups 0.034 5 0.007 1.063 0.413
Within Groups 0.114 18 0.006
Total 0.148 23
Kesimpulan: P>0.05 berarti perlakuan propolis tidak berpengaruh nyata terhadap rasio konversi pakan ikan nila merah pada perlakuan maskulinisasi dengan propolis.
Lampiran 9. Analisis data laju pertumbuhan spesifik (%) ikan nila merah pada perlakuan maskulinisasi dengan propolis
a. Laju pertumbuhan spesifik antar perlakuan maskulinisasi
Perlakuan
Laju Pertumbuhan Spesifik (%)
Rataan (%) Ulangan ke- n 1 n 2 n 3 n 4 0 ml/kg 50 2,15 49 3,15 49 2,74 50 2,55 2,65 ± 0,42a 0,6 ml/kg 46 2,59 49 2,41 49 2,63 49 2,99 2,66 ± 0,24a 1,2 ml/kg 49 2,22 49 2,50 49 2,62 49 2,86 2,55 ± 0,27a 1,8 ml/kg 45 2,69 50 2,71 50 2,46 47 2,66 2,63 ± 0,12a 2,4 ml/kg 49 2,50 50 2,45 50 2,33 50 2,53 2,45 ± 0,09a 3,0 ml/kg 44 2,53 50 2,91 50 2,88 46 2,82 2,78 ± 0,17a
Catatan: Angka yang diikuti huruf superscript yang sama pada kolom yang sama menunjukkan tidak berbeda nyata (P>0.05); rata-rata ± st. dev
(n: jumlah ikan) b. Analisis ragam (Anova)
Sum of Squares df Mean Square F Sig.
Between Groups 0.015 5 0.003 0.992 0.450
Within Groups 0.054 18 0.003
Total 0.069 23
Kesimpulan: P>0.05 berarti perlakuan propolis tidak berpengaruh nyata terhadap laju pertumbuhan spesifik kan nila merah pada perlakuan maskulinisasi dengan propolis.
Lampiran 10. Data suhu harian selama perlakuan maskulinisasi ikan nila merah dengan propolis
Waktu Jam Suhu (0C) Waktu Jam Suhu (0C)
H 0 06.00 24,5 H 15 06.00 25,0 12.00 25,0 12.00 26,0 18.00 26,0 18.00 27,5 H 1 06.00 23,5 H 16 06.00 24,0 12.00 25,5 12.00 25,0 18.00 26,0 18.00 27,0 H 2 06.00 23,5 H 17 06.00 25,0 12.00 25,5 12.00 26,0 18.00 26,0 18.00 27,5 H 3 06.00 24,5 H 18 06.00 25,0 12.00 25,5 12.00 26,0 18.00 26,0 18.00 27,5 H 4 06.00 24,5 H 19 06.00 25,0 12.00 26,5 12.00 26,0 18.00 27,4 18.00 27,5 H 5 06.00 25,0 H 20 06.00 25,5 12.00 25,7 12.00 26,5 18.00 27,4 18.00 28,0 H 6 06.00 25,5 H 21 06.00 26,0 12.00 26,3 12.00 26,8 18.00 27,7 18.00 28,2 H 7 06.00 25,5 H 22 06.00 25,0 12.00 26,3 12.00 26,5 18.00 27,5 18.00 27,5 H 8 06.00 26,0 H 23 06.00 25,0 12.00 27,5 12.00 26,5 18.00 28,5 18.00 27,5 H 9 06.00 26,3 H 24 06.00 26,0 12.00 27,5 12.00 27,0 18.00 28,0 18.00 28,5 H 10 06.00 26,0 H 25 06.00 26,0 12.00 27,5 12.00 27,5 18.00 28,0 18.00 28,5 H 11 06.00 26,0 H 26 06.00 26,0 12.00 27,0 12.00 27,5 18.00 28,0 18.00 28,5 H 12 06.00 26,5 H 27 06.00 26,5 12.00 27,0 12.00 28,0 18.00 28,0 18.00 29,0 H 13 06.00 26,0 H 28 06.00 27,0 12.00 27,0 12.00 28,0 18.00 28,0 18.00 29,0 H 14 06.00 25,5 12.00 26,5 18.00 27,0