i
SEX REVERSAL IKAN NILA MENGGUNAKAN MADU DAN
ANALISIS EKSPRESI GEN AROMATASE
ENY HERIYATI
MAYOR ILMU AKUAKULTUR SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
iii
PERNYATAAN MENGENAITESISDAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa tesis “Sex Reversal Ikan Nila Menggunakan Madu dan Analisis Ekspresi Gen Aromatase” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukkan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, September 2012
Eny Heriyati C151100181
v
ABSTRACT
ENY HERIYATI.Sex reversal of Nile tilapia using honey and analysis of aromatase gene expression.Supervised by ALIMUDDIN and HARTON ARFAH
The use of synthetic steroid hormones to produce monosex populations of tilapia for intensive productive systems may lead to environmental and public health concerns. Such a situation is derived from the fact that female tilapine species have a high fecundity, generally reproducing at a small size and exhibiting stunted somatic growth at higher densities, while male tilapias exhibit faster growth rates and are often the preferred gender for monosex aquaculture.The study was conducted to determine the effect of immersion Nile tilapia larvae in water containing different honey source on male fish percentage and aromatase gene expression. In the first experiment, in a total of 30 tilapia larvae at 12 days posthatch were immersed in the water containing honey derived from the forest, cultured and mangrove bees, with a dose of 10 mL/L water for 10 hours. Fish were then maintained in the same condition for 2 months. The results showed that percentage of male fish immersed by different honey was similar (p>0.05), and all treatment was significantly different with the control (p<0.05). In the second experiment tilapia larvae were immersed in two bioactive compounds of honey, namely chrysin and potassium solution in a dose of 20 mg/L and 0.026 g/L, respectively, to verify the materials of honey that affects sex differentiation in Nile tilapia. The results showed that both compounds increased male fish percentage compared to that of control (p<0.1). This indicated that chrysin and potassium were involved in Nile tilapia sex reversal. Growth, survival and biomass of honey bee treated fish were similar with the control (p>0.05), while chrysin and potassium treated fish have lower survival rate than that of control (p<0.1). The lower survival rate maybe caused slightly higher specific growth in the chrysin and potassium treated fish compared to control (p<0.1). Furthermore, RT-PCR analysis showed that honey bee, chrysin and potassium down-regulated gonadal-type aromatase gene expression at 12 hours post immersion. Thus, honey can be use to sex reverse of Nile tilapia, and evolved the gonadal-type aromatase expression.
vii
RINGKASAN
ENY HERIYATI.Sex Reversalikan nila menggunakan madu dan analisis ekspresi gen aromatase. Dibimbing oleh ALIMUDDIN and HARTON ARFAH
Ikan nila jantan memiliki laju pertumbuhan sekitar dua kali lebih cepat dibandingkan dengan ikan betina, sehingga tingkat produksi, dan potensi keuntungan budidaya ikan nila jantan semua (monoseks) adalah lebih tinggi.Salah satu cara untuk memproduksi populasi monoseks jantan adalah dengan teknologi sex reversal, yakni suatu teknologi yang mengarahkan diferensiasi kelamin menjadi jantan, dan dilakukan pada saat gonad ikan belum terdiferensiasi. Cara yang umum dilakukan untuk memperoleh ikan monoseks adalah dengan menggunakan hormon steroid 17α-metiltestosteron (MT) dan aromatase inhibitor seperti fadrozole. Akan tetapi, penggunaan hormon MT diduga dapat bersifat karsinogenik pada manusia dan aromatase inhibitor tidak dijual bebas di pasaran, sehingga untuk mengatasinya diperlukan bahan alternatif lain yang aman dan mudah diperoleh. Madu merupakan bahan alami mengandung flavonoid chrysin yang diduga dapat berfungsi sebagai penghambat kerja enzim aromatase atau sebagai aromatase inhibitor. Madu bersifat ramah lingkungan, dan kandungan mineralnya tinggi, terutama kalium. Kalium dalam madu diduga berfungsi sebagai pengarah diferensiasi kelamin ikan melalui modulasi peredaran testosteron, dan pengendalian tindakan androgen. Dalam penelitian ini digunakan tiga jenis madu, yaitu madu hutan (madu yang diperoleh dari beberapa macam nektar bunga dari lebah liar di hutan), madu ternak (madu yang diperoleh dari nektar tanaman tertentu oleh lebah yang dibudidayakan), dan madu bakau (madu dari nektar tanaman bakau oleh lebah di daerah hutan bakau). Analisis kandungan madu yang diuji, dan pemberian chrysin dan kalium dalam sex reversal juga berpotensi besar dapat menjelaskan perbedaan aktivitas madu uji, dan bahan yang berperan dalam sex reversal ikan nila.
Regulasi diferensiasi kelamin di dalam tubuh ikan dapat dilihat dari level aromatase pada ikan. Terdapat dua jenis aromatase, yaitu aromatase tipe 1 (tipe gonad) dan tipe 2 (tipe otak). Aktivitas enzim aromatase berkorelasi dengan struktur gonad, yaitu larva dengan aktivitas aromatase rendah akan mengarah pada terbentuknya testis, sedangkan aktivitas aromatase yang tinggi akan mengarahkan terbentuknya ovari.Penelitian ini dilakukan untuk mengevaluasi pengaruh perendaman larva ikan nila menggunakan 3 sumber madu berbeda, terhadap persentase ikan jantan dan ekspresi gen aromatase.
Dalam percobaan satu, 30 larva ikan nila berumur 12 hari setelah menetas direndam menggunakan madu hutan, madu ternak dan madu bakau, dengan dosis 10 mL/L air selama 10 jam. Pada percobaan kedua larva nila direndam dalam air mengandung chrysin dan kalium dengan dosis masing-masing 20 mg/L dan 0,026 g/L, untuk memverifikasi bahan dari lebah madu yang mempengaruhi diferensiasi seks ikan nila. Kemudian ikan dipelihara dalam kondisi yang sama selama 2 bulan.Ekspresi gen aromatase dianalisis menggunakan metode RT-PCR. Sampel jaringan diambil pada waktu 1, 6, 12, 24, dan 48 jam pasca perlakuan madu, chrysin, dan kalium, serta setelah ikan berumur dua bulan.
Hasil penelitian menunjukkan bahwa persentase ikan jantan yang direndam menggunakan 3 jenis madu menunjukkan hasil yang tidak berbeda
viii
nyata (p>0,05), tetapi semua perlakuan berbeda nyata dengan kontrol (p <0,05).Hasil penelitian dua menunjukkan bahwa chrysin dan kalium dapat meningkatkan persentase ikan jantan dibandingkan dengan kontrol (p<0,1). Hal ini menunjukkan bahwa chrysin dan kalium terlibat dalam pembalikan seks ikan nila. Selanjutnya, respons perendaman terhadappertumbuhan, kelangsungan hidup dan biomassa ikan pada perlakuan madu hasilnya tidak berbeda nyata antar perlakuan maupun dengan kontrol (p>0,05), sedangkan perendaman menggunakan chrysin dan kalium memiliki tingkat kelangsungan hidup lebih rendah dari kontrol (p<0,1),dan tingkat pertumbuhan relatif lebih tinggi dibandingkan dengan kontrol (p<0,1).
Analisis RT-PCR menunjukkan bahwa madu, chrysin dan kalium dapat menekan ekspresi gen aromatase tipe gonad pada jam ke-12 pasca perendaman. Dengan demikian dapat disimpulkan bahwa madu, chrysin dan kalium dapat digunakan untuk sex reversal ikan nila, dan menekan ekspresi aromatase tipe gonad.
ix
© Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjaun suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apa pun tanpa izin IPB.
xi
SEX REVERSAL IKAN NILA MENGGUNAKAN MADU DAN
ANALISIS EKSPRESI GEN AROMATASE
ENY HERIYATI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2012
xii
Penguji Luar Komisi pada Ujian Tesis: Prof. Dr. Ir. Komar Sumantadinata, M.Sc.
xiii
Disetujui Komisi Pembimbing
Dr. Alimuddin, S.Pi, M.Sc Ketua
Ir. Harton Arfah, M.Si Anggota
Mengetahui
Ketua Program Studi Ilmu Akuakultur
Prof.Dr.Ir.Enang Harris, M.S
Tanggal Ujian: 12 September 2012
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, M.Sc. Agr
Tanggal lulus:
Judul Penelitian : Sex Reversal Ikan Nila Menggunakan Madu dan Analisis Ekspresi Gen Aromatase
Nama : Eny Heriyati
xv
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah TESIS ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret sampai Juni 2012 adalah reproduksi dan genetika ikan, dengan judul “Seks reversal ikan nila menggunakan madu dan analisis ekspresi gen aromatase”. Penelitian dilakukan di Laboratorium Reproduksi dan Genetika Organisme Akuatik, Departemen Budidaya Perairan Fakultas Perikanan dan Ilmu Kelautan IPB.
Keberhasilan penulis dalam menyelesaikan penelitian ini tidak semata didapatkan sendiri, melainkan dengan bantuan orang-orang sekitar. Untuk itu penulis mengucapkan terima kasih kepada:
1. Dr. Alimuddin, S.Pi, M.Sc selaku Pembimbing I yang telah membimbing dan mengarahkan penulis selama melakukan penelitian sampai dengan penyusunan karya ilmiah ini.
2. Ir. Harton Arfah, MSi selaku Pembimbing II yang telah membimbing dan mengarahkan penulis selama melakukan penelitian sampai dengan penyusunan karya ilmiah ini.
3. Prof. Dr. Ir. Komar Sumantadinata, M.Sc selaku penguji luar komisi atas saran dan pengarahannya dalam memperbaiki penulisan tesis.
4. Anna Octavera, S.Pi, M.Si yang telah membantu dalam pelaksanaan penelitian dan penyusunan karya ilmiah ini.
5. Bapak, ibu, keluarga besarku, Almarhum suamiku yang selalu mendorong untuk studi lanjut ke S2 dan Anak-anakku: Naufal, Ina dan Nafi, yang telah memberi kasih sayang, dan doa restunya.
6. Bapak Hery yang telah mencarikan madu ternak dan madu hutan dari hutan Sono Gunung Kidul, BBAT Jambi yang telah memberikan madu bakau, dan Ibu Saira Banu yang telah mengirim chrysin dari USA untuk penelitian ini.
7. Mas Dedi,teman-teman S1, S2, dan S3 di Laboratorium Reproduksi dan Genetika Organisme Akuatik dan teman-teman Ilmu Akuakultur 2010 yang telah memberikan dukungan baik secara langsung maupun tidak langsung.
xvi
Penulis telah berusaha semaksimal mungkin dalam penyelesaian karya ilmiah ini. Dengan harapan, karya ilmiah ini dapat bermanfaat bagi penulis dan para pembaca pada umumnya.
Bogor, September 2012 Eny Heriyati
xvii
RIWAYAT HIDUP
Penulis dilahirkan di Bandung, 24 Agustus 1970 dari Bapak bernama Sutarjo dan Ibu Supari. Penulis merupakan anak ketiga dari tujuh bersaudara.
Pendidikan formal yang dilalui penulis adalah SDN 04 Wonogiri, Jawa Tengah pada tahun 1977-1983 dilanjutkan di SLTPN 1 Wonogiri pada tahun 1983-1986, kemudian masuk SMUN 1 Wonogiri lulus tahun 1989. Penulis melanjutkan pendidikan tinggi di IPB melalui jalur Undangan Seleksi Masuk Institut Pertanian Bogor pada tahun yang sama dan memilih program studi Budidaya Perairan Fakultas Perikanan dan Ilmu Kelautan. Pada tahun 1994 penulis menyelesaikan studi sarjana di IPB dan pada tahun 2010 melanjutkan di Sekolah Pascasarjana, Program Studi Ilmu Akuakultur, Institut Pertanian Bogor.
Untuk menyelesaikan studi di sekolah pascasarjana, penulis melakukan penelitian dengan judul tesis “Sex Reversal Ikan Nila Menggunakan Madu dan
Analisis Ekspresi Gen Aromatase”, di bawah bimbingan Dr. Alimuddin, dan Ir.
Harton Arfah, M.Si.
. .
xix
DAFTAR ISI
Halaman
DAFTAR TABEL ... xxi
DAFTAR GAMBAR ... xxiii
DAFTAR LAMPIRAN ... xxv
I. PENDAHULUAN ... 1
1.1 Latar belakang ... 1
1.2 Tujuan penelitian ... 3
II. TINJAUAN PUSTAKA ... 5
2.1 Ikan nila ... 5
2.2 Determinasi dan diferensiasi kelamin ... 6
2.3 Sex reversal ... 6
2.4 Madu ... 8
2.5 Flavonoid ... 9
2.6 Aromatase dan aromatase inhibitor ... 9
III. BAHAN DAN METODE.. ... 13
3.1 Analisis kandungan madu ... 13
3.2 Percobaan 1: respons ikan nila terhadap perendaman dalam madu dengan sumberberbeda ... 13
3.3Percobaan 2: respons ikan nila terhadap chrysin dan kalium ... 14
3.4 Identifikasi jenis kelamin ... 14
3.5 Analisis ekspresi gen aromatase ... 14
3.5.1 Ekspresi RNA dan sintesis cDNA ... 14
3.5.2 Amplifikasi gen aromatase ... 15
3.6 Analisis pertumbuhan spesifik ... 16
3.7 Analisis kualitas air ... 16
3.8 Analisis statistiik ... 16
IV. HASIL DAN PEMBAHASAN ... 17
4.1 Kandungan biokimia madu dan respons ikan terhadap perendaman madu, chrysin dan kalium ... 17
4.2 Kualitas air ... 19
xx
4.3 Ekspresi gen aromatase ... 20
V. SIMPULAN DAN SARAN... 23
5.1 Simpulan ... 23
5.2 Saran ... 23
DAFTAR PUSTAKA ... 25
LAMPIRAN ... 29
xxi
DAFTAR TABEL
Halaman
1. Kandungan proksimat (bobot kering), mineral, total flavonoid, kalium dan pH madu hutan, madu ternak dan madu bakau ... 17 2. Nisbah ikan jantan, laju pertumbuhan bobot spesifik (SGR),
kelangsungan hidup (KH), dan biomassa ikan hasil perlakuan madu
dengan sumber berbeda ... 17 3. Nisbah ikan nila jantan, laju pertumbuhan spesifik (SGR), kelangsungan
hidup (KH) dan biomassa ikan yang telah diberi perendaman chrysin dan kalium ... 18 4. Hasil pengukuran kualitas air pada perlakuan menggunakan madu ... 20 5. Hasil pengukuran pH dan suhu pada perlakuan chrysin dan kalium ... 20
xxiii
DAFTAR GAMBAR
Halaman
1. Diferensiasi gonad ikan nila (Ijiri et al. 2008). ... 11 2. Ekspresi gen aromatase tipe 1 (gonad) (A), tipe 2 (otak)(B) dan β-aktin
(C). M = marker DNA; P1-P48: Perlakuan madu pada jam ke-1 sampai 48 pasca perendaman; K1-K48: Kontrol; ♂O, ♀O = sampel otak jantan dan betina; ♂G, ♀G = sampel gonad jantan dan betina; tanda panah
menunjukkan target gen ... 21 3. Ekspresi gen aromatase tipe gonad (A) pada perlakuan madu (P12),
kalium (Kal12), chrysin (Chry12), dan kontrol pada jam ke-12 (K12) setelah perendaman. Β-aktin (B). M= marker DNA. Tanda panah
menunjukkan target gen ... 22
xxv
DAFTAR LAMPIRAN
Halaman
1. Hasil analisis statistik perlakuan madu ... 31 2. Hasil analisis statistik perlakuan chrysin dan kalium ... 35
1
I. PENDAHULUAN 1.1 Latar belakang
Ikan nila merupakan ikan konsumsi air tawar unggulan yang saat ini sudah dapat dibudidayakan dengan baik secara intensif. Kelebihan ikan nila adalah pertumbuhannya relatif cepat, dan cara pemeliharaannya relatif mudah, sertamemiliki toleransi yang cukup lebar terhadap kondisi lingkungan. Namun demikian, ikan ini mempunyai perbedaan kecepatan pertumbuhan antara jantan dengan betina. Ikan nila jantan memiliki laju pertumbuhan sekitar dua kali lebih cepat dibandingkan dengan ikan betina (Popma dan Masser 1999), sehingga tingkat produksi, dan potensi keuntungan budidaya ikan nila jantan semua (monoseks) adalah lebih tinggi. Budidaya ikan nila monoseks juga dapat mencegah pemijahan liar yang dapat menurunkan tingkat produksi budidaya, dan membuat waktu budidaya lebih lama atau bahkan sulit untuk mencapai ukuran sekitar 500 g/ekor.
Salah satu cara untuk memproduksi populasi monoseks adalah dengan teknologi sex reversal, yaknisuatu teknologi yang mengarahkan perkembangan kelamin menjadi jantan atau betina semua. Sex reversal dilakukan pada saat gonad ikan belum terdiferensiasi menjadi jantan atau betina. Cara yang umum dilakukan untuk memperoleh populasi ikan monoseks adalah dengan menggunakan hormon steroid 17α-metiltestosteron (MT). Namun demikian, penggunaan hormon MT diduga dapat menyebabkan adanya residu. Residu hormon MT diduga bersifat karsinogenik pada manusia (Phelps et al. 2001). Selain itu, MT juga sulit untuk didegrada7si secara alami, sehingga berpotensi sebagai endocrine residue agent (Conteras-Sancez dan Fitzpatrick 2001). Bahan lain yang telah terbukti efektif untuk sex reversal pada ikan adalah aromatase inhibitor seperti fadrozole (Kwon et al. 2000). Namun demikian, aromatase inhibitor termasuk obat yang tidak dijual bebas sehingga tidak mudah diperoleh. Selain itu, penggunaan bahan perangsang steroid yang tidak tepat dapat mengakibatkan kematian, kemandulan, dan pencemaran lingkungan yang merugikan organisme lain.
Madu merupakan bahan alami mengandung flavonoid chrysin yang diduga dapat berfungsi sebagai penghambat kerja enzim aromatase atau sebagai aromatase inhibitor (Dean 2004). Madu bersifat ramah lingkungan, dan
2
kandungan mineralnya tinggi, terutama kalium. Kalium dalam madu diduga dapat berfungsi sebagai pengarah diferensiasi kelamin ikan melalui modulasi peredaran testosteron, dan pengendalian tindakan androgen (Capelo et al. 2001).
Penggunaan madu untuk sex reversal telah dilakukan baik melalui pakan maupun perendaman. Syaifuddin (2004) telah melakukannya melalui pakan pada larva ikan nila GIFT dan menghasilkan ikan jantan sebanyak 93,33%, sementara pada kontrol 57,78%. Sukmara (2007) melakukan perendaman terhadap induk ikan gapi dan menghasilkan jantan sebesar 46,99%, sedangkan pada kontrol 25,96%. Utomo (2008) melakukan perendaman terhadap larva ikan gapi menghasilkan jantan 56,68%, sedangkan pada kontrol 47,16%. Mukti et al. (2008) memberikan madu melalui pakan pada induk red claw menghasilkan jantan sebesar 60,35%, sedangkan pada kontrol 50,56%. Penggunaan madu melalui pakan terhadap ikan nila dapat menghasilkan nila jantan yang cukup signifikan (Syaifuddin 2004). Namun demikian, hal ini kurang ekonomis karena dosis madu yang digunakan relatif tinggi (200 mL/kg pakan), sehingga perlu dilakukan uji penggunaan madu melalui metode massal lainnya, yakni perendaman.
Diferensiasi kelamin di dalam tubuh ikan dipengaruhi oleh ekspresi dari gen yang menghasilkan enzim aromatase. Aromatase merupakan enzim yang mangkatalis konversi testosteron (androgen) menjadi estradiol (estrogen), sehingga jenis kelamin yang dihasilkan mengarah ke betina. Aromatase inhibitor berperan pada pembentukan testosteron yang akan merangsang pertumbuhan organ kelamin jantan, dan menimbulkan sifat-sifat kelamin sekunder jantan (Zairin 2002). Aktivitas enzim aromatase berkorelasi dengan struktur gonad, yakni larva dengan aktivitas aromatase rendah akan mengarah pada terbentuknya testis, sedangkan aktivitas aromatase yang tinggi akan mengarah pada terbentuknya ovari (Sever et al. 1999). Awal diferensiasi kelamin tersebut ditandai dengan terdeteksinya produksi aromatase. Analisis ekspresi gen aromatase pada ikan diduga dapat menjelaskan mekanisme sex reversal menggunakan madu.
Madu dapat berupa madu hutan, madu ternak dan madu bakau. Madu hutan adalah madu yang diperoleh dari beberapa macam nektar bunga dari lebah liar di hutan, dan madu ternak adalah madu yang diperoleh dari nektar tanaman
3
tertentu oleh lebah yang dibudidayakan,sedangkan madu bakau merupakan madu dari nektar tanaman bakau oleh lebah di daerah hutan bakau. Kandungan bahan bioaktif madu yang berfungsi sebagai aromatase inhibitor dapat berbeda dari ketiga sumber tersebut. Oleh karena itu, pada penelitian ini akan dilakukan uji efektivitas tiga sumber madu dalam sex reversal ikan nila. Analisis kandungan madu yang diuji, dan pemberian chrysindan kalium dalam sex reversal juga berpotensi besar dapat menjelaskan perbedaan aktivitas madu uji, dan bahan yang berperan dalam sex reversal ikan nila.
1.2 Tujuan penelitian
Penelitian ini bertujuan untuk: (1) mengevaluasi persentase jenis kelamin jantan, pertumbuhan, kelangsungan hidup, dan biomassa ikan nila yang telah direndam dalam 3 jenis madu berbeda yaitu madu hutan, madu ternak dan madu bakau, dan perendaman larva dalam air mengandung chrysin, dan kalium, dan (2) menganalisis ekspresi gen aromatase ikan nila hasil perlakuan perendaman dengan madu, chrysin dan kalium.
5
II. TINJAUAN PUSTAKA 2.1 Ikan nila
Ikan nila (Oreochromis niloticus) merupakan salah satu jenis ikan tilapia yangberasal dari Benua Afrika. Namun demikian, pada saat ini ikan nila telah menyebar di berbagai negara di dunia termasuk Indonesia. Ikan nila termasuk ikan komoditas penting, baik di Indonesia maupun di dunia. Data FAO (2012) menunjukkan permintaan di seluruh dunia terus bertambah dan menjadi makanan favorit peringkat 4 dari produk perikanan di Amerika pada tahun 2010. Ikan nila ukuran >500 g lebih digemari di pasar ekspor karena dapat menggantikan ikan kakap. Akan tetapi, untuk mencapai ukuran >500 g, budidaya ikan nila masih mengalami kendala. Secara dimorfisme seksual, ikan nila jantan dan ikan nila betina berbeda dalam kecepatan tumbuh. Ikan nila jantan lebih cepat tumbuh hampir dua kali lipat dibandingkan ikan nila betina (Popma dan Masser 1999). Selain itu, kematangan seksual dini pada ikan nila populasi campuran menjadi salah satu penghambat pertumbuhan pada ikan nila betina(Mair et al. 1995). Kematangan kelamin dini tersebut dapat menghambat pertumbuhan populasi karena energi yang digunakan untuk pertumbuhan sel somatik sebagian terbagi untuk perkembangan kematangan gonad.
Kematangan seksual pada ikan nila adalah fungsi dari usia, ukuran dan kondisi lingkungan. Populasi ikan nila di danau besar, matang gonad pada usia lanjut dan ukuran lebih besar dari spesies yang sama yang dibesarkan di kolam budidaya. Sebagai contoh, ikan nila di danau Afrika Timur matang gonad sekitar 10 sampai 12 bulan dengan ukuran 350 sampai 500 g. Dalam kondisi yang optimum, spesies yang sama akan mencapai kematangan seksual di kolam budidaya pada usia 5 sampai 6 bulan dengan ukuran 150 sampai 200 g. Ketika pertumbuhan lambat, kematangan seksual pada ikan nila lebih lambat satu atau dua bulan dan dapat bertelur pada bobot badan yang kurang dari 1 ons (20 g). Pada kondisi pertumbuhan yang baik di kolam, ikan nila mencapai kematangan seksual hanya dalam waktu 3 bulan, ketika bobot mencapai 60 sampai 100 gram (Popma dan Masser 1999), sehingga budidaya ikan nila menggunakan benih dengan kelamin jantan dan betina yang dicampurkan mengalami pertumbuhan
6
yang lebih lambat. Untuk itu budidaya monoseks jantan tetap menjadi pendekatan utama dalam industri budidaya ikan nila.
2.2 Determinasi dan diferensiasi kelamin
Proses diferensiasi kelamin merupakan proses perkembangan gonad ikan menjadi suatu jaringan yang definitif dan jenis kelamin individu ditentukan oleh faktor genetik dan lingkungan (Silverin et al. 2000). Secara genetik, jenis kelamin ditentukan oleh kromosom yang telah terbentuk pada saat pembuahan (Matty 1985).Selanjutnya perkembangan jaringan gonad dimulai setelah sel bakal gonad (primordial germ cell; PGC) berdiferensiasi menjadi testis atau ovarium. Sebelum diferensiasi terjadi, ikan mengalami fase labil karena PGC masih belum terdiferensiasi menjadi oogonia atau spermatogonia. Dalam proses diferensiasi ini, faktor lingkungan sangat berpengaruh (Van Winkoop dan Timmermans 1992) dan pada kondisi normal, individu dengan gonad XX akan berkembang menjadi betina yang memiliki ovarium, sedangkan individu dengan gonad XY akan berkembang menjadi jantan yang memiliki testis.
Fase labil pada ikan memungkinkan untuk dilakukan rekayasa diferensiasi kelamin. Jika selama periode labil tersebut larva diintervensi dengan bahan-bahan seperti hormon androgen atau estrogen, maka perkembangan gonad dapat berlangsung secara berlawanan dengan yang seharusnya (Park et al. 2004). Pada kondisi ini terjadi pengarahan morfologi jenis kelamin ikan, tingkah laku, serta fungsi pada saat periode kritis, di mana otak embrio yang telah terbentuk masih dalam keadaan bipotensial untuk mengarahkan jenis kelamin.Diferensiasi kelamin pada ikan nila terjadi hingga 30 hari setelah penyerapan kuning telur, atau 37 hari setelah menetas (Kwon et al. 2000).
2.3 Sex reversal
Sex reversal adalah suatu teknologi yang mengarahkan perkembangan kelamin menjadi betina atau jantan. Cara ini dilakukan pada waktu gonad ikan belum berdiferensiasi secara jelas menjadi jantan atau betina, danhal tersebut tidak mengubah genotipenya.Yamamoto (1969) menyatakan bahwa perubahan kelamin secara buatan akan sempurna jika dilakukan sebelum proses diferensiasi kelamin, dan berlanjut sampai diferensiasi kelamin terjadi. Tujuan utama dari
7
penerapan teknik sex reversaladalah menghasilkan populasi monoseks (tunggal kelamin). Dengan membudidayakan ikan monoseks akan didapatkan berbagai manfaat, antara lain mendapatkan ikan dengan pertumbuhan yang cepat, mencegah pemijahan liar, mendapatkan penampilan yang baik, dan menunjang genetika ikan (Zairin 2002).
Pada dasarnya ada dua metode yang digunakan untuk mendapatkan atau memperoleh populasi monoseks, yaitu cara langsung melalui terapi hormonal dan cara tidak langsung atau rekayasa kromosom. Pada terapi langsung, hormon androgen dan estrogen mempengaruhi fenotipe tetapi tidak mempengaruhi genotipe (Zairin 2002). Metode langsung dapat diterapkan pada semua jenis ikan, apapun jenis kromosom kelaminnya.
Peningkatan penggunaan hormon steroid sintetis untuk menghasilkan populasi monoseks ikan nila untuk sistem produktif yang intensif dapat menyebabkan masalah kesehatan lingkungan dan masyarakat, dan telah dilarang oleh pemerintah dengan dikeluarkannya Surat Keputusan Menteri No: Kep. 20/Men/2003 tentanglarangan penggunaan 17α-Methyl Testosterone (DKP 2003).Alasan penggunaan hormon steroid sintetis untuk ikan nila adalah karena ikan nila betina, umumnya sudah bereproduksi pada ukuran kecil, dan menunjukkan pertumbuhansomatik yang lambat pada kepadatan tinggi. Sementara itu, ikan nila jantan menunjukkan tingkat pertumbuhan yang lebih cepat dan lebih disukai untuk budidaya monoseks (Hiness dan Watts 1995).
Mengingat adanya permasalahan dalam penggunaan hormon sintetik, maka diperlukan adanya bahan lain dalam sex reversal. Salah satu cara yang dianggap aman, yakni dengan penggunaan bahan alami yang ramah lingkungan, antara lain adalah dengan madu lebah hutan (Sukmara 2007, Utomo 2008). Perlakuan madu dalam sex reversal dapat dilakukan dengan beberapa cara, misalnya dengan perendaman induk atau larva (Martati 2006, Sukmara 2007), atau dengan pemberian pakan yang telah dicampur madu (Syaifuddin 2004, Mukti 2008, Utomo 2008). Pemilihan cara harus didasarkan pada efektivitas, efisiensi, palatabilitas, kemungkinan polusi, dan biaya. Metode perendaman adalah metode alternatif untuk mengatasi kelemahan yang terdapat pada pemberian melalui oral seperti terjadinya pencucian, teknis pencampuran yang mungkin
8
kurang homogen atau kurang efisien secara ekonomis. Dengan metode perendaman, diharapkan larutan yang digunakan akan masuk ke dalam tubuh ikan melalui proses difusi (Zairin 2002). Dengan demikian, penggunaan madu diharapkan mampu mengatasi masalah penggunaan hormon sintetik untuk kegiatan sex reversal dalam akuakultur, yang berdasarkan pada keamanan pangan dengan mengedepankan konsep back to nature(kembali ke alam).
2.4 Madu
Madu adalah cairan alami yang umumnya mempunyai rasa manis yang dihasilkan oleh lebah madu dari sari bunga tanaman (floral nektar), bagian lain dari tanaman (ekstra floral nektar), atau ekskresi serangga(SNI 2004). Karbohidrat merupakan fraksi terbesar dari madu, yakni kurang lebih 80%. Sebagian besar dari karbohidrat ini (85-95%) berupa monosakarida (fruktosa dan glukosa), berbentuk disakarida, oligosakarida dan polisakarida (White 1979 dalam Siregar 2002) sedangkan sisanya berupa kandungan mineral, vitamin, protein dan kandungan air.
Protein dalam madu berasal dari sisa-sisa larva, polen dan dari lebah itu sendiri. Protein madu terdapat dalam bentuk albumin, globulin,protease, pepton, histon, albumin,albuminoid, nukleoprotein dan asam-asam amino esensial (White 1979 dalam Siregar 2002). Selanjutnya dikatakan bahwa asam amino bereaksi perlahan-lahan dengan gula dan membentuk senyawa kuning atau coklat.
Kandungan vitamin dalam madu sangat sedikit, sehingga tidak signifikan secara nutrisi bila dihubungkan dengan jumlah madu yang biasa dikonsumsi (Siregar 2002). Madu mengandung berbagai mineral seperti kalium, kalsium, magnesium dan natrium yang bersifat alkali (Marhiyanto 1999). Kandungan mineral-mineral tersebut dapat mengakibatkan tubuh lobster air tawar menjadi alkali yang berpengaruh terhadap kelangsungan hidup kromosom X dan Y, sesuai dengan sifat kromosom X dan Y. Kromosom Y lebih tahan lama pada keadaan basa, sedangkan kromosom X tidak dapat bertahan lama, sehingga pada saat spermiasi, jumlah kromosom Y yang dihasilkan induk jantan lebih banyak daripada kromosom X (Toelihere 1979 dalam Irawan 2000).Semakin tinggi kandungan mineral, biasanya semakin gelap warna madunya (Gojmerac 1980 dalam Siregar 2002). Kalium mengatur regulasi testosteron dalam tubuh
9
dan berperan mengarahkan dan mengendalikan tindakan androgen. Kekurangan kalium menyebabkan sekresi testosteron menurun pada tikus jantan (Conteras-Sanchez dan Fitzpatrick2001).
2.5 Flavonoid
Dengan menggunakan teknik HPLC, diketahui bahwa madu mengandung 16 flavonoid, diantaranya adalah chrysin yang besarnya rata-rata 13% dari total flavonoid(Ferreres et al. 2006).Senyawa kimia yang diklasifikasikan sebagai phytochemical (isoflavonoid, flavonoid danligan) adalah steroid alami dengan kemampuan sebagai aromatase inhibitor yang bisa menekan biosintesis estrogen dalam sel (Eng et al. 2001). Tindakan tersebut terkait dengan struktur phytochemical yang stabil, dan berat molekulnya rendah sehingga dapat melewati membran sel (Ososki danKenelly 2003).Zat chrysin merupakan salah satu jenis flavonoid yang diakui sebagai salah satu penghambat enzim aromatase atau lebih dikenal sebagai aromatase inhibitor (Dean 2004). Tingkat hidroksilasi pada molekul meningkatkan kemampuan enzimatik inhibitor. Oleh karena itu jika dosis yang diberikan lebih tinggi, maka akan meningkatkan aktivitas penghambatan (Krazeisen et al. 2002).
Flavonoid bertindak sebagai fitoestrogen, karena senyawa ini memiliki struktur yang dikenali mirip estrogen untuk reseptor estrogen, sehingga senyawa ini bersaing dengan estrogen endogen untuk berikatan dengan reseptor. Akibatnya, mereka dapat bertindak sebagai anti estrogen atau estrogen lemah (Miyahara et al. 2003). Fitoestrogen biasanya estrogen lemah karena afinitas mereka lebih rendah untuk diterima oleh reseptor estrogen.
2.6 Aromatase dan aromataseinhibitor
Diferensiasi kelamin dapat dipengaruhi oleh ekspresi dari gen yang menghasilkan enzim aromatase. Aromatase adalah enzim sitokrom P-450 yang mengkatalis perubahan dari androgen menjadi estrogen. Aktivitas enzim aromatase terbatas pada daerah dengan target estradiol dan berfungsi untuk mengatur jenis kelamin, reproduksi dan tingkah laku (Callard et al. 2001).Ada 2 bentuk gen aromatase pada ikan, yaitu aromatase tipe otak, dan tipe ovari.Aktivitas aromatase di otak berperan dalam pengendalian tingkah laku,
10
sedangkan aromatase pada ovari mempengaruhi maturasi folikel dan tingkat ovulasi (Silverine et al. 2000). Aromatase otakberperan sebagai pengatur perilaku seks spesifik pada mamalia dan burung (Schlinger dan Callard 1990 dalam Melo dan Ramsdell 2001)dan mengatur reproduksi pada ikan (Pasmanik et al. 1988 dalam Melo dan Ramsdell 2001). Aktivitas enzim aromatase pada otak teleostei 100-1000 kali lebih tinggi dibandingkan dengan pada mamalia. Aktivitas enzim aromatase ovari kurang dari 1/10 kali aktivitas enzim aromatase otak (Tchaudakova dan Callard 1998 dalam Kitano et al. 2000).
Penghambatan aromatase bisa dikarenakan oleh faktor fisik, seperti suhu (Kitano et al. 2000, D’cottae et al. 2001), senyawa kimia steroid dan non steroidyang telah mencapai tingkat tertentu dalam keberhasilan sex reversalikan (Seralini dan Moslemi 2001). Hal ini dapat dianggap bahwa penghambatan tindakan aromatase oleh faktor fisikdan kimia bisa meniru efek pembalikan kelamin oleh pemberian androgen pada beberapa spesies ikan (Kwonet al. 2001).Aktivitas enzim aromatase berkorelasi dengan struktur gonad, yakni larva dengan aktivitas aromatase rendah akan mengarah pada terbentuknya testis, sedangkan aktivitas aromatase yang tinggi akan mengarah pada terbentuknya ovari (Sever et al. 1999).
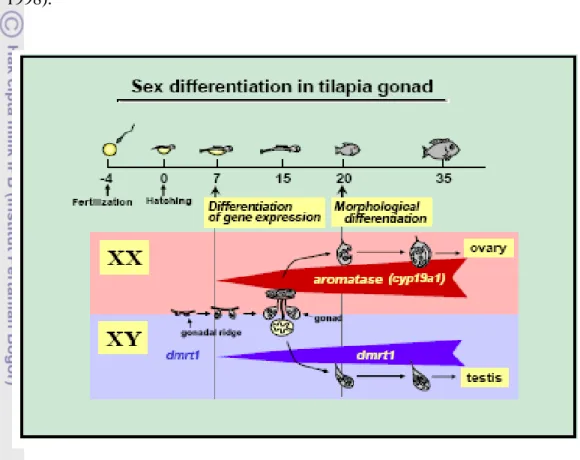
Dengan RT-PCR transkripsi aromatase (cyp19a1a), suatu enzim yang bertanggung jawabuntuk memproduksi 17β-estradiol , terungkap hanya dalam gonad XXpada 5 hari setelah menetas. Sebaliknya, ekspresi mRNA steroid 11β-hidroksilase(Cyp11b2), enzim bertanggung jawab untuk sintesis 11-ketotestosterone (11-KT, yaitu androgen dalam ikan), ditemukan di gonad XY pada 35 harisetelah menetas (Ijiri et al. 2008).Estradiol-17β memainkan peran pentingdalam diferensiasi ovarium pada ikan nila, sedangkan peran untuk 11-KT pada diferensiasi testis masih dipertanyakan. Jenis kelamin ditandai dari ekspresi secara specifikdari foxl2 dan cyp19a1a pada gonad XX dan dmrt1 pada gonad XY selama awal diferensiasi gonad yaitu 5-6 hari setelah menetas. Hal ini sangat pentinguntuk gonad dalam membedakan menjadi ovariumatau testis pada ikan nila (Ijiri et al. 2008).
Pada ovarium mamalia berbeda dengan ovarium burung, reptil, dan vertebrata yang lebih rendah yakni tanpa adanya estrogen. Estrogen diproduksi
11
secara normal oleh konversi biosintesis androgen oleh enzim aromatase (CYP19), yang merupakan mediator tunggal reaksi ini. Aromatase inhibitor mampu membalikkan jenis kelamin betina menjadi jantan pada kura-kura dan ayam, karena itu peran aromatase sebagai penentu kelamin betina telah dipostulasikan untuk spesies di mana penentuan seks bergantung pada suhu (Jeyasuria dan Place 1998).
Gambar 1 Diferensiasi gonad ikan nila (Ijiri et al. 2008).
Selanjutnya dikatakan bahwa diduga terdapat saklar untuk menurunkan kelimpahan transkripsi aromatase dalam otak penyu betina bersamaan dengan kenaikan eksponensial transkripsi aromatase di ovarium. Tingkataromatase mRNA umumnya berkurang di otak oleh aplikasi estradiol.
13
III. BAHAN DAN METODE 3.1 Analisis kandungan madu
Analisis kandungan bahan dalam madu berupa analisis proksimat dilakukan di Laboratorium Nutrisi Ikan FPIK IPB. Pengukuran kadar kalium menggunakan alat AAS (Atomic Absorbtion Spectrophotometer) dilakukan di Laboratorium Jasa Analisis Fateta IPB, pH madu diukur di Laboratorium Instrument Dept TIN-FATETA IPB, dan kadar total flavonoid di Laboratorium Biofarmaka LPPM, IPB.
3.2 Percobaan 1: respons ikan nila terhadap perendaman dalam madu dengan sumberberbeda
Penelitian ini dilakukan menggunakan rancangan acak lengkap (RAL) dengan empat perlakuan, dan masing-masing dilakukan tiga kali ulangan. Perlakuan yang diberikan adalah perbedaan sumber madu yaitu madu hutan, madu ternak, madu bakau dan kontrol yaitu perlakuan tanpa pemberian madu. Madu hutan diperoleh dari hutan sono di Gunung Kidul, madu ternak diperoleh dari peternakan lebah di Gunung Kidul, dan madu bakau dari hutan bakau Tanjung Jabung Jambi.
Dosis madu yang digunakan 10 mL/L airberdasarkan penelitian pendahuluan dengan lama perendaman 10 jam, berdasarkan peneliti sebelumnya. Larutan madu dibuat dengan cara mencampurkan sebanyak 10 mL madu dengan 1 liter air, kemudian dihomogenkan dengan cara pengadukan, dan diaerasi. Larva ikan nila yang digunakan adalah nirwana diperoleh dari BBPBAT Sukabumi. Larva ikan yang telah diberi perendaman, dipelihara dalam akuarium berukuran 40x30x60 cm3 dengan volume air 40 L sampai ikan berumur satu bulan, dan diberi pakan berupa cacing sutera secara ad libitum. Pemeliharaan ikan dilanjutkan di dalam hapa 1x1x1 m3 yang dipasang di kolam beton berukuran 20x10x1,5 m3 sampai ikan berumur 2 bulan. Ikan diberi pakan komersial dengan kadar protein 38% diberikan dengan cara at satiation dengan frekuensi tiga kali sehari.
14
3.3 Percobaan 2: respons ikan nila terhadap chrysin dan kalium
Pada percabaan dua ini juga menggunakan RAL dengan tiga perlakuan dan tiga kali ulangan. Perlakuan yang diberikan adalah perendaman dengan chrysinyang diproduksi oleh PhysiaMuscle, USA, kalium (KH2PO4) dan kontrol.Perendaman menggunakan kalium dilakukan sesuai dengan dosis hasil analisis kandungan kalium dalam madu yang digunakan dalam percobaan satu, yaitu 0,026 gram/L dengan lama perendaman 10 jam. Dosis ini juga setara dengan kandungan kalium dalam madu sebesar 0,022 g dalam 10 mL madu (Panse 2011). Pada perendaman menggunakan chrysin, dosis yang digunakan adalah 20 mg/Lberdasarkan penelitian yang telah dilakukan Dabrowski et al. (2005) selama 10 jam. Sebelum dilakukan perendaman menggunakan dosis dan lama waktu tersebut, dilakukan uji pendahuluan untuk lama waktu perendaman10 jam.Chrysin dilarutkan dalam DMSO (dimetil sulfoksida) 1%.Metode pemeliharaan ikan pasca-perendaman sama dengan yang dilakukan pada percobaan satu.
3.4 Identifikasi jenis kelamin
Identifikasi jenis kelamin dilakukan dengan menganalisis gonad ikan nila setelah berumur dua bulan dengan menggunakan metode asetokarmin. Metode analisis asetokarmin mengikuti metode Guerrero dan Shelton (1974). Asetokarmin adalah larutan pewarna yang digunakan untuk mewarnai jaringan gonad untuk pemeriksaan dengan mikroskop (Gunarso 1989).
3.5 Analisis ekspresi gen aromatase
Ekspresi gen aromatase dianalisis pada waktu 1, 6, 12, 24, dan 48 jam pasca perlakuan madu, chrysin, dan kalium, serta setelah ikan berumur dua bulan. Jaringan yang dianalisis pada larva adalah bagian setengah badan ke depan, sedangkan pada ikan berumur dua bulan adalah jaringan otak, dan gonad.
3.5.1 Ekstraksi RNA dan sintesis cDNA
Ekspresi gen aromatase dianalisis menggunakan metode RT-PCR. Sampel jaringan diambil pada waktu 1, 6, 12, 24, dan 48 jam pasca perlakuan madu, chrysin, dan kalium, serta setelah ikan berumur dua bulan. Pada fase larva, RNA total diekstraksi dari setengah bagian depan badan dari 6 ekor larva, sedangkan pada ikan berumur dua bulan adalah otak, dan gonad. RNA total diekstraksi
15
menggunakan Isogen (Nippon Gen, Japan) sesuai prosedur dalam manual. Pelet RNA dilarutkan dengan 30 µL DEPC 0,1%. Konsentrasi RNA total hasil ekstraksi diukur menggunakan RNA/DNA calculator (GeneQuant) pada panjang gelombang 260 dan 280 nm.
Sintesis cDNA dari RNA total dilakukan menggunakan kit Ready-To-Go You-Prime First Strand Beads, FSRMB, (GE Healthcare) dengan prosedur sesuai manual. Sebanyak 3 µg RNA total dilarutkan dalam 30 µL DEPC, diinkubasi pada suhu 65oC selama 10 menit, dan kemudian disimpan di atas es (on ice). Sampel RNA dipindahkan ke dalam tabung berisi kit FSRMB, dan ditambahkan 3
µL primer ’dT3’RACE-VECT’
(5’GTAATACGACTCACTATAGGGCACGCGTGGTCGACGGCCCGGGCTG GTTTTTTTTTTTTTTTTTTT-3’) dengan konsentrasi 1 µg/3 µL. Larutan dihomogenkan, dan selanjutnya diinkubasi pada suhu 37oC selama 1 jam. cDNA yang terbentuk ditambahkan 50 µL SDW steril, dan disimpan dalam freezer -20°C hingga akan digunakan.
3.5.2 Amplifikasi gen aromatase
Terdapat dua tipe gen aromatase, yaitu aromatase tipe 1 (tipe gonad), dan aromatase tipe 2 (tipe otak). Primer didesain berdasarkan sekuen gen aromatase tipe gonad dan otak ikan mujair (no akses: AF135850 dan AF135851). Primer tersebut adalah F: 5’-ATGGATCTGATCTCTGCTTGT-3’dan tiArm1-R:5’-CAAACCAAACAGAAAGAAGG-3’ untuk aromatase tipe gonad, dan tiArm2-F: 5’-ATGCTCCGGTAGAGGAGCTC-3’ dan tiArm2-R: 5’-CTCTC-CGTTTATCCACACCCG-3’ untuk tipe otak. Kondisi PCR yang digunakan untuk amplifikasi aromatase tipe gonad, yaitu pre-denaturasi 94°C selama 3 menit, 35 siklus pada denaturasi 94°C selama 30 detik, annealing 54°C selama 30 detik dan ekstensi 72°C selama 30 detik, serta ekstensi akhir 72°C selama 3 menit. Kondisi PCR yang digunakan untuk amplifikasi tipe otak, yaitu pre-denaturasi 94°C selama 3 menit, 35 siklus pada denaturasi 94°C selama 30 detik, annealing 59°C selama 30 detik dan ekstensi 72°C selama 30 detik, serta ekstensi akhir 72°C selama 3 menit. Hasil PCR diseparasi menggunakan elektroforesis dengan gel agarosa 1%. DNA divisualisasi dengan pewarna etidium bromida menggunakan cahaya ultraviolet.
16
3.6 Analisis pertumbuhan spesifik
Analisis pertumbuhan dihitung menggunakan rumus specific growth rate (Busacker et al. 1990):
Keterangan: Wt = Bobot rata-rata pada saat t (g); Wo= Bobot rata-rata pada saat tebar awal (g); t = Lama waktu pemeliharaan
3.7 Analisis kualitas air
Parameter kualitas air yang diukur adalah pH menggunakan pH meter, dan suhu menggunakan termometer. Pengukuran kualitas air dilakukan di awal perlakuan, saat pemeliharaan ikan di akuarium, serta pada saat pemeliharaan ikan di hapa.
3.8 Analisisstatistik
Data persentasekelamin ikan jantan, pertumbuhan bobotspesifik, dan tingkat kelangsungan hidup ikan dianalisis menggunakan metode sidik ragam denganbantuan program SPSS versi 16, dengan diuji lanjut Duncan.Kadar kandungan madu, dan tingkat ekspresi gen aromatase dianalisis secara deskriptif.
17
IV. HASIL DAN PEMBAHASAN
4.1 Kandungan biokimia madu dan respons ikan terhadap perendaman madu, chrysin dan kalium
Hasil analisis kandungan madu menunjukkan bahwa kadar flavonoid dan kalium tertinggi terdapat pada madu bakau, kemudian diikutioleh madu hutan dan madu ternak (Tabel 1). Madu bakau juga mempunyai kandungan mineral dan protein yang relatif tinggi dibandingkan madu hutan dan madu ternak.
Tabel 1 Kandungan proksimat (bobot kering), mineral, total flavonoid, kalium dan pH madu hutan, madu ternak dan madu bakau
Kandungan Bahan Madu Hutan Madu Ternak Madu Bakau
Karbohidrat (%) Lemak (%) Protein (%) Mineral (%) Total Flavonoid (%) Kalium (%) pH 98,39 0,22 1,00 0,39 0,99 0,33 3,40 97,94 0,23 0,86 0,97 0,79 0,12 3,48 96,04 0,47 2,40 1,16 1,52 0,35 3,71 Perendaman larva dengan menggunakan madu bakau menghasilkan jumlah jantan 100%, madu hutan 98,77% dan madu ternak 97,70% (Tabel 2). Secara statistik ketiga perlakuan madu tidak berbeda nyata (p>0,05), tetapi berbeda jika dibandingkan dengan kontrol (p<0,05). Hal ini dapat disimpulkan bahwa kadar kalium dan total flavonoid minimal seperti pada madu ternak dapat untuk mengarahkan diferensiasi kelamin ikan nila, karena ketiga jenis madu dapat meningkatan kelamin jantan sebesar 17-19% (rata-rata 18%).
Tabel 2 Nisbah ikan jantan, laju pertumbuhan bobot spesifik (SGR), kelangsungan hidup (KH), dan biomassa ikan hasil perlakuan madu dengan sumber berbeda
Perlakuan Nisbah ikan
jantan SGR KH Biomassa
Kontrol 80,86±1,62b 10,47±0,7a 86,67±3,33a 390,56±30,84a
Madu ternak 97,70±1,15a 10,41±0,7a 93,33±3,85a 405,50±18,01a Madu Hutan 98,76±1,23a 10,44±0,9a 90,00±1,92a 400,57±25,47a Madu Bakau 100,00±0,00a 10,49±0,1a 87,78±4,00a 400,57±25,47a
Huruf superskrip berbeda pada kolom yang sama menunjukkan berbeda nyata (p<0,05). Nilai ditampilkan dalam dalam bentuk rerata ± simpangan eror. Ikan dipelihara sampai berumur 2 bulan.
18
Hasil penelitian ini membuktikan bahwamadu cukup efektif untuk sex reversal ikan nila pada periode labil dan berpotensi tinggi untuk menggantikan hormon sintetis MT yang selama ini biasa digunakan. Menurut Matty (1985) diferensiasi kelamin pada ikan merupakan proses yang relatif labil dibandingkan vertebrata yang lebih tinggi, dan kondisi ini memungkinkan untuk dilakukan rekayasa kelamin.
Tabel 3 Nisbah ikan nila jantan, laju pertumbuhan spesifik (SGR), kelangsungan hidup (KH) dan biomassa ikan yang telah diberi perendaman chrysin dan kalium
Perlakuan Nisbah ikan
jantan SGR KH Biomassa
Kontrol 66,84±3,90a 11,03±0,08a 70,00±1,92a 235,99±10,81a
Chrysin 81,16±3,38b 11,70±0,05c 42,22±4,01b 213,66±25,90a
Kalium 80,64±5,61b 11,42±0,03b 44,44±5,09b 189,12±14,90a
Huruf superskrip berbeda pada kolom yang sama menunjukkan berbeda nyata (p<0,1). Nilai ditampilkan dalam bentuk rerata ± simpangan eror.Ikan dipelihara sampai berumur 2 bulan.
Hasil perendaman menggunakan chrysin menghasilkan jumlah jantan sebesar 81,16%, dan menggunakan kalium sebesar 80,64% (Tabel 3). Secara statistik persentase ikan kelamin jantan hasil perlakuan chrysin dan kalium menunjukkan perbedaan nyata dengan kontrol (p<0,1), tetapi tidak berbeda nyata antar perlakuan (p>0,1). Perlakuan chrysin dan kalium dapat meningkatkan jumlah ikan jantan sekitar 17%. Nilai tersebut relatif sama dengan hasil perlakuan perendaman dengan madu pada percobaan satu (18%). Namun demikian, pada perendaman madu, persentase ikan jantan pada kontrol relatif tinggi (80,86%). Hal tersebut dikarenakan perbedaan sumber larva ikan nila yang digunakan.
Peningkatan persentase ikan nila kelamin jantan hasil perendaman dengan chrysin dan kalium menunjukkan bahwa kedua bahan tersebut berperan penting dalam pengubahan arah diferesiasi kelamin ikan nila. Hal ini sejalan dengan yang dilaporkan oleh Howell et al. (1994) bahwa bahan fitokimia seperti chrysin, daidzein dan asam caffeic diduga dapat mendorong ketidakseimbangan hormon yang diperlukan untuk mengamati efek dalam diferensiasi kelamin ikan, dan secara in vitro telah dibuktikan bahwa beberapa bahan fitokimia mampu memblok biosintesis estrogen (Le Bail et al. 1998). Mekanisme yangsama dengan hasil uji in vitro diduga juga terjadi pada penelitian ini.
19
Berdasarkan kandungan kalium dalam madu (Tabel 1), kalium juga berpotensi dalam mengarahkan jenis kelamin jantan pada ikan nila, seperti pada pernyataan Capelo et al.(2001) bahwa kalium berfungsi sebagai pengarah diferensiasi kelamin ikan melalui modulasi peredaran testosteron, dan pengendalian tindakan androgen.Pertumbuhan bobot spesifik (SGR), tingkat kelangsungan hidup (KH), dan biomassaikan antar perlakuan madu dan dengan kontrol adalah tidak berbeda nyata (p>0,05; Tabel 2). Tidak adanya perbedaan nilai pertumbuhan dan biomassa antara perlakuan dan kontrol dapat dikatakan bahwa madu tidak memberikan efek yang berbeda terhadap pertumbuhan sampai pada akhir penelitian. Perbedaan pertumbuhan ikan nila mulai tampak ketika ikan mulai matang gonad, sementara lama waktu pemeliharaan ikan pada penelitian adalah dua bulan, sehingga belum bisa menggambarkan perbedaan pertumbuhan seperti yang dikatakan Popma dan Masser (1999) bahwa ikan nila jantan tumbuh 2 kali lebih cepat daripada ikan betina. Dikatakan pula bahwa dalam kondisi optimum, ikan nila akan mencapai matang gonad di kolam budidaya pada usia 5 sampai 6 bulan (150-200 g). Hal ini menunjukkan adanya peluang pertumbuhan yang lebih tinggi pada ikan hasil perlakuan disbanding ikan kontrol, jika ikan dipelihara lebih lanjut sampai mencapai matang gonad.
Sementara itu, peningkatan pertumbuhan pada ikan perlakuan chrysin dan kalium diduga disebabkan oleh kepadatan ikan lebih rendah akibat dari KH yang lebih rendah (p<0,1) dibandingkan dengan kontrol (Tabel 3). Selanjutnya, KH yang lebih rendah pada perlakuan chrysin dan kalium diduga karena kedua bahan kimia tersebutpada kadar yang diuji bersifat toksik pada larva.
4.2 Kualitas air
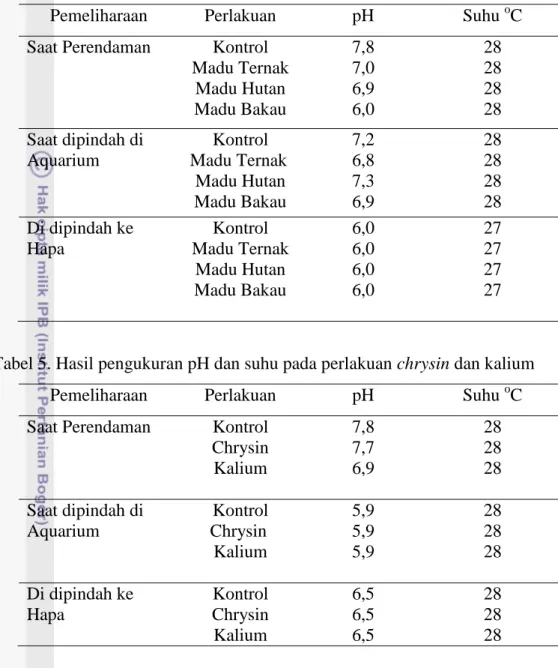
Dalam penelitian ini kualitas air yang diukur meliputi pH dan suhu. Nilai pH dan suhu air selama perlakuan dan pemeliharaan dari semua ikan perlakuan dan kontrol berada pada kisaran yang dapat ditoleransi oleh ikan nila, yaitu suhu 27-28oC dan pH 5,9-7,8 (Tabel 4 dan 5). Kondisi ini masih pada kisaran optimum bagi ikan nila (Popma dan Masser, 1999) bahwa nilai pH untuk ikan nila adalah 6-9 dan suhu 25 -28oC.
20
Tabel 4. Hasil pengukuran kualitas air pada perlakuan menggunakan madu
Pemeliharaan Perlakuan pH Suhu oC
Saat Perendaman Kontrol
Madu Ternak Madu Hutan Madu Bakau 7,8 7,0 6,9 6,0 28 28 28 28 Saat dipindah di Aquarium Kontrol Madu Ternak Madu Hutan Madu Bakau 7,2 6,8 7,3 6,9 28 28 28 28 Di dipindah ke Hapa Kontrol Madu Ternak Madu Hutan Madu Bakau 6,0 6,0 6,0 6,0 27 27 27 27
Tabel 5. Hasil pengukuran pH dan suhu pada perlakuan chrysin dan kalium
Pemeliharaan Perlakuan pH Suhu oC
Saat Perendaman Kontrol
Chrysin Kalium 7,8 7,7 6,9 28 28 28 Saat dipindah di Aquarium Kontrol Chrysin Kalium 5,9 5,9 5,9 28 28 28 Di dipindah ke Hapa Kontrol Chrysin Kalium 6,5 6,5 6,5 28 28 28
4.3 Ekspresi gen aromatase
Berdasarkan ekspresi gen aromatase pada jam 1, 6, 12, 24, dan 48 pasca perendaman (Gambar 2) terlihat perbedaan ekspresi gen pada tipe gonad (tipe 1) dan otak (tipe 2). Ekspresi gen aromatase tipe gonad terdeteksi pada jam ke-12, 24, dan 48 pada ikan kontrol, sedangkan pada ikan perlakuan tidak terdeteksi. Hal ini menunjukan pada jam ke-12 pasca perendaman, madu berhasil menekan ekspresi gen aromatase tipe gonad. Pada perlakuan chrysin dan kalium juga terlihat penekanan ekspresi aromatase gonad pada jam ke-12 (Gambar 3) sama halnya dengan pasca perendaman menggunakan madu. Hal ini menunjukan bahwa madu, chrysin dan kalium terbukti berhasil menekan ekspresi gen aromatase gonad pada
21
jam ke-12 pasca perlakuan, sehingga mengarahkan terbentuknya gonad jantan. Selanjutnya ekspresi gen aromatase tipe gonad pada K12, K24 dan K48 terlihat adanya perbedaan tingkat ekspresi gen, yaitu level ekspresi gen menurun dari K12 hingga K48,sementara itu, level ekspresi gen β-aktin relatif sama (Gambar 2). Hasil ini berbeda dari pernyataan Ijiriet al. (2008) bahwa ekspresi gen aromatase akan meningkat pada saat diferensiasi kelamin di gonad XX mulai dari hari ke-5 sampai 15 setelah menetas dan tetap tinggi setelah itu. Hal ini diduga karena RNA berasal dari kumpulan 6 larva, dan dijadikan satu sampel. Dari 6 larva tersebut, tidak diketahui mana yang berdiferensiasi menjadi jantan dan betina, sehingga ekpresi gen aromatase pada K12, K24, dan K48 tidak bisa menunjukkan peningkatan level ekspresi gen aromatase pada penelitian ini.
Ekspresi gen aromatase tipe otak terlihat pada semua titik pada perlakuan, sedangkan pada kontrol ekspresi gen tidak terlihat pada jam ke-12, 24, dan 48 (Gambar 2). Hal ini menunjukan ekspresi gen aromatase di otak terdeteksi sebelum diferensiasi kelamin terjadi. Akan tetapi, saat diferensiasi ovari terjadi, otak tidak mengekspresikan gen aromatase lagi. Estrogen yang diproduksi di otak mengarahkan beberapa tindakan pada satu set fungsi besar, dan belum tentu terkait dengan reproduksi (Nicolas et al. 2010).
Gambar 2. Ekspresi gen aromatase tipe 1 (gonad) (A), tipe 2 (otak) (B) dan β-aktin (C). M = marker DNA; P1-P48: Perlakuan madu pada jam ke-1 sampai 48 pasca perendaman; K1-K48: Kontrol; ♂O, ♀O = sampel otak jantan dan betina; ♂G, ♀G = sampel gonad jantan dan betina; tanda panah menunjukkantarget gen.
22
Gambar 3. Ekspresi gen aromatase tipe gonad (A) pada perlakuan madu (P12), kalium (Kal12), chrysin (Chry12) dan kontrol pada jam ke-12 (K12) setelah perendaman.β-aktin (B). M= marker DNA. Tanda panah menunjukkan target gen.
Ekpresi gen aromatase tipe gonad hanya terlihat pada gonad betina, sedangkan ekspresi gen aromatase tipe otak terlihat pada otak dan gonad jantan dan betina. Namun demikian, ada perbedaan ukuran fragmen DNA antara aromatase pada kontrol yaitu ~300 bp dan pada gonad betina ~200 bp untuk aromatase tipe gonad. Perbedaan ukuran fragmen DNA tersebut diduga karena adanya alternative splicing (Brett et al. 2002). Pada saat proses transkripsi, terjadi splicing intron sehingga mRNA hanya terdiri dari ekson saja. Alternativesplicing intron ini juga bisa menyebabkan perbedaan protein yang terbentuk (Brett et al.2002).
B A
200 bp 300 bp
23
V. SIMPULAN DAN SARAN 5.1 Simpulan
1. Madu hutan, madu ternak, dan madu bakau dapat digunakan untuk sex revesal ikan nila, dan memiliki efektivitas yang sama.
2. Chrysin dan kalium berperan penting dalam mengarahkan diferensiasi kelamin ikan nilamenjadi jantan.
3. Penekanan ekspresi aromatase tipe gonad oleh madu, chrysin dan kalium menyebabkan nila mengalami perubahan kelamin menjadi jantan.
5.2 Saran
Berbagai parameter perendaman madu dalam sex reversal ikan nila perlu diuji lebih lanjut untuk memperoleh hasil yang lebih baik, diantaranya lama perendaman, frekuensi perendaman, dan dosis perendaman.
25
DAFTAR PUSTAKA
Brett D, Pospisil H, Valcárcel J, Reich J, Bork P. 2002.Alternative splicing and genome complexity. Nat Genet 30(1): 29-30.
Busacker GP, AdelmanIR,GoolishEM. 1990. Growth. Di dalam: Schreck CB, Moyle PB. (eds). Methods for fish biology. American Fisheries Society. Callard GV, Tchoudakova AV, Kishida M, Wood E. 2001. Differential tissue
distribution, developmental programming, estrogen regulation andpromoter characteristics of cyp19 genes in teleost fish. Journal of Steroid Biochemistry and Molecular Biology 79: 305-314.
Capelo AS, Asuncion C, Francisco T, Teodomiro F, Rafael P. 2001. Potassium regulates plasma testosterone and renal ornithinedecarboxylase in mice. Federation of European Biochemical Societies 333: 32-34.
Contreras-Shanchez WM, Fitzpatrick MS. 2001. Fate of methyltestosteron in the pond environtment: Impact of Mt-contaminated soil on tilapia sex differentiation. Effluents and Pollution Research 2c (9er2c). Department of Fisheries and Wildlife. Oregon State University, USA
Dabrowski K, Gustavo R, Mary AGA. 2005. Use of phytochemicals as an environmentally friendly method to sex reverse Nile tilapia.Eleventh Work Plan, Fish Nutrition and Feed Technology Research 3 (11FNFR3): 287-303.
D’cottae H, Fostier A, Guiguen Y, Govoroun A. 2001. Aromatase plays a key role during normal and temperature-induced sex differentiation of tilapia (Oreochromis niloticus). Mol. Rep. Development 276: 265-276.
Dean W. 2004. Chrysin: is it an effective aromatase inhibitor? Vitamin Research Products News. Volume 18. Http://Vrp.Com/Art/1208.Asp.Htm. [11 September 2011].
(DKP) Departemen Kelautan dan Perikanan. 2003. Surat Keputusan Menteri No: Kep. 20/Men/2003 tentang Larangan Penggunaan 17α-Methyl Testosterone (Mt). DKP.
Eng ET, Williams D, Mandava U, Kirma U, Tekmal RR, Chen S. 2001. Suppression of aromatase (estrogen synthetase) by red wine phytochemicals. Breast Cancer Research andTreatment 67:133-146. (FAO) Food and Agriculture Organization. 2012. Marked reports of tilapia.
Globefish. FAO. http://www.globefish.org/tilapia-march-2012.html [30 Mei 2012]
Ferreres F, Francisco AT, Maria AIG, Francisco TL. 2006. An HPLC technique for flavonoid analysis in honey. Journal of the Science of Food and Agriculture 56: 45-56.
26
Guerrero RD, Shelton WL. 1974. An aceto-carmine squash technique for sexing juvenile fishes. The Progressive Fish-Culturist 36: 56.
Gunarso W. 1989. Mikroteknik. Departemen Pendidikan dan Kebudayaan Direktorat Jendral Pendidikan Tinggi, Pusat Antar Universitas Ilmu Hayat, Institut Pertanian Bogor.
Hines GA, Watts SA. 1995. Nonsteroidal chemical sex manipulation of tilapia. J World Aquacul Soc 26: 98-102.
Howell WM, Hunsinger RN, Blanchard PD. 1994. Paradoxical masculinization of female mosquito fish during exposure to spironolactone. The Progressive Fish-Culturist 56: 51-55.
Ijiri S, Hiroyo K, Tohru K, De-Shou W, Fumie S, Bindhu P, Masaru N, Y Nagahama. 2008. Sexual dimorphic expression of genes in gonads during early differentiation of a teleost fish, the Nile tilapia Oreochromis niloticus. Biology of Reproduction 78: 333–341
Irawan D. 2000. Pemisahan sel spermatozoa sapi madura kromosom X dan Y dengan teknik sentrifugasi menggunakan kolom percoll. [Skripsi]. Surabaya: Fakultas Kedokteran Hewan, Universitas Erlangga.
Jeyasuria P, Place A. 1998. Embryonic brain–gonadal axis in temperature-dependent sex determination of reptiles: a role for P450 aromatase (CYP19). J. Exp. Zool. 281: 428–449.
Kitano T, Takamune K, Nagahama Y, Abe S. 2000. Aromatase inhibitor and 17 alpha-methyltestosterone cause sex-reversal from genetical females to phenotypic males and suppression of P450 aromatase gene expression in Japanese flounder (Paralichthys olivaceus). Molecular Reproduction and Development 56: 1-5.
KrazeisenA, Breitling R, Moller G, Adamski J. 2000. Human 17β-hydroxysteroid dehydrogenase type 5 is inhibited by dietary flavonoids. In: Buslig S and Manthey J (Eds). Flavonoids in cell function. Kluwer Acad Press. USA. p151-160.
Kwon YJ, Haghpanah V, Kogson-Hurtado LM, McAndrew BJ, Penman DJ. 2000. Masculinization of genetic female Nile tilapia (Oreochromis niloticus) by dietry administration of an aromatase inhibitor during sexual differentiation. The Journal of Experimental Zoology 287: 46-53.
Le Bail JC, Laroche T, Marre-Fournier F, Habrioux G. 1998. Aromatase and 17β-hydroxysteroid dehydrogenase inhibition by flavonoids. Cancer Let-ters 133: 101-106.
Mair GC, Abucay JS, Beardmore JA, Skibinski DOF. 1995. Growth performance trials of genetically male tilapia (GMT) derived from YY-males in Oreochromis niloticus L.: on station comparisons with mixed sex and sex reversed male populations. Aquaculture 137: 1-4.
27
Marhiyanto B. 1999. Peluang Bisnis Beternak Lebah Madu. Gitamedia. Surabaya. Hal. 95.
Martati E. 2006. Efektivitas madu terhadap nisbah kelamin ikan gapi (Poecilia reticulata Peters). [Skripsi]. Bogor: Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Matty AJ. 1985. Fish endocrinology. Timber Press Portland. USA.
Melo AC, Ramsdell JS. 2001. Sexual dimorphism of brain aromatase activity in medaka: induction of a female phenotype by estradiol. EnvironHealth Perspect 109: 257-264.
Miyahara M, Ishibashi H, Inudo M, Nishijima H, Iguchi T, Guillette LJ, K. Arizono, 2003. Estrogenic activity of a diet to estrogen receptors -alpha and -beta in an experimental animal. Journal of Health Science 49:481-491.
Mukti A, Mubarak AS, Ermawan A. 2009. Pengaruh penambahan madu dalam pakan induk jantan lobster air tawar red claw (Cherax quadricarinatus) terhadap rasio jenis kelamin larva. Jurnal Ilmiah Perikanan dan Kelautan 1 (1): 37-42
Nicolas D, Yann Le P, Karen M, Sok-Keng T, b, Elisabeth P, Colette V, Isabelle A, François B, Farzad P, Bon-chu C, Olivier K. 2010. Review. Aromatase in the brain of teleost fish: Expression, regulation and putative functions.Frontiers in Neuroendocrinology 31: 172–192
Ososki AL, Kennelly EJ. 2003. Phytoestrogens: a review of the present state of research. Phytotherapy Research 17: 845-869.
Panse S. 2011. Potassium rich foods: list of foods high in potassium. Usda National Nutrient Database. Buzzle.Com. Intelligent Life on the Web. Update 25-11-2011.
Park IS, Kim JH, Cho SH, Kim DS. 2004. Sex differentiation and hormonal sex reversal in the bagrid catfish (Pseudobagrus fulvidraco Richardson). Aquaculture 232: 183-193.
Phelp RWC, Sanchez GM, Couturie M, Abiado, Darbowski K. 2001. Studies of the fate of metiltestosteron and it’s metabolism in tilapia and on the use of pytochemicals as an alternatif method to produce a monosex population of tilapia reproduction. Aquaculture Collaborative Research Support Program. Management Entity Oregon State University. Mexico.
Popma T, Masser M. 1999. Tilapia life history and biology. Southern Regional Aquaculture Center Publication No.283.
Seralini GE, Moslemi S. 2001. Aromatase inhibitors: past, present and future. Molecular and Cellular Endocrinology 178:117-131.
28
Sever DM, HallidayT, WaightV, BrownJ, DaviesHA,MoriartyEC. 1999. Sperm storage in female of the smoth new (Triturus vulgaris L.): ultrastructure of the spemathecal during the breeding season. Journal of Experimental Zoology 283 : 51-70.
Silverin B, Baillien M, Foidart A, Balthazart J. 2000. Distribution of aromatase activity in the brain and peripheral tissues of passerine and nonpasserine avian species. General and Comparative Endocrinology 117: 34–53. Siregar HC. 2002. Pengaruh metode penurunan kadar air, suhu dan lama
penyimpanan terhadap kualitas madu. [Tesis]. Bogor: Program Studi Ilmu Ternak. Institut Pertanian Bogor.
(SNI) Standar Nasional Indonesia. 2004. Madu. 01-3545-2004. SNI.
Sukmara. 2007. Sex reversal pada ikan gapi (Poecilia reticulata Peters) secara perendaman larva dalam larutan madu 5ml/l. [Skripsi]. Departemen Budidaya Perairan, Fakultas Perikanan Dan Ilmu Kelautan. Institut Pertanian Bogor.
Syaifuddin A. 2004.Pengaruh pemberian suplemen madu pada pakan larva ikan nila (Oreochromis niloticus) GIFT terhadap rasio jenis kelaminnya. [Skripsi]. Fakultas Perikanan. Universitas Brawijaya.
Utomo B. 2008. Efektivitas penggunaan aromatase inhibitor dan madu terhadap nisbah kelamin ikan gapi (Poecilia reticulata Peters). [Skripsi]. Program Studi Teknologi dan Manajemen Perikanan Budidaya, Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Van Winkoop A, Timmermans LPM. 1992. Phenotypic changes in germ cells during gonadal development of the common carp Cyprinus carpio and immunohistochemical study with anti-carp spermatogonia monoclonalantibodies. Histochemistry 98: 289– 298.
Yamamoto T. 1969. Sex differentiation. In: Hoar W, Randall D. (Eds.). Fish Physiology p117-175.
Zairin MJr. 2002. Sex reversal memproduksi benih ikan jantan atau betina. Jakarta: Penebar Swadaya.
29
31
Lampiran 1. Analisis statistik perlakuan madu Descriptives N Mean Std. Error 95% Confidence Interval for Mean
Min Max Lower Bound Upper Bound KH Kontrol 3 86,6633 3,33333 72,3212 101,0055 83,33 93,33 M.Ternak 3 93,3333 3,84804 76,7766 109,8901 86,67 100,00 M, Hutan 3 90,0000 1,92258 81,7278 98,2722 86,67 93,33 M. Bakau 3 87,7767 4,00540 70,5428 105,0105 80,00 93,33 Total 12 89,4433 1,63251 85,8502 93,0365 80,00 100,00 % Jantan Kontrol 3 80,8567 1,62498 73,8650 87,8484 78,57 84,00 M.Ternak 3 97,7000 1,15209 92,7430 102,6570 96,43 100,00 M, Hutan 3 98,7667 1,23333 93,4601 104,0733 96,30 100,00 M. Bakau 3 100,0000 ,00000 100,0000 100,0000 100,00 100,00 Total 12 94,3308 2,41067 89,0250 99,6367 78,57 100,00 Biomassa Kontrol 3 390,5600 30,84339 257,8516 523,2684 345,75 449,68 M.Ternak 3 405,5000 18,01361 327,9937 483,0063 374,40 436,80 M, Hutan 3 400,1767 30,72635 267,9719 532,3815 351,00 456,68 M. Bakau 3 400,5733 25,46754 290,9954 510,1513 354,00 441,72 Total 12 399,2025 11,53473 373,8147 424,5903 345,75 456,68 SGR Kontrol 3 10,4700 ,07234 10,1587 10,7813 10,34 10,59 M.Ternak 3 10,4133 ,06960 10,1139 10,7128 10,30 10,54 M, Hutan 3 10,4433 ,09025 10,0550 10,8316 10,30 10,61 M. Bakau 3 10,4933 ,06360 10,2197 10,7670 10,42 10,62 Total 12 10,4550 ,03306 10,3822 10,5278 10,30 10,62
Test of Homogeneity of Variances
Levene Statistic df1 df2 Sig. KH ,659 3 8 ,600 % Jantan 4,344 3 8 ,043 Biomassa ,414 3 8 ,748 SGR ,130 3 8 ,940
32 ANOVA Sum of Squares df Mean Square F Sig. KH Between Groups 77,844 3 25,948 ,758 ,548 Within Groups 273,948 8 34,244 Total 351,793 11
% Jantan Between Groups 734,162 3 244,721 59,446 ,000
Within Groups 32,934 8 4,117
Total 767,095 11
Biomassa Between Groups 351,538 3 117,179 ,054 ,982
Within Groups 17211,050 8 2151,381 Total 17562,589 11 SGR Between Groups ,011 3 ,004 ,214 ,884 Within Groups ,134 8 ,017 Total ,144 11 Multiple Comparisons Dependent Variable (I) perlakuan (J) perlakuan Mean Difference (I-J) Std. Error Sig. 90% Confidence Interval Lower Bound Upper Bound KH Dunnett T3 1 2 -6,67000 5,09102 ,724 -24,6644 11,3244 3 -3,33667 3,84804 ,919 -18,2615 11,5881 4 -1,11333 5,21098 1,000 -19,6252 17,3985 2 1 6,67000 5,09102 ,724 -11,3244 24,6644 3 3,33333 4,30159 ,945 -14,1152 20,7819 4 5,55667 5,55433 ,872 -13,9289 25,0422 3 1 3,33667 3,84804 ,919 -11,5881 18,2615 2 -3,33333 4,30159 ,945 -20,7819 14,1152 4 2,22333 4,44292 ,992 -16,0265 20,4732 4 1 1,11333 5,21098 1,000 -17,3985 19,6252 2 -5,55667 5,55433 ,872 -25,0422 13,9289 3 -2,22333 4,44292 ,992 -20,4732 16,0265 Nisbah kelamin jantan (%) Dunnett T3 1 2 -16.84333* 1,99194 ,007 -24,1404 -9,5463 3 -17.91000* 2,04001 ,005 -25,2723 -10,5477 4 -19.14333* 1,62498 ,022 -27,7602 -10,5264 2 1 16.84333* 1,99194 ,007 9,5463 24,1404 3 -1,06667 1,68772 ,979 -6,9946 4,8613 4 -2,30000 1,15209 ,483 -8,4093 3,8093