MASKULINISASI IKAN NILA
Oreochromis niloticus
DENGAN PEMBERIAN TEPUNG TESTIS SAPI
MUSLIM
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Maskulinisasi Ikan Nila Oreochromis niloticus Dengan Pemberian Tepung Testis Sapi adalah benar hasil karya yang belum pernah diajukan dalam bentuk apapun kepada Perguruan Tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juli 2010
RINGKASAN
MUSLIM. Maskulinisasi Ikan Nila Oreochromis niloticus dengan Pemberian Tepung Testis Sapi. Dibimbing oleh MUHAMMAD ZAIRIN JUNIOR dan NUR BAMBANG PRIYO UTOMO.
Laju pertumbuhan ikan nila (Oreochromis niloticus) jantan lebih cepat dibandingkan dengan ikan betina, oleh karena itu dalam usaha pembesaran ikan nila sebaiknya menggunakan benih monosek jantan. Salah satu teknik untuk memperoleh benih monosek jantan adalah masculinization dengan pemberian hormon secara oral (pakan). Hormon yang umum digunakan adalah hormon sintetik 17α-metyltestosteron. Namun penggunaan hormon ini di Indonesia sudah dilarang, oleh karena itu perlu dikaji bahan alami alternatif pengganti hormon sintetik. Salah satu sumber hormon testosteron alami adalah testis sapi. Penelitian ini bertujuan untuk mengetahui pengaruh pemberian tepung testis sapi terhadap pembentukan kelamin jantan ikan nila, kelangsungan hidup dan pertumbuhan ikan uji, serta menentukan dosis dan lama pemberian tepung testis sapi untuk maskulinisasi ikan nila.
Testis sapi yang digunakan dalam penelitian ini dengan bobot 200 – 450 gr, berasal dari sapi lokal (jenis bull) yang sudah berumur 5-7 tahun, dengan bobot 4-7 kuintal, sapi jantan normal (bukan sapi kastrasi). Pembuatan tepung testis sapi (TTS) menggunakan alat freeze dry. Kandungan hormone dalam TTS dianalisis dengan metode HPLC (High Performance Liquid Chromatography). Hasil analisis kandungan hormone testosterone dalam TTS sebesar 10.01 mcg/g TTS.
Rancangan percobaan yang digunakan dalam penelitian ini adalah Rancangan Acak Lengkap (RAL) Faktorial. Faktor pertama adalah dosis tepung testis sapi (TTS) dan faktor kedua adalah lama pemberian TTS. Faktor pertama (dosis TTS) terdiri dari empat (4) taraf yaitu D1(0%), D2(3%), D3(6%), D4 (9%), sedangkan faktor kedua (lama pemberian) terdiri dari tiga (3) taraf yaitu T1(7 hari), T2 (14 hari), T3(21 hari), masing-masing perlakuan dilakukan pengulangan sebanyak 3x ulangan. Ikan yang digunakan adalah ikan nila hitam, larva ikan berumur 7 hari, dengan kepadatan 40 ekor/akuarium. Akuarium yang digunakan berukuran 50 x 40 x 30 cm, sebanyak 36 unit yang dilengkapi sistem resirkulasi. Selama pemeliharaan ikan diberi pakan sebanyak 10-30%/hari. Ikan uji dipelihara selama 7 minggu sampai mencapai ukuran lebih dari 5 gram/ekor supaya mempermudah dalam proses pembedahan untuk mengamati gonad ikan uji.
kelamin jantan ikan nila, karena mengandung hormon jantan (testosteron) yang dapat mempengaruhi perkembangan karakteristik jantan ikan nila.
Kelangsungan hidup ikan uji pada minggu pertama pemberian TTS : D1T1 (100%), D2T1(100%), D3T1 (100%) dan D4T1 (99.2%). Pada minggu kedua kelangsungan hidup ikan uji : D1T2 (100%), D2T2(100%), D3T2 (97.5%), dan D4T2 (100%), pada minggu ketiga: D1T3 (99.2%), D2T3 (97.5%), D3T3 (100%) dan D4T3 (98.3%). Kelangsungan hidup ikan tidak dipengaruhi dosis pemberian maupun lama pemberian TTS. Dilihat dari data kelangsungan hidup ikan pada tiga minggu pertama (saat pemberian perlakuan TTS) dapat dinyatakan bahwa pemberian TTS aman terhadap ikan tidak menyebabkan kematian pada ikan. Selain itu data kelangsungan hidup ikan uji pada akhir penelitian juga masih tinggi yaitu : D1T1 (99.5%), D1T2 (98%), D1T3 (98.3%), D2T1 (98%), D2T2 (98%), D2T3 (95%), D3T1 (97.3%), D3T2 (98.3%), D3T3 (99.2%), D4T1 (95%), D4T2 (99%), dan D4T3 (97.5%). Hal ini merupakan keunggulan/kelebihan penggunaan TTS dibandingkan penggunaan hormon /bahan kimia sintetik lainnya yang dapat menimbulkan tekanan fisiologis pada ikan uji sehingga dapat menyebabkan kematian ikan uji saat maupun sesudah diberi perlakuan.
Pertumbuhan ikan uji yang diberi TTS lebih cepat dibandingkan dengan yang tidak diberi TTS, secara statistik berbeda nyata (P≥0.05). Data pertumbuhan mutlak ikan uji pada akhir penelitian masing-masing perlakuan adalah sebagai berikut : D1T1 (6.0 gram), D1T2 (6.20 gram), D1T3 (6.60 gram), D2T1 (7.11 gram ), D2T2 (7.20 gram ), D2T3 (7.47 gram ), D3T1 (7.39 gram ), D3T2 (7.50 gram ), D3T3 (7.68 gram ), D4T1 (8.10 gram ), D4T2 (8.30 gram ), dan D4T3 (8.50 gram ). Laju pertumbuhan harian ikan uji pada perlakuan D4 sebesar 12%, Dosis 6% (D3) sebesar 11.83%, Dosis 3% (D2) sebesar 11.76%, dan Dosis 0% (D1) sebesar 11.44%. Hal ini menunjukn bahwa pemberian tepung testis sapi berpengaruh terhadap pertumbuhan ikan uji. TTS merupakan bahan organic yang mengandung nutrisi seperti protein yang cukup tinggi yaitu sebesar 76.26%. dengan kandungan protein yang tinggi tersebut maka pertumbuhan ikan dapat lebih cepat dibandingkan dengan ikan kontrol yang tidak diberi TTS. Kualitas air selama penelitian dalam kisaran layak untuk pemeliharaan benih ikan nila. Kesimpulan dari penelitian ini adalah pemberian tepung testis sapi berpengaruh terhadap pembentukan kelamin jantan ikan nila, pemberian tepung testis sapi tidak menyebabkan kematian ikan uji, dosis pemberian TTS dan lama pemberian TTS yang terbaik adalah D3T2 (dosis 6% dan lama pemberian 14 hari).
ABSTRACT
MUSLIM. Masculinization of Nile Tilapia through Oral Administration of Bull Testes Meal. Under direction of MUHAMMAD ZAIRIN JUNIOR and NUR BAMBANG PRIYO UTOMO.
The synthetic steroid 17α-Methyltestosteron (MT) is commonly used as a feed additive to produce male population of nile tilapia (Oreochromis niloticus). The use of synthetic testosterone hormone is not recommended in Indonesia. This study was conducted to evaluate the effect of natural testosterone hormone in bull testes meal (BTM) on the masculinization of nile tilapia. Experimental design that is utilized two factors experiments in completely randomized design. Fry kept in 40-L glass aquaria at a density of 40 fry/aquarium. Fry (7 dph) received the BTM for 7 days (T1), 14 days (T2) and 21 days (T3) and doses 0% (D1), 3% (D2), 6% (D3), and 9% (D4). Result, indicated that there were significant (P<0.05) differences between group treated by BTM and untreated group. In the BTM treated group, doses and duration of treatments are not significantly different. The percentage of male fish on the three treatments was 83.3% (9%-14d, 9%-21d, 6%-21d: doses and duration, respectively), higher than the other groups but not significantly different with all treated group. There were no significant difference on the survival rate of fry (95-99.5%) between all treatments. Survival rate was not affected by the treatment of BTM (not significant P≥0.05). The body growth rate were not different between BTM treated groups and untreated group. The highest growth performance of fry was obtained by the treatment of 9% BTM. Conclusion, the best of treatment is D3T2 (6% BTM and 14 days), resulted male fish 81.67%.
©
Hak Cipta milik Institut Pertanian Bogor, tahun 2010
Hak Cipta dilindungi Undang-undang
1.
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa
mencantumkan atau menyebutkan sumbernya.
a.
Pengutipan hanya untuk kepentingan pendidikan, penelitian,
penulisan karya ilmiah, penyusunan laporan, penulisan kritik
atau tinjauan suatu masalah
b.
Pengutipan tersebut tidak merugikan kepentingan yang wajar
IPB
MASKULINISASI IKAN NILA
Oreochromis niloticus
DENGAN PEMBERIAN TEPUNG TESTIS SAPI
MUSLIM
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul :
Maskulinisasi Ikan Nila Oreochromis niloticusDengan Pemberian Tepung Testis Sapi
Nama
:
MuslimNIM :
C151080011Disetujui :
Komisi Pembimbing
Prof. Dr. Ir. M. Zairin Junior, M.Sc Dr. Ir. Nur Bambang P.U, M.Si Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Akuakultur,
Prof. Dr. Enang Harris, MS Prof. Dr. Ir.Khairil Anwar Notodiputro, MS
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT, yang telah memberikan rahmat dan hidayah-Nya sehingga penyusunan tesis ini dapat diselesaikan. Tesis ini berjudul ”Maskulinisasi Ikan Nila Oreochromis niloticus dengan Pemberian Tepung Testis Sapi”.
Pada kesempatan ini penulis mengucapkan rasa terima kasih kepada : 1. Bapak Prof. Dr. Ir. Muhammad Zairin Junior, M.Sc dan Bapak Dr. Ir. Nur
Bambang Priyo Utomo, M.Si selaku dosen pembimbing, yang telah banyak memberikan arahan, bimbingan dan semangat mulai dari penyusunan proposal sampai pembuatan tesis ini.
2. Istriku yang tercinta (Selly Oktarina, S.P, M.Si) dan anak-anak ku yang tersayang (Nabilah Zhafirah dan Muhammad Fauzan Zhafran), atas cinta dan kasih sayang yang terjalin sehingga menjadi motivator dalam setiap langkah hidupku.
3. Keluarga di Palembang dan Air Itam yang telah mendukung dan selalu mendoakanku.
4. Rektor Universitas Sriwijaya (Unsri), Dekan Fakultas Pertanian (FP) Unsri, Ketua PS Budidaya Perairan (BDA) FP Unsri serta seluruh dosen dan staf PS. BDA FP Unsri yang telah memberikan doa dan dukungan selama saya menjalankan tugas belajar di IPB ini.
5. Teman-teman AKU’08 yang telah bekerjasama dalam banyak hal, semoga persahabatan antar kita tetap terjalin walaupun dipisahkan jarak. Teman-teman AKU’07 dan AKU’09 juga saya ucapkan terima kasih atas persahabatan dan kerjasamanya.
Semoga tesis ini dapat bermanfaat bagi siapa saja yang memerlukannya. Baik sekarang maupun di masa yang akan datang.
Bogor, Juli 2010
DAFTAR ISI
METODE PENELITIAN ... 11
Waktu dan Tempat Penelitian... 11
Rancangan Penelitian... 11
Prosedur Penelitian ... 12
1. Pembuatan Tepung Testis... 12
2. Analisis Hormon Testosteron... 12
3. Analisis Proksimat Tepung Testis ... 12
4. Pemeliharaan Ikan Uji... 12
5. Pemeriksaan Gonad Ikan Uji... 13
Analisis Data... 15
HASIL DAN PEMBAHASAN ... 16
Persentase Ikan Jantan... 16
Kelangsungan Hidup Ikan Uji... 20
DAFTAR TABEL
Halaman
1. Desain rancangan percobaan yang digunakan dalam penelitian... 11 2. Persentase (%) ikan jantan akhir penelitian tiap perlakuan... 16 3. Kelangsungan hidup ikan (%), selama diberi TTS (SRt) tiap
perlakuan ... 20 4. Kelangsungan hidup ikan nila (%), akhir penelitian (SR) tiap
perlakuan... 21 5. Pertumbuhan mutlak ikan uji yang diberi tepung testis sapi
selama penelitian ... 23 6. Hasil proksimat testis sapi segar (TSS) dan tepung testis sapi
DAFTAR GAMBAR
Halaman
1. Grafik kecenderungan peningkatan persentase ikan jantan hasil
akhir penelitian maskulinisasi dengan pemberian TTS ... 17 2. Persentase ikan jantan, intersex dan betina hasil penelitian ... 18 3. Jaringan gonad ikan jantan (1), intersex (2) dan betina (3).
Pewarnaan acetokarmin. Mikroskop pembesaran 40X. (a) sel
DAFTAR LAMPIRAN
Halaman
1. Prosedur Pembuatan Tepung Testis... 36
2. Prosedur Pengukuran Hormon Testosteron... 37
3. Prosedur Analisia Proksimat TTS... 37
4. Data dan Uji Statistik Persentase Ikan Jantan... 40
5. Data dan Uji Statistik Kelangsungan Hidup Ikan Uji... 46
RIWAYAT HIDUP
PENDAHULUAN
Latar Belakang
Ikan nila (Oreochromis niloticus) merupakan salah satu ikan ekonomis di dunia (Biswas et al., 2005). Ikan ini memiliki keunggulan mudah berkembangbiak, pertumbuhan cepat, toleran terhadap kondisi lingkungan, berdaging tebal, disukai masyarakat, mudah dibudidayakan (Phelps dan Popma, 2000; Shalaby et al., 2007; Bombata dan Somatun, 2008). Karena mudah berkembangbiak, maka dapat terjadi pemijahan yang tidak terkontrol dan menyebabkan pertumbuhan menjadi lambat (Vandaraj dan Pandian, 1990; Phelps dan Popma, 2000; Dunham, 2004; Biswas et al., 2005).
Laju pertumbuhan ikan nila jantan lebih cepat dibandingkan dengan ikan betina (Popma dan Masser,1999; Phelps dan Popma, 2000; Manosroi et al., 2004; Dunham, 2004; Shalaby et al., 2007). Selisih biomass ikan pada waktu panen yang disebabkan oleh fenomena tersebut dapat mencapai 30-50% (Mair et al., 1995). Untuk mengatasi hal tersebut, dilakukan budidaya ikan nila tunggal kelamin (monosex) jantan. Budidaya monosex dilakukan untuk (1) memperoleh pertumbuhan yang lebih cepat, (2) mengendalikan pemijahan liar, dan (3) mendapatkan penampilan yang lebih baik (Zairin, 2003).
Salah satu teknik untuk mendapatkan benih ikan nila monosex jantan adalah melalui teknik sex reversal dengan pemberian hormon jantan (testosteron). Hormon yang umum digunakan adalah hormon sintetik 17α-methyltestosteron (Macintosh dan Little, 1995; Phelps dan Popma, 2000). Peredaran hormon tersebut terbatas, sehingga harga mahal dan juga sulit didapat. Menurut Phelps et al,. (2001), diduga residu hormon ini menjadi bahan pencemar lingkungan.
(2008), testis sapi yang dikeringkan menggunakan oven dengan suhu 60oC (Murni dan Jenny, 2001). Penelitian ini akan mengkaji efektivitas tepung testis sapi (TTS) yang dibuat dengan metode freeze drying terhadap maskulinisasi ikan nila.
Rumusan Masalah
Penggunaan hormon steroid sintetik (metyl testosteron) dalam kegiatan produksi benih ikan monosex jantan perlu dihindari karena sudah dilarang pemerintah. Oleh karena itu perlu dikaji sumber-sumber hormon testosteron alami untuk kegiatan tersebut. Salah satu sumber hormon testosteron alami adalah testis sapi (TS). TS mudah didapat, harga relatif murah, dan ukurannya besar. Namun, kelemahan penggunaan TS segar yaitu cepat larut, menurunkan kualitas air, palatability, dan sulit dalam penyimpanan. Oleh karena itu TS segar perlu dibuat menjadi tepung (TTS), sehingga tidak cepat larut, tidak menurunkan kualitas air, larva tertarik untuk makan, dan mudah dalam penyimpanan. Berapa dosis TTS dan berapa lama waktu pemberian TTS untuk keberhasilan maskulinisasi ikan nila belum diketahui.
Tujuan dan Manfaat
Tujuan penelitian ini adalah (1) mengetahui pengaruh pemberian TTS terhadap maskulinisasi ikan nila, (2) menentukan dosis optimal pemberian TTS untuk menghasilkan ikan nila berkelamin jantan dan (3) menentukan lama waktu pemberian TTS untuk menghasilkan ikan nila berkelamin jantan.
Hipotesis
Bentuk hipotesis yang diuji dalam rancangan dua faktor dalam rancangan acak lengkap seperti penelitian ini adalah sebagai berikut :
1. Pengaruh utama faktor 1 (Dosis TTS)
Ho : α1=...= αa=0 (faktor 1 tidak berpengaruh) H1 : paling sedikit ada satu i dimana αi≠0
2. Pengaruh utama faktor 2 (Lama Pemberian TTS) Ho : β1=...= βb=0 (faktor 2 tidak berpengaruh) H1 : paling sedikit ada satu j dimana βj≠0 3. Pengaruh sederhana (interaksi) Faktor 1 dan 2.
TINJAUAN PUSTAKA
Biologi Ikan Nila
Klasifikasi ikan nila termasuk Filum Chordata, Sub Filum Vertebrata, Kelas Osteichtyes, Sub Kelas Acanthoptherigii, Ordo Percomorphii, Sub Ordo Percoidea, Famili Cichlidae, dan Genus Oreochromis. Ikan nila adalah ikan endemic Afrika, tetapi sudah tersebar keseluruh dunia (Popma, 1999; Biswas et al., 2005).
Ikan nila bersifat omnivora, pemakan alga, tumbuhan air, invertebrata kecil, detritus dan beberapa organisme jasad renik lainnya, organisme dasar (benthos) seperti cacing, larva serangga air (Fitzsimmons, 1997). Dalam wadah budidaya ikan ini sangat responsif terhadap pakan buatan (pelet) baik pelet tenggelam maupun terapung (Cholik et al.,2005). Pertumbuhan kan nila jantan lebih cepat daripada betina (Popma dan Masser,1999; Phelps dan Popma, 2000; Manosroi et al., 2004; Dunham, 2004; Shalaby et al., 2006).
Reproduksi ikan nila bersifat prolific (beranak pinak). Kedewasaan pertama tercapai pada umur 4-6 bulan dengan berat 100-200 gram. Ikan ini dapat memijah 6-7 kali/tahun (Cholik et al.,2005). Ikan nila termasuk kelompok mouth brooders (mengerami telur di dalam mulut), dimana telur dibuahi pada substrat yang kemudian dengan segera diambil oleh induk betina untuk diinkubasi hingga beberapa hari setelah menetas di dalam mulutnya (buccal cavity) (Popma dan Masser, 1999).
Diferensiasi Kelamin
Terbentuknya kelamin (sex determination) pada ikan nila dipengaruhi tiga faktor yaitu genetik mayor, genetik minor dan lingkungan (environmental factor) (Baroiller et al,2009). Menurut Devlin dan Nagahama (2002), sex determination dikendalikan oleh aksi berbagai proses biokimia dalam tubuh termasuk berbagai protein berbeda seperti faktor transkripsi, enzim steroidogenis, reseptor dan messenger system.
Sex differentiation (diferensiasi kelamin) pada ikan teleost umumnya terjadi pada awal setelah penetasan. Proses diferensiasi kelamin pada teleost berangsur-angsur dan labil (Pandian, 1999). Proses diferensiasi kelamin adalah suatu proses perkembangan gonad ikan menjadi suatu jaringan yang definitif (sudah pasti). Pada kondisi normal tanpa ada gangguan, perkembangan gonad akan berlangsung secara normal dimana individu dengan genotof XX akan berkembang menjadi betina yang memiliki ovari, sedangkan individu dengan genotof XY akan berkembang menjadi jantan yang memiliki testis. Namun demikian, bila diintervensi dengan bahan-bahan tertentu seperti hormon maka perkembangan gonad dapat berlangsung berlawanan dengan seharusnya (Zairin, 2002).
Piferrer (2001) menyatakan bahwa diferensiasi kelamin meliputi seluruh aktivitas yang berhubungan dengan keberadaan gonad, yang meliputi perpindahan awal sel nutfah, munculnya bagian tepi gonad dan diferensiasi gonad menjadi testis atau ovari. Selanjutnya dikatakan bahwa diferensiasi kelamin pada ikan dapat melalui dua jalan yang berbeda. Jalan pertama gonad secara langsung berdiferensiasi menjadi ovari atau testis, sedangkan jalan kedua ikan akan berdiferensiasi menjadi ovari kemudian berubah menjadi testis.
Menurut Pandian dan Sheela (1995), masa diferensiasi kelamin ikan sangat beragam bergantung kepada spesies. Diferensiasi kelamin pada golongan Ochilds dan Cyprinodontids berlangsung antara 10-30 hari setelah penetasan, sedangkan pada golongan Anabamids antara 30-40 hari. Selanjutnya Nagy et al., (1981), menjelaskan bahwa diferensiasi kelamin pada ikan mas (Cyprinus carpio L) terjadi pada 8-98 hari setelah penetasan.
diferensiasi kelamin pada ikan nila terjadi pada saat larva berumur 6-7 hari setelah menetas sampai sekitar 27-28 hari setelah menetas (Yuniarti, et al., 2007). Menurut Kwon et al,. (2000), waktu yang paling sensitif untuk maskulinisasi (masa diferensiasi) ikan nila adalah pada hari ke-7 hingga ke-14 setelah penetasan.
Menurut Piferrer (2001), beragamnya diferensiasi kelamin ikan sangat bergantung pada kondisi periode labil masing-masing spesies ikan. Pandian dan Sheela (1995) juga menerangkan bahwa pada beberapa spesies ikan diferensiasi kelamin dapat dimulai dari embrio, setelah penetasan (larva), juvenil, bahkan dewasa.
Maskulinisasi
Sex reversal merupakan teknologi untuk mengarahkan perkembangan gonad/kelamin ikan. Pada penerapan teknologi ini ikan yang seharusnya berkelamin jantan diarahkan perkembangan gonadnya menjadi betina (feminimisasi) dan dari betina menjadi jantan (maskulinisasi). Hal ini bisa dilakukan karena gonad ikan pada waktu baru menetas belum berdiferensiasi secara jelas menjadi jantan atau betina (Zairin, 2002).
Beberapa teknik yang dapat diaplikasikan untuk meningkatkan persentase ikan jantan adalah manual sexing, sterilisasi, hibridisasi, gynogenesis, androgenesis, poliploidi, sex reversal, dan sex reversal yang dikombinasi dengan breeding (Dunham, 2004), hibridisasi interspesifik, dan produksi YY supermale (Biswas et al., 2005).
Untuk mengarahkan ikan berkelamin jantan, hormon yang digunakan adalah hormon androgen (Nakamura et al., 1998; Dunham, 2004; Pandian, 1999) Menurut Phelps dan Popma (2000), hormon androgen mempunyai dua aktifitas fisiologi yaitu androgenic activity dan anabolic activity. Berkembangnya karakteristik kelamin jantan terkait dengan androgenic activity.
Hormon androgen yang umum digunakan dalam pengarahan kelamin (sex reversal) adalah hormon sintetik 17α-methyltestosteron (Macintosh dan Little, 1995; Phelps dan Popma, 2000). Peredaran hormon tersebut terbatas, sehingga harga mahal dan juga sulit didapat. Menurut Phelps et al,. (2001), diduga residu hormon ini menjadi bahan pencemar lingkungan. DKP (2008), menyatakan larangan penggunaan 21 jenis obat-obatan dalam kegiatan budidaya perikanan, salah satunya steroid sintetik (metyltestosteron).
Faktor yang mempengaruhi keberhasilan sex reversal adalah ukuran dan umur ikan, lingkungan, spesies ikan, genetik, tipe hormon, dosis hormon, waktu pemberian hormon, lama pemberian hormon, cara pemberian hormon (Nagy et al., 1981; Hunter dan Donaldson, 1983; Phelps dan Popma, 2000; Dunham, 2004). Aplikasi sex reversal sudah banyak dilakukan seperti pada ikan guppy (Emilda, 2008), udang galah (Hadie et al.,2001; Arisandi, 2007; Triajie, 2008), ikan nila (Macintosh dan Little, 1995; Phelps dan Popma, 2000; Kwon et al,. 2000; Zairin, 2002; Dunham, 2004; Manosroi et al., 2004; Arsenia et al., 2007; Fitzpatrick et al., 2008).
Testis Sapi
Organ reproduksi sapi jantan dapat dibagi menjadi tiga komponen yaitu (a) organ kelamin primer yaitu testis, (b) sekelompok kelenjar-kelenjar kelamin pelengkap yaitu kelenjar vesikulares, prostatan dan cowper dan saluran-saluran yang terdiri epididymis dan vas deferens, (c) alat kelamin atau organ kopulatoris yaitu penis (Toelihere, 1981). Menurut Taylor dan Thomas (2004), organ reproduksi sapi terdiri dari testicle, epididymis, scrotum, vasdeferens, accessory glands dan penis.
Testis sapi berjumlah dua buah, dalam keadaan normal kedua testis berukuran sama besar, terletak pada daerah prepubis, terbungkus dalam kantong scrotum dan digantung oleh funiculus spermaticus yang mengandung unsur-unsur yang terbawa oleh testis dalam perpindahannya dari cavum abdominalis melalui canalis inguinalis ke dalam scrotum (Toelihere, 1981).
Testis sapi berukuran panjang 10-13 cm, lebar 5-6,5 cm dan berat 300 – 400 gr (Bearden, et al., 2004). Menurut Toelihere (1981), berat testis sapi tergantung pada umur, berat badan dan jenis/varietas sapi. Setiap testis banyak mengandung tubuli, di antara tubuli dalam jaringan interstitial mengandung pembuluh darah, lymphe, dan syaraf, terdapat sel-sel datar dan polygonal yang disebut sel-sel interstitial dari leydig, yang menghasilkan androgen (hormon jantan) terutama testosteron.
Testis sebagai organ kelamin primer mempunyai dua fungsi yaitu (1) menghasilkan spermatozoa atau sel-sel kelamin jantan, dan (2) mensekresikan hormon kelamin jantan (testosteron). Spermatozoa dihasilkan di dalam tubuli seminiferi sedangkan hormon androgen (testosteron) diproducer oleh sel-sel interstitial dari Leydig (Toelihere, 1981; Taylor dan Thomas, 2004).
Menurut Lindner (1961), kandungan hormon testosteron dalam testis sapi berkisar antara 14-231 µg.hr/testis. Menurut Hay et al (1961) konsentrasi hormon dalam testis sapi berkisar 0-25 mg/100 g. Menurut Hafez (1980), pada sapi kandungan hormon testosteron dalam cairan testis (testicular fluid) sebanyak 2,3 µg/100 ml.
berdasarkan hasil penelitian Murni dan Jenny (2001), kandungan hormon testosteron dari tepung testis sapi berkisar 142,8-1204 ng/gram. Menurut Adamu et al (2006), kandungan testosteron dari testis sapi White Fulani berkisar antara 15-18 ng mL-1. Menurut Meyer et al (2008), kandungan hormon testosteron dalam testis sapi segar 18,8 ppm dan kadar hormon testosteron dalam testis kering dapat lebih dari 60 ppm.
Hormon Steroid
Hormon merupakan suatu zat kimia organik yang dihasilkan oleh bagian tertentu berupa kelenjar dan langsung berdifusi ke dalam aliran darah yang menuju organ tertentu (Turner dan Baghara, 1976). Sedangkan menurut Schunack et al., (1990) hormon adalah senyawa aktif biologis, bekerja dalam konsentrasi yang kecil, yang dibentuk dalam jaringan atau organ tertentu dari organisme hewan dan manusia, melalui aliran darah mencapai organ sasaran dan memperlihatkan kerja spesifik. Hormon juga merupakan senyawa kimia yang dilepaskan dalam jumlah sedikit dan kemudian disebarkan melalui sirkulasi darah hingga memperoleh respon fisiologis yang khas pada organ sasaran (Lehninger, 1982).
Berdasarkan bahan pembentukannya secara kimiawi hormon dapat digolongkan menjadi tiga kelompok yaitu (1) hormon peptida : mempunyai residu asam amino meliputi semua hormon hypothalamus dan pituitary, insulin dan glukagon pada pankreas. (2) hormon amina : ukurannya kecil, dapat larut dalam air, mengandung grup amina meliputi adrenalin pada medula adrenal dan hormon tiroid, dan (3) hormon steroid : dapat larut dalam minyak meliputi hormon adrenal cortical, androgen dan estrogen (Lehninger, 1982; Siswandono dan Soekarjo, 1995)
Steroid adalah salah satu jenis asam lemak yang berupa hormon turunan kolesterol dengan struktur kimia terdiri dari 27 atom karbon. Steroid dihasilkan oleh kelenjar testis, ovarium, korteks adrenalis, dan placenta (Martin, 1979).
cholesterol, asam-asam empedu dan vitamin D (Toelihere, 1981; Gass dan Kaplan, 1982).
Hormon steroid banyak terdapat pada hewan yang dihasilkan testis, ovari, korteks dan plasenta (Voet et al,. 1999). Sementara Murray et al. (1997), mengatakan bahwa hormon steroid dibentuk dari jaringan adrenal di dalam tubuh. Devlin (1993), membagi hormon steroid kedalam dua kelompok yaitu hormon adrenal dan hormon seks (testosteron, estrogen dan progesteron).
Androgen (hormon jantan) diantaranya berfungsi dalam menstimulasi proses spermatogenesis tahap akhir, meningkatkan pertumbuhan dan aktifitas ekspresi dari organ kelamin pelengkap, perkembangan kelamin sekunder serta tingkah laku seksual (Martin, 1979). Menurut Ganong (1983), hormon androgen dihasilkan oleh testis dan berfungsi dalam maskulinisasi dan pertahanan tubuh. Androgen ada yang dihasilkan secara alami seperti testosteron, 11α-metyltestosteron serta dihydrotestosteron dan ada pula yang sintetik seperti 17α-metyltestosteron dan testosteron propionat (Sower dan Iwamoto, 1985).
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan di Lab. Biotek THP FPIK IPB (pembuatan TTS), Lab. Biotek LIPI (analisa hormon testosteron), Lab. Nutrisi BDP FPIK (uji proksimat dan pemeliharaan ikan), dan Lab. Pengembangbiakan dan Genetika Ikan BDP FPIK IPB (analisis gonad metode acetocarmin). Pelaksanaan penelitian dari Nopember 2009 – Januari 2010.
Rancangan Penelitian
Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap (RAL) Faktorial. Dua faktor perlakuan yaitu dosis TTS (faktor 1) dan lama pemberian TTS (faktor 2). Masing-masing perlakuan (faktor 1 dan faktor 2) diulang 3 kali.
Tabel 1. Desain rancangan percobaan yang digunakan dalam penelitian Dosis
(faktor 1)
Lama Pemberian (faktor 2)
T1 (7 hari) T2 (14 hari) T3 (21 hari)
D1 (0%) D1T1 D1T2 D1T3
D2 (3%) D2T1 D2T2 D2T3
D3 (6%) D3T1 D3T2 D3T3
D4 (9%) D4T1 D4T2 D4T3
Model rancangan penelitian yang digunakan sebagai berikut (Mattjik dan Sumertajaya, 2006) :
Yijk = µ + αi + βj + (αβ)ij + Єijk
Keterangan :
Yijk : Nilai pengamatan pada faktor 1 taraf ke-i, faktor 2 taraf ke-j dan ulang ke-k µ : Rata-rata umum
i : Pengaruh faktor 1 (dosis tepung testis) j : Pengaruh faktor 2 (lama pemberian)
(αβ)ij : Komponen interaksi dari faktor 1 dan faktor 2
Prosedur Penelitian
1. Pembuatan Tepung Testis
Testis sapi yang digunakan dalam penelitian ini dengan bobot 200 – 450 gr, berasal dari sapi local (jenis bull) yang sudah berumur 5-7 tahun, dengan bobot 4-7 kuintal, sapi jantan normal (bukan sapi kastrasi). Tepung Testis Sapi (TTS) dibuat kering segar dengan menggunakan alat Freeze Dry. Prinsip kerjanya adalah mengeringkan testis dengan suhu rendah, sehingga kandungan nutrisi testis tidak rusak termasuk hormon. Prosedur kerja yang dilakukan untuk membuat TTS dapat dilihat pada Lampiran 1.
2. Analisis Hormon Testosteron
Pengukuran kadar testosteron dilakukan dengan menggunakan alat HPLC (High Performance Liquid Chromatography). Prosedur kerja yang dilakukan untuk mengukur kandungan hormon testosteron dalam TTS dapat dilihat pada Lampiran 2. Hasil analisis kadar hormon TTS sebesar 10.01 mcg/g TTS.
3. Analisis Proksimat TTS
Kandungan nutrisi TTS diproksimat untuk mengetahui kadar protein, lemak, kadar abu, serat kasar dan air. Prosedur kerja yang dilakukan untuk melakukan uji prokimat kandungan nutrisi TTS dapat dilihat pada Lampiran 3. Hasil proksimat TTS (dalam bobot kering) : protein 76.26%, lemak 13.40%, kadar abu 7.41%, serat kasar 0.02% dan BETN 2.91%.
4. Pemeliharaan Ikan Uji
Prosedur kerja yang dilakukan dalam memelihara ikan adalah sebagai berikut : 4.1. Persiapan Wadah
Wadah yang digunakan akuarium ukuran 50x40x30 cm sebanyak 36 unit. Akuarium diisi 40 liter air yang sudah diendapkan dalam tandon selama 4 hari. Pergantian air setiap hari dilakukan dengan sistem resirkulasi. Dalam tandon dipasang heater untuk menstabilkan suhu pada kisaran 28-30oC.
4.2. Penebaran Larva
Ikan uji yang digunakan adalah larva ikan nila hitam (Oreochromis niloticus) diperoleh dari BBPBAT Sukabumi. Pengambilan larva pada saat larva berumur 1 hari (kuning telur masih ada), selama 5 hari dipelihara dalam akuarium sampai kuning telur habis (umur 7 hari), dengan bobot 0.01-0.02 g/larva. Kepadatan larva dalam akuarium sebanyak 1ekor/liter (Shalaby et al.,2007)
4.3. Pemberian Pakan
Pakan yang diberikan berupa pelet komersil ditambahkan dengan TTS. Sebelum diberikan, TTS dan pelet ditimbang menggunakan timbangan digital sesuai dengan perlakuan. Prosentase pemberian pakan harian 10-30%/hari dengan frekuensi pemberian 3-4 kali/hari (SNI 6141-2009). Pemberian TTS setiap hari dilakukan lebih dahulu sesuai dosis perlakuan baru kemudian diberi pelet. Setelah selesai pemberian pelet ditambah TTS selanjutnya ikan diberi pelet saja sampai panen. Ukuran pelet disesuaikan dengan tingkat perkembangan larva.
4.4. Pengukuran Kualitas Air
Pengukuran kualitas air meliputi suhu air, DO, pH dilakukan setiap hari menggunakan Termometer, DO meter, kertas lakmus dan NH3 diukur setiap minggu menggunakan spektrofotometer.
5. Pemeriksaan Gonad Ikan Uji
Metode yang digunakan dalam pemeriksaan gonad adalah metode asetokarmin (Zairin, 2002).
1. Pembuatan larutan asetokarmin
Larutan asetokarmin dibuat dengan melarutkan 0,6 g bubuk karmin dalam 100 ml asam asetat 45%. Larutan dididikan selama 2-4 menit kemudian didinginkan. Setelah dingin larutan disaring dengan kertas saring. Selanjutnya masukan dalam botol tertutup dan disimpan pada suhu ruang. 2. Pemeriksaan gonad
Pengambilan gonad dilakukan secara hati-hati menggunakan pinset. Untuk memudahkan pengambilan gonad, usus dan organ dalam perut ikan lainnya diangkat. Sebagian gonad diletakan di atas objek glass kemudian dicincang dengan menggunakan pisau scalpel sampai halus. Kemudian cincangan gonad di atas objek glass, diberi larutan asetokarmin sebanyak 2 tetes. Objek glass ditutup dengan cover glass. Gonad siap diamati dibawah mikroskop binokuler dengan pembesaran 40X.
Pengamatan Parameter
1. Persentase Ikan Jantan, Betina, Intersek
Perhitungan persentase ikan jantan, betina dan intersek menggunakan rumus sebagai berikut :
2. Kelangsungan Hidup Ikan Uji
Untuk mengetahui tingkat kelangsungan hidup/survival rate ikan yang diberi TTS, pada akhir perlakuan dihitung jumlah ikan yang hidup. Perhitungan kelangsungan hidup menggunakan rumus :
%
SRt : Survival rate selama perlakuan (treatment) pemberian TTS Ntt : Jumlah ikan pada akhir treatment (ekor)
Untuk mengetahui tingkat kelangsungan hidup ikan setelah masa perlakuan, pada akhir pemeliharaan dihitung jumlah ikan akhir. Perhitungan menggunakan rumus :
SR : Survival rate selama penelitian
No : Jumlah ikan pada awal penelitian (ekor) Nt : Jumlah ikan pada akhir penelitian (ekor)
3. Pertumbuhan Ikan Uji
Pengukuran bobot ikan dilakukan setiap minggu untuk perhitungan kebutuhan pakan dan pertumbuhan. Perhitungan pertumbuhan menggunakan rumus sebagai berikut :
W = Wt - Wo Keterangan :
W : Pertumbuhan mutlak ikan uji (gram)
Wt : Bobot rata-rata individu pada akhir pemeliharaan (gram) Wo: Bobot rata-rata individu pada awal pemeliharaan (gram)
Analisis Data
Data persentase ikan jantan, kelangsungan hidup dan pertumbuhan ikan dibuat tabulasi. Data dari tabulasi diolah menggunakan program Microsof Excel 2007 dan program MINITAB. Data yang sudah diolah dilakukan analisis sidik ragam (ANOVA) dengan uji F dan bila terdapat perbedaan nyata atau sangat nyata dilakukan uji lanjut berupa uji Kontras Polinomial Orthogonal. Data yang sudah dianalisis disajikan dalam bentuk tabel dan grafik dan dibahas sesuai dengan parameter uji yang diamati.
HASIL DAN PEMBAHASAN
Dari hasil penelitian mengenai maskulinisasi ikan nila dengan pemberian tepung testis sapi (TTS) diperoleh data persentase ikan nila jantan, kelangsungan hidup ikan selama pemberian pakan uji dan selama penelitian, pertumbuhan ikan selama penelitian, kadar hormon testosterone dan nutrisi yang terkandung dalam TTS, serta data kualitas air sebagai data penunjang.
Persentase Ikan Jantan
Persentase ikan jantan dan pertumbuhan merupakan elemen penting dari performa budidaya yang dapat digunakan untuk mengukur keberhasilan dari pembenihan ikan nila. Persentase ikan jantan berpengaruh terhadap tingkat pertumbuhan populasi ikan yang dibudidayakan. Hal ini disebabkan laju pertumbuhan ikan nila jantan lebih cepat dibandingkan dengan betina (Popma dan Masser,1999; Phelps dan Popma, 2000; Manosroi et al., 2004; Dunham, 2004; Shalaby et al., 2007).
Berdasarkan hasil pengamatan persentase ikan jantan, perlakuan dengan pemberian TTS menghasilkan persentase jantan lebih tinggi dibandingkan dengan perlakuan tanpa diberi TTS. Data pengamatan persentase ikan jantan pada akhir penelitian selengkapnya dapat dilihat pada Lampiran 4. Berikut tabel dan gambar rangkuman data persentase ikan jantan pada akhir penelitian :
Tabel 2. Persentase (%) ikan jantan akhir penelitian tiap perlakuan Dosis TTS
(Faktor1)
Lama Pemberian TTS (Faktor 2)
T1 (7 hari) T2 (14 hari) T3 (21 hari) D1 (0%)/control 56.7 ± 2.9 Bd 55.0 ± 5.0 Bd 55.0 ± 5.0 Bd D2 (3%) 75.0 ± 5.0 Ac 75.0 ± 0.0 Ac 80.0 ± 0.0 Ac D3 (6%) 76.6 ± 7.6 Ac 81.7 ± 2.9 Ac 83.3 ± 5.8 Ac D4 (9%) 80.0 ± 10.0 Ac 83.3 ± 2.9 Ac 83.3 ± 2.9 Ac Keterangan : Angka yang diikuti huruf yang sama pada kolom yang sama (A-B)
dan lajur yang sama (c-d) menunjukan tidak berbeda nyata (P≥0.05); rata-rata ± STDEV
Gambar 1. Grafik kecenderungan peningkatan persentase ikan jantan hasil akhir penelitian maskulinisasi dengan pemberian TTS
Dari data diatas ada kecenderungan semakin tinggi dosis TTS dan semakin lama waktu pemberian TTS, maka persentase ikan jantan semakin meningkat. Pemberian TTS dengan dosis 9% selama 14 hari dan 21 hari serta dosis 6% selama 21 hari menghasilkan persentase ikan jantan yang tertinggi yaitu sebesar 83.3%. Lama pemberian TTS tiap dosis tidak berpengaruh nyata (P>0.05). Namun dari data tersebut ada perbedaaan sangat nyata antara perlakuan pemberian TTS dengan perlakuan kontrol (tidak diberi TTS).
Persentase ikan jantan dari hasil penelitian ini lebih tinggi dibandingkan penelitian lain menggunakan testis sapi segar : Phelps et al,. (1996) dalam Phelps dan Popma (2000), sebesar 65% jantan; Iskandaria (1996) sebesar 62.2-70.6% jantan; Yulfianti et al,.(1995) sebesar 65.67% jantan. Hal ini menunjukan bahwa penggunaan testis sapi lebih efektif dibuat tepung (TTS) daripada testis sapi segar. Penggunaan testis sapi juga lebih efektif daripada menggunakan bahan alami lainnya seperti testis beri-beri (ram) sebesar 57% (Haylor dan Pascual, 1991) dalam Phelps dan Popma (2000); testis babi (hog) sebesar 83% jantan (Meyer et al, 2008).
Gambar 2. Persentase ikan jantan, intersek dan betina hasil penelitian Menurut Nakamura et al (1998), pemberian hormon steroid dengan dosis yang rendah tidak akan mampu untuk membentuk populasi jantan secara maksimal, dan menyebabkan terbentuknya individu interseks. Sebaliknya dosis terlalu yang tinggi akan menyebabkan efek kebalikan dari populasi yang diharapkan, dan terbentuknya individu steril. Terjadinya ikan intersex umumnya akibat pemberian hormon steroid dosis rendah (suboptimum) (Yamazaki, 1983).
Gambar 3. Jaringan gonad ikan jantan (1), intersex (2) dan betina (3).Pewarnaan acetokarmin. Mikroskop pembesaran 40X. (a) sel bakal sperma, (b) sel bakal telur
Terbentuknya kelamin (sex determination) pada ikan nila dipengaruhi tiga faktor yaitu major genetic factor, minor genetic factor dan environmental factor (Baroiller et al,2009). Menurut Devlin dan Nagahama (2002), sex determination dikendalikan oleh aksi berbagai proses biokimia dalam tubuh termasuk berbagai protein berbeda seperti faktor transkripsi, enzim steroidogenesis, reseptor dan messenger system.
b a
1 2
Faktor yang mempengaruhi keberhasilan sex reversal adalah ukuran dan umur, lama perlakuan, lingkungan (Phelps dan Popma, 2000), spesies ikan, genetic, tipe hormon, dosis hormon, waktu perlakuan (Dunham, 2004). Masa diferensiasi gonad pada ikan nila terjadi hingga 30 hari setelah penetasan, namun periode paling sensitif untuk pengarahan jenis kelamin pada ikan nila adalah pada 7-14 hari setelah menetas (Kwon et al.,2000). Menurut Yuniarti, et al., (2007), diferensiasi kelamin pada ikan nila terjadi pada saat larva berumur 6-7 hari setelah menetas sampai sekitar 27-28 hari setelah menetas. Faktor lingkungan yang berpengaruh terhadap pengarahan jenis kelamin adalah suhu (Smith et al.,1994; Nakamura et al, 1998; Phelps dan Popma, 2000).
Sex differentiation (diferensiasi kelamin) pada ikan teleost umumnya terjadi pada awal setelah penetasan. Proses difensiasi kelamin pada teleost berangsur-angsur dan labil (Pandian, 1999). Aplikasi teknik pengarahan kelamin umumnya dilakukan pada ikan yang masih dalam proses diferensiasi (periode labil) (Dunham, 2004). Pada periode labil ini kelamin ikan dapat diarahkan melalui induksi hormon (Pandian, 1999). Untuk mengarahkan ikan berkelamin jantan, hormon yang digunakan adalah hormon androgen (Nakamura et al., 1998; Dunham, 2004; Pandian, 1999). Menurut Phelps dan Popma (2000), hormon androgen mempunyai dua aktifitas fisiologi yaitu androgenic activity dan anabolic activity. Berkembangnya karakteristik kelamin jantan terkait dengan androgenic activity.
(nutrisi) yang berguna bagi tubuh ikan, tidak menimbulkan tekanan fisiologis pada ikan sehingga tidak menyebabkan kematian pada ikan, ramah lingkungan dan aman terhadap konsumen. Selain itu testis sapi termasuk sumberdaya lokal lebih mudah diperoleh dengan harga relatif murah.
Kelangsungan Hidup Ikan Uji
Kelangsungan hidup merupakan parameter penting dalam pemeliharaan ikan uji sehingga dapat diketahui hasil akhir dari pemberian perlakuan terhadap ikan uji. Dalam penelitian ini data kelangsungan hidup terdiri dari dua jenis yaitu kelangsungan hidup ikan selama diberi perlakuan (SRt) dan kelangsungan hidup ikan akhir penelitian (SR). Data SRt dan SR serta analisa statistiknya dapat dilihat pada tabel 2 dan tabel 3 di bawah ini.
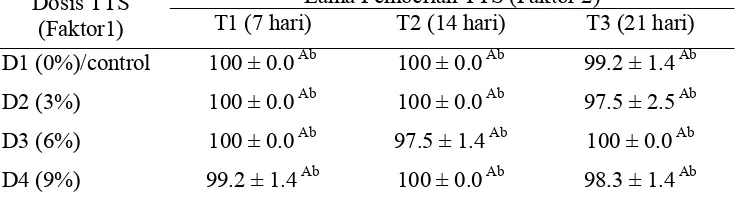
Tabel 3. Kelangsungan hidup ikan (%), selama diberi TTS (SRt) tiap perlakuan Dosis TTS
(Faktor1)
Lama Pemberian TTS (Faktor 2)
T1 (7 hari) T2 (14 hari) T3 (21 hari) D1 (0%)/control 100 ± 0.0Ab 100 ± 0.0Ab 99.2 ± 1.4 Ab D2 (3%) 100 ± 0.0Ab 100 ± 0.0Ab 97.5 ± 2.5 Ab D3 (6%) 100 ± 0.0Ab 97.5 ± 1.4Ab 100 ± 0.0 Ab D4 (9%) 99.2 ± 1.4Ab 100 ± 0.0Ab 98.3 ± 1.4 Ab Keterangan : Angka yang diikuti huruf yang sama pada kolom yang sama (A) dan
lajur yang sama (b) menunjukan tidak berbeda nyata (P≥0.05); rata-rata ± STDEV
Pada minggu pertama perlakuan, kelangsungan hidup (SR) ikan yang diberi TTS dosis 9% (D4) sebesar 99.2%, D3 (100%), dan D2 (100%). Hasil ini menunjukan bahwa SR ikan pada awal perlakuan tinggi hanya ada 1 ekor ikan yang mati pada perlakuan D4. Hal ini mungkin terkait dengan ikan yang digunakan dalam kondisi baik tidak stress karena ikan yang digunakan berasal dari telur yang baru menetas 1 hari, sehingga ikan sudah beradaptasi selama 5 hari dalam akuarium sebelum diberi perlakuan.
uji baik yang diberi perlakuan berbagai dosis TTS (D2,D3,D4) maupun yang tidak diberi TTS (D1), berdasarkan uji statitik hasilnya tidak berbeda nyata (P>0.05) (Lampiran 6). Dengan demikian dapat dinyatakan bahwa perlakuan pemberian TTS tidak berpengaruh terhadap kelangsungan hidup ikan uji.
Pada perlakuan dosis 9% diberi selama 7 hari (D4T1), setelah 7 hari pemberian TTS selanjutnya ikan diberi pakan pellet biasa tanpa TTS, begitu juga pada perlakuan lain. Kelangsungan hidup ikan akhir penelitian (SR) dihitung dari pengurangan jumlah ikan akhir perlakuan dan awal pemeliharaan. Data dan uji statistik kelangsungan hidup ikan pada akhir penelitian dapat dilihat pada tabel dibawah ini.
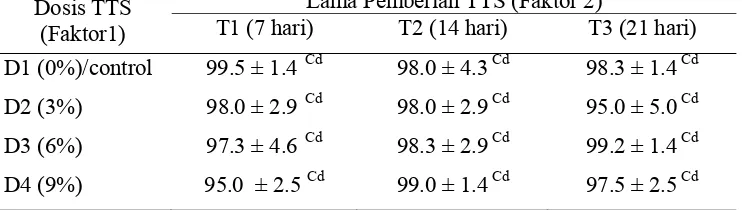
Tabel 4. Kelangsungan hidup ikan nila (%), akhir penelitian (SR) tiap perlakuan Dosis TTS
(Faktor1)
Lama Pemberian TTS (Faktor 2)
T1 (7 hari) T2 (14 hari) T3 (21 hari) D1 (0%)/control 99.5 ± 1.4 Cd 98.0 ± 4.3Cd 98.3 ± 1.4 Cd D2 (3%) 98.0 ± 2.9 Cd 98.0 ± 2.9Cd 95.0 ± 5.0 Cd D3 (6%) 97.3 ± 4.6 Cd 98.3 ± 2.9Cd 99.2 ± 1.4 Cd D4 (9%) 95.0 ± 2.5 Cd 99.0 ± 1.4Cd 97.5 ± 2.5 Cd Keterangan : Angka yang diikuti huruf yang sama pada kolom yang sama (C) dan
lajur yang sama (d) menunjukan tidak berbeda nyata (P≥0.05); rata-rata ± STDEV
Pada akhir penelitian SR ikan uji masih tinggi berkisar 95% - 99.5%. SR ikan yang diberi TTS (D4, D3 dan D2) secara statistik tidak berbeda nyata terhadap SR ikan yang tidak diberi TTS (P≥0.05). Pada perlakuan pemberian TTS rata-rata SR secara keseluruhan sebesar 97.2% - 98.3%, sedangkan rata-rata SR ikan yang tidak diberi TTS sebesar 98.3% (Lampiran 6).
Pada penelitian Meyer, et al., (2008), rendahnya SR ikan uji (40.2%) disebabkan testis sapi segar (tanpa dibuat tepung), kurang disukai larva ikan nila karena bentuknya yang lembek dan mudah larut dalam air sehingga mempengaruhi kualitas air menyebabkan nafsu makan ikan menurun. Bahkan dengan terlarutnya testis dalam air dapat meningkatkan bahan organik terlarut, dapat membentuk bahan beracun (amoniak) yang dapat menyebabkan kematian ikan uji.
Dalam penelitian ini SR ikan uji baik pada saat diberi perlakuan (SRt) maupun SR akhir penelitian lebih tinggi. Hal ini karena TTS tidak mudah larut, disukai oleh larva, mengandung nutrisi yang tinggi, sesuai dengan bukaan mulut larva ikan, tidak menyebabkan kekeruhan air sehingga tidak mempengaruhi kelangsungan hidup ikan uji.
Beberapa penelitian maskulinisasi ikan nila menggunakan hormon dan bahan kimia sintetik, menghasilkan SR lebih rendah dibandingkan dengan penelitian ini: Shalaby et al,.(2007), menggunakan 17α-MT secara oral SR sebesar 60-70%; Arsenia et al., (2007), menggunakan 17α-MT secara immersion/perendaman, SR sebesar 88.26-90.98%; Fitzpatrick et al., (2008), menggunakan 17α-MT dan MDHT secara immersion, SR sebesar 42-88%.
Secara umum, perlakuan menggunakan steroid sintetik menghasilkan mortalitas lebih tinggi (Pandian, 1999). Penggunaan hormon atau bahan kimia sintetik dalam sex reversal ikan mempengaruhi SR diduga adanya tekanan fisiologi terhadap ikan yang diberi perlakuan. Ikan uji masih dalam fase larva sehingga kondisi fisiologinya masih lemah. TTS adalah bahan alami yang tidak menyebabkan tekanan fisiologi ikan uji sehingga SR ikan uji tinggi.
Pertumbuhan Ikan Uji
Pertumbuhan adalah pertambahan bobot ikan uji selama pemeliharaan. Parameter pertumbuhan penting diamati untuk mengetahui kondisi fisiologis ikan uji yang dipelihara. Data hasil pengamatan pertumbuhan ikan uji selama penelitian dapat dilihat pada tabel di bawah ini.
Tabel 5. Pertumbuhan mutlak ikan uji yang diberi TTS selama penelitian Dosis TTS
(Faktor1)
Lama Pemberian TTS (Faktor 2)
T1 (7 hari) T2 (14 hari) T3 (21 hari) D1 (0%) 6.02 ± 0.4 Cd 6.20 ± 0.1 Cd 6.60 ± 0.2 Cd D2 (3%) 7.11 ± 0.1 Ab 7.20 ± 0.4 Ab 7.47 ± 0.1 Ab D3 (6%) 7.39 ± 0.1 Ab 7.50 ± 0.1 Ab 7.68 ± 0.2 Ab D4 (9%) 8.10 ± 0.3 Ab 8.30 ± 0.0 Ab 8.50 ± 0.1 Ab Keterangan : Angka yang diikuti huruf yang sama pada kolom yang sama (A-C)
dan lajur yang sama (b-d) menunjukan tidak berbeda nyata (P≥0.05); rata-rata ± STDEV
Dari tabel di atas, bahwa pertumbuhan ikan uji yang diberi TTS dengan dosis berbeda (D2, D3 dan D4) secara statistik berbeda nyata dengan ikan yang tidak diberi TTS (D1) (P≥0.05) (Lampiran 6). Namun pertumbuhan ikan yang diberi TTS dengan berbagai dosis secara statistik tidak berbeda nyata antar perlakuan. Dari data di atas pertumbuhan ikan uji cenderung meningkat dengan semakin tingginya dosis TTS yang diberikan. Pada perlakuan dosis 9% (D4) pertambahan bobot ikan uji rata-rata sebesar 8.3 gram, dosis 6% (D3) sebesar 7.523 gram dan dosis 3% (D2) sebesar 7.260 gram (Lampiran 6).
Laju pertumbuhan harian ikan uji pada perlakuan D4 sebesar 12%, Dosis 6% (D3) sebesar 11.83%, Dosis 3% (D2) sebesar 11.76%, dan Dosis 0% (D1) sebesar 11.44% (Lampiran 6). Dari data tersebut menunjukan kecenderungan semakin tinggi dosis TTS yang diberikan maka semakin cepat laju pertumbuhan harian ikan uji, walaupun secara statistik tidak berbeda nyata laju pertumbuhan ikan uji yang diberi perlakuan dosis 9%,6% dan 3%.
pertumbuhan sedangkan Aromatase Inhibitor dan bahan kimia sintetik lainya bukan bahan organic dan tidak mengandung nutrisi.
Pertumbuhan ikan dipengaruhi faktor internal dan faktor eksternal. Faktor eksternal antara lain kualitas air khususnya suhu air (Phelps dan Popma, 2000; Devlin dan Nagahama, 2002), nutrisi khususnya protein (Shalaby et al., 2007), dan faktor internal antara lain genetik (Dunham, 2004).
Faktor internal selain genetic pertumbuhan ikan juga dipengaruhi oleh faktor jenis kelamin. Pada ikan nila, jantan lebih cepat pertumbuhannya (Popma dan Masser,1999; Phelps dan Popma, 2000; Manosroi et al., 2004; Dunham, 2004; Shalaby et al., 2006). Pertumbuhan ikan nila betina lebih lambat karena kematangan gonad ikan nila betina lebih cepat sehingga energi untuk pertumbuhan berkurang karena digunakan untuk perkembangan telur (Dunhum, 2004). Ikan nila dapat matang kelamin dan siap memijah pada umur 4-6 bulan dengan berat 100-200 gram. Ikan ini dapat memijah 6-7 kali/tahun (Cholik et al.,2005).
Kualitas air khususnya suhu, beraksi mempengaruhi struktur dan fungsi protein serta makro molekul lain dalam tubuh ikan sehingga dapat mempengaruhi pertumbuhan ikan (Devlin dan Nagahama, 2002). Menurut Shalaby et al, (2007), tingkat kandungan protein dalam pakan ikan nila berpengaruh terhadap pertumbuhan ikan yang dipelihara.
Pemberian pakan yang mengandung hormon metyltestosteron, dapat meningkatkan daya cerna dan laju penyerapan nutrient sehingga pertumbuhan meningkat (Yamazaki, 1983). Menurut Phelps dan Popma (2000), hormon androgen mempunyai dua aktifitas fisiologi yaitu androgenic activity dan anabolic activity. Pertumbuhan ikan terkait dengan anabolic activity yaitu merangsang biosintesis protein.
Kadar Hormon Testosteron dan Proksimat TTS
Hormon merupakan suatu zat kimia organik yang dihasilkan oleh bagian tertentu berupa kelenjar dan langsung berdifusi ke dalam aliran darah yang menuju organ tertentu (Turner dan Baghara, 1976; Bearden, et al., 2004). Hormon testosteron dari testis sapi diproduksi oleh sel-sel interstitial dari Leydig (Toelihere, 1981; Taylor dan Thomas, 2004).
Kadar hormon testosterone yang terkandung dalam tepung testis sapi (TTS) yang digunakan sebesar 10.01 mcg/gr TTS. Hasil penelitian ini lebih tinggi dibandingkan hasil penelitian lainnya : 142.8-1.204 ng/gram (Murni dan Jenny, 2001); 2.300-27.700 pg/gr (Iskandariah, 1996); 18.8 ppm (Meyer et al.,2008). Tingginya kandungan hormon dalam TTS ini karena proses pembuatan TTS menggunakan metode fresh drying (kering segar). Dengan menggunakan metode ini tidak merusak bahan kimia termasuk hormon yang terkandung dalam bahan (TTS).
Kandungan hormon testosterone dalam TTS ini juga lebih tinggi daripada cacing laut, jeroan teripang, dan teripang segar. Hormon testosteron yang berasal dari cacing laut sebesar 0,574 mg/gr ekstrak (Alwir, 2001); teripang segar sebesar 6.124 ppm/kg (Kustriariyah, 2001); jeroan teripang sebesar 527 ppm/gr ekstrak steroid (Emelda, 2008).
Hormon testosteron yang terkandung dalam TTS ini termasuk hormon alami. Menurut Pandian dan Sheela (1995), ada 13 hormon steroid yang digunakan untuk sex reversal yang terdiri dari 16 androgen dan 15 estrogen. Dari hormon androgen, terbagi atas 5 hormon alami dan 11 hormon sintetik. Kelima hormon alami tersebut adalah testosteron, 11-ketotestosteron, 11β -hidrosiandrostenedion, androstenedion, dehidroepiandrostenedion.
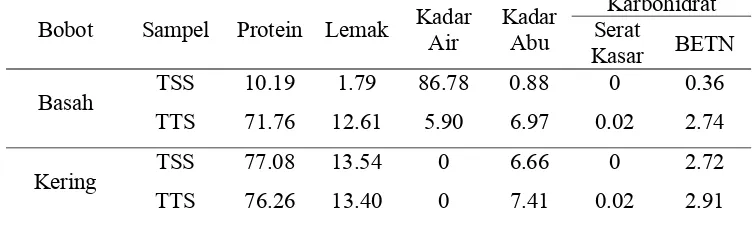
Tabel 6. Hasil proksimat testis sapi segar (TSS) dan tepung testis sapi (TTS) (%)
Bobot Sampel Protein Lemak Kadar Air
Kadar Abu
Karbohidrat Serat
Kasar BETN
Basah TSS 10.19 1.79 86.78 0.88 0 0.36
TTS 71.76 12.61 5.90 6.97 0.02 2.74
Kering TSS 77.08 13.54 0 6.66 0 2.72
TTS 76.26 13.40 0 7.41 0.02 2.91
Berdasarkan data di atas, bahwa kandungan protein testis sapi segar (TSS) sebesar 77.08% dan tepung (TTS) sebesar 76.26% (dalam bobot kering). Kandungan protein dalam testis sapi lebih tinggi daripada testis kambing sebesar 47.33% (Bombata dan Somatun, 2008) dan teripang 64,25% (Triajie, 2008). Protein hasil penelitian ini lebih tinggi dari hasil penelitian Iskandariah (1996) sebesar 63.49%. Hal ini disebabkan sampel testis sapi yang digunakan dalam penelitian ini benar-benar dalam kondisi segar diperoleh langsung dari RPH Kota Bogor, langsung disimpan dalam freezer dan dibuat tepung dalam kondisi segar dengan menggunakan mesin freeze dryer.
Kandungan protein TTS ini juga lebih tinggi dari tepung daging 50.95%, tepung rebon 57.71%, tepung pollard 9.56% , tepung kedelai 44.50% (Prabowo, 2005). tepung maggot 38.32%% (Sugianto, 2007); Meat and Bone Meal (MBM) 49.79%, tepung ikan 64.30%, tepung bungkil kedelai 54.67% (Tyas, 2009).
Kualitas Air
Kualitas air sangat berpengaruh terhadap kelangsungan hidup dan pertumbuhan ikan, juga berpengaruh terhadap pembentukan kelamin jantan saat ikan nila masih dalam masa labil saat diferensiasi sex berlangsung oleh karena itu penting untuk diamati. Data kualitas air selama penelitian baik pada saat perlakuan pemberian TTS (minggu 1-3) dan masa pemeliharaan sampai akhir penelitian, dapat dilihat pada tabel berikut :
Tabel 7. Kualitas air media pemeliharaan ikan uji selama penelitian
Parameter Satuan
Hasil Pengukuran Kisaran yang layak menurut
Selama pemeliharaan ikan nila, kualitas air media pemeliharaan ikan baik selama perlakuan maupun selama pembesaran masih dalam kisaran yang tidak mengganggu pertumbuhan maupun tingkat kelangsungan hidup ikan nila. Data kualitas air pada tabel 6 diatas menunjukan bahwa parameter suhu, oksigen terlarut, dan amoniak baik pada masa perlakuan maupun pemeliharaan masih dalam kisaran layak (Popma dan Lovshin, 1999). Parameter pH selama pemeliharaan berfluktuasi pernah tidak dalam kisaran standar, pH 6.0 saat perlakuan pemberian TTS dan pH 6.1 saat perlakuan TTS namun ikan yang dipeliharan masih tetap hidup dan tumbuh. Menurut Popma dan Masser (1999) lingkungan optimal untuk pemeliharaan ikan nila adalah DO ≥ 3 ppm; pH 6.5-8.5; suhu 25-28oC. Suhu optimum pemeliharaan ikan nila 26-28oC (Phelps dan Popma, 2000).
Faktor lingkungan yang sangat berpengaruh terhadap pengarahan kelamin adalah suhu (Smith et al., 1994; Phelps dan Popma, 2000; Dunham, 2004; Strussmann et al., 2005). Beberapa spesies ikan, phenotypic sex dapat dipengaruhi suhu air selama periode awal hidup. Fenomena ini dikenal sebagai thermolabile sex determination / TSD (Strussmann et al., 2005).
Nakamura et al (1998), suhu media pemeliharaan selama proses embrionik dan tahapan perkembangan larva mempengaruhi diferensiasi kelamin pada ikan.
KESIMPULAN DAN SARAN
Kesimpulan
Dari hasil penelitian ini dapat disimpulkan bahwa tepung testis sapi (TTS) berpengaruh terhadap maskulinisasi ikan nila. Berdasarkan pertimbangan data persentase ikan jantan, kelangsungan hidup ikan uji baik saat pemberian perlakuan TTS dan kelangsungan hidup ikan akhir penelitian, pertumbuhan mutlak dan laju pertumbuhan harian ikan uji, maka dalam penelitian ini dapat disimpulkan perlakuan yang paling efektif adalah perlakuan D3T2 (dosis TTS 6% dan lama pemberian 14 hari).
Saran
DAFTAR PUSTAKA
Adamu S; M.Y Fatihu; N.M. Useh; N.G.D Ibrahim; M. Mamman; V.O Sekoni; dan K.A.N. Kesievo. 2006. Testicular Phatologic Changes in Relation to Serum Concentrations of Testosterone in Trypanosoma vivax Infected White Fulani Bull. Journal of Animal and Veterinary Advances 5: 1165-1171 Alwir Y. 2001. Isolasi, Penentuan Komposisi Kimia dan Uji Biologi Senyawa
Steroid dari Cacing Laut (Eunice siciliensis). Tesis. Institut Pertanian Bogor. Bogor.
Baroiller. JF, H.D’Cotta, E.Bezault, S.Wessel, G.Hoerstgen-Schwark. 2009. Tilapia Sex Determination : Where Temparature and Genetics Meet. Review. Comparative Biochemistry and Physiology (in Press)
Biswas. A. K, Tetsuro.M, Goro.Y, Masasi.M, Toshio.T, 2005. Control of Reproduction in Nile Tilapia (Oreochromis niloticus L.) by Photoperiod Manipulation. Aquaculture 243 : 229 – 239
Bearden H.J; John W. Fuquay And Scott T. W. 2004. Applied Animal Reproduction (Sixth Edition). Pearson Prentice Hall. New Jersey.427 P Bombata H.A.F dan Somatun, A.O. 2008. The Effect of Lyophilized Goat Testes
Meal as First Feed on the Growth of “Wesafu” : An Ecotype Cichlid of Epe-Lagoon, in Lagos State, Negeria. Pakistan Journal of Nutrition 7 (5) : 686-688.
Cholik, F; Ateng G.J; Poernomo, dan A. Jauzi. 2005. Akuakultur : Tumpuan Harapan Masa Depan Bangsa. Diterbitkan atas Kerjasama Masyarakat Perikanan Nusantara (MPN) dengan Taman Mini Indonesia Indah (TMII). Jakarta.
Devlin TM. 1993. The Textbook of Biochemistry, With Clinical Correlation Edition. Wiley Liss, A John Wiley And Sons Inc. Publication. New York. Devlin RH dan Nagahama Y. 2002. Sex Determination and Sex Differentiation in
Fish : an Overview of Genetic, Physiological, and Enviromental Influences. Aquaculture 208 : 191-364.
DKP. 2008. 21 Obat-Obatan Yang Dilarang. Dirjen Perikanan Budidaya, Balai Besar Pengembangan Budidaya Air Tawar. Sukabumi.
Emelda. 2008. Pemanfaatan Steroid Asal Jeroan Teripang Sebagai Bahan Aktif Dalam Sex Reversal Pada Ikan Gapi. Tesis. Institut Pertanian Bogor. Bogor. Fitzsimmoons. K. 1997. Introduction to Tilapia Nutrition in Tilapia Aquaculture.
Proceeding from The Fourth International Symposium on Tilapia in Aquaculture. Orlando, Florida, 1 : 9-12
Fitzpatrick MS, CB Schreck and WL Gale. 2008. Masculinization of Tilapia Through Immersion in 17α- Methyltestosteron or 17α- Methyldihydro- testosteron. Oregon Cooperative Fishery Research Unit. Oregon State University. Corvallis. USA.
Fitzpatrick MS, W.M.C. Sanchez, RH Milston, M Lucero, GW Feist. 1999. Steroid Immersion for Masculinization of Tilapia : Immersion of Tilapia Fry in MDHT. Oregon Cooperative Fishery Research Unit. Oregon State University. Corvallis. USA.
Ganong WF. 1983. Review of Medical Physiology. Lange Medical Publications. Los Atos, California.
Gass GH dan Kaplan HM. 1982. Handbook of Endocrinology. CRC Press,Inc. Boca Raton, Florida.
Hafez, E.S.E. 1980. Reproduction in Farm Animals. 4th edition. LEA&FEBIGER. Philadelphia.
Hay, M.F; H.R. Lindner dan T. Mann. 1961. Morphology of Bull Testes and Seminal Vesicles in Relation to Testicular Androgens. Proceedings of the Royal Society of London. Series B, Biological Sciences: 154:433-448
Iskandariah. 1996. Pemanfaatan Testis Sapi Dalam Teknik Pengalihan Jenis Kelamin (Sex Reversal) Ikan Nila Merah (Oreochromis sp). Skripsi. Universitas Djuanda. Bogor.
Kaban. I.R.E. 2010. Pengaruh Pemberian Aromatase Inhibitor Melalui Pakan Buatan Terhadap Keberhasilan Sex Reversal Ikan Nila Merah Oreochromis sp. Skripsi. Fakultas Perikanan dan Ilmu Kelautan IPB. Bogor.
Kustiariyah. 2006. Isolasi, Karakteristisasi dan Uji Biologis Senyawa Steroid dari Teripang sebagai Aprodisiaka Alami. Tesis. Institut Pertanian Bogor. Bogor. Kwon YJ, Haghpanah V, Kongson-Hurtado ML, Mc Andrew JB, and Penman JD. 2000. Masculinization of Genetic Female Nile Tilapia (Oreochromis niloticus) By Dietry Administration of an Aromatase Inhibitor During Sexual Differentiation. The Journal of Experimental Zoology 287 : 46-53 Lehninger, L Albert. 1982. Principles of Biochemistry. Worth Publiser. New
Lindner, H.R. 1961. Androgen and Related Compounds in The Spermatic Vein Blood of Domestic Animals. Journal of Endocrinology 23 : 139-159
Macintosh DJ dan Litte DC. 1995. Nile Tilapia (Oreochromis niloticus) in Bromage NR dan Ronald JB. Eds. Broodstock Management and Egg and Larval Quality. Blackwell Science. USA. Pp 277-330..
Mair, G. C; Abucay, J. S; Beardmore, J. A dan Skibinski, D.O.F. 1995. Growth Performance Trial of Genetically Male Tilapia (GMT) derived from YY Males in Oreochromis niloticus L; on Stationm Comparisons with Mixed Sex and Reversed male Population. Aquaculture 137 : 313-322
Manosroi J; Petchjul K; dan A. Manosroi. 2004. Effect of Fluoxymesterone Fish Feed Granule on Sex Reversal of the Hybrid Thai Red Tilapia (O.niloticus X O. mossambicus). Asian Fisheries Science. 17 : 323-331
Mattjik A. A dan Sumertajaya, I.M. 2006. Perancangan Percobaan : Dengan Aplikasi SAS dan Minitab. Penerbit IPB Press. Bogor.
Martin CR. 1979. Texbook of Endocrine Physiology. Oxford University Press. New York.
Meyer D; Mraco G; W. Chan dan C. Castillo. 2008. Use of Fresh Bull and Hog Testis in Sex Reversal of Nile Tilapia Fry. Aquaculture Collaborative Research Support Program United State Agency for International Development (USAID). Honduras.
Murni A.P. dan jenny M.U. 2001. Pengalihan Jenis Kelamin Ikan Nila Gift (Oreochromis niloticus) dengan Pemberian Hormon Testosteron Alami. Risalah Pertemuan Ilmiah Penelitian dan Pengembangan Aplikasi Isotop dan Radiasi. BATAN. Jakarta.
Murni. A.P. 2005. Efektivitas Hormon Methyl Testosteron terhadap Sex Reversal Ikan. Risalah Pertemuan Ilmiah Penelitian dan Pengembangan Aplikasi Isotop dan Radiasi. BATAN. Jakarta.
Murni. A.P. 2009. Kiat Pacu Produksi Teknik Pejantanan/Sex Reversal Ikan dengan Hormon Methyl Testosteron (MT) Alami. Makalah Pelatihan Teknik Pejantanan Ikan. BATAN. Jakarta.
Murray RK; Granner DK; Mayes PA; dan Rodwell VW. 1997. Biokimia Harper: Edisi 24. Penerbit Buku Kedokteran EGC. Jakarta.
Nakamura, M; Kabayashi, T; Chang, X.T; and Nagahama, Y. 1998. Gonadal Sex Differentiation in Teleost Fish. The Journal of Experimental Zoology. 281:362-372
Pandian TJ dan Sheela SG. 1995. Hormonal Induction of Sex Reversal in Fish. Aquaculture 138 : 1-22.
Pandian TJ. 1999. Sex Determination and Differentiation in Teleosts. In Karunasagar I, Indrani K, Alan R : Aquaculture and Biotechnology. Science Publisher, Inc. USA.
Phelps RP dan Thomas JP. 2000. Sex Reversal of Tilapia. Page 34-59 in B.A. Costa-Pierce and J.E. Rakocy, eds. Tilapia Aquaculture in the Americas, Vol 2. The Word Aquaculture Society, Baton Rounge, Louisiana, United States. Phelps RP; Sanchez WC, Couturier GM; Abiado M; Dabrowski K. 2001. Studies
on Fate of Methyltestosteron and Its Metabolism In Tilapia and on The Use of Phytochemicals as an Alternative Methode to Produce a Monosex Population of Tilapia. Reproduction Control Research 1 (10RCR1/Experiment/Mexico.
Piferrer F. 2001. Endocrine Sex Control Strategies for Feminization of Teleost Fish. Aquaculture 197 : 229-281
Prabowo. W.T. 2005. Penggunaan Kombinasi Tepung Ikan, Tepung Bungkil Kedelai dan Tepung Rebon yang Berbeda dalam Pakan Juvenil Ikan Kerapu Bebek Cromileptes altivelis. Skripsi. Fakultas Perikanan IPB. Bogor.
Popma, T.J and M. Masser. 1999. Tilapia : Life History and Biology. SRAC Publ. No. 283. Http:/Aqpublications.Tamu.Edu/Pubs/Efish/238fs.Pdf.
Popma, T.J dan Lovshin LL. 1999. Worldwide Prospect for Commercial Production of Tilapia. Research and Development Series No. 41. International Center for aquaculture and Aquaric Environments. Departemen of Fisheries and Allied Aquaculture Auburn University. Alabama
Schunach WK; Mayer; dan M. Haake. 1990. Pengaruh Obat. Buku Pelajaran Kimia Farmasi. Gajah Mada University Press. Yogyakarta.
Shalaby, AME, Ashraf. AR dan Yassir. A.E.K. 2007. Sex Reversal of Nile Tilapia Fry Using Different Doses of 17α-Metyltestosteron at Different Dietary Protein Levels. Central Laboratory for Aquaculture Research, Abbassa, Abo-Hammad, Sharkia Governorate, Egypt.
Siswandono dan Soekardjo B. 1995. Kimia Medisinal. Airlangga University Press. Surabaya.
SNI 6141-2009. Produksi Benih Ikan Nila Hitam (Oreochromis niloticus Bleeker) Kelas Benih Sebar. Badan Standarisasi Nasional (BSN). Jakarta.
Sower SA and RN Iwamoto. 1985. The Identification of the Sex Steroid, Testosteron In Various Commercial Salmon Diets. Aquaculture, 49 : 11-17. Strussmann, CA; M. Karube; LA. Miranda; R. Patino; GM. Somoza; D. Uchida;
M.Yamashita. 2005. Methods of Sex Control in Fishes and an Overview of Novel Hypotheses Concerning the Mechanisms of Sex Differentiatin. In: Pandian TJ, CA. Strussmann, MP. Marian (eds) : Fish Genetics and Aquaculture Biotechnology. Science Publisher, Inc. USA.
Sugianto. D. 2007. Pengaruh Tingkat Pemberian Maggot terhadap Pertumbuhan dan Efisiensi Pemberian Pakan Benih Ikan Gurami (Osphronemus gourami). Skripsi. Fakultas Perikanan dan Ilmu Kelautan IPB. Bogor.
Takeuchi. 1988. Laboratory work Chemical Evaluation of Dietary Nutrients. p179-233. In Wanatabe T (eds) : Fish Nutrition and Marinculture. Tokyo. Departement of Aquatic Biosiences. Tokyo University of Fisheries. JICA. Taylor, Robert. E And Thomas G. Field. 2004. Scientific Farm Animal
Production : An Introduction To Animal Science (Eighth Edition). Pearson Prentice Hall. New Jersey..764 P.
Trewavas, E. 1982. Tilapias : Taxonomy and Spesification. In Biology and Culture of Tilapias (R.S.V. Pulin and R.H. Lowe Mc. Cannel Eds). ICLARM conference Proceeding 7. International Center for Living Aquatic Resource Management. Manila. Filipina
Triajie H. 2008. Efektivitas Ekstrak Teripang Pasir yang telah Diformulasikan terhadap Maskulinisasi Udang Galah. Tesis. Institut Pertanian Bogor. Bogor. Turner EM dan Baghara DA. 1976. Hormonal Enchanment of Growth In Fish
Physiology Vol VIII. Academic Press. New York.
Toelihere, M.R. 1981. Fisiologi Reproduksi pada Ternak. Penerbit Angkasa. Bandung. 327 Hal.
Tyas.D.M. 2009. Penggunaan Meat and Bone Meal (MBM) sebagai Sumber Protein Utama dalam Pakan untuk Pembesaran Ikan Nila Oreochromis niloticus. Skripsi. Fakultas Perikanan dan Ilmu Kelautan IPB. Bogor.
Vandaraj K dan Pandian T.J. 1990. Production of All Female Sterile Triploid Oreochromis mossambicus. Aquaculture 84 : 117-123
Yamazaki, F. 1983. Sex Control and Manipulation in Fish. Aquaculture 33 : 329-354
Yuniarti, T; Sofi Hanif; Teguh Prayoga, dan Suroso. 2007. Teknik Produksi Induk Betina Ikan Nila. Jurnal Budidaya Air Tawar. 4 : 32-36.
Yulfianti. E.M. Effendi. Sularto. M. Soewarsono. 1995. Peluang Pemakaian Testis Sapi pada Pengalihan Jenis Kelamin (Sex Reversal) Ikan Nila Merah (Oreochromis sp).Abstrak Makalah Seminar Ilmiah FMIPA Unpak 5 Desember 1995. Unpak. Bogor.
Zairin.Jr. M. 2002. Sex Reversal : Memproduksi Benih Ikan Jantan atau Betina. Penebar Swadaya. Jakarta.
Lampiran 1. Prosedur pembuatan tepung testis (TTS)
a. Testis segar dari hasil pemotongan di RPH, dikuliti, dibelah kemudian dipotong-potong, lalu dicincang sampai halus.
b. Testis yang sudah halus dimasukan dalam gelas ukur volume 250 ml sebanyak 100 gram, kemudian dimasukan dalam frezeer untuk dibekukan dengan suhu rendah ( -20oC) selama 24 jam.
c. Testis yang sudah beku, sudah siap dipasang pada mesin frezee dry. Sebelum mesin dinyalakan, pastikan semua katup pada ruang silinder stainless sudah pada posisi “vent” (tertutup).
d. Nyalakan stop kontak mesin pada posisi “on” biarkan sampai suhu mencapai -75oC, yang dapat dilihat pada penunjuk digital yang menempel pada mesin.
e. Setelah mencapai -75oC selanjutnya pompa vacum dinyalakan dengan menyalakan stop kontak power pada posisi “on” dan biarkan hingga tekanannya mencapai -0,1 Mpa. Besarnya tekanan dapat dilihat pada penunjuk tekanan (press gauge) yang ada pada mesin.
f. Selanjutnya pasang gelas frezee dry yang berisi sampel pada slot-slot yang tersedia, kemudian katup yang sebelumnya berada pada posisi “vent” diputar hingga posisi “vacum”
g. Biarkan sampai sampel benar-benar kering (lebih kurang 20-24 jam). h. Setelah sampel terlihat kering, putar katup yang sebelumnya pada posisi
“vacum” ke posisi ‘vent”, kemudian angkat gelas frezee dry yang berisi sampel dari slot yang sudah diputar tadi.
i. Testis yang sudah kering dikeluarkan dari gelas frezee dry dan siap untuk diblender sampai berbentuk seperti tepung, testis yang sudah halus kemudian diayak dengan menggunakan ayakan halus.
Lampiran 2. Prosedur pengukuran hormon testosteron
1. Timbang 1 gram tepung testis, kemudian diekstrak dengan buffer phospat pH 6.5 sebanyak 10 ml
2. Selama 20 menit (mixer, blender dan desomikasi), sampel kemudian disaring dengan kertas saring Whatman 42
3. Seluruh sampel dilewatkan pada kolom penakar (sepadex 100) 4. Sampel dielusi dengan larutan buffer phospat 6.5
5. Seluruh hormone dalam sampel akan tertahan pada kolom sepadex 100 6. Sampel dielusi kembali dengan 70% methanol.
7. Sampel dipekatkan kembali dengan spray drier sampai volume 1 ml 8. 20 µL sampel diinjekkan ke alat HPLC, dengan λ 235 nm
9. Sampel dan standart dibandingkan dengan sepadex atau luas area contoh, maka akan diperoleh konsentrasi contoh.
Lampiran 3. Prosedur Analisa Proksimat Tepung Testis Sapi 1. Prosedur Analisis Kadar Protein (Takeuchi, 1988)
1. Sampel 0.5 -1.0 gram ditimbang dan dimasukan ke dalam labu kjeldahl no.1 dan salah satu labu (no.2) digunakan sebagai blanko dimana pada labu itu tidak dimasukan sampel
2. Kedalam labu no. 1 ditambahkan 3 gram katalis (K2SO4 +CuSO45H2O) dengan rasio 9:1 dan 10 ml H2SO4 pekat.
3. Labu no. 2dipanaskan selama 3-4 jam, sampai cairan dalam labu berwarna hijau, setelah itu pemanasan diperpanjang lagi 30 menit.
4. Larutan didinginkan, lalu ditambahkan air destilasi 30 ml, kemudian larutan no. 2 dimasukan ke labu takar, tambahkan larutan destilasi sampai volume larutan mencapai 100 ml.
5. Dilakukan proses destilasi untuk membebaskan kembali NH3 yang berasal dari proses destruksi pada langkah no. 4
6. Labu erlenmeyer diisi 10 ml H2SO4 0,005 N dan ditambahkan 2-3 tetes indikator (metyl red / methylen blue) dipersiapkan sebagai penampung NH3 yang dibebaskan dari labu no. 4
7. Labu destilata diisi 5 ml larutan no.4 lalu ditambahkan larutan sodium hydroxide 30%.
8. Pemanasan dengan uap terhadap labu destilasi (no. 7) dilakukan minimum 10 menit setelah kondensasi uap terlihat pada kondensor.
9. Larutan dalam labu erlenmeyer dititrasi dengan 0,05 N larutan sodium hydroxide
Keterangan :
Vs : ml 0,05 N titer NaOH untuk sampel Vb : ml titer NaOH untuk blanko
F : faktor koreksi dari 0,05 N larutan NaOH S : bobot sampel
* : setiap ml 0,05 N NaOH equivalent dengan 0,0007 g Nitrogen **: faktor nitrogen
2. Prosedur Analisis Kadar Lemak (Takeuchi, 1988)
1. Labu ekstraksi dipanaskan suhu 110oC selama 1 jam. Kemudian didinginkan selama 30 menit dalam desikator. Panaskan kembali 30 menit, lalu didinginkan, kemudian ditimbang. Proses tersebut diulang sampai tidak ada perbedaan bobot labu lebih dari 0,3 mg. Bobot ekstraksi (A) 2. Sampel sebanyak 1-2 gram dimasukan dalam tabung filter, lalu dipanaskan
pada suhu 90-100 oC selama 2-3 jam.
3. Tempatkan tabung filter pada no. 2 kedalam ekstraksi dari alat Soxhlet. Kemudian sambungkan dengan kondensor labu ekstraksi pada no. 1 yang telah diisi 100 ml petroleum ether.
4. Panaskan ether pada labu ekstraksi dengan penggunaan water bath, suhu 70oC selama 16 jam
5. Panaskan labu ekstraksi pada suhu 100oC kemudian ditimbang (B) 6. Persen (%) lemak = ((B-A)/berat sampel) x 100%.
3. Prosedur Analisis Kadar Abu (Takeuchi, 1988)
1. Cawan porselin dipanaskan pada suhu 600 oC selama 1 jam dengan menggunakan muffle furnace, kemudian dibiarkan sampai suhu muffle furnace turun sampai 110 oC, lalu cawan porselin dikeluarkan dan disimpan dalam desikator selama 30 menit, lalu ditimbang (A)
2. Masukan sampel lalu ditimbang (B), penimbangan sampai empat desimal 3. Panaskan dalam muffle furnace pada suhu 600 oC, sampai bahan berwarna
putih
4. Cawan porselin dikeluarkan lalu didinginkan dalam desikator selama 30 menit lalu ditimbang (C)