PENAMBAHAN TEPUNG DAUN BINAHONG
Anredera cordifolia
(Ten) Steenis DALAM PAKAN
UNTUK PENCEGAHAN INFEKSI
Aeromonas hydrophila
PADA IKAN LELE
IQBAL WIJAYA
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI
Dengan ini saya menyatakan bahwa skripsi berjudul “Penambahan Tepung Daun Binahong Anredera cordifolia (Ten) Steenis dalam Pakan untuk Pencegahan Infeksi Aeromonas hydrophila pada Ikan Lele” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Desember 2015
Iqbal Wijaya
ABSTRAK
IQBAL WIJAYA. Penambahan Tepung Daun Binahong Anredera cordifolia
(Ten) Steenis dalam Pakan untuk Pencegahan Infeksi Aeromonas hydrophila pada Ikan Lele. Dibimbing oleh DINAMELLA WAHJUNINGRUM dan JULIE EKASARI.
Penelitian ini bertujuan untuk menentukan dosis yang tepat dalam mencegah infeksi bakteri Aeromonas hydrophila pada ikan lele. Penelitian ini terdiri tiga perlakuan pakan tepung daun binahong dengan dosis yang berbeda (0,3%, 0,4%, dan 0,5%), masing-masing dengan tiga ulangan dan satu kontrol tanpa penambahan tepung daun binahong. Pakan diberikan pada ikan lele berbobot rata-rata 9,15±0,55 g selama 14 hari masa pemeliharaan. Pada hari ke-15 dilakukan uji tantang dengan Aeromonas hydrophila yang disuntikkan secara intramuskular dengan konsentrasi 107 CFU/mL sebanyak 0,1 mL/ekor. Perlakuan pakan dengan tepung daun binahong menunjukkan tingkat kelangsungan hidup ikan lele setelah uji tantang yang lebih tinggi (92–100%) dibandingkan dengan ikan pada perlakuan kontrol positif (52%) (P<0.05).
Kata kunci: Aeromonas hydrophila, Anredera cordifolia (Ten) Steenis, Ikan Lele
ABSTRACT
IQBAL WIJAYA. Addition of Flour Binahong Anredera cordifolia (Ten) Steenis. leaves in feed for the Prevention Infections of Aeromonas hydrophila on Catfish. Supervised by DINAMELLA WAHJUNINGRUM and JULIE EKASARI.
The aim of this study was to determine the optimum dose in preventing of Aeromonas hydrophila infection in catfish. This study consisted of three treatment flour binahong leaves feed with different doses (0.3% , 0.4% and 0.5%), each with three replicates and one control without flour binahong leaves feed. The feed given to the catfish weighing an average of 9.15±0.55 g during the 14-days maintenance period. On the 15th day challenge test performed by Aeromonas hydrophila were injected intramuscularly with a concentration of 107 CFU mL as much as 0.1mL/fish. Treatment of feed with flour binahong leaves showed catfish survival rate after challenge test higher (92-100%) compared with the fish in the positive control treatment (52%) (P<0.05).
PENAMBAHAN TEPUNG DAUN BINAHONG
Anredera cordifolia
(Ten) Steenis DALAM PAKAN
UNTUK PENCEGAHAN INFEKSI
Aeromonas hydrophila
PADA
IKAN LELE
IQBAL WIJAYA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan
pada
Departemen Budidaya Perairan
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Penambahan Tepung Daun Binahong Anredera cordifolia (Ten) Steenis dalam Pakan untuk Pencegahan Infeksi Aeromonas hydrophila pada Ikan Lele.
Nama : Iqbal Wijaya NIM : C14110031
Program Studi : Teknologi dan Manajemen Perikanan Budidaya
Disetujui oleh
Dr Dinamella Wahjuningrum SSi MSi Pembimbing I
Dr Julie Ekasari SPi MSc Pembimbing II
Diketahui oleh
Dr Ir Sukenda MSc Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga penyusunan skripsi yang berjudul Penambahan Serbuk Daun Binahong Anredera cordifolia (Ten) Steenis untuk Pencegahan Infeksi Bakteri Aeromonas hydrophila pada Ikan Lele (Clarias Sp.) berhasil diselesaikan. Penelitian ini dilaksanakan pada bulan Maret sampai April 2015 bertempat di Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada :
1. Kedua orang tua yaitu Bapak Dodi Mas’ud dan Ibu Sumyati serta kedua saudara penulis Iwan Irmawan dan Irfan Nurwandi atas do’a, dukungan, nasihat, dan harapan yang selalu diberikan.
2. Dr Dinamella Wahjuningrum, SSi, MSi, dan Dr Julie Ekasari, SPi, MSc selaku dosen pembimbing yang telah memberikan bimbingan, saran serta nasihat.
3. Teman-teman LKI (Adel, Adhiet, Zani, Maley, Hesti, Mulyati, Mita, Yuri, Risma, Fenti, Kak Dian, Kak Dinda, Dhana, Hana, Kiki, Syifa, dan Fadhilatun) yang telah memberikan do’a dan bantuannya selama penelitian. 4. Teman BDP 48 atas motivasi, solidaritas, dan kebersamaan selama kuliah 5. Pak Ranta, Kang Yosi, Kang Arman, Pak Jajang, Kang Abe atas bantuannya
selama penelitian
6. Sahabat SMAN 1 Jampang Tengah (Rahmat Taufik, Choerunnisa Awaliyah, Sestiana Damayanti, Rina Raspanti, dan Meliasari) yang selalu mendukung dan berdo’a bersama untuk sukses
7. Amirah Agharid Nauli Harahap yang selalu memberikan dukungan, do’a, dan bantuan selama penelitian dan penulisan skripsi
Semoga karya ilmiah ini bermanfaat bagi yang memerlukan.
Bogor, Desember 2015
DAFTAR ISI
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 2
METODE ... 2
Materi Uji ... 2
Rancangan Penelitian ... 2
Prosedur Penelitian ... 3
Parameter Penelitian ... 5
Analisis Data ... 7
HASIL DAN PEMBAHASAN ... 7
Hasil ... 7
Pembahasan ... 13
KESIMPULAN DAN SARAN ... 16
Kesimpulan ... 16
Saran ... 16
DAFTAR PUSTAKA ... 17
LAMPIRAN ... 19
viii
DAFTAR TABEL
1 Hasil identifikasi morfologi koloni dan uji biokimia bakteri A. hydrophila ... 3 2 Diameter zona bening disekitar kertas cakram yang diberi ekstrak tepung
daun binahong ... 4 3 Parameter kualitas air selama pemeliharaan dan nilai optimum ... 7 4 Gejala klinis infeksi motile aeromonad septicaemia (MAS) pada ikan lele
yang diberi pakan dengan tepung daun binahong dengan konsentrasi yang berbeda (0,3%, 0,4% dan 0,5%) pada hari ke-3, 6, dan 10 setelah uji
tantang ... 11 5 Warna dan morfologi organ dalam ikan lele yang diberi pakan dengan
tepung daun binahong dengan konsentrasi yang berbeda (0,3%, 0,4% dan 0,5%) pada hari ke-12 setelah uji tantang ... 13
DAFTAR GAMBAR
1 Skema rancangan perlakuan uji in vivo pada ikan lele ...
2 Kelangsungan hidup ikan lele yang diberi pakan dengan tepung daun
binahong dengan konsentrasi yang berbeda (0,3%, 0,4% dan 0,5%) sebelum uji tantang dan setelah uji tantang. ... 7 3 Jumlah konsumsi pakan ikan lele yang diberi pakan dengan tepung daun
binahong dengan konsentrasi yang berbeda (0.3%, 0,4% dan 0,5%) sebelum uji tantang dan setelah uji tantang ... 8 4 Konversi pakan ikan lele yang diberi pakan dengan tepung daun binahong
dengan konsentrasi yang berbeda (0.3%, 0,4% dan 0,5%) sebelum uji
tantang dan setelah uji tantang ... 8 5 Sel darah merah ikan lele yang diberi pakan dengan tepung daun binahong
dengan konsentrasi yang berbeda (0.3%, 0,4% dan 0,5%) sebelum uji
tantang dan setelah uji tantang ... 9 6 Sel darah putih ikan lele yang diberi pakan dengan tepung daun binahong
dengan konsentrasi yang berbeda (0.3%, 0,4% dan 0,5%) sebelum uji
tantang dan setelah uji tantang ... 9 7 Hemoglobin ikan lele yang diberi pakan dengan tepung daun binahong
dengan konsentrasi yang berbeda (0.3%, 0,4% dan 0,5%) sebelum uji
tantang dan setelah uji tantang ... 10 8 Hematokrit ikan lele yang diberi pakan dengan tepung daun binahong
dengan konsentrasi yang berbeda (0.3%, 0,4% dan 0,5%) sebelum uji
tantang dan setelah uji tantang ... 10 9 Pengamatan organ dalam ikan lele pada setiap perlakuan (K-, K+, 0.3%,
ix
DAFTAR LAMPIRAN
1 Gambar tanaman binahong Anredera cordifolia (Ten) Steenis ... 19
2 Perhitungan LD50 ... 19
3 Hasil uji statistik zona bening ... 19
4 Hasil uji statistik tingkat kelangsungan hidup ikan lele ... 20
5 Hasil uji statistik konversi pakan ikan lele ... 20
6 Hasil uji statistik jumlah konsumsi pakan ... 20
7 Hasil uji statistik sel darah merah ... 21
8 Hasil uji statistik sel darah putih ... 21
9 Hasil uji statistik hemoglobin... 21
1
PENDAHULUAN
Latar Belakang
Ikan lele (Clarias sp.) adalah salah satu ikan yang banyak dibudidayakan dimasyarakat karena memiliki keunggulan seperti mudah untuk dibudidayakan, tidak perlu lahan yang luas pada saat produksi serta memiliki pasar yang terbuka lebar. Kementrian Kelautan dan Perikanan (KKP) menargetkan produksi sebesar 450% pada tahun 2014, yaitu 200.000 ton di tahun 2009 menjadi 900.000 ton di tahun 2014 (KKP 2010). Data produksi tahun 2014 ikan lele baru mencapai 613.120 ton (DJPB 2014), artinya pencapaian kurang lebih 30% dari target awal ditahun 2009. Salah satu kendala yang sering dihadapi adalah penyakit yang disebabkan oleh bakteri Aeromonas hydrophila atau sering disebut penyakit
motile aeromonad septicaemia (MAS).
Beberapa upaya pencegahan penyakit MAS pada ikan lele umumnya menggunakan probiotik, dan fitofarmaka. Menurut penelitian Ulkhaq (2014) pencegahan infeksi bakteri A. hydrophila dengan probiotik dapat memberikan tingkat kelangsungan hidup sebesar 92,23%. Keunggulan menggunakan probiotik adalah dapat merangsang sistem imun dalam saluran pencernaan dan keseimbangan mikroba saluran pencernaan (Nayak 2010), dan penggunaan probiotik secara langsung dalam media pemeliharaan menghasilkan efek yang lebih cepat dibandingkan metode pemberian lain, meskipun kandungan bakteri probiotik didalamnya lebih sedikit (Sahu et al. 2008). Adapun kelemahan probiotik adalah memerlukan waktu yang cukup lama dalam pembuatannya serta membutuhkan teknologi yang cukup modern. Salah satu upaya lain yang dapat dilakukan adalah penggunaan obat herbal atau sering disebut dengan fitofarmaka. Fitofarmaka memiliki keunggulan diantaranya adalah mudah diaplikasikan, sederhana dalam pembuatan, tidak menimbulkan kerusakan lingkungan apabila dipakai dalam jangka panjang, serta tidak menimbulkan residu pada ikan karena mudah terdegradasi dalam tubuh.
Salah satu bahan yang dapat digunakan sebagai fitofarmaka adalah binahong (Anredera cordifolia) (Ten) Steenis. Tanaman ini dapat tumbuh dengan cepat dan mudah untuk diperbanyak serta tidak butuh lahan yang luas untuk media tanam dapat ditanam di pekarangan rumah. Binahong memiliki daun yang bulat, batang yang merambat, dan sistem reproduksi secara generatif dan vegetatif. Spesies dari famili Basellaceae ini secara empiris telah dijadikan obat tradisional untuk manusia di berbagai negara seperti di Kolombia, Taiwan, China dan Indonesia serta banyak negara lainnya (Sukandar et al 2011).
Menurut Salikin et al (2014), dan Setiaji (2009) ekstrak daun binahong mengandung senyawa aktif berupa alkaloid, saponin, quinon, fenolik, dan tanin serta antioksidan. Senyawa-senyawa tersebut dikenal dapat berperan sebagai senyawa antibakteri.
2
pencampuran tepung daun binahong dengan pakan (coating) untuk meningkatkan sistem imunitas pada ikan lele (Clarias sp.).
Tujuan Penelitian
Penelitian ini bertujuan untuk menentukan dosis optimal tepung daun binahong (Anredera cordifolia) (Ten) Steenis untuk pencegahan infeksi yang ditimbulkan oleh bakteri Aeromonas hydrophila pada ikan lele (Clarias sp).
METODE
Materi Uji
Tanaman binahong (Lampiran 1) diperoleh dari daerah Sukabumi, Jawa Barat. Bagian tanaman yang diambil yaitu daun dengan jarak pengambilan 7 - 8 daun dari pucuk. Bakteri uji yang digunakan adalah A. hydrophila. Bakteri ini merupakan koleksi Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Ikan lele yang digunakan dalam penelitian berasal dari daerah Bogor, Jawa Barat. Ukuran panjang ikan lele rata-rata 10,32±0,07 cm dengan bobot rata-rata 9,15±0,55 g.
Rancangan Penelitian
Penelitian ini terdiri dari 3 perlakuan pemberian pakan dengan dosis tepung daun binahong yang berbeda (0,3%, 0,4%, dan 0,5%) dan kontrol dengan masing-masing 3 ulangan. Pada saat uji tantang (hari ke-15) ikan pada perlakuan kontrol negatif disuntik dengan larutan phosphate buffer saline (PBS) sebanyak 0,1 mL/ekor sedangkan ikan pada perlakuan kontrol positif dan perlakuan lainnya disuntik dengan bakteri A. hydrophila dengan konsentrasi 107 CFU/mL sebanyak 0,1 mL/ekor (Gambar 1).
Keterangan : PBS (phosphate buffer saline), K- (kontrol negatif), K+ (kontrol positif), P1 (dosis 0,3%), P2 ( dosis 0,4%), P3 (dosis 0,5%), A (pengambilan darah hari ke-3 setelah uji tantang), B ((pengambilan darah hari ke-6 setelah uji tantang), C (pengambilan darah hari ke-10 setelah uji tantang)
0
Gambar 1 Skema rancangan perlakuan uji in vivo pada ikan lele di suntik PBS
18 21 26
3
Prosedur Penelitian
Penyediaan Bakteri Uji
Bakteri disuntikkan ke ikan lele secara intramuskular atau pada bagian dorsal untuk menguji virulensinya. Setelah itu dilakukan reisolasi dengan cara menggoreskan ose ke bagian ginjal atau luka. Selanjutnya goresan ose dibiakkan pada media Trypticase Soy Agar (TSA) pada cawan petri dengan metode kuadran untuk mendapatkan koloni tunggal lalu diinkubasi selama 24 jam. Koloni tunggal yang telah murni diambil menggunakan ose dan digores pada media TSA miring lalu diinkubasi selama 24 jam. Bakteri hasil reisolasi diidentifikasi baik morfologi maupun biokimia dan fisiologi sebelum digunakan. Uji morfologi meliputi warna, elevasi, dan tepian. Sedangkan uji biokimia meliputi pewarnaan Gram, uji O/F (oksidatif/fermentatif), uji motilitas, uji katalase, dan uji oksidase. Identifikasi berdasarkan Austin dan Austin (2012). Hasil identifikasi uji fisiologis dan biokimia disajikan pada Tabel 1.
Tabel 1 Hasil identifikasi morfologi koloni dan uji biokimia bakteri A. hydrophila
Parameter Isolat murni Isolat reisolasi
Morfologi koloni
Warna Krem Krem
Elevasi Cembung Cembung
Tepian Halus Halus
Uji biokimia dan fisiologi
Pewarnaan Gram Batang, negatif Batang, negatif
O/F Fermentatif Fermentatif
Katalase + +
Oksidase + +
Motilitas Motil Motil
Regenerasi Bakteri Uji
Bakteri uji diregenerasi terlebih dahulu sebelum digunakan. Bakteri dari stok primer yang telah murni di gores media TSA miring lalu diinkubasi selama 24 jam, bakteri berumur 24 jam diambil satu ose lalu diinokulasi pada media
Trypticase Soy Broth (TSB) sebanyak 25 mL didalam gelas erlenmeyer kemudian diinkubasi selama 18-24 jam dalam shaker pada suhu 28 oC.
Penentuan Nilai LD50
Uji LD50 adalah penentuan tingkat virulensi bakteri dengan melihat konsentrasi bakteri yang mampu mematikan 50% populasi ikan. Pengujian dilakukan dengan cara bakteri diinjeksikan pada ikan lele secara intramuskular dengan kepadatan 105, 106, dan 107 CFU/mL sebanyak 0,1 mL/ekor. Pengamatan dilakukan dengan menghitung jumlah ikan yang mati sampai hari ke lima. Selanjutnya dilakukan perhitungan untuk mengetahui LD50 yaitu konsentrasi pada waktu ikan mati mencapai 50% dari populasi selama 5 hari (Wahjuningrum et al. 2008) (Lampiran 2).
Penyediaan Tepung Daun Binahong
4
dan disaring agar hasil yang didapatkan tepung halus. Kemudian disimpan pada wadah kedap udara sebelum digunakan yaitu dicampur dengan pakan.
Uji In Vitro
Uji in vitro dilakukan untuk mengetahui daya antibakteri dari ekstrak tepung daun binahong terhadap bakteri A. hydrophila dengan menggunakan metode Kirby Bauer atau kertas cakram (Lay 1994). Sebelum uji hambat terlebih dulu siapkan ekstrak daun binahong dengan cara dipanaskan pada aquades steril disuhu stabil 50°C selama 15 menit (Wahjuningrum et al. 2008). Dosis ekstrak daun binahong yang digunakan untuk uji hambat adalah 0 %, 0,3%, 0,4%, dan 0,5% dengan 3 kali ulangan berdasarkan Salikin et al. 2014. Bakteri A. hydrophila
dengan konsentrasi 107 CFU/mL sebanyak 0,1 mL disebar pada permukaan media TSA di cawan petri. Kertas cakram dicelupkan pada ekstrak daun binahong lalu diletakkan di atas media TSA yang sudah disebar bakteri kemudian diinkubasi selama 24 jam. Pengamatan dilakukan dengan melihat zona bening yang terbentuk di sekitar kertas cakram dan diukur diameternya, hasil uji statistik diameter zona bening dapat di lihat pada Lampiran 3 . Hasil diameter zona bening disajikan pada Tabel 2.
Tabel 2 Diameter zona bening di sekitar kertas cakram yang diberi ekstrak tepung daun binahong
Perlakuan Diameter zona bening (cm) Rata-rata (cm)
1 2 3
0,3% 0,8 0,9 0,9 0,86±0,06a
0,4% 1 1 1.1 1,03±0,06ab
0,5% 1,1 1,3 1,3 1,23±0,12b
Pembuatan Pakan Uji
Pembuatan pakan dilakukan dengan cara coating, serbuk daun binahong ditimbang sesuai dengan dosis yang akan digunakan yaitu 0,3%, 0,4%, dan 0,5% sedangkan untuk perlakuan kontrol pakan tidak diberi serbuk daun binahong. Setelah itu serbuk daun binahong yang telah ditimbang dicampur dengan air sebanyak 8% dari jumlah pakan dan diaduk secara merata. Selanjutnya pencampuran dengan putih telur sebanyak 2% dari jumlah pakan kemudian diaduk hingga merata dan tunggu hingga kering. Pakan yang telah kering dimasukan ke dalam lemari pendingin.
Persiapan Wadah
5
Pemasangan sistem aerasi menggunakan blower, selang aerasi dan batu aerasi. Akuarium yang telah diisi air selanjutnya diaerasi kuat dan siap digunakan untuk pemeliharaan.
Persiapan Ikan Uji
Ikan uji terlebih dahulu diadaptasikan terhadap lingkungan laboratorium selama 3-5 hari sebelum dipindahkan ke dalam akuarium perlakuan. Setelah itu ikan dipindahkan ke dalam akuarium perlakuan dengan kepadatan 14 ekor/akuarium.
Pemeliharan Ikan
Pemberian pakan uji dilakukan selama 14 hari pertama masa pemeliharaan, sedangkan setelah uji tantang pada hari ke-15 pakan yang diberikan adalah pakan kontrol tanpa tepung daun binahong. Pemberian pakan dilakukan secara at satiation dengan frekuensi pemberian pakansebanyak3 kali yaitu pagi hari (08.00 WIB), siang hari (13.00 WIB) dan sore hari (17.00 WIB). Air yang digunakan dijaga kualitasnya dengan cara penyiponan setiap hari dan pergantian air sebanyak 30%-50% setiap 4 hari sekali selama pemeliharaan.
Parameter Penelitian
Tingkat Kelangsungan Hidup
Tingkat kelangsungan hidup dihitung berdasarkan proporsi ikan yang masih hidup dibandingkan dengan jumlah ikan pada awal penebaran selama masa pemeliharaan.
Jumlah Konsumsi Pakan
Jumlah konsumsi pakan ditentukan berdasarkan jumlah pakan yang masuk ke dalam tubuh ikan uji. Sebelum pemberian pakan terlebih dahulu dilakukan penimbangan pakan, hal tersebut dilakukan untuk mengetahui pakan yang termakan dan sisa pakan yang tidak termakan. Perhitungan jumlah konsumsi pakan dilakukan dengan cara menghitung pakan awal dikurangi sisa pakan yang tidak termakan.
Konversi Pakan
Konversi pakan dapat dihitung dengan menggunakan rumus sebagai berikut:
Konversi pakan = x 100
Keterangan :
Bt = Biomassa ikan pada akhir pemeliharaan Bm = Biomassa ikan mati selama pemeliharaan Bo = Biomassa pada awal pemeliharaan
6
Gejala Klinis
Pengamatan gejala klinis dilakukan setiap hari setelah uji tantang pada 3 ekor ikan tiap ulangan, gejala klinis yang diamati adalah kelainan pada bagian luar tubuh ikan lele seperti hemoragi, tukak, nekrosis, dan pengukuran diameter luka setiap 3 hari sekali untuk melihat perubahan diameter luka. Pengukuran perkembangan luka ikan dilakukan pada individu ikan yang sama karena telah diberi tanda sebelumnya.
Pengamatan Organ Dalam
Pengamatan organ dalam bertujuan untuk mengamati morfologi dan warna organ dalam ikan dan dilakukan pada akhir perlakuan. Pengamatan organ dalam dilakukan untuk menentukan dan membedakan kelainan klinis yang terjadi dari perlakuan yang diuji. Pengamatan meliputi warna dan morfologi organ dalam ikan lele pada akhir pemeliharaan.
Sel Darah Merah (SDM) dan Sel Darah Putih (SDP)
Pengamatan sel darah merah dan sel darah putih dilakukan pada saat praperlakuan, pascaperlakuan, hari ke-3, ke-6, dan ke-10 setelah uji tantang. Perhitungan jumlah sel darah merah dapat dihitung dengan rumus Blaxhall dan
Pengukuran hemoglobin dilakukan saat praperlakuan, pascaperlakuan, hari ke-3, ke-6, dan ke-10 setelah uji tantang. Pengukuran hemoglobin dilakukan dengan cara memasukan HCl 0,1 N ke dalam tabung Hb meter sampai angka 10 pada skala merah, lalu masukan darah sebanyak 0,02 mL. Campuran ini kemudian dihomogenkan dan ditunggu 1-2 menit sebelum dilakukan pembacaan.
Hematokrit
Darah diambil dengan tabung mikrohematokrit hingga tigaperempat bagian tabung, lalu salah satu ujung ditutup dengan crystoseal. Selanjutnya darah disentrifuge dengan kecepatan 3000 rpm selama 5 menit. Perhitungan hematokrit dilakukan dengan menggunakan rumus menurut Anderson dan Siwicki (1993) sebagai berikut:
Total hematokrit (%) = x 100 Keterangan :
x = bagian darah yang mengendap
y = seluruh bagian darah dalam tabung mikrohematokrit
Kualitas Air
7
Tabel 3 Parameter kualitas air selama pemeliharaan dan nilai optimum
Parameter Hasil Pengukuran Nilai optimum (Boyd 1982)
Oksigen terlarut 4,3 – 6,2 mg/L ≥3,0 mg/L
Suhu 25°C – 28°C 25°C – 30°C
pH 7,13 – 7,75 6,5 – 8,5
TAN 0,15 – 0,20 mg/L ≤ 1
Analisis Data
Data yang telah diperoleh kemudian ditabulasi menggunakan program Ms. Excel 2013. Analisis sidik ragam (ANOVA) diikuti uji lanjut Tukey dilakukan untuk menentukan perbedaan antar perlakuan pada parameter tingkat kelangsungan hidup, konversi pakan, jumlah konsumsi pakan, dan gambaran darah ikan meliputi sel darah merah, sel darah putih, hemoglobin, serta hematokrit. Analisis statistik dilakukan dengan menggunakan program statistik Minitab 16. Sedangkan parameter gejala klinis, dan pengamatan organ dalam dianalisis secara deskriptif.
HASIL DAN PEMBAHASAN
Hasil Kelangsungan Hidup
Kelangsungan hidup sebelum uji tantang semua perlakuan yaitu 100% (Gambar 2). Setelah uji tantang kelangsungan tertinggi yaitu pada perlakuan 0,4% dan berbeda nyata (P<0,05) dengan kontrol positif tetapi tidak berbeda nyata (P>0,05) dengan perlakuan 0,3% dan 0,5% (Lampiran 4).
Sebelum uji tantang Setelah uji tantang
Keterangan : huruf yang berbeda pada tiap diagram batang menunjukan hasil berbeda nyata (P<0,05)
Gambar 2 Kelangsungan hidup ikan lele yang diberi pakan dengan tepung daun binahong dengan konsentrasi yang berbeda (0,3%, 0,4% dan 0,5%) sebelum dan setelah uji tantang.
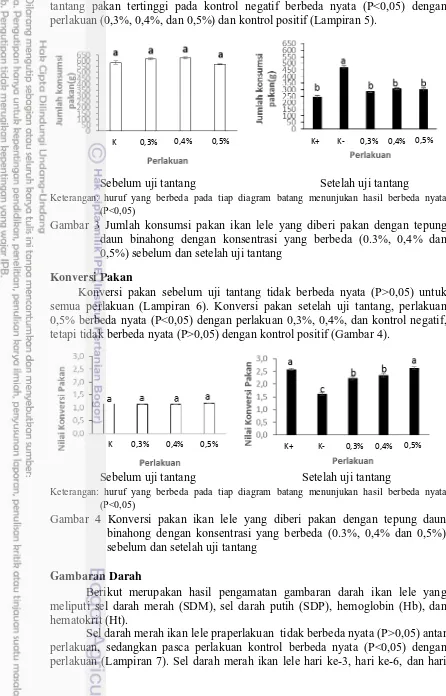
Jumlah Konsumsi Pakan
Jumlah konsumsi pakan sebelum uji tantang tidak berbeda nyata (P>0,05) dengan antar perlakuan (Gambar 3). Sedangkan jumlah konsumsi setelah uji
8
tantang pakan tertinggi pada kontrol negatif berbeda nyata (P<0,05) dengan perlakuan (0,3%, 0,4%, dan 0,5%) dan kontrol positif (Lampiran 5).
Sebelum uji tantang Setelah uji tantang
Keterangan: huruf yang berbeda pada tiap diagram batang menunjukan hasil berbeda nyata (P<0,05)
Gambar 3 Jumlah konsumsi pakan ikan lele yang diberi pakan dengan tepung daun binahong dengan konsentrasi yang berbeda (0.3%, 0,4% dan 0,5%) sebelum dan setelah uji tantang
Konversi Pakan
Konversi pakan sebelum uji tantang tidak berbeda nyata (P>0,05) untuk semua perlakuan (Lampiran 6). Konversi pakan setelah uji tantang, perlakuan 0,5% berbeda nyata (P<0,05) dengan perlakuan 0,3%, 0,4%, dan kontrol negatif, tetapi tidak berbeda nyata (P>0,05) dengan kontrol positif (Gambar 4).
Sebelum uji tantang Setelah uji tantang
Keterangan: huruf yang berbeda pada tiap diagram batang menunjukan hasil berbeda nyata (P<0,05)
Gambar 4 Konversi pakan ikan lele yang diberi pakan dengan tepung daun binahong dengan konsentrasi yang berbeda (0.3%, 0,4% dan 0,5%) sebelum dan setelah uji tantang
Gambaran Darah
Berikut merupakan hasil pengamatan gambaran darah ikan lele yang meliputi sel darah merah (SDM), sel darah putih (SDP), hemoglobin (Hb), dan hematokrit (Ht).
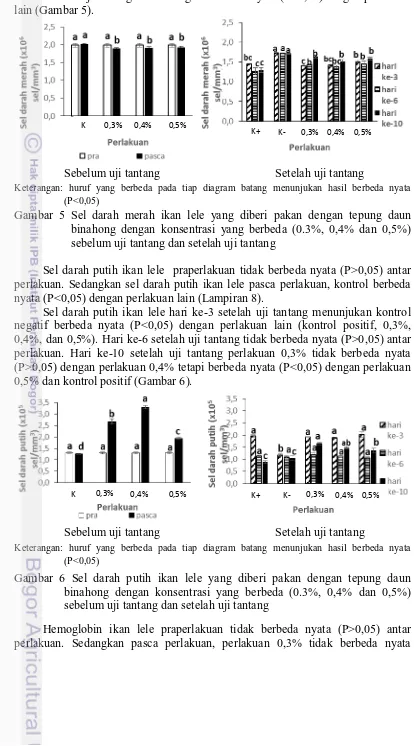
Sel darah merah ikan lele praperlakuan tidak berbeda nyata (P>0,05) antar perlakuan, sedangkan pasca perlakuan kontrol berbeda nyata (P<0,05) dengan perlakuan (Lampiran 7). Sel darah merah ikan lele hari ke-3, hari ke-6, dan hari
K 0,3% 0,4% 0,5% K+ K- 0,3% 0,4% 0,5%
9
ke-10 setelah uji tantang kontrol negatif berbeda nyata (P<0,05) dengan perlakuan lain (Gambar 5).
Sebelum uji tantang Setelah uji tantang
Keterangan: huruf yang berbeda pada tiap diagram batang menunjukan hasil berbeda nyata (P<0,05)
Gambar 5 Sel darah merah ikan lele yang diberi pakan dengan tepung daun binahong dengan konsentrasi yang berbeda (0.3%, 0,4% dan 0,5%) sebelum uji tantang dan setelah uji tantang
Sel darah putih ikan lele praperlakuan tidak berbeda nyata (P>0,05) antar perlakuan. Sedangkan sel darah putih ikan lele pasca perlakuan, kontrol berbeda nyata (P<0,05) dengan perlakuan lain (Lampiran 8).
Sel darah putih ikan lele hari ke-3 setelah uji tantang menunjukan kontrol negatif berbeda nyata (P<0,05) dengan perlakuan lain (kontrol positif, 0,3%, 0,4%, dan 0,5%). Hari ke-6 setelah uji tantang tidak berbeda nyata (P>0,05) antar perlakuan. Hari ke-10 setelah uji tantang perlakuan 0,3% tidak berbeda nyata (P>0,05) dengan perlakuan 0,4% tetapi berbeda nyata (P<0,05) dengan perlakuan 0,5% dan kontrol positif (Gambar 6).
Sebelum uji tantang Setelah uji tantang
Keterangan: huruf yang berbeda pada tiap diagram batang menunjukan hasil berbeda nyata (P<0,05)
Gambar 6 Sel darah putih ikan lele yang diberi pakan dengan tepung daun binahong dengan konsentrasi yang berbeda (0.3%, 0,4% dan 0,5%) sebelum uji tantang dan setelah uji tantang
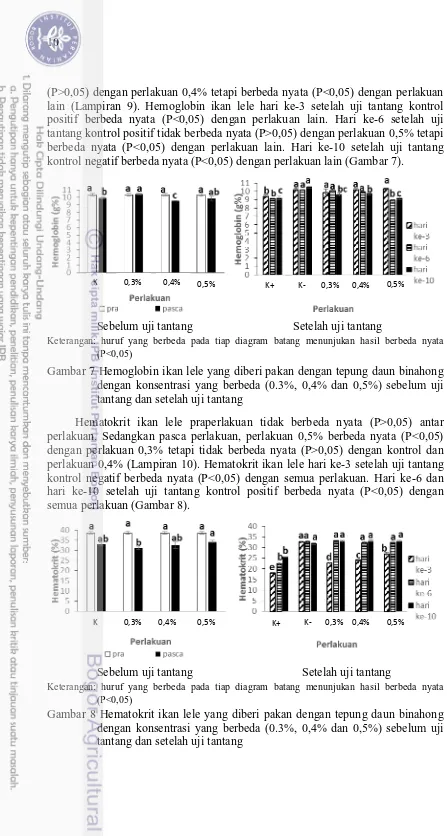
Hemoglobin ikan lele praperlakuan tidak berbeda nyata (P>0,05) antar perlakuan. Sedangkan pasca perlakuan, perlakuan 0,3% tidak berbeda nyata
K 0,3% 0,4% 0,5% K+ K- 0,3% 0,4% 0,5% K 0,3% 0,4% 0,5%
10
(P>0,05) dengan perlakuan 0,4% tetapi berbeda nyata (P<0,05) dengan perlakuan lain (Lampiran 9). Hemoglobin ikan lele hari ke-3 setelah uji tantang kontrol positif berbeda nyata (P<0,05) dengan perlakuan lain. Hari ke-6 setelah uji tantang kontrol positif tidak berbeda nyata (P>0,05) dengan perlakuan 0,5% tetapi berbeda nyata (P<0,05) dengan perlakuan lain. Hari ke-10 setelah uji tantang kontrol negatif berbeda nyata (P<0,05) dengan perlakuan lain (Gambar 7).
Sebelum uji tantang Setelah uji tantang
Keterangan: huruf yang berbeda pada tiap diagram batang menunjukan hasil berbeda nyata (P<0,05)
Gambar 7 Hemoglobin ikan lele yang diberi pakan dengan tepung daun binahong dengan konsentrasi yang berbeda (0.3%, 0,4% dan 0,5%) sebelum uji tantang dan setelah uji tantang
Hematokrit ikan lele praperlakuan tidak berbeda nyata (P>0,05) antar perlakuan. Sedangkan pasca perlakuan, perlakuan 0,5% berbeda nyata (P<0,05) dengan perlakuan 0,3% tetapi tidak berbeda nyata (P>0,05) dengan kontrol dan perlakuan 0,4% (Lampiran 10). Hematokrit ikan lele hari ke-3 setelah uji tantang kontrol negatif berbeda nyata (P<0,05) dengan semua perlakuan. Hari ke-6 dan hari ke-10 setelah uji tantang kontrol positif berbeda nyata (P<0,05) dengan semua perlakuan (Gambar 8).
Sebelum uji tantang Setelah uji tantang
Keterangan: huruf yang berbeda pada tiap diagram batang menunjukan hasil berbeda nyata (P<0,05)
Gambar 8 Hematokrit ikan lele yang diberi pakan dengan tepung daun binahong dengan konsentrasi yang berbeda (0.3%, 0,4% dan 0,5%) sebelum uji tantang dan setelah uji tantang
K 0,3% 0,4% 0,5% K+ K- 0,3% 0,4% 0,5%
11
Gejala Klinis
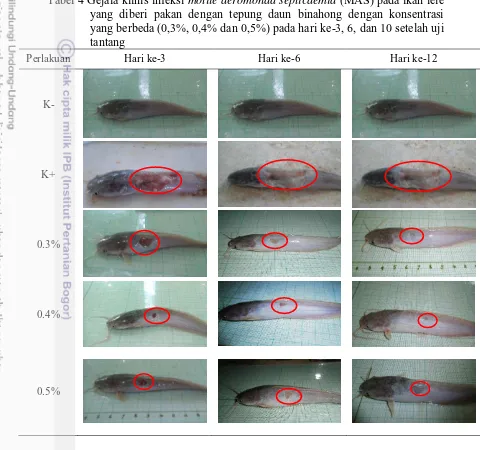
Gejala klinis yang ditimbulkan oleh infeksi A. hydrophila mulai dari pendarahan lalu peradangan hingga tukak. Gejala klinis tersebut dapat menyebabkan kematian apabila gejalanya semakin parah. Gejala klinis yang diamati pada ikan lele selama uji tantang disajikan pada Tabel 4.
Tabel 4 Gejala klinis infeksi motile aeromonad septicaemia (MAS) pada ikan lele yang diberi pakan dengan tepung daun binahong dengan konsentrasi yang berbeda (0,3%, 0,4% dan 0,5%) pada hari ke-3, 6, dan 10 setelah uji tantang
Perlakuan Hari ke-3 Hari ke-6 Hari ke-12
K-K+
0.3%
0.4%
0.5%
Pengamatan Organ Dalam
12
Perlakuan K- Perlakuan K+
Perlakuan 0,3% Perlakuan 0,4%
Perlakuan 0,5%
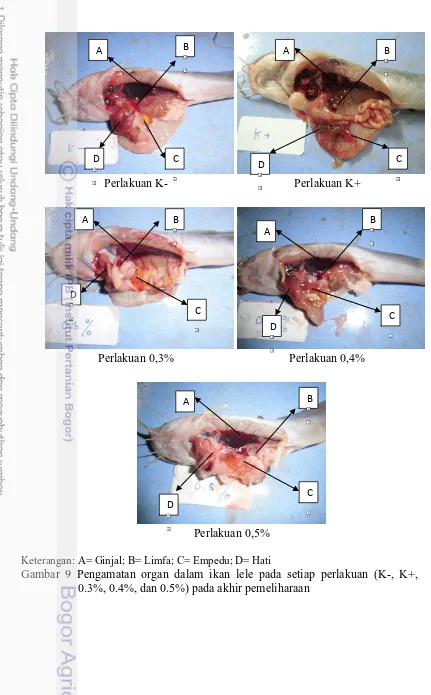
Keterangan: A= Ginjal; B= Limfa; C= Empedu; D= Hati
Gambar 9 Pengamatan organ dalam ikan lele pada setiap perlakuan (K-, K+, 0.3%, 0.4%, dan 0.5%) pada akhir pemeliharaan
13
Tabel 5 Warna dan morfologi organ dalam ikan lele yang diberi pakan dengan tepung daun binahong dengan konsentrasi yang berbeda (0,3%, 0,4% dan 0,5%) pada hari ke-12 setelah uji tantang
Organ
Hasil penelitian parameter kelangsungan hidup didapatkan bahwa kontrol negatif tidak terjadi kematian baik sebelum uji tantang maupun setelah uji tantang, hal tersebut terjadi ikan pada kontrol negatif tidak disuntik bakteri A.hydrophila
melainkan disuntik dengan PBS. Persentase tingkat kelangsungan hidup ikan paling rendah terdapat pada kontrol positif sebesar 52,38± 2,51%. Sedangkan tingkat kelangsungan hidup pada perlakuan suplementasi daun binahong terlihat lebih tinggi (P<0.05) dari pada perlakuan kontrol positif dan tidak berbeda nyata dengan kontrol negatif (P>0,05). Hal ini menunjukkan bahwa ikan lele yang diberi pakan dengan tepung daun binahong lebih tahan terdapat serangan bakteri
14
bakteri, sehingga lapisan dinding sel tidak terbentuk secara utuh dan menyebabkan kematian sel tersebut (Angka 2005).
Jumlah konsumsi pakan sebelum uji tantang tidak berbeda nyata (P>0,05) pada semua perlakuan. Jumlah konsumsi pakan setelah uji tantang mengalami penurunan yang signifikan kecuali pada kontrol negatif yang mengalami penurunan yang sedikit dibandingkan sebelum uji tantang. Jumlah konsumsi pakan erat kaitan dengan nafsu makan ikan, jumlah konsumsi pakan akan menurun seiring penurunan nafsu makan ikan. Nafsu makan ikan menurun setelah uji tantang disebabkan oleh infeksi bakteri sehingga ikan mengalami stress (Affandi dan Tang 2002).
Nilai konversi pakan sebelum uji tantang tidak berbeda nyata (P>0,05) pada kontrol dan pakan dengan tepung daun binahong 0,3%. 0,4%, dan 0,5%. Hal tersebut menunjukkan bahwa penambahan tepung daun binahong tidak berpengaruh pada nilai konversi pakan. Sedangkan setelah uji tantang nilai konversi pakan naik pada setiap perlakuan. Nilai konversi pakan tertinggi setelah uji tantang adalah kontrol positif yaitu sebesar 2,68±0,05.
Pengamatan sel darah merah dilakukan pada praperlakuan, pasca perlakuan, hari ke-3, 6, dan 10 setelah uji tantang. Kadar sel darah merah pada ikan normal berkisar antara 1,22x106 – 2,52x106 sel/mm3 (Purwanti et al 2014). Sel darah merah ikan lele sebelum uji tantang berkisar dari 1,89x106-2,01x106 sel/mm3. Sel darah merah ikan lele setelah uji tantang berkisar dari 1,27 x106-1,72x106 sel/mm3. Berdasarkan hasil penelitian menunjukan bahwa sel darah merah sebelum uji tantang masih dalam kisaran normal, tetapi setelah uji tantang mengalami penurunan. Penurunan total sel darah merah disebabkan oleh adanya adanya luka sehigga darah keluar dari pembuluhnya. Menurut Bastiawan et al. (2001) infeksi bakteri A.hydrophila dapat menyebabkan penurunan kadar sel darah merah. Kemudian sel darah merah meningkat pada perlakuan 0,3%, 0,4%, dan 0,5% hari ke-6 setelah uji tantang yang disebabkan oleh serbuk daun binahong yang memiliki kandungan zat antibakteri sehingga organ penghasil sel darah cepat kembali pada kondisi normal.
Sel darah putih sangat berpengaruh pada sistem imun ikan. Total sel darah putih pasca perlakuan meningkat dan berbeda nyata (P<0,05) dengan kontrol. Hal ini dapat disebabkan oleh kandungan flavanoid yang ada pada serbuk daun binahong. Peningkatan jumlah sel darah putih menunjukkan bahwa sistem limfoid
yang diaktifkan oleh flavonoid (Angka et al., 2004) dapat meningkatkan produksi sel
darah putih. Menurut DeNoon (2004) flavonoid dapat meningkatkan kerja
organ-organ penghasil darah sehingga produksi darah dapat ditingkatkan.
Total sel darah putih setelah uji tantang pada kontrol positif mengalami kenaikan, hal ini terjadi karena ikan uji terinfeksi oleh bakteri A.hydrophila. Peningkatan sel darah putih disebabkan oleh sel darah putih berfungsi sebagai pertahanan tubuh yang bereaksi cepat terhadap masuknya antigen kedalam tubuh (Sukenda et al. 2008). Tetapi pada tiap perlakuan pasca uji tantang mengalami penurunan sel darah putih, hal ini diduga telah melewati penurunan dari pada infeksi bakteri dan sel darah putih telah habis untuk pertahanan terhadap bakteri.
15
mengalami penurunan setelah uji tantang pada tiap perlakuan. Hal ini disebabkan oleh adanya gejala klinis pada ikan uji setelah uji tantang, sehingga darah keluar dari pembuluh kapiler (Wahjuningrum et al. 2008).
Nilai hematokrit ikan lele normal adalah sebesar 30,8%-45,5% (Bastiawan
et al 2001). Berdasarkan hasil penelitian pola grafik hematokrit mengalami pola yang sama yaitu tinggi di awal kemudian hari ke-3 setelah uji tantang mengalami penurunan dan naik lagi pada hari ke-6 setelah uji tantang. Penurunan nilai hematokrit diduga disebabkan oleh turunnya nafsu makan ikan yang disebabkan oleh adanya infeksi bakteri A. hydrophila. Bastiawan et al. (2001) menambahkan bahwa ikan yang terkena infeksi akan menurunkan kadar hematokrit menjadi tidak normal.
Perlakuan kontrol negatif yang disuntik dengan PBS tidak mengalami kelainan klinis dari awal penyuntikan sampai akhir pemeliharaan. Gejala klinis yang ditimbulkan akibat infeksi A. hydrophila pada ikan lele yang terlihat mulai hari ke-3 sampai dengan hari terakhir uji tantang pada setiap perlakuan yang diuji tantang adalah hemoragi, peradangan dan tukak. Gejala klinis ini disebabkan oleh bakteri yang menghasilkan eksotoksin dan endotoksin (Angka 2005). Hasil pengamatan pada ikan perlakuan pemberian pakan dengan tepung daun binahong menunjukkan bahwa diameter gejala klinis yang lebih kecil dari pada kontrol positif.
16
KESIMPULAN DAN SARAN
Kesimpulan
Perlakuan terbaik pemberian pakan dengan penambahan tepung daun binahong adalah dosis 0,3%, dosis tersebut dapat mencegah infeksi bakteri A. hydrophila pada ikan lele.
Saran
17
DAFTAR PUSTAKA
Affandi R, Tang UM. 2002. Fisiologi hewan air. Pekanbaru (ID): Unri Press Anderson DP, Siwicki AK. 1993. Basic hematology and serology for fish health
programs. Paper presented in second symposium on diseases in Asean Aquaculture “Aquatic Animal Health and The Environment”. Phuket,
Thailand. 25 – 29th October 1993. 17p.
Angka SL, BP Priosoeryanto, BW Lay dan E. Harris. 2004. Penyakit Motile Aeromonad Septicaemia pada ikan lele dumbo: Upaya pencegahan dan pengobatannya dengan fitofarmaka. Forum Pascasarjana, 27: 339-350 Angka SL. 2005. Kajian penyakit Motile Aeromonad Septicaemia (MAS) pada
ikan lele dumbo (Clarias sp.): patologi, pencegahan, dan pengobatannya dengan fitofarmaka [disertasi]. Bogor (ID): Institut Pertanian Bogor. Austin B, Austin DA. 2012. Bacterial Fish Phatogens: Disease Of Farmed And
Wild Fish. Ed ke-5. London: Springer Dordrecht Heidelberg New York Bastiawan D, Wahid A, Alifudin M, Agustiawan I. 2001. Gambaran Darah Lele
Dumbo (Clarias spp.) yang diinfeksi Cendawan Aphanomyces sp. pada pH yang Berbeda Jurnal Penelitian Indonesia. 7(3): 44- 47.
Blaxhall P, Daisley K. 1973. Some blood parameters of the rainbow trout I. The Kamloops Variety. J. Fish. Biol. 5:1-8
Boyd CE. 1982. Water Quality Management for Pond Fish Culture. Auburn University. 4th Printing. Internasional Centre for Aquaculture Experiment Station, Auburn.
Ceyhun, Sezgin AE, N Artik. 2010. Determination of Saponin content in Turkish Tahini Halvah by using HPLC. Advance Journal of food Science and Technology. 2(2):109-115.
[DJPB] Direktorat Jenderal Perikanan Budidaya. 2014. Data produksi tahun 2014. http://www.djpb.kkp.go.id/index.php/arsip/c/209/data-statistik-lainnya/ [1 Mei 2015].
[KKP] Kementerian Kelautan dan Perikanan. 2010. Kementerian Kelautan dan Perikanan dalam Angka. Kementrian Kelautan dan Perikanan. http://www.perikanan-budidaya.dkp.go.id. Jakarta (11 Juni 2014).
DeNoon, D. 2004. A dark chocolate a day keeps the doctor away : daily dark chocolate good for the heart, loaded with flavonoids. WebMD Medical News. http://www.webmd.com/content/article/88/99702/htm. [1 November 2015]
Lay BW. 1994. Analisis Mikroba di Laboratorium. Jakarta: PT Raja Grafindo Persada.
Nayak SK. 2010. Probiotics and immunity: A fish perspective. Fish and Shellfish Immunology. 29: 2-14. doi: 10.1016/j.fsi.2010.02.017.
Purwanti SC, Suminto, Sudaryono A. 2014. Gambaran profil darah ikan lele dumbo (Clarias gariepinus) yang diberi pakan dengan kombinasi pakan buatan dan cacing tanah (Lumbricus rubellus). Journal of Aquaculture Management and Technology. 3(2) :53-60.
18
Sahu MK, Swarnakumar NS, Sivakumar K, Thangaradjou T, Kannan L. 2008. Probiotics in aquaculture: importance and future perspectives [review].
Indian Journal Microbiology. 48: 299-308. doi: 10.1007/s12088-0080024-3.
Salikin RQ, Sarjito, Prayitno SB. 2014. Pengaruh perendaman ekstrak daun binahong (Anredera cordifolia) terhadap mortalitas dan histologi hati ikan mas (Cyprinus carpio) yang diinfeksi bakteri Aeromonas caviae. Journal of Aquaculture Management and Technology. 3(3): 43-50. Setiaji A. 2009. Efektivitas ekstrak daun papaya Carica papaya L. untuk
pencegahan dan pengobatan ikan lele dumbo Clarias sp. yang diinfeksi bakteri Aeromonas hydrohila [Skripsi]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Sukandar EY, Fidrianny I, Adiwibowo LF. 2011. Efficacy of Ethanol Extract of
Anredera cordifolia (Ten) Steenis Leaves on Improving Kidney Failure in Rats. International Journal of Pharmacology. 7(8): 850-855
Sukenda, Jamal L, Wahjuningrum D, A Hasan. 2008. Penggunaan Kitosan untuk Pencegahan Infeksi Aeromonas hydrophila pada Ikan Lele Dumbo
Clarias sp. Jurnal Akuakultur Indonesia. 7(2): 159-169.
Ulkhaq MF. 2014. Pemberian probiotik bacillus pada media pemeliharaan Ikan lele dumbo (clarias gariepinus) untuk pencegahan penyakit Motile Aeromonad Septicemia [Tesis]. Bogor. (ID): Institut Pertanian Bogor. Wahjuningrum D, Ashry N, Nuryati S. 2008. Pemanfaatan ekstrak daun ketapang
Ternimalia cattapa untuk pencegahan dan pengobatan ikan patin
19
LAMPIRAN
Lampiran 1 Gambar tanaman binahong Anredera cordifolia (Ten) Steenis
Lampiran 2 Perhitungan LD50
Konsentrasi Bakteri
Ikan
hidup Ikan mati
Nilai Akumulasi
Hidup (ekor)
Mati
(ekor) Rasio Kematian (%)
107 5 5 5 8 61,54
106 7 3 12 5 29,41
105 8 2 20 2 9,09
= 0,56
= -Log 107 + 0,56 = 6,44
Maka LD50 = 106,44 CFU/mL = 107 CFU/mL
Lampiran 3 Hasil uji statistik zona bening
Anova
Uji Tukey BNJa
Source DF SS MS F P
Perlakuan 2 0,20222 0,10111 15,17 0,005
Error 6 0,04000 0,00667
Total 8 0,24222
Perlakuan N Mean Grouping (α = 0,05)
0,5% 3 1,23 A
0,4% 3 1,03 AB
20
Lampiran 4 Hasil uji statistik tingkat kelangsungan hidup ikan lele
Anova
Uji Tukey BNJa
Lampiran 5 Hasil uji statistik jumlah konsumsi pakan ikan lele
Anova
Uji Tukey BNJa
Lampiran 6 Hasil uji statistik konversi pakan
21
Lampiran 7 Hasil uji statistik sel darah merah
Anova
Uji Tukey BNJa
Lampiran 8 Hasil uji statistik sel darah putih
Anova
Uji Tukey BNJa
Lampiran 9 Hasil uji statistik hemoglobin
Anova
Uji Tukey BNJa
Lampiran 10 Hasil uji statistik hematokrit
22
Uji Tukey BNJa
Perlakuan N Mean Grouping (α = 0,05)
0,3% 3 2,6750 A
0,4% 3 3,2950 B
0,5% 3 1,9367 C
23
RIWAYAT HIDUP
Penulis dilahirkan di Sukabumi pada tanggal 30 Juli 1992, merupakan anak ke-3 dari 3 bersaudara dari keluarga Bapak Dodi Mas’ud dan Ibu Sumyati. Penulis menyelesaikan pendidikan akademik di SDN Cijulang, Desa Cijulang, Kecamatan Jampang Tengah, Kabupaten Sukabumi tahun 2005 , MTs. Manbaul Ulum, Desa Jampang Tengah, Kecamatan Jampang Tengah, Kabupaten Sukabumi tahun 2008 dan SMAN 1 Jampang Tengah, Kabupaten Sukabumi tahun 2011. Penulis diterima sebagai mahasiswa Program Studi Teknologi dan Manajemen Perikanan Budidaya, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor melalui jalur SNMPTN undangan pada tahun 2011.
Selama Perkuliahan, penulis pernah menjadi asisten praktikum Dasar-dasar Mikrobiologi Akuatik dan Penyakit Organisme Akuatik pada tahun (2014/2015), Manajemen Kesehatan Organisme Akuatik (2015), mengikuti kegiatan magang di Balai Besar Pengembangan Budidaya Air Tawar pada (2013) dan mengikuti praktik lapang akuakultur di PT. Surya Windu Kartika, Rogojampi, Banyuwangi-Jawa Timur (2014). Selain itu penulis juga aktif menjadi pengurus Badan Eksekutif Mahasiswa di Fakultas Perikanan dan Ilmu Kelautan (BEM FPIK) sebagai anggota Departemen Advokasi Kesejateraan Mahasiswa (2012/2013) dan pengurus Himpunan Mahasiswa Akuakultur (HIMAKUA) sebagai anggota divisi Pengembangan Sumberdaya Masyarakat (2013/2014).