PERUBAHAN KARAKTERISTIK KIMIA, MIKROBIOLOGI,
DAN HISTOLOGI IKAN NILA (
Oreochromis niloticus
)
BERDASARKAN FASE
POST MORTEM
IMAM HIDAYAT
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi dengan judul “Perubahan Karakteristik Kimia, Mikrobiologi, dan Histologi Ikan Nila (Oreochromis niloticus) Berdasarkan Fase Post Mortem” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
ABSTRAK
IMAM HIDAYAT. Perubahan Karakteristik Kimia, Mikrobiologi, dan Histologi Ikan Nila (Oreochromis niloticus) Berdasarkan Fase Post Mortem. Dibimbing oleh RUDDY SUWANDI dan AGOES MARDIONO JACOEB.
Penelitian mengenai perubahan karakteristik ikan nila telah dilakukan dengan tujuan mengevaluasi perubahan karakteristik ikan nila berdasarkan fase post mortem. Parameter yang diamati adalah nilai organoleptik, pH, Total Volatile Base, Total Plate Count, dan histologi. Hasil penelitian ini didapatkan data fase
post mortem ikan nila, fase pre rigor terjadi selama 7 jam setelah ikan dimatikan, fase rigor terjadi selama 10 jam setelah fase pre rigor. Sedangkan fase post rigor
terjadi setelah 18 jam ikan dimatikan. Parameter pH ikan nila pada fase rigor
mengalami penurunan, dan kembali naik ketika masuk fase post rigor. Parameter TVB dan TPC menunjukkan nilai yang semakin tinggi seiring fase post mortem. Analisis histologis menunjukkan bahwa struktur jaringan daging ikan nila mengalami peningkatan kerusakan seiring fase post mortem.
Kata kunci: Histologi, ikan nila, kesegaran, post mortem.
ABSTRACT
IMAM HIDAYAT. Characteristics Changes in Chemistry, Mikrobiology, and Histology of Tilapia (Oreochromis niloticus) Based on Post Mortem Phase. Supervised by RUDDY SUWANDI and AGOES MARDIONO JACOEB.
Study of changes in the tilapia characteristics had been done with the aim of evaluating the changes of tilapia characteristics by post mortem phase. Parameters measured were organoleptic value, pH, Total Volatile Base, Total Plate Count, and its histology. This study resulted data of tilapia post mortem phase, which pre-rigor phase occurred seven hours after the fish was killed by exposing its medula oblongata, rigor phase occurred 10 hours after the pre rigor phase. While the post-rigor phase had occured after 18 hours since fish was off. The pH value of tilapia in rigor phase decreased, and increased again when entering the post rigor phase. TVB and TPC parameters indicated the higher value as the post mortem phase running. Histology analysis showed that the tissue structure defect of tilapia’s flesh increased as post mortem phase running.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sembernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
iii
PERUBAHAN KARAKTERISTIK KIMIA, MIKROBIOLOGI,
DAN HISTOLOGI IKAN NILA (
Oreochromis niloticus
)
BERDASARKAN FASE
POST MORTEM
IMAM HIDAYAT
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Teknologi Hasil Perairan
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
KATA PENGANTAR
Puji syukur penulis panjatkan kepada Allah SWT yang telah melimpahkan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi ini dengan baik. Skripsi yang berjudul “Perubahan Karakteristik Kimia, Mikrobiologi, dan Histologi Ikan Nila (Oreochromis niloticus) Berdasarkan Fase Post Mortem” ini merupakan salah satu syarat untuk memperoleh gelar sarjana di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Pada kesempatan ini, dengan segala kerendahan hati penulis ingin mengucapkan terima kasih kepada semua pihak yang telah memberikan bantuan dan dorongan hingga penulis dapat menyelesaikan skripsi ini, yaitu :
1 Dr Ir Ruddy Suwandi MS,MPhil dan Dr Ir Agoes M. Jacoeb Dipl-Biol selaku dosen pembimbing yang telah memberikan pengarahan dalam penyusunan skripsi ini.
2 Prof Dr Ir Joko Santoso MSi selaku ketua Departemen Teknologi Hasil Perairan.
3 Bambang Riyanto SPi Msi dan Safrina Dyah Hardiningtyas SPi MSi yang telah memberikan pengarahan untuk perbaikan penyusunan skripsi ini. 4 Ayah, ibu, dan keluarga yang tercinta atas segala doa, dukungan, dan
semangat yang tiada henti kepada penulis.
5 Teman-teman THP 46 (alto) untuk kebersamaan dan bantuannya terhadap penulis dalam menyelesaikan skripsi ini.
6 Ibu Ema yang telah banyak membantu di laboratorium.
7 Kakak kelas dan adik kelas yang telah memberikan dorongan semangat. 8 Semua pihak yang telah membantu dalam menyelesaikan penelitian.
Penulis menyadari bahwa penulisan skripsi ini masih jauh dari sempurna. Oleh sebab itu kritik dan saran yang bersifat membangun dari semua pihak sangat diharapkan. Semoga skripsi ini dapat memberikan manfaat bagi semua pihak yang memerlukannya.
Bogor, Agustus 2015
vii
Analisis Prosedur Penelitian ... 4
Morfometrik Ikan Nila ... 4
Proporsi bagian tubuh Ikan Nila ... 10
Nilai Organoleptik Ikan Nila ... 11
DAFTAR TABEL
1 Morfometrik ikan nila ... 10
2 Standar TVB untuk hasil perikanan ... 16
DAFTAR GAMBAR
1 Diagram alir prosedur penelitian ... 42 Penampakan ikan nila ... 10
3 Proporsi bagian tubuh ikan nila ………..……. 10
4 Nilai organoleptik ikan nila ... 11
5 Komposisi kimia daging ikan nila …... 13
6 Nilai rata-rata pH ikan nila …………... 14
7 Nilai TPC ikan nila ... 15
8 Nilai TVB ikan nila ... 16
9 Jaringan ikan nila fase pre rigor (400 kali) ... 17
10 Jaringan ikan nila fase rigor (400 kali) ... 18
11 Jaringan ikan nila fase post rigor (400 kali) ... 18
1
PENDAHULUAN
Latar Belakang
Ikan nila (Oreochromis sp.) merupakan salah satu komoditas unggulan budidaya perikanan Indonesia selain rumput laut, udang, patin, lele, dan bandeng. Volume produksi nasional ikan nila dari sektor budidaya pada tahun 2013 mencapai 1,1 juta ton (KKP 2013). Ikan nila sendiri menempati posisi kedua untuk kategori jenis ikan yang paling banyak dibudidaya di dunia. Pada umumnya, ikan nila dijual dalam kondisi hidup di pasar lokal atau dibekukan untuk pengolahan lebih lanjut. Di Indonesia, ikan nila seringkali dijajakan dalam kondisi segar pada showcase dengan atau tanpa penambahan es.
Kemunduran mutu yang mengarah ke pembusukan terjadi pada ikan mati. Kemunduran mutu ikan merupakan akumulasi dari beberapa faktor yakni reaksi enzim, reaksi biokimia dalam tubuh ikan, dan aktivitas bakteri pembusuk. Beberapa faktor yang dapat mempengaruhi kecepatan kemunduran mutu ikan diantaranya adalah cara mati, kondisi biologis ikan, kondisi lingkungan hidup ikan, suhu, penanganan ikan, dan sanitasi, serta higienitas. Pada suhu ruang, ikan mengalami kemunduran mutu lebih cepat (Munandar et al. 2009).
Berbagai studi mengenai analisis kemunduran mutu ikan nila telah banyak dilakukan. Studi tersebut akan menjadi dasar pengembangan teknik penanganan dan pengemasan ikan nila yang efektif dan efisien. Kesegaran ikan nila selama penanganan dan penyimpananannya akan berimplikasi dengan nilai nutrisi, keamanan pangan, dan nilai ekonomi dari ikan nila yang diperdagangkan. Nurjanah et al. (2004) telah melakukan studi mengenai kemunduran mutu ikan nila merah selama penyimpanan suhu ruang. Parameter yang digunakan sebagai respon kemunduran mutunya adalah Total Plate Count (TPC), Total VolatileBase
(TVB), nilai pH, dan nilai K. Munandar et al. (2009) menganalisis perubahan parameter TPC, TVB, dan pH selama penyimpanan ikan nila pada suhu rendah dengan perlakuan cara kematian dan penyiangan. Castillo-Yanez et al. (2014) telah mempelajari perubahan biokimia dan kesegaran ikan nila selama penyimpanan dengan penambahan es. Parameter yang diamati diantaranya nilai TVB, pH, Total Viable Count (TVC), warna, tekstur, Water Holding Capacity
(WHC), dan nilai K. Adapun studi lainnya mengenai kemunduran mutu ikan nila telah dilakukan oleh Riyanto et al. (2012) tentang prediksi umur simpan fillet ikan nila yang dikemas vakum dalam HDPE, Abelti (2013) tentang kemunduran mutu fillet ikan nila yang disimpan dengan penambahan es, dan Liu et al. (2010) tentang perubahan kualitas ikan nila yang dikemas secara tray-packed dalam plastik polietilen pada suhu 0°C.
2
struktur otot selama fase post mortem tidak dapat dijelaskan oleh degradasi struktur primer molekul protein. Ando et al. (1991) berhasil menunjukkan bahwa proses tenderisasi daging ikan salmon dipengaruhi oleh disintegrasi struktur matriks ekstraseluler, dan hal ini hanya dapat dijelaskan dengan adanya kajian histologi. Untuk pengembangan ke depannya, kajian histologi pada kemunduran mutu ikan dapat dijadikan dasar untuk pengembangan alat pendeteksi kerusakan jaringan ikan berdasarkan perubahan struktur jaringan dan dapat juga dijadikan sebagai dasar rekayasa penghambatan terjadinya kemunduran mutu pada ikan.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengevaluasi perubahan karakteristik ikan nila dengan uji parameter kesegaran ikan (nilai organoleptik, pH, Total Volatile Base, Total Plate Count, histologi) dan menentukan lamanya periode berlangsungnya fase pre rigor, rigor, dan post rigor, serta menentukan perubahan struktur jaringan ikan nila.
Manfaat Penelitian
Penelitian ini diharapkan dapat menambah informasi dan data mengenai perubahan karakteristik ikan nila selama kematian. Dengan deketahuinya data kemunduran mutu ikan nila, industri maupun konsumen dapat menentukan penanganan dan pemanfaatannya secara tepat, sehingga pengolahan ikan nila akan tetap memperhatikan kaidah nutrisi, sanitasi, dan higienitas.
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini adalah pengambilan dan preparasi sampel, pengujian organoleptik, pH, Total Volatile Bases (TVB), Total Plate Count (TPC) dan pengujian histologi.
METODE PENELITIAN
Waktu dan Tempat
3
Bahan dan Alat Penelitian
Bahan
Bahan yang digunakan dalam penelitian ini adalah ikan nila (Oreochromis niloticus) dengan ukuran 200-250 g per ekor (umur ± 5 bulan) dan berbagai bahan yang digunakan untuk analisis proksimat (H2SO4, NaOH 40%, H3BO3, HCl 0,1
N), Total Volatile Base (H3BO3, K2CO3, TCA 7%, HCl 0,032N), Total Plate Count (larutan KH2PO4 1,7% steril, PCA), dan analisis histologi (larutan Buffer
Normal Formalin 10% (Merck p.a.), alkohol p.a. 50-100% (Merck), xylol p.a. (Merck), paraffin p.a. (Merck), hematoksilin p.a. (Merck), eosin p.a. (Merck), dan
mounting agent p.a. (Merck)).
Alat
Alat yang digunakan untuk aklimatisasi ikan yaitu akuarium dan aerator. Alat untuk penghitungan morfometrik adalah penggaris dan timbangan, dan beberapa alat yang digunakan untuk uji organoleptik (score sheet BSN 2006), analisis proksimat (oven, desikator, cawan, labu kjeldahl, labu lemak), Total Volatile Base (homogenizer (model Nissei Am)), cawan conway, inkubator). Alat yang digunakan untuk analisis Total Plate Count (labu erlenmeyer, cawan petri, inkubator), pH (pH meter (Eutech Instruments)). Instrumen khusus yang digunakan untuk analisis histologi, antara lain: mikrotom putar (Yamanto Kohki LR-85), mikroskop cahaya (model Olympus CX41), dan kamera DP-21.
Prosedur penelitian
Ikan nila yang digunakan berasal dari kolam ikan FPIK IPB, ikan diambil dari kolam ikan dengan menggunakan serokan ikan, kemudian dibawa ke laboratorium, ikan dimasukkan ke dalam akuarium berukuran 60x30x30 cm3 yang berisi air yang telah diendapkan selama ± 7 hari untuk dilakukan aklimatisasi, aklimatisasi dilakukan dengan tujuan menjaga ikan agar tidak stres. Ikan yang sudah diaklimatisasi selama 1x24 jam dimatikan secara langsung dengan cara ditusuk menggunakan jarum pada bagian medulla oblongata. Pematian ikan dengan cara tersebut bertujuan mengurangi aktivitas fisik ikan saat pematian, memperlambat asidifikasi otot pada fase post mortem, dan memperlambat terjadinya fase rigor mortis (Azam et al. 1989; Marx et al. 1997; Robb dan Kestin 2002; Morzel et al. 2002). Ikan selanjutnya diletakkan dalam wadah pada suhu ruang (±29 oC) dalam keadaan utuh untuk dilakukan uji organoleptik, serta dihitung proporsi tubuh ikan, morfometrik, dan proksimat. Tahapan selanjutnya adalah uji pH, uji TVB, uji TPC, dan histologis berdasarkan periode waktu fase
4
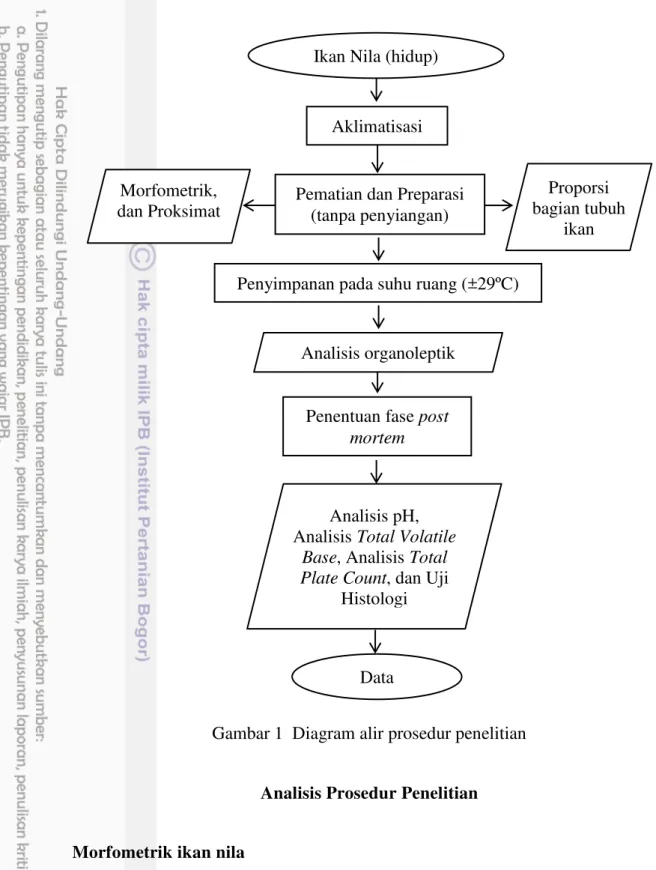
Gambar 1 Diagram alir prosedur penelitian
Analisis Prosedur Penelitian
Morfometrik ikan nila
Morfometrik adalah ciri yang berkaitan dengan ukuran tubuh atau bagian tubuh ikan (Affandi et al. 1992). Ciri morfometrik ikan nila yang diamati pada penelitian ini, yaitu panjang total, panjang baku, tebal, tinggi, dan bobot. Metode pengukuran morfometrik dilakukan dengan menggunakan penggaris untuk parameter panjang total, panjang baku, tebal dan tinggi, sedangkan untuk parameter bobot dihitung dengan menggunakan timbangan.
Penyimpanan pada suhu ruang (±29ºC)
Penentuan fase post mortem
Ikan Nila (hidup)
Aklimatisasi
Pematian dan Preparasi (tanpa penyiangan)
Data Analisis pH, Analisis Total Volatile
Base, Analisis Total Plate Count, dan Uji
Histologi Morfometrik,
dan Proksimat
Proporsi bagian tubuh
ikan
5
Proporsi Bagian Tubuh Ikan
Pengamatan proporsi bagian tubuh ikan nila dilakukan dengan cara memisahkan bagian tubuh ikan yang meliputi bagian tulang dan kepala, daging, jeroan dan kulit. Pengukuran dilakukan pada setiap bagian yang dipisahkan. Total berat dari keseluruhan bagian ditulis dalam persen. Data diolah dari 6 ekor sampel ikan nila yang diteliti rata-ratanya.
Proksimat
Sampel ikan nila yang diperoleh, kemudian diambil dagingnya pada bagian punggung ikan untuk dianalisis komposisi kimianya melalui uji proksimat sebanyak 2 ulangan. Uji proksimat dilakukan terhadap daging ikan nila saat dalam kondisi segar atau jam ke nol. Uji proksimat yang dilakukan terhadap daging ikan nila meliputi kadar air, kadar abu, kadar lemak, kadar protein, dan kadar karbohidrat (by difference).
Kadar Air (AOAC 2005)
Tahap pertama yang dilakukan untuk menganalisis kadar air adalah mengeringkan cawan porselen dalam oven pada suhu 105 oC selama 1 jam. Cawan tersebut diletakkan ke dalam desikator (kurang lebih 15 menit) dan dibiarkan sampai dingin kemudian ditimbang. Cawan ditimbang kembali hingga beratnya konstan. Sebanyak 5 g contoh dimasukkan ke dalam cawan, kemudian dikeringkan dengan oven pada suhu 105oC selama 5 jam. Setelah selesai proses kemudian cawan tersebut dimasukkan ke dalam desikator dan dibiarkan sampai dingin dan selanjutnya ditimbang kembali. 105oC, kemudian didinginkan selama 15 menit di dalam desikator dan ditimbang hingga didapatkan berat yang konstan. Sampel sebanyak 5 g dimasukkan ke dalam cawan pengabuan dan dipijarkan di atas nyala api bunsen hingga tidak berasap lagi. Setelah itu dimasukkan ke dalam tanur pengabuan dengan suhu 600oC selama 1 jam, kemudian ditimbang hingga didapatkan berat yang konstan.
6
Kadar Protein (AOAC 2005)
Tahapan yang dilakukan dalam analisis protein terdiri atas tiga tahap yaitu destruksi, destilasi, dan titrasi. Pengukuran kadar protein dilakukan dengan metode mikro Kjeldahl. Sampel ditimbang sebanyak 0,25 g, kemudian dimasukkan ke dalam labu kjeldahl 100 mL, lalu ditambahkan 0,25 g selenium dan 3 mL H2SO4 pekat. Sampel didestruksi pada suhu 410oC selama kurang lebih
1 jam sampai larutan jernih lalu didinginkan. Setelah dingin, ke dalam labu kjeldahl ditambahkan 50 mL akuades dan 20 mL NaOH 40%, kemudian dilakukan proses destilasi dengan suhu destilator 100oC. Destilat ditampung dalam labu erlenmeyer 125 mL yang berisi campuran 10 mL asam borat (H3BO3)
2% dan 2 tetes indikator bromcresol green-methyl red yang berwarna merah muda, setelah volume destilat mencapai 40 mL dan berwarna hijau kebiruan, maka proses destilasi dihentikan. Destilat kemudian dititrasi dengan HCl 0,1 N sampai terjadi perubahan warna merah muda. Volume titran dibaca dan dicatat. Larutan blanko dianalisis seperti contoh.
Perhitungan kadar protein:
ujung bungkus ditutup dengan kapas bebas lemak dan selanjutnya dimasukkan ke dalam selongsong lemak, kemudian sampel yang telah dibungkus dimasukkan ke dalam labu lemak yang sudah ditimbang berat tetapnya (W2) dan disambungkan
dengan tabung soxhlet. Selongsong lemak dimasukkan ke dalam ruang ekstraktor tabung soxhlet dan disiram dengan pelarut lemak (benzena). Refluks dilakukan selama 6 jam. Pelarut lemak yang ada dalam labu lemak didestilasi hingga semua pelarut lemak menguap. Pada saat destilasi pelarut akan tertampung di ruang ekstraktor, pelarut dikeluarkan sehingga tidak kembali ke dalam labu lemak, selanjutnya labu lemak dikeringkan dalam oven pada suhu 105oC, setelah itu labu didinginkan dalam desikator sampai beratnya konstan (W3).
7
Kadar karbohidrat (AOAC 2005)
Analisis karbohidrat dilakukan secara by difference, yaitu hasil pengurangan dari 100 % dengan kadar air, kadar abu, kadar protein dan kadar lemak, sehingga kadar karbohidrat tergantung pada faktor pengurangannya. Hal ini karena karbohidrat sangat berpengaruh terhadap zat gizi lainnya.
Perhitungan kadar karbohidrat:
Karbohidrat (%) = 100% - (kadar air + kadar abu + kadar lemak + kadar protein)
Analisis Organoleptik
Penilaian organoleptik meliputi spesifikasi mutu mata, warna dan kenampakan daging, lendir pada permukaan badan, insang, bau, dan tekstur. Penilaian organoleptik pada penelitian ini dilakukan setiap jam selama 22 jam pada suhu ruang (±29 oC), menggunakan score sheet yang telah ditetapkan oleh Badan Standarisasi Nasional (BSN 2006). Ikan nila yang akan diamati nilai organoleptiknya dimatikan melalui cara penusukan kepala ikan pada bagian
medulla oblongata menggunakan jarum. Uji organoleptik dilakukan terhadap empat sampel ikan nila dalam keadaan utuh yang diambil secara acak. Data yang didapatkan berupa nilai 1-9, dan nilai tersebut diinterpretasikan dengan kriteria sebagai berikut :
Segar = nilai organoleptik berkisar antara 7-9 Agak segar = nilai organoleptik berkisar antara 5-6 Tidak segar = nilai organoleptik berkisar antara 1-3
Analisis pH (BSN 2004)
Pengukuran pH dilakukan dengan menggunakan pH meter dengan cara dikalibrasi terlebih dahulu. Sampel daging ikan nila sebanyak 15 g dihancurkan dan dihomogenkan dengan 90 mL air destilata. Kemudian daging homogen tersebut diukur dengan pH meter yang sebelumnya telah dikalibrasi dengan buffer standar pH 4 dan 7. Data yang terbaca pada alat menunjukkan nilai pH yang terukur. Metode ini didasarkan pada metode yang tercantum pada dokumen SNI 06-6989.11-2004 mengenai cara uji derajat keasaman menggunakan alat pH meter. Analisis pH pada penelitian ini dilakukan sebanyak dua kali pengulangan.
Analisis Total Volatile Base (TVB)(BSN 1998)
8
ditambahkan ke dalam outer chamber sebelah kanan sehingga filtrat dan K2CO3
tidak tercampur. Cawan segera ditutup dengan diolesi vaselin pada pinggirnya agar proses penutupan sempurna, lalu digerakkan memutar sehingga kedua cairan di outer chamber tercampur.
Disamping itu dikerjakan blanko dengan prosedur yang sama tetapi filtrat diganti dengan TCA 7 %. Kedua cawan conway tersebut diinkubasi selama 2 jam pada suhu 37 ˚C. Setelah diinkubasi, larutan asam borat dalam inner chamber
cawan conway yang berisi blanko dititrasi dengan larutan HCl 0,032 N dan cawan digoyangkan sampai larutan asam borat berubah warna menjadi merah muda. Selanjutnya cawan conway yang berisi sampel juga dititrasi dengan larutan HCl 0,032 N yang sama dengan blanko. Analisis TVB pada penelitian ini dilakukan sebanyak dua kali pengulangan. Kadar TVB dapat dihitung dengan rumus :
% N (mg N/100 g) = (a-b) x N HCl x 100 x fp x 14 mg N/100 g
Prinsip kerja analisis TPC adalah penghitungan jumlah bakteri yang ada di dalam sampel (daging ikan) dengan pengenceran sesuai kebutuhan. Pembuatan larutan contoh dilakukan dengan mencampurkan 10 g sampel yang telah dihancurkan yang diambil dari bagian punggung ikan, lalu dimasukkan ke dalam botol yang berisi 5 mL larutan KH₂PO₄ 1,7% steril, kemudian ditambah akuades 500 mL, dikocok sampai larutan homogen. Campuran larutan contoh tersebut diambil 1 mL dan dimasukkan ke dalam botol berisi 9 mL larutan garam sehingga diperoleh contoh dengan pengenceran 10-2, setelah itu dikocok agar homogen. Banyaknya pengenceran dilakukan sesuai dengan keperluan penelitian, biasanya sampai pengenceran 10-5. Pemipetan dilakukan dari masing-masing tabung pengenceran sebanyak 1 mL larutan contoh dan dipindahkan ke dalam cawan petri steril menggunakan pipet steril.
9
Analisis Histologi (Metode Parafin) (Curran dan Gregory 1980)
Analisis histologi daging ikan nila diawali dengan pembuatan preparat daging ikan. Tahapan pembuatan preparat terdiri atas pematian ikan, pemotongan daging ikan pada bagian punggung tepat di bawah sirip dorsal, kemudian fiksasi, dehidrasi, clearing, dan embedding. Pembuatan preparat dimulai dengan fiksasi selama 24-48 jam dalam larutan Buffer Normal Formalin (BNF). Fiksasi dilakukan untuk mencegah kerusakan dan mempertahankan keadaan jaringan seperti keadaan hidup. Proses dehidrasi dilakukan dengan perendaman jaringan daging sebanyak lima kali dalam larutan alkohol. Proses clearing dilakukan dengan cara bahan dipindahkan ke dalam larutan alkohol-xylol. Bahan kemudian dipindahkan ke dalam larutan xylol-parafin (1:1) selama 45 menit dan dimasukkan ke dalam oven dengan suhu (65-70) ºC. Pergantian parafin dilakukan setiap 45 menit sekali sebanyak 3 kali pergantian. Proses embedding dilakukan dengan memindahkan larutan parafin ke dalam cetakan dan dilakukan penyusunan jaringan di dalam cetakan. Selanjutnya dilakukan penyayatan dengan mikrotom Yamoto RV-240 putar setebal 7-8 μm. Hasil sayatan kemudian direkatkan pada gelas obyek, selanjutnya direndam dalam larutan xylol. Preparat diwarnai dengan haematoxylin selama tujuh menit dan eosin selama satu menit. Preparat direkatkan menggunakan entellan atau Canada balsam dengan gelas penutup. Preparat daging ikan diamati dan difoto menggunakan mikroskop cahaya merk Olympus CX41 beserta kamera DP-21.
Analisis Data
Metode analisis deskriptif digunakan untuk menggambarkan data yang telah dikumpulkan. Data yang terkumpul diolah menggunakan aplikasi Microsoft Excel. Data disajikan dalam bentuk tabel, grafik dan charts.
HASIL DAN PEMBAHASAN
Morfometrik Ikan Nila
10
Tabel 1 Morfometrik ikan nila
Parameter Nilai
Panjang total (cm) Panjang baku (cm) Tebal (cm)
Tinggi (cm) Bobot (g)
23,75±1,08 19,80±0,81 2,75±0,15 7,23±0,22 219,17±13,51
Gambar 2 Penampakan Ikan nila
Nilai morfometrik ikan nila diperoleh dari 6 ekor sampel ikan nila yang diambil secara acak. Tiap spesies ikan dapat memiliki ciri morfometrik yang berbeda-beda. Menurut Affandi et al. (1992), faktor yang mempengaruhi ciri morfometrik adalah jenis ikan, umur ikan, dan habitat ikan.
Proporsi Bagian Tubuh Ikan Nila
Data proporsi bagian tubuh ikan nila dapat dijadikan informasi untuk pemanfaatan ikan nila secara keseluruhan, karena tidak hanya bagian daging ikan saja yang dapat dimanfaatkan, tetapi bagian lain ikan juga dapat dimanfaatkan. Hasil persentase proporsi bagian tubuh ikan nila dapat dilihat pada Gambar 3.
Gambar 3 Proporsi bagian tubuh ikan nila
Daging 31%
Jeroan 11%
Kulit 6% Tulang
dan kepala
11
Persentase proporsi bagian tubuh ikan nila menunjukkan hasil yang berbeda pada penelitian Munandar et al. (2009), yaitu tulang dan kepala 49,52 %, daging 31,4 %, jeroan 6,78 %, dan kulit 4,45 %. Persentase rendemen ikan dipengaruhi oleh beberapa faktor, yaitu faktor jenis ikan, umur ikan, alat yang digunakan, dan cara penanganan (Ilyas 2004). Persentase proporsi jeroan akan mempengaruhi tingkat kemunduran mutu ikan. Sebagaimana diketahui bahwa bagian jeroan ikan kaya akan enzim, terutama enzim yang termasuk kategori protease dan lipase (Venugopal 2006). Enzim tersebut digunakan dalam sistem pencernaan saat ikan hidup. Namun saat ikan mati, enzim tersebut tetap bekerja pada jaringan ikan sebagai substrat. Proses tersebut menginisiasi terjadinya kemunduran mutu ikan yang disusul oleh kerusakan secara mikrobiologis. Di samping persentase rendemen jeroan, faktor lainnya yang saling berinteraksi mempengaruhi tingkat kemunduran ikan, antara lain: jenis ikan dan proporsi organ dalam terhadap total bobot jeroan yang didapat. Proporsi organ dalam akan berkaitan dengan jenis enzim dominan yang bekerja saat kemunduran mutu ikan. Prasertsan dan Prachumratana (2008) melaporkan bahwa bagian limpa cenderung memiliki aktivitas protease yang tinggi dibandingkan hati, pankreas, dan usus. Sedangkan bagian pankreas cenderung memiliki aktivitas lipase yang tinggi.
.
Nilai Organoleptik Ikan Nila
Ikan yang telah mati akan mengalami fase post mortem. Penentuan fase
post mortem ikan nila pada penelitian ini dilakukan menggunakan metode sensori, yaitu secara organoleptik. Pengujian organoleptik merupakan cara pengujian menggunakan indera manusia. Hasil analisis organoleptik ikan nila dapat dilihat pada Gambar 4.
Waktu (jam)
Gambar 4 Nilai organoleptik ikan nila
12
dimatikan. Fase post rigor ikan nila terjadi pada penyimpanan jam ke-18. Hasil uji organoleptik penelitian ini menunjukkan hasil yang berbeda dengan penelitian Nurjanah et al. (2004), fase pre rigor terjadi pada penyimpanan jam ke-0 hingga jam ke-2, fase pre rigor terjadi selama 2 jam setelah ikan dimatikan, fase rigor
terjadi pada penyimpanan jam ke-2 hingga jam ke-12, fase rigor terjadi selama 10 jam setelah ikan dimatikan, dan fase post rigor terjadi pada jam ke-12 setelah ikan dimatikan. Perbedaan lama waktu berlangsungnya fase post mortem ini dapat disebabkan oleh beberapa faktor, yaitu kondisi fisik ikan, jenis ikan, cara kematian, ukuran, cara penangkapan, cara penanganan, dan suhu penyimpanan (Junianto 2003). Menurut Moeljanto (1992), aktifitas enzimatis (autolisis) mempengaruhi laju post mortem ikan nila. Beberapa enzim yang berperan dalam proses autolisis, yaitu katepsin, tripsin, kemotripsin, pepsin, serta enzim dari mikroorganisme yang terdapat dalam tubuh ikan.
Fase pre rigor ikan nila pada penelitian ini berdasarkan nilai organoleptik (7-9) berlangsung selama 7 jam setelah ikan dimatikan. Ciri-ciri organoleptik pada fase pre rigor yaitu mata cerah, kornea jernih, insang merah cemerlang, bau segar spesifik jenis, tekstur padat, daging elastis bila ditekan dengan jari, otot daging mudah dilenturkan. Fase pre rigor terjadi saat otot masih lembut dan lentur serta secara biokimiawi ditandai dengan menurunnya kadar ATP dan kreatin fosfat (Eskin 1990). Selain itu proses enzimatis berpengaruh pada fase pre rigor. Hal yang terjadi pada fase ini ialah adanya pelemasan otot-otot ikan sesaat setelah ikan mati sehingga ikan mudah dilenturkan. Perubahan ini terjadi karena terhentinya peredaran darah yang membawa oksigen untuk proses metabolisme (Yunizal dan Wibowo 1998).
Fase rigor ditandai dengan menghilangnya kelenturan tubuh ikan karena otot yang kaku (Eskin 1990). Fase rigor ikan nila pada penelitian ini berdasarkan nilai organoleptik (5-6) berlangsung selama 10 jam, yaitu pada jam ke-8 hingga jam ke-17 setelah ikan dimatikan. Ciri-ciri organoleptik ikan nila pada fase rigor
yaitu mata agak cerah, kornea agak keruh, insang merah kurang cemerlang, bau netral, tekstur agak padat, elastis bila ditekan dengan jari, otot daging kaku. Hilangnya kelenturan ikan berhubungan dengan terbentuknya aktomiosin yang berlangsung lambat. Fase rigor terjadi saat siklus miosin dan aktin di dalam miofibril terhenti dan terbentuknya aktomiosin yang permanen (Eskin 1990). Menurut Dwiari et al. (2008), penurunan kelenturan otot terus berlangsung seiring dengan semakin sedikitnya jumlah ATP.
Fase post rigor merupakan awal dari proses pembusukan serta menandakan ikan dalam kualitas yang rendah dan sudah tidak layak untuk dikonsumsi. Fase ini ditandai dengan mulai melunaknya otot ikan secara bertahap yang disebabkan oleh proses autolisis, proses autolisis menghasilkan senyawa yang berfungsi sebagai media petumbuhan bakteri. Petumbuhan bakteri pada fase
13
Setelah ikan mati, Enzim ATP-ase akan mengubah ATP menjadi ADP, kemudian berubah menjadi AMP oleh enzim miokinase. Perubahan AMP menjadi IMP dipengaruhi oleh enzim deaminase dan dari IMP menjadi inosin dipengaruhi oleh enzim fosfatase (Nurjanah et al. 2004).
Hasil uji organoleptik ini digunakan untuk menentukan waktu pengujian pH, total volatile base (TVB), total plate count (TPC), dan histologis. Berdasarkan data organoleptik, pengujian tersebut dilakukan pada jam ke-0 (fase
pre rigor), kemudian pada jam ke-8 (fase rigor), dan pada jam ke-18 (fase post rigor).
Komposisi Kimia Ikan Nila
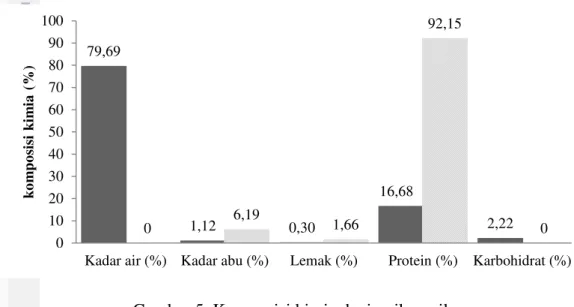
Ikan nila merupakan salah satu jenis komoditas perikanan yang mempunyai nilai ekonomis dan banyak dikosumsi masyarakat karena memiliki daging yang enak. Sampel ikan nila yang diperoleh, kemudian diambil dagingnya pada bagian punggung ikan untuk dianalisis komposisi kimianya melalui uji proksimat. Komposisi kimia yang diuji terdiri dari kadar air, kadar abu, kadar lemak, dan kadar protein. Hasil analisis proksimat daging ikan nila dapat dilihat pada Gambar 5.
Gambar 5 Komposisi kimia daging ikan nila ( = bobot basah, = bobot kering)
Zat lain yang terkandung dalam daging ikan nila yaitu karbohidrat. Perhitungan karbohidrat dilakukan dengan cara by difference, sehingga nilai yang didapat merupakan proporsional dari perhitungan keseluruhan proksimat. Hasil perhitungan kadar karbohidrat (by difference) ikan nila sebesar 2,22 %. Hasil analisis proksimat menunjukkan nilai yang berbeda dengan Suyanto (1994), dalam penelitianya terhadap spesies yang sama memperoleh kadar air 79,44 %, kadar abu 1,26 %, kadar lemak 2,57 %, dan kadar protein 12,52 %. Komposisi kimia ikan guramijuga menunjukkan nilai yang berbeda yaitu, kadar air 75,48 %, kadar abu 1,03 %, kadar lemak 2,20, kadar protein 18,71 (Zakaria 2008).
Kadar air (%) Kadar abu (%) Lemak (%) Protein (%) Karbohidrat (%)
14
Perbedaan ini diduga disebabkan oleh beberapa faktor, yakni perbedaan kondisi lingkungan, spesies, ukuran ikan, serta pakan (Lugo et al. 2003). Menurut Astawan (2007), komposisi gizi ikan dipengaruhi oleh beberapa faktor, yaitu spesies, jenis kelamin, umur, musim, kematangan gonad, dan letak geografis.
Derajat Keasaman (pH)
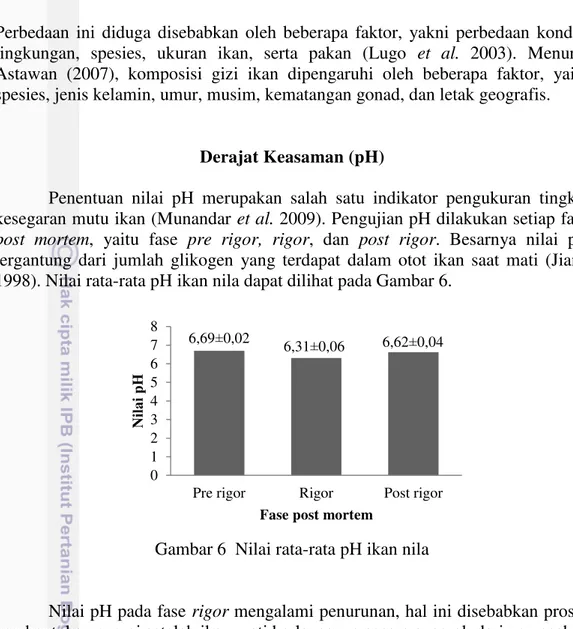
Penentuan nilai pH merupakan salah satu indikator pengukuran tingkat kesegaran mutu ikan (Munandar et al. 2009). Pengujian pH dilakukan setiap fase
post mortem, yaitu fase pre rigor, rigor, dan post rigor. Besarnya nilai pH tergantung dari jumlah glikogen yang terdapat dalam otot ikan saat mati (Jiang 1998). Nilai rata-rata pH ikan nila dapat dilihat pada Gambar 6.
Gambar 6 Nilai rata-rata pH ikan nila
Nilai pH pada fase rigor mengalami penurunan, hal ini disebabkan proses pembentukan energi setelah ikan mati berlangsung secara anaerob dari pemecahan glikogen yang menghasilkan ATP dan asam laktat. Akumulasi asam laktat inilah yang menyebabkan terjadinya penurunan pH daging ikan (Eskin 1990). Nilai pH ikan nila pada fase post rigor mengalami peningkatan. Peningkatan kembali nilai pH ikan yang mati dapat disebabkan oleh proses autolisis yang mendorong terjadinya penguraian protein menjadi senyawa yang lebih sederhana berupa peptida, amonia, dan asam amino yang dapat menaikkan pH jaringan daging ikan (Yunizal dan Wibowo 1998).
Total Plate Count (TPC)
15
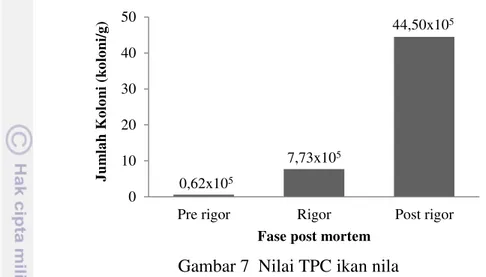
anggapan bahwa setiap sel yang dapat hidup akan berkembang menjadi satu koloni, jadi jumlah koloni yang muncul pada cawan merupakan suatu indeks bagi jumlah mikroorganisme yang dapat hidup yang terkandung dalam sampel (Hadioetomo 1993). Nilai TPC ikan nila dapat dilihat pada Gambar 7.
Gambar 7 Nilai TPC ikan nila
Nilai TPC pada fase pre rigor menunjukkan bahwa ikan masih layak untuk dikonsumsi, sedangkan nilai TPC ikan nila pada fase rigor dan post rigor
menunjukkan bahwa ikan sudah dalam keadaan tidak layak untuk dikonsumsi. Nilai TPC maksimum ikan segar yang ditetapkan dalam (BSN 2009) adalah sebesar 5x105 koloni/g. Nilai TPC pada ikan nila mengalami peningkatan pada setiap fase post mortem. Hal ini menandakan adanya pertumbuhan mikroba pada sampel selama proses penyimpanan. Menurut Leksono dan Amin (2001), selama penyimpanan berlangsung terjadi penguraian protein oleh enzim yang merupakan media untuk pertumbuhan mikroba, sehingga mikroba dapat tumbuh dan berkembang biak. Pertumbuhan mikroba dipengaruhi oleh keadaan lingkungan hidup serta temperatur yang cocok. Mikroba aktif akan berkembang biak dengan cara membelah diri selama penyimpanan. Umumnya mikroba yang hidup pada kondisi lingkungan yang sesuai mampu membelah diri setiap 20-30 menit (Waluyo 2007). Bakteri yang umum ditemukan pada ikan adalah bakteri
Pseudomonas, Akaligenes, Sarcia, Vibrio, Flavobacterium, Serratia, dan Bacillus,
pada ikan air tawar juga terdapat jenis bakteri Aeromonas, Lactobacillus, Bevibacterium, dan Streptococcus (Junianto 2003). Jenis bakteri yang tumbuh dan berperan dalam proses kemunduran mutu ikan antara lain Escherichia coli, Salmonella, Vibrio Cholerae (BSN 2006b).
Total volatile Base (TVB)
16
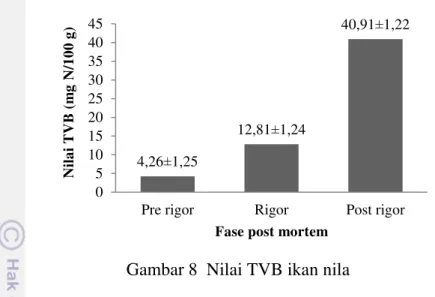
Gambar 8 Nilai TVB ikan nila
Proses penguraian secara enzimatis terjadi setelah ikan mati dengan mekanisme yang kompleks. Beberapa enzim yang berperan dalam proses ini yaitu enzim katepsin (dalam daging), tripsin, kemotripsin dan pepsin (dalam organ pencernaan), serta enzim dari mikroorganisme yang ada pada tubuh ikan. Enzim-enzim yang dapat menguraikan protein berperan penting dalam proses kemunduran mutu ikan (Moeljanto 1992). Standar nilai TVB untuk produk hasil perikanan dapat dilihat pada Tabel 2.
Tabel 2 Standar TVB untuk hasil perikanan.
Tingkat Kesegaran Nilai TVB (mg N/100 g) Sangat segar antara 10-20 mg N/100 g termasuk dalam kriteria ikan segar (Farber 1965). Nilai TVB ikan nila pada fase post rigor menunjukkan sudah dalam keadaan busuk dan tidak layak untuk dikonsumsi, yakni sebesar 40,91±1,22 mg N/100 g. Menurut Farber (1965), ikan dengan nilai TVB lebih dari 30 mg N/100 g tergolong ikan yang tidak layak untuk dikonsumsi.
Nilai TVB ikan akan semakin meningkat seiring lamanya waktu penyimpanan. Peningkatan nilai TVB disebabkan oleh aktivitas autolisis dan kegiatan bakteri pembusuk selama proses penyimpanan. Pada proses enzimatis, protein akan diuraikan menjadi senyawa-senyawa yang lebih sederhana, antara lain: peptida, asam amino dan amonia. Disamping itu, hidrolisis protein membentuk basa purin dan pirimidin (Kreuzer 1965). Peningkatan nilai TVB
17
selama proses penyimpanan akibat degradasi protein dan derivatnya menghasilkan sejumlah basa mudah menguap, yaitu amoniak, histamin, H2S, dan trimetilamin
yang berbau busuk (Karungi et al. 2003).
Nukleotida utama yang berperan dalam mentransfer energi yaitu ATP, juga berperan dalam penambahan jumlah amonia pada volatil amin setelah kematian ikan. Nukleotida ATP adalah senyawa utama pembawa energi kimia dalam sel. Ketika ikan mati, kondisi anaerob dan ATP akan terurai dengan melepas energi (Jiang 1998).
Karakteristik Histologis
Histologi adalah suatu ilmu yang menguraikan struktur dari hewan secara terperinci dan hubungan antara struktur pengorganisasian sel dan jaringan serta fungsi-fungsinya. Jaringan merupakan sekumpulan sel yang tersimpan dalam suatu kerangka struktur atau matriks yang mempunyai suatu kesatuan organisasi yang mampu mempertahankan keutuhan dan penyesuaian terhadap lingkungan diluar batas dirinya (Bavelander dan Ramaley 1998). Analisis histologis pada penelitian ini dilakukan untuk mengetahui struktur jaringan daging ikan nila secara mikroskopis. Sampel daging ikan nila diamati pada setiap fase post mortem
yaitu fase pre rigor, rigor dan post rigor. Hasil analisis histologis ikan nila penampang transfersal pada fase pre rigor dapat dilihat pada Gambar 9.
Gambar 9 Jaringan ikan nila fase pre rigor (400 kali)
(a. Myomer utuh dan kompak, b. Myomer mengalami kerusakan, c. Myoseptum)
Jaringan ikan nila pada fase pre rigor menunjukkan kondisi yang masih kompak. Sebagian besar myomer masih utuh dan kompak, tidak mengalami perenggangan antar fibril, namun sebagian terlepas dari myoseptum. Myomer yang telah mengalami keretakan pada fase ini, menunjukkan benang-benang fibril namun jarak antar tepinya masih dekat dan pada tepi myomer sebagian besar masih utuh.
18
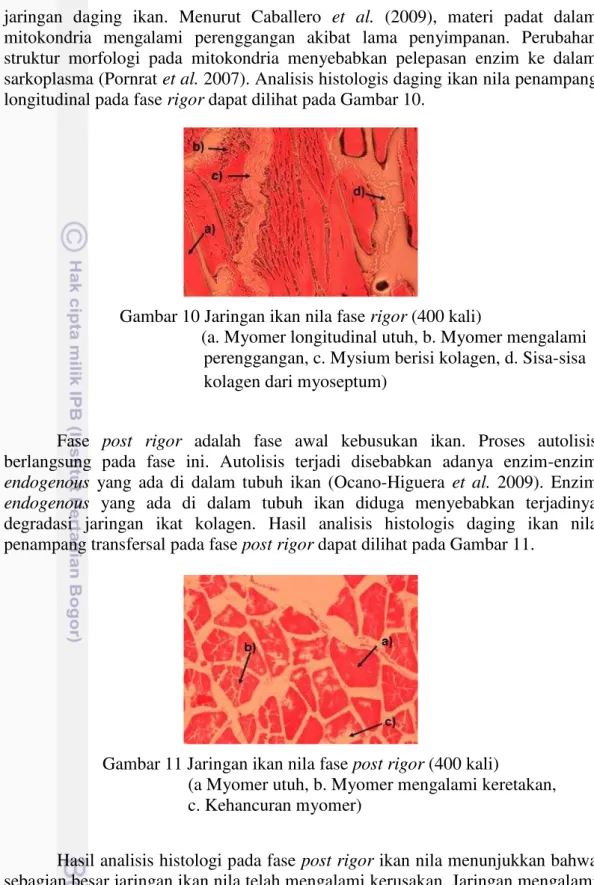
jaringan daging ikan. Menurut Caballero et al. (2009), materi padat dalam mitokondria mengalami perenggangan akibat lama penyimpanan. Perubahan struktur morfologi pada mitokondria menyebabkan pelepasan enzim ke dalam sarkoplasma (Pornrat et al. 2007). Analisis histologis daging ikan nila penampang longitudinal pada fase rigor dapat dilihat pada Gambar 10.
Gambar 10 Jaringan ikan nila fase rigor (400 kali)
(a. Myomer longitudinal utuh, b. Myomer mengalami perenggangan, c. Mysium berisi kolagen, d. Sisa-sisa kolagen dari myoseptum)
Fase post rigor adalah fase awal kebusukan ikan. Proses autolisis berlangsung pada fase ini. Autolisis terjadi disebabkan adanya enzim-enzim
endogenous yang ada di dalam tubuh ikan (Ocano-Higuera et al. 2009). Enzim
endogenous yang ada di dalam tubuh ikan diduga menyebabkan terjadinya degradasi jaringan ikat kolagen. Hasil analisis histologis daging ikan nila penampang transfersal pada fase post rigor dapat dilihat pada Gambar 11.
Gambar 11 Jaringan ikan nila fase post rigor (400 kali)
(a Myomer utuh, b. Myomer mengalami keretakan, c. Kehancuran myomer)
19
ikan nila pada fase post rigor menunjukkan kondisi kerusakan yang lebih parah dibandingkan kondisi jaringan ikan nila pada fase rigor maupun pre rigor. Hal ini menunjukkan bahwa tingkat kerusakan jaringan pada ikan akan semakin meningkat seiring lamanya waktu setelah ikan mengalami kematian.
Tingkat kesegaran ikan akan terus menurun seiring bertambahnya waktu penyimpanan hingga akhirnya ikan menjadi busuk. Menurut Kim et al. (2002), Enzim proteolitik berperan dalam degradasi protein selama proses pembusukan. Salah satu enzim proteolitik adalah enzim katepsin, enzim katepsin berada dalam organel lisosom dimana lisosom ini berada dalam serabut otot dan membran sel (Hu dan Leung 2006). Aktifnya enzim katepsin mampu merusak serabut otot pada daging ikan sehingga secara histologi dapat diketahui bahwa daging ikan mengalami kerusakan dan menjadi tidak kompak. Menurut Chereta et al. (2007), penurunan tingkat kekenyalan daging disebabkan oleh aktifitas enzim proteolitik (katepsin dan kalpain) yang merusak miofibril daging ikan.
Kerusakan jaringan ikan nila juga disebabkan oleh aktivitas enzim kolagenase. Enzim kolagenase dan beberapa subfamili metalloproteinase mampu memecah triple helix dari kolagen yang akhirnya mendegradasi kolagen yang menghasilkan hidrolosis asam amino glisin dan leusin dari rantai α molekul kolagen. Serin kolagenase dan sistein akan mendegradasi bagian lain dari kolagen yang tidak memiliki struktur helix (Saito et al. 2000).
Hasil analisis organoleptik menunjukkan adanya korelasi dengan parameter kesegaran ikan (TVB, TPC, dan histologis). Pada kondisi fase pre rigor, nilai organoleptik ikan nila masih tinggi, parameter histologis menunjukkan kondisi jaringan yang masih utuh, parameter TVB dan TPC menunjukkan nilai yang masih rendah. Kondisi fase rigor menunjukkan nilai organoleptik menurun, dilihat dari parameter histologi menunjukkan kondisi jaringan yang mulai mengalami kerusakan, dan nilai TVB dan TPC semakin meningkat. Kondisi fase
20
Saran
Perlu dilakukan penelitian lebih lanjut mengenai kemunduran mutu ikan nila, dengan perlakuan yang lebih spesifik pada umur, jenis kelamin, habitat, dan waktu pengambilan sampel. Analisis histologis ikan nila perlu dilakukan pada bagian selain daging, misalkan pada bagian mata, jeroan, dan insang.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemist. 2005. Official Method of Analysis of The Association of Official Analytical of Chemist. Arlington: The Association of Official Analytical Chemist, Inc.
[BSN] Badan Standardisasi Nasional. 1998. SNI 01-4495-1998. Penentuan kadar total volatile base (TVB) dan trimethylamine (Tmas) secara Conway.
Jakarta (ID): Badan Standardisasi Indonesia.
[BSN] Badan Standardisasi Nasional. 2004. SNI 06-6989.11-2004. Air dan air limbah - Bagian 11: Cara uji derajat keasaman (pH) dengan menggunakan alat pH meter. Jakarta (ID): Badan Standardisasi Indonesia. [BSN] Badan Standardisasi Nasional. 2009. SNI 7338-2009. Batas maksimum
cemaran mikroba dalam pangan. Jakarta (ID): Badan Standardisasi Indonesia.
[BSNa] Badan Standardisasi Nasional. 2006. SNI 01-2332.3-2006. Cara uji mikrobilologi-Bagian 3: Penentuan angka lempeng total (ALT) pada produk perikanan. Jakarta (ID): Badan Standardisasi Indonesia.
[BSNb] Badan Standardisasi Nasional. 2006. SNI 01-2345-2006. Uji Organoleptik Ikan Segar. Jakarta (ID): Badan Standardisasi Indonesia.
Abelti AL. 2013. Microbiological and chemical changes of nile tilapia (Oreochromis niloticus L.) fillet during ice storage: effect of age and sex.
Advance Journal of Food Science and Technology. 5(10): 1260-1265. Affandi R, Djaja SS, Rahardjo MF, Sulistiona. 1992. Ikhtiologi, Suatu Pedoman
Kerja Laboratorium. Bogor (ID): Institut Pertanian Bogor.
Ando M, Toyohara H, Shimizu Y, Sakaguchi M. 1991. Postmortem tenderization of rainbow trout (Oncorhynchus mykiss) muscle caused by gradual disintegration of the extracellular matrix. Journal of The Science of Food Agriculture. 55 (4): 589-597.
Apriyantono A, Fardiaz D, Puspitasari NL, Sedarnawati Y, Budijanto S. 1989.
Petunjuk Laboratorium Analisis Pangan. Bogor (ID): Pusat Antar Universitas Pangan dan Gizi. Institut Pertanian Bogor.
21
Azam K, Mackie IM, Smith J. 1989. The effect of slaughter method on the quality of rainbow trout (Salmo gairdneri) during storage on ice. International Journal of Food Science and Technology. 24:69-79.
Bavelander G, Ramaley J. 1998. Dasar-dasar Histologi. Edisi kedelapan. Jakarta(ID): Erlangga.
Caballero MJ, Betancor M, Escring JC, Montero D, Monteros AE, Castro P, Gines R, Izquierdo M. 2009. Post mortem changesnproduced in the muscle of sea bream (Sparus aurata) during ice storage. Aquaculture. 291:210-216.
Castillo-Yanez FJ, Jimenez-Ruiz EI, Canizales-Rodriguez DF, Marquez-Rios E, Montoya-Camacho N, Ruiz-Cruz S, Ocano-Higuera VM. 2014. Postmortem biochemical changes and evaluation of the freshness in the muscle pf tilapia (Oreochromis niloticus) during the storage in ice.
Journal of Fisheries and Aquatic Sciences. 9(6): 435-443.
Chereta R, Ladrat CD, Anton ML, Bagnis VV. 2007. Calpain and cathepsin activities in post mortem fish and meat muscles. Food chemistry. 101(4): 1474-1479.
Curran RC, Gregory J. 1980. Effect of fixation and processing on immune histo chemical demonstration of immunoglobulin in paraffin section of tonsil and bone marrow. Journal Clinic Pathology. 33(11): 1047-1057.
Dwiari SR, Asadayanti DD, Nurhayati, Sofyaningsih M, Yudhanti SFAR, Yoga IBKW. 2008. Teknologi Pangan. Jakarta (ID): Departemen Pendidikan Nasional
Eskin NAM. 1990. Biochemistry of Food. San Diego (US): Academic Press. Inc. FAO. 1995. Quantity and Quality Changes in Fresh Fish, by Huss, ed. New York
(US): Fisheries Technical Paper No.384. 95 pp.
Farber L. 1965. Freshness test. Dalam: Borgstrom G (ed). Fish as Food. Vol IV. New York (US): Academic Press, Inc.
Fardiaz S. 1987. Penuntun Praktek Mikrobiologi Pangan. Bogor (ID): IPB.
Hadioetomo RS. 1993. Mikrobiologi Dasar dalam Praktek: Teknik dan Prosedur Dasar Laboratorium. Yogyakarta (ID): Gramedia Pustaka Utama.
Hadiwiyoto S. 1993. Teknologi Pengolahan Hasil-Hasil Perikanan. Yogyakarta (ID): Liberty.
Hu KJ, Leung PC. 2006. Food degestion by cathepsin L and degestion-related rapid cell differentiation in shrimp hepatopankreas. Comparative Biochemistry and Physiologi. 146:69-80.
Ilyas S. 2004. Teknologi Refrigrasi Hasil Perikanan Jilid 1. Jakarta (ID): CV Paripurna.
Jiang ST. 1998. Contribution of muscle proteinases to meat tenderization.
22
Karungi C, Byaruhanga YB, Muyonga JH. 2003. Effect of pre-icing duration on quality deteriration of iced Nile perch (Lates niloticus). Food Chemistry.
85: 13-17.
Kim SK, Park PJ, Kim JB, Shahidi F. 2002. Purification and characterization of the collagenase from the tissue of filefish Novoden modestrus. Journal of Biochemistry and Molecular Biology. 35(2): 165-171.
Kreuzer R. 1965. The Technology of Fish Utilization. London (GB): Fishing microbiological, biochemical and physical attributes. African Journal of Biotechnology. 9(5): 692-701.
Lugo MG, Ivonne GA, Miguel AO, German MG. 2003. Comparison of growth, fillet yield, and proximate composition between stirling nile tilapia (wild type) (Ooreochromis niloticus L) and red hybrid tilapia (florida red tilapia x stirling red O.niloticus) males. Agriculture Research. 34:1023-1028. Marx H, Brunner B, Weinzierl W. 1997. Methods of stunning freshwater fish:
impact on meat quality and aspects of animal welfare. Zeitschrift für Lebensmittel und Untersuchung Forschning A. 204:282-286.
Moeljanto. 1992. Pengawetan dan Pengolahan Hasil Perikanan. Jakarta (ID): Penebar Swadaya.
Morzel M, Sohier S, Van de Vis JW. 2002. Evaluation of slaughtering methods of turbots with respect to animal protection and flesh quality. Journal of the Science of Food and Agriculture. 82:19-28.
Munandar A, Nurjanah, Nurilmala M. 2009. Kemunduran mutu ikan nila (Oreochromis niloticus) pada penyimpanan suhu rendah dengan perlakuan cara kematian dan penyiangan. Jurnal Teknologi Pengolahan Hasil Perikanan Indonesia. 12(2): 88-101.
Nurjanah, Setyaningsih I, Sukarno, Muldani M. 2004. Kemunduran mutu ikan nila merah (Oreochromis sp.) selama penyimpanan pada suhu ruang.
Buletin Teknologi Hasil Perikanan. 7(1): 37-43.
Ocano-Higuera VM, Marquez-Rios E, Canizales-Davila M, Castillo-Yanez, Pacheco-Aguilar R, Lugo-Sanchez ME, Garcia-Orozco, Graciano-Verdugo. 2009. Postmortem changes in cazon fish muscle stored on ice.
Food Chemistry. 116(4):933-938.
23
Prasertsan P, Prachumratana T. 2008. Comparison and selection of protease and lipase sources from visceral organs of three tuna species. Songklanakarin J. Sci. Technol. 30 (1): 73-76.
Price SA, Wilson LM. 2006. Patofisiologi. Volume 1. Philadelphia (US): EGC. Riyanto R, Supriyadi, Suparmo, Heruwati ES. 2012. Persamaan prediksi umur
simpan filet ikan nila (Oreochromis niloticus) yang dikemas vakum dalam HDPE. JPB Perikanan. 7 (2): 105–116.
Robb DHF, Kestin SC. 2002. Methods used to kill fish: Field observations and literature reviewed. Animal Welfare. 11: 269-292.
Saito M, Sato K, Kunisaki N, Kimura S. 2000. Characterization of a rainbow trout matrix metalloproteinase capable of degrading type 1 collagen. Journal of Biochemistry. 267:6943-6950.
Sakaguchi M. 1990. Sensory and non sensory methods for measuring freshness of fish and fishery products. Science of Processing Marine Food Product. Japan: Japan Corporation International Agency.
Suyanto. 1994. Budidaya Ikan Nila. Jakarta (ID): PT Gramedia Pustaka Utama. Venugopal V. 2006. Application of enzymes in fish processing and quality
control. Seafood Processing. United States of America. Taylor and Francis Group, LLC CRC Press.
Waluyo L. 2007. Mikrobiologi Umum. Malang (ID): UMM Press.
Yunizal, Wibowo S. 1998. Penanganan Ikan Segar. Jakarta (ID): Pusat Penelitian dan Pengembangan Perikanan.
24
LAMPIRAN
25
26
RIWAYAT HIDUP
Penulis dilahirkan di Banyumas, pada tanggal 08 Januari 1991. Penulis adalah anak keempat dari empat bersaudara dari Bapak Muhni dan Ibu Umi Kulsum. Penulis memulai jenjang pendidikan formal di SDN 1 Rancamaya pada tahun 1997 hingga tahun 2003. Penulis melanjutkan Sekolah Menegah Pertama di SMP Negeri 02 Cilongok dan lulus pada tahun 2006, Penulis kemudian melanjutkan Sekolah Menengah Atas di SMA Muhammadiyah 1 Purwokerto dan lulus pada tahun 2009.