KAJIAN HISTOPATOLOGI LIMPA DAN JANTUNG SAPI
YANG TERINFEKSI
Coxiella burnetii
DI RUMAH POTONG
HEWAN TERPADU KOTA BOGOR
WULANDARI UTAMI
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Kajian Histopatologi Limpa dan Jantung Sapi yang Terinfeksi Coxiella burnetii di Rumah Potong Hewan Terpadu Kota Bogor adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2014
Wulandari Utami
NIM B04090042
.
ABSTRAK
WULANDARI UTAMI. Kajian Histopatologi Limpa dan Jantung Sapi yang Terinfeksi Coxiella burnetii di Rumah Potong Hewan Terpadu Kota Bogor. Dibimbing oleh AGUS SETIYONO dan MAWAR SUBANGKIT.
Coxiella burnetii merupakan agen penyebab zoonosis Query fever. Penyakit ini meyerang berbagai jenis hewan termasuk sapi potong. Gejala yang ditimbulkan oleh infeksi C. burnetii bersifat subklinis sehingga sulit didiagnosa. Penelitian tentang infeksi C. burnetii pada sapi dilakukan sejak bulan Februari hingga Oktober 2013 di RPH Terpadu Kota Bogor. Penelitian dilakukan untuk mengetahui adanya infeksi C. burnetii serta membandingkan gambaran histopatologi organ limpa dan jantung sapi yang terinfeksi dan tidak terinfeksi C. burnetii. Sampel organ berupa limpa, jantung, hati, ginjal, dan paru-paru diambil dari 50 individu sapi, kemudian dilakukan pembuatan sediaan histopatologi dan diwarnai dengan teknik pewarnaan imunohistokimia dan hematoksilin dan eosin. Hasil pewarnaan imunohistokimia menunjukkan 5 sampel yang imunoreaktif terhadap antibodi poliklonal rabbit anti-Coxiella burnetii FKH IPB. Hasil positif ditemukan pada organ limpa, hati, dan ginjal. Pewarnaan hematoksilin dan eosin pada sediaan limpa yang positif terinfeksi C. burnetii menunjukkan lesio berupa akumulasi pigmen hemosiderin, deplesi folikel limfoid, infiltrasi sel radang limfosit, makrofag, neutrofil, dan eosinofil, serta edema. Lesio yang sama juga ditemukan pada sediaan limpa yang negatif terinfeksi C. burnetii, sehingga lesio dianggap tidak patognomonis. Tidak ditemukan lesio pada sediaan jantung yang positif terinfeksi C. burnetii, namun ditemukan lesio pada sediaan jantung yang negatif terinfeksi C. burnetii berupa degenerasi miokardium, regenerasi miokardium, dan kongesti ringan.
ABSTRACT
WULANDARI UTAMI. Histopathological Study on Spleen and Heart of Cattle Infected by Coxiella burnetii at Bogor Slaughterhouse. Supervised by AGUS SETIYONO and MAWAR SUBANGKIT.
Query fever is a zoonotic disease caused by Coxiella burnetii. This agent infects any kinds of animal including cattle. In many cases report, there are no clinical signs appear during the infection of C. burnetii. Then, it is also difficult to diagnose this disease. The study about infection of C. burnetii in cattle was carried out from February to October 2013 at Bogor Slaughterhouse. The aim of this study was to know the infection of C. burnetii and compare the histopathological finding of spleen and heart of infected cattle. A total of 50 samples of cattle spleen, heart, liver, kidney, and lung were collected, and processed for immunohistochemical and hematoxyllin and eosin staining. The result of immunohistochemical staining showed 5 samples were immunoreactive to polyclonal rabbit anti-Coxiella burnetii antibody FKH IPB in the spleen, liver, and kidney. The histopathological finding indicated hemosiderin pigment deposits, lymphoid follicle depletion, infiltration of lymphocyte, macrophage, neutrophil, and eosinophil cells, and oedema. No lesion appeared in heart with positive infection of C. burnetii, however myocardial degeneration, myocardial regeneration, and myocardial congestion were found in heart with negative infection of C. burnetii.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan
pada
Fakultas Kedokteran Hewan
KAJIAN HISTOPATOLOGI LIMPA DAN JANTUNG SAPI YANG
TERINFEKSI
Coxiella burnetii
DI RUMAH POTONG HEWAN
TERPADU KOTA BOGOR
WULANDARI UTAMI
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
Judul Skripsi : Kajian Histopatologi Limpa dan Jantung Sapi yang Terinfeksi
Coxiella burnetii di Rumah Potong Hewan Terpadu Kota Bogor Nama : Wulandari Utami
NIM : B04090042
Disetujui oleh
drh Agus Setiyono, MS PhD APVet Pembimbing I
drh Mawar Subangkit, MSi APVet Pembimbing II
Diketahui oleh
drh Agus Setiyono, MS PhD APVet Wakil Dekan
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga skripsi ini dapat diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari sampai Oktober 2013 ini adalah Q fever, dengan judul Kajian Histopatologi Limpa dan Jantung Sapi yang Terinfeksi Coxiella burnetii di Rumah Potong Hewan Terpadu Kota Bogor. Terima kasih penulis ucapkan kepada drh Agus Setiyono, MS PhD APVet dan drh Mawar Subangkit, MSi APVet yang telah membimbing penulis mulai dari pemilihan materi penelitian hingga penulisan skripsi. Terima kasih atas segala masukan dan sarannya.
Terima kasih penulis ucapkan kepada ayahanda Syahruddin S, ibunda Humaerah, adinda Ayu Syafitri, adinda Sri Rezki Khairunnisa, adinda Noviana Maharani, keluarga besar penulis di Kabupaten Bulukumba dan Kota Palopo, teman-teman Geochelone FKH 46, serta teman-teman IKAMI Sulawesi Selatan atas doa, kasih sayang, dan dukungannya kepada penulis selama ini. Penghargaan penulis sampaikan kepada Tim Peneliti Q Fever (Srimita Kristiani Br. Sembiring, Andre Yudhi, dan Hario Pranaditya Munif AN), Bambang Rifky Yudyantoro, dokter hewan dan staf Rumah Potong Hewan Terpadu Kota Bogor, serta staf Laboratorium Histopatologi FKH IPB (Pak Kas, Pak Sholeh, dan Pak Endang) yang telah membantu penulis selama pengumpulan data. Penulis juga mengucapkan terima kasih kepada seluruh dosen dan staf di Institut Pertanian Bogor, terkhusus di Fakultas Kedokteran Hewan yang telah dengan ikhlas mengajarkan berbagai ilmu pengetahuan sebagai bekal penulis dalam menyelesaikan skripsi ini serta bekal di kemudian hari. Semoga skripsi ini bermanfaat. Wassalamu ‘alaikum wr. wb.
Bogor, Januari 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 3
Tujuan Penelitian 3
Manfaat Penelitian 3
METODE PENELITIAN 3
Waktu dan Tempat Penelitian 3
Peralatan Penelitian 4
Bahan Penelitian 4
Prosedur Penelitian 4
HASIL DAN PEMBAHASAN 6
Pengamatan Sediaan Imunohistokimia 6
Pengamatan Sediaan Hematoksilin dan Eosin 8
SIMPULAN DAN SARAN 15
Simpulan 15
Saran 15
DAFTAR PUSTAKA 15
DAFTAR TABEL
1 Hasil pengamatan sediaan dengan pewarnaan IHK menggunakan antibodi poliklonal rabbit anti-Coxiella burnetii FKH IPB 6 2 Hasil pengamatan lesio pada sediaan histopatologi limpa yang positif dan
negatif terhadap infeksi C. burnetii 9
3 Hasil pengamatan lesio pada sediaan histopatologi jantung yang positif dan
negatif terhadap infeksi C. burnetii 13
DAFTAR GAMBAR
1 Hasil pewarnaan IHK dengan metode LSAB, kromogen DAB, antibodi poliklonal rabbit anti-Coxiella burnetii FKH IPB, dan counterstain Mayer
Hematoksilin pada organ limpa 7
2 Hasil pewarnaan IHK dengan metode LSAB, kromogen DAB, antibodi poliklonal rabbit anti-Coxiella burnetii FKH IPB, dan counterstain
Mayer Hematoksilin pada organ ginjal 7
3 Hasil pewarnaan IHK dengan metode LSAB, kromogen DAB, antibodi poliklonal rabbit anti-Coxiella burnetii FKH IPB, dan counterstain
Mayer Hematoksilin pada organ hati 8
4 Limpa dengan akumulasi pigmen hemosiderin 9
5 Limpa yang mengalami deplesi pulpa putih 10
6 Limpa yang diinfiltrasi sel radang neutrofil dan eosinofil 10
7 Limpa yang diinfiltrasi sel radang limfosit dan makrofag 11
8 Limpa yang mengalami edema 11
9 Limpa yang mengalami hemoragi di sekitar pembuluh darah 12
10 Limpa yang mengalami hemoragi pada trabekula 13
11 Jantung yang mengalami degenerasi otot 14
12 Jantung yang mengalami regenerasi otot 14
PENDAHULUAN
Latar Belakang
Indonesia merupakan negara yang rentan terkena wabah Query fever (Q fever). Hal ini dikarenakan Indonesia adalah negara agraris yang sebagian besar mata pencaharian penduduknya adalah petani dan peternak. Pertanian sering diiringi dengan kegiatan yang berkontak langsung dengan hewan terutama ruminansia besar (Rasmana 2007). Berdasarkan Keputusan Menteri Pertanian nomor 4026/Kpts./OT.140/3/2013 tentang penetapan jenis penyakit hewan menular strategis (PHMS) ditetapkan 22 jenis PHMS di Indonesia, salah satunya
Q fever. Masuknya Q fever dalam daftar PHMS menjadi bukti kekhawatiran pemerintah Indonesia terhadap bahaya Q fever.
Coxiella burnetii (C. burnetii) adalah agen penyebab terjadinya Q fever. Q fever merupakan zoonosis yang sangat menular pada hewan maupun manusia (Setiyono et al. 2008). Bakteri C. burnetii merupakan mikroorganisme Gram negatif yang bersifat obligat intraseluler pada inangnya (Maurin dan Raoult 1999). Menurut Center for Diseases Control and Prevention (CDC 2013), C. burnetii
tergolong dalam kelompok B yaitu mikroorganisme berbahaya yang berpotensi menjadi senjata biologi. C. burnetii mempunyai daya tahan yang sangat tinggi di alam dan dosis infeksius yang rendah (Setiyono et al. 2008).
Menururt Angelakis dan Raoult (2010) transmisi penyakit Q fever pada hewan sangat dipengaruhi oleh siklus hidup caplak. Transmisi Q fever pada hewan terjadi melaui rute aerosol, perkutan, oral, seksual, transplasenta, dan transmamari. Transmisi penyakit Q fever pada manusia dapat terjadi melalui rute aerosol, oral, seksual, dan dipengaruhi oleh umur.
Hewan yang dapat terinfeksi C. burnetii antara lain ruminansia (sapi, kambing, dan domba), unggas, hewan peliharaan seperti anjing dan kucing, serta hewan liar (Maurin dan Raoult 1999; Acha dan Szyfres 2003; Angelakis dan Raoult 2010). Rodensia, caplak, serangga, bahkan ikan juga merupakan sumber penularan penting bagi penyakit Q fever (Marrie 2003). Beberapa hewan yang terinfeksi C. burnetii dapat mengalami bakteremia. Hal ini mengakibatkan caplak dapat bertindak sebagai vektor Q fever selama proses makan dari caplak tersebut (Maurin dan Raoult 1999). Sumber infeksi utama C. burnetii pada manusia adalah hewan ternak seperti sapi, kambing dan domba (Fournier et al. 1998).
Manifestasi klinis dari infeksi C. burnetii terdiri dari 2 bentuk yaitu akut dan kronis. Fournier et al. (1998) menyatakan bahwa bentuk akut Q fever pada manusia dapat berupa demam, hepatitis, pneumonia, ruam pada kulit, dan gejala pada syaraf, sedangkan bentuk kronis Q fever berupa endokarditis, kondisi ini dapat terjadi sebagai kelanjutan dari bentuk akut Q fever. Infeksi kronis C. burnetii sering terjadi 6 bulan setelah onset. Endokarditis merupakan manifestasi klinis yang paling sering ditemukan pada kasus Q fever kronis (Fournier et al.
1998; Maurin dan Raoult 1999; Angelakis dan Raoult 2010).
2
kambing dan domba yang terinfeksi C. burnetii akan menunjukkan gejala klinis berupa gangguan reproduksi seperti abortus. Kambing, domba, dan sapi merupakan hewan yang dapat bertindak sebagai carrier subklinis, sehingga dapat menyebarkan bakteri melalui sekreta dan eksretanya (OIE 2010). Stein et al.
(2005) melakukan penelitian berupa mencit yang diinfeksi C. burnetii melaui rute aerosol. Mencit menunjukkan gejala klinis berupa rambut yang kusut dan inaktif pada 4 hingga 7 hari setelah infeksi. Pengamatan sediaan histopatologi menunjukkan mencit mengalami pneumonia, hepatitis, dan splenitis.
Diagnosa Q fever berdasarkan kemunculan gejala klinis sulit dilakukan. Hal ini disebabkan gejala klinis sering kali bersifat polimorfik, nonspesifik, dan akut. Beberapa kasus lain justru tidak menunjukkan gejala sama sekali atau bersifat subklinis (Fournier et al. 1998). Diperlukan diagnosa secara laboratoris untuk peneguhan diagnosa awal (Setiyono et al. 2008). Beberapa teknik diagnosa Q fever dengan imunodeteksi yang sering digunakan yaitu pewarnaan imunohistokimia, enzyme-linked immunosorbent assay (ELISA) atau enzyme-linked immunofluorescent assay, dan uji dot immunoblotting (Fournier et al.
1998).
Salah satu teknik diagnosa yang dapat dilakukan untuk mendeteksi keberadaan C. burnetii di dalam sel atau jaringan adalah pewarnaan imunohistokimia (IHK). IHK merupakan suatu teknik yang dilakukan untuk mendeteksi keberadaan berbagai macam komponen yang terdapat di dalam sel atau jaringan dengan menggunakan prinsip reaksi ikatan antigen dan antibodi (Porter et al. 2011). Penggunaan antibodi primer yang bersifat monoklonal atau poliknonal yang spesifik berikatan dengan antigen yang terdapat pada jaringan. Antibodi primer berikatan dengan antibodi sekunder yang dapat divisualisasikan oleh kromogen dalam bentuk warna (Subangkit 2012). Menurut Key (2009) terdapat 2 tipe pewarnaan IHK yaitu pewarnaan IHK secara langsung (direct method) dan tidak langsung (indirect method). Pewarnaan IHK secara langsung melibatkan hanya satu antibodi, sedangkan pewarnaan IHK secara tidak langsung melibatkan lebih dari satu antibodi. Terdapat beberapa jenis pewarnaan IHK secara tidak langsung misalnya metode peroxidase anti-peroxidase (PAP)
complex, metode avidin-biotin complex (ABC), dan metode labeled streptavidin-biotin (LSAB).
Sapi potong termasuk komoditi ternak yang banyak diminati peternak di Indonesia. Hewan ini berpotensi menjadi reservoir dan inang C. burnetii. Pemotongan sapi potong dengan baik dan benar dalam skala besar dilakukan di Rumah Potong Hewan (RPH). RPH merupakan tempat pemotongan hewan yang didatangkan dari berbagai daerah. RPH dapat menjadi salah satu sarana baru penyebaran penyakit Q fever ke berbagai daerah. Salah satu RPH yang memiliki aktivitas pemotongan sapi yang cukup tinggi adalah RPH Terpadu Kota Bogor. Berdasarkan data lapangan diketahui RPH Terpadu Kota Bogor dapat memotong sekitar 30 sampai 40 ekor sapi setiap harinya.
3 putih. Menurut Cesta (2006) pulpa merah terdiri dari 2 subkompartemen yaitu bingkai limpa dan sinus venosus. Bingkai limpa disusun oleh serat retikular, sel retikular, dan makrofag. Pulpa merah merupakan filter darah yang mengeliminasi material asing dan berbahaya serta eritrosit yang sudah tua (Krieken dan Orazi 2007). Fungsi limfatik limpa dijalankan oleh pulpa putih. Pulpa putih terdiri atas 3 subkompartemen yaitu periarteriol lymphoid sheath (PALS), folikel, dan zona marginal (Ross dan Pawlina 2011). Pulpa putih disusun oleh limfosit, makrofag, sel dendritik, sel plasma, arteriol, dan kapiler dalam jaringan retikular (Cesta 2006). Jantung merupakan organ yang berfungsi memompa darah yang kaya oksigen dan nutrisi melalui sistem sirkulasi, selain itu juga memompa darah yang telah dioksigenasi ke sistem sirkulasi pulmonum. Jantung terbagi menjadi bagian dextra dan sinistra, setiap bagian terdiri dari atrium dan ventrikel. Dinding jantung secara histologi memiliki 3 lapisan yaitu epikardium, miokardium, dan endokardium (Maxie dan Robinson 2007).
Perumusan Masalah
Penelitian ini mengkaji mengenai histopatologi organ limpa dan jantung sapi yang diduga telah terinfeksi C. burnetii di RPH Terpadu Kota Bogor.
Pengambilan sampel (limpa, jantung, hati, ginjal, dan paru-paru) dilakukan pada 50 individu sapi. Organ tersebut diwarnai menggunakan metode imunohistokimia (IHK) untuk mendeteksi adanya infeksi C. burnetii. Pewarnaan hematoksilin dan eosin (HE) pada sampel organ limpa dan jantung untuk melihat lesio yang ditimbulkan oleh C. burnetii pada organ tersebut dan membandingkan dengan sediaan yang tidak terinfeksi C. burnetii.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui adanya kejadian Q fever pada sapi di RPH Terpadu Kota Bogor. Penelitian ini juga bertujuan untuk mengetahui dan membandingkan gambaran histopatologi organ limpa dan jantung yang terinfeksi dan tidak terinfeksi C. burnetii melalui pengamatan terhadap sediaan histopatologi dari sapi di RPH Terpadu Kota Bogor.
Manfaat Penelitian
Penelitian ini diharapkan dapat mendeteksi adanya penyakit Q fever pada sapi di RPH Terpadu Kota Bogor. Mengetahui gambaran histopatologi penyakit Q fever pada sampel limpa dan jantung dari individu yang positif atau negatif terinfeksi C. burnetii.
METODE PENELITIAN
Waktu dan Tempat Penelitian
4
Oktober 2013. Kegiatan pengambilan sampel organ hewan yang diduga terinfeksi
C. burnetii bertempat di RPH Terpadu Kota Bogor. Pembuatan dan pengamatan sediaan histopatologi dilakukan di Laboratorium Histopatologi, Departemen Klinik Reproduksi dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Peralatan Penelitian
Alat yang digunakan dalam proses penelitian ini yaitu sarung tangan, gunting, pinset, botol sampel, kertas label tissue cassette, keranjang jaringan, automatic tissue processor, Paraffin Embedding Console, cetakan blok parafin,
mikrotom putar, penangas air, inkubator, refrigerator, gelas objek, chamber, gelas penutup, tissue, heater, gelas piala, pipet tetes, dan mikroskop cahaya.
Bahan Penelitian
Bahan yang digunakan dalam proses penelitian ini yaitu sampel organ (limpa, jantung, hati, ginjal, dan paru-paru sapi), parafin cair, etanol bertingkat (absolut, 96%, 80%, 70%), xylene, pewarna Mayer Hematoksilin, pewarna Eosin, Litium Karbonat, mounting medium (Permount®), poly-L-lysine, akuades, PBS
(Phosphate Buffer Saline), H2O2 0.3%, FBS (Fetal Bovine Serum) 1%, antibodi
primer (polyclonal antibody rabbit anti-Coxiella burnetii FKH IPB), kit pewarnaan imunohistokimia yang terdiri dari biotin, streptavidine, dan
diamminobenzidine (DAB).
Prosedur Penelitian Persiapan Pengambilan Sampel
Pembuatan surat izin dari Dinas Peternakan Kota Bogor untuk melakukan pengambilan sampel di RPH yang berlokasi di kota Bogor. RPH tersebut adalah RPH Terpadu Kota Bogor. Pembuatan surat pengantar dari institusi yaitu Fakultas Kedokteran Hewan, Institut Pertanian Bogor kepada RPH Terpadu Kota Bogor. Proses Pengambilan Sampel
Sampel berupa limpa, jantung, hati, ginjal, dan paru-paru diambil sesaat setelah proses penyembelihan dilakukan, dilakukan dengan melihat adanya lesio atau penyimpangan terhadap organ tersebut (organ dari hewan yang diduga terinfeksi C. burnetii). Sampel diambil dari 50 individu dan dilakukan selama 2 minggu. Sampel organ diambil sebesar 1×1×2 cm setiap organ, lalu disimpan dalam botol sampel berisi BNF 10% dan diberi kertas label. Hal ini bertujuan untuk mengawetkan sampel agar tidak rusak selama penyimpanan.
Pembuatan Sediaan Histopatologi
5 Jaringan diletakkan pada cetakan blok parafin yang telah diisi dengan sedikit parafin cair agar jaringan terfiksir dengan sempurna. Letak jaringan diatur sedemikian rupa agar selalu berada di tengah-tengah cetakan. Cetakan diisi penuh dengan parafin cair kemudian didiamkan hingga mengeras.
Blok parafin berisi jaringan sebaiknya dimasukkan ke dalam refrigerator
dengan suhu 4 ºC agar konsistensinya lebih padat sehingga pemotongan lebih mudah dan hasilnya lebih baik. Jaringan dipotong (trimming) menggunakan mikrotom dengan ketebalan 5 µm, selanjutnya diletakkan dalam penangas air berisi akuades dengan suhu kurang lebih 45 ºC untuk menghilangkan lipatan pada jaringan akibat proses pemotongan. Potongan blok jaringan diangkat menggunakan gelas objek, didiamkan pada suhu ruangan hingga kering, lalu disimpan dalam inkubator dengan suhu kurang lebih 60 ºC. Clearing
menggunakan xylene I dan xylene II masing-masing selama 2 menit, deparafinisasi dengan etanol absolut selama 2 menit, etanol 95% dan 80% masing-masing selama 1 menit, lalu dicuci dengan air selama 1 menit.
Pewarnaan Imunohistokimia
Tipe pewarnaan IHK yang digunakan pada penelitian ini yaitu LSAB (labeled streptavidin biotin). Coating slide yaitu melapisi gelas objek dengan
poly-L-lysine untuk menjaga agar jaringan tetap menempel pada gelas objek selama proses pewarnaan IHK. Pembukaan epitop antigen pada jaringan (antigen retrieval) dengan merendam sediaan dalam PBS selama 30 menit pada suhu 95 ºC, didinginkan hingga mencapai suhu 37 ºC, lalu dicuci dengan PBS sebanyak 3 kali masing-masing selama 5 menit. Blocking endogenous peroxidase yaitu penutupan enzim endogenous peroxidase untuk mencegah timbulnya warna yang tidak spesifik pada saat pewarnaan. Blocking endogenous peroxidase dilakukan dengan meneteskan 0.3% H2O2 pada sediaan, didiamkan selama 30 menit pada suhu
ruang, lalu dicuci dengan PBS sebanyak 3 kali masing-masing selama 5 menit.
Blocking normal serum yaitu penutupan serum normal jaringan agar serum normal tidak mengikat warna yang dapat mengganggu interpretasi hasil pewarnaan IHK. Blocking normal serum dilakukan dengan meneteskan FBS 1% pada sediaan, didiamkan selama 30 menit pada suhu ruang, lalu dicuci dengan PBS sebanyak 3 kali masing-masing selama 5 menit. Antibodi primer (antibodi poliklonal rabbit anti-Coxiella burnetii FKH IPB) diinkubasikan selama 1 malam pada suhu 4 ºC, kemudian dicuci dengan PBS sebanyak 3 kali masing-masing selama 5 menit.
Inkubasi biotin dan streptavidin dilakukan masing-masing selama 30 menit pada suhu ruang, kemudian dicuci dengan PBS sebanyak 3 kali masing-masing selama 5 menit. Pewarnaan dengan DAB kromogen dilakukan selama kurang lebih 15 detik, lalu sediaan direndam dalam akuades selama 5 menit. Counterstain
dengan pewarna Mayer Hematoksilin dilakukan selama 1 menit (kurang lebih 10 celupan) kemudian sediaan direndam pada akuades. Counterstain akan memberikan warna biru pada inti sel sehingga akan kontras dengan warna antigen yang dimunculkan oleh kromogen.
Sediaan didehidrasi dengan etanol 70%, 80%, 96%, etanol absolut I, absolut II, dan absolut III masing-masing selama 2 menit. Clearing dengan xylene I,
xylene II, dan xylene III masing-masing selama 2 menit. Mounting atau covering
6
mounting medium pada sediaan kemudian ditutup dengan gelas penutup. Sediaan diamati menggunakan mikroskop cahaya.
Pewarnaan Hematoksilin dan Eosin
Proses pewarnaan umum Hematoksilin dan Eosin (HE) dimulai dengan memasukkan sediaan ke dalam pewarna Mayer Hematoksilin selama 8 menit, kemudian dicuci dengan air selama 30 detik. Sediaan dimasukkan ke dalam Litium Karbonat selama 15 sampai 30 detik kemudian dicuci dengan air selama 2 menit. Setelah itu sediaan dimasukkan ke dalam pewarna Eosin selama 2 sampai 3 menit, kemudian dicuci lagi dengan air selama 30 sampai 60 detik.
Sediaan didehidrasi dengan etanol 70%, 80%, 96%, etanol absolut I, absolut II, dan absolut III masing-masing selama 2 menit. Clearing dengan xylene I,
xylene II, dan xylene III masing-masing selama 2 menit. Mounting atau covering
yaitu pemasangan gelas penutup pada gelas objek, dilakukan dengan meneteskan
mounting medium pada sediaan kemudian ditutup dengan gelas penutup. Sediaan diamati menggunakan mikroskop cahaya.
HASIL DAN PEMBAHASAN
Pengamatan Sediaan Imunohistokimia
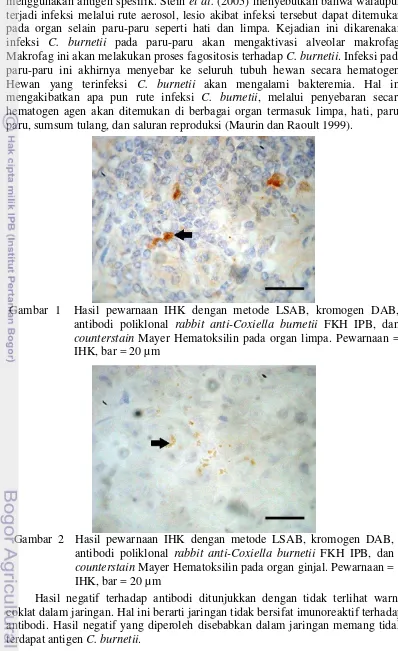
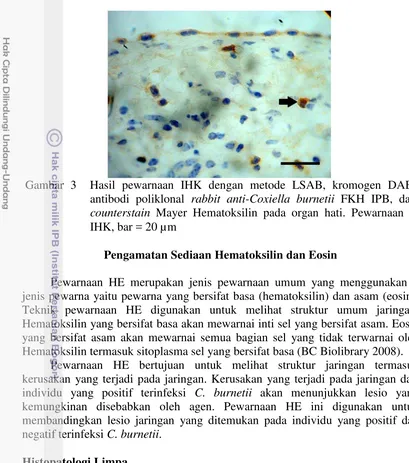
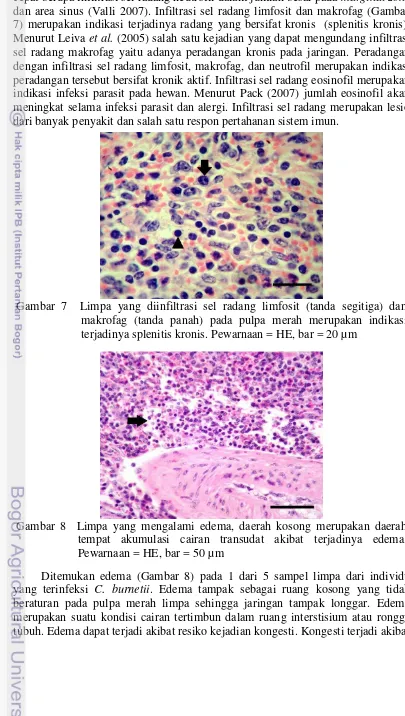
Sediaan diwarnai dengan pewarnaan IHK untuk mendeteksi adanya individu yang positif terinfeksi C. burnetii. Hasil positif dintunjukkan pada 5 dari 50 sampel yang menunjukkan hasil positif. Hasil positif ditemukan pada 2 sampel limpa, 2 sampel ginjal, dan 1 sampel hati. Hasil positif berarti jaringan bersifat imunoreaktif terhadap antibodi yang digunakan dan ditunjukkan dengan adanya warna coklat dalam jaringan.
Pada infeksi akut, C. burnetii dapat ditemukan pada darah, jantung, limpa, dan hati (Angelakis dan Raoult 2010). Menurut Maurin dan Raoult (1999), makrofag merupakan target sel bakteri C. burnetii. Makrofag merupakan sel radang yang memiliki fungsi fagositosis. C. burneti masuk ke dalam sel makrofag Tabel 1 Hasil pengamatan sediaan dengan pewarnaan IHK menggunakan antibodi
poliklonal rabbit anti-Coxiella burnetii FKH IPB
Organ Infeksi Coxiella burnetii
a)Jumlah sediaan yang bersifat imunoreaktif terhadap antibodi poliklonal rabbit anti-Coxiella
burnetii FKH IPB
b)Jumlah sediaan yang bersifat non imunoreaktif terhadap antibodi poliklonal rabbit anti-Coxiella
7 menggunakan antigen spesifik. Stein et al. (2005) menyebutkan bahwa walaupun terjadi infeksi melalui rute aerosol, lesio akibat infeksi tersebut dapat ditemukan pada organ selain paru-paru seperti hati dan limpa. Kejadian ini dikarenakan infeksi C. burnetii pada paru-paru akan mengaktivasi alveolar makrofag. Makrofag ini akan melakukan proses fagositosis terhadap C. burnetii. Infeksi pada paru-paru ini akhirnya menyebar ke seluruh tubuh hewan secara hematogen. Hewan yang terinfeksi C. burnetii akan mengalami bakteremia. Hal ini mengakibatkan apa pun rute infeksi C. burnetii, melalui penyebaran secara hematogen agen akan ditemukan di berbagai organ termasuk limpa, hati, paru-paru, sumsum tulang, dan saluran reproduksi (Maurin dan Raoult 1999).
Hasil negatif terhadap antibodi ditunjukkan dengan tidak terlihat warna coklat dalam jaringan. Hal ini berarti jaringan tidak bersifat imunoreaktif terhadap antibodi. Hasil negatif yang diperoleh disebabkan dalam jaringan memang tidak terdapat antigen C. burnetii.
Gambar 2 Hasil pewarnaan IHK dengan metode LSAB, kromogen DAB, antibodi poliklonal rabbit anti-Coxiella burnetii FKH IPB, dan
counterstain Mayer Hematoksilin pada organ ginjal. Pewarnaan = IHK, bar = 20 µm
Gambar 1 Hasil pewarnaan IHK dengan metode LSAB, kromogen DAB, antibodi poliklonal rabbit anti-Coxiella burnetii FKH IPB, dan
8
Pengamatan Sediaan Hematoksilin dan Eosin
Pewarnaan HE merupakan jenis pewarnaan umum yang menggunakan 2 jenis pewarna yaitu pewarna yang bersifat basa (hematoksilin) dan asam (eosin). Teknik pewarnaan HE digunakan untuk melihat struktur umum jaringan. Hematoksilin yang bersifat basa akan mewarnai inti sel yang bersifat asam. Eosin yang bersifat asam akan mewarnai semua bagian sel yang tidak terwarnai oleh Hematoksilin termasuk sitoplasma sel yang bersifat basa (BC Biolibrary 2008).
Pewarnaan HE bertujuan untuk melihat struktur jaringan termasuk kerusakan yang terjadi pada jaringan. Kerusakan yang terjadi pada jaringan dari individu yang positif terinfeksi C. burnetii akan menunjukkan lesio yang kemungkinan disebabkan oleh agen. Pewarnaan HE ini digunakan untuk membandingkan lesio jaringan yang ditemukan pada individu yang positif dan negatif terinfeksi C. burnetii.
Histopatologi Limpa
Sebanyak 5 sampel limpa dari individu positif terhadap infeksi C. burnetii
diamati secara mikroskopis. Hasil pengamatan terhadap sediaan HE limpa yang dinyatakan positif terinfeksi agen C. burnetii menunjukkan beberapa lesio. Sampel limpa positif menunjukkan lesio berupa akumulasi pigmen hemosiderin, deplesi folikel limfoid (pulpa putih), infiltrasi sel radang limfosit, makrofag, neutrofil, dan eosinofil, serta edema.
Akumulasi pigmen hemosiderin ditemukan pada 1 dari 5 sampel limpa yang positif terinfeksi C. burnetii. Akumulasi pigmen hemosiderin terlihat pada pulpa merah dan pulpa putih limpa (Gambar 4). Menurut Valli (2007), akumulasi pigmen hemosiderin pada pulpa merah terjadi pada bingkai limpa, sedangkan pada pulpa putih terjadi pada zona marginal dan folikel. Hemosiderin merupakan bentuk penyimpanan besi (Fe). Salah satu fungsi limpa yaitu mengeliminasi sel darah merah yang sudah tua, sehingga ditemukannya sedikit hemosiderin pada limpa merupakan hal yang normal. Apabila ditemukan pigmen hemosiderin dalam Gambar 3 Hasil pewarnaan IHK dengan metode LSAB, kromogen DAB,
antibodi poliklonal rabbit anti-Coxiella burnetii FKH IPB, dan
9
jumlah besar, maka kejadian tersebut merupakan indikasi kondisi patologis. Pigmen hemosiderin seringkali terakumulasi dalam makrofag sehingga disebut
hemosiderin-containing macrophages atau hemosiderofag. Kejadian ini dapat berasosiasi dengan kejadian hemoragi dan kongesti (Suttie 2006). C. burnetii
dapat ditemukan di pembuluh darah dan berpotensi mengakibatkan arterial emboli. Emboli dapat mengakibatkan kongesti hingga hemoragi dan tidak hanya ditemukan pada limpa tetapi juga pada organ lain seperti ginjal dan otak (Maurin dan Raoult 1999).
Deplesi folikel limfoid ditemukan pada 4 dari 5 sampel limpa yang positif terinfeksi C. burnetii. Deplesi folikel limfoid (Gambar 5) dapat diketahui dengan melihat kerapatan sel pada pulpa putih. Pulpa putih yang mengalami deplesi memiliki folikel dengan kerapatan sel yang lebih rendah dibanding folikel normal. Menurut Suttie (2006) deplesi folikel limfoid menunjukkan ciri berupa kondensasi atau penggumpalan kromatin (piknosis), karyoreksis, dan karyolisis nukleus limfosit serta adanya peningkatan jumlah makrofag pada daerah PALS dan folikel.
Gambar 4 Limpa dengan akumulasi pigmen hemosiderin, pigmen hemosiderin (tanda panah) terakumulasi pada pulpa merah dan marginal zone. Pewarnaan = HE, bar = 20 µm
Tabel 2 Hasil pengamatan lesio pada sediaan histopatologi limpa yang positif dan negatif terhadap infeksi Coxiella burnetii
Lesio Infeksi Coxiella burnetii
a)Jumlah lesio yang terdapat pada sediaan histopatologi limpa yang positif terinfeksi Coxiella
burnetii
b)Jumlah lesio yang terdapat pada sediaan histopatologi limpa yang negatif terinfeksi Coxiella
10
Deplesi folikel limfoid terjadi karena sel-sel limfoid mengalami sitolisis. Valli (2007) menyebutkan bahwa pada saat terjadi bakteremia, limpa akan membesar, mengalami kongesti akut, dan terjadi degenerasi folikel limfoid. C. burnetii
merupakan salah satu agen mikrobiologi yang dapat mengakibatkan terjadinya deplesi pada folikel limfoid. Peningkatan jumlah makrofag dalam folikel merupakan respon tubuh terhadap kejadian inflamasi.
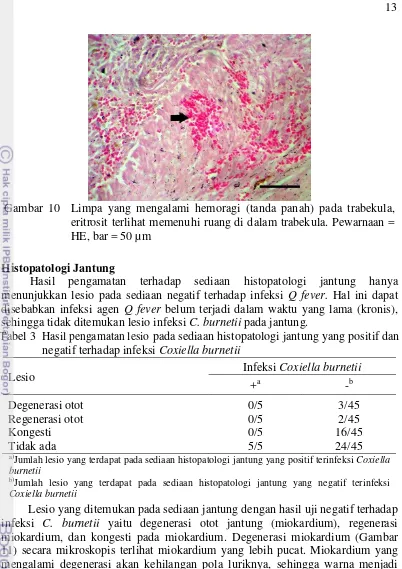
Pada limpa yang positif terinfeksi Coxiella burnetii ditemukan 2 dari 5 sampel diinfiltrasi oleh sel radang limfosit dan makrofag, 1 dari 5 sampel diinfiltrasi sel radang eosinofil, dan semua sampel diinfiltrasi sel radang neutrofil. Sel radang menginfiltrasi limpa pada pulpa merah dan pulpa putih. Apabila terdapat sel radang neutrofil (Gambar 6) pada limpa, maka limpa diindikasikan mengalami peradangan yang bersifat akut (splenitis akut) dan atau adanya infeksi bakterial. Infeksi bakterial yang terjadi disebabkan oleh bakteri C. burnetii. Radang yang bersifat sistemik akan memicu limpa untuk memberikan respon peradangan. Pada saat terjadi septisemia, limpa akan memberikan respon dengan
Gambar 6 Limpa yang diinfiltrasi sel radang neutrofil (tanda panah) dan eosinofil (tanda segitiga) pada pulpa merah merupakan indikasi terjadinya splenitis akut disertai infeksi parasit. Pewarnaan = HE, bar = 20 µm
11 cepat berupa infiltrasi sel radang neutrofil dalam jumlah besar pada marginal zone
dan area sinus (Valli 2007). Infiltrasi sel radang limfosit dan makrofag (Gambar 7) merupakan indikasi terjadinya radang yang bersifat kronis (splenitis kronis). Menurut Leiva et al. (2005) salah satu kejadian yang dapat mengundang infiltrasi sel radang makrofag yaitu adanya peradangan kronis pada jaringan. Peradangan dengan infiltrasi sel radang limfosit, makrofag, dan neutrofil merupakan indikasi peradangan tersebut bersifat kronik aktif. Infiltrasi sel radang eosinofil merupakan indikasi infeksi parasit pada hewan. Menurut Pack (2007) jumlah eosinofil akan meningkat selama infeksi parasit dan alergi. Infiltrasi sel radang merupakan lesio dari banyak penyakit dan salah satu respon pertahanan sistem imun.
Ditemukan edema (Gambar 8) pada 1 dari 5 sampel limpa dari individu yang terinfeksi C. burnetii. Edema tampak sebagai ruang kosong yang tidak beraturan pada pulpa merah limpa sehingga jaringan tampak longgar. Edema merupakan suatu kondisi cairan tertimbun dalam ruang interstisium atau rongga tubuh. Edema dapat terjadi akibat resiko kejadian kongesti. Kongesti terjadi akibat Gambar 8 Limpa yang mengalami edema, daerah kosong merupakan daerah
tempat akumulasi cairan transudat akibat terjadinya edema. Pewarnaan = HE, bar = 50 µm
12
gangguan sirkulasi porta dan sistemik, serta respon tubuh terhadap anemia hemolitik akut (Valli 2007).
Sediaan limpa yang bereaksi negatif terhadap antibodi memperlihatkan lesio yang sama dengan lesio pada sediaan yang positif disertai dengan hemoragi. Lesio yang ditemukan dapat diakibatkan oleh berbagai faktor. Akumulasi pigmen hemosiderin sering berkaitan dengan kejadian hemoragi dan kongesti. Menurut Valli (2007) hemosiderin akan ditemukan dalam jumlah besar pada kondisi anemia. Peningkatan akumulasi hemosiderin merupakan salah satu perubahan yang terjadi pada limpa hewan yang mengalami anemia hemolitik. Kongesti yang terjadi dalam waktu lama akan menyebabkan edema pada jaringan. Deplesi pulpa putih dapat terjadi akibat infeksi agen asing atau pengaruh bahan kimiawi. Deplesi pulpa putih merupakan salah satu penyebab infiltrasi sel radang pada limpa. Sebagian besar infiltrasi sel radang ini didominasi neutrofil sebagai respon terjadinya radang akut. Menurut Gough (2007) infiltrasi sel radang neutrofil juga dapat terjadi akibat kejadian nekrosa jaringan, akumulasi toksin, infeksi bakteri lain, fungi, protozoa, dan virus. Terdapat beberapa kejadian yang dapat mengundang infiltrasi sel radang makrofag pada jaringan yaitu peradangan kronis, infeksi virus, fungi, dan parasit. Peningkatan jumlah infiltrasi sel radang limfosit pada jaringan dapat terjadi pada kondisi fisiologis seperti post vaksinasi dan stress, serta pada kondisi patologis seperti peradangan kronis dan adanya neoplasia.
Lesio hemoragi ditemukan di sekitar pembuluh darah (perivaskular) pulpa merah (Gambar 9) dan daerah trabekula (Gambar 10). Hemoragi perivaskular berupa keluarnya darah dari pembuluh darah (ekstravasasi) akibat kerusakan dinding pembuluh darah. Kerusakan ini dapat terjadi akibat trauma, infeksi agen patogen lain, kelemahan dinding pembuluh darah atau bahan toksik. Eritrosit ditemukan di dalam trabekula limpa.
Lesio yang ditemukan pada limpa dari individu positif terinfeksi C. burnetii
juga ditemukan pada limpa dari individu yang tidak terinfeksi C. burnetii. Lesio-lesio yang ditemukan merupakan Lesio-lesio histopatologi umum limpa. Hal ini berarti lesio tersebut tidak patognomonis terhadap infeksi C. burnetii.
13
Histopatologi Jantung
Hasil pengamatan terhadap sediaan histopatologi jantung hanya menunjukkan lesio pada sediaan negatif terhadap infeksi Q fever. Hal ini dapat disebabkan infeksi agen Q fever belum terjadi dalam waktu yang lama (kronis), sehingga tidak ditemukan lesio infeksi C. burnetii pada jantung.
Lesio yang ditemukan pada sediaan jantung dengan hasil uji negatif terhadap infeksi C. burnetii yaitu degenerasi otot jantung (miokardium), regenerasi miokardium, dan kongesti pada miokardium. Degenerasi miokardium (Gambar 11) secara mikroskopis terlihat miokardium yang lebih pucat. Miokardium yang mengalami degenerasi akan kehilangan pola luriknya, sehingga warna menjadi pucat. Menururt Maxie dan Robinson (2007) degerasi miokardium dapat disebabkan oleh defisiensi vitamin E dan atau unsur selenium (Se). Defisiensi terjadi kemungkinan hewan diberikan diet yang rendah kandungan vitamin E dan unsur Se. Reaksi terhadap kerusakan atau gangguan pada miokardium sering dalam bentuk degenerasi, nekrosa, peradangan, dan penyembuhan langsung. Degenerasi miokardium merupakan respon dari berbagai penyebab yang nospesifik seperti anemia dan toksemia (Maxie dan Robinson 2007).
Tabel 3 Hasil pengamatan lesio pada sediaan histopatologi jantung yang positif dan negatif terhadap infeksi Coxiella burnetii
a)Jumlah lesio yang terdapat pada sediaan histopatologi jantung yang positif terinfeksi Coxiella
burnetii
b)Jumlah lesio yang terdapat pada sediaan histopatologi jantung yang negatif terinfeksi
Coxiella burnetii
14
Regenerasi miokardium (Gambar 12) merupakan proses perbaikan terhadap miokardium. Proses regenerasi miokardium dapat diketahui dengan melihat susunan inti sel miokardium. Pada miokardium yang mengalami regenerasi, inti sel terlihat lebih besar dan berjejer membentuk garis. Leri et al. (2005) menyatakan bahwa regenerasi merupakan salah satu cara untuk menjaga homeostasis miokardium.
Kongesti pada miokardium (Gambar 13) merupakan kondisi darah yang tergenang di kapiler atau vena akibat lambatnya aliran darah. Kongesti disebut sebagai heperemia pasif. Pada jantung yang mengalami kongesti, terjadi dilatasi kapiler jantung sehingga akan penuh dengan sel darah merah. Menurut Valli (2007) kongesti terjadi akibat gangguan sirkulasi porta dan sirkulasi sistemik. Kongesti yang ditemukan pada sediaan jantung berupa kongesti ringan. Tidak begitu banyak bagian jantung yang kapilernya yang terisi sel darah merah.
Lesio yang ditemukan pada sediaan histopatologi jantung berupa degenerasi miokardium, regenerasi miokardium, dan kongesti ringan. Tidak ditemukan lesio pada sediaan histopatologi jantung yang positif terinfeksi C. burnetii, sehingga tidak dapat dilakukan perbandingan terhadap lesio yang ditimbulkan agen Q fever
pada sediaan histopatologi jantung.
Gambar 12 Jantung yang mengalami regenerasi (tanda panah) miokardium, inti sel miokardium terlihat lebih besar dan berderet membentuk garis. Pewarnaan = HE, bar = 50 µm
15
SIMPULAN DAN SARAN
Simpulan
Berdasarkan gambaran histopatologi hasil pewarnaan IHK, ditemukan 5 dari 50 sampel positif terinfeksi C. burnetii. Hasil pengamatan lesio pada limpa dan jantung dengan pewarnaan HE tidak menunjukkan lesio yang spesifik atau patognomonis terhadap infeksi C. burnetii pada sapi di RPH Terpadu Kota Bogor. Lesio yang ditemukan pada sediaan histopatologi limpa yang positif terinfeksi C. burnetii berupa akumulasi pigmen hemosiderin, deplesi pulpa putih, edema, dan infiltrasi sel radang. Tidak ditemukan lesio pada sediaan histopatologi jantung yang positif terinfeksi C. burnetii.
Saran
Perlu dilakukan penelitian Q fever lebih lanjut dikaitkan dengan daerah asal serta jenis sapi yang dipotong di RPH Terpadu Kota Bogor. Hal ini perlu dan penting untuk mengetahui penyebaran Q fever, sehingga dapat disusun program pencehagan dan pengendalian Q fever dengan baik.
DAFTAR PUSTAKA
Acha PH, Szyfres B. 2003. Zoonosis and Communicable Disease Common to Man and Animals, Vol II. Chlamidioses, Rickettsioses and Viroses. Ed ke-3. Washington (US): World Health Organization.
Angelakis E, Raoult D. 2010. Review Q Fever. J Vet Microbiol. 140:297-309. Gambar 13 Jantung yang mengalami kongesti (tanda panah), eritrosit terlihat
16
[BC Biolibrary] The British Columbia Biolibrary. 2008. Hematoxylin and eosin staining of tissue sections [internet]. [diunduh 2013 Juli 7]. Tersedia pada: http://www.bcbiolibrary.icapture.ubc.ca/pathologists-researchers/docs/BL.LAB. GN.006.01
[CDC] Center for Disease Control and Prevention. 2013. Q fever [internet]. [diunduh 2013 Juli 7]. Tersedia pada: http://www.cdc.gov/qfever/symptoms/ index.html
Cesta MF. 2006. Normal structure, function, and histology of the spleen. Toxicol Pathol. 34:455-465.
Fournier PE, Marrie TJ, Raoult D. 1998. Diagnosa of Q fever. J Clin Microbiol.
36(7):1823-1834.
Gough A. 2007. Differential Diagnosis in Small Animal Medicine. Oxford (GB): Blackwell Publishing.
[Kementan RI] Kementerian Pertanian Republik Indonesia. 2013. Keputusan Menteri Pertanian tentang penetapan jenis penyakit hewan menular strategis nomor 4026/Kpts./OT.140/3/2013. Indonesia (ID): Kementerian Pertanian Republik Indonesia.
Key M. 2009. Immunohistochemistry Staining Methods. In: Education Guide Immunohistochemical Staining Methods. Ed ke-5. Kumar GL dan Rudbeck L, editor. California (US): Dako North America.
Krieken JHJM, Orazi A. 2007. Spleen. In: Histopathology for Pathologist. Ed ke-3. Philadelphia (US): Williams & Wilkins.
Leiva M, Lloret A, Pena T, Roura X. 2005. Therapy of ocular and visceral leishmaniasis in a cat. Vet Ophthalmol. 8:71–75.
Leri A, Kajstura J, Anversa P. 2005. Cardiac stem cells and mechanisms of myocardial regeneration. Physiol Rev. 85:1373-1416.
Marrie TJ. 2003. Coxiella burnetii pneumonia. J Eur Resp. 21:713-719. Maurin M, Raoult D. 1999. Q fever. Clin Microbiol Rev. 12:518-553.
Maxie MG, Robinson WF. 2007. Cardiovascular System. In: Pathology of Domestic Animals. Ed ke-5. Maxie MG, editor. Philadelphia (US): Saunders Elsevier.
[OIE] Office International des Epizootics. 2010. Q fever [internet]. [diunduh 2013 Juli 7]. Tersedia pada: http://www.oie.int/fileadmin/Home/eng/Health_ standards/tahm/2.01.12_Q-FEVER.pdf
Pack PE. 2007. Anatomi dan Fisiologi. Wibisono TD, Setio H, Rudiyanto, Waluyo B, Sarjoko D, Arghisa A, Herawati N, Tyas VP, Wulandari, editor. Bandung (ID): Pakar Raya. Terjemahan dari: Anatomy and Physiology.
Porter SR, Czaplicki G, Mainil J, Guattéo R, Saegerman C. 2011. Q fever: current state of knowledge and perspectives of research of neglected zoonosis. Int J Microbiol [internet]. [diunduh 2013 September 29]. Tersedia pada: www.hindawi/com/journals/ijmb/2011/248411/.
Rasmana ID. 2008. Q-fever: suatu tinjauan perkembangan teknik diagnostik dan permasalahannya [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Ross MH, Pawlina W. 2011. Histology: A Text and Atlas. Ed ke-6. Philadephia (US): Williams & Wilkins.
17 Stein A, Luoveau C, Lepidi H, Ricci F, Baylac P, Davoust B, Raoult D. 2005. Q fever pneumonia: Virulence of Coxiella burnetii Pathovars in a Murine Model of Aerosol Infection. Infect Immun. 73(4):2469-2477.
Subangkit M. 2012. Kajian diagnostik patologi marek’s menggunakan metode imunohistokimia [tesis]. Bogor (ID): Institut Pertanian Bogor.
Suttie AW. 2006. Histopathology of the spleen. Toxicol Pathol. 34:466-503. Valli VEO. 2007. Hematopoietic System. In: Pathology of Domestic Animals. Ed
19
RIWAYAT HIDUP
Penulis lahir pada tanggal 10 Agustus 1991 di Kota Makassar, Sulawesi Selatan. Penulis merupakan putri pertama dari 4 bersaudara pasangan Syahruddin S dan Humaerah. Pada tahun 2009, penulis terdaftar sebagai mahasiswa program studi Kedokteran Hewan, Fakultas Kedokteran Hewan, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB. Pendidikan formal yang pernah ditempuh penulis sebelumnya yaitu SD Negeri 2 Unggulan Maros pada tahun 1997, SMP Negeri 2 Maros pada tahun 2003, dan SMA Negeri 1 Maros pada tahun 2006.
Selama masa perkuliahan, penulis aktif menjadi asisten praktikum dalam beberapa mata kuliah yang diselenggarakan di FKH IPB. Penulis pernah menjadi asisten praktikum pada mata kuliah Histologi Veteriner II pada tahun ajaran 2011/2012, Patologi Sistemik II pada tahun ajaran 2013/2014, dan Pengelolaan Kesehatan Hewan dan Lingkungan pada tahun ajaran 2013/2014. Penulis juga aktif dalam berbagai lembaga kemahasiswaan. Beberapa lembaga kemahasiswaan yang pernah diikuti penulis yaitu paduan suara Gita Klinika FKH IPB, kepala divisi Event Organizer STERIL FKH IPB, bendahara Himpunan Minat dan Profesi (HIMPRO) Satwaliar FKH IPB, dan staf divisi Komunikasi dan Informasi (Kominfo) Ikatan Mahasiswa Kedokteran Hewan Indonesia (IMAKAHI) cabang FKH IPB.