EFEK DAUN BINAHONG (Anredera cordifolia (Ten) Steenis)) YANG DIEKSTRAKSI ETANOL 70% TERHADAP AKTIVITAS ALT TIKUS
PUTIH (Rattus norvegicus) JANTAN GALUR Sprague dawley YANG DIINDUKSI ETANOL 50%
Oleh
RAMAYANG NASTITI ESTOWO
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA KEDOKTERAN
Pada
Jurusan Pendidikan Dokter Umum Fakultas Kedokteran Universitas Lampung
FAKULTAS KEDOKTERAN UNIVERSITAS LAMPUNG
ABSTRAK
EFEK DAUN BINAHONG (Anredera cordifolia (Ten) Steenis)) YANG DIEKSTRAKSI ETANOL 70% TERHADAP AKTIVITAS ALT TIKUS
PUTIH (Rattus norvegicus) JANTAN GALUR Sprague dawley YANG DIINDUKSI ETANOL 50%
Oleh
RAMAYANG NASTITI ESTOWO
Hati merupakan organ yang dapat memetabolisme etanol. Hal ini menyebabkan peningkatan produksi radikal bebas yang akan merusak jaringan hati. Gangguan jaringan hati ditandai dengan peningkatan aktivitas ALT. Untuk itu dilakukan pemberian ekstrak daun binahong (Anredera cordifolia) terhadap ALT tikus putih yang diinduksi etanol.
tidak dapat mencegah kenaikan enzim ALT, tetapi dosis 100 mg/kgBB dan 200 mg/kgBB dapat mencegah kenaikan enzim ALT.
ABSTRACT
THE EFFECT OF BINAHONG LEAVES EXTRACTION (Anredera cordifolia (Ten) Steenis)) IN 70% ETHANOL TOWARD ALT ACTIVITIES OF MALE
RAT (Rattus norvegicus) OF Sprague dawley WHICH HAS INDUCED BY ETHANOL 50%
By
RAMAYANG NASTITI ESTOWO
Liver is a body part for which metabolizes ethanol. This influences the raise of free– radical productions that effect to dysfunction liver tissues. The dysfunction itself is indicated by raise of ALT activities which, by that reason, necessarily to research on taking extraction of binahong leaves (Anredera cordifolia) toward rat’s ALT which has been induced by ethanol.
leave extraction dosed at 50 mg/kgbw will not suspend the raise of ALT enzyme, otherwise dosed at 100 mg/kgbw and 200 mg/kgbw will prevent the raise of ALT enzyme.
iv
DAFTAR TABEL
Tabel Halaman
1. Definisi operasional 40
2. Hasil Pemeriksaan Aktivitas Enzim ALT (U/L) 43 3. Pasangan Ukuran Pemusatan dan Penyebaran Hasil Pemeriksaan
Aktivitas Enzim ALT 44
v
DAFTAR GAMBAR
Gambar Halaman
1. Kerangka Teori 6
2. Kerangka Konsep 7
3. Gambaran Makroskopik Hati Manusia dari Anterior 9
4. Metabolisme Alkohol 19
5. Tanaman Binahong (Anredera cordifolia) 23
DAFTAR TABEL
Tabel Halaman
1. Definisi operasional 40
2. Hasil Pemeriksaan Aktivitas Enzim ALT (U/L) 43 3. Pasangan Ukuran Pemusatan dan Penyebaran Hasil Pemeriksaan
Aktivitas Enzim ALT 44
I. PENDAHULAN
A. Latar Belakang
Hati merupakan organ yang mempunyai kemampuan tinggi untuk mengikat, memetabolisme dan mengekskresi zat kimia. Hati juga mendetoksifikasi zat kimia yang tidak berguna/merugikan tubuh termasuk alkohol/etanol (Hernawati, 2010).
Konsumsi alkohol kronis menimbulkan berbagai efek samping. Namun, dampak terbesarnya adalah tiga bentuk penyakit hati yang tersendiri yaitu steatosis hati (perlemakan hati), hepatitis alkoholik dan sirosis, yang secara bersama–sama disebut sebagai penyakit hati alkoholik. Paling sedikit 80% dari para peminum berat mengalami perlemakan hati (steatosis), 10% hingga 35% mengalami hepatitis alkoholik dan sekitar 10% terjangkit sirosis. Karena dua keadaan pertama dapat terbentuk secera independen, keduanya tidak mencerminkan suatu kontinum kelainan (Robbins dkk, 2007).
etanol dengan H2O2 dan radikal reaktif spesies yang lain akan menghasilkan radikal hidroksietil yang merupakan oksidan kuat (Hernawati, 2010). Pada konsentrasi tinggi, radikal bebas dan bahan sejenisnya berbahaya bagi mahluk hidup dan merusak semua bagian pokok sel. Radikal bebas juga mengganggu produksi normal DNA dan merusak lipid pada membran sel (Arief, 2007).
Karena itu, hati rentan terhadap berbagai gangguan metabolik, toksik, mikroba dan sirkulasi. Jika penyakit meluas atau terjadi gangguan sirkulasi darah atau aliran empedu, gangguan fungsi hati dapat mengancam nyawa (Robbins dkk, 2007). Kerusakan sel hati secara klinis baru dapat diketahui jika sudah lanjut. Kerusakan pada sel hati yang sedang berlangsung dapat diketahui dengan mengukur parameter fungsi hati berupa zat dalam peredaran darah yang dibentuk akibat sel hati yang rusak. Parameter enzim hati menjadi petunjuk dini dan lokal penyakit hati (Widmann & Frances, 1995).
Gangguan hati ditandai dengan peningkatan aktivitas serum transaminase berupa ALT (alanine aminotransferase), AST (aspartate aminotransferase), laktat dehidrogenase serta bilirubin serum (Wilmana, 1995). Peningkatan aktivitas ALT dalam serum menjadi petunjuk yang lebih sensitif ke arah kerusakan hati karena sedikit kondisi selain hati yang berpengaruh pada kadar ALT dalam serum (Widmann & Frances, 1995).
3
Steenis). Tanaman binahong mulai menjadi tanaman yang serius diteliti di Australia, Afrika Selatan, Hawai, New Zeland dan negara pasifik lainnya (Cagnotti et al., 2007). Hal ini disebabkan karena tanaman binahong memiliki kandungan metabolit sekunder yang terdapat pada daun binahong, yaitu flavonoid, alkaloid, tanin, steroid, triterpenoid, saponin dan minyak atsiri (Rochani, 2009).
Menurut penelitian Selawa dkk tahun 2013, pada sampel segar daun binahong mengandung konsentrasi antioksidan sebanyak 4,2 mmol/ 100 gr. Sampel kering binahong mengadung konsentrasi antioksidan sebesar 3,68 mmol/ 100 gr. Berdasarkan penelitian Djamil et al. tahun 2012, menunjukan bahwa kandungan antioksidan tumbuhan binahong paling banyak terdapat pada ekstrak metanol daunnya yang bisa dilihat dari kadar IC–50 nya.
Menurut penelitian Sukandar dkk tahun 2011, ekstrak metanol daun binahong menunjukkan efek anti inflamasi, antioksidan dan memiliki aktivitas hepatoprotektor. Hal ini diperkuat oleh penelitian Orbayinah & Kartyanto tahun 2008, yang menyatakan bahwa pemberian jus binahong setiap hari terhadap tikus
putih dapat menurunkan efek hepatotoksisitas dari pemberian karbon tetraklorida
pada tikus putih galur Wistar.
norvegicus) galur Sprague dawley yang diinduksi etanol. Parameter yang digunakan sebagai indikator kerusakan sel hati adalah aktivitas enzim ALT.
B. Rumusan Masalah
Apakah ada efek pemberian ekstrak daun binahong (Anredera cordifolia (Ten.) Steenis) yang diekstraksi etanol 70% terhadap aktivitas enzim ALT tikus putih jantan (Rattus norvegicus) galur Sprague dawley yang diinduksi etanol 50%?
C. Tujuan Penelitian
1. Tujuan Umum
5
2. Tujuan Khusus
Untuk mengetahui efek pemberian ekstrak daun binahong (Anredera cordifolia (Ten.) Steenis) yang diekstraksi etanol 70% dengan peningkatan dosis 50, 100 dan 200 mg/kgBB terhadap aktivitas enzim ALT tikus putih jantan (Rattus norvegicus) galur Sprague dawley yang diinduksi etanol 50%?
D. Manfaat Penelitian
1. Bagi Peneliti
Dapat menambah pengalaman dan pengetahuan tentang manfaat daun binahong untuk mencegah kerusakan pada hati yang diakibatkan oleh etanol. 2. Bagi Ilmu Pengetahuan
Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah mengenai efek ekstrak daun binahong terhadap hati.
3. Bagi Peneliti Lain
a. Dapat dijadikan bahan ajuan untuk dilakukannya penelitian yang serupa yang berkaitan dengan efek daun binahong.
E. Kerangka Pemikiran
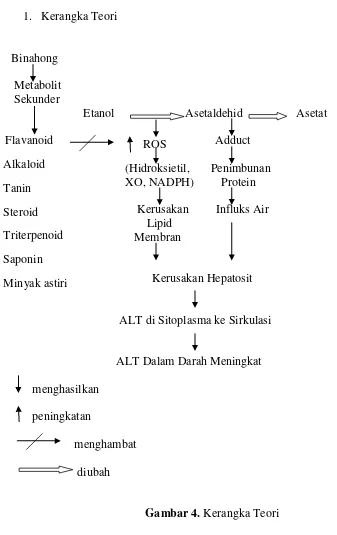
1. Kerangka Teori
Binahong
Metabolit Sekunder
Etanol Asetaldehid Asetat
Flavanoid Adduct
(Hidroksietil, Penimbunan XO, NADPH) Protein Kerusakan Influks Air
Lipid Membran
Kerusakan Hepatosit
ALT di Sitoplasma ke Sirkulasi
[image:15.612.108.445.119.654.2]ALT Dalam Darah Meningkat menghasilkan peningkatan menghambat diubah
7
2. Kerangka Konsep
Binahong
Metabolit Sekunder
Etanol Asetaldehid
Flavanoid
(Hidroksietil, XO, NADPH) Kerusakan
Lipid Membran
Kerusakan Hepatosit
ALT di Sitoplasma ke Sirkulasi
ALT Dalam Darah Meningkat menghasilkan
peningkatan
menghambat
[image:16.612.136.392.112.620.2]diubah
F. Hipotesis
II. TINJUAN PUSTAKA
A. Hati
1. Anatomi Hati
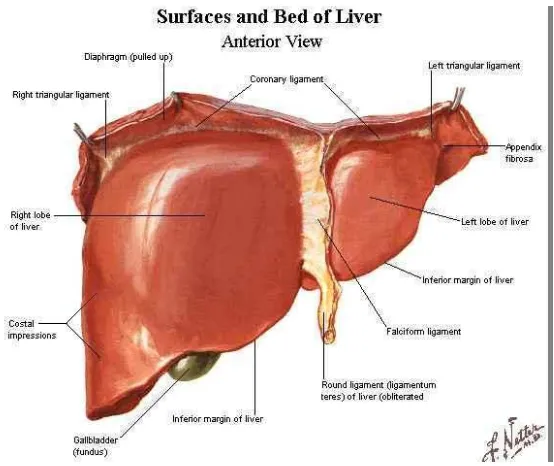
[image:18.612.199.476.372.605.2]Hati merupakan organ terbesar kedua dan kelenjar terbesar di dalam tubuh. Organ ini memiliki berat sekitar 1,5 kg dan terletak di rongga abdomen, di bawah diafragma (Junqueira & Carneiro, 2007).
2. Fisiologi Hati
Hati mempunyai beberapa fungsi yaitu: a. Fungsi Pembentukan dan Eksresi Empedu
Hati mengekskresikan empedu sebanyak satu liter per hari ke dalam usus halus. Unsur utama empedu adalah air 97%, elektrolit dan garam empedu (Kujovich, 2005).
b. Fungsi Metabolik
Fungsinya terdapat dalam metabolisme karbohidrat, lemak dan protein (Kujovich, 2005).
c. Fungsi Pertahanan Tubuh
Hati sebagai fagositosis dan imunitas, yang berperan dalam hal ini sel–sel Kupffer, merupakan saringan penting bagi bakteri dan bahan–bahan asing melalui proses fagositosis (Kujovich, 2005).
d. Fungsi Detoksifikasi
11
e. Fungsi Vaskular
Fungsi hati sebagai hemodinamik, hati merupakan organ yang penting untuk mempertahankan aliran darah, hati menerima 25% darah dari cardiac output, aliran darah hati yang normal sekitar 1500 cc/menit (Burt & Day, 2002).
3. ALT
Tes fungsi hati merupakan tes yang digunakan sebagai deteksi awal penyakit hati, yang diklasifikasikan menjadi tiga:
- Tes kapasitas hati mengangkut anion organik dan memetabolisme obat. Seperti serum bilirubin, urobilinogen dan lain lain.
- Tes yang mendeteksi kerusakan pada hepatosit (tes enzim serum). Seperti aminotransferase dan lain lain.
- Tes kapasitas biosintesis hati. Seperti, albumin, prealbumin dan lain lain (Thapa & Walia, 2007).
Aminotransferase sering digunakan dan merupakan indikator yang spesifik terhadap nekrosis hepatoseluler (Thapa & Walia, 2007).
enzim dalam sel hati. Jika terjadi kerusakan hati, enzim ALT akan keluar dari sel hati menuju sirkulasi darah. Kadar normal AST darah 5–40 U/L dan kadar normal ALT darah 5–35 U/L (Huang et al., 2006).
ALT terletak di dalam sitoplasma, sedangkan AST terletak di dalam sitoplasma dan mitokondria (Thapa & Walia, 2007). ALT lebih spesifik untuk menilai kerusakan hati (Prihatini dkk, 2005). Aktivitas enzim ALT yang normal pada tikus putih yaitu 17,5–30,2 U/L (Smith & Mangkoewidjojo, 1988).
Kerja enzim ALT:
ALT
Alanin + α ketoglutarate Piruvat + Glutamat (Thapa & Walia, 2007).
B. Radikal Bebas
1. Definisi
Radikal bebas adalah sekelompok bahan kimia baik berupa atom maupun molekul yang memiliki elektron tidak berpasangan (elektron bebas) pada lapisan luarnya (Arief, 2007).
2. Tipe
13
ROS yang paling penting secara biologis antara lain peroxyl radicals (RO2 ·) dan hydrogen peroxide (H2O2) (Tremallen, 2008). Bentuk radikal bebas yang lain adalah hydroperoxylHO2 ·), alkoxyl (RO·), carbonate (CO3 ·–), carbon dioxide (CO2 ·–), atomic chlorine (Cl·) dan nitrogen dioxide (NO2 ·) (Halliwell & Whiteman, 2004).
3. Sumber a. Endogen
- Autooksidasi.
Merupakan produk dari metabolisme aerobik (Arief, 2007). - Oksidasi enzimatik
Beberapa sistem enzim mampu menghasilkan radikal bebas, meliputi xanthine oxidase (terakfifasi saat iskemia), prostaglandin synthase, lipoxygenase, aldehyde oxidase dan aminoacid oxidase (Arief, 2007). - Respiratory burst
Proses sel fagositik menggunakan oksigen jumlah besar selama fagositosis. Lebih kurang 70–90 % penggunaan oksigen tersebut dapat diperhitungkan dalam produksi superoksida (Arief, 2007).
b. Eksogen
- Obat–obatan - Radiasi
4. Cara Kerja
Elektron yang tidak berpasangan dalam senyawa radikal memiliki kecenderungan untuk mencari pasangan. Caranya, menarik atau menyerang elektron dari senyawa lain. Hal ini mengakibatkan terbentuknya senyawa radikal baru (Winarsi, 2007).
X:H + •O–H → X• + H–O–H
Radikal hidroksil Radikal baru
Radikal bebas memiliki reaktivias yang sangat tinggi. Hal ini ditunjukkan oleh sifatnya segera menarik atau menyerang elektron di sekelilingnya. Senyawa radikal bebas juga dapat mengubah suatu molekul menjadi suatu radikal (Winarsi, 2007).
15
- Radikal bebas akan memberikan elekron yang tidak berpasangan (reduktor) kepada senyawa bukan radikal bebas.
- Radikal bebas menerima eletron (oksidator) darri senyawa bukan radikal bebas.
- Radikal bebas bergabung dengan senyawa bukan radikal bebas (Winarsi, 2007).
5. Mekanisme Perusakan
Target utama radikal bebas adalah protein, asam lemak tak jenuh dan lipoprotein, serta unsur DNA (Winarsi, 2007). Mekanisme kerusakan sel atau jaringan akibat serangan radikal bebas yang paling awal diketahui dan terbanyak diteliti adalah peroksidasi lipid. Peroksidasi lipid paling banyak terjadi di membran sel, terutama asam lemak tidak jenuh yang merupakan komponen penting penyusun membran sel. Pengukuran tingkat peroksidasi lipid diukur dengan mengukur produk akhirnya, yaitu malondialdehyde (MDA). Peroksidasi ini akan mempengaruhi fluiditas membran, struktur dan fungsi membran (Powers and Jackson, 2008).
mengakibatkan perubahan fungsi membran dan/atau mengubah karakter membran menjadi seperti antigen, (c) radikal bebas mengganggu sistem transport membran sel melalui ikatan kovalen, mengoksidasi kelompok thiol, atau dengan merubah asam lemak polyunsaturated, (d) radikal bebas menginisiasi peroksidasi lipid secara langsung terhadap asam lemak polyunsaturated dinding sel. Radikal bebas akan menyebabkan terjadinya peroksidasi lipid membran sel. Peroksidaperoksida lipid akan terbentuk dalam rantai yang makin panjang dan dapat merusak organisasi membran sel (Agarwal & Sekhlon, 2010).
17
6. Penghambatan
Reaktivitas radikal bebas dapat dihambat melalui 3 cara berikut: - Mecegah atau mengambat pembentukan radikal bebas baru.
- Menginaktivasi atau menangkap radikal dan memotong propagasi (pemutusan rantai).
- Memperbaiki (repair) kerusakan oleh radikal (Winarti, 2007).
C. Etanol
1. Klasifikasi
Menurut Darmono 2005 dalam Rini 2012, jenis alkohol yaitu
- alkohol absolut, alkoholyang hampir alkohol murni dengan kadar alkohol dihitung sebagai C2H5OHsebesar 99,8% dan air 0,2%,
- etanol (ethyl alcohol) adalah alkohol berkadar95 sampai 96,8% v/v, - metanol (methyl alcohol), adalah alkohol yang mempunyai struktur
paling sederhana
- isopanol (isoprophyl alcohol)
2. Definisi
3. Absorbsi
Alkohol yang masuk ke dalam saluran pencernaan akan diabsorbsi melalui mukosa mulut dan epitel gastrointestinal dan sebagian besar diabsorbsi di usus halus, sisanya diabsorbsi di kolon. Kecepatan absorbsi tergantung pada takaran dan konsentrasi alkohol dalam minuman yang mengisi lambung dan usus (Zakhari, 2006). Tingkat absorbsi paling tinggi pada saat lambung kosong. Adanya lemak di dalam lambung menurunkan tingkat absorbsi alkohol (Chandrasoma &Taylor, 2005).
4. Distribusi
Setelah minum alkohol dalam keadaan puasa, kadar puncak alkohol di dalam darah dicapai dalam waktu 30 menit. Distribusinya berjalan cepat, dengan kadar obat dalam jaringan mendekati kadar di dalam darah. Volume distribusi dari etanol mendekati volume cairan tubuh total (0,5–0,7 L/Kg) (Masters, 2002).
5. Metabolisme
Alkohol yang masuk ke dalam tubuh akan mengalami serangkaian proses biokimia. Metabolisme alkohol melibatkan 3 jalur yaitu:
a. Jalur Sitosol/Lintasan Alkohol Dehidrogenase
19
oxidasi yang memiliki afinitas yang tinggi terhadap alkohol dan memecah etanol dalam sitoplasma (Setshedi et al, 2010).
b. Jalur Peroksisom/Sistem Katalase
Sistem ini berlangsung di dalam peroksisom dengan menggunakan katalase. Pada jalur ini diperlukan H
2O2 (Zakhari, 2006). c. Jalur Mikrosom
Jalur ini juga sering disebut dengan sistem SOEM (Sistem Oksidasi Etanol Mikrosom), yang terletak dalam retikulum endoplasma. Bisa juga disebut jalur sitokrom P450 2E1 (CYP2E1). Jalur ini diaktifasi pada penggunaan alkohol secara kronis (Zakhari, 2006).
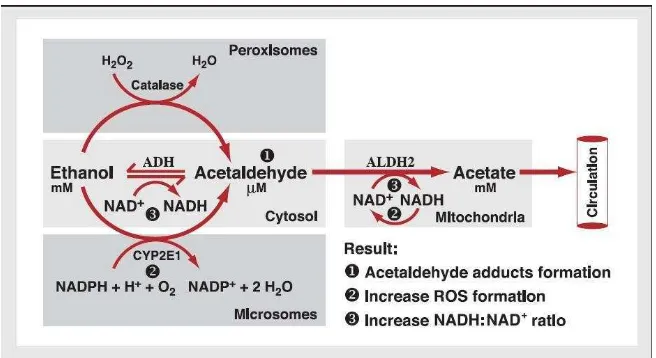
[image:28.612.171.499.473.652.2]Oleh ketiga jalur tersebut alkohol akan diubah menjadi asetaldehid, kemudian akan diubah menjadi asetat oleh aldehid dehidrogenase di dalam mitokondria. (Zakhari, 2006).
Etanol dapat menimbulkan kerusakan pada hati disebabkan oleh asetaldehid adduct, ROS (reactive oxidative species) dan rasio NAD: NADH. (Hernawati, 2010).
Asetaldehid dan oksigen radikal dapat berinteraksi dengan protein dan molekul kompleks lainnya di dalam sel, membentuk senyawa hibrida yang dinamakan adduct. Adduct lainnya dibentuk dari molekul aldehid, yang diproduksi saat interaksi radikal oksigen dengan lipid dalam sel. Pembentukan adduct menghambat fungsi asli dari protein yang terlibat adduct tersebut. Lebih lanjut, adduct dapat menginduksi respon imun (Dean et al., 2003).
Salah satu akibat dari pembentukan adduct– asetaldehid adalah menurunnya pembentukan protein yang membentuk partikel lipoprotein hati dan berkurangnya sekresi protein yang dependent–tubulin. Sebagai akibat gangguan mekanisme sekretorik terjadi penimbunan trigliserol dan protein di dalam hati. Penimbunan protein menyebabkan influks air ke dalam hepatosit dan pembengkakan hati ikut serta menimbulkan hipertensi porta dan kerusakan arsitektur hati (Marks dkk, 2000).
21
ketersediaan katalis, memproduksi oksidan kuat seperrti radikal hidroksil (Lu & Cederbaum, 2008).
Selain radikal hidroksietil pada peminum alkohol kronis terjadi peningkatan radikal bebas yang lain yang sumbernya belum jelas. Diperkirakan sumber dari radikal bebas tersebut adalah xanthin oxidase dan NADPH sebab penghambatan enzim tersebut dapat menurunkan produksi radikal bebas pada tikus yang diberikan etanol (Kono, et al. 2001 dalam Hernawati 2010).
Pemberian alkohol secara kronis menyebabkan peningkatan level endotoksin di sirkulasi portal, demikian mengaktivasi sel Kupffer untuk memproduksi mediator toksik yang menyebabkan kerusakan hati (Thurman, 1998).
Transkripsi NF–B, pengatur gen yang terlibat dalam peradangan, diaktivasi oleh endotoksin atau stress oksidatif (Baeuerle & Baltimore, 1996).
Penelitian yang dilakukan Nanji et al. 2001, menyebutkan bahwa tikus yang diberikan etanol terjadi peningkatan endotoksemia dan peroksidasi lipid, menstimulasi NF–kB dan produksi kemokin, meningkatkan kerusakan hati. TNF–a dan COX–2 mungkin penting dalam menyebabkan kerusakan hati tetapi tidak dijelaskan perbedaan yang berkaitan dengan jenis kelamin.
menginduksi produksi TNF. Bagaimanapun, penyebab dan efek dari faktor tersebut belum sepenuhnya diketahui (Zhou et al., 2003).
Toksikan dapat menyebabkan berbagai jenis efek toksik pada berbagai organel dalam sel hati, seperti perlemakan hati (steatosis), nekrosis, kolestasis dan sirosis (Lu & Cederbaum, 2008).
D. Sistem Pertahanan Antioksidan dan Stres Oksidatif
Radikal bebas dan senyawa oksigen reaktif yang diproduksi dalam jumlah yang normal, penting untuk fungsi biologis, seperti sel darah putih yang menghasilkan H2O2 untuk membunuh beberapa jenis bakteri dan jamur serta pengaturan pertumbuhan sel. Radikal bebas tidak menyerang sasaran spesifik sehingga akan menyerang asam lemak tidak jenuh ganda dari membran sel, organel sel atau DNA yang dapat menyebabkan kerusakan struktur dan fungsi sel (Winarsi, 2007).
Namun tubuh diperlengkapi oleh seperangkat sistem pertahanan untuk menangkal serangan radikal bebas atau oksidan sehingga dapat membatasi kerusakan yang diakibatkan oleh radikal bebas. Sistem pertahanan antioksidan ini antara lain adalah enzim superoxide dismutase (SOD) yang terdapat di mitokondria dan sitosol, glutathione peroxidase (GPX), glutathione reductase dan catalase (Powers & Jackson, 2008).
23
pertahanan ini bekerja dengan beberapa cara antara lain berinteraksi langsung dengan radikal bebas, oksidan atau oksigen tunggal, mencegah pembentukan senyawa oksigen reaktif atau mengubah senyawa reaktif menjadi kurang reaktif (Winarsi, 2007).
Namun dalam keadaan tertentu, produksi radikal bebas atau senyawa oksigen reaktif melebihi sistem pertahanan tubuh, kondisi yang disebut sebagai stres oksidatif (Agarwal & Sekhlon, 2010). Pada kondisi stres oksidatif, imbangan normal antara produksi radikal bebas atau senyawa oksigen reaktif dengan kemampuan antioksidan alami tubuh untuk mengeliminasinya mengalami gangguan sehingga menggoyahkan rantai reduksi–oksidasi normal dan menyebabkan kerusakan oksidatif jaringan. Kerusakan jaringan ini juga tergantung pada beberapa faktor antara lain target molekuler, tingkat stres yang terjadi, mekanisme yang terlibat, serta waktu dan sifat alami dari sistem yang diserang (Winarsi, 2007).
E. Tanaman Binahong (Anredera cordifolia (Tenore) Steenis)
1. Nama Umum
Gambar 3. Tanaman Binahong (Anredera cordifolia) (Wikipedia). 2. Klasifikasi Taksonomi
Klasifikasi tanaman binahong (Anredera cordifolia (Tenore) Steen)) adalah sebagai berikut (Bargumono, 2013):
Kingdom : Plantae
Subkingdom : Tracheobionta Superdivisio : Spermatophyta Divisio : Magnoliophyta Kelas : Magnoliopsida Subkelas : Hamamelidae Ordo : Caryophyllales Familia : Basellaceae
Genus : Anredera
25
3. Deskripsi Tumbuhan
Binahong merupakan kelompok tumbuhan menjalar, berumur panjang (perenial), bisa mencapai panjang ± 5 m. Batang binahong bersifat lunak, berbentuk silindris, saling membelit, berwarna merah, permukaan halus, kadang membentuk semacam umbi yang melekat di ketiak daun dengan bentuk tak beraturan dan bertekstur kasar. Daun binahong berjenis tunggal, bertangkai sangat pendek (subsessile), tersusun berseling, berwarna hijau, bentuk jantung (cordata), panjang 5–10 cm, lebar 3–7 cm, helaian daun tipis lemas, ujung runcing, permukaan licin, bisa dimakan. Binahong mempunyai jenis bunga majemuk berbentuk tandan, bertangkai panjang, muncul di ketiak daun, mahkota berwarna krem keputih–putihan berjumlah lima helai tidak berlekatan, panjang helai mahkota 0,5–1 cm dan berbau harum. Akarnya berbentuk rimpang dan berdaging lunak (Bargumono, 2013).
4. Kandungan a. Flavonoid
Falavanoid merrupakan senyawa polar yang umumnya mudah larut dalam pelarut polar seperti etanol, metanol, butanol, aseton dan lain–lain. Aktivitas farmakologi dari flavanoid sebagai anti–inflamasi, analgesi, anti–oksidan. Flavanoid juga mengobati gangguan fungsi hati. Senyawa– senyawa flavonoid terdapat dalam semua bagian tumbuhan tinggi, seperti bunga, daun, ranting, buah, kayu, kulit kayu dan akar (Bargumono, 2013).
Berdasarkan penelitian Widya Selawa 2013, jenis flavonoid yang diperoleh dari hasil isolasi dan identifikasi serbuk segar dan serbuk kering ekstrak etanol daun binahong ialah flavonol. Flavonoid total pada sampel segar daun binahong sebesar 11,23 mg/kg. Kandungan flavonoid pada sampel segar lebih besar, karena pada proses preparasi sampel segar tidak mengalami pemanasan. Hal tersebut dikarenakan proses pemanasan dapat membuat kadar dari senyawa flavonoid berkurang. Proses pemanasan ini dapat mengakibatkan penurunan kadar total flavonoid sebesar 15–78 % (Selawa, 2013).
b. Saponin
27
c. Asam Oleanolik
Asam oleanik merupakan golongan tripentenoid yang merupakan antioksidan pada tanaman. Mekanisme perlidungan oleh asam oleanik adalah dengan mencegah masuknya racun ke dalam sel dan meningkatkan sistem pertahanan sel. Selain itu juga meningkatkan nutrisi yang dibawa dalam darah ke setiap jaringan sehingga merangsang tubuh menghasilkan hormon pertumbuhan dan proses regenerasi sel (Blumert & Liu, 2003).
d. Alkaloid
Alkaloid merupakan golongan zat tumbuhan sekunder yang terbesar. Alkaloid memiliki kemampuan sebagai antibakteri dan memiliki aktivitas hipoglikemik (Robinson, 1995).
F. Tikus (Rattus norvegicus)
Terdapat tiga galur atau varietas tikus yang memiliki kekhususan tertentu yang biasa digunakan sebagai hewan percobaan yaitu galur Sparague dawley berwarna albino putih, berkepala kecil dan ekornya lebih panjang dari badannya, galur Wistar ditandai dengan kepala besar dan ekor yang lebih pendek dan galur Long evans yang lebih kecil daripada tikus putih dan memiliki warna hitam pada kepala dan tubuh bagian depan (FKH UGM, 2006).
29
Klasifikasi tikus putih (Rattus novergicus) dalam taksonomi adalah (FKH UGM, 2006):
Dunia : Animalia Fillum : Chordata Sub Fillum : Vertebrata Kelas : Mamalia Sub klas : Theria
Ordo :Rodentia
Sub ordo :Myomorpha Famili :Muridae Sub famili :Murinae Genus :Rattus
G. Kerangka Pemikiran
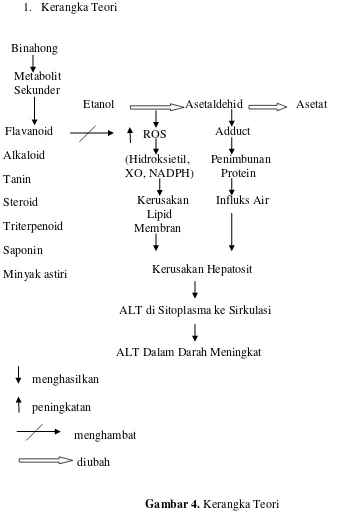
1. Kerangka Teori
Binahong
Metabolit Sekunder
Etanol Asetaldehid Asetat
Flavanoid Adduct
(Hidroksietil, Penimbunan XO, NADPH) Protein Kerusakan Influks Air
Lipid Membran
Kerusakan Hepatosit
ALT di Sitoplasma ke Sirkulasi
[image:39.612.108.445.154.667.2]ALT Dalam Darah Meningkat menghasilkan peningkatan menghambat diubah
31
2. Kerangka Konsep
Binahong
Metabolit Sekunder
Etanol Asetaldehid
Flavanoid
(Hidroksietil, XO, NADPH) Kerusakan
Lipid Membran
Kerusakan Hepatosit
ALT di Sitoplasma ke Sirkulasi
ALT Dalam Darah Meningkat menghasilkan
peningkatan
menghambat
[image:40.612.134.386.117.589.2]diubah
III.METODE PENELITIAN
A. Rancangan Penelitian
Penelitian ini merupakan studi eksperimental dengan metode acak terkontrol menggunakan post test only controlled group design. Pada penelitian ini 25 ekor tikus putih galur Sprague Dawley berumur 2–3 bulan yang dipilih secara random yang dibagi menjadi 5 kelompok .
B. Tempat dan Waktu
Pengambilan tanaman uji dilakukan di Bandar Lampung. Sedangkan pengolahan tanaman dilaksanakan di Laboraturium Kimia Organik FMIPA, Universitas Lampung dan pengelolaan tikus putih dilaksanakan di Fakultas Kedokteran Universitas Lampung.
C. Variabel Penelitian
Variabel yang digunakan dalam penelitian ini adalah sebagai berikut :
1. Variabel bebas (independent variable) adalah ekstrak etanol daun binahong (Anredera cordifolia).
31
D. Populasi dan Sampel
Populasi penelitian ini adalah mencit galur Sprague dawley berumur 2–3 bulan yang diperoleh dari laboraturium Patologi Fakultas Kedokteraan Hewan IPB. Sampel penelitian sebanyak 25 ekor yang dipilih secara acak yang dibagi kedalam 5 kelompok dengan pegulangan sebanyak 5 kali.
Menurut Supranto (2000), rumus penentuan sampel untuk uji eksperimental, yakni (t–1) (n–1)≥15. Dimana t merupakan jumlah kelompok perlakuan dan n adalah jumlah pengulangan atau sampel setiap kelompok, niai n sama dengan 5 kali.
Cara pengambilan sampel untuk penelitian eksperimental dengan menggunakan Supranto (2000) :
(t–1) (n–1)≥15
t : jumlah kelompok n : jumlah sampel
Pada penelitian kali ini terdapat 4 kelompok, sehingga (t–1) (n–1) ≥ 15
(5–1) (n–1) ≥ 15 (n–1) ≥ 3,75
n ≥ 3,75 +1 n ≥ 4,75
E. Kriteria Inklusi dan Eksklusi
Sampel yang di ambil harus memiliki kriteria inklusi sebagai berikut : 1. Memiliki berat badan antar 180–220 gram.
2. Jenis kelamin jantan. 3. Berusia sekitar 2–3 bulan. 4. Dinyatakan sehat.
Adapun kriteria eksklusi dalam penelitian ini adalah sebagai berikut :
1. Memiliki penampakan rambut kusam, rontok atau botak dan aktivitas kurang atau tidak aktif.
2. Keluarnya eksudat yang tidak normal darimata, mulut, anus, genital setelah masa adaptasi.
3. Terdapat penurunan berat badan lebih dari 10 % setelah masa adaptasi di laboraturium
F. Alat dan Bahan
Untuk mendukung terlaksananya penelitian ini penulis menggunakan alat dan bahan, sebagai berikut :
1. Bahan Penelitian
Bahan penelitian yang digunakan yaitu - Etanol dengan dosis 10ml/kgBB.
33
- Hewan coba berupa tikus putih (Rattus norvegicus) jantan galur Sprague dawley berasal dari IPB Bogor dan memenuhi kriteria inklusi. Mendapat pakan standar dan minum secara ad libitum.
2. Alat penelitian
Alat yang digunakan pada penelitian ini adalah: - Kandang hewan.
- Tempat pakan hewan. - Tempat minum hewan.
- Neraca analitik Metler Toledo dengan tingkat ketelitian 0,01 g untuk menimbang berat tikus.
- Beaker glass. - Sonde lambung. - Disposable spuit 1cc. - Handschoen.
- Alat centrifuge.
- Vacutainer SST (Yellow Top). - Mikropipet.
- Tabung mikro. - Kapas.
G. Prosedur Penelitian
1. Prosedur Pembuatan Ekstrak Daun Binahong (Anredera cordifolia)
Pembuatan ekstrak dilakukan di laboratorium Kimia Organik FMIPA Universitas Lampung. Pembuatan ekstrak diawali dengan menyediakan daun binahong. Masing masing sampel tersebut dicuci bersih kemudian dikeringkan selanjutnya digiling hingga menjadi serbuk. Serbuk yang dihasilkan kemudian ditimbang, serbuk tersebut diekstraksi menggunakan etanol sebagai pelarut.
Buat ekstrak dari serbuk kering simplisia dengan cara maserasi menggunakan pelarut yang sesuai yang dapat menyaring sebagian besar metabolit sekunder yang terkandung dalam serbuk simplisia. Jika tidak dinyatakan lain gunakan etanol 70% (Depkes, 2009).
Masukan satu bagian serbuk simplisia ke dalam maserator, tambahkan 10 bagian pelarut. Rendam selama 6 jam pertama sambil sesekali diaduk, kemudian diamkan selama 18 jam. Pisahkan maserat dengan cara pengendapan, sentrifugasi, dekantasi atau filtrasi. Ulangi proses penyaringan sekurang–kurangnya dua kali dengan jenis dan jumlah pelarut yang sama (Depkes, 2009).
35
2. Prosedur Pemberian Etanol
Dosis etanol yang digunakan dalam penelitian ini adalah berdasarkan dari hasil penelitian sebelumnya yang telah terbukti memiliki efek kerusakan signifikan pada hati. Pada penelitian Chen (2010), digunakan etanol dengan dosis 5g/kgBB.
Perhitungan volume pemberian etanol yaitu 1 gram etanol sama dengan 1 mL alkohol 100% . Jadi jika konsentrasi etanol dibuat 50% maka dalam 50% v/v 100 ml terdapat 50 gram etanol.
3. Prosedur Pemberian Ekstrak Daun Binahong
Dosis pada penelitian ini di daasarkan atas penelitian sebelumnya yaitu Elin Yulinah et al, pemberian ekstrak etanol terhadap mencit dengan dosis 100mg/kgBB dan 200mg/kgBB dapat meminimalisir kerusakan organ dalam tikus akibat induksi bahan toksik. Untuk itu dalam penelitian ini digunakan dosis 100mg/kgBB dan 200mg/kgBB.
Tikus yang digunakan pada penelitian ini adalah tikus putih jantan galur Sprague dawley berumur 8–12 minggu dengan berat 130g–1500g, untuk itu dilakukan penyesuaian dosis untuk sebagai berikut:
Konversi dosis 50mg/kgBB ke tikus dengan berat 130g dan 150g = 130g = 130/1000 x 50mg = 6.5mg/130grBB tikus (satu ekor) 150g = 150/1000 x 50mg = 7.5mg/150grBB tikus (satu ekor) Konversi dosis 100mg/kgBB ke tikus dengan berat 180gr dan 220gr =
130g = 180/1000 x 100mg = 13mg/130grBB tikus (satu ekor) 150g = 150/1000 x 100mg = 15mg/150grBB tikus (satu ekor) Konversi dosis 200mg/kgBB ke tikus dengan berat 180gr dan 220gr =
130g = 180/1000 x 200mg = 26mg/130grBB tikus (satu ekor) 150g = 150/1000 x 200mg = 30mg/150grBB tikus (satu ekor)
4. Prosedur Perlakuan pada Tikus
a. Tikus sebanyak 25 ekor, dikelompokkan dalam 5 kelompok.
b. Selama satu minggu tiap–tiap kelompok tikus diadaptasikan sebelum diberi perlakuan.
c. Mengukur berat badan tikus sebelum perlakuan. d. Melakukan perlakuan pada masing–masing kelompok:
- Kelompok kontrol normal diberikan aquades (minum) dan pakan standar.
- Kelompok kontrol positif, diberikan aquades pada hari 1–4, kemudian etanol dosis 10 ml/ kgBB pada hari 5–14 dan pakan standar.
- Kelompok perlakuan 1 diberikan aquades dan pakan standar ditambah ekstrak daun binahong dosis 50 mg/kgBB pada hari 1– 4. Pada hari 5–14 diberi ekstrak daun binahong dosis 50 mg/kgBB selang 2 jam diinduksi etanol dosis 10 ml/kgBB. - Kelompok perlakuan 2 diberikan aquades dan pakan standar
37
- Kelompok perlakuan 3 diberikan aquades dan pakan standar ditambah ekstrak daun binahong dosis 200 mg/kgBB pada hari 1–4. Pada hari 5–14 diberi ekstrak daun binahong dosis 200 mg/kgBB selang 2 jam diinduksi etanol dosis 10 ml/kgBB. e. Setelah 14 hari perlakuan dihentikan.
- Pengambilan Sampel Darah Tikus
Pengambilan sampel darah dilakukan pada akhir penelitian. Tikus dikeluarkan dari kandang dan ditempat terpisah dengan tikus lainnya kemudian ditunggu beberapa saat untuk mengurangi penderitaan pada tikus akibat aktivitas antara lain pemindahan, penanganan, gangguan antar kelompok dan penghapusan berbagai tanda yang pernah diberikan. Setelah itu, tikus dianestesi dengan Ketamine–xylazine 75–100 mg/kg + 5– 10 mg/kg secara IP kemudian tikus di euthanasia berdasarkan Institusional Animal Care and Use Committee (IACUC) menggunakan metode cervical dislocation dengan cara ibu jari dan jari telunjuk ditempatkan dikedua sisi leher di dasar tengkorak atau batang ditekan ke dasar tengkorak. Dengan tangan lainnya, pada pangkal ekor atau kaki belakang dengan cepat ditarik sehingga menyebabkan pemisahan antara tulang leher dan tengkorak (AVMA, 2013).
yang sudah berisi clot activator dan inner separator. Tikus kemudian dimusnahkan dengan cara dibakar.
- Cara Pembuatan Serum
Darah yang sudah berhasil didapatkan lalu dipusingkan selama 10–20 menit pada kecepatan 4000 rpm. Serum yang terbentuk dipisahkan dari endapan sel–sel darah dengan menggunakan pipet sebanyak 200 µL.
- Prosedur Pemeriksaan Aktivitas AST dan ALT
39
Timbang Berat Badan Tikus
Kn K+ P1 P2 P3
Tikus diadaptasi selama 7 hari Timbang berat badan
Hari 1–4
Hari 5–10
Tikus di anesthesia kemudian di euthanasia
Sampel darah kemudian dikirim ke Laboratorium Patologi Klinik RS. Abdoel Moeloek untuk pemeriksaan ALT
Intepretasi hasil pemeriksaan Gambar 6. Diagram Alur Penelitian
diet standar
diet standar+ cekok akuades
diet standar + cekok ekstrak 50mg/kgBB
diet standar+ cekok ekstrak 100mg/kgBB
diet standar + cekok ekstrak 200mg/kgBB diet standar diet standar+ cekok etanol 10mg/kgBB
diet standar + cekok ekstrak 50mg/kgBB
diet standar + cekok ekstrak 100mg/kgBB
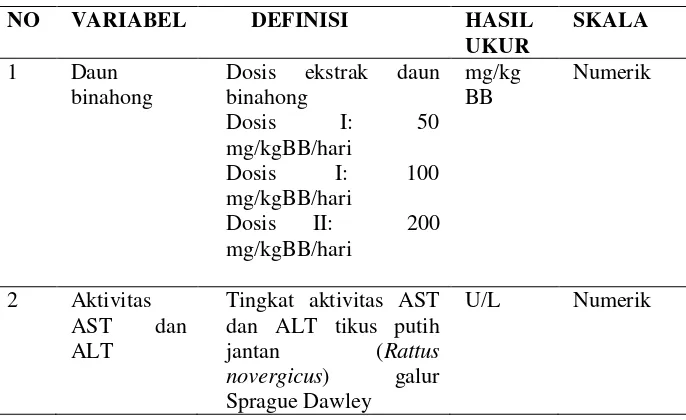
5. Definisi Operasional
[image:51.595.172.515.213.423.2]Untuk memudahkan pelaksanaan penelitian dan agar penelitian tidak menjadi terlalu luas maka dibuat definisi operasional sebagai berikut:
Tabel 1. Definisi Operasional
NO VARIABEL DEFINISI HASIL
UKUR
SKALA
1 Daun binahong
Dosis ekstrak daun binahong
Dosis I: 50 mg/kgBB/hari
Dosis I: 100 mg/kgBB/hari
Dosis II: 200 mg/kgBB/hari
mg/kg BB
Numerik
2 Aktivitas AST dan ALT
Tingkat aktivitas AST dan ALT tikus putih jantan (Rattus
novergicus) galur
Sprague Dawley
U/L Numerik
H. Analisis Data
41
Jika tidak homogen atau distribusi tidak normal atau tidak homogen dan distribusi tidak normal, dilanjutkan dengan uji non–parametrik Kruskal Wallis. Kemudian dilanjutkan dengan uji post hoc Mann Whiteney. Hipotesis akan dianggap bermakna bila p<0,05.
I. Ethical Clearance
Penelitian ini telah diajukan ke Komisi Etik Penelitian Kesehatan Fakultas Kedokteran Universitas Lampung, dengan menerapkan prinsip 3R dalam protokol penelitian, yaitu:
1. Replacement adalah keperluan memanfaatkan hewan percobaan sudah diperhitungkan secara seksama, baik dari pengalaman terdahulu maupun literatur untuk menjawab pertanyaan penelitian dan tidak dapat digantikan oleh makhluk hidup lain seperti sel atau biakan jaringan.
2. Reduction adalah pemanfaatan hewan dalam penelitian sesedikit mungkin, tetapi tetap mendapatkan hasil yang optimal. Dalam penelitian ini sampel dihitung berdasarkan rumus Supranto yaitu (t–1) (n–1)≥15 dengan n adalah jumlah hewan yang diperlukan dan t adalah jumlah kelompok perlakuan.
3. Refinement adalah memperlakukan hewan percobaan secara manusiawi, dengan prinsip dasar membebaskan hewan coba dalam beberapa kondisi. a. Bebas dari rasa lapar dan haus maka pada penelitian ini hewan coba
diberikan pakan standar dan minum secara ad libitum.
hewan coba dibagi menjadi 2–3 ekor tiap kandang. Pet house berada jauh dari gangguan bising dan aktivitas manusia serta kandang dijaga kebersihannya sehingga mengurangi stress pada hewan coba.
c. Bebas dari nyeri dan penyakit dengan menjalankan program kesehatan, pencegahan pemantauan serta pengobatan terhadap hewan percobaan jika diperlukan. Pada penelitian hewan coba diberikan perlakuan dengan menggunakan sonde. Dosis perlakuan diberikan berdasarkan pengalaman terdahulu maupun literatur yang telah ada.
52
V. SIMPULAN DAN SARAN
A. Simpulan
1. Ekstrak etanol daun binahong (Anredera cordofolia (Ten.) Steenis ) dengan dosis 50 mg/kgBB tidak dapat mencegah peningkatan ALT tikus yang diinduksi oleh etanol.
2. Ekstrak etanol daun binahong (Anredera cordofolia (Ten.) Steenis ) dengan dosis 100 mg/kgBB dan 200 mg/kgBB dapat mencegah peningkatan ALT tikus yang diinduksi oleh etanol.
B. Saran
1. Peneliti disarankan untuk membandingkan efektifitas pemberian sediaan daun binahong antara jus, ekstrak, infusa dan dekok.
2. Peneliti lain disarankan untuk mencari pelarut dan konsentrasi yang lebih efektif untuk mengekstraksi daun binahong.
3. Peneliti lain disarankan untuk menguji lebih lanjut toksisitas dan efektivitas pada tanaman binhong baik secara utuh maupun perbagian tanaman.
5. Peneliti lain disarankan untuk meneliti lebih lanjut terkait dosis terapeutik tanaman binahong sebagai hepatoprotektor dengan meminimalisasi efek samping yang mungkin timbul sebagai.
6. Peneliti lain disarankan meneliti lebih lanjut dengan jangka waktu yang berbeda untuk melihat bagiamana hubungan durasi waktu pemberian ekstrak etanol daun binahong terhadap aktivitas ALT tikus yang di induksi etanol.
7. Peneliti disarankan untuk melakukan pengamatan jaringan histopatologis hepar, selain mengukur aktivitas enzim ALT.
54
DAFTAR PUSTAKA
Agarwal A and Sekhon LH. 2010. The role of antioksidant therapy in the treatment of male infertility. J Human Fertility. 13(4): 217-225.
Amirudin R. 2006. Fisiologi dan biokimia hati. Dalam: Buku Ajar Ilmu Penyakit Dalam, Jilid I, Edisi IV. Jakarta: Departemen Ilmu Penyakit Dalam Fakultas Kdokteran Universitas Indonesia. hlm. 415-419.
Arief S. 2007. Radikal bebas. Surabaya: Bagian/SMF Ilmu Kesehatan Anak FK UNAIR/RSU Dr. Soetomo.
Aslam M., Tan CK, Prayitno A. 2003. Farmasi Klinis (Clinical Pharmacy) Menuju Pengobatan Rasional dan Penghargaan Pilihan Pasien. Jakarta: Elex Media Komputindo.
Baeuerle PA, Baltimore D. 1996. NF-kappa B: ten years after. J. Cell. 87(1):13-20. Bargumono HM. 2013. Tiga puluh tiga (33) tanaman toka (tanaman obat, kosmetika,
aromatika bermanfaat untuk semua umat). Jogja: Leutikaprio.
Blumert M and Liu J. 2003. Jiaogulan (Gynostemma pentaphyllum), China’s. immortality herb. Edisi: 3. China: Torchlight
Burt AD, Day CP. 2002. Pathophysiology of the liver. New York: Churchill Livingstone. hlm. 67-105.
Cagnotti C, Kay FM, Gandolfo D. 2007. Biology and host specificity of Plectonycha correntina Lacordaire (Chrysomelidae), a candidate for the biological control of Anredera cordifolia (Tenore) Steenis (Basellaceae). Argentina: South American Biological Control Laboratory.
Clarkson PM and Thompson HS. 2000. Antioxidant: what role do they play in physical activity and health. The American Journal of Clinical Nutrition. 72: 637-46.
Dean J, Tuma PD, Carol AC. 2003. Dangerous byproducts of alcohol breakdown focus on adducts. 27(4): 1-6.
Djamil R, Wahyudi PS, Wahono S, Hanafi M. 2012. Antioxidant activity of flavonoid andredera cordofolia. J. International Research Journal of Pharmacy. 3(9): 241-3.
Dooley JS, Lok ASF, Burroughs AK, Heatcote EJ. 2011. Sherlock’s disease of the liver. USA: Wiley.
Dorland, Newman WA. 2010. Kamus kedokteran Dorland. Edisi31. Jakarta : EGC Hernawati. 2010. Gambaran efek toksik etanol pada sel hati. Bandung: UPI.
Halliwell B and Whiteman M. 2004. Measuring reactive species and oxidative damage in vivo and in cell culture: how should you do it and what do the results mean?. British Journal of Pharmacology. 142: 231-255.
Hariyatmi. 2004. Kemampuan vitamin E sebagai antioksidan terhadap radikal bebas pada lanjut usia. J. MIPA. 14(1):52-60
Hong ZHU, Zhequan JIA, Hara MISRA, Robert LI. 2012. Oxidative stress and redox signaling mechanisms of alcoholic liver disease: update experimentaland clinical evidence. J Dig Dis. 13(3): 133-142.
Huang XJ, Choi YK, Im HS, Yarimaga, Yoon E, Kim HS. 2006. Aspartate aminotransferase (ast/got) and alanine aminotransferase (alt/gpt) detection techniques. J. Sensors. pp. 756-782
Junqueira LC, Carneiro J. 2007. Histologi dasar. Edisi 10. Jakarta: EGC.
Kujovich JL. 2005. Hemostatic defects in end stage liver disease. Journal Critical Care Clinic. (21): 563-587
Lawrence AK and Amadeon JP. 1996. Clinical chemistry: theory, analysis, correlation. Philadelphia.
56
Manoi, F. 2009. Binahong (anredera cordifolia (ten.) steenis sebagai obat. Jurnal Warta Penelitian Dan Pengembangan Tanaman Industri. 15(1:3).
Marks DB, Marks AD, Smith CM. 2000. Biokimia kedokteran dasar. Jakarta: EGC. hlm:576.
Masters SB. 2002. Farmakologi dasar dan klinik katzung: alkohol. Jakarta: Salemba Media.
Nanji AA, Jokelainen K, Fotouhinia M, Rahemtulla A, Thomas P, Tipoe GL, Su GL, Dannenberg AJ. 2001. Increased severity of alcoholic liver injury in female rats: role of oxidative stress, endotoxin, and chemokines. J Physiol Gastrointest Liver Physiol. 281: G1348-G1356.
Nanji et al. 2002. Curcumin prevents alcohol-induced liver disease in rats by inhibiting the expression of NF-KB-dependent genes. Am J Physiol Gastrointest Liver Physiol. 284: 321-7.
Neuman RC. 2004. Organic Chemistry. California.
Nita R. 2009. Uji aktivitas antijamur ekstrak daun binahong (Anredera cordifolia (Ten.) Steenis) terhadap candida albicans serta skrining fitokimianya. Skripsi. Surakarta: UMS.
Orbayinah S, Kartyanto A. 2008. Efikasi Binahong (Anredera cordifolia (Tenore) Steenis) terhadap Kadar Alkaline Phosphatase. J Mutiara Medika. 8 (2): 89-95. Powers SK and Jackson MJ. 2008. Exercise-induced oxidative stress: cellular
mechanisms and impact on muscle force production. Physiol. 88: 1243-76. Prihatni D, Ida P, Idaningroem S, Coriejati R. 2005. Efek hepatotoksik tuberculosis
terhadap kadar aspatate aminotransferase dan alanine aminotransferase serum penderita tuberkulosis paru. Indonesian Journal of Clinical Pathology and Medical Laboratory. 12 (1): 1-5.
PutzR,Pabst. 2007. Atlas anatomi manusia sobotta jilid dua. Jakarta: EKG.
Robbins S, Ramzi, Vinay K. 2007. Robbins dasar patologi penyakit. Edisi 7. Jakarta: EGC.
Rochani N. 2009.Uji aktivitas antijamur ekstrak daun binahong (Anredera cordifolia (Tenore) Steenis) terhadap candida albicans serta skrining fitokimianya. Skripsi. Surabaya: Farmasi UMS.
Schimdt LE, Dalhoff K, Poulsen HE. 2002. Acute versus chronic alcohol consumption in acetaminophen-induced hepatotoxicity. J Hepatology. 35(4): 1-7.
Selawa W, Runtuwene MRJ, Citraningtyas G. 2013. Kandungan flavonoid dan kapasitas antioksidan total ekstrak etanol daun binahong (Anredera cordifolia(Ten.)Steenis). J Ilmiah Farmasi. 2(1): 1-6.
Setshedi M, Wands JR, Monte SM. 2010. Acetaldehyde adducts in alcoholic liver disease . Oxid Med Cell Longev. 3(3):178-85.
Smith JB, Mangkoewidjojo S. 1988. Pemeliharaan, pembiakan dan penggunaan hewan percobaan di daerah tropis - tikus laboratorium (Rattus norvegicus). Jakarta: Universitas Indonesia. hal. 37-57
Sukandar EY, Qowiyyah A, Larasari L. 2011. Effect of methanol extract hearhleaf madeiravine (Anredera cordifolia (Ten.) Steenis) leaves on blood sugar in diabetes mellitus model mice. J Medika Planta. 1(4): 1-10.
Suroyo MF. 2001. Pengaruh penambahan kurkumin dan waktu reoksigenisasi terhadap jumlah radikal bebas pada proses reperfus jantung marmut terisolasi. Skripsi. Bogor: IPB.
Suyatna FD, Syamsudin, Ganiswarna S, Sadikin M. 2010. Efek kurkumin terhadap aktivitas enzim glutation peroksidase mitokondria hati tikus yang diinduksi dengan butilhidroperoksida-tersier. J Universitas Indonesia. hlm 1-5.
Thapa BR, Walia A. 2007. Liver function tests and their interpretation. Indian J Pediatric. 74 (7): 663-671.
Thurman RG. 1998. Mechanisms of hepatic toxicity: alcoholic liver injury involves activation of kupffer cells by endotoxin. J American Physiological Society. 1-7. Widmann, Frances K. 1995. Tinjauan klinis atas hasil pemeriksaan laboratorium.
Edisi 9. Jakarta: EGC. hal. 331
Wilmana PF. 1995. Analgesik-antipiretik, analgesik anti-inflamasi non steroid
58
Winarsi H. 2007. Antioksidan alami dan radikal bebas. Yogyakarta: Kanisius. Yogyakarta
Zakhari S. 2006. Overview: how is alcohol metabolized by the body?. 29(4): 1-10. Zhou Z, Wang L, Song Z, Lambert JC, McClain CJ, Kang YJ. 2003. A critical