1 PENDAHULUAN
1.1 Latar Belakang
Kesehatan memiliki peran penting agar kelangsungan hidup manusia berjalan dengan baik. Masalah kesehatan yang sering terjadi umumnya akibat lingkungan yang kotor dan makanan yang tercemar mikroorganisme, sehingga menyebabkan penyakit. Mikroorganisme yang menimbulkan penyakit pada manusia umumnya berasal dari golongan bakteri. Bakteri yang merugikan dan menimbulkan penyakit disebut sebagai bakteri patogen (Pelczar dan Chan 2005).
Bakteri patogen dapat merugikan kesehatan manusia sehingga perlu diatasi dengan menggunakan antibakteri yang tepat. Antibakteri merupakan senyawa kimia yang memiliki fungsi menghambat pertumbuhan maupun membunuh sel bakteri (Madigan et al. 2009). Antibakteri dapat berupa senyawa sintetik maupun senyawa yang berasal dari bahan alami (natural product). Senyawa sintetik berpotensi menimbulkan efek negatif yang dapat mengganggu kesehatan, misalnya kanker (Gold dan Slone 1999). Hal ini memicu perlunya pencarian alternatif bahan alami sebagai antibakteri yang aman bagi kesehatan manusia, dan salah satu sumber penghasil antibakteri alami adalah mikroalga.
Mikroalga umumnya mengandung komponen aktif yang dapat dimanfaatkan dalam bidang pharmaceutical, neutraceutical, bahan tambahan pakan, dan kosmetik (Barsanti dan Gualtieri 2006). Komponen aktif mikroalga banyak diaplikasikan sebagai obat bagi manusia maupun hewan serta pertanian (Borowitzka 1995). Berbagai potensi mikroalga yang telah diteliti memiliki aktivitas antibakteri (Uma et al. 2011); antihiperglikemik (Rahman 2011);
antitumor dan antimikroba (Taskin et al. 2010); antimikroba (Abedin dan Taha 2008); antioksidan (Marxen et al. 2007); dan aktivitas
antibakteri (Kusmiyati dan Agustini 2007).
P. cruentum ini dapat menjadi suatu peluang dalam pengembangan sumber daya perairan untuk diaplikasikan dalam bidang yang lebih luas.
Menurut Kusmiyati dan Agustini (2007), mikroalga P. cruentum yang ditumbuhkan dalam media Becker dapat menghasilkan senyawa yang memiliki aktivitas antibakteri. Proses ekstraksi dilakukan dengan metode ekstraksi bertingkat menggunakan pelarut diklorometan. Hasil uji aktivitas antibakteri menunjukkan bahwa P. cruentum memiliki aktivitas untuk menghambat pertumbuhan Bacillus subtilis, Staphylococcus aureus, dan Escherichia coli.
Faktor penting dalam pertumbuhan mikroalga, antara lain nutrisi dalam media pertumbuhannya. Mikroalga P. cruentum umumnya ditumbuhkan dalam media Becker (Becker 1994) yang harganya relatif mahal. Larastri (2006) melaporkan bahwa substrat biocrete yang ditambah pupuk (NPSi) dengan konsentrasi P sebesar 0,2 ppm menghasilkan biomassa mikroalga Cyclotella tertinggi. Setyaningsih (2010) melaporkan bahwa Chaetoceros gracilis dalam media NPSi memiliki aktivitas antibakteri yang dapat menghambat bakteri Gram positif dan negatif.
Penelitian ini menggunakan media pupuk dan modifikasi media Becker sebagai media alternatif dalam menumbuhkan P. cruentum. Data mengenai pertumbuhan P. cruentum dalam media tersebut belum diketahui sehingga perlu kajian lebih lanjut mengenai pola pertumbuhan dan aktivitas antibakteri yang dihasilkan.
1.2 Tujuan
Tujuan dari penelitian ini yaitu:
1) Menentukkan pola pertumbuhan Porphyridium cruentum menggunakan modifikasi media Becker dan media pupuk.
2 TINJAUAN PUSTAKA
2.1 Deskripsi dan Klasifikasi Porphyridium cruentum
Porphyridium cruentum adalah mikroalga merah bersel satu yang termasuk kelas Rhodophyceae, hidup bebas atau berkoloni yang terikat dalam mucilago. Senyawa mucilago dieksresikan secara konstan oleh sel membentuk sebuah kapsul yang mengelilingi sel. Mucilago merupakan polisakarida sulfat yang bersifat larut dalam air (Borowitzka dan Borowitzka 1988).
Klasifikasi biologi P. cruentum (Vonshak 1988) adalah sebagai berikut: Divisi : Rhodophyta
Sub kelas : Bangiophyceae Ordo : Porphyridiales Famili : Porphyriceae Genus : Porphyridium
Spesies : Porphyridium cruentum
Alga merah (rhodophytes) umumnya ditemukan pada habitat laut, namun beberapa spesies ditemukan di air tawar dan daerah terestrial. Alga bersifat fototrofik dan mengandung klorofil a, hal ini perlu mendapat perhatian khusus dimana kloroplasnya tidak memiliki klorofil b dan mengandung fikobiliprotein, pigmen utama pada pemanenan sianobakteria. Warna merah dari sebagian besar alga merah bersumber dari fikoeritrin yang merupakan pigmen tambahan yang menutupi warna hijau klorofil. Habitat dengan kedalaman yang semakin besar menghasilkan fikoeritrin yang lebih besar dimana penetrasi cahaya berkurang dan akan berwarna merah gelap. Kedalaman habitat yang dangkal akan menyebabkan kadar fikoeritrin yang diproduksi menjadi lebih sedikit dan akan tampak berwarna hijau (Madigan et al. 2009).
Gambar 1 Morfologi Porphyridium cruentum.
Komposisi biomassa P. cruentum yaitu 32,1% (w/w) karbohidrat dan
34,1% protein kasar. Kandungan mineral dalam 100 g biomassa kering: Ca (4960 mg), K (1190 mg), Na (1130 mg), Mg (629 mg), Zn (373 mg).
Kandungan asam lemak terdiri dari 1,6% untuk 16:0; 0,4% untuk 18:2ώ6; 1,3 %, 20:4ώ6; 1,3% untuk 20:5ώ3. Biomassa P. cruentum mengandung pigmen berupa fikoeritrin dengan karakteristiknya berwarna merah. Biomassa juga mengandung tokoferol, vitamin K, dan karoten (Fuentes et al. 2000).
Porphyridium dapat hidup di berbagai habitat alam seperti air laut, air tawar, maupun pada permukaan tanah yang lembab dan membentuk lapisan kemerah-merahan yang sangat menarik. Habitat asli dari P. cruentum diduga berasal dari laut karena dapat hidup dengan baik pada media cair maupun media padat air laut. Sel P. cruentum dapat menghasilkan metabolit-metabolit yang aktif secara biologi seperti antibiotik. Kelompok senyawa kimia utama yang merupakan antibakteri adalah fenol, fenolat, alkohol, halogen, logam berat, detergen, aldehid, dan gas kemosterilisator (Borowitzka dan Borowitzka 1988).
5
2.2 Bakteri Patogen
Bakteri patogen merupakan bakteri yang menyebabkan penyakit pada manusia, hewan, dan juga pada tumbuhan (Pelczar dan Chan 2005). Beberapa jenis bakteri patogen yang umum menjadi penyebab masalah kesehatan manusia, yaitu Staphylococcus aureus, Staphylococcus epidermidis, Bacillus subtilis, Bacillus cereus, dan Escherichia coli.
2.2.1 Staphylococcus aureus
Staphylococcus aureus merupakan bakteri Gram-positif penyebab infeksi (membentuk nanah) dan bersifat toksik bagi manusia. Hal ini menyebabkan berbagai masalah pada kulit seperti bisul, hordeolum, bahkan masalah serius seperti pneumonia, mastitis, meningitis, dan infeksi saluran kemih. S. aureus merupakan penyebab utama infeksi di rumah sakit (nosokomial) yang berasal dari infeksi luka bedah dan infeksi yang terkait dengan perangkat medis yang digunakan. S. aureus penyebab keracunan makanan dengan melepaskan enterotoksin pada makanan dan menimbulkan efek yang disebut toxic shock syndrome (Todar 2011).
Enterotoksin yang bersifat tahan panas ini dikeluarkan pada bahan pangan yang terkontaminasi S. aureus. Makanan yang mengandung toksin apabila masuk pencernaan manusia akan menimbulkan efek muntah-muntah, mual, dan diare setelah 1-6 jam (Madigan et al. 2009). Pertumbuhan bakteri ini dalam makanan dapat terjadi jika makanan disimpan pada suhu ruang dalam waktu yang lama (Salyers dan Whitt 1994). Rahayu (1999) menyatakan bahwa S. aureus merupakan mikroflora normal pada permukaan tubuh, rambut, mulut, dan tenggorokan. Bakteri S. aureus yang mencemari makanan terjadi akibat kurangnya tingkat higienis dalam penanganan pangan.
2.2.2 Staphylococcus epidermidis
aksila, perineum, lengan, kaki, dan jaringan di antara jari kaki. S. epidermidis memiliki adhesin yang terkait dengan patogenesis penyebab infeksi kulit (Wilson 2005).
2.2.3 Bacillus subtilis
Bacillus subtilis merupakan bakteri Gram-positif, uniseluler yang berbentuk batang dan hidup secara aerob. Bakteri ini membentuk tipe khusus saat dorman yang disebut endospora. Endospora terbentuk dari sel vegetatif sebagai respon terhadap lingkungan yang ekstrim. B. subtilis tumbuh pada makanan dengan pH lebih dari 4 dengan kondisi aerob. Hal yang sering terjadi yaitu terbentuknya lendir pada makanan (Todar 2011).
2.2.4 Bacillus cereus
Bacillus cereus merupakan bakteri Gram-positif, membentuk spora, bersifat aerobik atau anaerobik fakultatif. Penyebaran B. cereus sangat luas termasuk makanan yang menyebabkan keracunan makanan. Keracunan makanan yang diakibatkan B. cereus menyebabkan efek diare dan muntah. Terdapat dua tipe efek keracunan makanan akibat B. cereus yaitu, tipe penyebab diare dengan periode inkubasi selama 8-16 jam, dan tipe penyebab efek muntah dengan periode inkubasi selama 1-5 jam (Shinagawa 1990).
2.2.5 Escherichia coli
Escherichia coli hidup dalam saluran pencernaan manusia dan organisme lainnya. Penyakit pada manusia akibat E. coli terjadi ketika adanya kontaminasi dari air yang digunakan. Infeksi E. coli juga dapat terjadi karena memakan makanan yang belum matang, kontaminasi pada daging, maupun pada susu yang belum dipasturisasi (Belk dan Maier 2010).
7
ETEC menyebabkan diare, demam ringan, keram perut, dan mual. ETEC membutuhkan waktu 8-44 jam untuk menyebabkan gejala tersebut, dan gejala ini berlangsung selama 3-19 hari. EPEC menimbulkan gejala diare, demam, muntah, dan keram perut. EPEC membutuhkan waktu selama 17-72 jam untuk menimbulkan gejala penyakit, dan gejala tersebut berlangsung selama 6 jam hingga 3 hari. EIEC menyebabkan diare berlebih atau disentri, meriang, sakit kepala, nyeri otot, dan keram perut. Waktu yang diperlukan EIEC untuk menginvasi adalah 8-24 jam, dan menyebabkan efek gejala penyakit berhari-hari hingga mingguan. EHEC menyebabkan diare disertai darah, muntah, bahkan hingga kematian. EHEC menggunakan waktu selama 3-9 hari sehingga menimbulkan gejala penyakit, dan gejala berlangsung 2-9 hari. EAEC menyebabkan diare disertai lendir dimana biasanya tidak disertai darah maupun demam. Penyakit akibat EAEC ini umumnya terjadi pada negara berkembang (Percival et al. 2004).
2.3 Antibakteri
Senyawa antimikroba merupakan senyawa alami maupun kimia sintetik yang dapat membunuh atau menghambat pertumbuhan mikroorganisme. Senyawa yang dapat membunuh organisme (bakteri) disebut bakterisidal. Bahan kimia yang tidak membunuh namun dapat menghambat pertumbuhan organisme (bakteri) disebut bakteriostatik (Madigan et al. 2009).
molekul protein dan asam nukleat, menghambat kerja enzim, serta menghambat sintesis asam nukleat dan protein (Pelczar dan Chan 2005).
Respon tiap mikroorganisme terhadap antimikroba berbeda-beda. Bakteri memiliki tingkat sensitivitas yang berbeda dimana umumnya bakteri Gram-positif lebih rentan dibandingkan dengan bakteri Gram-negatif yang secara alami lebih resisten. Target penting antibiotik terhadap bakteri yaitu ribosom, dinding sel, membran sitoplasma, enzim biosintesis lemak, serta replikasi, dan transkripsi DNA (Madigan et al. 2009).
Suatu zat aktif dikatakan memiliki potensi yang tinggi sebagai antibakteri jika pada konsentrasi rendah mempunyai daya hambat yang besar. Kriteria kekuatan antibakteri menurut Nazri et al. (2011) adalah sebagai berikut.
Diameter zona hambat 15-20 mm : Daya hambat kuat Diameter zona hambat 10-14 mm : Daya hambat sedang Diameter zona hambat 0-9 mm : Daya hambat lemah
2.4 Isolasi Komponen Aktif Antibakteri
Komponen aktif antibakteri dapat diisolasi melalui proses ekstraksi. Berk (2009) menyatakan bahwa ekstraksi adalah suatu proses pemisahan komponen yang diinginkan dari suatu bahan. Isolasi komponen aktif dari suatu bahan dapat dibedakan menjadi dua kelas berdasarkan proses pemisahan komponen aktifnya, yaitu :
Ekstraksi padatan-cairan (Solid-liquid extraction) yaitu proses ekstraksi yang memisahkan komponen dari suatu bahan pada fase padat menggunakan bantuan pelarut. Contoh : ekstraksi garam dari bebatuan menggunakan air sebagai pelarut, ekstraksi larutan kopi dari gilingan biji kopi dalam produksi ekstrak biji kopi, ekstraksi minyak dari biji-bijian yang mengandung minyak, ekstraksi protein dari dari kedelai dalam produksi protein kedelai (isolated soybean protein), dan sebagainya.
9
Isolasi komponen antibakteri dari mikroalga P. cruentum pada penelitian ini dilakukan menggunakan metode ektraksi padatan-cairan (Solid-liquid extraction). Berk (2009) menyatakan bahwa ekstraksi padatan-cairan ini dapat dilakukan dengan cara bertingkat yakni menggunakan berbagai pelarut dengan
tingkat kepolaran yang berbeda, baik secara berkelanjutan (kontinu) maupun semi-kontinu.
Ekstraksi bertingkat atau ekstraksi bertahap merupakan ekstraksi yang dilakukan beberapa kali dengan jenis pelarut berbeda. Ekstraksi ini menggunakan pelarut yang lebih sedikit dan hasilnya akan lebih efektif dibandingkan ekstraksi satu kali dengan semua pelarut sekaligus (Nur dan Adijuwana 1987).
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada Februari hingga Agustus 2011. Tempat pelaksanaan penelitian adalah Laboratorium Bioteknologi Hasil Perairan dan Laboratorium Mikrobiologi Hasil Perairan, Departemen Teknologi Hasil Perairan; Laboratorium Molekular Bioteknologi, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan; Unit Pelayanan Mikrobiologi Terpadu bagian Mikrobiologi Medik, Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
3.2 Bahan dan Alat Penelitian
Bahan-bahan yang digunakan dalam penelitian meliputi mikroalga Porphyridium cruentum, air laut, media Becker (NaCl, MgSO4, MgCl2, CaCl2, KNO3, KH2PO4, NaHCO3, Tris HCl, FeCl3 dan EDTA tanpa trace element), media pupuk (NPK, TSP, vitamin, FeCl3 dan EDTA), etanol, diklorometan, akuades, NaOH 0,5 N; HCl 8 N; NA (Nutrient Agar) dan NB (Nutrient broth), MHA (Mueller Hinton Agar), antibiotik kloramfenikol, dan biakan bakteri (Staphylococcus aureus, Staphylococcus epidermidis, Bacillus subtilis, Bacillus cereus, Escherichia coli). Mikroalga P. cruentum yang digunakan diperoleh dari koleksi mikroalga Laboratorium Bioteknologi Teknologi Hasil Perairan, Institut Pertanian Bogor.
Alat-alat yang digunakan, yaitu lampu UV, toples kaca, aerator, selang plastik, lemari pendingin, mikroskop, hemositometer, pipet volumetrik, mikropipet, refraktometer, magnetic stirer, rotary evaporator, sentrifuse, freeze dryer, spektrofotometer, water bath shaker, jangka sorong, dan inkubator.
3.3 Metode Penelitian
11
bakteri Gram-negatif yakni E. coli. Diagram alir pelaksanaan penelitian disajikan pada Gambar 2.
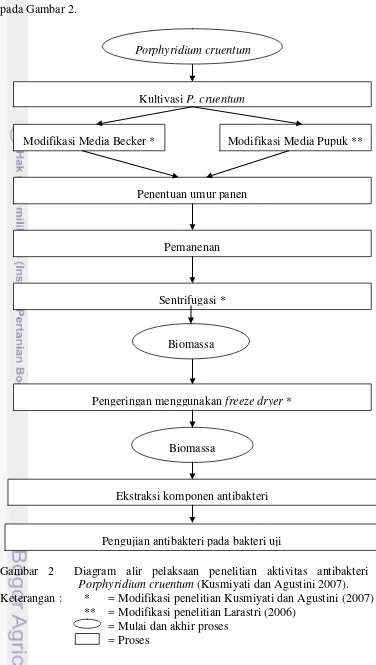
Gambar 2 Diagram alir pelaksaan penelitian aktivitas antibakteri dari Porphyridium cruentum (Kusmiyati dan Agustini 2007).
Keterangan : * = Modifikasi penelitian Kusmiyati dan Agustini (2007) ** = Modifikasi penelitian Larastri (2006)
= Mulai dan akhir proses = Proses
Ekstraksi komponen antibakteri Porphyridium cruentum
Kultivasi P. cruentum
Penentuan umur panen
Pemanenan
Modifikasi Media Becker * Modifikasi Media Pupuk **
Sentrifugasi *
Pengeringan menggunakan freeze dryer *
Biomassa
3.3.1 Kultivasi Porphyridium cruentum
P. cruentum dikultivasi menggunakan dua media berbeda, yaitu modifikasi media Becker dan media pupuk. Media kultivasi dalam modifikasi media Becker (Becker 1994), yaitu natrium klorida (27 g/L), magnesium sulfat heptahidrat (6,6 g/L), magnesium klorida heksahidrat (5,6 g/L), kalsium klorida dihidrat (1,5 g/L), kalium nitrat (1 g/L), kalium dihidrogen fosfat (0,07 g/L), natrium bikarbonat (0,04 g/L), tris hidroklorida (20 mL/L), campuran larutan besi (III) klorida dan etilen diamin tetra asetat (EDTA) dengan modifikasi tanpa penambahan trace element. Media pupuk modifikasi Larastri (2006) yaitu NPK (3 mL/L), TSP (1 mL/L), vitamin (1 mL/L), dan campuran larutan besi (III) klorida dan etilen diamin tetra asetat (EDTA) (1 mL/L).
3.3.2 Perhitungan jumlah sel (Hadioetomo 1993)
Pertumbuhan P. cruentum diamati dengan mengambil sampel setiap hari menggunakan mikropipet, kemudian dimasukkan ke dalam chamber hemositometer dan dihitung jumlah sel secara langsung menggunakan mikroskop. Hasil perhitungan nilainya dikonversikan ke dalam nilai logaritmik dan dibuat kurva pertumbuhan dengan jumlah sel (logaritmik) sebagai sumbu y dan waktu (hari) sebagai sumbu x. Proses perhitungan jumlah sel ini dengan metode hitung langsung sebagai berikut :
1) Permukaan hitung hemositometer dan kaca penutup dibersihkan dari sisa kotoran.
2) Tutup kaca hemositometer diletakkan pada permukaan hemositometer. Suspensi biakan P. cruentum hasil pengambilan sampel dikocok, kemudian diambil dengan mikropipet sebanyak 20 µL. Suspensi tersebut diteteskan pada tempat menaruh sampel yang terdapat pada hemositometer hingga suspensi P. cruentum menyebar pada ruang hitung.
13
Formulasi yang dipakai dalam menghitung kepadatan sel adalah sebagai berikut :
Keterangan :
N = kepadatan sel (sel/mL)
N1 = jumlah sel dalam 80 kotak kecil ke-1 N2 = jumlah sel dalam 80 kotak kecil ke-2 1 mm = panjang hemositometer dalam 80 kotak 0,2 mm = lebar hemositometer dalam 80 kotak 0,1 mm = tinggi hemositometer dalam 80 kotak
Hasil perhitungan diplotkan pada grafik hingga diperoleh kurva pertumbuhan dengan umur kultur (hari) sebagai sumbu x dan log kepadatan sel (sel/mL) sebagai sumbu y.
3.3.3 Pemanenan biomassa (Kusmiyati dan Agustini 2007)
Pemanenan dilakukan pada fase awal stasioner dilihat dari masing-masing kurva pertumbuhan. Pemanenan P. cruentum dilakukan dengan pengendapan selama 10 hari di dalam lemari pendingin dengan suhu chilling 4 oC kemudian disentrifugasi pada kecepatan 10000 rpm. Biomassa basah yang diperoleh kemudian dikeringkan menggunakan freeze dryer selama 6 jam. Hasil dari proses pengeringan ini diperoleh biomassa kering P. cruentum.
3.3.4 Ekstraksi senyawa antibakteri (Kusmiyati dan Agustini 2007, dan Naviner et al. 1999)
Sejumlah 5 g biomassa mikroalga disuspensikan dalam 30 ml etanol 96%, kemudian diaduk selama 30 menit dan disentrifugasi dengan kecepatan 4000 rpm selama 15 menit. Pekerjaan tersebut diulangi 5 kali. Filtrat hasil sentrifugasi dikumpulkan dan diuapkan menggunakan rotary evaporator pada suhu 37 ºC. Residu ditambah 10 mL akuades dan 10 mL diklorometan. Lapisan akuades ditambah 10 mL diklorometan dan dikocok. Pekerjaan ini dilakukan tiga kali. Lapisan diklorometan dikumpulkan, kemudian dikeringkan dengan rotary evaporator pada suhu 37 ºC (ekstrak A).
Lapisan NaOH dinetralkan dengan HCl 8N. Larutan netral ini kemudian ditambahkan dengan 20 mL diklorometan dan dikocok. Lapisan diklorometan dipisahkan dan lapisan NaOH ditambah dengan 20 mL diklorometan lagi dan dikocok. Pekerjaan ini dilakukan enam kali. Lapisan diklorometan yang telah dipisahkan tadi, kemudian kumpulkan dan dikeringkan menggunakan rotary evaporator pada suhu 37 ºC (ekstrak B). Ekstrak B inilah yang akan diuji aktivitas antibakteri pada berbagai jenis bakteri patogen.
3.3.5 Analisis aktivitas antibakteri
Pengujian aktivitas antibakteri dari P. cruentum melalui beberapa tahap, yaitu persiapan bakteri melalui peremajaan bakteri, pewarnaan Gram, dan kultivasi bakteri uji. Kondisi kultur bakteri yang telah disiapkan sebagai bakteri uji kemudian dilakukan pengujian aktivitas antibakteri menggunakan teknik difusi sumur agar (agar well diffusion).
Peremajaan bakteri uji
Media yang digunakan adalah NA (Nutrient Agar) dengan komposisi: Ektrak daging 1%, pepton 1%, dan agar 1,5%. Media dilarutkan dalam akuades dan dipanaskan hingga larut sempurna, lalu dimasukkan ke dalam tabung reaksi sebanyak 4 mL dan disterilkan dalam autoklaf pada suhu 121 ºC, tekanan 1 atm selama 15 menit. Setelah steril, tabung dimiringkan dan didiamkan hingga memadat. Sejumlah 1 ose stok bakteri (S. aureus, S. epidermidis, B. subtilis, B. cereus, dan E. coli) diinokulasi ke dalam media regenerasi kemudian diinkubasi pada suhu 37ºC selama 24 jam.
Pewarnaan Gram (Hadioetomo 1993)
15
bakteri tadi lalu didiamkan selama 30 detik, kemudian bilas dengan akuades dan keringkan. Hasil pewarnaan Gram kemudian diamati di bawah mikroskop.
Kultivasi bakteri uji (Setyaningsih 2010)
Bakteri (S. aureus, S. epidermidis, B. subtilis, B. cereus, dan E. coli) yang segar diinokulasikan sebanyak 1 ose ke dalam media NB, diinkubasi pada suhu 37 °C dalam water-bath shaker selama 18-24 jam. Kultur bakteri diukur kekeruhannya secara turbidimetri dengan menggunakan spektrofotometer UV-VIS pada panjang gelombang 600 nm hingga mencapai OD lebih dari 0,5.
Pengujian aktivitas senyawa antibakteri P. cruentum terhadap bakteri uji (Holo et al. 1991)
Pengujian dilakukan dengan menggunakan teknik difusi sumur agar (agar well diffusion). Sampel antibakteri merupakan senyawa aktif hasil proses ekstraksi bertingkat dari kultur mikroalga P. cruentum. Proses pengujian menggunakan teknik difusi sumur agar (agar well diffusion) adalah sebagai berikut: bakteri (S. aureus, S. epidermidis, B. subtilis, B. cereus, E. coli) yang telah disiapkan, masing-masing dimasukkan ke dalam media MHA steril.
Media MHA yang mengandung bakteri uji dihomogenisasi menggunakan
4.1 Kultivasi Porphyridium cruentum
Salah satu faktor lingkungan yang penting dalam kultivasi mikroalga
adalah cahaya. Cahaya merupakan faktor utama dalam fotosintesis (Arad dan Richmond 2004). Kultivasi P. cruentum pada penelitian ini
menggunakan intensitas cahaya 1900-2400 lux. Intensitas cahaya berpengaruh terhadap pertumbuhan sel yang dihasilkan. Pertumbuhan yang optimum akan menghasilkan jumlah sel yang optimum pula dan hal ini akan berpengaruh terhadap jumlah biomassa P. cruentum yang dihasilkan.
Intensitas cahaya pada rentang 1900-2400 lux mendekati intensitas cahaya yang optimal bagi pertumbuhan P. cruentum. Kusumawarni (1998) melaporkan bahwa pertumbuhan sel P. cruentum tertinggi dengan warna merah terbaik pada
kultivasi diperoleh pada pemberian intensitas cahaya 2000 lux. Kultivasi P. cruentum disajikan pada Gambar 3.
Gambar 3 Kultivasi Porphyridium cruentum skala laboratorium.
Suhu yang digunakan saat proses kultivasi berkisar antara 25-27 oC dan kelembaban udara 65-75 %. Suhu saat kultivasi berada pada kisaran suhu pertumbuhan bagi P. cruentum. Vonshak (1988) menyatakan bahwa sel Porphyridium dapat tumbuh pada kisaran suhu 10-35 °C dan aktivitas optimum fotosintesis dari kultur P. cruentum terjadi pada suhu 25 °C.
17
KNO3, KH2PO4, NaHCO3, Tris-HCl, Fe-EDTA, dengan modifikasi tanpa pemberian trace element. Media pupuk yang digunakan terdiri dari NPK, TSP, vitamin, dan Fe-EDTA. Proses kultivasi hanya menggunakan nutrien awal yang diberikan dalam media masing-masing tanpa penambahan nutrien selama kultivasi berlangsung. Kurva pertumbuhan yang dihasilkan dari masing-masing media disajikan pada Gambar 4.
(1) Kultivasi dalam modifikasi media Becker
(2) Kultivasi dalam media pupuk
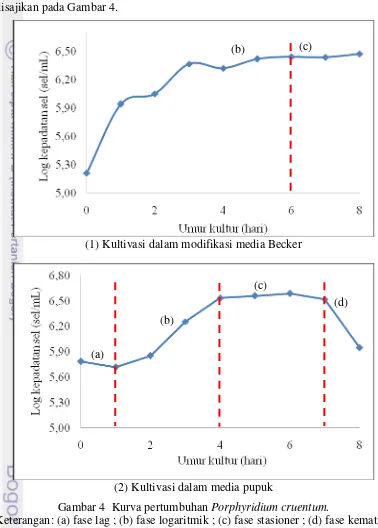
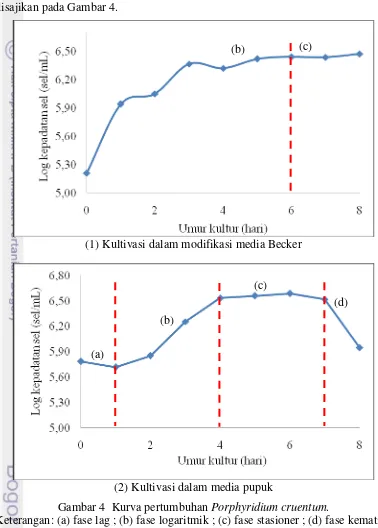
Gambar 4 Kurva pertumbuhan Porphyridium cruentum.
Keterangan: (a) fase lag ; (b) fase logaritmik ; (c) fase stasioner ; (d) fase kematian
(b) (c)
(a)
(b)
(c)
Kultivasi P. cruentum dalam modifikasi media Becker maupun media pupuk menggunakan inokulum dari media Becker (dilengkapi trace element) berumur 6 hari. Kurva pertumbuhan kultur P. cruentum dalam modifikasi media Becker menunjukkan keberlangsungan hidup yang lebih panjang daripada media pupuk. Gambar 4 menampilkan kurva pertumbuhan P. cruentum dalam media Becker (1) memasuki fase stasioner pada hari ke-6 dengan log kepadatan sel sebesar 6,44-6,47 sel/mL hingga akhir pengamatan hari ke-8, sedangkan dalam media pupuk (2) mengalami fase stasioner (c) pada hari ke-4 kemudian memasuki fase kematian (d) pada hari ke-7 dengan jumlah sel menurun yang ditunjukkan oleh log kepadatan sel sebesar 5,95 sel/mL saat akhir pengamatan pada hari ke-8.
Kultur P. cruentum dalam modifikasi media Becker tidak teramati fase adaptasi yang terjadi, namun mengalami fase logaritmik hingga hari ke-6 kemudian memasuki fase stasioner. Kultur mengalami pertumbuhan yang ditunjukkan pada Gambar 4 (1) dengan peningkatan log kepadatan sel dari 5,21-6,44 sel/mL hingga hari ke-6. Hari selanjutnya, sel tidak mengalami pertumbuhan yang signifikan dimana log kepadatan sel berada pada kisaran 6,44-6,47 sel/mL hingga pengamatan hari ke-8.
19
terjadi penurunan log kepadatan sel hingga akhir pengamatan hari ke-8 yaitu mencapai 5,95 sel/mL.
Perbedaan pola pertumbuhan P. cruentum pada penelitian ini terjadi karena perbedaan media, yaitu modifikasi media Becker dan pupuk. Kultur dalam modifikasi media Becker tidak teramati fase adaptasi melainkan membentuk pola pertumbuhan yang langsung memasuki fase logaritmik, sedangkan kultur dalam media pupuk mengalami adaptasi dari hasil pengamatan dengan rentang waktu satu hari. Fase adaptasi dapat terjadi akibat adanya pergantian media atau kondisi kultivasi (Lee dan Shen 2004). Hal ini terjadi karena inokulum awal yang digunakan, yaitu menggunakan media Becker dimana komposisinya relatif sama dengan modifikasi media Becker yang digunakan pada penelitian ini sehingga adaptasi berlangsung sangat cepat dan tidak teramati saat pengamatan per hari, sedangkan media pupuk hanya terdiri dari 4 nutrien yaitu NPK, TSP, vitamin, dan FeCl3-EDTA sehingga mengalami fase adaptasi lebih lama dalam pertumbuhannya. Kusmiyati dan Agustini (2007) menyatakan bahwa stok (inokulum) awal yang digunakan berpengaruh terhadap fase yang dialami kultur saat proses kultivasi. Inokulum pada fase logaritmik menyebabkan kultur cepat melanjutkan perbanyakan sel tanpa adaptasi terlalu lama.
Umur kultur dalam modifikasi media Becker lebih panjang daripada media pupuk. Komposisi nutrien dalam media pupuk belum optimal bagi pertumbuhan P. cruentum sehingga kultur dalam media pupuk mengalami siklus hidup lebih pendek. Nutrien berperan dalam pertumbuhan sel sehingga ketika tidak dilakukan penambahan nutrien maka ketersediaan nutrien dalam kultur akan semakin sedikit. Nutrien menjadi faktor pembatas sehingga menyebabkan kompetisi dalam pertumbuhan sel. Fogg dan Thake (1987) menyatakan bahwa jumlah sel yang semakin bertambah menyebabkan kepadatan sel meningkat dan penetrasi cahaya menjadi berkurang, sehingga menyebabkan pertumbuhan sel menjadi terhambat bahkan sel mengalami kematian.
pertumbuhan P. cruentum. Borowitzka dan Borowitzka (1988) menyatakan bahwa P. cruentum dapat tumbuh dengan baik pada kisaran pH 5,2-8,3 dengan derajat keasaman (pH) optimum untuk fotosintesis, yaitu 7,5.
Salinitas air laut yang digunakan pada kultivasi P. cruentum sebesar 3% yang diukur menggunakan alat refraktometer. Kultur P. cruentum dalam modifikasi media Becker memiliki salinitas sebesar 7,4% sedangkan dalam media pupuk sebesar 4,0%. Salinitas dari media Becker maupun media pupuk ini lebih besar dibandingkan dengan salinitas air laut yang digunakan. Pengaruh penambahan nutrien mengakibatkan terbentuknya garam dalam media sehingga menyebabkan salinitas meningkat. Kultur dengan media Becker memiliki salinitas yang sangat tinggi yakni lebih dari dua kali dari salinitas air laut, namun kultur tetap dapat tumbuh. Borowitzka dan Borowitzka (1988) menyatakan bahwa Porphyridium dapat bertahan hidup pada kisaran salinitas yang cukup besar, yaitu 0,5-2 kali konsentrasi air laut (3,5%). Richmond (1988) menjelaskan bahwa salinitas media Becker P. cruentum pada kisaran 3,5-4,5% dapat memacu pertumbuhan yang optimal namun salinitas 4,6% tidak menghambat proses pertumbuhan, sedangkan pada kondisi salinitas kurang dari 3,5%, Porphyridium tidak mampu bersaing hidup dengan mikroalga lainnya jika ditumbuhkan pada kultur terbuka.
4.2 Pemanenan Biomassa Porphyridium cruentum
Tahap pemanenan pada penelitian ini diawali dengan tahap pengendapan sebelum dilakukan sentrifugasi untuk mengurangi biaya dalam pemanenan biomassa. Umumnya pemisahan biomassa P. cruentum dilakukan melalui sentrifugasi untuk mendapatkan sejumlah biomassa dari suatu kultur, namun dengan adanya tahapan pengendapan akan mengefisienkan proses pemanenan sehingga biaya pemanenan dapat ditekan. Kapasitas sentrifugasi yang sama akan menghasilkan jumlah biomassa basah yang lebih banyak bila melalui tahap pengendapan terlebih dahulu karena biomassa dalam cairan yang disentrifugasi telah terkonsentrasi dari jumlah kultur yang lebih banyak sehingga proses pemanenan menjadi lebih efisien.
21
Lemari pendingin menjaga kultur agar tidak mengalami pertumbuhan lebih lanjut setelah pemanenan sebab dalam lemari pendingin tercipta kondisi gelap dan dingin selama proses pengendapan berlangsung. Kultur dipanen pada fase stasioner, yaitu dalam modifikasi media Becker dipanen pada umur 7 hari, sedangkan kultur dalam media pupuk dipanen pada umur 4 hari. Proses pengendapan membentuk 2 lapisan, yakni lapisan biomassa di bagian bawah dan lapisan cairan media di bagian atas. Hasil pengendapan kultur P. cruentum ini dapat dilihat pada Gambar 5.
(a) (b)
Gambar 5 Pemanenan biomassa Porphyridium cruentum (a) kultur awal panen ; (b) kultur setelah pengendapan 10 hari.
Hasil pengendapan biomassa ini kemudian dikumpulkan dan langsung disentrifugasi menggunakan sentrifuse dingin dengan suhu 4 oC dan kecepatan 10000 rpm selama 15 menit. Proses sentrifugasi ini menyebabkan biomassa terpadatkan pada dasar tabung sehingga mempermudah dalam pemisahan biomassa P. cruentum. Biomassa yang telah terkumpul kemudian dilakukan pengeringan untuk mengurangi kadar air menggunakan freeze dryer selama 6 jam. Biomassa P. cruentum basah dan kering yang diperoleh dapat dilihat pada Gambar 6.
(a) (b)
Aplikasi komersial pertama yang dilakukan melalui freeze drying dalam metode pengeringan adalah bidang industri pharmaceutical (antibiotik, sel, plasma darah) (Berk 2009). Pengeringan dilakukan dengan menggunakan freeze dryer pada suhu rendah dan tekanan terkontrol, sehingga dapat mempertahankan komponen aktif yang ada pada biomassa P. cruentum agar tidak mengalami kerusakan akibat suhu tinggi. Suhu tinggi menyebabkan kerusakan komponen bioaktif dari suatu bahan. Hal ini sesuai dengan Yuan et al. (2011) yang menjelaskan bahwa suhu tinggi dapat menyebabkan kerusakan komponen bioaktif diantaranya terjadi penurunan akumulasi komponen flavonoid baicalin dan baicalein pada Scutellaria baicalensis seiring dengan meningkatnya perlakuan suhu yang digunakan yaitu 25 oC dan 40 oC. Jumlah baicalin dengan perlakuan suhu 40 oC mengalami penurunan hingga 43% pada hari ke-22, sedangkan baicalein pada perlakuan suhu 40 oC tidak terdeteksi pada HPLC.
4.3 Ekstraksi Senyawa Antibakteri
Ekstraksi adalah suatu proses pemisahan komponen yang diinginkan dari suatu bahan (Berk 2009). Metode ekstraksi yang digunakan mengacu pada Kusmiyati dan Agustini (2007) dan Naviner et al. (1999). Komponen antibakteri yang ingin dipisahkan dari mikroalga P. cruentum ini diperoleh melalui ekstraksi bertingkat menggunakan pelarut dengan tingkat kepolaran yang berbeda. Pelarut yang berbeda ini digunakan untuk mendapatkan ekstrak yang lebih murni sehingga komponen antibakteri terbebas dari komponen lain yang dapat mengganggu dalam pengujian aktivitasnya.
23
Rendemen ekstrak etanol dari biomassa yang dikultivasi dalam media Becker adalah 18,2%, yakni sebanyak 0,91 gram, sedangkan biomassa dari kultur dalam media pupuk hanya menghasilkan rendemen sebesar 2,8%, yakni sebanyak 0,14 gram.
Hasil ekstrak dari kultur dalam media pupuk tidak dilanjutkan ekstraksi dan pengujian aktivitas antibakteri karena jumlah rendemen yang terlalu kecil sehingga tidak memungkinkan untuk diteruskan menuju tahapan selanjutnya. Rendemen ekstrak kasar dari kultur dalam media pupuk jauh lebih sedikit dibandingkan rendemen kultur dengan modifikasi Becker. Hal ini diduga karena adanya tepung pengisi (filler) dalam pupuk sehingga kebutuhan nutrien belum terpenuhi.
Sifat pupuk mudah larut dalam air terkait dengan fungsinya sebagai pelengkap unsur hara yang dibutuhkan tanaman menyebabkan nutrien dalam pupuk lebih cepat terlarut dan dimanfaatkan dalam pertumbuhan P. cruentum. Rosmarkam dan Yuwono (2002) menyatakan bahwa pemberian pengisi (filler) pada pupuk bertujuan agar pupuk dengan kadar tinggi memiliki ratio fertilizer tepat sesuai dengan keinginan dan mempermudah penggunaannya agar lebih merata sebagai pupuk pada tanaman terestrial.
Komponen pengisi ini juga dapat menghambat pertumbuhan dalam proses kultivasi karena tepung pengisi akan meningkatkan kepadatan partikel dalam kultur sehingga menyebabkan umur kultur dalam media pupuk lebih singkat. Kematian sel lebih cepat terjadi karena terhalangnya penetrasi cahaya sebagai faktor penting dalam pertumbuhan sel. Fogg dan Thake (1987) menyatakan bahwa kepadatan sel yang meningkat akan mengakibatkan terhambatnya penetrasi cahaya sehingga menghambat pertumbuhan sel bahkan lama-kelamaan akan mengakibatkan kematian sel.
15 menit sehingga diperoleh ekstrak P. cruentum dalam larutan diklorometan. Ekstrak dalam campuran diklorometan ini kemudian dipisahkan melalui proses evaporasi. Rendemen hasil ekstraksi diklorometan dan air adalah 3,4%, yakni sebanyak 0,17 gram.
Tahap ekstraksi akhir menggunakan pelarut diklorometan dengan penambahan NaOH 0,5N. Pelarut NaOH bersifat alkali dimana pelarut alkali digunakan untuk mengekstrak secara langsung komponen lipid dari biomassa mikroalga (Grima et al. 2004). Larutan NaOH dipisahkan dan dilakukan penetralan menggunakan HCl 8N agar NaOH habis bereaksi dengan HCl membentuk garam. Larutan ini kemudian dilakukan penambahan diklorometan sehingga lipid terlarut dalam pelarut diklorometan, dan ekstrak dipisahkan dari pelarut diklorometan melalui proses evaporasi. Rendemen hasil ekstraksi akhir yang diperoleh adalah 1% dari 5 gram biomassa yang diekstraksi, yakni sebesar 0,05 gram ekstrak. Hasil ekstrak akhir P. cruentum sebelum evaporasi dan setelah evaporasi disajikan pada Gambar 7.
(a) (b)
Gambar 7 Ekstrak akhir Porphyridium cruentum (a) sebelum evaporasi ; (b) setelah evaporasi.
4.4 Aktivitas Antibakteri
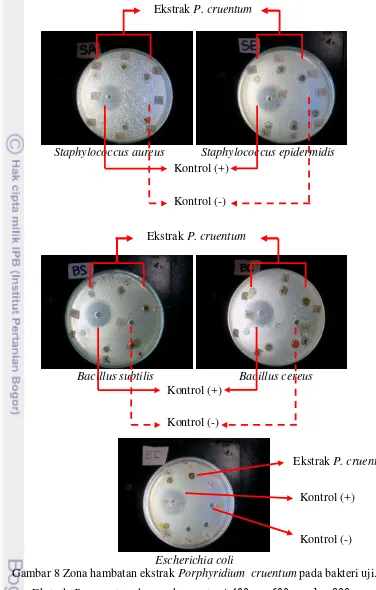
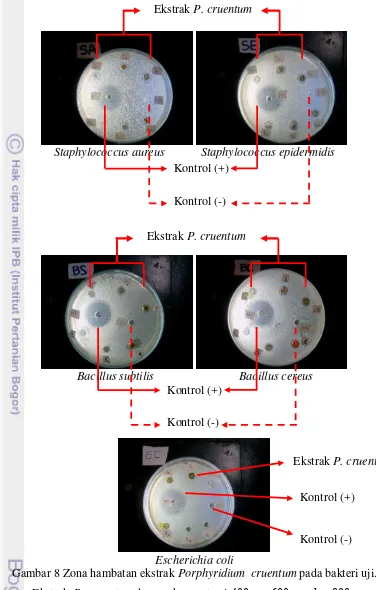
Pengujian aktivitas antibakteri dari P. cruentum dilakukan terhadap bakteri Gram-positif S. aureus, S. epidermidis, B. subtilis, B. cereus, dan bakteri Gram-negatif yakni E. coli. Hasil zona hambat ekstrak P. cruentum disajikan pada Gambar 8 dan diameter zona hambat terhadap bakteri uji pada Tabel 1.
25
namun tidak menunjukkan aktivitas antibakteri pada bakteri Gram-negatif (E.coli) pada ekstraksi bertingkat menggunakan pelarut etanol, dan pelarut diklorometan dalam berbagai kondisi, yakni diklorometan/akuades dan diklorometan/NaOH. Respon yang berbeda dari dua golongan bakteri terhadap hasil ekstraksi ini disebabkan karena adanya perbedaan kepekaan pada bakteri Gram-positif dan bakteri Gram-negatif terhadap senyawa ekstrak tersebut. Bakteri Gram-positif cenderung lebih sensitif terhadap komponen antibakteri karena struktur dinding sel bakteri Gram-positif lebih sederhana sehingga memudahkan senyawa antibakteri untuk masuk ke dalam sel dan menemukan sasaran untuk bekerja menghambat pertumbuhan sel bahkan menyebabkan kematian sel.
Jumlah ekstrak P. cruentum yang digunakan dalam pengujian aktivitas antibakteri tiap sumur yaitu 400 μg, 600 μg, dan 800 μg. Bakteri yang digunakan memiliki OD (optical density) pada rentang 0,6 sampai 0,8. Kontrol positif yang digunakan, yaitu kloramfenikol (10 μg), sedangkan kontrol negatif, yaitu diklorometan (20 μL) yang digunakan sebagai pelarut dalam ekstraksi.
Tabel 1 Diameter zona hambat ekstrak P. cruentum terhadap bakteri uji
Bahan uji Diameter zona hambat (mm)
S. aureus S. epidermidis B. subtilis B. cereus E. coli
Keterangan : (-) : Tidak dilakukan pengujian
Kusmiyati dan Agustini (2007) melaporkan semakin tinggi konsentrasi ekstrak P. cruentum menunjukkan zona hambat yang semakin besar terhadap bakteri S. aureus, B. subtilis, dan E. coli. Wesierska et al. (2005) melaporkan zona hambat semakin besar seiring dengan meningkatnya konsentrasi cystatin ayam yang digunakan pada berbagai bakteri dan salah satu bakteri uji yang digunakan adalah S. aureus. Konsentrasi (IC50) sebesar 150-200 μg cystatin/mL menghambat sebagian pertumbuhan bakteri, sedangkan konsentrasi 300-1000 μg cystatin/mL dapat menghambat seluruh pertumbuhan bakteri uji.
Kontrol negatif dan kontrol positif digunakan sebagai pembanding dalam menentukan aktivitas antibakteri dari ekstrak P. cruentum. Kontrol negatif berupa diklorometan digunakan sebagai pembanding untuk melihat pengaruh pelarut yang digunakan pada tahap ekstraksi terhadap zona hambat yang dihasilkan ekstrak. Tabel 1 menunjukkan bahwa diklorometan tidak menghasilkan zona hambat sehingga pelarut diklorometan tidak mempengaruhi hasil dari zona hambat ekstrak terhadap bakteri uji. Kontrol positif kloramfenikol memiliki zona hambat lebih besar daripada ekstrak P. cruentum.
Kloramfenikol sebagai antibiotik dengan spektrum luas yang aktif terhadap banyak bakteri Gram-positif dan Gram-negatif. Kloramfenikol relatif tidak beracun bagi mamalia bila digunakan secara terapeutik, antibiotik ini dapat menyebabkan beberapa kelainan yang gawat di dalam darah beberapa pasien. Hal ini menyebabkan anjuran pemakaiannya hanya pada kasus-kasus yang tidak dapat diobati secara efektif dengan antibiotik lain (Pelczar dan Chan 2005). Hal ini menyebabkan diameter zona hambat yang terbentuk sangat besar terhadap seluruh bakteri uji, yaitu pada kisaran 23,20-28,45 mm.
27
Staphylococcus aureus Staphylococcus epidermidis
Bacillus subtilis Bacillus cereus
Escherichia coli
Gambar 8 Zona hambatan ekstrak Porphyridium cruentum pada bakteri uji. Ekstrak P. cruentum dengan konsentrasi 400 μg, 600 μg, dan 800 μg yang digunakan menunjukkan daya hambat yang cukup baik terhadap bakteri Gram-positif namun tidak menghasilkan zona hambat pada bakteri Gram-negatif.
Kontrol (+)
Kontrol (-) Ekstrak P. cruentum
Kontrol (+)
Kontrol (-) Ekstrak P. cruentum
Ekstrak P. cruentum
Kontrol (+)
Diameter zona hambat yang diperoleh dari seluruh bakteri Gram-positif memiliki rentang nilai 1-4 mm, sehingga termasuk kategori zat yang memiliki daya hambat lemah sebagai antibakteri. Nazri et al. (2011) menyatakan bahwa senyawa antibakteri termasuk kategori lemah bila memiliki zona hambat 0-9 mm. Kusmiyati dan Agustini (2007) melaporkan bahwa ekstrak P. cruentum tidak menghasilkan aktivitas antibakteri pada bakteri Gram-negatif (E. coli) terkait dengan struktur sel Gram-negatif lebih kompleks daripada bakteri Gram-positif sehingga resisten terhadap komponen antibakteri dari ekstrak P. cruentum yang diekstrak secara bertingkat menggunakan pelarut etanol, diklorometan/akuades, dan diklorometan/NaOH.
Bakteri Gram-negatif (contoh: E. coli) memiliki struktur dinding sel berlapis dan kompleks. Dinding sel hanya memiliki 10% peptidoglikan dan sebagian besar dinding sel tersusun oleh membran luar. Lapisan membran luar terdir atas fosfolipid, protein, dan polisakarida. Lipid dan polisakarida terhubung dan membentuk struktur kompleks pada lapisan membran luar sel. Struktur dinding sel bakteri Gram-positif lebih sederhana, yaitu memiliki lapisan tunggal terdiri atas 90% peptidoglikan dan substansi lain berupa asam teikoat (Madigan et al. 2009).
5 KESIMPULAN DAN SARAN
5.1 Kesimpulan
Porphyridium cruentum dalam modifikasi media Becker (tanpa trace element) memiliki siklus hidup lebih panjang daripada dalam media pupuk. Fase pertumbuhan pada kultur P. cruentum dalam modifikasi media Becker, fase lag (adaptasi) berlangsung sangat cepat sehingga tidak teramati dan mengalami fase logaritmik hingga hari ke-6 kemudian memasuki fase stasioner, sedangkan kultur dalam media pupuk memiliki fase pertumbuhan berupa fase adaptasi (awal kultivasi hingga hari ke-1), fase logaritmik (hingga hari ke-4), fase stasioner (hingga hari ke-7), dan fase kematian (setelah hari ke-7). Rendemen hasil ekstraksi akhir P. cruentum dalam modifikasi media Becker sebesar 1%.
Ekstrak P. cruentum menghasilkan aktivitas antibakteri terhadap Staphylococcus aureus, Staphylococcus epidermidis, Bacillus subtilis, dan Bacillus cereus pada konsentrasi ekstrak 400 μg/sumur, 600 μg/sumur, dan 800 μg/sumur. Diameter zona hambat terbesar berasal dari ekstrak 800 μg pada S. epidermidis yaitu sebesar 4 mm. Semakin tinggi konsentrasi ekstrak
menghasilkan zona hambat yang semakin besar. Potensi antibakteri dari P. cruentum dalam modifikasi media Becker termasuk kategori antibakteri dengan
daya hambat lemah.
5.2 Saran
Beberapa hal yang disarankan dalam penelitian ini adalah :
Pencarian komposisi media pupuk terbaik untuk pertumbuhan optimal P. cruentum
Pengujian lebih lanjut untuk mengetahui jenis asam lemak sebagai komponen aktif dari P. cruentum yang dikultivasi dalam modifikasi media Becker
BAKTERI PATOGEN
YUNNY KOSASIH
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
RINGKASAN
YUNNY KOSASIH. C34070005. Aktivitas Komponen Antibakteri Mikroalga Porphyridium cruentum terhadap Berbagai Jenis Bakteri Patogen. Dibimbing oleh ELLA SALAMAH dan IRIANI SETYANINGSIH.
Masalah kesehatan sering terjadi akibat lingkungan yang kotor dan makanan yang tercemar mikroorganisme yang umumnya adalah golongan bakteri. Hal ini dapat diatasi dengan penggunaan senyawa antibakteri yang aman. Antibakteri yang umum beredar adalah antibakteri sintetik dimana senyawa sintetik berpotensi menimbulkan efek negatif yang dapat mengganggu kesehatan sehingga membutuhkan pencarian alternatif antibakteri alami yang aman. Porphyridium cruentum adalah mikroalga merah bersel satu yang memiliki potensi antibakteri. Media Becker sebagai media pertumbuhan yang umum digunakan dalam kultivasi P. cruentum dinilai cukup mahal sehingga perlu dilakukan pencarian alternatif media pertumbuhan. Media yang digunakan dalam penelitian ini adalah modifikasi media Becker (tanpa penambahan trace element) dan media pupuk.
Penelitian ini meliputi tiga tahap yaitu: 1) kultivasi dan pemanenan P. cruentum dalam modifikasi media Becker dan media pupuk, 2) ekstraksi
komponen antibakteri P. cruentum, dan 3) analisis aktivitas antibakteri P. cruentum terhadap bakteri Gram-positif Staphylococcus aureus, Staphylococcus epidermidis, Bacillus subtilis, Bacillus cereus, dan bakteri
Gram-negatif yakni Escherichia coli.
BAKTERI PATOGEN
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
Oleh :
YUNNY KOSASIH
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Skripsi : Aktivitas Komponen Antibakteri Mikroalga Porphyridium cruentum terhadap Berbagai Jenis Bakteri Patogen
Nama Mahasiswa : Yunny Kosasih
NRP : C34070005
Menyetujui
Pembimbing I Pembimbing II
Dra. Ella Salamah, M.Si. Dr.Ir. Iriani Setyaningsih, MS.
NIP. 19530629 198803 2 001 NIP. 19600925 198601 2 001
Mengetahui
Ketua Departemen Teknologi Hasil Perairan
Dr. Ir. Ruddy Suwandi, MS., M. Phil. NIP. 19580511 1985031 002
Dengan ini saya menyatakan bahwa skripsi saya yang berjudul “Aktivitas Komponen Antibakteri Mikroalga Porphyridium cruentum terhadap
Berbagai Jenis Bakteri Patogen” adalah hasil karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Desember 2011
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan di Samarinda pada 24 Juni 1989 sebagai anak keempat dari empat bersaudara pasangan Gunawan Kosasih (alm) dan Mieke Tjandrawati. Jenjang pendidikan penulis yaitu TK Cendrawasih Samarinda (1993-1995), SD Negeri 054 Samarinda (1995-2001), SMP Negeri 1 Samarinda (2001-2004) dan SMA Negeri 1 Samarinda (2004-2007).
Penulis diterima sebagai mahasiswi strata satu (S1) di Institut Pertanian Bogor melalui Jalur USMI (Undangan Seleksi Masuk IPB) pada tahun 2007. Selama masa perkuliahan, penulis aktif dalam Fisheries Processing Club (FPC) (2008-2010), UKM Keluarga Mahasiswa Buddhis IPB (2007-2010), UKM CUA (Chess Unity Agriculture) (2007-2008) dan Agrifarma (Unit Kebun Tanaman Obat Mahasiswa) (2008). Penulis aktif dalam kepanitian kegiatan mahasiswa di Institut Pertanian Bogor serta kegiatan sosial di Vihara Buddhasena Bogor.
Penulis menjadi presenter dalam IEEE ICAMS (International Conference on Advanced Management Science) tahun 2010 di Chengdu, China; peserta PKM (Program Kreativitas Mahasiswa) yang didanai DIKTI berturut-turut pada tahun 2009, 2010, 2011 bidang penelitian dan kewirausahaan; juara 6 dalam kejuaraan nasional catur grup antar mahasiswa se-Indonesia tahun 2008; penerima beasiswa IPB (2009-2011). Penulis aktif sebagai asisten berbagai mata kuliah, yaitu: Mikrobiologi Hasil Perairan (2010-2011), Teknologi Proses Hasil Perairan (2011), Biotoksikologi Hasil perairan (2010), Biokimia Hasil Perairan (2010), Teknologi Penanganan dan Transportasi Biota Perairan tahun ajaran (2010), Fisika Dasar untuk mahasiswa TPB (Tingkat Persiapan Bersama) tahun ajaran (2008), dan mata kuliah Agama Buddha tahun (2008). Penulis juga telah melaksanakan praktek lapangan di PT Indocitra Jaya Samudera, Bali dengan topik HACCP (Hazard Analysis Critical Control Point).
Puji dan syukur kepada Tuhan Yang Maha Esa karena berkat karuniaNya penulis dapat menyelesaikan skripsi dengan judul “Aktivitas Komponen Antibakteri Mikroalga Porphyridium cruentum terhadap Berbagai Jenis Bakteri Patogen”.
Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu penulis dalam menyelesaikan laporan ini, terutama kepada:
1) Dra. Ella Salamah, M.Si. dan Dr. Ir. Iriani Setyaningsih, MS. selaku dosen pembimbing, atas segala bimbingan dan pengarahan yang diberikan dalam penulisan skripsi ini.
2) Dr. Kustiyariah Tarman, S.Pi., M.Si. selaku dosen penguji, atas segala saran dan pengarahan yang telah diberikan dalam penulisan skripsi ini.
3) Dr. Ir. Ruddy Suwandi, MS., M.Phill., selaku Ketua Departemen Teknologi Hasil Perairan.
4) Mama (Mieke Tjandrawati), papa (alm) (Gunawan Kosasih), dan kakak (Jemmy, Dhanny, dan Wine), yang telah memberikan kasih sayang, semangat, dan dukungan.
5) Ko Kenchi yang telah memberikan semangat dan motivasi dalam menyelesaikan skripsi ini.
6) Teman-teman THP 44 khususnya Indah RW, Ellis, Ratna, Rianda, Siska, Motto, Yoga, Azwin, Yuli, Ikma, dan lainnya.
7) Seluruh teman-teman UKM Keluarga Mahasiswa Buddhis maupun Vihara Buddhasena serta Pink House (Anti, Medith, Kak Iyam, Irenz, dsb) atas semangat dan keceriaan yang diberikan.
Penulis menyadari bahwa masih banyak kekurangan dalam penulisan skripsi ini. Oleh karena itu penulis mengharapkan kritik dan saran yang dapat membangun dalam penyempurnaan skripsi ini. Semoga tulisan ini bermanfaat bagi pihak-pihak yang memerlukan.
Bogor, Desember 2011
DAFTAR PUSTAKA... ... 30 LAMPIRAN ... 34
DAFTAR TABEL
Halaman 1 Morfologi Porphyridium cruentum ... 4 2 Diagram alir pelaksanaan penelitian aktivitas antibakteri dari
Porphyridium cruentum ... 11 3 Kultivasi Porphyridium cruentum skala laboratorium ... 16 4 Kurva pertumbuhan Porphyridium cruentum (1) modifikasi media Becker; (2) media pupuk ... 17 5 Pemanenan biomassa Porphyridium cruentum (a) kultur awal panen ;
(b) kultur setelah pengendapan 10 hari ... 21 6 Biomassa Porphyridium cruentum (a) basah ; (b) kering ... 21 7 Ekstrak akhir Porphyridium cruentum (a) sebelum evaporasi ;
DAFTAR LAMPIRAN
Halaman 1 Medium Porphyridium cruentum dalam modifikasi media Becker ... 36 2 Medium Porphyridium cruentum dalam modifikasi media pupuk ... 37 3 Data pengamatan jumlah biomassa Porphyridium cruentum selama 8 hari ... 38 4 Data pengukuran suhu, intensitas cahaya, pH, dan salinitas ... 39 5 Perhitungan ekstrak Porphyridium cruentum dan kontrol positif
1.1 Latar Belakang
Kesehatan memiliki peran penting agar kelangsungan hidup manusia berjalan dengan baik. Masalah kesehatan yang sering terjadi umumnya akibat lingkungan yang kotor dan makanan yang tercemar mikroorganisme, sehingga menyebabkan penyakit. Mikroorganisme yang menimbulkan penyakit pada manusia umumnya berasal dari golongan bakteri. Bakteri yang merugikan dan menimbulkan penyakit disebut sebagai bakteri patogen (Pelczar dan Chan 2005).
Bakteri patogen dapat merugikan kesehatan manusia sehingga perlu diatasi dengan menggunakan antibakteri yang tepat. Antibakteri merupakan senyawa kimia yang memiliki fungsi menghambat pertumbuhan maupun membunuh sel bakteri (Madigan et al. 2009). Antibakteri dapat berupa senyawa sintetik maupun senyawa yang berasal dari bahan alami (natural product). Senyawa sintetik berpotensi menimbulkan efek negatif yang dapat mengganggu kesehatan, misalnya kanker (Gold dan Slone 1999). Hal ini memicu perlunya pencarian alternatif bahan alami sebagai antibakteri yang aman bagi kesehatan manusia, dan salah satu sumber penghasil antibakteri alami adalah mikroalga.
Mikroalga umumnya mengandung komponen aktif yang dapat dimanfaatkan dalam bidang pharmaceutical, neutraceutical, bahan tambahan pakan, dan kosmetik (Barsanti dan Gualtieri 2006). Komponen aktif mikroalga banyak diaplikasikan sebagai obat bagi manusia maupun hewan serta pertanian (Borowitzka 1995). Berbagai potensi mikroalga yang telah diteliti memiliki aktivitas antibakteri (Uma et al. 2011); antihiperglikemik (Rahman 2011);
antitumor dan antimikroba (Taskin et al. 2010); antimikroba (Abedin dan Taha 2008); antioksidan (Marxen et al. 2007); dan aktivitas
antibakteri (Kusmiyati dan Agustini 2007).
2
P. cruentum ini dapat menjadi suatu peluang dalam pengembangan sumber daya perairan untuk diaplikasikan dalam bidang yang lebih luas.
Menurut Kusmiyati dan Agustini (2007), mikroalga P. cruentum yang ditumbuhkan dalam media Becker dapat menghasilkan senyawa yang memiliki aktivitas antibakteri. Proses ekstraksi dilakukan dengan metode ekstraksi bertingkat menggunakan pelarut diklorometan. Hasil uji aktivitas antibakteri menunjukkan bahwa P. cruentum memiliki aktivitas untuk menghambat pertumbuhan Bacillus subtilis, Staphylococcus aureus, dan Escherichia coli.
Faktor penting dalam pertumbuhan mikroalga, antara lain nutrisi dalam media pertumbuhannya. Mikroalga P. cruentum umumnya ditumbuhkan dalam media Becker (Becker 1994) yang harganya relatif mahal. Larastri (2006) melaporkan bahwa substrat biocrete yang ditambah pupuk (NPSi) dengan konsentrasi P sebesar 0,2 ppm menghasilkan biomassa mikroalga Cyclotella tertinggi. Setyaningsih (2010) melaporkan bahwa Chaetoceros gracilis dalam media NPSi memiliki aktivitas antibakteri yang dapat menghambat bakteri Gram positif dan negatif.
Penelitian ini menggunakan media pupuk dan modifikasi media Becker sebagai media alternatif dalam menumbuhkan P. cruentum. Data mengenai pertumbuhan P. cruentum dalam media tersebut belum diketahui sehingga perlu kajian lebih lanjut mengenai pola pertumbuhan dan aktivitas antibakteri yang dihasilkan.
1.2 Tujuan
Tujuan dari penelitian ini yaitu:
1) Menentukkan pola pertumbuhan Porphyridium cruentum menggunakan modifikasi media Becker dan media pupuk.
2.1 Deskripsi dan Klasifikasi Porphyridium cruentum
Porphyridium cruentum adalah mikroalga merah bersel satu yang termasuk kelas Rhodophyceae, hidup bebas atau berkoloni yang terikat dalam mucilago. Senyawa mucilago dieksresikan secara konstan oleh sel membentuk sebuah kapsul yang mengelilingi sel. Mucilago merupakan polisakarida sulfat yang bersifat larut dalam air (Borowitzka dan Borowitzka 1988).
Klasifikasi biologi P. cruentum (Vonshak 1988) adalah sebagai berikut: Divisi : Rhodophyta
Sub kelas : Bangiophyceae Ordo : Porphyridiales Famili : Porphyriceae Genus : Porphyridium
Spesies : Porphyridium cruentum
Alga merah (rhodophytes) umumnya ditemukan pada habitat laut, namun beberapa spesies ditemukan di air tawar dan daerah terestrial. Alga bersifat fototrofik dan mengandung klorofil a, hal ini perlu mendapat perhatian khusus dimana kloroplasnya tidak memiliki klorofil b dan mengandung fikobiliprotein, pigmen utama pada pemanenan sianobakteria. Warna merah dari sebagian besar alga merah bersumber dari fikoeritrin yang merupakan pigmen tambahan yang menutupi warna hijau klorofil. Habitat dengan kedalaman yang semakin besar menghasilkan fikoeritrin yang lebih besar dimana penetrasi cahaya berkurang dan akan berwarna merah gelap. Kedalaman habitat yang dangkal akan menyebabkan kadar fikoeritrin yang diproduksi menjadi lebih sedikit dan akan tampak berwarna hijau (Madigan et al. 2009).
4
Gambar 1 Morfologi Porphyridium cruentum.
Komposisi biomassa P. cruentum yaitu 32,1% (w/w) karbohidrat dan
34,1% protein kasar. Kandungan mineral dalam 100 g biomassa kering: Ca (4960 mg), K (1190 mg), Na (1130 mg), Mg (629 mg), Zn (373 mg).
Kandungan asam lemak terdiri dari 1,6% untuk 16:0; 0,4% untuk 18:2ώ6; 1,3 %, 20:4ώ6; 1,3% untuk 20:5ώ3. Biomassa P. cruentum mengandung pigmen berupa fikoeritrin dengan karakteristiknya berwarna merah. Biomassa juga mengandung tokoferol, vitamin K, dan karoten (Fuentes et al. 2000).
Porphyridium dapat hidup di berbagai habitat alam seperti air laut, air tawar, maupun pada permukaan tanah yang lembab dan membentuk lapisan kemerah-merahan yang sangat menarik. Habitat asli dari P. cruentum diduga berasal dari laut karena dapat hidup dengan baik pada media cair maupun media padat air laut. Sel P. cruentum dapat menghasilkan metabolit-metabolit yang aktif secara biologi seperti antibiotik. Kelompok senyawa kimia utama yang merupakan antibakteri adalah fenol, fenolat, alkohol, halogen, logam berat, detergen, aldehid, dan gas kemosterilisator (Borowitzka dan Borowitzka 1988).
2.2 Bakteri Patogen
Bakteri patogen merupakan bakteri yang menyebabkan penyakit pada manusia, hewan, dan juga pada tumbuhan (Pelczar dan Chan 2005). Beberapa jenis bakteri patogen yang umum menjadi penyebab masalah kesehatan manusia, yaitu Staphylococcus aureus, Staphylococcus epidermidis, Bacillus subtilis, Bacillus cereus, dan Escherichia coli.
2.2.1 Staphylococcus aureus
Staphylococcus aureus merupakan bakteri Gram-positif penyebab infeksi (membentuk nanah) dan bersifat toksik bagi manusia. Hal ini menyebabkan berbagai masalah pada kulit seperti bisul, hordeolum, bahkan masalah serius seperti pneumonia, mastitis, meningitis, dan infeksi saluran kemih. S. aureus merupakan penyebab utama infeksi di rumah sakit (nosokomial) yang berasal dari infeksi luka bedah dan infeksi yang terkait dengan perangkat medis yang digunakan. S. aureus penyebab keracunan makanan dengan melepaskan enterotoksin pada makanan dan menimbulkan efek yang disebut toxic shock syndrome (Todar 2011).
Enterotoksin yang bersifat tahan panas ini dikeluarkan pada bahan pangan yang terkontaminasi S. aureus. Makanan yang mengandung toksin apabila masuk pencernaan manusia akan menimbulkan efek muntah-muntah, mual, dan diare setelah 1-6 jam (Madigan et al. 2009). Pertumbuhan bakteri ini dalam makanan dapat terjadi jika makanan disimpan pada suhu ruang dalam waktu yang lama (Salyers dan Whitt 1994). Rahayu (1999) menyatakan bahwa S. aureus merupakan mikroflora normal pada permukaan tubuh, rambut, mulut, dan tenggorokan. Bakteri S. aureus yang mencemari makanan terjadi akibat kurangnya tingkat higienis dalam penanganan pangan.
2.2.2 Staphylococcus epidermidis
6
aksila, perineum, lengan, kaki, dan jaringan di antara jari kaki. S. epidermidis memiliki adhesin yang terkait dengan patogenesis penyebab infeksi kulit (Wilson 2005).
2.2.3 Bacillus subtilis
Bacillus subtilis merupakan bakteri Gram-positif, uniseluler yang berbentuk batang dan hidup secara aerob. Bakteri ini membentuk tipe khusus saat dorman yang disebut endospora. Endospora terbentuk dari sel vegetatif sebagai respon terhadap lingkungan yang ekstrim. B. subtilis tumbuh pada makanan dengan pH lebih dari 4 dengan kondisi aerob. Hal yang sering terjadi yaitu terbentuknya lendir pada makanan (Todar 2011).
2.2.4 Bacillus cereus
Bacillus cereus merupakan bakteri Gram-positif, membentuk spora, bersifat aerobik atau anaerobik fakultatif. Penyebaran B. cereus sangat luas termasuk makanan yang menyebabkan keracunan makanan. Keracunan makanan yang diakibatkan B. cereus menyebabkan efek diare dan muntah. Terdapat dua tipe efek keracunan makanan akibat B. cereus yaitu, tipe penyebab diare dengan periode inkubasi selama 8-16 jam, dan tipe penyebab efek muntah dengan periode inkubasi selama 1-5 jam (Shinagawa 1990).
2.2.5 Escherichia coli
Escherichia coli hidup dalam saluran pencernaan manusia dan organisme lainnya. Penyakit pada manusia akibat E. coli terjadi ketika adanya kontaminasi dari air yang digunakan. Infeksi E. coli juga dapat terjadi karena memakan makanan yang belum matang, kontaminasi pada daging, maupun pada susu yang belum dipasturisasi (Belk dan Maier 2010).
ETEC menyebabkan diare, demam ringan, keram perut, dan mual. ETEC membutuhkan waktu 8-44 jam untuk menyebabkan gejala tersebut, dan gejala ini berlangsung selama 3-19 hari. EPEC menimbulkan gejala diare, demam, muntah, dan keram perut. EPEC membutuhkan waktu selama 17-72 jam untuk menimbulkan gejala penyakit, dan gejala tersebut berlangsung selama 6 jam hingga 3 hari. EIEC menyebabkan diare berlebih atau disentri, meriang, sakit kepala, nyeri otot, dan keram perut. Waktu yang diperlukan EIEC untuk menginvasi adalah 8-24 jam, dan menyebabkan efek gejala penyakit berhari-hari hingga mingguan. EHEC menyebabkan diare disertai darah, muntah, bahkan hingga kematian. EHEC menggunakan waktu selama 3-9 hari sehingga menimbulkan gejala penyakit, dan gejala berlangsung 2-9 hari. EAEC menyebabkan diare disertai lendir dimana biasanya tidak disertai darah maupun demam. Penyakit akibat EAEC ini umumnya terjadi pada negara berkembang (Percival et al. 2004).
2.3 Antibakteri
Senyawa antimikroba merupakan senyawa alami maupun kimia sintetik yang dapat membunuh atau menghambat pertumbuhan mikroorganisme. Senyawa yang dapat membunuh organisme (bakteri) disebut bakterisidal. Bahan kimia yang tidak membunuh namun dapat menghambat pertumbuhan organisme (bakteri) disebut bakteriostatik (Madigan et al. 2009).
8
molekul protein dan asam nukleat, menghambat kerja enzim, serta menghambat sintesis asam nukleat dan protein (Pelczar dan Chan 2005).
Respon tiap mikroorganisme terhadap antimikroba berbeda-beda. Bakteri memiliki tingkat sensitivitas yang berbeda dimana umumnya bakteri Gram-positif lebih rentan dibandingkan dengan bakteri Gram-negatif yang secara alami lebih resisten. Target penting antibiotik terhadap bakteri yaitu ribosom, dinding sel, membran sitoplasma, enzim biosintesis lemak, serta replikasi, dan transkripsi DNA (Madigan et al. 2009).
Suatu zat aktif dikatakan memiliki potensi yang tinggi sebagai antibakteri jika pada konsentrasi rendah mempunyai daya hambat yang besar. Kriteria kekuatan antibakteri menurut Nazri et al. (2011) adalah sebagai berikut.
Diameter zona hambat 15-20 mm : Daya hambat kuat Diameter zona hambat 10-14 mm : Daya hambat sedang Diameter zona hambat 0-9 mm : Daya hambat lemah
2.4 Isolasi Komponen Aktif Antibakteri
Komponen aktif antibakteri dapat diisolasi melalui proses ekstraksi. Berk (2009) menyatakan bahwa ekstraksi adalah suatu proses pemisahan komponen yang diinginkan dari suatu bahan. Isolasi komponen aktif dari suatu bahan dapat dibedakan menjadi dua kelas berdasarkan proses pemisahan komponen aktifnya, yaitu :
Ekstraksi padatan-cairan (Solid-liquid extraction) yaitu proses ekstraksi yang memisahkan komponen dari suatu bahan pada fase padat menggunakan bantuan pelarut. Contoh : ekstraksi garam dari bebatuan menggunakan air sebagai pelarut, ekstraksi larutan kopi dari gilingan biji kopi dalam produksi ekstrak biji kopi, ekstraksi minyak dari biji-bijian yang mengandung minyak, ekstraksi protein dari dari kedelai dalam produksi protein kedelai (isolated soybean protein), dan sebagainya.
Isolasi komponen antibakteri dari mikroalga P. cruentum pada penelitian ini dilakukan menggunakan metode ektraksi padatan-cairan (Solid-liquid extraction). Berk (2009) menyatakan bahwa ekstraksi padatan-cairan ini dapat dilakukan dengan cara bertingkat yakni menggunakan berbagai pelarut dengan
tingkat kepolaran yang berbeda, baik secara berkelanjutan (kontinu) maupun semi-kontinu.
Ekstraksi bertingkat atau ekstraksi bertahap merupakan ekstraksi yang dilakukan beberapa kali dengan jenis pelarut berbeda. Ekstraksi ini menggunakan pelarut yang lebih sedikit dan hasilnya akan lebih efektif dibandingkan ekstraksi satu kali dengan semua pelarut sekaligus (Nur dan Adijuwana 1987).
3 METODOLOGI
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada Februari hingga Agustus 2011. Tempat pelaksanaan penelitian adalah Laboratorium Bioteknologi Hasil Perairan dan Laboratorium Mikrobiologi Hasil Perairan, Departemen Teknologi Hasil Perairan; Laboratorium Molekular Bioteknologi, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan; Unit Pelayanan Mikrobiologi Terpadu bagian Mikrobiologi Medik, Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
3.2 Bahan dan Alat Penelitian
Bahan-bahan yang digunakan dalam penelitian meliputi mikroalga Porphyridium cruentum, air laut, media Becker (NaCl, MgSO4, MgCl2, CaCl2, KNO3, KH2PO4, NaHCO3, Tris HCl, FeCl3 dan EDTA tanpa trace element), media pupuk (NPK, TSP, vitamin, FeCl3 dan EDTA), etanol, diklorometan, akuades, NaOH 0,5 N; HCl 8 N; NA (Nutrient Agar) dan NB (Nutrient broth), MHA (Mueller Hinton Agar), antibiotik kloramfenikol, dan biakan bakteri (Staphylococcus aureus, Staphylococcus epidermidis, Bacillus subtilis, Bacillus cereus, Escherichia coli). Mikroalga P. cruentum yang digunakan diperoleh dari koleksi mikroalga Laboratorium Bioteknologi Teknologi Hasil Perairan, Institut Pertanian Bogor.
Alat-alat yang digunakan, yaitu lampu UV, toples kaca, aerator, selang plastik, lemari pendingin, mikroskop, hemositometer, pipet volumetrik, mikropipet, refraktometer, magnetic stirer, rotary evaporator, sentrifuse, freeze dryer, spektrofotometer, water bath shaker, jangka sorong, dan inkubator.
3.3 Metode Penelitian
bakteri Gram-negatif yakni E. coli. Diagram alir pelaksanaan penelitian disajikan pada Gambar 2.
Gambar 2 Diagram alir pelaksaan penelitian aktivitas antibakteri dari Porphyridium cruentum (Kusmiyati dan Agustini 2007).
Keterangan : * = Modifikasi penelitian Kusmiyati dan Agustini (2007) ** = Modifikasi penelitian Larastri (2006)
= Mulai dan akhir proses = Proses
Ekstraksi komponen antibakteri Porphyridium cruentum
Kultivasi P. cruentum
Penentuan umur panen
Pemanenan
Modifikasi Media Becker * Modifikasi Media Pupuk **
Sentrifugasi *
Pengeringan menggunakan freeze dryer *
Biomassa
12
3.3.1 Kultivasi Porphyridium cruentum
P. cruentum dikultivasi menggunakan dua media berbeda, yaitu modifikasi media Becker dan media pupuk. Media kultivasi dalam modifikasi media Becker (Becker 1994), yaitu natrium klorida (27 g/L), magnesium sulfat heptahidrat (6,6 g/L), magnesium klorida heksahidrat (5,6 g/L), kalsium klorida dihidrat (1,5 g/L), kalium nitrat (1 g/L), kalium dihidrogen fosfat (0,07 g/L), natrium bikarbonat (0,04 g/L), tris hidroklorida (20 mL/L), campuran larutan besi (III) klorida dan etilen diamin tetra asetat (EDTA) dengan modifikasi tanpa penambahan trace element. Media pupuk modifikasi Larastri (2006) yaitu NPK (3 mL/L), TSP (1 mL/L), vitamin (1 mL/L), dan campuran larutan besi (III) klorida dan etilen diamin tetra asetat (EDTA) (1 mL/L).
3.3.2 Perhitungan jumlah sel (Hadioetomo 1993)
Pertumbuhan P. cruentum diamati dengan mengambil sampel setiap hari menggunakan mikropipet, kemudian dimasukkan ke dalam chamber hemositometer dan dihitung jumlah sel secara langsung menggunakan mikroskop. Hasil perhitungan nilainya dikonversikan ke dalam nilai logaritmik dan dibuat kurva pertumbuhan dengan jumlah sel (logaritmik) sebagai sumbu y dan waktu (hari) sebagai sumbu x. Proses perhitungan jumlah sel ini dengan metode hitung langsung sebagai berikut :
1) Permukaan hitung hemositometer dan kaca penutup dibersihkan dari sisa kotoran.
2) Tutup kaca hemositometer diletakkan pada permukaan hemositometer. Suspensi biakan P. cruentum hasil pengambilan sampel dikocok, kemudian diambil dengan mikropipet sebanyak 20 µL. Suspensi tersebut diteteskan pada tempat menaruh sampel yang terdapat pada hemositometer hingga suspensi P. cruentum menyebar pada ruang hitung.