UJI INOKULASI
Ganoderma
spp. TERHADAP TANAMAN
SENGON (
Paraserianthes falcataria
) SEBAGAI TANAMAN
PENAUNG KAKAO (
Theobroma cacao
)
PERMANA ZAINAL
E44052097
DEPARTEMEN SILVIKULTUR
FAKULTAS KEHUTANAN
INSTITUT PERTANIAN BOGOR
RINGKASAN
Permana Zainal. E44052097. Uji Inokulasi Ganoderma spp. Terhadap Tanaman Sengon (Paraserianthes falcataria) Sebagai Tanaman Penaung Kakao (Theobroma cacao). Dibawah Bimbingan Dr. Ir. Elis Nina Herliyana, M.Si dan Dr. Ir. Darmono Taniwiryono, M.Sc.
Ganoderma spp. adalah jamur penyebab penyakit busuk akar yang menyerang tanaman sengon (Paraserianthes falcataria) dan kakao (Theobroma cacao). Penanganan dari penyakit busuk akar relatif sulit dilakukan, sehingga perlu dikembangkan teknik pengendalian Ganoderma spp. yang lebih aplikatif. Salah satu upaya untuk mengembangkan teknik pengendalian penyakit tersebut adalah dengan melakukan uji inokulasi. Pada umumnya Ganoderma spp. ditemukan di lapangan pada tanaman yang sudah dewasa, namun untuk efektifitas waktu dan materi maka perlu dikembangkan teknik inokulasi pada tanaman tingkat semai. Tujuan dari penelitian ini adalah menemukan teknik inokulasi
Ganoderma spp. yang efektif terhadap bibit tanaman sengon usia semai.
Bahan yang digunakan dalam penelitian ini antara lain, isolat Ganoderma
spp. sengon (Sp.3), isolat Ganoderma spp. kakao (Sp.4), bibit sengon, kayu, dan
PDA. Alat yang digunakan antara lain toples transparan berukuran diameter 12~15 cm dan tinggi 13~16 cm, cawan Petri, alat isolasi aseptik, autoclave, sungkup bambu dan rumah kaca. Metode yang digunakan dalam penelitian ini meliputi pembuatan bahan pembawa kayu dan bahan pembawa agar, penanaman sengon bersama bahan pembawa, pengamatan, pemeliharaan, dan analisis statistik. Pembuatan bahan pembawa kayu terdiri dari sterilisasi kayu, perbanyakan isolat pada toples, dan inokulasi isolat pada media kayu ke dalam toples. Sterilisasi kayu terdiri dari kegiatan pengupasan kulit kayu, perebusan kayu selama 2 jam, dan sterilisasi dengan autoclave selama 30 menit. Selain pada wadah toples, isolat juga diperbanyak pada wadah cawan Petri, untuk digunakan sebagai bahan pembawa agar. Setelah isolat memenuhi permukaan agar, kayu dimasukkan ke dalam toples kemudian kayu tersebut di inkubasi selama 1~2 bulan. Analisis statistik menggunakan model RAK dua faktor dan 4 blok. Faktor yang digunakan terdiri dari, faktor jenis isolat dan faktor pemotongan akar. Blok dibedakan berdasarkan jenis bahan pembawa, yaitu, bahan pembawa kayu diameter 3 (K3), 4 (K4), dan 5cm (K5), dan bahan pembawa agar (A). Variabel
yang diamati adalah variabel pertambahan jumlah anak daun dan pertambahan tinggi tanaman.
Hasil penelitian menjelaskan bahwa metode inokulasi kayu yang dilakukan cukup efektif menginfeksi bibit tanaman sengon. Jenis pembawa yang paling efektif adalah pembawa kayu dengan diameter 5 cm dengan nilai rata-rata pertambahan tinggi dan jumlah daun 0,4 cm dan 0,2 cm. Selain itu pada perlakuan kayu ditemukan tanda penyakit berupa miselium pada akar dan tubuh buah. Tanaman yang diberikan perlakuan agar tidak terlihat secara pasti pengaruhnya karena mendapat gangguan dari serangan kutu putih.
Isolat Sp.3 dan isolat Sp.4 dapat dengan baik menginfeksi tanaman sengon.
Hal tersebut dapat dilihat dari nilai rata rata pertambahan daun dari Sp.0, Sp.3, dan
pertambahan tinggi dari perlakuan Sp.0, Sp.3, dan Sp.4 adalah berturut-turut 4,3,
0,3, dan -0,2 cm.Faktor pemotongan akar tidak berpengaruh nyata pada taraf uji 0,05. Kemudian pada interaksi kedua faktor, variabel pertambahan jumlah daun berbeda nyata pada taraf uji 0,05, dan variabel pertambahan tinggi berbeda nyata pada taraf uji 0,01. pada variabel pertambahan jumlah anak daun, perlakuan yang memiliki pertumbuhan paling baik adalah P0 Sp.0 dengan nilai 14,2, sedangkan
perlakuan yang memiliki pertambahan anak daun terendah adalah P0 Sp.4 dengan
nilai -2,4. Pada variabel pertambahan tinggi perlakuan P0 Sp.0 memiliki
pertumbuhan yang paling tinggi yaitu 4,5 cm, sedangkan perlakuan P1 Sp.4
SUMMARY
Permana Zainal. E44052097. Inoculation test of Ganoderma spp. Against Albizia (Paraserianthes falcataria) as shade plants of Cacao (Theobroma cacao). Under Academic Supervision Dr. Ir. Elis Nina Herliyana, M.Si and Dr. Ir. Darmono Taniwiryono, M.Sc.
Root rot diseases of albizia (Paraserianthes falcataria) and cocoa (Theobroma cacao) is relatively difficult to handle, so the development of more applicable techniques to control Ganoderma spp. is needed. One effort to develop it is to do inoculation test. In general, Ganoderma spp. found in the field on plants that have been mature, but for time and materials effectiveness, the development of inoculation technique of Ganoderma spp. on seedling plants is needed. The purpose of this study was to find effective inoculation technique of Ganoderma
spp. against albizia on seedling age.
Materials used in this study are isolates of Ganoderma spp. albizia (Sp.3),
isolates of Ganoderma spp. cocoa (Sp.4), albizia seeds, woods, and PDAs. Tools
that used in this study consist of transparent jar with 12 -15 cm diameter and 13-16 cm height, a Petri dish, aseptic isolation equipment, autoclave, bamboo containment and greenhouse. The method used in this study consist of the manufacture of wood and agar carriers, albizia planting with wood and agar carriers, observation, maintenance, and statistical analysis. Manufacturing process of wood carrier consists of wood sterilization, isolates multiplication in jars, and inoculation of woods on isolates inside the jars. Wood sterilization process consists of stripping bark, wood boiling for 2 hours, and sterilization by autoclave for 30 minutes. Beside the jars, isolates were also multiplied on Petri dish to be used as agar carrier. The wood inserted into the jar after the isolates wrapped surface of agar and then the wood incubated for 1 ~ 2 months until Ganoderma
spp. mycelium wrapped surface of woods. Statistical analysis used RBD model with two factors and four blocks. Factors consist of isolate types and root cutting factors. Blocks differentiated by type of carrier, wood carriers 3 (K3), 4 (K4), and
5 cm (K5) diameter, and agar carriers (A). Observed variables are number of
leaflet and plant height increment.
The result explains that the method of wood inoculation done quite effectively infect albizia seeds. The most effective type of carrier is wood carriers with diameter of 5 cm with an average value of height 0.4 cm and number of leaflet 0.2. Moreover in the treatment of wood carriers found signs of disease such as mycelium at the roots and fruiting bodies. The effect of agar carrier treatment seeds did not to look exactly because they get interference from white lice.
Both of Sp.4 isolates and Sp.3 isolates can infect albizia seeds well. This
can be seen from the average value of the number of leaflet of Sp.0, Sp.3, and Sp.4
are successively 10.9, -1.3, and -1.0. While the average height increment of treatment Sp.0, Sp.3, and Sp.4 are successively 4.3, 0.3, and -0.2 cm. Root cutting
best growth is P0 Sp.0 with average value 14.2, whereas the treatment that had the
lowest is Sp.4 P0 with the average value -2.4. At high accretion variable Sp.0 P0
treatment had the highest growth in average value 4.5 cm, while the P1 Sp.4
UJI INOKULASI
Ganoderma
spp. TERHADAP TANAMAN
SENGON (
Paraserianthes falcataria
) SEBAGAI TANAMAN
PENAUNG KAKAO (
Theobroma cacao
)
PERMANA ZAINAL
E44052097
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kehutanan
Pada Departemen Silvikultur Fakultas Kehutanan
Institut Pertanian Bogor
DEPARTEMEN SILVIKULTUR
FAKULTAS KEHUTANAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Uji Inokulasi Ganoderma spp. terhadap Tanaman Sengon (Paraserianthes falcataria) sebagai Tanaman Penaung Kakao (Theobroma cacao)
Nama : Permana Zainal
NIM : E44052097
Menyetujui : Dosen Pembimbing,
Dr. Ir. Elis Nina Herliyana, M.Si Dr. Ir. Darmono Taniwiryono, M.Sc NIP. 19670421 199103 2 001 NIK. 110 400 12
Mengetahui :
Plh. Ketua Departemen Silvikultur
Dr. Ir. Noor Farikhah Haneda, M.Si NIP. 19660921 199003 2 001
PERNYATAAN
Dengan ini saya menyatakan bahwa skripsi berjudul ”Uji Inokulasi
Ganoderma spp. terhadap Tanaman Sengon (Paraserianthes falcataria) sebagai Tanaman Penaung Kakao (Theobroma cacao)” adalah benar-benar hasil karya saya sendiri dengan bimbingan dosen pembimbing belum pernah digunakan sebagai karya ilmiah pada perguruan tinggi atau lembaga manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Bogor, Mei 2011
KATA PENGANTAR
Puji syukur penulis panjatkan kepada Allah SWT. atas segala rahmat, taufik, dan hidayat-Nya, sehingga penulis dapat menyelesaikan karya ilmiah yang berjudul ”Uji Inokulasi Ganoderma spp. terhadap Tanaman Sengon (Paraserianthes falcataria) sebagai Tanaman Penaung Kakao (Theobroma cacao)”. Karya ilmiah ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Kehutanan di Fakultas Kehutanan, Institut Pertanian Bogor. Tujuan dari penelitian ini ialah untuk mendapatkan teknik inokulasi Ganoderma spp. yang efektif terhadap bibit sengon. Selain itu penelitian ini bertujuan untuk membandingkan efektifitas bahan pembawa PDA dan bahan pembawa kayu.
Terima kasih penulis ucapkan kepada Dr. Ir. Elis Nina Herliyana, M. Si selaku dosen pembimbing I dan juga kepada Dr. Ir. Darmono Taniwiryono, M. Sc selaku dosen pembimbing II yang telah memberikan arahan dan bimbingan. Selain itu penghargaan penulis disampaikan pula kepada para staf dan dosen pengajar Departemen Silvikultur serta teman-teman yang membantu dalam menyelesaikan karya ilmiah ini. Penulis menyadari banyak kekurangan dan kelemahan dalam penulisan karya ilmiah ini, untuk itu saran dan kritikan sangat saya harapkan. Ungkapan terimakasih juga penulis sampaikan kepada ayah, ibu serta seluruh keluarga atas segala dukungan, doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Mei 2011
RIWAYAT HIDUP
Penulis dilahirkan di Makassar, Sulawesi Selatan pada tanggal 2 November 1987 sebagai anak pertama dari dua bersaudara dengan nama orang tua BJ. Basuki dan Nadhya Damayanti. Penulis menyelesaikan pedidikan sekolah menengah atas di SMA Negeri 2 Bekasi pada tahun 2005. Penulis masuk Institut Pertanian Bogor pada tahun 2005 melalui jalur SPMB di Departemen Silvikultur, Fakultas Kehutanan, Institut Pertanian Bogor.
Selama menjadi mahasiswa, penulis aktif di organisasi kemahasiswaan sebagai anggota himpunan mahasiswa TGC (Tree Grower Community) Fakultas Kehutanan IPB. Penulis juga melaksanakan Praktek Pengenalan Ekosistem Hutan (PPEH) di Kamojang dan Sancang pada tahun 2007. Pada tahun 2009, Penulis melaksanakan Praktek Pengelolaan Hutan (PPH) di Hutan Pendidikan Gunung Walat (HPGW) Sukabumi. Penulis juga melaksanakan Praktek Kerja Profesi (PKP) di PT. Erna Djuliawati, Kalimantan Tengah pada bulan Maret- Mei 2010 di bawah bimbingan Dadan Mulyana, S. Hut. M. Si.
UCAPAN TERIMA KASIH
Pada kesempatan ini, penulis dengan kerendahan hati ingin menyampaikan penghargaan dan terima kasih kepada :
1. Keluarga saya tercinta, Bapak Ir. BJ. Basuki dan Ibu Nadhya Damayanti, beserta adik Ahadiah Nur Maisaroh yang telah memberi semangat, doa, dukungan, dan kasih sayang dalam menyelesaikan karya ilmiah ini.
2. Keluarga Besar Najamudin Saleh terutama Ir. Jeffrey Mulyono dan Ibu Rita Tejamirah atas semangat yang diberikan dan partisipasinya dalam mendukung kelancaran studi saya sampai bisa mencapai tingkat sarjana. 3. Dr. Ir. Elis Nina Herliyana, M. Si dan Dr. Ir. Darmono Taniwiryono, M.Sc
sebagai dosen pembimbing yang telah sabar memberikan bimbingan, pengarahan dan saran selama penelitian hingga penyelesaian karya ilmiah ini.
4. Dosen moderator seminar Dr. Ir. Basuki Wasis, MS. Kemudian Dr. Ir. Nurheni Wijayanto, MS dan Ir. Rachmat Hermawan, M.Sc selaku ketua sidang dan dosen penguji atas pengarahan, saran, dan kritik pembangunnya.
5. Keluarga bapak Rachmat Djiono serta ibu Sugiati dan Lukman Muharom yang telah memberikan semangat moril dan kepercayaan untuk menyelesaikan skripsi. Ratna Jamilah terima kasih atas bantuan, dukungan, doa, dan semangat yang diberikan.
6. Prof. Dr. Ir. Andry Indrawan, MS atas nasihat, semangat dan dukungannya. Serta memberikan kesempatan untuk saya agar dapat melakukan Praktek Kerja Profesi di PT. Erna Djuliawati.
7. Ibu Aliyah, Kang saiful, Ibu Tutin, Kakak Ai R., Kakak Agus, Ismail, Bibi Ncah, staf ahli Laboratorium biologi tanah yang telah memberikan bantuan, semangat, doa dan kelancaran administrasi.
8. Bapak Sardjito dan Bapak Gunawan yang telah memberikan pengarahan mengenai sterilisasi tanah.
atas penghiburan, deskripsi masa depan dan harapan yang telah kalian tanamkan.
10.Teman-temanku Enike Ratna Sari, Helga Sugiarti, Wulan, Icha, Dedi Mulyana, Randhi F. Kiswantara, Niechi Valentino, Hania Purwitasari, Noviandri Asmar, Radita Daneswara, Linda , dan Suke atas bantuan, semangat, dukungan dan penghiburannya.
11.Adik kelasku Nur Syamsi, Subhan, Umar Atik, Renando Mieko, Fransisxo Tambunan, yang telah membantu pada saat penelitian. Beserta keluarga besar Fahutan, khususnya Silvikultur.
12.Guru-guru sekolah menengah yang saya hormati alm. Drs. Khaerudin, Dra. Farida, dan Drs. Sarmani Abbas, M.Pd.
DAFTAR ISI
1.1 Latar Belakang ... 1
1.2 Tujuan ... 3
1.3 Manfaat………..…...4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Kakao (Theobroma cacao) ... 5
2.2 Sengon (Paraserianthes falcataria) ... 5
2.3 Inokulasi ... 7
2.3.1 Teknik Inokulasi Dengan Pembawa Organik ... 8
2.4 Teknik Aseptik ... 9
2.5 Biologi Jamur ... 9
2.5.1 Botani ... 9
2.5.2 Kebutuhan Nutrisi ... 11
2.5.3 Pengaruh Lingkungan ... 12
2.6 Ganoderma spp. ... 13
BAB III METODOLOGI ... 16
3.1 Waktu dan tempat ... 16
3.2 Bahan dan Alat ... 16
3.3 Metode Penelitian ... 16
3.3.1 Pembuatan Bahan Pembawa Kayu dan Bahan Pembawa PDA ... 17
3.3.2 Penanaman Inokulum Bersama Bibit Sengon Usia 1½ Bulan. ... 19
3.3.3 Pengamatan, Pengambilan Data, dan Pengolahan Data ... 21
BAB IV HASIL DAN PEMBAHASAN ... 23
4.1 Hasil ... 23
4.1.1. Pengaruh Blok (Jenis Bahan Pembawa) ... 25
4.1.2. Pengaruh Jenis Isolat (Sp.) ... 26
Halaman
4.1.4. Pengaruh Interaksi Faktor Pemotongan Akar dan Jenis Isolat... 29
4.2. Pembahasan ... 30
BAB V KESIMPULAN DAN SARAN ... 34
5.1. Kesimpulan ... 34
DAFTAR TABEL
No. Uraian Halaman 1. Jumlah pohon dan % siap panen 8 jenis pohon pada hutan rakyat di
beberapa daerah…..……… 6
2. Jenis hama dan penyakit tanaman sengon... 7 3. Ciri-ciri utama kelas jamur………. 10 4. Rekapitulasi rata-rata pertambahan jumlah anak daun dan tinggi
tanaman selama 2 bulan……….. 24 5. Rekapitulasi hasil sidik ragam terhadap variabel yang diamati……….. 26 6. Hasil uji Duncan pengaruh blok terhadap pertambahan anak daun…… 27 7. Hasil uji Duncan pengaruh blok terhadap pertambahan tinggi……….. 27 8. Hasil uji Duncan pengaruh faktor jenis isolat jamur terhadap
pertambahan anak daun……….. 28 9. Hasil uji Duncan pengaruh faktor jenis isolat jamur terhadap
pertambahan tinggi tanaman………... 28 10. Hasil uji Duncan pengaruh pemotongan akar terhadap pertambahan
anak daun……… 29
11. Hasil uji Duncan pengaruh pemotongan akar terhadap pertambahan
tinggi………... 29
12. Hasil uji Duncan pengaruh interaksi antara faktor pemotongan akar dan jenis isolat terhadap pertambahan jumlah anak daun………... 30 13. Hasil uji Duncan pengaruh interaksi antara faktor pemotongan akar
dan jenis isolat terhadap pertambahan jumlah anak daun………... 31
DAFTAR GAMBAR
No. Uraian Halaman
1. Pengamatan mikroskopis Ganoderma spp……….………. 15
2. Bagan kegiatan penelitian….………... 17
3. Tahapan sterilisasi kayu. 3a Pengupasan kulit. 3b Perebusan kayu. 3c Pengukusan kayu dengan autoclave……… 18
4. Bahan pembawa kayu……….. 19
5. Perbandingan kompos, arang sekam, dan tanah……….. 20
6. Perbandingan perlakuan Sp.0, Sp.3, dan Sp.4………. 25
7. Tubuh buah Ganoderma spp. pada perlakuan kayu yang diinokulasi Isolat Sp.3 dan Sp.4 (diberi tanda lingkaran putih)………. 25
8. Tubuh buah setelah polibag dibuka………. 33
9. Miselium pada akar tanaman yang diberikan perlakuan inokulasi kayu………. 33
DAFTAR LAMPIRAN
No. Uraian Halaman 1. Hasil uji Duncan terhadap variabel jumlah anak daun menggunakan
software SAS 9………... 41 2. Hasil uji Duncan terhadap variabel jumlah tinggi menggunakan
BAB I
PENDAHULUAN
1.1 Latar Belakang
Alih-guna lahan hutan menjadi lahan pertanian atau perkebunan disadari menimbulkan banyak masalah seperti penurunan kesuburan tanah, erosi, kepunahan flora dan fauna, banjir, kekeringan dan bahkan perubahan lingkungan global. Masalah ini bertambah berat dari waktu ke waktu sejalan dengan meningkatnya luas areal hutan yang dialih-gunakan menjadi lahan usaha lain. Agroforestri merupakan salah satu sistem pengelolaan lahan yang dapat ditawarkan untuk mengatasi masalah yang timbul akibat adanya alih guna lahan tersebut.
Sebagai contoh di daerah hulu Way Besai, hutan yang semula luasnya mencapai 60% telah berubah menjadi perkebunan rakyat, persawahan di lembah bukit, dan perkampungan, sehingga hutan yang tersisa hanya 12% dari total luas lahannya. Namun, karena himbauan yang dilakukan selama 15 tahun terakhir, semakin banyak budidaya perkebunan yang semula berbentuk sistem monokultur, secara bertahap berubah menjadi budidaya perkebunan campuran dengan pohon penaung (Verbist et al., 2004).
Salah satu tanaman perkebunan yang populer dan banyak dibudidayakan petani di indonesia adalah kakao (Daniri, 2010). Kakao (Theobroma cacao) merupakan komoditas ekspor yang cukup menjanjikan di masa depan dan mempunyai posisi kuat di pasar dunia, sehingga sangat potensial untuk dikembangkan di Indonesia. Komoditas kakao pada masa yang akan datang diharapkan menduduki tempat yang sejajar dengan komoditas-komoditas perkebunan lainnya seperti karet dan kelapa sawit, setidaknya dari segi luas area tanam dan kuantitas produksi yang memadai untuk memenuhi pangsa pasar yang terus meningkat (Daniri, 2010).
dan tanpa persiapan naungan yang baik, pengembangan tanaman kakao akan sulit diharapkan keberhasilannya.
Salah satu tanaman penaung yang populer dalam pengusahaan agroforestri kakao adalah tanaman leguminosa, salah satunya sengon (Paraserianthes falcataria). Selain sebagai tanaman pelindung, tanaman sengon juga bernilai ekologis sebagai salah satu tanaman konservasi tanah dan air, sengon juga memiliki ekonomi yang baik dan cukup banyak diminati sebagai jenis tanaman hutan rakyat. Secara umum di Jawa terdapat hutan rakyat seluas hampir 400 ha. dan mampu memasok kurang lebih 895.000 m3 kayu per tahun; dan jumlah ini adalah 10% serapan kayu berbagai industri di pulau Jawa. Produktivitas hutan rakyat di pulau Jawa rata-rata adalah 2,29 m3/ha/tahun (Arupa, 2008).
Selain bernilai ekonomi yang cukup menjanjikan, tanaman sengon juga rentan terhadap serangan hama dan penyakit, ada sekitar 9 jenis hama dan penyakit yang menyerang sengon (Nair, 2000). Dari seluruh patogen yang menyerang tanaman sengon, serangan penyakitbusuk akar yang disebabkan oleh jamur Ganoderma spp. pada tanaman kehutanan termasuk sengon telah banyak dilaporkan (Basset dan Peters, 2003; Widyastuti, 2007). Serangan Ganoderma
spp. di lapangan sulit di deteksi karena gejalanya mirip dengan gejala kekeringan. Meskipun tanaman sudah menunjukkan gejala sakit, namun terkadang tubuh buah
Ganoderma spp. belum terbentuk. Dan di lain pihak, pada tanaman yang tampak sehat ditemukan tubuh buah Ganoderma spp. di pangkal batangnya (Bassett dan Peters, 2003).
Kasus kerusakan akibat penyakit jamur akar merah ini di tegakan sengon masih jarang, belum banyak dijumpai. Namun demikian bilamana kasus serangan sudah dapat dijumpai maka pada tahun-tahun mendatang potensi kerusakan/kematian pohon pada tegakan akan semakin membesar.
menghasilka jutaan spora secara serentak. Spora yang diterbangkan oleh angin dan dibawa terbang oleh serangga diduga memiliki peranan penting dalam penularan penyakit dari tanaman satu ke tanaman lain pada jarak yang melebihi jarak perkembangan sistem perakaran, dan penularan penyakit dari tanaman yang sakit ke tanaman sehat yang berada di dekatnya terjadi melalui kontak akar (Darmono dan Panji, 1999).
Uji inokulasi Ganoderma spp. perlu dilakukan sebagai salah satu upaya untuk meningkatkan teknologi perlindungan tanaman sengon dan kakao terhadap penyakit busuk akar. inokulasi adalah pekerjaan memasukkan inokulum dari medium yang lama ke medium yang baru dengan tingkat ketelitian yang sangat tinggi (Pelczar dan Chan, 1986).
Produksi bahan pembawa jamur pada umumnya menggunakan bahan pembawa anorganik seperti zeolit. Seiring dengan perkembangannya, terutama di dalam hal pemanfaatan sumber daya lokal dan menciptakan biaya produksi yang lebih ekonomis, dirasakan perlu untuk dicarikan alternatif bahan pembawa lain yang lebih murah dan mudah didapat tanpa mengurangi kualitas dari bahan pembawa. Bahan organik belum banyak digunakan sebagai bahan pembawa bahan pembawa, sebagai contoh, kompos gambut pernah digunakan sebagai
carrier (pembawa)bahan pembawa mikoriza (Baon, 1998), akan tetapi informasi mengenai penggunaan bahan organik atau limbah organik lain masih sangat terbatas.
Kasus Serangan Ganoderma Spp. yang ditemukan di lapangan biasanya terdapat pada tanaman dewasa yang pertumbuhannya sudah menurun (Widyastuti, 2007). Karena keterbatasan waktu dan materi, perlu dilakukan simulasi menggunakan tanaman pada usia semai, serta menguji efektifitas metode inokulasi Ganoderma spp. pada tanaman sengon tingkat semai. Dalam penelitian.ini, usia semai yang digunakan adalah 1-1 ½ bulan, dan bahan pembawa yang digunakan adalah kayu sengon dan Potato Dextrose Agar (PDA). 1.2 Tujuan
Penelitian ini secara umum bertujuan untuk mendapatkan teknik inokulasi
dan bahan pembawa kayu, dan menguji kemungkinan penularan Ganoderma spp. dari tanaman kakao ke tanaman sengon.
1.3 Manfaat
Selama ini belum ada penelitian mengenai uji inokulasi Ganoderma spp. pada tanaman sengon usia semai. Selanjutnya, hasil penelitian ini dapat digunakan sebagai acuan ntuk mengembangkan teknik pengendalian serangan Ganoderma
BAB II
TINJAUAN PUSTAKA
2.1 Kakao (T. cacao)
Menurut Tjitrosoepomo (1988) sistematika tanaman ini sebagai berikut : • Divisi Spermatophyta
• Anak divisi Angioospermae • Kelas Dicotyledoneae • Anak kelas Dialypetalae • Bangsa Malvales • Suku Sterculiaceae • Marga Theobroma • Jenis T. cacao L.
Beberapa sifat (penciri) dari buah dan biji digunakan dasar klasifikasi dalam sistem taksonomi. Berdasarkan bentuk buahnya, kakao dapat dikelompokkan ke dalam empat populasi Kakao lindak (bulk) yang telah tersebar luas di daerah tropika adalah anggota subjenis Sphaerocarpum. Bentuk bijinya lonjong (oval), pipih dan keping bijinya (kotiledon) berwarna ungu gelap. Mutunya beragam tetapi lebih rendah daripada subjenis cacao. Permukaan kulit buahnya relatif halus karena aluralurnya dangkal. Kulit buah ini tipis tetapi keras (liat). Pertumbuhan tanamannya kuat dan cepat, daya hasilnya tinggi dan relatif tahan terhadap beberapa jenis hama dan penyakit (Tjitrosoepomo, 1988).
2.2 Sengon (P. falcataria)
Hendromono, 1992), menurut Dela Cruz (1988) dalam Haselwandter and Bowen (1996), sengon juga bersimbiosis dengan mikoriza arbuskular karena sengon adalah tanaman leguminosa yang mampu melakukan fiksasi nitrogen. Karena hal tersebut tanaman sengon baik untuk konservasi tanah dan air (Nusantara, 2002)
Pada tahun 2003, Biro Pusat Statistik (BPS) bekerjasama dengan Departemen Kehutanan telah melakukan pandataan potensi hutan rakyat di Indonesia (Arupa, 2004). Sensus tersebut mencakup 22 jenis tanaman kehutanan, namun data potensi hutan rakyat hanya mencakup 10 jenis, yaitu: akasia, bamboo, cendana, jati, mahoni, pinus, sengon, rotan, sonokeling dan sungkai. Pemilihan kesepuluh jenis tanaman kehutanan tersebut berdasarkan distribusi penyebarannya hampir merata di seluruh Indonesia selain jenis-jenis tersebut dianggap komoditi unggulan nasional (BPS, 2004). Hasil sensus yang dilakukan di seluruh wilayah Indonesia kecuali propinsi Nanggroe Aceh menunjukkan bahwa konsentrasi tanaman hutan rakyat adalah di Pulau Jawa, sedangkan beberapa jenis lainnya tersebar di Sumatera, Sulawesi dan Kalimantan.
Tabel 1. Jumlah pohon dan % siap panen 8 jenis pohon pada hutan rakyat di beberapa daerah
Jenis Pohon Jumlah Kebun Rakyat
Jumlah dan % Siap Panen Konsentrasi Lokasi Jumlah Siap Panen (%)
Akasia 1.200.000 32.020.000 37,69 Jawa
Cendana 73.400 66.330 30,01 NTT, Sulsel,
Jateng, DIY
Jati 3.050.000 79.710.000 23,14 Jawa
Mahoni 2.310.000 45.260.000 20,98 Jawa
Pinus 156.000 5.820.000 46,73 Jawa, Sumut,
Sulsel
Sengon 2.320.000 59.830.000 41,13 Jawa
Sonokeling 204.000 2.350.000 31,56 Jateng, DIY,
Jatim
Sungkai 22.300 1.010.000 37,72 Kalimantan,
Sumsel, Sulsel Sumber: BPS (2004)
cm, serta bentuk batang sengon yang bulat dan tidak berbanir, sehingga banyak petani memilih pohon ini sebagai tanaman peneduh tanaman kopi dan kakao.
Jenis sengon ini rentan terhadap serangan Ganoderma spp.. Gejalanya adalah tampak pada anak daun yang layu dan rontok sehingga akhirnya sengon bisa mati. Jika kulit akar dikupas tampak benang merah menempel pada kayu akar (Siregar et al., 2008). Berikut adalah hama dan penyakit yang menyerang tanaman sengon (Nair, 2000) ditampilkan pada Tabel 2.
Tabel 2. Jenis hama dan penyakit tanaman sengon
No Bagian yang diserang Jenis hama dan penyakit Nama umum Keterangan 1 Menggerek Batang Xystrocera festiva
(Coleoptera, Ceramycidae) X. globosa
Hama boktor
2 Pemakan anak daun Pteroma plagiophleps (Lepidoptera,Psychidae)
3 Pemakan akar Beberapa spesies (Coleoptera, Scarabaeidae)
Ulat putih Menyerang sapling 4 Pemakan kulit batang Indarbela quadrinotata
(Lepidoptera, Indarbelidae)
Ulat kulit batang 5 Penggerek batang Xylosandrus morigerus
(Coleoptera, Scolytidae)
Kumbang sisik
6 Damping-off Pythium sp.
Phytoptora sp.
7 Penyakit Antraknosa Colletotrichum sp. Antraknosa Menyerang semai 8 Busuk akar Botryo diplodia sp.
Ganoderma sp. Ustulina sp. Rosellinia sp.
Jamur akar Menyerang tanaman muda
9 Kanker karat/puru Uromycladium tepperianum Jamur karat Menyerang semua umur Sumber: Nair (2000)
2.3 Inokulasi
1. Menyiapkan ruangan
Ruang tempat harus bersih dan keadannya harus steril agar tidak terjadi kesalahan dalam pengamatan atau percobaaan .dalam labotarium pembuataan serum vaksin dan sebagainya. Inokulasi dapat dilakukan dalam sebuah kotak kaca (encast) udara yang lewat dalam kotak tersebut dilewatkan saringan melalui suatu jalan agar tekena sinar ultraviolet (Pelczar dan Chan, 1986).
2. Pemindahan dengan dengan pipet
Cara ini dilakukan dalam penyelidikan air minum atau pada penyelidikan untuk diambil 1 ml contoh yang akan diencerkan oleh air sebanyak 99 ml murni (Pelczar dan Chan, 1986).
3. Pemindahan dengan kawat inokulasi
Ujung kawat inokulasi sebaliknya dari platina atau nikel .ujungnya boleh lurus juga boleh berupa kolongan yang diametrnya 1-3mm. Dalam melakukuan penanaman bakteri kawat ini terlebih dahulu dipijarkan sedangkan sisanya tungkai cukup dilewatkan nyala api saja setelah dingin kembali kawat itu disentuhkan lagi dalam nyala (Pelczar dan Chan, 1986).
2.3.1 Teknik Inokulasi Dengan Pembawa Organik
Bahan pembawa umumnya berbentuk spora dari spesies tertentu ataupun campuran lebih dari satu spesies jamur. Spora dan miselia yang dihasilkan dicampur dengan bahan pembawa yang umumnya berupa mineral lempung atau zeolit (Prematuri dan Faiqoh, 1999). Salah satu hambatan belum meluasnya penggunaan teknologi inokulasi di masyarakat Indonesia adalah masih terbatasnya ketersediaan bahan pembawa, yang diproduksi dalam skala besar secara komersial. Produksi bahan pembawa mikoriza sebenarnya relatif sederhana. Hal terpenting di dalam proses produksi ini adalah tersedianya sumber daya manusia, starter inokulum dengan kualitas yang baik, sumber bahan baku pembawa seperti pasir atau zeolit, tanaman inang dan fasilitas produksi (Redecker et al., 1998; Prematuri dan Faiqoh, 1999 dalam Nurbaity et al., 2009).
lahan salin (Nurbaity et al., 2005 dalam Nurbaity et al. 2009), dan lahan yang tercekam kekeringan (Nurbaity et al., 2007 dalam Nurbaity et al., 2009). Kompos gambut pernah digunakan sebagai pembawa bahan pembawa mikoriza (Baon, 1998 dalam Nurbaity et al., 2009).
2.4 Teknik Aseptik
Sebelum benar-benar dilakukan proses kultur mikroorganisme, pertama- tama kita harus mempertimbangkan bagaimana agar tidak terjadi kontaminasi. Karena ukurannya yang sangat kecil, mikroorganisme mudah lepas dalam udara dan permukaan. Oleh karena itu, medium kultur harus disterilisasi secepatnya setelah preparasi untuk pemindahan mikroorganisme. Mediun kultur harus tetap steril demikian juga materi yang lain dalam isolasi (Cappuccino dan Sherman, 1983).
Teknik yang digunakan dalam pencegahan kontaminasi disebut teknik aseptik. Kontaminasi udara paling sering menjadi masalah karena udara selalu kontak dengan partikel mikroorganisme pada debu. Pembukaan wadah isolasi harus dengan hati-hati agar tidak terkontaminasi dengan udara sekitar. Transfer aseptik pada kultur dari salah satu medium ke medium yang lain harus dengan cermat. Alat pemindah materi (loop inokulasi atau jarum) harus disterilisasi oleh pembakaran pada nyala api. Dalam pertumbuhan kultur dibutuhkan tempat yang mudah dipindahkan ke permukaan agar datar, dimana pertumbuhan suatu koloni berasal dari pertumbuhan dan pembelahan sel tunggal (Cappuccino dan Sherman, 1983).
2.5 Biologi Jamur 2.5.1 Botani
Jamur dalam bahasa yunani disebut myless, dalam bahasa latin disebut
fungus (Schlegel dan Schmidt, 1985). Jamur adalah mikroorganisme yang tidak berklorofil, berbentuk hifa atau sel tunggal, termasuk eukariotik, dinding sel dari kitin atau selulosa, berproduksi secara seksual dan aseksual, dan memperoleh energi melalui absorpsi bahan organik (Gandjar et al., 1999).
mikron yang bercabang beberapa kali. Benang atau hifa terdiri dari dinding sel dan sitoplasma. Hifa pada jamur tingkat rendah mungkin tanpa dinding melintang (asepta) atau pada jamur tingkat tinggi sel-selnya terpisah oleh dinding-dinding melintang (septa) (Schlegel dan Schmidt, 1985).
Pada sebagian besar jamur, tiap-tiap bagian dari miselium memiliki potensi untuk tumbuh. Hal ini memudahkan memindahtumbuhkan jamur untuk perbanyakan (peremajaan) atau untuk mempertahankan isolat. Miselium dapat dibedakan atas miselium vegetatif yang berfungsi menyerap nutrisi dari lingkungan dan miselium fertil yang berfungsi dalam reproduksi (Gandjar et al., 1999). Kebanyakan jamur berproduksi secara seksual dan aseksual. Secara aseksual dengan membentuk spora, pembelahan, atau penguncupan (Pelczar dan Chan, 1986). Secara seksual berakhir dengan penyatuan dua inti. Reproduksi secara seksual dibedakan menjadi tiga tahap, yaitu: (1) plasmogami, yaitu penyatuan kedua protoplasma, sel yang terbentuk mengandung dua inti yang tidak segera menyatu diri tetapi dapat bertahan selama pembelahan sel sebagai stadium dikariotik, (2) kariogami, yaitu peleburan kedua inti haploid, dan (3) meiosis, yaitu pengurangan jumlah kromosom ke jumlah asal (haploid).
Klasifikasi jamur didasarkan pada ciri-ciri spora seksual dan tubuh buah yang dihasilkan selama tahap-tahap seksual dalam daur hidupnya. Jamur yang telah diketahui tingkat seksualnya disebut jamur sempurna, sedangkan jamur yang belum diketahui tingkat seksualnya disebut jamur tidak sempurna (Pelczar dan Chan, 1986). Berdasarkan cara dan ciri reproduksinya jamur dibagi menjadi empat kelas, yaitu: Phycomycetes, Ascomycetes, Basidiomycetes dan Deuteromycetes. Ciri utama keempat jamur tersebut diuraikan dalam Tabel 3.
Tabel 3. Ciri-ciri utama kelas jamur
Ciri-ciri Kelas
Phycomycetes Ascomycetes Basidiomycetes Deuteromycetes
Miselium Aseptat Septat Septat Septat
Spora aseksual Sporangiospora, Konida Konida` Konida Konida Spora seksual Zigospora, Oospora Askospora Basidiospora Tidak diketahui Habitat alami Air, tanah, hewan Air, hewan,
tumbuhan
2.5.2 Kebutuhan Nutrisi
Jamur dapat dibiakkan pada berbagai medium. Kebanyakan jamur dapat tumbuh dan berkembang baik pada medium yang mengandung karbohidrat tinggi dengan kisaran pH antara 5-6 (Dharmaputra et al., 1989). Kebutuhan nutrisi jamur diantaranya: karbon, nitrogen, mineral, oksigen dan zat-zat pelengkap.
a. Karbon
Jamur mendapatkan energi dengan cara mengoksidasi senyawa-senyawa organik atau dengan memanfaatkan CO2 sebagai sumber energi (Schlegel dan
Schmidt, 1985). Karbon dibutuhkan untuk pembentukan komponen sel (karbohidrat, asam amino, lipid, asam nukleat). Jamur memerlukan senyawa organik yang bersumber dari karbon seperti karbohidrat (monosakarida, disakarida, dan polisakarida) dan asam organik. Dari semua itu yang terpenting adalah karbohidrat (Landecker, 1996).
Disakarida dan polisakarida merupakan kelompok gula yang lebih kompleks dan merupakan sumber karbon yang paling banyak terdapat di alam, sedangkan monosakarida merupakan kelompok gula sederhana yang paling sering digunakan dalam jumlah sekitar 2%. Untuk memecahkan disakarida atau polisakarida jamur harus menghasilkan enzim ekstraseluler dan menyederhanakan komponen substrat menjadi unit yang larut yang kemudian dibawa hifa secara absortif (Miles, 1993).
b. Nitrogen
Nitrogen berperan untuk sintesa asam amino yang akan dipakai untuk membangun protoplasma (cairan sel). Nitrogen juga berperan sebagai komponen asam nukleat dan beberapa vitamin (B1, B2, dan lainnya). Sumber nitrogen yang umum pada media tumbuh jamur adalah garam nitrat, ammonium, dan komponen N organik (dalam bentuk asam amino, peptida atau pepton) (Landecker, 1996). c. Mineral
Mineral yang diperlukan jamur untuk pertumbuhan sama halnya dengan tumbuhan, berupa makro elemen seperti fosfor, sulfur, kalium, magnesium, dan berupa mikro elemen seperti: besi, seng, mangan, tembaga, dan molybdenum.
produk-produk metabolit sekunder. Fosfor terdapar dalam ATP, asam nukleat, dan fosfolipid membran. Kalium sebagai kofaktor berbagaisistem enzim. Magnesium sebagai pengaktivasi enzim. Elemen mukro berperan sebagai elemen konstituen dalam enzim-enzim dan dibutuhkan jamur dalam jumlah dan jenis yang terbatas. d. Oksigen
Fungsi utama oksigen adalah sebagai akseptor elektron terminal pada respirasi aerob, pada peristiwa ini oksigen direduksi menjadi air. Untuk sel oksigen tersedia dalam bentuk air selanjutnya oksigen juga terdapat dalam CO2
dan dalam banyak senyawa organik (Schlegel dan Schmidt, 1985). e. Zat pelengkap
Zat pelengkap merupakan zat-zat yang diperlukan oleh banyak organisme disamping nutrisi. Ada tiga kelompok zat pelengkap yaitu: asam-asam amino, senyawa purin, senyawa pirimidin, dan vitamin-vitamin. Senyawa purin, senyawa pirimidin dan asam amino merupakan bagian dari senyawa protein dan asam nukleat. Vitamin merupakan bagian dari iso enzim dan gugus prostetik yang mempunyai fungsi enzimatik katalitik yang digunakan dalam jumlah amat kecil (Schlegel dan Schmidt, 1985).
2.5.3 Pengaruh Lingkungan a. Suhu
Suhu berpengaruh terhadap aktivitas enzim, yaitu setiap kenaikan 10 oC aktivitas enzim berlangsung dua kali lebih cepat. Enzim juga terinaktivasi dapa suhu tinggi yang mempengaruhi kemampuan mensintesis komponen-komponen yang dibutuhkan, seperti vitamin, asam amino, atau metabolit lainnya (Landecker, 1996).
b. Derajat Keasaman (pH)
lintas kation esensial terbatas, sebaliknya pada pH tinggi menjadi jenuh dengan ion OH sehingga anion esensial terbatas (Landecker, 1996)
c. Cahaya
Pertumbuhan miselia sebagian besar jamur tidak sensitive terhadap cahaya. Meskipun demikian, cahaya yang kuat dapat menghambat pertumbuhan miselia, bahkan dapat membunuhnya, efek cahaya dapat merusak vitamin yang dibentuk jamur. Sebaliknya cahaya dibutuhkan pada pembentukan tubuh buah (Landecker, 1996)
2.6 Ganoderma spp.
Jamur pelapuk kayu dan penyebab penyakit pada pohon pohon hutan sebagian besar berasal dari beberapa spesies Ganoderma spp.. Ganoderma spp. merupakan jamur tingkat tinggi yang tergolong dalam kelas Basidiomycetes ordo Polyporanceae family Ganodermataceae.
Ganoderma spp. adalah jamur polyporus yang mempunyai daerah penyebaran tempat tumbuh yang cukup luas dan dikenal sebagai penyebab penyakit akar pada banyak jenis tanaman berkayu. Di hutan alam jamur ini cenderung menyerang pohon-pohon tua atau yang telah mengalami penurunan pertumbuhan, dan juga dapat menyebabkan pembusukan kayu kayu yang sudah mati. Pada hutan tanaman dan perkebunan jamur ini telah dilaporkan menjadi pathogen akar yang potensial dan telah banyak menyerang beberapa jenis tanaman (Semangun, 2000).
Keunikan dari jenis ini adalah miseliumnya yang tidak sekompleks tubuh buahnya. Pada miselium Ganoderma spp. sebagian besar kandungan di dalamnya adalah senyawa polisakarida dan Germanium organic sedangkan dalam tubuh buahnya Ganoderma spp. memilki lebih dari 200 senyawa aktif dengan tiga kelompok utama. Kelompok pertama adalah senyawa larut dalam air sebanyak 30% seperti polisakarida dan Germanium organic, senyawa yang larut dalam pelarut organik 65% seperti adenosin dan terpenoid, 5% nya adalah senyawa volatil seperti ganoderat. Zat unik dalam jenis ini adalah immunopotentiator dan polisakarida yang dapat menginduksi interferon (Jong dan Birmingham, 1992). Jamur ini dideskripsikan pertama kali oleh Karsten (1881, dalam Basset, 2005) dengan G. Lucidun (W. Curt. Fr.) sebagai satu-satunya jenis. Murill (1908, dalam Pajirmo dan Soenanto, 2008), yang mendasarkan taksonominya pada spesifikasi inang, distribusi geografi, dan morfologi luar tubuh buah, menyebutkan terdapat tujuh jenis Ganoderma spp. yang hidup di daerah iklim sedang, yaitu G. tsugae, G. sessile, G. zonatum, G. ulcatum, G. Oregonense, G. sequolae dan G. nevadense. Turner (1981) melaporkan bahwa paling sedikit terdapat 15 species
Ganoderma di berbagai tempat di dunia, yang menyebabkan penyakit busuk pangkal batang. Saat ini di seluruh dunia sudah diidentifikasi 250 spesies
Ganoderma spp. namun masih terdapatnya tumpang tindihnya penamaan yang menyebabkan perkiraan jumlah spesies Ganoderma spp. sebenarnya kurang dari angka tersebut.
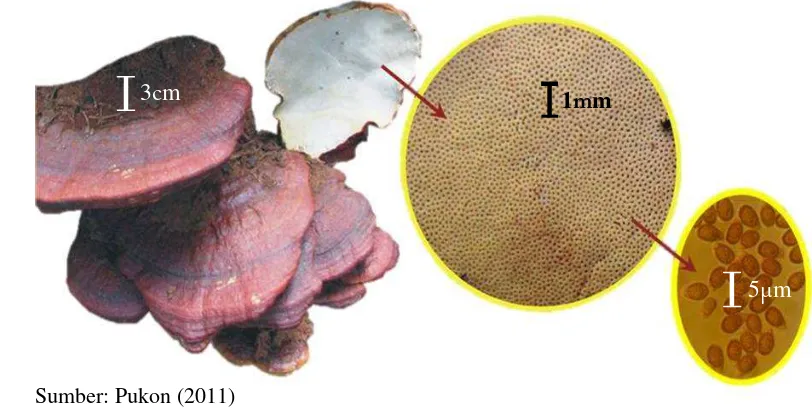
Berikut adalah deskripsi dari tubuh buah Ganoderma Spp. yang diamati secara mikroskopis.
Sumber: Pukon (2011)
Gambar 1 Pengamatan mikroskopis Ganoderma spp.
5µm 1mm
BAB III
METODOLOGI
3.1 Waktu dan tempat
Seluruh rangkaian kegiatan dari penelitian ini dilakukan selama kurang lebih 9 bulan efektif. Setiap kegiatan dari penelitian ini dilakukan pada tempat yang berbeda-beda. Peremajaan dan inokulasi dari kedua buah Ganoderma spp. tersebut dilakukan di Laboratorium Penyakit Hutan IPB dan LRPI. Selanjutnya seluruh rangkaian kegiatan dilakukan di Laboratorium Penyakit Hutan IPB, Laboratorium Biologi Tanah IPB, dan rumah kaca Departemen Silvikultur IPB. 3.2 Bahan dan Alat
Bahan dan alat yang digunakan untuk inokulasi isolat Ganoderma spp. ke media kayu, antara lain, toples kaca transparan berukuran diameter 12 -15 cm dan tinggi 13-16 cm berlabel, kayu sengon diameter 3 cm, 4 cm, dan 5 cm dengan panjang 5 cm, PDA steril, Laminar air flow, dan peralatan isolasi aseptik,
Autoclave, Plastic wrap, dan Isolat murni dari Ganoderma spp. dari tanaman kakao (Sp.4) dan sengon (Sp.3) koleksi laboratorium Penyakit Hutan. Lalu bahan
dan alat untuk penanaman inokulum Ganoderma spp. bersama bibit sengon usia 2 bulan antara lain, bibit sengon usia 1½ bulan dari persemaian Cibanteng, Bogor, Polibag, bahan pembawa agar dan bahan pembawa kayu yang telah diinokulasi
Ganoderma spp. kakao dan sengon, PDA steril dan kayu steril, media tanam tanah, arang sekam, dan kompos dengan perbandingan 2:1:1, Autoclave dan plastik PP, dan Sungkup bambu dengan paranet 75 %
3.3 Metode Penelitian
Rangkaian kegiatan dari penelitian ini terdiri dari pembuatan bahan pembawa, penanaman bahan pembawa bersama bibit sengon, pemeliharaan bibit, pengambilan data, dan analisis statistik. Kegiatan ini dimulai dari kegiatan pembuatan bahan pembawa PDA dan bahan pembawa kayu. Bahan pembawa PDA dibuat dengan cara peremajaan isolat Ganoderma spp. kakao (Sp.4) dan
isolat Ganoderma spp. sengon (Sp.3). bahan pembawa kayu dibuat dengan cara
Kegiatan penanaman bahan pembawa bersama bibit membutuhkan PDA dan kayu yang steril, dan PDA dan kayu yang telah diinokulasi. Apabila semua tanaman sengon pada semua perlakuan berhasil hidup dengan stabil pasca penyapihan, kegiatan pengamatan dan pengambilan data dari tanaman dapat dilakukan. Data yang dikumpulkan selama kegiatan pengamatan diolah kembali dalam kegiatan analisa statistik.
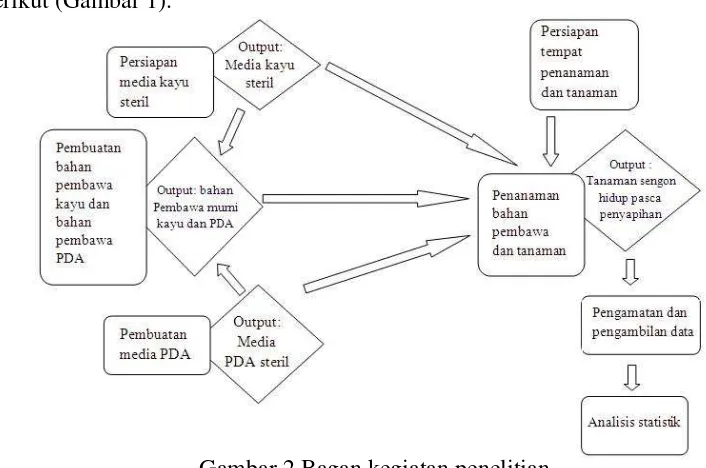
Secara umum, rangkaian kegiatan penelitian ini digambarkan dalam Bagan berikut (Gambar 1).
Gambar 2 Bagan kegiatan penelitian.
3.3.1 Pembuatan Bahan Pembawa Kayu dan Bahan Pembawa PDA
Kegiatan ini terdiri atas sterilisasi media kayu sengon, peremajaan isolat Sp.3 dan isolat Sp.4 pada wadah stoples dan cawan Petri yang diisi media PDA, dan kegiatan inokulasi isolat ke media kayu dengan menggunakan bahan pembawa PDA.
Gambar 3 Tahapan sterilisasi kayu. 3a Pengupasan kulit. 3b Perebusan kayu. 3c Pengukusan kayu dengan autoclave.
Kegiatan peremajaan isolat dilakukan secara aseptik dalam laminar air flow. Cawan Petri yang digunakan memiliki ukuran diameter 9 cm. Stoples yang digunakan sebagai wadah memiliki ukuran diameter 12 cm-15 cm dan tinggi 13 cm-16 cm. Isolat murni Ganoderma spp. dari cawan Petri ditanamkan pada media PDA dalam stoples hingga isolat berkembang dan menutupi seluruh permukaan media PDA.
Setelah isolat menutupi seluruh permukaan media didalam stoples dan dipastikan tidak terjadi kontaminasi, Media kayu steril dimasukkan ke dalam stoples, jumlah kayu disesuaikan berdasarkan ukuran diameter kayu dan diameter stoples. Kemudian stoples diinkubasi selama 1-2 bulan atau sampai miselium
Ganoderma spp. merayap naik ke atas media kayu dan menutupi seluruh permukaan kayu.
Gambar 4 Bahan pembawa kayu.
a b c
5 cm 5 cm
5 cm
3.3.2 Penanaman Inokulum Bersama Bibit Sengon Usia 1½ Bulan.
Kegiatan ini diawali dengan kegiatan penyiapan media tanam sengon steril dengan komposisi tanah, arang sekam, dan kompos sapi dengan perbandingan 2:1:1. Metode sterilisasi tanah yang digunakan adalah sterilisasi panas basah dengan menggunakan autoclave. Tanah yang sudah steril langsung digunakan setelah 1x24 jam untuk mengantisipasi terjadinya kontaminasi dan menghindari suhu tanah yang terlalu panas. Penyapihan dilakukan setelah batangnya berkayu dan kulit terlepas, yaitu pada umur 1 – 1½ bulan setelah tumbuh pada waktu pagi atau sore hari (Hidayat 2002). Setelah seluruh bibit sengon di sapih dan inokulum ditanam bersama bibit, seluruh bibit di letakkan ke dalam sungkup yang telah dilapisi dengan paranet 75% untuk menjaga ke stabilan suhu dan mengurangi intensitas cahaya matahari.
Gambar 5 Perbandingan kompos, arang sekam, dan tanah.
Bibit sengon ditanam dengan beberapa perlakuan yang berbeda, yaitu perlakuan kontrol, penanaman kayu tanpa inokulasi (Sp.0) dan kayu dengan
inokulasi (Sp.3 dan Sp.4), dan penanaman PDA tanpa inokulasi dan PDA dengan
inokulasi (A). Kayu yang ditanamkan bersama bibit untuk dibedakan atas 3 ukuran, yaitu kayu dengan diameter 3 cm (K3), 4 cm (K4), dan 5 cm (K5). Isolat
yang ditanamkan terbagi atas 2 jenis yaitu isolat Ganoderma spp. sengon (Sp.3)
dan isolat Ganoderma spp. kakao (Sp.4). Bibit sengon pada setiap perlakuan
diberikan 2 jenis perlakuan pemotongan akar, yaitu dengan pemotongan akar (P1)
dan tanpa pemotongan akar (P0). Setiap perlakuan diberikan 3 kali ulangan,
sehingga apabila seluruh perlakuan diurutkan adalah sebagai berikut : Kompos
Arang
• Perlakuan 1, yaitu perlakuan kontrol, tanpa pemotongan akar (Kontrol P0)
• Perlakuan 2, yaitu perlakuan kontrol, pemotongan akar (Kontrol P1)
• Perlakuan 3, yaitu penanaman dengan kayu tanpa inokulasi 3 cm, tanpa pemotongan akar (K3 Sp.0 P0)
• Perlakuan 4, yaitu penanaman dengan kayu tanpa inokulasi 3 cm, pemotongan akar (K3 Sp.0 P1)
• Perlakuan 5, yaitu penanaman dengan kayu tanpa inokulasi 4 cm, tanpa pemotongan akar (K4 Sp.0 P0)
• Perlakuan 6, yaitu penanaman dengan kayu tanpa inokulasi 4 cm, pemotongan akar (K4 Sp.0 P1)
• Perlakuan 7, yaitu penanaman dengan kayu tanpa inokulasi 5 cm, tanpa pemotongan akar (K5 Sp.0 P0)
• Perlakuan 8, yaitu penanaman dengan kayu tanpa inokulasi 5 cm, pemotongan akar (K5 Sp.0 P1)
• Perlakuan 9, yaitu penanaman dengan PDA tanpa inokulasi, tanpa pemotongan akar (A Sp.0 P0)
• Perlakuan 10, yaitu penanaman dengan PDA tanpa inokulasi, pemotongan akar (A Sp.0 P1)
• Perlakuan 11, yaitu penanaman dengan kayu yang diinokulasi isolat
Ganoderma spp. sengon 3 cm, tanpa pemotongan akar (K3 Sp.3 P0)
• Perlakuan 12, yaitu penanaman dengan kayu yang diinokulasi isolat
Ganoderma spp. sengon 3 cm, pemotongan akar (K3 Sp.3 P1)
• Perlakuan 13, yaitu penanaman kayu yang diinokulasi isolat Ganoderma spp. sengon 4 cm, tanpa pemotongan akar (K4 Sp.3 P0)
• Perlakuan 14, yaitu penanaman kayu yang diinokulasi isolat Ganoderma spp. sengon 4 cm, pemotongan akar (K4 Sp.3 P1)
• Perlakuan 15, yaitu penanaman kayuyang diinokulasi isolat Ganoderma spp. sengon 5 cm, tanpa pemotongan akar (K5 Sp.3 P0)
• Perlakuan 16, yaitu penanaman kayu yang diinokulasi isolat Ganoderma spp. kakao 5 cm, pemotongan akar (K5 Sp.3 P1)
• Perlakuan 18, yaitu penanaman PDA yang diinokulasi isolat Ganoderma spp. sengon, pemotongan akar (A Sp.3 P1)
• Perlakuan 19, yaitu penanaman kayu yang diinokulasi isolat Ganoderma spp. kakao 3 cm, tanpa pemotongan akar (K3 Sp.4 P0)
• Perlakuan 20, yaitu penanaman kayu yang diinokulasi isolat Ganoderma spp. kakao 3 cm, pemotongan akar (K3 Sp.4 P1)
• Perlakuan 21, yaitu penanaman kayu yang diinokulasi isolat Ganoderma spp. kakao 4 cm, tanpa pemotongan akar (K4 Sp.4 P0)
• Perlakuan 22, yaitu penanaman kayu yang diinokulasi isolat Ganoderma spp. kakao 4 cm, pemotongan akar (K4 Sp.4 P1)
• Perlakuan 23, yaitu penanaman kayu yang diinokulasi isolat Ganoderma spp. kakao 5 cm, tanpa pemotongan akar (K5 Sp.4 P0)
• Perlakuan 24, yaitu penanaman kayu yang diinokulasi isolat Ganoderma spp. kakao 5 cm, pemotongan akar (K3 Sp.4 P1)
• Perlakuan 25, yaitu penanaman PDA yang diinokulasi isolat Ganoderma spp. kakao, tanpa pemotongan akar (A Sp.4 P0)
• Perlakuan 26, yaitu penanaman PDA yang diinokulasi isolat Ganoderma spp. kakao, pemotongan akar (A Sp.4 P1)
3.3.3 Pengamatan, Pengambilan Data, dan Pengolahan Data
Variabel yang diukur adalah pertambahan jumlah anak daun dan tinggi bibit. Tinggi bibit yang diukur adalah dari pangkal batang bawah hingga pucuk teratas yang dilakukan dengan menggunakan penggaris. Data yang didapat kemudian dituliskan pada tally sheet (lampiran) yang telah dipersiapkan. Data akhir diolah menggunakan program SAS versi 9. Pengolahan data bertujuan untuk mengukur pengaruh inokulasi Ganoderma spp. terhadap pertumbuhan bibit sengon (P. falcataria), memperhitungkan pengaruh ukuran kayu sebagai pembawa, membandingkan jenis isolat Ganoderma spp., dan mengukur pengaruh pemotongan akar terhadap kedua variabel yang diamati.
kebanyakan dilakukan secara mekanik (pengambilan langsung hama yang terlihat) supaya tidak mempengaruhi pertumbuhan jamur.
Model analisa yang digunakan adalah RAK (Rancangan acak kelompok) 4 blok dan 2 faktor. Model ini digunakan karena setiap amatan ditempatkan pada kondisi bahan pembawa jamur yang berbeda. Empat blok amatan terbagi atas, pembawa kayu diameter 3 cm, pembawa kayu diameter 4 cm, pembawa kayu 5 cm, dan pembawa agar (PDA).
Faktor dalam model terdiri dari faktor pemotongan akar dan faktor isolat
Ganoderma spp. yang digunakan. Faktor pemotongan akar terdiri dari dengan pemotongan akar (P1) dan tanpa pemotongan akar (P0). Faktor inokulasi terdiri
dari inokulasi isolat sengon (Sp.3), inokulasi isolat kakao (Sp.4), dan tanpa
inokulasi (Sp.0).
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil
Berikut ini adalah rekapitulasi dari rata-rata pertambahan jumlah anak daun dan pertambahan tinggi sengon di setiap perakuan yang ditampilkan dalam bentuk tabel.
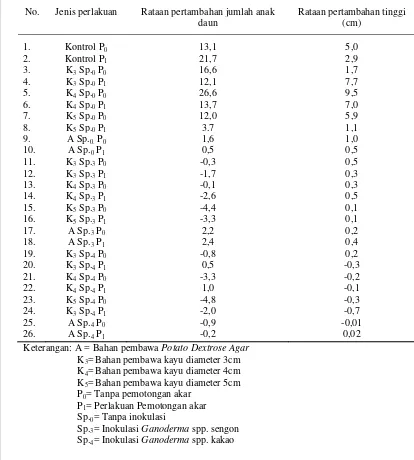
Tabel 4. Rekapitulasi rata-rata pertambahan jumlah anak daun dan tinggi tanaman selama 2 bulan
No. Jenis perlakuan Rataan pertambahan jumlah anak daun
Keterangan: A = Bahan pembawa Potato Dextrose Agar K3=Bahan pembawa kayu diameter 3cm
K4=Bahan pembawa kayu diameter 4cm
K5=Bahan pembawa kayu diameter 5cm
P0= Tanpa pemotongan akar
P1= Perlakuan Pemotongan akar
Sp.0= Tanpa inokulasi
Sp.3= Inokulasi Ganoderma spp. sengon
Berdasarkan tabel rekapitulasi diatas, dapat diketahui bahwa perlakuan inokulasi Ganoderma spp. (Sp.3 dan Sp.4) memiliki tingkat pertumbuhan anak
daun dan tinggi lebih rendah daripada perlakuan tanpa inokulasi (Sp.0). Hal
tersebut juga terlihat dari pengamatan fisik sesuai dengan Gambar 5 dibawah ini.
Gambar 6 Perbandingan perlakuan Sp.0, Sp.3, dan Sp.4.
Nilai minus disebabkan oleh berkurangnya rata-rata pertambahan jumlah anak daun dan tinggi tanaman. Secara kasat mata, pada 3 minggu pertama setelah penanaman, tidak ada perbedaan yang mencolok dari perkembangan tanaman sengon pada setiap perlakuan. Pada minggu ke-5, pertumbuhan tanaman antara perlakuan Sp.0, Sp.3 dan Sp.4 mulai terlihat perbedaannya. Perbedaan tersebut
terdapat pada perkembangan pucuk tanaman yang terhambat, serta munculnya tanda penyakit berupa tubuh buah Ganoderma spp. pada beberapa tanaman sengon yang diberikan perlakuan kayu yang diinokulasi isolat Sp.3 dan Sp.4 seperti
yang ditunjukkan pada Gambar 6.
Gambar 7 Tubuh buah Ganoderma spp pada perlakuan kayu yang diinokulasi Isolat Sp.3 dan Sp.4 (diberi tanda
lingkaran putih).
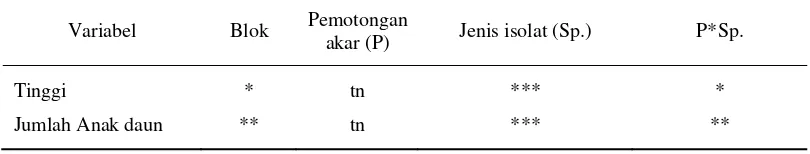
Tabel 5. Rekapitulasi hasil sidik ragam terhadap variabel yang diamati Variabel Blok Pemotongan
akar (P) Jenis isolat (Sp.) P*Sp.
Tinggi * tn *** *
Jumlah Anak daun ** tn *** **
Keterangan : ***= Berbeda nyata pada taraf uji 0,01 **= Berbeda nyata pada taraf uji 0,05 *= Berbeda nyata pada taraf uji 0,1 tn= Tidak berbeda nyata
Berdasarkan hasil sidik ragam, faktor pemotongan akar tidak berbeda nyata terhadap variabel pertambahan tinggi dan pertambahan jumlah anak daun. Faktor jenis isolat (Sp.0, Sp.3, dan Sp.4) berbeda nyata pada pada tingkat
kepercayaan 99% terhadap kedua variabel. Interaksi kedua faktor tersebut berbeda nyata pada tingkat kepercayaan 95% terhadap variabel pertambahan jumlah anak daun dan berbeda nyata terhadap variabel pertambahan tinggi pada tingkat kepercayaan 90%. Blok yang terdiri dari jenis bahan pembawa yang digunakan (PDA, kayu diameter 3 cm, 4, cm, dan 5 cm) berbeda nyata pada tingkat kepercayaan 90% terhadap variabel pertambahan tinggi dan berbeda nyata pada tingkat kepercayaan 95% terhadap variabel pertambahan anak daun.
4.1.1. Pengaruh Blok (Jenis Bahan Pembawa)
Tabel 6. Hasil uji Duncan pengaruh blok terhadap pertambahan anak daun Jenis bahan pembawa Rata-rata pertambahan jumlah anak daun
Kayu diameter 4 cm (K3) 5,9 a
Kayu diameter 3 cm (K4) 4,4 ab
Kayu diameter 5 cm (K5) 0,2 c
PDA (A) 0,9 bc
Keterangan: Huruf yang sama dibelakang angka menunjukkan pengaruh yang tidak berbeda nyata pada tingkat kepercayaan 95%.
Secara umum keempat jenis bahan pembawa memberikan pengaruh yang berbeda, baik terhadap pertambahan anak daun, maupun terhadap pertambahan tinggi tanaman. K5 memiliki rata-rata pertambahan jumlah anak daun terkecil
dengan nilai 0,9. Nilai dari rata-rata pertumbuhan anak daun kedua jenis bahan pembawa tersebut berbeda cukup jauh dengan rata-rata pertumbuhan anak daun dari K4 dan K3 yang masing masing bernilai 5,9 dan 4,4.
Walaupun nilai dari A dan K4 terpaut cukup jauh, namun kedua perlakuan
tersebut tidak berbeda nyata pada tingkat kepercayaan 95%. Perlakuan A hanya berbeda nyata terhadap perlakuan K3 dan tidak berbeda nyata dengan perlakuan
K5. Perlakuan K5 berbeda nyata dengan perlakuan K4 dan K3, namun tidak
berbeda nyata dengan perlakuan A.
Pengaruh jenis bahan pembawa terhadap pertumbuhan tinggi tanaman tidak menunjukkan perbedaan menonjol sebagaimana ditunjukkan pada variabel pertambahan jumlah anak daun. Rata-rata pertambahan tinggi terkecil terdapat pada jenis bahan pembawa K5 dengan nilai 0,4 cm. Rata-rata pertumbuhan tinggi
yang paling tinggi terdapat pada jenis bahan pembawa K4 dengan nilai 2,8 cm. K3
dan A masing masing bernilai 1,7 cm dan 1,0 cm.
Tabel 7. Hasil uji Duncan pengaruh blok terhadap pertambahan tinggi Jenis bahan pembawa Rata-rata pertambahan tinggi
(cm)
Kayu diameter 3 cm (K3) 1,7 ab
Kayu diameter 4 cm (K4) 2,8 a
Kayu diameter 5 cm (K5) 0,4 b
PDA (A) 1,0 ab
Keterangan: Huruf yang sama dibelakang angka menunjukkan pengaruh yang tidak berbeda nyata pada tingkat kepercayaan 95%
Jenis bahan pembawa yang berbeda nyata pada variabel pertambahan tinggi hanya K4 dan K5. Bahan pembawa K3 dan A tidak berbeda nyata satu sama
lain dan tidak berbeda nyata dengan bahan pembawa K3 dan A.
4.1.2. Pengaruh Jenis Isolat (Sp.)
Isolat jamur yang digunakan dalam penelitian ini hanya 2 jenis, namun untuk membandingkan perlakuan dengan kontrol, maka Sp.0 (tanpa inokulasi)
pertambahan jumlah anak daun yang lebih baik daripada perlakuan Sp.3 (inokulasi
isolat sengon) dan SP.4 (inokulasi isolat kakao). Perbedaan tersebut juga terlihat
secara statistik. Tanaman yang diberikan perlakuan Sp.0 memiliki rata-rata
pertambahan anak daun paling tinggi dengan nilai 10,9. Nilai tersebut jauh lebih tinggi jika dibandingkan rata-rata pertambahan anak daun dari tanaman yang diberikan perlakuan Sp.4 dan Sp.3 yang masing masing bernilai -1,3 dan -1,0.
Tabel 8. Hasil uji Duncan pengaruh faktor jenis isolat jamur terhadap pertambahan anak daun
Perlakuan jenis isolat Rata-rata pertambahan jumlah anak daun
Tanpa Inokulasi (Sp.0) 10,9 a
Inokulasi Ganoderma spp. kakao (Sp.4) -1,3 b
Inokulasi Ganoderma spp. sengon (Sp.3) -1,0 b
Keterangan: Huruf yang sama dibelakang angka menunjukkan pengaruh yang tidak berbeda nyata pada tingkat kepercayaan 95%
Pada hasil uji Duncan pengaruh faktor jenis isolat terhadap pertambahan anak daun, perlakuan Sp.0 berbeda nyata dengan Sp.3 dan Sp.4. Walaupun rata-rata
pertambahan anak daun perlakuan Sp.3 memiliki rata-rata pertambahan jumlah
anak daun yang lebih kecil daripada perlakuan Sp.4, namun perlakuan Sp.3 tidak
berbeda nyata dengan perlakuan Sp.4.
Tanaman yang diberikan perlakuan Sp.0 memiliki rata-rata pertambahan
tinggi yang paling tinggi dengan nilai 4,3 cm. Perlakuan Sp.3 memiliki rata-rata
pertambahan tinggi 0,3 cm dan Perlakuan Sp.4 memiliki rata-rata pertambahan
tinggi -0,2 cm.
Tabel 9. Hasil uji Duncan pengaruh faktor jenis isolat jamur terhadap pertambahan tinggi tanaman
Perlakuan jenis jamur Rata-rata pertambahan tinggi (cm)
Tanpa Inokulasi (Sp.0) 4,3 a
Inokulasi Ganoderma spp. sengon (Sp.3) 0,3 b
Inokulasi Ganoderma spp. kakao (Sp.4) -0,2 b
Hasil uji Duncan faktor jenis isolat jamur terhadap pertambahan tinggi menunjukkan bahwa, pertambahan tinggi paling rendah terdapat pada tanaman yang diberikan inokulasi isolat jamur Sp.4. Perlakuan Sp.3 dan Sp.4 tidak berbeda
nyata pada tingkat kepercayaan 95%. Perlakuan Sp.3 dan Sp.4 berbeda nyata
terhadap perlakuan Sp.0 yang memiliki rata-rata pertambahan tinggi paling tinggi.
4.1.3. Pengaruh Pemotongan Akar (P)
Perlakuan P1 memiliki pertambahan anak daun lebih tinggi dengan nilai
dengan nilai 3,7. Perlakuan P0 yang memiliki rata-rata pertambahan jumlah anak
daun lebih rendah dengan nilai 2,0. Kedua perlakuan tersebut tidak berbeda nyata pada tingkat kepercayaan 95%.
Tabel 10. Hasil uji Duncan pengaruh pemotongan akar terhadap pertambahan anak daun
Perlakuan pemotongan akar Rata-rata pertambahan jumlah anak daun
Pemotongan Akar (P1) 3,7 a
Tanpa Pemotongan Akar (P0) 2,0 a
Keterangan: Huruf yang sama dibelakang angka menunjukkan pengaruh yang tidak berbeda nyata pada tingkat kepercayaan 95%
Perlakuan P0 dan P1 tidak memiliki perbedaan nilai rata-rata pertambahan
tinggi yang signifikan. Rata-rata pertambahan tinggi dari kedua perlakuan tersebut hanya terpaut kurang dari 1 cm. Rata-rata pertambahan tinggi tanaman pada perlakuan P0 lebih tinggi daripada rata-rata pertambahan tinggi tanaman pada
perlakuan P1. Nilai dari rata-rata pertambahan tinggi dari kedua perlakuan tersebut
secara berturut-turut adalah 1,6 cm untuk perlakuan P0 dan 1,4 cm untuk
perlakuan P1.
Tabel 11. Hasil uji Duncan pengaruh pemotongan akar terhadap pertambahan tinggi
Perlakuan pemotongan akar Rata-rata pertambahan tinggi (cm)
Pemotongan Akar (P1) 1,4 a
Tanpa Pemotongan Akar (P0) 1,6 a
4.1.4. Pengaruh Interaksi Faktor Pemotongan Akar dan Jenis Isolat
Tabel 12. Hasil uji Duncan pengaruh interaksi antara faktor pemotongan akar dan jenis isolat terhadap pertambahan jumlah anak daun
Perlakuan Interaksi 2 Faktor Rata-rata pertambahan jumlah anak daun
Pemotongan akar, tanpa inokulasi (P1 Sp.0) 7,5 b
Tanpa pemotongan akar, tanpa inokulasi (P0 Sp.0) 14,2 a
Tanpa Pemotongan akar, inokulasi Ganoderma spp. sengon (P0 Sp.3)
-0,7 c
Pemotongan akar, inokulasi Ganoderma spp. sengon (P1 Sp.3)
-1,3 c
Pemotongan akar, inokulasi Ganoderma spp. kakao (P1 Sp.4)
-0,2 c
Tanpa pemotongan akar, inokulasi Ganoderma spp. kakao (P0 Sp.4)
-2,4 c
Keterangan: Huruf yang sama dibelakang angka menunjukkan pengaruh yang tidak berbeda nyata pada tingkat kepercayaan 95%
Interaksi faktor dalam suatu penelitian menjelaskan bagaimana interaksi antar faktor dapat mempengaruhi respon atau variabel yang diamati. Dalam penelitian ini hanya terdapat dua faktor sehingga hanya ada 1 interaksi yaitu interaksi antara faktor pemotongan akar dengan faktor jenis isolat jamur. Rata-rata pertambahan jumlah anak daun tertinggi terdapat pada perlakuan P0 Sp.0 dengan
nilai 14,2. Rata-rata pertambahan anak daun yang paling rendah terdapat pada perlakuan P1 Sp.4 dengan nilai -0,2.
Interaksi dari kedua faktor mempengaruhi pertambahan jumlah anak daun pada tanaman. Perlakuan P0 Sp.0 berbeda nyata dengan perlakuan P1 Sp.0.
Perlakuan P0 Sp.0 dan perlakuan P1 Sp.0 berbeda nyata dengan perlakuan P1 Sp.3,
P0 Sp.3, P1 Sp.4, dan P0 Sp.4. Perlakuan P1 Sp.3, P0 Sp.3, P1 Sp.4, dan P0 Sp.4 tidak
berbeda nyata satu sama lain.
Pada tabel hasil uji Duncan pengaruh interaksi faktor terhadap pertambahan tinggi tanaman, perlakuan P0 Sp.0 dan P1 Sp.0, yang nilai memiliki
nilai rata-rata pertambahan tinggi masing-masing 4,5 cm dan 4,064 cm, tidak berbeda nyata satu sama lain. Perlakuan P0 Sp.0 dan P1 Sp.0 berbeda nyata dengan
perlakuan P0 Sp.3, P1 Sp.3, P0 Sp.4, dan P0 Sp.4 yang masing masing bernilai 0,3
Tabel 13. Hasil uji Duncan pengaruh interaksi antara faktor pemotongan akar dan jenis isolat terhadap pertambahan jumlah anak daun
Perlakuan interaksi 2 faktor Rata-rata pertambahan tinggi (cm)
Tanpa pemotongan akar, tanpa inokulasi (P0 Sp.0) 4,5 a
Pemotongan akar, tanpa inokulasi (P1 Sp.0)
4,1 a
Tanpa Pemotongan akar, inokulasi Ganoderma spp. sengon (P0 Sp.3)
0,3 b
Pemotongan akar, inokulasi Ganoderma spp. sengon (P1
Sp.3)
0,3 b
Tanpa Pemotongan akar, inokulasi Ganoderma spp. kakao (P0 Sp.4)
-0,07 b
Pemotongan akar, inokulasi Ganoderma spp. kakao (P1
Sp.4)
-0,3 b
Keterangan: Huruf yang sama dibelakang angka menunjukkan pengaruh yang tidak berbeda nyata pada tingkat kepercayaan 95%
4.2. Pembahasan
Hasil penelitian ini menunjukkan bahwa faktor yang paling mempengaruhi pertumbuhan tanaman secara nyata adalah faktor jenis isolat. Hal tersebut menunjukkan perbedaan antara perlakuan tanpa inokulasi dan perlakuan dengan inokulasi, sehingga terdapat gambaran bahwa metode inokulasi Ganoderma spp. yang dilakukan cukup efektif.
Isolat Ganoderma spp., baik yang diambil dari tanaman sengon maupun tanaman kakao, mampu menginfeksi tanaman sengon dengan baik. Meskipun tanaman yang diberikan perlakuan isolat Sp.4 memiliki pertumbuhan yang lebih
buruk terhadap pertambahan tinggi dan pertambahan jumlah anak daun dibandingkan dengan tanaman yang diberikan perlakuan isolat Sp.3, namun kedua
isolat yang diujikan tidak berbeda nyata pada tingkat kepercayaan 95%. Hal tersebut mengindikasikan bahwa Ganoderma spp. yang menginfeksi tanaman kakao dapat menular ke tanaman sengon, begitu pula sebaliknya. Sehingga bisa dikatakan bahwa sistem agroforestri tanaman cokelat dan sengon memiliki resiko epidemi penyakit busuk akar yang disebabkan Ganoderma Spp.. Hasil Penelitian juga mengindikasikan bahwa tanaman sengon pada tingkat semai dapat terinfeksi
Ganoderma spp. apabila media tanam telah telah terkontaminasi Ganoderma
Faktor pemotongan akar yang tidak berbeda nyata satu sama lain disebabkan oleh perbedaan reaksi dari tanaman yang diberikan perlakuan tanpa inokulasi dan perlakuan inokulasi terhadap pemotongan akar. Tanaman yang diberikan perlakuan potong akar pada perlakuan tanpa inokulasi (Sp.0 P1)
memiliki rata-rata pertambahan anak daun yang lebih tinggi dibandingkan perlakuan tanpa inokulasi tanpa potong akar (Sp.0 P0). Rook (1972) menyatakan
bahwa semai yang diberikan perlakuan pemotongan akar memiliki rasio pucuk/akar yang lebih seimbang dan meningkatkan keberhasilan penanaman di lapangan. Sedangkan Darmono dan Panji (1999) menyatakan bahwa penularan
Ganoderma terjadi melalui kontak akar dengan cendawan,luka pada akar dapat meningkatkan kemungkinan infeksi dari jamur busuk akar. Gejala yang dialami oleh tanaman yang terinfeksi jamur Ganoderma spp. antara lain, terhambatnya perkembangan pucuk dan akar, serta daun yang rontok. Pada penelitian ini perlakuan pemotongan akar dan tanpa pemotongan akar pada perlakuan inokulasi tidak berbeda nyata, hal ini menunjukkan bahwa terdapat faktor lain diluar perlakuan yang mempengaruhi perlakuan pemotongan akar.
Pada beberapa perlakuan inokulasi kayu ditemukan tubuh buah
Ganoderma spp.. Jamur yang telah membentuk tubuh buah memiliki hambatan pertumbuhan lebih rendah (Jones, 1997), maka kemungkinan jamur untuk berkembang dan menginfeksi akar akan semakin besar. Tubuh buah Ganoderma
spp. pada bibit sengon tidak muncul pada pangkal batang sebagaimana ditemukan pada tanaman dewasa (Basset dan Peters, 2003). Tubuh buah Ganoderma spp. muncul dari bagian polibag yang berlubang. Ganoderma spp dari kayu diduga berkembang dan merambat melalui arang sekam dan membentuk tubuh buah. Arang sekam digunakan sebagai campuran media dalam penelitian ini karena memiliki porositas yang baik bagi perkembangan akar dan memiliki daya pegang air yang tinggi (Balai Penelitian Pasca Panen, 2001 dalam Nurbaity et al., 2009). Namun rupanya baru-baru ini media arang sekam juga telah digunakan sebagai media bahan pembawa mikoriza arbuskula untuk aplikasinya di lapangan (Patadungan, 2009 dalam Nurbaity et al.,2009). Dengan begitu, ada kemungkinan bahwa arang sekam juga efektif sebagai bahan pembawa pada uji inokulasi
inokulasi dengan menggunakan bahan pembawa kayu, terdapat tanda penyakit lain yaitu miselium pada akar tanaman.
Gambar 8 Tubuh buah setelah polibag dibuka.
Pertumbuhan tinggi dan anak daun yang paling rendah ditemukan pada tanaman dengan jenis bahan pembawa kayu berdiameter 5 cm. Dengan kata lain bahan pembawa kayu berukuran 5 cm adalah bahan pembawa yang paling efektif untuk menginokulasi tanaman. Hal ini disebabkan karena kayu dengan diameter 5 cm memiliki volume yang lebih besar dan secara memiliki kandungan nutrisi yang lebih banyak, sehingga lebih menunjang jamur untuk berkembang.
Gambar 9 Miselium pada akar tanaman yang diberikan perlakuan inokulasi kayu Walaupun perlakuan inokulasi dengan bahan pembawa PDA memiliki rata-rata pertambahan tinggi dan anak daun yang kecil, namun pada perlakuan tersebut tidak ditemukan tanda penyakit seperti miselium akar dan tubuh buah, sebagaimana yang muncul pada perlakuan inokulasi kayu. Berdasarkan data yang didapatkan, pertumbuhan seluruh tanaman yang diberikan perlakuan dengan
1 cm
bahan pembawa PDA cenderung buruk. Tanaman yang diberikan perlakuan inokulasi isolat Sp.3 pada media agar memiliki pertambahan tinggi dan jumlah
anak daun yang lebih tinggi dibandingkan tanaman yang diberikan perlakuan agar tanpa inokulasi, hal tersebut menunjukkan bahwa ada faktor lain yang berpengaruh terhadap tanaman selain perlakuan yang diberikan.
Setelah dicermati dilapangan, ditemukan serangga kutu putih pada sebagian besar perlakuan yang menggunakan bahan pembawa PDA. Serangga kutu putih menyerang pucuk tanaman muda dan menghisap cairan dari tanaman tersebut sehingga dapat menghambat pertumbuhan tanaman sampai mematikan tanaman (Wibawanti, 2010). Serangga tersebut bersimbiosis dengan semut untuk membantu penyebarannya (Wibawanti, 2010). Karena bahan pembawa PDA yang digunakan mengandung gula, maka penyebaran semut kerap kali berada pada perlakuan bahan pembawa PDA, sehingga penyebaran kutu putih umumnya berkisar pada tanaman yang diberikan perlakuan agar dan mempengaruhi pertumbuhan tanaman tersebut.
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Metode inokulasi kayu yang diaplikasikan dalam penelitian ini efektif dalam menginokulasi tanaman sengon pada tingkat semai. Kedua isolat yang dipakai dalam penelitian ini efektif menyebabkan infeksi yang menghambat pertumbuhan tanaman. Inokulasi menggunakan pembawa kayu lebih efektif daripada inokulasi menggunakan pembawa agar. Perlakuan pemotongan akar cenderung tidak berpengaruh. Pola agroforestri sengon dan kakao memiliki resiko terkena epidemi penyakit busuk akar, karena isolat Ganoderma spp. yang didapat dari tanaman kakao dapat menginfeksi tanaman sengon.
5.2 Saran