TRANSFORMASI GENETIK TEMBAKAU DENGAN GEN
BtCsp
B PENYANDI
COLD SHOCK PROTEIN
MELALUI
PERANTARA
Agrobacterium tumefaciens
SEAGAMES WALUYO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN TESIS DAN SUMBER INFORMASI
SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Transformasi Genetik Transformasi genetik tembakau dengan gen BtCspB penyandi Cold Shock Protein melalui Agrobacterium tumefaciens adalah benar karya saya bersama komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan mencantumkan dalam Daftar Pustaka di bagian akhir tesis ini. Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2013
RINGKASAN
SEAGAMES WALUYO. Transformasi genetik tembakau dengan gen BtCspB penyandi Cold Shock Protein Melalui Perantara Agrobacterium
tumefaciens. Dibimbing oleh SUHARSONO dan SUSTIPRIJATNO.
Cold shock protein (Csp) merupakan komponen penting dalam organisme untuk ketahanan terhadap kondisi cekaman abiotik. Protein ini melindungi RNA dari kesalahan melipat dari berbagai cekaman abiotik. Gen BtCspB dari Bacillus thuringensis telah difusikan dengan promoter Ubiquitin di daerah T-DNA dari pCambia 1300int, dan telah diintroduksikan ke dalam Agrobacterium tumefaciens LBA4404. Ekspresi berlebihan gen ini di dalam tanaman kemungkinan dapat meningkatkan toleransi terhadap cekaman abiotik termasuk cekaman dingin, panas dan kekeringan. Penelitian ini bertujuan untuk melakukan transformasi genetik tembakau (Nicotiana tabacum L) cv Samsun dengan gen BtCspB dibawah
kendali promoter Ubiquitin dan terminator NosT yang diperantarai A. tumefaciens.
Potongan daun tembakau diinokulasi melalui metode ko-kultivasi dengan A. tumefaciens LBA4404 yang membawa pCambia1300int-BtCspB. Penelitian ini membandingkan pengaruh lama perendaman untuk inokulasi eksplan yaitu 20 dan 30 menit terhadap efisiensi transformasi. Seleksi kalus transgenik dilakukan dengan menggunakan 20 mg/l dan 50 mg/l higromisin dengan media regenerasi MS yang mengadung, 1 mg/l BAP dan 0,1 mg/l NAA.
Berdasarkan kalus yang resisten terhadap 50 mg/l higromisin, efisiensi transformasi antara perendaman 20 menit dan 30 menit pada penelitian ini adalah relatif sama yaitu 65% dan 57,5%. Analisis PCR menunjukkan bahwa gen BtCspB di bawah kendali promoter Ubiquitin telah terintegrasi ke dalam genom tembakau transgenik. Analisis genotipe menunjukkan bahwa gen hpt diwariskan kepada tembakau generasi T1 dengan mengikuti hukum Mendel. Berdasarkan analisis khi-kuadrat, rasio tanaman yang resisten dan sensitif terhadap higromisin pada generasi T1 adalah 3:1 yang menunjukkan bahwa gen hpt yang terintegrasi kedalam genom tanaman transgenik generasi To adalah satu salinan.
SUMMARY
SEAGAMES WALUYO. Transformation Genetic Tobacco with BtCspB Coding Cold Shock Protein Agrobacterium Tumefaciens-Mediated.Supervised by SUHARSONO and SUSTIPRIJATNO.
Cold shock protein (Csp) is essential for organisms to survive in the abiotic stress condition. It protects RNA from misfolding caused by various abiotic stresses. BtCsp gene had been isolated from Bacillus thuringiensis, fused to promoter of ubiquitin in the T-DNA of pCambia 1300int, and introduced into Agrobacterium tumefaciens LBA4404. We suppose that plant overexpressing this gene would be tolerant to abiotic stress including cold heat and drought stress. This research had an objective to transform genetically Nicotiana tabacum cv Samsun by BtCsp gene under the control of pUbiquitin promoter and NosT terminator mediated by A. tumefaciens.
Leaf disks were inoculated by the method of co-cultivation with A. tumefaciens LBA4404 harboring pCambia1300int-BtCspB. We compared the
effect of shoaking time between 20 and 30 minutes on the transformation
efficiency. The transformation calli were selected on the medium containing 20 mg/l and 50 mg/l hygromcin and regenerated on MS medium containing 1 mg/l BAP and 0,1 mg/L IAA.
Based on resistant calli to 50 mg/l hygromicin, the efficiency of transformation between 20 and 30 minutes was selatively equal i.e 65% and 57.5% respectively. PCR analaysis showed that BtCspB gene under the control of Ubquitin promoter is integrated into N. tabacum genome of To generation. Genetic analysis showed that hpt gene was inherited to the progeny T1 generation following Mendalian law. Based on chi-square analysis, the ratio of resistant and sensitive plant To hygromycin in T1 generation was 3:1, indicating that only one copy of hpt gene was integrated into the genome of transgenic plant in To generation.
©Hak Cipta Milik IPB Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya tulis ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
TRANSFORMASI GENETIK TEMBAKAU DENGAN GEN
BtCsp
B PENYANDI
COLD SHOCK PROTEIN
MELALUI
PERANTARA
Agrobacterium tumefaciens
SEAGAMES WALUYO
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
7
8
Judul Tesis : Transformasi Genetik Tembakau dengan Gen BtCspB Penyandi Cold Shock Protein Melalui Perantara Agrobacterium tumefaciens Nama : Seagames Waluyo
NIM : P051100051
Disetujui oleh
Komisi Pembimbing
Prof. Dr. Ir. Suharsono, DEA
Ketua
Dr. Sustiprijatno, MSc
Anggota
Diketahui oleh
Ketua Program studi Bioteknologi Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Suharsono, DEA Dr. Ir. Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah Subhanahu Wa Ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Topik yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juni 2012 sampai dengan Febuari 2013 ini ialah rekayasa genetik tanaman, dengan judul Transformasi genetik tembakau dengan gen BtCspB penyandi cold shock protein melalui perantara Agrobacterium tumefaciens. Terima kasih penulis ucapkan kepada Prof. Dr. Ir. Suharsono, DEA dan Dr. Sustiprijatno, MSc selaku pembimbing atas segala perhatian dan bimbingannya selama penelitian dan
penulisan naskah tesis. Penulis juga mengucapkan terima kasih kepada Dr. Ir. Utut Widyastuti, MSi selaku penguji luar komisi atas kritik dan saran
terhadap tesis ini. Terima kasih penulis ucapkan kepada Dr.Tri Joko Santoso yang telah memberikan materi genetik berupa Agrobacterium tumefaciens yang membawa pCAMBIA1300int-BtCspB dan Prof. Dr. Ir. Suharsono, DEA yang memberikan materi genetik berupa benih tembakau cv Samsun. Penghargaan penulis sampaikan kepada Kepala Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian (BB-Biogen) dan Kepala Laboratorium Molekuler BB-Biogen yang telah memberikan izin untuk penelitian di Balai Besar Sumber Daya Genetik dan Bioteknologi Pertanian (BB-Biogen), grup riset gandum yang telah membantu penelitian hingga selesai, teman-teman PS Bioteknologi IPB angkatan 2010, dan Kost Baristar atas motivasinya. Kepada Rikno Harmoko, MSc, Bernet Agung Saputra, SP, Rhyza Aditia Priatama, SSi penulis mengucapkan trimakasih atas bantuannya dalam mendapatkan beberapa artikel dari jurnal yang akses terbatas. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, dan seluruh keluarga serta Selvi Ariyunita, SSi atas doa, semangat dan kasih sayangnya.
Semoga karya tulis ini bermanfaat
Bogor, Juni 2013
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
TINJAUAN PUSTAKA 3
Protein yang terinduksi panas 3
Transformasi Diperantarai Agrobacterium tumefaciens 4
Kultur In Vitro Tembakau 4
METODE
Bahan Penelitian 5
Metode Penelitian 5
Konfirmasi gen BtCspB menggunakan analisis PCR koloni 6 Konfirmasi gen BtCspB menggunakan enzim ristriksi 6 Persiapan bahan tanam dan Agrobacterium tumefaciens 6 Inokulasi, kokultivasi, seleksi dan regenerasi 6 Analisis molekuler tembakau transgenik To dengan PCR 7
Analisis pewarisan gen hpt ke generasi T1 8
Analisis molekuler tembakau transgenik T1 dengan PCR 8
HASIL DAN PEMBAHASAN 9
Transformasi genetik tembakau L. Samsun
dengan gen BtCspB 9
Analisis molekuler tembakau transgenik To dengan PCR 12 Analisis pewarisan gen hpt di dalam tembakau transgenik 14
SIMPULAN DAN SARAN 17
Simpulan 17
Saran
DAFTAR PUSTAKA 18
DAFTAR TABEL
1 Jumlah eksplan yang membentuk kalus di media seleksi 10 2 Jumlah tunas yang dihasilkan dari kalus yang resisten higromisin
di media regenerasi yang mengandung 50 mg/l higromisin 12 3 Hasil PCR dengan primer UbiQF dan CspR2 pada
tanaman tembakau T1 13
4 Jumlah tembakau yang resisten dan sensitif terhadap
DAFTAR GAMBAR
1 Peta daerah T-DNA pada plasmid pCambia 1300int-BtCspB 5 2 Konfirmasi keberadaan gen BtCspB di dalam A. tumefaciens 9 3 Perakitan tanaman tembakau transgenik yang
mengandung gen BtCspB 11
4 Hasil PCR dengan primer UbiQF dan CspR, dan aktinF dan aktinR 13 5 Uji resistensi tembakau populasi T1 terhadap higromisin 14
DAFTAR LAMPIRAN
1 Larutan stok Murashige dan Skoog (MS) 22
2 Media LB (Lauria Bertani) 23
1 PENDAHULUAN
Latar Belakang
Cekaman lingkungan seperti salinitas, kekeringan, dingin dan panas merupakan faktor pembatas pertumbuhan dan perkembangan tanaman. Indonesia diprediksi pada tahun 2060 terjadi peningkatan suhu lingkungan 70-99% (Bastiti & Naylor 2009). Peningkatan panas menyebabkan evapotranspirasi meningkat sehingga menyebabkan cekaman ikutan seperti kekeringan dan salin (Taiz & Zeiger 2002). Cekaman panas dapat menurunkan produksi hasil panen hingga 70%. Peningkatan suhu dapat terjadi di dalam tanah dan udara baik pada siang maupun malam (Acquaah 2007).
Tanaman mempunyai respon berbeda terhadap cekaman panas. Toleransi tanaman terhadap cekaman panas berbeda, seperti tembakau dan jagung mempunyai titik kritis pada 49-51ºC selama 10 menit, dan tanaman tomat pada suhu 45ºC Selama 10 menit (Nguyen 2008). Cekaman panas menyebabkan proses fotosintesis dan metabolisme sel terganggu hingga saat terjadi cekaman akut menyebabkan kematian sel (Carmer et al. 2011). Pada tingkat molekul, cekaman panas menyebabkan terganggunya proses translasi.
Cekaman panas menyebabkan kesalahan melipat pada RNA dan protein. RNA mempunyai struktur utas tunggal sehingga mempunyai fleksibilitas tinggi. Cekaman panas menginduksi kesalahan melipat RNA sehingga menghambat efisiensi penerjemahan mRNA (Chaikam & Karlson 2009). Cekaman panas mengakibatkan ujung 5’mRNA di daerah Shine Dalgarno mudah melipat (Chowdhury et al. 2006). Cekaman panas juga menyebabkan kesalahan dalam self splicing dan pelipatan RNA (Herschlag 1995; Kang et al. 2013).
Banyak bakteri mempunyai kemampuan adaptasi yang luas pada kondisi cekaman panas. Bakteri ini mempunyai kemampuan untuk melindungi RNA dengan protein RNA-Chaperone. RNA-chaperone mempunyai banyak jenisnya seperti SptA (Splicing-deficient group-I-intron), NCp7 (Nucleocapsid protein), La protein, Hfq protein dan Cold Shock Protein (Csp) (Schroeder et al. 2004).
Secara alami, keberadaan Csp berlimpah pada semua organisme bakteri, virus, hewan dan tanaman (Schroeder et al. 2004). Gen Csp telah ditemukan pada Bacillus subtilis (Willimsky et al. 1992), Escherichia coli (Yamanaka et al. 1999), gandum (Nakaminami et al. 2004), dan Arabidopsis thaliana (Kim et al. 2009; Park et al. 2009). Gen Csp mampu diekspresikan pada kondisi panas dan dingin (Castiglioni et al. 2008). Secara in vitro protein CspB dari B. caldolyticus dan B. subtilis masing-masing mempunyai suhu Tm 76,9 dan 53,6˚C (Perl et al. 2000). Gen Csp telah berhasil diintroduksikan ke dalam genom A. thaliana, padi dan jagung yang menghasilkan tanaman transgenik yang mampu bertahan terhadap cekaman dingin, panas, dan kekeringan (Castiglioni et al. 2008). Protein BsCspB dan WCsp ditemukan di sitoplasma, retikulum endoplasma (ER) dan intisel (Castiglioni et al. 2008 & Nakaminami et al. 2004).
2
tidak dipublikasikan). Untuk menguji peranan gen BtCspB dalam toleransi tanaman terhadap cekaman panas, maka gen ini diintroduksikan ke dalam genom Nicotiana tabaccum.
Tanaman A. thaliana, N. tabaccum, N. bentamiana, dan Oryza sativa sub spesies japonica untuk merupakan tanaman yang digunakan sebagai tanaman model untuk transformasi genetik. Keberhasilan transformasi genetik tembakau telah digunakan untuk berbagai tujuan seperti mengungkap regulasi sistem biologi tanaman (Langbecker et al. 2004), bioremediasi untuk merkuri (He et al. 2001) dan tanaman model untuk pengujian cekaman biotik (Waigmann et al. 2000) dan abiotik (Rizhsky et al. 2002).
Eksplan yang digunakan untuk transformasi genetik dapat berupa daun muda (Jones 1996; Su et al. 2012) dan suspensi sel (An 1985; Mayo et al. 2006). Setiap bagian tanaman mempunyai sifat totipotensi untuk menjadi tanaman utuh (Quiroz-Figueroa et al. 2006). Tembakau sebagai tanaman model mempunyai kelebihan yaitu mudah dibiakkan secara in vitro, cepat tumbuh dan merupakan inang alami bagi A. tumefaciens (Mayo et al. 2006).
Agrobacterium tumefaciens mempunyai kemampuan mentransfrer T-DNA ke dalam genom tanaman. Secara alami, A. tumefaciens menyebabkan tumor tanaman dikarenakan pada bagian T-DNA terdapat gen penyandi auksin dan sitokinin (Wood et al. 2001). Banyak tanaman yang menggunakan A. tumefaciens untuk transformasi genetik seperti Pinus taeda L (Wei 2001), tembakau (Mayo et al. 2006), A. thaliana (Zhang et al. 2006), padi (Nishimura et al. 2006; Hiei & Komari 2008), jagung (Ishida et al. 2007), dan bunga matahari (Manabella & Chan 2009).
Tujuanpenelitian
2 TINJAUAN PUSTAKA
Protein yang Terinduksi Panas
Organisme memiliki mekanisme ketahanan terhadap cekaman panas dengan mengekspresikan gen spesifik seperti protein chaperone seperti HSP (Heat shock protein) (HSP100, HSP90, HSP70, HSP60 dan small HSPs (sHSPs) (Shanker & Venkateswarlu 2011) dan RNA-chaperone (Schroeder et al. 2004) yang terdapat di semua organism. Pada tanaman tembakau, gen yang ekspresinya terinduksi oleh panas adalah gen penyandi thioredoxin peroxidase, dan ascorbate peroxidase (Rizsky et al. 2002), glycinebetaine, isoprene, omega-3 fatty acid desaturase (LeFAD7) (Shanker & Venkateswarlu 2011), phytochrome-interacting factor 4 (PIF4) dan small auxin up RNA (SAUR) pada Arabidopsis (Franklin et al. 2011). Gen SbDREB2A dan ZmDREB2A diinduksi pada kondisi kekeringan, salinitas, dingin dan panas, OsDREB2B diinduksi pada kondisi dingin dan panas, DvDREB2A diinduksi pada kondisi kekeringan panas dan dingin dan gen CarNAC5 diinduksi oleh kekeringan dan panas (Shanker & Venkateswarlu 2011). Cekaman panas berdampak negatif pada RNA yang menyebabkan kesalahan melipat (Holcik & Sonenberg 2005). Pada kondisi in vitro, 90-100% RNA mengalami inaktivasi karena kesalahan melipat. Pada phage T4 kesalahan
melipat juga dialami oleh gen thymidylate synthase (td) pada pembentukan pre-mRNA (Schroeder et al. 2004). Sel mempunyai sistem pertahanan yang
diakibatkan oleh kesalahan melipat RNA yaitu melalui protein RNA-chaperone. Protein chaperone membantu RNA untuk melepaskan kesalahan melipat sehingga RNA melipat dengan benar. SptA (Splicing-deficient group-I-intron), NCp7 (Nucleocapsid protein), La protein, Hfq protein dan Cold Shock Protein (Csp) merupakan jenis protein yang mempunyai aktivitas RNA-chaperone (Schroeder et al. 2004). RNA-chaperone menjalankan fungsinya tidak membutuhkan ATP (Adenosine Triphospate) (Castiglioni et al. 2008).
CSP merupakan salah satu protein yang mempunyai aktifitas RNA-chaperone. Protein ini mempunyai selektifitas rendah sehingga semua jenis
RNA dapat berinteraksi. Protein Csp mempunyai peranan penting dalam proses transkripsi, translasi dan pembentukan ribosom (Castiglioni et al. 2008).
Gen Csp terdapat di semua organisme dan virus. Gen Csp telah berhasil diidentifikasi pada berbagai organisme seperti B. subtilis (Willimsky et al. 1992), E. coli (Yamanaka et al.1999), gandum (Nakaminami et al. 200), dan A. thaliana (Kim et al.2009; Park et al. 2009). Daerah CSD (Cold shock domain) B. subtilis mempunyai panjang 200 bp yang menyandikan 67 asam amino dengan berat molekul 7,37 kDa (Willimsky et al. 1992).
4
BsCspB berlokasi di sitoplasma, retikulum endoplasma (ER) dan inti sel (Castiglioni et al. 2008 & Nakaminami et al. 2006).
Transformasi Diperantarai Agrobacterium tumefaciens
Konsorsium genom A. thumefaciens telah berhasil melakukan perunutan genom penuh A. tumefaciens C58 (Wood et al. 2001 dan Goodner et al. 2001). A. tumefaciens berkerabat dengan Sinorhizobium meliloti dan Mesorhizobium loti (Wood et al. 2001). Keseluruhan genom A. tumefaciens yang berukuran 567 Mbp mengandung 5400 gen dengan dengan 64% gen fungsional putatif, dan 24% merupakan gen baru (Goodner et al. 2001). Regulasi dan interaksi antar protein berjalan dengan dinamis untuk T-DNA tersisip kedalam genom tanaman inang (Goodner et al. 2001).
Transfer T-DNA ke dalam tanaman inang merupakan proses yang kompleks. Proses transfer T-DNA dimulai dari terinduksinya gen-gen vir oleh senyawa fenolik yang mengaktifkan vir A, sehingga menyebabkan terjadinya fosforilasi kemudian mengaktifkan protein virG. Gen vir D, E dan F diaktifkan oleh protein virG. VirD1 betugas memotong T-DNA kemudian virD2 menempel pada bagian 5’ yang membawanya menuju sitosol sel inang (Ciftci 2012). T-DNA dalam sitosol membentuk protein kompleks virE2-VIP1 (Dafny-Yelin et al. 2008). Kompleks protein virE2 berinteraksi dengan leucine zip (bZIP) dan bertindak sebagai adaptor sehingga dapat berinteraksi dengan kromatin. Kompleks virE2 dilepaskan protein virF untuk teritegrasi ke dalam genom inang (Dafny-Yelin et al. 2008). T-DNA dintegrasikan acak pada daerah untai ganda pemotongan DNA (DSB) (Tzfira et al. 2004).
Kultur In Vitro Tembakau
Keberhasilan transformasi tembakau ditunjang dengan kestabilan kultur in vitro tembakau. Setiap bagian tembakau mempunyai sifat totipotensi untuk menjadi tembakau utuh (Quiroz-Figueroa et al. 2006). Media dasar MS (Murasige dan Skoog 1962) dengan kombinasi auksin dan sitokinin berhasil digunakan untuk regenerasi tembakau in vitro. Keberhasilan regenerasi dapat digunakan untuk mendapatkan tembakau transgenik dengan gen-gen tertentu.
Tembakau transgenik dapat dihasilkan dari berbagai eksplan seperti potongan daun (Jones 1996; Su et al. 2012) dan suspesi sel (An 1985; Mayo et al. 2006). Eksplan tersebut ditumbuhkan pada media in vitro untuk menghasilkan tanaman transgenik. Media regenerasi sering berfungsi juga sebagai media seleksi dengan penambahan agen seleksi. Agen seleksi disesuaikan dengan gen ketahanan
terhadap antibiotik yang terdapat di T-DNA (Rahmawati 2003), seperti hpt (hygromycin phosphotransferase), pmi (phosphomannose-isomerase), nptII (neomycin phosphotransferase), bar (phosphoinothricin acetyl transferase)
3 BAHAN DAN METODE
Bahan PenelitianTanaman tembakau cv Samsun yang diperoleh dari Prof. Dr. Ir. Suharsono, DEA (Institut Pertanian Bogor, Bogor) digunakan sebagai
tanaman yang ditransformasi. Agrobacterium tumefaciens LBA4404 yang mengandung pCambia1300Int-BtCspB digunakan sebagai perantara untuk transformasi genetik tembakau. Selain mengandung Csp, plasmid ini juga mengandung gen penanda seleksi hptII (Gambar 1) (Santoso et al, data tidak dipublikasikan).
Primer CspF: 5’-ACG TTA GCA GCT TGT GGT C -3’ dan CspR1:3’-GCG GTA CCT TAC GCT TCT TTA GTA ACG TTA GCA-5’
digunakan untuk verifikasi gen BtcspB di dalam A. thumefaciens LBA4404. Primer UbiQF: 5’-TGA TGG CCC TGC CTT CAT ACG-3’ dan CspR2: 3’-ACG TTA GCA GCT TGT GGT C-5’ digunakan untuk menganalisis integrasi gen BtCspB di dalam tanaman tembakaau transgenik. Posisi primer CspF dan CspR1 adalah di kedua ujung gen Csp yang berukuran 200 pb dan posisi primer UbiQF dan CspR2 berada di ujung promoter Ubiquitin dan gen Csp yang berukuran 287 pb di daerah T-DNA. Posisi keempat primer tersebut disajikan pada gambar 1.
Gambar 1. Peta daerah T-DNA pada plasmid pCambia 1300int-BtCspB (Santoso et al, data tidak dipublikasikan). RB = right border; Nos-T = terminator napoline sythase; Csp = Cold Shock Protein; Ubi-P = Promoter ubiquitin; CaMV-P = Promoter CaMV; CaMV-T= terminator CaMV.
Penelitan ini menggunakan media dasar MS (Murashige & Skoog 1962, Lampiran 1) yang digunakan untuk kultur in vitro tanaman, LB (Lampiran 2) digunakan untuk kultur E. coli dan YEP (Lampiran 3) digunakan untuk kultur A. thumefaciens.
Metode Penelitian
6
Konfirmasi gen BtCspB menggunakan analisis PCR koloni
Amplifikasi gen BtCspB di dalam koloni A. tumefaciens LBA 4404 pCambia1300int- BtCspB menggunakan primer CspF dan CspR1. Komposisi PCR terdiri atas 1 koloni tunggal, 1x buffer PCR, 10 mM dNTP mix, 25 pmol setiap primer UbiQF dan CspR, dan 1 unit Taq polymerase (Generay Biotech) dan ddH2O hingga volume total reaksi 20 µl. PCR dilakukan di dalam mesin thermal cycler (MJ Research Tetrad) dengan program PCR yang terdiri atas denaturasi 94°C selama 30 detik, penempelan 63°C selama 15 detik, pemanjangan 72°C selama 30 detik dengan 20 siklus. Hasil amplifikasi PCR yang dimigrasikan di gel agarose di dalam larutan penyangga 1×TAE (40 mM Tris, 20 mM asam asetat, dan 1 mM EDTA) selama 30 menit kemudian direndam dalam larutan EtBr (Etidium Bromida) selama 10 menit dibilas dengan H2O dan diamati di bawah lampu UV.
Konfirmasi gen BtCspB menggunakan enzim ristriksi
Satu koloni E. coli yang mengandung pCambia1300Int-BtCspB ditumbuhkan di dalam 5 ml media LB (Lauria Bertani, Lampiran 2) cair yang mengandung 30 mg/l kanamisin pada suhu 37ºC selama 12 jam pada shaker dengan kecepatan 150 rpm. Plasmid diisolasi dengan menggunakan metode alkali (Sambrook et al. 2003). pCambia1300int-BtCspB dipotong dengan enzim restriksi BamHI dan KpnI. Komposisi reaksi pemotongan pCambia 1300intr-BtCspB terdiri atas 200 ng DNA plasmid, 1x buffer BamHI, 1x buffer KpnI, 10 unit BamHI dan 10 unit KpnI dalam 50 µl volume total. Reaksi pemotongan diinkubasi di suhu 37 ºC selama 3 jam. Hasil pemotongan dimigrasikan di gel agarose di dalam larutan penyangga 1×TAE selama 30 menit kemudian direndam di dalam larutan EtBr (Etidium Bromida) selama 10 menit, dibilas dengan H2O dan diamati di bawah lampu UV.
Persiapan bahan tanam dan Agrobacterium tumefaciens
Biji tembakau cv Samsun disterilisasi dengan 5% NaOCl selama 1 menit kemudian dicuci dengan air steril. Biji ditumbuhkan pada media Murashige & Skoog (1962) selama 10 minggu. Daun dipotong dengan ukuran 5 x 10 mm, kemudian dipre-kultur selama 1 jam di media prekultur (MS mengandung 1 mg/l BAP, 0,1 mg/l IAA dan 300 µM asetosiringon). Potongan daun ini digunakan sebagai eksplan.
Koloni tunggal A. tumefaciens LBA 4404 yang mengandung pCambia1300intr-BtCspB ditumbuhkan di dalam 5 ml media YEP (yeast extract pepton, Lampiran 3) yang mengandung 50 mg/l kanamisin dan 30 mg/l rifampisin, kemudian dikocok di shaker pada kecepatan 150 rpm pada suhu 28ºC selama 2 hari. Bakteri disegarkan dengan menumbuhkan 5 µl suspensi bakteri di dalam 50 ml media dengan kondisi yang sama hingga OD600=0,5.
Inokulasi, kokultivasi, seleksi dan regenerasi
7
media kokultivasi (MS yang mengandung 1 mg/l BAP, 0,1 mg/l IAA dan 300 µM asetosiringon) dan diinkubasi pada kondisi gelap selama 3 hari.
Eksplan dari media kokultivasi dicuci dengan media MS kemudian ditanam pada media induksi kalus yang juga merupakan media seleksi yaitu MS yang mengandung 1 mg/l BAP, 0,1 mg/l IAA, 20 mg/l higromisin B, 100 mg/l vancomisin dan 400 mg/l cefotaksim. Kalus yang tumbuh kemudian dipindahkan ke media regenerasi yaitu MS tanpa ZPT (Zat pengatur tumbuh) yang mengandung 50 mg/l higromisin dan 250 mg/l cefotaksim. Tunas yang muncul dipisahkan dari kalus dan ditanam pada media perakaran yaitu MS yang mengandung 50 mg/l higromisin. Tunas yang berakar dipindahkan ke media tanah di dalam pot dan ditempatkan di rumah kaca.
Analisis molekuler tembakau transgenik To dengan PCR
DNA total diisolasi dari daun tanaman in vitro yang berumur 10 minggu dengan metode Dellaporta et al. (1983). DNA dilarutkan dalam ddH2O. Konsentrasi DNA diukur dengan menggunakan Thermo scientific NanoDrop 2000. DNA diencerkan hingga konsentrasinya 100 ng/µl yang digunakan untuk analisis molekuler dengan PCR.
Amplifikasi DNA transgen dilakukan dengan PCR menggunakan primer UbiQF dan CspR2. Amplifikasi DNA aktin dengan PCR untuk mengetahui adanya DNA total tanaman dilakukan dengan primer aktin F: 5’-CCT CTT AAC CCG AAG GCT AA-3’; aktin R: 5’-GAA GGT TGG AAA AGG ACT TC-3’ (Salkol et al. 2007).
Komposisi PCR untuk mengetahui integrasi promoter Ubiquitin dan gen BtCspB terdiri atas 500 ng DNA total, 1x buffer PCR, 10 mM dNTP mix, 25 pmol setiap primer UbiQF dan CspR2, 1 unit Taq polymerase (Generay Biotech) ditambah ddH2O hingga volume total reaksi 20 µl. PCR dilakukan di dalam mesin thermal cycler (MJ Research Tetrad) dengan program PCR yang terdiri atas denaturasi 94°C selama 30 detik, penempelan 55°C selama 15 detik, pemanjangan 72°C selama 30 detik dengan 20 siklus.
Komposisi reaksi PCR untuk gen aktin terdiri atas 500 ng DNA total, 1x buffer PCR, 10 mM dNTP mix, 25 pmol setiap primer aktinF dan aktinR, 1 unit taq polymerase (Generay Biotech) dan ditambahi ddH2O hingga volume total 20 µl. PCR dilakukan di dalam mesin thermal cycler (MJ Research Tetrad) dengan program PCR yang terdiri atas denaturasi 94°C selama 30 detik, penempelan 60°C selama 30 detik, pemanjangan 72°C selama 30 detik dengan 30 siklus. Hasil amplifikasi PCR dimigrasikan di gel agarose di dalam larutan penyangga 1×TAE selama 30 menit kemudian direndam dalam larutan EtBr (Etidium Bromida) selama 10 menit dibilas dengan H2O dan diamati di bawah lampu UV.
Analisis pewarisan gen hpt ke generasi T1
8
yang mengandung 50 mg/l higromisin selama 21 hari, kemudian kecambah yang hidup dan mati dihitung. Kecambah yang hidup adalah yang resisten higromisin dan yang mati adalah yang sensitif. Analisis khi-kuadrat (chi-square) dilakukan untuk menentukan rasio kecambah resisten dan kecambah sensitif.
Analisis molekuler tembakau transgenik T1 dengan PCR
4 HASIL DAN PEMBAHASAN
Transformasi genetik tembakau L Samsun
Untuk memastikan bahwa A. tumefaciens yang akan digunakan untuk menginokulasi potongan daun tembakau mengandung gen BtCspB, maka PCR dilakukan terhadap koloni bakteri ini (Gambar 2A) dengan menggunakan primer CspF dan CspR1. Hasil PCR menunjukkan bahwa A. tumefaciens mengandung gen Csp (Gambar 2B). Hasil ini dikonfirmasi dengan memotong plasmid pCambia1300Int-BtCspB yang diisolasi dari koloni tersebut dengan enzim restriksi BamHI dan KpnI. Pemotongan plasmid menggunakan kedua enzim tersebut menghasilkan fragmen berukuran 200 pb (Gambar 2C) sesuai dengan yang diperkirakan. Hasil ini menunjukkan bahwa A. tumefaciens mengandung plasmid pCambia1300Int-BtCspB dan dapat digunakan untuk mengintroduksikan gen BtCspB ke dalam tanaman tembakau.
M 1 2 M 1
(A) (B) (C)
Gambar 2. Konfirmasi keberadaan gen BtCspB di dalam A. tumefaciens. A= Biakan
A. tumefaciens di media YEP padat. B= Hasil PCR koloni, M= marker 1 kb plus, 1= A. tumefaciens yang mengandung pCambia1300Int, 2= A. tumefaciens yang mengandung pCambia1300Int-BtCspB. C= hasil pemotongan pCambia1300Int-BtCspB dengan enzim restriksi BamHI dan
KpnI, M= 1 kb plus, 1= pCambia1300Int-BtCspB yang dipotong BamHI dan KpnI.
Transformasi genetik tembakau kultivar Samsun dilakukan dengan menggunakan eksplan yang berupa potongan daun. Potongan daun yang telah diinokulasi dengan A. tumefaciens ditanam pada media penginduksi kalus yang sekaligus berfungsi sebagai media seleksi. Pada media induksi kalus yang mengandung 20 mg/l higromisin (atau seleksi I), dari 40 eksplan yang diinokulasi dengan waktu perendaman 30 menit menghasilkan 27 eksplan (atau 67,5%) yang tumbuh membentuk kalus. Hasil ini tidak berbeda dengan eksplan yang direndam 20 menit yang menghasilkan 28 eksplan (atau 70%) yang membentuk kalus. Pada
media yang sama, semua eksplan yang sebelumnya tidak diinokulasi oleh A. tumefaciens tidak membentuk kalus dan mengalami kematian pada minggu
10
ketiga (Tabel 1). Hal ini menunjukkan bahwa 20 mg/l higromisin dapat digunakan untuk membedakan kalus transgenik dan non-transgenik.
Tabel 1. Jumlah eksplan yang membentuk kalus di media seleksi
Perlakuan* Jumlah juga berfungsi sebagai media seleksi I adalah transgenik, maka kalus tersebut dipindahkan ke media seleksi II yang juga berfungsi untuk regenerasi. Pada media regenerasi yang mengandung 50 mg/l higromisin, 23 dari 27 kalus (atau 57%) yang dihasilkan dari perlakuan perendaman 30 menit dapat bertahan hidup. Dari 28 kalus yang diperoleh dari perlakuan perendaman 20 menit, 26 kalus (atau 65%) dapat bertahan hidup pada seleksi yang sama (Tabel 1). Hal ini menunjukkan bahwa waktu perendaman 20 menit sudah mencukupi untuk melakukan transformasi pada tembakau. Seleksi bertingkat ini dimaksudkan untuk mendapatkan tanaman transgenik yang jumlahnya banyak dan sudah digunakan pada penelitian sebelumnya (Dewanti et al. 2011; Anggraito 2012; Eskundari 2012; Hannum 2012).
Konsentrasi 50 mg/l higromisin biasa digunakan untuk menyeleksi tanaman transgenik yang mengandung gen penanda seleksi hptII (Anggraito 2012; Su et al 2012). Berdasarkan jumlah kalus yang resisten terhadap higromisin di media seleksi II yang mengandung 50 mg/l higromisin, efisiensi transformasi dalam penelitian ini adalah 57,5% dengan perlakuan perendaman 30 menit sedangkan dengan perlakuan perendaman 20 menit adalah 65%. Efisiensi transformasi pada penelitian ini lebih rendah daripada efisiensi transformasi pada penelitian lain. Anggraito (2012) dan Hannum (2012) memperoleh efisiensi transformasi masing-masing 82% dan 79% pada tembakau. Walaupun demikian, efisiensi transformasi pada penelitian ini lebih tinggi daripada yang diperoleh Eskundari (2012) yang hanya mendapatkan 16%.
11
tanaman tembakau dari perlakuan perendaman 20 menit dan 21 tanaman tembakau dari perlakuan perendaman 30 menit.
(A) (B)
(C) (D)
Gambar 3. Perakitan tanaman tembakau transgenik yang mengandung gen BtCspB. A= eksplan di media seleksi I, B= Kalus yang beregenerasi membentuk tunas transgenik, C= Tunas transgenik di media pengakaran, D= Tanaman tembakau transgenik To.
Dari 26 kalus yang berasal dari perendaman 20 menit yang resisten di media seleksi II yang juga merupakan media regenerasi, 16 kalus (61,5%) yang membentuk tunas dengan rataan tunas yang terbentuk tiap kalus adalah 5. Dari perlakuan perendaman 30 menit, 19 dari 23 kalus (82,6 %) yang resisten higromisin menghasilkan tunas dengan rataan tunas tiap kalus adalah 3. Pada media yang sama, semua eksplan yang tidak diinokulasi yang ditumbuhkan pada media non seleksi mampu membentuk kalus dan tunas (Tabel 2). Hal ini menunjukkan bahwa eksplan yang digunakan dapat tumbuh dan berkembang dengan baik. Selain itu, kombinasi media dasar MS dan ZPT (1 mg/l BAP dan 0,1 mg/l IAA) dapat digunakan untuk menghasilkan tanaman tembakau in vitro.
Regenerasi dari kalus menjadi tunas sangat tergantung dari medianya. Zat pengatur tumbuh sangat berpengaruh terhadap proses regenerasi ini.
12
mengandung antibiotik mencapai 100%, sedangkan pada tembakau transgenik yang diregenerasikan di media yang mengandung antibiotik efisiensi regenerasi antara 61,5% dan 82,6%.
Analisis molekuler tanaman transgenik To dengan PCR
Analisis molekular dengan PCR dilakukan terhadap 39 tembakau transgenik putatif yang berhasil tumbuh menjadi tanaman dewasa. Analisis molekuler pada penelitian ini bertujuan untuk mengetahui adanya integrasi gen BtCspB di bawah kendali promoter ubiquitin. Oleh sebab itu, PCR dilakukan dengan menggunakan primer yang mengamplifikasi daerah antara promoter (UbiQF) dan BtCspB (CspR) yang berukuran 278 pb. Primer yang dapat mengamplifikasi sebagian dari gen aktin yang berukuran sekitar 600 pb, digunakan sebagai kontrol adanya DNA yang bagus di setiap tanaman yang dianalisis.
Analisis PCR dengan primer UbiQF dan CspR2 terhadap 39 tembakau transgenik putatif menunjukkan bahwa 18 tembakau dari perendaman 30 menit dan 21 tembakau dari perendaman 20 menit, mengandung fragmen berukuran sekitar 278 pb yang merupakan DNA dari transgen antara UbiQ dan CspR2 (Tabel 3). Hasil amplifikasi dengan PCR dari 8 tanaman transgenik yang diambil
secara acak disajikan pada Gambar 4. Hasil PCR dari DNA tanaman non-transgenik tidak menunjukkan amplifikasi yang berukuran 287 pb. Hasil PCR
terhadap PCR DNA tembakau transgenik sesuai dengan PCR plasmid pCambia1300int-BtCspB yang berukuran 287 pb (Gambar 4). Gen aktin merupakan house keeping gene sehingga dapat digunakan sebagai kontrol internal PCR. Primer aktinF dan aktinR mampu mengamplifikasi 9 tembakau yang terdiri dari 1 tembakau non transgenik dan 8 tembakau transgenik putatif yang diambil secara acak yang menghasilkan amplikon yang berukuran 600 pb (Gambar 4). Hal ini menunjukkan bahwa seluruh DNA dari tanaman yang dianalisis adalah baik dan amplikon yang berukuran sekitar 278 bp adalah fragmen yang mengandung promoter ubiquitin dan gen BtCspB.
13
Tabel 3. Hasil PCR dengan primer UbiQF dan CspR2 pada tanaman tembakau To
Genotipe Inokulasi 30 menit Inokulasi 20 menit Non-transgenik Tidak P2U1 1.2 Ada marker, Nt= N. tabaccum non-transgenik, P= plasmid
pCambia1300Int-BtCspB, 1-4= tanaman transgenik yang dihasilkan dari inokulasi 30 menit, 5-8= tanaman transgenik yang dihasilkan dari inokulasi 20 menit.
14
Pada umumnya tanaman To adalah heterozigot sehingga jika melakukan penyerbukan sendiri maka tidak semua keturunannya adalah transgenik. Hanya 75% dari populasi keturunannya yang transgenik dan 25% non-transgenik. Dari 75% yang transgenik, hanya 25% populasi tanaman yang transgenik homozigot. Untuk menguji homosigositas generasi T1, biji dari setiap tanaman T1 dikumpulkan secara terpisah, dan ditumbuhkan di media yang mengandung agen seleksi higromisin. Populasi yang tidak mengandung tanaman yang sensitif terhadap higromisin adalah populasi homosigot dan tetua dari populasi tersebut adalah homosigot.
Analisis pewarisan gen hpt ke generasi T1
Tanaman transgenik To selanjutnya dipelihara dalam pot di dalam rumah kaca hingga menghasilkan biji tembakau. Buah tembakau yang masak fisiologis dipanen dari tanaman To untuk mendapatkan biji tanaman T1. Pada konsentrasi 50 mg/L higromisin biji non transgenik mampu berkecambah namun tidak mampu tumbuh lebih lanjut. Pada umur 3 minggu setelah tanam, kecambah non transgenik dapat dibedakan dengan jelas dari kecambah transgenik. Kecambah non transgenik hanya mempunyai daun kotiledon dan mengalami klorosis. Pada umur yang sama (3 minggu) kecambah transgenik mampu tumbuh membentuk daun selain daun kotiledon (Gambar 5). Hal ini menunjukkan bahwa 50 mg/l higromisin dapat digunakan untuk menyeleksi antara kecambah tembakau transgenik dan non transgenik.
(A) (B)
Gambar 5. Uji resistensi tembakau populasi T1 terhadap higromisin. A= kecambah non transgenik, B = kecambah tembakau transgenik T1. Tanda panah menunjukkan tembakau yang rentan higromisin. Tanda panah menunjukan kecambah tembakau non transgenik pada generasi T1.
15
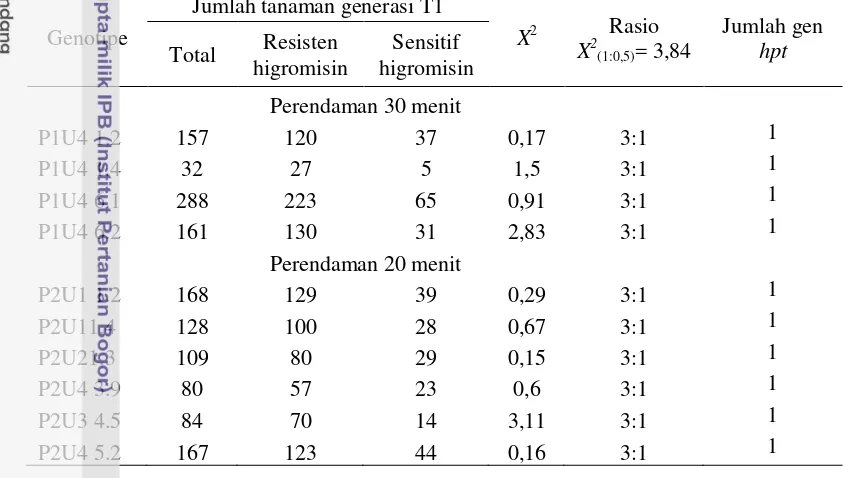
Analisis pewarisan gen hpt dilakukan terhadap 10 genotipe tembakau transgenik To yang diambil secara acak. Hasil penelitian menunjukkan bahwa semua genotipe yang dianalisis menghasilkan keturunan dengan perbandingan 3 resisten dan 1 sensitif terhadap higromisin (Tabel 4). Hasil ini menunjukkan bahwa tanaman transgenik mengandung satu gen hpt fungsionalyang diwariskan dengan mengikuti hukum mendel .
Tabel 4. Jumlah tembakau yang resisten dan sensitif terhadap higromisin dari generasi T1 dengan pola segregasi gen hpt.
Genotipe gen ini diwariskan bersama-sama ke generasi berikutnya sehingga jumlah gen BtCspB yang terintegrasi di generasi T1 tembakau transgenik adalah satu salinan.
Hasil segregasi T1 tembakau transgenik sesuai dengan Anggraito (2012). Toki et al. (2006) menunjukkan bahwa terdapat kesesuaian antara hasil estimasi
salinan gen berdasarkan analisis segregasi dengan Southern blot di padi transgenik T1.
Untuk mengkonfirmasi bahwa tanaman tembakau T1 mengandung gen BtCspB dibawah kendali promoter Ubiquitin, analisis PCR dengan primer UbiQF dan CspR2 dilakukan terhadap keturunan dari 10 genotipe yang masing-masing genotipe terdiri dari 2 kecambah yang resisten terhadap higromisin yang diambil secara acak. Hasil PCR menunjukkan bahwa 10 genotipe menghasilkan amplikon yang berukuran 287 pb. Hasil amplifikasi ini sesuai dengan amplifikasi menggunakan plasmid pCambia1300int-BtCspB sebagai cetakan yang menghasilkan amplikon 287 pb. PCR yang sama terhadap tembakau non transforman T1 tidak menghasilkan amplikon (Gambar 5).
16
M Nt P 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20
Gambar 4. Hasil PCR dengan primer UbiQF dan CspR2. M= marker, Nt= tembakau non-transgenik, P= plasmid pCambia1300Int-BtCspB, 1 dan 2= genotipe P1U4 1.2; 3 dan 4= genotipe P1U4 1.4; 5 dan 6= genotipe P1U4 6.1; 7 dan 8= genotipe P1U4 6.2; 9 dan 10= genotipe P2U1 1.2; 11 dan 12= genotipe P2U11.4; 13 dan 14= genotipe P2U21.3; 15 dan 16= genotipe P2U4 3.9; 17 dan 18= genotipe P2U3 4.5; 19 dan 20= genotipe P2U4 5.2.
5 SIMPULAN DAN SARAN
Simpulan
Transformasi genetik tembakau cv Samsun dengan gen BtCspB penyandi protein cold shock protein diperantarai A. tumefacies telah menghasilkan tembakau transgenik. Gen BtCspB dibawah kendali promoter Ubiquitin telah terintegrasi di dalam genom tembakau transgenik dan diwariskan kepada generasi T1.
Saran
DAFTAR PUSTAKA
Acquaah, G. 2007. Principle of plant genetic and breeding. Blackwell Publishing Ltd. Oxford. UK.
An G. 1985. High efficiency transformation of cultured tobacco cell. Plant Physiol
79:568-570.
Anggraito YU. 2012. Transformasi genetik Nicotiana benthamiana L. dan kedelai dengan gen MaMt2 penyandi metallothionein tipe II dari Melastoma malabathricum L [Disertasi]. Institut Pertanian Bogor. Bogor.
Bastiti DS, Naylor RL. 2009. Historical warming of future food insecurity with unprecedented seasional heat. Science 323 (5911):240-244.
Batti KH dan He C. 2009. Agrobacterium mediated tobacco transformation with rice fae gene and segregation analysis of T1 generation. Pak. J. Bot., 41(1):403-412. Carmer GR, Urano K, Delrot S, Pezzoti M, Shinozaki K. 2011. Effects of abiotic stres on
plants: a systems biology perspective. BMC Plant Biol. 11 (163): 1-14. Castigolini P, Warner D, Bansen RJ, Anstrom DC, Harrison J, Stoeker M, Abad M,
Kumar G, Salvador S D’Oridine R et al. 2008. Bacterial RNA chaperones confer abiotic stress tolerance in plants and improved grain yield in maize under water-limited conditions. Plant Physiol. 147 (2):446-455.
Chaikam V, Karlson DT. 2009. Comparison of structure. function and regulation of plant cold shock domain proteins to bacterial and animal cold shock domain proteins.
BMP Report 43(1):1-8.
Chowdhury S, Maris C, Allain FHT, Narberhaus F. 2006. Molecular basis for temperature sensing by an RNA thermometer. EMBO J. 26:2487–2497.
Ciftci YO. 2012. Transgenic Plant Advances and Limitation. InTech. Rejeka. Kroasia. Cramer, G.R., Urano, K., S, Delrot, M. Pezzoti dan K. Shinozaki. 2011. Effects of
Abiotic Stres on Plants: a Systems Biology Perspective. BMC Plant Biol.: 11 (163): 1-14.
Dafny-Yelin M, Leny A, Tzfira T. 2008. The on going sanga of Agrobacterium-host interactions. Trends Plants Sci. 13(3):102-105.
Dellaporta SL, Wood J, Hicks JB. 1983. A plant DNA mini preparation Plant Mol. Biol. Reporter 1(4):19-21.
Dewanti P, Islahuddin M, Okviandari P, Waluyo S, Saputra BA, Wardiyati T, Sugiharto B. 2011. Efisiensi transformasi tomat (Lycopersicon esculentum) dengan gen SoSPS1 menggunakan Agrobacterium tumefaciens. Berk. Penel. Hayati 4(C). 73-78. Eskundari RD. 2012. Transformasi genetik tanaman tembakau oleh Gen LFY kakao
(TcLFY) menggunakan Agrobacterium tumefaciens [Tesis]. Institut Pertanian Bogor. Bogor.
Fraklin KA, Lee SH, Patel D, Kumar SV, Spartz AK, Gu C, Ye S, Yu P, Breen G, Cohen JD, Wingge PA, Gray WM. 2011. Phytochrome-interacting factor 4 (PIF4) regulates auxin biosynthesis at high temperature. PNAS 108 (50):1-5.
Glick BR, Pasternak JJ. 2010. Molecular Biotechnology, Principles and Aplication of Recombinan DNA. ASM Press. Washington, D.C. USA.
Goodner B, Hinkle G, Gattung S, Miller N, Blanchard M, Qurollo B, Goldman BS, Cao Y, Asekenazi M, Halling C et al. 2001. Genome sequence of the plant pathogen and biotechnology agent Agrobacterium tumefaciens C58. Science 294 (5550):2323-2328.
19
He YK, Sun JG, Feng XZ, Czako M, Marton L. 2001. Differential mercury volatilization by tobacco organs expressing a modified bacterial merA gene. Cell Res. 11:231– 236.
Herschlag D. 1995. RNA Chaperones and the RNA folding problem. Biol Chem. 270 (36):20871–20874.
Hiei Y, Komari T. 2006. Improved protocols for transformation of indica rice mediated by Agrobacterium tumefaciens. Plant Cell, Tiss. Org. Cult. 85:271–283.
Hiei Y, Komari T. 2008. Agrobacterium-mediated transformation of rice using immature embryos or calli induced from mature seed. Nature Protocols 3(5):824-834. Holcik M, Sonenberg. 2005. Translational control in stress and apoptosis. Nature Rev.
Mollec. Cell Biol. 6: 318–327
Ishida Y, Hiei Y, Komari T. 2007. Agrobacterium-mediated transformation of maize.
Nature Protocol 2:1614-1621.
Jones H. 1996. Plant gene transfer and expression protocols. Methods Molec Biol 49:39-48.
Kang H, Park SJ, Kwak KJ. 2013. Plant RNA chaperones in stress response. Trends Plant Sci.18(2):100-107.
Kim MH, Sasaki K, Imai R. 2009. Cold shock domain protein 3 regulates freezing tolerance in Arabidopsis thaliana. Biol. Chem. 284:23454–23460.
Kyozuka J, Shimamoto K. 1991. Transformation and regeneration of rice protoplast.
Plant Tiss. Cult. Manual:1-17.
Langbecker CL, Ye GN, Broyles DL, Duggan LL, Xu CW, Hajdukiewicz PT, Armstrong CL, Staub JM. 2004. High-frequency transformation of undeveloped plastids in tobacco suspension cells. Plant Physiol. 135:139-146.
Manabella PA, Chan RL. 2009.Transient transformation of sunflower leaf discs via an
Agrobacterium-mediated method: applications for gene expression and silencing studies. Nature Protocol 4: 1699-1707.
Mayo KJ, Gonzalez BJ, Mason HS. 2006. genetic transformation of tobacco NT1 cell with Agrobacterium tumefaciens. Nature Protocol 1(3): 1105-1111.
McCoy LS, Xie Y, Tor Y. 2011. Antibiotics that target protein synthesis. Wiley Interdisciplinary 2(2):209-232.
Miki B, McHugh S. 2004. Selectable marker genes in transgenic plants: applications, alternatives and biosafety. J. Biotechnol. 107:193-232.
Murashige T , Skoog F. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol Plant 15: 473-497.
Nakaminami K, Karlson DT, Imai. 2006. Functional conservation of cold shock domains in bacteria and higher plants. PNAS 103:10122–10127.
Nguyen, N.V. 2008. Global Climate Changes and Rice Food Security. International Rice Commission. Italia. .
Nishimura A, Aichi I, Matsuoka M. 2006. A protocol for Agrobacterium-mediated transformation in rice. Nature Protocols 1: 2796-2802.
Park SJ, Kwak KJ, Oh TR, Kim YO, Kang H.2009. Cold shock domain proteins affect seed germination and growth of Arabidopsis thaliana under abiotic stress conditions. Plant Cell Physiol 50(4):869–878.
Perl D, Mueller U, Heinemann U, Schmid FX. 2000. Two esposed amino acid residues confer thermostability on a cold shock protein. Nature Structural Biol. 7(5):380-383.
20
Rachmawati, D, Hosaka T, Inoue E, Anzai H. 2004. Agrobacterium-mediated transformation of Javanica rice cv. Rojolele. Biosci. Biotechnol. Biochem
68(6):1193-1200.
Rahmawati S. 2003. Gen penyeleksi alternatif untuk transformasi tanaman. Buletin AgroBio 6(1):26-33.
Rizhsky L, Liang H, Mittler R. 2002. The combined effect of drought stres and heat shock on gene expression in tobacco. Plant Physiol. 130:1143-1151.
Shanker AK, Venkateswarlu, 2011. Abiotic stress respone in plant – physiological, biochemical and genetic prespective. InTech. Rejeka. Kroasia.
Salkol A, Kwiatkowska A, Jerzmanowski A dan Prymakowska-Bosak M. 2007. Up-regulation of stress-inducible genes in tobacco and arabidopsis cells in response to abiotic stresses and ABA treatment correlates with dynamic changes in histone H3 and H4 modifications. Planta 227: 245–254.
Schroeder R, Barta A, Semrad K. 2004. Strategies for RNA folding and assembly. Nature Rev. Mol. Cell Biol. 5: 908-919.
Su G, Park S, Lee S, Murai N.2012. Low co-cultivation temperature at 20˚C resulted in the reproducible maximum increase in both the fresh weight yield and stable expression of gus activity after Agrobacterium tumefaciens-mediated transformation of tobacco leaf disks. Amer. J. Plant Sci. 3:537-545.
Taiz L, Zeiger, E. 2002. Plant Physiology, 3rd . Sinauer Associates. Sunderland. UK. Toki S, Hara N, Ono K, Onodera H, Tagiri A, Oka S, Tanaka H. 2006. Early infection of
scutellum tissue with agrobacterium allows high-speed transformation of rice.
Plant J 47:969–976.
Tzfira T, Li J, Laroix B, Citovsky V. 2004. AgrobacteriumT-DNA integration: molecules and models. Trends Gen 20 (8):375-383.
Waigmann E, Chen M, Bachmair R, Ghoshroy S, Citovsky V. 2000. Regulation of plasmodesmal transport by phosporilation of tobacco mosaic virus cell-to-cell movement protein. EMBO J 19:4875-4884.
Wei T. 2001. Agrobacterium-mediated transformation and assessment of factors influencing transgene expression in loblolly pine (Pinus taedaL.). Cell Res. Wood GE et al. 2001. The Genome of the natural genetic engineer Agrobacterium tumefaciens C58. Science 294 (5550):2317-2323.
Yamanaka K. 1999. Cold shock response in Escherichia coli. J. Mol. Microbiol. Biotechnol 1(2):193-202.
22
Lampiran 2. Media LB (Lauria Bertani)
Komposisi Jumlah (g/l)
Pepton 10
Khamir 10
23
Lampiran3. Media YEP (yeast extract pepton)
Komposisi Jumlah (g/l)
Pepton 10
Khamir 10
Tripton 10
24