i
TRANSFORMASI GENETIKA PADI DENGAN
PERANTARA
RHIZOBIUM
DAN
AGROBACTERIUM
DAN ANALISIS PERANAN GEN
OsHox
6
SYAMSIDAH RAHMAWATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi Transformasi Genetika Padi dengan Perantara Rhizobium dan Agrobacterium dan Analisis Peranan Gen
OsHox6 adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Januari 2012
ABSTRACT
SYAMSIDAH RAHMAWATI. Genetic Transformation of Rice using Rhizobium and Agrobacterium and Functional Analysis of OsHox6 Gene. Under direction of SUHARSONO, DIDY SOPANDIE, and INEZ HORTENSE SLAMET-LOEDIN
Rice (Oryza sativa) is not only the most important crop in the world, but also a model plant for functional genomic studies. Genetic transformation is a routine technique for transferring important traits into plants including rice genome and for gene function analysis. Agrobacterium transformation technique is the most commonly used for genetic transformation of plants. However, the complexity of patents landscape surrounds this technology restricts its use for agricultural development in developing countries. In this study, the effectiveness of Rhizobium transformation techniques were evaluated in three rice cultivars Ciherang, Nipponbare, and Rojolele, and compared to Agrobacterium. Six-day old callus induced from immature embryos were co-cultivated with Rhizobium leguminosarum ANU845 and Agrobacterium tumefaciens LBA288 both carrying the plasmid pCAMBIA 5106. pCAMBIA 5106 is a cointegrative vector. The T-DNA contained an hpt gene and a GUSPlus each controlled by the CaMV 35S promoter. This study showed that the Rhizobium could transfer genes into rice genome as efficient as that of Agrobacterium based on evaluation on transformation efficiency, transgene expression, copy number, segregation pattern, and plant growth and fertility. Drought is one of abiotic factors that inhibit rice growth and production. A number of genes responsible for drought tolerance have been identified, isolated and tested in different plant species. However, none of these genes was effective in the fields. In this study, a drought inducible gene, OsHox6, was selected to be studied further. Bioinformatics analysis of OsHox6 promoter sequences indicated that the OsHox6 promoter contains cis-regulatory elements important to drought and ABA responses. Temporal and spatial expression patterns of GUSPlus gene fused to OsHox6 promoter through histochemical visualization of GUSPlus in transgenic plant of Ciherang and Nipponbare showed that promoter activity was increased during dehydrated condition in vegetative and generative organs, although the expression was relatively low. Promoter activity was higher in meristematic tissues. Transgenic rice plants containing an extra copy of OsHox6 genes controlled by OsLEA3 promoter were obtained. Four transgenic of IR64 lines (I.19, I.23, I.33, and I.40) containing an extra copy of OsHox6 gene were more tolerant to drought condition, showing higher survival rate compare to wild type plants. It is anticipated that the increase in the survival rate was associated with the expression level of OsHox6 gene. Thus, the expression of OsHox6 gene will be further evaluated. The growths of transgenic rice plants were similar to its wild type counterpart. Further studies are needed to understand the modulation of drought tolerant by the OsHox6 gene.
RINGKASAN
SYAMSIDAH RAHMAWATI. Transformasi Genetika Padi dengan Perantara Rhizobium dan Agrobacterium dan Analisis Peranan Gen OsHox6. Dibimbing oleh SUHARSONO, DIDY SOPANDIE, dan INEZ HORTENSE SLAMET-LOEDIN
Padi merupakan tanaman yang sangat penting, salah satu makanan pokok penduduk dunia dan tanaman model untuk penelitian functional genomic. Transformasi genetik merupakan teknik yang rutin digunakan saat ini untuk mentransfer berbagai sifat penting pada tanaman termasuk padi dan untuk analisis fungsi gen. Teknik transformasi Agrobacterium merupakan teknik transformasi yang paling umum digunakan karena besar kemungkinan untuk mendapatkan tanaman dengan salinan gen tunggal. Namun, teknik ini telah dipatenkan sehingga perlu agen transformasi alternatif yang memiliki kemampuan transfer gen seperti Agrobacterium. Penggunaan bakteri selain Agrobacterium sebagai agen transformasi genetik memungkinkan untuk dilakukan dengan melibatkan T-DNA dan gen-gen virulen dari plasmid Ti yang telah dimodifikasi. Efektifitas teknik transformasi Rhizobium dievaluasi pada tiga kultivar padi, Ciherang (Indica), Nipponbare (Japonica), dan Rojolele (Javanica), dibandingkan dengan Agrobacterium. Kalus umur 6 hari yang diinduksi dari embrio padi masak susu (immature) dikokultivasi dengan Rhizobium leguminosarum bv trifolii ANU845 dan Agrobacterium tumefaciens LBA288 yang membawa plasmid pCAMBIA 5106. Plasmid pCAMBIA 5106 ini mengandung satu set minimal gen virulen dan T-DNA yang penting dalam proses transfer gen. Didalam T-DNA terdapat gen GUSPlus dan gen hpt masing-masing dikendalikan oleh promoter CaMV 35S. Efisiensi transformasi (jumlah tanaman PCR positif hpt dibagi jumlah kalus yang diinokulasi) bervariasi antara 1,14 hingga 12,05% tergantung pada genotipe dan bakteri yang digunakan. Efisiensi transformasi dan regenerasi tertinggi (12,05% dan 59,38%) diperoleh pada Ciherang yang ditransformasi dengan R. leguminosarum. Hampir semua tanaman transgenik yang diperoleh baik hasil transformasi dengan Agrobacterium maupun Rhizobium secara morfologi normal dan fertil. Integrasi, ekspresi dan pola pewarisan gen, dibuktikan dengan analisis molekuler dan genetik pada tanaman T0 dan T1
sekuen promoter OsHox6, tidak ditemukan. Hasil analisis pola ekspressi temporal dan spasial promoter gen OsHox6 melalui visualisasi gen GUSPlus secara histokimia pada jaringan tanaman transgenik Ciherang dan Nipponbare menunjukkan bahwa aktivitas promoter ini meningkat saat kekeringan pada organ vegetatif (batang, daun, dan akar) dan generatif (bunga). Aktivitas promoter lebih kuat pada daerah dimana terdapat jaringan meristem yang aktif membelah.
Untuk mempelajari peranan gen OsHox6 dalam merespon kekeringan, digunakan tanaman padi transgenik mengandung gen OsHox6 yang dikendalikan oleh promoter OsLEA3 untuk meningkatkan ekspresi gen OsHox6. Empat galur padi transgenik mengandung ekstra salinan gen OsHox6 (IR64 I.19, I.23, I.33, dan I.40) lebih tahan pada kondisi kekeringan pada fase vegetatif, ditunjukkan oleh persentase recovery yang lebih tinggi dibandingkan dengan tanaman kontrol tipe liarnya (IR64). Diduga peningkatan persentase recovery berhubungan dengan tingkat ekspresi gen OsHox6. Oleh karena itu konfirmasi ekspresi gen OsHox6 akan dilakukan. Penampilan morfologi (tinggi tanaman) padi hasil transformasi dengan gen OsHox6 yang dikendalikan oleh promoter OsLEA3 tidak berbeda dengan tanaman padi tipe liarnya. Karena aktivitas promoter OsHox6 lebih tinggi pada daerah akar lateral, maka diduga OsHox6 penting dalam pembentukan akar lateral. Oleh karena itu penelitian lebih lanjut diperlukan untuk mengamati morfologi akar tanaman transgenik yang mengoverekspresikan OsHox6.
Hak cipta milik IPB, tahun 2012 Hak dilindungi undang-undang
Dilarang mengutip sebahagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
TRANSFORMASI GENETIKA PADI DENGAN
PERANTARA
RHIZOBIUM
DAN
AGROBACTERIUM
DAN ANALISIS PERANAN GEN
OsHox
6
SYAMSIDAH RAHMAWATI
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Departemen Biologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul : Transformasi Genetika Padi dengan Perantara Rhizobium dan Agrobacterium dan Analisis Peranan Gen OsHox6
Nama Mahasiswa : Syamsidah Rahmawati
NRP : G361060111
Program Studi : Biologi
Disetujui, Komisi Pembimbing
Ketua
Prof. Dr. Ir. Suharsono, DEA
Dr. Ir. Inez Hortense Slamet-Loedin
Anggota Anggota
Prof. Dr. Ir. Didy Sopandie, M.Agr
Diketahui,
Ketua Program Studi Biologi Dekan Sekolah Pascasarjana
Dr. Ir. Dedy Duryadi Solihin, DEA Dr. Ir. Dahrul Syah, M.Sc. Agr
PRAKATA
Segala puji bagi Allah yang telah memberikan kenikmatan yang sangat banyak serta kemudahan-kemudahan, sehingga penulis dapat menyelesaikan disertasi ini. Penulis sangat beruntung mendapat kesempatan untuk melakukan penelitian Transformasi Genetika Padi dengan Perantara Rhizobium dan Agrobacterium dan Analisis Peranan Gen OsHox6. Penelitian ini merupakan penelitian yang sangat menarik bagi penulis karena memberikan wawasan baru tentang adanya teknik transformasi alternatif bagi tanaman dengan menggunakan bakteri selain Agrobacterium dan bagaimana mempelajari fungsi suatu gen. Penelitian ini akan sangat bermanfaat untuk mendukung karier penulis sebagai peneliti di masa mendatang.
Pada kesempatan ini penulis mengucapkan terimakasih yang sebesar-besarnya kepada Prof. Suharsono, Prof. Didy Sopandie, dan Dr. Inez Hortense Slamet-Loedin atas kesediannya membimbing penulis dalam melakukan penelitian ini. Ucapan terimakasih disampaikan kepada Kepala Puslit Bioteknologi LIPI yang telah memberikan izin untuk melanjutkan studi pada program S3, kepada Kementrian Riset dan Teknologi dan Lembaga Ilmu Pengetahuan Indonesia yang telah memberikan beasiswa kepada penulis selama pendidikan berlangsung, kepada Dekan Sekolah Pascasarjana dan Ketua Departemen Biologi IPB yang telah memberi kesempatan untuk mengikuti pendidikan S3 di Sekolah Pascasarjana Departemen Biologi IPB. Kepada Dr. Satya Nugroho dan Dr. Amy Estiati atas izin peggunaan fasilitas di Lab. Biologi Molekuler Puslit Bioteknologi LIPI. Kepada keluarga besar di Bogor dan di Medan saya ucapkan terimakasih atas semua dukungan dan doa sehingga penulis tetap bersemangat dalam menyelesaikan disertasi ini. Juga kepada semua teman dari lab “Padi” Puslit Bioteknologi LIPI, angkatan 2006 Pascasarjana IPB atas semua dukungan, bantuan, serta doanya saya ucapkan terimakasih.
Semoga Disertasi ini bermanfaat bagi pengembangan ilmu pengetahuan dan teknologi.
Bogor, Januari 2012
RIWAYAT HIDUP
Penulis dilahirkan Tapanuli Utara tanggal 8 April 1969, anak sulung dari Bapak Saman dan Ibu Amijah Porman Marpaung. Pendidikan Sarjana ditempuh di Fakultas Pertanian, Universitas Sumatera Utara Medan, lulus pada tahun 1992. Pada tahun 1997 penulis mendapatkan kesempatan mengikuti program S2 LINK Institut Teknologi Bandung dengan University of New South Wales Australia melalui program Beasiswa STAID yang dikoordinir oleh Badan Pengkajian dan Penerapan Teknologi (BPPT), lulus tahun 1999. Pada tahun 2006, penulis mendapat kesempatan untuk melanjutkan pendidikan S3 di Sekolah Pascasarjana IPB, Departemen Biologi dengan beasiswa dari Kementrian Riset dan Teknologi pada tahun pertama dan kedua, dan kemudian Lembaga Ilmu Pengetahuan Indonesia pada tahun ke tiga dan ke empat.
Penulis bekerja sebagai staf peneliti di Pusat Penelitian Bioteknologi sejak tahun 1993 pada bidang konservasi benih, kemudian sejak tahun 1996 pindah ke bidang biologi molekuler hingga sekarang. Penulis terlibat dalam kegiatan penelitian padi sejak tahun 1999 hingga sekarang terutama untuk transformasi genetika padi untuk memperbaiki sifat toleran padi terhadap cekaman biotik dan abiotik.
Selama mengikuti program S3, penulis mendapat kesempatan untuk mengikuti training mengenai “Rice:Research to Production” di International Rice Research Institute (IRRI) Filipina selama 3 minggu pada tahun 2008. Topik penelitian untuk Disertasi adalah Transformasi Genetika Padi dengan Perantara Rhizobium dan Agrobacterium dan Analisis Peranan Gen OsHox6. Comparative analysis of rice transformation using Agrobacterium tumefaciens and Rhizobium leguminosarum yang merupakan bagian dari Disertasi ini telah dipublikasi di Indonesian Journal of Biotechnology Volume 15 No. 1 Juni 2010.
DAFTAR ISI
Halaman
Daftar Tabel ... iii
Daftar Gambar ... v
Daftar Lampiran ... . vii
I. PENDAHULUAN Latar Belakang ... 1
Tujuan Penelitian ... 5
Manfaat Penelitian ... 5
Ruang Lingkup Penelitian ... 6
II. TINJAUAN PUSTAKA Padi Sebagai Tanaman Penting ... 9
Cekaman Kekeringan ... 10
Mekanisme Toleran Kekeringan pada Tanaman ... 11
Identifikasi Gen yang Terlibat dalam Mekanisme Toleran Kekeringan ... 12
Faktor Transkripsi ... 13
HD-Zip ... 16
Analisis Fungsi Gen ... 18
Transformasi Genetika Tanaman ... 21
III. ANALISIS KOMPARATIF TRANSFORMASI GENETIK PADI MENGGUNAKAN AGROBACTERIUM TUMEFACIENS DAN RHIZOBIUM LEGUMINOSARUM Abstrak ... 27
Abstract ... 27
Pendahuluan ... 28
Bahan dan Metode ... 29
Hasil ... 33
Pembahasan ... 38
IV. ANALSIS REGULASI PROMOTER OsHox6 PADA TANAMAN PADI
Abstrak ... 41
Abstract ... 41
Pendahuluan ... 42
Bahan dan Metode ... 43
Hasil ... 48
Pembahasan ... 56
Simpulan ... 58
V. OVEREKSPRESI GEN OsHox6 PADA TANAMAN PADI Abstrak ... 59
Abstract ... 59
Pendahuluan ... 60
Bahan dan Metode ... 62
Hasil ... 65
Pembahasan ... 70
Simpulan ... 72
VI. PEMBAHASAN UMUM Rhizobium Sebagai Agen Tranformasi Genetik Alternatif... 73
Pendekatan Reverse Genetic untuk Mempelajari Fungsi Gen OsHox6... 75
Upaya Lebih Lanjut Analisis Fungsi Gen OsHox6 pada Tanaman Padi... 77
VII. SIMPULAN UMUM DAN SARAN SIMPULAN UMUM... 79
SARAN ... 79
DAFTAR PUSTAKA ... 81
iii
DAFTAR TABEL
Halaman
1 Gen yang terlibat dalam respon terhadap cekaman kekeringan
dan fungsinya... 14 2 Contoh faktor transkripsi tanaman dan peranannya dalam respon
kekeringan... 15 3 Subfamili HD-Zip dan fungsinya... 18 4 Media yang digunakan untuk transformasi tiga varietas padi
(Ciherang, Nipponbare, dan Rojolele)... 32 5 Efisiensi transformasi tiga varietas padi hasil transformasi
dengan Rhizobium leguminosarum dan Agrobacterium
tumefaciens... 34 6 Ekspresi GUS dan HPT pada tiga varietas padi hasil
transformasi dengan Rhizobium leguminosarum dan Agrobacterium tumefaciens berdasarkan uji GUS dan
higromisin pada daun... 35 7 Prakiraan jumlah gen hpt pada galur tanaman transgenik
terpilih hasil transformasi dengan Agrobacterium (A) dan
Rhizobium (R)... 37 8 Segregasi gen hpt pada populasi tanaman T1 galur terpilih... 37 9 Pertumbuhan dan fertilitas beberapa galur transgenik terpilih
hasil transformasi dengan Rhizobium dan Agrobacterium... 38 10 Kandidat cis-acting element responsif kekeringan dan ABA
pada 1 kb daerah promoter OsHox6... 50 11 Segregasi gen hpt pada populasi tanaman T1 Ciherang dan IR64
yang ditransformasi dengan gen OsHox6 yang dikendalikan oleh promoter OsLEA3... 67 12 Tingkat recovery tanaman transgenik pada kondisi
kekeringan... 69 13 Perbandingan antara transformasi menggunakan bantuan A.
v
DAFTAR GAMBAR
Halaman
1 Diagram alur penelitian... 7 2 Skema struktur protein unik dari setiap subfamili HD-Zip... 18 3 T-DNA di dalam pCAMBIA 5106... 31 4 Amplifikasi fragmen gen hpt tanaman transgenik terpilih hasil
transformasi dengan A. tumefaciens atau R. leguminosarum
pembawa plasmid pCAMBIA 5106... 34 5 Daun tanaman padi transgenik yang mengekspresikan β
-glucuronidase dan higromisin fosfotransferase ... 35 6 Contoh hasil hibridisasi Southern... 36 7 Penampilan morfologi Niponbare, Ciherang, dan Rojolele hasil
transformasi dengan A. tumefaciens LBA288 (pCAMBIA5106)
and R. leguminosarum (pCAMBIA5106)... 38 8 Skema proses kloning untuk pembentukan fusi promoter OsHox6
dengan gen pelapor GUSPlus ... 46 9 Posisi elemen cis-acting responsif kekeringan pada daerah promoter
OsHox6... 50 10 Hasil pensejajaran sekuen kandidat promoter OsHox6 yang diisolasi
dari padi Ciherang dengan sekuen acuan dari Nipponbare... 51 11 Contoh hasil PCR menggunakan primer spesifik untuk gen hpt... 52 12 Ekspresi GUSPlus pada berbagai organ tanaman padi cv Ciherang
dan Nipponbarehasil transformasi dengan gen GUSPlus yang
dikontrol oleh promoter terinduksi kekeringan OsHOx6 dan promoter konstitutif CaMV 35S pada saat ada atau tidak ada induksi
kekeringan... 54 13 Pola ekspresi GUSPlus yang dikontrol oleh promoter OsHox6 pada
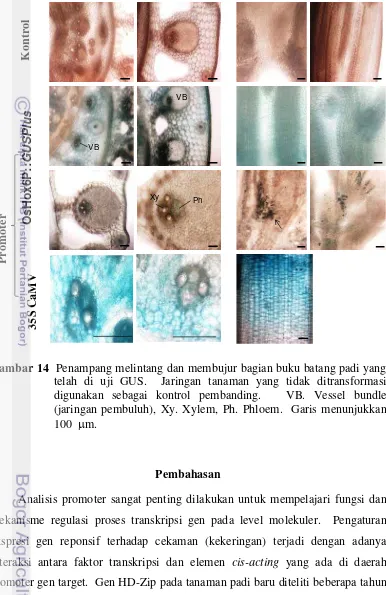
berbagai organ tanaman... 55 14 Penampang melintang dan membujur bagian buku batang padi yang
telah di uji GUS... 56 15 T-DNA di dalam pCAMBIA 1301H OsHox6... 65 16 Tahapan kultur jaringan untuk menghasilkan tanaman padi varietas
Ciherang atau IR64 yang mengandung OsLEA3::OsHox6 ... 68 17 Hasil hibridisasi Southern DNA tanaman IR64 yang ditransformasi
dengan gen OsHox6... 69 18 Recovery tanaman transgenik galur IR64 tahan higromisin
mengandung 1 salinan gen hasil transformasi dengan gen OsHox6
vii
DAFTAR LAMPIRAN
Halaman
Latar Belakang
Padi (Oryza sativa L.) merupakan komoditas strategis, makanan pokok
penduduk Indonesia dan penduduk di berbagai belahan dunia terutama Asia,
Timur Tengah dan Amerika Latin. Selain sebagai makanan pokok, padi juga
merupakan tanaman model untuk kelompok monokotil, karena dibandingkan
dengan tanaman lain dari kelompok monokotil, padi memiliki ukuran genom yang
relatif kecil (430 Mb), umur relatif singkat, menyerbuk sendiri, diploid sehingga
memudahkan dalam melakukan analisis genom (http://www.patentlens.
net/daisy/RiceGenome/3649/3593.html
Kekeringan adalah salah satu faktor utama penghambat produksi tanaman
termasuk padi. Kekeringan menurunkan produksi tanaman dengan menghambat
pertumbuhan dan fotosintesis (Shou et al. 2004). Menurunnya produksi akibat
kekeringan berdampak pada peningkatan harga produk pertanian dan
memperburuk kemiskinan
). Meskipun variasi ukuran genom dan
ploidi pada tanaman monokotil sangat besar, genom padi dan tanaman monokotil
lainnya sangat konservatif baik dalam hal sekuen dari gen yang ada, juga dalam
urutan gen atau “synteni”. Sehingga informasi yang ada pada genom tanaman
padi dapat digunakan sebagai acuan untuk mempelajari genom tanaman
monokotil lainnya.
tahun terakhir dan prediksi 50 tahun ke depan menggunakan model perubahan
iklim global mengindikasikan bahwa kekeringan akan semakin sering terjadi
(Naylor et al. 2007). Kekeringan dapat terjadi kapan saja selama fase
pertumbuhan padi, namun yang paling merugikan adalah kekeringan yang terjadi
pada fase generatif. Perakitan padi toleran kekeringan sangat penting untuk
mengantisipasi perubahan iklim yang ekstrim. Upaya untuk mempelajari sifat
toleran kekeringan pada level molekul sangat aktif dilakukan di seluruh dunia
untuk membantu mengungkap mekanisme molekuler tanaman pada kondisi
kekurangan air. Pemahaman ini sangat membantu upaya perakitan padi toleran
2
Sifat toleran kekeringan sangat kompleks, dikendalikan oleh banyak gen
(multigenik) yang tersebar di banyak lokus dan diwariskan secara kuantitatif
(Valliyodan & Nguyen 2006; Fleury et al. 2010; Lang & Buu 2010). Selain itu
tanaman memiliki mekanisme yang berbeda (escape, penghindaran atau
avoidance, atau toleran) dalam merespon kekeringan (Levit 1972). Tanaman
escape kekeringan dengan mempersingkat siklus hidupnya. Sebahagian tanaman
menghindari kekeringan dengan meningkatkan penyerapan air dan meminimalkan
kehilangan air. Tanaman toleran kekeringan melibatkan mekanisme osmotic
adjustment, antioksidan, dan ketahanan desikasi. Namun bagaimana mekanisme
molekuler tanaman dalam merespon dan beradaptasi terhadap kekeringan belum
sepenuhnya dimengerti.
Berbagai pendekatan telah diupayakan untuk mempercepat pengungkapan
mekanisme toleran kekeringan pada level molekuler. Sejumlah gen terinduksi
kekeringan telah berhasil diidentifikasi pada level transkripsi menggunakan
analisis microarray pada tanaman model Arabidopsis dan padi (Seki et al. 2001;
Seki et al. 2002; Rabbani et al. 2003; Zhou et al. 2007), namun belum semua
fungsi gen berhasil diungkapkan. Analisis fungsional genomik sangat penting
dilakukan untuk memahami lebih lanjut fungsi gen terkait dan bagaimana
mekanisme pengaturannya pada level molekuler.
Berdasarkan pengaturan ekspresi gen, Yamaguchi-Shinozaki dan Shinozaki
(1993a) mengelompokkan gen-gen yang terlibat dalam mekanisme toleran
kekeringan ke dalam dua kelompok utama, yaitu kelompok yang ekspresinya
bergantung pada ABA (ABA dependent) dan tidak bergantung pada ABA
(ABA-independen). Berdasarkan peran atau fungsi proteinnya maka Shinozaki et al.
(2003) mengelompokkan gen-gen yang terlibat dalam mekanisme toleran
kekeringan pada dua kelompok utama, protein fungsional (seperti osmoprotektan,
LEA, transporter, chaperon) dan protein regulator (misalnya faktor transkripsi
dan protein kinase). Yang et al. (2010) membagi gen responsif kekeringan
berdasarkan fungsi biologisnya ke dalam 3 kelompok; yaitu yang berperan dalam
(1) regulasi transkripsi, (2) post-transkripsi RNA atau fosforilasi protein, dan (3)
metabolisme osmoprotektan atau molekul chaperon. Selain itu masih ada
Oleh karena kompleksnya sifat toleran kekeringan, penyisipan satu gen
yang memiliki fungsi tunggal tidak cukup untuk mengembalikan fungsi sel dan
membuat tanaman lebih toleran kekeringan (Bohnert et al. 1995; Mitra 2001).
Untuk mengatasi hal tersebut akhir-akhir ini penelitian lebih diarahkan pada
penggunaan faktor transkripsi yang bertanggungjawab pada sifat toleran
kekeringan. Faktor transkripsi berperan dalam mengatur ekspresi gen-gen lain
melalui pengikatan spesifik antara protein faktor transkripsi dengan elemen
cis-acting promoter gen target. Sejumlah faktor transkripsi terinduksi kekeringan
pada tanaman telah berhasil diungkap. Secara umum faktor transkripsi yang
responsif terhadap kekeringan tersebut dikelompokkan ke dalam beberapa famili
seperti AP2/ERF, bZIP, NAC, MYB, MYC, Cys2His2 zinc finger dan WRKY
(Vinocur & Altman 2005; Bartels & Sunkar 2005; Shinozaki &
Yamaguchi-Shinozaki 2007).
Setelah sekuen genom padi dan Arabidopsis berhasil diungkap, faktor
transkripsi yang ada pada tanaman padi dan Arabidopsis dapat diidentifikasi (Seki
et al. 2002; Shinozaki & Yamaguchi-Shinozaki 2007; Agalou et al. 2008).
Berbagai teknik reverse genetik telah dikembangkan untuk mempelajari fungsi
faktor transkripsi. Secara umum teknik reverse genetik ini dibagi ke dalam 2
pendekatan, yaitu overekspresi dan knockout (Zhang 2003). Selain itu analisis
promoter yang difusikan dengan gen pelapor digunakan untuk mempelajari
mekanisme regulasi proses transkripsi gen pada level molekuler dan aktivitas
promoter secara spasial dan temporal (Hiwatashi & Fukuda 2000; Xiao & Xue
2001; Johannesson et al. 2003; Itoh et al. 2008).
HD-Zip adalah salah satu faktor transkripsi yang unik ditemukan pada
tanaman, dikenali dengan adanya homeodomain yang penting untuk pengikatan
DNA dan motif leucin zipper yang membantu proses dimerisasi protein. Proses
dimerisasi protein diperlukan untuk membantu proses pengikatan DNA. HD-Zip
merupakan suatu famili faktor transkripsi yang besar yang dibagi ke dalam IV
sub-famili berdasarkan kespesifikan pengikatan DNA oleh homeodomain, struktur
dan fungsi gen, dan adanya motif lain (Ariel et al. 2007). HD-Zip memiliki
fungsi yang sangat beragam. Ekspresi Gen HD-Zip sub-famili I dan II di
4
perkembangan tanaman pada saat terjadi cekaman (Olsson et al. 2004; Dezar et
al. 2005a; Agalou et al. 2008). Faktor transkripsi HD-Zip di tanaman padi baru
diteliti beberapa tahun belakangan ini. Informasi tentang fungsi dan mekanisme
regulasinya masih sangat terbatas. Dari 31 gen HD-Zip sub-famili I,II, dan III
yang ada pada padi, baru 2 yang dipelajari fungsinya, yaitu OsHox1 dan OsHox4.
OsHox1 berperan dalam differensiasi jaringan pembuluh (Scarpella et al. 2000),
sedangkan OsHox4 berperan dalam pemanjangan dan pembesaran sel pembuluh
(Agalou et al. 2008).
Pada penelitian ini fungsi gen faktor transkripsi OsHox6 yang diisolasi dari
tanaman padi dipelajari. Gen OsHox6, merupakan anggota HD-Zip sub-famili I,
dilaporkan meningkat ekspresinya pada saat kekeringan (Purwantomo 2007;
Agalou et al. 2008), sehingga diduga berperan penting dalam menentukan sifat
toleran kekeringan. Untuk mempelajari lebih lanjut fungsi gen OsHox6 dalam
adaptasi toleran kekeringan, aktivitas native promoter OsHox6 yang difusikan
dengan gen GUSPlus diamati pada tanaman padi saat kekeringan. Kekeringan
meningkatkan ekspresi gen OsHox6 pada berbagai organ (batang, akar, daun, dan
bunga) tanaman padi, namun ekspresinya rendah. Oleh karena itu pada percobaan
tahap berikutnya dilakukan penambahan jumlah salinan gen OsHox6 yang
dikendalikan oleh promoter terinduksi kekeringan OsLEA3 untuk meningkatkan
ekspresi gen OsHox6 padi pada kondisi kekeringan. Sebelumnya, Xiao et al.
(2007) melaporkan bahwa OsLEA3 menunjukkan aktivitas yang tinggi pada
kondisi kekurangan air. Selanjutnya toleransi tanaman padi yang mengandung
tambahan gen OsHox6 terhadap kekeringan dievaluasi.
Selanjutnya untuk mendukung kegiatan analisis fungsi gen, pengembangan
teknik transformasi menggunakan Rhizobium sebagai upaya untuk menyediakan
teknik transformasi alternatif untuk tanaman khususnya padi akan di pelajari.
Teknik yang umum digunakan saat ini untuk mengintroduksi gen pada tanaman,
khususnya padi, adalah menggunakan transformasi Agrobacterium. Teknik ini
memiliki keunggulan dimana kemungkinan untuk menghasilkan satu salinan gen
lebih besar dan dapat digunakan untuk mentransformasi berbagai tanaman
dipatenkan yang mana dapat menjadi ganjalan bila produk akan dipasarkan. Oleh
karena itu perlu diupayakan teknik transformasi alternatif.
Broothaerts et al. (2005) melaporkan bahwa sejumlah bakteri yang
berasosiasi dengan tumbuhan, jika dilengkapi dengan gen-gen virulen dan T-DNA
dari plasmid Ti mampu mentransfer T-DNA ke dalam genom tanaman. Bakteri
Sinorhizobium meliloti, Rhizobium sp dan Mesorhizobium loti mengandung
plasmid Ti dari Agrobacterium dapat mentransfer T-DNA ke dalam genom padi,
tembakau dan Arabidopsis dengan efisiensi transformasi yang bervariasi antara
1-40% tergantung pada spesies dan pengujian yang digunakan. Evaluasi efektititas
bakteri selain Agrobacterium dalam mentransfer gen ke dalam genom tanaman
dibandingkan dengan A. tumefaciens belum pernah dilakukan. Informasi ini
penting sebagai langkah awal dalam upaya pengembangan transformasi genetik
menggunakan bakteri selain Agrobacterium. Selanjutnya perubahan faktor yang
mempengaruhi keberhasilan transformasi diharapkan dapat meningkatkan
efisiensi transformasi di masa mendatang.
Tujuan Penelitian
Penelitian ini bertujuan untuk;
1. Mengevaluasi efektifitas sistem transformasi Rhizobium pada tanaman padi
dibandingkan dengan sistem transformasi Agrobacterium,
2. Menjelaskan regulasi gen OsHox6 melalui studi bioinformatik promoter gen
OsHox6 serta analisis pola ekspresinya pada tanaman padi transgenik yang
mengandung fusi promoter OsHox6 dengan gen penyandi β-glucuronidase, dan
3. Menjelaskan peranan faktor transkripsi OsHox6 pada tanaman transgenik
mengandung ekstra salinan gen OsHox6 pada kondisi kekeringan.
Manfaat Penelitian
1. Teknik transformasi alternatif perlu ada selain untuk menghindari kendala
paten juga untuk meningkatkan efisiensi transformasi tanaman yang sulit di
6
2. Informasi tentang peranan gen OsHox6 dalam mekanisme toleran
kekeringan tanaman padi penting untuk diketahui dalam upaya mencari
gen-gen potensial untuk toleran kekeringan.
3. Promoter terinduksi kekeringan dapat digunakan untuk mengendalikan
ekspresi gen-gen penting terkait toleran kekeringan.
4. Padi toleran kekeringan sangat diperlukan untuk antisipasi fluktuasi iklim
ekstrim (kemarau panjang) yang semakin sering terjadi akibat pemanasan
global yang mengakibatkan gagal panen di daerah utama padi sawah yang
rawan kekeringan.
Ruang Lingkup Penelitian
Untuk mencapai tujuan penelitian di atas, maka penelitian ini dibagi dalam
3 tahap percobaan. Pada tahap awal dilakukan penelitian pendahuluan dengan
topik “Analisis komparatif transformasi genetik padi menggunakan
Agrobacterium tumefaciens dan Rhizobium leguminosarum”. Untuk
mengevaluasi keefektifan teknik transformasi Rhizobium dibandingkan dengan
transformasi Agrobacterium pada tanaman padi, maka pengamatan difokuskan
pada efisiensi regenerasi dan transformasi masing-masing sistem, ekspresi gen,
kecenderungan jumlah salinan gen, pola pewarisan gen, dan pertumbuhan dan
kesuburan (fertilitas) tanaman yang dihasilkan oleh kedua sistem transformasi ini.
Pada tahap berikutnya dilakukan isolasi dan konstruksi vektor yang
mengandung promoter OsHox6 yang difusikan dengan gen GUSPlus. Selanjutnya
vector ini ditransformasikan ke dalam genom tanaman padi. Aktivitas promoter
OsHox6 diamati pada tanaman padi yang mengandung promoter OsHox6 yang
difusikan dengan gen GUSPlus pada kondisi air terbatas (kekeringan) atau tidak
kekurangan air (normal). Selanjutnya, pengamatan dilakukan pada organ
vegetatif (batang, akar, daun) dan generatif (bunga). Untuk mengamati jaringan
yang mengakumulasikan GUSPlus dilakukan irisan secara melintang dan
membujur.
Percobaan tahap berikutnya dilakukan penambahan jumlah salinan gen
OsHox6 yang dikendalikan oleh promoter terinduksi kekeringan OsLEA3 untuk
ketahanan tanaman padi yang mengandung tambahan gen OsHox6 terhadap
kekeringan dievaluasi. Seluruh kegiatan penelitian dalam disertasi ini dirangkum
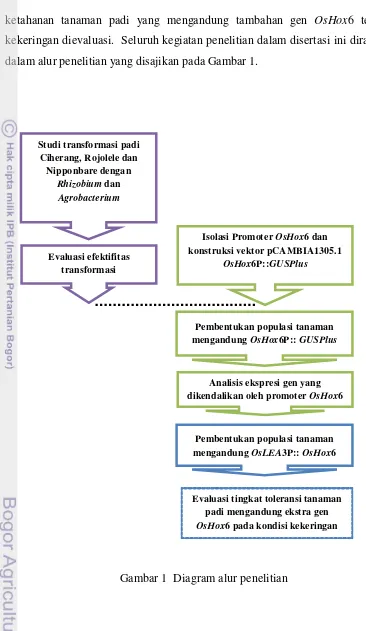
[image:32.595.108.474.84.715.2]dalam alur penelitian yang disajikan pada Gambar 1.
Gambar 1 Diagram alur penelitian
Pembentukan populasi tanaman mengandung OsHox6P:: GUSPlus
Pembentukan populasi tanaman mengandung OsLEA3P:: OsHox6 Isolasi Promoter OsHox6 dan konstruksi vektor pCAMBIA1305.1
OsHox6P::GUSPlus Studi transformasi padi
Ciherang, Rojolele dan Nipponbare dengan
Rhizobium dan Agrobacterium
Evaluasi efektifitas transformasi
Analisis ekspresi gen yang dikendalikan oleh promoter OsHox6
Padi Sebagai Tanaman Penting
Padi tergolong ke dalam genus Oryza, sub-famili Oryzoideae, famili
Poaceae kelas monocotyledoneae. Padi yang dibudidayakan tergolong ke dalam
2 spesies, yaitu Oryza sativa L. umum ditanam di Asia dan Oryza glaberrima
Steud atau disebut juga padi Afrika. Dari kedua spesies tersebut O. sativa adalah
yang paling banyak dibudidayakan. O. sativa diperkirakan terdiri dari sedikitnya
140,000 varietas dan secara umum dikelompokkan ke dalam 3 grup atau
sub-spesies; yaitu Indica, Japonica dan Javanica (Tropical Japonica).
Padi merupakan tanaman yang memiliki nilai ekonomi sangat penting,
makanan pokok lebih dari separuh penduduk dunia. Berdasarkan nilai ekonomi
tanaman pangan secara global tahun 2005-2009, padi menempati urutan teratas
dibandingkan dengan tanaman pangan penting lainnya (jagung, gandum, kentang,
singkong dan sorghum), sedangkan berdasarkan jumlah produksi, padi menempati
urutan kedua setelah jagung (FAOSTAT
urutan pertama dari 7 komoditas pangan utama baik dari segi produksi maupun
nilai ekonomi (FAOSTAT 2009; B
Selain sebagai makanan pokok, padi juga merupakan tanaman model untuk
kelompok monokotil. Sebagai tanaman model padi memiliki ukuran genom yang
relatif kecil (∼430 Mb), umur relatif singkat, dan jumlah set kromosom sederhana
(diploid)
sehingga memudahkan dalam analisis sekuen genom. Selanjutnya tersedianya
protokol transformasi genetika tanaman padi dengan efisiensi tinggi (Hiei et al.
1994; Hiei & Komari 2006), peta fisik dan genetika dengan kepadatan tinggi
(Harushima et al. 1998; Temnykh et al. 2001; McCouch et al. 2002), dan
kenyataan bahwa antara tanaman sereal memiliki derajat ‘synteni’ yang tinggi,
menjadikan padi sebagai organisme yang unik untuk mempelajari fisiologi,
biologi pertumbuhan dan perkembangan, serta genetika dan evolusi tumbuhan.
Tahun 2002 sekuen lengkap genom padi berhasil diungkap dan dipublikasi
(Goff et al. 2002; Yu et al. 2002), sebagai langkah awal dari upaya pemahaman
10
memprediksi padi mengandung ∼32.000 gen. Jumlah ini lebih sedikit dibandingkan dengan prediksi sebelumnya (30-50 ribu gen) oleh Goff et al.
(2002). Sebanyak 28.469 cDNA utuh telah berhasil disekuen dan berdasarkan
pencarian BLASTN dan BLASTX menunjukkan bahwa 75,86% diantaranya
merupakan gen yang menyandikan protein yang mirip dengan data yang ada
dipangkalan data (Rice Full-Length cDNA Consortium 2003). Sisanya, masih
belum dipelajari. Oleh karena itu tugas berikutnya adalah mempelajari fungsi dari
gen-gen tersebut.
Cekaman Kekeringan
Kekeringan adalah salah satu faktor yang menghambat pertumbuhan dan
produksi tanaman termasuk padi. Kekeringan menyebabkan kerugian ekonomi
yang nyata (Kalsim 2007). Kerugian akibat kekeringan ditaksir mencapai
milyaran rupiah setiap tahunnya. Kerugian akibat kekeringan sangat bergantung
pada genotipe yang digunakan, fase pertumbuhan dimana kekeringan terjadi, dan
lama serta tingkat keparahan kekeringan (Setter et al. 1995). Fase generatif
merupakan fase yang sangat sensitif terhadap kekeringan (Yue et al. 2006).
Kekeringan yang terjadi pada fase generatif dapat menyebabkan berkurangnya
jumlah malai dan hasil, bahkan dapat mengakibatkan puso.
Dalam beberapa tahun terakhir kasus kekeringan semakin sering terjadi
akibat adanya perubahan iklim yang disebabkan oleh pemanasan global. Menurut
prediksi menggunakan model perubahan iklim global berdasarkan data iklim dan
produksi padi di Jawa dan bali 25 tahun terakhir mengindikasikan bahwa
kekeringan akan semakin sering terjadi 50 tahun ke depan (Naylor et al. 2007).
Oleh karena itu perakitan padi toleran kekeringan sangat penting untuk
mengantisipasi fluktuasi iklim yang ekstrim.
Untuk dapat merakit padi toleran kekeringan diperlukan pemahaman yang
komprehensif tentang mekanisme pengaturan sifat toleran kekeringan pada
tanaman. Oleh karena itu kajian tentang mekanisme pengaturan sifat toleran
kekeringan pada level molekuler sangat penting dilakukan. Data hasil kajian yang
telah berhasil diperoleh hingga saat ini dapat dijadikan sebagai dasar di dalam
tanaman sereal lainnya. Tanaman toleran kekeringan adalah tanaman yang
mampu hidup, tumbuh, dan memberikan hasil yang memuaskan pada kondisi air
terbatas (Turner 1979, diacu dalam Fleury et al. 2010). Padi toleran kekeringan
yang ideal adalah padi yang dalam kondisi tercekam kekeringan memberikan hasil
yang tinggi dibandingkan padi lainnya (Fukai & Cooper 1995) atau memberikan
hasil stabil dan mampu bertahan pada kondisi kekeringan (Price et al. 2002).
Mekanisme Toleran Kekeringan pada Tanaman
Tanaman tidak seperti makhluk hidup lain yang dapat bergerak atau berlari
menghindar dari bahaya yang mengancam dirinya. Oleh karena itu untuk
mengatasi cekaman lingkungan yang tidak menguntungkan, tanaman
mengembangkan suatu mekanisme toleransi (Levit 1980; Mundree et al. 2002).
Setiap tanaman memiliki kemampuan ini dengan derajat yang berbeda beda.
Kemampuan tanaman dalam mengatasi cekaman lingkungan sangat dipengaruhi
oleh mekanisme yang dimiliki tumbuhan untuk menghindari atau mengatasi
cekaman yang dihadapinya dan tingkat keparahan cekaman.
Untuk dapat mengatasi cekaman lingkungan, tanaman memberikan
tanggapan dan adaptasi melalui perubahan morfologi, fisiologi, biokimia dan
perkembangan, termasuk menginduksi ekspresi gen dan sintesis sejumlah protein
(Takahashi et al. 2000). Tanaman yang berada di bawah cekaman menunjukkan
perubahan pada aktivitas enzim daun, akumulasi mRNA, fotosintesis, kandungan
karbohidrat dan asam amino (Foyer et al. 1998).
Secara umum mekanisme yang dikembangkan oleh tumbuhan untuk
mengatasi cekaman lingkungan (kekeringan) dikelompokkan ke dalam tiga
kelompok (Levit 1980; Chaves et al. 2003), yaitu escape, penghindaran
(avoidance), dan toleran. Mekanisme adaptasi tanaman ini tidak saling terpisah.
Suatu tanaman dapat menggabungkan berbagai mekanisme yang berbeda untuk
proses adaptasi terhadap cekaman (Ludlow 1989, diacu dalam Chavez et al.
12
Identifikasi Gen yang Terlibat dalam Mekanisme Toleran Kekeringan
Salah satu kunci utama dalam pemuliaan tanaman toleran kekeringan adalah
mengetahui gen-gen yang mengendalikan sifat toleran kekeringan. Diduga ada
ratusan gen yang terlibat dalam mekanisme toleran kekeringan. Berbagai
pendekatan telah dilakukan untuk mengidentifikasi gen responsif kekeringan,
diantaranya adalah substractive hybridization (Ouvrard et al. 1996; Deokar et al.
2011), differential display RT-PCR (Medini et al. 2009), cDNA AFLP (Gao et al.
2009), dan DNA microarray (Seki et al. 2001; Seki et al. 2002; Rabbani et al.
2003; Lorenz et al. 2011).
Seki et al. (2001) mengamati 1300 gen Arabidopsis menggunakan cDNA
microarray dan menemukan 40 gen terinduksi kekeringan, 14 diantaranya sudah
pernah dilaporkan sebelumnya (rd29A/cor78, cor15a, kin1, kin2, rd17/cor47,
erd10, dan rd20), sedangkan 30 sisanya belum diketahui fungsinya. Kemudian
Seki et al. (2002) mengamati 7000 gen Arabidopsis lainnya dan menemukan 277
gen terinduksi kekeringan. Sebanyak 128 diantaranya ekspresinya hanya
terinduksi oleh kekeringan, sedangkan sisanya diinduksi oleh kekeringan,
salinitas, dan ABA. Rabbani et al. (2003) mengamati 1700 cDNA tanaman padi
menggunakan cDNA microarray dan menemukan 67 gen terinduksi kekeringan,
sebahagian diantaranya belum diketahui fungsinya. Akhir-akhir ini Gao et al.
(2009) membandingkan ekspresi gen terinduksi kekeringan pada padi sawah dan
padi gogo. Dari hasil kajian tersebut ditemukan bahwa ada 57 gen yang secara
spesifik diekspresikan pada padi gogo dan 38 gen yang secara spesifik
diekspresikan pada padi sawah mengindikasikan adanya ekspresi gen yang
berbeda antara padi gogo dan padi sawah.
Berdasarkan pengaturan ekspresinya Shinozaki dan Yamaguchi-Shinozaki
(1997) membagi gen terinduksi kekeringan ke dalam dua kelompok, yaitu yang
ekspresinya diinduksi oleh ABA (ABA-dependent) dan tidak diinduksi ABA
(ABA-independent). Berdasarkan fungsinya, Shinozaki dan Yamaguchi-Shinozaki
(2007) membagi produk dari gen-gen ini ke dalam 2 grup, yaitu: protein
fungsional dan protein regulator. Protein fungsional meliputi protein yang
berperan dalam merespon kekeringan misalnya protein yang berperan sebagai
makromolekul, (LEA protein dan Chaperon), dan enzim kunci untuk biosintesa
osmolit (prolin, gula). Protein regulator meliputi protein yang mengatur ekspresi
gen lain, misalnya faktor transkripsi, protein kinase, dan protein yang mengatur
biosintesa ABA. Menurut Cushman dan Bohnert (2000) setidaknya ada 8
kelompok gen responsif kekeringan berdasarkan fungsi gennya, yaitu yang
berperan dalam sintesa osmoprotektan, reactive oxygen spesies (ROS), protein
stres, ion atau proton transporter, protein yang mengendalikan status air sel,
komponen sinyal, kontrol transkripsi, dan pengaturan pertumbuhan. Beberapa
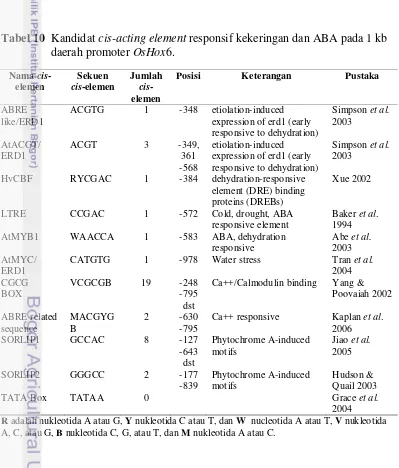
gen yang berperan dalam mekanisme toleran kekeringan disajikan pada Tabel 1.
Pada masa awal pengembangan tanaman toleran kekeringan, pendekatan
yang digunakan adalah memanfaatkan atau meningkatkan ekspresi satu gen
dengan fungsi tunggal seperti osmoprotektan, protein LEA, atau heat shock
protein. Tanaman yang dihasilkan, berdasarkan pengamatan di Laboratorium atau
di rumah kaca, memiliki ketahanan yang lebih baik dari tetuanya. Namun, hingga
saat ini belum ada tanaman toleran kekeringan hasil rekayasa genetika yang telah
berhasil dilepas secara komersial.
Karena kompleksnya sifat toleran kekeringan yang melibatkan banyak gen
penting, rekayasa satu enzim atau protein kelihatannya tidak cukup untuk
membantu tanaman menghadapi kondisi cekaman kekeringan (Nakashima &
Yamaguchi-Shinozaki 2005; Bhatnagar-Mathur et al. 2008). Oleh karena itu
akhir-akhir ini pengembangan padi toleran kekeringan dengan pendekatan
rekayasa genetika diarahkan pada penggunaan faktor transkripsi yang
mengendalikan sekaligus beberapa gen terkait toleran kekeringan
(Bhatnagar-Mathur et al. 2008).
Faktor Transkripsi
Faktor transkripsi, disebut juga faktor pengikat sekuen DNA tertentu
(sequence-specific DNA-binding factor), adalah suatu protein yang menempel
pada urutan DNA tertentu dan mengatur proses transkripsi satu atau lebih gen.
Sejak sekuen lengkap genom beberapa tanaman berhasil diungkap, faktor
14
Tabel 1 Gen yang terlibat dalam respon terhadap cekaman kekeringan dan fungsinya
Kelompok/ Fungsi
Kemungkinan mekanisme
Produk Gen
Osmo protektan Penyesuaian osmotic (osmotic adjustment); perlindungan atau stabilisasi membrane/ protein, pemusnah reactive (OH-)
• Asam amino (prolin, ektoin)
• Senyawa dimetil sulfonium (glisin betain, DMSP)
• Polyol (mannitol, D-ononitol, sorbitol)
• Gula (sucrose, trehalose, fruktan)
•Dadc (Capel et al. 2004),
ectABC (Nakayama et al. 2000), AtP5CS (Yamada
et al. 2005)
•CMO (Shirasawa et al. 2006)
•mtlD (Karakas et al. 1997), IMT1 (Sheveleva
et al. 1997)
•OtsA, OtsB (Garg et al. 2002)
Reactive oxygen scavengers
Detoksifikasi spesies oksigen reaktif (ROS)
• Enzim (catalase, Fe/Mn superoxide dismutase, askorbat peroksidase, enzim siklus glutation, glutathione S-transferase, glutation peroksidase, gamma-glutamilsistein sintetase, alternative oksidase)
• Non enzim (askorbat, flavon, karotenoid, antosianin)
chlCU/ZN SOD (Chatzidimitriadou et al. 2009), PpAPX (Li et al. 2009), SOD, APX (Lu et al. 2010), Eltayeb et al. 2007)
Protein stres Stabilisasi protein, stabilisasi membrane, chaperon
Protein LEA (late embryogenesis abundant ); mis. dehidrin
HaDhn1,2 (Cellier et al. 1998), OsLEA3-1 (Xiao
et al. 2007) Status air Tingkah laku stomata,
pengaturan jumlah AQP pada tonoplas dan membrane plasma
Aquaporin atau lubang (channel) air
OsPIP2-2 (Guo et al. 2006)
Komponen sinyal
Transduksi sinyal yang dimediasi oleh sensor Ca 2+
Homolog histidin kinase (AtRR1/2), MAP kinase (PsMAPK, HOG), Ca /
fosforilasi
2+
SNF1/kinase, protein fosfatase (ABI1/2), system sinyal CAN/B,Ca
dependent protein kinase,
2+
inositol kinase sensor (SOS3),
OsMPK5 (Xiong & Yang 2003), OsSIK1 (Ouyang
et al. 2010).
Kontrol transkripsi
Pengaktifan transkripsi
Faktor transkripsi famili: APETELA2 (AP2), bZIP, zinc-finger, MYB, MYC, NAC,HD-Zip
•OsDREB1 (Ito et al. 2006)
•OsbZIP23 (Xiang et al. 2008)
•WRKY11 (Wu et al. 2009),
•OsMyb4 (Mattana et al. 2005)
•SNAC1 (Hu et al. 2006)
• Hahb4 (Dezar et al. 2005a) Pengatur pertumbuh an Perubahan homeostasis hormon
Mengubah jalur biosintesis atau level konjugat ABA, sitokinin dan/atau brassinosteroid
ARR4 and ARR5 (Miyata
et al. 1998)
[image:39.595.44.479.87.784.2]bioinformatik. Konsorsium faktor transkripsi tanaman, menggunakan data dari 50
spesies tanaman, memperkirakan tanaman mengandung ribuan faktor transkripsi
yang dibagi ke dalam 58 famili berdasarkan struktur dari domain penempelannya
(binding domain) (Zhang et al. 2011). Jumlah ini diperkirakan akan meningkat
dimasa mendatang seiring dengan bertambahnya spesies tanaman yang dipelajari.
Setiap tanaman memiliki komposisi faktor transkripsi yang berbeda. Arabidopsis,
misalnya, diprediksi mengandung 2023 faktor transkripsi yang dikelompokkan ke
dalam 58 famili. Sementara padi Japonica dan Indica diprediksi masing-masing
mengandung 2438 dan 1943 faktor transkripsi yang dikelompokkan kedalam 56
famili. Setiap famili memiliki anggota yang bervariasi jumlahnya mulai dari
puluhan hingga ribuan anggota dan baru sedikit yang sudah dipelajari. Dari 58
famili faktor transkripsi yang ada pada tanaman beberapa dilaporkan terkait
dengan toleran kekeringan, yaitu famili AP2/ERF, C2H2 Zinc finger, NF-YA,
bZip, NAC, MYB, WRKY, dan HD-Zip. Beberapa contoh anggota dari
masing-masing famili dan fungsi yang diperankan terkait dengan toleran kekeringan
disajikan pada Tabel 2.
Tabel 2 Contoh faktor transkripsi tanaman dan peranannya dalam respon kekeringan
Family Gen Mekanisme Pustaka
AP2/ERF DREB
CBF4 HARDY
GmERF3 SHN1/WIN1
Biosintesa osmoprotectan, protein LEA, & pengaturan pertumbuhan
Pengaturan pertumbuhan Meningkatkan efisiensi penggunaan air (WUE) Biosintesa osmoprotektan Biosintesa lapisan lilin
Ito et al. 2006;
Lopato & Langridge 2011
Haake et al. 2002 Karaba et al. 2007
Zhang et al. 2009 Aharoni et al. 2004 C2H2 Zinc
Finger
dst Pengaturan stomata Huang et al. 2009
WRKY BhWRKY1 Signaling oligosakarida famili rafinosa
Wang et al. 2009
NF-YA NFYA5 Pengaturan stomata Li et al. 2008,
Cominelli et al. 2010
MYB MYB96
AtMYB60
Pengaturan lapisan lilin kutikula
Pengaturan stomata
Seo et al. 2011
Cominelli et al. 2005
NAC SNAC
ONAC045
Pengaturan stomata Hu et al. 2006 Zheng et al. 2009 bZip PtrABF Scavenging ROS Huang et al. 2010 HD-Zip Hahb4 Pengaturan perpanjangan sel
atau pertumbuhan
16
HD-Zip
HD-Zip atau homeodomain leucin zipper protein adalah faktor transkripsi
yang unik pada tumbuhan. Protein HD-Zip memiliki ciri yang unik yaitu adanya
homeodomain (HD) dan leucin zipper motif yang penting untuk proses
pembentukan protein dimer. Homo ataupun heterodimerisasi protein diperlukan
dalam proses pengikatan DNA. Faktor transkripsi HD-Zip ditemukan pada
berbagai tumbuhan, mulai dari tumbuhan tingkat rendah lumut (Sakakibara et al.
2001), paku (Aso et al. 1999), hingga tumbuhan tingkat tinggi poplar (Populus
tricocarpa) (Robischon et al. 2011), dari kelas monokotil seperti padi (Agalou et
al. 2008) dan jagung (Whipple et al. 2011), maupun dikotil misalnya Arabidopsis
(Henriksson et al. 2005), bunga matahari (Manavella et al. 2008), dan tumbuhan
gurun Craterostigma plantagineum (Deng et al. 2002), tanaman C3 padi dan
tanaman C4 jagung.
Pusat bioinformatik China memprediksi secara total ada 1419 gen dari
famili HD-Zip pada tanaman yang sudah diidentifikasi (http://planttfdb.cbi.
pku.edu.cn/
Berdasarkan hasil penelitian sebelumnya pada berbagai tanaman
menunjukkan gen HD-Zip memiliki fungsi yang sangat beragam (Tabel 3).
Beberapa protein HD-Zip yang terkenal adalah GLABRA dari sub-famili IV dan
PHABULOSA, CORONA dan REVOLUTA dari sub-famili III. Gen GLABRA
penting dalam pembentukan trikoma (Rerie et al. 1994), sedangkan gen
REVOLUTA, PHABULOSA dan CORONA berperan dalam perkembangan
daun, jaringan pembuluh dan inisiasi jaringan meristem (Prigge et al. 2005).
Akhir-akhir ini gen dari faktor transkripsi HD-Zip khususnya sub-famili I dan II
banyak dipelajari terkait respon kekeringan. Pada tanaman gurun yang sangat ). Pada Arabidopsis thaliana, misalnya, terdapat 56 gen HD-Zip,
kemudian pada bunga matahari ada 15, sedangkan pada padi Indica dan pada padi
Japonica secara berturut-turut adalah 46 dan 61 (Zhang et al. 2011). Gen HD-Zip
ini dibagi kedalam empat sub-famili (I-IV) berdasarkan empat kriteria, yaitu; (1)
konservasi domain HD-Zip yang menggambarkan spesifisitas pengikatan DNA,
(2) struktur gen, (3) motif conserved tambahan, dan (4) berdasarkan fungsinya
(Ariel et al. 2007). Perbedaan struktur protein dari masing-masing sub-famili
toleran kekeringan Craterostigma plantagineum telah diisolasi 5 gen HD-Zip
(CpHB3, 4, 5, 6, 7) responsif kekeringan (Deng et al. 2002). Sebelumnya, Frank
et al. (1998) telah mengisolasi 2 gen HD-Zip (CpHB1 & 2) responsif kekeringan
dari spesies yang sama. Namun, belum ada laporan lebih lanjut mengenai fungsi
atau mekanisme toleran yang diperankan oleh masing gen HD-Zip ini dalam
merespon kekeringan. Pada Arabidopsis 26 gen HD-Zip dari sub-famili I dan II
telah berhasil diisolasi. Empat (AtHB5, 6, 7, dan 12) diantaranya responsif
terhadap kekeringan. Kekeringan menurunkan ekspresi gen AtHB5 dan 6, dan
sebaliknya meningkatkan ekspresi gen AtHB7 dan 12 (Ariel et al. 2007).
Overekspresi gen AtHB7 dan 12 mengakibatkan tanaman menjadi lebih pendek
karena panjang sel berkurang (Hjellstrom et al. 2003; Olsson et al. 2004), namun
belum membuktikan bahwa gen AtHB7 dan 12 meningkatkan ketahanan terhadap
kekeringan. Penelitian yang menunjukkan bahwa gen HD-Zip meningkatkan
ketahanan tanaman terhadap kekurangan air dilaporkan oleh Dezar et al. (2005a)
menggunakan gen Hahb-4 (HD-Zip sub-famili I) bunga matahari. Overekspresi
Hahb-4 dengan promoter CaMV35S menyebabkan tanaman lebih toleran
kekeringan dengan tingkat survival yang lebih tinggi dari tetuanya. Hal ini
menunjukkan potensi pemanfaatan gen HD-Zip dalam perakitan tanaman toleran
kekeringan di masa mendatang.
Pada tanaman padi gen HD-Zip baru dipelajari beberapa tahun terakhir ini.
Hasil analisis in silico terhadap sekuen utuh genom padi yang dilakukan oleh
Agalou et al. (2008) berhasil mengidentifikasi 26 gen HD-Zip sub-famili I dan II.
Delapan (yaitu OsHox4, 6, 11, 19, 20, 22, 24, dan 27) dari 26 gen HD-Zip tersebut
responsif kekeringan pada dua varitas padi Zhensan97 (padi sawah sensitif
kekeringan) dan IRAT109 (padi gogo toleran kekeringan) berdasarkan hasil
analisis ekspresi menggunakan real-time PCR. Overekspresi OsHox4
menggunakan promoter CaMV35S pada tanaman Arabidopsis dan padi
meningkatkan ketahanan tanaman terhadap kekeringan. Namun, tanaman menjadi
kerdil akibat ukuran sel yang pendek dan steril (Agalou et al. 2008). Hal ini
mengindikasikan bahwa OsHox4 berperan dalam pemanjangan sel. Fungsi gen
responsif kekeringan OsHox lainnya belum diketahui, sehingga analisis fungsi gen
18
Gambar 2 Skema struktur protein unik dari setiap sub-famili HD-Zip. HD
homeodomain, LZ leucin zipper, CPSCE asam amino konservatif Cys, Pro, Ser, Cys, Glu dengan sandi satu huruf, domain
MEKHLA asam amino konservatif Met, Glu, Lys, His, Leu, Ala ,
N-term consensus ujung-N, SAD START-adjacent domain, START (steroidogenic acute regulatory protein-related lipid transfer ( Ariel et al. 2007).
Tabel 3 Sub-famili HD-Zip dan fungsinya
Sub-famili Fungsi
HD-Zip I Respon terhadap cekaman abiotik , respon terdap ABA, de-etiolasi, sinyal cahaya biru
HD-Zip II Respon terhadap keadaan pencahayaan,toleran naungan (Shade avoidance), respon terhadap auxin
HD-Zip III Embriogenesis, pengaturan meristem, inisiasi organ lateral, polaritas daun, perkembangan jaringan pembuluh, transport auxin
HD-Zip IV Differensiasi sel epidermis, akumulasi antosianin, perkembangan akar, pembentukan trikom
Sumber: Ariel et al. 2007
Analisis Fungsi Gen
Tujuan jangka panjang dari proyek sekuensing genom adalah diketahuinya
fungsi setiap gen yang ada di dalam genom dan bagaimana interaksinya dengan
gen lain. Data ini sangat penting dalam memahami biologi tanaman pada level
molekuler dan untuk memuliakan tanaman pada masa mendatang. Secara umum
ada 2 pendekatan untuk melakukan analisis fungsi gen, yaitu dengan pendekatan
forward dan reverse genetic (Peters et al. 2003). Forward genetic adalah
pendekatan yang digunakan untuk mengidentifikasi gen yang bertanggung jawab
menentukan fenotipe tertentu dalam suatu organisme. Sebaliknya reverse genetic
meliputi pendekatan yang digunakan untuk mengetahui fenotipe dari suatu gen
Forward genetic secara umum dilakukan untuk mengindentifikasi gen atau
mutasi gen yang menentukan fenotipe mutan yang spesifik. Fenotipe mutan yang
spesifik menjadi bahan dasar kajian dari forward genetic. Tanaman mutan
diperoleh dari hasil mutasi alam atau mutasi buatan. Mutasi alam terjadi sangat
jarang dan kemungkinannya sangat kecil sehingga untuk mendapatkan populasi
mutan yang besar diperlukan induksi mutasi. Ada beberapa pendekatan yang
digunakan untuk menginduksi mutasi pada tanaman, yaitu dengan menggunakan
senyawa kimia (mis. EMS, NaN3
Secara ringkas tahapan yang dilakukan untuk mengidentifikasi gen
menggunakan teknik map-based cloning atau disebut juga positional cloning
adalah; (1) membuat populasi mapping yang besar dengan menyilangkan tanaman
mutan dengan tipe liarnya, (2) mengidentifikasi marka yang bertautan (linkage)
erat dengan gen target, (3) mengidentifikasi pustaka YAC (yeast artificial
chromosom) atau BAC (bacterial artificial chromosom) yang berhibridisasi
dengan pelacak marka, (4) membuat atau mencari marker baru dari YAC atau
BAC (biasanya sekuen dari ujung klon) yang berkosegregasi dengan gen target,
(5) skrining ulang (jika diperlukan) dari klon YAC atau BAC yang berbeda untuk
memperoleh marker yang berkosegregasi dengan gen target, (6) mengidentifikasi
kandidat gen dari klon BAC atau YAC yang berkosegregasi dengan gen target, (7)
melakukan komplementasi genetika, dengan transformasi kandidat gen ke ), radiasi ion (mis. sinar gamma), transformasi
T-DNA atau dengan penyisipan transposon (Ramachandran & Sundaresan 2001;
Walden 2002; Kim et al. 2006; Al-Qurainy & Khan 2009; Suprasanna et al.
2009). Identifikasi gen dari mutan hasil induksi dengan senyawa kimia atau
iradiasi sinar gamma membutuhkan proses yang panjang dan memerlukan waktu
dan tenaga yang banyak karena harus menggunakan teknik map-based cloning
(Peters et al. 2003). Sebaliknya, identifikasi gen pada mutan yang diperoleh
dengan transformasi T-DNA dan penyisipan transposon lebih mudah dan cepat
dengan menggunakan sequen yang ada pada daerah T-DNA atau transposon
sebagai pelacak. Namun, keberhasilan insersi T-DNA dan transposon biasanya
tergantung pada genotipe tanaman yang digunakan dan hanya dapat dilakukan
pada tanaman dimana sistem transformasinya sudah dikuasai dengan baik (Gepts
20
tanaman mutan, untuk memulihkan fenotipe tipe liar, dan terakhir (8) menyekuen
gen dan mengidentifikasi sekuen untuk menentukan fungsinya (McClean 1998).
Saat ini banyak teknik yang dikembangkan untuk memudahkan identifikasi
gen pada tanaman menggunakan pendekatan insertional mutagenesis. Beberapa
dari teknik tersebut adalah T-DNA tagging, transposon tagging, retrotransposon
tagging, activation tagging, dan entrapmen tagging. Masing-masing memiliki
keunggulan dan kelemahan (Jeon & An 2001; Ramachandran & Sundaresan
2001). DNA tagging atau gene tagging secara sederhana dapat diartikan sebagai
penandaan atau pelabelan gen sehingga mudah dilacak. Pada dasarnya tahapan
yang dilakukan untuk mengidentifikasi gen pada mutan hasil insertional
mutagenesis adalah sama meskipun teknik insertional mutagenesis yang dipilih
berbeda. Tahapan yang dilakukan meliputi (1) pembentukan populasi mutan yang
besar menggunakan teknik transformasi tanaman, (2) karakterisasi molekuler
mutan untuk mencari galur-galur dengan satu salinan, (3) penapisan galur mutan
stabil dengan teknik PCR, (4) penapisan galur stabil dengan fenotipe yang
diharapkan, (5) isolasi sekuen DNA yang mengapit daerah yang diberi label (mis.
dengan thermal asymmetric interlaced (TAIL) PCR, adapter-ligated PCR, inverse
PCR, atau plasmid rescue), (6) Sekuensing DNA yang mengapit daerah yang
diberi label dan identifikasi sekuen untuk menentukan fungsinya dengan studi
bioinformatik (Vandenbusschea et al. 2003).
Pendekatan reverse genetic memanfaatkan data yang ada di pangkalan data
hasil proyek sekuen genom, EST, atau transcript profiling. Reverse genetic
dimulai dengan pemilihan gen target kemudian melihat pengaruh yang
ditimbulkan terhadap fenotipenya akibat perubahan yang dibuat pada gennya.
Secara umum pendekatan yang digunakan untuk mempelajari fungsi gen secara
reverse genetika terdiri dari beberapa percobaan; (1) menghilangkan fungsi (loss
of function) gen target, (2) meningkatkan fungsi (gain of function) gen target, (3)
tracking dan (4) kajian ekspresi
Percobaan untuk menghilangkan fungsi suatu gen melibatkan pembuatan
atau manipulasi DNA secara in vitro dengan teknik tertentu sehingga gen tersebut
knockout dan silencing gen. Knockout gen menghilangkan fungsi gen dengan
mengubah suatu sekuen gen menjadi tidak aktif sedangkan silencing gen
menghilangkan fungsi gen dengan menghambat proses transkripsinya
(Thorneycroft et al. 2001). Knockout dapat dilakukan diantaranya dengan insersi
T-DNA atau transposon (Thorneycroft et al. 2001), sedangkan silencing dapat
dilakukan dengan teknik RNAi (Kusaba 2004). Konstruk gen dari hasil
modifikasi ditransformasikan kembali ke dalam genom tanaman untuk melihat
pengaruhnya pada fenotipe yang dikendalikan.
Kegiatan meningkatkan fungsi (gain of function) suatu gen adalah kebalikan
dari loss of function. Kegiatan ini biasanya diparalelkan dengan loss of function
untuk mendapatkan data atau hasil yang lebih komprehensif. Prosesnya sama
seperti loss of function hanya konstruknya dirancang untuk meningkatkan fungsi
gen. Umumnya dengan menambah ekstra salinan gen disertai dengan
penggunakan promoter yang lebih kuat (Lloyd 2003; Cho & Hong 2006)
Tracking dilakukan untuk menggali informasi tentang lokalisasi dan
interaksi protein terkait. Salah satu cara untuk melakukan ini adalah
menggabungkan sekuen gen aslinya dengan gen pelapor misalnya green
fluorescent protein (GFP) yang memudahkan visualisasi produk modifikasi
genetika dalam sel atau jaringan tanaman (Boulin et al. 2006; Ko et al. 2007).
Kajian ekspresi bertujuan mengetahui dimana dan kapan protein tertentu
dihasilkan. Dalam melakukan penelitian ekspressi gen, promoter gen target
difusikan dengan suatu gen pelapor (mis. gus, atau GFP) dan ditransformasikan
kembali ke dalam sistem tanaman. Expresi gen kemudian diamati pada berbagai
sel atau jaringan, pada tahap pertumbuhan tertentu, atau pada kondisi lingkungan
tertentu (Boulin et al. 2006; Ko et al. 2007).
Transformasi Genetika Tanaman
Transformasi genetika tanaman adalah salah satu teknik yang sangat penting
dalam penelitian biologi molekuler dan pemuliaan tanaman. Transformasi
genetika memungkinkan pemindahan dan penyisipan satu atau beberapa DNA/gen
dari berbagai sumber (bakteri, fungi, hewan dan tumbuhan) ke dalam suatu genom
22
dalam 2 kelompok, yaitu teknik transformasi langsung (penembakan DNA,
elektroporasi, mikroinjeksi, dan PEG), dan dengan bantuan bakteri Agrobacterium
(Jahne et al. 1995; Komari et al. 1998; Tzfira & Citovsky 2006). Teknik
transformasi secara langsung dapat diaplikasikan pada berbagai jenis tanaman,
namun cenderung menyisipkan gen dengan jumlah salinan banyak pada satu lokus
(Dai et al. 2001). Hal ini menyebabkan tingginya DNA rearrangement
(penyusunan kembali) atau pembungkaman gen, sehingga dapat menimbulkan
kesalahan dalam interpretasi data (Kohli et al. 1998; Reddy et al. 2003).
Transformasi Agrobacterium merupakan teknik yang paling umum digunakan saat
ini, karena memiliki kelebihan antara lain tidak memerlukan peralatan yang
mahal, dapat diaplikasikan secara luas baik pada kelompok tanaman dikotil
maupun monokotil, pola integrasi DNA lebih mudah diprediksi dan yang paling
penting adalah kemungkinan untuk mendapatkan tanaman dengan satu salinan
gen sangat tinggi (Roy et al. 2000; Dai et al. 2001). Tanaman homozigot dengan
satu salinan gen sangat penting didalam pemuliaan tanaman dan kajian fungsi gen
karena tanaman dianggap sudah stabil dan lebih mudah dalam interpretasi
datanya.
Secara alami Agrobacterium tumefaciens adalah bakteri patogen tanah
yang dapat menyebabkan penyakit tumor pada tumbuhan dari kelas
dikotiledoneae. Dalam sistematika mikroorganisme Agrobacterium
diklasifikasikan sebagai berikut:
Kingdom
Phylum
Class
Ordo
Famili
Genus : Agrobacterium
Tumor disebabkan oleh suatu plasmid Agrobacterium yang sangat besar
yang kemudian disebut dengan plasmid Ti (Tumor inducing). Plasmid Ti
mengandung T-DNA yang diapit oleh 23 pasang sekuen basa berulang dan satu
untuk mengangkut T-DNA dari sel bakteri dan menyisipkannya ke dalam genom
tanaman. T-DNA mengandung gen penyandi senyawa opine (octopin, nopalin,
atau leucinopin) yang diperlukan oleh Agrobacterium dan gen penyandi hormon
pertumbuhan tanaman yang mengakibatkan pertumbuhan sel tidak terkendali dan
membentuk tumor. Proses transfer gen oleh Agrobacterium sudah banyak diulas
sebelumnya diantaranya oleh Sheng dan Citovsky (1996) dan Tinland (1996).
Hasil penelitian sebelumnya yang menunjukkan bahwa T-DNA dapat
dipisahkan secara fisik dari gen virulen menjadi dua plasmid yang terpisah yang
kemudian dikenal dengan sistim biner (Hoekema et al. 1984). Sifat onkogenik
tetap terpelihara selama kedua plasmid berada di dalam Agrobacterium yang
sama. Selanjutnya setiap DNA asing yang disisipkan ke dalam T-DNA dapat
ditransfer ke dalam sel tanaman. Hal ini sangat menguntungkan karena plasmid
lebih kecil dan mudah dimanipulasi. Selanjutnya onkogen dapat dihilangkan dari
T-DNA agar tanaman tumbuh normal, dan situs restriksi unik ditambahkan untuk
memudahkan penyisipan gen asing (Riva et al. 1998; Lee & Gelvin 2008).
Transformasi Agrobacterium kemudian digunakan secara luas pada tanaman
dikotil, namun tidak pada monokotil karena tanaman dari kelompok ini bukan
inang dari Agrobacterium. Keberhasilan transformasi dari kelompok monokotil
pertama kali dilaporkan oleh Hiei et al. (1994) pada tanaman padi Japonica
kultivar Tsukinohikasi, Asanohikari, dan Koshihikari. Dari berbagai eksplan yang
diuji, kalus embriogenik dari skutellum umur tiga hari adalah bahan yang paling
sesuai untuk infeksi Agrobacterium. Kalus diko-kultivasi dengan A. tumefaciens
strain LBA4404 dan EHA101, masing-masing mengandung plasmid pTOK233
atau pIG121Hm, selama tiga hari pada media mengandung 100 µM asetosyringon.
Plasmid pTOK233 dan pIG121Hm masing-masing mengandung gen penanda gus
dan penyeleksi hpt. Hasil analisis berdasarkan gen β-glucuronidase (gus) dan gen penyeleksi hygromycin phosphotransferase (hpt) pada tanaman transgenik R1 dan
R2 menunjukkan integrasi, ekspresi, dan pewarisan gen yang stabil (Hiei &
Komari 1996). Meskipun efisiensi transformasi Agrobacterium masih dianggap
rendah pada saat itu dan sulit untuk padi Indica, penelitian ini telah menginspirasi
peneliti untuk meningkatkan efisiensi transformasi pada tanaman padi.
24
dipelajari, diantaranya pengaruh genotipe tanaman, strain Agrobacterium,
plasmid, senyawa penginduksi gen virulen (vir), komposisi media, dan jaringan
yang digunakan (Opabode 2006). Faktor lain yang juga penting menentukan
keberhasilan transformasi tanaman adalah perlakuan osmotik pada eksplan, lama
ko-kultivasi, kerapatan A. tumefaciens, pengeringan eksplan, perlakuan
antinekrotik, suhu selama ko-kultivasi, penambahan surfaktan, media inokulasi
dan ko-kultur, antibiotik dan agen penyeleksi yang digunakan. Saat ini
transformasi tanaman padi Japonica sangat mudah dilakukan dengan efisiensi
transformasi yang tinggi. Selanjutnya protokol transformasi untuk tanaman padi
Indica juga sudah tersedia (Toki 1997; Saharan et al. 2004; Lin & Zhang 2005;
Hiei & Komari 2006). Sejumlah sifat agronomi penting telah ditransformasi ke
dalam genom tanaman padi dengan bantuan Agrobacterium untuk meningkatkan
ketahanan cekaman biotik dan abiotik, dan meningkatkan kualitas nutrisinya (Roy
et al. 2000).
Higga saat ini Agrobacterium masih dianggap sebagai satu-satunya genus
bakteri yang mampu melakukan transfer gen ke dalam genom tanaman dan
digunakan secara luas pada tanaman termasuk padi. Namun, kebanyakan
teknologi yang terlibat di dalamnya dilindungi oleh paten di berbagai belahan
dunia, yang kebanyakan dipegang oleh perusahaan multi nasional. Hal ini dapat
menjadi kendala dalam pemanfaatan teknik ini untuk pemuliaan tanaman
(Jambresic 2005), sehingga ada upaya untuk mencari bakteri alternatif selain
Agrobacterium.
Adanya kenyataan bahwa gen virulen dan T-DNA yang terlibat dalam
transfer gen tidak dipatenkan kemudian dimanfaatkan untuk merekayasa bakteri
selain Agrobacterium untuk digunakan sebagai agen transfer gen. Ide ini pertama
kali direalisasikan oleh Broothaerts et al. (2005) yang merekayasa bakteri dari
golongan Rhizobia agar dapat dimanfaatkan sebagai agen transfer gen. Bakteri
yang tergolong ke dalam kelompok Rhizobia adalah bakteri tanah yang sudah
lama dikenal berasosiasi dengan tanaman membentuk bintil akar yang penting
untuk proses fiksasi nitrogen dari udara (Weir 2011). Contoh bakteri yang
Ensifer/Shinorhizobium, dan Bradyrhizobium. Semua masuk dalam famili
Rhizobiaceae.
Proses transfer gen yang terjadi pada Rhizobia hasil rekayasa adalah
dengan melibatkan gen virulen dan T-DNA dari Agrobacterium (Broothaerts et al.
2005).