KINERJA ANTIKOROSI ZINK DIALKILDITIOFOSFAT
BERDASARKAN STUDI TERMODINAMIKA DAN KINETIKA
DENGAN TEKNIK POLARISASI POTENSIODINAMIK
DENAR ZULIANDANU
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Kinerja Antikorosi Zink Dialkilditiofosfat Berdasarkan Studi Termodinamika dan Kinetika dengan Teknik Polarisasi Potensiodinamik adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
DENAR ZULIANDANU. Kinerja Antikorosi Zink Dialkilditiofosfat Berdasarkan Studi Termodinamika dan Kinetika dengan Teknik Polarisasi Potensiodinamik. Dibimbing oleh KOMAR SUTRIAH dan MOHAMMAD KHOTIB.
Zink Dialkilditiofosfat (ZDTP) merupakan aditif pelumas yang memiliki banyak fungsi di antaranya sebagai antifriksi, antiaus, antioksidan, dan antikorosi. Kinerja ZDTP sebagai antikorosi dapat diukur menggunakan teknik polarisasi potensiodinamik. Tiga jenis ZDTP dibuat berdasarkan panjang rantai alkil. Pengukuran menunjukkan bahwa ZDTP 8 memiliki efektivitas inhibisi korosi paling besar dibandingkan dengan ZDTP 4 dan ZDTP 16. Efektivitas inhibisi ZDTP 8 pada logam Cu mencapai 80% pada konsentrasi larutan inhibitor 2%. Hasil penelitian ini juga menjelaskan adanya pengaruh panjang rantai alkil ZDTP terhadap kinerja antikorosi. Verifikasi parameter termodinamika menunjukkan spontanitas korosi berkurang dengan kehadiran inhibitor. Energi aktivasi proses korosi dengan kehadiran ZDTP 8 sebesar 38.60 kJ mol-1, nilai ini lebih besar daripada energi aktivasi blangko yakni 31.14 kJ mol-1. Fenomena ini menunjukkan adanya penurunan laju korosi yang berkaitan dengan kenaikan energi minimum reaksi.
Kata kunci: efektivitas inhibisi, kinetika, polarisasi, termodinamika, ZDTP
ABSTRACT
DENAR ZULIANDANU. The Performance of Zinc Dialkyldithiophosphates as Anti-Corrosion Based on Thermodynamic and Kinetic Study with Potentiodynamic Polarization Technique. Supervised by KOMAR SUTRIAH and MOHAMMAD KHOTIB.
KINERJA ANTIKOROSI ZINK DIALKILDITIOFOSFAT
BERDASARKAN STUDI TERMODINAMIKA DAN KINETIKA
DENGAN TEKNIK POLARISASI POTENSIODINAMIK
DENAR ZULIANDANU
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Nama Denar Zuliandanu
NIM G44090103
Disetujui oleh
-
Dr Komar Sutriah, MS Mohammad Khotib, SSi, MSi
Pembimbing I Pembimbing II
Diketahui oleh
MS
Judul Skripsi : Kinerja Antikorosi Zink Dialkilditiofosfat Berdasarkan Studi Termodinamika dan Kinetika dengan Teknik Polarisasi Potensiodinamik
Nama : Denar Zuliandanu NIM : G44090103
Disetujui oleh
Dr Komar Sutriah, MS Mohammad Khotib, SSi, MSi
Pembimbing I Pembimbing II
Diketahui oleh
Prof Dr Ir Tun Tedja Irawadi, MS Ketua Departemen
PRAKATA
Puji dan syukur penulis ucapkan kepada Allah SWT atas segala nikmat dan karunia-Nya sehingga penelitian ini dapat diselesaikan dengan baik. Penelitian ini dilaksanakan sejak bulan Maret sampai Juni 2013. Tema yang dipilih ialah antikorosi, dengan judul Kinerja Antikorosi Zink Dialkilditiofosfat Berdasarkan Studi Termodinamika dan Kinetika dengan Teknik Polarisasi Potensiodinamik.
Terima kasih penulis ucapkan kepada Bapak Dr Komar Sutriah, MS dan Bapak Mohammad Khotib, SSi, MSi selaku pembimbing yang telah banyak memberikan arahan, serta Bapak Dr Zainal Alim Mas’ud, DEA, Bapak Novryandi Hanif, MSc, DSc, dan Bapak Drs Muhammad Farid, MSi yang telah memberi saran. Penghargaan juga disampaikan kepada Rismawati, SSi dan Itoh Khitotul Hayati, SSi yang telah membantu penelitian. Di samping itu, terima kasih penulis sampaikan kepada Ibu Dr Henny Purwaningsih, SSi, MSi dan Mas Eko atas fasilitas Laboratorium Bersama Departemen Kimia IPB. Terima kasih juga untuk Sujono, SSi, Indah, Ibrahim, dan staf analis Laboratorium Terpadu IPB, serta Bapak Yani dari Bengkel Fisika IPB yang telah membantu selama pengumpulan data.
Ungkapan terima kasih juga disampaikan kepada kedua orang tua serta seluruh keluarga atas doa dan motivasinya. Terima kasih juga disampaikan kepada mahasiswa penelitian di Laboratorium Terpadu IPB, rekan-rekan mahasiswa Laboratorium Kimia Fisik dan Lingkungan, serta teman-teman angkatan Kimia 46 atas doa dan dukungannya.
Semoga skripsi ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL iii
DAFTAR GAMBAR iii
DAFTAR LAMPIRAN iii
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Waktu dan Tempat Penelitian 2
METODE 2
Bahan dan Alat 2
Sintesis Zink Dialkilditiofosfat (Dinoiu et al. 2007) 2
Pencirian Produk 3
Pengukuran dengan Teknik Polarisasi Potensiodinamik 3
Parameter Termodinamika Proses Korosi 4
Kinetika Laju Korosi dengan Tinjauan Energi Aktivasi 4
HASIL DAN PEMBAHASAN 4
Hasil Sintesis ZDTP dan penciriannya 4
Efektivitas Inhibisi Korosi ZDTP Berdasarkan Polarisasi Potensiodinamik 7 Pengaruh Panjang Rantai ZDTP pada Kinerja Antikorosi 8
Pengaruh Suhu pada Arus Korosi 9
Parameter Termodinamika dan Kinetika Korosi 10
SIMPULAN 12
DAFTAR PUSTAKA 12
LAMPIRAN 14
DAFTAR TABEL
1 Rendemen sintesis ZDTP 5
2 Parameter korosi dan efektivitas inhibisi korosi larutan ZDTP yang diukur pada suhu 28 oC dan lama pencelupan 15 detik 7
3 Pengaruh suhu pada arus korosi 10
4 Parameter termodinamika dan kinetika korosi 11
DAFTAR GAMBAR
1 Rute sintesis ZDTP 5
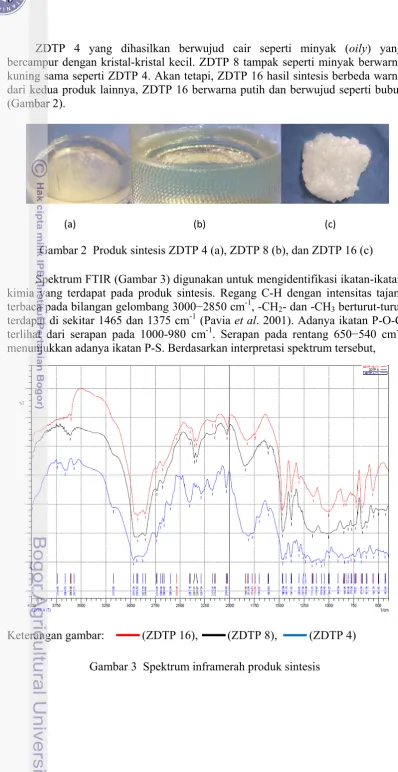
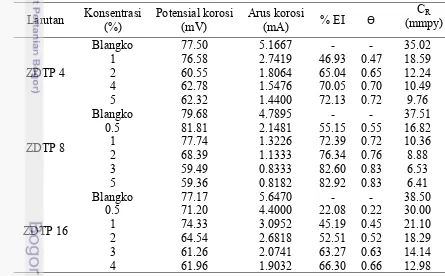
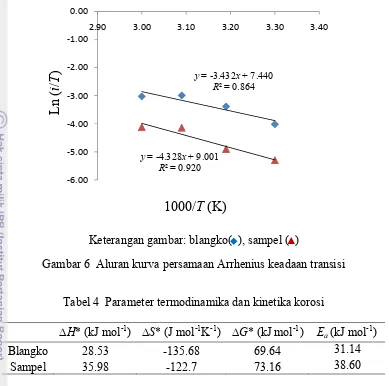
2 Produk sintesis ZDTP 4 (a), ZDTP 8 (b), dan ZDTP 16 (c) 6
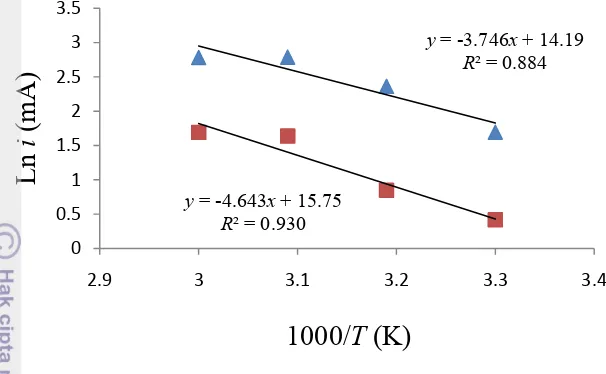
3 Spektrum inframerah produk sintesis 6
4 Model adsorpsi molekul ZDTP 8 yang telah dioptimisasi energi dengan metode mekanika molekuler menggunakan perangkat lunak HyperChem 8 5 Hubungan konsentrasi larutan ZDTP dengan efektivitas inhibisi korosi 9 6 Aluran kurva persamaan Arrhenius keadaan transisi 11
7 Aluran kurva persamaan Arrhenius 12
DAFTAR LAMPIRAN
1 Diagram alir penelitian 15
2 Rangkaian alat sintesis ZDTP 16
3 Elektrode Cu, reservoir, dan rangkaian alat pengukuran elektrokimia 17 4 Bobot reaktan dan perhitungan sintesis ZDTP 18 5 Contoh perhitungan data polarisasi potensiodinamik 19 6 Kurva polarisasi zink dialkilditiofosfat 20
PENDAHULUAN
Latar Belakang
Korosi merupakan suatu fenomena permukaan yang terjadi akibat adanya reaksi oksidasi-reduksi antara permukaan logam dan lingkungannya. Benda yang terserang korosi akan mengalami penurunan mutu dan apabila korosi dibiarkan terus-menerus akan semakin fatal akibatnya. Bukan hanya kerugian dari segi ekonomi, korosi dapat juga berefek pada keamanan dan keselamatan, misalnya proses korosi yang menyerang infrastruktur jalan, bangunan, serta tangki dan pipa penyaluran minyak. Rapuhnya logam akibat korosi dapat membuat infrastruktur tersebut menjadi rusak dan ambruk. Oleh karena itu, kajian mengenai korosi menjadi begitu penting, terutama kajian mengenai senyawa-senyawa yang memiliki aktivitas inhibisi korosi, sehingga dampak yang terjadi dapat diminimumkan. Antikorosi merupakan zat kimia yang mampu menginhibisi laju korosi lingkungan terhadap logam.
Antikorosi dapat berupa senyawa organik, anorganik, dan senyawa kompleks koordinasi. Contoh senyawa kompleks koordinasi yang dapat bertindak sebagai antikorosi ialah senyawa zink dialkilditiofosfat (ZDTP) (Sangvanich et al. 2008). Pada mulanya senyawa ZDTP banyak digunakan sebagai pelumas pada industri automotif (Becchi et al. 2001), tetapi kemudian diketahui bahwa senyawa ini juga mampu bertindak sebagai antikorosi (Loftus 2002). Senyawa ZDTP dapat teradsorpsi pada antarmuka logam, sehingga melindungi logam dari serangan korosi. Selain sebagai antikorosi, senyawa ini juga memiliki kemampuan sebagai antifriksi, antiaus, dan antioksidan (Rudnick 2009).
Rantai alkil pada ZDTP dapat dibuat beragam sesuai dengan kebutuhan pemakaian, rantai alkil yang berbeda tentunya akan memberikan sifat fisikokimia yang berbeda. Menurut Yu et al. (2007) gugus alkil sekunder memberikan kinerja antiaus yang lebih baik daripada alkil primer atau aril. Semakin panjang rantai alkil dari ZDTP, semakin tinggi kestabilannya terhadap panas. ZDTP dari alkohol sekunder kurang stabil terhadap panas, tetapi memiliki sifat antioksidan dan pelumasan yang lebih baik dari rantai primer (Evstaf’ev et al. 2001). Pada minyak pelumas komersial, ZDTP yang banyak digunakan memiliki rantai alkil C4 sampai C10 (Sangvanich et al. 2008). Saat ini belum banyak penelitian yang melaporkan kinerja antikorosi ZDTP dengan alkohol rantai panjang (fattyalcohol). Struktur yang lebih teratur dan rapat dari ZDTP dengan rantai fattyalcohol diduga akan memberikan kinerja antikorosi yang lebih baik daripada ZDTP yang umum digunakan pada minyak pelumas komersial saat ini. Menurut Peng et al. (2011), struktur ZDTP yang lebih teratur dan rapat memberikan kinerja antikorosi yang lebih baik dibandingkan dengan struktur yang lebih meruah dan bercabang.
Selain parameter polarisasi, besaran termodinamika dan kinetika juga dapat digunakan untuk mengukur kemudahan suatu reaksi korosi terjadi. Parameter termodinamika juga dapat memberi informasi mengenai transfer energi di antara sistem dan lingkungannya (Atkins dan Paula 2006). Derajat ketidakteraturan sistem dijelaskan dengan perubahan entropi (∆S) dan kespontanan suatu reaksi mampu dijelaskan melalui perubahan energi bebas Gibbs (∆G). Tinjauan mengenai kinetika korosi dapat dijelaskan berdasarkan nilai energi aktivasi (Ea) proses korosi. Nilai perubahan besaran termodinamika dan energi aktivasi tersebut bisa didapatkan berturut-turut melalui persamaan Arrhenius keadaan transisi dan persamaan Arrhenius (Rafiquee et al. 2008).
Tujuan Penelitian
Penelitian ini bertujuan mengukur kinerja antikorosi ZDTP, mengukur nilai parameter termodinamika dan kinetika korosi menggunakan teknik polarisasi potensiodinamik, serta mempelajari pengaruh panjang rantai ZDTP pada aktivitas inhibisi korosi pada logam Cu .
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Maret sampai Juni 2013 di Laboratorium Terpadu IPB Baranangsiang dan Laboratorium Bersama Departemen Kimia IPB.
METODE
Bahan dan Alat
Penelitian ini terdiri atas 2 bagian, pertama ialah sintesis ZDTP dan penciriannya, bagian kedua ialah pengukuran elektrokimia (Lampiran 1). Bahan-bahan yang digunakan untuk sintesis ZDTP antara lain P2S5 (Merck), n-butanol (Univar), 1-oktanol (Merck), setilalkohol, ZnO (teknis), n-heptana (AnalaR), dan HNO3 pekat. Untuk pengukuran elektrokimia, digunakan aseton, ampelas silikon karbida 100 CW, HCl 5%, dan kupon tembaga (elektrode kerja). Adapun peralatan yang digunakan antara lain adalah labu didih, termometer, pemanas, pengaduk magnetik, neraca analitik, stopwatch, potensiostat EA160 yang dilengkapi program EChem® versi 2.1, perangkat lunak HyperChem® versi 6, dan spektrofotometer inframerah transformasi Fourier (FTIR) Prestige-21 Shimadzu.
Sintesis Zink Dialkilditiofosfat (Dinoiu et al. 2007)
3
di dalam labu didih (Lampiran 2). Produk samping reaksi ini berupa gas H2S, oleh karena itu labu didih disambungkan dengan rangkaian alat penjerap H2S (Hayati 2013). Pemanasan dan pengadukan dilakukan pada suhu 70−90 oC pada penangas air. Reaksi tersebut akan membentuk asam dialkilditiofosfat (ADTP). Sebanyak 1 mol ZnO ditambahkan pada reaktor yang sama untuk membentuk ZDTP. Dilakukan pengadukan tanpa pemanasan selama 12 jam pada reaksi tahap 2 untuk pembentukan ZDTP. Produk sintesis kemudian dipisahkan dengan cara diekstraksi menggunakan 20 mL n-heptana dan dicuci dengan 20 ml air (Rismawati 2013). Ekstraksi dan pencucian dilakukan hingga fase air terlihat jernih. Fase organik yang diambil kemudian diuapkan pelarutnya dan ditimbang bobot ZDTP untuk mendapatkan rendemennya.
Pencirian Produk
ZDTP hasil sintesis dicirikan dengan menggunakan FTIR yang bertujuan menentukan gugus fungsi atau ikatan kimia yang terdapat pada produk. Pengukuran dilakukan dengan cara menggerus produk dengan KBr, kemudian dibuat pelet dan diukur.
Pengukuran dengan Teknik Polarisasi Potensiodinamik
%EI х %
Parameter Termodinamika Proses Korosi
Parameter termodinamika ditentukan berdasarkan persamaan Arrhenius keadaan transisi (Rafiquee et al. 2008):
ln ln ∆ ∆
Parameter ΔH* dan ΔS* berturut-turut merupakan perubahan entalpi dan entropi keadaan transisi, sedangkan NAh adalah tetapan Planck molar (3.99 x 10−10 J S mol−1). Dengan memvariasikan suhu (T), maka ΔH* dan ΔS* dapat ditentukan dari kurva ln( /T) vs 1/T, sedangkan perubahan energi bebas Gibbs transisi (ΔG*) dihitung menurut persamaan termodinamika berikut:
∆ ∆ ∆
Kinetika Laju Korosi dengan Tinjauan Energi Aktivasi
Kemudahan terjadinya suatu reaksi bergantung pada energi minimum yang dibutuhkan agar reaksi tersebut berjalan. Energi aktivasi dapat dihitung berdasarkan aluran data antara ln Icorr dan 1/T berdasarkan persamaan Arrhenius berikut (Morad dan El-Dean 2006):
e
ln ln
dengan A ialah tetapan Arrhenius yang ditentukan secara empirik, Ea adalah energi aktivasi proses korosi (kJ mol-1), R adalah tetapan gas ideal (8.314 J mol -1
K-1), dan T adalah suhu (K).
HASIL DAN PEMBAHASAN
Hasil Sintesis ZDTP dan penciriannya
5
membentuk ZDTP. Rute sintesis diperlihatkan pada Gambar 1. Diketahui bahwa metode sintesis ZDTP yang berbeda akan berpengaruh pada kinerjanya sebagai aditif pelumas (Dinoiu et al. 2007). Fosforus pentasulfida yang direaksikan dibuat berlebih untuk memastikan alkohol yang direaksikan pada tahap 1 habis terpakai. Jika terdapat alkohol yang tersisa dikhawatirkan akan terjadi persaingan adisi pada tahap 2 antara alkohol sisa dan ADTP terhadap zink oksida yang memungkinkan berkurangnya rendemen ZDTP yang dihasilkan. Zink oksida yang ditambahkan juga dibuat berlebih agar ADTP dipastikan habis bereaksi membentuk ZDTP.
Gambar 1 Rute sintesis ZDTP
Keberhasilan sintesis ZDTP tentunya bergantung pada keberhasilan pembentukan senyawa intermediet ADTP. Reaksi adisi alkohol terhadap fosforus pentasulfida berlangsung secara eksotermik. Tabel 1 menunjukkan rendemen yang dihasilkan dari 3 ZDTP yang berbeda panjang rantai alkilnya. Perolehan rendemen ZDTP 4 dan ZDTP 16 mendekati sama, tetapi rendemen ZDTP 8 jauh lebih kecil daripada keduanya. Bobot reaktan dan perhitungan rendemen disajikan pada Lampiran 4.
Tabel 1 Rendemen sintesis ZDTP
Senyawa Gugus alkil Suhu sintesis (◦C) Rendemen (%)
ZDTP 4 CH3(CH2)3 70 86.14
ZDTP 8 CH3(CH2)7 90 62.22
ZDTP 16 CH3(CH2)15 90 82.06
ZDTP 4 yang dihasilkan berwujud cair seperti minyak (oily) yang bercampur dengan kristal-kristal kecil. ZDTP 8 tampak seperti minyak berwarna kuning sama seperti ZDTP 4. Akan tetapi, ZDTP 16 hasil sintesis berbeda warna dari kedua produk lainnya, ZDTP 16 berwarna putih dan berwujud seperti bubur (Gambar 2).
Spektrum FTIR (Gambar 3) digunakan untuk mengidentifikasi ikatan-ikatan kimia yang terdapat pada produk sintesis. Regang C-H dengan intensitas tajam terbaca pada bilangan gelombang 3000−2850 cm-1, -CH2- dan -CH3 berturut-turut terdapat di sekitar 1465 dan 1375 cm-1 (Pavia et al. 2001). Adanya ikatan P-O-C terlihat dari serapan pada 1000-980 cm-1. Serapan pada rentang 650−540 cm-1 menunjukkan adanya ikatan P-S. Berdasarkan interpretasi spektrum tersebut,
Keterangan gambar: (ZDTP 16), (ZDTP 8), (ZDTP 4)
Gambar 2 Produk sintesis ZDTP 4 (a), ZDTP 8 (b), dan ZDTP 16 (c)
(a) (b) (c)
7
dapat dikatakan bahwa produk yang terbentuk adalah ZDTP. Hilangnya serapan OH di sekitar 3500−3200 cm-1 menunjukkan bahwa alkohol telah habis bereaksi membentuk produk. Sementara itu, serapan Zn-S pada daerah inframerah jauh 400−300 cm-1 tidak diukur.
Efektivitas Inhibisi Korosi ZDTP Berdasarkan Polarisasi Potensiodinamik
Kinetika elektrokimia dari perkaratan logam dapat dicirikan dengan menentukan minimum 3 parameter polarisasi, yaitu arus korosi (icorr), potensial korosi (Ecorr), dan kemiringan Tafel (β). Sifat korosi dapat didekati dengan kurva polarisasi (Lampiran 6) yang didapat dari alur E vs log i (Perez 2004). Arus korosi didapatkan dari perpotongan antara kurva Tafel anode dan Tafel katode (Lampiran 4). Tabel 2 menunjukkan penurunan arus korosi dan kenaikan efektivitas inhibisi seiring dengan kenaikan konsentrasi dari ketiga larutan ZDTP. Arus korosi sampel menjadi lebih kecil dibandingkan dengan arus korosi blangko. Tabel 2 Parameter korosi dan efektivitas inhibisi korosi larutan ZDTP yang diukur pada
suhu 28 oC dan lama pencelupan 15 detik
Kenaikan konsentrasi inhibitor tidak selalu diikuti dengan kenaikan efektivitas inhibisi secara linear. Ketiga sampel menunjukkan bahwa pada konsentrasi tertentu, penambahan konsentrasi tidak lagi meningkatkan efektivitas inhibisi secara signifikan. Diduga konsentrasi tersebut adalah dosis efektif ZDTP dalam menginhibisi arus korosi. ZDTP 8 menginhibisi arus korosi maksimum sampai 0.8 mA. Nilai ini lebih kecil dibandingkan dengan ZDTP 4 yang menginhibisi maksimum pada 1.5 mA dan ZDTP 16 yang hanya mampu Larutan Konsentrasi
(%)
Potensial korosi (mV)
Arus korosi
(mA) % EI Ѳ
CR (mmpy)
ZDTP 4
Blangko 77.50 5.1667 - - 35.02
1 76.58 2.7419 46.93 0.47 18.59
2 60.55 1.8064 65.04 0.65 12.24
4 62.78 1.5476 70.05 0.70 10.49
5 62.32 1.4400 72.13 0.72 9.76
ZDTP 8
Blangko 79.68 4.7895 - - 37.51
0.5 81.81 2.1481 55.15 0.55 16.82
1 77.74 1.3226 72.39 0.72 10.36
2 68.39 1.1333 76.34 0.76 8.88
3 59.49 0.8333 82.60 0.83 6.53
5 59.36 0.8182 82.92 0.83 6.41
ZDTP 16
Blangko 77.17 5.6470 - - 38.50
0.5 71.20 4.4000 22.08 0.22 30.00
1 74.33 3.0952 45.19 0.45 21.10
2 64.54 2.6818 52.51 0.52 18.29
3 61.26 2.0741 63.27 0.63 14.14
menginhibisi arus korosi sampai 2.0 mA (Tabel 2). Kehadiran inhibitor mengakibatkan potensial korosi (Ecorr) cenderung menurun, hal ini berarti daerah polarisasi anode berkurang dan reaksi oksidasi menjadi lebih terhambat. Meningkatnya efektivitas inhibisi diikuti oleh kenaikan derajat penutupan permukaan (Ѳ). Nilai Ѳ tinggi mengindikasikan penutupan penuh permukaan oleh inhibitor (El-Lateef et al. 2012). ZDTP teradsorpsi pada permukaan dan menutupi permukaan logam dari medium korosif. Laju korosi (CR) dapat diwakili oleh laju kehilangan bobot atau laju penetrasi permukaan oleh konstituen korosif. Besaran ini menunjukkan disolusi logam yang berkaitan dengan penetrasi permukaan per tahunnya (Perez 2004). ZDTP mampu menurunkan laju penetrasi permukaan logam dengan membentuk lapisan protektif. Dengan demikian, penurunan mutu logam dapat diminimumkan dan masa pakai meningkat dengan adanya ZDTP.
Pengaruh Panjang Rantai ZDTP pada Kinerja Antikorosi
ZDTP memiliki inti organologam yang bersifat hidrofilik dapat teradsorpsi pada permukaan elektrode dan membentuk lapisan pasif (pasivasi) sehingga permukaan menjadi tidak terlalu aktif untuk terkorosi. Gambar 4 memperlihatkan model adsorpsi molekul ZDTP 8 pada permukaan. Diduga atom zink yang berperan utama pada proses adsorpsi, namun atom lain yang terdapat pada bagian hidrofilik ZDTP seperti sulfur (Benali et al. 2006), fosforus, dan oksigen (Gece 2011) juga dapat teradsorpsi. Rantai alkil (hidrofobik) dari ZDTP juga dapat bertindak sebagai penghalang (barrier) yang melindungi permukaan logam dari serangan konstituen korosif. Kedua mekanisme inhibisi inilah yang akhirnya menurunkan arus korosi.
Gambar 4 Model adsorpsi molekul ZDTP 8 yang telah dioptimisasi energi dengan metode mekanika molekuler menggunakan perangkat lunak HyperChem
9
inhibisi secara signifikan. ZDTP 4 juga memiliki dosis efektif 2%, dengan efektivitas inhibisi 68%, sedangkan dosis efektif ZDTP 16 lebih tinggi, yaitu 2.5% dan efektivitasnya hanya 58%. Hal tersebut menunjukkan bahwa panjang rantai berpengaruh pada kinerja antikorosi dari ZDTP.
Kinerja meningkat ketika ZDTP dengan gugus butil panjangnya ditingkatkan 2 kali menjadi gugus oktil, tetapi menurun ketika panjang rantai dinaikkan lagi 2 kali lipatnya menjadi gugus setil. Kehadiran gugus alkil rantai panjang memiliki potensi melindungi logam dari media korosif (Wahyuningrum et al. 2008). Namun, halangan sterik yang lebih besar dapat mengurangi kemudahan molekul ZDTP untuk teradsorpsi pada permukaan logam. Selain itu, sifat hidrofobik ZDTP meningkat seiring memanjangnya rantai alkil sehingga pada saat pencelupan elektrode pada larutan ZDTP, interaksi hidrofobik antara ZDTP dan pelarut organik (n-heptana) lebih disukai dibandingkan dengan proses adsorpsi permukaan. Diduga faktor-faktor tersebut yang mengakibatkan lebih sedikit molekul ZDTP 16 teradsorpsi dengan waktu pencelupan dan pelarut yang sama sehingga kemampuannya menginhibisi arus korosi menjadi lebih kecil dibandingkan dengan ZDTP 4 dan ZDTP 8.
Keterangan : (ZDTP 16), (ZDTP 8), (ZDTP 4)
Gambar 5 Hubungan konsentrasi larutan ZDTP dengan efektivitas inhibisi korosi
Pengaruh Suhu pada Arus Korosi
Konsentrasi dan orde reaksi tidak peka akan perubahan suhu. Tetapan laju reaksilah yang peka akan perubahan suhu (Atkins dan Paula 2006). Dalam kinetika elektrokimia korosi, arus korosi peka pada perubahan suhu (Rafiquee et al. 2008). Oleh karena itu, parameter tetapan laju sebanding dengan arus korosi. Kenaikan suhu memberikan energi lebih pada sistem. Energi tersebut akan meningkatkan gerakan konstituen korosif (Cl−) menjadi lebih aktif. Akibatnya, arus korosi meningkat dengan kenaikan suhu seperti yang ditunjukkan pada Tabel 3. Arus korosi blangko maupun sampel meningkat hampir 2 kalinya dengan kenaikan suhu 10 oC pada rentang suhu pengujian 30−50 oC. Akan tetapi, ketika
20 30 40 50 60 70 80 90
0 1 2 3 4 5
% EI
suhu dinaikkan lebih lanjut dari 50 oC ke 60 oC, arus korosi tidak berubah signifikan baik untuk blangko ataupun sampel. Diduga kenaikan suhu yang lebih tinggi ini menyebabkan pergerakan konstituen korosif semakin acak dan cepat dalam reservoir. Hal tersebut mengakibatkan efektivitas ion klorida untuk kontak dengan logam berkurang. Proses korosi menjadi tidak meningkat disebabkan waktu kontak antara konstituen korosif dan permukaan logam terlalu cepat. Dari fenomena ini diketahui bahwa arus korosi maksimum untuk logam Cu terjadi pada suhu 50 oC. Artinya penggunaan logam Cu dalam medium NaCl akan mengalami perkaratan maksimum jika suhu sistem yang digunakan di atas suhu tersebut. Proses inhibisi juga akan menjadi lebih sulit akibat kenaikan suhu.
Tabel 3 Pengaruh suhu pada arus korosi
Suhu (oC) Larutan Garis Tafel Arus korosi
(mA) anode katode 30 b y = −0.013x + 0.156 y = 0.012x + 0.026 5.200
a y = −0.004x + 0.087 y = 0.025x + 0.043 1.517 40 b y = −0.005x + 0.122 y = 0.004x + 0.025 10.625
a y = −0.019x + 0.109 y = 0.008x + 0.046 2.333 50 b y = −0.004x + 0.125 y = 0.004x + 0.006 16.250
a y = −0.003x + 0.079 y = 0.004x + 0.043 5.142 60 b y = −0.002x + 0.105 y = 0.003x + 0.015 16.160
a y = −0.013x + 0.128 y = 0.001x + 0.052 5.428 Keterangan: b = blangko
a = sampel
Parameter Termodinamika dan Kinetika Korosi
11
Keterangan gambar: blangko( ), sampel ( )
Gambar 6 Aluran kurva persamaan Arrhenius keadaan transisi
Tabel 4 Parameter termodinamika dan kinetika korosi
∆H* (kJ mol-1) ∆S* (J mol-1K-1) ∆G* (kJ mol-1) Ea(kJ mol-1)
Blangko 28.53 -135.68 69.64 31.14
Sampel 35.98 -122.7 73.16 38.60
Identifikasi kinetika korosi dimanifestasikan melalui parameter energi aktivasi (Ea). Nilai Ea didapat melalui aluran kurva Arrhenius (Gambar 7). Kemiringan kurva dikalikan tetapan gas ideal (R) merupakan nilai Ea yang didapatkan. Penambahan ZDTP didapati berpengaruh meningkatkan energi aktivasi (Tabel 4), yang berarti bahwa terjadi peningkatan energi minimum reaksi korosi. Semakin tinggi energi aktivasi, proses korosi menjadi lebih sulit, karena kebutuhan energi minimum sebagai syarat suatu reaksi terjadi menjadi lebih besar. Dengan kata lain, laju korosi menurun dengan kehadiran inhibitor. Nilai ∆S* yang negatif dan ∆H* positif bila dimasukkan dalam fungsi Gibbs akan menghasilkan nilai ∆G* yang selalu positif berapapun nilai suhu (T) yang digunakan. Hal ini memberikan gambaran bahwa reaksi selalu berjalan tidak spontan disemua rentang suhu. Artinya, diperlukan energi atau kerja tambahan dari luar agar reaksi tersebut dapat berjalan. Hadirnya ZDTP meningkatkan ketidakspontanan proses korosi,terlihat dari perbedaan nilai besaran termodinamika korosi. Hal ini berarti bahwa dibutuhkan energi atau kerja tambahan yang lebih besar bagi konstituen korosif untuk dapat mengkarat permukaan logam ketika ZDTP hadir membentuk lapisan protektif dipermukaan.
y= -3.432x+ 7.440 R² = 0.864
y= -4.328x+ 9.001 R² = 0.920
‐6.00 ‐5.00 ‐4.00 ‐3.00 ‐2.00 ‐1.00 0.00
2.90 3.00 3.10 3.20 3.30 3.40
Ln (
i
/
T
)
Keterangan gambar: blangko ( ), sampel ( )
Gambar 7 Aluran kurva persamaan Arrhenius
SIMPULAN
Kinerja antikorosi zink dialkilditiofosfat telah berhasil ditentukan dengan teknik polarisasi potensiodinamik. ZDTP 8 memiliki efektivitas inhibisi korosi logam Cu paling besar, yakni mencapai 80%, sedangkan ZDTP 4 dan ZDTP 16 berturut-turut sebesar 68% dan 58%. Nilai tersebut menunjukkan pula adanya pengaruh panjang rantai terhadap aktivitas antikorosi terutama dari segi halangan ruangnya. ZDTP mampu menurunkan spontanitas korosi yang terukur berdasarkan peningkatan ∆G* dari 69.64 kJ mol-1 menjadi 73.16 kJ mol-1.Nilai Ea sampel didapati lebih besar daripada blangko, yang artinya bahwa laju korosi menurun dengan kehadiran ZDTP.
DAFTAR PUSTAKA
Atkins P, Paula JD. 2006. Physical Chemistry Ed ke-8. New York (US): WH Freeman.
Becchi M, Perret F, Carraze B, Beziau JF, Michael JP. 2001. Structural determination of zinc dithiophosphates in lubricating oils by GCMS with electron impact and electron-capture negative ion chemical ionization. J Chrom. 905:207–222.
Benali O, Larabi L, Mekelleche SM, Harek Y. 2006. Influence of substitution of phenyl group by naphthyl in a diphenylthiourea molecule on corrosion inhibition of cold-rolled steel in 0.5 M HSO4. J Matter Sci. 41:7064– 7073.doi:10.1007/s10853-006-0942-6.
y= -3.746x+ 14.19 R² = 0.884
y= -4.643x+ 15.75 R² = 0.930 0 0.5 1 1.5 2 2.5 3 3.5
2.9 3 3.1 3.2 3.3 3.4
Ln
i
(m
A)
13
Dinoiu V, Danilian F, Bogatu L. 2007. The influence of synthesis method of zinc dialkyldithiophosphates on the process of additivation. Rev Chim (Bucureºti) 58(2):183-185.
El-Lateef HM, Aliyeva LI, Abbasov VM, Ismayilov TI. 2012. Corrosion inhibition of low carbon steel in CO2 -saturated solution using anionic surfactant. Adv Appl Sci Res. 3(2):1185−1201.
Evstaf’ev VP, Kononova EA, Levin AYa, Trofimova, Ivanova OV. 2001. A new dithiophosphate additive for lubricating oils. Chem and Tech of Fuels and Oils. 37(6):427-431.
Gece G. 2011. Review drugs: A review of promising novel corrosion inhibitors. CorrSci. 53:3873-3898.doi:10.1016/j.corsci.2011.08.006.
Hayati IK. 2013. Pengaruh pelarut pada rendemen sintesis zink bis(dibutilditiofosfat) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Houston PL. 2001. Chemical Kinetics and Reaction Dynamics. New York (US): McGraw-Hill.
Jaenudin. 1998. Pembuatan Zn-Diisobutilditiofosfat dan penggunaanya sebagai aditif minyak lumas otomotif [tesis]. Jakarta (ID): Universitas Indonesia. Lotfus S. 2002. Zinc Dialkildithiophosphate Category. New York (US): The
American Chemistry Council.
Morad MS, El-Dean AMK. 2006. 2,2'-Dithiois(3-cyano-4,6-dimethylpyridine): A new class of acid corrosion inhibitors for mild steel. Corr Sci. 48(11):3398-3412.doi:10.1016/j.corsci.2005.12.006.
Pavia DL, Lapman GM, Kriz GS. 2001. Intoduction to Spectroscopy Ed ke-3. Washington (US): Thomson Learning.
Peng L, Li F, Ren T, Wu H, Ma C. 2011. The tribological behaviour of a novel triazine derivative and its combination with ZDDP as additive in mineral oil. Ind L Tribology. 63(3):216-221.doi:10.1108/00368791111126644. Perez N. (2004). Electrochemistry and Corrosion Science. New York (US):
Kluwer Academic Publishers.
Rafiquee MZA, Saxena N, Khan S, Quraishi MA. 2008. Influence of surfactants on the corrosion inhibition behavior of 2-aminophenyl-5-mercapto-1-oxa-3,4-diazole (AMOD) on mild steel. M Chem and Phys. 107(2-3):528-533. doi:10.1016/j.matchemphys.2007.08.022.
Rismawati. 2013. Pengaruh jenis alkohol pada rendemen sintesis zink dialkilditiofosfat [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Rudnick LR. 2009. Lubricant Additives Chemistry and Applications Ed ke-2. Prancis: CRC Pr.
Sangvanich P, Jannate T, Amorn P. 2008. Analysis of ZDTP additives in commercial lubricating oil using matrix assisted laser of flight mass spectrometry. Acta Chim Slov 55:582-587.
Wahyuningrum D, Achmad S, Syah YM, Buchari, Bundjali B, Ariwahjoedi B. 2008. The Correlation between structure and corrosion inhibition activity of 4,5-diphenyl-1-vinylimidazole derivative compounds towards mild steel in 1% NaCl solution. Int J Electrochem Sci. 3:154-166.
15
Lampiran 1 Diagram alir penelitian
Alkohol
P
2S
5ZnO
CRUDE
PRODUK
ZDTP
Sintesis ZDTP
1. Pemisahan 2. Pencucian
Karakterisasi dengan FT-IR
Kinerja antikorosi (Potensiostat EA160)
Lampiran 2 Rangkaian alat sintesis ZDTP
(sumber: Hayati 2013) Keterangan:
a. campuran pereaksi b. penangas air
17
Lampiran 3 Elektrode Cu, reservoir, dan rangkaian alat pengukuran elektrokimia
Elektrode Cu
Reservoir
Potensiostat EA160
Lampiran 4 Bobot reaktan dan perhitungan sintesis ZDTP
Contoh perhitungan rendemen (ZDTP 4): Mol n-butanol (reaktan pembatas) = bobot butanol
Mr butanol
= 8.91 g
74.12 g/mol
= 0.12 mol Mol produk = ¼ x mol butanol
= ¼ x 0.12 mol
= 0.03 mol
Bobot teoritis ZDTP 4 = mol teoritis x Mr ZDTP 4 = 0.03 mol x 547.58 g/mol
= 16.4274 g
Rendemen (%) =bobot percobaan
bobot teoritis x 100%
= 14.1510 g
16.4274 g x 100%
= 86.14%
Sampel Alkohol
Bobot reaktan yang
ditimbang (g) Bobot ZDTP (g)
Rendemen (%) P2S5 Alkohol ZnO
19
Lampiran 5 Contoh perhitungan data polarisasi potensiodinamik
Perhitungan Ekstrapolasi Tafel
• Arus blangko
Persamaan garis Tafel anode ==> y1 = 0.156 – 0.013x Persamaan garis Tafel katode ==> y2 = 0.026 + 0.012x Arus korosi (X), saat terjadi perpotongan (y1 = y2) maka, y1 = y2
0.156 – 0.013x = 0.026 + 0.012x 0.025x = 0.13
x = 5.2000 mA
• Efektivitas Inhibisi
%EI= icorr blangko - icorr (inhibitor)
icorr (blangko) x 100%
= 5.2000 mA - 1.5172 mA
5.2000 mA x 100%
= 70.82%
• Derajat penutupan permukaan
Ѳ =1 - icorr(inhibitor)
icorr(blangko)
=1 - 1.5172
5.200
= 0.71 Suhu
(celcius) Larutan
Garis Tafel Arus korosi
(mA) % EI Ѳ anode katode
30 b y = ‐0,013x + 0,156 y = 0,012x + 0,026 5.200 70.82 0.71 a y = ‐0,004x + 0,087 y = 0,025x + 0,043 1.5172
40 b y = ‐0,005x + 0,122 y = 0,004x + 0,025 10.625 78.04 0.78 a y = ‐0,019x + 0,109 y = 0,008x + 0,046 2.333
50 b y = ‐0,004x + 0,125 y = 0,004x + 0,006 16.250 68.35 0.68 a y = ‐0,003x + 0,079 y = 0,004x + 0,043 5.1428
60 b y = ‐0,002x + 0,105 y = 0,003x + 0,015 16.160 66.41 0.66 a y = ‐0,013x + 0,128 y = 0,001x + 0,052 5.428
b = blangko
Lamp
P
t
i
l
(V
lt)
piran 6 Ku
0.000 0.020 0.040 0.060 0.080 0.100 0.120 0
Potensial (volt)
0.000 0.020 0.040 0.060 0.080 0.100 0.120 0.0P
o
tens
ia
l
(V
o
lt)
0.000 0.020 0.040 0.060 0.080 0.100 0.120 0Potensial (V
olt)
urva polarisa 0 2 0 2.00 0.00 2.0asi zink dial
21
Lampiran 7 Pengolahan data variasi suhu dan perhitungan CR
Contoh perhitungan laju korosi CR(blangko ZDTP 4):
CR= RF
ρ
CR= icorr
A Aw
z F ρ
CR=
5.1667 x 10-3A
1.71 cm2 63.54 g mol -1
2 96500 A s mol-1 8.96 g cm-3
CR= 1.1102 x 10-7cm s-1 CR= 35.02 mm y-1
Larutan Suhu (k) 1000/T I (mA) Ln i i/T Ln (i/T)
Blangko
303 3.30 5.4483 1.6953 0.0180 -4.0184
313 3.19 10.6250 2.3632 0.0339 -3.3830 323 3.09 16.2500 2.7881 0.0503 -2.9896 333 3.00 16.1600 2.7825 0.0485 -3.0256
1% ZDTP 8
303 3.30 1.5172 0.4169 0.0050 -5.2969
313 3.19 2.3333 0.8473 0.0075 -4.8989
323 3.09 5.1428 1.6376 0.0159 -4.1401
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 3 Juli 1990 sebagai putra ketiga dari lima bersaudara pasangan Dadang Iskandar dan Siti Nuraeni. Tahun 2009 penulis lulus dari SMA Negeri 1 Leuwiliang Bogor dan pada tahun yang sama penulis diterima di Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN).