ERLY ANACE LOUISA MAMUSUNG
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Eliminasi Polutan dari Limbah Cair Laboratorium dengan Proses Koagulasi adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Januari 2009
ERLY ANACE LOUISA MAMUSUNG. Pollutants elimination from laboratory wastewater by coagulation process. Under the supervision of NASTITI SISWI INDRASTI and SUPRIHATIN.
RINGKASAN
ERLY ANACE LOUISA MAMUSUNG. Eliminasi Polutan dari Limbah Cair Laboratorium dengan Proses Koagulasi. Dibimbing oleh NASTITI SISWI INDRASTI dan SUPRIHATIN.
@ Hak Cipta milik IPB, tahun 2009 Hak Cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
ELIMINASI POLUTAN DARI LIMBAH CAIR
LABORATORIUM DENGAN PROSES KOAGULASI
ERLY ANACE LOUISA MAMUSUNG
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains
Pada Program Studi Pengelolaan Sumberdaya Alam dan Lingkungan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Eliminasi Polutan dari Limbah Cair Laboratorium dengan Proses Koagulasi
Nama : Erly Anace Louisa Mamusung
NIM : P052030401
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. Nastiti Siswi Indrasti Dr. Ir. Suprihatin, Dipl.Eng. Ketua Anggota
Diketahui
Ketua Program Studi Ilmu Pengelolaan Dekan Sekolah Pascasarjana Sumberdaya Alam dan Lingkungan
Prof. Dr. Ir. Surjono H. Sutjahjo, MS Prof. Dr. Ir. Khairil A. Notodiputro, MS
Puji dan syukur penulis panjatkan ke hadirat TUHAN YESUS KRISTUS, karena atas berkat, kasih karunia dan perkenan-Nya penulis dapat menyelesaikan Tesis yang berjudul Eliminasi Polutan dari Limbah Cair Laboratorium dengan Proses Koagulasi. Tesis ini dibuat dalam rangka memenuhi salah satu persyaratan yang diperlukan untuk memperoleh gelar Magister Sains pada Program Studi Pengelolaan Sumberdaya Alam dan Lingkungan (PSL) Sekolah Pascasarjana Institut Pertanian Bogor.
Ucapan terima kasih penulis sampaikan kepada semua pihak yang telah memberikan bantuan, dukungan serta bimbingan kepada penulis, yaitu :
1. Prof. Dr. Ir. Nastiti Siswi Indrasti, selaku ketua komisi pembimbing. 2. Dr. Ir. Suprihatin, Dipl.Eng. selaku anggota komisi pembimbing.
3. Mama dan Papa, Mami, Om Ernest dan Tante Joice, adikku (Mariane), para sepupu tersayang (Pinx, Ann dan Ghe) yang selalu memberikan doa, dukungan, perhatian dan semangat.
4. Staf pegawai FATETA IPB Bapak Yogi, Edi, Sugi, Angga, Ibu Sri, Ega, Mbak Anis dan Vindi.
5. Teman-teman mahasiswa PSL 2004 khususnya bahkan seluruh teman-teman mahasiswa PSL yang tidak dapat disebutkan satu per satu yang menjadi teman “seperjuangan” selama kuliah di PSL.
6. Teman-teman seperjuangan di kos Perwira 12, terutama Sherly dan Santi. We’re more than conqueror!
Penulis berharap semoga tesis ini dapat bermanfaat bagi semua pihak. Amin.
Bogor, Januari 2009
RIWAYAT HIDUP
Penulis dilahirkan di Manado, Sulawesi Utara, pada tanggal 27 Oktober 1976 dari Ayah Gerrit A. Mamusung dan Ibu Juliana Runtukahu, SPd. Penulis merupakan anak pertama dari dua bersaudara.
Penulis menamatkan pendidikan Sekolah Dasar di SD GMIM (Gereja Masehi Injili di Minahasa) 50 Paniki Bawah pada tahun 1988, Sekolah Menengah Pertama di SMP Negeri 10 Paniki Bawah pada tahun 1991 dan Sekolah Menengah Atas di SMA Negeri I Manado pada tahun 1994.
Halaman
DAFTAR TABEL... iii
DAFTAR GAMBAR... iv
DAFTAR LAMPIRAN... v
I. PENDAHULUAN... 1
II. TINJAUAN PUSTAKA... 7
2.1. Polutan ... 7
2.2. Karakteristik Fisik, Kimia dan Biologi Polutan... 7
2.2.1. Kekeruhan ... 10
2.2.2. Padatan Tersuspensi Total... 11
2.2.3. Warna ... 12
3.5. Perhitungan Efisiensi Eliminasi Polutan... 21
3.6. Analisis Data ... 21
IV. HASIL DAN PEMBAHASAN... 22
4.1. Karakteristik Limbah Cair Laboratorium... 22
4.2. Perubahan Fisik Larutan selama Koagulasi ... 23
4.4. Efisiensi Eliminasi Polutan ... 28
4.4.1. Efisiensi Eliminasi Polutan Warna... 28
4.4.2. Efisiensi Eliminasi Polutan Perak (Ag)... 29
4.4.3. Efisiensi Eliminasi Polutan Merkuri (Hg)... 30
4.4.4. Efisiensi Eliminasi Polutan Krom (Cr) ... 31
4.5. Perubahan Konsentrasi Limbah Cair setelah Koagulasi ... 32
4.5.1. Kekeruhan... 32
4.5.2. Padatan Tersuspensi Total ... 33
4.5.3. Warna... 34
4.5.4. Perak (Ag)... 36
4.5.5. Merkuri (Hg)... 37
4.5.6. Krom (Cr) ... 39
4.6. Aspek Ekonomi... 41
V. KESIMPULAN DAN SARAN... 42
5.1. Kesimpulan ... 42
5.2. Saran... 42
DAFTAR PUSTAKA... 43
DAFTAR GAMBAR
Halaman
1. Kerangka pemikiran ... 6
2. Mekanisme koagulasi ... 17
3. Jar test ... 19
4a. Larutan berwarna kuning dan endapan coklat yang terbentuk pada pH 6 ... 24
4b. Larutan berwarna coklat yang terbentuk pada pH 8, 10 dan 12 ... 24
4c. Endapan coklat yang terbentuk pada pH 8, 10 dan 12 ... 24
5. Efisiensi eliminasi polutan warna... 29
6. Efisiensi eliminasi polutan Ag... 30
7. Efisiensi eliminasi polutan Hg... 31
8. Efisiensi eliminasi polutan Cr... 32
9. Kekeruhan setelah koagulasi ... 33
10. Konsentrasi padatan tersuspensi total setelah koagulasi ... 34
11. Konsentrasi warna setelah koagulasi ... 35
12. Konsentrasi Ag setelah koagulasi... 36
13. Konsentrasi Hg setelah koagulasi... 38
Halaman 1. Hasil pengukuran kadar polutan dalam limbah cair laboratorium
I. PENDAHULUAN
1.1. Latar Belakang
Kegiatan industri dan berbagai aktivitas manusia dapat memicu terjadinya
pencemaran karena limbah yang dihasilkan tidak diolah dengan baik sebelum
dibuang ke lingkungan. Salah satu contoh aktivitas manusia yang dapat
menyebabkan pencemaran adalah kegiatan laboratorium di perguruan tinggi yang
merupakan sarana belajar mahasiswa untuk meningkatkan pengetahuan terhadap
mata kuliah yang dipelajari bahkan untuk melakukan penelitian.
Laboratorium yang berada di perguruan tinggi merupakan fasilitas
penunjang untuk mewujudkan pendidikan, penelitian dan pengabdian masyarakat.
Di laboratorium para mahasiswa memperoleh pengalaman praktis guna
memahami teori-teori yang dipelajari di bangku kuliah melalui kegiatan
praktikum dan pembuatan tugas, sedangkan dosen memerlukan laboratorium
untuk memperoleh data ilmiah (Blaauw 1998, diacu dalam Tripuruswati &
Trihadiningrum 1999). Dalam kegiatan-kegiatan di laboratorium selalu
menghasilkan limbah yang berbentuk padat, cair dan gas. Dalam penelitian ini
jenis limbah yang diteliti dibatasi pada limbah cair.
Menurut Metcalf dan Eddy (2004), ada tiga bentuk limbah yaitu limbah cair,
limbah padat dan emisi udara. Limbah berbentuk cair atau yang sering disebut air
limbah atau limbah cair adalah hasil pemakaian cairan atau air dari suatu
komunitas dengan berbagai variasi pemakaiannya. Limbah cair ini berasal dari
perumahan, institusi, tempat-tempat komersil dan industri.
Limbah cair yang dihasilkan dari laboratorium yang menggunakan
bahan-bahan kimia berasal dari hasil atau sisa reaksi kimia dan air pencucian peralatan.
Limbah cair tersebut pada umumnya mempunyai kadar pencemar yang tinggi
karena adanya bahan kimia pekat sisa reaksi yang dibuang dalam saluran air
buangan. Laboratorium penanganan belum terlalu baik dalam menangani limbah
cair yang ada. Hal tersebut bila tidak ditangani dengan baik akan mencemari
lingkungan sekitarnya (Tripuruswati & Trihadiningrum 1999). Polutan atau bahan
pencemar mengandung gas, bahan-bahan terlarut, partikel bahkan bahan
biologis lingkungan bahkan berbahaya bagi kesehatan manusia (Djajadiningrat &
Amir 1991; KLH 2002; Effendi 2003 & Sawyer et al. 2003).
Limbah cair laboratorium yang diteliti pada penelitian ini adalah limbah cair
yang berasal dari hasil atau sisa analisis COD. Analisis COD menggunakan
berbagai bahan kimia seperti K2Cr2O7, Ag2SO4 dan HgSO4 yang berpotensi
mencemari lingkungan.
Dalam penelitian ini dilakukan pengolahan limbah dengan proses koagulasi
untuk mengeliminasi konsentrasi polutan yang ada di dalam limbah cair
laboratorium yang diteliti. Proses koagulasi adalah proses pengolahan limbah
dengan penambahan koagulan ke dalam limbah. Koagulan yang biasa digunakan
adalah aluminum sulfat. Penambahan koagulan ini menetralkan muatan negatif
yang biasanya terkandung dalam polutan pada limbah cair sehingga terjadi
agregasi koloid dalam bentuk flok (Suriawiria 2005 dan Ebeling et al. 2006).
Proses koagulasi efektif digunakan pada limbah cair karena polutan yang ada di
dalam limbah tidak bisa diendapkan secara konvensional.
Penelitian mengenai eliminasi polutan pada limbah cair dengan proses
koagulasi khususnya yang mengandung berbagai jenis logam berat belum banyak
dilakukan. Polutan yang dieliminasi pada umumnya adalah polutan fisik dan
organik. Salah satu penelitian eliminasi polutan pada limbah cair yang
mengandung logam berat adalah penelitian yang dilakukan oleh Agustina et al.
(2001) untuk mengeliminasi Zn pada limbah cair industri sepatu. Pada penelitian
ini ditemukan eliminasi konsentrasi Zn sebesar 0,03 ppm pada pH 9 dan dosis
koagulan 5 ml.
Penelitian lainnya yang dapat menunjukkan eliminasi konsentrasi polutan
yang tinggi pada limbah cair dengan proses koagulasi yaitu Al-Mutairi et al.
(2004) yang melakukan penelitian pada instalasi limbah tempat pemotongan
hewan menemukan penurunan kekeruhan sebesar 76-93% dengan dosis alum
100-1000 mg/L dan pH 4-9. Penelitian lainnya yang dilakukan oleh Ebeling et al.
(2006) pada limbah hasil pencucian saringan mikro (microscreen backwash
effluent) menemukan penyerapan padatan (solids) sebesar 82% dan fosfor reaktif
3
Penelitian lainnya yang dilakukan pada kolam budidaya untuk memperbaiki
kualitas air kolam budidaya (Ozbay 2005). Penelitian ini menggunakan alum yang
dicampur dengan kapur pertanian dengan pengamatan selama 24 jam. Hasil
reduksi konsentrasi polutan dalam limbah cair oleh alum dan kapur pertanian
dalam limbah cair sebesar 70% setelah 1 jam dan 80% setelah 24 jam dengan
parameter kualitas air seperti kekeruhan, padatan tersuspensi dan fosfor.
Pada umumnya penelitian-penelitian diatas dilakukan pada parameter fisik
dan bahan organik dengan efisiensi eliminasi polutan yang cukup tinggi.
Penelitian mengenai penurunan polutan khususnya yang mengandung
bermacam-macam logam berat dan parameter fisik lainnya dari limbah cair laboratorium
dengan proses koagulasi masih kurang dilakukan sehingga penelitian ini
dilakukan untuk mengetahui kadar penurunan polutan dalam limbah cair
laboratorium seperti kekeruhan, padatan tersuspensi total, warna, Ag
(perak/silver), Hg (air raksa/merkuri) dan Cr (krom total).
1.2. Perumusan Masalah
Lingkungan yang merupakan habitat makhluk hidup perlu dipertahankan
dalam kondisi yang baik namun perkembangan hidup manusia untuk memenuhi
segala kebutuhan hidupnya dapat menyebabkan kerusakan lingkungan dan untuk
memulihkan lingkungan membutuhkan waktu yang lama dan biaya mahal.
Aktivitas manusia akibat perkembangan hidup tersebut dapat menyebabkan
terjadinya pencemaran lingkungan. Contohnya laboratorium penelitian yang dapat
menjadi sumber pencemar (polutan).
Untuk menangani polutan ini telah dilakukan berbagai teknik pengolahan
yang dianggap mampu menurunkan konsentrasi polutan di lingkungan. Salah satu
alternatif pengolahan tersebut adalah koagulasi menggunakan alum. Alum mudah
diperoleh dan mudah digunakan sehingga banyak dipakai di tempat pengolahan
limbah atau bahkan digunakan sendiri di rumah.
Penelitian-penelitian sebelumnya yang menggunakan alum telah
memperlihatkan penurunan konsentrasi polutan yang signifikan dengan jenis
limbah yang berbeda-beda. Penelitian ini dilakukan untuk mengetahui penurunan
Untuk mengetahui penurunan tersebut maka digunakan pH dan dosis alum
berbeda. Melalui variasi perlakuan ini dapat diketahui pH dan dosis terbaik untuk
menurunkan konsentrasi polutan limbah laboratorium yang diteliti.
1.3. Tujuan
1. Mengetahui efisiensi eliminasi polutan dengan proses koagulasi/flokulasi.
2. Mengetahui pengaruh nilai pH dan dosis alum pada efisiensi eliminasi dari
limbah cair laboratorium dalam proses koagulasi/flokulasi.
1.4. Hipotesis
1. Konsentrasi setiap polutan yang dieliminasi oleh koagulan alum dalam
proses koagulasi berbeda-beda.
2. Nilai pH dan dosis alum berpengaruh terhadap efisiensi eliminasi dari
limbah cair laboratorium dalam proses koagulasi/flokulasi.
1.5. Manfaat
1. Memperoleh informasi mengenai kemampuan koagulan alum dalam
proses koagulasi untuk mengeliminasi beberapa polutan dari limbah cair
laboratorium.
2. Memberikan masukan kepada pihak yang berkepentingan sebagai
rekomendasi dalam usaha pengolahan limbah cair laboratorium dengan
koagulasi khususnya untuk perancangan unit pengolahan limbah cair pada
laboratorium.
1.6. Ruang Lingkup
Penelitian skala laboratorium menggunakan peralatan jar test bervolume 500
mL. Limbah cair yang digunakan adalah limbah cair laboratorium hasil
sampingan analisis COD. Tempat penelitian di Laboratorium Teknik dan
Manajemen Lingkungan (TML), Departemen Teknologi Industri Pertanian (TIN),
IPB. Koagulan yang digunakan adalah alum dan perubahan yang diamati adalah
perubahan konsentrasi polutan dalam limbah cair laboratorium setelah proses
5
1.7. Kerangka Pemikiran
Polutan menyebabkan penurunan kualitas lingkungan. Untuk mencegah
lingkungan tercemar maka polutan harus dikelola agar tidak menambah kerusakan
lingkungan. Saat ini telah diketahui berbagai metode pengolahan untuk
menurunkan kadar polutan di lingkungan. Metode koagulasi kimia menggunakan
alum merupakan salah satu alternatif pengolahan limbah cair selain metode fisik
dan biologi.
Alum dengan rumus kimia Al2(SO4)3 merupakan bahan kimia yang mudah
diperoleh dan umum digunakan untuk mengolah limbah industri. Alum mampu
mengikat substansi kimia yang berukuran mikro dan diendapkan menjadi flok.
Pembentukan flok ini menyebabkan limbah mudah diendapkan, sehingga dapat
direduksi dan kerusakan lingkungan akibat limbah cair laboratorium dapat
Polutan
Alternatif Penanganan Penurunan
Kualitas Lingkungan
Alum
Metode Fisik
Mudah diperoleh
Mudah digunakan
Kemampuan koagulasi-flokulasi substansi/bahan kimia dalam limbah
Metode Biologi Metode
Kimia
pH Koagulasi Optimum
Dosis Alum Optimum
Penurunan Konsentrasi Polutan Maksimum
Perbaikan Kualitas Lingkungan
II. TINJAUAN PUSTAKA
2.1. Polutan
Polutan adalah bahan-bahan yang bersifat asing bagi alam atau bahan yang
berasal dari alam itu sendiri yang memasuki suatu tatanan ekosistem sehingga
mengganggu peruntukan ekosistem tersebut (Effendi 2003). Menurut Manahan
(2002) polutan adalah substansi yang melebihi konsentrasi alami sebagai akibat
dari aktivitas manusia yang memiliki pengaruh yang merugikan terhadap
lingkungannya atau suatu nilai di lingkungan. Polutan dikelompokkan menjadi
dua berdasarkan cara masuknya ke dalam lingkungan yaitu polutan alami dan
antropogenik. Polutan alami adalah polutan yang memasuki suatu lingkungan
secara alami misalnya akibat letusan gunung berapi, tanah longsor, banjir dan
fenomena alam lain (Notodarmojo 2005). Polutan antropogenik adalah polutan
yang masuk ke badan air akibat aktivitas manusia misalnya kegiatan domestik,
perkotaan dan kegiatan industri. Intensitas polutan antropogenik dapat
dikendalikan dengan cara mengontrol aktivitas yang disebabkan oleh polutan
tersebut.
2.2. Karakteristik Fisik, Kimia dan Biologi Polutan
Polutan yang berada di limbah cair harus diketahui karakteristiknya untuk
mempermudah penanganan atau pengolahannya sehingga harus dipahami dengan
baik asal limbah cair karena merupakan hal yang penting dalam desain dan
operasi dari fasilitas pengumpulan, pengolahan dan pembuangannya. Demikian
pula dalam teknik pengelolaan kualitas lingkungan. Perlu ditekankan bahwa pada
dasarnya parameter-parameter limbah cair ini saling berhubungan seperti
temperatur yang mempengaruhi aktivitas biologi dan jumlah gas terlarut dalam
limbah cair itu sendiri. Komposisi fisik, kimia dan biologi limbah cair dapat
Tabel 1. Karakteristik fisik, kimia, biologi dan sumber limbah cair
Hidrogen sulfida
Limbah domestik dan rumah tangga, penguraian alami bahan organik
Dekomposisi limbah cair, limbah industri Suplai air domestik, limbah industri dan domestik, erosi tanah, inflow/infiltrasi
Limbah industri dan domestik
Limbah industri, komersil dan domestik Limbah industri, komersil dan domestik
Limbah pertanian Limbah industri
Limbah industri, komersil dan domestik Limbah industri, komersil dan domestik Limbah industri, komersil dan domestik Limbah industri, komersil dan domestik
Penguraian alami bahan organik
Limbah domestik, suplai air domestik, infiltrasi air tanah
Limbah domestik, suplai air domestik, infiltrasi air tanah
Limbah industri
Limbah pertanian dan industri
Limbah industri, komersil dan domestik Limbah industri, komersil dan domestik, aliran air alami
Limbah industri, komersil dan domestik
Suplai air domestik, limbah industri, komersil dan domestik
Dekomposisi limbah domestik
Suplai air domestik, infiltrasi air permukaan
Perairan dan instalasi pengolahan limbah Perairan dan instalasi pengolahan limbah
Limbah domestik, infiltrasi air permukaan, instalasi pengolahan limbah
Limbah domestik, infiltrasi air permukaan, instalasi pengolahan limbah
9
Karakteristik biologi, terutama berguna untuk mendeteksi kandungan
mikroorganisme dalam air yaitu hewan bersel satu atau protista. Protista adalah
hewan yang mampu hidup sendiri dan membuat sel-sel baru untuk regenerasinya.
Hewan multiseluler tergolong dalam protista sebab ada satu sel yang bisa hidup
sendiri bila dipisahkan. Selain protista, makhluk hidup yang termasuk dalam
karakteristik biologi adalah virus, hewan dan tumbuhan (Sugiharto 2005).
Menurut Slamet (2006) protista memiliki efek yang merugikan terhadap
kesehatan manusia khususnya dan lingkungan pada umumnya karena berbagai
penyakit yang berbahaya dapat tersebar melalui air. Adanya penyebab penyakit di
dalam air, dapat menyebabkan efek langsung terhadap kesehatan. Penyebab
penyakit yang mungkin ada, dapat dikelompokkan menjadi 2 bagian besar yaitu
penyebab hidup, yang menyebabkan penyakit menular dan penyebab tidak hidup
yang menyebabkan penyakit tidak menular. Peran air dalam terjadinya penyakit
menular dapat bermacam-macam sebagai berikut :
a. Air sebagai penyebar mikroba patogen
b. Air sebagai sarang insekta penyebar penyakit
c. Jumlah air bersih yang tersedia tidak mencukupi sehingga orang tidak dapat
membersihkan dirinya dengan baik
d. Air sebagai sarang hospes sementara penyakit.
Penyakit menular yang disebabkan air secara langsung dikenal sebagai
penyakit bawaan air atau waterborne-disease. Penyakit-penyakit ini hanya dapat
menyebar bila mikroba dapat masuk ke dalam sumber air yang dipakai
sehari-hari. Sedangkan jenis mikroba yang dapat menyebar melalui air seperti virus,
bakteri, protozoa dan metazoa.
Menurut Hilgenkamp (2006), ada 2 jenis epidemi yaitu epidemi umum dan
inang ke inang. Epidemi umum disebabkan oleh kontaminasi air dan makanan
dari pencernaan manusia. Bakteri, virus dan protozoa merupakan agen epidemi
umum seperti antraks, disentri, botulism, brucellosis, kolera, giardiasis, hepatitis
dan demam tifoid. Sedangkan epidemi inang ke inang berpindah dari satu inang
ke inang lainnya dan untuk menjadi epidemi maka mikroba harus berpindah ke
Mikroba seperti bakteri, virus atau parasit tetap ada di dalam air minum
meskipun air minum diperiksa secara teratur. Pada umumnya air minum
terkontaminasi bakteri coliform (E. coli) akibat kebocoran pipa setelah dilakukan
uji kandungan bakteri oleh instalasi pengolahan air. Bakteri tersebut berasal dari
pipa pembuangan yang dialirkan ke badan air dan air permukaan yang
terkontaminasi oleh semua materi yang memasuki air permukaan.
Cryptosporidium merupakan parasit lain yang terkandung pada air permukaan.
Parasit penyebab penyakit lainnya adalah Giardia lambia yang mengkontaminasi
kotoran hewan dan manusia yang menyebabkan sakit perut dan diare. Infeksi
bakteri terjadi sesaat setelah air diminum.
2.2.1. Kekeruhan
Istilah keruh diaplikasikan pada air yang mengandung materi tersuspensi
yang menghambat cahaya melewati air atau tingkat visual terbatas. Kekeruhan
dapat disebabkan oleh berbagai variasi materi tersuspensi yang bervariasi dalam
ukuran mulai dari koloid ke dispersi kasar tergantung pada tingkat turbulensinya.
Sungai yang mengalir sampai ke laut akan melewati daerah perkotaan sehingga
menambah kadar limbah cair industri dan domestik, baik yang sudah diolah atau
belum. Limbah industri tertentu dapat menambah jumlah substansi organik dan
substansi anorganik lainnya yang menyebabkan kekeruhan (Metcalf & Eddy
2004).
Air dengan tingkat kekeruhan tinggi sukar disaring sehingga menambah
biaya pengolahan. Kekeruhan air juga dapat menghambat proses desinfeksi
sehingga kekeruhan air harus dihilangkan dari air yang akan dipergunakan untuk
air minum. Berdasarkan sifat pengendapannya, bahan-bahan yang mengakibatkan
kekeruhan air yaitu bahan-bahan yang mudah diendapkan (settleable) dan bahan
yang sukar mengendap (koloid). Bahan jenis pertama dapat dihilangkan dengan
sedimentasi dan filtrasi dan yang kedua dapat dihilangkan dengan proses
koagulasi dan filtrasi diikuti proses sedimentasi dan filtrasi yang memerlukan
11
2.2.2. Padatan Tersuspensi Total
Sumber utama padatan tersuspensi adalah fasilitas yang membuang berbagai
macam padatan termasuk yang menghasilkan BOD. Kandungan padatan
tersuspensi di dalam air sangat tinggi. Tingginya kandungan padatan tersuspensi
tersebut dapat merusak kehidupan ekosistem di dalam air tersebut. Di dalam udara
juga padatan tersuspensi merupakan penyebab masalah kesehatan tertinggi. Hal
yang sama juga adalah padatan tersuspensi dalam aliran air tanah yang mengalir
ke dalam air yang juga dapat merusak kehidupan ekosistem di dalam air tersebut.
Peningkatan kandungan padatan tersuspensi membuat air makin keruh atau kabur
sehingga membatasi cahaya matahari mencapai tumbuhan air dan menghambat
pertumbuhannya.
Padatan tersuspensi, selain membahayakan respirasi hewan air pada
umumnya, juga dapat menyebabkan gangguan pada insang ikan karena insang
luka akibat bergesekan dengan padatan tersuspensi sehingga epitelium insang
menebal dan mengembang sebagai respons pertahanan hidup karena adanya
padatan tersuspensi yang masuk ke dalam insang tersebut (Slanina 1962, diacu
dalam Alabaster & Lloyd 1980). Insang yang bergesekan dengan padatan
tersuspensi dalam waktu yang singkat dapat membahayakan ikan meskipun tidak
memiliki efek letal (Herbert & Merkens 1961, diacu dalam Alabaster & Lloyd
1980). Padatan tersuspensi juga dapat bercampur dengan air yang didisinfeksi
sehingga melindungi mikroorganisme dari disinfektan. Mikroorganisme yang
bertahan hidup tersebut dapat mengkontaminasi air (Hill 2004).
Penentuan padatan tersuspensi penting dalam analisis polusi air. Parameter
ini merupakan salah satu parameter utama untuk mengevaluasi kandungan limbah
cair domestik dan menentukan efisiensi unit pengolahan limbah (Sawyer et al.
2.2.3. Warna
Warna alami air berada dalam bentuk partikel koloid bermuatan negatif
sehingga penyerapan warna dapat dengan mudah dilakukan melalui koagulasi
dengan penambahan garam yang mengandung ion logam trivalen seperti
aluminum. Air permukaan dapat terlihat sangat berwarna karena adanya materi
tersuspensi berwarna tetapi dalam kenyataannya tidak berwarna. Warna yang
disebabkan materi tersuspensi merupakan warna yang bukan sebenarnya
(apparent color) dan berbeda dari warna yang disebabkan oleh daun-daunan atau
bahan organik yang berbentuk koloid sehingga disebut warna yang sebenarnya
(true color). Pada analisis air penting untuk membedakan warna sebenarnya dan
bukan sebenarnya (Sawyer et al. 2003).
Dilihat dari segi estetika, konsumen pada umumnya tidak mau meminum air
yang berwarna. Warna yang berasal dari bahan-bahan buangan industri
kemungkinan dapat membahayakan kesehatan. Warna dalam air juga dapat
menunjukkan kemungkinan hadirnya senyawa-senyawa organik yang bila
dilakukan proses klorinasi terhadap air tersebut akan mengakibatkan terbentuknya
kloroform. Senyawa-senyawa organik tersebut dapat meningkatkan pertumbuhan
mikroorganisme akuatik (Suriawiria 2008).
2.2.4. Perak (Ag)
Perak atau argentum (Ag) adalah logam berwarna putih. Perak ditemukan
pada industri alloy, keramik, gelas, fotografi, cermin dan cat rambut. Perak akan
menjadi sangat korosif bila terikat pada nitrat. Senyawa perak berbentuk debu
dapat menimbulkan iritasi kulit dan terakumulasi di dalam berbagai organ bila
masuk ke dalam tubuh sehingga menimbulkan pigmentasi kelabu atau
penghitaman kulit yang disebut argyria. Pigmentasi ini bersifat permanen karena
13
2.2.5. Merkuri (Hg)
Merkuri merupakan satu-satunya logam berbentuk cair pada suhu ruang.
Kadar merkuri di kulit bumi adalah 0,1 – 1 ppm. Merkuri mempunyai tiga valensi
yaitu valensi 0, I dan II. Merkuri memiliki beberapa bentuk tetapi bentuk
utamanya adalah HgS (cinnabar) yang stabil. Unsur merkuri dalam bentuk
cinnabar dapat mengalami oksidasi dan mengeluarkan uap merkuri. Merkuri
dalam bentuk senyawa organik dan anorganik bersifat sangat toksik (Landis & Yu
2004; Notodarmojo 2005; Eisler 2006). Hg anorganik dapat berubah menjadi
organik dan sebaliknya karena terjadi interaksi dengan mikroba. Genus
Pseudomonas dan Neurospora dapat mengubah Hg anorganik menjadi organik.
Staphylococcus aureus dapat mereduksi Hg2+ menjadi unsur Hg (Slamet 2006).
2.2.6. Krom (Cr)
Krom adalah logam kelabu yang keras, ditemukan pada industri gelas,
logam, fotografi dan pelapisan logam. Krom dalam bentuk unsur sebenarnya tidak
beracun tetapi bila berada dalam bentuk senyawa maka sangat iritan dan korosif
sehingga menimbulkan ulcus yang dalam pada kulit dan selaput lendir. Inhalasi
krom dapat menimbulkan kerusakan pada tulang hidung. Di dalam paru-paru,
krom dapat menimbulkan kanker (Slamet 2006).
Di dalam air, krom terlarut berada dalam bentuk kromat [Cr(VI)] dan dalam
bentuk trivalen [Cr(III)] terhidrolisis seluruhnya dalam air dan krom tersebut
mengendap sebagai hidroksida sehingga kandungan kromium dalam larutan hanya
tertinggal sedikit. Krom III tidak berbahaya bagi kesehatan manusia. Krom
digunakan secara ekstensif dalam industri untuk membuat campuran logam, kaca
pembesar, katalis, krom oksida dan garam kromat. Krom oksida digunakan untuk
memproduksi asam kromat dam industri pelapisan logam. Garam kromat
digunakan pada cat dan menghasilkan larutan pembersih di laboratorium.
Keracunan kromat dapat menyebabkan kelainan kulit dan kerusakan hati bahkan
2.3. Alum
Koagulan yang paling populer dalam aplikasi pengolahan limbah adalah
aluminum sulfat atau alum yang dapat diperoleh dalam bentuk cairan atau padat.
Alum adalah suatu garam yang bila dimasukkan ke dalam cairan akan
menghasilkan endapan aluminum hidroksida. Alum bersifat amfoter artinya dapat
larut dalam basa dan asam kuat (Eckenfelder 2000; Sawyer et al. 2003).
Menurut Eckenfelder (2002), reaksi yang terjadi ketika alum dimasukkan ke
dalam air adalah :
Al2(SO4)3 + 6H2O → 2Al(OH)3 + 3H2SO4
Menurut Chang (2002), Al(OH)3 bereaksi dengan asam dan basa dengan
reaksi sebagai berikut :
Al(OH)3(s) + 3H+(aq)→ Al3+(aq) + 3H2O(l)
Al(OH)3(s) + OH-(aq)↔ Al(OH)4-(aq)
Tingginya kelarutan Al(OH)3 dalam medium basa adalah hasil dari
pembentukan ion kompleks Al(OH)4- karena Al(OH)3 bertindak sebagai asam
Lewis dan OH- sebagai basa Lewis.
Menurut Sawyer et al. (2003) kemampuan alum untuk larut dalam basa dan
asam kuat merupakan hal yang penting dalam koagulasi karena ion pada alum,
basa dan asam kuat bereaksi membentuk kompleks ion yang bertambah atau
berkurang karena penambahan basa dan asam kuat sampai reaksi menjadi netral
dan terbentuk endapan. Reaksi yang terjadi pada ion Al3+ dan OH- adalah :
Al3+ + OH-↔ Al(OH)2+
Al(OH)2+ + OH-↔ Al(OH)2+
Al(OH)2+ + OH-↔ Al(OH)3(aq)
Al(OH)3 + OH-↔ Al(OH)4
-Konsentrasi OH- rendah ketika dalam kondisi asam dan ion yang berada
dalam larutan adalah ion positif yaitu Al3+ dan Al(OH)4+ dan jika dalam kondisi
basa maka konsentrasi OH- akan bertambah sehingga ion ini akan menambah
jumlah ion kompleks alum sampai muatan ion menjadi netral dan terbentuk ion
Al(OH)3 yang kemudian mengendap dalam larutan. Basa yang terus menerus
ditambahkan akan meningkatkan konsentrasi OH- dalam larutan sehingga
15
2.4. Koagulasi
Pada umumnya pengendapan gravitasi digunakan untuk mengendapkan
partikel yang besar sehingga terpisah dari limbah cair. Limbah cair mengandung
partikel besar dan kecil yang berasal dari batuan, tanah dan dekomposisi hewan
dan tanaman air. Partikel kecil melayang di dalam air dalam bentuk koloid
sehingga tidak bisa diendapkan secara konvensional. Koloid ini berukuran 0,001 –
1 µm yang terdiri dari kelompok molekul atau ion yang memiliki ikatan lemah.
Kelompok ini tidak berada dalam bentuk ion atau molekul tunggal tetapi dalam
sebuah unit. Ion atau molekul tunggal tersebut dalam partikel koloid terorganisir
secara spasial sehingga permukaan partikel berisi kelompok ion. Muatan ion pada
permukaan salah satu partikel menolak muatan-muatan ion pada partikel yang
berdekatan sehingga mencegah agregasi dan pembentukan endapan (Baird &
Cann 2005).
Koloid harus dihilangkan dari limbah cair karena alasan estetika dan
kesehatan. Koloid dapat dihilangkan dari limbah cair melalui proses koagulasi
yaitu dengan penambahan koagulan seperti alum. Pada pH netral atau basa (≥7)
ion-ion Al3+ yang dihasilkan dari garam-garam koagulan tersebut membentuk
hidroksida gelatin yang secara fisik menggabungkan partikel dan membentuk
endapan yang terpisah dengan cairan sehingga mudah diangkat dari cairan.
Menurut Sawyer et al. (2003), dalam koagulasi, koloid didestabilisasi sehingga
mereka berkumpul atau berkoagulasi menjadi partikel yang lebih besar sehingga
koloid tersebut dapat dengan mudah diendapkan.
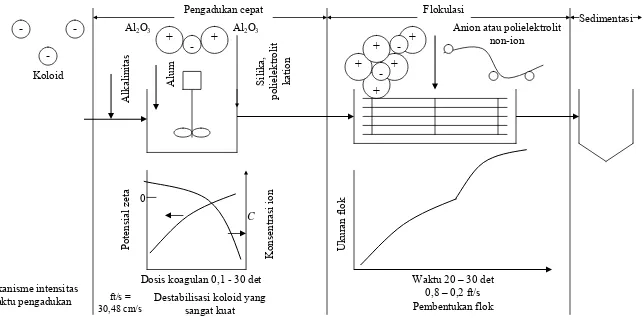
Menurut Eckenfelder (2000), koagulasi terdiri dari 2 mekanisme dasar :
1. Perikinetik atau elektrokinetik adalah reduksi potensial zeta oleh ion dan
koloid dengan muatan berlawanan yang terjadi karena adanya gaya tarik van
der Waals.
2. Ortokinetik adalah agregasi misel sehingga membentuk gumpalan yang
menggaglomerasi partikel koloid.
Penambahan kation valensi tinggi menekan muatan partikel dan lapisan
ganda sehingga menurunkan nilai potensial zeta dan jika koagulan terlarut, kation
bertindak menetralisir muatan negatif koloid. Hal ini terjadi sebelum
proses koagulasi dengan pelindung yang masih efektif dalam fase ini. Flok mikro
kemudian terbentuk yang menahan muatan positif dalam kondisi asam karena
adsorpsi ion H+. Flok mikro ini juga bertindak menetralkan dan melindungi
partikel koloid. Flokulasi mengagglomerasi koloid dengan flok hidroksida. Dalam
fase ini adsorpsi permukaan juga aktif. Koloid yang pada awalnya tidak
diadsorpsi, hilang karena terperangkap dalam flok (Eckenfelder 2000).
17
Sedimentasi
Gambar 2. Mekanisme koagulasi (Eckenfelder 2000)
-3.1. Tempat dan Waktu
Penelitian dilakukan di Laboratorium Teknik dan Manajemen Lingkungan
(TML), Departemen Teknologi Industri (TIN), IPB pada bulan Juni-Juli 2008.
3.2. Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini yaitu limbah cair
laboratorium dari sisa (residu) analisis COD, alum p.a. (pro analysi), NaOH dan
H2SO4 untuk menaikkan dan menurunkan pH. Bahan-bahan kimia lain untuk
analisis kekeruhan, warna, padatan tersuspensi total dan analisis logam.
Alat-alat yang digunakan dalam penelitian ini yaitu VELP scientifica test di
cessione C6F jar test apparatus (peralatan jar test), pompa peristaltik, gelas piala
dan alat-alat gelas lainnya, buret, pH meter, botol plastik untuk wadah sampel,
spektrofotometer direct reading (DR) 2000 dan atomic absorption
spectrophotometry (AAS).
3.3. Rancangan Percobaan
Rancangan percobaan yang digunakan adalah rancangan acak lengkap
(RAL) faktorial 2 faktor. Faktor 1: pH koagulasi yang terdiri dari 4 taraf yaitu 6,
8, 10 dan 12. Faktor 2: dosis alum yang terdiri dari 3 taraf yaitu kontrol (tanpa
penambahan alum), 20 mg/L dan 30 mg/L. Percobaan diulang sebanyak 2 kali
19
Gambar 3. Jar test
Model matematik (Hines & Montgomery 1990; Srivastava 2002) untuk
percobaan ini adalah sebagai berikut :
Yij = µ + Ai + Bj + (AB)ij + εij
Yijk = Nilai respon pada pH koagulasi ke-i, dosis alum ke-j dan ulangan
ke-k
µ = Pengaruh rata-rata
Ai = Pengaruh faktor pH koagulasi ke-i (i = 6, 8, 10, 12)
BBj = Pengaruh faktor dosis alum ke-j (j = kontrol, 20 mg/L, 30 mg/L)
3.4. Tahap Pelaksanaan
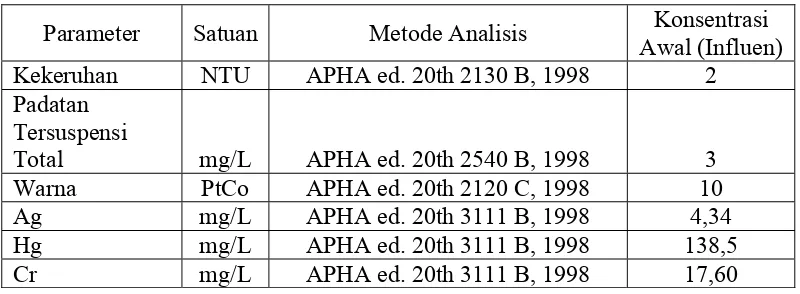
1) Karakterisasi Limbah Cair Laboratorium Hasil Analisis COD
Karakterisasi limbah cair ini dilakukan sebelum dan sesudah perlakuan.
Parameter-parameter yang dianalisis yaitu kekeruhan (NTU), padatan tersuspensi
total (mg/L), warna (PtCo), Ag (mg/L), Hg (mg/L) dan Cr (mg/L). Karakterisasi
limbah cair ini dilakukan untuk mengetahui konsentrasi setiap polutan dalam
limbah cair. Analisis parameter dilakukan sesuai dengan Standard Methods
(APHA 1998).
2) Jar Test
Pertama-tama limbah cair laboratorium diencerkan sampai 6 kali. Kemudian
diambil sebanyak 3000 mL. Setelah itu diatur pH sesuai dengan pH yang diteliti
menggunakan pH meter. Kemudian limbah 3000 mL tersebut yang sudah diatur
pH-nya dituangkan ke dalam 6 gelas piala masing-masing sebanyak 500 mL. Ke-6
gelas piala tersebut masing-masing diberi dosis 0 mg/L (tanpa penambahan alum)
kode gelas 0; 15 mg/L kode gelas 1; 20 mg/L kode gelas 2; 25 mg/L kode gelas 3;
30 mg/L kode gelas 4 dan 35 mg/L kode gelas 5. Setelah itu ke-6 gelas piala
tersebut diletakkan dalam peralatan jar test.
Jar test dilakukan dengan pengadukan lambat dan cepat untuk mempercepat
percampuran limbah dengan alum untuk memaksimalkan efektivitas destabilisasi
koloid dan inisiasi koagulasi (Ebeling et al. 2006). Setelah 5 menit kemudian
maka terbentuk flok. Setelah itu limbah dibiarkan selama 30 menit - 1 jam sampai
flok yang terbentuk mengendap dengan baik. Supernatan yaitu cairan limbah yang
telah diberi perlakuan koagulasi kemudian dianalisis menggunakan
spektrofotometer DR 2000 untuk mengetahui konsentrasi kekeruhan, warna dan
padatan tersuspensi total serta AAS untuk mengetahui perubahan konsentrasi
21
3.5. Perhitungan Efisiensi Eliminasi Polutan (Rehm dan Reed 1986) Efisiensi eliminasi polutan dihitung dengan persamaan :
Efisiensi (%) = C0 – Ce x 100%
Ce
dengan :
C0 = konsentrasi influen
Ce = konsentrasi efluen
3.6. Analisis Data
Data yang diperoleh dianalisis dengan analisis ragam untuk mengetahui ada
tidaknya pengaruh faktor-faktor perlakuan tunggal dan interaksinya. Perlakuan
yang memiliki pengaruh nyata, dilakukan uji lanjut untuk nilai rataan
masing-masing taraf perlakuan. Uji nilai rataan dilakukan dengan Uji jarak berganda
Duncan (duncan multiple range test-DMRT) untuk mengetahui perlakuan tunggal
atau interaksi yang berpengaruh nyata (Steel & Torrie 1960; Mattjik &
4.1. Karakteristik Limbah Cair Laboratorium
Karakteristik limbah cair laboratorium ini adalah jenis atau ciri limbah cair
laboratorium yang diteliti. Berdasarkan kandungan polutan yang ada di dalam
limbah cair ini maka limbah ini tergolong limbah asam karena analisis COD yang
dilakukan menggunakan bahan-bahan kimia yang mengandung asam yaitu asam
sulfat dan ion sulfat selain itu dapat digolongkan beracun karena mengandung
logam berat krom, merkuri dan perak pada senyawa yang digunakan pada analisis
COD.
Limbah cair ini berwarna bening kebiruan dengan pH 2. Bahan-bahan kimia
yang terkandung di dalam limbah cair ini dapat digolongkan sebagai limbah
berbahaya dan beracun jika tidak diolah sebelum dibuang ke lingkungan. Analisis
COD menggunakan bahan-bahan kimia seperti kalium permanganat (K2Cr2O7),
perak sulfat (Ag2SO4.H2SO4), ferro amonium sulfat [Fe(NH4)2(SO4)2.6H2O], asam
sulfat pekat (H2SO4), kristal merkuri sulfat (HgSO4) dan indikator ferroin (APHA
1998).
Tabel 2. Karakteristik limbah cair laboratorium
Parameter Satuan Metode Analisis Konsentrasi
23
Berdasarkan kandungan polutan yang dijelaskan maka untuk mengetahui
jumlah konsentrasi polutan yang ada di dalam limbah cair ini maka dilakukan
pengukuran awal terhadap kekeruhan, padatan tersuspensi total, warna, Ag, Hg
dan Cr. Setelah itu hasil pengukuran awal dibandingkan dengan hasil pengukuran
sesudah koagulasi untuk mengetahui kecenderungan penurunan atau kenaikan
konsentrasi setiap parameter. Karakteristik limbah cair laboratorium ini dapat
dilihat pada Tabel 2.
4.2. Perubahan Fisik Larutan selama Koagulasi
Pada pH 6 dengan dosis 0 mg/L terbentuk endapan berwarna coklat
[Al(OH)3] dan larutan berwarna kuning (CrO42-) demikian pula pada dosis 20
mg/L dan 30 mg/L (Gambar 4a). Hal ini juga terjadi pada pH 8, pH 10 dan pH 12
dengan dosis yang sama tetapi endapan [Al(OH)3] dan larutannya berwarna coklat
(Al3+) (Gambar 4b dan 4c). Perubahan warna yang terjadi selama proses koagulasi
dapat disebabkan oleh penambahan bahan-bahan kimia dalam larutan namun
setelah diendapkan selama 30 menit sampai 1 jam warna larutan menjadi bening
dengan sedikit flok dan flok yang mengendap semuanya berwarna coklat pada
Gambar 4a. Larutan berwarna kuning dan endapan coklat yang terbentuk pada pH 6
Gambar 4b. Larutan berwarna coklat yang terbentuk pada pH 8, 10 dan 12
25
4.3. Pengaruh pH dan Dosis Koagulan Alum dalam Koagulasi
pH merupakan karakteristik yang sangat penting yang mempengaruhi
keefektivan koagulasi karena pengaturan pH menentukan tingkat eliminasi
polutan dari limbah cair. Pengaturan pH dilakukan dengan menambahkan basa
kuat (NaOH) dan asam kuat (H2SO4). Basa kuat dan asam kuat digunakan dalam
koagulasi karena keduanya terionisasi sempurna dalam cairan. Menurut teori
ionisasi Arrhenius, basa kuat dan asam kuat dalam suatu senyawa akan terurai
menjadi ion apabila berada dalam cairan. Ion-ion dari basa kuat dan asam kuat
dapat berinteraksi dengan berbagai zat kimia yang berada dalam cairan. Interaksi
ini terjadi agar reaksi berbagai zat kimia dalam cairan tersebut mencapai
kesetimbangan (Sawyer et al. 2003).
Pada kondisi asam, konsentrasi OH- dalam larutan sedikit dan ion-ion yang
berada dalam larutan adalah ion-ion positif seperti Al3+ dan pada kondisi basa,
konsentrasi OH- akan meningkat dan ion-ion ini akan semakin menambah
kompleksitas aluminum sehingga larutan menjadi netral sampai terbentuk
Al(OH)3 padat yang mengendap dalam larutan. Basa kuat yang terus menerus
ditambahkan akan semakin meningkatkan konsentrasi OH- sehingga terbentuk ion
Al(OH)4- yang terlarut dalam larutan.
Hidroksida alum dapat larut dalam asam dan basa sehingga disebut
hidroksida amfoter. Hidroksida amfoter bereaksi dengan hidroksida dari basa kuat
juga asam kuat membentuk suatu kumpulan ion kompleks. Kompleks yang
terbentuk pada kondisi asam atau basa adalah ion-ion bermuatan yang mudah larut
dalam cairan. Ion-ion yang terbentuk pada kondisi ini adalah ion-ion netral dan
larut dalam cairan.
Dosis alum juga mempengaruhi koagulasi. Dosis yang terlalu tinggi
menyebabkan alum tidak hanya menetralkan muatan negatif pada partikel tetapi
menambah jumlah muatan positif yang memiliki kecenderungan gaya tarik yang
sama antar partikel seperti pada kondisi awal limbah (Ebeling et al. 2006).
Endapan hidroksida dengan cepat terbentuk bila dosis alum sangat tinggi.
Mekanisme eliminasi yang terjadi disebut tumbukan partikel (sweep floc) karena
partikel koloid terperangkap dalam presipitat logam sehingga hilang dari larutan.
banyaknya kompleks hidroksida yang dapat terbentuk ketika alum ditambahkan
pada larutan. Kompleks hidroksida berinti banyak tersebut mempengaruhi
kelarutan alum dalam larutan. Koagulasi biasanya baik dilakukan pada pH dengan
kelarutan terendah (Sawyer et al. 2003).
Al(III) dalam kuantitas yang tepat bila ditambahkan pada larutan akan
membentuk presipitat hidroksida [Al(OH)3]. Partikel koloid dapat menyediakan
tempat kondensasi sehingga presipitat dapat terbentuk dan oleh karena itu koloid
terperangkap dalam presipitat dan berada dalam presipitat tersebut. Presipitat juga
dapat menangkap koloid yang melewatinya, mengumpulkannya dan
menghilangkannya dari air.
Al(III) yang digunakan dalam koagulasi limbah cair untuk menghilangkan
warna dan kekeruhan dapat berfungsi sebagai koagulan melalui beberapa
mekanisme. Ketika Al(III) ditambahkan ke dalam limbah cair, Al(III) terionisasi
menjadi trivalen, ion logam bebas (Al3+), jumlah dan keberadaan yang merupakan
fungsi karakteristik air yaitu pH dan alkalinitas. Beberapa ion logam tidak
diragukan mencapai target dan menetralkan muatan partikel koloid. Mayoritas ion
logam trivalen bergabung dengan ion hidroksida membentuk berbagai hidroksida
kompleks seperti kompleks inti banyak [Al13(OH)345+] yang sebagian besar
membawa muatan positif dan dapat terjerap ke dalam koloid yang menyebabkan
netralisasi dan tekanan lapisan ganda. Koloid yang didestabilisasi ini berkumpul
membentuk partikel yang makin besar yang langsung mengendap. Jika jumlah
kompleks hidroksida bermuatan positif lebih dari yang dibutuhkan untuk bereaksi
dengan partikel warna atau kekeruhan yang negatif, pembalikan muatan dapat
terjadi karena muatan yang berlawanan dari koloid dan kompleks hidroksida
saling membatalkan sehingga terjadi koagulasi. Ion positif yang berlebihan ini
menyebabkan pembalikan muatan dan akhirnya terbentuk partikel bermuatan
positif yang stabil.
Koloid hidrofobik biasanya langsung mengalami koagulasi dengan
penambahan kuantitas garam yang mengkontribusi ion pada larutan. Koloid
tersebut distabilkan oleh tekanan elektrostatik. Oleh karena itu penjelasan
sederhana mengenai koagulasi oleh ion dalam larutan adalah bahwa ion
27
mengalami agregasi karena muatan listrik lapisan ganda dikelilingi oleh partikel
bermuatan maka mekanisme agregasi ini disebut tekanan lapisan ganda. Ion
positif yang terikat pada permukaan negatif koloid dapat menyebabkan presipitasi
yang diikuti oleh restabilisasi koloid. Netralisasi awal muatan permukaan negatif
pada partikel melalui serapan ion positif menyebabkan terjadinya koagulasi dan
jika sumber ion positif semakin banyak ditambahkan, serapannya menyebabkan
pembentukan partikel koloid positif (Manahan 2000).
Flok alum kurang larut pada pH 7. Muatan flok positif di bawah pH 7,6 dan
negatif di atas pH 8,2. Diantara dua batas pH ini muatan flok tercampur. Dosis
alum yang tingi dapat menyebabkan tambahan presipitasi dari flok alum
tergantung pada pH flokulasi (Eckenfelder 2000).
Endapan yang dihilangkan dalam limbah cair biasanya menggunakan teknik
pemisahan fisik seperti sedimentasi atau filtrasi. Koagulan atau flokulan dapat
ditambahkan pada campuran untuk mempercepat pemisahan presipitat dari fase
larutan. Contoh koagulan anorganik yang biasa digunakan adalah aluminum sulfat
(alum). Proses presipitasi biasanya dilakukan untuk menghilangkan ion anorganik
terlarut terutama logam. Sejumlah anion cocok untuk direaksikan dengan logam.
Anion ini bervariasi sesuai dengan kecepatan reaksi, toksisitas dan biayanya. Hal
utama dalam pengendapan ion logam terlarut adalah melalui pembentukan
hidroksida. Sumber ion hidroksida dapat berasal dari NaOH, Na2CO3 atau
Ca(OH)2. Jika logam terlarut bereaksi dengan senyawa alkali maka sebagian besar
4.4. Efisiensi Eliminasi Polutan
Kemampuan koagulan alum dalam eliminasi polutan dari limbah cair
dengan proses koagulasi dapat diketahui pada efisiensi eliminasi limbah cair
melalui persentase perubahan atau penurunan konsentrasinya. Perhitungan
efisiensi ini dapat menjadi ukuran atau pertimbangan pemakaian dosis alum pada
limbah cair yang diteliti jika digunakan dalam skala besar (Satterfield 2005).
Polutan yang dibahas dalam efisiensi eliminasi polutan ini adalah polutan yang
memiliki eliminasi konsentrasi yang signifikan yaitu konsentrasi polutan yang
mengalami penurunan dari konsentrasi polutan awal.
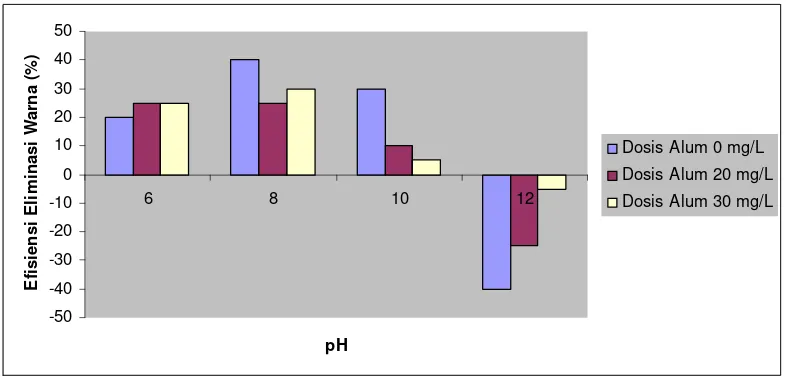
4.4.1. Efisiensi Eliminasi Polutan Warna
Efisiensi eliminasi polutan warna adalah efisiensi perubahan konsentrasi
polutan warna pada pengukuran awal setelah mengalami proses koagulasi.
Gambar 5 menunjukkan bahwa koagulan alum kurang efisien dalam menurunkan
konsentrasi polutan warna. Pada dosis 0 mg/L efisiensi eliminasi polutan
meningkat tajam dengan pencapaian tertinggi pada pH 8 (40%). Efisiensi ini juga
menurun dengan tajam sejalan dengan makin meningkatnya pH (basa). Hal ini
berbeda dengan dosis 30 mg/L yang memiliki efisiensi eliminasi polutan yang
agak stabil karena efisiensinya pada pH 12 hanya -5% jika dibandingkan dengan
efisiensi pada dosis 0 mg/L dengan peningkatan sampai -25%.
Grafik memperlihatkan bahwa dosis alum yang ditambahkan dapat
meningkatkan efisiensi eliminasi polutan meskipun tidak signifikan artinya ada
peningkatan efisiensi eliminasi polutan meskipun berada di daerah negatif pada
grafik. Dosis alum 0 mg/L jika dibandingkan dengan dosis 20 mg/L dan 30 mg/L
berada paling bawah di daerah grafik diikuti dengan dosis 20 mg/L kemudian
dosis 30 mg/L dengan efisiensi tertinggi.
Menurut Sawyer et al. (2003) intensitas warna meningkat sejalan dengan
kenaikan pH. Hal ini memang dapat dilihat pada grafik tetapi itu berarti polutan
warna tidak mengalami penurunan. Air berwarna alami adalah air yang berwarna
kuning kecoklatan. Limbah cair yang masih baru biasanya berwarna coklat kelabu
terang tetapi warna limbah bisa berubah menjadi lebih gelap jika berada dalam
29
kandungan sulfida logam yang terbentuk saat sulfida bereaksi dengan logam
dalam limbah (Metcalf & Eddy 2004).
-50
Gambar 5. Efisiensi eliminasi polutan warna
Limbah cair yang diteliti berwarna bening kebiruan dengan pH yang sangat
asam tetapi setelah pH dinaikkan maka warna limbah cair menjadi coklat. Warna
bening atau jernih suatu limbah cair atau air tidak menjamin bahwa limbah cair
atau air itu tidak mengandung polutan berbahaya dan beracun (Suriawiria 2008).
Warna coklat pada larutan diduga disebabkan oleh penambahan NaOH dan ion
Al3+ yang berada dalam larutan. Al3+ adalah ion bebas yang mempengaruhi
agregasi koloid yaitu produk hidrolisisnya (Stumm & Morgan 1962; Stumm &
O’Melia 1968, diacu dalam Metcalf & Eddy 2004).
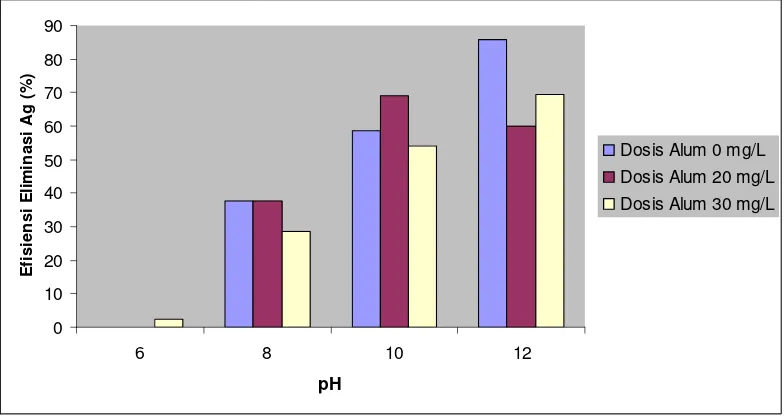
4.4.2. Efisiensi Eliminasi Polutan Perak (Ag)
Efisiensi eliminasi polutan argentum adalah efisiensi perubahan konsentrasi
polutan argentum pada pengukuran awal setelah mengalami proses koagulasi.
Gambar 6 menunjukkan efisiensi eliminasi Ag semakin tinggi sejalan dengan
naiknya pH kecuali pada dosis 20 mg/L yang turun cukup drastis pada pH 12
(60,14%). Secara umum dapat dilihat pada grafik bahwa koagulan alum cukup
efisien dalam menurunkan konsentrasi Ag pada limbah cair yang diteliti meskipun
dosis 0 mg/L merupakan dosis terbaik dalam menurunkan konsentrasi Ag
limbah cair dapat mengalami penurunan konsentrasi hingga tingkat yang cukup
rendah. Dosis alum 30 mg/L juga cukup efisien dalam menurunkan konsentrasi
polutan meskipun tidak sebaik dosis 0 mg/L karena dapat mencapai efisiensi
eliminasi 69,58% pada pH 12. Pada pH 12 penurunan konsentrasi polutan Ag
sangat efisien dilakukan.
0
Gambar 6. Efisiensi eliminasi polutan Ag
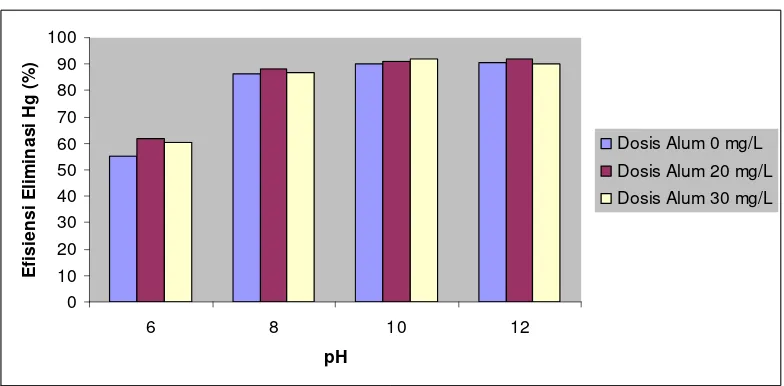
4.4.3. Efisiensi Eliminasi Polutan Merkuri (Hg)
Efisiensi eliminasi polutan merkuri adalah efisiensi perubahan konsentrasi
polutan merkuri pada pengukuran awal setelah mengalami proses koagulasi.
Gambar 7 menunjukkan efisiensi eliminasi Hg yang semakin tinggi sejalan
dengan naiknya pH tetapi pada pH 12 efisiensi eliminasi mengalami penurunan.
Secara umum dapat dilihat pada grafik bahwa koagulan alum efisien dalam
menurunkan konsentrasi Hg dalam limbah cair. Dosis yang semakin besar
semakin besar pula efisiensi eliminasi polutannya. Efisiensi eliminasi tertinggi
sebesar 92,06% diperoleh pada pH 10 dengan dosis 30 mg/L. Hal ini berarti
penurunan konsentrasi polutan Hg sangat efisien dilakukan pada pH basa dengan
dosis alum yang tinggi karena semakin tinggi pH maka semakin rendah
31
Gambar 7. Efisiensi eliminasi polutan Hg
4.4.4. Efisiensi Eliminasi Polutan Krom (Cr)
Efisiensi eliminasi polutan krom adalah efisiensi perubahan konsentrasi
polutan krom pada pengukuran awal setelah mengalami proses koagulasi. Gambar
8 menunjukkan bahwa koagulan alum sangat efisien dalam menurunkan
konsentrasi polutan Cr pada limbah cair yang diteliti. Efisiensi eliminasi polutan
Cr ini merupakan eliminasi tertinggi dari semua polutan yang diteliti. Efisiensi
eliminasi polutan Cr dapat mencapai 93,58% pada pH 12 dengan dosis 20 mg/L.
Efisiensi eliminasi Cr ini semakin tinggi sejalan dengan naiknya pH. Sama halnya
dengan kedua polutan logam berat diatas maka penurunan konsentrasi polutan Cr
ini sangat efisien dilakukan pada pH yang sangat basa.
Sebagian besar logam berat dapat dieliminasi dari limbah cair hanya dengan
menaikkan pH karena pada dasarnya hidroksida logamnya mudah larut. Hal ini
dapat dilakukan juga pada polutan Cr dengan mereduksi Cr(VI) menjadi Cr(III).
Cr(VI) yang berada dalam ion kromat (CrO42-) bersifat toksik dan karsinogen. Ion
ini mudah masuk ke dalam sel karena struktur molekulnya yang mirip dengan ion
sulfat (SO42-). Cr(III) kurang toksik bila dibandingkan dengan Cr(VI) bahkan
0
Gambar 8. Efisiensi eliminasi polutan Cr
4.5. Perubahan Konsentrasi Polutan dalam Limbah Cair setelah Koagulasi Perubahan konsentrasi polutan dalam limbah cair yang diteliti adalah
perubahan konsentrasi polutan dalam limbah cair sesudah diberi perlakuan pH dan
dosis alum berbeda. Polutan yang dibahas pada topik ini adalah semua polutan
pada pengukuran awal untuk mengetahui semua perubahan yang terjadi pada
semua polutan tersebut setelah dilakukan proses koagulasi. Hasil pengukuran
kadar polutan setelah koagulasi dapat dilihat pada Lampiran 1.
4.5.1. Kekeruhan
Kekeruhan yang diukur pada penelitian ini adalah kekeruhan yang
disebabkan oleh koloid yang ada pada limbah cair laboratorium sehingga harus
dihilangkan dengan proses koagulasi karena koloid tersebut tidak dapat
dihilangkan dari cairan dengan pengendapan konvensional.
Berdasarkan hasil sidik ragam diperoleh bahwa pH dan dosis tidak
berpengaruh terhadap penurunan konsentrasi kekeruhan. Gambar 9 menunjukkan
perubahan kekeruhan setelah diberi perlakuan pH dan dosis alum berbeda.
Kekeruhan awal yang diukur sebelum perlakuan adalah 2 NTU. Kekeruhan sama
sekali tidak mengalami penurunan, kecuali pada pH 6. Dengan dosis 30 mg/L
33
dosis 30 mg/L konsentrasinya tetap atau sama dengan konsentrasi awal yaitu 2
NTU.
Gambar 9. Kekeruhan setelah koagulasi
Kekeruhan yang tinggi yang berbeda dengan konsentrasi awal dapat
disebabkan oleh kandungan bahan-bahan kimia yang terlarut dalam larutan
sehingga koagulan tidak dapat menurunkan konsentrasi awal sebesar 2 NTU. Pada
pH 12 yang sangat basa yang berarti alkalinitas tinggi karena penambahan NaOH
terjadi penetralan muatan sehingga larutan menjadi keruh. Asam dan basa kuat
yang dicampurkan dalam larutan menyebabkan terjadinya penetralan muatan
tersebut. Harga pH tergantung pada konsentrasi asam atau basa yang ditambahkan
pada larutan artinya jika larutan dalam keadaan asam maka pH menjadi rendah,
sedangkan jika dalam keadaan basa maka pH larutan menjadi tinggi (Rivai 1995).
4.5.2. Padatan Tersuspensi Total
Padatan tersuspensi yang diukur dalam penelitian ini adalah padatan
tersuspensi yang disebabkan oleh kandungan berbagai bahan kimia yang ada pada
limbah cair laboratorium yang berasal dari reagen atau zat kimia yang digunakan
pada analisis COD.
Berdasarkan sidik ragam diperoleh bahwa faktor pH yang berpengaruh
dalam koagulasi dan setelah dilanjutkan dengan uji Duncan diperoleh bahwa pH
12 berbeda nyata dengan pH 6 dan pH 10. Gambar 10 menunjukkan bahwa
konsentrasi awal padatan tersuspensi total 3 mg/L tidak mengalami penurunan
konsentrasi padatan tersuspensi total tertinggi berada pada pH 12 sedangkan pada
pH 6 dan pH 10 konsentrasi padatan tersuspensi total hampir sama.
Kecenderungan ini dapat dilihat pada pH 12 dan dosis 30 mg/L dengan
konsentrasi padatan tersuspensi total sebesar 37 mg/L. Keadaan ini berbeda
dengan yang diharapkan yaitu bahwa dengan koagulasi, konsentrasi padatan
tersuspensi total awal dapat mengalami penurunan. Hal ini dapat disebabkan
karena adanya penambahan berbagai bahan kimia selama koagulasi yang
menambah jumlah padatan tersuspensi dalam larutan yang tidak menurunkan
konsentrasi padatan tersuspensi tetapi makin menambah konsentrasinya dan selain
itu pada pH 12 diduga terjadi penetralan muatan karena reaksi berbagai bahan
kimia pada pH yang sangat basa sehingga bahan-bahan kimia yang ada dalam
larutan tidak mengendap tetapi larut kembali (Sawyer et al. 2003).
Gambar 10. Konsentrasi padatan tersuspensi total setelah koagulasi
4.5.3. Warna
Warna limbah cair pada penelitian ini adalah warna yang disebabkan oleh
koloid negatif karena kandungan berbagai bahan kimia yang ada pada limbah cair
laboratorium. Warna bening kebiruan limbah cair ini dapat menjadi indikasi
bahwa limbah ini tergolong limbah dengan pH yang sangat asam.
Berdasarkan sidik ragam diperoleh bahwa faktor pH yang paling
berpengaruh dalam koagulasi dan setelah dilanjutkan dengan uji Duncan diperoleh
35
pH 6, pH 8 dan pH 10 dan jika dibandingkan dengan konsentrasi awal sebesar 10
PtCo maka pada pH 12, konsentrasi warna tersebut tidak mengalami penurunan.
Gambar 11 menunjukkan konsentrasi warna yang diukur sesudah diberi
perlakuan pH dan dosis alum berbeda. Konsentrasi awal warna ini adalah 10
PtCo. Penurunan konsentrasi warna setelah perlakuan terjadi pada semua variasi
pH dan dosis alum yang berbeda kecuali pada pH 12 dengan perubahan
konsentrasi yang tidak sama dengan variasi pH dan dosis lainnya.
Penurunan konsentrasi warna ini terjadi pada pH 6, pH 8 dan pH 10 dengan
konsentrasi yang hampir sama besarnya. Penurunan tertinggi terjadi pada pH 8
dengan dosis 0 mg/L dengan konsentrasi warna sebesar 6 PtCo.
0
Gambar 11. Konsentrasi warna setelah koagulasi
Kenaikan konsentrasi warna dari konsentrasi awal 10 PtCo pada pH 12
dapat disebabkan oleh kandungan bahan-bahan kimia dalam larutan dan juga pH
ini sangat alkali karena sudah di atas 7. Warna dalam larutan dapat disebabkan
oleh bahan-bahan tersuspensi yang terkandung dalam larutan tersebut. Larutan
hasil analisis COD ini pada awalnya berwarna bening kebiruan dan setelah
dilakukan jar test warna larutan menjadi sangat bening. Analisis COD yang
menggunakan bermacam-macam bahan kimia dan reaksinya pada pH 12 diduga
4.5.4. Perak (Ag)
Perak yang diteliti dalam penelitian ini adalah perubahan konsentrasi ion
Ag+ yang ada dalam limbah cair setelah melewati proses koagulasi. Gambar 12
menunjukkan penurunan konsentrasi Ag yang cukup konsisten berdasarkan
kenaikan pH meskipun penurunan konsentrasi berdasarkan dosis tidak konsisten.
Konsentrasi awal sebesar 4,34 mg/L dapat turun menjadi 0,62 mg/L pada pH 12
dan dosis 0 mg/L.
Berdasarkan sidik ragam diperoleh bahwa faktor pH yang paling
berpengaruh dalam koagulasi dan setelah dilanjutkan dengan uji Duncan diperoleh
bahwa penurunan konsentrasi signifikan pada semua pH. Hal ini menunjukkan
bahwa penurunan konsentrasi Ag ini tergantung pada pH. pH yang semakin tinggi
sejalan dengan penurunan konsentrasi Ag yang semakin tinggi pula.
0
Gambar 12. Konsentrasi Ag setelah koagulasi
Menurut Chang (2002) Ag+ tergolong logam transisi yang memiliki
kecenderungan membentuk ion kompleks karena memiliki beberapa bilangan
oksidasi. Sifat ini menyebabkan Ag secara efektif bertindak sebagai asam Lewis
dalam reaksi dengan berbagai molekul dan ion yang bertindak sebagai donor
elektron atau sebagai basa Lewis. Ion Ag+ akan membentuk ion kompleks Ag2SO4
ketika dalam larutan ditambahkan H2SO4 dan bila ditambahkan NaOH maka akan
terbentuk ion kompleks AgOH yang akan semakin meningkat kelarutannya bila
37
2Ag+ + H2SO4 → Ag2SO4 + 2H+
Ag+ + NaOH ↔ AgOH + Na-
Penurunan konsentrasi yang tidak sesuai dengan penambahan jumlah dosis
alum diduga disebabkan oleh kombinasi pH yang semakin tinggi (basa) dan dosis
alum yang semakin tinggi. pH basa menyebabkan ion Ag+ makin bertambah
dalam larutan, dengan kata lain kelarutan ion Ag+ besar. Dosis yang semakin
tinggi menyebabkan terjadinya netralisasi dalam larutan sehingga Ag+ tidak
mengendap tetapi larut kembali dalam larutan. Ion Na- juga menyebabkan larutan
menjadi netral.
4.5.5. Merkuri (Hg)
Merkuri yang diteliti pada penelitian ini adalah perubahan konsentrasi ion
Hg setelah melewati proses koagulasi. Gambar 13 menunjukkan konsentrasi Hg
mengalami penurunan konsentrasi yang sangat drastis setelah diberi perlakuan pH
dan dosis berbeda. Konsentrasi awal Hg yang diukur adalah 138,5 mg/L.
Penurunan konsentrasi Hg ini sangat konsisten berdasarkan pH dan dosis alum
berbeda yang diberikan saat percobaan. Penurunan konsentrasi tertinggi sebesar
11 mg/L dapat dilihat pada pH 10 dengan dosis alum 30 mg/L.
Berdasarkan sidik ragam diperoleh bahwa faktor pH yang paling
berpengaruh dan setelah dilanjutkan dengan uji Duncan diperoleh bahwa pH 6
berbeda nyata dengan pH 8, pH 10 dan pH 12. Hal ini menunjukkan bahwa
tingkat penurunan konsentrasi Hg pada pH 6 sangat rendah bila dibandingkan
0
Gambar 13. Konsentrasi Hg setelah koagulasi
Senyawa merkuri dalam larutan sangat kompleks karena keberadaan
senyawa merkuri ini tergantung pada pH, alkalinitas, redoks, variabel lainnya dan
berbagai bahan kimia yang bisa terbentuk yang memiliki kelarutan dan muatan
listrik yang berbeda (Boudou & Jernelov 1983, diacu dalam Eisler 2006). Ketiga
bentuk merkuri yaitu Hg0 (elemental), Hg22+ (ion merkuro) dan Hg2+ (ion
merkuri) sangat reaktif dan mudah bereaksi dengan berbagai bahan kimia di
lingkungan bahkan di dalam tubuh manusia. Ion merkuri merupakan ion yang
paling beracun diantara ketiga bentuk merkuri tersebut.
Pada penelitian ini konsentrasi merkuri dapat turun cukup tinggi pada semua
pH perlakuan tetapi penurunan konsentrasi yang paling tinggi diperoleh pada pH
basa (pH 8, 10 dan 12) meskipun pada pH sedang (pH 6) juga terjadi penurunan
konsentrasi yang tidak sebesar ketiga pH basa.
Penelitian mengenai hubungan pH air dan konsentrasi merkuri dalam ikan
di danau menunjukkan bahwa konsentrasi merkuri sangat besar pada pH asam dan
semakin menurun konsentrasinya bila pH semakin basa. pH yang diteliti mulai
dari pH 4 – 10 (Lean 2003, diacu dalam Baird & Cann 2005). Penurunan
konsentrasi merkuri semakin besar mulai dari pH 7 – 10 dan bila dibandingkan
dengan penelitian yang dilakukan maka pH maksimum yang diperoleh (pH 8 -12)
maka merupakan kisaran pH dengan penurunan konsentrasi merkuri terbesar.
Hg2+ tergolong asam lunak karena elektronnya mudah mengalami polarisasi
39
transisi seperti Ag yang mudah bereaksi dengan berbagai molekul dan ion dalam
larutan. Dalam penelitian ini Hg bereaksi dengan asam dan basa kuat yang
terionisasi sempurna dalam cairan sehingga ion Hg2+ akan membentuk ion
kompleks HgSO4 yang tidak larut bila berada dalam kondisi asam dan HgOH
dalam kondisi basa dan akan semakin meningkat kelarutannya jika terus menerus
ditambahkan basa. Reaksi yang diduga terjadi adalah :
Hg2+ + 2H2SO4 → 2HgSO4 + 4H+
Hg2+ + 2NaOH ↔ 2HgOH + 2Na
-4.5.6. Krom (Cr)
Krom yang diteliti pada penelitian ini adalah perubahan konsentrasi ion Cr
setelah melewati proses koagulasi. Gambar 14 menunjukkan penurunan
konsentrasi Cr setelah diberi perlakuan pH dan dosis alum berbeda. Konsentrasi
awal Cr adalah 17,60 mg/L. Penurunan tertinggi sebesar 1,13 mg/L terjadi pada
pH 12 dengan dosis 20 mg/L. Penurunan ini juga sangat konsisten seperti pada
parameter Hg.
Berdasarkan sidik ragam diperoleh bahwa faktor pH yang paling
berpengaruh dan setelah dilanjutkan dengan uji Duncan diperoleh bahwa
penurunan konsentrasi signifikan pada semua pH. Hal ini menunjukkan bahwa
0
Gambar 14. Konsentrasi Cr setelah koagulasi
pH 12 yang merupakan pH koagulasi maksimum yang ditemukan dalam
penelitian ini merupakan pH yang sangat basa. Pada pH 6 larutan berwarna
kuning cerah merupakan indikasi adanya Cr(VI) dalam bentuk CrO42- tetapi pada
pH 8 -12 larutan berwarna coklat merupakan indikasi terbentuknya Cr(OH)3.
Menurut Baird dan Cann (2005), pada kondisi oksidasi krom berada dalam
bentuk Cr(VI) yaitu ion kromat (CrO42-) yang bereaksi dengan asam membentuk
HCrO4- (1). Oksianion Cr(VI) sangat mudah larut dalam air. CrO42- dan HCrO4
-berwarna kuning bahkan pada konsentrasi Cr yang paling rendah (1 ppm) dan
pada kondisi reduksi Cr berbentuk Cr3+ (2). Ion ini tidak mudah larut dalam air
dan biasanya mengendap menjadi ion hidroksida bila berada dalam kondisi basa,
netral bahkan asam. Dalam penelitian ini digunakan koagulan alum untuk
mereduksi Cr(VI) menjadi Cr(III) sehingga koloid yang berada dalam limbah cair
mengendap dan dengan demikian konsentrasi Cr dalam limbah cair berkurang (3).
H+ + CrO42-↔ HCrO4-………... (1)
Cr3+ + OH- ↔ Cr(OH)3(s)…………...(2)
41
4.6. Aspek Ekonomi
Jumlah limbah cair laboratorium umumnya kecil, dan terdiri atas berbagai
macam bahan anorganik oleh karena itu metode pengolahan secara kimia
merupakan alternatif yang terbaik, ditinjau dari aspek teknis dan ekonomis.
Sebagai ilustrasi, untuk pengolahan limbah cair laboratorium sebanyak 1000 liter
(1 m3) diperlukan alum sekitar 20 gram dari botol ukuran 500 g dengan harga Rp.
320.000. Selain itu digunakan juga bahan-bahan kimia lain untuk analisis
parameter fisik dan kimia misalnya untuk analisis logam Hg digunakan bahan
kimia cair dalam botol ukuran 500 g dengan harga sekitar Rp. 500.000 – 800.000.
Selain bahan kimia, biaya analisis laboratorium seluruh parameter fisik dan kimia
mencapai Rp. 3,6 juta. Biaya-biaya lain yaitu untuk botol sampel dan lain-lain
sekitar Rp. 500.000. Secara keseluruhan biaya analisis ini masih terjangkau dan
dapat dijadikan perbandingan bila akan dilakukan pengolahan limbah cair
laboratorium dalam skala besar. Untuk analisis biaya (cost analysis) atau analisis
ekonomi (economic analysis) pengolahan limbah cair laboratorium yang lebih
baik perlu dilakukan penelitian lebih lanjut sehingga dapat diketahui total biaya
5.1. Kesimpulan
1. Hasil penelitian menunjukkan bahwa efisiensi eliminasi logam berat (Ag,
Cr, Hg) sangat dipengaruhi oleh nilai pH, dan hanya sedikit dipengaruhi
oleh dosis alum. Nilai pH optimum untuk eliminasi masing-masing logam
dalam limbah cair laboratorium berbeda.
2. Nilai eliminasi 93,58% Cr, 92,06% Hg dan 85,71% Ag dapat dicapai pada
perlakuan pH 12 dan dosis alum 20 mg/L. Konsentrasi Cr turun dari 17,60
mg/L menjadi 1,13 mg/L. Konsentrasi Hg turun dari 138,5 mg/L menjadi
11 mg/L dan konsentrasi Ag turun dari 4,34 mg/L menjadi 0,62 mg/L.
Hasil pengolahan ini masih relatif tinggi dan memerlukan pengolahan
lebih lanjut, misalnya dengan fitoremediasi.
5.2. Saran
1. Perlu dilakukan penelitian lebih lanjut pada skala yang lebih besar
khususnya untuk pengolahan limbah cair laboratorium.
2. Perlu dilakukan penelitian lainnya dengan jenis atau karakteristik limbah
yang berbeda dengan proses presipitasi (pengaturan pH).