LABORATORIUM DENGAN PROSES KOAGULASI
ERLY ANACE LOUISA MAMUSUNG
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2009
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Eliminasi Polutan dari Limbah
Cair Laboratorium dengan Proses Koagulasi adalah karya saya sendiri dan
belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Januari 2009
Erly Mamusung NRP P052030401
ERLY ANACE LOUISA MAMUSUNG. Pollutants elimination from laboratory wastewater by coagulation process. Under the supervision of NASTITI SISWI INDRASTI and SUPRIHATIN.
Coagulation is a treatment technique that is often used in wastewater treatment, especially for reducing heavy metals. Laboratory wastewater contain metals and other pollutants that need to be reduced before discharging it to environment. This research was intended to examine alum coagulant ability in pollutants elimination and to study the effects of alum dosages and pH in order to determine the maximum elimination of pollutants. Initial concentrations all of the parameters respectively were turbidity 2 NTU, total suspended solids 3 mg/L, color 10 PtCo, silver 4.34 mg/L, mercury 138.5 mg/L and chrome 17.60 mg/L. Method used was jar test. Experimental design used was completely random with 2 factors which were (1) pH coagulation : 6, 8, 10 and 12 and alum dosages : 0 (without alum), 20 and 30 mg/L. Optimum pH was 12 and best alum dosage was 20 mg/L in Cr with 93.58% efficiency followed by Hg 92.06% (11 mg/L), Ag 85.71% (0.62 mg/L) and color 40% (6 PtCo). Results indicated that alum coagulant ability in elimination of each pollutant was different. Best concentration elimination based on pH escalation was 0.62 mg/L in Ag in pH 12. The higher the pH coagulation, more pollutants were able eliminated by alum coagulant.
RINGKASAN
ERLY ANACE LOUISA MAMUSUNG. Eliminasi Polutan dari Limbah Cair Laboratorium dengan Proses Koagulasi. Dibimbing oleh NASTITI SISWI INDRASTI dan SUPRIHATIN.
Salah satu teknik pengolahan limbah cair, terutama untuk menurunkan kadar logam berat adalah koagulasi. Limbah cair laboratorium mengandung logam berat dan polutan lainnya yang harus dieliminasi sebelum dibuang ke lingkungan. Tujuan penelitian ini adalah untuk mengetahui pengaruh pH dan dosis alum yang bervariasi untuk memperoleh eliminasi polutan maksimum pada pengolahan limbah cair laboratorium. Konsentrasi awal masing-masing parameter limbah cair yang diukur yaitu kekeruhan 2 NTU, padatan tersupensi total 3 mg/L, warna 10 PtCo, perak 4,34 mg/L, merkuri 138,5 mg/L dan krom 17,60 mg/L. Metode yang digunakan adalah jar test. Rancangan percobaan yang digunakan adalah rancangan acak lengkap (RAL) 2 faktor yaitu (1) pH koagulasi : 6, 8, 10 dan 12 dan (2) dosis koagulan alum : 0 (tanpa penambahan alum), 20 dan 30 mg/L. pH koagulasi terbaik yang diperoleh dalam penelitian ini adalah pH 12 dan dosis alum terbaik adalah 20 mg/L pada Cr dengan nilai efisiensi 93,58% (1,15 mg/L) diikuti oleh Hg 92,06% (11 mg/L), Ag 85,71% (0,62 mg/L) dan warna 40% (6 PtCo). Hasil penelitian menunjukkan bahwa kemampuan koagulan alum dalam eliminasi setiap polutan berbeda tergantung dosis dan pH proses koagulasi. Eliminasi polutan terbesar berdasarkan kenaikan pH adalah pada Ag dengan nilai konsentrasi 0,62 mg/L pada pH 12. Semakin tinggi pH semakin banyak polutan yang dapat dieliminasi oleh koagulan alum dari limbah cair laboratorium.
@ Hak Cipta milik IPB, tahun 2009 Hak Cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya
ELIMINASI POLUTAN DARI LIMBAH CAIR
LABORATORIUM DENGAN PROSES KOAGULASI
ERLY ANACE LOUISA MAMUSUNG
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains
Pada Program Studi Pengelolaan Sumberdaya Alam dan Lingkungan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2009
Judul Tesis : Eliminasi Polutan dari Limbah Cair Laboratorium dengan Proses Koagulasi
Nama : Erly Anace Louisa Mamusung
NIM : P052030401
Disetujui Komisi Pembimbing
Prof. Dr. Ir. Nastiti Siswi Indrasti Dr. Ir. Suprihatin, Dipl.Eng. Ketua Anggota
Diketahui
Ketua Program Studi Ilmu Pengelolaan Dekan Sekolah Pascasarjana Sumberdaya Alam dan Lingkungan
Prof. Dr. Ir. Surjono H. Sutjahjo, MS Prof. Dr. Ir. Khairil A. Notodiputro, MS Tanggal ujian : 12 Desember 2008 Tanggal lulus : 28 Januari 2009
Puji dan syukur penulis panjatkan ke hadirat TUHAN YESUS KRISTUS, karena atas berkat, kasih karunia dan perkenan-Nya penulis dapat menyelesaikan Tesis yang berjudul Eliminasi Polutan dari Limbah Cair Laboratorium
dengan Proses Koagulasi. Tesis ini dibuat dalam rangka memenuhi salah satu
persyaratan yang diperlukan untuk memperoleh gelar Magister Sains pada Program Studi Pengelolaan Sumberdaya Alam dan Lingkungan (PSL) Sekolah Pascasarjana Institut Pertanian Bogor.
Ucapan terima kasih penulis sampaikan kepada semua pihak yang telah memberikan bantuan, dukungan serta bimbingan kepada penulis, yaitu :
1. Prof. Dr. Ir. Nastiti Siswi Indrasti, selaku ketua komisi pembimbing. 2. Dr. Ir. Suprihatin, Dipl.Eng. selaku anggota komisi pembimbing.
3. Mama dan Papa, Mami, Om Ernest dan Tante Joice, adikku (Mariane), para sepupu tersayang (Pinx, Ann dan Ghe) yang selalu memberikan doa, dukungan, perhatian dan semangat.
4. Staf pegawai FATETA IPB Bapak Yogi, Edi, Sugi, Angga, Ibu Sri, Ega, Mbak Anis dan Vindi.
5. Teman-teman mahasiswa PSL 2004 khususnya bahkan seluruh teman-teman mahasiswa PSL yang tidak dapat disebutkan satu per satu yang menjadi teman “seperjuangan” selama kuliah di PSL.
6. Teman-teman seperjuangan di kos Perwira 12, terutama Sherly dan Santi. We’re more than conqueror!
Penulis berharap semoga tesis ini dapat bermanfaat bagi semua pihak. Amin.
Bogor, Januari 2009
Penulis
RIWAYAT HIDUP
Penulis dilahirkan di Manado, Sulawesi Utara, pada tanggal 27 Oktober 1976 dari Ayah Gerrit A. Mamusung dan Ibu Juliana Runtukahu, SPd. Penulis merupakan anak pertama dari dua bersaudara.
Penulis menamatkan pendidikan Sekolah Dasar di SD GMIM (Gereja Masehi Injili di Minahasa) 50 Paniki Bawah pada tahun 1988, Sekolah Menengah Pertama di SMP Negeri 10 Paniki Bawah pada tahun 1991 dan Sekolah Menengah Atas di SMA Negeri I Manado pada tahun 1994.
Pendidikan Sarjana ditempuh di Program Studi Budidaya Perairan, Jurusan Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Universitas Sam Ratulangi, Manado pada tahun 1994 dan lulus tahun 2002. Pada tahun 2004 penulis melanjutkan pendidikan S2 pada Program Studi Pengelolaan Sumberdaya Alam dan Lingkungan dengan bidang minat Pencemaran Lingkungan.
Halaman
DAFTAR TABEL ... iii
DAFTAR GAMBAR... iv DAFTAR LAMPIRAN ... v I. PENDAHULUAN ... 1 1.1. Latar Belakang ... 1 1.2. Perumusan Masalah ... 3 1.3. Tujuan ... 4 1.4. Hipotesis... 4 1.5. Manfaat ... 4 1.6. Ruang Lingkup... 4 1.7. Kerangka Pemikiran... 5
II. TINJAUAN PUSTAKA... 7
2.1. Polutan ... 7
2.2. Karakteristik Fisik, Kimia dan Biologi Polutan... 7
2.2.1. Kekeruhan ... 10
2.2.2. Padatan Tersuspensi Total... 11
2.2.3. Warna ... 12 2.2.4. Perak (Ag) ... 12 2.2.5. Merkuri (Hg) ... 13 2.2.6. Krom (Cr)... 13 2.3. Alum... 14 2.4. Koagulasi ... 15 III. METODE ... 18
3.1. Tempat dan Waktu ... 18
3.2. Bahan dan Alat... 18
3.3. Rancangan Percobaan ... 18
3.4. Tahap Pelaksanaan... 20
3.5. Perhitungan Efisiensi Eliminasi Polutan... 21
3.6. Analisis Data ... 21
IV. HASIL DAN PEMBAHASAN... 22
4.1. Karakteristik Limbah Cair Laboratorium... 22
4.2. Perubahan Fisik Larutan selama Koagulasi ... 23
4.4. Efisiensi Eliminasi Polutan ... 28
4.4.1. Efisiensi Eliminasi Polutan Warna... 28
4.4.2. Efisiensi Eliminasi Polutan Perak (Ag)... 29
4.4.3. Efisiensi Eliminasi Polutan Merkuri (Hg)... 30
4.4.4. Efisiensi Eliminasi Polutan Krom (Cr) ... 31
4.5. Perubahan Konsentrasi Limbah Cair setelah Koagulasi ... 32
4.5.1. Kekeruhan... 32
4.5.2. Padatan Tersuspensi Total ... 33
4.5.3. Warna... 34
4.5.4. Perak (Ag)... 36
4.5.5. Merkuri (Hg)... 37
4.5.6. Krom (Cr) ... 39
4.6. Aspek Ekonomi... 41
V. KESIMPULAN DAN SARAN ... 42
5.1. Kesimpulan ... 42
5.2. Saran... 42
DAFTAR PUSTAKA ... 43
Halaman 1. Karakteristik fisik, kimia, biologi dan sumber limbah cair ... 8 2. Karakteristik limbah cair laboratorium... 22
DAFTAR GAMBAR
Halaman
1. Kerangka pemikiran ... 6
2. Mekanisme koagulasi ... 17
3. Jar test ... 19
4a. Larutan berwarna kuning dan endapan coklat yang terbentuk pada pH 6 ... 24
4b. Larutan berwarna coklat yang terbentuk pada pH 8, 10 dan 12 ... 24
4c. Endapan coklat yang terbentuk pada pH 8, 10 dan 12 ... 24
5. Efisiensi eliminasi polutan warna... 29
6. Efisiensi eliminasi polutan Ag... 30
7. Efisiensi eliminasi polutan Hg... 31
8. Efisiensi eliminasi polutan Cr... 32
9. Kekeruhan setelah koagulasi ... 33
10. Konsentrasi padatan tersuspensi total setelah koagulasi ... 34
11. Konsentrasi warna setelah koagulasi... 35
12. Konsentrasi Ag setelah koagulasi... 36
13. Konsentrasi Hg setelah koagulasi... 38
Halaman 1. Hasil pengukuran kadar polutan dalam limbah cair laboratorium
setelah koagulasi... 46 2. Sidik ragam... 48 3. Bahan dan alat yang digunakan dalam penelitian... 50
I. PENDAHULUAN
1.1. Latar Belakang
Kegiatan industri dan berbagai aktivitas manusia dapat memicu terjadinya pencemaran karena limbah yang dihasilkan tidak diolah dengan baik sebelum dibuang ke lingkungan. Salah satu contoh aktivitas manusia yang dapat menyebabkan pencemaran adalah kegiatan laboratorium di perguruan tinggi yang merupakan sarana belajar mahasiswa untuk meningkatkan pengetahuan terhadap mata kuliah yang dipelajari bahkan untuk melakukan penelitian.
Laboratorium yang berada di perguruan tinggi merupakan fasilitas penunjang untuk mewujudkan pendidikan, penelitian dan pengabdian masyarakat. Di laboratorium para mahasiswa memperoleh pengalaman praktis guna memahami teori-teori yang dipelajari di bangku kuliah melalui kegiatan praktikum dan pembuatan tugas, sedangkan dosen memerlukan laboratorium untuk memperoleh data ilmiah (Blaauw 1998, diacu dalam Tripuruswati & Trihadiningrum 1999). Dalam kegiatan-kegiatan di laboratorium selalu menghasilkan limbah yang berbentuk padat, cair dan gas. Dalam penelitian ini jenis limbah yang diteliti dibatasi pada limbah cair.
Menurut Metcalf dan Eddy (2004), ada tiga bentuk limbah yaitu limbah cair, limbah padat dan emisi udara. Limbah berbentuk cair atau yang sering disebut air limbah atau limbah cair adalah hasil pemakaian cairan atau air dari suatu komunitas dengan berbagai variasi pemakaiannya. Limbah cair ini berasal dari perumahan, institusi, tempat-tempat komersil dan industri.
Limbah cair yang dihasilkan dari laboratorium yang menggunakan bahan-bahan kimia berasal dari hasil atau sisa reaksi kimia dan air pencucian peralatan. Limbah cair tersebut pada umumnya mempunyai kadar pencemar yang tinggi karena adanya bahan kimia pekat sisa reaksi yang dibuang dalam saluran air buangan. Laboratorium penanganan belum terlalu baik dalam menangani limbah cair yang ada. Hal tersebut bila tidak ditangani dengan baik akan mencemari lingkungan sekitarnya (Tripuruswati & Trihadiningrum 1999). Polutan atau bahan pencemar mengandung gas, bahan-bahan terlarut, partikel bahkan bahan berbahaya dan beracun. Polutan tersebut menyebabkan perubahan fisik, kimia dan
biologis lingkungan bahkan berbahaya bagi kesehatan manusia (Djajadiningrat & Amir 1991; KLH 2002; Effendi 2003 & Sawyer et al. 2003).
Limbah cair laboratorium yang diteliti pada penelitian ini adalah limbah cair yang berasal dari hasil atau sisa analisis COD. Analisis COD menggunakan berbagai bahan kimia seperti K2Cr2O7, Ag2SO4 dan HgSO4 yang berpotensi
mencemari lingkungan.
Dalam penelitian ini dilakukan pengolahan limbah dengan proses koagulasi untuk mengeliminasi konsentrasi polutan yang ada di dalam limbah cair laboratorium yang diteliti. Proses koagulasi adalah proses pengolahan limbah dengan penambahan koagulan ke dalam limbah. Koagulan yang biasa digunakan adalah aluminum sulfat. Penambahan koagulan ini menetralkan muatan negatif yang biasanya terkandung dalam polutan pada limbah cair sehingga terjadi agregasi koloid dalam bentuk flok (Suriawiria 2005 dan Ebeling et al. 2006). Proses koagulasi efektif digunakan pada limbah cair karena polutan yang ada di dalam limbah tidak bisa diendapkan secara konvensional.
Penelitian mengenai eliminasi polutan pada limbah cair dengan proses koagulasi khususnya yang mengandung berbagai jenis logam berat belum banyak dilakukan. Polutan yang dieliminasi pada umumnya adalah polutan fisik dan organik. Salah satu penelitian eliminasi polutan pada limbah cair yang mengandung logam berat adalah penelitian yang dilakukan oleh Agustina et al. (2001) untuk mengeliminasi Zn pada limbah cair industri sepatu. Pada penelitian ini ditemukan eliminasi konsentrasi Zn sebesar 0,03 ppm pada pH 9 dan dosis koagulan 5 ml.
Penelitian lainnya yang dapat menunjukkan eliminasi konsentrasi polutan yang tinggi pada limbah cair dengan proses koagulasi yaitu Al-Mutairi et al. (2004) yang melakukan penelitian pada instalasi limbah tempat pemotongan hewan menemukan penurunan kekeruhan sebesar 76-93% dengan dosis alum 100-1000 mg/L dan pH 4-9. Penelitian lainnya yang dilakukan oleh Ebeling et al. (2006) pada limbah hasil pencucian saringan mikro (microscreen backwash
effluent) menemukan penyerapan padatan (solids) sebesar 82% dan fosfor reaktif
3 Penelitian lainnya yang dilakukan pada kolam budidaya untuk memperbaiki kualitas air kolam budidaya (Ozbay 2005). Penelitian ini menggunakan alum yang dicampur dengan kapur pertanian dengan pengamatan selama 24 jam. Hasil reduksi konsentrasi polutan dalam limbah cair oleh alum dan kapur pertanian dalam limbah cair sebesar 70% setelah 1 jam dan 80% setelah 24 jam dengan parameter kualitas air seperti kekeruhan, padatan tersuspensi dan fosfor.
Pada umumnya penelitian-penelitian diatas dilakukan pada parameter fisik dan bahan organik dengan efisiensi eliminasi polutan yang cukup tinggi. Penelitian mengenai penurunan polutan khususnya yang mengandung bermacam-macam logam berat dan parameter fisik lainnya dari limbah cair laboratorium dengan proses koagulasi masih kurang dilakukan sehingga penelitian ini dilakukan untuk mengetahui kadar penurunan polutan dalam limbah cair laboratorium seperti kekeruhan, padatan tersuspensi total, warna, Ag (perak/silver), Hg (air raksa/merkuri) dan Cr (krom total).
1.2. Perumusan Masalah
Lingkungan yang merupakan habitat makhluk hidup perlu dipertahankan dalam kondisi yang baik namun perkembangan hidup manusia untuk memenuhi segala kebutuhan hidupnya dapat menyebabkan kerusakan lingkungan dan untuk memulihkan lingkungan membutuhkan waktu yang lama dan biaya mahal. Aktivitas manusia akibat perkembangan hidup tersebut dapat menyebabkan terjadinya pencemaran lingkungan. Contohnya laboratorium penelitian yang dapat menjadi sumber pencemar (polutan).
Untuk menangani polutan ini telah dilakukan berbagai teknik pengolahan yang dianggap mampu menurunkan konsentrasi polutan di lingkungan. Salah satu alternatif pengolahan tersebut adalah koagulasi menggunakan alum. Alum mudah diperoleh dan mudah digunakan sehingga banyak dipakai di tempat pengolahan limbah atau bahkan digunakan sendiri di rumah.
Penelitian-penelitian sebelumnya yang menggunakan alum telah memperlihatkan penurunan konsentrasi polutan yang signifikan dengan jenis limbah yang berbeda-beda. Penelitian ini dilakukan untuk mengetahui penurunan konsentrasi polutan maksimum dengan koagulasi kimia menggunakan alum.
Untuk mengetahui penurunan tersebut maka digunakan pH dan dosis alum berbeda. Melalui variasi perlakuan ini dapat diketahui pH dan dosis terbaik untuk menurunkan konsentrasi polutan limbah laboratorium yang diteliti.
1.3. Tujuan
1. Mengetahui efisiensi eliminasi polutan dengan proses koagulasi/flokulasi. 2. Mengetahui pengaruh nilai pH dan dosis alum pada efisiensi eliminasi dari
limbah cair laboratorium dalam proses koagulasi/flokulasi.
1.4. Hipotesis
1. Konsentrasi setiap polutan yang dieliminasi oleh koagulan alum dalam proses koagulasi berbeda-beda.
2. Nilai pH dan dosis alum berpengaruh terhadap efisiensi eliminasi dari limbah cair laboratorium dalam proses koagulasi/flokulasi.
1.5. Manfaat
1. Memperoleh informasi mengenai kemampuan koagulan alum dalam proses koagulasi untuk mengeliminasi beberapa polutan dari limbah cair laboratorium.
2. Memberikan masukan kepada pihak yang berkepentingan sebagai rekomendasi dalam usaha pengolahan limbah cair laboratorium dengan koagulasi khususnya untuk perancangan unit pengolahan limbah cair pada laboratorium.
1.6. Ruang Lingkup
Penelitian skala laboratorium menggunakan peralatan jar test bervolume 500 mL. Limbah cair yang digunakan adalah limbah cair laboratorium hasil sampingan analisis COD. Tempat penelitian di Laboratorium Teknik dan Manajemen Lingkungan (TML), Departemen Teknologi Industri Pertanian (TIN), IPB. Koagulan yang digunakan adalah alum dan perubahan yang diamati adalah perubahan konsentrasi polutan dalam limbah cair laboratorium setelah proses koagulasi.
5
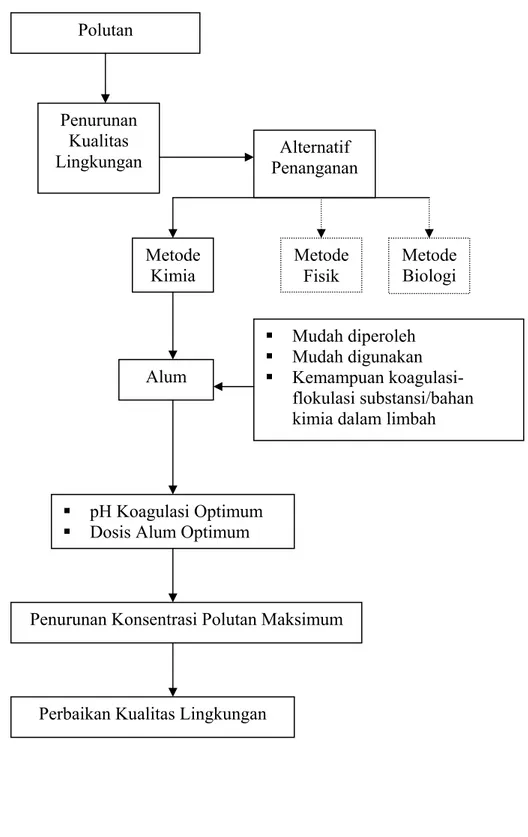
1.7. Kerangka Pemikiran
Polutan menyebabkan penurunan kualitas lingkungan. Untuk mencegah lingkungan tercemar maka polutan harus dikelola agar tidak menambah kerusakan lingkungan. Saat ini telah diketahui berbagai metode pengolahan untuk menurunkan kadar polutan di lingkungan. Metode koagulasi kimia menggunakan alum merupakan salah satu alternatif pengolahan limbah cair selain metode fisik dan biologi.
Alum dengan rumus kimia Al2(SO4)3 merupakan bahan kimia yang mudah
diperoleh dan umum digunakan untuk mengolah limbah industri. Alum mampu mengikat substansi kimia yang berukuran mikro dan diendapkan menjadi flok. Pembentukan flok ini menyebabkan limbah mudah diendapkan, sehingga dapat direduksi dan kerusakan lingkungan akibat limbah cair laboratorium dapat dikurangi atau dicegah.
Polutan Alternatif Penanganan Penurunan Kualitas Lingkungan Alum Metode Fisik Mudah diperoleh Mudah digunakan Kemampuan koagulasi-flokulasi substansi/bahan kimia dalam limbah
Metode Biologi Metode Kimia pH Koagulasi Optimum
Dosis Alum Optimum
Penurunan Konsentrasi Polutan Maksimum
Perbaikan Kualitas Lingkungan
II. TINJAUAN PUSTAKA
2.1. Polutan
Polutan adalah bahan-bahan yang bersifat asing bagi alam atau bahan yang berasal dari alam itu sendiri yang memasuki suatu tatanan ekosistem sehingga mengganggu peruntukan ekosistem tersebut (Effendi 2003). Menurut Manahan (2002) polutan adalah substansi yang melebihi konsentrasi alami sebagai akibat dari aktivitas manusia yang memiliki pengaruh yang merugikan terhadap lingkungannya atau suatu nilai di lingkungan. Polutan dikelompokkan menjadi dua berdasarkan cara masuknya ke dalam lingkungan yaitu polutan alami dan antropogenik. Polutan alami adalah polutan yang memasuki suatu lingkungan secara alami misalnya akibat letusan gunung berapi, tanah longsor, banjir dan fenomena alam lain (Notodarmojo 2005). Polutan antropogenik adalah polutan yang masuk ke badan air akibat aktivitas manusia misalnya kegiatan domestik, perkotaan dan kegiatan industri. Intensitas polutan antropogenik dapat dikendalikan dengan cara mengontrol aktivitas yang disebabkan oleh polutan tersebut.
2.2. Karakteristik Fisik, Kimia dan Biologi Polutan
Polutan yang berada di limbah cair harus diketahui karakteristiknya untuk mempermudah penanganan atau pengolahannya sehingga harus dipahami dengan baik asal limbah cair karena merupakan hal yang penting dalam desain dan operasi dari fasilitas pengumpulan, pengolahan dan pembuangannya. Demikian pula dalam teknik pengelolaan kualitas lingkungan. Perlu ditekankan bahwa pada dasarnya parameter-parameter limbah cair ini saling berhubungan seperti temperatur yang mempengaruhi aktivitas biologi dan jumlah gas terlarut dalam limbah cair itu sendiri. Komposisi fisik, kimia dan biologi limbah cair dapat dilihat pada Tabel 1.
Tabel 1. Karakteristik fisik, kimia, biologi dan sumber limbah cair Karakteristik Sumber Fisik: Warna Bau Padatan Temperatur Kimia: Organik: Karbohidrat
Lemak, minyak dan tumpahan minyak Pestisida Fenol Protein Polutan prioritas Surfaktan
Volatile Organic Compounds (VOC) Lain-lain Anorganik: Alkalinitas Klorida Logam berat Nitrogen pH Fosfor Polutan prioritas Belerang Gas: Hidrogen sulfida Metana Oksigen Biologi: Hewan Tumbuhan Protista: Eubakteria Archaebakteria Virus
Limbah domestik dan rumah tangga, penguraian alami bahan organik
Dekomposisi limbah cair, limbah industri Suplai air domestik, limbah industri dan domestik, erosi tanah, inflow/infiltrasi
Limbah industri dan domestik
Limbah industri, komersil dan domestik Limbah industri, komersil dan domestik Limbah pertanian
Limbah industri
Limbah industri, komersil dan domestik Limbah industri, komersil dan domestik Limbah industri, komersil dan domestik Limbah industri, komersil dan domestik Penguraian alami bahan organik
Limbah domestik, suplai air domestik, infiltrasi air tanah
Limbah domestik, suplai air domestik, infiltrasi air tanah
Limbah industri
Limbah pertanian dan industri
Limbah industri, komersil dan domestik Limbah industri, komersil dan domestik, aliran air alami
Limbah industri, komersil dan domestik
Suplai air domestik, limbah industri, komersil dan domestik
Dekomposisi limbah domestik
Suplai air domestik, infiltrasi air permukaan Perairan dan instalasi pengolahan limbah Perairan dan instalasi pengolahan limbah Limbah domestik, infiltrasi air permukaan, instalasi pengolahan limbah
Limbah domestik, infiltrasi air permukaan, instalasi pengolahan limbah
Limbah domestik
9 Karakteristik biologi, terutama berguna untuk mendeteksi kandungan mikroorganisme dalam air yaitu hewan bersel satu atau protista. Protista adalah hewan yang mampu hidup sendiri dan membuat sel-sel baru untuk regenerasinya. Hewan multiseluler tergolong dalam protista sebab ada satu sel yang bisa hidup sendiri bila dipisahkan. Selain protista, makhluk hidup yang termasuk dalam karakteristik biologi adalah virus, hewan dan tumbuhan (Sugiharto 2005).
Menurut Slamet (2006) protista memiliki efek yang merugikan terhadap kesehatan manusia khususnya dan lingkungan pada umumnya karena berbagai penyakit yang berbahaya dapat tersebar melalui air. Adanya penyebab penyakit di dalam air, dapat menyebabkan efek langsung terhadap kesehatan. Penyebab penyakit yang mungkin ada, dapat dikelompokkan menjadi 2 bagian besar yaitu penyebab hidup, yang menyebabkan penyakit menular dan penyebab tidak hidup yang menyebabkan penyakit tidak menular. Peran air dalam terjadinya penyakit menular dapat bermacam-macam sebagai berikut :
a. Air sebagai penyebar mikroba patogen b. Air sebagai sarang insekta penyebar penyakit
c. Jumlah air bersih yang tersedia tidak mencukupi sehingga orang tidak dapat membersihkan dirinya dengan baik
d. Air sebagai sarang hospes sementara penyakit.
Penyakit menular yang disebabkan air secara langsung dikenal sebagai penyakit bawaan air atau waterborne-disease. Penyakit-penyakit ini hanya dapat menyebar bila mikroba dapat masuk ke dalam sumber air yang dipakai sehari-hari. Sedangkan jenis mikroba yang dapat menyebar melalui air seperti virus, bakteri, protozoa dan metazoa.
Menurut Hilgenkamp (2006), ada 2 jenis epidemi yaitu epidemi umum dan inang ke inang. Epidemi umum disebabkan oleh kontaminasi air dan makanan dari pencernaan manusia. Bakteri, virus dan protozoa merupakan agen epidemi umum seperti antraks, disentri, botulism, brucellosis, kolera, giardiasis, hepatitis dan demam tifoid. Sedangkan epidemi inang ke inang berpindah dari satu inang ke inang lainnya dan untuk menjadi epidemi maka mikroba harus berpindah ke inang yang baru contohnya pada penyakit tuberkulosis.
Mikroba seperti bakteri, virus atau parasit tetap ada di dalam air minum meskipun air minum diperiksa secara teratur. Pada umumnya air minum terkontaminasi bakteri coliform (E. coli) akibat kebocoran pipa setelah dilakukan uji kandungan bakteri oleh instalasi pengolahan air. Bakteri tersebut berasal dari pipa pembuangan yang dialirkan ke badan air dan air permukaan yang terkontaminasi oleh semua materi yang memasuki air permukaan.
Cryptosporidium merupakan parasit lain yang terkandung pada air permukaan.
Parasit penyebab penyakit lainnya adalah Giardia lambia yang mengkontaminasi kotoran hewan dan manusia yang menyebabkan sakit perut dan diare. Infeksi bakteri terjadi sesaat setelah air diminum.
2.2.1. Kekeruhan
Istilah keruh diaplikasikan pada air yang mengandung materi tersuspensi yang menghambat cahaya melewati air atau tingkat visual terbatas. Kekeruhan dapat disebabkan oleh berbagai variasi materi tersuspensi yang bervariasi dalam ukuran mulai dari koloid ke dispersi kasar tergantung pada tingkat turbulensinya. Sungai yang mengalir sampai ke laut akan melewati daerah perkotaan sehingga menambah kadar limbah cair industri dan domestik, baik yang sudah diolah atau belum. Limbah industri tertentu dapat menambah jumlah substansi organik dan substansi anorganik lainnya yang menyebabkan kekeruhan (Metcalf & Eddy 2004).
Air dengan tingkat kekeruhan tinggi sukar disaring sehingga menambah biaya pengolahan. Kekeruhan air juga dapat menghambat proses desinfeksi sehingga kekeruhan air harus dihilangkan dari air yang akan dipergunakan untuk air minum. Berdasarkan sifat pengendapannya, bahan-bahan yang mengakibatkan kekeruhan air yaitu bahan-bahan yang mudah diendapkan (settleable) dan bahan yang sukar mengendap (koloid). Bahan jenis pertama dapat dihilangkan dengan sedimentasi dan filtrasi dan yang kedua dapat dihilangkan dengan proses koagulasi dan filtrasi diikuti proses sedimentasi dan filtrasi yang memerlukan penambahan koagulan dalam air (Suriawiria 2008).
11
2.2.2. Padatan Tersuspensi Total
Sumber utama padatan tersuspensi adalah fasilitas yang membuang berbagai macam padatan termasuk yang menghasilkan BOD. Kandungan padatan tersuspensi di dalam air sangat tinggi. Tingginya kandungan padatan tersuspensi tersebut dapat merusak kehidupan ekosistem di dalam air tersebut. Di dalam udara juga padatan tersuspensi merupakan penyebab masalah kesehatan tertinggi. Hal yang sama juga adalah padatan tersuspensi dalam aliran air tanah yang mengalir ke dalam air yang juga dapat merusak kehidupan ekosistem di dalam air tersebut. Peningkatan kandungan padatan tersuspensi membuat air makin keruh atau kabur sehingga membatasi cahaya matahari mencapai tumbuhan air dan menghambat pertumbuhannya.
Padatan tersuspensi, selain membahayakan respirasi hewan air pada umumnya, juga dapat menyebabkan gangguan pada insang ikan karena insang luka akibat bergesekan dengan padatan tersuspensi sehingga epitelium insang menebal dan mengembang sebagai respons pertahanan hidup karena adanya padatan tersuspensi yang masuk ke dalam insang tersebut (Slanina 1962, diacu dalam Alabaster & Lloyd 1980). Insang yang bergesekan dengan padatan tersuspensi dalam waktu yang singkat dapat membahayakan ikan meskipun tidak memiliki efek letal (Herbert & Merkens 1961, diacu dalam Alabaster & Lloyd 1980). Padatan tersuspensi juga dapat bercampur dengan air yang didisinfeksi sehingga melindungi mikroorganisme dari disinfektan. Mikroorganisme yang bertahan hidup tersebut dapat mengkontaminasi air (Hill 2004).
Penentuan padatan tersuspensi penting dalam analisis polusi air. Parameter ini merupakan salah satu parameter utama untuk mengevaluasi kandungan limbah cair domestik dan menentukan efisiensi unit pengolahan limbah (Sawyer et al. 2003).
2.2.3. Warna
Warna alami air berada dalam bentuk partikel koloid bermuatan negatif sehingga penyerapan warna dapat dengan mudah dilakukan melalui koagulasi dengan penambahan garam yang mengandung ion logam trivalen seperti aluminum. Air permukaan dapat terlihat sangat berwarna karena adanya materi tersuspensi berwarna tetapi dalam kenyataannya tidak berwarna. Warna yang disebabkan materi tersuspensi merupakan warna yang bukan sebenarnya (apparent color) dan berbeda dari warna yang disebabkan oleh daun-daunan atau bahan organik yang berbentuk koloid sehingga disebut warna yang sebenarnya (true color). Pada analisis air penting untuk membedakan warna sebenarnya dan bukan sebenarnya (Sawyer et al. 2003).
Dilihat dari segi estetika, konsumen pada umumnya tidak mau meminum air yang berwarna. Warna yang berasal dari bahan-bahan buangan industri kemungkinan dapat membahayakan kesehatan. Warna dalam air juga dapat menunjukkan kemungkinan hadirnya senyawa-senyawa organik yang bila dilakukan proses klorinasi terhadap air tersebut akan mengakibatkan terbentuknya kloroform. Senyawa-senyawa organik tersebut dapat meningkatkan pertumbuhan mikroorganisme akuatik (Suriawiria 2008).
2.2.4. Perak (Ag)
Perak atau argentum (Ag) adalah logam berwarna putih. Perak ditemukan pada industri alloy, keramik, gelas, fotografi, cermin dan cat rambut. Perak akan menjadi sangat korosif bila terikat pada nitrat. Senyawa perak berbentuk debu dapat menimbulkan iritasi kulit dan terakumulasi di dalam berbagai organ bila masuk ke dalam tubuh sehingga menimbulkan pigmentasi kelabu atau penghitaman kulit yang disebut argyria. Pigmentasi ini bersifat permanen karena tubuh tidak dapat mengekskresikannya (Slamet 2006).
13
2.2.5. Merkuri (Hg)
Merkuri merupakan satu-satunya logam berbentuk cair pada suhu ruang. Kadar merkuri di kulit bumi adalah 0,1 – 1 ppm. Merkuri mempunyai tiga valensi yaitu valensi 0, I dan II. Merkuri memiliki beberapa bentuk tetapi bentuk utamanya adalah HgS (cinnabar) yang stabil. Unsur merkuri dalam bentuk cinnabar dapat mengalami oksidasi dan mengeluarkan uap merkuri. Merkuri dalam bentuk senyawa organik dan anorganik bersifat sangat toksik (Landis & Yu 2004; Notodarmojo 2005; Eisler 2006). Hg anorganik dapat berubah menjadi organik dan sebaliknya karena terjadi interaksi dengan mikroba. Genus
Pseudomonas dan Neurospora dapat mengubah Hg anorganik menjadi organik. Staphylococcus aureus dapat mereduksi Hg2+ menjadi unsur Hg (Slamet 2006).
2.2.6. Krom (Cr)
Krom adalah logam kelabu yang keras, ditemukan pada industri gelas, logam, fotografi dan pelapisan logam. Krom dalam bentuk unsur sebenarnya tidak beracun tetapi bila berada dalam bentuk senyawa maka sangat iritan dan korosif sehingga menimbulkan ulcus yang dalam pada kulit dan selaput lendir. Inhalasi krom dapat menimbulkan kerusakan pada tulang hidung. Di dalam paru-paru, krom dapat menimbulkan kanker (Slamet 2006).
Di dalam air, krom terlarut berada dalam bentuk kromat [Cr(VI)] dan dalam bentuk trivalen [Cr(III)] terhidrolisis seluruhnya dalam air dan krom tersebut mengendap sebagai hidroksida sehingga kandungan kromium dalam larutan hanya tertinggal sedikit. Krom III tidak berbahaya bagi kesehatan manusia. Krom digunakan secara ekstensif dalam industri untuk membuat campuran logam, kaca pembesar, katalis, krom oksida dan garam kromat. Krom oksida digunakan untuk memproduksi asam kromat dam industri pelapisan logam. Garam kromat digunakan pada cat dan menghasilkan larutan pembersih di laboratorium. Keracunan kromat dapat menyebabkan kelainan kulit dan kerusakan hati bahkan menyebabkan kanker (karsinogen) (Sawyer et al. 2003).
2.3. Alum
Koagulan yang paling populer dalam aplikasi pengolahan limbah adalah aluminum sulfat atau alum yang dapat diperoleh dalam bentuk cairan atau padat. Alum adalah suatu garam yang bila dimasukkan ke dalam cairan akan menghasilkan endapan aluminum hidroksida. Alum bersifat amfoter artinya dapat larut dalam basa dan asam kuat (Eckenfelder 2000; Sawyer et al. 2003).
Menurut Eckenfelder (2002), reaksi yang terjadi ketika alum dimasukkan ke dalam air adalah :
Al2(SO4)3 + 6H2O → 2Al(OH)3 + 3H2SO4
Menurut Chang (2002), Al(OH)3 bereaksi dengan asam dan basa dengan
reaksi sebagai berikut :
Al(OH)3(s) + 3H+(aq) → Al3+(aq) + 3H2O(l)
Al(OH)3(s) + OH-(aq) ↔ Al(OH)4-(aq)
Tingginya kelarutan Al(OH)3 dalam medium basa adalah hasil dari
pembentukan ion kompleks Al(OH)4- karena Al(OH)3 bertindak sebagai asam
Lewis dan OH- sebagai basa Lewis.
Menurut Sawyer et al. (2003) kemampuan alum untuk larut dalam basa dan asam kuat merupakan hal yang penting dalam koagulasi karena ion pada alum, basa dan asam kuat bereaksi membentuk kompleks ion yang bertambah atau berkurang karena penambahan basa dan asam kuat sampai reaksi menjadi netral dan terbentuk endapan. Reaksi yang terjadi pada ion Al3+ dan OH- adalah :
Al3+ + OH- ↔ Al(OH)2+ Al(OH)2+ + OH- ↔ Al(OH)2+
Al(OH)2+ + OH- ↔ Al(OH)3(aq)
Al(OH)3 + OH- ↔ Al(OH)4
-Konsentrasi OH- rendah ketika dalam kondisi asam dan ion yang berada dalam larutan adalah ion positif yaitu Al3+ dan Al(OH)4+ dan jika dalam kondisi
basa maka konsentrasi OH- akan bertambah sehingga ion ini akan menambah jumlah ion kompleks alum sampai muatan ion menjadi netral dan terbentuk ion Al(OH)3 yang kemudian mengendap dalam larutan. Basa yang terus menerus
ditambahkan akan meningkatkan konsentrasi OH- dalam larutan sehingga terbentuk ion negatif Al(OH)4- yang mudah larut.
15
2.4. Koagulasi
Pada umumnya pengendapan gravitasi digunakan untuk mengendapkan partikel yang besar sehingga terpisah dari limbah cair. Limbah cair mengandung partikel besar dan kecil yang berasal dari batuan, tanah dan dekomposisi hewan dan tanaman air. Partikel kecil melayang di dalam air dalam bentuk koloid sehingga tidak bisa diendapkan secara konvensional. Koloid ini berukuran 0,001 – 1 µm yang terdiri dari kelompok molekul atau ion yang memiliki ikatan lemah. Kelompok ini tidak berada dalam bentuk ion atau molekul tunggal tetapi dalam sebuah unit. Ion atau molekul tunggal tersebut dalam partikel koloid terorganisir secara spasial sehingga permukaan partikel berisi kelompok ion. Muatan ion pada permukaan salah satu partikel menolak muatan-muatan ion pada partikel yang berdekatan sehingga mencegah agregasi dan pembentukan endapan (Baird & Cann 2005).
Koloid harus dihilangkan dari limbah cair karena alasan estetika dan kesehatan. Koloid dapat dihilangkan dari limbah cair melalui proses koagulasi yaitu dengan penambahan koagulan seperti alum. Pada pH netral atau basa (≥7) ion-ion Al3+ yang dihasilkan dari garam-garam koagulan tersebut membentuk hidroksida gelatin yang secara fisik menggabungkan partikel dan membentuk endapan yang terpisah dengan cairan sehingga mudah diangkat dari cairan. Menurut Sawyer et al. (2003), dalam koagulasi, koloid didestabilisasi sehingga mereka berkumpul atau berkoagulasi menjadi partikel yang lebih besar sehingga koloid tersebut dapat dengan mudah diendapkan.
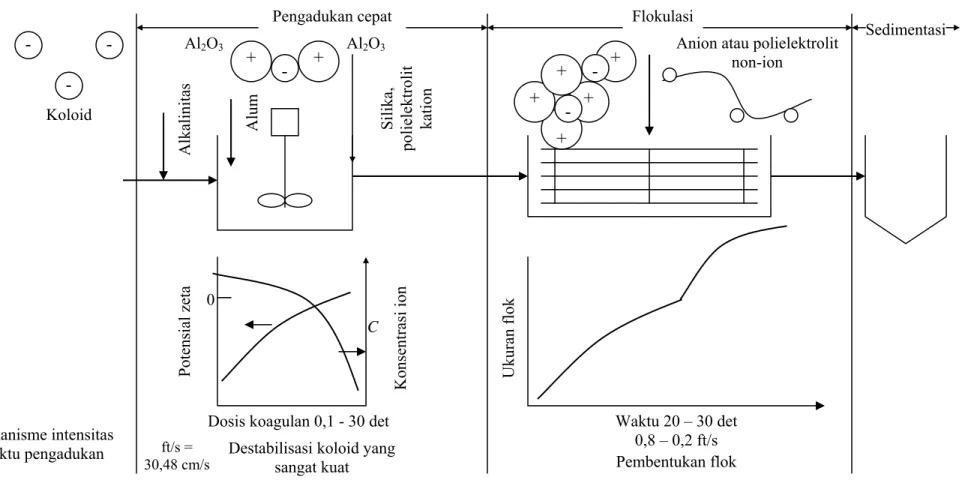
Menurut Eckenfelder (2000), koagulasi terdiri dari 2 mekanisme dasar : 1. Perikinetik atau elektrokinetik adalah reduksi potensial zeta oleh ion dan
koloid dengan muatan berlawanan yang terjadi karena adanya gaya tarik van der Waals.
2. Ortokinetik adalah agregasi misel sehingga membentuk gumpalan yang menggaglomerasi partikel koloid.
Penambahan kation valensi tinggi menekan muatan partikel dan lapisan ganda sehingga menurunkan nilai potensial zeta dan jika koagulan terlarut, kation bertindak menetralisir muatan negatif koloid. Hal ini terjadi sebelum pembentukan flok yang dapat dilihat secara fisik dan pengadukan cepat saat
proses koagulasi dengan pelindung yang masih efektif dalam fase ini. Flok mikro kemudian terbentuk yang menahan muatan positif dalam kondisi asam karena adsorpsi ion H+. Flok mikro ini juga bertindak menetralkan dan melindungi partikel koloid. Flokulasi mengagglomerasi koloid dengan flok hidroksida. Dalam fase ini adsorpsi permukaan juga aktif. Koloid yang pada awalnya tidak diadsorpsi, hilang karena terperangkap dalam flok (Eckenfelder 2000). Mekanisme koagulasi ini dapat dilihat pada Gambar 2.
17
Sedimentasi
Gambar 2. Mekanisme koagulasi (Eckenfelder 2000)
- -Mekanisme intensitas waktu pengadukan Koloid Alkalinitas Alum -Pengadukan cepat + + Al2O3 Silika, polielektrolit kation 0 C Konsentrasi ion
Dosis koagulan 0,1 - 30 det Destabilisasi koloid yang
sangat kuat Flokulasi -+ + + + +
Anion atau polielektrolit non-ion Waktu 20 – 30 det 0,8 – 0,2 ft/s Pembentukan flok Ukuran flok Al2O3 ft/s = 30,48 cm/s Potensial zeta
3.1. Tempat dan Waktu
Penelitian dilakukan di Laboratorium Teknik dan Manajemen Lingkungan (TML), Departemen Teknologi Industri (TIN), IPB pada bulan Juni-Juli 2008.
3.2. Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini yaitu limbah cair laboratorium dari sisa (residu) analisis COD, alum p.a. (pro analysi), NaOH dan H2SO4 untuk menaikkan dan menurunkan pH. Bahan-bahan kimia lain untuk
analisis kekeruhan, warna, padatan tersuspensi total dan analisis logam.
Alat-alat yang digunakan dalam penelitian ini yaitu VELP scientifica test di
cessione C6F jar test apparatus (peralatan jar test), pompa peristaltik, gelas piala
dan alat-alat gelas lainnya, buret, pH meter, botol plastik untuk wadah sampel, spektrofotometer direct reading (DR) 2000 dan atomic absorption
spectrophotometry (AAS).
3.3. Rancangan Percobaan
Rancangan percobaan yang digunakan adalah rancangan acak lengkap (RAL) faktorial 2 faktor. Faktor 1: pH koagulasi yang terdiri dari 4 taraf yaitu 6, 8, 10 dan 12. Faktor 2: dosis alum yang terdiri dari 3 taraf yaitu kontrol (tanpa penambahan alum), 20 mg/L dan 30 mg/L. Percobaan diulang sebanyak 2 kali sehingga secara keseluruhan terdiri dari 24 satuan percobaan (4x3x2).
19
Gambar 3. Jar test
Model matematik (Hines & Montgomery 1990; Srivastava 2002) untuk percobaan ini adalah sebagai berikut :
Yij = µ + Ai + Bj + (AB)ij + εij
Yijk = Nilai respon pada pH koagulasi ke-i, dosis alum ke-j dan ulangan
ke-k
µ = Pengaruh rata-rata
Ai = Pengaruh faktor pH koagulasi ke-i (i = 6, 8, 10, 12)
BBj = Pengaruh faktor dosis alum ke-j (j = kontrol, 20 mg/L, 30 mg/L)
(AB)ij = Pengaruh interaksi taraf, pH koagulasi dan taraf ke-j dosis alum
3.4. Tahap Pelaksanaan
1) Karakterisasi Limbah Cair Laboratorium Hasil Analisis COD
Karakterisasi limbah cair ini dilakukan sebelum dan sesudah perlakuan. Parameter-parameter yang dianalisis yaitu kekeruhan (NTU), padatan tersuspensi total (mg/L), warna (PtCo), Ag (mg/L), Hg (mg/L) dan Cr (mg/L). Karakterisasi limbah cair ini dilakukan untuk mengetahui konsentrasi setiap polutan dalam limbah cair. Analisis parameter dilakukan sesuai dengan Standard Methods (APHA 1998).
2) Jar Test
Pertama-tama limbah cair laboratorium diencerkan sampai 6 kali. Kemudian diambil sebanyak 3000 mL. Setelah itu diatur pH sesuai dengan pH yang diteliti menggunakan pH meter. Kemudian limbah 3000 mL tersebut yang sudah diatur pH-nya dituangkan ke dalam 6 gelas piala masing-masing sebanyak 500 mL. Ke-6 gelas piala tersebut masing-masing diberi dosis 0 mg/L (tanpa penambahan alum) kode gelas 0; 15 mg/L kode gelas 1; 20 mg/L kode gelas 2; 25 mg/L kode gelas 3; 30 mg/L kode gelas 4 dan 35 mg/L kode gelas 5. Setelah itu ke-6 gelas piala tersebut diletakkan dalam peralatan jar test.
Jar test dilakukan dengan pengadukan lambat dan cepat untuk mempercepat percampuran limbah dengan alum untuk memaksimalkan efektivitas destabilisasi koloid dan inisiasi koagulasi (Ebeling et al. 2006). Setelah 5 menit kemudian maka terbentuk flok. Setelah itu limbah dibiarkan selama 30 menit - 1 jam sampai flok yang terbentuk mengendap dengan baik. Supernatan yaitu cairan limbah yang telah diberi perlakuan koagulasi kemudian dianalisis menggunakan spektrofotometer DR 2000 untuk mengetahui konsentrasi kekeruhan, warna dan padatan tersuspensi total serta AAS untuk mengetahui perubahan konsentrasi logam. Jar test yang dilakukan dapat dilihat pada Gambar 3.
21
3.5. Perhitungan Efisiensi Eliminasi Polutan (Rehm dan Reed 1986)
Efisiensi eliminasi polutan dihitung dengan persamaan : Efisiensi (%) = C0 – Ce x 100% Ce dengan : C0 = konsentrasi influen Ce = konsentrasi efluen 3.6. Analisis Data
Data yang diperoleh dianalisis dengan analisis ragam untuk mengetahui ada tidaknya pengaruh faktor-faktor perlakuan tunggal dan interaksinya. Perlakuan yang memiliki pengaruh nyata, dilakukan uji lanjut untuk nilai rataan masing-masing taraf perlakuan. Uji nilai rataan dilakukan dengan Uji jarak berganda Duncan (duncan multiple range test-DMRT) untuk mengetahui perlakuan tunggal atau interaksi yang berpengaruh nyata (Steel & Torrie 1960; Mattjik & Sumertajaya 2000).
4.1. Karakteristik Limbah Cair Laboratorium
Karakteristik limbah cair laboratorium ini adalah jenis atau ciri limbah cair laboratorium yang diteliti. Berdasarkan kandungan polutan yang ada di dalam limbah cair ini maka limbah ini tergolong limbah asam karena analisis COD yang dilakukan menggunakan bahan-bahan kimia yang mengandung asam yaitu asam sulfat dan ion sulfat selain itu dapat digolongkan beracun karena mengandung logam berat krom, merkuri dan perak pada senyawa yang digunakan pada analisis COD.
Limbah cair ini berwarna bening kebiruan dengan pH 2. Bahan-bahan kimia yang terkandung di dalam limbah cair ini dapat digolongkan sebagai limbah berbahaya dan beracun jika tidak diolah sebelum dibuang ke lingkungan. Analisis COD menggunakan bahan-bahan kimia seperti kalium permanganat (K2Cr2O7),
perak sulfat (Ag2SO4.H2SO4), ferro amonium sulfat [Fe(NH4)2(SO4)2.6H2O], asam
sulfat pekat (H2SO4), kristal merkuri sulfat (HgSO4) dan indikator ferroin (APHA
1998).
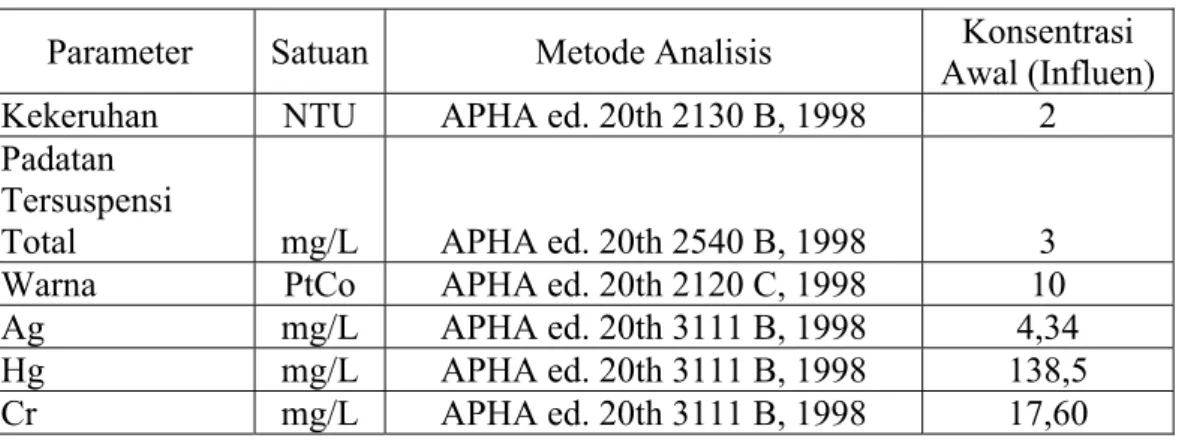
Tabel 2. Karakteristik limbah cair laboratorium
Parameter Satuan Metode Analisis Awal (Influen)Konsentrasi Kekeruhan NTU APHA ed. 20th 2130 B, 1998 2 Padatan
Tersuspensi
Total mg/L APHA ed. 20th 2540 B, 1998 3
Warna PtCo APHA ed. 20th 2120 C, 1998 10
Ag mg/L APHA ed. 20th 3111 B, 1998 4,34
Hg mg/L APHA ed. 20th 3111 B, 1998 138,5
23 Berdasarkan kandungan polutan yang dijelaskan maka untuk mengetahui jumlah konsentrasi polutan yang ada di dalam limbah cair ini maka dilakukan pengukuran awal terhadap kekeruhan, padatan tersuspensi total, warna, Ag, Hg dan Cr. Setelah itu hasil pengukuran awal dibandingkan dengan hasil pengukuran sesudah koagulasi untuk mengetahui kecenderungan penurunan atau kenaikan konsentrasi setiap parameter. Karakteristik limbah cair laboratorium ini dapat dilihat pada Tabel 2.
4.2. Perubahan Fisik Larutan selama Koagulasi
Pada pH 6 dengan dosis 0 mg/L terbentuk endapan berwarna coklat [Al(OH)3] dan larutan berwarna kuning (CrO42-) demikian pula pada dosis 20
mg/L dan 30 mg/L (Gambar 4a). Hal ini juga terjadi pada pH 8, pH 10 dan pH 12 dengan dosis yang sama tetapi endapan [Al(OH)3] dan larutannya berwarna coklat
(Al3+) (Gambar 4b dan 4c). Perubahan warna yang terjadi selama proses koagulasi dapat disebabkan oleh penambahan bahan-bahan kimia dalam larutan namun setelah diendapkan selama 30 menit sampai 1 jam warna larutan menjadi bening dengan sedikit flok dan flok yang mengendap semuanya berwarna coklat pada setiap variasi pH dan dosis yang diberikan.
Gambar 4a. Larutan berwarna kuning dan endapan coklat yang terbentuk pada pH 6
Gambar 4b. Larutan berwarna coklat yang terbentuk pada pH 8, 10 dan 12
25
4.3. Pengaruh pH dan Dosis Koagulan Alum dalam Koagulasi
pH merupakan karakteristik yang sangat penting yang mempengaruhi keefektivan koagulasi karena pengaturan pH menentukan tingkat eliminasi polutan dari limbah cair. Pengaturan pH dilakukan dengan menambahkan basa kuat (NaOH) dan asam kuat (H2SO4). Basa kuat dan asam kuat digunakan dalam
koagulasi karena keduanya terionisasi sempurna dalam cairan. Menurut teori ionisasi Arrhenius, basa kuat dan asam kuat dalam suatu senyawa akan terurai menjadi ion apabila berada dalam cairan. Ion-ion dari basa kuat dan asam kuat dapat berinteraksi dengan berbagai zat kimia yang berada dalam cairan. Interaksi ini terjadi agar reaksi berbagai zat kimia dalam cairan tersebut mencapai kesetimbangan (Sawyer et al. 2003).
Pada kondisi asam, konsentrasi OH- dalam larutan sedikit dan ion-ion yang berada dalam larutan adalah ion-ion positif seperti Al3+ dan pada kondisi basa, konsentrasi OH- akan meningkat dan ion-ion ini akan semakin menambah kompleksitas aluminum sehingga larutan menjadi netral sampai terbentuk Al(OH)3 padat yang mengendap dalam larutan. Basa kuat yang terus menerus
ditambahkan akan semakin meningkatkan konsentrasi OH- sehingga terbentuk ion Al(OH)4- yang terlarut dalam larutan.
Hidroksida alum dapat larut dalam asam dan basa sehingga disebut hidroksida amfoter. Hidroksida amfoter bereaksi dengan hidroksida dari basa kuat juga asam kuat membentuk suatu kumpulan ion kompleks. Kompleks yang terbentuk pada kondisi asam atau basa adalah ion-ion bermuatan yang mudah larut dalam cairan. Ion-ion yang terbentuk pada kondisi ini adalah ion-ion netral dan larut dalam cairan.
Dosis alum juga mempengaruhi koagulasi. Dosis yang terlalu tinggi menyebabkan alum tidak hanya menetralkan muatan negatif pada partikel tetapi menambah jumlah muatan positif yang memiliki kecenderungan gaya tarik yang sama antar partikel seperti pada kondisi awal limbah (Ebeling et al. 2006).
Endapan hidroksida dengan cepat terbentuk bila dosis alum sangat tinggi. Mekanisme eliminasi yang terjadi disebut tumbukan partikel (sweep floc) karena partikel koloid terperangkap dalam presipitat logam sehingga hilang dari larutan. Reaksi yang terjadi dalam mekanisme eliminasi ini sangat kompleks karena
banyaknya kompleks hidroksida yang dapat terbentuk ketika alum ditambahkan pada larutan. Kompleks hidroksida berinti banyak tersebut mempengaruhi kelarutan alum dalam larutan. Koagulasi biasanya baik dilakukan pada pH dengan kelarutan terendah (Sawyer et al. 2003).
Al(III) dalam kuantitas yang tepat bila ditambahkan pada larutan akan membentuk presipitat hidroksida [Al(OH)3]. Partikel koloid dapat menyediakan
tempat kondensasi sehingga presipitat dapat terbentuk dan oleh karena itu koloid terperangkap dalam presipitat dan berada dalam presipitat tersebut. Presipitat juga dapat menangkap koloid yang melewatinya, mengumpulkannya dan menghilangkannya dari air.
Al(III) yang digunakan dalam koagulasi limbah cair untuk menghilangkan warna dan kekeruhan dapat berfungsi sebagai koagulan melalui beberapa mekanisme. Ketika Al(III) ditambahkan ke dalam limbah cair, Al(III) terionisasi menjadi trivalen, ion logam bebas (Al3+), jumlah dan keberadaan yang merupakan fungsi karakteristik air yaitu pH dan alkalinitas. Beberapa ion logam tidak diragukan mencapai target dan menetralkan muatan partikel koloid. Mayoritas ion logam trivalen bergabung dengan ion hidroksida membentuk berbagai hidroksida kompleks seperti kompleks inti banyak [Al13(OH)345+] yang sebagian besar
membawa muatan positif dan dapat terjerap ke dalam koloid yang menyebabkan netralisasi dan tekanan lapisan ganda. Koloid yang didestabilisasi ini berkumpul membentuk partikel yang makin besar yang langsung mengendap. Jika jumlah kompleks hidroksida bermuatan positif lebih dari yang dibutuhkan untuk bereaksi dengan partikel warna atau kekeruhan yang negatif, pembalikan muatan dapat terjadi karena muatan yang berlawanan dari koloid dan kompleks hidroksida saling membatalkan sehingga terjadi koagulasi. Ion positif yang berlebihan ini menyebabkan pembalikan muatan dan akhirnya terbentuk partikel bermuatan positif yang stabil.
Koloid hidrofobik biasanya langsung mengalami koagulasi dengan penambahan kuantitas garam yang mengkontribusi ion pada larutan. Koloid tersebut distabilkan oleh tekanan elektrostatik. Oleh karena itu penjelasan sederhana mengenai koagulasi oleh ion dalam larutan adalah bahwa ion mereduksi tekanan elektrostatik antara partikel sebesar mungkin sehingga partikel
27 mengalami agregasi karena muatan listrik lapisan ganda dikelilingi oleh partikel bermuatan maka mekanisme agregasi ini disebut tekanan lapisan ganda. Ion positif yang terikat pada permukaan negatif koloid dapat menyebabkan presipitasi yang diikuti oleh restabilisasi koloid. Netralisasi awal muatan permukaan negatif pada partikel melalui serapan ion positif menyebabkan terjadinya koagulasi dan jika sumber ion positif semakin banyak ditambahkan, serapannya menyebabkan pembentukan partikel koloid positif (Manahan 2000).
Flok alum kurang larut pada pH 7. Muatan flok positif di bawah pH 7,6 dan negatif di atas pH 8,2. Diantara dua batas pH ini muatan flok tercampur. Dosis alum yang tingi dapat menyebabkan tambahan presipitasi dari flok alum tergantung pada pH flokulasi (Eckenfelder 2000).
Endapan yang dihilangkan dalam limbah cair biasanya menggunakan teknik pemisahan fisik seperti sedimentasi atau filtrasi. Koagulan atau flokulan dapat ditambahkan pada campuran untuk mempercepat pemisahan presipitat dari fase larutan. Contoh koagulan anorganik yang biasa digunakan adalah aluminum sulfat (alum). Proses presipitasi biasanya dilakukan untuk menghilangkan ion anorganik terlarut terutama logam. Sejumlah anion cocok untuk direaksikan dengan logam. Anion ini bervariasi sesuai dengan kecepatan reaksi, toksisitas dan biayanya. Hal utama dalam pengendapan ion logam terlarut adalah melalui pembentukan hidroksida. Sumber ion hidroksida dapat berasal dari NaOH, Na2CO3 atau
Ca(OH)2. Jika logam terlarut bereaksi dengan senyawa alkali maka sebagian besar
4.4. Efisiensi Eliminasi Polutan
Kemampuan koagulan alum dalam eliminasi polutan dari limbah cair dengan proses koagulasi dapat diketahui pada efisiensi eliminasi limbah cair melalui persentase perubahan atau penurunan konsentrasinya. Perhitungan efisiensi ini dapat menjadi ukuran atau pertimbangan pemakaian dosis alum pada limbah cair yang diteliti jika digunakan dalam skala besar (Satterfield 2005). Polutan yang dibahas dalam efisiensi eliminasi polutan ini adalah polutan yang memiliki eliminasi konsentrasi yang signifikan yaitu konsentrasi polutan yang mengalami penurunan dari konsentrasi polutan awal.
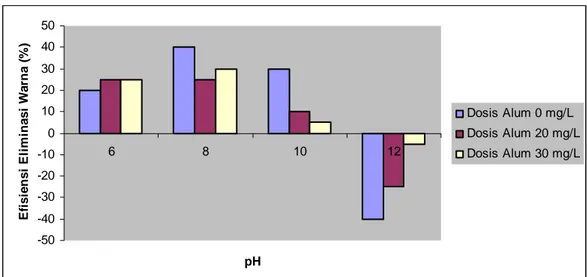
4.4.1. Efisiensi Eliminasi Polutan Warna
Efisiensi eliminasi polutan warna adalah efisiensi perubahan konsentrasi polutan warna pada pengukuran awal setelah mengalami proses koagulasi. Gambar 5 menunjukkan bahwa koagulan alum kurang efisien dalam menurunkan konsentrasi polutan warna. Pada dosis 0 mg/L efisiensi eliminasi polutan meningkat tajam dengan pencapaian tertinggi pada pH 8 (40%). Efisiensi ini juga menurun dengan tajam sejalan dengan makin meningkatnya pH (basa). Hal ini berbeda dengan dosis 30 mg/L yang memiliki efisiensi eliminasi polutan yang agak stabil karena efisiensinya pada pH 12 hanya -5% jika dibandingkan dengan efisiensi pada dosis 0 mg/L dengan peningkatan sampai -25%.
Grafik memperlihatkan bahwa dosis alum yang ditambahkan dapat meningkatkan efisiensi eliminasi polutan meskipun tidak signifikan artinya ada peningkatan efisiensi eliminasi polutan meskipun berada di daerah negatif pada grafik. Dosis alum 0 mg/L jika dibandingkan dengan dosis 20 mg/L dan 30 mg/L berada paling bawah di daerah grafik diikuti dengan dosis 20 mg/L kemudian dosis 30 mg/L dengan efisiensi tertinggi.
Menurut Sawyer et al. (2003) intensitas warna meningkat sejalan dengan kenaikan pH. Hal ini memang dapat dilihat pada grafik tetapi itu berarti polutan warna tidak mengalami penurunan. Air berwarna alami adalah air yang berwarna kuning kecoklatan. Limbah cair yang masih baru biasanya berwarna coklat kelabu terang tetapi warna limbah bisa berubah menjadi lebih gelap jika berada dalam kondisi anaerobik dalam waktu lama. Warna ini disebabkan karena adanya
29 kandungan sulfida logam yang terbentuk saat sulfida bereaksi dengan logam dalam limbah (Metcalf & Eddy 2004).
-50 -40 -30 -20 -10 0 10 20 30 40 50 6 8 10 12 pH E fi s ie n s i E limin a s i W a rn a ( % ) Dosis Alum 0 mg/L Dosis Alum 20 mg/L Dosis Alum 30 mg/L
Gambar 5. Efisiensi eliminasi polutan warna
Limbah cair yang diteliti berwarna bening kebiruan dengan pH yang sangat asam tetapi setelah pH dinaikkan maka warna limbah cair menjadi coklat. Warna bening atau jernih suatu limbah cair atau air tidak menjamin bahwa limbah cair atau air itu tidak mengandung polutan berbahaya dan beracun (Suriawiria 2008). Warna coklat pada larutan diduga disebabkan oleh penambahan NaOH dan ion Al3+ yang berada dalam larutan. Al3+ adalah ion bebas yang mempengaruhi agregasi koloid yaitu produk hidrolisisnya (Stumm & Morgan 1962; Stumm & O’Melia 1968, diacu dalam Metcalf & Eddy 2004).
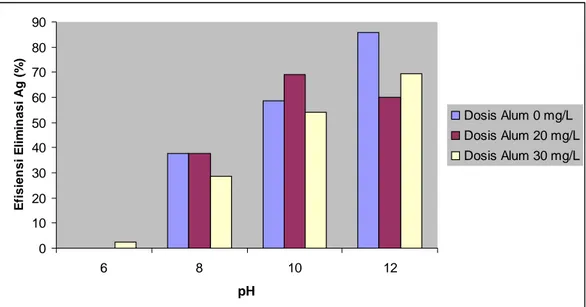
4.4.2. Efisiensi Eliminasi Polutan Perak (Ag)
Efisiensi eliminasi polutan argentum adalah efisiensi perubahan konsentrasi polutan argentum pada pengukuran awal setelah mengalami proses koagulasi. Gambar 6 menunjukkan efisiensi eliminasi Ag semakin tinggi sejalan dengan naiknya pH kecuali pada dosis 20 mg/L yang turun cukup drastis pada pH 12 (60,14%). Secara umum dapat dilihat pada grafik bahwa koagulan alum cukup efisien dalam menurunkan konsentrasi Ag pada limbah cair yang diteliti meskipun dosis 0 mg/L merupakan dosis terbaik dalam menurunkan konsentrasi Ag (85,71%). Hal ini berarti meskipun tanpa penambahan alum konsentrasi Ag pada
limbah cair dapat mengalami penurunan konsentrasi hingga tingkat yang cukup rendah. Dosis alum 30 mg/L juga cukup efisien dalam menurunkan konsentrasi polutan meskipun tidak sebaik dosis 0 mg/L karena dapat mencapai efisiensi eliminasi 69,58% pada pH 12. Pada pH 12 penurunan konsentrasi polutan Ag sangat efisien dilakukan.
0 10 20 30 40 50 60 70 80 90 6 8 10 12 pH E fis ie n s i E lim in a s i A g ( % ) Dosis Alum 0 mg/L Dosis Alum 20 mg/L Dosis Alum 30 mg/L
Gambar 6. Efisiensi eliminasi polutan Ag
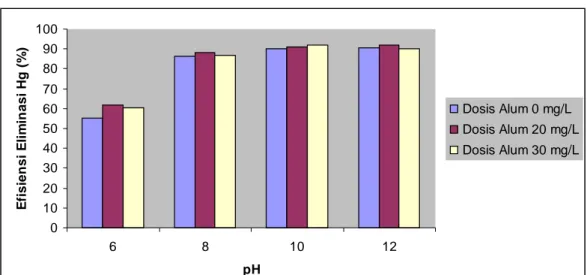
4.4.3. Efisiensi Eliminasi Polutan Merkuri (Hg)
Efisiensi eliminasi polutan merkuri adalah efisiensi perubahan konsentrasi polutan merkuri pada pengukuran awal setelah mengalami proses koagulasi. Gambar 7 menunjukkan efisiensi eliminasi Hg yang semakin tinggi sejalan dengan naiknya pH tetapi pada pH 12 efisiensi eliminasi mengalami penurunan. Secara umum dapat dilihat pada grafik bahwa koagulan alum efisien dalam menurunkan konsentrasi Hg dalam limbah cair. Dosis yang semakin besar semakin besar pula efisiensi eliminasi polutannya. Efisiensi eliminasi tertinggi sebesar 92,06% diperoleh pada pH 10 dengan dosis 30 mg/L. Hal ini berarti penurunan konsentrasi polutan Hg sangat efisien dilakukan pada pH basa dengan dosis alum yang tinggi karena semakin tinggi pH maka semakin rendah konsentrasi Hg dalam larutan (Baird & Cann 2005).
31 0 10 20 30 40 50 60 70 80 90 100 6 8 10 12 pH E fisi e n s i E lim in asi H g ( % ) Dosis Alum 0 mg/L Dosis Alum 20 mg/L Dosis Alum 30 mg/L
Gambar 7. Efisiensi eliminasi polutan Hg
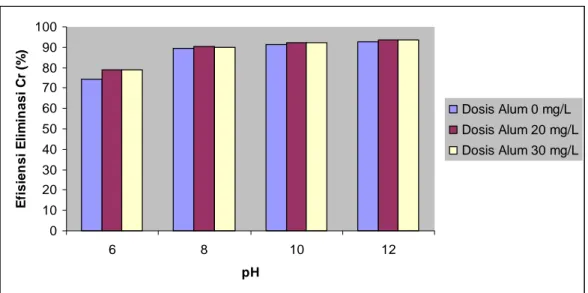
4.4.4. Efisiensi Eliminasi Polutan Krom (Cr)
Efisiensi eliminasi polutan krom adalah efisiensi perubahan konsentrasi polutan krom pada pengukuran awal setelah mengalami proses koagulasi. Gambar 8 menunjukkan bahwa koagulan alum sangat efisien dalam menurunkan konsentrasi polutan Cr pada limbah cair yang diteliti. Efisiensi eliminasi polutan Cr ini merupakan eliminasi tertinggi dari semua polutan yang diteliti. Efisiensi eliminasi polutan Cr dapat mencapai 93,58% pada pH 12 dengan dosis 20 mg/L. Efisiensi eliminasi Cr ini semakin tinggi sejalan dengan naiknya pH. Sama halnya dengan kedua polutan logam berat diatas maka penurunan konsentrasi polutan Cr ini sangat efisien dilakukan pada pH yang sangat basa.
Sebagian besar logam berat dapat dieliminasi dari limbah cair hanya dengan menaikkan pH karena pada dasarnya hidroksida logamnya mudah larut. Hal ini dapat dilakukan juga pada polutan Cr dengan mereduksi Cr(VI) menjadi Cr(III). Cr(VI) yang berada dalam ion kromat (CrO42-) bersifat toksik dan karsinogen. Ion
ini mudah masuk ke dalam sel karena struktur molekulnya yang mirip dengan ion sulfat (SO42-). Cr(III) kurang toksik bila dibandingkan dengan Cr(VI) bahkan
0 10 20 30 40 50 60 70 80 90 100 6 8 10 12 pH E fi s ie n s i E lim in asi C r (% ) Dosis Alum 0 mg/L Dosis Alum 20 mg/L Dosis Alum 30 mg/L
Gambar 8. Efisiensi eliminasi polutan Cr
4.5. Perubahan Konsentrasi Polutan dalam Limbah Cair setelah Koagulasi
Perubahan konsentrasi polutan dalam limbah cair yang diteliti adalah perubahan konsentrasi polutan dalam limbah cair sesudah diberi perlakuan pH dan dosis alum berbeda. Polutan yang dibahas pada topik ini adalah semua polutan pada pengukuran awal untuk mengetahui semua perubahan yang terjadi pada semua polutan tersebut setelah dilakukan proses koagulasi. Hasil pengukuran kadar polutan setelah koagulasi dapat dilihat pada Lampiran 1.
4.5.1. Kekeruhan
Kekeruhan yang diukur pada penelitian ini adalah kekeruhan yang disebabkan oleh koloid yang ada pada limbah cair laboratorium sehingga harus dihilangkan dengan proses koagulasi karena koloid tersebut tidak dapat dihilangkan dari cairan dengan pengendapan konvensional.
Berdasarkan hasil sidik ragam diperoleh bahwa pH dan dosis tidak berpengaruh terhadap penurunan konsentrasi kekeruhan. Gambar 9 menunjukkan perubahan kekeruhan setelah diberi perlakuan pH dan dosis alum berbeda. Kekeruhan awal yang diukur sebelum perlakuan adalah 2 NTU. Kekeruhan sama sekali tidak mengalami penurunan, kecuali pada pH 6. Dengan dosis 30 mg/L kekeruhan limbah cair pada pH 6 turun menjadi 1,5 NTU. Pada pH 10 dengan
33 dosis 30 mg/L konsentrasinya tetap atau sama dengan konsentrasi awal yaitu 2 NTU. 0 2 4 6 8 10 12 14 6 8 10 12 pH K eker u h an ( N T U ) Dosis Alum 0 mg/L Dosis Alum 20 mg/L Dosis Alum 30 mg/L
Gambar 9. Kekeruhan setelah koagulasi
Kekeruhan yang tinggi yang berbeda dengan konsentrasi awal dapat disebabkan oleh kandungan bahan-bahan kimia yang terlarut dalam larutan sehingga koagulan tidak dapat menurunkan konsentrasi awal sebesar 2 NTU. Pada pH 12 yang sangat basa yang berarti alkalinitas tinggi karena penambahan NaOH terjadi penetralan muatan sehingga larutan menjadi keruh. Asam dan basa kuat yang dicampurkan dalam larutan menyebabkan terjadinya penetralan muatan tersebut. Harga pH tergantung pada konsentrasi asam atau basa yang ditambahkan pada larutan artinya jika larutan dalam keadaan asam maka pH menjadi rendah, sedangkan jika dalam keadaan basa maka pH larutan menjadi tinggi (Rivai 1995).
4.5.2. Padatan Tersuspensi Total
Padatan tersuspensi yang diukur dalam penelitian ini adalah padatan tersuspensi yang disebabkan oleh kandungan berbagai bahan kimia yang ada pada limbah cair laboratorium yang berasal dari reagen atau zat kimia yang digunakan pada analisis COD.
Berdasarkan sidik ragam diperoleh bahwa faktor pH yang berpengaruh dalam koagulasi dan setelah dilanjutkan dengan uji Duncan diperoleh bahwa pH 12 berbeda nyata dengan pH 6 dan pH 10. Gambar 10 menunjukkan bahwa konsentrasi awal padatan tersuspensi total 3 mg/L tidak mengalami penurunan sama sekali. Hasil uji Duncan yang diperoleh hanya menunjukkan bahwa
konsentrasi padatan tersuspensi total tertinggi berada pada pH 12 sedangkan pada pH 6 dan pH 10 konsentrasi padatan tersuspensi total hampir sama.
Kecenderungan ini dapat dilihat pada pH 12 dan dosis 30 mg/L dengan konsentrasi padatan tersuspensi total sebesar 37 mg/L. Keadaan ini berbeda dengan yang diharapkan yaitu bahwa dengan koagulasi, konsentrasi padatan tersuspensi total awal dapat mengalami penurunan. Hal ini dapat disebabkan karena adanya penambahan berbagai bahan kimia selama koagulasi yang menambah jumlah padatan tersuspensi dalam larutan yang tidak menurunkan konsentrasi padatan tersuspensi tetapi makin menambah konsentrasinya dan selain itu pada pH 12 diduga terjadi penetralan muatan karena reaksi berbagai bahan kimia pada pH yang sangat basa sehingga bahan-bahan kimia yang ada dalam larutan tidak mengendap tetapi larut kembali (Sawyer et al. 2003).
0 5 10 15 20 25 30 35 40 6 8 10 12 pH P a d a ta n Te rs us p e ns i To ta l ( m g /L) Dosis Alum 0 mg/L Dosis Alum 20 mg/L Dosis Alum 30 mg/L
Gambar 10. Konsentrasi padatan tersuspensi total setelah koagulasi
4.5.3. Warna
Warna limbah cair pada penelitian ini adalah warna yang disebabkan oleh koloid negatif karena kandungan berbagai bahan kimia yang ada pada limbah cair laboratorium. Warna bening kebiruan limbah cair ini dapat menjadi indikasi bahwa limbah ini tergolong limbah dengan pH yang sangat asam.
Berdasarkan sidik ragam diperoleh bahwa faktor pH yang paling berpengaruh dalam koagulasi dan setelah dilanjutkan dengan uji Duncan diperoleh bahwa pH 12 memiliki konsentrasi yang paling besar jika dibandingkan dengan
35 pH 6, pH 8 dan pH 10 dan jika dibandingkan dengan konsentrasi awal sebesar 10 PtCo maka pada pH 12, konsentrasi warna tersebut tidak mengalami penurunan.
Gambar 11 menunjukkan konsentrasi warna yang diukur sesudah diberi perlakuan pH dan dosis alum berbeda. Konsentrasi awal warna ini adalah 10 PtCo. Penurunan konsentrasi warna setelah perlakuan terjadi pada semua variasi pH dan dosis alum yang berbeda kecuali pada pH 12 dengan perubahan konsentrasi yang tidak sama dengan variasi pH dan dosis lainnya.
Penurunan konsentrasi warna ini terjadi pada pH 6, pH 8 dan pH 10 dengan konsentrasi yang hampir sama besarnya. Penurunan tertinggi terjadi pada pH 8 dengan dosis 0 mg/L dengan konsentrasi warna sebesar 6 PtCo.
0 2 4 6 8 10 12 14 16 6 8 10 12 pH Wa rn a (P tC o ) Dosis Alum 0 mg/L Dosis Alum 20 mg/L Dosis Alum 30 mg/L
Gambar 11. Konsentrasi warna setelah koagulasi
Kenaikan konsentrasi warna dari konsentrasi awal 10 PtCo pada pH 12 dapat disebabkan oleh kandungan bahan-bahan kimia dalam larutan dan juga pH ini sangat alkali karena sudah di atas 7. Warna dalam larutan dapat disebabkan oleh bahan-bahan tersuspensi yang terkandung dalam larutan tersebut. Larutan hasil analisis COD ini pada awalnya berwarna bening kebiruan dan setelah dilakukan jar test warna larutan menjadi sangat bening. Analisis COD yang menggunakan bermacam-macam bahan kimia dan reaksinya pada pH 12 diduga merupakan penyebab tingginya konsentrasi warna pada pH 12.
4.5.4. Perak (Ag)
Perak yang diteliti dalam penelitian ini adalah perubahan konsentrasi ion Ag+ yang ada dalam limbah cair setelah melewati proses koagulasi. Gambar 12 menunjukkan penurunan konsentrasi Ag yang cukup konsisten berdasarkan kenaikan pH meskipun penurunan konsentrasi berdasarkan dosis tidak konsisten. Konsentrasi awal sebesar 4,34 mg/L dapat turun menjadi 0,62 mg/L pada pH 12 dan dosis 0 mg/L.
Berdasarkan sidik ragam diperoleh bahwa faktor pH yang paling berpengaruh dalam koagulasi dan setelah dilanjutkan dengan uji Duncan diperoleh bahwa penurunan konsentrasi signifikan pada semua pH. Hal ini menunjukkan bahwa penurunan konsentrasi Ag ini tergantung pada pH. pH yang semakin tinggi sejalan dengan penurunan konsentrasi Ag yang semakin tinggi pula.
0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5 6 8 10 12 pH Ag ( m g /L ) Dosis Alum 0 mg/L Dosis Alum 20 mg/L Dosis Alum 30 mg/L
Gambar 12. Konsentrasi Ag setelah koagulasi
Menurut Chang (2002) Ag+ tergolong logam transisi yang memiliki kecenderungan membentuk ion kompleks karena memiliki beberapa bilangan oksidasi. Sifat ini menyebabkan Ag secara efektif bertindak sebagai asam Lewis dalam reaksi dengan berbagai molekul dan ion yang bertindak sebagai donor elektron atau sebagai basa Lewis. Ion Ag+ akan membentuk ion kompleks Ag2SO4
ketika dalam larutan ditambahkan H2SO4 dan bila ditambahkan NaOH maka akan
terbentuk ion kompleks AgOH yang akan semakin meningkat kelarutannya bila terus menerus ditambahkan basa. Reaksi yang diduga terjadi adalah :
37 2Ag+ + H2SO4 → Ag2SO4 + 2H+
Ag+ + NaOH ↔ AgOH + Na-
Penurunan konsentrasi yang tidak sesuai dengan penambahan jumlah dosis alum diduga disebabkan oleh kombinasi pH yang semakin tinggi (basa) dan dosis alum yang semakin tinggi. pH basa menyebabkan ion Ag+ makin bertambah dalam larutan, dengan kata lain kelarutan ion Ag+ besar. Dosis yang semakin tinggi menyebabkan terjadinya netralisasi dalam larutan sehingga Ag+ tidak mengendap tetapi larut kembali dalam larutan. Ion Na- juga menyebabkan larutan
menjadi netral.
4.5.5. Merkuri (Hg)
Merkuri yang diteliti pada penelitian ini adalah perubahan konsentrasi ion Hg setelah melewati proses koagulasi. Gambar 13 menunjukkan konsentrasi Hg mengalami penurunan konsentrasi yang sangat drastis setelah diberi perlakuan pH dan dosis berbeda. Konsentrasi awal Hg yang diukur adalah 138,5 mg/L. Penurunan konsentrasi Hg ini sangat konsisten berdasarkan pH dan dosis alum berbeda yang diberikan saat percobaan. Penurunan konsentrasi tertinggi sebesar 11 mg/L dapat dilihat pada pH 10 dengan dosis alum 30 mg/L.
Berdasarkan sidik ragam diperoleh bahwa faktor pH yang paling berpengaruh dan setelah dilanjutkan dengan uji Duncan diperoleh bahwa pH 6 berbeda nyata dengan pH 8, pH 10 dan pH 12. Hal ini menunjukkan bahwa tingkat penurunan konsentrasi Hg pada pH 6 sangat rendah bila dibandingkan penurunan konsentrasi pada pH 8, pH 10 dan pH 12 yang sangat tinggi.
0 10 20 30 40 50 60 70 6 8 10 12 pH Hg ( m g /L ) Dosis Alum 0 mg/L Dosis Alum 20 mg/L Dosis Alum 30 mg/L
Gambar 13. Konsentrasi Hg setelah koagulasi
Senyawa merkuri dalam larutan sangat kompleks karena keberadaan senyawa merkuri ini tergantung pada pH, alkalinitas, redoks, variabel lainnya dan berbagai bahan kimia yang bisa terbentuk yang memiliki kelarutan dan muatan listrik yang berbeda (Boudou & Jernelov 1983, diacu dalam Eisler 2006). Ketiga bentuk merkuri yaitu Hg0 (elemental), Hg22+ (ion merkuro) dan Hg2+ (ion
merkuri) sangat reaktif dan mudah bereaksi dengan berbagai bahan kimia di lingkungan bahkan di dalam tubuh manusia. Ion merkuri merupakan ion yang paling beracun diantara ketiga bentuk merkuri tersebut.
Pada penelitian ini konsentrasi merkuri dapat turun cukup tinggi pada semua pH perlakuan tetapi penurunan konsentrasi yang paling tinggi diperoleh pada pH basa (pH 8, 10 dan 12) meskipun pada pH sedang (pH 6) juga terjadi penurunan konsentrasi yang tidak sebesar ketiga pH basa.
Penelitian mengenai hubungan pH air dan konsentrasi merkuri dalam ikan di danau menunjukkan bahwa konsentrasi merkuri sangat besar pada pH asam dan semakin menurun konsentrasinya bila pH semakin basa. pH yang diteliti mulai dari pH 4 – 10 (Lean 2003, diacu dalam Baird & Cann 2005). Penurunan konsentrasi merkuri semakin besar mulai dari pH 7 – 10 dan bila dibandingkan dengan penelitian yang dilakukan maka pH maksimum yang diperoleh (pH 8 -12) maka merupakan kisaran pH dengan penurunan konsentrasi merkuri terbesar.
Hg2+ tergolong asam lunak karena elektronnya mudah mengalami polarisasi atau mudah terlepas (Pearson 1963, diacu dalam Jolly 1991). Hg tergolong logam
39 transisi seperti Ag yang mudah bereaksi dengan berbagai molekul dan ion dalam larutan. Dalam penelitian ini Hg bereaksi dengan asam dan basa kuat yang terionisasi sempurna dalam cairan sehingga ion Hg2+ akan membentuk ion kompleks HgSO4 yang tidak larut bila berada dalam kondisi asam dan HgOH
dalam kondisi basa dan akan semakin meningkat kelarutannya jika terus menerus ditambahkan basa. Reaksi yang diduga terjadi adalah :
Hg2+ + 2H2SO4 → 2HgSO4 + 4H+
Hg2+ + 2NaOH ↔ 2HgOH + 2Na
-4.5.6. Krom (Cr)
Krom yang diteliti pada penelitian ini adalah perubahan konsentrasi ion Cr setelah melewati proses koagulasi. Gambar 14 menunjukkan penurunan konsentrasi Cr setelah diberi perlakuan pH dan dosis alum berbeda. Konsentrasi awal Cr adalah 17,60 mg/L. Penurunan tertinggi sebesar 1,13 mg/L terjadi pada pH 12 dengan dosis 20 mg/L. Penurunan ini juga sangat konsisten seperti pada parameter Hg.
Berdasarkan sidik ragam diperoleh bahwa faktor pH yang paling berpengaruh dan setelah dilanjutkan dengan uji Duncan diperoleh bahwa penurunan konsentrasi signifikan pada semua pH. Hal ini menunjukkan bahwa konsentrasi Cr turun pada semua pH koagulasi dengan nilai yang berbeda.