DIAN ASRIANI
S
SE
EK
KO
OL
LA
AH
H
P
PA
AS
SC
CA
AS
SA
AR
RJ
JA
AN
NA
A
I
IN
NS
ST
T
IT
I
TU
UT
T
P
PE
ER
RT
TA
AN
NI
IA
AN
N
B
BO
O
GO
G
OR
R
B
BO
OG
GO
O
R
R
2
Dengan ini saya menyatakan bahwa tesis Issoollaassii XXaannttoorriizzooll ddaarrii T
Teemmuullaawwaakk TTeerrppiilliihh BBeerrddaassaarrkkaann NNoommoorr HHaarraappaann adalah karya saya dengan a
arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhit tesis ini.
Bogor, Januari 2010
Dian Asriani
DIAN ASRIANI. Isolation of Xanthorrhizol from the Selected Temulawak Based on Promising Line. Under direction of SUMINAR SETIATI ACHMADI, LATIFAH KOSIM DARUSMAN, and MAHARANI HASANAH.
Temulawak (Curcuma xanthorrhiza), belongs to Zingiberaceae, empirically used as herbal medicines. One of its bioactive compounds is xanthorrhizol which is a volatile oil. The research was aimed to determine promising line A or F of temulawak from Balittro based on the highest xanthorrhizol content, to establish agrobiophysic environmental condition, and to get a new separation method (solvent extraction using ethanol 96%, acetylation of crude extract, separation with preparative thin layer chromatography/TLC, and deacetylation) which can isolate xanthorrhizol with higher yield than the existing method (solvent extraction using methanol 75%, separation with coloumn chromatography step 1, acetylation, separation with column chromatography step 2, and deacetylation). The result showed that the promising line A produced the highest xanthorrhizol content (0,0382%). According to agrobiophysic parameter of Cileungsi, temulawak was suitable in environment which has temperature of 28-34 ºC, rainfall about 224 mm annual precipitation, and sandy clay soil. Verification of previous method succesfully isolated xanthorrhizol with 0.064% (b/b) yield. Modification method which conducted with preparative TLC still resulted two spots, the first spot was identified as xanthorrhizol with 0.14% (b/b) yield, while the second was unidentified, supposed to be more polar than xantorizol. Additional step with the second preparative TLC is still needed to obtain pure xanthorrhizol.
DIAN ASRIANI. IIssoollaassiiXXaannttoorriizzoollddaarriiTTeemmuullaawwaakkTTeerrppiilliihhBBeerrddaassaarrkkaannNNoommoorr H
Haarraappaan. Dibimbing oleh SUMINAR SETIATI ACHMADI, LATIFAH KOSIM n
DARUSMAN, dan MAHARANI HASANAH.
Temulawak (Curcuma xanthorrhiza) termasuk ke dalam famili Zingiberaceae, yang secara empiris banyak digunakan sebagai obat untuk mengatasi batu empedu, batu ginjal, demam, kolesterol tinggi, nyeri haid, nyeri sendi, pelancar ASI, sembelit, dan eksim. Banyaknya ragam manfaat temulawak baik untuk obat tradisional maupun fitofarmaka adalah karena rimpangnya mengandung komponen aktif utama yang berkhasiat, yaitu kurkuminoid dan minyak atsiri. Beberapa penelitian menunjukkan bahwa komponen aktif utama dalam minyak atsiri temulawak yang juga merupakan senyawa khas dari rimpang temulawak adalah xantorizol. Kandungan dan komposisi senyawa aktif, termasuk xantorizol, pada temulawak yang merupakan hasil metabolisme sekunder dari tanaman sangat bergantung pada interaksi antara sifat genetik tanaman dan kondisi agrobiofisik tanaman yang meliputi iklim, media tanam (jenis tanah), dan ketinggian. Penelitian ini bertujuan menentukan nomor harapan temulawak A atau F koleksi Balittro yang terbaik berdasarkan kandungan xantorizol yang tinggi, menentukan kondisi lingkungan agrobiofisik yang menghasilkan tingkat bahan aktif tinggi, dan memperoleh metode pemisahan baru yang dapat mengisolasi xantorizol dengan hasil yang lebih tinggi dibandingkan dengan metode terdahulu (metode Hwang) yang berhasil mengisolasi xantorizol dari fraksi etil asetat ekstrak metanol sebanyak 0.2% (b/b) dari rimpang temulawak kering.
Secara garis besar penelitian dibagi menjadi 2 bagian utama, yaitu (1) pemilihan sampel temulawak dari 2 nomor harapan dan 2 lokasi tanam yang menghasilkan kadar bioaktif tinggi (xantorizol), dan (2) isolasi xantorizol dari sampel temulawak terpilih. Pada bagian pertama, dilakukan pemilihan sampel temulawak yang terdiri atas dua nomor harapan temulawak koleksi Balittro (A dan F), yang berasal dari dua daerah, yaitu Cileungsi dan Boyolali. Sampel yang memiliki kadar xantorizol tertinggi merupakan sampel terpilih yang digunakan untuk tahap penelitian selanjutnya. Kadar xantorizol diukur dengan menggunakan HPLC. Pada bagian kedua penelitian ini dilakukan isolasi xantorizol dari temulawak terpilih menggunakan metode ekstraksi dengan pelarut etanol 96%, asetilasi ekstrak kasar, dan separasi dengan teknik kromatografi lapis tipis (KLT) preparatif, serta dilakukan pula isolasi menggunakan metode Hwang (2000) sebagai metode pembanding untuk memperoleh informasi mengenai ciri xantorizol. Hwang menggunakan metode ekstraksi dengan pelarut metanol 75%, separasi kromatografi kolom dua tahap, dan asetilasi fraksi hasil kolom.
Berdasarkan parameter agrobiofisik di lokasi tanam Cileungsi, temulawak cocok tumbuh di lingkungan dengan suhu 28-34 ºC, curah hujan 224 mm/tahun dan tanah liat berpasir.
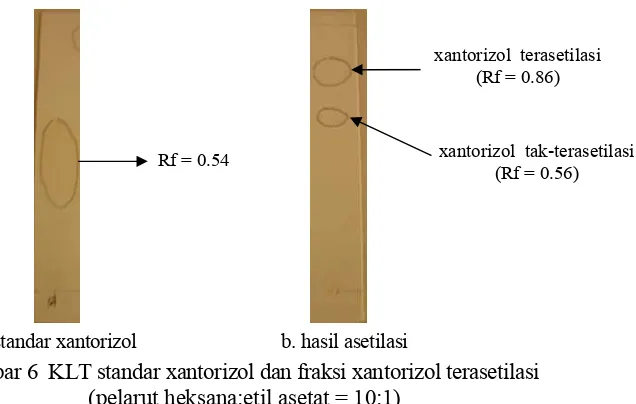
Berdasarkan hasil isolasi xantorizol menggunakan metode Hwang, diperoleh informasi ciri senyawa xantorizol yaitu KLT, spektrum FTIR, kromatogram HPLC, dan LC-MS. Ekstrak kasar metanol diperoleh sebanyak 14.6244 g dari sampel awal 250 g (5.8%). Fraksinasi lanjut dengan etil asetat menghasilkan ekstrak etil asetat sebanyak 5.7127 g (39.06%). Fraksinasi kolom kromatografi I menghasilkan 20 fraksi. Berdasarkan hasil KLT, ditentukan fraksi yang mengandung xantorizol adalah fraksi nomor 4 sampai fraksi nomor 10. Dari hasil asetilasi diperoleh dua fase, yaitu fase pertama (fase atas) merupakan fase yang tidak larut air yang mengandung xantorizol terasetilasi, sedangkan fase bawah merupakan fase yang larut air sehingga diduga tidak terdapat xantorizol. Dari hasil KLT fase atas, terdeteksi di bawah sinar lampu UV pada λ = 254 nm adanya dua spot. Spot pertama dengan nilai Rf = 0.86 dapat diidentifikasi sebagai xantorizol terasetilasi, sedangkan spot kedua dengan nilai Rf = 0.56 diidentifikasi sebagai xantorizol tak terasetilasi karena hampir sama dengan nilai Rf standar = 0.54. Fraksinasi lanjut xantorizol terasetilasi dengan kolom kromatografi II, menghasilkan fraksi 1 dan fraksi 2 yang diduga merupakan fraksi xantorizol terasetilasi tunggal. Deasetilasi terhadap fraksi tersebut menghasilkan fraksi dugaan xantorizol dengan rendemen sebesar 0.1608 g (0.064%). Pencirian dilakukan dengan FTIR, HPLC, dan LC-MS. Berdasarkan spektrum FTIR, terlihat kembali serapan dengan intensitas yang cukup besar pada bilangan gelombang 3430.88 cm-1 yang menunjukkan terbentuknya kembali gugus –OH dari xantorizol, dan hilangnya serapan gugus asetil pada daerah serapan sekitar 1700 cm-1. Dari kromatogram HPLC, muncul satu puncak pada waktu retensi 14.820 menit dengan luas area yang cukup besar. Jika dibandingkan dengan kromatogram standar xantorizol yang menunjukkan puncak xantorizol pada waktu retensi 14.817 menit. Dapat dikatakan bahwa isolasi dengan melakukan verifikasi metode Hwang berhasil memperoleh senyawa xantorizol. Hal ini juga diperkuat dengan spektrum hasil LC-MS yang juga menunjukkan adanya satu puncak pada waktu retensi 2.848 menit dengan bobot molekul 218.03 yang merupakan bobot molekul xantorizol.
muncul di bawah sinar lampu UV pada λ = 254 nm; spot pertama teridentifikasi sebagai xantorizol dan spot kedua belum dapat teridentifikasi. Pencirian lain yang dilakukan adalah dengan FTIR, HPLC, dan LC-MS. Berdasarkan spektrum FTIR yang diperoleh, terlihat kembali serapan dengan intensitas yang cukup besar pada bilangan gelombang 3445 cm-1 yang menunjukkanterbentuknya kembali gugus – OH dari xantorizol dengan intensitas yang lebih besar, namun pada daerah serapan sekitar 1700 cm-1 masih terdapat serapan dengan intensitas rendah. Hal ini menunjukkan bahwa belum semua gugus asetil terdeasetilasi kembali menjadi gugus -OH. Berdasarkan kromatogram HPLC yang diperoleh, terlihat bahwa muncul dua puncak pada waktu retensi 6.103 menit dan 14.813 menit. Jika dibandingkan dengan kromatogram standar xantorizol yang menunjukkan puncak xantorizol pada waktu retensi 14.817 menit, maka dapat diduga bahwa hasil isolasi dengan modifikasi metode ini berhasil memperoleh senyawa xantorizol (puncak kedua) namun belum murni atau masih terdapat campuran dengan satu senyawa lain (puncak pertama). Hal ini juga diperkuat dengan data hasil LC-MS yang juga menunjukkan adanya dua puncak yang terdeteksi pada tabel waktu retensi, yaitu terdapat puncak yang muncul pada waktu retensi 2.9 menit dan puncak kedua yang muncul pada waktu retensi 16.800 menit. Dapat dipastikan bahwa puncak pertama adalah xantorizol dengan BM 218.03. Puncak kedua pada waktu retensi 16.8 menit tidak terdeteksi bobot molekulnya, sehingga tidak dapat diduga secara pasti jenis dan struktur senyawanya. Namun, berdasarkan waktu retensi yang lebih besar dibanding waktu retensi xantorizol, dapat diduga bahwa senyawa tersebut bersifat lebih polar dibandingkan xantorizol.
Rendemen yang dihasilkan dari metode modifikasi adalah 0.140% (b/b). Jika dibandingkan dengan rendemen verifikasi metode Hwang (2000) yang dilakukan sebagai metode pembanding pada penelitian ini (0.064%), rendemen yang diperoleh dari modifikasi metode ini dua kali lebih besar. Namun, dari segi kemurnian hasil masih kurang, karena masih terdapat dua puncakyang terdeteksi dari hasil KLT, kromatogram HPLC dan LC-MS, dan puncak kedua belum dapat teridentifikasi jenis dan strukturnya karena masih memerlukan pemurnian lebih lanjut, misalnya dengan KLT preparatif tahap II. Berdasarkan hasil KLT, jarak antara spot 1 (Rf = 0.52) yang diduga merupakan senyawa xantorizol dengan spot 2 (Rf = 0.39) cukup jauh, sehingga masih dimungkinkan untuk dapat dipisahkan kembali dengan cara KLT preparatif. Kemurnian senyawa xantorizol yang diperoleh dari metode modifikasi adalah 99.5%, sedangkan Hwang (2000) berhasil mengisolasi xantorizol dengan kemurnian 99.9%.
© Hak cipta milik IPB, tahun 2010
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencamtumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh Karya tulis dalam bentuk apapun tanpa izin IPB
DIAN ASRIANI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Kimia
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
NIM : G451060061
Disetujui
Komisi Pembimbing
Prof. Dr. Suminar S. Achmadi Ketua
Prof. Dr. Latifah K. Darusman Prof (r). Dr. Maharani Hasanah Anggota Anggota
Diketahui
Ketua Program Studi Kimia a.n. Dekan Sekolah Pascasarjana
Sekretaris Program Magister
Prof. Dr. Ir. Latifah. K. Darusman Dr. Ir. Naresworo Nugroho, M.S
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia dan kemudahan yang diberikan sehingga penulis dapat menyelesaian studi pada program Magister Sains Institut Pertanian Bogor, dengan menghasilkan karya ilmiah berupa tesis dengan judul IIssoollaassii XXaannttoorriizzooll ddaarrii TTeemmuullaawwaakk TTeerrppiilliihh
B
Beerrddaassaarrkkaann NNoommoorr HHaarraappaan. Penelitian dilaksanakan di Laboratorium Uji n
Biofarmaka Pusat Studi Biofarmaka (PSB) LPPM IPB, Laboratorium Kimia Organik dan Kimia Analitik Departemen Kimia FMIPA IPB mulai bulan Mei 2008 sampai bulan Februari 2009. Penelitian ini merupakan bagian dari Kerjasama Kemitraan Penelitian Pertanian dengan Perguruan Tinggi (KKP3T) Tahun 2007 dan kerja sama antara Pusat Studi Biofarmaka LPPM-IPB dengan Balai Penelitian Tanaman Rempah dan Obat (Balittro) Bogor dengan judul “Potensi Temulawak Terstandar Untuk Menanggunalangi Flu Burung“.
Selama menempuh studi program magister sains, penulis banyak mendapatkan bantuan moril dan material dari berbagai pihak. Untuk itu ucapan terima kasih penulis sampaikan kepada Prof. Dr. Suminar S. Achmadi sebagai pembimbing utama, Prof. Dr. Latifah K. Darusman dan Prof (r). Dr. Maharani Hasanah sebagai pembimbing anggota, Prof. Dr. Purwantiningsih Sugita sebagai penguji, ketua dan staf pengajar Program Studi Kimia Sekolah Pascasarjana IPB atas semua ilmu, bimbingan, dan saran yang sangat berarti bagi penulis dalam menyelesaikan studi. Terima kasih kepada PSB atas dilibatkannya penulis menjadi bagian dalam penelitian KKP3T dan kepada para staf PSB yang telah banyak memberi semangat dan bantuan dalam penelitian ini.
Terima kasih tak terhingga khusus kepada kedua orangtuaku yang telah memberikan dorongan, doa dan pengertian selama penulis menempuh studi. Tak lupa kepada Wahyu Diana, terima kasih atas doa dan dukungannya. Kepada teman-temanku di Program Studi Kimia, penulis ucapkan terima kasih karena telah menjadi teman dan sahabat, semoga pertemanan dan persahabatan yang tulus tetap terjalin selamanya.
Akhirnya seraya berserah diri ke hadirat Allah SWT, penulis mempersembahkan karya ini dengan harapan semoga bermanfaat.
Bogor, Januari 2010
Penulis dilahirkan di Yogyakarta pada tanggal 21 Februari 1985 dari Ayah Irpan Ganda Putra, S.H., M.H. dan Ibu Muasriyah, B.Sc. Penulis merupakan putri pertama dari dua bersaudara.
Tahun 2002 penulis lulus dari SMA Negeri 3 Semarang dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB di Jurusan Kimia FPMIPA hingga berhasil menyelesaikan studi pada bulan Juli 2006. Kemudian pada September 2006 penulis melanjutkan studi ke Program Magister Kimia Sekolah Pascasarjana IPB.
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 3
TINJAUAN PUSTAKA ... 4
Temulawak ... 4
Komposisi Kimia Temulawak ... 6
Xantorizol ... 8
Aktivitas Biologis Xantorizol ... 8
Isolasi Xantorizol (Hwang 2000) ... 9
METODE PENELITIAN ... 10
Alat dan Bahan ... 10
Prosedur Penelitian ... 10
HASIL DAN PEMBAHASAN ... 13
Sampel Temulawak Terpilih ... 13
Isolasi Xantorizol Metode Hwang ... 15
Isolasi Xantorizol Metode Modifikasi ... 20
SIMPULAN DAN SARAN ... 24
DAFTAR PUSTAKA ... 25
1 Komposisi rimpang temulawak ... 6
2 Kadar minyak atsiri rimpang temulawak ... 7
3 Komponen minyak temulawak ………. 7
4 Kandungan xantorizol keempat jenis sampel temulawak ... 13
5 Ciri agrobiofisik lokasi penanaman temulawak ………... 15
DAFTAR GAMBAR
Halaman 1 Tanaman temulawak dan irisan rimpangnya …... 62 Struktur kimia xantorizol ... 8
3 KLT fraksi hasil separasi kolom metode Hwang ……… 16
4 Skema reaksi asetilasi xantorizol ……… 16
5 Hasil reaksi asetilasi ……… 17
6 KLT standar xantorizol dan fraksi xantorizol terasetilasi ……… 17
7 8 9 10 11 12 13 14
Perbandingan spektrum FTIR sebelum dan setelah asetilasi
(metode Hwang) ………..………
KLT fraksi xantorizol terasetilasi hasil separasi kolom metode Hwang …..
KLT fraksi dugaan xantorizol metode Hwang ...
KLT fraksi xantorizol hasil asetilasi ...
Perbandingan spektrum FTIR ekstrak etanol sebelum dan setelah asetilasi (metode modifikasi) ………
KLT preparatif fraksi xantorizol hasil asetilasi metode modifikasi ...
KLT fraksi xantorizol 1 dan 2 hasil asetilasi metode modifikasi …………
1 Diagram alir isolasi xantorizol ... 32
2 Analisis statistika pengaruh lokasi tanam dan nomor harapan terhadap
kandungan xantorizol ……… 33
3
4
Contoh kromatogram HPLC pemilihan sampel berdasarkan kadar xantorizol tertinggi dan contoh perhitungannya ………
a. Spektrum FTIR fraksi aktif xantorizol hasil kolom sebelum asetilasi (metode Hwang) ...
34
36
b. Spektrum FTIR fraksi aktif xantorizol hasil kolom setelah asetilasi
(metode Hwang) ……… 37
c. Spektrum FTIR fraksi dugaan xantorizol (metode Hwang) ... 38
5 Kromatogram HPLC fraksi dugaan xantorizol (metode Hwang) …….… 39
6 7 8 9 10 11
Kromatogram HPLC standar xantorizol ...
Kromatogram LC-MS fraksi dugaan xantorizol (metode Hwang) ……...
a. Spektrum FTIR sampel ekstrak etanol temulawak sebelum asetilasi (metode modifikasi) ... b. Spektrum FTIR sampel ekstrak etanol temulawak setelah asetilasi (metode modifikasi) ... c. Spektrum FTIR fraksi dugaan xantorizol (metode modifikasi) ...
Beberapa rumus struktur komponen yang mungkin terdapat dalam temulawak ………
Kromatogram HPLC fraksi dugaan xantorizol (metode modifikasi) ……
PENDAHULUAN
Latar Belakang
Temulawak (Curcuma xanthorrhiza) merupakan salah satu jenis tumbuhan
dari keluarga Zingiberaceae yang secara empirik banyak digunakan sebagai obat,
baik dalam bentuk tunggal maupun campuran. Secara tradisional temulawak telah
banyak digunakan masyarakat antara lain sebagai obat untuk mengatasi batu
empedu, batu ginjal, demam, kolesterol tinggi, nyeri haid, nyeri sendi, pelancar
ASI, sembelit, dan eksim. Seiring dengan kemajuan ilmu pengetahuan dan
banyaknya penelitian ilmiah, temulawak diketahui pula memiliki khasiat sebagai
antioksidan (Masuda et al. 1992), antilipidemia (Yasni et al. 1994), antibakteri
(Hwang et al. 2000, Darusman et al. 2006), dan antijamur (Rukayadi & Hwang
2007). Temulawak (Curcuma xanthorrhiza) juga termasuk sebagai salah satu
tanaman obat unggulan Departemen Pertanian (Deptan) dan Badan Pengawas
Obat dan Makanan (BPOM) tahun 2004 (Deptan 2004).
Temulawak sangat prospektif untuk dikembangkan menjadi berbagai
produk obat bahan alam seperti minuman kesehatan, pangan fungsional
(nutraseutikal), kosmeseutikal (kometik dan produk kesehatan pribadi), jamu,
herbal terstandar dan fitofarmaka. Kebutuhan industri terhadap temulawak, yaitu
sekitar 3,140 ton/tahun berat segar untuk temulawak yang menempati urutan
pertama terbesar dibandingkan dengan bahan baku obat lainnya untuk keperluan
Industri Obat Tradisional di Jawa Tengah dan sekitar 70% jamu yang beredar di
pasaran mengandung temulawak (Kemala et al. 2003).
Bagian dari tanaman temulawak yang dimanfaatkan adalah rimpangnya.
Banyaknya ragam manfaat temulawak baik untuk obat tradisional maupun
fitofarmaka adalah karena rimpangnya mengandung komponen aktif utama yang
berkhasiat, yaitu kurkuminoid dan minyak atsiri. Kurkuminoid memberikan warna
kuning pada rimpang temulawak, yang terdiri atas kurkumin dan
desmetoksikurkumin. Kandungan kimia minyak atsirinya antara lain feladren,
kamfer, turmerol, tolilmetilkarbinol, ar-kurkumen, zingiberen, kuzerenon,
germakron, β-tumeron, dan xantorizol (Rahardjo & Rostiana 2005). Beberapa
temulawak yang juga merupakan senyawa khas dari rimpang temulawak adalah
xantorizol.
Kandungan dan komposisi senyawa aktif pada temulawak yang merupakan
hasil metabolisme sekunder dari tanaman sangat bergantung pada interaksi antara
sifat genetik yang ada pada tanaman dan kondisi agrobiofisik yang menjadi
lingkungan tempat tanaman tersebut tumbuh. Menurut Sidik et al. (1995),
produktivitas dan mutu rimpang temulawak dipengaruhi oleh kondisi lingkungan
tempat tumbuh yang meliputi iklim, media tanam (jenis tanah), dan ketinggian. Oleh
karena itu perlu diketahui nomor harapan tanaman temulawak yang unggul dan
lingkungan tumbuh yang sesuai, sehingga diperoleh produksi dan mutu rimpang
yang tinggi.
Balai Penelitian Tanaman Obat dan Aromatik (Balittro) memiliki 22 nomor
aksesi yang berasal dari berbagai daerah di Indonesia. Berdasarkan hasil
karakterisasi dan evaluasi plasma nutfah telah diperoleh enam nomor harapan
temulawak hasil seleksi dari dua puluh nomor aksesi plasma nutfah temulawak
dengan perbedaan produksi rimpang dan mutu kandungan zat berkhasiat lebih
tinggi. Produksi rimpang keenam aksesi tersebut lebih tinggi (2,39–3,37 kg/m2)
dibandingkan dengan produksi rata-rata nasional (1,07 kg/m2) (Direktorat Aneka
Tanaman 2000). Kandungan minyak atsiri enam nomor harapan tersebut juga
lebih tinggi (6,2–9,8%) dibandingkan dengan persyaratan yang telah ditentukan
oleh Materia Medika Indonesia (5,0%). Kadar kurkuminnya berkisar 1,2–3,6%
dan rata-rata yang terdapat di pasaran adalah lebih kurang 1,93% (Setiyono &
Ajijah 2002).
Pada bagian pertama penelitian ini dilakukan pemilihan sampel dari dua
nomor harapan (A dan F) dan dua lokasi tanam (Cileungsi dan Boyolali) yang
sesuai untuk budidaya temulawak yang memiliki kandungan bioaktif tinggi
(xantorizol). Nomor harapan A dan F dipilih berdasarkan keunggulan produksi
rimpang dan mutu kandungan zat berkhasiat terhadap enam nomor harapan
temulawak yang telah dilakukan pada uji multilokasi oleh tim peneliti Balittro
(Setiono et al. 2006). Selanjutnya temulawak terpilih yang mengandung xantorizol
tertinggi digunakan lebih lanjut untuk keperluan penelitian bagian kedua, yaitu
Xantorizol merupakan antibakteri potensial yang memiliki spektrum luas
terhadap aktivitas antibakteri, stabil terhadap panas, dan aman terhadap kulit
manusia. Xantorizol dapat menghambat berbagai macam bakteri, misalnya
Streptococcus mutans, Bifidobacterium bifidum, Penicilium chrysogenum, dan
beberapa bakteri lainnya (Hwang 2004). Oleh karena itu xantorizol dapat
dimanfaatkan pada berbagai produk, misalnya pada pasta gigi, sabun, pembersih
mulut, permen karet, kosmetik, dan industri farmasi. Hwang et al. (2000) telah
berhasil mengisolasi xantorizol dari fraksi etil asetat ekstrak metanol temulawak
sebanyak 0.2 g dari 100 g rimpang temulawak kering (rendemen 0.2%). Aguilar et
al. (1993) juga telah mengisolasi xantorizol dari ekstrak kloroform akar tanaman
Iostephane heterophylla (asal Meksiko) sebanyak 12.02 g dari 2.8 kg sampel yang
digunakan (rendemen 0.42%). Pada bagian kedua penelitian ini dilakukan isolasi
xantorizol dari temulawak terpilih menggunakan metode separasi dengan teknik
kromatografi lapis tipis (KLT) preparatif dan asetilasi ekstrak kasar. Asetilasi ekstrak
kasar sebelum pemurnian dengan KLT preparatif diharapkan dapat menghasilkan
rendemen lebih tinggi. Selain itu dilakukan pula isolasi xantorizol menggunakan
metode Hwang et al. (2000) sebagai metode pembanding untuk memperoleh
informasi mengenai karakteristik xantorizol.
Tujuan Penelitian
Tujuan penelitian ini adalah (a) memilih nomor harapan temulawak A atau F
dari Balittro yang terbaik berdasarkan kandungan xantorizol yang tinggi, (b)
menentukan kondisi lingkungan agrobiofisik yang menghasilkan tingkat bahan aktif
tinggi, dan (c) mendapatkan metode separasi (ekstraksi – asetilasi – separasi dengan
KLT preparatif – deasetilasi) yang dapat memisahkan xantorizol dengan kadar lebih
tinggi daripada metode yang sudah ada (metode Hwang 2000: ekstraksi – separasi
kolom kromatografi tahap 1 – asetilasi – separasi kolom kromatografi tahap 2 -
TINJAUAN PUSTAKA
Temulawak (Curcuma xanthorrhiza Roxb)
Curcuma berasal dari bahasa Yunani, xanthos yang berarti kuning dan
rhizaa yang berarti umbi akar. Jadi Curcuma xanthorrhiza berarti akar kuning.
Temulawak atau koneng gede (Sunda), temo labak (Madura), temulawas
(Malaysia) merupakan tanaman asli Indonesia yang penyebarannya banyak
terdapat di Ambon, Bali, dan Jawa (Sutarno & Atmawidjojo 2001). Saat ini
tanaman ini selain di Asia Tenggara dapat ditemui pula di Cina, Indocina,
Bardabos, India, Jepang, Korea, Amerika Serikat, dan beberapa negara Eropa
(Anonim 2005). Dari segi taksonomi, temulawak masuk dalam dunia plantae,
divisi Spermatophyta, sub divisi Angiospermae, kelas Monocotyledonae, keluarga
Zingiberaceae, genus Curcuma, dan spesies Curcuma xanthorrhiza.
Temulawak dapat tumbuh pada ketinggian 5-1800 meter di atas permukaan
laut (m dpl) dengan ketinggian tempat optimum adalah 750 m dpl.
Pembudidayaan di dataran rendah pada ketinggian 240 m dpl menghasilkan
rimpang yang kandungan patinya lebih tinggi, sebaliknya di dataran tinggi
menghasilkan minyak atsiri yang lebih tinggi dibanding dataran rendah
(Direktorat Aneka Tanaman 2000).
Secara alami temulawak tumbuh dengan baik di lahan-lahan yang teduh dan
terlindung dari sinar matahari. Di habitat alamiya, rumpun tanaman ini tumbuh
subur di bawah naungan pohon bambu dan jati. Meskipun demikian, temulawak
juga dapat tumbuh di tempat yang terik, seperti di tanah tegalan. Tanaman ini
memiliki daya adaptasi yang tinggi pada berbagai cuaca di daerah beriklim tropis
(Afifah & Lentera 2003). Tanaman ini memerlukan curah hujan tahunan
1500-4000 mm/tahun atau daerah bertipe iklim A, B, dan C menurut Schimdt-Ferguson.
Pada daerah iklim C tanaman cepat mengalami fase pertumbuhan mengering pada
bagian daun dan batang semu karena musim hujan yang relatif lebih pendek
dibandingkan daerah dengan tipe iklim A dan B, sedangkan toleransi suhu untuk
pertumbuhan adalah antara 19-35oC (Soediarto 1985).
Perakaran temulawak dapat beradaptasi dengan baik pada berbagai jenis
berliat. Produksi rimpang yang optimum memerlukan tanah yang subur, gembur,
dan berdrainase baik. Pemupukan anorganik dan organik diperlukan juga untuk
memberi unsur hara yang cukup dan menjaga struktur tanah agar tetap gembur.
Tanah yang mengandung bahan organik diperlukan untuk menjaga agar tanah
tidak mudah tergenang air (Rahardjo & Rostiana 2005).
Temulawak (Gambar 1a) merupakan tumbuhan tahunan yang tumbuh tegak
dengan tinggi hingga lebih dari 1 m tetapi kurang dari 2 m, berwarna hijau atau
cokelat gelap. Akar rimpang terbentuk dengan sempurna dan bercabang kuat,
berwarna hijau gelap. Tiap batang mempunyai 2–9 helai daun dengan bentuk
bundar memanjang sampai lanset, warna daun hijau atau cokelat keunguan terang
sampai gelap, panjang daun 31–84 cm dan lebar 10–18 cm, panjang tangkai daun
termasuk helaian 43–80 cm. Daun termasuk tipe daun sempurna, artinya tersusun
dari pelepah daun, tangkai daun, dan helai daun (Sidik et al. 1995). Kelopak
bunga berwarna putih berbulu, panjang 8–13 mm, mahkota bunga berbentuk
tabung dengan panjang keseluruhan 4,5 cm, helaian bunga berbentuk bundar
memanjang berwarna putih dengan ujung yang berwarna merah dadu atau merah,
panjang 1,25–2 cm dan lebar 1 cm (Anonim 2005).
Sebagai tanaman monokotil, temulawak tidak memiliki akar tunggang. Akar
yang dipunyai adalah rimpang. Rimpang adalah bagian batang di bawah tanah.
Rimpang disebut juga umbi akar, umbi batang atau umbi tinggal. Rimpang
temulawak berukuran paling besar di antara semua rimpang genus Curcuma
dengan diameter sampai 6 cm. Rimpang temulawak terdiri atas rimpang induk
(empu) dan rimpang anakan (cabang). Rimpang induknya berbentuk bulat seperti
telur dan berwarna kuning tua atau cokelat kemerahan. Bagian dalamnya
berwarna jingga kecokelatan. Rimpang kedua yang lebih kecil keluar dari rimpang
induk. Arah pertumbuhannya ke samping, berwarna lebih muda dengan bentuk
yang bermacam-macam, jumlahnya sekitar 3-7 buah. Jika dibiarkan tumbuh lebih
dari satu tahun, akan tumbuh banyak rimpang lagi. Rimpang ini aromanya tajam
dan rasanya pahit agak pedas. Produk yang diambil dari tanaman tersebut adalah
rimpang induk yang tumbuh dekat permukaan tanah dengan kedalaman 5–8 cm
dan kering. Panen yang terbaik adalah ketika tanaman berumur 11-12 bulan
(Darwis et al. 1991). Irisan rimpang temulawak ditunjukkan pada Gambar 1b.
( a) (b)
Gambar 1 (a) Tanaman temulawak dan (b) irisan rimpang temulawak
Komposisi Kimia Temulawak
Rimpang temulawak mengandung zat warna kuning kurkumin, minyak
atsiri, pati, protein, lemak, selulosa, dan mineral (Ketaren 1988). Kadar dari setiap
komponen tersebut bergantung pada umur panen. Rimpang kering temulawak
mengandung 29–34% karbohidrat, dan 6–10% minyak atsiri, sedangkan rimpang
segar mengandung air 70–80% (Herman 1985). Suwiah (1991) menguraikan
komposisi rimpang kering temulawak dengan kadar air 10% yang ditunjukkan
pada Tabel 1. Menurut Sinambela (1985), komponen utama rimpang temulawak
adalah fraksi zat warna kurkuminoid dan minyak atsiri. Kadar minyak atsiri
rimpang temulawak dari berbagai sumber pustaka ditunjukkan pada Tabel 2.
Komponen minyak temulawak menurut Liang et al. (1985), Anang 1992, serta
Dickes dan Nicholas (1976) dapat dilihat pada Tabel 3.
Tabel 1 Komposisi rimpang temulawak
Komponen Persentase (%)
Pati 27.62
Lemak (fixed oil) 5.38
Kurkumin 1.93
Serat kasar 6.89
Abu 3.96 Protein 6.44
Minyak atsiri 10.96
Tabel 2 Kadar minyak atsiri rimpang temulawak
Sumber Kadar minyak atsiri (%)
Balai Penelitian dan Pengembangan
Industri Ujung Pandang (1980 dalam Herman 1985)
6-10
Meijer dan Kollhaas (1939 dalam Nurdjanah et al. 1994) 7,3-9,5
Lucker et al. (1976 dalam Liang et al. 1985) 7-11
Sirait et al. (1985)
Rimpang temulawak berumur:
8 bulan 4,6
10 bulan 5,2
12 bulan 5,3
15 bulan 5,1
Tabel 3 Komponen minyak temulawak
I II III
1. trisiklin 2.α-pinena 3. kamfena 4.β-pinena 5. sabrinena 6. mirsena 7. felandrena 8. limonena 9. 1,8-sineol 10. δ-terpinena 11. β- simen 12. terpionlen
13. δ-elemena
14. kamfor 15. α-bergamolena 16. β-elemena 17. kariofilena 18. allo-aromadendren 19. trans-β-farnesena 20. berneol
21. gerwakrena D 22. zingiberena 23. β-bisabolen 24. β-kurkumena 25. β-kadinena 26. β-seskuifelandrena 27. ar-kurkumen 28. isofuranogermasen 29. turmeron 30. turmerol 31. ar-turmeron 32. xantorizol *seskuiterpen - β-kurkumena -α-kurkumena -1-sikloisoprenmirsean -zingiberena -xantorizol -turunan bisabolen -epolisid-bisakuron -bisakuron A -bisakuron B -bisakuron C *ketonseskuiterpena -turmeron
-α-turmeron -α-atlanton (0,3%) -germakron *monoterpena -sineol -d-borneol -d-α-feladrena -d-kamfan -α-lumulena (25,2%) -kamfan (21,9%) -zerumbon (21,2%) -α-kurkumen (0,8%) -lumulen epolesi (4,6%)
-kamfor (4,2%) -α-pinena (3,4%) -borneol dan α-terpineol (0,6%) -eukaliptol (1,8%) -β-kariofilena (1,6%) -limonena (1,5%) -linaloal (0,9%) -3-karena (0,3%) -lumulena dioksida -β-pinena (0,6%) Sumber:
I = Liang et al. (1985)
Xantorizol
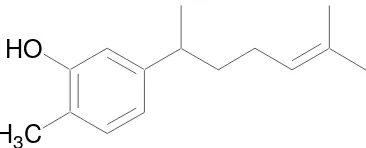
Xantorizol merupakan komponen minyak atsiri rimpang temulawak yang
termasuk ke dalam kelompok terpena teroksigenasi. Xantorizol merupakan
komponen yang khas dari minyak temulawak yang membedakannya dengan minyak
jenis curcuma yang lain (Setijadi 1985, Sirait et al. 1985).
Ciri xantorizol menurut Hwang (2000) adalah sebagai berikut: golongan
seskuiterpena, BM 218 g/mol, tidak berwarna, tak-asiri, stabil terhadap suhu dan
panas, sangat pahit, dan rumus molekulnya ialah C15H22O. Xantorizol larut dalam
DMSO dan etanol 96%. Nama IUPAC (International Union of Pure and Applied
Chemistry) xantorizol adalah 5-(1,5-dimetil-heks-4-enil)-2-metil-fenol. Rumus
strukturnya ditunjukkan pada Gambar 2.
HO
H
3C
Gambar 2 Struktur xantorizol (Hwang 2000)
Aktivitas Hayati Xantorizol
Xantorizol mempunyai daya hambat yang tinggi terhadap bakteri spesies
Streptococus penyebab karies pada gigi. Berdasarkan hal tersebut maka xantorizol
dapat digunakan dalam produk makanan dan pasta gigi untuk mencegah penyakit
pada gigi (Hwang 2000). Xantorizol juga dapat digunakan sebagai agen potensial
pembentukan biofilm oleh Streptococcus mutans (Rukayadi & Hwang 2007).
Penelitian lain menunjukkan bahwa xantorizol memiliki aktivitas sebagai anti-fungi
pada spesies candida, sehingga dimungkinkan dapat digunakan untuk pengobatan
candidiasis (Rukayadi 2006).
Xantorizol juga memiliki aktivitas hayati sebagai antikanker dan antiinflamasi.
Penelitian Lee et al. (2002) memperlihatkan bahwa xantorizol dapat digunakan
sebagai kandidat inhibitor COX-2 dan iNOS bagi penderita kanker kemopreventif
Liem et al. (2005) melaporkan bahwa xantorizol merupakan kandidat efektif untuk
pengobatan penyakit alzheimer dan penyakit saraf lain yang terkait dengan Reactive
Oxygen Species (ROS) dan inflamasi. Yamazaki et al. (1987 dalam Sidik 1995) juga
menyatakan xantorizol mempunyai efek memperpanjang masa tidur yang
diakibatkan oleh pentobarbital dengan cara menghambat aktivitas sitokrom P450,
atau dengan kata lain xantorizol dapat digunakan sebagai antidepresan.
Penelitian lain yang dilakukan Chilwan et al. (1993) yang meneliti efek
insektisida empat jenis rimpang spesies Zingiberaceae, yaitu Curcuma xanthorriza,
C. Zeodoaria, Kaempferia galanga, dan K. pandurata. 17 komponen terbesar
termasuk flavonoid, seskuiterpenoid, dan derivat asam sinamat berhasil diisolasi dan
diidentifikasi menggunakan nuclear magnetic resonance (NMR) dan spektrum
massa. Semua komponen ini diuji toksisitasnya terhadap larva Spodoptera littoralis.
Hasil uji biologis nya menunjukkan bahwa xantorizol dan furanodienon merupakan
senyawa yang paling aktif menunjukkan toksisitas melawan larva yang baru lahir.
Isolasi Xantorizol (Hwang 2000)
Hwang telah berhasil mengisolasi xantorizol dari rimpang tanaman
temulawak menggunakan metode ekstraksi pelarut, kolom kromatografi, dan
reaksi asetilasi dan deasetilasi. Sistem ekstraksi yang dilakukan adalah ekstraksi
bertahap menggunakan pelarut metanol dan etil asetat. Ekstrak kasar yang
diperoleh kemudian diaplikasikan dalam kromatografi kolom menggunakan fase
diam silika gel dan eluen campuran heksana dan etil asetat untuk memperoleh
fraksi aktif yang mengandung xantorizol. Tahap selanjutnya yang dilakukan
Hwang (2000) adalah melakukan asetilasi terhadap fraksi aktif hasil kolom, dan
dilanjutkan dengan mengaplikasikan kembali fraksi aktif terasetilasi tersebut ke
dalam kolom kromatografi untuk memperoleh senyawa tunggal terasetilasi. Tahap
terakhir adalah deasetilasi terhadap fraksi aktif terasetilasi tunggal untuk
memperoleh senyawa xantorizol murni. Identifikasi yang dilakukan adalah dengan
spektroskopi inframerah dan NMR. Berdasarkan hasil penelitiannya, Hwang
berhasil memperoleh senyawa xantorizol sebanyak 0.2 g dari 100 g sampel
temulawak kering yang digunakan, atau dengan kata lain rendemen yang
METODE PENELITIAN
Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini adalah evaporator, pelat KLT
silika gel GF254, kolom kromatografi silika gel (Merck; 70-230 mesh; 1×25 cm),
spektrofotometer FTIR merek Shimadzu, HPLC merek Shimadzu, dan LC-MS
merek Shimadzu.
Bahan-bahan yang digunakan adalah temulawak yang berasal dari
Kabupaten Boyolali dan Cileungsi yang masing-masing terdiri atas dua nomor
harapan, yaitu A dan F (Balittro), yang dipanen pada umur 9 bulan setelah tanam,
resin penukar kation jenis Dowex C-211, dan standar xantorizol (diperoleh dari
Prof. Hwang JK, Universitas Yonsei, Korea Selatan).
Prosedur
Secara garis besar penelitian dibagi menjadi 2 bagian utama, yaitu (1)
pemilihan sampel temulawak dari 2 nomor harapan dan 2 lokasi tanam yang
menghasilkan kadar bioaktif tinggi (xantorizol), dan (2) isolasi xantorizol dari
sampel temulawak terpilih.
Pemilihan Sampel Temulawak
Pada bagian pertama, dilakukan pemilihan sampel temulawak yang terdiri
atas dua nomor harapan temulawak yang dimiliki Balittro (A dan F), yang berasal
dari dua daerah, yaitu Cileungsi dan Boyolali. Dengan demikian pada percobaan ini
diamati sebanyak empat sampel, masing-masing sampel terdiri atas tiga ulangan.
Sampel diekstraksi menggunakan etanol 96%, selama enam jam sambil sekali-kali
diaduk, kemudian didiamkan sampai 24 jam. Maserat dipisahkan, dan proses
diulang dua kali dengan jenis dan jumlah pelarut yang sama. Semua maserat
dikumpulkan kemudian disaring dengan kertas saring Whatman lalu diuapkan
dengan penguap vakum. Ekstrak kental diukur kadar xantorizolnya dengan
menggunakan HPLC. Sistem HPLC yang digunakan ialah kolom C18, detektor
UV-Vis, volume injeksi 10 µL, elusi gradien (eluen H3PO4 dan metanol), dan
tertinggi merupakan sampel terpilih yang digunakan untuk tahap penelitian
selanjutnya.
Isolasi Xantorizol
Pada bagian kedua, dilakukan isolasi xantorizol menggunakan metode
modifikasi ekstraksi pelarut, asetilasi ekstrak kasar, dan kromatografi lapis tipis
preparatif, serta dilakukan pula isolasi menggunakan metode Hwang (2000) sebagai
metode pembanding. Bagan alir isolasi xantorizol ditunjukkan pada Lampiran 1.
Metode Hwang (2000)
Isolasi Ekstrak Kasar
Isolasi ekstrak kasar dilakukan dengan cara ekstraksi pelarut. Sampel
temulawak terpilih (dari bagian 1) diekstraksi dengan cara maserasi dengan
pelarut metanol 75% (v/v) selama 6 jam sambil sekali-kali diaduk, kemudian
didiamkan sampai 24 jam. Maserat dipisahkan, dan proses diulang 2 kali dengan
jenis dan jumlah pelarut yang sama. Semua maserat dikumpulkan kemudian
disaring dengan kertas saring Whatman lalu diuapkan dengan penguap vakum.
Ekstrak kental yang dihasilkan difraksinasi lebih lanjut dengan pelarut etil asetat
kemudian diuapkan lagi sehingga diperoleh fraksi etil asetat dan metanol. Kedua
fraksi tersebut lalu dianalisis dengan KLT menggunakan pelarut heksana:etil
asetat (10:1, v/v). Fraksi yang mengandung senyawa xantorizol (Rf-nya sama
dengan Rf standar) digunakan untuk isolasi lebih lanjut dengan kromatografi
kolom.
Kromatografi Kolom
Ekstrak kasar yang diperoleh selanjutnya difraksinasi menggunakan
kromatografi kolom. Kromatografi kolom dilakukan dengan menggunakan fase
diam berupa silika gel Merck dengan ukuran 70-230 mesh, dimensi 1×25 cm, dan
fase gerak berupa heksana:etil asetat (10:1, v/v). Fraksi-fraksi ditampung setiap 5
ml. Selanjutnya fraksi yang diperoleh dianalisis dengan KLT dan Rf dari fraksi
dibandingkan dengan standar xantorizol. Fraksi yang mempunyai Rf dan jumlah
spot yang sama digabung, kemudian diuapkan sehingga diperoleh fraksi
Asetilasi dan Deasetilasi
Asetilasi dilakukan terhadap fraksi xantorizol hasil kromatografi kolom
dengan cara melarutkannya ke dalam piridin:asetat anhidrat (1:1, v/v) dan
direaksikan selama 24 jam pada suhu kamar. Kemudian senyawa terasetilasi yang
diperoleh dimasukkan ke dalam kolom kromatografi lagi menggunakan eluen
heksana:etil asetat (10:1, v/v) sehingga diperoleh fraksi xantorizol terasetilasi.
Fraksi ini kemudian dicirikan dengan KLT dan FTIR.
Deasetilasi dilakukan terhadap fraksi xantorizol terasetilasi dengan cara
melarutkannya ke dalam metanol, lalu ditambahkan KOH dengan konsentrasi
3-7%, kemudian dimasukkan ke dalam resin penukar kation selama 3 jam sehingga
diperoleh senyawa xantorizol. Pencirian dilakukan menggunakan KLT,
spektrofotometer FTIR, HPLC, dan LC-MS.
Metode Modifikasi
Isolasi ekstrak kasar dilakukan dengan cara ekstraksi pelarut. Sampel
temulawak sebanyak 250 g diekstraksi dengan cara maserasi dengan pelarut
etanol 96% (v/v) selama enam jam sambil sekali-kali diaduk, kemudian
didiamkan sampai 24 jam. Maserat dipisahkan, dan proses diulang dua kali
dengan jenis dan jumlah pelarut yang sama. Semua maserat dikumpulkan
kemudian disaring dengan kertas saring Whatman lalu diuapkan dengan penguap
vakum. Ekstrak kental yang dihasilkan kemudian dihilangkan kandungan airnya
menggunakan natrium sulfat anhidrat, kemudian diasetilasi menggunakan
prosedur yang sama dengan prosedur asetilasi metode Hwang (2000). Produk
asetilasi kemudian dicirikan (KLT dan FTIR), hasilnya dibandingkan dengan hasil
asetilasi metode Hwang. Selanjutnya senyawa hasil asetilasi tersebut difraksinasi
lanjut dengan KLT preparatif menggunakan eluen yang sama dengan eluen kolom
kromatografi metode Hwang, lalu dideasetilasi. Hasil deasetilasi dicirikan dengan
HASIL DAN PEMBAHASAN
Sampel Temulawak Terpilih
Pada penelitian ini sampel yang digunakan terdiri atas empat jenis sampel,
yang dibedakan berdasarkan lokasi tanam dan nomor harapan. Lokasi tanam terdiri
atas daerah Cileungsi (Jawa Barat) dan Boyolali (Jawa Tengah). Pemilihan kedua
lokasi tanam tersebut dimaksudkan untuk mewakili kondisi agrobiofisik yang
berbeda sehingga dapat menunjukkan lokasi yang paling sesuai untuk
membudidayakan tanaman temulawak yang memiliki kandungan bioaktif tertinggi
(dalam hal ini xantorizol). Cileungsi mewakili sentra pengembangan budidaya
temulawak di Jawa Barat sedangkan Kragilan (Boyolali) yang mewakili sentra
pengembangan budi daya temulawak di Jawa Tengah. Nomor harapan yang
digunakan sebagai sampel adalah nomor harapan A dan F, yang keduanya
merupakan nomor harapan temulawak yang digunakan oleh Balai Penelitian
Tanaman Rempah dan Obat (Balittro) untuk uji multilokasi. Nomor harapan A dan
F dipilih berdasarkan keunggulan produksi rimpang dan mutu kandungan zat
berkhasiat dibandingkan enam nomor harapan temulawak lainnya yang telah
dilakukan tim peneliti Balittro (Setiono et al. 2006).
Berdasarkan uji xantorizol, kedua nomor harapan temulawak memiliki
kecenderungan yang berbeda dalam menghasilkan bioaktif. Analisis statistika
pengaruh lokasi tanam dan nomor harapan pada kandungan xantorizol ditunjukkan
pada Lampiran 2. Hasilnya menunjukkan bahwa lokasi penanaman dan nomor
harapan mempunyai pengaruh yang berbeda nyata pada kandungan xantorizol
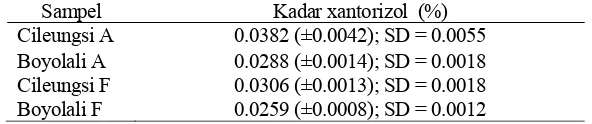
temulawak. Kandungan xantorizol tertinggi dihasilkan oleh nomor harapan
temulawak A di lokasi Cileungsi, yaitu 0,0382%. Contoh kromatogram HPLC dan
cara perhitungan kadar xantorizol ditunjukkan pada Lampiran 3 dan rekapitulasi
hasil pengukuran kandungan xantorizol dalam keempat jenis sampel ditunjukkan
pada Tabel 4.
Tabel 4 Kandungan xantorizol keempat jenis sampel temulawak
Sampel Kadar xantorizol (%)
Produksi metabolit sekunder pada suatu tanaman dipengaruhi oleh banyak
faktor, di antaranya genetik, nutrisi, enzim, umur tanaman, dan interaksi antara
lingkungan biotik dan abiotik. Setiap faktor memiliki mekanisme biokimiawi
kompleks tertentu yang menyebabkan kedua nomor harapan temulawak
memproduksi bioaktif xantorizol berbeda baik yang ditanam di Cileungsi maupun di
Boyolali.
Kondisi curah hujan di lokasi penelitian menurut Setiyono et al. (2006) adalah
5500-6500 mm/tahun untuk Boyolali dan 223,97 mm/tahun untuk Cileungsi.
Waterman dan Mole (1989; dalam Seigler 1998) menyatakan bahwa kuantitatif dan
kualitatif yang beragam dari metabolit sekunder pada tanaman dapat terjadi sebagai
respons dari cekaman yang ditimbulkan oleh lingkungannya. Curah hujan di
Cileungsi lebih rendah dan kondisi tanah lebih liat dibandingkan Boyolali. Hal ini
diduga merupakan salah satu kondisi cekaman yang memungkinkan terjadinya
induksi dalam produksi xantorizol yang tinggi di lokasi Cileungsi. Meskipun
induksi xantorizol dipengaruhi juga oleh faktor genetik kedua nomor harapan
temulawak tersebut. Hal ini sesuai dengan penelitian yang dilakukan oleh
Khaerana (2007) yang menunjukkan bahwa cekaman kekeringan menyebabkan
meningkatnya kandungan metabolit jenis asiri dalam temulawak. Kondisi
agrobiofisik lokasi penanaman temulawak pada penelitian ini ditunjukkan pada
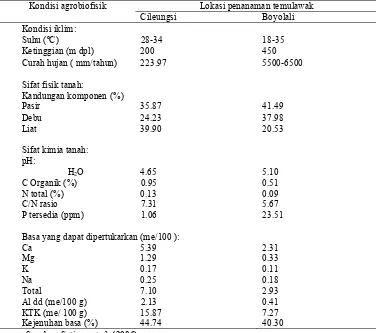
Tabel 5.
Berdasarkan hasil penelitian, sampel yang menunjukkan kandungan
xantorizol tertinggi dimiliki oleh sampel yang ditanam di Cileungsi dengan nomor
harapan A, maka sampel tersebutlah yang dipilih sebagai sampel untuk keperluan
Tabel 5 Ciri agrobiofisik lokasi penanaman temulawak
Kondisi agrobiofisik Lokasi penanaman temulawak
Cileungsi Boyolali Kondisi iklim:
Suhu (ºC) 28-34 18-35
Ketinggian (m dpl) 200 450
Curah hujan ( mm/tahun) 223.97 5500-6500
Sifat fisik tanah:
Kandungan komponen (%)
Pasir 35.87 41.49 Debu 24.23 37.98 Liat 39.90 20.53
Sifat kimia tanah:
pH:
H2O 4.65 5.10
C Organik (%) 0.95 0.51
N total (%) 0.13 0.09
C/N rasio 7.31 5.67
P tersedia (ppm) 1.06 23.51
Basa yang dapat dipertukarkan (me/100 ):
Ca 5.39 2.31
Mg 1.29 0.33
K 0.17 0.11
Na 0.25 0.18
Total 7.10 2.93
Al dd (me/100 g) 2.13 0.41
KTK (me/ 100 g) 15.87 7.27
Kejenuhan basa (%) 44.74 40.30
Sumber: Setiono et al. (2006)
Isolasi Xantorizol
Pada bagian kedua penelitian ini dilakukan dua jenis metode isolasi
xantorizol. Metode pertama menggunakan metode Hwang (2000) sebagai metode
pembanding, dan metode kedua menggunakan kromatografi lapis tipis preparatif
yang digabung dengan modifikasi dari metode Hwang.
Metode Hwang (2000)
Ekstraksi menghasilkan ekstrak kasar metanol sebanyak 14.6244 g dari
sampel awal 250 g (5.8%). Fraksinasi lanjut dengan etil asetat menghasilkan
ekstrak etil asetat sebanyak 5.7127 g (39.06%). Dari hasil fraksinasi kolom
ekstrak etil asetat diperoleh 20 fraksi. Masing-masing fraksi yang diperoleh
tersebut dianalisis menggunakan kromatografi lapis tipis (KLT) dan dibandingkan
xantorizol ditunjukkan pada Gambar 3. Berdasarkan hasil KLT tersebut,
ditentukan fraksi yang mengandung xantorizol adalah fraksi nomor 4 sampai
fraksi nomor 10. Fraksi tersebut (2.5083 g) kemudian diasetilasi untuk
menghasilkan fraksi xantorizol terasetilasi yang diharapkan dapat memisahkan
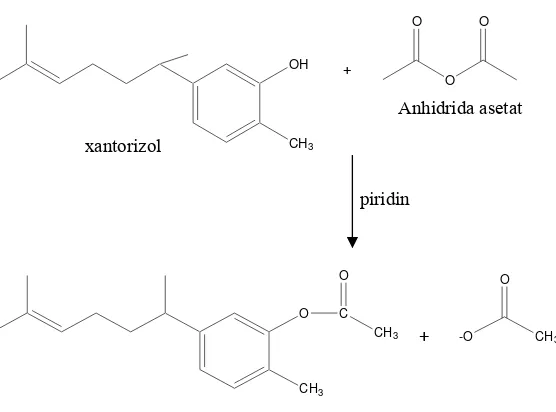
fraksi yang mengandung xantorizol dengan yang tidak. Skema reaksi yang terjadi
[image:31.612.201.441.213.402.2]saat proses asetilasi ditunjukkan pada Gambar 4.
Gambar 3 KLT fraksi hasil separasi kolom metode Hwang (pelarut heksana:etil asetat = 10:1)
+ OH
CH3
O
O O
Gambar 4 Skema reaksi asetilasi xantorizol Sampel Stdr 3 5 7 9 11 13 15 17 19
O
CH3 C O
CH3 -O CH3
O
piridin
+
xantorizol
Anhidrida asetat
[image:31.612.192.470.455.661.2]Berdasarkan hasil reaksi asetilasi, diperoleh dua fase seperti yang ditunjukkan
pada Gambar 5. Fase pertama (fase atas) merupakan fase yang tidak larut air
sehingga diduga merupakan fase tempat terdapatnya xantorizol, sedangkan fase
kedua (fase bawah) merupakan fase yang larut dalam air sehingga diduga tidak
[image:32.612.235.516.181.342.2]terdapat xantorizol.
Gambar 5 Hasil reaksi asetilasi
Lapisan atas yang diduga mengandung xantorizol terasetilasi dipisahkan dari
lapisan bawah dengan menggunakan corong pisah, lalu dianalisis menggunakan
KLT. Hasilnya ditunjukkan pada Gambar 6.
a. standar xantorizol b. hasil asetilasi
Gambar 6 KLT standar xantorizol dan fraksi xantorizol terasetilasi (pelarut heksana:etil asetat = 10:1)
Fraksi xantorizol sebelum dan sesudah asetilasi juga dianalisis dengan FTIR
untuk membuktikan berlangsungnya reaksi asetilasi. Hasil analisis menggunakan
Lapisan atas:
xantorizol terasetilasi (tak larut air)
Lapisan bawah: fraksi larut air
xantorizol terasetilasi (Rf = 0.86)
[image:32.612.197.515.446.648.2]FTIR untuk fraksi xantorizol sebelum diasetilasi ditunjukkan pada Lampiran 4a,
sedangkan untuk fraksi xantorizol setelah diasetilasi ditunjukkan pada Lampiran 4b.
Perbandingan spektrum FTIR sebelum dan setelah asetilasi ditunjukkan pada
Gambar 7. Dari spektrum yang diperoleh, pada spektrum hasil asetilasi (warna
merah) menunjukkan adanya serapan yang muncul pada bilangan gelombang 1767
cm-1 yang merepresentasikan adanya gugus asetil (Sudjadi 1983), sedangkan pada
spektrum sebelum asetilasi (warna biru) tidak ditemukan adanya serapan tersebut.
Selain itu, jika dilihat dari keberadaan gugus –OH, pada spektrum sebelum asetilasi
terdapat serapan dengan intensitas yang sangat besar pada bilangan gelombang
sekitar 3500 cm-1, sedangkan pada spektrum setelah asetilasi juga ditemukan serapan
tersebut namun dengan intensitas yang jauh lebih kecil. Hal tersebut menunjukkan
bahwa reaksi asetilasi berlangsung dengan baik.
Secara teoretis, reaksi asetilasi xantorizol juga dapat diduga berdasarkan efek
konjugasi dan induksi dari gugus-gugus fungsi yang terlibat. Gugus asetil dari
anhidrida asetat akan cenderung memilih terikat pada gugus fenol dibandingkan
terikat pada cincin benzena dari struktur xantorizol. Hal ini dikarenakan efek induksi
dari atom oksigen (O) yang lebih dominan dibandingkan efek konjugasi. Akibatnya
energi yang dihasilkan lebih tinggi dan bilangan gelombang ikatan C=O juga
bergeser ke bilangan gelombang yang lebih tinggi. Ikatan C=O pada ester normalnya
memiliki bilangan gelombang sekitar 1730 cm-1, sedangkan pada spektrum FTIR
setelah asetilasi yang diperoleh muncul serapan pada bilangan gelombang 1767 cm-1.
Sebaliknya, kemungkinan gugus asetil terikat pada cincin benzena dapat dieliminasi,
karena secara teori jika hal tersebut terjadi, maka efek konjugasi atau delokalisasi
elektron π antara ikatan C=O dengan cincin bezena akan lebih dominan, sehingga
menaikkan karakter ikatan rangkap dari ikatan yang menghubungkan C=O dengan
cincin, dan akan menurunkan bilangan gelombang sebesar 20-30 cm-1 (Sudjadi
1983). Artinya jika hal ini terjadi, seharusnya akan muncul serapan pada bilangan
gugus ‐OH
gugus asetil (COCH3)
sebelumasetilasi
setelah asetilasi
Gambar 7 Perbandingan spektrum FTIR sebelum dan setelah asetilasi (metode Hwang)
Lapisan atas (xantorizol terasetilasi sebanyak 1.0951 g) difraksinasi lebih
lanjut dengan kolom kromatografi. Kondisi operasi kolom sama seperti kolom
pertama, lalu hasilnya dikembangkan lagi dengan KLT (Gambar 8) untuk
memperoleh fraksi tunggal xantorizol terasetilasi. Berdasarkan hasil KLT, diduga
fraksi yang mengandung xantorizol terasetilasi adalah fraksi 1 dan fraksi 2.
Gambar 8 KLT fraksi xantorizol terasetilasi hasil separasi kolom metode Hwang (pelarut heksana:etil asetat = 10:1)
Fraksi xantorizol terasetilasi tersebut (0.6175 g) (selanjutnya dilarutkan
dalam metanol, lalu dideasetilasi dengan cara ditambahkan KOH 5%, kemudian di
masukkan ke dalam resin penukar kation (Dowex C-211). Fungsinya adalah untuk
memperoleh kembali xantorizol murni dengan prinsip menukarkan kembali ion
asetil yang diperoleh dari hasil asetilasi dengan ion H+ yang berasal dari resin.
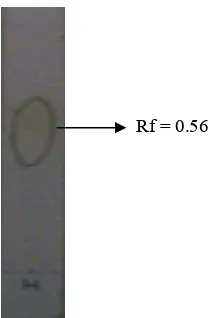
Berdasarkan hasil penelitian diperoleh kembali fraksi yang diduga xantorizol
sebanyak 0.1608 g (0.064%). KLT fraksi dugaan xantorizol ditunjukkan pada
Gambar 9. Pencirian lain yang dilakukan adalah dengan FTIR, HPLC dan
LC-MS, yang masing-masing hasilnya ditunjukkan berturut-turut pada Lampiran 4c,
Lampiran 5, dan Lampiran 7.
[image:35.612.303.407.271.430.2]
Gambar 9 KLT fraksi dugaan xantorizol metode Hwang (pelarut heksana:etil asetat = 10:1)
Berdasarkan spektrum FTIR yang diperoleh, terlihat kembali serapan
dengan intensitas yang cukup besar pada bilangan gelombang 3430.88 cm-1 yang
menunjukkan terbentuknya kembali gugus –OH dari xantorizol, dan hilangnya
serapan gugus asetil pada daerah serapan sekitar 1700 cm-1. Berdasarkan
kromatogram HPLC yang diperoleh, terlihat bahwa muncul satu puncak pada
waktu retensi 14.817 menit dengan luas area yang cukup besar. Jika dibandingkan
dengan kromatogram standar xantorizol (Lampiran 6) yang menunjukkan puncak
xantorizol pada waktu retensi 14.820 menit, maka dapat diduga bahwa hasil
isolasi dengan metode Hwang berhasil memperoleh senyawa xantorizol. Hal ini
juga diperkuat dengan data hasil LC-MS yang juga menunjukkan adanya satu
puncak dengan bobot molekul 218.03 yang merupakan bobot molekul dari
xantorizol.
Metode Modifikasi
Metode modifikasi dilakukan dengan ekstraksi pelarut, reaksi asetilasi dan
KLT preparatif. Pelarut yang digunakan adalah etanol 96%. Ekstrak kasar etanol
yang diperoleh dari 250 g sampel awal adalah sebanyak 18.0454 g (7.2%).
Ekstrak etanol ini lebih besar daripada ekstrak kasar metanol yang diperoleh pada
metode Hwang (5.8%). Hal ini karena polaritas etanol yang lebih rendah
dibandingkan metanol, sehingga komponen-kompenen yang bersifat semi-polar
juga ikut terekstrak. Reaksi asetilasi terhadap ekstrak etanol tersebut
menghasilkan dua lapisan, sama seperti hasil asetilasi pada metode Hwang
(Gambar 6). Lapisan atas yang diduga mengandung xantorizol terasetilasi
dipisahkan dari lapisan bawah dengan menggunakan corong pisah, lalu dianalisis
menggunakan KLT. Hasilnya ditunjukkan pada Gambar 10.
Hasil asetilasi dan ekstrak etanol sebelum asetilasi juga dianalisis dengan
FTIR untuk membuktikan berlangsungnya reaksi asetilasi. Hasil analisis
menggunakan FTIR untuk ekstrak etanol sebelum diasetilasi ditunjukkan pada
Lampiran 8a, sedangkan untuk fraksi setelah diasetilasi ditunjukkan pada Lampiran
8b. Perbandingan spektrum FTIR ekstrak etanol sebelum dan setelah asetilasi
ditunjukkan pada Gambar 11. Spektrum hasil asetilasi menunjukkan serapan yang
muncul pada bilangan gelombang 1768 cm-1 yang merepresentasikan adanya gugus
asetil (Sudjadi 1983), sedangkan pada spektrum sebelum asetilasi tidak ditemukan
adanya serapan tersebut. Namun pada spektrum sebelum asetilasi terdapat serapan
pada bilangan gelombang 1748 cm-1 yang menunjukkan adanya gugus karbonil. Hal
ini diduga karena sebelum asetilasi, masih banyak senyawa kandungan temulawak
lain yang ikut terekstraksi ke dalam etanol 96% yang digunakan sebagai pelarut,
terutama senyawa-senyawa yang bersifat semipolar, seperti α-turmeron, β-turmeron,
atau ar-turmeron. Rumus struktur beberapa senyawa yang mungkin terdapat dalam
temulawak ditunjukkan pada Lampiran 9. Selain itu, jika dilihat dari keberadaan
gugus –OH, pada spektrum sebelum asetilasi terdapat serapan dengan intensitas
yang sangat besar pada bilangan gelombang sekitar 3400 cm-1, sedangkan pada
spektrum setelah asetilasi juga ditemukan serapan tersebut namun dengan intensitas
yang jauh lebih kecil. Hal tersebut menunjukkan bahwa reaksi asetilasi telah
Gambar 10 KLT fraksi xantorizol hasil asetilasi (pelarut heksana:etil asetat=10:1)
gugus asetil (COCH3)
gugus ‐OH
sebelum asetilasi
setelah asetilasi
Gambar 11 Perbandingan spektrum FTIR ekstrak etanol sebelum dan setelah asetilasi (metode modifikasi)
Sebanyak 8.1152 g fraksi xantorizol hasil asetilasi difraksinasi lebih lanjut
dengan KLT preparatif menggunakan eluen yang sama (heksana:etil asetat).
Hasilnya ditunjukkan pada Gambar 12. Terlihat bahwa pemisahan berlangsung
baik, dengan hasil spot dugaan xantorizol terasetilasi (fraksi 1) dan xantorizol tak
terasetilasi (fraksi 2). Setiaplariktersebut dikerok, lalu dilarutkan kembali dengan
xantorizol terasetilasi (Rf= 0.87)
heksana, kemudian diuji lagi dengan KLT analitik. Hasilnya ditunjukkan pada
Gambar 13.
[image:38.612.301.416.361.543.2]
Gambar 12 KLT preparatif fraksi xantorizol hasil asetilasi metode modifikasi (pelarut heksana:etil asetat = 10:1)
Gambar 13 KLT fraksi xantorizol 1 dan 2 hasil asetilasi metode modifikasi (pelarut heksana:etil asetat = 10:1)
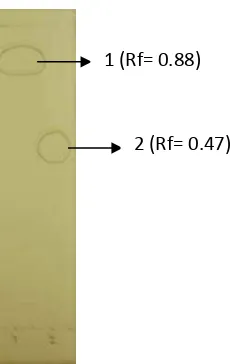
Fraksi 1 (xantorizol terasetilasi sebanyak 0.7456 gram) lalu dideasetilasi,
(dengan cara yang sama dengan metode Hwang), sehingga menghasilkan fraksi
dugaan xantorizol sebanyak 0.1155 g (0.140%). Hasil KLT-nya ditunjukkan pada
Gambar 14.
1
2
1 (Rf= 0.88)
2 (Rf= 0.47)
xantorizol terasetilasi (Rf= 0.88)
Gambar 14 KLT fraksi dugaan xantorizol metode modifikasi (pelarut heksana:etil asetat = 10:1)
Berdasarkan hasil KLT tersebut, dapat dideteksi dua spot yang muncul
dibawah sinar lampu UV pada λ = 254 nm, spot pertama (Rf = 0.52)
teridentifikasi sebagai xantorizol dan spot kedua (Rf = 0.39) belum dapat
teridentifikasi. Pencirian lain yang dilakukan adalah dengan FTIR, HPLC, dan
LC-MS, yang hasilnya ditunjukkan berturut-turut pada Lampiran 8c, Lampiran 10
dan Lampiran 11. Berdasarkan spektrum FTIR yang diperoleh, terlihat kembali
serapan dengan intensitas yang cukup besar pada bilangan gelombang 3445 cm-1
yang menunjukkan terbentuknya kembali gugus –OH dari xantorizol dengan
intensitas yang lebih besar, namun pada daerah serapan sekitar 1700 cm-1 masih
terdapat serapan dengan intensitas rendah. Hal ini menunjukkan bahwa belum
semua gugus asetil terdeasetilasi kembali menjadi gugus -OH. Berdasarkan
kromatogram HPLC yang diperoleh, terlihat bahwa muncul dua puncak pada
waktu retensi berturut-turut 6.103 menit dan 14.817 menit. Jika dibandingkan
dengan kromatogram standar xantorizol (Lampiran 5) yang menunjukkan puncak
xantorizol pada waktu retensi 14.820 menit, maka dapat diduga bahwa hasil
isolasi dengan modifikasi metode ini berhasil memperoleh senyawa xantorizol
(puncak kedua). Hal ini juga diperkuat dengan data pada tabel hasil LC-MS
(Lampiran 9) yang juga menunjukkan adanya dua puncak yang muncul, yaitu
puncak pertama pada waktu retensi 2.9 menit dan puncak kedua pada waktu
retensi 16.8 menit. Dapat dipastikan bahwa puncak pertama adalah xantorizol
dengan BM 218.03. Puncak kedua pada waktu retensi 16.8 menit tidak terdeteksi
bobot molekulnya, sehingga tidak dapat diduga secara pasti jenis dan struktur
senyawanya. Namun berdasarkan waktu retensi yang lebih besar dibanding waktu
retensi xantorizol, dapat diduga bahwa senyawa tersebut bersifat lebih polar
dibandingkan xantorizol.
Rendemen yang dihasilkan dari metode modifikasi ini adalah 0.140% (b/b).
Jika dibandingkan dengan rendemen verifikasi metode Hwang (2000) yang
dilakukan sebagai metode pembanding pada penelitian ini (0.064%), rendemen
yang diperoleh dari modifikasi metode ini dua kali lebih besar. Hal ini mungkin
disebabkan oleh tahapan dalam metode ini lebih sederhana, tanpa melalui tahap
kolom kromatografi yang memungkinkan kehilangan sampel cukup besar, serta
asetilasi yang dilakukan terhadap ekstrak kasar sebelum pemurnian
memungkinkan jumlah xantorizol yang terisolasi lebih besar. Namun dari segi
kemurnian hasil masih kurang, karena masih terdapat dua puncak yang terdeteksi
dari hasil KLT, kromatogram HPLC dan LC-MS, dan puncak kedua belum dapat
teridentifikasi jenis dan strukturnya karena masih memerlukan pemurnian lebih
lanjut, misalnya dengan KLT preparatif tahap II. Berdasarkan hasil KLT (Gambar
12), jarak antara spot 1 (Rf = 0.52) yang diduga merupakan senyawa xantorizol
dengan spot 2 (Rf = 0.39) cukup jauh, sehingga masih dimungkinkan untuk dapat
dipisahkan kembali dengan cara KLT preparatif. Kemurnian senyawa xantorizol
yang diperoleh dari metode modifikasi adalah 99.5%, sedangkan Hwang (2000)
SIMPULAN DAN SARAN
Simpulan
Berdasarkan kandungan xantorizol, nomor harapan temulawak terbaik adalah
nomor harapan temulawak A. Lokasi Cileungsi dengan kondisi suhu 28-34 ºC, curah
hujan 223,97 mm/tahun, dan tanah liat berpasir merupakan lokasi yang paling sesuai
untuk budidaya temulawak dibandingkan Boyolali. Modifikasi metode ekstraksi
pelarut, asetilasi-deasetilasi yang dilanjutkan dengan KLT preparatif belum berhasil
memisahkan xantorizol dengan baik, karena masih diperoleh campuran dengan
senyawa lain yang tidak diketahui identitasnya. Rendemen yang diperoleh dari
metode modifikasi sebesar 0.140% (b/b) dengan kemurnian sebesar 99.5%.
Saran
Perlu dilakukan penelitian mengenai faktor-faktor lingkungan yang
mempengaruhi mekanisme biokimiawi pada temulawak untuk meningkatkan
produksi bioaktif xantorizol. Penelitian lanjutan untuk memurnikan fraksi hasil
metode modifikasi, misalnya dengan KLT preparatif tahap 2, sehingga diperoleh
DAFTAR PUSTAKA
Aguilar MI, Delgado G, Byes R, Linaress E. 1993. Bisabolenes polycyclic diterpenoids and other constituents from the roots of Iostephane heterophylla. Phytochemistry 33:1161-1163.
Afifah E, Lentera T. 2003. Khasiat dan Manfaat Temulawak: Rimpang Penyembuh Aneka Penyakit. Jakarta: Agromedia Pustaka.
Anang SFR. 1992. Pengaruh curcuma komplek plus terhadap kerusakan hati mencit yang diinduksi dengan karbon tetraklorida [skripsi]. Bandung: Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Padjadaran.
Anonim. 2005. Temulawak. http://www.IPTEKnet.id/ [20 Jan 2008].
Chilwan P, Claudia G, Victor W, Ludger W, Peter P. 1993. Insecticidal constituents from four species of the zingiberaceae. Phytochemistry 34:415-419.
Darusman LK, Djauhari E, Nurcholis W. 2006. Kandungan Xanthorrhizol Temulawak (Curcuma xanthorrhiza Roxb.) pada Berbagai Cara Budidaya dan Masa Tanam. Di dalam: Prosiding Seminar Tumbuhan Obat Indonesia XXIX; Surakarta, 24-25 Mar 2006. Surakarta: Fakultas Kedokteran Universitas Sebelas Maret. hlm 567-580.
Darusman LK, Priosoeryanto BP, Hasanah M, Rahardjo M, Djauhari E. 2007. Potensi temulawak terstandar untuk menanggunalangi flu burung [laporan hasil penelitian]. Bogor: Institut Pertanian Bogor bekerjasama dengan Sekretariat Badan Penelitian dan Pengembangan Pertanian.
Darwis SN, Hiyah S, Madjo-Indo ABD. 1991. Tumbuhan Obat Famili Zingeberaceae. Bogor: Pusat Pengembangan Tanaman Industri.
[Deptan] Departemen Pertanian, Direktorat Jendral Bina Produksi Hortikultura. 2004. Informasi Pengembangan Agribisnis Tanaman Biofarmaka. Jakarta: Deptan.
Dickes GJ, Nicholas PV. 1976. Gas Chromathography in Food Analysis. London: Butterworths.
Direktorat Aneka Tanaman. 2000. Budidaya Tanaman Temulawak. Jakarta: Direktorat Jendral Produksi Hortikultura dan Aneka Tanaman.
Temulawak; Bandung, 17-18 Sep 1985. Bandung: Lembaga Penelitian Universitas Padjadaran. hlm 186-194.
Hwang JK. 2000. Xanthorrizol: A New Bioactive Natural Compound. Seoul: Department of Biotechnology, Yonsei University.
Hwang JK. 2004. Xanthorrizol: a potential antibacterial agent from Curcuma xanthorriza against Steptococcus mutans. Planta Medica 66:196-197.
Kemala S, Susiarto, Pribadi ER, Yuhono JT, Yusron M, Mauludi L, Rahardjo M, Ferry Y, Waskito B, Nurhayati H. 2003. Studi serapan pasokan dan pemanfaatan tanaman obat di Indonesia [laporan teknis penelitian bagian proyek penelitian tanaman rempah dan obat APBN tahun 2003]. Bogor: Balai Penelitian Tanaman Rempah dan Obat.
Ketaren S. 1988. Penentuan komponen utama minyak atsiri temulawak (Curcuma xanthorriza Roxb) [tesis]. Bandung: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Teknologi Bandung.
Khaerana. 2007. Pengaruh cekaman kekeringan dan umur panen yang berbeda terhadap kandungan xanthorrhizol tanaman temulawak (Curcuma xanthorrhiza Roxb.) [tesis]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor.
Lee SK et al. 2002. Suppressive effect of natural sesquiterpenoids on inducible cyclooxygenase (COX-2) and nitric oxide synthase (iNOS) activity in mouse macrophage cells. Environmental Pathology, Toxicology and Oncology 21(2): 141-148.
Lim CS et al. 2005. Antioxidant and anti-inflammatory activities of xanthorrizol in hippocampal neurons and primary cultured Microglia. http://www.ncbi.nlm.nih.gov/entrez/queryfegi?cmd=Retrieve&db=pubme d&dopt=Abstract&list_uids=16273545&query_hl=l&itool=pubmed_docs um. [27 Jan 2008].
Liang OB, Widjaja Y, Asparton Y, Puspa S. 1985. Beberapa aspek isolasi, identifikasi, dan penggunaan komponen-komponen Curcuma Xanthorriza Roxb dan Curcuma domestica Val. Di dalam: Prosiding Simposium Nasional Temulawak; Bandung, 17-18 Sep 1985. Bandung: Lembaga Penelitian Universitas Padjadaran.
Masuda T, Isobe J, Jitoe A, Nakatawa N. 1992. Antioxidative Curcuminoids
From Rhizomes Of Curcuma xanthorrhiza. Phytochemistry
31:3645-3647.
Rukayadi Y, Yong D, Hwang JK. 2006. In vitro anticandidal activity of xanthorrizol isolated from Curcuma xanthorriza Roxb. Antimicrobial Chemotheraphy; doi:10.1093/jac/dk1132.
.
Rukayadi Y, Hwang JK. 2007. In vitro antimycotic activity of xanthorrizol isolated from Curcuma xanthorriza Roxb. against opportunistic filamentous fungi. Phytotherapy Research. http://www.interscience.wiley. com/ [20 Jan 2008].
Seigler DS. 1998. Plant Secondary Metabolism. Boston: Kluwer Academic Publishers.
Setijadi T. 1985. The Identification of the Active Ingredients of Curcuma xanthorriza and Curcuma longa after extraction with supercritical carbondioxide. Bogor: PT Daya Varia Laboratoria.
Setiyono RT, Ajijah N. 2002. Evaluasi beberapa sifat agronomi plasma nutfah temulawak (Curcuma xanthorrhiza Roxb.). Buletin Penelitian Tanaman Rempah dan Obat 13:7 – 12.
Setiyono RT et al. 2006. Uji multilokasi nomor-nomor harapan temulawak pada berbagai kondisi agroekologi [laporan akhir penelitian]. Bogor: Balittro.
Soediarto, Wahid, Pasril. 1985. Pembudidayaan tanaman temulawak. Di dalam: Prosiding Simposium Nasional Temulawak; Bandung, 17-18 Sep 1985. Bandung: Lembaga Penelitian Universitas Padjajaran. hlm 5-18.
Sidik, Mulyono MW, Mutadi A. 1995. Temulawak (Curcuma xanthorriza Roxb). Jakarta: Phyto Medika.
Sinambela JM. 1985. Fitoterapia, fitostandar, dan temulawak. Di dalam: Prosiding Symposium Nasional Temulawak; Bandung, 17-18 Sep 1985. Bandung: Lembaga Penelitian Universitas Padjajaran. hlm 150-155.
Sirait M et al. (1985). Pemeriksaan kadar xanthorrhizol dalam Curcuma xanthorrhiza Roxb. Di dalam: Prosiding Simposium Nasional Temulawak; Bandung, 17-18 Sep 1985. Bandung: Lembaga Penelitian Universitas Padjajaran.
Sudjadi. 1983. Penentuan struktur senyawa organik. Bandung: Ghalia Indonesia.
Sutarno H, Atmowidjojo S, editor. 2001. Tantangan Pengembangan dan Fakta Jenis Tanaman Rempah. Bogor: Prosea Foundation.
Wahid P, Sudiarto. 1985. Pembudidayaan tanaman temulawak. Di dalam: Prosiding Symposium Nasional Temulawak; tanggal 17-18 September 1985; Bandung. Bandung: Lembaga Penelitian Universitas Padjajaran. hlm 5-18.
Lampiran 1 Diagram Alir Isolasi Xantorizol
Maserasi MeOH (75%, v/v)
Ekstrak cair
+ Na2SO4anhidrat ;disaring dengan Whatman
evaporasi, 60oC
Ekstrak kasar
Fraksinasi dengan EtOAc
Fraksi etil asetat
sampel temulawak terpilih
diaduk 6 jam; didiamkan 24 jam;
Maserasi EtOH (96%, v/v)
Kromatografi kolom I
Fraksi xantorizol (Rf=standar)
asetilasi
asetilasi
KLT Preparatif
Fraksi xantorizol terasetilasi
deasetilasi
Kromatografi kolom II
xantorizol
a. Hwang (2000)
b. Metode modifikasi
Keterangan:
Tulisan warna biru : metode Hwang (2000) Tulisan warna merah : metode modifikasi
Lampiran 2 Analisis statistika pengaruh lokasi tanam dan nomor harapan pada kandungan xantorizol
N
Lokasi B 6
C 6
Nomor Harapan A 6
F 6
Sumber Keragaman
Jumlah Kuadrat
Derajat Bebas
Kuadrat
Tengah F hitung F tabel
Model .000(a) 3 8.23E-005 8.570 .007
Intersep .011 1 .011 1191.295 .000
Lokasi_tanam .000 1 .000 15.301 .004
Nomor_harapan 8.32E-005 1 8.32E-005 8.661 .019
Lokasi_tanam *
Nomor_harapan 1.68E-005 1 1.68E-005 1.749 .223
Galat 7.69E-005 8 9.61E-006
Total .012 12
Signifikan karena lebih kecil dari 0.05, jadi lokasi tanam dan nomor harapan berpengaruh pada kandungan xantorizol
Tidak signifikan karena lebih
Lampiran 3 Contoh kromatogram HPLC pemilihan sampel berdasarkan kadar xantorizol tertinggi dan contoh perhitungannya
Contoh sampel temulawak Cileungsi nomor harapan F ulangan 1:
Cara perhitungan:
konsentrasi sampel = xkonsentrasistdr
stdr area
sampel area
kadar xantorizol =
sampel bobot
fp x sampel volume
x sampel i
konsentras
Krmatogram HPLC sampel:
Lanjutan lampiran 3
Kromatogram standar :
konsentrasi sampel = x200 ppm
19792738 7180918
= 72.56 ppm
kadar xantorizol =
g mg x g ml L x x ml x ppm / 1000 0865 .