POTENSI ANTIOKSIDAN FILTRAT DAN BIOMASSA HASIL
FERMENTASI KAPANG ENDOFIT Colletotrichum spp.
DARI TANAMAN KINA (Cinchona calisaya Wedd.)
AYU SEPTIAWAN
JURUSAN BIOLOGI
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
AYU SEPTIAWAN
1110095000004
SKRIPSI
Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana Sains Pada Program Studi Biologi Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
JURUSAN BIOLOGI
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA
PERNYATAAN
DENGAN INI SAYA MENYATAKAN BAHWA SKRIPSI INI ADALAH HASIL KARYA SENDIRI YANG BELUM PERNAH DIAJUKAN SEBAGAI SKRIPSI ATAU KARYA ILMIAH PADA PERGURUAN TINGGI ATAU LEMBAGA MANAPUN.
Jakarta, Desember 2014
spp.
dari
Tanaman
Kina
ABSTRAK
AYU SEPTIAWAN. Potensi Antioksidan Filtrat dan Biomassa Hasil Fermentasi Kapang Endofit Colletotrichum spp. dari Tanaman Kina
(Cinchona calisaya Wedd.). Skripsi. Jurusan Biologi Fakultas Sains dan
Teknologi. UIN Syarif Hidayatullah Jakarta. 2014.
Kapang endofit yang hidup pada suatu tanaman memiliki kemampuan untuk menghasilkan senyawa metabolit yang sama dengan tanaman inang tanpa merugikan inangnya. Kapang endofit Colletotrichum spp. pada tanaman kina (Cinchona calisaya Wedd.) berpotensi menghasilkan senyawa antioksidan. Penelitian ini bertujuan untuk mengetahui potensi ekstrak biomassa dan filtrat kapang endofit Colletotrichum spp. sebagai antioksidan serta mengetahui aktivitas antioksidan yang tertinggi dari keduanya. Ekstrak diuji menggunakan metode 1,1-difenil-2-pikrilhidrazil (DPPH) dengan pengujian Kromatografi Lapis Tipis (KLT) dan spektrofotometer UV-Vis. Pengujian KLT menunjukkan seluruh ekstrak filtrat dan biomassa Colletotrichum spp. memiliki hasil positif antioksidan yang ditandai dengan perubahan warna pelat menjadi kuning. Terdapat dua isolat yang memiliki nilai Rf yang hampir sama dengan standar vitamin C yaitu ekstrak biomassa Colletotrichum sp. 8 dan ekstrak filtrat Colletotrichum sp. 10 yaitu 0,71. Pengujian spektrofotometer UV-Vis menunjukkan bahwa isolat M1 (Colletotrichum sp. 1) memiliki nilai Inhibition Concentration 50% (IC50)
tertinggi ekstrak biomassa yaitu 1489,565 ppm dan ekstrak filtrat yaitu 837,143 ppm. Hasil identifikasi senyawa menggunakan Gas Chromatography Mass Spectrophotometry (GCMS) menunjukkan terdapat 4 senyawa dari ekstrak biomassa dan 5 senyawa dari ekstrak filtrat yang memiliki aktivitas antioksidan.
Biology. Faculty of Science and Technology. UIN Syarif Hidayatullah Jakarta. 2014.
Endophytic fungus which lived on a plant can produce a metabolit compound that equal to the host plant without damaging the plant. Endophytic fungus in
cinchona plant (Cinchona calisaya Wedd.) was potentially produce bioactive compound, the example was Colletotrichum spp. The research aimed to know the potential of biomass and filtrate extract of Colletotrichum spp. as an antioxidant with the highest antioxidant activity amongst them. The extract was test with 1,1-diphenyl-2-picrylhydrazyl method (DPPH) with Thin Layer Cromatografi (TLC) and UV-Vis spectrofotometry tested. The result from TLC test showed that all of the Colletotrichum spp. filtrate and biomass had positive value antioxidant seen from the color turning to yellow after it extracted with DPPH solution. There are two isolates which has an Rf value that almost equal to the vitamin C standard that is 0.71, those are biomass extract Colletotrichum sp. 8 and filtrate exctract
Colletotrichum sp. 10. UV-Vis spectrofotometry tested showed M1 (Colletotrichum sp. 1) isolate has the highest IC50 (inhibition concentration)
biomass extract value of 1489,565 ppm and filtrat exctract value of 837,143 ppm. The result of compound identification with GCMS showed that were four compound of biomass extract and five of filtrate extract that have antioxidant activity.
i
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT atas segala rahmat dan karunia-Nya hingga penulis dapat menyelesaikan penulisan skripsi ini. Skripsi yang berjudul “Potensi Antioksidan Filtrat dan Biomassa Hasil Fermentasi Kapang Endofit Colletotrichum spp. dari Tanaman Kina (Cinchona calisaya Wedd.)
”
ini disusun untuk memenuhi salah satu syarat melaksanakan tugas akhir pada Jurusan Biologi Fakultas Sains dan Teknologi UIN Syarif Hidayatullah Jakarta.Penyusunan skripsi ini tidak terlepas dari bantuan berbagai pihak sehingga pada kesempatan ini penulis ingin menyampaikan ucapan terima kasih kepada:
1. Dr. Agus Salim, M.Si., selaku Dekan Fakultas Sains dan Teknologi UIN Syarif Hidayatullah Jakarta.
2. Dr. Dasumiati, M.Si., selaku Ketua Jurusan Biologi UIN Syarif Hidayatullah Jakarta dan penguji I sidang skripsi yang telah memberikan saran, kritik dan ilmu yang bermanfaat bagi penulis.
ii
5. Drs. Dede Sukandar, M.Si., selaku pembimbing II yang telah memberikan ilmu, pengarahan, pemahaman, saran dan bimbingan selama melaksanakan penelitian dan penulisan skripsi.
6. Kedua orang tua yang saya cintai yaitu Jurnalis Chaniago dan Irnawati karena telah memberikan dukungan moril maupun materil, serta keluarga besar saya yang memberikan motivasi dalam menyelesaikan penulisan.
7. Dr. Irawan Sugoro, Dr. Megga Ratnasari Pikoli, dan Adi Riyadhi, M.Si. selaku penguji seminar yang memberikan saran dan kritik.
8. Seluruh dosen Jurusan Biologi UIN Syarif Hidayatullah Jakarta yang telah mendidik penulis selama kegiatan perkuliahan.
9. Dalli, Alfida, Ario, Arif, Indina, Irma, Jane, Ima, Ayun, Nisa, Mutia, Sara, Ica, Rini, Mala, Mega serta seluruh rekan-rekan Biologi angkatan 2010 yang memberikan motivasi kepada penulis semoga silaturahmi kita semua terus terjalin sampai akhir hayat.
10.Ami Prawira yang selalu meluangkan waktu dan memberikan motivasi penulis saat penelitian dan penulisan skripsi.
iii
12.Puji Astuti, S.Si., Ida Farida, S.Pd., Festy Auliyaur R, S.Si., Nur Amaliah Solihat, S.Si., Fitriyah, S.Si., mba Nita, pak Aris, mba ernita, dan staf laboratorium lainnya di Pusat Laboratorium Terpadu UIN Syarif Hidayatullah Jakarta yang telah membantu penulis saat penelitian.
13.Semua pihak yang senantiasa memberikan dorongan serta bantuan moral maupun material sehingga Penulis dapat menyelesaikan skripsi ini.
Penulis menyadari dalam penulisan ini masih jauh dari kesempurnaan, untuk itu saran dan kritik dari pembaca yang membangun sangat penulis harapkan. Akhir kata, semoga tulisan ini dapat bermanfaat bagi para pembacanya.
Jakarta, Desember 2014
iv
DAFTAR ISI ... iv
DAFTAR GAMBAR ... vi
DAFTAR TABEL ... vii
DAFTAR LAMPIRAN ... viii
BAB I. PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Rumusan Masalah ... 3
1.3. Hipotesis ... 3
1.4. Tujuan ... 4
1.5. Manfaat ... 4
BAB II. TINJAUAN PUSTAKA ... 5
2.1. Tanaman Kina (Cinchona calisaya Wedd.) ... 5
2.1.1 Senyawa Bioaktif pada Tanaman Kina (Cinchona calisaya Wedd.) ... . 6
2.2. Mikroba Endofit ... 7
2.2.1 Interaksi Mikroba Endofit dengan Tanaman ... 8
2.3. Colletotrichum spp ... 8
2.4. Radikal Bebas dan Antioksidan ... 10
2.5. Uji DPPH (1,1-difenil-2-pikrilhidrazil) ... 12
2.6. Kromatografi Lapis Tipis ... 13
2.7. Spektrofotometer UV-Vis ... 15
2.8. GC-MS ... 15
BAB III. METODOLOGI PENELITIAN ... 17
3.1. Waktu dan Tempat Penelitian ... 17
3.2. Alat dan Bahan ... 17
3.3. Sumber Isolat ... 18
v
3.4.1.Bagan Kerja Penelitian ... 19
3.4.2.Peremajaan Kapang Endofit ... 20
3.4.3.Pengamatan Kapang Endofit ... 20
3.4.4.Fermentasi Cair Kapang Endofit ... 20
3.4.5.Ekstraksi Hasil Fermentasi dengan Pelarut Organik ... 21
3.4.6.Uji Senyawa Antioksidan dari Ekstrak Hasil Fermentasi ... 22
3.4.6.1 Metode DPPH Menggunakan Uji Kromatografi Lapis Tipis (KLT) ... 22
3.4.6.2 Metode DPPH Menggunakan Spektrofotometer UV-Vis ... 23
3.4.7. Analisis Ekstraksi Metabolit Sekunder dengan GC-MS ... 23
3.5. Analisis Data ... 24
BAB IV. HASIL DAN PEMBAHASAN ... 25
4.1 Fermentasi Cair Kapang Endofit Coletotrichum spp. ... 25
4.2 Uji Autografi Aktivitas Antioksidan ... 28
4.3 Uji Aktivitas Antioksidan Menggunakan Spektrofotometer UV-Vis ... 31
4.4 Analisa GC-MS ... 38
BAB V. PENUTUP ... 44
5.1 Kesimpulan ... 44
5.2 Saran ... 44
vi
Gambar 2. Morfologi Colletotrichum spp A) makroskopis B) mikroskopis ... 9
Gambar 3. Konida dan appresoria dalam skala 10 µm dari genus Colletotrichum A) Colletotrichum crassipes (kiri) dan B)Colletotrichum gleosporoides (kanan) ... 9
Gambar 4. Struktur kimia DPPH ... 13
Gambar 5. Mekanisme reaksi metode DPPH ... 13
Gambar 6. Skema bagan kerja penelitian ... 19
Gambar 7 Nilai Rf (Retardation factor) keterangan: K) kontrol Vitamin C A) intraseluler Colletotrichum sp. 8 B) ekstraseluler Colletotrichum sp. 10 ... 30
Gambar 8. Aktivitas antioksidan ekstrak filtrat Colletotrichum spp. berdasarkan nilai IC50 ... 32
Gambar 9. Aktivitas antioksidan ekstrak biomassa Colletotrichum spp. berdasarkan nilai IC50 ... 34
Gambar 10. Kromatogram hasil GC-MS ekstrak filtrat ... 38
vii
DAFTAR TABEL
Tabel 1. Kode isolat Colletorichum spp. ... 18 Tabel 2. Hasil fermentasi cair kapang endofit Colletorichum spp. pada
medium PDB selama 21 hari pada suhu ruang ... 25 Tabel 3. Hasil uji KLT ekstrak Colletorichum spp. setelah disemprot
DPPH ... 29 Tabel 4. Hasil identifikasi komponen ekstrak filtrat Colletorichum sp. 1
dengan pelarut etil asetat ... 38 Tabel 5. Hasil identifikasi komponen ekstrak biomassa Colletorichum sp.1
viii
Lampiran 2. Hasil Kromatografi Lapis Tipis (KLT) ekstrak kapang
1
BAB I
PENDAHULUAN
1.1 Latar Belakang
Senyawa antioksidan adalah senyawa pemberi elektron (electron donors). Secara biologis, pengertian antioksidan adalah senyawa yang mampu menangkal atau meredam dampak negatif oksidan dalam tubuh (Winarsi, 2007). Senyawa bioaktif antioksidan dapat diperoleh dari beberapa sumber yaitu tanaman, hewan, mikroba dan organisme laut (Prihatiningtias, 2005). Penggunaan senyawa antioksidan saat ini semakin meluas seiring dengan semakin besarnya pemahaman masyarakat tentang peranan antioksidan dalam menghambat penyakit degeneratif (Tahrir et al., 2003).
Salah satu tanaman obat yang banyak dikenal adalah tanaman kina (Cinchona calisaya Wedd.). Tanaman kina (Cinchona sp.) dapat menghasilkan senyawa alkaloid kuinin, kuinidin, sinkonin, dan sinkonidin yang dapat digunakan sebagai sumber bahan baku obat antimalaria (Simanjuntak et al., 2002). Ekstrak daun tanaman Cinchona ledgeriana diketahui memiliki aktivitas antioksidan serta kadar fenol yang tinggi (Al–Mustafa dan Al–Thunibat, 2008). Tanaman Cinchona officinalis memiliki aktivitas antioksidan dan mengandung senyawa fenolik (Ravishankara et al., 2003).
senyawa metabolit yang sama dengan tanaman inangnya (Strobel dan Daisy, 2003). Penelitian dari Maehara et al. (2011), menyatakan bahwa kapang endofit
Diaporthe sp. yang diisolasi dari tanaman kina dapat memproduksi senyawa alkaloid yang sama seperti tanaman kina. Penelitian dari Winarno (2006), menyatakan bahwa kapang endofit dari batang C. ledgeriana dan C. pubescens
dapat menghasilkan senyawa alkaloid yang sama seperti tanaman inangnya. Kapang endofit yang hidup pada suatu tanaman telah banyak diteliti sebagai sumber penghasil senyawa bioaktif salah satunya sebagai antioksidan. Kapang Phomopsis sp. dari tanaman obat Mesua ferrea memiliki aktivitas antioksidan dengan pengujian peredaman radikal bebas (Jayanthi et al., 2011). Kapang endofit Phomopsis sp. dan Xylaria sp. dari tanaman Emblica officinalis
memiliki aktivitas antioksidan yang tinggi (Nath et al., 2012). Kapang genus
Aspergillus dan Colletotrichum dari tanaman Rhizophora sp. memiliki aktivitas antioksidan (Saputri, 2013). Kapang Colletotrichum gleosporioides dari tanaman
Justicia gendarussa menghasilkan senyawa antikanker yang sama seperti tanaman induknya (Gangadevi dan Muthumary, 2008). Kapang endofit Colletotrichum spp. dari tanaman C. calisaya Weed. menghasilkan senyawa kuinin serta senyawa bioaktif lainnya yang berperan sebagai antibakteri (Mutiea, 2014). Kapang endofit yang hidup pada tanaman kina dapat digunakan sebagai salah satu sumber penghasil senyawa antioksidan.
Kapang Colletotrichum termasuk genus yang banyak ditemukan setelah kapang Phomopsis spp. sebagai kapang endofit dari tanaman kina (C. calisaya
3
Colletotrichum spp. sebanyak 14 morphotype. Kapang Colletotrichum spp. telah diisolasi dari beberapa organ tanaman kina yaitu daun, buah, kulit kayu, petiole, dan akar di Pusat Perkebunan Teh dan Kina (PPTK) Gambung, Ciwidey, Jawa Barat. Selama ini belum pernah dilaporkan potensi antioksidan isolat kapang endofit Colletotrichum spp. dari tanaman kina karena penelitian kapang endofit dari tanaman kina lebih banyak difokuskan untuk mendapatkan senyawa kuinin sebagai antimalaria. Oleh karena itu, perlu dilakukan penelitian potensi antioksidan isolat kapang endofit Colletotrichum spp. dari tanaman kina (C. calisaya Wedd.).
1.2 Rumusan Masalah
1. Isolat ekstrak filtrat dan biomassa kapang endofit Colletotrichum spp. dari tanaman kina (C. calisaya Wedd.) manakah yang berpotensi sebagai antioksidan?
2. Bagaimana aktivitas antioksidan ekstrak filtrat dan biomassa isolat kapang endofit Colletotrichum spp. dari tanaman kina(C. calisaya Wedd.)?
1.3 Hipotesis
1. Seluruh isolat ekstrak filtrat dan biomassa kapang endofit Colletotrichum
2. Ekstrak filtrat dan biomassa isolat kapang endofit Colletotrichum spp. dari tanaman kina (C. calisaya Wedd.) memiliki aktivitas antioksidan yang berbeda.
1.4 Tujuan
1. Mengetahui potensi ekstrak filtrat dan biomassa seluruh isolat kapang endofit Colletotrichum spp. daritanaman kina (C. calisaya Wedd.) sebagai antioksidan.
2. Mengetahui aktivitas antioksidan yang tertinggi dari ekstrak filtrat dan biomassa isolat kapang endofit Colletotrichum spp. dari tanaman kina (C. calisaya Wedd.).
1.5 Manfaat
5
BAB II
TINJAUAN PUSTAKA
2.1 Tanaman Kina (Cinchona calisaya Wedd.)
Tanaman kina merupakan tanaman obat berupa pohon yang berasal dari Amerika Selatan di sepanjang pegunungan Andes. Tanaman kina masuk ke Indonesia tahun 1852 berasal dari Bolivia (Sultoni, 1995). Tinggi pohon antara 4-15 m, berbulu halus atau lokos. Daun elip sampai lanset, bagian pangkal dan ujung daun lancip, tangkai daun tidak berbulu, panjang tangkai 3-6 mm. Mahkota bunga berwarna kuning agak putih, bentuk melengkung panjang 8-12 mm. Buah lanset sampai bulat telur dengan ukuran panjang 8-12 mm dan lebar 3-4 mm (Tao dan Taylor, 2011). Menurut Tjitrosoepomo (2002), klasifikasi tanaman kina adalah sebagai berikut Kelas : Dicotyledoneae; Suku : Rubiaceae; Genus :
Cinchona; Spesies : Cinchona calisaya Wedd.
Gambar 1. Morfologi Bunga, Daun dan Batang Cinchona calisaya Wedd. (Dokumentasi pribadi, 2013).
2.1.1 Senyawa Bioaktif pada Tanaman Kina (Cinchona calisaya Wedd.)
Tanaman kina merupakan bahan baku farmasi yang sangat bernilai ekonomis dan dikenal lama sebagai obat antimalaria. Khasiat tanaman kina sebagai antimalaria berasal dari senyawa bioaktif berupa alkaloid kinin (C20H24N2O2), kinidin (isomer dari kinin), sinkona (C19H22N2O) dan sinkonidin
(isomer dari sinkona). Beberapa bagian dari tanaman kina (akar, batang, daun dan kulit) mengandung senyawa alkaloid kuinin dalam jumlah yang berbeda (Simanjuntak et al., 2002).
Alkaloid yang sangat penting dari tanaman kina yaitu kinin (C20H24N2O2)
untuk penyakit malaria dan kinidin (isomer dari kinin) untuk penyakit jantung (Sultoni, 1995). Umumnya di dalam ekstrak C. ledgeriana Moens dan C. pubescens VAHL terdapat 12-18% alkaloid (Winarno, 2006). Ekstrak kulit kayu
7
2.2 Mikroba Endofit
Mikroba endofit adalah mikroba yang hidup di dalam jaringan tanaman pada periode tertentu dan mampu hidup dengan membentuk koloni dalam jaringan tanaman tanpa membahayakan inangnya. Mikroba endofit dapat diisolasi dari jaringan akar, batang, dan daun. Jenis mikroba yang paling umum ditemukan adalah fungi (Strobel dan Daisy, 2003). Menurut Radji (2005), mikroba endofit memiliki kemampuan untuk memproduksi senyawa metabolit sekunder sesuai tanaman inangnya. Menurut Tan dan Zou (2001), hal ini disebabkan adanya pertukaran genetik yang terjadi antara inang dan mikroba endofit secara evolusioner. Kapang diketahui mampu menghasilkan senyawa metabolit sekunder seperti alkaloid, terpen, steroid, flavonoid, kuinon, fenol dan lain sebagainya. Senyawa-senyawa ini sebagian besar mempunyai potensi sebagai senyawa bioaktif. Menurut Winarsi (2007), flavonoid dan kuinon diketahui merupakan antioksidan non enzimatis larut lemak.
Kapang endofit tidak memerlukan lahan luas untuk tumbuh dan membutuhkan waktu lebih pendek untuk menghasilkan senyawa metabolit aktif dibandingkan bila menumbuhkan tanaman inangnya (Strobel dan Daisy, 2003). Hasil penelitian Azizah (2013), bahwa ekstrak isolat kapang dari tanaman
kina. Berdasarkan penelitian Simanjuntak et al. (2002), skrining dan identifikasi hasil fermentasi dalam media sintetik menunjukkan bahwa mikroba endofit yang diisolasi dari tanaman Cinchona sp. dapat memproduksi senyawa alkaloid. Hasil penelitian yang dilakukkan oleh Nath et al. (2012) menyatakan bahwa kapang endofit Phomopsis sp. dan Xilaria sp. memperlihatkan aktifitas antioksidan yang tinggi dan juga memiliki tingkat fenol yang tinggi.
2.2.1 Interaksi Mikroba Endofit dengan Tanaman
Hubungan simbiosis mutualisme antara mikroba endofit dengan tanaman inang terutama perannya yang sangat penting dalam melindungi tanaman inangnya terhadap patogen dan predator (Strobel dan Daisy, 2003). Simbiosis antara fungi (mikroba) endofit dengan tanaman obat, fungi (mikroba) dapat membantu proses penyerapan unsur hara yang dibutuhkan oleh tumbuhan untuk proses fotosintesis serta melindungi tumbuhan inang dari serangan penyakit, dan hasil dari fotosinteis dapat digunakan oleh fungi untuk mempertahankan kelangsungan hidupnya (Petrini et al., 1992).
2.3 Colletotrichum spp.
Ciri-ciri umum Colletotrichumsp. yaitu permukaan koloni berwarna putih dengan tepi tidak rata serta ekstur seperti kapas tebal dan bagian belakang koloni berwarna putih dengan bercak merah kekuningan. Konidia berbentuk lonjong, berwarna hialin dan memiliki apresorium berdinding tebal. Spora Colletotrichum
dijadikan bahan dalam meningkatkan produksi taxol seperti yang dihasilkan oleh
Justicia gendarussa (Gangadevi dan Muthumary, 2008). Ekstrak kapang endofit
Colletotrichum sp. dari tanaman Piper ornatum memiliki kemampuan sebagai antioksidan (Tianpanich et al., 2011). Ekstrak kapang endofit Colletotrichum dari tanaman Polygala elongata berpotensi sebagai sumber antioksidan (Pawle dan singh, 2014).
2.4 Radikal Bebas dan Antioksidan
Radikal bebas merupakan salah satu bentuk senyawa berupa oksigen reaktif dan sebagai senyawa yang memiliki elektron yang tidak berpasangan serta memiliki reaktivitas yang lebih tinggi dibandingkan senyawa oksidan non radikal. Radikal bebas dapat terbentuk melalui dua cara yaitu secara endogen (sebagai respon normal proses biokimia intrasel maupun ekstrasel) dan secara eksogen (misalnya dari polusi, makanan, serta injeksi ataupun absorpsi melalui kulit). Serangan radikal bebas terhadap molekul di sekelilingnya akan menyebabkan terjadinya sebuah reaksi berantai yang dapat menghasilkan senyawa radikal baru. Dampak reaktivitas senyawa radikal bebas yaitu kerusakan sel atau jaringan, penyakit autoimun, penyakit degeneratif, hingga kanker (Winarsi, 2007). Serangan radikal bebas ini dapat diatasi dengan suatu senyawa penangkal yang disebut antioksidan (Salamah et al., 2011).
11
sehingga aktivitas senyawa oksidan tersebut bisa dihambat. Berdasarkan sumbernya ada dua macam antioksidan yaitu antioksidan alami dan antioksidan buatan (sintetik). Antioksidan alami mampu melindungi tubuh terhadap kerusakan yang disebabkan oksigen reaktif dan mampu menghambat penyakit degeneratif (Winarsi, 2007).
Secara umum, antioksidan dikelompokkan menjadi 2, yaitu antioksidan enzimatis dan non enzimatis. Antioksidan enzimatis misalnya enzim superoksida dismutase (SOD), katalase, dan glutation peroksida. Antioksidan non enzimatis masih dibagi lagi menjadi dua kelompok yaitu antioksidan larut lemak dan antioksidan larut air. Tokoferol, karotenoid, flavonoid, quinon, dan bilirubin tergolong antioksidan larut lemak. Asam askorbat, asam urat, protein pengikat logam, dan protein pengikat heme tergolong antioksidan larut air. Vitamin C atau asam askorbat mampu bereaksi dengan radikal bebas kemudian berubah menjadi radikal askorbil. Askorbat dapat langsung menangkap radikal bebas dengan atau tanpa katalisator enzim. Reaksinya terhadap senyawa oksigen reaktif lebih cepat dibandingkan dengan komponen cair lainnya (Winarsi, 2007). Antioksidan tidak hanya digunakan dalam industri farmasi, tetapi juga digunakan secara luas dalam industri makanan, industri petroleum, industri karet dan sebagainya (Tahrir et al., 2003). Senyawa bioaktif berupa antioksidan dapat diperoleh dari beberapa sumber diantaranya dari tumbuhan, hewan, mikroba dan organisme laut (Prihatiningtias, 2005).
ekstrak biomassa yaitu memiliki IC50 407,407 µg/mL yaitu genus kapang
Aspergillus yang diisolasi dari tanaman mangrove Avicennia sp. Penelitian dari Saputri (2013), aktivitas antioksidan yang dihasilkan genus Colletotrichum yang diisolasi dari tanaman mangrove Rhizophora sp. ekstrak biomassa lebih tinggi yaitu IC50 44,62 µg/mL dibandingkan aktivitas antioksidan genus Aspergillus
ekstrak filtrat yaitu IC50 404,41 µg/mL (Saputri, 2013).
2.5 Uji DPPH (1,1-difenil-2-pikrilhidrazil)
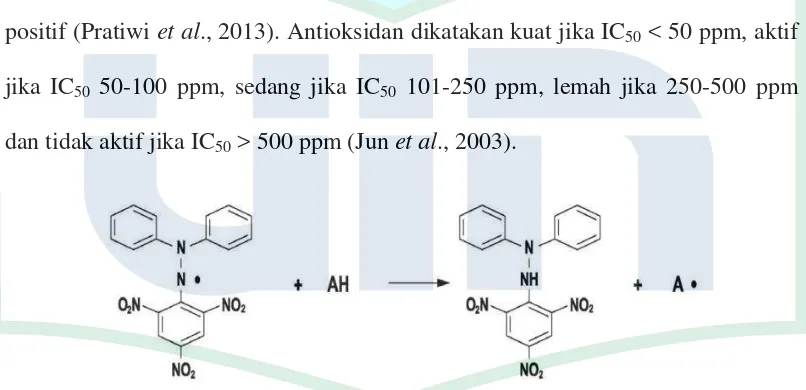
DPPH merupakan senyawa radikal bebas. Metode uji DDPH adalah metode untuk mengukur kemampuan suatu senyawa antioksidan dalam menangkap radikal bebas. Penangkapan senyawa radikal bebas berhubungan dengan kemampuan komponen senyawa dalam menyumbangkan elektron atau hidrogen. Setiap molekul yang dapat menyumbangkan elektron atau hidrogen akan bereaksi dan akan memudarkan DPPH. Intensitas warna DPPH akan berubah dari ungu menjadi kuning oleh elektron yang berasal dari senyawa antioksidan. Semakin tinggi konsentrasi sampel yang digunakan maka semakin rendah nilai absorbansi dari larutan DPPH. DPPH memberikan serapan kuat pada panjang gelombang 517 nm dengan warna violet gelap (Molyneux, 2004).
13
Gambar 4. Struktur Kimia DPPH (Molyneux, 2004)
Inhibiton Concentration (IC50) merupakan nilai yang menunjukkan
kemampuan penghambatan proses oksidasi sebesar 50% suatu konsentrasi sampel (ppm). Senyawa murni yang memiliki aktivitas antioksidan tinggi akan memiliki IC50 yang rendah. Aktivitas antioksidan yang sangat kuat memiliki nilai IC50
kurang dari 50 µg/mL begitu juga dengan nilai IC50 vitamin C sebagai kontrol
positif (Pratiwi et al., 2013). Antioksidan dikatakan kuat jika IC50 < 50 ppm, aktif
jika IC50 50-100 ppm, sedang jika IC50 101-250 ppm, lemah jika 250-500 ppm
dan tidak aktif jika IC50 > 500 ppm (Jun et al., 2003).
Gambar 5. Mekanisme reaksi metode DPPH (Molyneux, 2004)
2.6 Kromatografi Lapis Tipis
campuran terserap pada permukaan partikel atau terbagi kedalam sejumlah cairan yang melewatinya (Khopkar, 2003).
Salah satu jenis kromatografi cair-padat adalah kromatografi lapis tipis (KLT). Prinsip kerja dari KLT adalah perbedaan tingkat kelarutan suatu senyawa diantara dua fase. Metode ini sering digunakan karena sederhana, cepat dalam memisahkan dan sensitif. Metode KLT melibatkan dua sifat fase yaitu fase diam dan fase gerak dengan komposisi berbagi pelarut dimana dapat memisahkan senyawa berdasarkan perbedaan kepolaran. Fase diam yang digunakan adalah senyawa yang dapat menahan pergerakan sampel yang dibawa oleh fase gerak karena memiliki kepolaran yang sesuai dengan komponen yang dipisahkan. Fase diam yang digunakan adalah silika gel GF254. Permukaan silika gel terdiri atas
gugus Si-O-Si dan gugus silanol (Si-OH). Gugus silanol bersifat sedikit asam dan polar sehingga gugus ini mampu membentuk ikatan hidrogen dengan solut-solut yang sedikit polar sampai polar (Rohman dan Gandjar, 2008). Pemisahan yang optimal dapat terjadi apabila fase gerak yang digunakan adalah campuran dua pelarut organik karena daya elusi campuran kedua pelarut dapat mudah diatur (Rohman, 2009).
15
2.7 Spektrofotometer UV-Vis
Metode ini didasarkan pada perubahan warna radikal bebas. Absorbansi yang diukur pada metode ini adalah absorbansi larutan DPPH sisa yang tidak beraksi dengan senyawa antioksidan. Spektrofotometer UV-Vis akan mengukur besarnya energi yang diabsorbansi atau diteruskan oleh suatu zat. Larutan yang mengandung zat yang dapat menyerap cahaya monokromatik akan mengakibatkan terjadinya pemantulan, penyerapan atau penerusan dari cahaya tersebut (Harmita, 2006). Panjang gelombang yang digunakan untuk uji antioksidan adalah panjang gelombang maksimum absorbansi. Variasi ukuran λ max yang digunakan adalah
515 nm, 516 nm, 517 nm, 518 nm, dan 520 nm (Molyneux, 2004). Penelitian Azizah (2013), menggunakan λ max sebesar 517 nm untuk mengetahui aktivitas
antioksidan dari ekstrak kapang mangrove Avicennia sp. dengan menggunakan spektrofotometer UV-Vis. Penelitian Saputri (2013), juga menggunakan λ max
sebesar 517 nm untuk mengetahui aktivitas antioksidan dari ekstrak kapang mangrove Rhizophora sp. dengan menggunakan spektrofotometer UV-Vis.
2.8GC-MS
digunakan untuk mengidentifikasi suatu senyawa yang terdapat pada campuran gas dan juga menentukan konsentrasi suatu senyawa dalam fase gas. Penggunaan GC dapat dipadukan dengan MS sehingga menghasilkan data yang lebih akurat dalam mengidentifikasi senyawa yang dilengkapi standar molekulnya (Pavia et al, 2006).
17
BAB III
METODOLOGI PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Desember 2013. Lokasi penelitian yaitu laboratorium Mikrobiologi, laboratorium Lingkungan dan Pangan. Pusat Laboratorium Terpadu (PLT) UIN Syarif Hidayatullah Jakarta.
3.2 Alat dan Bahan
Alat-alat yang digunakan adalah autoklaf (ALP), timbangan analitik (Ohaus), Laminar Air Flow Cabinet (ESCI), rotary evaporator (Heidolph Instrument), hot plate (Thermolyne Chimarec ® 1), Magnetik Stirer, shaker, mikropipet 1000 µL dan 100 µL, vortex (Thermolyne), oven (Memmert), corong pisah (Schoot Duran), mortar, spektrofotometer UV-Vis (Perkin Elmer Precisely), mikroskop cahaya (Olympus C 011), mikroskop stereo (Olympus C 011), GC-MS Shimadzu QP 2010, lampu UV dan kamera.
Bahan-bahan yang digunakan adalah isolat kapang endofit Colletotrichum
spp. dari tanaman kina (Cinchona calisaya Wedd.), media Potato Dextrose Agar
3.3 Sumber Isolat
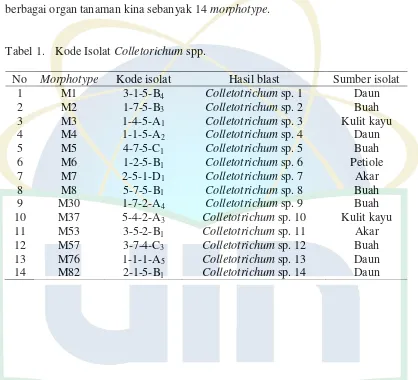
Isolat kapang endofit Colletorichum spp. yang telah diisolasi berasal dari berbagai organ tanaman kina sebanyak 14 morphotype.
Tabel 1. Kode Isolat Colletorichum spp.
No Morphotype Kode isolat Hasil blast Sumber isolat 1 M1 3-1-5-B4 Colletotrichum sp. 1 Daun
2 M2 1-7-5-B3 Colletotrichum sp. 2 Buah
3 M3 1-4-5-A1 Colletotrichum sp. 3 Kulit kayu
4 M4 1-1-5-A2 Colletotrichum sp. 4 Daun
5 M5 4-7-5-C1 Colletotrichum sp. 5 Buah
6 M6 1-2-5-B1 Colletotrichum sp. 6 Petiole
7 M7 2-5-1-D1 Colletotrichum sp. 7 Akar
8 M8 5-7-5-B1 Colletotrichum sp. 8 Buah
9 M30 1-7-2-A4 Colletotrichum sp. 9 Buah
10 M37 5-4-2-A3 Colletotrichum sp. 10 Kulit kayu
11 M53 3-5-2-B1 Colletotrichum sp. 11 Akar
12 M57 3-7-4-C3 Colletotrichum sp. 12 Buah
13 M76 1-1-1-A5 Colletotrichum sp. 13 Daun
19
3.4 Cara Kerja
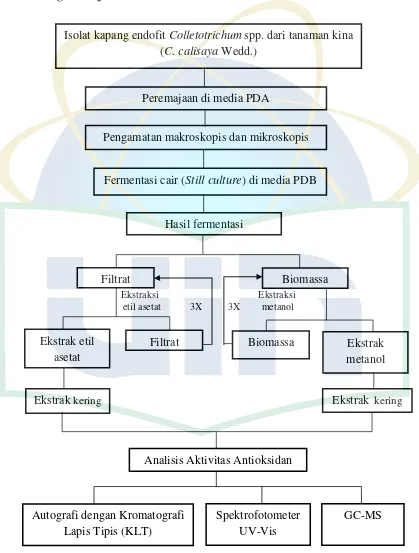
3.4.1. Bagan Kerja Penelitian
Ekstraksi Ekstraksi etil asetat 3X 3X metanol
Gambar 6. Skema Bagan Kerja Penelitian.
Isolat kapang endofit Colletotrichum spp. dari tanaman kina (C. calisaya Wedd.)
Peremajaan di media PDA
Fermentasi cair (Still culture) di media PDB
Hasil fermentasi
Filtrat Biomassa
Ekstrak etil asetat
Filtrat Biomassa Ekstrak metanol
Ekstrak kering
Ekstrak kering
Analisis Aktivitas Antioksidan
Autografi dengan Kromatografi Lapis Tipis (KLT)
Spektrofotometer UV-Vis Pengamatan makroskopis dan mikroskopis
3.4.2. Peremajaan Kapang Endofit
Isolat kapang endofit Colletotrichum spp. dari masing-masing morphotype
ditanam pada cawan petri yang berisi media Potato Dextrose Agar (PDA) secara duplo dan disimpan selama 7 hari pada suhu ruang. Isolat yang diremajakan tersebut disimpan sebagai kultur stok dan working culture.
3.4.3. Pengamatan Kapang Endofit
Pengamatan secara makroskopis dilakukkan dengan mengamati warna koloni kapang, bentuk area miselium kapang, bentuk tepi miselium kapang, mengamati ada atau tidaknya bintik jingga dan bintik hitam serta kapang yang terdapat pada cawan didokumentasikan menggunakan kamera digital.
Pengamatan secara mikroskopis menggunakan mikroskop stereo dan mikroskop cahaya. Konidia diambil menggunakan ose secara aseptis. Bagian permukaan koloni diambil dan diletakan diatas gelas objek yang telah ditetesi
shear’s diamati di bawah mikroskop cahaya dengan perbesaran 100 sampai 1000
kali menggunakan minyak imersi.
3.4.4. Fermentasi Cair Kapang Endofit
Isolat tunggal yang telah diremajakan dari cawan petri diinokulasikan ke dalam medium fermentasi cair yaitu Potato Dextrose Broth (PDB). Medium PDB yang digunakan yaitu sebanyak 200 ml untuk setiap isolat. Pembuatan medium dilakukan dengan menimbang medium lalu dilarutkan dengan menggunakan akuades. Medium dilarutkan dan dipanaskan diatas hot plate menggunakan
21
kedalam botol fermentasi yang ditutup sumbat dan disterilisasi pada suhu 121°C selama 15 menit.
Inokulasi dilakukan dengan mengambil 3 cetakan dari isolat kapang yang ada didalam PDA cawan dengan sedotan steril lalu dimasukkan kedalam medium PDB secara aseptis. Medium PDB tersebut diinkubasikan selama 21 hari pada suhu ruang (27°C) tanpa pengocokan. Setelah 21 hari, hasil fermentasi dipisahkan antara filtrat dan biomassa dengan cara disaring untuk uji antioksidan.
3.4.5. Ekstraksi Hasil Fermentasi dengan Pelarut Organik
Hasil fermentasi yang telah disaring dan dipisahkan antara filtrat dan biomassa, kemudian diekstraksi cair cair pada filtrat dengan penambahan etil asetat sedangkan ekstraksi cair cair pada biomassa menggunakan metanol.
a) Ekstraksi cair cair terhadap filtrat (ekstrak filtrat)
b) Ekstraksi cair cair terhadap biomassa (ekstrak biomassa)
Biomassa hasil saringan diekstraksi dengan metanol sebanyak 100 ml (v/v) dan dihaluskan menggunakan mortar sampai isolat kapang halus kemudian dimaserasi dan di shaker selama 24 jam. Kemudian disaring untuk diambil filtratnya sedangkan biomassanya (ampas) diberi metanol baru (maserasi dilakukan berulang sebanyak tiga kali). Hasil ekstraksi yang diperoleh kemudian dipekatkan menggunakan rotary evaporator suhu 40°C sehingga diperoleh ekstrak pekat untuk dilakukkan uji antioksidan.
3.4.6. Uji Senyawa Antioksidan dari Ekstrak Hasil Fermentasi
3.4.6.1. Metode DPPH Menggunakan Kromatografi Lapis Tipis (KLT)
Ekstrak pekat yang didapatkan dari biomassa dan filtrat sebanyak satu mg dilarutkan dengan 10 ml metanol lalu di vortex sampai larut, setelah itu sampel ditotolkan pada pelat kromatografi lapis tipis (KLT) begitu juga dengan pembuatan vitamin C sebagai kontrol. Pelat KLT dimasukkan ke dalam chamber
23
pada λ 254 nm dan λ 366 nm. Bercak pada pelat diamati dan dihitung nilai Rf (retardation factor) dengan rumus :
3.4.6.2. Metode DPPH Menggunakan Spektrofotometer UV-Vis
Pengujian dilanjutkan dengan uji persentasi yaitu untuk menentukan kadar antioksidan menggunakan spektrofotometer dengan cara ekstrak dilarutkan didalam metanol dan dibuat stok untuk pengenceran. Seri pengenceran dibuat dari larutan stok sebanyak lima variasi konsentrasi. Ekstrak kapang dari berbagai variasi konsentrasi sebanyak 2 ml ditambahkan 2 ml DPPH 0,002% didalam metanol. Ekstrak didiamkan selama 30 menit di dalam botol gelap (Bendra, 2012). Larutan stok DPPH disimpan kedalam botol gelap (pembuatan larutan ini selalu baru untuk setiap pengujian) lalu diamkan selama 20 menit (Azizah, 2013). Pembanding (kontrol) yang digunakan adalah larutan vitamin C dalam metanol dengan berbagai variasi konsentrasi. Absorbansi dari kedua larutan tersebut diukur menggunakan spektrofotometer UV-VIS pada λ maksimum 517 nm. Pengukuran absorbansi dilakukan 2 kali pengulangan. Aktivitas antioksidan diukur dari penurunan absorbansi larutan DPPH akibat penambahan ekstrak hasil fermentasi (Molyneux, 2004).
3.4.7. Analisis Ekstraksi Metabolit Sekunder dengan GC-MS
Ekstrak kapang endofit yang memiliki nilai IC50 yang tertinggi secara
untuk dianalisis menggunakan GC-MS Shimadzu QP 2010 untuk mengetahui komponen senyawa yang terdapat pada kedua ekstrak tersebut. Sampel sebanyak 1 µl diinjeksikan ke dalam GC-MS yang dioperasikan menggunakan kolom kaca panjang 25 m, diameter 0,25 mm dan ketebalan 0,25 µl dengan fase diam CP-Sil 5 CB dengan temperatur 10oC/menit, gas pembawa helium bertekanan 12 kPa, total laju 30 mL/menit dan split rasio sebesar 1:50 (Sastroamidjojo, 2001).
3.5 Analisis Data
Data hasil uji aktivitas antioksidan dibuat dalam bentuk kurva dengan menggunakan program Microsoft Excel 2007. Pembanding (kontrol) yang digunakan adalah vitamin C. Persentase inhibisi ekstrak kapang terhadap larutan DPPH dihitung menggunakan rumus :
Hasil pengujian didapat nilai absorbansi sampel uji dan absorbansi kontrol, dari nilai absorbansi tersebut dihitung nilai % inhibisi dari berbagai konsentrasi kemudian disajikan dalam bentuk kurva regresi linier yang diplotkan antara konsentrasi pada sumbu X dengan aktivitas peredaman DPPH (% inhibisi) pada sumbu Y. Nilai IC50 ditetapkan dari persamaan regresi linier Y = ax+b dengan
25
BAB IV
HASIL DAN PEMBAHASAN
4.1 Fermentasi Cair Kapang Endofit Colletotrichum spp.
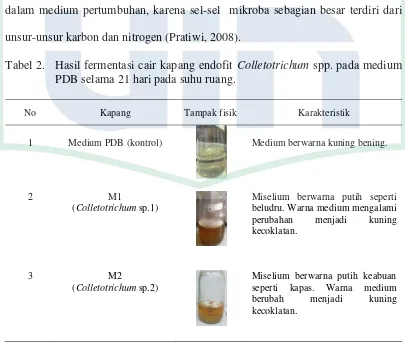
Fermentasi cair kapang endofit Colletotrichum spp. bertujuan untuk mendapatkan metabolit sekunder dari kapang tersebut. Medium Potato Dextrose Broth (PDB) adalah medium yang umum digunakan untuk menumbuhkan jamur, kapang dan khamir karena media ini mengandung sumber nutrisi yang mendorong sporulasi kapang, produksi zat warna dan pertumbuhan jamur secara subur (Pelczar dan Chan, 2010). Media PDB mengandung sumber karbon yang berasal dari kentang dan dextrose. Sumber karbon merupakan komponen terpenting dalam medium pertumbuhan, karena sel-sel mikroba sebagian besar terdiri dari unsur-unsur karbon dan nitrogen (Pratiwi, 2008).
Tabel 2. Hasil fermentasi cair kapang endofit Colletotrichum spp. pada medium PDB selama 21 hari pada suhu ruang.
No Kapang Tampak fisik Karakteristik
1 Medium PDB (kontrol) Medium berwarna kuning bening.
2 M1
(Colletotrichum sp.1)
Miselium berwarna putih seperti beludru. Warna medium mengalami perubahan menjadi kuning kecoklatan.
3 M2
(Colletotrichum sp.2)
Tabel 2. (lanjutan)
No Kapang Tampak fisik Karakteristik
4 M3
(Colletotrichum sp. 3)
Miselium berwarna putih seperti kapas. Warna medium berubah menjadi kuning keruh.
5 M4
(Colletotrichum sp. 4)
Miselium berwarna putih seperti beludru. Warna medium berubah menjadi kuning agak kecoklatan.
6 M5
(Colletotrichum sp. 5)
Miselium berwarna putih seperti beludru dengan sedikit miselium yang mengandung konidia berwarna jingga. Warna medium berubah menjadi kuning kecoklatan
7 M6
(Colletotrichum sp. 6)
Miselium berwarna putih agak krem dengan bercak abu-abu. Warna medium berubah menjadi kuning sedikit keruh.
8 M7
(Colletotrichum sp. 7)
Miselium berwarna abu-abu dengan sedikit warna putih seperti kapas. Warna medium berubah menjadi kuning keruh.
9 M8
(Colletotrichum sp. 8)
Miselium berwarna putih seperti beludru dengan sedikit miselium yang mengandung konidia berwarna jingga. Warna medium berubah menjadi kuning kecoklatan.
10 M30
(Colletotrichum sp. 9)
Miselium berwarna putih seperti beludru. Warna medium berubah menjadi kuning keruh agak kecoklatan.
11 M37
(Colletotrichum sp. 10)
27
Tabel 2. (lanjutan)
No Kapang Tampak fisik Karakteristik
12 M53
(Colletotrichum sp. 11)
Miselium berwarna putih keabuan seperti kapas. Warna medium berubah menjadi kuning lebih bening.
13 M57
(Colletotrichum sp. 12)
Miselium berwarna putih seperti kapas dengan sedikit miselium yang mengandung konidia berwarna jingga. Warna medium berubah menjadi kuning kecoklatan.
14 M76
(Colletotrichum sp. 13)
Miselium berwarna putih seperti beludru seperti kapas. Warna medium berubah menjadi kuning keruh.
15 M82
(Colletotrichum sp. 14)
Miselium berwarna putih dengan sedikit abu-abu dibagian tepi. Warna medium berubah menjadi kuning agak kecoklatan.
Warna medium PDB mengalami perubahan menjadi kuning kecoklatan yang awalnya kuning bening, seperti yang terjadi pada sampel M1, M2, M4, M5, M8, M30, M37, M57, dan M82. Warna medium menjadi kuning keruh yang awalnya kuning bening terjadi pada sampel M3, M6, M7, dan M76 sedangkan pada sampel M53 warna medium berubah menjadi kuning lebih bening (Tabel 2). Perubahan yang terjadi diduga karena adanya aktivitas dari kapang dalam memanfaatkan nutrisi yang terdapat pada medium PDB selama proses fermentasi. Hal ini sesuai dengan penelitian Jauhari (2010), yang menyatakan bahwa perubahan warna substrat dapat dikarenakan adanya aktivitas kapang endofit atau proses metabolisme kapang dalam memanfaatkan nutrisi yang terdapat di dalam medium. Kapang diduga menghasilkan metabolit primer dan metabolit sekunder. Menurut Gandjar et al. (2006), pertumbuhan fungi dapat diketahui dari penambahan massa sel dan proses metabolisme kapang yang menyebabkan perubahan pada substrat yaitu timbulnya perubahan warna atau kekeruhan pada suatu substrat cair. Medium yang semula bening akan berubah menjadi keruh tetapi medium yang semula tidak terlalu bening menjadi bening karena adanya aktivitas dari kapang. Oleh karena itu, dapat dikatakan bahwa kapang endofit
Colletotrichum spp. mengalami pertumbuhan dan menghasilkan metabolit dalam medium fermentasi PBD.
4.2 Uji Autografi Aktivitas Antioksidan
29
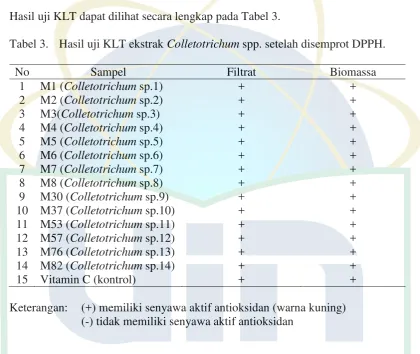
ditandai dengan perubahan warna pada pelat KLT dari ungu menjadi kuning setelah disemprot larutan 1,1-difenil-2-pikrilhidrazil (DPPH) (Mailandari, 2012). Keberadaan aktivitas antioksidan ditandai dengan hasil positif dan sebaliknya. Hasil uji KLT dapat dilihat secara lengkap pada Tabel 3.
Tabel 3. Hasil uji KLT ekstrak Colletotrichum spp. setelah disemprot DPPH. No Sampel Filtrat Biomassa
1 M1 (Colletotrichum sp.1) + +
2 M2 (Colletotrichum sp.2) + +
3 M3(Colletotrichum sp.3) + +
4 M4 (Colletotrichum sp.4) + +
5 M5 (Colletotrichum sp.5) + +
6 M6 (Colletotrichum sp.6) + +
7 M7 (Colletotrichum sp.7) + +
8 M8 (Colletotrichum sp.8) + +
9 M30 (Colletotrichum sp.9) + + 10 M37 (Colletotrichum sp.10) + + 11 M53 (Colletotrichum sp.11) + + 12 M57 (Colletotrichum sp.12) + + 13 M76 (Colletotrichum sp.13) + + 14 M82 (Colletotrichum sp.14) + + 15 Vitamin C (kontrol) + + Keterangan: (+) memiliki senyawa aktif antioksidan (warna kuning)
(-) tidak memiliki senyawa aktif antioksidan
Hasil uji KLT memperlihatkan bahwa seluruh ekstrak filtrat dan biomassa
mampu mendonorkan atom hidrogennya untuk berikatan dengan DPPH ditandai dengan semakin hilangnya warna ungu menjadi kuning pucat. Hal ini menunjukkan bahwa seluruh ekstrak filtrat dan biomassa Colletotrichum spp. berpotensi sebagai antioksidan yang ditandai dengan hasil positif pada uji KLT.
Gambar 7. Nilai Retardation factor (Rf) K) kontrol Vitamin C A) ekstrak biomassa Colletotrichum sp.8 B) ekstrak filtrat Colletotrichum sp. 10
Nilai Retardation factor (Rf) digunakan untuk mengetahui komponen senyawa yang terdapat pada ekstrak filtrat dan biomassa yang akan dibandingakan dengan vitamin C. Nilai Rf standar vitamin C dengan menggunakan eluen etil asetat, metanol dan air adalah 0,74. Nilai Rf sampel yang mendekati nilai Rf standar vitamin C adalah ekstrak biomassa Colletotrichum sp. 8 dan ekstrak filtrat
31
apabila dua bercak memiliki nilai Rf yang hampir sama maka kemungkinan besar komponen tersebut berasal dari kelompok senyawa yang sama. Hal ini diduga bahwa bercak ekstrak biomassa Colletotrichum sp. 8 dan ekstrak filtrat
Colletotrichum sp. 10 dengan standar vitamin C diduga merupakan kelompok senyawa yang sama.
Nilai Rf dari seluruh sampel bervariasi ada yang nilainya lebih tinggi atau lebih rendah dibandingkan standar vitamin C yaitu dari 0,2 sampai 0,82 (Lampiran 2). Nilai Rf menunjukan keberadaan suatu senyawa yang terdapat di dalam suatu sampel. Senyawa yang terkandung antara satu sampel dengan sampel yang lain memiliki perbedaan. Menurut Lasmaria (2011), sampel yang memiliki nilai Rf yang lebih tinggi atau lebih rendah dapat dikarenakan adanya senyawa lain yang terkandung pada masing-masing ekstrak sehingga menghasilkan nilai Rf yang berbeda. Nilai Rf merupakan nilai yang sangat sensitif karena banyak faktor yang dapat menyebabkan nilai Rf berubah. Menurut Robinson (1995), nilai Rf berubah karena faktor suhu, eluen, dan banyaknya senyawa yang ditotolkan. Oleh karena itu, nilai Rf tidak dapat diandalkan untuk identifikasi senyawa sehingga perlu adanya pengujian lanjutan.
4.3 Uji Aktivitas Antioksidan Menggunakan Spektrofotometer UV-Vis.
akan menurun apabila konsentrasi sampel semakin besar yang mengakibatkan semakin besarnya persen penghambatan. Aktivitas antioksidan dari sampel akan merubah warna larutan DPPH dalam metanol yang semula berwarna ungu menjadi kuning (Molyneux, 2004; Lasmaria, 2011). Aktivitas antioksidan dinyatakan dengan nilai Inhibition Concentration 50% (IC50). Nilai IC50 dihitung
berdasarkan persen penghambatan terhadap radikal DPPH dari masing-masing konsentrasi larutan sampel secara lengkap dapat dilihat pada Gambar 8.
Gambar 8. Aktivitas antioksidan ekstrak filtrat Colletotrichum spp. berdasarkan nilai IC50
Hasil analisis regresi menunjukan bahwa seluruh ekstrak filtrat memiliki aktivitas antioksidan yang bervariasi. Ekstrak filtrat Colletotrichum sp. 1 memiliki aktivitas antioksidan tertinggi dengan nilai IC50 837,143 ppm dan ekstrak filtrat
Colletotrichum sp. 11 memiliki aktivitas antioksidan terendah dengan nilai IC50
2017,2 ppm (Gambar 8). Aktivitas antioksidan dinyatakan dengan nilai IC50
dimana aktivitas antioksidan akanberbanding terbalik dengan nilai IC50. Semakin
tinggi aktivitas antioksidan suatu sampel maka semakin rendah nilai IC50 dan 0
500 1000 1500 2000 2500
IC
50
(ppm
)
33
sebaliknya (Pratiwi et al., 2013). Aktivitas antioksidan tertinggi dari seluruh ekstrak filtrat memiliki nilai IC50 sebesar 837,143 ppm. Hal ini menunjukkan
bahwa seluruh ekstrak filtrat Colletotrichum spp. tergolong tidak aktif sebagai antioksidan. Menurut Jun et al. (2003), aktivitas antioksidan dikatakan tidak aktif jika memiliki nilai IC50 > 500 ppm.
Aktivitas antioksidan seluruh ekstrak filtrat Colletotrichum spp. jauh lebih rendah apabila dibandingkan dengan vitamin C yang memiliki IC50 sebesar 3,793
ppm (Gambar 8). Rendahnya aktivitas antioksidan pada seluruh ekstrak filtrat
Colletotrichum spp. karena vitamin C merupakan senyawa murni yang umum digunakan sebagai pembanding karena memiliki aktivitas antioksidan kuat terbukti dengan nilai IC50 yang kecil (Arindah, 2010). Ekstrak filtrat
Colletotrichum spp. yang diuji pada penelitian ini masih berupa ekstrak kasar (crude extract) dan bukan senyawa murni. Menurut Hanani et al. (2005), apabila ekstrak masih berupa ekstrak kasar masih ada kemungkinan senyawa murni yang dikandung suatu sampel memiliki aktivitas peredaman radikal bebas lebih kuat dibandingkan ekstrak kasarnya.
Aktivitas antioksidan yang dihasilkan setiap ekstrak filtrat Colletotrichum
kemampuan setiap ekstrak filtrat kapang endofit Colletotrichum spp. berbeda dalam menghasilkan senyawa metabolit berupa antioksidan terlihat dari aktivitas antioksidan yang bervariasi.
Ekstrak filtrat Colletotrichum sp. 1 memiliki aktivitas antioksidan tertinggi apabila dibandingan seluruh ekstrak filtrat spesies lainnya (Gambar 8). Tingginya aktivitas antioksidan dari ekstrak filtrat Colletotrichum sp. 1 diduga karena spesies kapang endofit tersebut memiliki kemampuan memproduksi metabolit tertentu yang berperan sebagai antioksidan dibandingkan spesies lainnya. Menurut Strobel dan Daisy (2003), endofit dengan spesies yang sama diisolasi dari tanaman yang sama tetapi hanya salah satu endofit yang akan menghasilkan senyawa bioaktif sangat tinggi pada suatu kultur. Menurut Dewick (2002), produksi metabolit sekunder tertentu hanya ditemukan pada organisme spesifik, atau terdapat pada strain (galur) yang spesifik serta hanya diproduksi pada kondisi-kondisi tertentu.
Gambar 9. Aktivitas antioksidan ekstrak biomassa Colletotrichum spp. berdasarkan nilai IC50
0 500 1000 1500 2000 2500
IC
50
(ppm
)
35
Aktivitas antioksidan yang dihasilkan seluruh ekstrak biomassa
Colletotrichum spp. bervariasi. Hasil analisis regresi menunjukkan ekstrak biomassa Colletotrichum sp. 1 memiliki aktivitas antioksidan tertinggi dengan nilai IC50 1489,565 ppm. Aktivitas antioksidan terendah terdapat pada ekstrak
biomassa Colletotrichum sp. 7 dengan nilai IC50 2351,157 ppm (Gambar 9). Hal
ini menunjukkan bahwa seluruh ekstrak biomassa Colletotrichum spp. tergolong tidak aktif sebagai antioksidan. Menurut Jun et al. (2003), aktivitas antioksidan dikatakan tidak aktif jika memiliki nilai IC50 > 500 ppm.
Ekstrak biomassa Colletotrichum sp. 1 memiliki aktivitas antioksidan tertinggi dari seluruh ekstrak biomassa dengan nilai IC50 1489,565 ppm tetapi
memiliki aktivitas antioksidan yang sangat rendah (Gambar 9). Kapang endofit
Colletotrichum sp. 1 diisolasi dari organ daun tanaman kina (Chinchona calisaya
Kapang endofit Colletotrichum sp. 4, Colletotrichum sp. 10, dan
Colletotrichum sp. 14 diisolasi dari organ yang sama yaitu organ daun tetapi memiliki aktivitas antioksidan yang berbeda serta seluruh ekstrak biomassa
Colletotrichum spp. yang diisolasi dari organ tanaman yang berbeda memiliki aktivitas yang berbeda pula (Gambar 9). Hal ini menunjukan bahwa setiap spesies
Colletotrichum spp. memiliki kemampuan yang berbeda dalam menghasilkan senyawa antioksidan. Penelitian Petrini et al. (1992), menyatakan bahwa kapang endofit dengan spesies yang sama pada satu tanaman yang sama namun diisolasi dari organ tanaman yang berbeda memiliki kemampuan untuk memproduksi metabolit sekunder yang berbeda. Menurut Srikandace et al. (2007), kapang endofit memiliki kemampuan untuk menghasilkan senyawa metabolit yang berbeda-beda. Oleh sebab itu, ekstrak biomassa Colletotrichum spp. dalam penelitian ini memiliki kemampuan yang berbeda dalam menghasilkan senyawa antioksidan.
Ekstrak biomassa Colletotrichum sp. 1 memiliki aktivitas antioksidan yang lebih tinggi dibandingkan seluruh ekstrak biomassa dengan nilai IC50 1489,565
ppm (Gambar 9). Penelitian Saputri (2013), menyatakan bahwa ekstrak biomassa kapang genus Colletotrichum yang diisolasi dari tanaman Rhizophora sp. memiliki nilai IC50 sebesar 44,62 µg/ml. Menurut Jun et al. (2003), aktivitas
antioksidan dikatakan aktif jika IC50 50-100 ppm dan tidak aktif jika IC50 > 500
ppm. Hal ini menunjukkan bahwa ekstrak biomassa Colletotrichum dari
37
Seluruh ekstrak biomassa Colletotrichum spp. memiliki aktivitas antioksidan yang sangat rendah dibandingkan standar vitamin C. Vitamin C sebagai kontrol positif memiliki nilai IC50 sebesar 3,793 ppm (Gambar 9).
Rendahnya aktivitas antioksidan yang dihasilkan ekstrak biomassa Colletotrichum
spp. dibandingkan vitamin C diduga karena ekstrak yang diuji masih merupakan ekstrak kasar (crude extract) dan bukan senyawa murni. Apabila ekstrak masih berupa ekstrak kasar masih ada kemungkinan senyawa murni yang dikandung suatu sampel memiliki aktivitas peredaman radikal bebas lebih kuat dibandingkan ekstrak kasarnya (Hanani et al., 2005).
Tingginya aktivitas antioksidan vitamin C karena vitamin C merupakan senyawa murni. Vitamin C memiliki aktivitas antioksidan kuat terbukti dengan nilai IC50 yang kecil (Arindah, 2010). Vitamin C mudah mengalami oksidasi oleh
radikal bebas karena mempunyai ikatan rangkap serta terdapat 2 gugus –OH yang terikat pada ikatan rangkap tersebut. Vitamin C mampu menangkap radikal bebas dengan atau tanpa katalisator enzim. Reaksinya terhadap senyawa oksigen reaktif lebih cepat dibandingkan dengan komponen cair lainnya (Winarsi, 2007).
4.4 Analisis GC-MS
Gambar 10. Kromatogram Hasil GC-MS Ekstrak Filtrat
Tabel 4. Hasil identifikasi komponen ekstrak filtrat Colletotrichum sp.1 dengan pelarut etil asetat.
No Nama Komponen % area
1 Etilbenzena 3.86
2 p-Dimetilbenzena 3.28
3 o-Silena 21.38
4 1-metiletil-Benzena 0.67
5 1,4-dikloro-Benzena 1.61
6 Cis-Limonen Oksida 1.34
7 Naptalen * 5.55
8 Metil Salisilat* 1.34
9 4-kloro-Fenol* 2.09
10 Sikloundekanon 0.72
11 9,10-dihidroksi-Asam oktadekanoat* 1.25 12 1,2,4-Trihidroksi-p-metana 1.00 13 2,4-bis(1,1-dimetiletil)-Fenol * 1.42 14 3,4-dihidro-8-hidroksi-3-metil 1H-2-Benzopiran-1-one* 24.44 15 1,1'-(2,6-dimetil-3,5-piridindiyl)bis- Etanon 23.12
16 Benzopenon 1.30
39
Hasil GC-MS senyawa bioaktif yang terkandung didalam ekstrak etil asetat kapang endofit Colletotrichum sp. 1 sedikitnya terdapat 19 komponen senyawa yang termasuk kedalam golongan senyawa fenol, aromatik, ester, keton, dan alkana. Senyawa naftalen memiliki % area 5.55. Senyawa fenol banyak ditemukan dengan % area yang berbeda yaitu 2.09, 1.42, 1.47. Senyawa asam oktadekanoat memiliki % area 1.25. Senyawa benzopiran memiliki % area 24.44. Persen area yang paling tinggi terdapat pada komponen senyawa benzopiran (Tabel 4).
Senyawa naptalen, metil salisilat, fenol, asam oktadekanoat dan benzopiran memiliki aktivitas antioksidan. Kemampuan senyawa-senyawa tersebut telah dibuktikan oleh beberapa penelitian yang telah dilakukan sebelumnya. Penelitian Vijayavel et al. (2007), senyawa naptalen dari ekstrak
coronopifolia yaitu 1-nonadekena; asam heksadekanoat; asam 9-oktadekanoat. Penelitian Seo et al. (2006), senyawa benzopiran dari ganggang coklat Sargasum thunbergii terbukti efektif meredam radikal bebas. Penelitian Tianpanich et al. (2006), menyatakan bahwa senyawa benzopiran atau isokumarin yang dihasilkan kapang endofit Colletotrichum sp. dari tanaman Piper ornatum memiliki aktivitas antioksidan.
41
antioksidan, antitumor, dan antibiotik. Kandungan total fenol memiliki korelasi yang kuat dan berbanding lurus dengan aktivitas antioksidan (Widiastuti, 2010).
Gambar 11. Kromatogram Hasil GC-MS Ekstrak Biomassa
Tabel 5. Hasil identifikasi komponen ekstrak biomassa Colletotrichum sp.1 dengan pelarut metanol.
No Nama Komponen % area
1 N,N-Dimethyl-3-metoksipropilamin 3.26
2 2-butoksi Etanol 4.78
3 Siklotetrasiloksan 12.83
4 Asam butanedioat, dimetil ester 6.84
5 4-metoksi Fenol* 4.21
6 Etanol, 2-butoksi (CAS) (2-Asam Butoksietil asetat) 5.16 7 Siklopentasiloksan-dekametil 6.43 8 1,2-dihidro-1,1,6-trimetil Naptalen* 9.72
9 Korlumidin 7.06
10 Asam heksadekanoat* 11.51 11 Metil ester 8,11-Asam oktadekanoat * 7.50 12 13-Asam oktadekanoat, metil ester (CAS) Metil
Oktadec-13-Enoat *
Hasil analisis GC-MS menunjukan bahwa dalam ekstrak metanol kapang endofit Colletotrichum sp.1 terdapat sedikitnya 13 komponen senyawa yang termasuk kedalam golongan senyawa fenol, aromatik, ester, alkana, alkohol, dan amina. Senyawa fenol memiliki % area 4.21. Senyawa naftalen memiliki % area 9.72. Senyawa asam heksadekanoat memiliki % area 11.51. Senyawa asam oktadekanoat banyak ditemukan dengan % area yang berbeda yaitu 7.50, 15.32, 5.38. Persen area yang paling tinggi terdapat pada komponen senyawa asam oktadekanoat (Tabel 5).
Senyawa fenol, naptalen, asam heksadekanoat dan asam oktadekanoat diperkirakan memiliki aktivitas antioksidan pada ekstrak metanol (Tabel 5). Kemampuan senyawa-senyawa tersebut telah dibuktikan oleh beberapa penelitian. Menurut Liu et al. (2007), ekstrak metanol fungi endofit Xylaria sp. dari tanaman
Ginkgo biloba memiliki aktivitas antioksidan yang tinggi karena keberadaan senyawa fenol. Penelitian Swantara dan Parwata (2011), menyatakan bahwa senyawa yang paling aktif bersifat antioksidan pada Gracilaria coronopifolia
yaitu 1-nonadekena, asam heksadekanoat, dan asam 9-oktadekanoat. Persen area dari komponen senyawa asam oktadekanoat memiliki persen area yang tertinggi dibandingkan senyawa lain yang berperan sebagai antioksidan (Tabel 5). Hal ini diduga komponen senyawa asam oktadekanoat yang banyak berperan dalam meredam radikal bebas dari larutan DPPH sebagai antioksidan. Penelitian Miryati
43
(Jatropha curcas L.) memiliki efek antioksidan. Penelitian Vijayavel et al. (2007), menyatakan senyawa naptalen dari ekstrak Chorola vulgaris memiliki efek anti radikal bebas.
44
5.1 Kesimpulan
1. Seluruh ekstrak kapang endofit Colletotrichum spp. dari tanaman kina (C. calisaya Wedd.) memiliki potensi antioksidan ekstrak biomassa dan ekstrak filtrat yang ditandai dengan perubahan warna pelat KLT menjadi kuning setelah disemprot DPPH dan nilai IC50 dari masing-masing ekstrak
filtrat dan biomassa.
2. Ekstrak kapang endofit Colletotrichum sp. 1 dari tanaman kina (C. calisaya Wedd.) memiliki aktivitas antioksidan tertinggi dari ekstrak filtrat yaitu sebesar 837,143 ppm dan ekstrak biomassa sebesar 1900,46 ppm. 3. Senyawa hasil GC-MS Colletotrichum sp. 1 yang berperan sebagai
antioksidan dari ekstrak biomassa adalah senyawa fenol, naptalen, asam heksadekanoat dan asam oktadekanoat sedangkan senyawa ekstrak filtrat yang berperan sebagai antioksidan adalah naptalen, metil salisilat, fenol, asam oktadekanoat dan benzopiran.
5.2 Saran
45
DAFTAR PUSTAKA
Al–Mustafa, A.H., dan O.Y. Al–Thunibat. 2008. Antioxidant Activiity of Some Jordanian Medicinal Plants Used Traditionally for Treatment of Diabetes.
Pakistan Journal of Biological Sciences. 11(3):351–358.
Aly, A., A. Debbab, dan P. Proksch. 2011. Fifty Years of Drug Discovery from Fungi. Fungal Divers. 50: 3–19.
Andayani, R., Y. Lisawati, dan Maimunah. 2008. Penentuan Aktivitas Antioksidan, Kadar Fenolat total dan Likopen pada Buah Tomat (Lycopersicum L.). Jurnal Sains dan Teknologi Farmasi. 13: 9
Arindah, D. 2010. Fraksinasi dan Identifikasi Golongan Senyawa pada Daging Buah Pepino (Solanum muricatum Aiton) yang Berpotensi Sebagai Antioksidan. Skripsi. Fakultas Sains dan Teknologi. UIN Malang.
Azizah, S.K. 2013. Aktivitas Antioksidan Ekstrak Isolat-Isolat Kapang dari Tanaman Mangrove Avicennia sp. Skripsi. Fakultas Sains dan Teknologi. Universitas Islam Negeri Syarif Hidayatullah Jakarta.
Bendra, A. 2012. Uji Aktivitas Antioksidan Ekstrak Daun Premma oblongata
Miq. dengan Metode DPPH dan Identifikasi Golongan Senyawa Kimia dari Fraksi Teraktif. Skripsi. FMIPA. Universitas Indonesia.
Cano, J., J. Guarro, dan J. Gene. 2004. Molecular and Morphological Identification of Colletotrichum Species of Clinical Interest. Journal Of Clinical Microbiology. 42(6): 2450–2454.
Dewick, M. D. 2002. Medicinal Natural Product: A Biosynthetic Approach. Edisi 2. John Wiley dan Sons LTD. England.
Gandjar, I., W. Sjamsuridzal, dan A. Oetari. 2006. Mikologi Dasar dan Terapan. Yayasan Obor Indonesia. Jakarta.
Gangadevi, V., dan J. Muthumary. 2008. Isolation of Colletotrichum gloeosporioides, a Novel Endophytic Taxol-Producing Fungus From the Leaves of a Medicinal Plant (Justicia gendarussa). Mycologia Balcanica.
5: 1–4.
Hanani, E., A. Mun’in, dan R. Sekarini. 2005. Identifikasi Senyawa Antioksidan dalam Spons Callyspongia sp dari Kepulauan Seribu. Majalah Ilmu Kefarmasian. 2(3): 127-133.
Harmita. 2006. Buku Ajar Analisis Fisikokimia. Departemen Farmasi FMIPA UI. Depok.
Hermanto, S. 2008. Mengenal Lebih Jauh Teknik Analisa Kromatografi dan Spektofotometri. Pusat Laboratorium Terpadu UIN Syarif Hidayatullah. Jakarta.
Jauhari, L.T. 2010. Seleksi dan Identifikasi Kapang Endofit Penghasil Antimikroba Penghambat Pertumbuhan Mikroba Patogen. Skripsi. UIN Syarif Hidayatullah. Jakarta.
Jayanthi, G., S. Kamairaj, K. Karthikeyan, dan J. Muthumary. 2011. Antimicrobial and Antioksidan Activity of Cassia siamea Flowers
Phomopsis sp. GJJM07 isolated from Mesua ferrea. International Journal of Science. 1:85-90.
Jun, M.H.Y., Yu, J., Fong, X., Wan, C.S., dan Yang, C.T. 2003. Comparison of Antioxidant Activities of Isoflavones from Kudzu Root (Pueraria labata Ohwl). Journal Food Science. 68(6): 2117– 2122.
Khopkar, S.M. 2003. Konsep Dasar Kimia Analitik. UI Press. Jakarta.
Komisi Nasional Sumber Daya Genetik. 2008. Lokakarya Penyusunan National Report on Plant Genetic Resources : Warta Plasma Nutfah Indonesia No 20 Tahun 2008. http://indoplasma.or.id. Diakses pada 8 Oktober 2013 pukul 20.13 WIB
Lasmaria, C. 2011. Antioksidan yang Dihasilkan Kapang Aspergillus spp. dan pengaruhnya Terhadap Perbaikan Jaringan Hati Tikus Putih (Rattus norvegicus L.) Galur Sprague Dawley. Tesis. Program Pascasarjana. UI. Depok.
Listiandiani, K. 2011. Identifikasi Kapang Endofit ES1, ES2, ES3,DAN ES4 dari
Broussonetia papyrifera Vent. dan Pengujian Aktivitas Antimikroba.
Skripi. FMIPA. Universitas Indonesia.
Liu, X., M. Dong, X. Chen, M. Jiang, X. Lu, dan G. Yan. 2007. Antioxidant Activity and Phenolics of an Endophytic Xylaria sp. from Ginkgo biloba.
Food Chemistry. 105(2): 548–554.
Maehara, S., P. Simanjuntak, C. Kitamura, K. Ohashi, dan H. Shibuya. 2011.
47
Mailandari, M. 2012. Uji Aktivitas Antioksidan Ekstrak Daun Garcinia kydia
Roxb. dengan Metode DPPH dan Identifikasi Senyawa Kimia Fraksi yang Aktif. Skripsi. FMIPA. Universitas Indonesia.
Margiono, S. 2008. Produksi Metabolit Sekunder (Antibiotik) oleh Isolat Jamur Endofit Indonesia. Majalah Farmasi Indonesia. 19(2): 86-94.
Miryanti, A., L. Sapei, K. Budion, dan S. Indra. 2011.Ekstraksi Antioksidan dari Kulit Buah Manggis (Garcinia mangostana L.). Lembaga Penelitian dan Pengabdian Masyarakat. Bandung.
Molyneux, P. 2004. The Use of The Stable Free Radical Diphenylpicryl-hydrazyl (DPPH) for Estimating Antioxidant Activity. Journal of Science and Technology. 26(2): 211-219.
Mutiea, D. 2014. Aktivitas Antibakteri dan Produksi Kuinin dari Kapang Endofit (Colletotrichum spp.) Tanaman Kina (Cinchona calisaya Wedd.). Skripsi.
UIN Syarif Hidayatullah Jakarta.
Nath, A., P. Raghunatha, dan S.R. Joshi. 2012. Diversity and Biological Activities of Endophytic Fungi of Emblica officinalis, an Ethnomedicinal Plant of India. Journal ofMycobiology. 40(1): 8-13
Nimah, S., W. F. Ma’ruf dan A. Trianto. 2012. Uji Bioaktivitas Ekstrak Teripang Pasir (Holothuria scabra) Terhadap Bakteri Pseudomonas aeroginosa dan
Bacillus cereus. Jurnal Perikanan. 1(2): 1-9.
Oyi, A.R., J.A. Onaolapo, A.K. Haruna, dan C.O. Morah. 2007. Antimicrobial Screening and Stability Studies of the Crude Exctract of Jatropha curcas
Linn. Latex (Euphorbiaceae). Nigerian Journal of Parmaceutical Science.
6(2):14-20.
Pavia D.L., G.M. Lampman, G.S. Kriz, dan R.G. Engel. 2006. Introduction to Organic Laboratory Techniques: A Microscale Approach. Edisi 4. Brooks Cole Pub Co. United Kingdom.
Pawle, G dan S.K. Singh. 2014. Antioxidant Potential of Endophytic Fungus
Colletotrichum Species Isolated From Polygala elongata. International Journal of Pharma and Bio Sciences. 5(3): 313-319.
Pelczar, M.J., dan Chan. 2010. Dasar-Dasar Mikrobiologi. UI Press. Jakarta. Petrini, O., T.N. Sieber, L. Toti, dan O. Viret. 1992. Ecology Metabolite
Production and Utilization in Endophytic Fungi. Swiss Naturs Toxins.
78:196
Pratiwi, D., S. Wahdaningsih, dan Isnidar. 2013. The Test of Antioxidant Activity from Bawang Mekah Leaves (Eleutherine americana Merr.) Using DPPH (2,2-Diphenyl-1-Picrylhydrazyl) Method. Traditional Medicine Journal.
18(1): 9-16.
Prihatiningtias, W. 2005. Senyawa Bioaktif Fungi Endofit Akar Kuning (Fibraurea chloroleuca Miers) Sebagai Senyawa Antimikroba. Tesis. Sekolah Pascasarjana. UGM.
Radji, M. 2005. Peranan Bioteknologi dan Mikroba Endofit dalam Pengembangan Obat Herbal. Majalah Ilmu Kefarmasian. 2(3): 113-126. Ravishankara, M.N., H. Padh dan M. Rajani. 2003. Antioxidant Activity of
Cinchona officinalis Stem Bark Exctract. Oriental Pharmacy and Experience Medicine. 3(4): 205-211.
Robinson, T. 1995. Kandungan Organik Tumbuhan Tinggi. ITB Press. Bandung. Rohman, A. 2009. Kromatografi untuk Analisis Obat. Graha Ilmu. Yogyakarta. Rohman, A dan I.G. Gandjar. 2008. Kimia Farmasi Analisis. Pustaka Belajar.
Yogyakarta.
Salamah, E., P. Sri, dan P. Ellis. 2011. Aktivitas Antioksidan dan Komponen Bioaktif pada Selada Air (Nasturtium offcinale L. R. Br). Jurnal Pengolahan Hasil Perikanan Indonesia. 14(2): 85-91.
Saputri, R.E. 2013. Aktivitas Antioksidan Ekstrak Kapang Mangrove Rhizophora
sp. Skripsi. Universitas Islam Negeri Syarif Hidayatullah Jakarta.
Semangun, H. 2000. Penyakit-Penyakit Tanaman Perkebunan di Indonesia. Gajah Mada University Press. Yogyakarta.
Seo, Y., K.E Park, Y.A. Kim, H.Y. Lee, J.S. Yoo, J.W. Ahn, dan B.J. Lee. 2006. Isolation of Tetraprenyltolyquinols from the Brown Alga Sargasum thunbergii. Chem Pharm Bull. 54(12): 1730-1733.
Setyaningsih, D., C. Pandji, dan D.D. Perwatasari. 2014. Kajian Aktivitas Antiosidan dan Antimikroba Fraksi dan Ekstrak dari Ranting Jarak Pagar (Jatropha curcas L.) serta Pemanfaatannya pada Produk Personal Hygiene. Jurnal Agritech. 34(2).