EVALUASI PROFIL DISOLUSI SEDIAAN LEPAS LAMBAT DILTIAZEM HIDROKLORIDA YANG BEREDAR DI PASARAN
SKRIPSI
WARDAH ANNAJIAH 1111102000084
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN PROGRAM STUDI FARMASI
UIN SYARIF HIDAYATULLAH JAKARTA
EVALUASI PROFIL DISOLUSI SEDIAAN LEPAS LAMBAT DILTIAZEM HIDROKLORIDA YANG BEREDAR DI PASARAN
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
WARDAH ANNAJIAH 1111102000084
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN PROGRAM STUDI FARMASI
ABSTRAK
Nama : Wardah Annajiah
Program Studi : Strata-1 Farmasi
Judul Skripsi : Evaluasi Profil Disolusi Sediaan Lepas Lambat Diltiazem Hidroklorida yang Beredar di Pasaran
Informasi mengenai profil disolusi dari suatu produk dapat menjadi pertimbangan khusus bagi tenaga kesehatan dalam menentukan produk yang sesuai dengan kebutuhan dan kondisi pasien. Dua nama dagang sediaan lepas lambat diltiazem hidroklorida yaitu tablet CD 180 mg dan kapsul HB 90 mg diuji dengan metode uji disolusi satu yang tercantum dalam United State of Pharmacopeia XXX (USP XXX). Uji disolusi dilakukan dengan menggunakan medium air dengan volume 900 ml, alat tipe 2 (dayung), kecepatan pengadukan 100 rpm, suhu 37°C±0,5, dan waktu pengujian selama 12 jam. Kadar diltiazem hidroklorida yang terdisolusi diukur dengan spektrofotometer UV-vis. Hasil rata-rata persen kumulatif pelepasan diltiazem produk uji CD dan HB pada jam ke-3, 9, dan 12 secara berturut-turut adalah 32,588 % dan 30,190 %; 59,449 % dan 61,939%%; 70,300 % dan 70,026 %. Hasil uji disolusi menunjukkan bahwa produk uji CD dan HB tidak memenuhi persyaratan uji disolusi satu sebagaimana yang tercantum dalam USP XXX. Hasil kinetika pelepasan menunjukkan bahwa produk uji CD mengikuti kinetika pelepasan model Higuchi dan produk uji HB mengikuti kinetika pelepasan orde satu dengan mekanisme pelepasan pada kedua produk uji mengikuti difusi non-Fick. Hasil statistik data laju pelepasan pada model kinetika pelepasan orde nol, orde satu dan Higuchi menunjukkan bahwa produk uji CD tidak berbeda bermakna dengan produk uji HB.
ABSTRACT
Name : Wardah Annajiah
Study Program : Bachelor of Pharmacy
Title : Evaluation of Dissolution Profiles of Diltiazem Hydrochloride Sustained Release Preparation which are Available in The Markets
Informations of dissolution profiles of a formulation can be a particular consideration for health personnels determining the formulation according to needs and conditions of a patient. Two brand of diltiazem hydrochloride sustained release preparation which are CD 180 mg tablet and HB 90 mg capsule were tested using a dissolution test method one which is provided in United State of Pharmacopeia XXX (USP XXX). The dissolution tests were undertaken by using 900 ml water as a medium, instrument type 2 (paddle), 100 rpm striring speed, temperature of 37° C ± 0.5, and by taking time as long as 12 hours. The content of the diltiazem hydrochloride which has dissolved was measured by using UV-vis spectrophotometer. Percent average of cumulative release diltiazem hydrochloride on CD and HB at the 3rd, 9th and 12th hour respectively are 32,588 % and 30,190 %; 59,449 % and 61,939 %; 70,300 % and 70,026 %. The result of dissolution tests showed that CD and HB did not meet the requirements of a dissolution test one that is specified in USP XXX. The result of release kinetics indicated that CD followed the release kinetics model of Higuchi and HB followed the first-order kinetic release by using a release mechanism of non-Fick diffusion. Statistically, the data of a release rate at zero order, first-order and Higuchi release kinetics models showed that CD and HB was not significantly different.
KATA PENGANTAR
Alhamdulillahirabbil’alamin, segala puji dan syukur penulis ucapkan kehadirat Allah SWT yang telah melimpahkan rahmat dan ridho-Nya sehingga penulis dapat menyelesaikan penyusunan skripsi ini hingga selesai. Penulisan skripsi yang berjudul “Evaluasi Profil Disolusi Sediaan Lepas Lambat Diltiazem Hidroklorida yang Beredar di Pasaran” bertujuan untuk memenuhi persyaratan guna memperoleh gelar Sarjana Farmasi pada Fakultas Kedokteran dan Ilmu Kesehatan (FKIK), Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
Pada kesempatan ini, penulis menyadari bahwa, tanpa bantuan dan bimbingan dari berbagai pihak, dari masa perkuliahan sampai pada penyusunan skripsi ini, sangatlah sulit bagi saya untuk menyelesaikan skripsi ini. Oleh karena itu, penulis mengucapkan terima kasih dan penghargaan sebesar-besarnya kepada: 1. Ibu Yuni Anggraeni,M. Farm.,Apt dan Bapak Drs.Umar Mansur,M.Sc.,
Apt selaku pembimbing yang telah memberikan arahan, bimbingan, serta ilmunya dalam proses penelitian dan penyelesaian skripsi ini, semoga segala ilmu serta bimbingan ibu dan bapak mendapatkan imbalan yang lebih di sisi Allah SWT.
2. Bapak Dr. Arief Sumantri, SKM., M.Kes selaku Dekan Fakultas
Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
3. Bapak Yardi.,Ph.D., Apt selaku ketua Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
4. Bapak dan Ibu staf pengajar yang telah memberikan ilmu pengetahuan yang bermanfaat selama menempuh pendidikan di Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
Rijal dan Ahmad Musa Burhani yang telah memberikan doa, bantuan dan motivasi.
6. Sahabatku Rizza Permana Suci, Inten Novita Sari dan Rahmi Sertiana Nur Aiman yang telah menjadi sahabat terbaik, yang selalu mendengarkan dan memberikan motivasi kepadaku baik saat suka dan duka.
7. Teman seperjuangan penelitian, Umniyaty Mufidah dan Herlina Pertiwi, atas kebersamaan, bantuan, ilmu serta motivasinya sejak awal penelitian hingga akhir penyelesaian skripsi ini.
8. Teman-teman “Tableters” yang telah berbagi canda, tawa, susah dan senang selama melakukan penelitian di Laboratorium Formulasi Sediaan Padat.
9. Teman-teman Farmasi 2011 atas persaudaraan dan kebersamaan yang telah banyak membantu dan memotivasiku baik selama pengerjaan skripsi ini maupun selama di bangku perkuliahan.
10.Laboran Farmasi UIN Syarif Hidayatullah Jakarta, Kak Rahmadi, Kak Eris dan kak Rani yang dengan sabar membantu penulis mempersiapkan alat dan bahan selama penelitian.
11.Semua pihak yang tidak dapat disebutkan satu-persatu, yang telah memberikan bantuan dan dukuangan selama penelitian dan penulisan
skrispsi ini.
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna, namun penulis berharap semoga hasil penelitian ini dapat bermanfaat bagi perkembangan ilmu pengetahuan pada umumnya, dan ilmu farmasi pada khususnya. Akhir kata, penulis berharap Allah SWT berkenan membalas segala kebaikan semua pihak yang telah membantu penulis dalam penelitian ini.
Ciputat, 24 Juni 2015
DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERNYATAAN ORISINALITAS ... ii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN ... iv
ABSTRAK ... v
ABSTRACT ... vi
KATA PENGANTAR ... vii
HALAMAN PERSETUJUAN PUBLIKASI ... ix
DAFTAR ISI ... x
DAFTARTABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB 1 PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Rumusan Masalah ... 3
1.3. Tujuan Penelitian ... 3
1.4. Manfaat Penelitian ... 3
BAB 2 TINJAUAN PUSTAKA ... 4
2.1. Disolusi ... 4
2.2. Uji Disolusi ... 5
2.2.1. Kondisi Uji Disolusi ... 6
2.2.2. Metode Uji Disolusi ... 8
2.2.2.1. Metode Keranjang/Alat 1 ... 8
2.2.2.2. Metode Dayung/Alat 2 ... 9
2.2.3. Intrepretasi Hasil Uji Disolusi HCl ... 10
2.2.4. Uji Disolusi Sediaan Lepas Lambat Diltiazem HCl ... 10
2.3. Sediaan Lepas Lambat ... 12
2.3.1. Keuntungan & Kerugian Sediaan Lepas Lambat ... 13
2.3.2. Teknologi Sediaan Lepas Lambat ... 14
2.3.2.1. Tablet Lepas Lambat yang Menggunakan Matriks ... 14
2.3.2.2. Tablet Lepas Lambat yang Menggunakan Penyalutan ... 15
2.3.3. Mekanisme Pelepasan Zat Aktif ... 18
2.3.3.1. Sistem Difusi ... 18
2.3.3.2. Sistem Disolusi Terkendali ... 20
2.3.3.4. Sistem Osmotik Terkendali ... 21
2.3.3.5. Sistem Pertukaran Ion ... 21
2.4. Kinetika pelepasan Obat ... 22
2.4.1. Kinetika Pelepasan Orde Nol ... 22
2.4.2. Kinetika Pelepasan Orde Satu ... 23
2.4.3. Kinetika Pelepasan Model Higuchi ... 23
2.4.4. Kinetika Pelepasan Model Korsmeyer-Peppas ... 23
2.5. Spektrofotometer UV-Vis ... 24
2.6. Diltiazem Hidroklorida ... 24
BAB 3 METODE PENELITIAN ... 26
3.1. Lokasi dan Waktu Penelitian ... 26
3.2. Bahan Penelitian ... 26
3.3. Alat-Alat ... 26
3.4. Prosedur Penelitian ... 26
3.4.1. Pemilihan Sampel ... 26
3.4.2. Penentuan Panjang Gelombang Maksimal ... 26
3.4.3. Pembuatan Kurva Baku ... 27
3.4.4. Penetapan Kadar ... 27
3.4.5. Keseragaman Sediaan ... 28
3.4.5.1. Keragaman Bobot ... 28
3.4.5.2. Keseragaman Kandungan ... 28
3.4.6. Uji Disolusi ... 28
3.4.7. Analisis Kinetika Pelepasan Sediaan ... 29
3.4.8. Analisis Statistik ... 30
BAB 4 HASIL DAN PEMBAHASAN ... 31
4.1. Pemilihan Sampel ... 31
4.2. Penentuan Panjang Gelombang Maksimum ... 31
4.3. Pembuatan Kurva Baku ... 31
4.4. Penetapan Kadar ... 32
4.5. Keseragaman Sediaan ... 32
4.6. Uji Disolusi ... 34
4.7. Hasil Kinetika Pelepasan ... 39
4.8. Hasil Uji Statistik ... 41
BAB 5 PENUTUP ... 42
5.1. Kesimpulan ... 42
5.2. Saran ... 42
DAFTAR PUSTAKA ... 47
DAFTAR TABEL
2.1. Penerimaan hasil uji disolusi sediaan lepas lambat diltiazem HCl menurut USP XXX ... 10 2.2. Peralatan dan konsisi uji disolusi sediaan lepas lambat diltiazem HCL
menurut USP XXX ... 11 2.3. Rentang penerimaan kadar hasil uji disolusi sediaan lepas lambat diltiazem
HCl menurut USP XXX ... 12 2.4. Rumus perhitungan kinetika pelepasan obat ... 22 2.5. Hubungan eksponen pelepasan n dengan mekanisme pelepasan obat pada
persamaan korsmeyer-peppas ... 23 4.1. Hasil keseragaman kandungan produk uji CD ... 33 4.2. Hasil keragaman bobot produk uji HB ... 33 4.3. Hasil analisis kesesuaian pelepasan diltiazem HCl dari tablet CD SR
menurut USP XXX ... 36 4.4. Hasil analisis kesesuaian pelepasan diltiazem HCl dari kapsul HB SR
DAFTAR GAMBAR
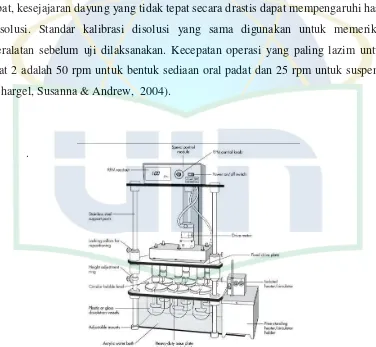
2.1. Susunan alat uji disolusi USP ... 9
2.2. Profil kadar obat dalam darah terhadap waktu dari bentuk sediaan lepas lambat yang ideal ... 13
2.3. Struktur kimia diltiazem HCl ... 24
4.1. Kurva baku diltiazem HCl dalam aqua destilata ... 32
DAFTAR LAMPIRAN
Lampiran 1. Alur penelitian ... 49
Lampiran 2. Sertifikat analisis diltiazem HCl ... 50
Lampiran 3. Gambar alat-alat ... 51
Lampiran 4. Kurva panjang gelombang masimum diltiazem HCl ... 52
Lampiran 5. Kurva baku diltiazem HCl ... 53
Lampiran 6. Hasil penetapan kadar ... 54
Lampiran 7. Hasil keseragaman kandungan ... 55
Lampiran 8. Hasil keragaman bobot ... 56
Lampiran 9. Hasil uji disolusi ... 57
Lampiran 10. Hasil analisis kinetika pelepasan obat ... 63
Lampiran 11. Perhitungan nilai koefisien pelepasan dari beberapa model kinetika ... 64
1.1. Latar Belakang
Pada tahun-tahun terakhir, berbagai produk obat pelepasan termodifikasi (modified release) telah dikembangkan. Produk pelepasan termodifikasi adalah bentuk sediaan yang dirancang untuk melepaskan obat secara terkendali untuk mencapai efikasi dan keamanan yang diinginkan. Salah satu produk pelepasan termodifikasi yang telah dikembangkan adalah sediaan lepas lambat (sustained release). Bentuk sediaan lepas lambat yang ideal hendaknya melepaskan suatu dosis terapeutik awal yang diikuti oleh suatu pelepasan obat yang lambat dan konstan. Dengan produk lepas lambat, konsentrasi obat dalam plasma yang konstan dapat dipertahankan dengan fluktuasi yang minimal (Shargel, Susanna & Andrew, 2004).
Fokus utama dari formulasi sediaan lepas lambat adalah pengendalian laju pelepasan obat, karena pengontrolan pelepasan obat yang tidak tepat dapat mengakibatkan berkurangnya efikasi atau dapat meningkatkan toksisitas. Selain itu, suatu sediaan lepas lambat juga memiliki resiko terjadinya kegagalan sistem yang menyebabkan terjadinya dose dumping (Mei et al., 2010; Wolny et al.,2012).
Salah satu sediaan lepas lambat yang telah dikembangkan dan dipasarkan adalah sediaan lepas lambat diltiazem hidroklorida. Diltiazem hidroklorida merupakan salah satu golongan penghambat kanal ion kalsium yang digunakan pada terapi angina pektoris, aritmia dan hipertensi yang bekerja dengan menghambat saluran L-kalsium di otot polos pembuluh darah dan otot jantung. Penghambatan tersebut bersifat reversibel sehingga telah ditemukan adanya hubungan antara konsentrasi plasma obat dengan efek kardiovaskularnya (Bertera
et al., 2007; Sweetman, 2009). Hal tersebut menandakan bahwa konsentrasi plasma diltiazem hidroklorida akan berpengaruh terhadap efektifitas terapi.
formulasi dari jenis obat yang sama menunjukkan perbedaan karakteristik absorpsi dan aktivitas terapeutik. Studi perbandingan terhadap formulasi sediaan lepas lambat tramadol yang tersedia di pasaran menunjukkan bahwa obat tersebut tidak memiliki kesetaraan dalam profil farmakokinetika. Perbedaan farmakokinetika di antara formulasi tersebut dapat menyebabkan variasi respon klinis pada pasien. Untuk itu pemilihan formulasi yang sesuai oleh tenaga kesehatan harus dilakukan berdasarkan kondisi penyakit, dan kebutuhan pasien (Kizilbash dan Cuong 2014; Leeson dan carstensen, 1974 dalam Timko dan Nicholas, 1977; Martin, 2008).
Profil pelepasan merupakan salah satu bagian penting untuk menilai keberhasilan suatu formulasi sediaan, terutama untuk formulasi sediaan lepas lambat, dimana pengontrolan laju pelepasan obat merupakan fokus utamanya. Profil pelepasan juga dapat menjadi gambaran awal dalam memprediksi profil farmakokinetika obat serta berapa lama waktu yang dibutuhkan oleh suatu obat lepas dari sediaannya. Informasi mengenai profil pelepasan dari suatu formulasi dapat menjadi pertimbangan khusus bagi tenaga kesehatan dalam menentukan formulasi yang sesuai dengan kebutuhan dan kondisi pasien. Namun, informasi profil pelepasan ini sangat jarang sekali ditemukan pada lembar informasi obat contohnya pada buku annual prescribing MIMS Indonesia. Pada buku tersebut
tidak terdapat profil pelepasan yang ditampilkan dalam lembar informasi obat. Uji disolusi merupakan uji in vitro yang dapat menggambarkan profil pelepasan obat serta dapat menggambarkan profil farmakokinetika obat di dalam tubuh. Dalam bidang farmasi, uji disolusi sangat penting dan bermanfaat untuk mengkarakterisasi kinerja produk obat, misalnya untuk mendeteksi adanya variasi dari batch ke batch di dalam formulasi suatu sediaan dan juga variasi antara sediaan dari pabrik yang satu dengan pabrik lainnya (Lachman, 1994 Lachman, 1994; Wolny et al., 2012; Alegantina et al, 2003).
yaitu obat CD dengan kandungan 180 mg diltiazem hidroklorida dan obat HB dengan kandungan 90 mg diltiazem hidroklorida untuk mengetahui apakah kedua produk tersebut memiliki profil disolusi yang sama dan memenuhi syarat pelepasan sediaan lepas lambat diltiazem hidroklorida menurut United State Pharmacopeia XXX (USP XXX). Evaluasi profil disolusi dilakukan dengan menggunakan metode uji disolusi tes satu untuk sediaan lepas lambat diltiazem hidroklorida yang tertera pada United State Pharmacopeia XXX (USP XXX) tahun 2007.
1.2. Rumusan Masalah
1. Bagaimanakah profil disolusi dan kinetika pelepasan sediaan lepas lambat diltiazem hidroklorida yang beredar di pasaran ?
2. Apakah terdapat perbedaan profil disolusi dan kinetika pelepasan pada sediaan lepas lambat diltiazem hidroklorida yang beredar di pasaran?
1.3. Tujuan Penelitian
1. Mengetahui profil disolusi dan kinetika pelepasan sediaan lepas lambat diltiazem hidroklorida yang beredar di masyarakat yang diuji
menggunakan metode uji satu untuk sediaan lepas lambat diltiazem hidroklorida yang ditetapkan United State Pharmacopeia edisi XXX (USP XXX)
2. Membandingkan profil disolusi dan kinetika pelepasan sediaan lepas lambat diltiazem hidroklorida yang beredar di pasaran.
1.4. Manfaat Penelitian
1. Memberikan informasi kepada instansi terkait dan masyarakat mengenai profil disolusi produk lepas lambat diltiazem hidroklorida apakah sesuai dengan syarat yang ditentukan sehingga dapat menjamin mutu dan keamanannya.
TINJAUAN PUSTAKA 2.1. Disolusi
Disolusi mengacu pada proses ketika fase padat (misalnya, tablet atau serbuk) masuk dalam fase larutan, seperti air. Ketika obat melarut, partikel-partikel padat memisah dan molekul demi molekul bercampur dengan cairan menjadi bagian dari cairan tersebut. Oleh sebab itu, disolusi obat adalah proses ketika molekul obat dibebaskan dari fase padat dan masuk ke dalam fase larutan. Umumnya, hanya obat dalam bentuk larutan yang dapat diabsorpsi, disistribusi, dimetabolisme dan dieksresi atau bahkan memberikan kerja farmakologis. Untuk itu, disolusi merupakan proses penting dalam ilmu kefarmasian (Sinko, 2006).
Kecepatan suatu padatan melarut dalam suatu pelarut dinyatakan secara kuantitatif oleh Noyes dan Whitney pada tahun 1897, persamaan tersebut ialah :
....(2.1)
Atau
...(2.2)
M adalah massa zat terlarut yang terlarut selama waktu t; dM/dt adalah kecepatan disolusi massa (massa/waktu); D adalah koefisien difusi zat terlarut dalam larutan; S adalah luas permukaan padatan yang terpajan; h adalah tebal lapisan difusi; Cs adalah kelarutan padatan (yakni, konsentrasi senyawa dalam larutan jenuh pada permukaan padatan dan pada temperatur percobaan); C adalah konsentrasi zat terlarut dalam larutan bulk pada waktu t. Kuantitas dC/dt adalah kecepatan disolusi dan V adalah volume larutan (Sinko, 2006).
Dalam teori transfer massa atau disolusi, diasumsikan bahwa lapisan difusi berair atau selaput cair stagnan setebal h terbentuk pada permukaan suatu padatan yang mengalami disolusi, seperti yang digambarkan pada persamaan 2.1. Ketebalan, h, menggambarkan lapisan stasioner yang mengandung molekul zat
lebih dari h), pencampuran terjadi dalam larutan, dan obat tampak dalam konsentrasi yang seragam, C, di seluruh fase bulk (Sinko, 2006).
Pada antarmuka lapisan difusi-permukaan padat, x=0, obat dalam padatan berada dalam kesetimbangan dengan obat dalam lapisan difusi. Gradien (atau perubahan konsentrasi berdasarkan jarak di sepanjang lapisan difusi) bernilai konstan, seperti yang dapat dilihat dari garis lurus miring ke bawah. Ini adalah gradien yang ditunjukkan pada persamaan 2.1 dan 2.2 oleh suku (Cs-C)/h. Kemiripan antara persamaan Noyes-Whitney dan hukum Fick pertama merupakan bukti persamaan 2.1 (Sinko, 2006).
Oleh sebab itu, jika C jauh lebih kecil dari kelarutan obat, Cs, sistem dinyatakan sebagai kondisi sink, dan konsentrasi C dapat dihilangkan dari persamaan 2.1 dan 2.2. Dengan demikian, persamaan 2.1 menjadi :
...(2.3)
Pada penurunan persamaan 2.1 dan 2.2, diasumsikan bahwa h dan S
bernilai konstan, namun di sini tidak demikian. Ketebalan lapisan difusi statis diubah oleh gaya pengadukan pada permukaan tablet yang melarut Luas permukaan, S, jelas tidak konstan seiring melarutnya serbuk, granul, atau tablet. Selain itu, nilai S yang akurat sulit diperoleh ketika proses berlanjut. Dalam penelitian eksperimental mengenai disolusi, permukaan dapat dikendalikan dengan menempatkan pelet kempa dalam suatu penahan yang memajan permukaan dengan luas yang konstan (Sinko, 2006).
2.2. Uji Disolusi
pengembangan produk dan uji stabilitas sebagai bagian dari spesifikasi pengembangan untuk produk. Khususnya, dalam perspesktif R&D (research and development), adalah potensial untuk mengkorelasi data disolusi in vitro dengan bioavaiabilitas in vivo (Swarbrick, 2007).
2.2.1. Kondisi Uji Disolusi
Ukuran dan bentuk wadah dapat mempengaruhi laju dan tingkat disolusi. Sebagai contoh, wadah dapat mempunyai rentang ukuran dari beberapa mililiter sampai beberapa liter. Bentuk wadah dapat mempunyai alas bulat atau datar; sehingga dalam percobaan yang berbeda, tablet dapat berada dalam posisi yang berbeda. Volume media yang lazim yaitu 500-1000 mL. Obat-obat dengan kelarutan dalam air yang kecil memerlukan penggunaan kapasitas wadah yang sangat besar (sampai 2000 mL) untuk mengamati pelarutan yang bermakna (Shargel, Susanna & Andrew, 2004).
Pemilihan medium disolusi tergantung dari beberapa parameter sebagai berikut (Karuppiah, 2012) :
1. Tipe formulasi : Pelepasan segera (immediate release) atau pelepasan termodifikasi (modified release).
2. Kelarutan zat aktif.
[image:24.595.111.513.222.542.2]3. Jenis rancangan formulasi (contohnya, kapsu gel lunak, kapsul gel keras, tablet, suspensi berminyak dsb).
Sistem Klasifikasi Biofarmasetika (SKB) mengklasifikasikan kelarutan obat kedalam empat kategori, yaitu : (i) kelarutan tinggi dan permeabilitas tinggi;
(ii) kelarutan rendah dan permeabilitas tinggi; (iii) kelarutan tinggi dan permeabilitas rendah; (iv) kelarutan rendah dan permeabilitas rendah (Karuppiah,
2012).
lepas lambat) dapat digunakan buffer pH 6,8 sebagai medium disolusi. Buffer pH 4,5 dapat digunakan sebagai intermediat media untuk profil disolusi pada formulasi pelepasan segera ataupun pelepasan termodifikasi (Karuppiah, 2012). Untuk formulasi yang memiliki zat aktif dengan klasifikasi SKB kelas ii dan kelas iv, dikarenakan kelarutan yang rendah maka diperlukan surfaktan (contohnya natrium lauril sulfat) untuk meningkatkan kelarutan obat di dalam medium disolusi. Konsentrasi surfaktan yang digunakan mulai dari 0,5 sampai 2%. Konsentrasi yang lebih tinggi juga dapat digunakan (Karuppiah, 2012).
Jumlah pengadukan dan sifat pengaduk mempengaruhi hidrodinamika sistem, sehingga mempengaruhi laju disolusi. Kecepatan pengadukan harus dikendalikan, dan spesifikasi berbeda antar produk obat. Laju pengadukan rendah (50-75 rpm) lebih membedakan fakor formulasi yang mempengaruhi disolusi dibanding laju pengadukan yang lebih tinggi. Akan tetapi, laju pengadukan yang lebih tinggi diperlukan untuk beberapa formulasi khusus untuk memperoleh laju disolusi yang reprodusibel. Suspensi yang mengandung bahan kental atau pengental dapat mengendap dalam suatu daerah difusi terkendali di dalam labu bila pengadukan terlalu lambat (Shargel, Susanna & Andrew, 2004).
Suhu media disolusi harus dikendalikan, dan perbedaan suhu harus dihindarkan. Sebagian besar uji disolusi dilakukan pada 370C. Sifat media disolusi juga akan mempengaruhi uji disolusi. Disolusi maupun jumlah obat dalam sediaan harus dipertimbangkan. Media disolusi hendaknya tidak jenuh dengan obat (yakni kondisi “sink” dipertahankan). Dalam uji seperti itu biasanya digunakan suatu
volume media yang lebih besar daripada jumlah pelarut yang diperlukan untuk melarutkan obat secara sempurna (Shargel, Susanna & Andrew, 2004).
Rancangan alat disolusi, bersama faktor-faktor yang digambarkan sebelumnya mempunyai pengaruh pada hasil uji disolusi. Tidak satupun alat atau uji yang dapat digunakan untuk seluruh produk obat. Tiap produk obat harus diuji secara individual dengan uji disolusi yang memberikan korelasi yang paling baik dengan bioavailabilitas in vivo (Shargel, Susanna & Andrew, 2004).
Deteksi yang umum digunakan untuk senyawa yang memiliki gugus kromofor yaitu menggunakan UV/Vis. Teknik deteksi dengan selektifitas dan sensitifitas yang tinggi seperti elektrokimia, fluorosens dan spektrometri massa perlu dipertimbangkan ketika deteksi UV dianggap tidak sesuai. Dalam beberapa hal, modifikasi kimia atau derivatisasi dapat digunakan untuk analisis senyawa obat yang tidak memiliki gugus kromofor (Wang et al ., 2006).
2.2.2. Metode Uji Disolusi
USP/NF memberi beberapa metode resmi untuk melaksanakan uji disolusi tablet, kapsul dan produk khusus lain seperti sediaan transdermal. Tablet dikelompokkan ke dalam tablet tidak bersalut, salut sederhana, dan salut enterik. Pemilihan suatu metode tertentu untuk suatu obat biasanya dinyatakan dalam monografi produk obat tertentu. Terdapat beberapa alat atau metode uji disolusi yang tertera dalam USP yaitu metode keranjang, dayung, reciprocating cyllinder,
flow-trough cell, paddle-over disk, silinder, dan reciprocating disk (Shargel, Susanna & Andrew, 2004).
2.2.2.1. Metode Keranjang/ Alat 1
2.2.2.2. Metode Dayung/ Alat 2
Alat paddle terdiri atas suatu dayung yang dilapisi khusus, yang berfungsi memperkecil turbulensi yang disebabkan oleh pengadukan. Dayung diikat secara vertikal ke suatu motor yang berputar dengan suatu kecepatan terkendali. Tablet atau kapsul diletakkan dalam labu disolusi yang beralas bulat yang juga memperkecil turbulensi dari media disolusi. Alat ditempatkan dalam suatu bak air yang bersuhu konstan, seperti pada metode rotating basket
dipertahankan pada 370C. Posisi dan kesejajaran dayung ditetapkan dalam USP. Metode paddle sangat peka terhadap kemiringan dayung. Pada beberapa produk obat, kesejajaran dayung yang tidak tepat secara drastis dapat mempengaruhi hasil disolusi. Standar kalibrasi disolusi yang sama digunakan untuk memeriksa peralatan sebelum uji dilaksanakan. Kecepatan operasi yang paling lazim untuk alat 2 adalah 50 rpm untuk bentuk sediaan oral padat dan 25 rpm untuk suspensi (Shargel, Susanna & Andrew, 2004).
[image:27.595.123.499.270.617.2].
2.2.3. Intrepretasi Hasil Uji Disolusi Sediaan Lepas Lambat Diltiazem Hidroklorida
Berikut adalah intrepetasi hasil uji disolusi sediaan lepas lambat diltiazem hidroklorida yang tertera pada United Stated Pharmakopea XXX tahun 2007 :
Tabel 2.1. Penerimaan hasil uji disolusi sediaan lepas lambat diltiazem HCl menurut USP XXX
Uji Jumlah
unit
kriteria
L1 6 Tidak ada satupun nilai yang berada di luar rentang yang ditentukan, dan
tidak ada satupun nilai yang kurang dari jumlah yang ditentukan pada akhir waktu pengujian.
L2 6 Rata-rata nilai dari 12 unit (L1 +L2) berada di dalam setiap rentang yang
ditentukan dan tidak boleh kurang dari jumlah yang ditentukan pada akhir waktu pengujian. Pada jam ke-3 tidak ada satupun unit di luar rentang 10-35% dari kandungan yang tertera pada label; pada jam ke-9 tidak ada satupun unit di luar rentang 45-95% dari kandungan yang tertera pada label; dan pada jam ke-12 tidak ada satupun unit kurang dari 65% dari kandungan yang tertera pada label pada akhir waktu pengujian.
L3 12 Rata-rata nilai dari 24 unit (L1+L2+L3) berada di dalam setiap rentang yang
ditentukan dan tidak boleh kurang dari jumlah yang ditentukan pada akhir waktu pengujian. Pada jam ke-3 tidak lebih dari 2 dari 24 unit di luar rentang 10-35% dari kandungan yang tertera pada label, dan 2 unit ini harus berada di rentang 5-45% dari kandungan yang tertera pada label; pada jam ke-9 tidak lebih dari 2 dari 24 unit di luar rentang 45-95% dari kandungan yang tertera pada label, dan 2 unit ini harus berada di dalam rentang 35-100% dari kandungan yang tertera pada label; pada jam ke-12 tidak lebih dari 2 dari 24 unit kurang dari 65% dari kandungan yang tertera pada label pada akhir waktu pengujian, dan 2 unit tidak dapat kurang dari 60% dari kandungan yang tertera pada label pada akhir waktu pengujian.
2.2.4. Uji Disolusi Sediaan Lepas Lambat Diltiazem Hidroklorida
[image:28.595.110.515.153.606.2]langsung ke metoda uji disolusi yang dilabelkan untuk sediaan lepas lambat yang akan diuji. Untuk peralatan, kondisi dan penerimaan uji disolusi sediaan lepas lambat diltiazem hidroklorida lebih rinci dijelaskan pada tabel 2.2 dan 2.3.
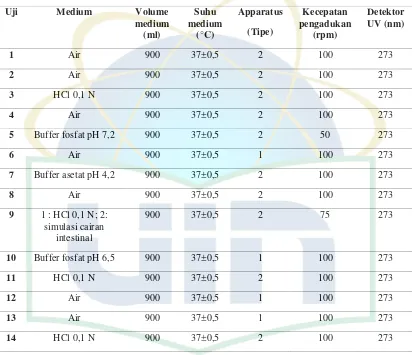
Tabel 2.2. Peralatan dan kondisi uji disolusi sediaan lepas lambat diltiazem HCl menurut USP XXVII
Uji Medium Volume
medium (ml)
Suhu medium
(°C)
Apparatus
(Tipe)
Kecepatan pengadukan
(rpm)
Detektor UV (nm)
1 Air 900 37±0,5 2 100 273
2 Air 900 37±0,5 2 100 273
3 HCl 0,1 N 900 37±0,5 2 100 273
4 Air 900 37±0,5 2 100 273
5 Buffer fosfat pH 7,2 900 37±0,5 2 50 273
6 Air 900 37±0,5 1 100 273
7 Buffer asetat pH 4,2 900 37±0,5 2 100 273
8 Air 900 37±0,5 2 100 273
9 1 : HCl 0,1 N; 2:
simulasi cairan intestinal
900 37±0,5 2 75 273
10 Buffer fosfat pH 6,5 900 37±0,5 1 100 273
11 HCl 0,1 N 900 37±0,5 2 100 273
12 Air 900 37±0,5 1 100 273
13 Air 900 37±0,5 1 100 273
Tabel 2.3. Rentang penerimaan kadar hasil uji disolusi sediaan lepas lambat diltiazem HCl menurut USP XXX
Waktu (Jam)
Uji
1 2 3 4 5 6 7 8 9 10 11 12 13 14
1
5-20
15 10
5-20
10 10
2 25
0-5/20-45
20 20
3
10-25
45-70
4
30-50 10-25 25-50 15-35 30-50
6
20-45 10-30 30-40 20-45
8
35-60
80
60-85
30-55
30-55
9
45-85
34-60
10
70-90
65-85
60-90
12 70
25-50
55-70
70 35-55
36-58
25-50
14 65
60-80
15 80 80 80
16 80
18
35-70
60 85
35-70
24 80 80 80 80 80 70
30 80
Keterangan : Penerimaan kadar dalam satuan persen (%)
2.3. Sediaan Lepas Lambat
[image:30.595.109.513.113.588.2]memelihara tingkat pengruhnya selama periode waktu yang diperpanjang, biasanya 8 sampai 12 jam (Ansel et al., 1989).
Bentuk sediaan lepas lambat yang ideal hendaknya akan melepaskan suatu dosis terapeutik awal (dosis awal) yang diikuti oleh suatu pelepasan obat yang lambat dan konstan (dosis penjagaan). Dosis muatan diberikan untuk mendapatkan kadar aman maksimal sehingga memberikan efek terapi yang cepat dan kemudian diikuti dengan pelepasan obat secara konstan sampai akhirnya obat tersebut dieksresikan. Dengan produk lepas lambat, konsentrasi obat dalam plasma yang konstan dapat dipertahankan dengan fluktuasi yang minimal (Shargel, Susanna & Andrew, 2004).
[image:31.595.109.512.137.510.2]Profil kadar obat dalam darah terhadap waktu pada sediaan konvensional dan pada sediaan lepas lambat dapat digambarkan sebagai berikut :
Gambar 2.2. Profil kadar obat dalam darah terhadap waktu dari bentuk sediaan lepas lambat yang ideal
Sumber : Lachman et al., 1986
2.3.1. Keuntungan dan Kerugian Sediaan Lepas Lambat
Banyak keuntungan yang bisa diperoleh dari sediaan lepas lambat. Bentuk sediaan lepas lambat memungkinkan untuk :
1. Mempertahankan kadar obat terapeutik dalam darah yang akan memberikan respon klinik yang diperpanjang dan konsisten pada penderita (Shargel, Susanna & Andrew, 2004).
2. Jika masukan obat konstan maka kadar dalam darah tidak mengalami
terapeutik yang tepat jika kadar obat dalam darah terlalu rendah (Shargel, Susanna & Andrew, 2004).
3. Dapat mengurangi frekuensi pemberian obat karena bentuk sediaan ini dapat mempertahankan kadar terapeutik dalam darah dalam jangka waktu yang lama. Hal ini akan dapat meningkatkan kepatuhan penderita serta memudahkan pemberian obat, misalnya pada pasien yang harus banyak istirahat (Lachman et al., 1986; Gennaro, 1995).
4. Pada penggunaan suatu produk obat pelepasan terkendali, penderita juga mendapatkan keuntungan ekonomik. Suatu dosis tunggal dari produk lepas lambat dapat menguragi biaya dari suatu dosis obat yang sama yang diberikan beberapa kali sehari dalam tablet konvensional (Shargel, Susanna & Andrew, 2004).
Selain keuntungan-keuntungan tersebut diatas, sediaan lepas lambat juga mempunyai kerugian, antara lain :
1. Pemberiaan obat dimana terjadi efek yang merugikan atau toksik, maka pemberiaan obat tidak dapat segera dihentikan.
2. Kesulitan dalam pengaturan dosis, bentuk sediaan lepas lambat dirancang untuk populasi normal, yaitu berdasarkan waktu paruh biologis rata-rata,
sehingga tidak sesuai pada keadaan penyakit tertentu serta variasi pasien. 3. Proses pembuatan dan peralatan untuk membuat sediaan lepas lambat lebih
mahal daripada sediaan konvensional pada umumnya.
4. Tidak semua obat sesuai untuk dibuat sediaan leps lambat (Lachman et al.,
1986).
2.3.2. Teknologi Tablet Lepas Lambat
2.3.2.1. Tablet Lepas Lambat yang Menggunakan Matriks
Terdapat tiga tipe tablet matriks, yaitu matriks hidrofilik, matriks malam-lemak, dan matriks plastik yang dibedakan berdasarkan bahan yang membentuk matriks (Lieberman.,et al, 1990 dalam Siregar, 2008).
1. Tablet Matriks Hidrofilik
karboksipolimetilen, asam alginat, gelatin, dan gom alam dapat digunakan sebagai bahan matriks (Lieberman et al., 1990 dalam Siregar, 2008).
Matriks hidrofilik memerlukan air untuk mengaktifkan mekanisme pelepasan. Matriks ini memiliki berbagai keuntungan, antara lain tablet matriks mudah dibuat dan memiliki keseragaman yang sangat baik. Apabila dicelupkan dalam air, matriks hidrofilik segera membentuk lapisan gel disekeliling tablet. Pelepasan zat aktif dikendalikan oleh difusi melalui sawar gel yang terbentuk atau oleh erosi tablet (Lieberman et al., 1990 dalam Siregar, 2008).
2. Tablet Matriks Malam-Lemak
Konstituen utama matriks malam-lemak umumnya adalah asam lemak dan/atau ester lemak. Erosi permukaan matriks malam-lemak bergantung pada sifat dan persentase matriks serta pada pengembang dalam matriks. Faktor lain seperti ukuran partikel dan konsentrasi zat aktif mempengaruhi pelepasan zat aktif dari sistem matriks. Penambahan surfaktan pada formulasi juga dapat mempengaruhi kecepatan pelepasan zat aktif dan perbandingan zat aktif total yang dapat dimasukkan ke dalam matriks (Lieberman et al., 1990 dalam Siregar, 2008).
3. Tablet Matriks Plastik
Bahan matriks yang digunakan biasanya adalah polivinil klorida, polietilen vinil asetat/kopolimer vinil klorida, viniliden klorida/kopolimer akrilonitril, akrilat/kopolimer metil matakrilat, etilselulosa, selulosa asetat, dan polistiren. Dalam tablet matriks plastik, zat aktif ditanamkan dalam struktur tablet yang berkerangka koheren (kohesif) dan berpori. (Lieberman et al., 1990 dalam Siregar, 2008).
2.3.2.2. Tablet Lepas Lambat yang Menggunakan Penyalutan
difusi; dan tablet yang menggunakan sistem osmosis (Lieberman et al., 1990 dalam Siregar, 2008).
1. Tablet yang Menggunakan Sistem Disolusi
Metode disolusi dalam sediaan lepas lambat umumnya diperoleh dengan menyalut masing-masing partikel atau masing-masing granul zat aktif dengan bahan penyalut terentu dengan cara sedemikian rupa sehingga menghasilkan ketebalan yang beragam. Disolusi bahan penyalut tersebut akan menghasilkan pelepasan zat aktif yang terkandung dalam sediaan; proses ini terjadi disepanjang jangka waktu yang lama karena adanya perbedaan ketebalan salut. Partikel atau granul yang disalut kemudian dikempa langsung menjadi tablet atau ditempatkan dalam kapsul (Lieberman et al., 1990 dalam Siregar, 2008).
Selain itu, salut bagian luar tablet dapat mengandung konstituen yang mempunyai kelarutan berbeda; konstituen tersebut larut dan membentuk kulit luar guna mempertahankan panjang lorong difusi untuk zat aktif yang dikandung dalam kulit. Bentuk lepas lambat ini terutama berguna untuk zat aktif yang relatif tidak larut karena bentuk ini mempertahankan dosis disintegrasi dan menyebar keluar sepanjang saluran cerna. Dengan demikian, beberapa pengaturan media dan area disolusi dilakukan untuk mengendalikan proses ini sehingga dapat mempertahankan keadaan lepas lambat zat aktif (Lieberman et al., 1990 dalam
Siregar, 2008).
2. Tablet Dosis Berirama Teratur atau Dosis Berdenyut
3. Tablet Dosis Kontinu
Tablet dosis kontinu memiliki faktor pengendali utama pelepasan zat aktif yang mirip dengan tablet dosis berirama teratur. Namun, pada tipe ini ada beberapa aspek penting, yaitu zat aktif dibuat tersedia dengan modus kontinu dan bukan berdenyut. Pelepasan zat aktif secara kontinu diperoleh dari zat aktif yang dibacam (impregnated) dalam suatu salut tipis (film) yang larut lambat; zat aktif tersedia setelah terjadi disolusi. Tipe sistem salut ini sangat mirip dengan penanaman zat aktif dalam matriks yang tidak larut. Perbedaannya, produk ini diformulasi dengan sistem mikroenkapsulasi partikel atau granul zat aktif, sedangkan tablet matriks diformulasi dengan cara yang berbeda (Lieberman et al., 1990 dalam Siregar, 2008).
4. Tablet yang Menggunakan Sistem Difusi
Kebanyakan sediaan dalam kategori ini berupa salut tipis yang dikempa; inti zat aktif dimasukkan ke lubang cetak. Selanjutnya, bahan penyalut ditekan pada inti itu sehingga menghasilkan tablet salut tunggal. Cara lain, seluruh tablet atau partikel yang telah disalut diformulasi melalui teknik suspensi udara. Bahan penyalut yang digunakan adalah campuran etilselulosa dan metilselulosa. Dengan menggunakan bahan penyalut metilselulosa yang larut dan etilselulosa yang tidak
larut, kulit tersisa akan tertinggal, yang kiranya akan memberikan suatu sawar penahan yang menjaga panjang lorong difusi zat aktif selalu konstan. (Lieberman
et al., 1990 dalam Siregar, 2008).
5. Tablet yang Menggunakan Sistem Gabungan dan Difusi
Difusi zat aktif keluar inti merupakan mekanisme utama yang digunakan untuk memberikan zat aktif dalam bentuk lepas lambat. Dalam sediaan ini luas difusi relatif konstan (terutama jika terjadi disolusi inti) dan zat aktif berada dalam jumlah berlebihan. Dalam hal ini, faktor yang mengubah adalah hubungan panjang jalan difusi dalam hukum Fick pertama. Jika zat aktif telah banyak berdifusi keluar inti, cairan saluran cerna yang berpenetrasi harus melintasi jalan yang lebih panjang dan lebih berliku-liku untuk mencapai zat aktif yang masih ada. Zat aktif yang terlarut selanjutnya harus berdifusi keluar melalui jalan yang sama, tetapi telah mengalami perubahan tersebut. Jadi, faktor turuositas yang harus dicakup dalam persamaan menjelaskan pelepasan zat aktif (Lieberman et al., 1990 dalam Siregar, 2008).
6. Tablet yang Menggunakan Sistem Osmosis
Tablet yang menggunakan pendekatan osmotik lepas lambat melalui osmosis disebut tablet osmotik. Salut sediaan ini benar-benar hanya merupakan suatu membran semipermeabel yang dapat dipenetrasi oleh air untuk melarutkan kandungannya, tetapi tidak dapat dipenetrasi oleh zat aktif. Zat aktif dan bahan pengencer (diluent) yang larut menciptakan tekanan osmotik dan menekan larutan zat aktif sehingga terpompa keluar dari lubang kecil dalam salut tablet. Kecepatan
zat aktif terpompa kuluar dapat dikendalikan dengan mengatur komposisi inti bahan penyalut dan lubang penghantar (Lieberman et al., 1990 dalam Siregar, 2008).
2.3.3. Mekanisme Pelepasan Zat Aktif 2.3.3.1. Sistem Difusi
Sistem difusi dicirikan oleh kecepatan pelepasan zat aktif yang bergantung pada difusi melalui suatu sawar membran inert. Sawar biasanya berupa polimer yang tidak larut. Secara umum, ada dua tipe atau subgolongan sistem difusi yang dikenal, yaitu sistem reservoir dan sistem matriks (Lieberman
1. Sistem Reservoir
Sistem reservoir dicirikan oleh suatu inti zat aktif yang dikelilingi oleh suatu membran polimer. Sifat membran menentukan kecepatan pelepasan zat aktif dari sistem. Proses difusi umumnya dijelaskan oleh persamaan dalam hukum Fick. Hukum Fick menjelaskan bahwa jumlah zat aktif yang melintasi suatu satuan bidang berbanding lurus dengan perbedaan konsentrasi lintas-bidang tersebut (Gennaro, 2000 dalan Siregar, 2008). Dalam hukum ini dinyatakan bahwa zat aktif berdifusi melintasi suatu membran mengarah ke area yang memiliki konsentrasi lebih kecil dengan/ adalah perubahan zat aktif terus-meneruss, yang dinyatakan dalam jumlah/ waktu area (Lieberman et al., 1990 dalam Siregar, 2008).
2. Sistem Matriks
Sistem matriks terdiri atas zat aktif yang terdispersi homogen dalam keseluruhan matriks polimer. Dalam model ini, zat aktif yang ada dalam lapisan luar yang terpajan larutan tangas (bathing solution) mula-mula terlarut dan kemudian terdifusi (menyebar) keluar matriks. Selanjutnya, antarmuka larutan tangas dan zat aktif padat bergerak ke arah bagian dalam. Supaya sistem difusi terkendali, laju disolusi partikel-partikel zat aktif di dalam matriks harus jauh
lebih cepat daripada laju difusi zat aktif terlarut meninggalkan matriks (Gennaro, 2000 dalan Siregar, 2008).
Persamaan yang telah diuraikan oleh higuchi menjelaskan kecepatan pelepasan zat aktif yang terdispersi dalam suatu sistem matriks inert.
...(2.4)
dM = Perubahan jumlah zat aktif yang dilepaskan per satuan luas
Dh = Perubahan ketebalan daerah (zona) matriks yang tidak mengandung zat aktif lagi (telah dikosongkan)
Co = Jumlah total zat aktif di dalam satu satuan volume matriks
2.3.3.2. Sistem Disolusi Terkendali
Sistem disolusi terkendali dapat dibuat menjadi sistem lepas lambat dengan cara membentuk lapisan-lapisan zat aktif yang disalut dengan lapisan pengendali kecepatan, suatu pengantaran yang berirama teratur (berdenyut) dapat dicapai. Jika lapisan sebelah luar dengan cepat melepaskan dosis bolus zat aktif, konsentrasi awal zat aktif dalam tubuh dapat ditetapkan dengan cepat sebelum waktu denyut selanjutnya. Walaupun bukan merupakan sistem pelepasan terkendali yang sesungguhnya, sistem ini dapat menghasilkan efek biologis yang mirip. Metode pilihan yang dapat digunakan adalah dengan memberikan zat aktif sebagai sekelompok butiran obat yang mempunyai ketebalan salut yang berbeda-beda. Karena butiran obat mempunyai ketebalan salut yang berbeda, pelepsan zat aktif akan terjadi secara bertahap. Butiran obat yang memiliki ketebalan salut paling tipis akan menjadi dosis awal. Pemeliharaan konsentrasi zat aktif untuk waktu berikutnya dicapai melalui pelepasan zat aktif dari salut yang lebih tebal (Gennaro, 2000 dalam Siregar, 2008).
2.3.3.3. Bioerodibel dan Kombinasi Sistem Difusi dan Disolusi
Mekanisme pelepasan zat aktif dari silinder, sferik, dan lempeng erodibel yang sederhana telah diuraikan oleh Hopfenberg. Persamaan sederhana berikut
menjelaskan pelepsan zat aktif dari ketiga sistem erodibel (Gennaro, 2000 dalam Siregar, 2008).
...(2.5)
n = 3 untuk sferik, n = 2 untuk silinder, dan n = 1 untuk lempeng. Radius sferik atau silinder atau setengah dari tinggi lempeng dinyatakan oleh a. Mt adalah massa zat aktif yang dilepaskan pada waktu t; M adalah massa yang dilepaskan pada waktu tidak terbatas.
Tipe ketiga dari sistem ini adalah sistem yang menggunakan kombinasi difusi dan disolusi sebagai matriks menggelembung terkendali. Pada tipe ini, zat aktif terlarut dalam polimer dan terjadi penggelembungan polimer. Hal ini menyebabkan air dapat masuk dan zat aktif terdisolusi dan kemudian berdifusi
sistem ini sangat bergantung pada kecepatan penggelembungan polimer; dengan demikian, reformulasi pembawa umumnya tidak diperlukan untuk zat aktif yang berbeda. Sistem ini biasanya meminimalkan efek peningkatan konsentrasi tiba-tiba karena polimer harus menggelembung terlebih dahulu barulah pelepasan zat aktif dapat terjadi (Gennaro, 2000 dalan Siregar, 2008).
2.3.3.4. Sistem Osmotik Terkendali
Dalam sistem ini, tekanan osmotik memberikan gaya penggerak untuk menimbulkan pelepasan zat aktif yang terkendali. Apabila sistem ini terpajan pada air atau cairan tubuh tertentu, air akan mengalir ke dalam tablet karena adanya perbedaan tekanan osmotik. Kecepatan aliran air ke dalam sistem, dV/dt dapat ditunjukkan sebagai berikut (Gennaro, 2000 dalan Siregar, 2008) :
...(2.6)
k = Permeabilitas membran A = Luas permukaan
h = Ketebalan
∆π = Perbedaan tekanan osmotik ∆P = Perbedaan tekanan hidrostatik
2.3.3.5. Sistem Pertukaran Ion
Sistem pertukaran ion umumnya menggunakan resin yang terdiri atas polimer taut silang yang tidak larut dalam air. Polimer ini mengandung gugus fungsional pembentuk garam dalam posisi berulang pada rantai polimer. Zat aktif terikat pada resin dan dilepaskan melalui pertukaran dengan ion bermuatan yang sesuai dalam suatu kontak dengan kelompok penukar ion (Gennaro, 2000 dalan Siregar, 2008).
Resin+-zat aktif- + X- Resin+-X- + Zat aktif- Resin--zat aktif+ + Y+ Resin—Y+ + Zat aktif+
kolom kromatografi atau kontak diperlama dalam larutan (Gennaro, 2000 dalan Siregar, 2008).
Kecepatan zat aktif berdifusi keluar resin sangat dipengaruhi oleh area difusi, panjang lorong difusi, dan kekakuan resin, yang merupakan fungsi dari jumlah zat taut-silang yang digunakan untuk membuat resin (Gennaro, 2000 dalan Siregar, 2008).
2.4. Kinetika Pelepasan Obat
[image:40.595.121.506.171.541.2]Kinetika pelepasan zat aktif dari suatu sediaan yang pelepasannya dimodifikasi dapat diperoleh dengan menggunkan persamaan Higuchi, orde nol, orde satu, dan Korsmeyer-Peppas. Berikut rangkuman rumus keempat model matematika (Tabel 2.1) tersebut beserta penjelasannya, yaitu :
Tabel 2.4. Rumus perhitungan kinetika pelepasan obat
Persamaan y= a + bx
Orde nol Qt/Qo=k0.t
Orde satu Ln Qt/Qo=k1.t
Higuchi Qt/Qo=kH.t1/2
Korsmeyer-Peppas Ln Qt/Qo=n ln t + ln k
[Sumber : Koester, Ortega, Mayotga, dan Bassani, 2004 dalam Mariyam, 2011
Keterangan : Qt/Qo = Fraksi obat yang dilepaskan pada waktu t
Ko, k1, kH, k = Konstanta pelepasan obat
n = Eksponen difusi obat
2.4.1.1. Kinetika Pelepasan Orde Nol
2.4.1.2. Kinetika Pelepasan Orde Satu
Kinetika ini menggambarkan sistem dimana pelepasan zat aktif bergantung pada konsentrasi zat aktif di dalamnya.
2.4.1.3. Kinetika Pelepasan Model Higuchi
Menurut model ini, pelepasan obat dari suatu matriks yang tidak larut berbanding langsung dengan akar waktu dan berdasarkan difusi fickian, diartikan bahwa pelepasan zat aktif dipengaruhi oleh waktu. Semakin lama, zat aktif akan dilepaskan dengan kecepatan yang rendah. Hal tersebut disebabkan jarak difusi zat aktif semakin panjang (Banakar, 1992 dalam Mariyam, 2011).
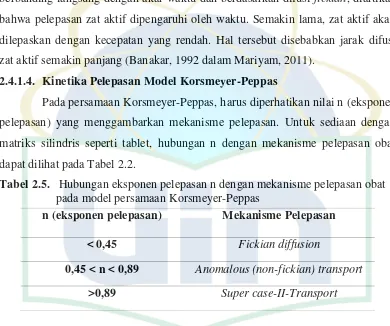
2.4.1.4. Kinetika Pelepasan Model Korsmeyer-Peppas
[image:41.595.114.504.218.544.2]Pada persamaan Korsmeyer-Peppas, harus diperhatikan nilai n (eksponen pelepasan) yang menggambarkan mekanisme pelepasan. Untuk sediaan dengan matriks silindris seperti tablet, hubungan n dengan mekanisme pelepasan obat dapat dilihat pada Tabel 2.2.
Tabel 2.5. Hubungan eksponen pelepasan n dengan mekanisme pelepasan obat pada model persamaan Korsmeyer-Peppas
[Sumber : Shoaib, Merchany, Tazeen, dan Yousuf, 2006 dalam Mariyam, 2011]
Kinetika Korsmeyer-Peppas bergantung nilai n. Untuk tablet dengan matriks silindris, jika nilai n<0,45 maka pelepasan obat terjadi berdasarkan mekanisme difusi Fickian. Akan tetapi jika 0,45<n<0,89 maka pelepasan obat berdasarkan difusi non-Fickian atau anomali, yang menggambarkan pelepasan obat dikendalikan oleh gabungan mekanisme difusi dan erosi. Jika n= 0,89 maka mekanisme pelepasan obat mengikuti orde nol atau disebut juga mekanisme case II transport, yang menggambarkan pelepasan obat terjadi akibat erosi polimer matriks. Jika n>0,89 maka mekanisme pelepasan obat disebut dengan mekanisme
n (eksponen pelepasan) Mekanisme Pelepasan
< 0,45 Fickian diffusion
super case II transport (Shoaib, Merchant, Tazeen, dan Yousuf, 2006 dalam Mariyam, 2011).
2.5. Spektrofotometer UV-Vis
Spektrofotometer yang sesuai untuk pengukuran di daerah spektrum ultraviolet dan sinar tampak terdiri atas suatu sistem optik dengan kemampuan menghasilkan sinar monokromatis dalam jangkauan panjang gelombang 200-800 nm. Spektrofotometer terdiri atas kompenen yang meliputi sumber sinar, monokromator, dan sistem optik (Gandjar dan Abdul, 2007).
1. Sumber sinar : lampu dueterium digunakan untuk daerah UV pada panjang gelombang dari 190-350 nm, sementara lampu halogen kuarsa atau lampu tungsten digunakan untuk daerah visibel (pada panjang gelombang anatar 350-900 nm) (Gandjar dan Abdul, 2007).
2. Monokromator : digunakan untuk mendispersikan sinar ke dalam komponen-komponen panjang gelombangnya yang selanjutnya akan dipilih oleh celah. Monokromator berputar sedemikian rupa sehingga kisaran panjang gelobang dilewatkan pada sampel sebagai scan instrumen melewati spektrum (Gandjar dan Abdul, 2007).
3. Optik-optik : dapat didesain untuk memecah sumber sinar sehingga sumber sinar melewati dua kompartemen, dan sebagaimana dalam
spektrofotometer berkas ganda (double beam), suatu larutan blanko dapat digunakan dalam satu kompartemen untuk mengkoreksi pembacaan atau spektrum sampel. Blanko yang paling sering digunakan adalah pelarut yang digunakan untuk melarutkan sampel (Gandjar dan Abdul, 2007).
[image:42.595.223.420.627.708.2]2.6. Diltiazem Hidroklorida
Diltiazem merupakan golongan benzotiazepin penghambat kanal kalsium dan termasuk antiaritmia kelas IV. Diltiazem merupakan vasodilator koroner dan kapiler dengan aktivitas inotropik negatif yang terbatas. Diltiazem menghambat konduksi jantung, khususnya pada nosus sino-atrial dan atrioventrikular (Sweetman, 2009).
Diltiazem hidroklorida diberikan secara oral untuk terapi angina pektoris dan hipertensi dan tersedia dalam beberapa formulasi untuk dosis sekali, dua kali dan tiga kali sehari. Pada bebera negara tersedia dalam bentuk intravena yang digunakan untuk penanganan berbagai kondisi aritmia jantung (fibrilasi atrial atau takikardia supraventrikular proksimal). Dilatiazem hidroklorida juga digunakan secara topikal untuk penanganan anal fissure (Sweetman, 2009).
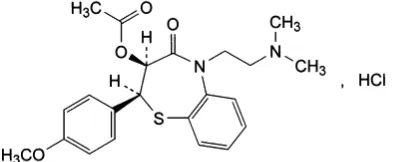
Diltiazem hidroklorida memiliki bobot molekul 450,98 dan rumus molekul C22H26N2O4S.HCl, serta memiliki nama kimia sebagai berikut : (+) -5 - [2-(Dimetilamino)etil]- cis-2, 3- dihidro-3- hidroksi- 2- (p-metoksifenil)- 1,5- benzo tiazepin- 4(5H)- on asetat (ester) monohidroklorida. Diltiazem HCl berupa serbuk hablur kecil putih, tidak berbau, melebur pada suhu 2100C disertai peruraian, mudah larut dalam kloroform, metanol, air dan asam; agak sukar larut dalam etanol mutlak dan tidak larut dalam eter (Departemen Kesehatan RI, 2014).
Diltiazem diabsorpi hampir sempurna di saluran gastrointestinal setelah
METODE PENELITIAN 3.1. Lokasi dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Formulasi Sediaan Padat dan Laboratorium Farmakologi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah, Jakarta. Penelitian dilaksanakan pada bulan Maret – Mei 2015.
3.2. Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini adalah dua nama dagang produk lepas lambat diltiazem hidroklorida yang diperoleh dari apotek dengan kode HB dan CD, diltiazem hidroklorida standar yang diperoleh dari PT.Indofarma, dan aquadestilata.
3.3. Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah alat uji disolusi tipe dayung (Erweka, Jerman), timbangan analitik, syringe 5 dengan ukuran 5 ml yang dilengkapi selang, disposable membran filter dengan ukuran pori 0,45µm,
alat-alat gelas skala laboratorium, spektrofotometer UV-Vis (Hitachi U-2910, Jepang).
3.4. Prosedur Penelitian 3.4.1. Pemilihan Sampel
Dipilih dua nama dagang sediaan lepas lambat diltiazem hidroklorida yang beredar di pasaran yakni HB SR 90 dan CD SR 180. Sampel yang digunakan sebagai produk uji dipilih berdasarkan kriteria nomor batch dan tahun produksi yang sama untuk masing-masing nama dagang.
3.4.2. Penentuan Panjang Gelombang Maksimal
batas tanda (kadar 20 µg/mL) . Serapan dibaca pada panjang gelombang antara 200- 400 nm.
3.4.3. Pembuatan Kurva Baku
Diltiazem hidroklorida ditimbang seksama 50,0 mg, dimasukkan dalam labu takar 100 ml, kemudian ditambah aquadestilata sampai batas tanda (kadar 500 μg/mL sebagai larutan stok), diambil 4 mL larutan dengan mikropipet 1000 μL kemudian larutan dimasukkan ke dalam labu takar 100 mL kemudian ditambah aquadestilata sampai batas tanda (kadar 20 µg/mL). Dibuat seri konsentrasi 2, 4, 8, 12, 16, 20 ppm dengan cara diambil 1, 2, 4, 6, 8, 10 mL kemudian larutan dimasukkan ke dalam labu takar 10 mL. Setiap seri konsentrasi dibaca absorbansinya dengan spektrofotometri UV-Vis pada panjang gelombang maksimal kemudian dibuat kurva y = bx + a, dimana y sebagai nilai dari hasil absorbansi dan x adalah sebagai kadar terukur.
3.4.4. Penetapan Kadar
Dua puluh buah tablet atau kapsul lepas lambat diltiazem hidroklorida dipilih secara acak. Untuk sediaan berupa kapsul, cangkang dibuka dan granul dipisahkan. Masing-masing tablet dan granul kapsul yang telah dipisahkan digerus hingga didapatkan serbuk halus. Serbuk ditimbang setara dengan 100,0 mg
diltiazem hidroklorida kemudian dimasukkan ke labu takar 100 mL, ditambahkan aquadestilata hingga tanda batas dan dikocok hingga homogen. Larutan kemudian disaring. Diambil 0,5 mL dari larutan ini, kemudian dimasukkan ke dalam labu takar 50 ml dan ditambahkan aquadestilata sampai tanda batas, dikocok sampai homogen. Diamati serapannnya dengan spektrofotometer UV-Vis pada panjang gelombang maksimum diltiazem hidroklorida dalam aquadestilata. Penetapan kadar diltiazem hiroklorida dilakukan sebanyak tiga kali.
3.4.5. Keseragaman Sediaan 3.4.5.1. Keragaman Bobot
Dilakukan untuk sediaan yang mengandung zat aktif 50 mg atau lebih yang merupakan 50% atau lebih dari bobot satuan sediaan. Ditimbang seksama 10 tablet satu persatu, dan dihitung bobot rata-rata. Dari hasil penetapan kadar, yang diperoleh seperti yang tertera dalam masing-masing monografi, dihitung jumlah zat aktif masing-masing dari 10 tablet dengan anggapan zat aktif terdistribusi merata. Keragaman bobot terletak antara 90,0-110,0% dari yang tertera pada etiket dan simpangan baku relatif kurang dari atau sama dengan 6,0% (Departemen Kesehatan RI, 2014).
3.4.5.2. Keseragaman Kandungan
Dilakukan untuk sediaan yang tidak masuk untuk kriteria pengujian keragaman bobot. Ditetapkan kadar 10 satuan sediaan satu persatu dengan cara masing-masing tablet digerus hingga didapatkan serbuk halus. Serbuk kemudian dimasukkan ke labu takar 100 mL, ditambahkan aquadestilata hingga tanda batas dan dikocok hingga homogen. Larutan kemudian disaring. Diambil 0,5 mL dari larutan ini, kemudian dimasukkan ke dalam labu takar 50 mL dan ditambahkan aquadestilata sampai tanda batas, dikocok sampai homogen. Diamati serapannnya dengan spektrofotometer UV-Vis pada panjang gelombang maksimum diltiazem
hidroklorida dalam aquadestilata. Keseragaman kandungan terletak 90,0-110,0% dari yang tertera pada etiket dan simpangan baku relatif kurang dari atau sama dengan 6,0% (Departemen Kesehatan RI, 2014).
3.4.6. Uji Disolusi
Uji disolusi dilakukan dengan menggunakan metode uji tes satu untuk sediaan lepas lambat diltiazem hidroklorida yang tertera pada United Stated Pharmacopea XXX (USP XXX). Uji disolusi dilakukan dengan menggunakan alat uji disolusi tipe 2 (dayung), medium disolusi air sebanyak 900 mL, kecepatan pengadukan 100 rpm, dan pada suhu 370C ± 0,5.
sebesar 2,5 cm ± 0,2 dari dasar labu. Setelah suhu stabil, granul atau tablet dimasukkan, dan alat uji disolusi dijalankan. Pencuplikan dilakukan dengan pada menit ke 15, 30 45 dan pada jam ke- 2, 3, 4, 5, 6, 7, 8, 9, 10 dan 12 dengan mengambil 5 mL larutan media disolusi. Untuk setiap selesai pencuplikan dilakukan penambahan larutan media disolusi dengan volume yang sama dengan volume pencuplikan. Larutan sampel kemudian diencerkan dengan aqua destilata dan ditentukan serapannya dengan menggunakan spektrofotometer UV-Vis pada panjang gelombang maksimum. Dihitung kadar diltiazem yang terlepas pada tiap waktu dan dibuat kurva % pelepasan diltiazem hidroklorida dibanding waktu.
3.4.7. Analisis Kinetika dan Mekanisme pelepasan Obat
Kinetika dan mekanisme pelepasan obat dianalisis dengan menggunakan persamaan kinetika orde nol, persamaan kinetika orde satu, persamaan Higuchi, dan persamaan Kors-Meyer. Dibuat persamaan garis lurus untuk setiap model kinetika, dengan cara:
1. Kinetika orde nol
Persamaan garis lurus dapat dibentuk untuk pelepasan orde nol dengan cara memplotkan persentase jumlah obat yang dilepaskan sebagai fungsi waktu
2. Kinetika orde satu
Persamaan garis lurus dapat dibentuk untuk pelepasan orde satu dengan cara memplotkan ln persentase jumlah obat yang tersisa sebagai fungsi waktu. 3. Kinetika model Higuchi
Persamaan garis lurus dapat dibentuk untuk pelepasan model Higuchi dengan cara memplotkan persentase jumlah obat yang dilepas sebagai fungsi akar waktu.
4. Kinetika model Korsmeyer-Peppas
Persamaan garis lurus dapat dibentuk untuk pelepasan model Korsmeyer-Peppas dengan cara memplotkan ln persentase obat yang dilepas sebagai fungsi ln waktu.
3.4.8. Analisis Statistik
Pengolahan data dilakukan secara statistik dengan metode independent t test ( Uji t) dengan program SPSS 16. Analisis statistik dilakukan terhadap nilai k (konstanta pelepasan) diltiazem hidrokrorida dari kedua produk uji. Sebelum dilakukan analisis menggunakan uji t data konstanta laju pelepasan diuji distribusi menggunakan uji saphiro wilk dan uji homogenitas , data dikatakan terdistribusi normal dan homogen jika nilai sig <0,05. Uji t dilakukan pada derajat kepercayaan 0,95 (α = 0,05). Dalam hal rancangan ini dapat diuji antar konstanta laju pelepasan produk uji terdapat perbedaan bermakna. Hal ini dapat diketahui dengan melihat nilai taraf signifikansi (α) pada kolom sig.Tabel uji t. Bila nilai α
4.1. Pemilihan Sampel
Kriteria masing-masing produk uji yang dipilih adalah yang memiliki nomor
batch dan tahun produksi yang sama. Produk uji diperoleh dari apotek. Diperoleh produk CD dan HB dengan nomor batch dan tahun produksi berturut turut BN 4511348/2014 dan HA846/2014 yang digunakan sebagai produk uji. Produk uji CD adalah produk lepas lambat dengan bentuk sediaan tablet dengan kandungan zat aktif 180 mg tiap tabletnya. Produk uji HB adalah produk lepas lambat dengan bentuk sediaan kapsul yang mengandung granul dengan kandungan zat aktif 90 mg tiap tabletnya.
4.2. Penentuan Panjang Gelombang Maksimum
Penentuan panjang gelombang maksimum dilakukan dengan mengukur serapan larutan diltiazem hidroklorida dalam aquades dengan kadar 20 ppm menggunakan spektrofotometer UV pada panjang gelombang 200-400 nm. Panjang gelombang maksimum yang didapat adalah 236,0 nm. Panjang gelombang maksium yang didapat tidak jauh dari panjang gelombang maksimum yang tercantum pada Farmakope Edisi V yaitu sekitar 240 nm.
4.3. Pembuatan Kurva Baku
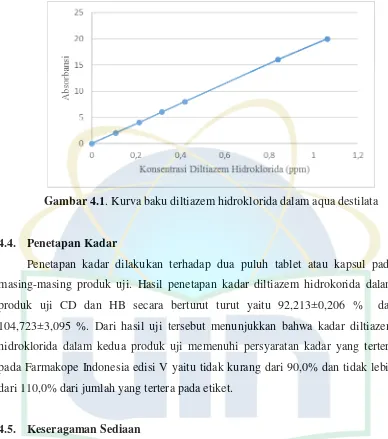
Gambar 4.1. Kurva baku diltiazem hidroklorida dalam aqua destilata
4.4. Penetapan Kadar
Penetapan kadar dilakukan terhadap dua puluh tablet atau kapsul pada masing-masing produk uji. Hasil penetapan kadar diltiazem hidrokorida dalam produk uji CD dan HB secara berturut turut yaitu 92,213±0,206 % dan 104,723±3,095 %. Dari hasil uji tersebut menunjukkan bahwa kadar diltiazem
hidroklorida dalam kedua produk uji memenuhi persyaratan kadar yang tertera pada Farmakope Indonesia edisi V yaitu tidak kurang dari 90,0% dan tidak lebih
dari 110,0% dari jumlah yang tertera pada etiket.
4.5. Keseragaman Sediaan
Keseragaman sediaan diuji dengan menggunakan prosedur yang telah ditetapkan oleh Farmakope Indonesia edisi V. Hal ini dimaksudkan untuk memastikan kandungan zat aktif pada produk uji seragam. Terdapat dua metode yang ditetapkan untuk menguji keseragaman sediaan yaitu keragaman bobot dan keseragaman kandungan. Uji keragaman bobot digunakan untuk sediaan yang mengandung zat aktif 50 mg atau lebih yang merupakan 50% atau lebih dari bobot satuan sediaan. Uji keseragaman kandungan digunakan untuk sediaan yang tidak masuk untuk kriteria pengujian keragaman bobot.
HB memiliki bobot rata-rata sediaan 172 mg dengan kandungan zat aktif 90 mg yang berarti bobot zat aktif lebih dari 50% dari bobot satuan sediaan sehingga digunakan uji keragaman bobot.
[image:51.595.134.494.185.732.2]Tabel 4.1. Hasil keseragaman kandungan produk uji CD
Tablet Kadar (mg) %Kadar
1 166,75 92,639
2 158,44 88,022
3 166,21 92,339
4 169,05 93,917
5 158,94 88,300
6 165,52 91,956
7 156,51 86,950
8 162,68 90,378
9 161,95 89,972
10 155,00 86,111
Rata-rata : 90,058
SD : 2,644
RSD : 2,936
Tabel 4.2. Hasil keragaman bobot produk uji HB
Kapsul Kadar (mg) % kadar
1 96,758 107,509
2 92,994 103,327
3 97,365 108,183
4 93,662 104,069
5 96,940 107,711
6 95,301 105,890
7 94,694 105,215
8 95,726 106,362
9 92,509 102,787
10 93,176 103,529
Rata-rata : 105,458
SD : 1,975
Hasil uji keseragaman kandungan produk uji CD dapat dilihat pada tabel 4.1 dengan hasil berkisar antara 86,111% hingga 93,917% dengan RSD 2,936%. Hasil keragaman bobot produk uji CD dapat dilihat pada tabel 4.2 dengan hasil berkisar antara 102,787%-108,183% dengan RSD 1,872%. Produk uji memenuhi keseragaman sediaan bila jumlah zat aktif dalam masing-masing sediaan terletak antara 90,0-110,0% dari yang tertera pada etiket, dan RSD tidak lebih dari 6% (Departemen Kesehatan RI, 2014). Dari hasil uji diatas dapat disimpulkan bahwa produk uji CD tidak memenuhi keseragaman sediaan karena terdapat lima tablet yang tidak memenuhi syarat dalam rentang penerimaan, sedangkan produk uji HB memenuhi persyaratan keseragaman sediaan karena keseluruhan kapsul yang diuji masuk dalam syarat rentang penerimaan keseragaman sediaan sesuai dengan yang ditetapkan oleh Farmakope Indonesia edisi V.
4.6. Uji Disolusi
Telah dilakukan evaluasi profil disolusi pada sediaan lepas lambat diltiazem hidroklorida yang beredar di pasaran. Penelitian ini bertujuan untuk melihat profil disolusi sediaan lepas lambat diltiazem hidroklorida yang beredar di pasaran sehingga dapat diketahui apakah profil disolusi sediaan tersebut telah sesuai dengan syarat yang ditentukan oleh USP XXX dan juga untuk mengetahui
kinetika pelepasannya.
Uji disolusi dilakukan dengan menggunakan metode uji disolusi tes satu untuk sediaan lepas lambat diltiazem hidroklorida yang tertera pada United Stated Pharmacopea XXX (USP XXX). Uji disolusi dilakukan dengan menggunakan alat uji disolusi tipe 2 (dayung), medium disolusi air sebanyak 900 ml, dan dengan kecepatan pengadukan 100 rpm. Uji dilakukan selama 12 jam dengan pencuplikan tiap 15 menit pada jam pertama, dan tiap 1 jam pada jam berikutnya. Pencuplikan dilakukan sebanyak 5 ml dan segera digantikan dengan medium disolusi baru sejumlah volume yang sama untuk mempertahankan sink condition. Uji dilakukan dengan 6 kali pengulangan pada setiap produk uji.
(FDA, 2000; Wu dan Benet, 2005 dalam Samaha, Shehayeb dan Kyriacos, 2009). Senyawa yang masuk ke dalam SKB kelas I merupakan senyawa yang memiliki permeabilitas yang baik serta memiliki kelarutan yang baik dalam media air pada rentang pH 1-8 (Rudman dan Willian, 1995 dalam Galia et al., 1998). Dalam pemilihian medium disolusi, yang terpenting adalah zat aktif harus larut dalam medium disolusi selama waktu pengujian (Qureshi, 2014). Untuk itu, pemakaian air sebagai medium disolusi dapat digunakan karena relevansinya terhadap sifat kelarutan zat aktif.
[image:53.595.125.496.222.591.2]
Gambar 4.2. Profil disolusi diltiazem hidroklorida pada produk uji CD dan HB Keterangan : a) Kurva akumulasi terdisolusi rata-rata (%) terhadap waktu (jam)
b) Kurva akumulasi terdisolusi rata-rata (mg) terhadap waktu (jam)
Hasil profil disolusi dari kedua produk uji dapat dilihat dalam Gambar 4.2. Dari gambar tersebut dapat dilihat bahwa terdapat kemiripan profil disolusi diantara kedua produk uji bila dilihat pada kurva akumulasi terdisolusi dalam
disebabkan oleh produk uji CD memiliki kandungan zat aktif dua kali lipat dari produk uji HB yaitu 180 mg.
Perbedaan kandungan zat aktif mempengaruhi dosis serta kemampuan dalam menurunkan tekanan darah diastolik. Diketahui bahwa sediaan dengan kandungan zat aktif 90 mg dapat menurunkan tekanan darah diastolik sebanyak 2,9 mmHg sedangkan sediaan dengan kandungan zat aktif 180 mg dapat menurunkan tekanan darah diastolik sebanyak 4,5 mmHg (Apotex, 2011) . Hal tersebut menandakan bahwa sediaan dengan kandungan zat aktif lebih besar memiliki kemampuan dalam menurunkan tekanan darah diastolik yang lebih besar.
[image:54.595.101.529.153.642.2]Hasil analisis kesesuaian pelepasan diltiazem hidroklorida dengan persyaratan sediaan lepas lambat diltiazem hidroklorida menurut USP XXX tertera pada tabel di bawah ini :
Tabel 4.3. Hasil analisis kesesuain pelepasan diltiazem hidroklorida dari tablet CD SR dengan persyaratan USP XXX
Waktu (Jam)
Rentang Penerimaan
% Terdisolusi
1 2 3 4 5 6 Rerata ±
SD%
3 10-25 % 33,360 32,767 31,628 32,638 33,760 31,364 32,588±0,938
9 45-85% 59,487 58,291 58,979 59,443 61,153 59,643 59,449±0,947
12 ≥70% 71,954 67,834 69,077 71,726 72,886 68,326 70,300±2,142
Tabel 4.4. Hasil analisi