VALIDASI METODE ANALISIS DAN PENENTUAN 3-MCPD
PADA KEMASAN KERTAS DUPLEKS SERTA MIGRASINYA
KE DALAM SIMULAN PANGAN
IRA DWI RACHMANI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Validasi Metode Analisis dan Penentuan 3-MCPD pada Kemasan Kertas Dupleks serta Migrasinya ke dalam Simulan Pangan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2015
Ira Dwi Rachmani
RINGKASAN
IRA DWI RACHMANI. Validasi Metode Analisis dan Penentuan 3-MCPD pada Kemasan Kertas Dupleks serta Migrasinya ke dalam Simulan Pangan. Dibimbing oleh FERI KUSNANADAR dan SLAMET BUDIJANTO.
Kertas dupleks banyak digunakan sebagai kemasan pangan baik sebagai kemasan sekunder, maupun kemasan primer yang bersinggungan langsung dengan bahan pangan. Penggunaan kertas dupleks dijumpai dalam bisnis katering, restoran, depot, dan warung makanan tertentu. Terkait dengan proses produksi kertas dan karton pada umumnya yang menggunakan aditif bahan kimia, kertas dupleks sangat mungkin mengandung residu senyawa kimia berbahaya yang apabila digunakan sebagai kemasan primer dapat bermigrasi ke dalam bahan pangan.
3-Monokloro-1,2-propandiol (3-MCPD) merupakan salah satu senyawa kontaminan pangan yang bersifat karsinogenik. 3-MCPD dapat ditemukan pada produk kecap, saus tiram, atau produk pangan lainnya yang mengandung protein nabati terhidrolisis asam (acid-HVP), serta pada produk olahan daging, keju, dan roti. 3-MCPD juga dapat ditemukan pada kertas kemasan termasuk kertas dupleks. Pembentukan 3-MCPD pada kemasan kertas dipicu oleh senyawa epiklorohidrin yang berperan sebagai wet-strength resin pada proses produksi kertas. Epiklorohidrin dikategorikan sebagai zat kontak pangan yang diizinkan digunakan sebagai bahan penolong dalam produksi kemasan pangan.
Penelitian ini bertujuan untuk: 1) memvalidasi metode analisis komponen 3-MCPD pada kemasan kertas; 2) menganalisis kandungan 3-MCPD kemasan kertas dupleks; dan 3) menganalisis migrasi 3-MCPD dari kemasan kertas ke dalam bahan pangan. Penelitian terbagi ke dalam tiga tahap. Tahap pertama yaitu pengembangan dan validasi metode analisis 3-MCPD dengan GC-MS. Tahap kedua adalah analisis kandungan 3-MCPD pada sampel kemasan kertas dupleks dari lima produsen kertas, dan tahap ketiga adalah penentuan persentase migrasi 3-MCPD dari kemasan kertas ke dalam bahan pangan.
Kadar 3-MCPD pada kemasan kertas dupleks dianalisa dengan metode GC-MS tervalidasi yang memiliki nilai linieritas (R2) 0.993, Limit Deteksi (LOD) dan Limit Kuantitasi (LOQ) berturut-turut sebesar 6.65 dan 22.15 ng/g, dan rentang akurasi antara 83.00 – 114.13%. Hasil analisis kadar 3-MCPD pada sampel kemasan kertas dupleks dari lima produsen kertas tidak berbeda nyata pada taraf uji 5% dengan kisaran 753.43 hingga 825.36 ppb. Kontak langsung antara simulan pangan dan kemasan kertas dupleks selama 24 jam pada suhu 40oC menyebabkan migrasi komponen 3-MCPD sebesar 40.55 hingga 57.61%.
SUMMARY
IRA DWI RACHMANI. Analytical Method Validation and Determination of 3-MCPD in Duplex Paper Packaging and Its Migration into Food Simulant. Supervised by FERI KUSNANDAR and SLAMET BUDIJANTO.
Duplex paper is widely used as a food packaging material as secondary packaging, and primary packaging that is directly in contact with foodstuffs. The use of duplex paper found in the catering business, restaurant, depots, and certain food stalls. Associated with the production of paper and cardboard in general, using chemical additives, duplex paper is likely to contain residues of hazardous chemical compounds when used as primary packaging which could migrate into food.
3-Monochloro-1,2-propanediol (3-MCPD) is considered as a food contaminant compound. 3-MCPD is possibly found in soy sauce, oyster sauce, or other food products that contain acid hydrolyzed vegetable protein (HVP-acid), as well as in processed meat products, cheese, and bread. 3-MCPD is also possibly present in paper packaging, including duplex paper. The formation of 3-MCPD in paper packaging is triggered by epichlorohydrin compounds that act as wet-strength resins in the paper production process. Epichlorohydrin is categorized as a food contact substance that is allowed to use as an adjuvant in the production of food packaging.
The objectives of this study were: 1) develop and validate the analytical method of 3-MCPD component in duplex paper packaging, 2) analyze the content of 3-MCPD on duplex paper, and 3) analyze the 3-MCPD migration from duplex paper packaging into food simulants. The study was divided into three stages, development and validation of methods of analysis of 3-MCPD with GC-MS, analysis of the content of 3-MCPD in the duplex paper packaging samples from five manufacturers of paper, and determination of the percentage of 3-MCPD migration from paper packaging into food.
3-MCPD content in duplex paper was analyzed by a validated GC-MS method which has linearity value (R2) 0.993, LOD and LOQ, respectively at 6.65 and 22.15 ng/g, and recovery range from 83.00 to 114.13%. 3-MCPD content analysis on five sample duplex paper from packaging paper manufacturer did not different significantly ranging from 753.43 to 825.36 ppb. Direct contact between food simulants and duplex paper for 24 hours at 40oC generated direct migration ranging from 40.55 to 57.61%.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Pangan
VALIDASI METODE ANALISIS DAN PENENTUAN 3-MCPD
PADA KEMASAN KERTAS DUPLEKS SERTA MIGRASINYA
KE DALAM SIMULAN PANGAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Validasi Metode Analisis dan Penentuan 3-MCPD pada Kemasan Kertas Dupleks serta Migrasinya ke dalam Simulan Pangan Nama : Ira Dwi Rachmani
NIM : F251110301
Disetujui oleh Komisi Pembimbing
Dr Ir Feri Kusnandar, MSc Ketua
Prof Dr Ir Slamet Budijanto, MAgr Anggota
Diketahui oleh
Ketua Program Studi Ilmu Pangan
Prof Dr Ir Ratih Dewanti-Hariyadi, MSc.
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Alhamdulillah, puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya tulis ini berhasil diselesaikan. Tema yang dipilih dalam penelitian ini adalah validasi metode analisis dan penentuan 3-MCPD pada kemasan kertas dupleks serta migrasinya ke dalam simulan pangan. Penghargaan dan terimakasih yang tulus penulis haturkan kepada:
1. Bapak Dr Ir Feri Kusnandar MSc dan Bapak Prof Dr Ir Slamet Budijanto, MAgr. selaku komisi pembimbing atas waktu, ilmu, kesabaran, nasehat, arahan dan bimbingan yang diberikan kepada penulis mulai dari tahap awal penelitian sampai akhir penyelesaian tesis ini.
2. Ibu Dr Nancy Dewi Yuliana, STP MSc yang telah banyak memberi bantuan, saran dan semangat kepada penulis.
3. Bapak Dr Nugraha Edhi Suyatma, STP DEA. selaku dosen penguji luar komisi dan Ibu Prof Dr Ratih Dewanti-Hariyadi, MSc selaku Ketua Program Studi Ilmu Pangan, atas saran dan masukannya dalam penyempurnaan tesis. 4. PT Indah Kiat Pulp melalui Prof Dr Slamet Budijanto, MAgr atas bantuan
dana penelitian.
5. Kementerian Pertanian, melalui Badan Penyuluhan dan Pengembangan SDM Pertanian atas bantuan beasiswa dalam Program Beasiswa Tugas Belajar Tahun 2011.
6. Para dosen dan staf lingkup Departemen Ilmu dan Teknologi Pangan dan Departemen Ilmu Pangan, IPB, atas ilmu yang penulis dapatkan selama ini. 7. Mbak Yane Regiana, STP,MSi, Pak Yahya dan Pak Zaenal atas bantuan yang
diberikan kepada penulis selama penelitian.
8. Kedua orangtua, Bapak Sugito dan Ibu Ani Sulastri, serta suami dan buah hati tercinta, Hari Priyanto dan Muhammad Anas Fathurrahman, atas ridho, doa, kasih sayang, dukungan moril dan materiil selama penulis menyelesaikan studi master ini.
9. Rekan-rekan mahasiswa Pascasarjana, khususnya Mayor Ilmu Pangan angkatan 2010, 2011 dan 2012 atas kebersamaan dan bantuannya selama perkuliahan hingga penyelesaian studi.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2015
DAFTAR ISI
DAFTAR TABEL xii
DAFTAR GAMBAR xii
DAFTAR LAMPIRAN xii
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
2 TINJAUAN PUSTAKA 3
Kemasan Kertas Dupleks 3
Bahan Kimia pada Pembuatan Kertas Dupleks 4
3-MCPD pada Produk Pangan dan Kertas Kemasan 5
Regulasi 3-MCPD 5
Metode Analisis Penentuan 3-MCPD 6
Penelitian 3-MCPD pada Kemasan Kertas 7
Validasi Metode Analisis 8
3 METODE 8
Waktu dan Tempat Penelitian 8
Bahan dan Alat 8
Tahapan Penelitian 9
4 HASIL DAN PEMBAHASAN 14
Pengembangan dan Validasi Metode Analisis 3-MCPD 14
Analisis 3-MCPD pada Sampel Kertas Dupleks 20
Persentase Migrasi 3-MCPD dari Kertas Dupleks ke Simulan Pangan 21
5 SIMPULAN DAN SARAN 23
Simpulan 23
Saran 24
DAFTAR PUSTAKA 24
LAMPIRAN 27
DAFTAR TABEL
1 Regulasi batas maksimum 3-MCPD di sejumlah negara 6
2 Kondisi analisis 3-MCPD dengan GC-MS 11
3 Simulan pangan dan kondisi pengujian migrasi 3-MCPD 13 4 Hasil uji kesesuaian sistem metode analisis 3-MCPD pada GC-MS 17 5 Hasil uji recovery 3-MCPD pada kertas kemasan menggunakan
GC-MS 19
6 Hasil penentuan LOD dan LOQ analisis 3-MCPD pada GC-MS 19 7 Hasil uji migrasi 3-MCPD dari kertas dupleks ke simulan pangan 22
DAFTAR GAMBAR
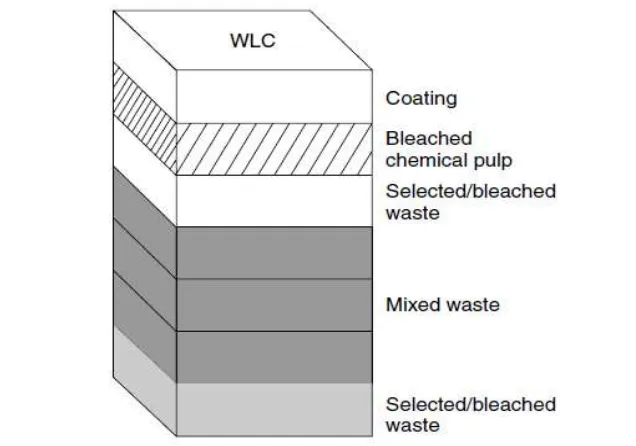
1 White lined chipboard (Coles et al. 2003) 3
2 Tampilan kertas dupleks di pasaran 4
3 Pembentukan kloropropanol dari epiklorohidrin (Hamlet 2002) 5 4 Pembentukan derivat heptafluorobutyrylate-3-MCPD volatil untuk
analisis GC-MS (Hamlet dan Sutton 1997) 7
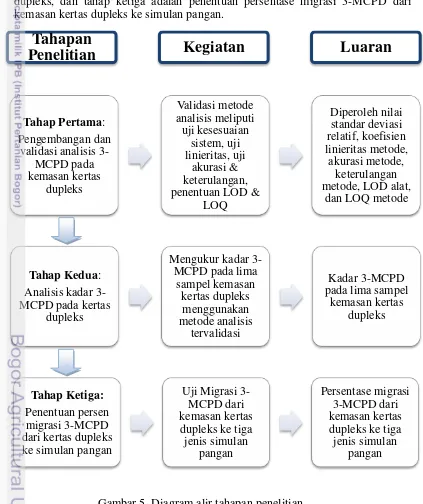
5 Diagram alir tahapan penelitian 9
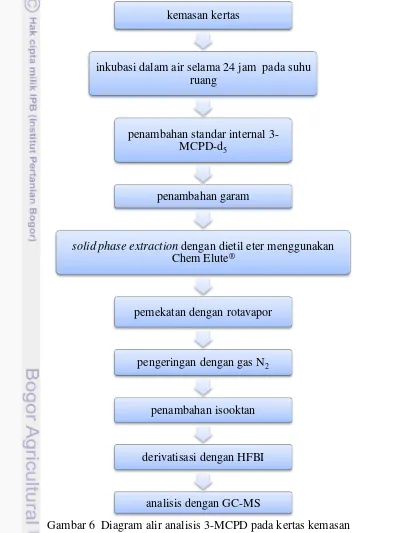
6 Diagram alir analisis 3-MCPD pada kertas kemasan (modifikasi Pace
dan Hartman 2010) 10
7 Alat uji migrasi 3-MCPD dari kemasan kertas ke bahan pangan (Pace
dan Hartman 2010) 14
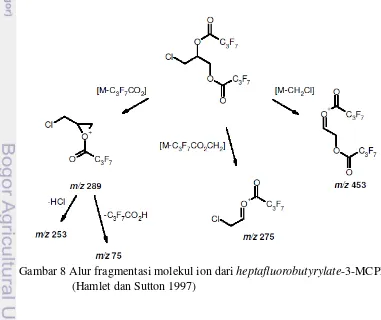
8 Alur fragmentasi molekul ion dari heptafluorobutyrylate-3-MCPD
(Hamlet dan Sutton 1997) 15
9 Spektrum massa 3-MCPD-d5 dan 3-MCPD 16
10 Kromatogram hasil analisis 3-MCPD 17
11 Kurva linieritas metode analisis 3-MCPD pada kertas kemasan
menggunakan GC-MS 18
12 Kandungan 3-MCPD sampel kertas dupleks 20
13 Mekanisme migrasi senyawa dari kemasan kertas ke bahan pangan
(Pocas et al. 2011) 21
DAFTAR LAMPIRAN
1 Hasil analisa statistik uji sidik ragam kadar 3-MCPD pada sampel
kertas dupleks menggunakan SPSS seri 17.0 27
2 Hasil analisa statistik uji sidik ragam kadar migrasi 3-MCPD dari sampel kertas dupleks E ke simulan pangan menggunakan SPSS seri
1
PENDAHULUAN
Latar Belakang
Pengemasan mempunyai peran penting dalam keseluruhan rantai pasok pangan. Fungsi kemasan pangan antara lain sebagai wadah yang mempermudah distribusi, melindungi dari kerusakan, mempertahankan mutu pangan, mem-berikan kenyamanan bagi konsumen dan sebagai alat untuk mengkomunikasikan produk pangan kepada konsumen. Dari berbagai variasi bahan baku kemasan, kemasan kertas merupakan salah satu pilihan yang banyak digunakan dan diminati oleh konsumen karena relatif murah, ramah lingkungan, penggunaan energi yang efisien dalam produksi, dan mudah dicetak (Coles et al. 2007).
Salah satu jenis kemasan kertas yang banyak dijumpai di pasaran adalah kertas dupleks. Kertas dupleks merupakan kertas multi-lapis yang 80 – 100% bahan bakunya berasal dari kertas daur ulang. Penggunaan kertas daur ulang sebagai bahan baku kertas kemasan dewasa ini meningkat, seiring bertambahnya kesadaran masyarakat untuk menjaga kelestarian lingkungan. Kertas kemasan dari bahan daur ulang digunakan baik sebagai kemasan sekunder maupun kemasan primer untuk bahan pangan kering seperti tepung, biji-bijian, serealia, dan pasta (Binderup et al. 2002).
Terkait dengan bahan bakunya yang berupa kertas daur ulang, kertas dupleks sangat mungkin mengandung senyawa-senyawa kimia yang membahaya-kan kesehatan. Dalam proses produksi kertas dupleks dan kertas daur ulang pada umumnya dilakukan penambahan bahan kimia tertentu yang berfungsi membantu proses produksi untuk menghasilkan kualitas lembaran kertas seperti yang diharapkan. Keamanan penggunaan kertas kemasan pangan dari bahan daur ulang telah banyak dikaji. Residu kontaminan berbahaya yang mungkin ditemukan pada kertas kemasan dari bahan daur ulang adalah benzofenon, poli aromatik hidrokar-bon (naftalen, fluoren, antrasen, piren, benzopiren dan benzofluoranten), DIPNs (2,6- and 2,7-diisopropilnaftalen), HTP’s (m-terfenil, o-terfenil) dan ftalat (dioktil-ftalat, di-N-butil (dioktil-ftalat, dimetil (dioktil-ftalat, dietil (dioktil-ftalat, etilhexil) adipat, bis(2-etilhexil) ftalat dan benzil butil ftalat (Triantafyllou et al. 2007, Parigoridi 2010, Suciu et al. 2013).
3-Monokloro-1,2-propandiol (3-MCPD) merupakan processing contaminant
atau senyawa kontaminan yang terbentuk pada proses pengolahan pangan. Kontaminan ini tidak terdapat pada bahan baku tetapi terbentuk oleh reaksi kimia tertentu selama proses pengolahan. Perhatian serius diberikan karena 3-MCPD bersifat karsinogenik. Meskipun tidak terdapat data bahwa 3-MCPD menimbulkan kanker pada manusia, namun sejumlah penelitian membuktikan 3-MCPD bersifat karsinogenik pada hewan percobaan (Cho et al. 2008). Tikus yang diberi asupan 3-MCPD mengalami toksisitas akut yang memberi efek pada ginjal dan organ reproduksi dengan nilai LD50 sebesar 150 mg/kg berat badan. Pemberian 3-MCPD dengan dosis > 25 mg/kg berat badan perhari dapat menimbulkan luka pada sistem syaraf pusat tikus dan mencit (Stadler dan Lineback 2009).
2
et al. 2007, Baer et al. 2010, Razak et al. 2012, Wenzl et al. 2007). Chung et al. (2008) menguji 318 sampel makanan di sejumlah pasar retail di Hongkong dan menemukan sebanyak 101 sampel (32%) mengandung 3-MCPD pada kisaran 3 – 66 µg/kg.
Studi lain mengungkapkan bahwa 3-MCPD tidak hanya ditemukan pada produk pangan, tapi juga pada kemasan kertas. Kehadiran 3-MCPD pada kemasan kertas dipicu oleh senyawa epiklorohidrin. Dalam industri kemasan dunia, epiklorohidrin merupakan jenis wet-strength resin yang paling umum digunakan dalam pembuatan kertas dan karton. Pace dan Hartman (2010) melaporkan bahwa kertas kemasan yang melibatkan epiklorohidrin dalam pembuatannya mengandung 3-MCPD dalam kadar yang melebihi batas ambang toleransi.
Perumusan Masalah
Berdasarkan Peraturan Kepala BPOM (2011) epiklorohidrin terkategori sebagai zat kontak pangan yang diizinkan penggunaannya sebagai bahan penolong dalam produksi kemasan pangan dan tanpa persyaratan batas migrasi. Senyawa epiklorohidrin ditambahkan sebagai komponen kertas dan karton yang kontak dengan pangan yang mengandung air dan lemak. Hal tersebut menunjukkan kemungkinan kandungan 3-MCPD pada kertas kemasan pangan.
Informasi mengenai kandungan 3-MCPD pada kemasan kertas dupleks di Indonesia belum tersedia. Sementara itu, seringkali ditemukan penggunaan kertas dupleks sebagai kemasan primer yang kontak langsung dengan bahan pangan. Untuk itu dibutuhkan penelitian untuk mengetahui kadar dan potensi migrasi 3-MCPD ke dalam produk pangan.
Pengembangan metode analisis 3-MCPD pada kertas kemasan masih terbatas dan belum terstandar. Dibutuhkan pengembangan dan validasi metode analisis 3-MCPD pada kertas dupleks.
Tujuan Penelitian
Penelitian ini bertujuan untuk memvalidasi metode analisis komponen 3-MCPD yang telah dimodifikasi pada kemasan kertas, menganalisis kandungan 3-MCPD kemasan kertas dupleks dan menganalisis migrasi 3-MCPD dari kemasan kertas dupleks ke dalam simulan pangan.
Manfaat Penelitian
3
2
TINJAUAN PUSTAKA
Kemasan Kertas Dupleks
Tren penggunaan kemasan berbahan dasar kertas menjadi alternatif kemasan masa depan. Penggunaan kemasan kertas untuk seluruh sektor industri di dunia menempati peringkat pertama dengan persentase sebesar 38%, diikuti berturut-turut oleh kemasan plastik kaku 21%, kemasan plastik fleksibel 13%, kemasan kaleng 16%, kemasan dari kaca 6%, dan kemasan lainnya 6% (WPO 2008). Di Indonesia penggunaan kemasan kertas sebesar 24% masih menempati peringkat kedua setelah kemasan plastik sebesar 53%, sementara sisanya kemasan kaleng sebesar 17% dan kemasan kaca sebesar 6%. Dan dari berbagai sektor industri yang menggunakan jasa kemasan, sektor pangan merupakan pengguna terbesar dengan prosentase lebih dari 50% (Coles et al. 2007).
Kertas dupleks (Multilayered Paperboard) merupakan kertas multilapis dengan bagian tengah berasal dari pulp daur ulang yang diperoleh dari campuran kertas atau karton bekas. Lapisan tengah kertas dupleks berwarna abu-abu. Lapisan bagian atas atau lapisan pertama berasal dari pulp yang telah dipucatkan secara kimia dan biasanya berwarna putih dengan coating pigmen mineral. Lapisan kedua, atau di bawah lapisan atas dapat berasal dari pulp yang dipucatkan secara kimia atau mechanical pulp. Produk tersebut dikenal dengan nama
newsboard. Istilah chipboard juga digunakan, meski lebih diasosiasikan dengan
unlined grade, seperti tanpa permukaan dengan warna putih atau warna lainnya (Gambar 1).
Lapisan bagian dalam biasanya berasal dari pulp daur ulang yang dipilih secara khusus dan berwarna abu-abu. Terdapat beberapa jenis kertas dupleks
4
dengan lapisan khusus untuk corrugated fibreboard atau tanpa lapisan tambahan. Kertas dupleks digunakan secara luas sebagai kemasan sereal, makanan yang dikeringkan, makanan dingin atau beku, hingga kemasan luar coklat dan permen. Gambar 2 memperlihatkan tampilan kertas dupleks yang ada di pasaran.
Bahan Kimia pada Pembuatan Kertas Dupleks
Kertas dan karton secara umum diproduksi dengan penambahan bahan kimia (aditif) yang memiliki dua fungsi utama yaitu sebagai bahan kimia fungsional dan bahan kimia kontrol. Bahan kimia fungsional ditambahkan dengan tujuan menghasilkan sifat tertentu dari kertas karton. Yang termasuk ke dalam bahan kimia jenis ini yaitu, bahan penguat kering (dry strength additive), bahan penguat basah (wet strength resins), bahan pendarihan (sizing agents), bahan pengisi (filler), pelapis (coating) dan pewarna (dyes). Bahan kimia kontrol membantu proses produksi dalam kontrol kualitas lembaran kertas karton yang dihasilkan. Bahan kimia kontrol yang umum digunakan seperti anti pitch (pitch dispersants), anti busa (defoamers), bahan pengontrol bakteri, lendir atau mikroba lainnya (biocides), pembersih (cleaners), dan penghilang tinta (de-inking agents) (Coles et al. 2007).
Wet strength resin merupakan bahan kimia yang ditambahkan dengan tujuan mencegah mengembangnya serat selulosa karena keberadaan air, sehingga meningkatkan kekuatan kertas dalam keadaan basah. Mekanisme kerja wet strength resin adalah membentuk ikatan sambung silang antara serat dan resin yang tidak larut air sehingga dapat mengurangi pengembangan dan penguraian serat selulosa, berpenetrasi (diserap) pada serat selulosa yang menghasilkan jaringan pelindung pada permukaan ikatan yang tidak larut air, atau membentuk kulit pelindung berupa polimer (Espy 1995).
Sifat kekuatan basah kertas berperan penting dalam kelancaran operasi mesin kertas terutama pada tahap pengepresan. Wet strength resin juga ditambahkan dengan tujuan meningkatkan umur simpan kertas dan penggunaannya oleh konsumen. Beberapa contoh jenis kertas yang menggunakan
wet strength resin yaitu kertas yang digunakan pada kondisi yang berbeda iklim (kertas pengepakan, kantong kertas, peta), kertas yang penggunaannya berkaitan dengan air (handuk kertas, serbet kertas, tissue, kertas lensa), kertas kemasan
5 pangan, dan kertas yang direndam dalam air pada saat digunakan seperti kertas fotografi, kertas saring, dan kantong teh celup (Coles et al. 2007).
Menurut Ginebreda et al. (2011) dalam industri pembuatan kertas terdapat tiga jenis wet strength resin yang paling banyak digunakan, urea-formaldehida (UF), melamine-formaldehida (MF), dan poliamida-epiklorohidrin (PAE). Dari segi kualitas kekuatan kertas yang dihasilkan, melamine-formaldehida lebih unggul. Namun, karena keterbatasan dalam regulasi kandungan formaldehida, penggunaan poliamida–epiklorohidrin menjadi lebih dominan.
3-MCPD pada Produk Pangan dan Kertas Kemasan
3-MCPD ditemukan dalam kecap, saus tiram, atau produk pangan lainnya yang mengandung protein nabati terhidrolisis asam (acid-HVP). Selain itu, 3-MCPD juga ditemukan dalam jumlah yang lebih rendah pada produk pangan dengan kadar garam tinggi (sup dan saus), kadar lemak tinggi (daging dan produk olahan susu), dan produk hasil pemanasan (sereal dan roti). Pembentukan 3-MCPD pada makanan secara umum berasal dari tiga jalur, yaitu hidrolisa asam, proses pemanasan dan kloroester (Baer et al. 2010). Meski demikian, 3-MCPD juga dideteksi pada produk pangan yang tidak berkaitan dengan ketiga jalur di atas. Contohnya 3-MCPD yang ditemukan pada produk salami yang diduga berasal dari kontaminasi sausage casing yang mengandung wet strength resin (Hamlet, 2002). Selain itu, sejumlah material kemasan yang kontak dengan pangan seperti kantong teh celup, kertas saring kopi, atau kertas penyerap pada kemasan daging berpotensi sebagai sumber kontaminan 3-MCPD, karena melibatkan wet strength resin dalam proses produksi kemasannya.
Pada kemasan kertas, 3-MCPD muncul sebagai produk sampingan pada proses pembentukan poliamida–epiklorohidrin (tahap penambahan epiklorohidrin). 3-MCPD terbentuk dari reaksi hidrolisis epiklorohidrin dalam kondisi aqueous
(Gambar 3). Selain 3-MCPD, kloropropanol lainnya yaitu 1,3-DCP (1,3-dikloro-2-propanol) juga terbentuk sebagai hasil reaksi gugus epoksida dari epiklorohidrin dengan ion klorin pada pH 8-9. Menurut Crews et al. (2002) 1,3-DCP biasanya terbentuk dalam jumlah yang lebih sedikit (rasio 1:6) dibandingkan 3-MCPD.
Regulasi 3-MCPD
Sejumlah regulasi mengenai 3-MCPD di berbagai negara umumnya ditujukan pada produk pangan, khususnya yang berasal dari hidrolisa protein
6
nabati (HVP). Hamlet dan Sadd (2009) mencatat batas toleransi 3-MCPD dalam produk pangan di sejumlah negara (Tabel 1).
Di Indonesia, Badan POM (2009) menetapkan batas maksimum kandungan 3-MCPD untuk semua makanan yang mengandung protein nabati terhidrolisis asam (makanan cair) sebesar 20 ppb, makanan padat sebesar 50 ppb dan pada protein nabati terhidrolisis asam (Acid-HVP) sebesar 1000 ppb. Sementara itu, regulasi batas maksimum 3-MCPD pada kertas kemasan kertas dan karton yang kontak dengan bahan pangan telah diberlakukan di Jerman, yaitu sebesar 300 ppb (Liu 2012).
Regulasi di atas diberlakukan karena dugaan 3-MCPD sebagai senyawa karsinogenik. Meskipun belum ada penelitian yang membuktikan status karsinogenik 3-MCPD pada manusia, namun beberapa penelitian menunjukkan bahwa 3-MCPD bersifat karsinogenik pada hewan percobaan, antara lain penelitian Cho et al. (2008) yang melaporkan pertumbuhan sel tumor pada tikus
Sprague-Dawley yang diberi air minum yang mengandung 3-MCPD. Metode Analisis Penentuan 3-MCPD
Analisis penentuan kandungan 3-MCPD dalam bahan pangan atau material kemasan, tidak sesederhana struktur molekulnya. Kesulitan pertama adalah analisis yang dilakukan dalam level ppm atau ppb sehingga memerlukan sensitifitas yang tinggi. Ketidakberadaan gugus kromofor yang sesuai, titik didih tinggi (114-120oC), dan berat molekul yang rendah (110,54) membuat 3-MCPD tidak bisa dideteksi menggunakan instrumen HPLC baik detektor ultraviolet atau fluoresens. Selain itu, volatilitas yang rendah dan polaritas yang tinggi juga mempersulit analisis langsung menggunakan GC-MS.
Tabel 1 Regulasi batas maksimum 3-MCPD di sejumlah negaraa
Negara 3-MCPD
(ppm) Ruang lingkup
Australia/Selandia Baru 0.2 Kecap/saus tiram
Kanada 1 Kecap/saus tiram
Cina 1 Acid-hydrolized vegetable protein
Uni Eropa 0.02 Hydrolized vegetable protein dan kecap (kepadatan 40%) Korea 0.3 Kecap mengandung Acid-hydrolized
vegetable protein
1 Hydrolized vegetable protein
Malaysia 0.02 Pangan cair dengan Hydrolized vegetable protein
1 Acid-hydrolized vegetable protein
produk industri
Swiss 0.2 Saus gurih
Thailand 1 Hydrolyzed soybean protein
Amerika Serikat 1 Acid-hydrolized vegetable protein
7 Keterbatasan tersebut diatasi dengan perlakuan derivatisasi sebelum analisis GC-MS. Langkah derivatisasi dilakukan dengan tujuan menghasilkan analit yang lebih volatil dan mencegah interaksi 3-MCPD dengan komponen lain pada sistem GC-MS. Derivatisasi juga memberikan karakteristik ion yang lebih meyakinkan karena meningkatnya berat molekul analit. Hampir seluruh metode analisis dalam penelitian 3-MCPD yang dipublikasikan selama satu dekade terakhir menggunakan derivat 3-MCPD yang lebih volatil dan stabil (Liu 2012). Menurut Wenzl et al. (2007), terdapat tiga jenis agen derivatisasi yang umum digunakan, yaitu heptafluorobutyryl (HFB), phenyl boronic acid (PBA) dan dioxolane.
Heptafluorobutyryl-imidazole (HFBI) merupakan agen derivatisasi yang paling banyak digunakan dari dahulu hingga saat ini (Hamlet dan Sutton 1997, Brereton et al. 2001, Pace dan Hartman 2010). Pemilihan HFBI sebagai agen derivatisasi berdasarkan pada kestabilan derivat yang terbentuk dan meningkatnya volatilitas analit. Pembentukan derivat heptafluorobutyrylate-3-MCPD ditunjukkan pada Gambar 4. Keuntungan lain yang dapat diperoleh dari penggunaan HFBI adalah untuk deteksi 3-MCPD dan 1,3-DCP yang dapat dilakukan secara simultan. Dalam metode analisis yang melibatkan HFBI, digunakan internal standar berupa deuterium-labeled 3-chloro-1,2-propanediol (3-MCPD-d5) yang merupakan isotop stabil. Internal standar 3-MCPD-d5 internal di-spike pada ekstrak sampel, dan 3-MCPD dipisahkan dengan pemisahan fase liquid-liquid dari air ke dietil eter dalam kolom solid-phase extraction (SPE) yang berisi penyerap. Hasil ekstrak yang mengandung analit 3-MCPD kemudian diderivatisasi dengan HFBI pada suhu 70oC selama 20 menit, untuk selanjutnya dianalisis menggunakan GC-MS.
Penelitian 3-MCPD pada Kemasan Kertas
Tidak seperti penelitian 3-MCPD pada makanan, penelitian 3-MCPD pada kemasan kertas masih terbilang sedikit. Analisis 3-MCPD pada kertas yang mengandung epiklorohidrin pertama kali dikembangkan oleh Boden et al. (1997). Pada analisis tersebut, digunakan asetonitril sebagai pelarut ekstraksi dan N,O-bis(trimethylsilyl)trifluoroacetamide (BSTFA) sebagai agen derivatisasi. Nilai LOD 3-MCPD pada penelitian ini adalah 0,04 mg/kg.
Penelitian 3-MCPD pada kemasan kertas berikutnya dilakukan oleh Pace dan Hartman (2010). Selain analisis kandungan 3-MCPD, dalam penelitian tersebut juga dilakukan studi migrasi 3-MCPD dari kemasan kertas ke dalam
8
bahan pangan. Dengan mengadopsi metode yang digunakan Brereton et al. (2001), dalam analisis ini digunakan dietil eter sebagai pelarut ekstraksi dan
heptafluorobutyryl-imidazole (HFBI) sebagai agen derivatisasi. Nilai LOD dan LOQ dari analisis 3-MCPD berturut-turut 5 μg/kg dan 10 μg/kg dengan mode SIM (Selected Ion Monitoring), lebih sensitif dibandingkan dengan penelitian terdahulu. Pace dan Hartman (2010) melaporkan, kandungan 3-MCPD yang melebihi batas toleransi pada kemasan kertas tidak bermigrasi ke bahan pangan dalam jumlah signifikan jika kemasan dilapisi dengan polietilen.
Penelitian terbaru mengenai 3-MCPD pada kemasan kertas dilaporkan oleh Liu (2012). Dalam penelitian tersebut, dilakukan pengembangan dan validasi metode analisis 3-MCPD pada kemasan kertas dengan peningkatan efisiensi penggunaan bahan dan waktu analisis.
Validasi Metode Analisis
Validasi metode analisis merupakan proses ilmiah untuk membuktikan bahwa karakteristik kinerja suatu metode analisis telah sesuai dengan tujuan penggunaannya, atau sebagai konfirmasi melalui pengujian dan pengadaan bukti yang objektif bahwa persyaratan tertentu untuk suatu maksud khusus telah dipenuhi (EURACHEM 1998). Validasi metode analisis perlu dilakukan karena tidak semua metode yang telah dikembangkan dapat diaplikasikan dan memenuhi kebutuhan laboratorium pengujian.
Pengujian menggunakan metode tervalidasi sangat penting dalam menjamin keamanan produk pangan dan memenuhi regulasi yang diterapkan pada produk, negara, dokumentasi serta proses dan persyaratan validasi itu sendiri (AOAC
Official Method Appendix E 2005).
Parameter yang umum digunakan dalam validasi metode analisis adalah kesesuaian sistem, linieritas, akurasi dan keterulangan, batas deteksi dan batas kuantitasi (EURACHEM 1998; AOAC 2002).
3
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan dari bulan Maret 2013 hingga November 2013. Penelitian ini dilakukan di Laboratorium Kimia Pangan dan Laboratorium Analisis Pangan, Departemen Ilmu dan Teknologi Pangan, IPB.
Bahan dan Alat
Bahan yang digunakan pada penelitian ini adalah lima sampel kertas dupleks dari lima produsen kertas di Indonesia, kertas virgin, standar 3-MCPD (Sigma-Aldrich), standar internal 3-MCPD-d5 (Sigma-Aldrich), Hepta Fluoro Butryl Imidazole (HFBI) kemurnian 97% (Sigma-Aldrich), solid phase extraction
9 Alat yang digunakan pada penelitian ini adalah peralatan gelas, neraca analitik, pipet mikro (Eppendorf), kertas saring (Whatman No.1), vortex (Thermo Scientific®, waterbath (GFL Waterbath 1002), inkubator, vacuum rotary evapator
(Buchi, R-II), alat uji migrasi, dan instrumen GC-MS Shimadzu seri QP2010 yang dilengkapi autosampler.
Tahapan Penelitian
Penelitian ini dilakukan dalam tiga tahapan seperti yang ditunjukkan pada Gambar 5. Tahap pertama adalah pengembangan dan validasi metode analisis 3-MCPD. Tahap kedua adalah analisis kandungan 3-MCPD pada kemasan kertas dupleks, dan tahap ketiga adalah penentuan persentase migrasi 3-MCPD dari kemasan kertas dupleks ke simulan pangan.
10
Tahap Pertama: Pengembangan dan validasi metode analisis 3-MCPD
Metode analisis yang digunakan pada penelitian ini adalah metode Pace dan Hartman (2010) yang dimodifikasi, terdiri dari empat tahapan yaitu ekstraksi,
clean-up, derivatisasi dan analisis dengan menggunakan kromatografi gas-spektrometri massa (GC-MS). Modifikasi dilakukan meliputi jumlah dan ukuran sampel yang dianalisis, spesifikasi dan kondisi operasi peralatan yang digunakan. Tahapan analisis 3-MCPD pada kemasan kertas secara garis besar mengikuti prosedur pada Gambar 6.
Gambar 6 Diagram alir analisis 3-MCPD pada kertas kemasan (modifikasi Pace dan Hartman 2010)
kemasan kertas
inkubasi dalam air selama 24 jam pada suhu ruang
penambahan standar internal 3-MCPD-d5
penambahan garam
solid phase extractiondengan dietil eter menggunakan Chem Elute®
pemekatan dengan rotavapor
pengeringan dengan gas N2
penambahan isooktan
derivatisasi dengan HFBI
11 Penyiapan larutan standar
Larutan standar eksternal 3-MCPD disiapkan dengan menimbang secara seksama lebih kurang 10 mg 3-MCPD, dimasukkan ke dalam labu takar 10 ml dan dilarutkan dengan etil asetat sehingga diperoleh konsentrasi 10 mg/ml. dari larutan stok tersebut, dibuat larutan standar dengan konsentrasi 100 µg/ml dan 10 µg/ml dengan cara melarutkan dalam etil asetat. Larutan standar internal 3-MCPD-d5 tersedia dalam konsentrasi 1 mg/ml, dilarutkan dalam etil asetat sehingga diperoleh konsentrasi 10 µg/ml.
Penentuan konsentrasi 3-MCPD dengan menggunakan GC-MS
Penentuan jumlah 3-MCPD dilakukan dengan menggunakan GC-MS Shimadzu series QP 2010. Kondisi analisis GC-MS seperti pada Tabel 2.
Validasi metode analisis
Validasi metode analisis dilakukan dengan cara melakukan uji kesesuaian sistem, uji linieritas, uji akurasi dan keterulangan, serta penentuan limit deteksi dan limit kuantitasi, mengikuti panduan EURACHEM (1998) dan AOAC (2002). 1. Uji kesesuaian sistem
Uji kesesuaian sistem metode analisis 3-MCPD dilakukan dengan menginjeksi standar 3-MCPD dan standar internal 3-MCPD-d5 yang telah diderivatisasi sebanyak enam kali ulangan. Konsentrasi larutan standar MCPD-d5 dan 3-MCPD yang digunakan berturut-turut adalah 10 μg/ml dan 0.5 μg/ml. Kemudian dihitung standar deviasi dan standar deviasi relatif (RSD) dari waktu retensi dan luas area hasil pengukuran dengan GC-MS. Nilai standar deviasi relatif yang diperbolehkan menurut JECFA adalah maksimum 2%.
Tabel 2 Kondisi analisis 3-MCPD dengan GC-MS
Kriteria Kondisi
GC
Kolom Rtx®5-MS dimensi 30 m x 0.25mm ID x 0.25μm Suhu injektor 270oC
Suhu oven 50°C selama 1 menit, ditingkatkan 2° per menit hingga suhu 90°C, kemudian ditingkatkan 20°C per menit hingga 270°C dengan holding time 5 menit
Gas pembawa Helium
Aliran kolom 1 ml/menit Penyuntikan splitless
Volume penyuntikan 1 µL MS
Mode aquisition Selected Ion Monitoring (SIM) Mode ionisasi Electron Impact (EI)
Suhu interface 270oC Suhu ionisasi 250oC
m/z 253, 257 (analisis kuantitatif)
12
2. Uji linieritas metode
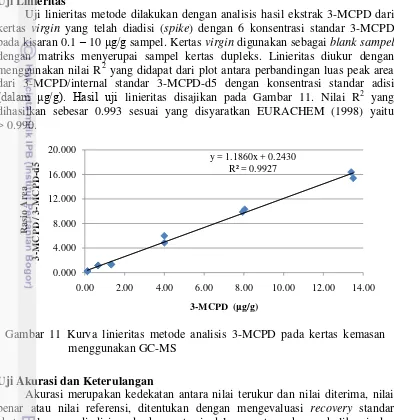
Uji linieritas metode dilakukan dengan analisis 3-MPCD yang diadisi pada kertas virgin sebagai blank sample yang memiliki matriks menyerupai kertas dupleks. Digunakan 6 konsentrasi standar eksternal 3-MCPD pada kisaran 0.1 – 10 μg/g dan standar internal 3-MCPD-d5 pada konsentrasi 1 μg/g. Linieritas diukur dengan memetakan rasio luas peak area standar eksternal dan standar internal terhadap rasio konsentrasi standar eksternal dan standar internal, dimana umumnya antara keduanya membentuk hubungan linier yang dinyatakan dengan persamaan regresi dan koefisien korelasi.
Persamaan regresi: y = bx + a
y = rasio luas peak area = luas peak area standar eksternal (3-MCPD) / luas
peak area standar internal (3-MCPD-d5)
x = rasio konsentrasi = konsentrasi (3-MCPD) / konsentrasi standar internal (3-MCPD-d5).
Nilai linieritas dievaluasi menggunakan nilai R2 yang diperoleh Nilai linieritas yang diharapkan adalah lebih dari 0.990.
3. Uji akurasi dan keterulangan
Uji akurasi (recovery) dan uji keterulangan (repeatability) dilakukan dengan adisi standar 3-MCPD pada kertas virgin dengan konsentrasi 5.36 μg/g sebanyak 7 ulangan. Kertas virgin yang telah diadisi tersebut kemudian dianalisis kandungan 3-MCPD-nya. Nilai recovery dari metode dihitung dengan rumus:
Recovery(%) = [konsentrasi yang ditemukan −konsentrasi tanpa adisi 3−MCPD ) x 100%
konsentrasi adisi
Nilai recovery yang direkomendasikan oleh AOAC (2002) yaitu 80-115% untuk analisis kandungan trace dalam sampel dengan konsentrasi dalam ppm. Hasil uji keterulangan analisis 3-MCPD ditunjukkan oleh nilai %RSD dari analisis 3-MCPD. Batas keberterimaan repeatability yang disarankan oleh AOAC (2002) untuk analisis traceyaitu nilai RSD ≤ 15%.
4. Penentuan batas deteksi dan batas kuantitasi
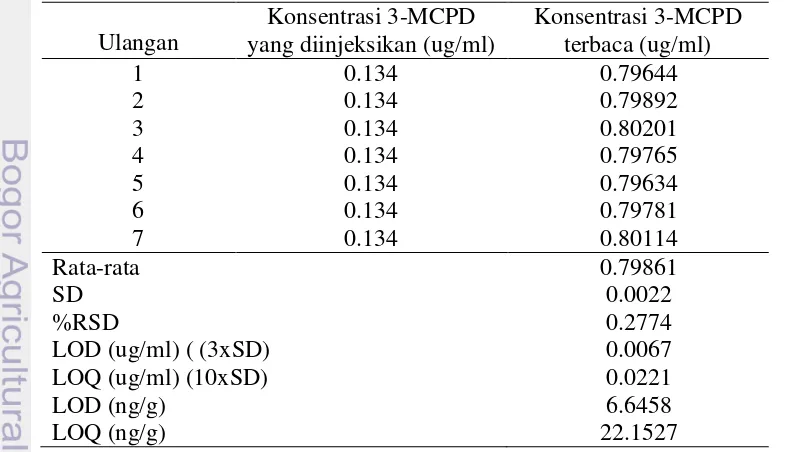
Nilai batas deteksi/limit of detection (LOD) dan batas kuantitasi/limit of quantitation (LOQ) instrumen ditentukan dengan injeksi standar 3-MCPD pada konsentrasi terendah yang masih dapat terdeteksi. Dilakukan tujuh penentuan dengan injeksi standar 3-MCPD pada konsentrasi 0.134 ug/ml. Standar deviasi (SD) dari ketujuh penentuan tersebut dihitung. Nilai LOD alat dinyatakan sebagai 3 kali standar deviasi, sedangkan LOQ adalah 10 kali standar deviasi.
Tahap Kedua: Analisis kadar 3-MCPD pada sampel kertas dupleks
13 selama 24 jam. Ekstrak disaring dengan kertas saring Whatman No.1 dan tabung dibilas dengan 5 ml air destilata. Ekstrak ditambah 100 μl 3-MCPD-d5 10 μg/ml dan NaCl sebanyak 8 g, diaduk hingga larut, dituang ke kolom SPE Agilent Chem Elut, dan dibiarkan selama 15-20 menit. Kolom kemudian dielusi dengan 250 ml dietil eter dengan kecepatan 10 ml/menit.
Untuk menghilangkan residu air pada eluan, ditambahkan 15 g Na2SO4 anhidrat. Ekstrak dipekatkan dengan vacuum rotary evaporator pada suhu 35oC hingga sekitar 10 ml. Sejumlah Na2SO4 anhidrat ditambahkan pada ekstrak hasil pemekatan. Ekstrak dipindahkan secara kuantitatif ke dalam vial 4.0 ml dan suhu sekitar 40oC, kemudian ditambahkan 1.0 ml air destilata dan divortex selama 30 detik. Vial didiamkan hingga terpisah lapisan air dan isooktan. Fase isooktan dipindahkan dengan hati-hati menggunakan pipet mikro ke dalam vial 2.0 ml dan diberi Na2SO4 anhidrat. Setelah 5 menit, ekstrak dipindahkan ke vial 2.0 ml baru dan siap untuk dianalisis dengan GC-MS.
Tahap 3: Penentuan persentase migrasi komponen 3-MCPD dari kemasan kertas dupleks ke dalam simulan pangan
Penentuan persentase migrasi 3-MCPD menggunakan sampel kertas dupleks dengan kandungan komponen 3-MCPD tertinggi. Uji migrasi yang dilakukan mengacu pada Protokol Uji Migrasi Tertentu (Lampiran 2) Guidance for Industry: Preparation of Premarket Submissions for Food Contact Substances: Chemistry Recommendations, FDA (FDA, 2007) dengan simulan pangan dan kondisi pengujian seperti ditunjukkan pada Tabel 3.
Uji migrasi menggunakan desain alat single side-extraction yang dimodifikasi dari Pace dan Hartman (2010) dapat dilihat pada Gambar 7. Model migrasi single side-extraction yang paling mendekati kondisi sebenarnya, dimana bagian dalam kertas dupleks kontak langsung dengan simulan pangan.
Simulan pangan sebanyak 30 ml ditempatkan dalam alat migrasi dan dibiarkan kontak dengan sisi bagian dalam kertas selama 24 jam pada suhu 40oC. Simulan pangan kemudian diekstrak dan di-clean-up dengan cara yang sama seperti analisis 3-MCPD pada sampel kertas, sehingga diperoleh kandungan 3-MCPD yang bermigrasi ke dalam simulan pangan. Kecuali untuk simulan pangan minyak jagung, pada tahap SPE, sebelum dielusi menggunakan 250 ml dietil eter, terlebih dahulu dielusi dengan 80 ml campuran heksana dan dietil eter
Tabel 3 Simulan pangan dan kondisi pengujian migrasi 3-MCPD Simulan Pangan Kondisi Pengujian
10% Etanol 40°C, 24 jam
50% Etanol 40°C, 24 jam
14
dengan perbandingan 9:1. Persentase migrasi 3-MCPD dihitung dengan rumus berikut:
Persen Migrasi (%) = konsentrasi 3MCPD simulan pangan x 100% konsentrasi 3MCPD pada sampel kertas
4
HASIL DAN PEMBAHASAN
Pengembangan dan Validasi Metode Analisis 3-MCPD
Pada penelitian ini dilakukan modifikasi pada metode analisis 3-MCPD yang telah dikembangkan oleh Pace dan Hartman (2010). Modifikasi dilakukan terhadap jumlah sampel dan pelarut yang digunakan dimana pada penelitian ini jumlah sampel yang digunakan hanya 1 g dengan jumlah pelarut yang telah disesuaikan. Selain itu, sejumlah peralatan yang digunakan pada proses clean up
memiliki spesifikasi yang berbeda dengan peralatan yang digunakan oleh metode terdahulu, antara lain penggunaan kolom solid phase extraction (SPE) Agilent Chem Elut® yang menggantikan kolom SPE Extrelute, serta penggunaan vacuum
15
rotavapor yang lebih sederhana mengadopsi prinsip kerja Dry-Vap® solvent evaporating system. Selain itu, terdapat perbedaan jenis dan kondisi penggunaan instrumen GC-MS.
Penggunaan sampel dan pelarut dalam jumlah yang lebih sedikit bertujuan untuk efisiensi bahan. Peralatan yang lebih sederhana dan umum digunakan dalam laboratorium dipilih dengan harapan metode ini dapat diaplikasikan lebih luas untuk pengukuran kadar 3-MCPD pada kertas kemasan untuk tujuan keamanan pangan.
Standar internal adalah standar yang ditambahkan ke dalam matriks sampel dengan jumlah tertentu yang biasanya tetap. Standar internal yang digunakan adalah senyawa yang mudah dibedakan dari analit namun memiliki sifat kimia yang sama. Pada penelitian ini, digunakan isotop 3-MCPD sebagai standar internal yaitu 3-MCPD-d5. Penggunaan isotop yang bersifat stabil diharapkan tidak mempengaruhi matrik sampel dan proses preparasi sehingga analit yang akan diuji memiliki sifat dan karakter yang sama dengan analit pada sampel.
Pada proses derivatisasi, 3-MCPD bereaksi dengan HFBI membentuk senyawa derivat dengan berat molekul 502 untuk heptafluorobutyrylate-3-MCPD dan 507 untuk heptafluorobutyrylate-3-MCPD-d5. Ketika memasuki ionization
chamber pada unit spektro massa, senyawa-senyawa tersebut akan diionisasi hingga terpecah menjadi fragmen-fragmen bermuatan dengan massa yang spesifik. Gambar 8 menunjukkan kemungkinan alur fragmentasi senyawa
heptafluorobutyrylate-3-MCPD. Penentuan nilai m/z oleh detektor spektrum massa menggunakan ion m/z 253, 275, 289, 453 untuk 3-MCPD dan ion m/z 257, 278, 294, 456 untuk 3-MCPD-d5 juga diterapkan oleh Abu-El-Haj et al. (2007) untuk menentukan kadar kloropropanol pada produk pangan.
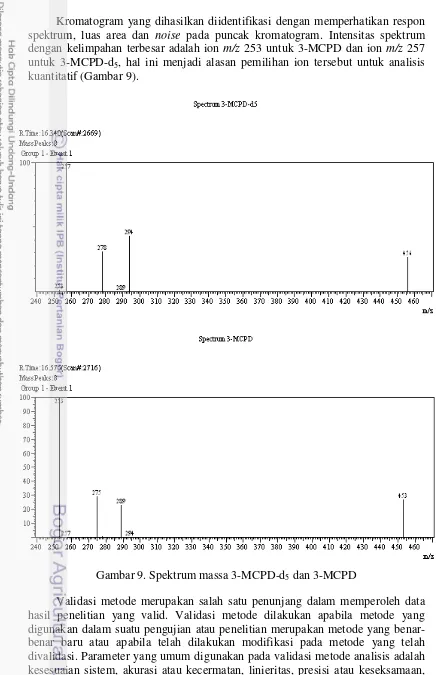
16
Kromatogram yang dihasilkan diidentifikasi dengan memperhatikan respon spektrum, luas area dan noise pada puncak kromatogram. Intensitas spektrum dengan kelimpahan terbesar adalah ion m/z 253 untuk 3-MCPD dan ion m/z 257 untuk 3-MCPD-d5, hal ini menjadi alasan pemilihan ion tersebut untuk analisis kuantitatif (Gambar 9).
Validasi metode merupakan salah satu penunjang dalam memperoleh data hasil penelitian yang valid. Validasi metode dilakukan apabila metode yang digunakan dalam suatu pengujian atau penelitian merupakan metode yang benar-benar baru atau apabila telah dilakukan modifikasi pada metode yang telah divalidasi. Parameter yang umum digunakan pada validasi metode analisis adalah kesesuaian sistem, akurasi atau kecermatan, linieritas, presisi atau keseksamaan,
17 batas deteksi dan batas kuantitasi (Codex Stan 193-1995 2010; AOAC 2002; EURACHEM 1998).
Uji Kesesuaian Sistem
Uji kesesuaian sistem metode analisis 3-MCPD menggunakan instrumen GC-MS dilakukan dengan menginjeksi standar 3-MCPD dan standar internal 3-MCPD-d5 pada konsentrasi tertentu sebanyak enam kali ulangan. Konsentrasi larutan standar 3-MCPD-d5 dan 3-MCPD yang digunakan berturut-turut adalah
10 μg/ml dan 0,5 μg/ml. Hasil uji kesesuaian sistem dapat dilihat pada Tabel 4.
Dari hasil pengujian diperoleh nilai deviasi standar relatif (RSD) untuk waktu retensi 3-MCPD-d5, waktu retensi 3-MCPD dan rasio luas peak area masing-masing 0,075%, 0,072% dan 1,753%. Nilai tersebut sesuai dengan standar RSD yang disarankan untuk prosedur analisis trace yaitu di bawah 2%.
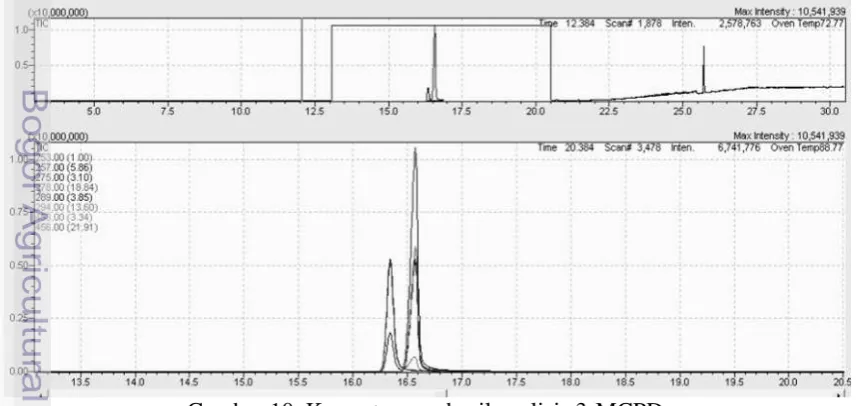
Kromatogram hasil analisis 3-MCPD dapat dilihat pada Gambar 10. Kromatogram TIC (Total Ion Chromatograms) dengan menggunakan mode
Tabel 4 Hasil uji kesesuaian sistem metode analisis 3-MCPD pada GC-MS
Ulangan
Waktu retensi 3-MCPD-d5
(menit ke-)
Waktu retensi 3-MCPD (menit ke-)
Rasio luas peak area
3-MCPD/3-MCPD-d5
1 16.314 16.505 0.0602
2 16.335 16.520 0.0596
3 16.336 16.528 0.0594
4 16.343 16.528 0.0594
5 16.347 16.535 0.0572
6 16.346 16.538 0.0597
Rata-rata 16.337 16.526 0.0592
SD 0.0122 0.0112 0.0010
%RSD 0.0750 0.0721 1.7528
18
deteksi scan menghasilkan luas puncak gabungan seluruh spektrum massa yang sebanding dengan konsentrasi analit terukur. Mode ion selektif (SIM) dapat memisahkan puncak kromatogram analit dengan lebih baik, sehingga memudahkan identifikasi dan pengukuran.
Uji Linieritas
Uji linieritas metode dilakukan dengan analisis hasil ekstrak 3-MCPD dari kertas virgin yang telah diadisi (spike) dengan 6 konsentrasi standar 3-MCPD pada kisaran 0.1 – 10 μg/g sampel. Kertas virgin digunakan sebagai blank sampel
dengan matriks menyerupai sampel kertas dupleks. Linieritas diukur dengan menggunakan nilai R2 yang didapat dari plot antara perbandingan luas peak area dari 3-MCPD/internal standar 3-MCPD-d5 dengan konsentrasi standar adisi
(dalam μg/g). Hasil uji linieritas disajikan pada Gambar 11. Nilai R2 yang dihasilkan sebesar 0.993 sesuai yang disyaratkan EURACHEM (1998) yaitu > 0.990.
Uji Akurasi dan Keterulangan
Akurasi merupakan kedekatan antara nilai terukur dan nilai diterima, nilai benar atau nilai referensi, ditentukan dengan mengevaluasi recovery standar eksternal yang diadisi pada konsentrasi dalam rentang kurva kalibrasi dan dilakukan tujuh ulangan. Hasil uji akurasi dan keterulangan untuk analisis 3-MCPD ditunjukkan pada Tabel 5. Konsentrasi standar 3-MCPD yang di-spiking ke dalam kertas virgin adalah 5.36 μg/g sampel. Hasil uji recovery pada standar 3-MCPD bervariasi antara 83.00 – 114.13% dengan rata-rata recovery adalah 96,96%. Nilai tersebut sesuai dengan nilai yang direkomendasikan oleh AOAC (2002) yaitu 80-115% untuk analisis kandungan trace dalam sampel dengan konsentrasi dalam ppm.
Hasil uji keterulangan analisis 3-MCPD ditunjukkan oleh nilai %RSD dari analisis 3-MCPD. Nilai keterulangan yang dihasilkan pada penelitian ini adalah 12,78%, lebih rendah dari batas keberterimaan yang disarankan oleh AOAC (2002) untuk analisis trace yaitu nilai RSD ≤ 15%.
Gambar 11 Kurva linieritas metode analisis 3-MCPD pada kertas kemasan
0.00 2.00 4.00 6.00 8.00 10.00 12.00 14.00
19
Batas Deteksi dan Batas Kuantitasi (LOD dan LOQ)
Batas deteksi merupakan konsentrasi minimum analit yang dapat dideteksi, batas kuantitasi merupakan konsentrasi minimum yang dapat ditentukan kuantitasnya. Data pada Tabel 6 menyatakan bahwa instrumen Gas Chromatography-Mass Spectrometry (GC-MS) yang digunakan pada penelitian ini dapat mendeteksi analit 3-MCPD pada konsentrasi 6.64 ng/g dan dapat mengkuantitasi 3-MCPD pada konsentrasi 22.15 ng/g. Nilai ini lebih rendah dibandingkan LOD dan LOQ yang pernah dilaporkan Liu (2012) berturut-turut sebesar 10 ng/g dan 50 ng/g.
Tabel 5 Hasil Uji Recovery 3-MCPD pada kertas kemasan menggunakan GC-MS
Ulangan
Tabel 6 Hasil penentuan LOD dan LOQ analisis 3-MCPD pada GC-MS
20
Limit deteksi yang rendah pada analisis penentuan kadar 3-MCPD sangat diperlukan mengingat regulasi batas minimal 3-MCPD yang rendah dalam produk pangan, yaitu sekitar 20 ppb (BPOM 2009).
Analisis 3-MCPD pada Sampel Kertas Dupleks
Analisis kandungan senyawa 3-MCPD dilakukan terhadap lima sampel kertas dupleks yang berasal dari lima produsen kertas. Sampel kertas dupleks yang diterima dari produsen dalam bentuk plano berukuran A0, dipotong hingga berukuran maksimal 5 x 5 mm2 untuk analisis. Pengujian dilakukan sebanyak dua kali ulangan untuk setiap sampel kertas. Hasil analisis kandungan 3-MCPD lima sampel kertas dupleks ditampilkan pada Gambar 12. Kandungan 3-MCPD antar sampel tidak berbeda nyata pada taraf uji 5%, dengan kadar terendah 753.43 ppb pada sampel kertas dupleks kode B dan kadar tertinggi sebesar 825.36 ppb pada sampel kertas dupleks kode E.
Kandungan 3-MCPD pada kemasan kertas yang diperoleh pada penelitian ini melampaui batas toleransi nilai 3-MCPD yang terkandung dalam kemasan kertas sebagai material yang kontak dengan bahan pangan yaitu sebesar 300 ppb (EU Standard CEN 1993). Meski demikina, nilainya lebih rendah dibandingkan hasil pengukuran 3-MCPD pada kertas karton kemasan minuman yang dilaporkan Pace dan Hartman (2010), dengan kisaran 4360 ppb hingga 9870 ppb. Liu (2012) bahkan melaporkan kadar 3-MCPD yang lebih tinggi yaitu pada kisaran 0.1 ppm hingga 100 ppm dari seratus sampel kertas karton komersial. Tingginya kadar 3-MCPD yang ditemukan pada kertas kemasan minuman tersebut berbanding lurus dengan kadar epiklorohidrin yang digunakan sebagai wet strength resin dalam pembuatan kertas karton.
Dari data di atas terlihat bahwa kandungan 3-MCPD pada kertas virgin tidak berbeda nyata dengan kandungan 3-MCPD pada kertas dupleks. Hal ini sejalan dengan hasil penelitian Liu (2012), dimana tidak terdeteksi keberadaan 3-MCPD Gambar 12 Kandungan 3-MCPD sampel kertas dupleks (data merupakan nilai
rerata ± standar deviasi)
Sampel A Sampel B Sampel C Sampel D Sampel E
21 (limit deteksi 0.01 ppm) pada sampel pulp kertas daur ulang. Sehingga kertas daur ulang sebagai bahan utama pembuat kertas dupleks tidak dapat diduga sebagai sumber kontaminan 3-MCPD, selain epiklorohidrin. Dalam penelitian ini tidak ada data mengenai kadar penggunaan epiklorohidrin pada produksi sampel kertas dupleks. Diduga rendahnya kandungan 3-MCPD baik pada kertas virgin maupun kertas dupleks disebabkan oleh penggunaan epiklorohidrin pada proses produksinya.
Senyawa kloropropanol lain yang dapat terbentuk dari epiklorohidrin adalah 1,3-DCP. Senyawa 1,3-DCP memiliki resiko bahaya yang lebih tinggi dibandingkan 3-MCPD, yakni merupakan senyawa karsinogen genotoksik. Dengan pertimbangan tersebut sejumlah regulasi mempersyaratkan ambang batas toleransi 1,3-DCP yang lebih rendah dibandingkan 3-MCPD. European Commission tidak menetapkan angka tolerable daily intake (TDI) untuk 1,3-DCP sebagaimana ditetapkan sebesar 2 µg/kg berat badan untuk 3-MCPD. FDA membuat batasan maksimum 3-MCPD sebesar 1 mg/kg dan 1,3-DCP sebesar 0.05 mg/kg pada hydrolyzed vegetable protein (HVP) dalam makanan (basis kering). Meski demikian, berbagai studi menunjukkan perhatian yang lebih besar pada 3-MCPD. Hal tersebut karena jumlah 3-MCPD sebagai senyawa kloropropanol pada pangan dan kemasan pangan jauh lebih besar dibandingkan 1,3-DCP maupun isomer kloropropanol lainnya, 2-MCPD dan 2,3-DCP (Wenzl et al. 2007).
Persentase Migrasi 3-MCPD dari Kertas Dupleks ke Simulan Pangan
Penggunaan kertas daur ulang sebagai kemasan primer pangan telah lama dilakukan. Kemasan yang terbuat dari kertas daur ulang tersebut diperuntukkan bagi jenis bahan pangan kering seperti tepung, biji-bijian, garam, gula, beras dan pasta. Untuk jenis bahan pangan cair dan semi padat, umumnya dilakukan laminasi menggunakan material plastik sebagai penghalang antara kertas dan bahan pangan (Binderup et al. 2002).
Pada prakteknya, sering ditemukan kertas dupleks tanpa laminasi plastik di bagian dalam, bersentuhan langsung dengan bahan pangan yang dikemas. Pada Gambar 13 Pocas et al. (2011) menjelaskan, dalam situasi tersebut senyawa dalam
22
kemasan kertas dapat bermigrasi ke makanan melalui kontak langsung (a) atau tidak langsung melalui fase gas antara materi permukaan dan permukaan makanan (b). Migrasi dapat terjadi tidak hanya dari bahan kemasan primer, tetapi juga dari kemasan sekunder, biasanya kertas atau karton bergelombang meskipun telah diantisipasi tidak bersentuhan langsung dengan makanan, senyawa organik volatil dan semi volatil dalam kemasan sekunder tersebut mungkin bermigrasi melalui kemasan primer ke makanan. Migrasi senyawa dari permukaan luar kemasan yang tidak dimaksudkan untuk kontak dengan makanan, seperti komponen dari tinta cetak juga dapat terjadi, melalui matriks serat selulosa ke dalam makanan (c) atau kondisi ketika karton lipat ditumpuk atau gulungan kertas disimpan (d).
Pada penelitian ini uji migrasi dilakukan menggunakan desain migrasi single cell, bertujuan untuk mendekati kondisi migrasi sesungguhnya, dimana bahan pangan kontak langsung dengan bagian dalam kemasan kertas dupleks sebagai kemasan primer. Uji migrasi dilakukan pada kondisi terakselerasi yaitu suhu 40oC selama 24 jam, di mana umumnya penyimpanan makanan dengan kertas dupleks biasanya tidak lebih dari 12 jam pada suhu ruang.
Simulan pangan yang digunakan dalam uji migrasi ini mewakili setiap tipe pangan. 10% etanol mensimulasikan pangan berair dan asam (Tipe I, II, IVB, VIB dan VIIB), 50% etanol mensimulasikan jenis pangan dengan kandungan alkohol rendah hingga tinggi (Tipe VIA dan VIC), sementara minyak jagung mewakili jenis makanan berlemak (Tipe III, IVA, V, VIIA dan IX). Hasil uji migrasi dapat dilihat pada Tabel 7.
Dari hasil uji migrasi 3-MCPD dari kertas dupleks (sampel E) ke simulan pangan diperoleh nilai persentase migrasi tertinggi terdapat pada simulan pangan etanol 10% diikuti oleh simulan pangan etanol 50%. Sementara nilai persentase migrasi terendah terdapat pada simulan pangan minyak jagung, berbeda nyata pada taraf uji 5% dari kedua simulan pangan sebelumnya. Hasil uji migrasi tersebut telah diduga sebelumnya berdasarkan polaritas komponen 3-MCPD yang cenderung polar, sehingga kontak langsung pada simulan pangan yang lebih polar akan menghasilkan persentase migrasi 3-MCPD yang lebih tinggi pula. Sebaliknya pada simulan pangan minyak jagung, nilai persentase migrasinya lebih rendah.
Kadar 3-MCPD yang ditemukan pada ketiga jenis simulan pangan dengan kisaran 334 ppb hingga 475 ppb jauh melebihi batas regulasi BPOM yang mensyaratkan batas maksimal kandungan 3-MCPD dalam makanan cair atau padat yang mengandung protein nabati terhidrolisis asam, sebesar 20 dan 50 ppb. Tingginya kadar 3-MCPD yang ditemukan pada ketiga jenis simulan pangan hasil penelitian antara lain disebabkan oleh penggunaan jenis simulan pangan dalam uji migrasi.
Tabel 7 Hasil uji migrasi 3-MCPD dari kertas dupleks ke simulan pangan
23
Kelarutan komponen 3-MCPD dalam simulan pangan cair lebih tinggi dibandingkan dengan simulan pangan solid atau semi solid. Di samping itu penggunaan sistem uji migrasi single side extraction lebih tepat diterapkan pada kemasan kertas yang dilaminasi plastik atau material pelapis lainnya. Tanpa adanya penghalang, seluruh komponen 3-MCPD pada kemasan kertas dupleks akan terekstrak, sehingga hasil uji migrasi akan setara dengan sistem immersion (perendaman).
Menurut Triantafyllou et al. (2007), idealnya simulan pangan yang digunakan pada studi migrasi dari kertas dan karton merupakan bahan adsorben solid yang menyerupai kontak dengan bahan pangan kering. Tenax® (modified poluphenylene oxide) merupakan simulan yang sering digunakan dalam studi migrasi pada makanan berlemak dalam suhu tinggi. Perilaku migrasi komponen dari kemasan kertas ke Tenax® mendekati migrasi komponen ke makanan kering yang sesungguhnya seperti pasta, gula, tepung, susu bubuk dan biji-bijian. Konsentrasi kesetimbangan migrasi yang diperoleh pada penggunaan Tenax® sedikit lebih tinggi dibandingkan bahan pangan sesungguhnya, mengindikasikan hasil yang diperoleh pada uji migrasi menggunakan Tenax® lebih aman.
Meski dalam penelitian ini terdapat sejumlah keterbatasan pada tahap uji migrasi 3-MCPD dari kemasan kertas dupleks ke simulan pangan, sehingga menghasilkan konsentrasi yang lebih tinggi dari seharusnya, namun tidak dapat mengabaikan kewaspadaan terhadap bahaya penggunaan kertas dupleks sebagai kemasan pangan primer khususnya bahan pangan cair dan semi solid. Di samping komponen 3-MCPD, terdapat sejumlah komponen kimia lain yang telah diketahui memiliki resiko bahaya terhadap kesehatan (Parigoridi et al. 2010).
Untuk mengurangi resiko migrasi kontaminan pada bahan pangan yang dikemas dengan kemasan kertas dupleks, salah satu cara yang efektif dilakukan adalah dengan memberikan laminasi pada bagian dalam kemasan yang kontak dengan bahan pangan. Pace dan Hartman (2010) membuktikan, 3-MCPD yang terdeteksi dalam satuan ppm pada kemasan karton yang dilaminasi polietilen, hanya bermigrasi dalam sejumlah kecil satuan ppb ke bahan pangan.
5
SIMPULAN DAN SARAN
Simpulan
24
Saran
1. Perlu dilakukan penyempurnaan metode dalam uji migrasi komponen 3-MCPD dari kertas kemasan ke bahan pangan, dalam hal sistem uji migrasi dan simulan pangan yang digunakan.
2. Perlu diketahui kadar epiklorohidrin yang digunakan dalam produksi kertas kemasan yang diteliti, sehingga dapat dikaji korelasi kadar epiklorohidrin dan 3-MCPD yang dihasilkan.
3. Penelitian lebih lanjut perlu dilakukan untuk mengetahui kadar dan potensi migrasi 3-MCPD pada jenis kertas kemasan pangan lainnya, serta upaya untuk meminimalisasi migrasi 3-MCPD dari kertas kemasan ke bahan pangan.
DAFTAR PUSTAKA
Abu-El-Haj S, Bogusz MJ, Ibrahim Z, Hassan H, Tufail MA. 2007. Rapid and simple determination of chloropropanols (3-MCPD and 1,3-DCP) in food products using isotope dilution GC-MS. J Food Cont 18: 81-90. DOI: 10.1016/j.foodcont.2005.08.014
[AOAC] Assosiation of Official Agricultural Chemists. 2002. Guidelines for Single Laboratory Validation of Chemical Method for Dietary Supplements and Botanical.
[AOAC] Assosiation of Official Agricultural Chemists, Official Method. 2005. Laboratory Quality Assurance. Official methods of analysis of AOAC International. 18th edition. Appendix E: 1-6. Gaithersburg, Maryland 20877-2417, USA.
Baer I, De-La-Calle B, Taylor P. 2010. 3-MCPD in food other than soy sauce or hydrolysed vegetable protein. J Anal Bioanal Chem. 396(1):443-456. DOI: 10.1007/s00216-009-3177-y.
[BPOM] Badan Pengawas Obat dan Makanan. 2009. Peraturan Kepala Badan POM RI No. HK.00.06.1.52.4011: Penetapan Batas Maksimum Cemaran Mikroba dan Kimia dalam Makanan.
[BPOM] Badan Pengawas Obat dan Makanan. 2011. Peraturan Kepala Badan POM RI No. HK.03.1.23.07.11.6664: Pengawasan Kemasan Pangan.
Binderup ML, Pedersen GA, Vinggaard AM, Rasmussen ES, Rosenquist H, Cederberg T. 2002. Toxicity testing and chemical analyses of recycled fiberbased paper for food contact. J Food Add and Cont. 25: 13–28.
Boden L, Lundgren M, Stensio KE, Gorzynski M. 1997. Determination of 1,3-dichloro-propanol and 3-chloro-1,2-propanediol in papers treated with polyamidoamine-epichlorohydrin wet-strength resins by gas chromatography-mass spectrometry in selective ion monitoring mode. Journal of Chromatography , 788: 195-203.
25 Cho WS, Han BS, Nam KT, Choi M, Kim SH, Jeong J, Jang DD. 2008. Carcinogenicity study of 3-monochloro-propane-1,2-diol in Sprague-Dawley rats. J Food and Chem Toxicology, 46: 3172-3177.
Chung SWC, Kwong KP, Yau JCW, Wong AMC, Xiao Y. 2008. Chloropropanols levels in foodstuffs marketed in Hong Kong. JFCA 21: 569-573. DOI: 10.1016/j.jfca.2008.04.010.
Coles R, Dowell DM, Kirwan MJ. 2007. Food Packaging Technology. London: Blackwell Publishing, CRC Press.
Codex Stan 193-1995. 2010. Codex general standard for contaminants and toxins in food and feed. Codex standard 193-1995.
Crews C, LeBrunough G, Brereton PA. 2002. Determination of 1,3-dichloropropanol in soy sauces by automated headspace gas chromatography-mass spectrometry. Food Additives and Contaminants, 19(4), 343-349.
EU Standard CEN. 1993. European Committee for Standardization. Paper and board intended to come into contact with foodstuffs – Preparation of a cold water extract. EN 645:1993
[EURACHEM] Working Group. 1998. The fitness for purpose of analytical methods. A laboratory quide to method validation and related topics. Eurachem Guide.
Espy HH. 1995. The mechanism of wet-strength development in paper: a review. Tappi Journal, 78(4), 90-99.
[FDA] Food and Drug Administration. 2007. Guidance for Industry: Preparation of Premarket Submissions for Food Contact Substances: Chemistry Recommendations. Guidance Complience Regulatory Information.
Ginebreda A, Guillen D, Barcelo D, Darbra RM. 2011. Additives in paper industry. In: Bilitewski B, Darbra RM, Barcelo D, editors. Global Risk-Based Management of Chemical Additives I: Usage and Environmental Occurance. The Handbook of Environmental Chemistry. Heidelberg: Springer Berlin. Hamlet CG, Sutton PG. 1997. Determination of chloropropanols 3-MCPD and
2-MCPD in hydrolyzed vegetable proteins and seasonings using gas chromatography/ion trap mass spectrometry. Journal Rapid Communications in Mass Spectrometry, 11: 1417-1424.
Hamlet CG, Sadd PA, Crews C, Velisek J, Baxter DE. 2002. Occurrence of 3-MCPD and related compounds in foods: a review. Food Additives and Contaminants. 19(7):619-631.
Hamlet CG, Sadd PA. 2009. Chloropropanols and chloroesters. In: Stadler RH, Lineback DR, editors. Process Induced Food Toxicants: Occurrence, Formation, Mitigation, and Health Risks. Hoboken, NJ:Wiley. P 175
Liu WY. 2012. Development and Validation of an Improved Method for Determination of Chloropropanols in Paperboard Food Packaging by GC-MS [Thesis]. Rutgers University. New Brunswick, New Jersey, USA.
Pace GV, Hartman, TG. 2010. Migration studies of 3-chloro-1,2-propanediol in polyethylene extrusion-coated paperboard food packaging. J Food Addit Contam: Part A, 27(6): 884-891. DOI:10.1080/19440041003636653.
26
Pocas MF, Jorge CO, Joel RP, Rainer B, Timothy H. 2011. Modelling migration from paper into a food stimulant. J Food Cont 22: 303-312. DOI: 10.1016/j.foodcont.2010.07.028.
Razak RA, Kuntom A, Siew WL, Ibrahim NA, Ramli MR, Hussein R, Nesaretnam K. 2012. Detection and monitoring of 3-monochloropropane-1,2-diol (3-MCPD) esters in cooking oils. J Food Cont 25: 355-360. DOI: 10.1016/j.foodcont.2011.10.058.
Suciu NA, Tiberto F, Vasileiadis S, Lamastra L, Trevisan M. 2013. Recycled paper-paperboard for food contact materials: Contaminant suspected and migration into foods and food stimulant. J Food Chem 141:4146-4151. DOI: 10.1016/j.foodchem.2013.07.014
Stadler RH, Lineback DR. 2009. Process-induced food toxicants. Occurrance, formation, mitigation and health risks. A John Wiley & Sons, Incc., Publication. Hoboken, New Jersey.
Triantafyllou VI, Demertzi KA, Demertzis PG. 2007. A study on the migration of organic pollutants from recycled paperboard packaging materials to solid food
matrices. J Food Chem. 101: 1759-1768. DOI:
10.1016/j.foodchem.2006.02.023.
Wenzl T, Lachenmeier DW, Gokmen V. 2007. Analysis of heat-induced contaminants (acrylamide, chloropropanols and furan) in carbohydrate-rich food. J Anal Bioanal Chem. 389(1):119–137.
27 Lampiran 1. Hasil analisa statistika uji sidik ragam kadar 3-MCPD pada sampel
kertas dupleks menggunakan SPSS seri 17.0
Oneway
Descriptives
N Mean Std.
Deviation Std. Error
95% Confidence Interval
for Mean
Minimum Maximum Lower
Bound
Upper
Bound
Kertas Virgin 2 774,81688 2,631512 1,860760 751,17368 798,46008 772,956 776,678
Sampel A 2 795,95805 8,171397 5,778050 722,54096 869,37514 790,180 801,736
sampel B 2 753,43070 10,108516 7,147800 662,60929 844,25211 746,283 760,579
sampel C 2 800,37711 53,941591 38,142465 315,73114 1285,02307 762,235 838,520
sampel D 2 787,45650 3,595638 2,542500 755,15097 819,76203 784,914 789,999
sampel E 2 825,36460 2,808487 1,985900 800,13135 850,59785 823,379 827,351
Total 12 789,56731 28,668068 8,275758 771,35248 807,78213 746,283 838,520
ANOVA
Sum of Squares df Mean Square F Sig.
Between Groups 5934,049 5 1186,810 2,292 ,171
Within Groups 3106,390 6 517,732
28
Lampiran 2. Hasil analisa statistika uji sidik ragam kadar migrasi 3-MCPD dari sampel kertas dupleks E ke simulan pangan menggunakan SPSS versi 17.0
10% Etanol 3 475,48493 7,534955 4,350308 456,76707 494,20280 470,857 484,180
50% Etanol 3 449,10073 17,816639 10,286441 404,84175 493,35972 437,823 469,641
Minyak Jgg 3 334,72493 10,859143 6,269529 307,74933 361,70054 323,496 345,172
Total 9 419,77020 65,741526 21,913842 369,23679 470,30361 323,496 484,180
ANOVA
Sum of Squares df Mean Square F Sig.
Between Groups 33591,327 2 16795,664 102,386 ,000
Within Groups 984,258 6 164,043
Means for groups in homogeneous subsets are displayed.
29
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 27 November 1980, dari pasangan Bapak Sugito dan Ibu Ani Sulastri. Penulis merupakan anak kedua dari tiga bersaudara. Penulis mengenyam pendidikan Sekolah Menengah Atas di SMA Negeri 1 Bogor hingga tahun 1998. Pada tahun yang sama penulis diterima pada jenjang pendidikan sarjana di Jurusan Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor melalui jalur USMI, dan menyelesaikan pendidikan sarjana pada tahun 2003.
Penulis bekerja sebagai Staf Direktorat Budidaya dan Pascapanen Sayuran dan Tanaman Obat, Ditjen Hortikultura, Kementerian Pertanian sejak tahun 2005. Pada tahun 2011 penulis memperoleh beasiswa pendidikan pascasarjana dari Badan Penyuluhan dan Pengembangan SDM Pertanian, Kementerian Pertanian.