i
AKTIVITAS IMUNOSTIMULAN EKSTRAK BUAH BAKAU
HITAM (Rhizophora mucronata) SECARA IN VIVO
PADA TIKUS (Rattus norvegicus)
INTAN NABILLA SARI
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
iii
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Aktivitas Imunostimulan Ekstrak Buah Bakau Hitam (Rhizophora mucronata) secara In Vivo
pada Tikus (Rattus norvegicus) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2016
Intan Nabilla Sari
v
ABSTRAK
INTAN NABILLA SARI. Aktivitas Imunostimulan Ekstrak Buah Bakau Hitam (Rhizophora mucronata)secara In Vivo pada Tikus (Rattus norvegicus). Dibimbing oleh SRI PURWANINGSIH dan EKOWATI HANDHARYANI.
Tubuh dengan sistem imun yang baik dapat menghindari terserangnya penyakit, membantu perlawanan terhadap bakteri, virus, fungi, dan memperbaiki sel yang rusak. Buah bakau (Rhizophora mucronata) diketahui memiliki aktivitas antioksidan tinggi, hepatoprotektif, dan anti hiperglikemik. Penelitian bertujuan mengetahui aktivitas imunostimulan ekstrak kasar buah bakau hitam (Rhizophora mucronata) menggunakan dosis 7,5; 15; dan 30 mg/kg BB yang diberikan secara kontinu selama 14 hari dengan menganalisis senyawa aktif, perubahan berat badan, gambaran histopatologi limpa dan hati, dan perhitungan jumah sel limfoid. Hasil penelitian didapatkan perlakuan ekstrak memberikan efek peningkatan sistem imun. Aktivitas imunostimulan terbaik dan dosis aman yaitu
dosis 7,5 mg/kg BB dengan peningkatan jumlah sel limfoid limpa 233±10,77 sel/obyektif 100. Senyawa flavonoid, saponin, dan steroid diduga
mempengaruhi sistem imun. Gambaran histopatologi limpa dan hati perlakuan terpilih menunjukkan adanya kesiagaan tubuh dalam menghadapi rangsangan benda asing.
Kata kunci : buah bakau hitam (Rhizophora mucronata), flavonoid, saponin, sistem imun, steroid
ABSTRACT
INTAN NABILLA SARI. Immunostimulant Activities of Hypocotyls Black Mangrove (Rhizophora mucronata Lamk.) Extract in Rats (Rattus norvegicus) with In Vivo Methods. Supervised by SRI PURWANINGSIH and EKOWATI HANDHARYANI.
The body with a great immune system can prevent attack of the diseases, help the resistance to bacteria, viruses, fungi, and repairing damaged cells. The hypocotyls of mangrove (Rhizophora mucronata) is known have a high antioxidant activity, hepatoprotective, and anti- hyperglycemia. The research aims to know the immunostimulant activity of hypocotyls black mangrove (Rhizophora mucronata) extracts at doses 7.5; 15; and 30 mg/kg body weight given continuously for 14 days by analyzing the active compounds, weight changes, the images of the histopathology of the spleen and liver, and calculation of lymphoid cell number. The results of the research found the treatment extracts increase the immune system. The best treatment to boost the immune system at dose 7.5 mg/kg body weight with the number of lymphoid spleen at 233±10,77 cell/objective of 100. Flavonoid, saponin and steroid allegedly affected the immune system. The depiction of the histopathology of the spleen and liver at selected dose showed a stalwart body to against the effects of the stimulus of foreign objects.
vii
© Hak Cipta Milik IPB, Tahun 2016 Hak Cipta Dilindungi Undang-Undang
ix
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Teknologi Hasil Perairan
AKTIVITAS IMUNOSTIMULAN EKSTRAK BUAH BAKAU
HITAM (Rhizophora mucronata) SECARA IN VIVO
PADA TIKUS (Rattus norvegicus)
INTAN NABILLA SARI
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
xi
Disetujui oleh
Dr Ir Sri Purwaningsih, MSi Prof drh Ekowati Handharyani, MSi PhD APVet
Pembimbing I Pembimbing II
Diketahui oleh
Prof Dr Ir Joko Santoso, MSi Ketua Departemen
Tanggal Lulus :
Judul Skripsi : Aktivitas Imunostimulan Ekstrak Buah Bakau Hitam (Rhizophora mucronata) secara In Vivo pada Tikus (Rattus norvegicus)
Nama : Intan Nabilla Sari
NIM : C34110051
xiii
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala karunia-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Aktivitas Imunostimulan Ekstrak Buah Bakau Hitam (Rhizophora mucronata)secara In Vivo
pada Tikus (Rattus norvegicus)”. Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dalam proses penulisan skripsi ini, terutama kepada:
1 Dr Ir Sri Purwaningsih, MSi dan Prof drh Ekowati Handharyani, MSi PhD APVet selaku dosen pembimbing, terima kasih atas segala saran, bimbingan, arahan, motivasi, dan ilmu yang diberikan kepada penulis, 2 Dr Ir Iriani Setyaningsih, MS selaku dosen penguji, atas segala
bimbingan dan arahan yang diberikan kepada penulis,
3 Dr Desniar, SPi MSi selaku Gugus Kendali Mutu (GKM) atas segala bimbingan dan arahan yang diberikan kepada penulis,
4 Prof Dr Ir Joko Santoso, MSi selaku Ketua Departemen Teknologi Hasil Perairan,
5 Orang Tua Ir Kasman dan Sri Handayani, SH serta seluruh keluarga tersayang atas segala dukungan moril, materil, doa, dan kasih sayangnya,
6 Staf Laboratorium Biokimia Hasil Perairan Departemen Teknologi Hasil Perairan, Staf Laboratorium Histopatologi Fakultas Kedokteran Hewan, Staf Rumah Sakit Hewan, Sekretaris bagian Patologi, Staf Laboratorium Terpadu Seafast Center PAU, Institut Pertanian Bogor, 7 Rekan selama penelitian yang telah membantu dan memberikan
motivasi Haris Achmad Nugrahadi, SPi; Eka Deskawati, SSi MPi; Indah Ria Lestari, SPi dan teman-teman (Nuraisya, Iman, Wekson, Fianita, Siti, Shindy, Bagja, Bram),
8 Keluarga besar Teknologi Hasil Perairan angkatan 48 dan 49, Jakarta Community, Dearest, Serdadu, Keluarga Cemara, dan S-Two atas dukungan dan kerjasamanya.
Penulis menyadari bahwa skripsi ini memiliki banyak kekurangan. Penulis mengharapkan saran dan kritik yang bersifat membangun untuk perbaikan skripsi ini. Semoga tulisan ini bermanfaat bagi semua pihak yang memerlukannya.
Bogor, Oktober 2015
xvi
DAFTAR TABEL
1 Morfometrik buah bakau hitam (Rhizophora mucronata) ... 12
2 Komposisi kimia buah bakau hitam (Rhizophora mucronata) ... 13
3 Komponen aktif ekstrak... 15
4 Hasil pengamatan mikroskopis limpa dengan pewarnaan HE ... 18
5 Hasil pengamatan mikroskopis hati dengan pewarnaan HE ... 21
DAFTAR GAMBAR
1 Diagram alir prosedur penelitian tahap pertama... 52 Diagram alir prosedur penelitian tahap kedua ... 7
3 Pengukuran morfometrik buah bakau hitam (Rhizophora mucronata) ... 12
4 Gambaran histopatologi limpa tikus model ... 19
5 Gambaran histopatologi hati tikus model ... 22
6 Jumlah sel limfoid limpa dengan obyektif 100 ... 25
7 Perubahan berat badan tikus model selama pemberian dosis ... 26
DAFTAR LAMPIRAN
1 Perhitungan jumlah tikus perkelompok ... 352 Tabel konversi dosis ... 35
3 Perhitungan dosis ... 35
4 Konversi umur tikus ... 36
5 Data morfometrik buah bakau ... 37
6 Perhitungan analisis proksimat ... 38
7 Perhitungan rendemen buah bakau ... 39
8 Hasil analisis fitokimia ... 40
9 Data sel limfoid limpa tikus perlakuan ... 42
10 Data berat badan tikus perlakuan (n=25) ... 43
11 Perhitungan survival rate... 44
12 Selisih berat badan hewan uji ... 44
1
PENDAHULUAN
Latar Belakang
Penggunaan bahan alami dalam bidang kesehatan telah berkembang dengan sangat pesat di dunia. Indonesia adalah negara yang masih tetap memanfaatkan bahan alami dalam upaya pelayanan kesehatan disamping penggunaan obat berbahan baku sintetik. Obat berbahan alami mulai banyak dipilih karena mulai terciptanya kesadaran akan pentingnya penggunaan bahan alami, karena dapat tercerna dengan baik oleh tubuh, dan kurang memberikan efek samping dibanding obat sintetik (Hargono 1996), serta berperan dalam upaya pemeliharaan, peningkatan, dan pemulihan kesehatan serta pengobatan penyakit.
Keanekaragaman hayati Indonesia berpotensi dalam penyediaan berbagai obat-obatan alami, maupun pangan fungsional yang salah satunya berasal dari flora (tumbuh-tumbuhan), baik di darat maupun di perairan. Mangrove salah satu ekosistem pesisir yang mempunyai peranan penting di daerah estuari. Mangrove memiliki banyak fungsi ekologi dan diyakini dapat digunakan sebagai bahan dalam pembuatan obat-obatan alami. Umumnya tumbuhan mangove yang banyak tumbuh di daerah tropis dan subtropis adalah Rhizophora mucronata, Rhizophora stylosa, Rhizophora apiculata, dan Rhizophora mangle. Tumbuhan ini biasa dijadikan sebagai bahan dalam pembuatan obat herbal. Suganthy et al. (2014) menyatakan, tumbuhan Rhizophora telah dijadikan sebagai obat alami di kawasan timur dan selatan Asia.
Rhizophora mucronata merupakan pohon bakau dari Genus Rhizophora dan Famili Rhizophoraceae yang lebih dikenal dengan sebutan bakau hitam. Tanaman ini toleran terhadap substrat berpasir dan seringkali ditemukan didaerah pasang surut air laut. Jenis bakau ini mudah sekali tumbuh dan dikembangkan (FAO 2000). Hasil penelitian Hidayatullah dan Aziz (2013) menunjukkan bahwa tanaman
Rhizophora mucronata dapat tumbuh 14,05 – 25,73 m dalam kurun waktu satu tahun.
Penelitian terkait buah bakau (Rhizophora mucronata) belum banyak dilakukan, penelitian ini menggunakan buah bakau (Rhizophora mucronata) matang sebagai bahan baku utama. Hasil penelitian Purwaningsih et al. (2013)a, ekstrak etanol buah bakau hitam (Rhizophora mucronata) memiliki nilai IC50
antioksidan yang sangat tinggi sebesar 0,72 ppm, lebih besar dari antioksidan standar yaitu vitamin C sebesar 4.81 ppm. Ekstrak buah bakau hitam (Rhizophora mucronata) yang telah dijadikan sirup memiliki IC50 efektif pada dosis
15 mg/kg BB tikus. Hasil ekstrak etanol buah bakau hitam (Rhizophora mucronata) pada penelitian Purwaningsih et al. (2013)b menunjukkan adanya aktivitas hepatoprotektif pada dosis 5 mg/kg BB tikus. Hasil pengujian toksisitas sub akut menurut Purwaningsih et al. (2015) ekstrak etanol hipokotil buah bakau hitam (Rhizophora mucronata) menunjukkan tidak terjadi perubahan karakteristik fisik dan profil biokimia darah pada seluruh kelompok tikus dengan pemberian dosis
aman yang disarankan yaitu 15 mg/kg BB. Ekstrak buah bakau hitam (Rhizophora mucronata) aman jika dikonsumsi pada dosis yang tepat.
2
imunostimulan. Imunostimulan merupakan substansi khusus yang memiliki kemampuan untuk meningkatkan perlawanan terhadap infeksi penyakit terutama oleh sistem fagositik, mengurangi infeksi, mengatasi imunodefisiensi, dan merangsang pertumbuhan sel pertahanan tubuh secara alami.
Imunostimulan diberikan dalam jangka waktu pendek yang dapat berperan sebagai stimulir prekursor limfosit T pada sistem imun mamalia dan meningkatkan aktivitas makrofag sebagaimana peningkatan level enzim neutrofil (Baratawidjaja 2002). Menurut Petrunov et al. (2007), imunostimulan bekerja dengan cara menstimulasi faktor utama sistem imun, antara lain melalui fagositosis, sistem komplemen, sekresi antibodi IgA dan IgG, pelepasan interferon α dan , limfosit T dan B, sintesis antibodi spesifik dan sitokin, dan sintesis surfaktan paru-paru. Bahan yang menunjukkan aktivitas imunostimulasi disebut dengan imunostimulator.
Sistem imun yang kurang baik atau mudah turun dapat menyebabkan
mudahnya benda asing masuk dan menyerang tubuh. Penelitian Sutiman dan Eli (2010) menyatakan Rhizophora mucronata mengandung senyawa
alkaloid, saponin, flavonoid, triterpenoid, steroid, tanin dan fenol. Buah bakau hitam diduga memiliki aktivitas imunostimulan karena senyawa aktif yang dimiliki. Senyawa aktif yang dapat meningkatkan sistem kekebalan tubuh yaitu saponin, flavonoid, dan steroid.
Pengujian antioksidan pada penelitian Purwaningsih et al. (2013)a menunjukkan bahwa buah bakau hitam (Rhizophora mucronata) memiliki antioksidan yang tinggi. Menurut Hughes (2002) sistem kekebalan tubuh rentan terhadap kerusakan oksidatif, hal ini disebabkan karena sel imun memproduksi komponen-komponen reaktif sebagai bagian dari mekanisme pertahanan tubuh. Efektivitas kerja sistem imun sangat bergantung pada komunikasi antar sel melalui reseptor membran terikat dimana sel membran mengandung asam lemak tidak jenuh (PUFA) yang jika terperoksidasi oleh Reactive Oxygen Species (ROS) dapat mereduksi ekspresi reseptor sel membran. Antioksidan pada sistem pertahanan tubuh banyak terdapat pada sel darah putih yang dapat membantu perlawanan terhadap infeksi benda asing. Penelitian Purwaningsih et al. (2015) menunjukkan bahwa terjadi kenaikan berat badan tikus percobaan akibat pemberian ekstrak buah bakau hitam pada dosis 15 mg/kg BB, dimana diduga terjadi peningkatan sistem imun yang berkorelasi dengan daya cerna pakan hewan model.
Penelitian ini perlu dilakukan untuk mengetahui aktivitas kandungan aktif ekstrak buah bakau hitam (Rhizophora mucronata) sebagai imunostimulator untuk meningkatkan sistem imun tubuh. Penggunaan hewan model mamalia yaitu tikus dimaksudkan sebagai tahap awal pengujian kandungan aktif yang kedepannya dapat dikembangkan sebagai obat herbal.
Perumusan Masalah
3
aktivitas imunostimulan pada ekstrak buah bakau hitam (Rhizophora mucronata) belum pernah dilakukan sebelumnya. Pengunaan ekstrak buah bakau hitam dilakukan pada tikus sebagai representatif pengujian tahap awal.
Tujuan
Penelitian ini bertujuan untuk menentukan aktivitas imunostimulan dari ekstrak kasar buah bakau hitam (Rhizophora mucronata) menggunakan dosis 7,5; 15; dan 30 mg/kg BB yang diberikan secara kontinu selama 14 hari secara in vivo. Tujuan khusus yang ingin dicapai dalam penelitian ini, antara lain:
1 Menentukan rendemen ekstrak kasar etanol dari buah bakau hitam,
2 Menentukan komponen aktif yang terkandung dalam ekstrak kasar etanol buah bakau hitam,
3 Menguji aktivitas imunostimulan ekstrak kasar etanol buah bakau hitam
terhadap tikus model Sprague Dawley dengan tipe jaringan normal (tanpa induksi patogen atau antigen),
4 Mendapatkan gambaran perubahan organ limpa dan hati setelah pemberian ekstrak,
5 Mendapatkan perhitungan jumlah sel limfoid limpa,
6 Mendapatkan dosis aman penggunaan ekstrak kasar buah bakau hitam sebagai agen imunostimulan.
Manfaat
Manfaat penelitian ini adalah dapat memberikan informasi mengenai aktivitas imunostimulan ekstrak kasar buah bakau hitam (Rhizophora mucronata) dengan pengukuran parameter karateristik fisik dan tingkat stimulasi pada limpa, dan hati sebagai representatif pengujian. Hasil penelitian diharapkan dapat menjadi sumber informasi baru dalam industri farmasi.
Ruang Lingkup Penelitian
4
METODE PENELITIAN
Penelitian “Aktivitas Imunostimulan Ekstrak Buah Bakau Hitam (Rhizophora mucronata) secara In Vivo pada Tikus (Rattus norvegicus)” dilakukan dalam jangka waktu delapan bulan (Januari - Agustus 2015). Rincian pelaksanaan yaitu 7 hari persiapan penelitian dan pengambilan sampel, 6 minggu proses ekstraksi, 21 hari persiapan penelitian, 6 minggu proses aklimatisasi tikus model, 14 hari perlakuan induksi ekstrak buah bakau hitam, 4 minggu prosedur analisis imunostimulan, dan 5 minggu analisis hasil. Penelitian ini dilaksanakan di beberapa laboratorium, antara lain Laboratorium Biokimia Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor; Laboratorium Terpadu Seafast Center, PAU, Institut Pertanian Bogor; Laboratorium Terpadu Biofarmaka, Institut Pertanian Bogor; Laboratorium Kimia Analitik, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor; Laboratorium Riset dan Teknologi; dan Laboratorium Histopatologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor; dan Ruang Fasilitas Hewan Laboratorium, Rumah Sakit Hewan Pendidikan, Institut Pertanian Bogor.
Bahan
Bahan utama yang digunakan adalah buah bakau hitam segar (Rhizophora mucronata) yang diperoleh dari Taman Wisata Air, Pantai Indah Kapuk, Jakarta. Buah bakau hitam dikategorikan matang dengan warna kuning kehijauan dan kotiledon berwarna kuning keemasan berumur ± 5 bulan.
Bahan-bahan yang dibutuhkan untuk ekstraksi yaitu pelarut etanol 95%. Analisis proksimat meliputi akuades, kjeltab jenis selenium, larutan H2SO4 pekat,
NaOH 40%, H3BO3 2% yang mengandung indikator bromocresol green methyl red
(1:2) berwarna merah muda, larutan HCl 0,1 N, pelarut lemak (n-heksana), HCl 10% dan larutan AgNO3 0,1 N. Pereaksi yang digunakan untuk uji fitokimia antara
lain akuades, H2SO4 2 N, pereaksi Meyer (HgCl2, dan KI), pereaksi Wagner (iodin
dan KI), dan pereaksi Dragendorff (bismutsubnitrat, CH3COOH, asam asetat
glasial, dan KI), serbuk magnesium, amil alkohol, alkohol, etanol 70%, FeCl3 5%,
HCl 2 N, kloroform, anhidra asetat, H2SO4 pekat, dan FeCl3 3%. Bahan-bahan yang
digunakan dalam uji aktivitas imunostimulan antara lain tikus Sprague Dawley, akuades, Stimuno Forte, Buffer Neutral Formalin (BNF) 10%, xylol, paraffin,
Mayer’s hematosilin, eosin, lithium, dan alkohol.
Alat
Alat yang digunakan antara lain penggaris (Maped, 50 cm), orbital shaker, labu erlenmeyer (Pyrex), gelas ukur (Pyrex), blender (National), sudip, tabung
reaksi (Pyrex), cawan porselen, aluminium foil, timbangan digital (Sartorius BSA224S), rotary vacuum evaporator (Buchi Vacuum Pump V-700),
5
lambung, mikroskop (Olympus CH20), kamera mikroskop (Olympus DP12),
disecting kit, pipet volumetrik, pipet tetes, gegep, botol vial, kaset jaringan,
dehidration tissue processor, tissue embedding console, water bath
(SB-30T WIGGEN Hauser), gelas obyek, gelas penutup, sentrifuse dingin (J2-21 BECKMAN), inkubator (Yamato IS 900), rak pewarna, kompor listrik,
kertas saring, kapas bebas lemak, penangas air, buret, microtube, spuit (Terumo), labu kjeldahl, destilator, desikator, kondensor, tabung soxhlet, oven, microtome
(Yamato RV – 240).
Prosedur Penelitian
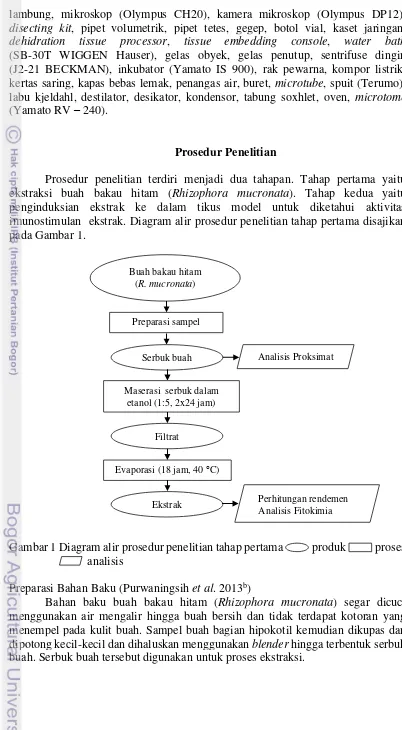
Prosedur penelitian terdiri menjadi dua tahapan. Tahap pertama yaitu ekstraksi buah bakau hitam (Rhizophora mucronata). Tahap kedua yaitu penginduksian ekstrak ke dalam tikus model untuk diketahui aktivitas imunostimulan ekstrak. Diagram alir prosedur penelitian tahap pertama disajikan pada Gambar 1.
Gambar 1 Diagram alir prosedur penelitian tahap pertama produk proses analisis
Preparasi Bahan Baku (Purwaningsih et al. 2013b)
Bahan baku buah bakau hitam (Rhizophora mucronata) segar dicuci menggunakan air mengalir hingga buah bersih dan tidak terdapat kotoran yang menempel pada kulit buah. Sampel buah bagian hipokotil kemudian dikupas dan dipotong kecil-kecil dan dihaluskan menggunakan blender hingga terbentuk serbuk buah. Serbuk buah tersebut digunakan untuk proses ekstraksi.
Buah bakau hitam (R. mucronata)
Preparasi sampel
Serbuk buah
Maserasi serbuk dalam etanol (1:5, 2x24 jam)
Filtrat
Evaporasi (18 jam, 40 °C)
Ekstrak
Analisis Proksimat
Perhitungan rendemen Analisis Fitokimia
6
Ekstraksi Senyawa Aktif (Purwaningsih et al. 2015 yang telah dimodifikasi)
Serbuk buah bakau hitam diekstraksi menggunakan metode maserasi tunggal dengan kecepatan 175 rpm. Serbuk halus diekstrak dengan menggunakan pelarut yaitu etanol 95%. Serbuk buah bakau sebanyak 1000 g direndam dalam pelarut etanol sebanyak 2500 mL dalam labu erlenmeyer selama 24 jam dengan perbandingan 1:2,5 (b/v). Filtrat hasil maserasi disaring menggunakan kertas saring
Whatman no.42. Residu direndam kembali menggunakan pelarut sebanyak 2500 mL dan dimaserasi selama 24 jam. Filtrat dihilangkan pelarutnya menggunakan rotary vacuum evaporator pada suhu 40 ºC selama 18 jam. Hasil ekstrak kasar kemudian ditimbang untuk mendapatkan rendemen ekstraknya. Hasil ekstrak disimpan dalam botol vial yang ditutup aluminium foil sampai digunakan untuk induksi tikus uji. Ekstrak ditimbang beratnya dan dihitung rendemen ekstraknya dengan rumus:
Rendemen % =Berat ekstrak (g)Berat sampel (g) ×100%
Induksi Ekstrak pada Tikus Sprague Dawley
Proses penginduksian diawali dengan aklimatisasi tikus model. Aklimatisasi merupakan proses adaptasi hewan model dengan lingkungan baru sebelum digunakan untuk tujuan penelitian. Aklimatisasi dilakukan selama 36 hari dengan pakan standar Rumah Sakit Hewan IPB dan air dengan sistem ad libitum
yang berjumlah 32 ekor. Tikus diaklimatisasi hingga mencapai berat rata-rata ± 200 g dengan umur 10 minggu yang berasal dari Badan Pengawas Obat dan Makanan (Badan POM), Jakarta. Hewan model disortir menjadi 25 ekor dengan kriteria tikus sehat berdasarkan Hendarsula (2011) yaitu mata merah menonjol, bulu tidak berdiri, tidak terjadi penurunan berat badan dan lincah kemudian dikelompokan menjadi lima kelompok (n=5) berdasarkan rumus Federer (Lampiran 1), lalu ditempatkan dalam boks plastik. Dosis ditetapkan sebelum proses induksi berlangsung.
Penentapan dosis awal mengacu pada penelitian Purwaningsih et al. (2015) dan perhitungan dosis serta konversi imunostimulan komersial disajikan pada Lampiran 2 dan Lampiran 3, dimana pada dosis 15 mg/kg BB terjadi peningkatan berat badan yang menjadi penduga adanya reaksi ekstrak sebagai imunostimulan. Kelompok perlakuan adalah sebagai berikut:
Kelompok 1 : Tikus kontrol diberikan akuades secara oral
7
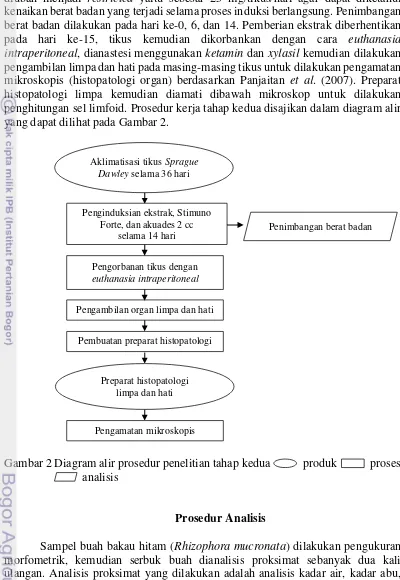
Induksi ekstrak dilakukan selama 14 hari. Sistem pakan yang diberikan diubah menjadi restricted yaitu sebesar 25 mg/tikus/hari agar dapat diketahui kenaikan berat badan yang terjadi selama proses induksi berlangsung. Penimbangan berat badan dilakukan pada hari ke-0, 6, dan 14. Pemberian ekstrak diberhentikan pada hari ke-15, tikus kemudian dikorbankan dengan cara euthanasia intraperitoneal, dianastesi menggunakan ketamin dan xylasil kemudian dilakukan pengambilan limpa dan hati pada masing-masing tikus untuk dilakukan pengamatan mikroskopis (histopatologi organ) berdasarkan Panjaitan et al. (2007). Preparat histopatologi limpa kemudian diamati dibawah mikroskop untuk dilakukan penghitungan sel limfoid. Prosedur kerja tahap kedua disajikan dalam diagram alir yang dapat dilihat pada Gambar 2.
Gambar 2 Diagram alir prosedur penelitian tahap kedua produk proses analisis
Prosedur Analisis
Sampel buah bakau hitam (Rhizophora mucronata) dilakukan pengukuran morfometrik, kemudian serbuk buah dianalisis proksimat sebanyak dua kali ulangan. Analisis proksimat yang dilakukan adalah analisis kadar air, kadar abu, kadar protein, kadar lemak, dan kadar karbohidrat (by difference). Proses ekstraksi sampel dilakukan untuk mendapatkan ekstrak kasar buah bakau hitam (Rhizophora mucronata) dan diuji kandungan aktif bahan, sehingga dapat dilakukan analisis aktivitas imunostimulan. Analisis aktivitas imunostimulan
Aklimatisasi tikus Sprague Dawley selama 36 hari
Penginduksian ekstrak, Stimuno Forte, dan akuades 2 cc
selama 14 hari
Pengorbanan tikus dengan
euthanasia intraperitoneal
Pengambilan organ limpa dan hati
Pembuatan preparat histopatologi
Preparat histopatologi limpa dan hati
Pengamatan mikroskopis
Penimbangan berat badan
8
dilakukan dengan beberapa analisis yang meliputi pengukuran berat badan tikus model, analisis histopatologi limpa dan hati, dan analisis jumlah sel limfoid limpa.
Pengukuran Morfometrik Sampel (Purwaningsih et al. 2015)
Tiga puluh sampel buah bakau dilakukan pengukuran morfometrik yang meliputi pengukuran panjang, lebar, dan berat buah. Pengukuran morfometrik dilakukan sebanyak tiga kali ulangan untuk setiap parameter uji.
Analisis Proksimat
a) Analisis kadar air (AOAC 2005)
Analisis kadar air dilakukan diawali dengan pengeringan porselen menggunakan oven bersuhu 105 ºC selama 60 menit. Cawan kemudian diletakkan ke dalam desikator selama ± 15 menit dan didinginkan kemudian ditimbang hingga cawan mencapai berat konstan. Sebanyak 5 g sampel dimasukkan ke dalam cawan, kemudian dilakukan pengeringan menggunakan oven bersuhu 105 ºC selama 5 jam hingga berat konstan. Cawan dengan sampel kemudian didinginkan di dalam desikator dan kemudian ditimbang kembali.
Perhitungan kadar air:
Kadar air % =Berat awal g -Berat akhir gBerat awal g ×100%
b) Analisis kadar abu (AOAC 2005)
Cawan abu porselen dibersihkan dan dikeringkan di dalam oven bersuhu sekitar 105 ºC selama 30 menit. Cawan abu porselen tersebut dimasukkan ke dalam desikator (30 menit) dan kemudian ditimbang. Sampel sebanyak 5 g ditimbang kemudian dimasukkan ke dalam cawan abu porselen. Selanjutnya dibakar di atas kompor listrik sampai tidak berasap dan dimasukkan ke dalam tanur pengabuan dengan suhu 600 ºC selama 7 jam. Cawan dimasukkan di dalam desikator dibiarkan sampai dingin dan kemudian ditimbang.
Perhitungan kadar abu:
Kadar abu % =Berat setelah tanurBerat sampel awalg -Cawan kosongg g ×100%
c) Analisis kadar protein (AOAC 2005)
Tahap-tahap yang dilakukan dalam analisis protein terdiri dari tiga tahap yaitu destruksi, destilasi, dan titrasi. Pengukuran kadar protein dilakukan dengan metode mikro Kjeldahl. Sampel ditimbang sebanyak 0,25 g kemudian dimasukkan ke dalam labu Kjeldahl 100 mL, lalu ditambahkan 0,25 g selenium dan 3 mL H2SO4
pekat. Contoh didestruksi pada suhu 410 ºC selama kurang lebih 1 jam sampai larutan jernih lalu didinginkan. Setelah dingin, ke dalam labu Kjeldahl ditambahkan 50 mL akuades dan 20 mL NaOH 40%, kemudian dilakukan proses destilasi dengan suhu destilator 100 oC. Hasil destilasi ditampung dalam labu erlenmeyer 125 mL
yang berisi campuran 10 mL asam borat (H3BO3) 2% dan 2 tetes indikator
9
Perhitungan kadar protein:
N % = mL HCl-mL blanko ×N HCl×14,007mg sampel ×100% Protein % = N % ×Faktor koreksi (6,β5)
d) Analisis kadar lemak (AOAC 2005)
Sampel seberat 5 g (W1) dimasukkan ke dalam kertas saring pada kedua
ujung bungkus ditutup dengan kapas bebas lemak dan selanjutnya dimasukkan ke dalam selongsong lemak, kemudian sampel yang telah dibungkus dimasukkan ke dalam labu lemak yang sudah ditimbang berat tetapnya (W2) dan disambungkan
dengan tabung Soxhlet. Selongsong lemak dimasukkan ke dalam ruang ekstraktor tabung Soxhlet dan disiram dengan pelarut lemak (n-heksana). Kemudian dilakukan refluks selama 6 jam. Pelarut lemak yang ada dalam labu lemak didestilasi hingga semua pelarut lemak menguap. Pada saat destilasi pelarut akan tertampung di ruang ekstraktor, pelarut dikeluarkan sehingga tidak kembali ke dalam labu lemak, selanjutnya labu lemak dikeringkan dalam oven pada suhu 105
oC, setelah itu labu didinginkan dalam desikator sampai beratnya konstan (W 3).
Perhitungan kadar lemak:
Kadar lemak % =Berat labu dan lemak g -Berat labu kosong (g)Berat sampel (g) ×100%
e) Analisis karbohidrat by difference (AOAC 2005)
Kadar karbohidrat total ditentukan dengan metode by difference yaitu: Karbohidrat (%) = 100% - (kadar air + abu + protein + lemak)
Analisis Fitokimia (Harborne 1987) a) Alkaloid
Pelarutan 1 g sampel dengan beberapa tetes asam sulfat (H2SO4) 2 N.
Pengujian dilakukan menggunakan tiga pereaksi alkaloid yaitu pereaksi Dragendoff, pereaksi Meyer, dan Pereaksi Wagner.
Pereaksi Dragendorff dibuat dengan cara 0,8 g bismutsubnitrat ditambahkan dengan 10 mL asam asetat dan 40 mL air. Larutan ini dicampur dengan larutan yang dibuat dari 8 g KI dalam 20 mL air. Satu volume campuran ini sebelum digunakan diencerkan dengan 2,3 volume asam asetat glasial dan 100 mL air. Pereaksi ini berwarna jingga.
Pereaksi Meyer dibuat dengan cara menambahkan 1,36 g HgCl2 dengan
0,5 g KI lalu dilarutkan dan diencerkan dengan akuades menjadi 100 mL dengan labu takar. Pereaksi ini tidak berwarna.
Pereaksi Wagner dibuat dengan cara 10 mL akuades ditambahkan 2,5 g iodine dan 2 g KI lalu dilarutkan dan diencerkan dengan akuades menjadi 200 mL dalam labu takar. Pereaksi ini berwarna coklat.
Hasil uji dinyatakan positif bila dengan pereaksi Dragendorff terbentuk endapan merah hingga jingga, endapan putih kekuningan dengan pereaksi Meyer dan endapan coklat dengan pereaksi Wagner.
b) Flavonoid
10
c) Fenol hidrokuinon
Sampel sebanyak 1 g diekstrak dengan 20 mL etanol 70%. Larutan yang dihasilkan diambil sebanyak 1 mL kemudian ditambahkan 2 tetes larutan FeCl3 5%.
Adanya senyawa fenol dalam bahan ditunjukkan dengan terbentuknya warna hijau atau hijau biru.
d) Saponin
Saponin dapat dideteksi dengan uji busa dalam air panas. Busa yang stabil selama 30 menit dan tidak hilang pada penambahan 1 tetes HCl 2 N menunjukkan adanya saponin.
e) Steroid
1 g sampel dilarutkan dalam 2 mL kloroform dalam tabung reaksi yang kering. Sampel ditambahkan 10 tetes anhidra asetat dan 3 tetes asam sulfat pekat. Reaksi positif ditunjukkan dengan terbentuknya larutan berwarna merah untuk pertama kali kemudian berubah menjadi biru dan hijau.
f) Tanin
Sampel sebanyak 1 g ditambah pereaksi FeCl3 3%. Adanya warna hijau
kehitaman menandakan suatu bahan mengandung komponen tanin.
Analisis Aktivitas Imunostimulan a) Pengukuran berat badan tikus model
Pengukuran berat badan dilakukan pada hari ke-0, ke-6, dan ke-14 dengan tikus umur 10 minggu dan konversi disajikan pada Lampiran 4. Tikus ditimbang menggunakan timbangan digital untuk hewan dan dicatat perkembangannya. Penimbangan dilakukan sebanyak tiga kali ulangan untuk didapat hasil yang maksimal.
b) Analisis histopatologi limpa dan hati (Panjaitan et al. 2007)
Tujuan dari pengamatan ini adalah untuk mengkonfirmasi kerusakan, daya kerja organ, dan juga mengetahui paparan kerusakan terhadap sel organ tersebut (Kiernan 2008). Pembuatan preparat histopatologi pada organ limpa dan hati dapat dilakukan dengan prosedur sebagai berikut:
Tikus model dinekropsi dengan cara euthanasia intraperitoneal dengan sebelumnya dianastesi menggunakan ketamine dan xylasil, yang selanjutnya dilakukan pengambilan organ limpa dan hati. Organ kemudian difiksasi dengan perendaman didalam larutan buffer neutral formalin (BNF) 10% selama minimal 1 x 24 jam hingga 3 x 24 jam. Organ yang telah difiksasi kemudian dilakukan
trimming atau pemotongan organ dengan ketebalan ± 3 mm yang selanjutnya dimasukkan ke dalam kaset jaringan.
11
sebanyak empat kali (parafin I, parafin II, parafin III, parafin IV) yang dilakukan pada suhu 60 °C selama masing-masing 30 menit.
Kaset jaringan yang telah melalui proses dehidrasi kemudian dilakukan proses pencetakkan (embedding). Potongan organ dimasukkan kedalam selongsong berbentuk persegi selanjutnya diberi paraffin hingga penuh dan dilabel. Pencetakan dilakukan menggunakan parafin wax dengan suhu 65 °C. Proses pencetakan dilakukan dengan menggunakan tissue embedding console.
Sediaan lalu dibekukan dan didinginkan sebelum dilakukan pemotongan dengan menggunakan mikrotom. Pemotongan jaringan dilakukan menggunakan
rotary microtome dengan ketebalan 5 μm. Potongan jaringan sebesar 5 μm
kemudian ditebar diatas water bath berisi air dengan suhu 35 °C. Hasil kemudian ditempelkan pada gelas objek, dan diletakkan vertikal hingga kering lalu disimpan dalam inkubator minimal 2 jam dengan suhu 35 °C agar jaringan melekat pada kaca objek.
Pewarnaan Hematoksilin-Eosin (HE) dilakukan dengan lima tahapan. Tahapan pertama dilakukan proses rehidrasi menggunakan xylol I, II, III dan alkohol 95%, 90%, 80% dan 70% untuk menghilangkan paraffin masing-masing selama tiga menit. Sediaan dilakukan pencucian menggunakan air mengalir selama 10 menit dan dilanjutkan dengan akuades selama 5 menit. Pewarnaan inti kemudian
dilakuan menggunakan Mayer’s hematosilin selama 1 menit, lalu dicuci dengan air mengalir selama 10 menit dan air akuades selama 5 menit. Tahapan ketiga yaitu perendaman dalam lithium agar warna lebih jelas selama 1 menit dan kembali dibilas. Sediaan diwarnai dengan pewarna Eosin selama 5 menit dan dicuci kembali dengan air mengalir selama 10 menit dan air akuades selama 5 menit. Sediaan dilakukan dehidrasi dengan alkohol 70%, 80%, 90% dan 95% masing-masing selama beberapa detik, dan kemudian alkohol 100% I, II dan III masing-masing 2 menit agar air terserap dan menguap. Proses clearing dilakukan dengan xilol I, II dan III untuk menghilangkan air selama 3 menit dan ditutup dengan gelas penutup. c) Analisis jumlah sel limfoid limpa
Preparat histopatologi limpa diamati dibawah mikroskop dengan perbesaran 100 µm. Preparat diletakkan dibawah mikroskop kemudian ditetesi oleh minyak imersi. Penghitungan jumlah sel limfoid dilakukan dengan tiga kali ulangan.
Analisis Data
12
HASIL DAN PEMBAHASAN
Morfometrik Buah Bakau Hitam (Rhizophora mucronata)
Pengukuran morfometrik sampel buah bakau hitam terdiri dari pengukuran panjang, lebar dan berat. Buah bakau hitam (Rhizophora mucronata) segar diseleksi dan diklasifikasi untuk dikategorikan sebagai buah matang berdasarkan pengamatan subyektif. Pengukuran morfometrik ini dilakukan dengan tiga kali ulangan yang diaplikasikan pada 30 buah bakau hitam (Rhizophora mucronata).
Buah bakau Rhizophora mucronata matang dapat diklasifikasikan dengan panjang minimal 30 cm, dan lebar minimal 1 cm (FAO 2000). Buah bakau hitam (Rhizophora mucronata) yang diperoleh dari Taman Konservasi Mangrove, Pantai Indah Kapuk, Jakarta ini memiliki hipokotil yang lurus, silindris, berwarna hijau kecoklatan, dan buah yang dipenuhi bintil-bintil.
Pengukuran panjang buah dimulai dari ujung buah setelah pangkal hipokotil hingga ke ujung buah yang menyerupai tongkat. Pengukuran lebar buah dilakukan dengan mengukur bagian terlebar dengan menggunakan jangka sorong. Contoh pengukuran morfometrik buah bakau hitam (Rhizophora mucronata) dapat dilihat pada Gambar 3 dan data morfometrik dapat dilihat pada Lampiran 5.
Gambar 3 Pengukuran morfometrik buah bakau hitam (Rhizophora mucronata) Sampel buah bakau hitam (Rhizophora mucronata) yang digunakan berjumlah 30 buah yang diperoleh secara selektif dan hasil pengukuran morfometriknya disajikan pada Tabel 1.
Tabel 1 Morfometrik buah bakau hitam (Rhizophora mucronata)
Parameter Nilai rata-rata (cm)
R. mucronata R. mucronataa
Panjang 43,52 ± 4,16 37,70 ± 0,10
Lebar 1,55 ± 0,25 1,18 ± 0,01
Berat 54,60 ± 12,60 44,90 ± 0,05
Keterangan: Data merupakan rataan 30 sampel buah bakau a) Priyanto (2012)
Tumbuhan Rhizophora mucronata berbuah diantara bulan September - Desember, dimana buah bakau yang telah matang memiliki ciri
panjang hipokotil ± 30 - 50 cm, dan memiliki kotiledon berwarna kuning berbentuk
Lebar
13
seperti cincin yang melingkar ± 2 cm dan berwarna kuning kehijauan (Wibisono et al. 2006). Tabel 1 menunjukkan bahwa buah bakau yang digunakan dalam penelitian ini berdasarkan pengamatan morfometrik telah tergolong ke dalam buah matang. Hal ini didukung dengan morfologi buah dimana setiap buah telah memiliki kotiledon berbentuk cincin berwarna kuning keemasan.
Hasil penelitian ini sesuai dengan penelitian Priyanto (2012) dimana hasil
morfometrik telah memenuhi ciri buah matang FAO (2000) dan Wibisono et al. (2006) dengan rata-rata sampel lebih besar pada tiap parameter uji.
Bahan baku yang digunakan pada penelitian Priyanto (2012) berasal dari Muara Karang, Jakarta Utara.
Faktor - faktor yang mempengaruhi perbedaan pertumbuhan
Rhizophora mucronata di suatu lokasi antara lain karakteristik substrat (tebal dan berlumpur), nutrient, fisiografi pantai (Rhizophora mucronata mudah dijumpai pada wilayah pantai yang selalu tergenang air), pasang-surut air laut (akar tunjang
Rhizophora mucronata tumbuh lebih tinggi pada daerah pasang tinggi dan sebaliknya), gelombang dan arus (mudah dijumpai pada wilayah yang terhindar dari gelombang dan arus), iklim (cahaya, curah hujan, suhu, dan angin), salinitas (optimum pada 10-30 ppt), oksigen terlarut, tanah, jarak lokasi dengan pemukiman, dan unsur hara (Hutching dan Saenger 1983).
Komposisi Kimia Buah Bakau Hitam (Rhizophora mucronata)
Analisis komposisi kimia dilakukan dalam penelitian ini untuk mengetahui informasi yang terkandung didalam buah bakau hitam (Rhizophora mucronata). Analisis ini digunakan sebagai penilaian kualitas pakan atau bahan pangan terutama pada standar zat makanan seperti kadar air, kadar protein, dan kadar lemak. Hasil komposisi kimia ekstrak buah bakau hitam (Rhizophora mucronata) dapat dilihat pada Tabel 2 dan perhitungan pada Lampiran 6.
Tabel 2 Komposisi kimia buah bakau hitam (Rhizophora mucronata) Komposisi kimia (%) R. mucronata segar R. mucronata segara
14
tumbuhan dalam menyerap serta mempertahankan air. Menurut Hardiningtyas et al. (2014) perbedaan kadar air dapat dipengaruhi oleh faktor
internal dan eksternal. Faktor internal yaitu morfologi dan sifat genetik, dan faktor eksternal yaitu habitat dan kondisi lingkungan.
Abu merupakan residu anorganik hasil pembakaran atau oksidasi komponen organik bahan pangan. Kadar abu suatu bahan mempresentasikan kadar mineral, kemurnian, dan kebersihan suatu bahan. Hasil kadar abu buah bakau menunjukkan persentase 1,09%. Penelitian Purwaningsih et al. (2015) hipokotil buah bakau hitam memiliki angka 0,85%. Hasil penelitian Manalu et al. (2013) untuk buah pedada (Sonneratia caseolaris) memiliki kadar abu 8,4%. Penelitian ini sesuai dengan Lacerda (1995) dimana spesies Rhizophora lebih sulit terdekomposisi sehingga lebih banyak ditemukan dalam bentuk bahan organik.
Hasil analisis kadar protein didapatkan bahwa buah bakau memiliki kadar protein sebesar 1,5%. Variasi kadar protein yang dimiliki oleh tumbuhan disebabkan oleh beberapa faktor, antara lain spesies, laju metabolisme, umur, lingkungan, dan habitat. Penelitian Purwaningsih et al. (2015) untuk ekstrak buah bakau yang berasal dari Pulau Untung Jawa, Kepulauan Seribu memiliki kadar protein 1,9%.
Lemak mempunyai peran penting dalam tubuh manusia. Lemak merupakan sumber energi utama yang lebih baik dari karbohidrat. Menurut Wahyuni (2009) lemak memiliki fungsi melarutkan vitamin A, D, E, dan K, melindungi alat-alat tubuh yang halus, memperbaiki rasa pada makanan, dan penyimpanan tenaga sebagai bahan penyekat yang melindungi dari rasa dingin yang merusak. Lemak pada tumbuhan berfungsi sebagai pembentuk struktur membran sel, sebagai bahan cadangan makanan, sumber energi, lapisan pelindung pada epidermis batang, daun dan buah (Hidayat 1995). Kadar air berhubungan terbalik dengan kadar lemak (Yunizal et al. 1998). Sampel memiliki persentase kadar lemak sebesar 1,29% hal ini sesuai dengan penelitian Purwaningsih et al. (2015) dimana buah bakau hitam memiliki kadar lemak yang cenderung rendah yaitu 0,55%.
Karbohidrat pada tanaman dibentuk melalui proses fotosintesis. Hasil analisis kadar karbohidrat dilakukan menggunakan perhitungan karbohidrat
by difference dimana nilai yang diperoleh yaitu sebesar 44,56%. Perhitungan karbohidrat dengan metode by difference merupakan metode penentuan kadar karbohidrat secara kasar dimana kadar serat kasar dan serat pangan juga terhitung sebagai karbohidrat (Winarno 2008). Hasil penelitian sesuai dengan Purwaningsih et al. (2015) yang menunjukkan persentase karbohidrat sebesar 45,03%.
Rendemen Ekstrak Kasar Buah Bakau (Rhizophora mucronata)
15
pelarut tertentu. Buah bakau hitam (Rhizophora mucronata) diekstraksi menggunakan maserasi pelarut tunggal.
Ekstraksi yang digunakan yaitu jenis ekstraksi dingin. Hasil ekstraksi buah bakau didapatkan hasil ekstrak sebesar 4,48% (Lampiran 7). Jumlah ekstrak yang dihasilkan berasal dari kemampuan pelarut etanol dalam mengikat bahan aktif pada buah bakau hitam. Hasil penelitian Purwaningsih et al. (2015) didapatkan hasil ekstrak kasar buah bakau hitam sebesar 0,8%. Perbedaan hasil ekstrak disebabkan oleh proses ekstraksi yang berbeda. Serbuk buah bakau dalam penelitian ini berinteraksi dengan pelarut selama 48 jam. Semakin lama kontak bahan dengan pelarut maka semakin banyak komponen aktif yang tertarik dalam ekstrak. Yuniwati et al. (2012) menyatakan faktor yang dapat mempengaruhi proses ekstraksi dan hasil yang diperoleh antara lain waktu, suhu, lamanya interaksi bahan dengan pelarut, kecepatan pengadukan dan pelarut yang digunakan.
Komponen Aktif Ekstrak Kasar Buah Bakau Hitam (Rhizophora mucronata)
Komponen aktif yang terdapat dalam ekstrak kasar buah bakau (Rhizophora mucronata) dianalisis golongan senyawanya menggunakan tes uji
warna (fitokimia) menggunakan beberapa pereaksi spesifik. Menurut Marliana et al. (2005) pereaksi yang digunakan pada pengujian fitokimia sebagian besar bersifat polar sehingga dengan mudah dapat berinteraksi dengan sampel
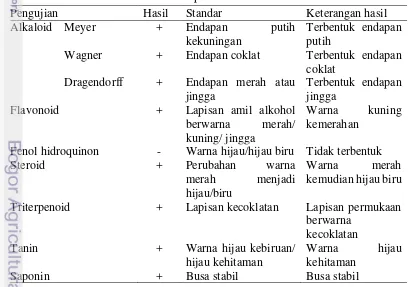
berdasarkan prinsip “like dissolve like”. Hasil analisis fitokimia ekstrak buah bakau hitam (Rhizophora mucronata) dapat dilihat pada Tabel 3 dan Lampiran 8.
Tabel 3 Komponen aktif ekstrak
Pengujian Hasil Standar Keterangan hasil
Alkaloid Meyer + Endapan putih
Fenol hidroquinon - Warna hijau/hijau biru Tidak terbentuk
Steroid + Perubahan warna
merah menjadi
hijau/biru
Warna merah
kemudian hijau biru
Triterpenoid + Lapisan kecoklatan Lapisan permukaan
berwarna
16
Hasil pengujian fitokimia dengan tujuh spesifikasi uji menunjukkan bahwa ekstrak buah bakau mengandung keenam komponen bahan aktif yang diujikan. Pengukuran fitokimia bersifat secara subyektif dari kepekatan dan endapan yang dihasilkan. Semakin kuat intensitas warna yang terbentuk maka kuantitas senyawa yang ada pada fraksi tersebut semakin banyak (Cannel 2008).
Alkaloid merupakan senyawa yang banyak ditemukan pada tumbuhan. Menurut Tyler et al. (1988) gugus senyawa alkaloid memiliki fungsi sebagai analgesik, narkotik, dapat meningkatkan tekanan darah namun juga dapat menurunkan tekanan darah pada beberapa alkaloid spesifik. Hasil menunjukkan bahwa ekstrak kasar buah bakau hitam (Rhizophora mucronata) positif memiliki kandungan alkaloid. Interaksi ekstrak dengan pereaksi meyer menunjukkan adanya endapan putih kuning, pereaksi wagner menunjukkan adanya endapan coklat, dan dengan pereaksi dragendorff menunjukkan adanya endapan merah jingga. Penelitian lain yang dilakukan oleh Purwaningsih et al. (2015) menunjukkan tidak terdapatnya senyawa alkaloid pada ekstrak buah bakau hitam. Perbedaan tersebut diduga disebabkan oleh tingkat kematangan buah, tahap pembentukan senyawa metabolit sekunder, habitat, dan lingkungan.
Triterpenoid adalah terpenoid dengan jumlah atom karbon 30. Triterpenoid dapat digunakan sebagai pengobatan diabetes. Penelitian Sucilestari (2013) menyatakan bahwa tumbuhan dengan kandungan senyawa triterpenoid dapat digunakan sebagai obat antimalaria. Hasil pengujian menunjukkan bahwa ekstrak mengandung senyawa triterpenoid dengan terbentuknya warna merah pada larutan. Laphookhieo et al. (2004) menyatakan ekstrak buah bakau Rhizophora mucronata
mengandung triterpenoid γ -Z-caffeoyl a axe ol, γ -E-caffeoyl a axe ol, γ -E
-p-couma oyl a axe ol, γ -Z-p-couma oyl a axe ol, -taraxerol.
Tanin merupakan salah satu metabolit sekunder yang tergolong kedalam polifenol terdapat di tanaman dan disintesis oleh tanaman. Tanin dapat digunakan sebagai anti hama, adstrigensia pada kulit, antiseptik, antidotum, dan pengawet polimer tanin gallic dan ellagic acid merupakan tanin yang mudah dihidrolisis. Smith et al. (2005) menyatakan tanin yang berikatan dengan protein dan dapat mengendapkannya sehingga dapat berpengaruh negatif terhadap pertumbuhan mikroorganisme saluran pencernaan dan dapat menghambat aktivitas enzim. Penelitian Jayanegara dan Sofyan (2008) tanaman Rhizophora sp. memiliki aktivitas tanin yang rendah sehingga aman digunakan untuk substitusi pakan tanpa menghasilkan gas metan berlebih yang dapat membahayakan. Hasil menunjukkan bahwa ekstrak memiliki kandungan tanin ditandai dengan warna kehijauan yang dihasilkan.
Preethi et al. (2011) menyatakan kandungan aktif yang berperan dalam peningkatan sistem imun adalah flavonoid, steroid, dan saponin. Menurut Middleton et al. (2000) senyawa flavonoid dan saponin mampu meningkatkan aktivitas Interleukin-2 (IL-2) dan proliferasi limfosit sel-T yang menyebabkan sel T helper-1 (Th1) teraktivasi. Sel Th1 yang telah teraktifasi akan mempengaruhi
Macrophage Activation Factor (MAF), yaitu molekul-molekul yang menyebabkan teraktivasinya makrofag, seperti Interferon-ɤ (IFNɤ) yang dapat meningkatkan aktivasi makrofag sehingga meningkatkan pula fagosistosis.
17
flavonoid dalam bakau hitam berpotensi sebagai antitumor/antikanker, anti virus dan anti alergi. Pemberian senyawa antioksidan menurut Block et al. (1992) dapat
menurunkan potensi kanker dan meningkatkan sistem imun. Menurut Hughes (2002) defisiensi antioksidan dalam tubuh dapat merusak proliferasi
limfosit, reaksi hipersensitivitas tipe lambat (DTH) pada tuberkulin, mengurangi kemampuan neutrofil membunuh bakteri, dan aktivitas sitotoksin sel T. Penelitian Adnin (2014) didapat bahwa ekstrak buah bakau memiliki kandungan senyawa flavonoid sebesar 0,51% (b/b). Hasil menunjukkan bahwa ekstrak kasar buah bakau hitam mengandung senyawa flavonoid yang ditandai dengan terbentuknya lapisan jingga pada tabung reaksi.
Steroid adalah golongan senyawa triterpenoid yang mengandung inti siklopentana perhidrofenantren. Steroid banyak dimanfaatkan pada hormon seksual untuk menjaga vitalitas, meningkatkan kerja kelenjar adrenalin, antiinflamasi dan menurunkan rasio densitas tinggi pada jantung. Widodo dan Alan (2010) menyatakan steroid memiliki kemampuan untuk berinteraksi dengan respon imun dan efek antiinflamasi, namun penggunaan steroid murni dinilai berbahaya sehingga digunakan kortikosteroid sebagai alternatif penggunaan aman senyawa steroid. Hasil menunjukkan bahwa buah bakau memiliki kandungan steroid.
Saponin merupakan glikosida alami yang terikat dengan steroid dan triterpena. Manfaat saponin antara lain sebagai imunomodulator, anti tumor, anti kanker, antibiotik, anti virus, antiinflamasi, hipokolesterol, hepatoprotektan, dan anti hiperglikemik. Keberadaan saponin dapat diketahui dengan timbulnya busa pada pengujian fitokimia. Sari (2008) menyatakan saponin dapat menginduksi produksi sitokin seperti interleukin dan interferon untuk meningkatkan sistem imun. Hasil uji menunjukkan ekstrak mengandung banyak saponin yang sudah terlihat dari proses evaporasi sebelum pengujian fitokimia.
Aktivitas Imunostimulan
Pengujian aktivitas imunostimulan dilakukan untuk mengetahui pengaruh ekstrak terhadap aktivitas sistem imun tubuh sehingga dapat dikatakan ekstrak berpotensi sebagai imunostimulator atau tidak. Imunostimulan tergolong kedalam imunomodulator. Imunomodulator merupakan zat ataupun obat yang dapat mengembalikan ketidak-seimbangan sistem kekebalan yang terganggu dengan cara merangsang dan memperbaiki fungsi sistem kekebalan (Baratawidjaja 2002). Pemberian imunomodulator dilakukan dalam jangka waktu pendek dengan dosis yang disesuaikan dengan daya terima tubuh.
Imunomodulator dapat dibedakan menjadi tiga yaitu imunorestorasi, imunosupresi dan imunostimulan. Imunostimulan merupakan bahan yang dapat meningkatkan sistem imun dengan menginduksi atau meningkatkan aktivitas dari komponen-komponennya. Imunostimulan diklasifikasikan menjadi dua yaitu
imunostimulan spesifik dan imunostimulan tidak spesifik (Playfair dan Chain 2012). Perbedaan imunostimulan ini terletak pada cara
kerjanya, imunostimulan spesifik bersifat antigenik spesifik, sedangkan imunostimulan tidak spesifik bekerja dengan menstimulasi respon imun.
18
hingga keluar melalui organ sekresi. Tahapan perjalanan obat didalam tubuh dibedakan menjadi empat, yaitu absorpsi, distribusi, metabolisme, dan eksresi. Pengujian farmakokinetik meliputi pengukuran darah, urin, dan cairan lain dapat dilakukan dipenelitian selanjutnya untuk mengkaji secara pasti potensi buah bakau sebagai imunostimulan (Shargel et al. 2012).
Penelitian ini terfokus pada perubahan yang terjadi terhadap organ yang diberi ekstrak buah bakau hitam (Rhizophora mucronata) dari segi imunologi. Organ limpa dan hati merupakan organ sasaran yang digunakan dalam penelitian ini. Limpa merupakan organ limfoid sekunder utama tempat respon imun terhadap imunogen dalam darah, sementara hati berperan penting dalam metabolisme dan merupakan organ yang paling sering mengalami kerusakan akibat adanya toksikan.
Histopatologi Organ Limpa
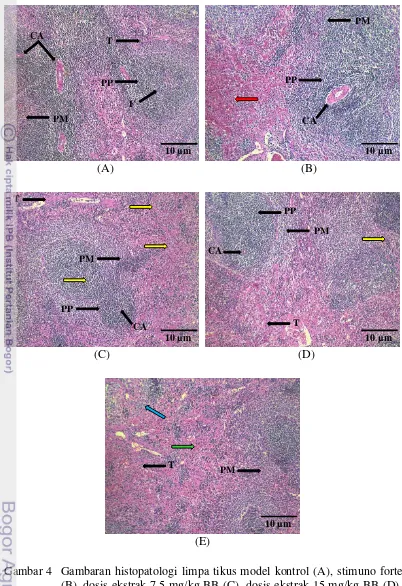
Limpa merupakan jaringan limfoid yang membentuk organ dan memiliki ukuran paling besar dalam tubuh hewan (Dellmann dan Brown 1989). Limpa berfungsi menyaring darah, melakukan eritropoiesis pada fetus, dan menyimpan eritrosit serta trombosit. Hasil pengamatan mikroskopis limpa dengan pewarnaan Hemaktosilin-Eosin (HE) secara kualitatif disajikan pada Tabel 4 dan gambaran histopatologi tikus model perkelompok dapat dilihat pada Gambar 4.
Tabel 4 Hasil pengamatan mikroskopis limpa dengan pewarnaan HE
Kelompok Hasil Pengamatan
Kontrol
Stimuno Forte 13,5 mg/kg BB
Dosis ekstrak buah bakau 7,5 mg/kg BB
Dosis ekstrak buah bakau 15 mg/kg BB
Dosis ekstrak buah bakau 30 mg/kg BB
Sel normal, tidak ada perubahan
Peningkatan jumlah eritrosit Terjadi reactive spleen
Peningkatan pembentukan sel darah Peningkatan jumlah sel megakareosit Terjadi reactive spleen
Sel megakariosit ada, tetapi tidak banyak
19
(A) (B)
(C) (D)
(E)
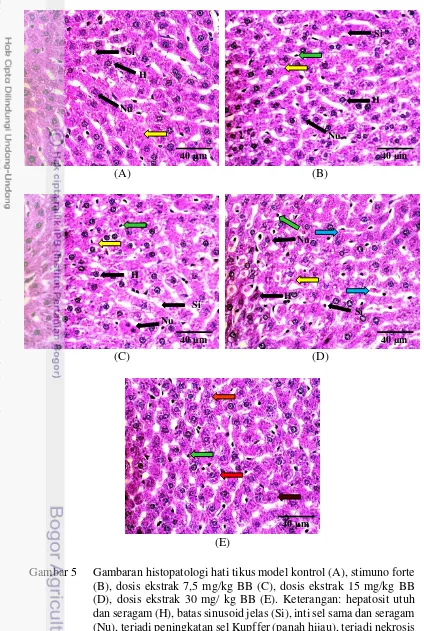
Gambar 4 Gambaran histopatologi limpa tikus model kontrol (A), stimuno forte (B), dosis ekstrak 7,5 mg/kg BB (C), dosis ekstrak 15 mg/kg BB (D), dosis ekstrak 30 mg/ kg BB (E). Keterangan: pulpa putih rapat dan teratur (PP), pulpa merah (PM), limfosit padat dibagian central artery
(CA), trabekulus (T), folikel sel B padat (F), terjadi eritropoiesis (panah merah), peningkatan jumlah sel megakariosit (panah kuning), peningkatan makrofag (panah hijau), terjadi deplesi pulpa putih (panah biru).
10 µm 10µm
10 µm 10 µm
10 µm PP
PM CA
T F
PP CA
PM
PP PM
CA T
PP PM CA
T
20
Hasil pengamatan organ limpa menunjukkan hasil adanya perubahan morfologis. Perubahan yang ditemukan mengindikasikan adanya perubahan yang mengarah pada peningkatan respon pertahanan organ limpa hingga terjadinya deplesi sel limpa. Gambaran histopatologi yang disajikan pada Gambar 4A dapat diamati bahwa preparat organ limpa kontrol pemberian akuades menunjukkan indikator sel limpa normal pada umumnya. Menurut Matheos et al. (2013) klasifikasi limpa yang dapat dikatakan normal yaitu adanya pulpa merah yang terdiri dari sel makrofag, sel plasma, dan elemen darah, dan memiliki pulpa putih yang terdiri dari limfosit yang tersusun padat didalam dan arteri sentralis pada bagian tengah. Preparat limpa normal merupakan acuan untuk membandingkan perubahan morfologis yang terjadi pada keempat perlakuan setelah proses induksi Stimuno Forte (Gambar 4B) dan ekstrak buah bakau (Gambar 4C, D, E).
Stimuno Forte merupakan imunomodulator komersial dengan bahan aktif ekstrak meniran hijau (Phyllanthus niruni). Gambaran organ limpa dengan pemberian Stimuno Forte (13,5 mg/kg BB) (Gambar 4B) menunjukkan terjadi peningkatan respon imun organ limpa yang ditandai dengan terjadinya peningkatan jumlah eritrosit (eritropoiesis). Eritropoiesis merupakan proses pembentukan sel darah merah di limpa dan sumsum tulang belakang hingga matang didalam darah tepi yang dipengaruhi oleh hormon eritropoietin dan didistribusikan ke organ-organ
pertahanan. Eritrosit dalam sistem kekebalan tubuh menurut Yakubu dan Afolayan (2009) berperan sebagai pembawa oksigen dan sari makanan
untuk diedarkan ke seluruh tubuh. Menurut Preet dan Prakash (2011) jumlah eritrosit total berkolerasi dengan persentase hemoglobin yang terukur. Hemoglobin di dalam sel darah merah menurut Widyastuti DA (2013) akan melepaskan radikal bebas untuk membunuh sel patogen dengan menghancurkan dinding dan membran sel sebagai mekanisme pertahanan tubuh. Gambaran pemberian Stimuno Forte meunjukkan terjadinya reactive spleen. Colovai et al. (2004) menyatakan
reactive spleen merupakan keadaan dimana terjadi kenaikan sel T pada limpa. Sel T atau limfosit T tergolong kedalam sistem imun seluler spesifik yang berfungsi sebagai regulator dan efektor terhadap TH1 dan sel T sitotoksik.
Preparat organ limpa setelah pemberian ekstrak buah bakau hitam dengan dosis 7,5 mg/kg BB (Gambar 4C) menunjukkan adanya perubahan morfologi yang ditandai dengan terjadinya peningkatan pembentukan sel darah, peningkatan jumlah sel megakariosit, dan terjadinya reactive spleen. Peningkatan pembentukan sel darah menunjukkan adanya peningkatan respon imun. Megakariosit berasal dari megakaroblas dimana peningkatan megakariosit berkorelasi dengan peningkatan trombosit. Hoffbrand et al. (2007) menyatakan setiap satu sel megakariosit menghasilkan 4000 trombosit. Trombosit dalam sistem kekebalan berperan dalam menghentikan pendarahan untuk mencegah masuknya patogen ke dalam tubuh. Kandungan aktif flavonoid, saponin, dan steroid diduga merupakan faktor terjadinya peningkatan respon imun.
21
dosis 30 mg/kg BB (Gambar 4E), dimana mulai terjadi kerusakan organ limpa tikus model.
Penggunaan ekstrak dengan dosis 30 mg/kg BB yang disajikan pada Gambar 4E menunjukkan hasil yang berbeda dari keempat preparat. Gambaran morfologi limpa pada dosis ini telah terjadi deplesi pulpa putih dan peningkatan jumlah makrofag. Perubahan ukuran, warna, dan konsistensi limpa merupakan respon limpa terhadap benda asing. Deplesi atau penurunan jumlah pulpa putih menandakan bahwa limpa mengalami degenerasi. Maxie (2007) menyebutkan bahwa degerasi limpa secara mikroskopis ditandai dengan penurunan jumlah dan ukuran pulpa putih. Menurut Widjajanto (2005) peningkatan jumlah makrofag menandakan dimulainya proses fagositosis, dan makrofag merupakan sel yang memacu hematopoiesis. Makrofag tergolong kedalam sistem pertahanan seluler non spesifik yang berperan sebagai sistem pertahanan awal ketika patogen terindikasi berada didalam tubuh. Hematopoiesis merupakan proses pembentukan komponen sel darah baru. Proses hematopoiesis ditandai dengan terjadinya proliferasi, maturasi dan diferensiasi sel secara serentak. Hematopoiesis merupakan tanda kerusakan organ dimana setelah terjadi kerusakan pada organ target maka proses hematopoiesis dimulai. Peningkatan jumlah makrofag terjadi seiring dengan terjadinya proses hematopoiesis dalam tubuh.
Histopatologi Organ Hati
Induksi oral yang dilakukan dalam penelitian ini menyebabkan adanya kesinambungan penelitian dengan organ pencernaan. Hati terlibat dalam metabolisme zat makanan baik obat maupun toksikan. Hati merupakan acuan kerusakan organ, didalam hati terdapat vena porta dimana pembuluh darah dari usus masuk ke hati dan dapat menyalurkan obat atau toksik ke dalamnya. Tahapan ketiga farmakokinetik yaitu metabolisme yang dilakukan dihati sehingga perlu dikaji perubahan yang terdapat di organ tersebut. Hasil pengamatan mikroskopis hati dengan pewarnaan HE secara kualitatif disajikan pada Tabel 5. Pengamatan menghasilkan bahwa terjadi perubahan morfologis hati yang mengindikasikan adanya respon sel-sel pertahanan organ hati dimana gambaran histopatologi hati dapat dilihat pada Gambar 5.
Tabel 5 Hasil pengamatan mikroskopis hati dengan pewarnaan HE
Kelompok Hasil Pengamatan
Kontrol
Stimuno Forte 13,5 mg/kg BB
Dosis ekstrak buah bakau 7,5 mg/kg BB
Dosis ekstrak buah bakau 15 mg/kg BB
Dosis ekstrak buah bakau 30 mg/kg BB
22
(A) (B)
(C) (D)
(E)
Gambar 5 Gambaran histopatologi hati tikus model kontrol (A), stimuno forte (B), dosis ekstrak 7,5 mg/kg BB (C), dosis ekstrak 15 mg/kg BB (D), dosis ekstrak 30 mg/ kg BB (E). Keterangan: hepatosit utuh dan seragam (H), batas sinusoid jelas (Si), inti sel sama dan seragam (Nu), terjadi peningkatan sel Kupffer (panah hijau), terjadi nekrosis sel hati (panah jingga), terjadi degenerasi sel (panah coklat), batas antar sel jelas (panah kuning), sinusoid berisi eritrosit (panah biru), pembengkakan sel hati (panah merah).
H Nu
Si
Nu
Si
Nu H
H
40 µm 40 µm
40 µm 40 µm
40 µm H
Nu Si
23
Hasil pengamatan histopatologi organ hati menunjukkan adanya perubahan morfologis antara tikus model kontrol dan tikus model induksi Stimuno Forte dan ekstrak buah bakau hitam yang mengarah pada peningkatan sistem pertahanan hingga terjadinya kematian sel hati. Gambaran histopatologi hati tikus kontrol yang disajikan pada Gambar 5A menunjukkan indikator jaringan hati normal. Sel hati normal menurut Chodidjah et al. (2007) yaitu sel hati yang tidak mengalami jejas, seragam, dan batas sinusoid yang jelas. Purwaningsih et al. (2015) menyatakan hati normal memiliki ciri hepatosit utuh, inti sel yang sama dan seragam, dan vena sentralis yang berbentuk normal. Tikus model kontrol merupakan acuan pembanding pada empat perlakuan lain.
Gambaran histopatologi hati terhadap pemberian Stimuno Forte 13,5 mg/kg BB, dosis ekstrak buah bakau hitam 7,5 mg/kg BB, dan dosis ekstrak
buah bakau hitam 15 mg/kg BB menunjukkan adanya peningkatan sel Kupffer. Sinusoid hati dapat tersusun oleh dua tipe sel yaitu sel endotel dan sel Kupffer. Sel Kupffer adalah makrofag jaringan yang mampu memfagositosis bakteri dan benda asing lain dalam darah sinus hepatikus (Guyton dan Hall 1997). Aktivasi sel Kupffer dapat disebabkan sebagai respon tubuh dalam menghadapi benda asing yang masuk ke dalam tubuh. Pemberian Stimuno Forte dan ekstrak buah bakau hitam diduga mengaktifkan sistem fagositosis dari sel sinusoidal dengan meningkatkan jumlah sel Kupffer untuk membantu menghilangkan patogen tubuh. Peningkatan jumlah sel Kupffer pada perlakuan kelompok 2, 3, dan 4 mengarah kepada peningkatan sistem pertahanan tubuh berdasarkan gambaran histopatologi
organ limpa Gambar 4. Hasil penelitian sesuai dengan penelitian Purwaningsih et al. (2015) dimana preparat hati tikus dengan pemberian dosis 15 mg/kg BB dapat meningkatkan jumlah sel Kupffer pada sel sinusoid. Keberadaan sel Kupffer menggambarkan kondisi tubuh yang siaga dalam menghadapi bakteri atau benda asing yang merugikan.
Kongesti merupakan keadaan dimana terdapat darah secara berlebihan didalam pembuluh darah pada daerah tertentu. Abdelhalim dan Jarrar (2012) menyatakan transfer oksigen ke jaringan akan merunun seiring terjadinya kongesti. Eritrosit yang terdapat didalam sinusoid dapat digolongkan ke dalam jenis kongesti kronik. Keberadaan eritrosit dalam sinusoid pada Gambar 5D dapat mendesak hepatosit mengalami pengecilan ukuran. Kongesti akan berkolerasi dengan terjadinya degenerasi sel hati. Penggunaan ekstrak buah bakau dosis 15 mg/kg BB telah menunjukkan adanya kerusakan sel hati ringan dengan adanya eritrosit di sel sinusoidal.
24
Pengertian degenerasi adalah perubahan morfologis dan penurunan fungsi dan struktur sel yang bersifat sementara yang disebabkan karena adanya gangguan metabolisme, anoksia, dan senyawa-senyawa toksik (Maxie 2007). Menurut Adikara et al. (2013) degenerasi dibedakan menjadi dua, degenerasi melemak dan degenerasi hidrofik. Degenerasi melemak ditandai dengan adanya vakuola berukuran besar yang bervariasi, sedangkan degenerasi hidrofik merupakan jejas sel yang reversible dengan penimbunan intraseluler. Secara mikroskopis Degenerasi dalam jangka waktu panjang dapat menyebabkan kematian sel (nekrosis). Degenerasi sel pada kasus ini ditandai dengan pembengkakan inti sel yang terjadi pada tikus model.
Nekrosis adalah kematian sel yang disebabkan karena kerusakan akut atau trauma. Pemberian ekstrak buah bakau 30 mg/kg BB selama 14 hari menimbulkan efek kematian sel. Kematian sel diawali dengan perubahan morfologi intisel yaitu piknosis, kemudian terjadi perpecahan inti sel (karioheksis) dan menghilangnya inti sel (kariolisis) (Kumar et al. 2007). Hasil penelitian Purwaningsih (2015) penginduksian 28 hari pada konsentrasi 105 mg/kg BB menyebabkan nekrosis sel hati, namun konsentrasi 15 mg/kg BB aman untuk nutraseutikal meskipun dalam
sel mulai terjadi degenerasi namun belum merusak organ ginjal. Penelitian Widadi et al. (2014) penggunaan sediaan ekstrak etanol buah bakau hitam
(Rhizophora mucronata) dalam bentuk sirup tidak menyebabkan adanya gejala
toksisitas pada tikus uji Sprague Dawley dengan konsentrasi 15, 105, 735 mg/kg BB yang menandakan ekstrak dalam sediaan sirup lebih aman
dikonsumsi. Menurut Ravikumar dan Gnenedesigan (2012), senyawa fenolik seperti flavonoid pada tumbuhan bakau hitam (Rhizophora mucronata) memiliki kandungan antioksidan yang dapat memelihara stabilitas membran sel hati, meningkatkan proses regenerasi sel, hati dengan cara mereduksi senyawa radikal bebas, dan mempercepat mekanisme perbaikan membran sel yang rusak.
Perubahan Jumlah Sel Limfoid Limpa
Limpa terdiri dari pulpa merah dan pulpa putih. Pulpa putih terdiri dai limfosit dan arteri sentralis. Limfosit merupakan jenis sel darah putih yang ditemukan didalam darah dan jaringan getah bening yang berperan dalam sistem kekebalan tubuh dan pembentuk antibodi. Limfosit tergolong kedalam sel-sel neoplasma (limfoblast dan limfosit), dimana sel neoplasma dapat digolongkan sebagai sel limfoid.
25
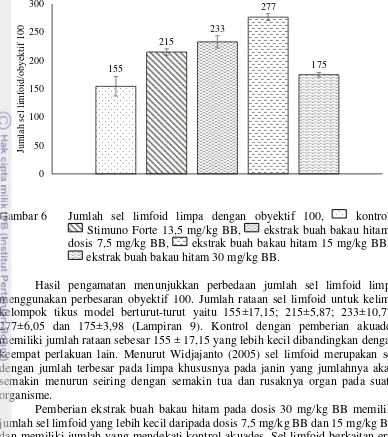
Gambar 6 Jumlah sel limfoid limpa dengan obyektif 100, kontrol Stimuno Forte 13,5 mg/kg BB, ekstrak buah bakau hitam
dosis 7,5 mg/kg BB, ekstrak buah bakau hitam 15 mg/kg BB, ekstrak buah bakau hitam 30 mg/kg BB.
Hasil pengamatan menunjukkan perbedaan jumlah sel limfoid limpa menggunakan perbesaran obyektif 100. Jumlah rataan sel limfoid untuk kelima kelompok tikus model berturut-turut yaitu 155±17,15; 215±5,87; 233±10,77; 277±6,05 dan 175±3,98 (Lampiran 9). Kontrol dengan pemberian akuades memiliki jumlah rataan sebesar 155 ± 17,15 yang lebih kecil dibandingkan dengan keempat perlakuan lain. Menurut Widjajanto (2005) sel limfoid merupakan sel dengan jumlah terbesar pada limpa khususnya pada janin yang jumlahnya akan semakin menurun seiring dengan semakin tua dan rusaknya organ pada suatu organisme.
Pemberian ekstrak buah bakau hitam pada dosis 30 mg/kg BB memiliki jumlah sel limfoid yang lebih kecil daripada dosis 7,5 mg/kg BB dan 15 mg/kg BB dan memiliki jumlah yang mendekati kontrol akuades. Sel limfoid berkaitan erat dengan sel limfosit. Menurut Sari (2008) penurunan jumlah limfosit terjadi karena adanya rangsangan benda asing, dan limfosit dapat pula dilepas menjadi penghasil antibodi pada korteks dan menjadi sel memori dalam aliran darah kapiler. Pemberian ekstrak bakau hitam dapat menginduksi folikel limfoid limpa, hematopoiesis dan dalam kondisi reaktif.
26
merupakan dosis teraman digunakan yang dilihat dari gambaran histopatologi limpa dan jumlah sel limfoid yang tidak jauh berbeda dengan imunomodulator komersial yang telah teruji aman.
Perubahan Berat Badan Tikus
Penimbangan berat badan dilakukan untuk mengetahui perubahan yang terjadi selama induksi ekstrak 14 hari. Tikus model yang telah diaklimatisasi diseleksi menjadi 25 ekor secara acak dengan ciri tikus sehat. Menurut Hendarsula (2010) tikus sehat memiliki ciri mata merah jernih tidak menonjol, bulu tidak berdiri, bulu tidak kusam, dan gerak motorik yang lincah. Data berat badan tikus dapat dilihat pada Lampiran 10 dan selama induksi tidak terjadi kematian tikus sehingga didapat nilai survival rate 100% (Lampiran 11). Perubahan berat badan selama perlakuan dengan pakan yang diseragamkan yaitu 25 g/tikus/hari secara
restricted disajikan dalam diagram batang pada Gambar 7.
Gambar 7 Berat badan tikus model selama pemberian dosis, hari ke-0, hari ke-6, hari ke-14.
Gambar 7 menunjukkan fluktuasi perubahan berat badan tikus selama induksi. Data menunjukkan terjadi penurunan dan kenaikan berat badan tiap kelompok perlakuan. Penurunan berat badan terjadi setelah 6 hari proses induksi dimana persentase berturut-turut sebesar 3,93%, 2,29%, 6,01%, 8,25%, dan 8,28% dimana selisih berat badan disajikan pada Lampiran 12. Penurunan berat badan diduga disebabkan oleh peningkatan tingkat stress pada tikus uji pada 6 hari awal pemberian perlakuan dengan menggunakan sonde lambung sehingga mempengaruhi pola makan dan metabolismenya. Penginduksian dengan alat dan penimbangan berlebih dapat meningkatkan stress dan berdampak pada penurunan berat badan. Paparan stressor tikus perhari yaitu 0,5 jam (Lampiran 13) dimana penggunaan optimum alat dan perlakuan penelitian sebaiknya tidak melebihi waktu tersebut (Baratawidjaja 2002). Dharmayudha et al. (2014) menyatakan tubuh membutuhkan energi, ketika metabolisme tidak baik untuk memenuhi kebutuhan
207,64 207,74 218,92 202,3 205,92
Kontrol negatif Stimuno Forte Dosis 1 Dosis 2 Dosis 3