SENYAWA METABOLIT CENDAWAN ENDOFIT
SEBAGAI ALTERNATIF PENGENDALIAN EFEKTIF
CENDAWAN PATOGEN TERBAWA BENIH PADI
ARIFDA AYU SWASTINI WARUWU
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Senyawa Metabolit Cendawan Endofit sebagai Alternatif Pengendalian Efektif Cendawan Patogen Terbawa Benih Padi adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Desember 2015
Arifda A S Waruwu
RINGKASAN
ARIFDA AS WARUWU. Senyawa Metabolit Cendawan Endofit sebagai Alternatif Pengendalian Efektif Cendawan Patogen Terbawa Benih Padi. Dibimbing oleh BONNY PW SOEKARNO dan ABDUL MUNIF.
Prioritas utama bidang pertanian dalam rangka menjaga stabilitas pangan nasional yaitu peningkatan produksi padi. Salah satu masalah dalam produksi padi disebabkan karena infeksi hama dan penyakit tanaman. Infeksi cendawan patogen terbawa benih pada tanaman padi di Indonesia menjadi masalah utama yang berpengaruh terhadap produksi padi yang menurun dari waktu ke waktu. Pemanfaatan cendawan endofit merupakan salah satu alternatif pengendalian yang dapat digunakan untuk mengendalikan patogen terbawa benih. Perlu adanya metode baru yang ramah lingkungan untuk mengendalikan patogen terbawa benih. Penelitian ini bertujuan untuk mengeksplorasi cendawan endofit potensial asal tanaman padi yang mampu menghambat pertumbuhan cendawan patogen terbawa benih padi dan memanfaatkan metabolit cendawan endofit untuk menekan cendawan patogen benih terbawa benih padi.
Penelitian ini terdiri atas 7 tahapan, yaitu 1) isolasi cendawan endofit dengan cara sterilisasi permukaan bagian tanaman padi dengan menggunakan NaOCl 1% dan alkohol 70%, 2) uji patogenisitas cendawan endofit terhadap benih padi varietas Ciherang yang telah disterilisasi permukaan, 3) isolasi cendawan patogen terbawa benih padi asal varietas Ciherang dan Kukubalam dengan metode
blotter test, 4) uji antagonis isolat cendawan endofit terhadap cendawan patogen terbawa benih dengan metode kultur ganda, 5) produksi dan analisis senyawa metabolit cendawan endofit, 6) uji senyawa metabolit cendawan endofit secara in vitro, dan 7) uji in vivo senyawa metabolit cendawan endofit dengan 3 media yaitu agar air, kertas, dan lumpur.
Cendawan endofit yang berhasil diisolasi sebanyak 21 isolat dan isolat yang digunakan pada uji senyawa metabolit sebanyak 3 isolat cendawan endofit potensial sebagai agen biokontrol terhadap cendawan patogen terbawa benih
Fusarium sp.1. Tiga isolat cendawan endofit tersebut yaitu LA6, LA11, dan LA14. Metabolit isolat LA11 menunjukkan persentase penghambatan tertinggi terhadap Fusarium sp.1 yaitu 28.97% dan metabolit isolat LA14 dengan persentase penghambatan 28.72%. Aplikasi metabolit cendawan endofit dengan perendaman benih padi menunjukkan pengurangan infeksi cendawan patogen terbawa benih padi. Hal ini ditunjukkan oleh isolat LA11 dan LA14 mampu menghambat pertumbuhan cendawan patogen terbawa benih secara potensial.
Cendawan endofit menghasilkan metabolit yang sebagian senyawa metabolit bersifat antifungal. Senyawa antifungal yang dihasilkan cendawan endofit dapat melindungi tanaman dari serangan mikroba patogen sehingga dapat dimanfaatkan sebagai biokontrol. Metabolit cendawan endofit juga mampu memperbaiki pertumbuhan tanaman dan sistem perakaran tanaman.
SUMMARY
ARIFDA AS WARUWU. Metabolites Compound of Endophytic Fungi as an Alternative to Control Seed-borne Pathogen Fungi on Rice. Supervised by BONNY PW SOEKARNO and ABDUL MUNIF.
The major priority of agriculture in order to maintain the stability of national food is increasing of rice production. One problem in rice production is due to the infection of plant pests and diseases. Seed-borne fungal pathogenic endophytic fungus capable of inhibiting the growth of seed-borne pathogens and using metabolites of endophytic fungi to suppress seed-borne fungal pathogens of rice seeds.
This study consisted of 7 stages, 1) the isolation of the endophytic fungi by sterilize the surface of rice plant with 1% NaOCl and 70% alcohol, 2) the pathogenicity test of isolated endophytic fungi against Ciherang rice seeds, 3) the isolation of seed-borne pathogens by blotter test method, 4) the inhibition test of isolated endophytic fungi against pathogenic fungi by dual culture method, 5) the production and analysis of metabolites of endophytic fungi, 6) the inhibition test of isolated endophytic fungi metabolites on seed-borne pathogenic fungi, and 7) the in vivo test of metabolites of endophytic fungi with 3 media, that is water agar, paper, and muds.
Endophytic fungi has been succeeded to isolate 21 isolates and 3 isolates were potential as a biocontrol agent against Fusarium sp.1 as pathogenic fungi. The three isolates of endophytic fungi namely LA6, LA11, and LA14. Metabolite of LA11 isolate showed the highest inhibition percentage against the Fusarium
sp.1by 28.97% and LA14 isolate with inhibition percentage by 28.72%. Metabolite of endophytic fungi which used to cover rice seed through soaked the seed enabled to reduce seed-borne pathogen fungi. It showed that LA11 and LA14 isolate have an inhibition potential to reduce growth of seed-borne pathogen fungi.
Endophytic fungi produce metabolite as antifungal. Antifungal compound that produced by endophytic fungi can protect plant from pathogenic fungal acts, so it can be a biocontrol. Metabolite of endophytic fungi also can repair the grow of plant and the plant root system.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Fitopatologi
SENYAWA METABOLIT CENDAWAN ENDOFIT
SEBAGAI ALTERNATIF PENGENDALIAN EFEKTIF
CENDAWAN PATOGEN TERBAWA BENIH PADI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Senyawa Metabolit Cendawan Endofit sebagai Alternatif Pengendalian Efektif Cendawan Patogen Terbawa Benih Padi Nama : Arifda Ayu Swastini Waruwu
NIM : A352130101
Disetujui oleh Komisi Pembimbing
Dr Ir Bonny PW Soekarno, MS Ketua
Dr Ir Abdul Munif, MScAgr Anggota
Diketahui oleh
Ketua Program Studi Fitopatologi
Prof Dr Ir Sri Hendrastuti Hidayat, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: 28 Oktober 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juli 2014 ini ialah cendawan endofit, dengan judul Senyawa Metabolit Cendawan Endofit sebagai Alternatif Pengendalian Efektif Cendawan Patogen Terbawa Benih Padi.
Terima kasih penulis ucapkan kepada Dr Ir Bonny PW Soekarno, MS dan Dr Ir Abdul Munif, MSc Agr selaku komisi pembimbing, dan juga kepada Dr Ir Titiek Siti Yuliani, SU selaku penguji luar komisi yang telah memberikan arahan, saran, dan motivasi bagi penulis dalam proses penelitian dan penulisan karya ilmiah ini. Ucapan terima kasih juga penulis sampaikan kepada Direktorat Jenderal Pendidikan (Dikti) Kemdikbud yang telah memfasilitasi biaya pendidikan melalui Beasiswa Unggulan (BU). Selain itu, penghargaan penulis sampaikan kepada Kepala UPT. Balai Proteksi Tanaman Pangan dan Hortikultura 1 Medan yang telah memberi izin penggunaan Laboratorium pada proses isolasi cendawan endofit dari tanaman padi asal Sumatera Utara. Ungkapan terima kasih juga disampaikan kepada ayahanda Filizaro Waruwu, ibunda Nurdiana dan seluruh keluarga untuk kasih sayang, segala doa dan dukungannya, serta kepada para sahabat yang telah memberikan motivasi kepada penulis.
Semoga karya ilmiah ini bermanfaat.
Bogor, Desember 2015
DAFTAR ISI
Uji Antagonis Isolat Cendawan Endofit terhadap Cendawan Patogen 10
Produksi dan Analisis Senyawa Metabolit Cendawan Endofit 11
Uji Senyawa Metabolit Cendawan Endofit 11
Uji In Vivo Senyawa Metabolit Cendawan Endofit 12
Analisis Data 12
DAFTAR TABEL
1 Hasil isolasi cendawan endofit asal tanaman padi varietas Ciherang dan
varietas Kukubalam 13
2 Hasil uji patogenisitas cendawan endofit terhadap benih varietas
Ciherang 14
3 Tingkat infeksi cendawan patogen terbawa benih padi varietas Ciherang
dan Kukubalam dengan metode blotter test 15
4 Daya hambat cendawan endofit potensial terhadap pertumbuhan koloni
Fusarium sp.1 pada media tumbuh PDA 16
5 Pengaruh senyawa metabolit cendawan endofit terhadap pertumbuhan koloni Fusarium sp.1 pada media tumbuh PDA 17 6 Senyawa metabolit yang dihasilkan cendawan endofit LA11 pada
pengujian Py-GC-MS 19
7 Senyawa metabolit yang dihasilkan cendawan endofit LA14 pada
pengujian Py-GC-MS 20
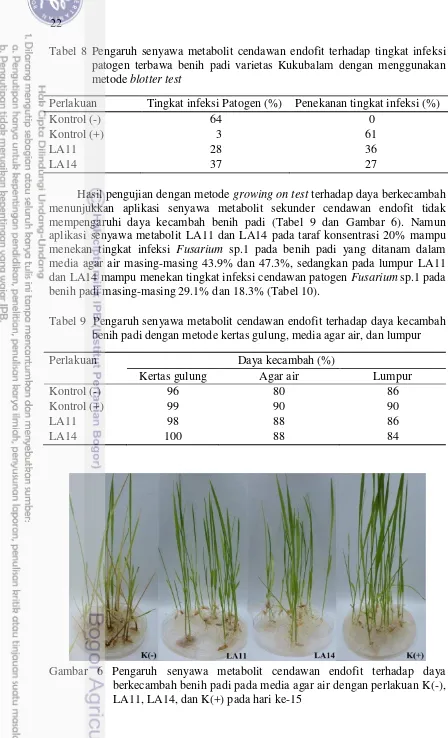
8 Pengaruh senyawa metabolit cendawan endofit terhadap tingkat infeksi patogen terbawa benih padi dengan menggunakan metode blotter test 22 9 Pengaruh senyawa metabolit cendawan endofit terhadap daya
kecambah benih padi dengan metode kertas gulung, media agar air, dan
lumpur 22
10 Tingkat infeksi dan penekanan tingkat infeksi cendawan patogen
Fusarium sp.1 pada media agar air dan lumpur 23
DAFTAR GAMBAR
1 2
Bagan alir penelitian senyawa metabolit cendawan endofit sebagai alternatif pengendalian efektif cendawan patogen terbawa benih padi Skema uji antagonis cendawan endofit (a) dan cendawan patogen (b) pada media PDA secara in vitro
3 11 3 Uji patogenisitas cendawan endofit pada benih padi varietas Ciherang.
(A) gejala nekrotik pada kecambah kontrol, dan (B) tidak ada gejala
5 Pengaruh senyawa metabolit cendawan endofit terhadap pertumbuhan
Fusarium sp.1
18 6 Pengaruh senyawa metabolit cendawan endofit terhadap daya
berkecambah padi pada media agar air dengan perlakuan K(-), LA11, LA14, dan K(+) pada hari ke-15
22
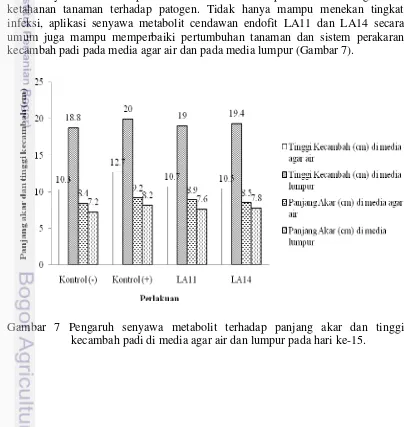
7 Pengaruh senyawa metabolit terhadap panjang akar dan tinggi kecambah padi di media agar air dan lumpur pada hari ke-15
DAFTAR LAMPIRAN
1 Hasil analisis senyawa metabolit LA11 30
2 Hasil analisis senyawa metabolit LA14 31
PENDAHULUAN
Latar Belakang
Padi adalah komoditas utama pertanian di Indonesia. Sebagian besar penduduk Indonesia mengonsumsi beras sebagai makanan pokok. Konsumsi beras di Indonesia yang tinggi menuntut tingkat produksi beras yang besar pula. Berdasarkan data Badan Pusat Statistik (BPS 2015), produksi padi di Indonesia pada tahun 2014 sebesar 70.83 juta ton gabah kering giling (GKG), mengalami penurunan sebanyak 450.000 ton dari produksi tahun 2013 sebesar 71.28 juta ton GKG. Salah satu penyebab penurunan produksi padi adalah gangguan dari hama dan penyakit tumbuhan. Produksi padi yang meningkat tidak terlepas dari kualitas benih. Ketersediaan benih bermutu menjadi faktor penentu produktivitas komoditas pertanian. Benih padi yang bermutu dan tersertifikasi sangat penting untuk mendapatkan produksi padi atau beras yang tinggi dan berkualitas. Mutu benih dilihat dari empat aspek, yaitu mutu fisik, mutu genetik, mutu fisiologis, dan kesehatan benih. Salah satu aspek penting dalam menentukan kualitas suatu benih adalah kesehatan benih. Pada proses penyimpanan tidak sedikit dari benih padi mengalami kerusakan baik dari segi tekstur, aroma, bahkan kandungannya. Kerusakan pada benih biasanya terjadi akibat adanya serangan serangga, tungau, burung, dan mikroorganisme patogen seperti cendawan dan bakteri (Agarwal dan Sinclair 1997). Sebagian cendawan patogen penyebab penyakit pada padi dapat terbawa benih.
Cendawan patogen terbawa benih padi antara lain Alternaria padwickii
(Ganguly) Ellis, Pyricularia oryzae Sacc., Fusarium solani (Mart.) Sacc., F. moniliforme Sheld, Phoma sp., Helminthosporium oryzae Breda de Haan,
Chaetomium sp., Aspergillus spp., Curvularia sp., Cercospora oryzae Miyake, dan Rhizoctonia solani Kuhn. Fusarium sp. merupakan cendawan patogen yang terbawa benih dalam kisaran luas. Beberapa spesies di antara cendawan tersebut dapat memproduksi mikotoksin dalam biji-bijian yang berbahaya bagi kesehatan manusia dan hewan. Fusarium sp. juga dapat menyebabkan penyakit layu pada tanaman dan bersifat sistemik. Kerugian yang ditimbulkan cendawan patogen terbawa benih adalah pertumbuhan tanaman yang kurang baik dan tersedianya sumber inokulum patogen sejak awal tanaman tumbuh di lapangan. Selain itu, cendawan patogen terbawa benih juga dapat menurunkan kualitas benih seperti menurunnya daya kecambah padi (Agarwal dan Sinclair 1997). Infeksi cendawan patogen terbawa benih terhadap pertanaman padi di Indonesia berdampak terhadap penurunan produksi hasil padi. Upaya untuk mengendalikan cendawan patogen terbawa benih padi telah banyak dilakukan. Cara pengendalian cendawan patogen terbawa benih yang sering dilakukan adalah pemakaian fungisida sintetis. Meskipun demikian masih perlu dilakukan upaya untuk mengembangkan cara pengendalian patogen terbawa benih yang efektif, berkelanjutan dan berwawasan lingkungan.
2
2
organisme endofit yang dapat hidup dalam organ tanaman dan mampu mengolonisasi di dalam jaringan tanaman tanpa menyebabkan kerusakan pada inangnya. Cendawan endofit adalah cendawan yang semua atau sebagian dari siklus hidupnya berada di dalam jaringan tanaman sehat dan tidak memperlihatkan gejala penyakit (Schulz dan Boyle 2005). Banyak kelompok cendawan endofit yang mampu memproduksi senyawa antibiotik yang aktif menekan pertumbuhan bakteri maupun cendawan patogen (Petrini 1992).
Senyawa antimikroba yang dihasilkan beberapa cendawan endofit pada tanaman mampu melindungi tanaman inang dari infeksi patogen penyebab penyakit tanaman. Untuk itu, cendawan endofit dapat dimanfaatkan sebagai alternatif cara pengendalian hayati penyakit pada tanaman (Schulz dan Boyle 2005). Telah banyak penelitian mengenai metabolit cendawan endofit mampu mengendalikan pertumbuhan cendawan patogen.
Senyawa metabolit yang dihasilkan cendawan endofit seperti alkaloid pada tanaman rumput-rumputan mampu melindungi inang dari serangan invertebrata herbivora, nematoda dan patogen. Cendawan endofit dapat memberi keuntungan kepada tanaman yaitu meningkatkan ketahanan terhadap serangga dan mamalia herbivora, meningkatkan ketahanan tanaman terhadap penyakit, memacu pertumbuhan dan meningkatkan ketahanan tanaman terhadap kekeringan dan suhu tinggi (Lehtonen et al. 2005). Saat ini telah dikembangkan cara pengendalian cendawan patogen terbawa benih dengan memanfaatkan senyawa yang dihasilkan mikroba endofit. Sebagian senyawa metabolit mikrobaendofit telah terbukti memiliki aktivitas antimikroba sehingga melindungi tanaman inang dari patogen penyebab penyakit tanaman. Sebagai contoh, senyawa metabolit dari cendawan endofit Phomopsis sp. bersifat antibakteri dan antifungal terhadap Bacillus megaterium dan Microbotryum violaceum (Pers.) G. Deml & Oberw. (Hussain et al. 2009). Kemampuan cendawan endofit memproduksi metabolit sekunder merupakan peluang yang sangat besar dan dapat diandalkan untuk memproduksi senyawa dari mikroba endofit yang diisolasi dari tanaman inangnya tersebut.
Perumusan Masalah
3 Tujuan Penelitian
Penelitian ini bertujuan untuk mengeksplorasi cendawan endofit potensial asal tanaman padi yang mampu menghambat pertumbuhan cendawan patogen terbawa benih padi dan memanfaatkan senyawa metabolit cendawan endofit untuk menekan patogen terbawa benih padi.
Manfaat Penelitian
Penelitian diharapkan menemukan cara pengendalian yang tepat dengan menggunakan metabolit dari cendawan endofit asal tanaman padi untuk mengendalikan perkembangan patogen terbawa benih padi.
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini adalah isolasi cendawan endofit dari tanaman padi, uji patogenisitas cendawan endofit, isolasi cendawan patogen terbawa benih padi, uji antagonis isolat cendawan endofit terhadap cendawan patogen, produksi dan analisis senyawa metabolit cendawan endofit, uji senyawa metabolit cendawan endofit, dan uji in vivo senyawa metabolit cendawan endofit (Gambar 1).
4
4
TINJAUAN PUSTAKA
Produksi padi
Tanaman padi dalam taksonomi tumbuhan diklasifikasikan ke dalam divisio
Spermatophyta, subdivisio Angiospermae, kelas Monocotyledoneae, ordo adalah
Poales, famili adalah Graminae, genus adalah Oryza Linn, dan spesiesnya adalah
Oryza sativa L (Grist 1960). Padi merupakan tanaman yang tumbuh di atas tanah yang digenangi air. Padi juga dapat tumbuh di tanah daratan atau tanah kering, apabila curah hujan mampu mencukupi kebutuhan akan air. Padi termasuk golongan Gramineae ditandai dengan batang yang tersususn dari beberapa ruas (Siregar 1981). Tanaman padi merupakan tanaman pangan yang penting dan makanan pokok bagi sebagian besar penduduk di Asia. Walaupun konsumsi beras bervariasi antarnegara, namun sumbangan beras terhadap pemenuhan kebutuhan kalori masyarakat relatif cukup tinggi. Sebagai contoh Laos dan Myanmar, konsumsi beras per kapitanya masing-masing mencapai sekitar 179 kg dan 190 kg per tahun (Suryana et al. 2009). Berdasarkan data rata-rata selama 5 tahun (2005-2008), tercatat bahwa Bangladesh merupakan negara dengan penyediaan beras per kapita terbesar di dunia yakni mencapai 171.14kg/kapita/tahun, disusul Republik Demokratik Laos dan Kamboja masing-masing sebesar 163.48 kg/kapita/tahun dan 159.08 kg/kapita/tahun. Indonesia menduduki urutan keempat sebagai negara dengan penyediaan beras terbesar di dunia dengan rata-rata sebesar 148.62 kg/kapita/tahun (Respati et al. 2014). Peningkatan jumlah penduduk mendorong banyak negara di Asia untuk terus mengembangkan teknologi yang mampu meningkatkan produktivitas padi.
Peningkatan dalam produksi padi masih merupakan prioritas utama pembangunan di bidang pertanian guna menjaga stabilitas pangan secara nasional dan untuk memenuhi kebutuhan masyarakat. Beberapa tahun terakhir, impor beras dilakukan untuk memenuhi kebutuhan di dalam negeri. Konsumsi beras tahun 2014 diperkirakan sebesar 97.67 kg/kapita/tahun atau naik sebesar 0.27% dibandingkan tahun 2013 (Respati et al. 2014). Kelangkaan beras terjadi antara lain karena menyempitnya areal persawahan, kendala yang bersifat abiotik seperti lingkungan dan biotik seperti serangan hama dan penyakit.
Penyakit padi yang disebabkan oleh mikroorganisme merupakan hambatan dalam produksi padi. Ada sekitar 60 jenis penyakit pada tanaman padi yang disebabkan virus, bakteri, cendawan, nematoda dan lainnya (Ou 1985). Akibat aktifitas patogen tersebut, menyebabkan penurunan produksi padi baik kuantitas maupun kualitas.
Cendawan Patogen Terbawa Benih Padi
5 cendawan patogen masuk ke dalam jaringan tanaman dan benih melalui lubang alami, seperti hidatoda, lentisel, mikrofil, dan pembukaan stomata, dan melalui luka oleh hujan, pasir, hewan, serangga, manusia, dan mikroorganisme lainnya, sedangkan cendawan patogen lain menggunakan tekanan mekanik, sekresi enzim degradasi atau keduanya untuk mempenetrasi jaringan tanaman dan benih secara langsung. Patogen pada benih dan jaringan inang menyebabkan adanya gejala atau tanda penyakit pada tanaman. Namun, beberapa cendawan tidak menghasilkan gejala selama siklus hidupnya di dalam jaringan tanaman inang (Agarwal dan Sinclair 1997).
Cendawan patogen terbawa benih padi dapat dikelompokkan menjadi 3 yaitu, cendawan patogen terbawa benih penyebab penyakit pada daun padi, cendawan patogen terbawa benih penyebab penyakit pada batang, pelepah dan akar padi, dan cendawan patogen terbawa benih penyebab penyakit pada biji. Penyakit paling penting yang disebabkan oleh cendawan patogen terbawa benih yaitu blas, hawar pelepah, busuk akar, dan penyakit pada pembibitan karena menghancurkan tanaman apabila lingkungan dan kondisi pertanaman sesuai bagi perkembangan patogen (Agarwal dan Sinclair 1997).
Kerugian yang ditimbulkan oleh cendawan patogen terbawa benih antara lain pertumbuhan tanaman yang kurang baik dan tersedianya sumber inokulum patogen sejak awal tanaman tumbuh di lapangan. Cendawan patogen terbawa benih juga dapat menurunkan kualitas benih seperti daya kecambah benih menurun, bahkan beberapa cendawan patogen tertentu tidak hanya menurunkan kualitas benih, juga menyebabkan benih yang terinfeksi menjadi sangat beracun (Sutopo 1993).
Cendawan merupakan kelompok patogen yang dapat terbawa benih padi. Menurut data UPT Balai Pengawasan dan Sertifikasi Benih Sumatera Utara (BPSB SUMUT 2013), cendawan patogen yang sering menginfeksi benih padi antara lain Aspergillus sp., Fusarium sp., Pyricularia oryzae, Alternaria padwickii, Helminthosporium sp., dan Cercospora oryzae. A. padwickii
merupakan salah satu cendawan terbawa benih padi yang dilaporkan paling sering dan paling banyak menginfeksi benih padi (Astuti et al. 2009). Tingkat infeksi oleh A. padwickii pada tanaman padi mencapai 80-90% di daerah Tropis (Mew dan Gonzales 2002).
Penyakit busuk batang oleh Sclerotium oryzae Catt. dapat menimbulkan kehilangan hasil panen padi sebesar 10-80%. Rhizoctonia solani Kuhn penyebab penyakit hawar pelepah daun menurunkan produksi padi hingga 20%, dan penyakit bakanae yang disebabkan oleh F. moniliforme pernah dilaporkan tahun 1938 di daerah Cirebon juga menurunkan hasil panen padi. Kehilangan hasil padi yang disebabkan Helminthosporium oryzae di Indonesia pernah mencapai 100% pada pertanaman padi gogo. Penyakit blas yang disebabkan oleh cendawan patogen P. oryzae merupakan salah satu penyakit penting pada tanaman padi di seluruh dunia dengan kehilangan hasil berkisar antara 50-90% (Utami et al. 2005).
Cendawan Endofit Tanaman Padi
6
6
Penggunaan istilah endofit sering digunakan untuk organisme yang menginfeksi secara internal, dimana jaringan inang yang terinfeksi setidaknya tanpa gejala untuk sementara, berlaku untuk prokariot dan eukariot. Endofitik mencakup kumpulan mikroorganisme dengan strategi hidup yang berbeda yaitu mengikuti fase pertumbuhan endofit, tumbuh saprofit pada jaringan yang mati atau gugur, mikroorganisme avirulen, tetapi juga patogen laten dan patogen virulen pada tahap awal infeksi. Interaksi parasit dapat bervariasi dari mutualistik sampai komensalistik pada patogen laten dan eksploitatif (Schulz dan Boyle 2005).
Cendawan endofit adalah kelompok mikroorganisme sangat beragam dan dapat berkembang dalam jaringan tanaman yang ada di atas tanah serta di bawah tanah, termasuk batang, daun, dan akar tanpa menimbulkan gejala (Kusari et al. 2012). Cendawan endofit adalah cendawan yang mampu hidup di dalam jaringan tanaman. Cendawan endofit terdapat di semua bagian tanaman, terutama di bagian daun. Pada jaringan tanaman sehat, cendawan endofit dapat berperan sebagai epifit, endofit, atau patogen laten (Maheswari 2006). Cendawan endofit bersimbiosis mutualisme pada inangnya untuk mendapatkan nutrisi dari hasil metabolisme tanaman dan memproteksi tanaman dari herbivora, serangga, atau patogen, sedangkan tanaman mendapatkan derivat nutrisi dan senyawa aktif yang diperlukan selama hidupnya (Simarmata et al. 2007). Cendawan endofit dapat ditemukan hampir di seluruh jenis tanaman, termasuk pada tanaman padi.
Beberapa contoh spesies cendawan endofit yang mendominasi tanaman padi yaitu Fusarium sp., Penicillium sp., Aspergillus sp., Paecilomyces sp.,
Gilmaniella sp., Arthrobotrys foliicola Matsush., Trichoderma sp., Trichocladium
sp., dan Nigrospora sp. (Zakaria et al. 2010; Manurung et al. 2014). Fusarium sp. banyak membentuk populasi pada bagian daun sebesar 40.9% dan pada bagian akar sebesar 56.9%. Nigrospora sp. diketahui sebagai cendawan patogen benih pada tanaman padi, tetapi bukan termasuk patogen yang menimbulkan kerusakan berarti pada padi. Terdapat hubungan simbiosis mutualisme antara cendawan endofit dan tumbuhan inangnya yaitu hubungan yang saling menguntungkan.
Cendawan endofit dapat melindungi tumbuhan inang dari serangan patogen dengan senyawa yang dikeluarkan oleh cendawan endofit. Senyawa yang dikeluarkan cendawan endofit berupa senyawa metabolit sekunder yang merupakan senyawa bioaktif dan dapat berguna dalam menghambat dan mengendalian pertumbuhan cendawan patogen. Tumbuhan inang menyediakan nutrisi yang dibutuhkan oleh mikroba endofit untuk melengkapi siklus hidupnya (Sunarminingsih 2002).
Ketika cendawan endofit dapat berkembang dari tanaman yang terinfeksi cendawan patogen, ketahanan tanaman terhadap serangan patogen bisa dipicu oleh cendawan endofit. Pertahanan tanaman yang berhubungan dengan cendawan endofit meningkat melalui peningkatan ketahanan dan produksi metabolit sekunder (Gao et al. 2010).
7 antimikroba seperti fitoaleksin; (3) perangsangan pertumbuhan tanaman sehingga lebih tahan terhadap serangan patogen; (4) kolonisasi jaringan tanaman sehingga patogen sulit penetrasi; dan (5) hiperparasit (Gao et al. 2010).
Penelitian pemanfaatan cendawan endofit semakin berkembang. Sebagai contoh cendawan endofit Pestalotiopsis microspora (Speg.) diketahui berperan sebagai obat antikanker yang mengolonisasi sejenis pohon cemara di Himalaya. Beberapa spesies cendawan endofit lain diteliti sebagai sumber antikanker, antidiabetes. Cendawan endofit juga mampu menghasilkan senyawa metabolit yang berfungsi dalam pertahanan tanaman inang terhadap kondisi lingkungan yang ekstrim, seperti Curvularia sp. pada tanaman di daerah gunung berapi di Amerika Serikat (Maheswari 2006).
Beberapa cendawan telah diketahui mampu menekan infeksi penyakit pada tanaman yang disebabkan oleh patogen Xylariaceae, Calocybe gambosa (Fr.) Donk, Resinicium friabile Hjortstam & Melo,dan Aschersonia Endl. merupakan cendawan endofit yang mampu menekan keparahan penyakit busuk buah alpukat (Tondok et al. 2012). Fusarium solani (Mart.) Sacc., Acremonium zeae W. Gams & D.R. Sumner, Verticillium sp., P. cassiae, Muscodor albus Worapong,
Periconia sp., Ampelomyces sp., Neotyphodium lolii (Latch, M.J. Chr. & Samuels) adalah cendawan endofit yang telah dikembangkan sebagai pengendali hayati terhadap hama dan penyakit pada tanaman (Gao et al. 2010). Hasil penelitian Melliawati et al. (2006) menunjukkan bahwa cendawan endofit dapat menghasilkan senyawa aktif yang berguna untuk memproteksi serangan mikroba patogen tanaman, seperti Xanthomonas campestris, Pseudomonas solanacearum
A.C Hayward, Colletroticum gloeosporioides (Penz.) Penz. & Sacc, dan
F.oxysporum. Hasil analisis menunjukkan bahwa endofit ternyata mengandung senyawa aktif steroid yang mampu menghambat pertumbuhan mikroba patogen.
Cendawan endofit Trichoderma spp. dilaporkan dapat meningkatkan ketahanan terinduksi tanaman kedelai terhadap penyakit layu Fusarium, memacu pertumbuhan tinggi tanaman kedelai, cendawan saprofit T. harzianum dan T. hamtum memacu keluarnya bunga lebih awal, menambah polong isi dan bobot biji kering kedelai per tanaman (Sudantha 2010). Cendawan endofit Taxomyces andreanae D. Stierle & W.M. Hessyang mampu menghasilkan senyawa antikanker, yaitu taxol. Senyawa ini ternyata juga dihasilkan oleh tumbuhan inangnya yaitu Taxus brevifolia bark. Cendawan endofit mampu menghasilkan senyawa yang sama dengan senyawa yang dihasilkan oleh tumbuhan inangnya, namun hal ini jarang terjadi. Senyawa yang dihasilkan cendawan endofit umumnya berbeda dengan senyawa yang dihasilkan oleh tumbuhan inangnya (Strobel 2003).
Metabolit Cendawan Endofit
8
8
bahkan strain yang spesifik, dan hanya diproduksi pada kondisi-kondisi tertentu (Dewick 1999). Mekanisme elisitor endofit menginduksi metabolit sekunder adalah mirip dengan stimulasi ketahanan tanaman. Kolonisasi cendawan endofit mensekresi enzim hidrolase dari sel tanaman untuk membatasi pertumbuhan cendawan, dengan demikian fragmen endofit bertindak sebagai elisitor, yang diproduksi dari hidrolisasi. Elisitor seperti lipopolisakarida, polisakarida dan glikoprotein akan merangsang pertahanan tanaman dan metabolit sekunder tanaman yang akan menekan pertumbuhan patogen (Gao et al. 2010).
Metabolit sekunder diduga merupakan produk samping (waste products) dari proses metabolisme primer dan tidak dimanfaatkan oleh organisme yang menghasilkan metabolit sekunder. Alasannya, sebagai waste product, metabolit sekunder harus bersifat tidak dapat lagi dimanfaatkan oleh organisme penghasilnya. Namun pada kenyataannya, beberapa alkaloid seperti asam-amino non protein, glikosida sianogen (kesemuanya metabolit sekunder) masih dapat mengalami biodegradasi dan dimanfaatkan pada masa germinasi dari spora organisme penghasil metabolit. Eksplorasi metabolit sekunder secara ekstensif dan intensif dilengkapi dengan pengembangannya ternyata tidak hanya menghasilkan senyawa bersifat antibiotik saja tetapi juga sifat farmako-aktif lainnya seperti: antifungal, antiviral, antitumor, sitotoksik, imunosupresif, promotor pertumbuhan, antiparasitik, insektisida, herbisida (Sunarminingsih 2002).
Berbagai cendawan endofit telah diisolasi dari tanaman inangnya dan berhasil dibiakkan dalam media pertumbuhan yang sesuai. Demikian pula metabolit sekunder yang diproduksi oleh mikroba endofit tersebut telah berhasil diisolasi dan dimurnikan serta telah dielusidasi struktur molekulnya. Mikroba endofit yang menghasilkan antibiotik kriptokandin adalah antifungal yang dihasilkan oleh cendawan endofit Cryptosporiopsis quercina Petr. yang berhasil diisolasi dari tanaman obat Tripterigeum wilfordii, dan bersifat sebagai antifungal terhadap cendawan penyebab penyakit pada manusia yaitu Candida albicans
(Strobel et al. 1999). Cendawan endofit Pestalotiopsis micrispora menghasilkan metabolit sekunder asam ambuik yang berkhasiat sebagai antifungal (Li et al. 2001). Phomopsichalasin merupakan metabolit yang diisolasi dari cendawan endofit Phomopsis spp. Berdasarkan penelitian Silva et al. (2006), cendawan endofit Phomopsis cassiae Sousa da Camara menghasilkan metabolit sekunder yaitu etil 2,4-dihydroxy-5,6-dimethylbenzoate dan phomopsilactone. Metabolit sekunder tersebut berperan sebagai antifungal terhadap cendawan patogen
9
METODE
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan pada bulan Juli 2014 sampai dengan Juni 2015. Tahap penelitian isolasi cendawan endofit dilakukan di Laboratorium Balai Proteksi Tanaman Pangan dan Hortikultura 1, Medan. Tahap uji in vitro dan in vivo dilakukan di Laboratorium Mikologi Tumbuhan Departemen Proteksi Tanaman Fakultas Pertanian, Institut Pertanian Bogor.
Bahan dan Alat
Bahan yang digunakan adalah isolat cendawan endofit dari tanaman padi dan benih padi varietas Ciherang (nasional) dan varietas Kukubalam (lokal) Sumatera Utara, alkohol 70%, NaOCl 1%, akuades steril, kertas saring Whatman no.1, media PDA (Potatoes Dextrose Agar), media GYP (Glucose Yeast Pepton) dengan komposisi glukosa 10 g, yeast ekstrak 5 g, pepton 5 g, gliserol 10 g, sodium klorida 5 g dilarutkan dalam 1 liter akuades, isolat cendawan patogen terbawa benih padi, dan fungisida sintetik (bahan aktif mankozeb 80%). Alat yang digunakan adalah shaker, sentrifus, inkubator, lampu Near Ultraviolet (NUV),
Laminar Air Flow (LAF), cork borer berdiameter 0.6 cm, Pyrolisis Gas Chromatography Mass Spectrometry (Py-GC-MS), vorteks, autoklaf dan corong pisah.
Isolasi Cendawan Endofit
Contoh akar, batang, daun padi dan benih tanaman padi yang sehat varietas Ciherang dan varietas Kukubalam asal Sumatera Utara dicuci dengan air mengalir untuk menghilangkan tanah dan kotoran yang menempel. Sampel ditiriskan di dalam cawan petri steril, lalu dipotong-potong dengan pisau steril. Contoh bagian tanaman tersebut disterilisasi permukaan dengan alkohol 70% selama 30 detik, direndam dalam NaOCl 1% selama 2 menit, dan dibilas dengan akuades steril 3 kali, lalu dikeringanginkan. Potongan akar, batang, dan daun yang sudah disterilkan tersebut ditanam pada media PDA dalam cawan petri steril dan diinkubasi pada suhu ruang (25 oC) selama 7 hari (modifikasi metode Rodrigues 1994). Hasil isolasi cendawan endofit dimurnikan pada media PDA dalam cawan petri dan disimpan pada suhu ruang.
Uji Patogenisitas Cendawan Endofit
10
10
untuk setiap isolat cendawan endofit di dalam cawan petri dan diinkubasi selama 2 minggu. Pengamatan dilakukan pada hari ke-14 terhadap perkecambahan benih padi yang sehat dan yang menunjukkan gejala nekrotik. Biakan cendawan endofit yang tidak menginfeksi perkecambahan benih padi disimpan sebagai isolat cendawan endofit untuk penelitian selanjutnya.
Isolasi Cendawan Patogen Terbawa Benih Padi
Blotter test merupakan suatu metode untuk mendeteksi cendawan patogen terbawa benih. Pada pengujian blotter sebanyak 400 benih padi ditanam pada media kertas saring lembab dalam cawan petri. Jumlah benih yang disemai sebanyak 25 bulir benih untuk setiap cawan dan diinkubasi pada suhu ruang selama 7 hari di bawah sinar NUV 12 jam terang 12 jam gelap secara bergantian. Pada hari ke-2 inkubasi, cawan dipindahkan ke dalam freezer pada suhu -20 oC selama 24 jam, selanjutnya cawan dipindahkan kembali ke dalam ruang inkubasi selama 5 hari berikutnya. Pengamatan dilakukan pada hari ke-8 setelah perlakuan benih. Cendawan patogen yang tumbuh di permukaan benih diidentifikasi di bawah mikroskop stereo dan mikroskop compound. Identifikasi cendawan patogen menggunakan kunci identifikasi Barnett dan Hunter (1998). Pengamatan dilakukan terhadap karakteristik pertumbuhan cendawan pada benih yang telah diinkubasi. Cendawan patogen diisolasi dengan menggunakan media PDA steril (ISTA 2014).
Uji Antagonis Isolat Cendawan Endofit terhadap Cendawan Patogen
Uji antibiosis secara in vitro dilakukan terhadap semua cendawan endofit yang tidak menyebabkan nekrotik dari hasil uji patogenisitas. Pengujian dilakukan mengikuti metode Santoso dan Sumarni (2008) yang telah dimodifikasi. Pengujian dengan menumbuhkan biakan murni cendawan patogendan masing-masing koloni isolat cendawan endofit padi umur 7 hari sebanyak satu cork borer
pada cawan petri yang telah berisi media PDA (Gambar 2). Perlakuan diulang sebanyak 10 kali dan pengamatan dilakukan selama 7 hari. Pengaruh penghambatan cendawan endofit terhadap cendawan patogen dihitung dengan rumus persentase:
Daya Hambat = x 100%
Keterangan:
R1 = jari-jari koloni hifa patogen yang tumbuh menjauhi koloni endofit (cm) R2 = jari-jari koloni hifa patogen yang tumbuh mendekati koloni endofit (cm)
11 patogen pada media PDA secara in vitro
Produksi dan Analisis Senyawa Metabolit Cendawan Endofit
Dipilih 3 isolat cendawan endofit dari hasil uji antibiosis yang mempunyai daya hambat paling besar. Tiga isolat cendawan endofit terpilih selanjutnya digunakan untuk pengujian senyawa metabolit. Pengujian dilakukan mengikuti metode Margino (2008) yang telah dimodifikasi. Isolat murni cendawan endofit ditumbuhkan di dalam 100 mL medium cair GYP dan di-shaker selama 7 hari dengan kecepatan 150 rpm. Suspensi cendawan endofit disaring secara bertahap menggunakan kertas saring Whatman no.1. Selanjutnya suspensi disentrifugasi pada kecepatan 5000 rpm selama 20 menit lalu disaring kembali. Metabolit yang sudah disaring selanjutnya digunakan untuk pengujian daya hambat pada uji in vitro dan analisis kualitatif senyawa metabolit dengan metode analisis Py-GC-MS. Analisis senyawa metabolit cendawan endofit melalui Py-GC-MS dilakukan di Litbang Hasil Hutan, Pusat Penelitian dan Pengembangan Kehutanan Gunung Batu, Bogor.
Uji Senyawa Metabolit Cendawan Endofit
12
12
Daya Hambat = x 100%
Keterangan:
D1 = diameter hifa cendawan patogen sebagai kontrol negatif (cm) D2 = diameter hifa cendawan patogen sebagai perlakuan (cm)
Dari hasil uji in vitro dipilih 2 perlakuan senyawa metabolit dengan daya hambat paling besar untuk digunakan dalam uji selanjutnya yaitu uji in vivo.
Uji In Vivo Senyawa Metabolit Cendawan Endofit
Dua senyawa metabolit cendawan endofit terpilih diuji secara in vivo untuk perlakuan benih. Pengujian dilakukan mengikuti metode Ilyas et al. (2007) yang dimodifikasi. Sebanyak 100 benih padi varietas Kukubalam direndam di dalam 10 ml suspensi senyawa metabolit cendawan endofit selama 24 jam, selanjutnya benih dikeringanginkan. Benih padi yang sudah diberi perlakuan tersebut diuji dengan menggunakan metode blotter test dan growing on test. Pengujian blotter test dilakukan sama seperti pada pengujian untuk mendeteksi dan mengisolasi cendawan patogen terbawa benih. Pengujian growing on test sebanyak 25 benih padi ditanam pada media agar air, lumpur, dan pada kertas gulung dalam plastik (UKDp). Masing-masing perlakuan diulang sebanyak 4 kali. Pada blotter test,
pengamatan dilakukan terhadap tingkat infeksi cendawan pada benih padi pada hari ke-8. Pada growing on test, pengamatan dilakukan terhadap benih yang berkecambah di media agar air, lumpur dan kertas gulung, sedangkan pengamatan dilakukan terhadap tingkat infeksi patogen pada media agar air dan lumpur pada hari ke-15. Tingkat infeksi dihitung dengan rumus berikut:
Tingkat infeksi = x 100%
Keterangan: A = jumlah tanaman terinfeksi B = jumlah tanaman yang tumbuh
Analisis Data
Pengujian penghambatan pertumbuhan cendawan patogen dengan uji metabolit menggunakan rancangan acak lengkap (RAL) dengan masing-masing ulangan sebanyak 5 kali. Data yang diperoleh diolah dengan menggunakan program Microsoft Office Excel 2007 dan Statistical Analisis System (SAS) for Windows versi 9.1.3. Perlakuan yang menunjukkan beda nyata diuji lanjut dengan uji selang berganda duncan pada taraf 5%.
D1-D2 D1
13
HASIL DAN PEMBAHASAN
Isolat Cendawan Endofit Tanaman Padi
Sebanyak 30 isolat cendawan endofit berhasil diisolasi dari bagian akar, batang, dan daun tanaman padi sehat varietas Ciherang dan Kukubalam asal Sumatera Utara (Tabel 1). Isolat cendawan endofit terbanyak diisolasi dari tanaman padi varietas Ciherang berasal dari daun sedangkan pada varietas Kukubalam isolat cendawan endofit yang paling banyak berasal dari akar. Cendawan endofit adalah cendawan yang hidup di dalam jaringan tanaman, sehingga hidupnya tidak terlepas dari pengaruh metabolisme tanaman inang. Cendawan endofit hidup dan menempati bagian-bagian organ tanaman seperti akar, daun, batang, ranting, xilem, dan benih. Dominasi spesies cendawan endofit yang mengolonisasi bagian tanaman inang dapat berbeda dari masing-masing bagian tanaman maupun varietas tanaman. Keragaman cendawan endofit dalam mengolonisasi tanaman inang dipengaruhi oleh beberapa faktor, diantaranya perbedaan varietas tanaman inang, curah hujan, dan lokasi pengambilan sampel (Petrini 1992).
14
14
Uji Patogenisitas Cendawan Endofit
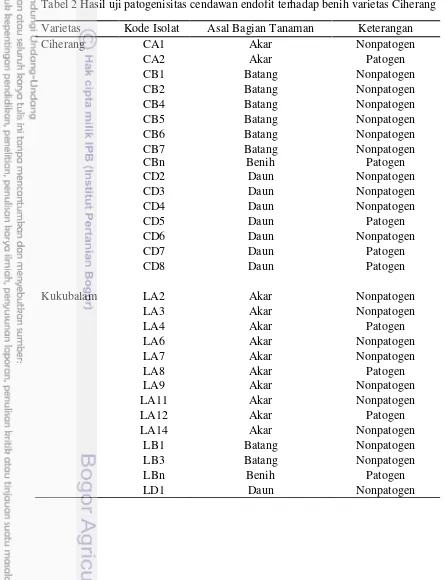
Berdasarkan hasil uji patogenisitas terhadap 30 isolat cendawan endofit yang telah diisolasi dari padi varietas Ciherang dan varietas Kukubalam sebanyak 21 isolat cendawan endofit bersifat tidak patogen, yaitu tidak menimbulkan nekrotik pada kecambah padi sehingga digunakan untuk uji selanjutnya (Tabel 2 dan Gambar 3).
Tabel 2 Hasil uji patogenisitas cendawan endofit terhadap benih varietas Ciherang Varietas Kode Isolat Asal Bagian Tanaman Keterangan
Ciherang CA1 Akar Nonpatogen
CA2 Akar Patogen
Kukubalam LA2 Akar Nonpatogen
15
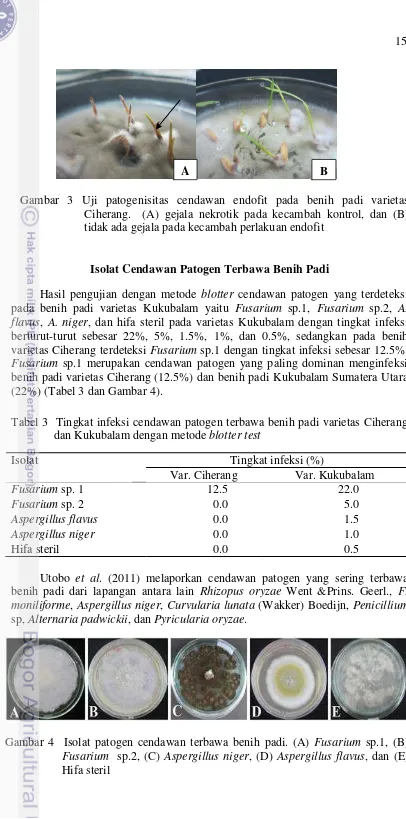
Isolat Cendawan Patogen Terbawa Benih Padi
Hasil pengujian dengan metode blotter cendawan patogen yang terdeteksi pada benih padi varietas Kukubalam yaitu Fusarium sp.1, Fusarium sp.2, A. flavus, A. niger, dan hifa steril pada varietas Kukubalam dengan tingkat infeksi berturut-turut sebesar 22%, 5%, 1.5%, 1%, dan 0.5%, sedangkan pada benih varietas Ciherang terdeteksi Fusarium sp.1 dengan tingkat infeksi sebesar 12.5%.
Fusarium sp.1 merupakan cendawan patogen yang paling dominan menginfeksi benih padi varietas Ciherang (12.5%) dan benih padi Kukubalam Sumatera Utara (22%) (Tabel 3 dan Gambar 4).
Tabel 3 Tingkat infeksi cendawan patogen terbawa benih padi varietas Ciherang dan Kukubalam dengan metode blotter test
Isolat Tingkat infeksi (%)
Var. Ciherang Var. Kukubalam
Fusarium sp. 1 12.5 22.0
Fusarium sp. 2 0.0 5.0
Aspergillus flavus 0.0 1.5
Aspergillus niger 0.0 1.0
Hifa steril 0.0 0.5
Utobo et al. (2011) melaporkan cendawan patogen yang sering terbawa benih padi dari lapangan antara lain Rhizopus oryzae Went &Prins. Geerl., F. moniliforme, Aspergillus niger, Curvularia lunata (Wakker) Boedijn, Penicillium
sp, Alternaria padwickii, dan Pyricularia oryzae.
Gambar 4 Isolat patogen cendawan terbawa benih padi. (A) Fusarium sp.1, (B)
Fusarium sp.2, (C) Aspergillus niger, (D) Aspergillus flavus, dan (E) Hifa steril
Gambar 3 Uji patogenisitas cendawan endofit pada benih padi varietas Ciherang. (A) gejala nekrotik pada kecambah kontrol, dan (B) tidak ada gejala pada kecambah perlakuan endofit
16
16
Daya Hambat Isolat Cendawan Endofit terhadap Fusarium sp.1
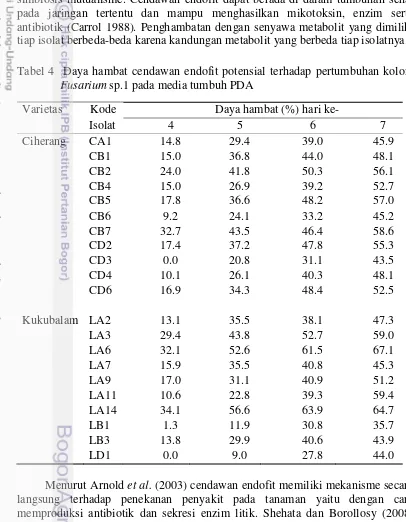
Hasil uji antagonis terhadap Fusarium sp.1 menunjukkan seluruh isolat cendawan endofit mampu menghambat pertumbuhan koloni cendawan patogen
Fusarium sp.1 antara 35.7-67.1% pada hari ke-7. Sebanyak 11 isolat cendawan endofit di antaranya mempunyai daya hambat lebih dari 50% (Tabel 4). Isolat cendawan endofit LA6, LA11, dan LA14 merupakan cendawan endofit yang sangat berpotensi menekan pertumbuhan cendawan patogen (Fusarium sp.1), masing-masing dengan daya hambat 67.1%, 59.3%, dan 64.7%.
Interaksi antara cendawan endofit dan tanaman inangnya umumnya bersifat simbiosis mutualisme. Cendawan endofit dapat berada di dalam tumbuhan sehat pada jaringan tertentu dan mampu menghasilkan mikotoksin, enzim serta antibiotik (Carrol 1988). Penghambatan dengan senyawa metabolit yang dimiliki tiap isolat berbeda-beda karena kandungan metabolit yang berbeda tiap isolatnya. Tabel 4 Daya hambat cendawan endofit potensial terhadap pertumbuhan koloni
Fusarium sp.1 pada media tumbuh PDA
Varietas Kode Daya hambat (%) hari
ke-Isolat 4 5 6 7
17 menyatakan bahwa salah satu sifat mikroba antagonis adalah pertumbuhannya lebih cepat dibanding dengan patogen dan menghasilkan senyawa antibiotik yang dapat menghambat pertumbuhan patogen. Setiap tanaman tingkat tinggi pada dasarnya mengandung beberapa mikroba endofit yang mampu menghasilkan senyawa metabolit di dalam tanaman inangnya. Kemampuan mikroba endofit menghasilkan senyawa metabolit sesuai dengan tanaman inangnya merupakan peluang yang sangat besar untuk memproduksi metabolit sekunder dari mikroba endofit (Radji 2005).
Daya Hambat Senyawa Metabolit Cendawan Endofit
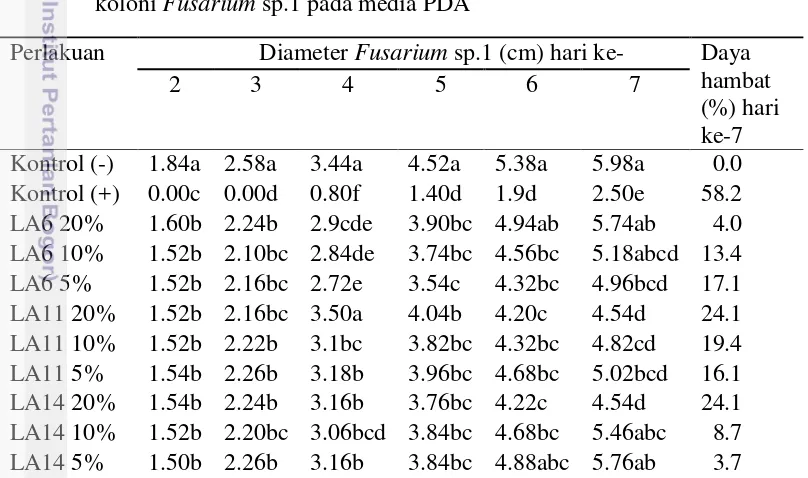
Penambahan senyawa metabolit cendawan endofit pada media tumbuh PDA mampu menekan pertumbuhan koloni cendawan Fusarium sp.1. Perlakuan senyawa metabolit isolat cendawan endofit LA11 dan LA14 pada konsentrasi 20% mampu menekan pertumbuhan koloni Fusarium sp.1 secara nyata, yaitu dengan daya hambat sebesar 24.08% (Tabel 5 dan Gambar 5). Kedua isolat ini kemudian digunakan dalam uji selanjutnya yaitu uji in vivo.
Cendawan endofit akan mengeluarkan suatu senyawa metabolit sekunder yang merupakan senyawa antibiotik. Metabolit sekunder merupakan senyawa yang disintesis oleh suatu mikroba, tidak untuk memenuhi kebutuhan primernya (tumbuh dan berkembang) tetapi untuk mempertahankan eksistensinya dalam berinteraksi dengan lingkungannya. Metabolit sekunder yang dihasilkan oleh cendawan endofit merupakan senyawa antibiotik yang mampu melindungi tanaman dari serangan serangga hama, mikroorganisme patogen, atau hewan Tabel 5 Pengaruh senyawa metabolit cendawan endofit terhadap pertumbuhan
koloni Fusarium sp.1 pada media PDA
18
18
pemangsanya, sehingga dapat dimanfaatkan sebagai agen biokontrol. Belum banyak diketahui senyawa apa yang terkandung di dalam metabolit yang dimiliki cendawan endofit, namun beberapa penelitian telah dianalisis senyawa yang terkandung. Metabolit sekunder yang dihasilkan oleh mikroba endofit dari rerumputan adalah kelompok alkaloid diantaranya peramin, ergovaline, tamin, dan lolitrem (Wang et al. 2002).
1
2
3
Gambar 5 Pengaruh senyawa metabolit cendawan endofit terhadap pertumbuhan
Fusarium sp.1 (1) metabolit isolat LA6, (2) metabolit isolat LA11 dan (3) metabolit isolat LA14 dengan perlakuan A) kontrol (-), B) konsentrasi metabolit 5%, C) konsentrasi 10%, D) konsentrasi 20%, dan E) kontrol (+) pada hari ke-7.
Aplikasi senyawa metabolit cendawan endofit LA6 menunjukkan kemampuannya menghasilkan senyawa pemacu pertumbuhan patogen yang ditunjukkan dari semakin besar konsentrasi senyawa metabolit yang dihasilkan maka semakin cepat pula pertumbuhan cendawan patogen Fusarium sp.1. Selain menghasilkan senyawa metabolit yang mampu menghambat pertumbuhan cendawan patogen, cendawan endofit juga memiliki senyawa yang terkandung dalam metabolit yang dapat memicu pertumbuhan patogen. Berbagai jenis senyawa metabolit sekunder, seperti alkaloid, indol, steroid, terpenoid, quinon, flavonoid berhasil diisolasi dari mikroba endofit (Tan dan Zou 2001).
Analisis Senyawa Metabolit Cendawan Endofit
Senyawa metabolit cendawan endofit LA11 dan LA14 dianalisis dengan menggunakan Py-GC-MS. Jumlah senyawa yang terdapat dalam ekstrak ditunjukkan oleh jumlah puncak (peak) pada kromatogram dan nama/jenis
19 senyawa yang ada diintepretasikan berdasarkan data spektra dari setiap puncak tersebut dengan menggunakan metode pendekatan pustaka pada database GC-MS (Hendrayana 1994).
Pengujian Py-GC-MS terhadap senyawa metabolit LA11 dan LA14 menunjukkan metabolit LA11 terdiri dari 32 senyawa, sedangkan metabolit LA14 terdiri dari 20 senyawa (Tabel 6 dan 7). Berdasarkan literatur, senyawa yang bersifat antifungal pada metabolit LA11 antara lain 1) palmitic acid (6.32%), 2)
lauric acid (4.98%), 3) acetic acid (3.21%), 4) phosphonic acid (3%), 5) phenol,
5 2-Methyl-2,4-pentanediol 0.67
6 Corylon 0.83
7 Glycerol 16.80
8 1H-pyrrole-2-carbonitrile 2.63
9 cis-Butenediol 2.78
10 1,4-Dimethoxy-2-butyne 2.00
11 Indole 3.16
12 Phenol, 2,6-Dimethoxy 2.81 Antifungal
13 Carbazic acid, 3-pentylidene-, ethyl ester 2.63
14 Phosphonic acid 3.00 Antifungal
15 Cyclohexanone, 3-methyl 2.85
16 Lauric acid 4.98 Antifungal
17 2,4-dimethyl-s-triazolo(1,5-a) pyridine 2.41 18 3-ethyl-5-and 6-hexyl-2-oxo-1,4-dioxane 4.59
19 2-Cyclohexenol 6.26
20 1,4-diaza-2,5-dioxobicyclo[4.3.0] nonane 6.75
21 Benzenesulfonic acid, p-hydroxy 1.43
22 m-Phenoxybenzyl alcohol 0.80
23 2,2,5-Trimethyl-4,5-tetramethylene
-3-imidazoline-3-oxide
1.74
24 Palmitic acid 6.32 Antifungal
25 Molybdaen, dicarbonylbis(hapto
-4-2-methylencycloheptanon)
1.56
26 1-Tetradecene 3.60
27 9-Hexadecenoic acid 3.33
28 2,5-Piperazinedione, 3,6-bis
(2-methylpropyl)-
31 1-Benzyl-3-phenyl-2-pyrazoline 1.27
20
20
Palmitic acid dan lauric acid telah diketahui sangat berpotensi sebagai antifungal dan mampu menghambat pertumbuhan cendawan patogen tumbuhan antara lain Aspergillus niger, Cucumerinum lagenarium, F. oxysporum (Altieri et al. 2007; Liu et al. 2008). Phosphonic acid dengan konsentrasi 552 µg/ml mampu menekan pertumbuhan cendawan patogen Phythophthora citricola Sawada dan P. cinnamomi Rands hingga mencapai 100%. Selain itu, phosphonic acid mampu menekan cendawan patogen Rhizoctonia solani Kuhn dan Alternaria alternata
(Fr.) Keissl. dengan daya hambat sebesar 38% dan 59% (Fenn dan Coffey 1984). Asam asetat telah diketahui merupakan senyawa antifungal. Hasil penelitian Octaviani (2015), menunjukkan bahwa asam asetat yang dihasilkan Trichoderma harzianum dan Gliocladium sp. merupakan salah satu senyawa metabolit yang efektif menekan pertumbuhan cendawan patogen Botryodiplodia sp. secara in vitro berturut-turut sebesar 52.5% dan 46.5%.
Berdasarkan beberapa literatur, senyawa yang bersifat antifungal pada metabolit LA14 antara lain 1) 5,10-diethoxy-2,3,7,8-tetrahydro
-1h,6h-dipyrrolo[1,2-a;1',2'-d] pyrazine (3.20%), 2) 3-pyrrolidin-2-yl-propionic acid
(2.71%), 3) 2,5-piperazinedione, dan 3,6-bis(2-methylpropyl) (1.93%) (Tabel 7). Tabel 7 Senyawa metabolit yang dihasilkan cendawan endofit LA14 pada
7 3-Methylcyclohexanone 1.22
8 3-cyclohex-1-enyl-prop-2-enal 0.54
9 Iso-propyl phenyl ether 1.71
10 N-phenyl-n'-furaldehyde hydrazone 5.63
11 3-pyrrolidin-2-yl-propionic acid 2.71 Antifungal
12 1,4-diaza-2,5-dioxobicyclo[4.3.0]nonane 13.91 13 1,4-diaza-2,5-dioxo-3-isobutyl bicyclo
[4.3.0] nonane
1.39 14 1,4-diaza-2,5-dioxo-3-isobutyl bicyclo
[4.3.0]nonane
-1h,6h-21 Berdasarkan penelitian Jalaluldeen et al. (2015), senyawa metabolit sekunder seperti 5,10-diethoxy-2,3,7,8-tetrahydro-1h,6h-dipyrrolo[1,2-a;1',2'-d]
pyrazine dan 3-pyrrolidin-2-yl-propionic acid merupakan senyawa antifungal dengan konsentrasi terbesar yang dihasilkan bakteri endofit Streptomycetes
mampu menekan pertumbuhan cendawan patogen F. oxysporum dengan tingkat daya hambat hingga 70%.
Mekanisme perlindungan cendawan endofit dapat secara langsung melalui produksi antibiotik dan sekresi enzim litik. Sementara itu, pada mekanisme perlindungan tanaman secara tidak langsung melalui peningkatan pertahanan tanaman (Arnold et al. 2003). Aktivitas lain dari cendawan endofit adalah memproduksi antibiotik, seperti cendawan endofit Verticillium sp. yang memproduksi antibiotik pyrrocidines yang mampu menghambat perkembangan P. oryzae (You et al. 2009).
Pirolisis kromatografi gas spektrometri digunakan untuk mengetahui karakteristik dari makromolekuler volatil dan kompleks di dalam berbagai materi alam. Asam asetat merupakan senyawa yang sangat berperan sebagai antimiroba. Peranannya semakin meningkat apabila asam asetat disertai senyawa fenol (Darmadji 1995).
Pengaruh Senyawa Metabolit Cendawan Endofit secara In vivo
Hasil pengujian in vivo dengan metode blotter test dan growing on test
menunjukkan bahwa aplikasi senyawa metabolit isolat cendawan LA11 dan LA14 mampu menekan tingkat infeksi Fusarium sp.1 pada benih padi dan tidak mempengaruhi daya berkecambah benih padi.
Interaksi antara cendawan endofit dan tanaman inangnya umumnya bersifat simbiosis mutualisme. Cendawan endofit dapat berada di dalam tumbuhan sehat pada jaringan tertentu dan mampu menghasilkan mikotoksin, enzim serta antibiotik (Carrol 1988). Penghambatan terhadap pertumbuhan cendawan patogen dari tiap senyawa metabolit berbeda-beda karena kandungan senyawa metabolit yang berbeda tiap isolat.
Hasil pengujian dengan metode blotter test, senyawa metabolit LA11 dan LA14 pada taraf konsentrasi 20% mampu menekan tingkat infeksi Fusarium sp.1 pada benih padi masing-masing sebesar 36% dan 27% (Tabel 8).
22
22
Tabel 8 Pengaruh senyawa metabolit cendawan endofit terhadap tingkat infeksi patogen terbawa benih padi varietas Kukubalam dengan menggunakan metode blotter test
Perlakuan Tingkat infeksi Patogen (%) Penekanan tingkat infeksi (%)
Kontrol (-) 64 0
Kontrol (+) 3 61
LA11 28 36
LA14 37 27
Hasil pengujian dengan metode growing on test terhadap daya berkecambah menunjukkan aplikasi senyawa metabolit sekunder cendawan endofit tidak mempengaruhi daya kecambah benih padi (Tabel 9 dan Gambar 6). Namun aplikasi senyawa metabolit LA11 dan LA14 pada taraf konsentrasi 20% mampu menekan tingkat infeksi Fusarium sp.1 pada benih padi yang ditanam dalam media agar air masing-masing 43.9% dan 47.3%, sedangkan pada lumpur LA11 dan LA14 mampu menekan tingkat infeksi cendawan patogen Fusarium sp.1 pada benih padi masing-masing 29.1% dan 18.3% (Tabel 10).
Tabel 9 Pengaruh senyawa metabolit cendawan endofit terhadap daya kecambah benih padi dengan metode kertas gulung, media agar air, dan lumpur
Perlakuan Daya kecambah (%)
Kertas gulung Agar air Lumpur
Kontrol (-) 96 80 86
Kontrol (+) 99 90 90
LA11 98 88 86
LA14 100 88 84
23 Kemampuan cendawan endofit dalam meningkatkan daya berkecambah benih bergantung pada kemampuannya memproduksi sejumlah senyawa pemacu perkecambahan. Srivastava (2002) melaporkan bahwa konsentrasi auksin dapat mempengaruhi pertumbuhan radikula pada benih. Metabolit yang telah dilaporkan mampu diproduksi oleh cendawan endofit adalah indole acetic acid (IAA), giberelin, auksin, dan sitokinin (Khan et al. 2012). Hormon auksin, giberelin dan sitokinin telah diketahui berfungsi dalam mematahkan dormansi biji, sehingga perkecambahan benih dapat lebih baik dibandingkan dengan kontrol.
Tabel 10 Tingkat infeksi dan penekanan tingkat infeksi cendawan patogen
Fusarium sp.1 pada media agar air dan lumpur
Perlakuan Tingkat infeksi (%) Penekanan tingkat infeksi (%)
Agar air Lumpur Agar air Lumpur
Kontrol (-) 57.5 80.2 0.0 0.0
Kontrol (+) 1.1 35.6 56.4 44.7
LA11 13.6 51.2 43.9 29.1
LA14 10.2 61.9 47.3 18.3
Senyawa metabolit pada cendawan endofit berperan dalam menginduksi ketahanan tanaman terhadap patogen. Tidak hanya mampu menekan tingkat infeksi, aplikasi senyawa metabolit cendawan endofit LA11 dan LA14 secara umum juga mampu memperbaiki pertumbuhan tanaman dan sistem perakaran kecambah padi pada media agar air dan pada media lumpur (Gambar 7).
24
24
Sejumlah cendawan endofit dapat memproduksi senyawa-senyawa yang mampu menghambat perkembangan beberapa patogen tanaman seperti
polyketides clavatol, patulin, asam salisilat, asamjasmonat dan peroksidase (Zhang
et al. 2008; Segarra et al. 2007). Cendawan endofit dilaporkan dapat memicu pertumbuhan tanaman sehingga meningkatkan hasil tanaman (Silva et al. 2006). Kemampuan cendawan endofit dalam meningkatkan pertumbuhan tanaman bergantung pada kemampuannya dalam memproduksi senyawa metabolit pemacu pertumbuhan yang tinggi (Ramdan et al. 2013).
25
SIMPULAN DAN SARAN
Simpulan
Sebanyak 21 isolat cendawan endofit berhasil diisolasi dari tanaman padi. Tiga diantaranya menunjukkan penghambatan tertinggi terhadap cendawan patogen terbawa benih padi. Isolat cendawan endofit LA11 dan LA14 merupakan cendawan endofit potensial untuk menekan tingkat infeksi cendawan patogen terbawa benih padi. Perlakuan cendawan endofit dalam bentuk metabolit efektif menekan infeksi cendawan patogen terbawa benih padi. Tiga isolat dari 21 cendawan endofit yang diuji menunjukkan penghambatan tertinggi terhadap pertumbuhan Fusarium sp.1secara in vitro dan dari hasil uji metabolit, 2 diantaranya menunjukkan penghambatan tertinggi terhadap pertumbuhan Fusarium sp.1. Isolat LA11 mampu menekan pertumbuhan cendawan patogen terbawa benih (Fusarium
sp.1) sebesar 29.0% dari pengujian in vitro, pada pengujian in vivo yaitu pada media kertas gulung, media lumpur, pengujian blotter, media lumpur sebesar 6.6 sampai 43.9% dan isolat LA14 mampu menekan pertumbuhan cendawan patogen terbawa benih (Fusarium sp.1) sebesar 28.7% dari pengujian in vitro, pada pengujian in vivo yaitu 11.0 sampai 47.3%.
Saran
26
26
DAFTAR PUSTAKA
Agarwal VK, Sinclair JB. 1997. Principles of Seed Pathology. Second edition. New York (US): CRC Press, Inc.
Altieri C, Cardillo D, Bevilacqua A, Singaglia, M. 2007. Inhibition of Aspergillus
spp. and Penicillium spp. by fatty acids and their monoglycerides. J Food Protec.70:1206-1212.
Arnold AE, Mejia LC, Kyllo D, Rojas EI, Maynard Z, Robbins N, Herre EA. 2003. Fungal endophytes limit pathogen demage in a tropical tree. PNAS. 100:15649-15654.
Astuti D, Ilyas S, Daryono D. 2009. Pengaruh matriconditioning plus fungisida nabati atau sintetis terhadap vigor dan kesehatan benih padi (Oryza sativa) yang terinfeksi Alternaria Padwickii. Bogor (ID): Makalah Seminar Departemen Agronomi dan Hortikultura Fakultas Pertanian Institut Pertanian Bogor.
Barnett HL, Hunter BB. 1998. Illustrated Genera of Imperfect Fungi. Forth edition. New York (US): APS Press.
[BPS] Badan Pusat Statistik. 2015. Produksi padi tahun 2014 (angka sementara) diperkirakan turun 0.63 persen [internet]. [diacu 2015 September 3]. Tersedia dari: http://www.bps.go.id.
Caldwell BA, Jumpponen A, Trappe JM. 2000. Ulitization of major detrital subrates by dark-septate, root endophytes. Mycologia 92:230-232.
Carrol G. 1988. Fungal endophytes in stems and leaves: from latent pathogens to mutualistic symbiont. Ecology 69(1):2-9.
Clay K. 1988. Fungal endophytes of grasses: a defensive mutualism between plants and fungi. Ecology 69(1):10-16.
Darmadji P. 1995. Produksi Asap Cair dan Sifat-sifat Fungsionalnya. Yogyakarta (ID): UGM Pr.
Dewick PM. 1999. Medicinal Natural Products.A Biosynthetic Approach. England (GB): John Wiley & Sons Ltd.
Fenn ME, Coffey MD. 1984. Studies on the in vitro and in vivo antifungal activity of fosetyl-Al and phosphorous acid. Phytopathology 74:606-611.
Gao FK, Dai CC, Liu XZ. 2010. Mechanisms of fungal endophytes in plant protection against pathogens. Afr J Microbiol Res. 4(13):1346-1351. Grist DH. 1960. Rice. Formerly Agricultural Economist, Colonial Agricultural
Service, Malaya. London (ENG): Longmans, Green and Co Ltd.
Hussain H, Akhtar N, Draeger S, Schulz B, Pescitelli G, Salvadori P, Antus S, Kurtán T, Krohn K. 2009. New bioactive 2,3-epoxycyclohexenes and isocoumarins from the endophytic fungus Phomopsis sp. from Laurus azorica. Eur J Org Chem. 2009:749-756.
Ilyas S, Kadir TS, Yukti AM, Fiana Y, Fadhilah S, Nugraha US, Sudarsono. 2007. Efektifitas pestisida nabati dan agens hayati dalam mengendalikan patogen terbawa benih padi secara in vitro. Bogor (ID): Apresiasi Hasil Penelitian Padi.
27 Jalaluldeen AM, Sijam K, Othman R, Ahmad ZAM. 2015. Growth characteristics and production of secondary metabolites from selected streptomyces species isolated from the Rhizosphere of Chili Plant. IJERSTE 4(1):1-8. Khan SA, Hamayun M, Khan AL, Lee IJ, Shinwari ZK, Kim J. 2012. Isolation of
plant growth promoting fungi from dicots inhabiting coastal sand dunes of Korea. J. Bot. 44:1453-1460.
Kusari S, Verma VC, Lamshoeft M, Spiteller M. 2012. An endophytic fungus from Azadirachta indicaa juss that produces azadirachtin. World J Microbiol Biotechnol. 28:1287-1294.
Lehtonen, Helander M, Saikkonen K. 2005. Are endophyte-mediated effects on herbivores conditional on soil nutrient?. Oecologia 142:38-45. doi:10.1007/s00442-004-1701-5.
Lewis GC, Ravel C, Naffaa W, Astier C, Charmet G. 1997. Occurence of
Acremonium endophytes in wild population of Lulium spp. in European countries and relationship between level of infection and climate in France. Ann Appl Biol. 130:227-238.
Li JY, Harper JK, Grant DM, Tombe BO, Basyal B, Hess WM, Srobel GA. 2001. Ambuic acid, a highly functionalized cyclohexenone with antifungal activity from Pestalotiopsis spp. and Monochaetia spp. Pytochemistry
56:463-468.
Liu S, Weibin R, Jing L, Hua X, Jingan W, Yubao G, Jingguo W. 2008. Biological control of phytopathogenic fungi by fatty acids.
Mycopathologia 166:93-102.
Maheswari R. 2006. What is an endophytic fungus. Current Science 90:1309. Manurung IR, Pinem MI, Lubis L. 2014. Uji antagonisme jamur endofit terhadap
Cercospora oryzae Miyake dan Culvularia lunata (Wakk) Boed. dari tanaman padi di laboratorium. J online Agrotek. 2(4):15663-1571.
Margino S. 2008. Produksi metabolit sekunder (antibiotik) oleh isolat jamur endofit Indonesia. Majalah Farmasi Indonesia 19(2):86-94.
Melliawati R, Widyaningrum DN, Djohan AC, Sukiman H. 2006. Pengkajian bakteri endofit penghasil senyawa bioaktif untuk proteksi tanaman. Pusat penelitian bioteknologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI).
Biodiversitas 7:221-224.
Mew TW, Gonzales P. 2002. A Handbook of Rice Seedborne Fungi. New York (US): Science Publishers, Inc.
Octaviani EA. 2015. Potensi Trichoderma harzianum dan Gliocladium sp. untuk Pengendalian Botryodiplodia sp. pada Jabon (Anthocephalus cadamba) [tesis]. Bogor (ID): Institut Pertanian Bogor.
Ou SH. 1985. Rice Disease. USA (US): Commonwealth Mycological Institute. Petrini O. 1992. Fungal endhophytes of tree leaves. Andrews JH, Hirano SS,
editor. (GER): Springer Verlag.
Radji M. 2005. Peranan bioteknologi dan mikroba endofit dalam pengembangan obat herbal. Majalah Ilmu Kefarmasian 2(3):113-126.
28
Santoso SJ, Sumarni. 2008. Uji antagonisme mikroba fitoplan terhadap
Helminthosporium sorokinianum penyebab bercak daun tanaman gandum.
Jurnal Inovasi Pertanian 7(1):86-89.
Schulz BJE, Boyle CJC. 2005. The endophyte continuum. Mycol Res. 109:661-686.
Segarra G, Casanova E, Bellido D, Odena MA, Oliveira E, Trillas I. 2007. Proteome, salicylic acid, and jasmonic acid changes in cucumber plants inoculated with Trichoderma asperellum strain T34. Proteomics 21:3943-3952.
Shehata FS, Borollosy AM. 2008. Induction of resistance against Zuccini Yellow Mosaic Potyvirus and growth enhancement of squash plants using some plant growth promoting rhizobacteria. AJBAS 2:174-182.
Silva GH, Teles HL, Zanardi LM,Young MCM, Eberlin MN, Hadad R, Pfenning LH,Bolzani VS, Araujo AR. 2006. Cadinane sesquiterpenoids of
Phomopsis cassiae, an endophytic fungus associated with Cassia spectabilis (Leguminosae). Phytochemistry 67:1964-1969.
Simarmata R, Lekatompessy S, Sukiman H. 2007. Isolasi mikroba endofitik dari tanaman obat sambung nyawa Gynura procumbens dan analisis potensinya sebagai antimikroba. Jurnal Penelitian Hayati 13:85-90.
Siregar H. 1981. Budidaya Tanaman Padi di Indonesia. Jakarta (ID): PT Sastra Hudaya.
Soepardi G. 1983. Sifat dan Ciri Tanah. Bogor (ID): Institut Pertanian Bogor. SrivastavaLM. 2002. Plant Growth and Development, Hormones and
Environment. Orlando (US): Academic Press.
Strobel GA, Miller RV, Miller C, Condron M, Teplow DB, Hess WM. 1999. Cryptocandin, a potent antimycotic from endophytic fungus
Cryptosporiopsis quercina. Microbiology 145:1919-1926.
Strobel GA. 2003. Endophytes as sources of bioactive products. Microbes Infect.
5:535-544.
Sudantha IM. 2010. Pengujian beberapa jenis jamur endofit dan saprofit
Trichoderma spp. terhadap penyakit layu fusarium pada tanaman kedelai.
Agroteksos. 20(2-3):90-102.
Sunarminingsih R. 2002. Metabolit sekunder: Manfaat dan Perkembangannya dalam Dunia Farmasi. Yogyakarta (ID): Universitas Gadjah Mada.
Suryana A, Mardianto S, Kariyasa K, Wardana IP. 2009. Kedudukan Padi dalam Perekonomian Indonesia. Balai Besar Penelitian Tanaman Padi.
Sutopo L. 1993. Teknologi Benih. Jakarta (ID): PT Raja Grafindo Persada.
Tan RX, Zou WX. 2001. Endophytes: a rich source of functional metabolites. Nat Prod Rep 18:448-459. doi.org/10.1039/b100918o.
29 [UPT BPSB] UPT Balai Pengawasan dan Sertifikasi Benih IV. 2013. Evaluasi Pelaksanaan Kegiatan UPT. Medan (ID): Balai Pengawasan dan Sertifikasi Benih TPH Satuan Kerja Dinas Pertanian Provinsi Sumatera Utara.
Utami DW, Moeljopawiro S, Aswidinnoor H, Setiawan A, Hanarida I. 2005. Gen pengendali sifat ketahanan penyakit blas (Pyricularia grisea Sacc.) pada spesies padi liar Oryza rufipogon Griff. dan padi budi daya IR64. J Agro Biogen 1(1):1-6.
Utobo EB, Ogbod EN, Nwogbaga AC. 2011. Seedborne mycoflora associated with rice and their influence on growth at Abakaliki, Southeast Agro-Ecology, Nigeria. Libyan Agric Res Center J Int. 2(2):79-84.
Varma A, Verma S, Sudha, Sahay N, Butehorn, Franken P. 1999. Piriformospora indica, a Cultivable Plant-Growth-Promoting Root Endophyte. Appl Environ Microbial. 65(6):2741-2744.
Wang SL, Yen YH, Tsiao WJ, Chang WT, Wang CL. 2002. Production of antimicrobial compounds by Monascus purpureus CCRC31499 using shrimp and crab shell powder as a carbon source. Enzyme Microb Technol.
31:337-344.
Wilia W, Hayati I, Ristiyadi D. 2012. Eksplorasi cendawan endofit dari tanaman padi sebagai agen pemacu pertumbuhan tanaman. Agroekoteknologi 1(4): 73-79.
You F, Han T, Wu JZ, Huang BK, Qin LP. 2009. Antifungal secondary metabolites from endophytic Verticillium sp. Biochem Syst Ecol. 37:162-165.
Zakaria L, Yaakop AS, Salleh B, Zakaria M. 2010. Endophytic fungi from paddy.
Trop Life Sci Res. 21(1): 101-107.
30
30