SENYAWA METABOLIT BAKTERI ENDOFIT SEBAGAI
ALTERNATIF PENGENDALIAN EFEKTIF CENDAWAN
PATOGEN TERBAWA BENIH JAGUNG
ANDINI HANIF
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis yang berjudul Senyawa Metabolit Bakteri Endofit sebagai Alternatif Pengendalian Efektif Cendawan Patogen Terbawa Benih Jagung adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Desember 2015
Andini Hanif
RINGKASAN
ANDINI HANIF. Senyawa Metabolit Bakteri Endofit sebagai Alternatif Pengendalian Efektif Cendawan Patogen Terbawa Benih Jagung. Dibimbing oleh BONNY POERNOMO WAHYU SOEKARNO dan ABDUL MUNIF.
Salah satu standar kualitas benih adalah kesehatan benih. Keberadaan patogen pada benih jagung dapat mempengaruhi kualitas benih jagung, dan berpotensi menyebabkan penyakit pada tanaman jagung. Salah satu patogen terbawa benih jagung adalah cendawan Fusarium sp. Bakteri endofit dilaporkan mampu menghasilkan senyawa metabolit yang berpotensi memiliki senyawa antifungi. Tujuan dari penelitian ini untuk mendapatkan bakteri endofit asal tanaman jagung yang menghasilkan senyawa metabolit untuk mengendalikan cendawan patogen terbawa benih jagung.
Isolasi bakteri endofit dengan metode sterilisasi permukaan, selanjutnya dilakukan uji hipersensitif terhadap isolat bakteri untuk menyeleksi bakteri patogen dan non patogen. Isolasi dan deteksi cendawan patogen terbawa benih dilakukan dengan metode blotter test. Isolat bakteri endofit diuji kemampuan antagonisnya terhadap cendawan Fusarium sp. Isolat bakteri dengan daya hambat tertinggi, selanjutnya diproduksi dan dianalisis senyawa metabolitnya. Senyawa metabolit yang diperoleh selanjutnya diuji in vitro dan in vivo terhadap cendawan patogen terbawa benih jagung.
Hasil penelitian menunjukkan tiga bakteri endofit berpotensi menghambat cendawan Fusarium sp. yaitu isolat EF14III, ER1I, dan ER10I. Berdasarkan karakterisasi secara morfologi, biokimia, dan fisiologi isolat EF14III diidentifikasi sebagai Lactobacillus sp., ER1I diidentifikasi sebagai Pseudomonas sp., dan ER10I diidentifikasi sebagai Aeromonas sp. Senyawa metabolit bakteri
Pseudomonas sp. ER1I terbukti paling efektif dalam menghambat pertumbuhan
Fusarium sp. pada uji in vitro dan pada uji in vivo mampu mengurangi tingkat infeksi hingga 65.0%. Senyawa metabolit bakteri Pseudomonas sp. ER1I juga mampu menekan tingkat infeksi patogen terbawa benih hingga 59.5% pada media WA dan 60.5 % pada tanah steril dengan menggunakan metode growing on test.
Senyawa metabolit bakteri endofit Pseudomonas sp. ER1I mampu menghambat pertumbuhan cendawan Fusarium sp. dan juga efektif dalam menekan tingkat infeksi cendawan terbawa benih pada benih dan kecambah jagung, sehingga senyawa metabolit yang bersifat anti cendawan dapat dimanfaatkan sebagai bahan aktif biofungisida.
SUMMARY
ANDINI HANIF. Metabolite Compound of Endophytic Bacteria as an Alternative to Control Seed-Borne Pathogen Fungi on Maize Seed. Supervised by BONNY POERNOMO WAHYU SOEKARNO and ABDUL MUNIF.
One of standard of seed quality is seed healthy. Existence of pathogens in seed can change quality of seed, and potentially caused plant disease. One of fungal seed borne pathogen on maize is Fusarium sp. Endophytic bacteria can produce metabolite as antifungal compound. This study was aimed to obtain endophytic bacteria which are able to produce metabolite with high ability to control seed borne pathogen Fusarium sp.
Isolation of endophytic bacteria was done using surface sterilization method, furthermore hypersensitive reaction test of bacteria was done for selection pathogenicity of bacteria. Detection and isolation of seed borne fungal pathogen from maize seed was done using blotter test method. Endophytic bacteria was tested their antagonism against Fusarium sp. for selection the potential of endophytic bacteria. Isolate of endophytic bacteria which have highest growth inhibitor would be extracted and analyzed the metabolite compound. Metabolite compound was tested toward seed borne pathogen under in vitro and in vivo condition.
The result showed that three isolate of endophytic bacteria wich one potentially in inhibiting Fusarium sp., EF14III, ER1I and ER101. Three isolates of endophytic bacteria were characterized, EF14III identified as Lactobacillus sp., ER1I identified as Pseudomonas sp., and ER10I identified as Aeromonas sp.. Metabolites compound of Pseudomonas sp. ER1I was the most effective in inhibiting the growth of Fusarium sp. and in vivo test result showed that metabolites compound of Pseudomonas sp. ER1I could decreased the infection
Fusarium sp. until 65.0% with blotter test. Metabolite compound of Pseudomonas
sp. ER1I could decreased the infection of seed borne pathogen until 59.5% with growing on test in WA and 60.5% using sterile medium soil.
Metabolite compound of Pseudomonas sp. ER1I can inhibiting Fusarium
sp. and effective decreased seed borne pathogen infection of maize on blotter test and growing on tets, with the result that metabolite compound of Pseudomonas sp. ER1I can used as biofungcide .
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Fitopatologi
SENYAWA METABOLIT BAKTERI ENDOFIT SEBAGAI
ALTERNATIF PENGENDALIAN EFEKTIF CENDAWAN
PATOGEN TERBAWA BENIH JAGUNG
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Senyawa Metabolit Bakteri Endofit Sebagai Alternatif
Pengendalian Efektif Cendawan Patogen Terbawa Benih Jagung Nama : Andini Hanif
NIM : A352130071
Disetujui oleh Komisi Pembimbing
Dr Ir Bonny PW Soekarno, MS Ketua
Dr Ir Abdul Munif, MSc Agr Anggota
Diketahui oleh
Ketua Program Studi Fitopatologi
Prof Dr Ir Sri Hendrastuti Hidayat, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: 27 Oktober 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala limpahan nikmat dan karunia-Nya sehingga tesis dengan judul Senyawa Bakteri Endofit Sebagai Alternatif Pengendalian Efektif Cendawan Patogen Terbawa Benih Jagung dapat diselesaikan.
Terima kasih penulis ucapkan kepada Dr Ir Bonny PW Soekarno, MS dan Dr Ir Abdul Munif, MSc Agr selaku pembimbing yang telah membimbing penulis hingga penulis dapat menyelesaikan tulisan ini, serta kepada penguji luar komisi Dr Ir Titiek Siti Yuliani, SU yang telah memberi saran dan kritik dalam perbaikan penulisan tesis. Ungkapan terima kasih teristimewa juga penulis sampaikan kepada ibunda Zamriyetti dan ayahanda Zulhanif, untuk segala doa, dukungan, dan kasih sayang yang tiada henti kepada penulis. Tulisan ini juga sebagai tanda bakti dan tanda cinta penulis. Terima kasih kepada saudara saudari penulis Larantika Hanif, Iqbal Alfarisi Hanif, dan Dhian Hanif, dan kepada seluruh keluarga besar atas segala doa, semangat, dan kasih sayangnya yang tiada henti kepada penulis. Teman-teman Fitopatologi SPs IPB angkatan 2013 Juwi, kak Novi, kak Jabal, mbak Putze, Mbak Mei, Nisa, Irwanto, Wafa, Ipul, Diana, Pandu, Kak Tika, Kak Cica, Kak Ria, Bulan, Hamda, Mbak Santi, dan Maman atas kebersamaannya. Terima kasih kepada teman-teman Lab Mikologi dan sahabat-sahabat kos bu Roma tersayang atas kebersamaan dan kerjasamanya selama ini. Ungkapan terima kasih juga penulis sampaikan khusus kepada sahabat terkasih seperjuangan dalam meraih cita-cita Arifda Ayu, Dewi Novina, dan Novi Malinda, semoga persahabatan ini menjadi cerita indah dimasa tua. Terima kasih kepada staf Balai Proteksi Tanaman Pangan dan Hortikultura Sumatera Utara atas bantuan dan dukungannya. Serta kepada Dirjen Dikti atas dana beasiswa pendidikan selama menjalankan studi di Institut Pertanian Bogor.
Semoga karya ilmiah ini bermanfaat.
Bogor, Desember 2015
DAFTAR ISI
Isolasi Bakteri Endofit dari Jagung dan Uji Hipersensitif 9 Deteksi dan Isolasi Cendawan Patogen Terbawa Benih Jagung 10Uji Antagonis Bakteri Endofit terhadap Cendawan Patogen Terbawa Benih secara In vitro 10
Pengukuran Kurva Pertumbuhan Bakteri Endofit 11
Ekstraksi dan Analisis Senyawa Metabolit Bakteri Endofit 11
UjiDaya Hambat Senyawa Metabolit Bakteri Endofit terhadap Cendawan Patogen Terbawa Benih secara In vitro 12
Uji Senyawa Metabolit Bakteri Endofit terhadap Cendawan Patogen Terbawa Benih secara In vivo 12
Analisis Data 13
4 HASIL DAN PEMBAHASAN 14 Isolasi Bakteri Endofit dari Tanaman Jagung dan Uji Hipersensitif 14 Deteksi dan Isolasi Cendawan Patogen Terbawa Benih Jagung 15 Uji Antagonis Bakteri Endofit terhadap Fusarium sp. secara In vitro 16 Kurva Pertumbuhan Bakteri 17
Uji Daya Hambat Senyawa Metabolit Bakteri Endofit terhadap Pertumbuhan Fusarium sp. secara In vitro 18
Analisis Senyawa Metabolit Bakteri Endofit 20
Uji Senyawa Metabolit Bakteri Endofit terhadap Tingkat Infeksi Cendawan Patogen Terbawa Benih Jagung secara In vivo 21
5 SIMPULAN DAN SARAN 25
Simpulan 25
DAFTAR PUSTAKA 26
LAMPIRAN 31
RIWAYAT HIDUP 36
DAFTAR TABEL
1 Jumlah isolat bakteri asal tanaman jagung dan uji hipersensitif 14 2 Jumlah isolat cendawan patogen terbawa benih jagung varietas New
honey dan varietas DK771 15 3 Daya hambat bakteri endofit terhadap Fusarium sp. pada media PDA 16 4 Diameter Fusarium sp. pada media PDA dengan berbagai perlakuan 19
5 Hasil analisis senyawa metabolit Pseudomonas sp. ER1I 21
DAFTAR GAMBAR
1 Bagan alir ruang lingkup penelitian 3
2 Metode pengukuran uji antagonis bakteri terhadap cendawan patogen
secara in vitro 11
3 Deteksi dan isolasi cendawan patogen terbawa benih jagung 15 4 Daya hambat bakteri endofit terhadap Fusarium sp. pada media PDA 17
5 Pertumbuhan bakteri endofit pada media LB 18
6 Pengaruh senyawa metabolit bakteri endofit pada beberapa konsentrasi
terhadap pertumbuhan koloni Fusarium sp. 19
7 Pengaruh senyawa metabolit bakteri Pseudomonas sp. ER1I terhadap tingkat infeksi cendawan patogen terbawa benih jagung 22 8 Pengaruh senyawa metabolit bakteri Pseudomonas sp. ER1I terhadap
penekanan tingkat infeksi cendawan patogen terbawa benih jagung 22
9 Isolasi nekrotik pada kecambah jagung 23
10 Pengaruh perendaman benih jagung pada senyawa metabolit
Pseudomonas sp. ER1I terhadap persentase daya berkecambah jagung 24
DAFTAR LAMPIRAN
1 Respons hipersensitif bakteri endofit pada tembakau 31 2 Karakterisasi morfologi, fisologis dan biokimia bakteri endofit 33 3 Analisis filtrat metabolit bakteri endofit Pseudomonas sp. ER1I 34 4 Pengaruh metabolit Pseudomonas sp. ER1I terhadap tingkat infeksi dan
PENDAHULUAN
Latar Belakang
Jagung (Zea mays L.) merupakan salah satu tanaman pangan penting di dunia, setelah gandum dan padi. Jagung merupakan sumber karbohidrat utama di beberapa negara. Manfaat lain jagung selain sebagai sumber karbohidrat, biji dan tongkol jagung dimanfaatkan sebagai pakan ternak, bulir jagung diambil minyaknya dan dapat dibuat tepung (tepung jagung atau maizena), dan tepung jagung tersebut dimanfaatkan sebagai bahan baku industri pangan lainnya. Menurut data Badan Pusat Statistik (BPS 2013), produksi jagung pada tahun 2012 sebesar 19.39 juta ton pipilan kering atau mengalami peningkatan sebesar 1.74 juta ton (9.9%) dibandingkan tahun 2011, dan produksi jagung pada tahun 2013 sebesar 18.84 juta ton pipilan kering atau mengalami penurunan sebesar 0.55 juta ton (2.8%) dibandingkan tahun 2012. Penurunan produksi ini diperkirakan terjadi karena penurunan luas panen seluas 66.62 ribu hektar (1.7%) dan penurunan produktivitas sebesar 0.57 kuintal/hektar (1.2%). Salah satu faktor utama penyebab penurunan produksi jagung adanya organisme pengganggu tanaman (OPT) yang menginfeksi tanaman maupun terbawa benih jagung.
Mutu benih mencakup mutu genetik, mutu fisiologis, mutu fisik dan kesehatan benih. Benih tanaman dapat menjadi sasaran patogen penyebab penyakit. Benih merupakan bagian tanaman yang memiliki sumber nutrisi yang kaya seperti karbohidrat, protein, dan lemak yang merupakan sumber makanan bagi sejumlah organisme. Oleh karena itu, patogen dapat memanfaatkan benih sebagai sumber nutrisi dengan cara menginfeksi benih. Serangan patogen terbawa benih dimulai dari proses pembungaan hingga pembuahan, atau pada saat penyimpanan benih (Yuniarti et al. 2013). Keberadaan patogen pada benih sangat mempengaruhi kualitas dan mutu benih jagung. Faktor eksternal seperti hama maupun patogen tular benih merupakan salah satu faktor yang mengakibatkan penurunan kualitas dan kuantitas benih jagung. Menurut Adjei (2011), ada 112 penyakit pada tanaman jagung dan 62% atau sekitar 70 diantaranya merupakan penyakit tanaman yang disebabkan oleh patogen terbawa benih jagung. Penyakit terbawa benih jagung dapat menyebabkan penurunan produksi jagung. Patogen terbawa benih penting pada tanaman jagung diantara adalah patogen penyebab penyakit bercak daun, hawar daun, busuk batang, busuk biji, hawar kecambah, antranoksa, dan busuk tongkol jagung (Richardson 1996).
2
memproteksi tanaman dari serangan mikroorganisme patogen, herbivora, serangga, sedangkan tanaman mendapatkan nutrisi dan senyawa aktif yang diperlukan selama hidupnya (Tanaka et al. 1999). Disamping itu, mikroba endofit memiliki banyak peran bagi tanaman, misalnya sebagai perangsang pertumbuhan tanaman, pemicu inang untuk memproduksi fitoaleksin, bertahan dalam kondisi stres, sekaligus sebagai agens pengendalian hayati. Mikroba endofit memiliki kelebihan sebagai agens hayati, yaitu mudah dibiakkan secara in vitro, mudah diaplikasikan, misalnya melalui perlakuan biji, terhindar dari kompetisi dengan mikroba lain khususnya bakteri rhizosfer, dan memiliki kemampuan dalam mempengaruhi tanaman merespons serangan parasit, tidak menghasilkan racun terhadap tanaman, bahkan menghasilkan hormon perangsang tumbuh (Siddiqui dan Shaukat, 2003).
Perumusan Masalah
Mutu dan kualitas benih masih menjadi masalah utama dalam pertanian di Indonesia, terutama mutu kesehatan benih. Patogen terbawa benih jagung dapat mengurangi mutu kesehatan benih yang selanjutnya dapat menyebabkan penyakit pada tanaman jagung, sehingga mengurangi hasil produksi tanaman jagung. Upaya perlindungan terhadap benih perlu dilakukan dengan memanfaatkan potensi agens hayati yang tidak berdampak negatif terhadap lingkungan, salah satunya dengan menggunakan bakteri endofit asal tanaman jagung. Senyawa metabolit yang dihasilkan oleh bakteri endofit diketahui memiliki potensi sebagai senyawa anti cendawan. Oleh karena itu perlu dilakukan penelitian untuk mengetahui pengaruh senyawa metabolit yang dihasilkan oleh mikroba endofit asal tanaman jagung dalam menghambat dan melindungi benih dari cendawan patogen terbawa benih jagung.
Tujuan Penelitian
Tujuan dari penelitian ini adalah mendapatkan isolat bakteri endofit yang menghasilkan senyawa metabolit bersifat anti cendawan untuk mengendalikan cendawan patogen terbawa benih jagung.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberi informasi kepada masyarakat tentang alternatif pengendalian efektif terhadap cendawan patogen terbawa benih jagung dengan memanfaatkan senyawa metabolit bakteri endofit.
Ruang Lingkup Penelitian
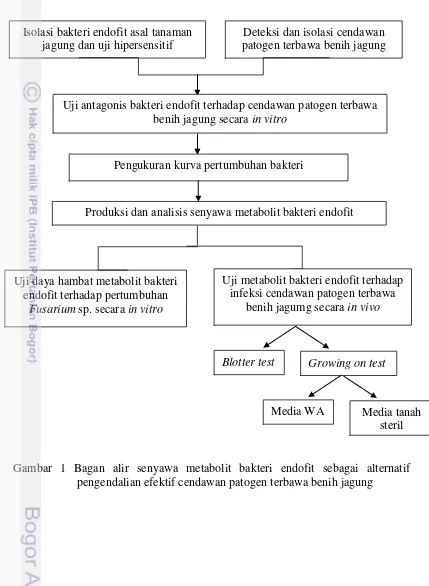
3 pertumbuhan bakteri, produksi dan analisis senyawa metabolit bakteri endofit, uji daya hambat senyawa metabolit bakteri endofit terhadap cendawan patogen terbawa benih secara in vitro, dan uji senyawa metabolit bakteri endofit terhadap infeksi cendawan patogen terbawa benih jagung secara in vivo (Gambar 1)
Gambar 1 Bagan alir senyawa metabolit bakteri endofit sebagai alternatif pengendalian efektif cendawan patogen terbawa benih jagung
Isolasi bakteri endofit asal tanaman jagung dan uji hipersensitif
Deteksi dan isolasi cendawan patogen terbawa benih jagung
Uji antagonis bakteri endofit terhadap cendawan patogen terbawa benih jagung secara in vitro
Produksi dan analisis senyawa metabolit bakteri endofit
Uji daya hambat metabolit bakteri endofit terhadap pertumbuhan
Fusarium sp. secara in vitro
Uji metabolit bakteri endofit terhadap infeksi cendawan patogen terbawa
benih jagumg secara in vivo
Blotter test Growing on test
Media WA Media tanah steril Pengukuran kurva pertumbuhan bakteri
4
TINJAUAN PUSTAKA
Morfologi dan Manfaat Tanaman Jagung
Jagung (Zea mays L.) merupakan tanaman herba dari kelompok monokotil dan merupakan tanaman semusim, termasuk famili Poaceae, genus Zea, dan spesies Zea mays L. Jagung memiliki bunga jantan yang tumbuh sebagai perbungaan ujung (tassel) pada batang utama (poros atau tangkai) dan bunga betina yang tumbuh terpisah sebagai perbungaan samping (tongkol) yang berkembang di ketiak daun. Batang tanaman jagung memiliki jumlah ruas yang bervariasi mulai dari 10 hingga 40 ruas. Batang jagung umumnya tidak bercabang. Panjang batang tanaman jagung antara 60 cm hingga 300 cm bahkan lebih tergantung jenis dan tipe jagung dan terbungkus oleh pelepah daun yang berselang seling. Tunas dari batang jagung yang sudah berkembang menghasilkan tajuk bunga betina (Rubatzky et al. 1998). Menurut Singh (1987), jumlah buku pada batang jagung tanaman jagung antara 10-20 buku per tanaman, dimana pada buku ke-6 atau ke-7 terdapat tongkol jagung. Daun tanaman jagung disebut lidah daun atau ligula yang terletak melingkupi batang pada ujung pelepah dengan lembar daun berselang-seling. Daun jagung memiliki lebar seragam dan tulang daun yang terlihat jelas, dengan banyak tulang daun kecil sejajar dengan panjang daun. Biji jagung berkeping tunggal, berderet rapi pada tongkolnya antar 10 hingga 14 deret biji jagung dan terdiri dari 200 hingga 400 butir biji jagung setiap tongkolnya (Suprapto dan Marzuki 2005). Biji jagung terdiri atas tiga bagian utama yaitu kulit biji (seed coat), endosperm, dan embrio.
Tanaman jagung merupakan salah satu jenis tanaman pangan yang memiliki nilai ekonomi tinggi dan menjadi tanaman pangan nomor tiga terpenting di dunia setelah gandum dan padi. Menurut Krisnamurthi (2010), jagung merupakan tanaman pangan penting dikarenakan jagung mengandung banyak sumber mineral yang diperlukan oleh tubuh antara lain fosfor, magnesium, mangan, seng, besi dan tembaga, serta mengandung mineral seperti selenium. Jagung dimanfaatkan sebagai sumber karbohidrat utama, dan sumber pangan alternatif. Jagung juga dimanfaatkan sebagai pakan ternak (biji maupun tongkolnya), minyak jagung, dibuat menjadi olahan tepung, dan sebagai bahan baku industri (Santosa et al. 2011). Manfaat lain dari jagung selain untuk pangan dan pakan ternak adalah biji jagung dapat diekstrak sebagai minyak dan dibuat tepung (maizena), serta serta bahan baku industri (tepung biji ataupun tepung tongkol). Senyawa pentosa yang terkandung pada tongkol jagung juga dapat dimanfaatkan sebagai bahan baku pembuatan furfural, dan di negara maju seperti Amerika Serikat jagung sudah mulai dimanfaatkan sebagai bahan baku produksi bioetanol (Krisnamurthi 2010).
Cendawan Patogen Terbawa Benih Jagung
5 dan agens penyebar, yang menghasilkan tanda penyakit dan gejala penyakit tanaman inang. Infeksi patogen pada benih berpotensi menyebabkan penyakit pada saat perkecambahan atau tanaman dewasa, sehingga tanaman sakit kembali menghasilkan benih yang terinfeksi patogen atau disebut patogen tular benih atau
seed transmited. Patogen terbawa benih antara lain bakteri, cendawan, virus, nematoda, atau mikroorganisme lainnya yang dapat masuk atau terbawa pada benih.
Patogen terbawa benih mempunyai arti penting dari budidaya tanaman karena dapat mengurangi hasil produksi tanaman, menurunkan daya kecambah dan vigor benih, menyebabkan penyakit tanaman di lapang, perubahan bentuk dan warna benih, perubahan biokimia benih, dan perubahan sifat fisik benih. Penyakit terbawa benih dapat mempengaruhi pertumbuhan dan produktivitas tanaman. Patogen terbawa benih dapat menyebabkan benih busuk, nekrosis pada benih, penurunan daya perkecambahan, serta kerusakan bibit yang mengakibatkan pengembangan penyakit pada tahap akhir dari pertumbuhan tanaman oleh infeksi sistemik atau lokal. Benih merupakan wahana yang sangat efektif untuk membawa dan menyebabkan patogen penyakit tanaman. Selain itu, cendawan yang tumbuh di substrat benih menghasilkan mikotoksin yang berbahaya bagi manusia dan hewan (Naqvi et al. 2013).
Berdasarkan penelitian Niaz dan Dawar (2009), dapat diidentifikasi dan diisolasi 23 genus dan 56 spesies cendawan yang diisolasi dari benih jagung antara lain; Drechslera spp., Fusarium spp., Penicillium spp., Aspergillus spp.,
Cladosporium spp., Curvularia spp., Rhizopus spp., Arthrinium sp., Aspergillus. tubingensis Mosseray, A. foetidus, Curvularia clavata B.L. Jain, C. intermedia
Boedijn, C. pallescens Boedijn, Helminthosporium maydis Y. Nisik dan C. Miyake, Drechslera carbonum Sivan., Diplodia zeae Mekht, Fusarium croockwellense L.W. Burgess, P.E. Nelson & Toussoun, F. culmorum (W.G. Sm.) Sacc., F. graminearum Schwabe, F. proliferatum (Matsush.) Nirenberg, Penicillium citrinum Thom, P. funiculosum Thom, Phoma herbarum Westend, Rhizopus oligosporum, Rhizoctonia solani J.G. Kühn, Syncephalastrum racemosum dan Trichoderma harzianum. Berdasarkan data Badan Pemeriksaan dan Sertifikasi Benih Sumatera Utara (BPSB 2013), cendawan patogen terbawa benih yang menginfeksi benih jagung di daerah Sumatera Utara adalah Fusarium moniliforme J. Sheld, Cercospora acremonium, Bipolaris maydis Y. Nisik dan C. Miyake, dan Phoma sp. Penyakit tanaman jagung yang disebabkan oleh cendawan terbawa benih jagung diantaranya Fusarium sp.penyebab busuk batang, penyakit gosong, bercak daun, hawar daun, dan juga layu. Selain itu juga dilaporkan cendawan patogen penyebab penyakit antraknosa, Penicillium sp., Aspergillus sp., Nigrospora sp., Botryodiplodia sp., cendawan penyebab penyakit embun tepung,
Acremonium sp., dan Alternaria sp. (Adjei 2011).
6
Dilaporkan Pakki (2005), benih jagung di Sumatera Barat telah terinfeksi F. moniliforme J. Sheld sebesar 20.4%.
Fusarium sp. merupakan salah satu organisme pengganggu tanaman (OPT) penting pada tanaman jagung penyebab penyakit busuk batang dengan tingkat serangan dapat mencapai 87% (Pakki 2005). Said et al. (2008), menambahkan penyakit busuk batang pada varietas jagung rentan dapat menurunkan produksi jagung sampai 65%. Menurut Popovsky dan Celar (2012), beberapa spesies Fusarium sp. patogen menginfeksi hampir seluruh pertanaman sereal di seluruh dunia, penyebab penyakit kanker (scab), gandum kecil, dan busuk tongkol pada jagung. Fusarium sp. umumnya dianggap sebagai cendawan lapang yang menyerang lebih dari 50% dari biji-bijian jagung sebelum panen. Beberapa spesies Fusarium yang ditemukan pada tanaman jagung F. verticillioides (Sacc.) Nirenberg, F. proliferatum (Matsush.) Nirenberg, F. graminearum Schwabe, dan F. anthophilum (A. Braun) Wollenw. Fusarium sp. menginfeksi tanpa gejala pada seluruh tanaman seperti daun, batang, akar, dan biji-bijian. Banyak kasus infeksi Fusarium sp. diabaikan karena tidak menyebabkan kerusakan berarti pada tanaman. F. verticillioides (Sacc.) Nirenberg menginfeksi jagung pada semua tahap pertumbuhan tanaman, baik melalui biji yang terinfeksi, lubang alami atau luka, menyebabkan busuk pada biji-bijian selama kedua periode pra dan pascapanen (Fandohan et al. 2003). Gejala yang ditimbulkan akibat infeksi Fusarium sp. penyebab penyakit busuk batang pada tanaman jagung adalah pada bagian bawah batang jagung berwarna hijau kekuningan, kemudian berubah warna menjadi coklat kekuningan. Ruas paling bawah empelurnya membusuk dan terlepas dari kulit luar batang sehingga batang menjadi lunak. Struktur batang berubah silinder rapat menjadi tabung yang selanjutnya menyebabkan kelayuan dikarenakan penghentian semua transportasi hara ke biji, sehingga mempengaruhi berat biji, serta akar akan menjadi busuk, mudah dicabut, dan mudah rebah.
Selain penyakit busuk batang, penyakit penting pada jagung lainya adalah penyakit hawar daun jagung yang disebabkan oleh cendawan Helminthosporium Maydis Y. Nisik dan C. Miyake. Menurut Said et al. (2008), kehilangan hasil akibat penyakit hawar daun jagung dapat mencapai 70%. Penyebaran cendawan H. maydis Y. Nisik dan C. Miyake penyebab penyakit hawar daun jagung salah satunya melalui benih jagung. Gejala hawar daun jagung yang disebabkan oleh H. maydis Y. Nisik dan C. Miyake daun berubah warna menjadi keabu-abuan hingga cokelat, gejala hawar paralel pada tepi daun, berbentuk seperti diamond dengan panjang 1-4 cm, luka berwarna kekuningan dengan batas cokelat dengan zona yang tidak teratur. Selain pada daun patogen penyebab hawar juga menginfeksi bagian tanaman jagung lainnya seperti pelepah, batang, kulit jagung, dan tongkol jagung. Luka hawar memanjang dengan batas di dalam bagian vascular, dan luka atau hawar meluas dan menyebabkan kematian jaringan daun (Naz et al. 2002). H. maydis Y. Nisik dan C. Miyakeselain menginfeksi tanaman secara langsung, juga merupakan salah satu cendawan patogen terbawa benih jagung.
7 Bakteri Endofit Asal Tanaman Jagung
Bakteri endofit adalah bakteri yang terdapat dalam jaringan tanaman sehat yang tidak menimbulkan gejala penyakit dan tidak merugikan tanaman inang. Bakteri endofit dapat diisolasi dan diekstraksi pada media tumbuh bakteri dengan teknik sterilisasi permukaan. Bakteri endofit dapat hidup pada akar, batang, daun, dan buah tanaman, dan umumnya mengkolonisasi bagian interselluler dari jaringan tanaman inang sistem pembuluh serta dapat ditranslokasikan secara sistemik ke seluruh bagian tanaman. Pada saat ini, mikroba endofit banyak diteliti karena memiliki manfaat dan efek positif pada tanaman inang seperti antimikroba, hormon pertumbuhan, fiksasi nitrogen, mobilitas fosfat, produksi siderofor, induksi SAR dan ISR, serta meningkatkan ketahanan terhadap stres lingkungan (Hallmann et al. 1997).
Menurut Yulianti (2013), pengendalian hayati terhadap hama dan penyakit tanaman dengan menggunakan musuh alami seperti predator, parasitoid, patogen, maupun antagonis telah lama digunakan sebagai salah satu komponen pengendalian hama dan penyakit terpadu. Namun, agens hayati tersebut seringkali kurang mampu diaplikasikan dalam skala komersial dikarenakan agens pengendali hayati tersebut tidak mampu beradaptasi di lingkungan yang baru atau kurang mampu bersaing dengan mikroorganisme yang telah lama menghuni lingkungan tersebut. Selain itu, pemeliharaan penyimpanan dalam waktu yang lama cenderung membuat agens hayati tersebut tidak stabil.
Penelitian untuk memperoleh bakteri endofit dari tanaman jagung telah banyak dilakukan, mengingat manfaat endofit yang sangat banyak. Bakteri endofit yang diisolasi dari akar tanaman jagung, yaitu bakteri dari genus Bacillus sp.,
Burkholderia sp., Klebsiella sp., Pantoea sp. (Ikeda et al. 2013). Menurut Fisher
et al. (1992), bakteri endofit dari hasil isolasi bagian batang tanaman jagung diperoleh beberapa bakteri endofit yaitu Pseudomonas flourescen, Enterobacter agglomerans, Klebsiella terrigena, P. corrugata, P. marginalis, dan Vibrio sp. Berdasarkan penelitian Orole dan Adejumo (2011), bakteri endofit yang diperoleh dari hasil isolasi akar dan biji jagung yaitu Cellulomonas sp., Bacillus sp., Pseudomonas sp., Staphylococcus sp., Micrococcus sp., Pediococcus sp., Microbacterium sp., Azospirillum sp., Kurtia sp., dan Enterobacter sp. Bakteri endofit yang diperoleh dari benih jagung adalah Undibacterium sp., Burkholderia
sp., Limnobacter sp., Pantoea sp. (Liu et al. 2012).
Senyawa Metabolit Bakteri Endofit
Senyawa metabolit sekunder merupakan senyawa-senyawa hasil metabolisme biosintetik turunan dari metabolit primer yang umumnya diproduksi oleh organisme yang bermanfaat sebagai pertahanan diri dari lingkungan maupun dari serangan organisme lain. Sementara senyawa yang dihasilkan oleh organisme melalui metabolisme dasar yang digunakan untuk pertumbuhan dan perkembangan organisme tersebut disebut dengan metabolit primer (Murniasih 2003).
8
agens hayati memiliki keuntungan dibandingkan mikroba antagonis lainnya dikarenakan mikroba endofit sudah terbentuk, hidup, dan bertahan di dalam jaringan selama perkembangan tanaman dan memberi perlindungan bagi tanaman. Kelebihan bakteri endofit sebagai agens hayati dibandingkan dengan bakteri rizosfer selain karena keberadaannya lebih terlindungi dan kemampuannya dalam kolonisasi di dalam jaringan tananam, kelebihan lainnya adalah proses translokasi senyawa metabolit yang dihasilkan ke dalam jaringan tanaman lebih baik (Hallmann et al. 1997).
Banyak penelitian yang menghasilkan produk alami antimikroba yang diisolasi dari bakteri endofit. Skrining senyawa antimikroba dari bakteri endofit adalah cara yang efektif untuk mengatasi masalah strain patogen yang resisten. Senyawa metabolit yang memiliki aktivitas antimikroba yang diisolasi dari endofit terdiri dari beragam struktur termasuk alkaloid, peptida, steroid, terpenoid, fenol, kuinon, dan flavonoid. Senyawa yang diisolasi dari ekstrak bakteri endofit dengan aktivitas antimikroba memberikan peluang untuk memanfaatkan bakteri endofit sebagai sumber baru untuk produksi antibiotik dan biofungisida (Yu et al.
2010).
Senyawa antibiotik polipeptida basitrasin dilaporkan dihasilkan oleh bakteri Bacillus licheniformis dan B. subtilis dan senyawa basitrasin tersebut telah diproduksi dalam skala industri. Galur lokal baru Bacillus sp. BAC4 diketahui memproduksi enzim penisilin G asilase (PGA) ekstrasel (Moeis et al. 2000). Berdasarkan penelitian Chen et al. (2009), senyawa metabolit sekunder yang dihasilkan oleh Bacillus amyloliquefaciens FZB42 yaitu surfactin, bacillomycin, fengycin, peptida, dan iron siderophore bacilibactin, yang mempunyai aktivitas anti cendawan. Mondol et al. (2013), menyebutkan bahwa Bacillus memproduksi senyawa metabolit sekunder berupa lipopeptida, polypeptida, macrolactones, asam lemak, polyketides, dan isocoumarins. Senyawa phenazine sebagai senyawa metabolit sekunder oleh bakteri Pseudomonas chlororaphis berperan sebagai antagonis dan aktivitas anti cendawan terhadap cendawan patogen Sclerotium sp. (Poritsanos 2005). Berdasarkan penelitian Elshafie et al. (2013), senyawa metabolit sekunder yang dihasilkan oleh bakteri Bulkhoderia sp. adalah liquid hydrocarbon cyclic terpene dan diidentifikasi sebagai senyawa cyclohexene
1-methyl-4-(1-methylethenyl) dan juga senyawa 4-flavanone (4H-1-Benzopyran
-4-one, 2, 3-dihydro-2-phenyl) kedua senyawa volatil tersebut dilaporkan memiliki aktivitas anti cendawan. Bakteri endofit Streptomyces aureofaciens diisolasi diisolasi dari jaringan akar Zingiber officinale Rosc. Uji antagonis S. aurefacien
terhadap cendawan patogen Colletotrichum musae dan Fusarium oxysporum
terdapat zona hambat pada masing-masing pertumbuhan cendawan patogen. Bahan aktif utama dari filtrat S. aureofaciens diidentifikasi sebagai 5,7-dimetoksi -4-p-methoxylphenylcoumarin dan 5,7 dimetoksi-4–phenylcoumarin, senyawa tersebut memiliki aktivitas anti cendawan cendawan C. musae dan F. oxysporum
9
METODE
Waktu dan Lokasi Penelitian
Penelitian dilaksanakan pada bulan Agustus 2014 sampai dengan Agustus 2015 di Laboratorium Balai Proteksi Tanaman Pangan dan Hortikultura Medan Sumatera Utara dan Laboratorium Mikologi Tumbuhan Departemen Proteksi Tanaman Fakultas Pertanian, Institut Pertanian Bogor.
Bahan dan Alat
Bahan yang digunakan adalah kertas cakram ukuran 0,6 cm (Oxoid), syringe milipore filter 0,22 µm, media Potato Dextrose Agar (PDA), media Tripton Soya Agar/Broth (TSA/TSB), media Luria Bertani /LB (tryptone 12.5 g; NaCl 6.25 g;
yeast extract 6.25 g; aquades 1 L), media Mueller Hinton Broth/MHB (beef extract 2 g; acid hydrolysate of casein 17.5 g; starch 1.5 g; aquades 1 L), media
Water Agar (WA), fungisida sintetik (bahan aktif Metalaksil 35%), blank disc paper, isolat bakteri endofit asal tanaman jagung varietas Scada asal kecamatan Medan Selayang Sumatera Utara, dan cendawan patogen diperoleh dari benih jagung varietas lokal DK771 asal Kecamatan Stabat Sumatera Utara dan benih jagung hibrida varietas New Honey asal Sang Hyang Seri Sumatera Utara.
Alat yang digunakan pada penelitian ini adalah laminar air flow, Pyrolisis Gas Chromatrography Mass Spectrometry (Py-GC-MS), mikroskop compound, mikroskop stereo, sentrifus, spektrofotometer, autoclave, shaker.
Isolasi Bakteri Endofit dari Jagung dan Uji Hipersensitif
10
Uji hipersensitif adalah uji yang dilakukan untuk mengetahui patogenisitas patogen (kemampuan patogen dalam menyebabkan penyakit). Teknik pengujian ini dilakukan dengan cara menginokulasi suspensi bakteri pada tanaman tembakau kemudian diinkubasi. Suspensi bakteri dibuat dengan mencampurkan 1 lup bakteri ke dalam 100 mL TSB kemudian digoyang dengan shaker selama 24 jam pada kecepatan 150 rpm hingga suspensi bakteri dengan kerapatan 108 sel/mL. Sebanyak 0.1 mL suspensi bakteri diambil dengan alat penyuntik kemudian disuntikkan pada daun tembakau dan diinkubasi selama 24 hingga 48 jam, pengamatan dilakukan dengan mengamati munculnya gejala nekrotik pada daun tembakau setelah masa inkubasi 24 jam (Schaad et al. 2000).
Deteksi dan Isolasi Cendawan Patogen Terbawa Benih Jagung
Deteksi dan isolasi cendawan patogen terbawa benih dilakukan dengan metode standar pengujian kesehatan benih International Seed Testing Association
(ISTA 1996), dengan metode blotter test. Kertas saring steril disiapkan 3 lembar untuk setiap cawan, kemudian dilembabkan. Sebanyak10 benih jagung diletakkan pada tiap cawan petri, dengan total benih jagung 400 benih. Selama 12 jam diinkubasi dibawah sinar N-UV dan 12 jam tanpa penyinaran N-UV pada suhu ruang, kemudian pada hari ke-2 diinkubasi pada suhu -20 oC selama 24 jam, dan diinkubasi kembali pada suhu ruang hingga hari ke 10. Cendawan patogen yang muncul selama masa inkubasi diamati. Cendawan patogen yang muncul diidentifikasi dengan mikroskop stereo dan mikroskop compound. Cendawan patogen yang didapat dari hasil blotter test kemudian dibuat biakan murni pada media PDA diikubasi selama kurang lebih dua hari kemudian diidentifikasi menggunakan kunci identifikasi Barnett dan Hunter (1998).
Uji Antagonis Bakteri Endofit terhadap Cendawan Patogen secara In vitro
11
Adapun rumus perhitungan penghambatan pertumbuhan cendawan patogen yaitu: Daya hambat :
Keterangan : Y = diameter koloni cendawan patogen normal (cm)
X = diameter koloni cendawan patogen yang terhambat pertumbuhannya (cm)
Tiga isolat bakteri yang menunjukkan daya hambat tertinggi terhadap pertumbuhan cendawan patogen dipilih dan dikarakterisasi secara morfologi, fisiologi, dan biokimia di Laboratorium ICBB Bogor. Ketiga isolat tersebut selanjutnya digunakan untuk uji in vitro dan in vivo senyawa metabolit terhadap pertumbuhan cendawan patogen.
Pengukuran Kurva Pertumbuhan Bakteri Endofit
Isolat bakteri endofit terpilih ditumbuhkan ke dalam media LB dan diinkubasi pada shaker dengan kecepatan 150 rpm selama 24 jam. Pengamatan dan pengukuran OD600 suspensi bakteri dilakukan tiap 1.5 jam dengan
menggunakan spektrofotometer. Hasil pengukuran dibuat dalam bentuk kurva pertumbuhan bakteri (Sunatmo 2009).
Ekstraksi dan Analisis Senyawa Metabolit Bakteri Endofit
Berdasarkan uji in vitro antagonis bakteri endofit terhadap cendawan patogen terbawa benih jagung, dipilih tiga isolat dengan daya hambat yang paling tinggi. Senyawa metabolit bakteri endofit dihasilkan dengan menumbuhkan 1 lup isolat bakteri endofit pada media fermentasi MHB kemudian diinkubasi pada
shaker dengan kecepatan 150 rpm dengan selang waktu berdasarkan kurva pertumbuhan bakteri pada fase stasioner. Suspensi bakteri disentrifugasi pada
12
kecepatan 3800 rpm selama 20 menit, dan supernatan disaring dalam keadaan steril dengan syringe milipore filter 0.22 µm (Elita et al. 2013). Senyawa metabolit bakteri endofit selanjutnya dianalisis dengan menggunakan Py-GCMS (Octaviani 2015).
Uji Daya Hambat Senyawa Metabolit Bakteri Endofit terhadap Pertumbuhan Cendawan Patogen Terbawa Benih secara In vitro
Senyawa metabolit dari masing-masing bakteri endofit ditambahkan pada media tumbuh PDA, sehingga terbentuk media tumbuh PDA dengan konsentrasi senyawa metabolit bakteri endofit 5%, 10%, dan 20%. Kontrol positif adalah media PDA ditambah dengan fungisida dengan bahan aktif metalaksil, dan kontrol negatif adalah media PDA tanpa perlakuan. Cendawan patogen ditumbuhkan pada masing-masing media PDA. Pertumbuhan koloni cendawan diamati dan dibandingkan dengan kontrol (Modifikasi Faturrahman 2001). Persentase penghambatan cendawan patogen dihitung dengan rumus:
Keterangan: D1 = diameter koloni cendawan patogen kontrol (cm) D2 = diameter koloni cendawan patogen perlakuan (cm)
Uji Senyawa Metabolit Bakteri Endofit terhadap Tingkat Infeksi Cendawan Patogen Terbawa Benih secara In vivo
Konsentrasi senyawa metabolit bakteri endofit dengan daya hambat paling besar dipilih dua tingkat konsentrasi untuk uji in vivo. Benih jagung disterilisasi permukaan dengan perendaman pada NaOCl selama 3 menit, dan dibilas dengan akuades steril sebanyak dua kali, kemudian benih dikeringanginkan dengan kertas tisu steril. Benih direndam dalam senyawa metabolit bakteri endofit dengan konsentrasi terpilih selama 24 jam, kemudian benih dikeringanginkan. Selanjutnya benih yang telah diberi perlakuan tersebut digunakan untuk pengujian
blotter test dan growing on test pada media WA dan tanah steril. Sebagai kontrol negatif benih direndam dalam akuades steril dan untuk kontrol positif benih direndam dalam fungisida dengan bahan aktif metalaksil. Pada pengujian blotter test digunakan 10 benih jagung dan diulang sebanyak 10 kali untuk setiap perlakuan. Sedangkan untuk pengujian growing on test 10 benih jagung ditanam pada media WA dan 5 benih jagung ditanam pada tanah steril dan diulang sebanyak 10 kali untuk setiap perlakuan. Pengamatan dilakukan pada hari ke 7 pada media WA dan hari ke 14 pada tanah steril, parameter pengamatan adalah tingkat infeksi, penekanan tingkat infeksi, dan daya berkecambah.
13 Analisis Data
14
HASIL DAN PEMBAHASAN
Isolasi Bakteri Endofit dari Tanaman Jagung dan Uji Hipersensitif
Sebanyak 67 isolat bakteri endofit berhasil diisolasi dari tanaman jagung, terdiri atas 20 isolat bakteri dari akar, 11 isolat bakteri dari batang, 24 isolat bakteri dari daun, serta 12 isolat dari benih jagung (Tabel 1).
Penelitian terkait bakteri endofit dari tanaman jagung telah banyak dilaporkan. Sebanyak 11 bakteri endofit telah diisolasi dan diidentifikasi dari akar jagung yaitu Bacillus sp., Cellulomonas sp., Kurtia sp., Microbacterium sp.,
Pediococcus sp., dan Pseudomonas sp. (Orelo dan Adejumo 2011). Liu et al. (2012) memperoleh 160 isolat bakteri endofit yang diisolasi dari benih jagung, dan diidentifikasi secara molekuler diperoleh genus bakteri Burkholderia,
Limnobacter, Pantoea, Undibacterium. Bakteri endofit yang diisolasi dari bagian batang diperoleh 8 isolat, yang diidentifikasi sebagai P. fluorescens, Enterobacter agglomerans, Klebsiella terrigena, Pseudomonas corrugata, P. marginalis, Vibrio
sp. (Fisher et al. 1992).
Pengujian hipersensitif bakteri endofit yang bersifat patogen ditandai dengan adanya nekrotik pada daun tembakau. Hasil pengujian hipersensitif terhadap 67 isolat bakteri, menunjukkan 36 isolat bakteri bersifat patogen yang ditandai dengan nekrotik pada daun tembakau setelah 24 jam inkubasi, 31 isolat bakteri (46%) bersifat non patogen (Lampiran 1), dan selanjutnya isolat bakteri tersebut digunakan untuk pengujian antagonis terhadap cendawan patogen terbawa benih.
Reaksi hipersensitif merupakan kematian sel yang cepat dan terlokalisasi setelah diinokulasi dengan bakteri. Reaksi ini muncul pada tanaman yang terinfeksi saat pengenalan patogen, juga merupakan usaha untuk menghambat pertumbuhan patogen. Reaksi hipersensitif dan patogenisitas dipengaruhi oleh gen
hrp yang umum ditemukan pada bakteri Gram negatif patogen tanaman, termasuk kelompok Xanthomonas sp. (Zhu et al. 2000).
Tabel 1 Jumlah isolat bakteri asal tanaman jagung dan uji hipersensitif Bagian tanaman
jagung
Jumlah isolat bakteri
Uji hipersensitif
Bakteri patogen Bakteri non patogen
Akar 20 8 12
Batang 11 7 4
Daun 24 16 8
Benih 12 5 7
15 Deteksi dan Isolasi Cendawan Patogen Terbawa Benih Jagung
Deteksi dan isolasi cendawan patogen terbawa benih jagung dilakukan dengan menggunakan metode standar pengujian kesehatan benih ISTA blotter test. Benih jagung yang digunakan adalah benih jagung varietas New Honey dan benih jagung varietas lokal DK711 asal Sumatera Utara. Hasil pengujian blotter test
pada kedua varietas benih jagung diperoleh cendawan patogen terbawa benih yang paling dominan yaitu cendawan Fusarium sp. sebesar 17.7% dan 60.5%, sedangkan cendawan yang paling sedikit menginfeksi yaitu Curvularia sp. 0.7% pada benih jagung varietas New honey dan Penicillium sp. 2% pada benih jagung varietas lokal DK771 (Tabel 2). Cendawan patogen terbawa benih Fusarium sp. digunakan untuk uji selanjutnya (Gambar 3).
Basak dan Lee (2002), melaporkan cendawan patogen terbawa benih jagung antara lain Alternaria Alternata (Fr.) Keissl, Aspergillus Niger van Tieghem, Fusarium Monoliforme J. Sheld, Fusarium sp., Penicillium sp., dan
Ustilago zeae., dengan tingkat infeksi tertinggi adalah F. moniliforme 47% dan yang terendah adalah Penicillium sp. dengan persentase 1.8%. Fawelo et al.
(2010), melaporkan bahwa cendawan patogen terbawa benih pada beberapa varietas benih jagung adalah Penicillium sp., Cladosporium sp., dan Fusarium
spp. Cendawan patogen terbawa benih A. alternata, F. moniliforme dan Fusarium
sp. menimbulkan busuk pada benih yang berbeda dan gejala infeksi bibit. Cendawan terbawa benih merupakan salah satu sumber inokulum utama yang menyebabkan penularan dan infeksi penyakit pada tanaman jagung.
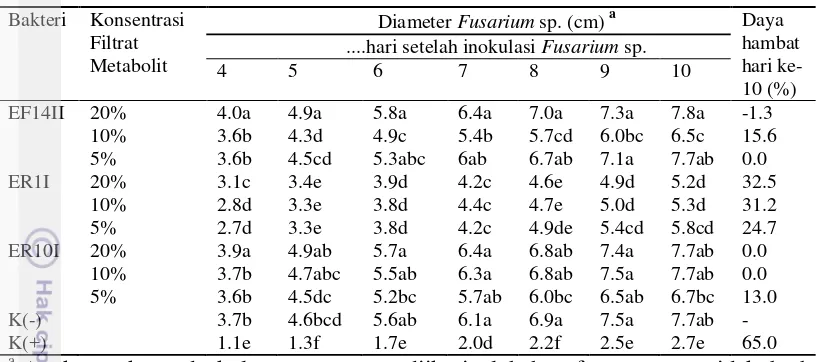
Gambar 3Deteksi dan isolasi cendawan patogen terbawa benih jagung (A) Blotter test
benih jagung pada hari ke 10, (B) benih jagung yang terinfeksi Fusarium
sp., (C) isolat Fusarium sp., (D) konidia Fusarium
A B C D
Tabel 2 Jumlah isolat (%) cendawan patogen terbawa benih jagung var. New honey dan var. DK771
Cendawan patogen Varietas
New Honey Lokal DK771
Fusarium sp. 17. 7 60.5
Aspergillus sp. 2.5 8.7
Curvularia sp. 0.7 0.0
16
Uji Antagonis Bakteri Endofit terhadap Fusarium sp. secara In vitro
Hasil uji antagonis secara in vitro 31 isolat bakteri endofit non patogen terhadap cendawan patogen terbawa benih jagung varietas lokal DK771 Fusarium
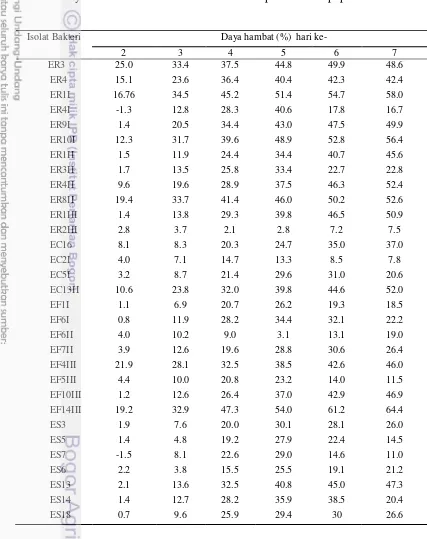
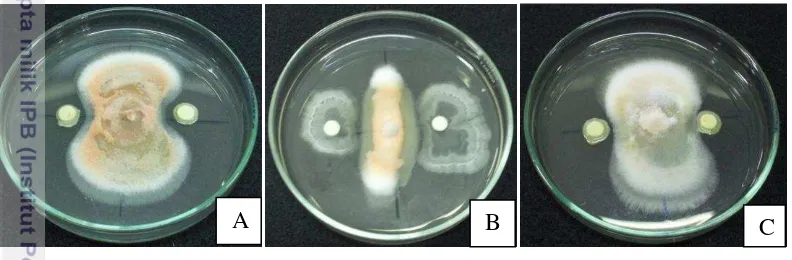
sp., diperoleh 3 isolat bakteri endofit yang menunjukkan daya hambat tertinggi terhadap pertumbuhan cendawan patogen terbawa benih Fusarium sp., (Gambar 4), yaitu isolat EF14III, isolat ER1I, dan isolat ER10I, masing-masing sebesar 64.4%, 58.0%, dan 56.4% (Tabel 3).
17 Mekanisme antibiosis bakteri endofit terhadap cendawan patogen berkaitan dengan kemampuan isolat bakteri endofit menghasilkan enzim degradasi seperti kitinase, protease, dan selulase serta senyawa lainnya yang berkaitan dengan induksi ketahanan tanaman inang (Hallmann et al. 1997). Bakteri endofit potensial sebagai agens antagonis terhadap cendawan patogen dengan menguji karakter fisiologisnya diantaranya, kemampuan bakteri menghasilkan enzim ekstraseluler (kitinase, protease, dan selulase), hidrogen sianida (HCN), pelarut fosfat, dan aktivitas fluoresensi (Eliza et al. 2007).
Mekanisme antagonis bakteri endofit dengan menggunakan metode agar diffusion ditemukan dinding sel cendawan patogen Fusarium sp. hancur terdegradasi oleh aktivitas enzim penghancur dinding sel. Bakteri endofit yang diuji antagonis dengan cendawan patogen Fusarium sp. menghasilkan senyawa iturin, surfactin, dan kitinase yang menghambat pertumbuhan cendawan Fusarium
sp. (Yuliar et al. 2013).
Berdasarkan hasil karakterisasi secara morfologi, fisiologi, dan biokimia, isolat EF14III diidentifikasi Lactobacillus sp., ER1I diidentifikasi sebagai
Pseudomonas sp., dan ER10I diidentifikasi sebagai Aeromonas sp. (Lampiran 2), ketiga isolat bakteri endofit tersebut diambil senyawa metabolit untuk uji selanjutnya. Halder et al. (2013), melaporkan bakteri Aeromonas hydrophila
memproduksi enzim kitinase yang bersifat anti cendawan terhadap cendawan patogen A. Flavus Link dan F. Oxysporum Schlecht. dengan penghancuran dinding sel patogen. Bakteri P. fluorescens mampu menekan pertumbuhan F. oxysporum secara in vitro sebesar 3.2% - 66.6% dan juga cendawan patogen
Rigidoporus lignosus (Sw.) Overeem (Rahayuniati dan Mugiastuti 2012; Hasanuddin 2011). Lactobacillus plantarum menghasilkan senyawa anti cendawan yang mampu menghambat pertumbuhan cendawan patogen F. Sporotrichioides Sherb. dan A. Fumigatus Fresenius pada uji antagonis dual culture (Strom K et al. 2002).
Gambar 4 Daya hambat bakteri endofit; (A) ER10I, (B) EF14III, (C) ER1I, terhadap
Fusarium sp. pada hari ke 7 setelah inokulasi pada media PDA
18
Kurva Pertumbuhan Bakteri
Hasil pengukuran kurva pertumbuhan bakteri menunjukkan bahwa ketiga bakteri endofit potensial Lactobacillus sp. EF14II, Pseudomonas sp. ER1I, dan
Aeromonas sp. ER10I, masing-masing mencapai fase stasioner berada pada selang waktu inkubasi 12 jam (Gambar 5).
Metabolit sekunder dihasilkan oleh bakteri pada akhir fase stasioner pertumbuhannya. Pada fase stasioner jumlah populasi bakteri tetap, jumlah sel bakteri yang hidup sama dengan jumlah sel bakteri yang mati. Sintesis metabolit sekunder dimulai pada saat nutrisi di dalam media pertumbuhan bakteri telah habis. Keterbatasan nutrisi menyebabkan terakumulasinya induser enzim metabolit sekunder dan terlepasnya gen-gen untuk sintesis metabolit sekunder (Pelczar et al. 1986).
Uji Daya Hambat Senyawa Metabolit Bakteri Endofit terhadap Fusarium sp. secara In vitro
Hasil uji In vitro senyawa metabolit bakteri endofit terhadap pertumbuhan
Fusarium sp. menunjukkan senyawa metabolit bakteri endofit Pseudomonas sp. ER1I merupakan senyawa metabolit yang paling efektif dalam menghambat pertumbuhan koloni Fusarium sp.. Senyawa metabolit isolat bakteri Pseudomonas
sp. ER1I pada konsentrasi 20% dan 10%, mampu menekan pertumbuhan koloni
19
Senyawa metabolit endofit Pseudomonas sp. ER1I mampu menghambat pertumbuhan cendawan Fusarium sp. (Gambar 6). Senyawa anti cendawan yang dihasilkan bakteri Pseudomonas sp. antara lain senyawa fenol seperti
2,4-diacetylphloroglucinol, sehingga sehingga bakteri Pseudomonas sp. dimanfaatkan sebagai biokontrol utama terhadap cendawan patogen (Reddy et al. 2009). Bakteri
P. fluorescens strain CHA0 mampu menekan cendawan Thielaviopsis basicola
penyebab busuk akar hitam pada tembakau dan Gaemannomyces gramnis pada gandum. Strain CHA0 diketahui mampu menghasilkan senyawa
2,4-diacetylphloglucinol yang bersifat anti cendawan, antibakteri, dan phytotoxic (Keel et al. 1992). Thomas et al. (1998), melaporkan bahwa bakteri rhizosfer yang diidentifikasi sebagai P. chlororaphis memiliki aktivitas antagonis terhadap cendawan patogen F. oxysporum f. sp. radicis-lycopersici penyebab penyakit busuk akar pada tomat. Senyawa anti cendawan yang dihasilkan oleh bakteri P. chlororaphis diidentifikasi sebagai phenazine-1-carboxamide (PCN).
Tabel 4. Diameter koloni Fusarium sp. pada media PDA dengan berbagai perlakuan Bakteri Konsentrasi
Filtrat Metabolit
Diameter Fusarium sp. (cm) a Daya hambat nyata pada taraf uji 5% (uji selang berganda Duncan)
Kontrol (+): Tanpa perlakuan
Kontrol (-) : Perlakuan fungisida Metalaksil
20
Senyawa metabolit yang dihasilkan oleh bakteri Lactobacillus plantarum
yang memiliki aktifitas anti cendawan yaitu 3-(R)-hydroxydecanoic acid,
3-hydroxy-5-cis-dodecenoic acid, 3-(R)-hydroxydodecanoic acid, dan 3-(R
)-hydroxytetradecanoic acid (Sjogren et al. 2003). Senyawa anti cendawan utama yang diperoleh dari ekstrak supernatan bakteri L. plantarum adalah Benzeneacetic acid, 2-propenyl ester. Senyawa tersebut memiliki aktivitas anti cendawan terhadap beberapa cendawan patogen diantaranya Botrytis cinerea, Glomerella cingulate, Phytophthora drechsleri, Penicillium citrinum, Penicillium digitatum
dan Fusarium oxysporum (Wang et al. 2012).
Analisis Senyawa Metabolit Bakteri Endofit
Analisis senyawa metabolit bakteri endofit dengan menggunakan Py-GC-MS atau pirolisis kromatografi gas spektrometri massa, merupakan metode analisis yang memungkinkan karakterisasi senyawa makromolekul volatil yang ada di alam (Octaviani 2015). Hasil analisis senyawa metabolit isolat bakteri
Pseudomonas sp. ER1I menunjukkan beberapa kandungan senyawa dengan konsentrasi yang paling tinggi seperti Cyclohexanone N, N-dimethylhydrazone
dengan konsentrasi 9.6%. Konsentrasi senyawa 2-Pyrrolidinone cukup rendah yaitu pada konsentrasi 0.67% (Tabel 5 dan Lampiran 3)
Senyawa metabolit Pseudomonas sp. ER1I yang diduga memiliki aktifitas anti cendawan adalah senyawa fenol dengan konsentrasi 1.09%, senyawa lauric acid dengan konsentrasi 1.7%, senyawa propenoic acid 0.9, dan senyawa
cyclohexanone dengan konsentrasi 9.7%. Salah satu turunan dari cyclohexanone,
pestalofones yang diisolasi dari cendawan endofit Pestalotiopsis fici, menunjukkan aktivitas anti cendawan terhadap A. Fumigatus (Liu et al. 2009). Fenol merupakan metabolit yang bersifat anti cendawan. Winkelhausen et al.
(2005) menjelaskan senyawa fenol memiliki akivitas anti cendawan terhadap cendawan patogen Fusarium culmorum. Fenol dengan konsentrasi 0.1 dan 0.25% efektif menghambat pertumbuhan F. culmorum. Fenol dapat dimanfaatkan sebagai fungisida alami terhadap patogen di lapang. Salah satu senyawa fenol p-kresol mampu menghambat pertumbuhan dan perkembangan cendawan
Aspergillus sp., sehingga senyawa p-kresol dapat dimanfaatkan sebagai senyawa anti cendawan (Pizzolitto et al. 2015).
Lauric acid merupakan asam lemak jenuh yang diketahui memiliki aktivitas antibakteri dan anti cendawan. Senyawa asam lemak menyebabkan peningkatan fluiditas membran, yang akan mengakibatkan kebocoran intraseluler dan kematian sel patogen, serta dapat menyebabkan penghambatan sintesis protein patogen. Lauric acid diketahui memiliki aktivitas anti cendawan terhadap beberapa cendawan patogen yaitu Aspergillus niger, Colletotrichum gloesporioides, Fusarium oxysporum, Phytium ultimum, Rhizoctonia solani (Phol
et al. 2011). Liu et al. (2008) melaporkan bahwa senyawa lauric acid memiliki aktifitas anti cendawan terhadap 4 cendawan patogen yaitu Alternaria solani
21
Uji Senyawa Metabolit Bakteri Endofit terhadap Tingkat Infeksi Cendawan Patogen Terbawa Benih secara In vivo
Perlakuan perendaman benih jagung dengan senyawa metabolit bakteri endofit Pseudomonas sp. ER1I pada konsentrasi 20% dan 10% mampu menekan tingkat infeksi cendawan patogen terbawa benih Fusarium sp. pada perlakuan
blotter test dan pada perlakuan growing on test di media WA dan juga tanah steril dibandingkan dengan kontrol (Gambar 7). Pada pengujian blotter tingkat infeksi
Tabel 5 Hasil analisis senyawa metabolit bakteri Pseudomonas sp. ER1I Konsentrasi (%) Nama Senyawa
2.61 Benzenesulfonic acid
0.71 4,4-dimethyl-.delta.2-cyclo
1.88 Cis-Non-3-Enol
1.16 Borinic acid
3.83 2,11-dodecadien, 4-acetyloxy
1.24 2,11-dodecadien
9.68 Cyclohexanone N,N-dimethylhydrazone
7.15 Formamide
1.76 Lauric acid
1.61 2,5-dioxo-3-isopropyl-6-methylpiperazine
1.12 Catechol Tetramethylene
7.61 Trans-2-methyl-3-isopropylaziridine
4.80 2-(2'-Nitro-2'-propenyl)-1-cyclohexanone
3.32 1,4-diaza-2,5-dioxo-3-isobutyl bicyclo[4.3.0]nonane
8.29 1,4-diaza-2,5-dioxo-3-isobutyl bicyclo[4.3.0]nonane
3.02 1,4-diaza-2,5-dioxo-3-isobutyl bicyclo[4.3.0]nonane
4.89 2,5-Piperazinedione, 3,6-bis(2-methylpropyl)-
5.52 1,4-diaza-2,5-dioxo-3-isobutyl bicyclo[4.3.0]nonane
1.85 Methyl elaidate
1.46 Valerylpyrollidine
2.99 1,4-diaza-2,5-dioxo-3-isobutyl bicyclo[4.3.0]nonane
1.82 1,4-diaza-2,5-dioxo-3-isobutyl bicyclo[4.3.0]nonane
4.11 3-benzyl-1,4-diaza-2,5-dioxobicyclo[4.3.0]nonane
4.91 3-benzyl-1,4-diaza-2,5-dioxobicyclo[4.3.0]nonane
22
Fusarium sp. terbawa benih jagung masing-masing 60% pada konsentrasi senyawa metabolit 20%, dan 35% pada konsentrasi 10%. Sedangkan pada pengujian growing on test tingkat infeksi Fusarium sp. terbawa benih jagung mencapai 29% dan 33% pada media WA, dan 31.9% dan 36% pada media tanah steril (Lampiran 4).
Berdasarkan nilai tingkat infeksi pada masing-masing perlakuan, dapat diperoleh nilai penekanan tingkat infeksi (Gambar 8). Penekanan tingkat infeksi
Fusarium sp. terbawa benih jagung pada pengujian blotter masing-masing 65.0% dan 40.0% pada konsentrasi senyawa metabolit 20% dan 10%, sedangkan pada pengujian growing on test penekanan tingkat infeksi Fusarium sp. terbawa benih jagung mencapai 59.5% dan 54.0% pada media WA, dan 60.5% dan 52.6% pada media tanah steril (Lampiran 4).
23
Infeksi Fusarium sp. pada jagung umumnya dipengaruhi oleh banyak faktor termasuk kondisi lingkungan (iklim, suhu, kelembaban), infestasi serangga, dan perlakuan pra serta pascapanen (Fandohan et al. 2013). Bakteri Pseudomonas sp. dilaporkan telah banyak dimanfaatkan sebagai salah satu agens pengendalian hayati yang efektif, hal ini dikarenakan bakteri Pseudomonas sp. menghasilkan senyawa metabolit yang bersifat anti cendawan. Hasil penelitian Soesanto et al. (2010), menunjukkan bahwa aplikasi bakteri P. fluorescens mampu menekan tingkat infeksi F. oxysporum sebesar 73.1-79.0%. Mekanisme antagonis P. fluorescens dalam mengendalikan penyakit yaitu dengan induksi resistensi, antibiosis, dan mempengaruhi pertumbuhan tanaman.
Nekrotik pada bagian daun dan akar kecambah jagung mengindikasikan adanya infeksi cendawan pada kecambah jagung. Bagian nekrotik pada kecambah jagung diisolasi dan memperlihatkan cendawan Fusarium sp. yang menginfeksi kecambah jagung (Gambar 9).
Patogen yang menginfeksi benih berpotensi menyebabkan penyakit pada saat perkecambahan atau tanaman dewasa, sehingga tanaman sakit kembali menghasilkan benih yang terinfeksi patogen atau disebut patogen tular benih atau
seed transmited. Gejala penyakit pada perkecambahan jagung dikarenakan adanya infeksi cendawan patogen pada benih jagung, ditandai dengan gejala nekrotik dan klorosis pada daun serta perkecambahan lemah karena terganggunya sistem perakaran kecambah seperti busuk pada akar (Fawole et al. 2010).
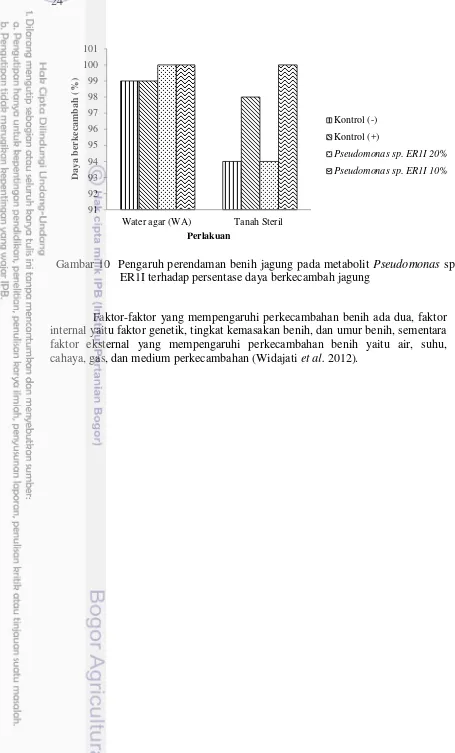
Persentase daya berkecambah pada perlakuan perendaman benih dengan senyawa metabolit bakteri Pseudomonas sp. ER1I 100% pada media WA dan 94% dan 100% pada tanah steril (Gambar 10). Hasil persentase daya berkecambah tersebut mengindikasikan bahwa senyawa metabolit bakteri tidak bersifat toksik pada benih dan tidak mempengaruhi perkecambahan benih.
Gambar 9 Isolasi nekrotik kecambah jagung (A) kecambah jagung yang terinfeksi
Fusarium, (B) isolasi kecambah jagung yang terinfeksi, (C) biakan
Fusarium, (D) konidia Fusarium sp.
24
Faktor-faktor yang mempengaruhi perkecambahan benih ada dua, faktor internal yaitu faktor genetik, tingkat kemasakan benih, dan umur benih, sementara faktor eksternal yang mempengaruhi perkecambahan benih yaitu air, suhu, cahaya, gas, dan medium perkecambahan (Widajati et al. 2012).
Gambar 10 Pengaruh perendaman benih jagung pada metabolit Pseudomonas sp. ER1I terhadap persentase daya berkecambah jagung
25
SIMPULAN DAN SARAN
Simpulan
Bakteri endofit yang berpotensi dalam menghambat pertumbuhan cendawan patogen terbawa benih jagung Fusarium sp. pada uji antagonis adalah isolat bakteri isolat Lactobacillus sp. EF14III, Pseudomonas sp. ER1I, dan
Aeromonas sp. ER10I dengan persentase daya hambat berturut-turut 64.4%, 58.0% dan 56.4%. Senyawa metabolit dari isolat bakteri endofit Pseudomonas sp. ER1I pada konsentrasi 20% dan 10% mampu menghambat pertumbuhan cendawan Fusarium sp. secara in vitro sebesar 32.5% dan 31.2% dan efektif dalam menekan tingkat infeksi cendawan terbawa benih pada benih dan kecambah jagung secara in vivo sebesar 65.0% dan 40.0% pada blotter test, 59.5% dan 54.0% pada growing on test media WA, dan 60.5% dan 52.6% growing on test
pada tanah steril.
Senyawa metabolit bakteri endofit Pseudomonas sp. ER1I mampu menghambat pertumbuhan cendawan Fusarium sp. dan juga efektif dalam menekan tingkat infeksi cendawan terbawa benih pada benih dan kecambah jagung sehingga senyawa metabolit tersebut dapat dimanfaatkan sebagai bahan aktif biofungisida.
Saran
26
Barnett HL, Hunter BB. 1998. Ilustrated Genera of Imperfect Fungi. USA (US): APS Press.
[BPS] Badan Pusat Statistik. 2013. Statistik Produksi Padi, Jagung, dan Kedelai (Angka Ramalan I Tahun 2013). Tersedia pada: http://www.bps.go.id/brs_file/aram_01jul13.pdf [7 April 2014].
[BPSB] Balai Pengawasan dan Sertifikasi Benih IV. 2013. Evaluasi Pelaksanaan Kegiatan UPT. BPSB THP Satuan Kerja Dinas Pertanian Provinsi Sumatera Utara. Laporan Tahunan.
Basak AB, Lee MW. 2002. Prevelence and transmission of seed-borne fungi of meize grown in a farm of Korea. Mycobiol. 30 (1): 47-50
Chen XH, Koumoutsi A, Scholz R, Borriss R. 2009. More than anticipated – production of antibiotics and other secondary metabolites by Bacillus amyloliquefaciens FZB42. J Mol Microbiol Biotechnol. 16:14–24. DOI: 10.1159/000142891.
Elita A, Saryono S, Christine J. 2013. Penentuan waktu optimum produksi antimikroba dan uji fitokimia ekstrak kasar fermentasi bakteri endofit
Pseudomonas sp. dari umbi tanaman dahlia (Dahlia variabilis). J Ind Che Acta. 3 (2): 56-62
Eliza, Munif A, Djatnika, Widodo. 2007. Karakter Fisiologis dan peranan antibiosis bakteri perakaran Graminae terhadap Fusarium dan pemacu pertumbuhan tanaman pisang. J Hort. 17(2): 150-160.
Elshafie HS, Bufo SA, Racioppi R, Camele I. 2013. Biochemical Characterizatio of Volatile Secondary Metabolites Produced by Burkholderia gladioli pv.
agaricicola. IJDD. 5(1): 181-184
Ezra D, Hess WM, Strobel GA. 2004. New endophytic isolates of Muscodor albus, a volatile-antibiotic-producing fungus. Microbiol. 150:4023–4031. doi:10.1099/mic0.27334-0
Fandohan P, Hell K, Marasas WFO, Wingfield MJ. 2003. Infection of maize by
Fusarium species and contamination with fumonisin in Africa. Afr J Biotechnol. 2 (12): 570-579.
Faturrahman. 2001. Kemampuan Bacillus subtilis GB03 yang diberi sumber karbon alami yang berebda dalam menghambat pertumbuhan Fusarium oxysporum. J Pen Unram. 2(12)
Fawelo OB, Ahmed O, Adetunji SB. 2010. Detection and determination of pathogenicity of seed-borne fungi in maize (Zea mays L.) varieties. Science Focus. 15(2): 249-256
27 Halder SK, Maity C, Jana A, Das A, Paul T, Mahopatra PKD, Pati BK. Mondal KC. 2013. Proficient biodegradation of shrimp shell waste by Aeromonas hydrophila SBK1 for the concomitant production of anti cendawan chitinase and antioxidant chitosaccharides. International Biodeterioration & Biodegradation. 79: 88-97. doi:10.1016/j.ibiod.2013.01.011
Hallmann J, Quadt-Hallmann A, Mahaffe WF, Kloepper JW. 1997. Bacterial endophytes in agricultural crop. Can J Microbiol. 43: 895-914.
Hasanuddin. 2011. Uji aktivitas antibiosis Pseudomonas fluorescent terhadap
Rigidoporus lignosus (Klotszch) Imazeki penyebab penyakit akar putih. J HPT. 11(1): 87-94
Ikeda AC, Bassani LL, Adamoski D, Sstringari D, Corderio VK, Glienke C, Steffens MB, Hungria M, Galli-Terasawa LV. 2013. Morphological and genetic characterization of endophytic bacteria isolated from roots of different maize genotypes. Microb Ecol. 65:154–160. doi: 10.1007/s00248-012-0104-0.
[ISTA] International Seed Testing Association. 1996. International Rules for Seed Testing. Seed Sci Technol. 24: 39-42.
Keel C, Schinder U, Maurhofer M, Voisard C, Laville J, Burger U, Wirthner P, Haas D, Defago D. 1992. Suppression of root disease by Pseudomonas fluorescens CHA0: Importance of the bacterial secondary metabolite 2, 4-Diacetylphloroglucinol. Molecular Plant–Microbes Interactions. 5(1): 4-13 Krisnamurthi B. 2010. Manfaat Jagung dan Peran Produk Bioteknologi Serealia
dalam Menghadapi Krisis Pangan, Pakan dan Energi di Indonesia. Prosiding Pekan Serealia Nasional.
Liu L, Liu S, Chen X, Guo L, Che Y. 2009. Pestalofones AE, bioactive cyclohexanone derivatives from the plant endophytic fungus Pestalotiopsis fici. Bioorganic & Medicinal Chemistry. 2(17): 606–613. doi:10.1016/j.bmc.2008.11.066
Liu S, Weibin R, Jing L, Hua X, Jingan W, Yubao G, Jingguo W. 2008. Biological control of phytopathogenic fungi by fatty acids. Mycopathologia.
166: 93-102.
Liu Y, Zuo S, Zuo Y, Wang J, Song W. 2012. Investigation on diversity and population succession dynamics of endophytic bacteria from seeds of maize (Zea mays L., Nongda 108) at different growth stages. Ann Microbiol. doi: 10.1007/s13213-012-0446-3.
Moeis RM, Ratnaningsih E, Susanto AH, Liang OB. 2000. A New Bacillus strain producing penicillin acylase. Prosiding Seminar Kimia Bersama ITB-UKM Ke empat (The forth ITB-UKM Joint Seminar on Chemistry): Yogyakarta (ID).
Mondol MAM, Shin HJ, Islam MT. 2013. Diversity of secondary metabolites from marine bacillus species: chemistry and biological activity. Mar Drugs.
11: 2846-2872. doi:10.3390/md11082846.
Munif A, Hallmann J, Sikora R. 2012. Isolation of endophytic bacteria from tomato and their biocontrol activities against fungal diseases. Microbiology.
6(4): 148-156. doi: 10.545/mi.6.4.2
Murniasih T. 2003. Metabolit sekunder dari spons sebagai bahan obat-obatan.