DETEKSI BAKTERI PATOGEN TERBAWA BENIH Burkholderia glumae (PENYAKIT BAKTERI HAWAR MALAI) PADA BEBERAPA VARIETAS BENIH PADI (Oryza sativa L.) DI SUMATERA UTARA
SKRIPSI
OLEH:
MARDIANA HASIBUAN 130301111
AGROTEKNOLOGI- HPT
PROGRAM STUDI AGROTEKNOLOGI FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA MEDAN
DETEKSI BAKTERI PATOGEN TERBAWA BENIH Burkholderia glumae (PENYAKIT BAKTERI HAWAR MALAI) PADA BEBERAPA VARIETAS BENIH PADI (Oryza sativa L.) DI SUMATERA UTARA
SKRIPSI
OLEH:
MARDIANA HASIBUAN 130301111
AGROTEKNOLOGI- HPT
Skripsi Sebagai Salah Satu Syarat untuk Mendapat Gelar Sarjana di Program Studi Agroteknologi Fakultas Pertanian Universitas Sumatera Utara, Medan
PROGRAM STUDI AGROTEKNOLOGI FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA MEDAN
2018
Judul : Deteksi Bakteri Patogen Terbawa Benih Burkholderia glumae (Penyakit
Bakteri Hawar Malai) pada Beberapa Varietas Benih Padi (Oryza sativa L.) di Sumatera Utara
Nama : Mardiana Hasibuan NIM : 130301111
Prodi : Agroteknologi- HPT
Diketahui Oleh:
Komisi Pembimbing
Dr. Lisnawita, SP., M.Si
Ketua Komisi Pembimbing Anggota Komisi Pembimbing Irda Safni, SP, MCP, Ph.D
Mengetahui,
Ketua Program Studi Agroteknologi Dr.Ir. Sarifuddin, MP
Abstract
MARDIANA HASIBUAN. Detection of Pathogenic Bacteria Carried by Seed of Burkholderia glumae (Panicle Blight Disease) on Several Varieties of Rice Seed (Oryza sativa L.) in North Sumatera, supervised by Dr. LISNAWITA, SP.,MSi., and IRDA SAFNI, SP, MCP, Ph.D. The purpose of the study was to determine the presence of bacterial panicle blight disease by B. glumae in several varieties of rice seeds in North Sumatera. This research was conducted at Plant Disease Laboratory, Faculty of Agriculture, Universitas of Sumatera Utara from March until November 2017. This research was curried out by the sampling of rice from rice seed center in Deli Serdang Regency, lawland of Sub District Percut Sei Tuan, P. Sidempuan city, Medan, Binjai and langkat Regency. The seed samples were extracted, isolated and purified then grown in semi-selective medium of Potato Peptone Glucose Agar (PPGA). The morphological characteristics of the bacterial strains were determined including bacterial colony’s and bacterial cell’s morphology, Gram staining, pigmentation, biochemical tests and pathogenic testing of onion bulbs in vitro. The results showed that based on morphological, biochemical, and in vitro tests on union bulbs, from 8 varieties of rice seeds in 6 locations in North Sumatera, obtained 3 isolates (CH BJ, IRC PRC, and IC PRC) were detected as B. glumae in the Binjai city and District Percut Sei Tuan.
Keyword : Burkholderia glumae, Panicle Blight Disease, Rice
ABSTRAK
MARDIANA HASIBUAN: Deteksi Bakteri Patogen Terbawa Benih Burkholderia glumae (Penyakit Hawar Malai) Pada Beberapa Varietas Benih Padi (Oryza sativa L.) di Sumatera Utara, dibimbing oleh Dr. LISNAWITA, SP.,MSi., dan IRDA SAFNI, SP, MCP, Ph.D. Penelitian ini bertujuan untuk mengetahui adanya penyakit bakteri hawar malai oleh bakteri B. glumae pada beberapa varietas benih padi di Sumatera Utara. Penelitian ini dilaksanakan di Laboratorium Penyakit Tanaman, Fakutas Pertanian Universitas Sumatera Utara dimulai pada bulan Maret sampai dengan November 2017. Penelitian ini dilakukan dengan pengambilan sampel benih dari balai benih padi di Kabupaten Deli Serdang, lahan masyarakat Kecamatan Percut Sei Tuan, Kota P. Sidempuan, Medan, Binjai dan Kabupaten Langkat. Sampel benih diekstraksi, disiolasi dan dimurnikan kemudian ditanam pada media semi-selektif Potato Peptone Glucose Agar (PPGA). Karakteristik morfologi strain bakteri ditentukan termasuk morfologi koloni dan sel bakteri, pewarnaan gram, pigmentasi, uji biokimia dan uji patogenitas pada umbi bawang secara in vitro. Hasil penelitian menunjukkan bahwa berdasarkan uji morfologi, biokimia, dan uji in vitro pada umbi bawang, dari 8 varietas benih padi di 6 lokasi di Sumatera Utara, di peroleh 3 isolat (CH BJ, IRC PRC, dan IC PRC) terdeteksi sebagai B. glumae di kota Binjai dan Kecamatan Percut Sei Tuan.
Kata kunci : Burkholderia glumae, Varietas, Padi
RIWAYAT HIDUP
Penulis dilahirkan di Binjai pada tanggal 26 Juli 1995 dari Ayah Ali Marhan SPd.I dan Ibu Yusmidar Siregar. Penulis merupakan puteri pertama dari empat bersaudara.
Pendidikan formal yang pernah dijalani adalah SD Negeri 027962 Binjai lulus pada tahun 2007, SMP Negeri 10 Binjai lulus pada tahun 2010, Madrasah Aliyah Negeri (MAN) Binjai lulus pada tahun 2013. Diterima sebagai mahasiswa melalui jalur SNMPTN (Seleksi Nasional Masuk Perguruan Tinggi Negeri) pada tahun 2013 program studi Agroteknologi, Fakultas Pertanian Universitas Sumatera Utara, Medan. Selama masa perkuliahan penulis aktif mengikuti organisasi kemahasiswaan BKM al-Mukhlisin Fakultas Pertanian Universitas Sumatera Utara pada tahun 2014-2016, kepanitiaan forum mahasiswa Agroteknologi/Agroekoteknologi se Indonesia (FORMATANI) pada tahun 2015, Asisten Mikologi dan Bakteriologi di Laboratorium Penyakit Tanaman, Fakultas Pertanian Universitas Sumatera Utara pada tahun 2017, sebagai anggota Ikatan Mahasiswa Perlindungan Tanaman (KLINTAN-IMAPTAN) Fakultas Pertanian Universitas Sumatera Utara pada tahun 2017 sampai dengan sekarang dan sebagai Oral Presenter dalam Seminar Internasional Conference on Agriculture, Environment and Food Security (AEFS) Organized by Faculty of Agriculture Universitas Sumatera Utara pada tahun 2017.
Penulis melaksanakan Praktek Kerja Lapangan (PKL) di PT. Tri Bakti Sarimas Kecamatan Kuantan Mudik Kabupaten Kuantan Singingi, Propinsi Riau pada bulan Juli sampai dengan Agustus 2016.
7
KATA PENGANTAR
Puji dan syukur penulis ucapkan kehadiran Tuhan Yang Maha Esa karena atas berkah dan rahmat-Nya sehingga penulis dapat menyelesaikan skripsi ini tepat pada waktunya.
Adapun judul skripsi ini adalah “Deteksi Bakteri Patogen Terbawa Benih Burkholderia glumae (Penyakit Bakteri Hawar Malai) Pada Beberapa Varietas Benih Padi (Oryza sativa L.) di Sumatera Utara” yang merupakan salah satu syarat untuk mendapatkan gelar sarjana di Fakultas Pertanian Universitas Sumatera Utara, Medan.
Pada kesempatan ini penulis mengucapkan terima kasih kepada komisi
pembimbing Dr. Lisnawita, SP., M.Si. selaku Ketua pembimbing dan Irda Safni, SP, MCP, Ph.D selaku Anggota pembimbing yang telah memberikan
saran dan kritik serta berbagai masukan kepada penulis dalam menyelesaikan skripsi ini.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Oleh karena itu, penulis mengharapkan kritik dan saran yang sifatnya membangun demi perbaikan skripsi ini di masa yang akan datang.
Akhir kata penulis mengucapkan terima kasih dan semoga skripsi ini bermanfaat bagi kita semua.
Medan, Januari 2018
Penulis
DAFTAR ISI
ABSTRACT ... i
ABSTRAK ... ii
RIWAYAT HIDUP ... iii
KATA PENGANTAR ... iv
DAFTAR ISI ... v
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... viii
PENDAHULUAN Latar Belakang ... 1
Tujuan Penelitian ... 3
Hipotesis Penelitian ... 3
Kegunaan Penelitian ... 3
TINJAUAN PUSTAKA Kesehatan Benih Padi (Oryza sativa L.) ... 4
Penyakit Bakteri Hawar Malai Padi (Bacterial Panicle Blight Karakteristik ) ... 5
Burkholderia glumae Gejala serangan ... 5
Burkholderia glumae Epidemiologi ... 7
... 6
Faktor Virulen Burkholderia glumae ... 9
Deteksi Burkholderia glumae ... 11
BAHAN DAN METODE Tempat dan Waktu Penelitian ... 13
Bahan dan Alat ... 13
Metode Penelitian ... 14
Pelaksanaan Penelitian ... 14
Pengambilan sampel benih ... 14
Ekstraksi, isolasi, dan purifikasi sampel benih ... 14
Uji karakteristik morfologi dan biokimia ... 15
Uji morfologi koloni (warna, bentuk, elevasi, margin) ... 16
Uji pigmentasi ... 16
Uji pewarnaan gram ... 16
Uji katalase ... 16
Uji oksidase ... 17
Uji oksidasi-fermentasi (OF) metode Hugh dan Leifson ... 17
Uji reduksi nitrat ... 17
Uji hidrolisis pati (starch) ... 18
Uji penggunaan sumber karbon inositol ... 18
Uji sitrat... 19
Uji patogenitas pada umbi bawang secara in vitro ... 19
HASIL DAN PEMBAHASAN Gejala serangan hawar malai di lapangan ... 20
Morfologi koloni dan sel bakteri ... 21
Uji pigmentasi ... 26
Identifikasi bakteri ... 28
KESIMPULAN DAN SARAN Kesimpulan ... 39
Saran... 39 DAFTAR PUSTAKA
LAMPIRAN
DAFTAR TABEL
No. Keterangan Halaman
1. Isolat bakteri, vaietas dan asal isolat ... 22
2. Morfologi koloni ... 22
3. Morfologi koloni dan sel bakteri ... 23
4. Morfologi koloni dan sel bakteri non kriteria B. glumae ... 26
5. Uji biokimia ... 37
6. Uji patogenitas pada umbi bawang secara in vitro ... 38
DAFTAR GAMBAR
No Keterangan Halaman
1. Serangan bakteri hawar malai pada bulir padi dilapangan ... 21
2. Uji pigmentasi ... 27
3. Uji katalase ... 29
4. Uji oksidase ... 30
5. Uji Oksidasi-Fermentasi ... 31
6. Uji reduksi nitrat ... 33
7. Uji hidrolisis pati (Starch) ... 34
8. Uji penggunaan sumber karbon inositol ... 35
9. Uji sitrat... 36
10.Uji patogenitas pada umbi bawang secara in vitro ... 38
PENDAHULUAN Latar Belakang
Beras merupakan salah satu makanan pokok masyarakat Indonesia.
Konsumsi beras Indonesia menduduki peringkat pertama di dunia sehingga mengakibatkan tinggi nya permintaan beras dalam negeri dan terkadang tidak seimbang dengan pasokan yang tersedia. Beras dijadikan makanan pokok karena kandungan karbohidratnya yang tinggi sehingga dapat berfungsi sebagai sumber energi bagi manusia. Kandungan dari beras dapat diperoleh jika kualitas beras yang dikonsumsi juga baik karena kualitas beras sangat dipengaruhi oleh kualitas benih yang pada gilirannya akan tumbuh menjadi padi (Risnawaty, 2012).
Produksi padi pada tahun 2015 (ATAP) sebesar 4,04 juta ton Gabah Kering Giling, naik sebesar 413.790 ton atau sebesar 11,40 persen dibanding produksi padi ATAP tahun 2014. Kenaikan produksi disebabkan kenaikan luas panen sebesar 64.451 hektar atau 8,98 persen dan kenaikan produktifitas sebesar 1,12 ku/ha atau sebesar 2,21 persen. Produksi padi selama tiga tahun terakhir menunjukkan perkembangan yang fluktuatif. Produksi padi tahun 2013 naik sebesar 0,32 persen (11.735 ton) dibanding produksi tahun 2012 namun pada tahun 2014 turun sebesar 2,65 persen (96.210 ton) dibanding produksi tahun 2013 dan di tahun 2015 produksi padi naik sebesar 11,40 persen (413.790 ton) dibanding tahun 2014 (BPS Provinsi Sumatera Utara, 2016).
Padi merupakan salah satu komoditas pangan utama yang menjadi prioritas pemerintah karena merupakan bahan pangan pokok sebagian besar penduduk Indonesia. Oleh karena itu, upaya untuk meningkatkan produksi padi telah banyak dilakukan. Tetapi berbagai hambatan sering dihadapi yang akhirnya menurunkan produktifitas padi. Salah satunya adalah kurang tersedianya benih
padi yang bermutu baik mutu genetis, mutu fisiologis, mutu fisik, dan status kesehatan benih. Status kesehatan benih dapat diketahui melalui uji kesehatan benih untuk mengetahui adanya inokulum yang patogenik sehingga dapat ditentukan kondisi kesehatan benih (Saylendra, 2010).
Benih dikatakan sehat kalau benih tersebut bebas dari mikroorganisme/patogen, baik berupa bakteri, cendawan, virus maupun nematoda. Mikroorganisme yang berada dibenih dapat menimbulkan kerugian seperti penurunan daya kecambah benih, mematikan bibit/tanaman muda, perkembangan penyakit, pembawa patogen atau penyakit baru, dan kontaminasi toksin yang menurunkan nutrisi benih, meracuni hewan ternak bahkan manusia.
(Sutopo, 2004).
International Standard for Phytosanitary Measures No. 32 tentang Categorization of Commodities According to Their Pests Risk menempatkan benih/bibit tanaman sebagai media pembawa OPTK yang memiliki resiko paling tinggi dibandingkan dengan jenis komoditas pertanian lainnya (Hermawan, 2017).
Dalam upaya mencegah masuk dan menyebarnya organisme pengganggu tumbuhan yang berbahaya dan belum terdapat di Indonesia atau penyebarannya masih terbatas di wilayah tertentu, pemerintah telah menetapkan daftar Organisme Pengganggu Tumbuhan Karantina (OPTK) Burkholderia glumae yang merupakan bakteri tular benih yang dapat menyebabkan kerusakan ekonomis yang tinggi termasuk dalam OPTK A2 golongan I yang belum ditemukan metode untuk membebaskannya dari benih padi (Permentan, 2015).
Di Indonesia sendiri, keberadaan penyakit ini sudah pernah ada sejak tahun 1987 seperti yang disampaikan dalam press release kementerian pertanian,
namun setelah itu belum dilaporkan kembali adanya kerusakan yang parah akibat penyakit ini hingga kemudian keberadaan penyakit ini mulai dilaporkan kembali sejak tahun 2015 di beberapa wilayah di Indonesia. B. glumae sebagai emerging pathogen telah dilaporkan di berbagai negara di seluruh dunia akibat adanya perubahan iklim global sehingga adanya impor benih dari negara yang telah terinfestasi penyakit busuk bulir padi dalam jumlah besar pada akhir-akhir ini dapat menjadi sumber inokulum baru (Joko, 2017).
Oleh karena itu penulis tertarik untuk mengetahui dugaan adanya penyebaran penyakit bakteri hawar malai (Bacterial Panicle Blight) oleh bakteri B. glumae pada beberapa varietas benih padi di Sumatera Utara.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui adanya penyakit hawar malai yang disebabkan oleh bakteri B.glumae pada beberapa varietas benih padi di Sumatera Utara.
Hipotesis Penelitian
Bakteri terbawa benih B. glumae penyebab penyakit hawar malai dapat ditemukan pada beberapa varietas benih padi di Sumatera Utara.
Kegunaan Penelitian
Sebagai salah satu syarat untuk mendapatkan gelar sarjana di Program Studi Agroteknologi Fakultas Pertanian Universitas Sumatera Utara dan sebagai bahan informasi bagi pihak yang membutuhkan.
TINJAUAN PUSTAKA Kesehatan Benih Padi (Oryza sativa L.)
Kesehatan benih sangat penting untuk produksi tanaman. Benih merupakan bahan pertukaran penting untuk pertanian, produksi benih, dan penelitian di tingkat nasional, regional, dan internasional. Pada tingkat internasional, pertukaran benih membantu menciptakan varietas baru tanaman dan bahan untuk penelitian. Dengan adanya pertukaran benih juga dapat menimbulkan bahaya datangnya hama dan patogen, sehingga perlu perlindungan yang ketat bagi bahan pertukaran benih (IRRI, 1994).
Perlindungan yang diperlukan untuk menghentikan penyebaran hama dan patogen hanya sementara memungkinkan pergerakan benih aman tanpa gangguan.
Pengamanan mencakup aturan, peraturan, izin impor, sertifikat phytosanitary, inspeksi, perawatan, karantina di rumah kaca, pengujian kesehatan benih, dan langkah-langkah lainnya yang telah diadopsi secara nasional dan internasional (IRRI, 1994).
Sebagai upaya untuk mencegah atau mengurangi risiko akibat gangguan penyakit atau patogen terbawa benih, maka perlu dilakukan pemeriksaan atau pengujian kesehatan benih sebelum benih disimpan ataupun sebelum ditanam.
Metode pengujian kesehatan benih yang digunakan sangat tergantung pada jenis benih dan jenis patogen yang mungkin terbawa benih. Penentuan metode tersebut dimaksudkan agar deteksi dan identifikasi patogen terbawa benih dapat dilakukan dengan mudah dan akurat. Hal tersebut berarti untuk pengujian suatu contoh benih dapat digunakan lebih dari satu metode pengujian kesehatan benih. Berbagai macam cara pengujian kesehatan benih untuk mendeteksi mikroorganisme atau
patogen terbawa benih dapat dikelompokkan menjadi : pengamatan secara visual terhadap benih kering , metode pencucian benih, metode inkubasi, uji gejala pada bibit/kecambah dan uji serologi (Harahap, 2010).
Penyakit Bakteri Hawar Malai Padi (Bacterial Panicle Blight)
Bakteri hawar malai (Bacterial Panicle Blight/ BPB) pada padi pertama kali dilaporkan di Jepang pada 1950-an, dan sejak saat itu telah menjadi salah satu penyakit padi yang paling serius di dunia (Xie et al., 2003).
B. glumae adalah patogen tular benih padi, dan BPB yang disebabkan oleh B. glumae bisa menyebabkan 75% kehilangan hasil yang parah di lapangan (Trung et al., 1993). Banyak negara, terutama negara-negara tropis dan subtropis, mempertimbangkan BPB sebagai penyakit bakteri potensial beras beresiko tinggi (Ham et al., 2011).
Hingga kini, BPB telah dilaporkan di banyak negara yang menanam padi di Amerika Selatan dan Tengah (Republik Dominika, Venezuela, Ekuador, Brazil, Panama, Kolombia, Nikaragua dan Costarica), Afrika (negara-negara Afrika Selatan dan Tanzania) dan Asia (Jepang , Korea, Vietnam, Filipina, India, Indonesia, Malaysia, Sri Lanka, Thailand dan Cina) (Nandakumar et al., 2005).
Karakteristik Burkholderia glumae
Pada tahun 1967, Kurita pertama sekali menamai bakteri patogen yang menyebabkan butir beras busuk sebagai Pseudomonas glumae.Sejak tahun 1992, berdasarkan sekuensing gen 16S rRNA, homologi - DNA-DNA, seluler lipid dan komposisi asam lemak serta karakteristik fenotip, bakteri non fluorescent, Pseudomonas diklasifikasikan sebagai genus Burkholderia spp. Oleh karena
itu, taksonomi Pseudomonas glumae direvisi menjadi Burkholderia glumae pada tahun 1992 (Yabuuchi et al., 1992).
B . glumae tergolong bakteri gram negatif, berbentuk batang dengan flagel polar (1-3 flagela polar), nonfluorescent, pigmen yang dihasilkan B. glumae kuning-hijau yang larut dalam air (Gambar. 1a). Koloni B. glumae berwarna putih keabu-abuan dan kuning karena pigmentasi (Gambar. 1b). Suhu pertumbuhan optimum adalah sekitar 30 ° C, tetapi dapat tumbuh bahkan pada suhu 41 ° C (Saddler, 1994). Arginine dehydrolase, reaksi oksidase dan reduksi nitrat mengekspresikan reaksi negatif. produksi lecithinase dan penggunaan L-arginine dan inositol bernilai positif (Yuan, 2004).
Gambar. 1a. Koloni bakteri B. glumae pada media King’s B
(http://www.lsuagcenter.com/topics/crops/rice/diseases/photos/bacterial-panicle- blight/bpb-1) b. Koloni bakteri B. glumae pada media CCNT
(Kawaradani et al., 2000) Gejala Serangan Burkholderia glumae
Patogen ini menginfeksi benih dan menyerang plumule (daun pertama) melalui stomata dan luka, dan berkembang biak dalam ruang-ruang antar parenkim selama perkecambahan biji. Pembelahan bakteri B. glumae di dalam
a B
plumule mengarah ke produksi bahan beracun, seperti toxoflavin, yang kemudian menghasilkan bibit padi membusuk (Zhu et al., 2010).
Bakteri cepat menyebar pada munculnya permukaan malai dan menginfeksi setelah munculnya bunga. Gejala luka termasuk kecil (1 sampai 5 mm) dengan tepi berwarna coklat pada daun dan bulir, mengakibatkan kosongnya biji yang terinfeksi sebelum pengisian lengkap. Kuntum yang terinfeksi menunjukkan dasar abu-abu atau coklat gelap (Gambar. 2), tetapi batang dari malai tetap hijau. Selubung luka tampak panjang beberapa sentimeter dengan dasar kecoklatan dan tepi berwarna coklat kemerahan bisa terbentuk pada selubung daun bendera anakan yang terinfeksi. Malai seringkali tetap tegak, karena kehilangan berat biji, bukan merunduk ( Sayler et al., 2006).
Gambar. 2 Gejala serangan B. glumaepada malai padi (Nandakumar et al.,2009) Epidemiologi
Epidemi penyakit tumbuhan berkembang sebagai akibat kombinasi yang tepat pada waktunya dari unsur – unsur yang sama dengan yang mengakibatkan penyakit tumbuhan, yaitu tumbuhan inang yang rentan, patogen yang virulen, dan kondisi lingkungan yang menguntungkan, dan terjadi dalam waktu yang cukup
lama. Akan tetapi karena aktivitas manusia yang mungkin tanpa disadari dapat membantu timbul dan berkembangnya epidemi, atau malahan mungkin juga secara efektif dapat menghentikan timbul dan perkembangan epidemi di bawah kondisi yang mungkin saja dapat tejadi tanpa adanya campur tangan manusia (Agrios, 1996).
Proses terjadinya epidemi penyakit pada populasi inang memerlukan jangka waktu tertentu. Oleh karena itu dalam jangka waktu tersebut terjadi interaksi antara patogen dan tanaman inang. Interaksi selama itu dipengaruhi oleh faktor-faktor yang dapat mendukung maupun menghambat proses terjadinya epidemi, diantaranya disebabkan oleh faktor ketahanan tanaman inang, virulensi patogen, dan lingkungan baik makro maupun mikro. Faktor ketahanan inang diperoleh dari jenis varietas tanaman maupun umur tanaman, sedangkan virulensi patogen dipengaruhi oleh jenis atau ras patogen. Disamping itu kondisi lingkungan seperti kelembaban udara, intensitas matahari, suhu dan curah hujan dapat memicu terjadinya epidemi (Nirwanto, 2007).
Terjadinya penyakit tanaman sangat dipengaruhi oleh praktek-praktek pertanian maupun oleh faktor meteorologi, tanaman tahan penyakit, dan lain-lain.
Hal ini berarti bahwa spesies bakteri yang telah diketahui maupun tidak diketahui dapat muncul menjadi patogen penting. Munculnya B. glumae sebagai patogen padi yang penting di Jepang adalah salah satu contohnya. Hal ini dikarenakan pengenalan sistem penggalangan bibit menggunakan kotak pembibitan, yang bersamaan dengan mekanisasi tanam bibit (Azegami, 2001).
B. glumae menyukai malam yang hangat dan kondisi kelembaban tinggi yang selalu terjadi selama musim bertanam padi (Cha et al., 2001). BPB muncul
selama tahap pembentukan beras ketika memiliki suhu malam yang tinggi dan sering curah hujan yang merupakan kondisi lingkungan yang penting mempengaruhi beras untuk wabah penyakit. Dalam kondisi lingkungan yang sesuai, serangan BPB dapat menyebar dan meningkat pesat. Xie et al., (2003) menemukan bahwa B. glumae dapat menyebabkan kemandulan gabah dan perubahan warna saat munculnya bulir B. glumae juga telah ditemukan karena bertanggung jawab atas penurunan berat gabah, sterilitas floret, penghambatan perkecambahan biji dan mengurangi tegakan bibit padi (Jeong et al., 2003).
Layu bakteri berbeda dari layu jamur di mana jamur tetap di jaringan pembuluh sampai kematian tanaman, sedangkan bakteri sering merusak bagian dinding sel dalam pembuluh xilem.Ketika menderita layu bakteri, jaringan pembuluh dari batang dan akar sakit berubah menjadi cokelat, dan cairan bakteri mengalir antar jaringan (Jeong et al., 2003).Selain padi, B. glumae juga telah dilaporkan mampu menyebabkan layu pada tanaman cabai, terong, wijen dan tanaman tomat di Korea,namun, gejala hawar bakteri atau layu yang disebabkan oleh B. glumae bisa dibedakan dari gejala yang disebabkan oleh bakteri Ralstonia solanacearum (Jeong et al., 2003). BPB sangat tergantung kepada
kondisi cuaca, aspek ekologi dan hubungan antara kemampuan bertahan hidup B. glumae dan faktor lingkungan, seperti suhu dan kekeringan. Faktor - faktor ini
perlu dipelajari secara efektif agar dapat mengelola penyakit BPB (Zhou-qi et al., 2016).
Faktor Virulen Burkholderia glumae
Patogenesis B. glumae adalah proses yang kompleks yang melibatkan beberapa faktor virulen.Studi genetika molekuler yang dilakukan oleh beberapa
kelompok penelitian telah mengidentifikasi faktor-faktor penentu patogen utama B. glumae.Di antara nya, faktor yang paling penting adalah fitotoksin dan lipase.Faktor virulen tambahan yang dikenal untuk berkontribusi virulensi penuh B. glumae termasuk polygalacturonase PehA dan PehB (Degrassi et al., 2008), katalase katG (Chun et al., 2009) dan sistem sekresi hrp tipe III (hrp-T3SS) (Kang et al., 2008). Endopolygalacturonase dan exopolysaccharides juga kandidat yang baik yang memiliki peran patogenesis dalam B. glumae (Jeong et al., 2003).
Fitotoksin
Fitotoksin yang paling penting yang dihasilkan oleh B. glumae adalah pigmen kuning cerah toxoflavin danfervenulin yang isomerase (Kim et al., 2004).
Untuksaat ini, sebagian besar penelitian berfokus pada toxoflavin.Produksi toxoflavin tergantung pada suhu pertumbuhan danmencapai tingkat maksimal pada 37° C, dan tidak ada terdeteksitoxoflavin diproduksi pada suhu 25° C hingga 28° C (Matsuda dan Sato, 1988).Toxoflavin dan fervenulin penting untuk patogenisitas bibit padi dan gandum busukyang mengakibatkan berkurangnya pertumbuhan daun dan akar di bibit padi, dan juga menyebabkan gejala klorosis pada malai padi (Jeong et al., 2003)
Lipase
Lipase memiliki kapasitas tinggi untuk menghidrolisis berbagai trigliserida dan mensintesis ester acylglycerol. Lipase mikroba memiliki banyak aplikasi industri yang penting karena mereka unggul dalam sifat enzimatik, stabilitas, selektivitas dan spesifisitas substrat. Lipase juga telah dilaporkan terlibat dalampatogenisitas B. glumae yang paling pentingvirulen-relatif lipase
adalah LipA, yang merupakanekstraseluler lipase aktif (Frenken et al., 1993).
Lipase lain yang penting adalah LipB, yang terlibat dalambiosintesis LipA dan penting untuk memperoleh LipA aktif, dan memiliki pengaruh besar pada stabilitasprotein untuk degradasi proteolitik (Frenken et al., 1993; El Khattabi et al., 2000). Ca2+ memainkan peran struktural aktif dalam menstabilkan lipase dari B. glumae dalam kondisi yang merugikan (Devescovi et al., 2007).
Deteksi Burkholderia glumae
Dengan adanya peningkatan bertahap penyakit BPB, banyak negara yang menanam padi, terutama daerah tropis dan subtropis, sekarang memberi perhatian lebih untuk membatasi masuknya patogen tular benih B. glumae ke ekosistem pertanian mereka selama perdagangan internasional. Oleh karena itu, berbagai negara membuat kesehatan tanaman (phytosanitary) dengan alat deteksi yang lebih akurat dan terpercaya untuk B. glumae (Zhou-qi et al., 2016).
Identifikasi bakteri patogen B. glumae berdasarkan morfologi koloni atau penyakit gejala sulit dan memakan waktu karena tingkat kesamaan yang tinggi di antara strain Burkholderia spp. Deteksi cepat dan identifikasi akurat dari patogen adalah langkah-langkah penting untuk mencegah patogen. Sampai saat ini, sebagian besar penelitian tentang deteksi bakteri terutama didasarkan pada metode biokimia dan molekuler konvensional. Maeda et al.,(2006) telah membedakan B.
glumae dari berbagai spesies Burkholderia spp dengan menggunakan metode Polymerase Chain Reaction (PCR) dan primer spesifik yang dirancang dari gen gyrB dan rpoD. Sayler et al.,(2006) juga telah mengembangkan metode real-time PCR (RT-PCR) untuk mendeteksi B. glumae yang diisolasi dari
Amerika Serikat menggunakan primer spesifik yang dirancang dari sekuensing Internal Transcribed Spacer (ITS) (Zhou-qi et al., 2016).
Dalam konteks ini, penggunaan benih bebas patogen merupakan praktek penting untuk mengurangi atau mengelola kejadian BPB. Oleh karena itu, sangat penting untuk mengembangkan metode yang cepat, sensitif, dan murah untuk mengidentifikasi dan mengukur tingkat B. glumae pada benih bersertifikat (Nandakumar et al., 2009).
BAHAN DAN METODE Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Penyakit Tanaman, Fakultas Pertanian, Universitas Sumatera Utara. Penelitian ini dilaksanakan mulai bulan Maret 2017 sampai dengan selesai.
Bahan dan Alat
Bahan yang digunakan untuk penelitian ini adalah berbagai benih varietas padi yang diambil dari Balai Benih Murni Lubuk Pakam, Sang Hyang Seri (varietas Bahgendit, Mekonggah, Cidenok, Inpari 32, Inpari 30, dan Cibogo) dan beberapa benih langsung dari lahan petani kota Padang Sidempuan, Medan dan Binjai (Ciherang, Paktiwi, Thailand, Sintanur, Arias, IR64, IR64 Ciherang, Inpari Cidenuk, dan Mekonggah) media selektif Potato Peptone Glucose Agar (PPGA) + 0.1 % CaCl2 (Matsuda et al.,1988), media King’s B, media NA, Nutrient Broth, alkohol 70%, aquades, kristal violet, iodine, etil alkohol, safranin, reagen oksidase (Tetramethyl-p-phenylenediamine dihydrochloride), media Oksidatif-Fermentatif (Hugh dan Leifson) (Schaad et al., 2001), media pati agar (Schaad et al., 2001), media garam mineral Ayers et al mineral salts medium (IRRI, 1994), media inositol, media Simmon’s Citrate Agar (SCA), reagen asam sulfanilat, larutan α- napthylamine, clorox, larutan sodium klorida, larutan Phosphat Buffer Saline (PBS), type strain B. glumae (DSM 9512T
Alat yang digunakan dalam penelitian ini adalah ini adalah cawan petri, beaker glass, timbangan analitik, jarum inokulasi, lampu bunsen, pipet tetes, batang pengaduk, tabung Erlenmeyer, tabung reaksi, Laminar Air Flow Cabinet
) yang berasal dari DSMZ Culture Collection Jerman, label dan bahan lainnya yang mendukung.
(LAFC), autoklaf, water bath, mikroskop compound, rotary shaker, gunting, handsprayer, tali pengikat, saringan nilon, camera, printer, dan alat lainnya yang mendukung.
Metode Penelitian
Metode penelitian yang dilakukan adalah deskriptif dengan cara pengisolasian bakteri yang terdapat pada benih varietas padi.
Pelaksanaan Penelitian Pengambilan Sampel Benih
Pengambilan sampel benih dilakukan di beberapa tempat berbeda. Sampel diambil secara acak sebanyak 500 gram dari balai benih murni Lubuk Pakam, dan balai Sang Hyang Seri, sedangkan sampel dari lahan masyarakat dari kota Padang Sidempuan, Medan, Binjai dan langkat diambil berdasarkan pengamatan gejala visual dilapangan. Masing-masing sampel benih dimasukkan dalam plastik potilen dan diberi label sebagai penanda varietas (nama varietas, lokasi dan tanggal pengambilan) selanjutnya sampel dibawa ke laboratorium untuk dianalisis.
Ekstrasi, Isolasi, dan Purifikasi Sampel Benih
Masing-masing sampel varietas benih yang telah diambil dimasukan ke dalam saringan nilon mesh (secara individu) lalu saringan nilon diikat dengan tali untuk mengamankan benih. Sampel ditempatkan di dalam wadah (plastik atau kaca), dan wadah harus memungkinkan sampel untuk "bergerak". Wadah selanjutnya ditutup dengan saringan nilon dan diikat dengan karet gelang untuk mengamankan sampel didalamnya. Kemudian sampel benih sebanyak 25 g dicuci di bawah air mengalir selama 30 menit dan dikeringkan pada kertas tissue steril, lalu sampel benih dipindahkan ke dalam 50 ml larutan phosphat buffer saline
(PBS). Selanjutnya sampel benih dihancurkan dengan menggunakan mortar steril dan alu hingga 80% dari benih hancur. Suspensi bakteri dibiarkan pada suhu ruang (25-28 °C) selama 1 jam, lalu suspensi dishaker selama 2 jam agar bakteri dapat membelah pada tahap yang dapat dideteksi. Suspensi selanjutnya diisolasi dengan metode serangkaian pengenceran berseri 10-1 hingga 10-8 menggunakan larutan sodium klorida steril (0,85% NaCl). Suspensi diambil sebanyak 1 ml kemudian dimasukkan kedalam tabung reaksi yang telah berisi 9 ml larutan garam steril sehingga diperoleh suspensi dengan pengenceran tahap 10-1 lalu di-vortex selama 5 menit, demikian seterusnya sampai dengan pengenceran 10-8. Kemudian masing-masing 0.1 ml suspensi yang berasal dari pengenceran 10-6, 10-7, dan 10-8
Uji Karakteristik Morfologi dan Biokimia
dipindahkan ke dalam cawan petri yang berisi media selektif PPGA dan digores secara merata ke seluruh permukaan agar dengan jarum inokulasi steril, lalu cawan petri diinkubasi pada suhu 28° C selama 2-3 hari (IRRI, 1994). Selanjutnya dipilih koloni tunggal yang seragam kemudian dipindahkan ke media King’s B ke dalam cawan petri dan diinkubasi pada suhu 28°C selama 2-3 hari. Koloni tunggal yang sudah murni selanjutnya digores pada tabung miring yang berisi media King’s B.
Karakteristik morfologi diamati dibawah mikroskop dengan perbesaran 1.000 kali untuk melihat bentuk bakteri melalui pewarnaan gram. Uji biokimia dilakukan untuk mengidentifikasi yang mengacu pada Bergey’s Manual of Determinative Bacteriology Ninth Edition ( Holt et al., 1994 ).
Uji Morfologi Koloni (warna, bentuk, elevasi, margin)
Isolat bakteri ditumbuhkan pada media King’s B selama 48 jam dan diamati karakter morfologi masing-masing isolat yang meliputi warna, bentuk koloni, elevasi, dan tepi koloni.
Uji Pigmentasi
Uji pigmentasi dilakukan dengan cara menumbuhkan isolat bakteri yang berumur 24 jam pada medium King’s B, kemudian diinkubasi selama 72 jam.
Reaksi positif terjadi apabila isolat bakteri menghasilkan pigmen pendar fluor ketika diamati dibawah sinar UV (Schaad et al., 2001).
Uji Pewarnaan Gram
Pengamatan sel bakteri dilakukan dengan meneteskan 1 tetes aquades pada kaca preparat ditambahkan 1 ose isolat, lalu difiksasi diatas api. Selanjutnya bakteri diwarnai dengan kristal violet dan dibiarkan selama 1 menit, dicuci dengan air mengalir, kemudian ditetesi iodine, dibiarkan selama 1 menit dan kembali dicuci dengan air mengalir. Selanjutnya bakteri ditetesi etil alkohol dan dibiarkan selama 30 detik, dicuci dengan air mengalir dan ditambahkan safranin kemudian dibiarkan selama 30 detik lalu dicuci lagi dengan air mengalir. Selanjutnya kaca preparat dikeringkan dengan menggunakan kertas serap dan ditambahkan minyak emersi. Bentuk dan warna sel bakteri diamati dibawah mikroskop dengan perbesaran 1000 kali. Bakteri gram negatif berwarna merah atau merah muda dan bakteri gram positif berwarna biru atau lembayung (Schaad et al., 2001).
Uji Katalase
Pengujian aktifitas enzim katalase dilakukan dengan cara menginokulasikan satu ose koloni bakteri pada kaca preparat kemudian ditetesi
dengan larutan H2O2
Uji Oksidase
3%. Timbulnya gelembung gas menunjukkan reaksi positif terhadap uji katalase (Schaad et al., 2001).
Uji oksidase dilakukan dengan menggoreskan satu ose koloni isolat pada kertas disc yang sudah mengandung reagen oksidase. Adanya warna biru atau ungu dalam waktu 10 detik menunjukkan reaksi positif dan jika tidak ada perubahan warna maka reaksi negatif (Schaad et al., 2001).
Uji Oksidasi-Fermentasi (OF) Metode Hugh dan Leifson
Menyiapkan medium Oksidatif-Fermentatif (Hugh dan Leifson) sebanyak 2 tabung reaksi untuk setiap isolat masing-masing 5 ml. Satu ose bakteri ditusukkan pada 2 medium tersebut, untuk tabung 1 ditutupi dengan minyak parafin dan tabung 2 tidak ditutupi dengan minyak parafin, kemudian masing- masing tabung diinkubasikan selama 7-14 hari dan diamati dengan melihat perubahan warna dari biru menjadi kuning baik pada tabung yang ditutupi parafin maupun yang tidak ditutupi parafin. Apabila seluruh media berwarna kuning maka isolat bakteri bersifat anaerob fermentatif (Schaad et al., 2001).
Uji Reduksi Nitrat
Bakteri yang telah berumur 24 jam diambil 1 ose dan diletakkan pada medium nitrat dalam tabung reaksi, kemudian diinkubasikan selama 3 hari.
Setelah 3 hari media tersebut ditetesi dengan reagen asam sulfanilat ditambah dengan 1 ml α-napthylamine. Apabila terjadi perubahan warna medium dari kuning menjadi merah maka bakteri bersifat positif (IRRI, 1994).
Uji Hidrolisis Pati (Starch)
Uji hidrolisis pati dilakukan dengan menginokulasikan isolat pada media pati agar (Schaad et al., 2001) dalam petridis lalu diinkubasi pada suhu 28° C selama 5 hari. Hasil inkubasi kemudian ditetesi dengan larutan iodin untuk memperlihatkan terbentuknya zona berwarna disekitar koloni. Reaksi positif jika media tersebut ungu-biru dengan sedikit kuning atau zona berwarna (zona hidrolisis) sekitar atau di bawah pertumbuhan bakteri. Dalam hal ini, pati benar- benar dihidrolisis oleh bakteri. Reaksi negatif jika media dan daerah sekitar pertumbuhan bakteri berwarna biru ungu. Hal ini menunjukkan bahwa pati masih ada, dan tidak ada terjadi hidrolisis, bakteri tidak memiliki kemampuan untuk menghidrolisis pati. Hidrolisis parsial telah terjadi jika coklat kemerahan terjadi di sekitar zona pertumbuhan, menunjukkan adanya dekstrin, bakteri yang tidak mampu menyelesaikan hidrolisis pati (IRRI, 1994).
Uji Penggunaan Sumber Karbon Inositol
Untuk mempelajari kemampuan bakteri dalam mendegradasi dan memfermentasikan karbohidrat yang disertai produksi asam organik. Media garam mineral Ayer et al mineral salts medium disterilisasikan dengan cara meng-autoklaf pada suhu 121 °C selama 15 menit. Sumber karbon ( inositol ) di- filter-sterilisasi dan ditambahkan pada media garam mineral Ayer et al mineral salts medium yang sudah disterilkan dan didinginkan (pada suhu 45° C) pada konsentrasi akhir 0,5% (berat/volume). Media dituang ke dalam piring petri dan dibiarkan menjadi padat. Isolat yang diuji digores per piring petri. Sebagai kontrol, disiapkan satu piring petri tanpa sumber karbon (inositol). Isolat diinkubasi pada suhu 28° C dan diamati pada hari ke-3, ke-7 dan ke-14. Amati
ada tidaknya pertumbuhan isolat bakteri pada media dengan kandungan inositol (IRRI, 1994).
Uji Sitrat
Uji sitrat dilakukan untuk menunjukkan bakteri mampu menggunakan sitrat sebagai satu-satunya sumber karbon. Pengamatan uji sitrat dilakukan pada medium Simmon’s Citrate Agar (SCA) yang diinokulasikan isolat bakteri berumur 24 jam dan diinkubasi pada suhu 37°C selama 24 jam. Sebagai pembanding disiapkan media tanpa inokulasi bakteri sebagai kontrol. Perubahan warna dari hijau menjadi biru maka bakteri bersifat positif (Lay, 1994).
Uji Patogenitas pada Umbi Bawang secara in vitro
Uji patogenitas pada umbi bawang secara in vitro dilakukan untuk mengetahui apakah isolat bakteri mampu menunjukkan patogenisitasnya pada umbi bawang. Isolat bakteri yang berumur 24 jam dipanen dan diambil suspensi nya dengan media Nutrient Broth, kemudian dilakukan dengan metode infectivity titration, yaitu dengan melukai bagian permukaan umbi bawang bombay yang sudah di sterilisasi permukaannya dimasukkan tip yang berisi 10– 20 μl suspensi bakteri (1 x 106 CFU/ml) ke bagian lubang tersebut (Schaad et al., 2001).
HASIL DAN PEMBAHASAN Gejala serangan hawar malai di lapangan
Berdasarkan hasil isolasi terhadap beberapa varietas padi yang diperoleh, sebanyak 23 isolat bakteri dilakukan reisolasi beberapa kali untuk menduga adanya bakteri B. glumae didalam biji padi yang terinfeksi bakteri. Hasil yang diperoleh dari beberapa lokasi balai padi, dan pengamatan sampel tanaman sakit yang diperoleh dari lahan masyarakat di wilayah Sumatera Utara yang diamati menunjukkan gejala yang hampir sama berupa gabah dan selubung malai berwarna hitam kecoklatan, serta bulir hampa atau kosong karena B.glumae merupakan patogen tular benih sehingga menginfeksi benih serta plumula (daun pertama) selama perkecambahan biji (Gambar 1). Hal ini sesuai dengan literatur Xie et al., (2003) dan Zhu et al., (2010) yang menyatakan gejala malai dapat berupa penghambatan perkecambahan benih, hawar bibit, busuk pelepah, bunga steril, dan bulir kosong, kehampaan pada gabah dan perubahan warna bulir.
Patogen ini menginfeksi benih dan menyerang plumula melalui stomata dan luka serta berkembang biak dalam ruang interseluler dari parenkima selama perkecambahan biji.
Keadaan malai padi yang sudah banyak ditemukan bergejala bakteri hawar malai ini menunjukkan gejala yang amat serius di lapangan yang dipengaruhi praktek-praktek pertanian maupun lingkungan mikro dan makro, sehingga serangan bakteri hawar malai dapat menyebar dan meningkat pesat. Menurut Jeong et al., (2003) meskipun belum jelas mekanisme patogenitasnya, diduga hal ini terjadi karena adanya penanaman yang dilakukan pada lahan yang berdekatan
dengan pertanaman padi yang terserang B. glumae sehingga dapat terjadi infeksi silang dari tanaman padi ke tanaman di dekatnya.
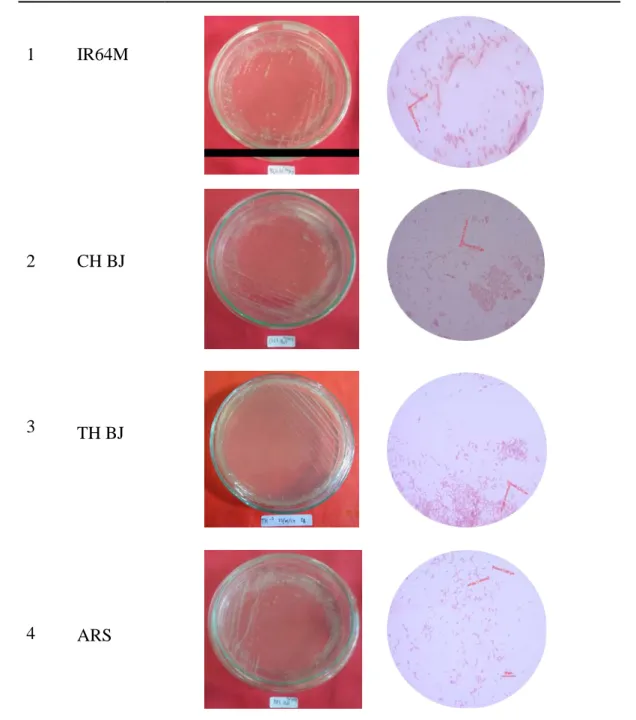
Gambar 1 : Serangan bakteri hawar malai pada bulir padi di lapangan Morfologi Koloni dan Sel Bakteri
Biakan bakteri diamati sebanyak 11 isolat dari 8 varietas padi yang
berasal dari lahan masyarakat yang diperoleh mewakili 6 daerah di Sumatera Utara (Tabel 1). Sedangkan 1 isolat adalah isolat rujukan (type strain)
yang berasal dari DSMZ Culture Collection. Morfologi yang diamati meliputi bentuk koloni, warna, margin dan elevasi. Pengamatan bentuk koloni dan margin dilakukan di bawah mikroskop dengan perbesaran 400 kali, sedangkan pengamatan warna dan elevasi dilakukan secara langsung. Morfologi isolat bakteri diuraikan pada Tabel 2.
Tabel 1. Isolat bakteri yang berasal dari beberapa varietas di beberapa lokasi di No
Sumatera Utara
Kode Isolat Varietas Asal Isolat
1 2 3 4 5 6 7 8 9 10 11 12
IR64M CH BJ TH BJ ARS THAI SIB ME PRC CIH PRC IRC PRC IC PRC IRP SID DSM 9512
IR64
T
Ciherang Thailand Arias Thailand Situ Bagendit Mekongga Ciherang IR64 Ciherang Inpari Cidenuk IR64
-
Medan Binjai Binjai Langkat Langkat Deli Sedang
Kec. Percut Sei Tuan Kec. Percut Sei Tuan Kec. Percut Sei Tuan Kec. Percut Sei Tuan Padang Sidempuan
DSMZ Culture Collection, Jerman
Keterangan: - = tidak diketahui asal varietas bakteri B. glumae
Kode Isolat
Tabel 2. Morfologi koloni isolat bakteri
Bentuk Warna Margin Elevasi
IR64M CH BJ TH BJ ARS THAI SIB ME PRC CIH PRC IRC PRC IC PRC IRP SID DSM 9512
Bulat
T
Bulat Bulat Bulat Bulat Bulat Bulat Bulat Bulat Bulat Bulat Bulat
Krim Krim Krim Krim Krim Krim Krim Krim Krim Krim Krim Krim
Rata Rata Rata Rata Rata Rata Rata Rata Rata Rata Rata Rata
Datar Datar Datar Datar Datar Datar Datar Datar Datar Datar Datar Datar
Hasil pengamatan morfologi koloni yang diperoleh menunjukkan seluruh isolat bakteri memiliki bentuk bulat berwarna krim dengan margin berbentuk rata
dan datar pada elevasinya, termasuk isolat yang berasal dari DSMZ Culture Collection Jerman. Hasil morfologi koloni dilanjutkan dengan pengamatan morfologi sel bakteri dibawah mikroskop dengan perbesaran 1.000 kali setelah dilakukan pewarnaan gram. Pewarnaan gram membedakan bakteri menjadi
kelompok gram positif dengan berwarna biru dan gram negatif berwarna merah.
Uraian mengenai morfologi koloni dan sel bakteri yang diperoleh disajikan pada
Tabel 3. Morfologi koloni dan sel bakteri Tabel 3.
No Kode
isolat
Morfologi koloni dan sel
1
2
3
4
IR64M
CH BJ
TH BJ
ARS
No Kode isolat
Morfologi koloni dan sel
5
6
7
8
9
THAI
SIB
ME PRC
CIH PRC
IRC PRC
Perbesaran mikroskop 1.000 kali
Hasil pengamatan morfologi sel pada benih padi yang merujuk bakteri B. glumae berbentuk sel batang dengan jenis gram negatif, menurut
No
Saddler (1994) menyatakan bahwa B. glumae tergolong bakteri gram negatif, berbentuk batang dengan flagela polar (1-3 flagela polar), non-fuorescent. Oleh karena itu, untuk isolat bakteri yang tidak sesuai dengan kriteria B. glumae tersebut lebih dominan mengarah bakteri gram positif, berbentuk basil, dan gram negatif, berbentuk coccus yang diperoleh dari balai perbenihan padi di Kabupaten Deli
Kode isolat
Morfologi koloni dan sel
10 IC PRC
11 IRP SID
12 DSM 9512T
Serdang , kota Medan dan sekitarnya (Tabel 4) sehingga 12 isolat ini tidak diidentifikasi lebih lanjut secara biokimia..
Tabel 4. Morfologi koloni isolat bakteri non kriteria B. glumae
Uji Pigmentasi
Pengujian pigmentasi pada isolat dilakukan dengan menumbuhkan isolat pada media Kings’B. Isolat bakteri yang menghasilkan pigmen pendar fluor ketika diamati dibawah sinar UV menunjukkan reaksi positif, sedangkan yang tidak menghasilkan pigmen pendar fluor menunjukkan hasil negatif. Pada hasil uji pigmentasi dari 12 isolat (termasuk DSM 9512T
No
) yang diduga bakteri B. glumae menunjukkan seluruh isolat tidak dapat menghasilkan pigmen pendar fluor
Strain bakteri
Lokasi isolasi
Bentuk dan susunan
sel
Uji gram
Morfologi sel
Warna Bentuk Elevasi Margin
1 SIB BJ Binjai Basil + Cream Bulat Datar Rata 2 CH
MD
Medan Basil + Cream Bulat Datar Bergelombang 3 CH M Medan Basil + Cream Bulat Datar Bergelombang 4 SNR Langkat Streptoco
ccus
- Cream Bulat Datar Rata 5 PAT Langkat Basil + Cream Bulat Datar Rata 6 IP30 Deli
Serdang
Basil + Cream Bulat Datar Rata 7 IP32 Deli
Serdang
Basil + Cream Bulat Datar Rata
8 ME Deli
Serdang
Coccus - Cream Bulat Datar Rata 9 CIB Deli
Serdang
Basil + Cream Bulat Datar Bergelombang 10 CID Deli
Serdang
Basil + Cream Bulat Datar Bergelombang 11 IR64
SR
Deli Serdang
Coccus - Cream Bulat Datar Rata 12 CH SR Deli
Serdang
Coccus - Cream Bulat Datar Bergelombang
(Gambar 2). Sedangkan pigmentasi yang dihasilkan dari media agar King’s B terlihat dari 3 isolat yaitu isolat IRC PRC, IC PRC dan IRP SID yang menghasilkan pigmen hijau-kekuningan, termasuk isolat bakteri DSM 9512T. Sedangkan 8 isolat lainnya tidak menghasilkan produksi pigmen pada media King’s B.
Hal ini menunjukkan bahwa produksi pigmen yang berwarna kekuningan pada media King’s B menghasilkan toxoflavin karena adanya aktifitas toksin yang dihasilkan bakteri dapat bersifat patogen dan ganas (virulen). Menurut Kim et al., (2004) dan Jeong et al., (2003) B.glumae menghasilkan toxoflavin berpigmen kuning cerah dan fervenulin yang isomerid. Toxoflavin dan fervenulin mengakibatkan berkurangnya pertumbuhan daun dan akar pada bibit padi, dan juga menyebabkan gejala klorosis pada malai padi. Yuan (2004) menyatakan jika media selektif yang dipilih untuk B. glumae dan B. gladioli diisolasi pada medium King's B dan diamati untuk melihat bakteri memproduksi pigmen, terlihat jelas bahwa media yang menghasilkan warna pigmen kuning-hijau bersifat toksin yang patogen dan virulen.
Gambar 2: Uji pigmentasi a. Bakteri tidak menghasilkan pigmen pendar fluor (negatif) b. Bakteri memproduksi pigmen kuning pada media King’s B
a b
Sel dari genus Burkholderia memiliki kesesuaian dengan karakteristik umum bakteri Pseudomonas aerobik lainnya. Namun, pigmentasi sama sekali bukan karakter universal burkholderia. Beberapa strain B. cepacia tidak berpigmen, sementara yang lain menghasilkan pigmen phenazine dengan berbagai warna yang beragam saat ditanam pada media kimia padat yang mengandung sumber karbon yang berbeda. Strain berpigmen dari spesies lain dapat dibagi menjadi dua jenis, berdasarkan pigmentasinya ada yang berwarna kuning pada ekstrak yeast glukosa pepton agar dan berbagai pigment seperti coklat, merah, dan ungu pada Bergey’s Manual of Determinative Bacteriology Ninth Edition (Holt et al,. 1994).
Dari hasil penelitian Yuan (2004) isolat bakteri yang dikulturkan pada media King’s B tersebut juga tidak dapat menghasilkan pigmen yang non-virulen, umumnya bersifat non-patogenik dan tanpa memproduksi pigmen dari kedua spesies B. glumae dan B. gladioli yang diidentifikasi pada media. Tentunya media tersebut akan berguna bagi penelitian selanjutnya untuk menentukan apakah produksi toksin dapat dikendalikan jika karakter bakteri tersebut dapat diubah dari kondisi media yang virulen ke non virulen. Ada kemungkinan bahwa gen-gen untuk memproduksi toksin ini dibawa oleh sebuah plasmid yang biasa ditransfer antar Burkholderia spp (Yuan, 2004).
Identifikasi Bakteri
Isolat dengan potensi terbaik diidentifikasi secara biokimia. Setelah dilakukan pengamatan terhadap morfologi koloni dan sel serta uji pigmentasi, selanjutnya dilakukan uji katalase, oksidase, oksidasi-fermentatif (O-F), reduksi
nitrat, hidrolisis pati (Starch), uji penggunaan sumber karbon inositol dan uji sitrat.
Uji Katalase
Katalase adalah enzim yang mengkatalisasikan penguraian hidrogen peroksida (H2O2) menjadi air dan O2. Hidrogen peroksida bersifat toksik terhadap sel karena bahan ini menginaktivasikan enzim dalam sel. Hidrogen peroksida terbentuk sewaktu metabolisme aerob, sehingga mikrobia yang tumbuh dalam lingkungan aerob harus menguraikan bahan toksik tersebut (Lay, 1994). Seluruh 11 isolat termasuk DSM 9512T menunjukkan hasil positif pada uji katalase, yaitu muncul gelembung udara sekitar koloni (Tabel 5 ).
Gambar 3 :Reaksi positif uji katalase, terbentuk gelembung yang ditunjukkan oleh anak panah
Uji Oksidase
Uji oksidase berfungsi untuk mengetahui adanya enzim sitokrom oksidase yang berperan dalam transport elektron pada jalur metabolisme nitrat bakteri tertentu (Amelia, 2011). Secara umum tes ini berguna untuk membedakan bakteri golongan enterik dan non enterik. Apabila berubah warna ungu kehitaman pada kertas disc yang sudah mengandung reagen oksidase menandakan reaksi positif dan jika tidak ada perubahan warna menandakan reaksi negatif (Gambar 4).
Berdasarkan hasil pengamatan terdapat 5 isolat bakteri yang diidentifikasi
menunjukkan hasil positif pada uji oksidase, dan terdapat 7 isolat yang diidentifikasi menunjukkan hasil negatif, termasuk isolat DSM 9512T
(Tabel 5).
Gambar 4 : Uji oksidase a. Reaksi positif terbentuk warna ungu pada ketas sitokrom, b. Reaksi negatif tidak terbentuk warna ungu
Uji oksidasi – Fermentasi (OF) Metode Hugh and Leifson
Pengujian ini bertujuan untuk mengetahui apakah bakteri mampu menggunakan glukosa sebagai sumber energi. Reaksi asam yang dihasilkan oleh organisme oksidatif akan terjadi pada kondisi aerob yang secara bertahap meluas ke bawah medium yaitu pada tabung yang tidak ditutup dengan parafin liquid dan tidak ada atau sedikit pembentukan asam pada tabung yang ditutupi parafin liquid.
Sedangkan fermentasi terjadi pada bakteri anaerob yaitu tabung yang ditutupi dengan parafin liquid. Hasil positif ditunjukkan dengan terbentuknya warna kuning. Asam yang dihasilkan dari fermentasi akan menurunkan pH sehingga indikator media berwarna kuning. Bakteri fakultatif dapat dilihat dari terbentuknya warna kuning pada kedua tabung. Pengujian ini dilakukan dengan menginokulasikan dengan cara menusukkan isolat bakteri kedalam 2 tabung yang berisi medium OF (Gambar 5). Setelah dilakukan penginokulasian, salah satu tabung ditutup dengan parafin liquid (IRRI, 1994).
a b
Gambar 5 : Uji oksidasi fermentasi a. Fermentasi positif, b. Oksidasi positif
Pengamatan untuk uji OF dengan membandingkan medium OF dengan atau tanpa parafin liquid yang diinokulasi bakteri terhadap medium kontrol yang berwarna hijau. Dari hasil pengamatan didapatkan bahwa terdapat 5 isolat bakteri (termasuk DSM 9512T
Uji Reduksi Nitrat
) termasuk organisme oksidatif, sedangkan terdapat 7 isolat bakteri termasuk organisme fermentatif (Tabel 5). Menurut IRRI (1994) organisme oksidatif seperti Pseudomonas dan Xanthomonas memproduksi reaksi asam (hasil dari pemecahan glukosa) pada media yang tidak ditutup parafin liquid, kurangnya produksi asam pada kedua tabung menunjukkan bahwa organisme tersebut tidak mampu untuk menguraikan glukosa atau medium tidak sesuai dengan pertumbuhan organisme. Dan tidak ada perubahan warna pada tabung atau bewarna biru (menunjukkan reaksi alkali) ini mengindikasikan bahwa oksidasi maupun fermentasi tidak terjadi.
Reduksi nitrat oleh beberapa mikroorganisme anaerob fakultatif dan aerob terjadi pada kondisi tidak ada oksigen molekular, suatu proses anaerob. Pada organisme-organisme ini, respirasi anaerob merupakan suatu proses oksidatif.
Dengan proses oksidatif ini, sel menggunakan senyawa-senyawa anorganik, b
a
seperti nitrat (NO3-
) atau sulfat (SO4-
NO
) untuk memasok oksigen yang selanjutnya berperan sebagai akseptor hidrogen akhir pada pembentukan energi (Cappuccino and Sherman, 1999).
Nitrat
3-
+ 2H+ + 2e- NO2- + H2O Reduktase
Nitrat Elektron Nitrit Air hidrogen
Reduksi nitrat dapat diketahui dengan menumbuhkan organisme di dalam media kaldu nitrat, media yang digunakan pada dasarnya adalah nutrient broth yang diberi tambahan kalium nitrat (KNO3) 0.1 % sebagai substrat nitrat. Selain itu, media dibuat semisolid dengan penambahan agar 0.1 %. Kondisi semisolid menghalangi difusi oksigen kedalam media sehingga mendukung persyaratan konsisi anaerob yang diperlukan untuk reduksi nitrat (Cappuccino and Sherman, 1999).
Hasil pengujian menunjukkan 9 isolat bakteri (termasuk DSM 9512T) bereaksi positif pada uji reduksi nitrat yang ditandai dengan timbulnya warna merah muda setelah ditetesi reagen asam sulfanilat + larutan α-napthylamin.
Sedangkan 3 isolat bereaksi negatif setelah ditetesi dengan reagen (Tabel 5), terbentuknya warna merah mengindikasikan adanya nitrit yang dihasilkan dari kemampuan bakteri mereduksi nitrat. Menurut Cappucino dan Sherman (1999) kemampuan organisme mereduksi nitrat menjadi nitrit ditentukan dengan menambahkan dua pereaksi: larutan A yaitu asam sulfanilat, dengan larutan B yaitu ɑ-napthylamine. Setelah reduksi, penambahan larutan A dan larutan B akan segera menghasilkan warna merah ceri (Gambar 6).
Gambar 6 : Uji reduksi nitrat a. Warna merah menunjukkan reduksi nitrat (positif), b. Tidak ada perubahan menunjukkan tidak terjadi reduksi nitrat (negatif)
Uji Hidrolisis Pati (starch)
Pati adalah suatu polimer bercabang berbobot molekul tinggi yang tersusun atas molekul- molekul glukosa yang saling terikat oleh ikatan glikosidik.
Pemecahan makro- molekul ini mula-mula membutuhkan adanya enzim ekstraseluler amilase untuk menghidrolisis pati menjadi polisakarida yang lebih pendek, misalnya dekstrin, dan akhirnya menjadi molekul-molekul maltosa.
Hidrolisis akhir pada disakarida ini, yang dikatalisis oleh maltase, menghasilkan molekul-molekul glukosa yang larut dalam air dan berbobot molekul rendah, molekul glukosa inilah yang dapat ditranspor kedalam sel dan digunakan untuk produksi energi melalui proses glikolisis (Cappuccino dan Sherman, 1999).
Uji hidrolisis pati pada bakteri menunjukkan seluruh isolat reaksi negatif yang ditandai dengan warna hitam pada area yang ditumbuhi oleh bakteri setelah ditetesi reagen iodin (Tabel 5). Menurut Cappuccino dan Sherman (1999) agar pati (agar amilum) digunakan untuk menunjukkan aktivitas hidrolisis eksoenzim.
Media yang digunakan adalah nutrient agar yang ditambah dengan pati, yang berperan sebagai substrat polisakarida. Deteksi aktivitas hidrolisis setelah periode
a b
pertumbuhan dilakukan dengan uji pati untuk menegtahui ada atau tidaknya pati didalam media. Jika ditambahkan iodin, pati akan memberikan warna biru-hitam pada media, yang mengindikasikan ketidakberadaan enzim pemecah pati dan menunjukkan hasil negatif. Jika pati telah dihidrolisis, suatu zona hidrolisis yang bening akan terlihat di sekeliling pertumbuhan organisme. Ini menandakan hasil positif (Gambar 7).
Gambar 7 : Uji hidrolisis pati (starch) menunjukkan hasil negatif Uji Penggunaan Sumber Karbon: Inositol
Bakteri memiliki kemampuan yang berbeda- beda dalam menggunakan karbohidrat untuk metabolisme. Penggunaan inositol termasuk salah satu parameter penentu pada uji fermentasi karbohidrat. Hasil akhir dari fermentasi karbohidrat ditentukan oleh sifat mikroba, media yang digunakan, serta faktor lingkungan berupa pH dan suhu. Isolat yang diuji digores kedalam piring petri yang berisi media garam mineral Ayers at al mineral salts medium dan tambahan inisitol sebagai sumber karbon yang diuji, sebagai pembanding disiapkan juga media tanpa sumber karbon inositol. Hasil pengujian seluruh isolat yang diidentifikasi menunjukkan hasil positif pada uji penggunaan sumber karbon
Kemampuan organisme memanfaatkan sumber karbon inositol terlihat adanya pertumbuhan bakteri dalam media, sebaliknya kemampuan bakteri tanpa sumber karbon tidak menunjukkan pertumbuhan (Gambar 8). Hal sesuai dengan literatur IRRI (1994) yang menyatakan Pseudomonas syringae dan B. glumae dapat tumbuh pada sumber karbon inositol dan tidak tumbuh pada sumber karbon trehalose, Pseudomonas fuscovaginae dapat tumbuh hanya di sumber karbon trehalose, serta Pseudomonas avena tidak dapat tumbuh pada kedua sumber karbon.
Gambar 8 : Uji penggunaan karbon a. Bakteri mampu tumbuh pada sumber karbon inositol (positif), b. Bakteri tidak tumbuh pada media tanpa sumber karbon inositol (negatif)
Uji Sitrat
Menurut Lay (1994) uji sitrat digunakan untuk melihat mikrobia menggunakan sitrat sebagai satu-satu nya sumber karbon dan energi dengan menggunakan medium Simmon-Sitrat agar yang berupa media padat. Simmon- Sitrat agar merupakan media sintetik dengan Na sitrat sebagai salah satunya sumber karbon, NH4+
sebagai sumber N dan bromthymol blue sebagai indikator pH. Bila mikrobia mampu menggunakan sitrat, maka asam akan dihilangkan dari
a b
medium biakan sehingga menyebabkan peningkatan pH dan mengubah warna medium dari hijau menjadi biru.
Dari hasil pengamatan menunjukkan bahwa bakteri yang diidentifikasi terdapat 7 isolat mengalami perubahan warna pada media menjadi biru termasuk isolat DSM 9512T, dan 5 isolat tidak mengalami perubahan warna (Gambar 9).
Perubahan warna mengindikasikan bakteri positif mampu menggunakan sitrat sebagai satu-satunya sumber karbon dan sebaliknya (Tabel 5). Mengacu pada Bergey’s Manual of Determinative Bacteriology Ninth Edition (Holt et al., 1994) pemanfaatan sumber karbon pada beberapa spesies Burkholderia dalam kategori asam sitrat menunjukkan hasil positif pada spesies B. glumae.
Gambar 9 : Uji sitrat, a Bakteri mampu menggunakan sitrat (positif), b. Bakteri tidak mampu menggunakan sitrat (negatif)
Tabel 5. Hasil uji biokimia pada isolat bakteri
Kode Isolat Katalase Oksidase O-F Reduksi Nitrat
Hidrolisa pati (starch)
Penggu- naan sumber
Sitrat
a b
inositol IR64M
CH BJ SIB TH BJ ARS THAI ME PRC CIH PRC IRC PRC IC PRC IRP SID DSM9512
+ + + + + + + + + + + +
- - - +
- - + + + - +
-
F O O F F F F F O O F O
+ + + + + + + + - - - +
- - - - - - - - - - - -
+ + + + + + + + + + + +
+ + - +
- - - - + + + +
Uji Patogenitas pada Umbi Bawang secara in vitro
Uji patogenitas dilakukan secara in vitro sebanyak 11 isolat termasuk isolat DSM 9512T yang telah diisolasi selama masa 3 hari inkubasi pada umbi bawang bombay. Hasil pengujian menunjukkan terdapat 5 isolat bakteri dan isolat DSM 9512T menyebabkan gejala yang muncul pada umbi bawang bombay mengalami pembusukan sehingga isolat bersifat patogen pada umbi bawang bombay, sedangkan 6 isolat bakteri tidak ada tanda terjadi pembusukan pada umbi bawang bombay (Gambar 10). Pada penelitian Aflaha et al., (2017) menyatakan teknik identifikasi cepat, akurat dan sederhana bakteri B.glumae pada tanaman padi dapat dilakukan dengan uji patogenitas pada umbi bawang, terjadinya gejala pembusukan pada potongan umbi bawang memberi bukti yang lebih menyakinkan
akan keberadaa bakteri B.glumae pada padi. Uji patogenitas secara in vitro pada umbi bawang diuraikan pada tabel 6.
Gambar 10 : a. Umbi mengalami pembusukan (positif), b.
Umbi tidak mengalami pembusukan (negatif)
Tabel 6. Uji Patogenitas pada Umbi Bawang secara in vitro
No Kode isolat Asal isolat Uji patogenitas pada umbi Bawang
1 2 3 4 5 6 7 8 9 10 11 12
IR64M CH BJ TH BJ ARS THAI SIB ME PRC CIH PRC IRC PRC IC PRC IRP SID DSM 9512
Medan
T
Binjai Binjai Langkat Langkat Deli Serdang
Kec.Percut Sei Tuan Kec. Percut Sei Tuan Kec. Percut Sei Tuan Kec. Percut Sei Tuan P.Sidempuan
DSMZ Culture Collection, Jerman
Negatif Positif Positif Positif Negatif Negatif Negatif Negatif Positif Positif Negatif Positif
Berdasarkan hasil identifikasi morfologi sel, morfologi koloni, dan uji biokimia pada 12 isolat bakteri termasuk bakteri pembanding B.glumae DSM 9512T dapat disimpulkan bakteri yang teridentifikasi B.glumae mengarah pada isolat CH BJ, IRC PRC, dan IC PRC. Hasil menunjukkan bahwa sel berbentuk
a b
batang, bersifat gram negatif, oksidasi aerob, warna koloni krim, positif terhadap uji katalase, penggunaan sumber karbon inositol, dan sitrat dan positif patogenitas pada umbi bawang secara in vitro, Sedangkan untuk uji oksidase dan reduksi nitrat pada beberapa literatur isolat B. glumae menunjukkan hasil yang bervariasi (Holt et al., 1994). Walaupun isolat TH BJ dan ARS menunjukkan patogenitas pada umbi bawang secara in vitro, tetapi dari hasil uji biokimia isolat bakteri termasuk fermentatif anaerob, positif katalase, reduksi nitrat, penggunaan sumber karbon inositol, tetapi hasil uji oksidase dan sitrat bervariasi.
KESIMPULAN DAN SARAN Kesimpulan
1. Berdasarkan uji morfologi, biokimia, dan uji in vitro pada bawang, dari 11 isolat yang berhasil diisolasi berasal dari 8 varietas di 6 lokasi di Sumatera Utara, diperoleh 3 isolat (CH BJ, IRC PRC dan IC PRC) terdeteksi sebagai bakteri B. glumae.
2. Isolat yang diperoleh dari Deli Serdang mampu menghasilkan pigmen hijau- kekuningan pada media King’s B yaitu isolat IRC PRC , IC PRC dan IRP SID.
3. Isolat yang termasuk ke dalam bakteri bersifat oksidasi aerob sebanyak 4 isolat termasuk DSM 9512T
4. Dari 6 lokasi di Sumatera Utara, bakteri B. glumae terdeteksi di kota Binjai dan Kecamatan Percut Sei Tuan.
, dan sebanyak 7 isolat bersifat fermentatif anaerob.
Saran
Perlu dilakukan penelitian lebih lanjut untuk menguji isolat-isolat yang terdeteksi sebagai B.glumae secara molekuler dengan menggunakan primer spesifik Polymerase Chain Reaction (PCR) dan menguji isolat-isolat ini pada beberapa varietas padi pada skala rumah kaca.
DAFTAR PUSTAKA
Aflaha, I., Fatmawati., Suparmi dan Baharuddin. 2017. Pengembangan Teknik Identifikasi Cepat, Akurat, dan Sederhana Bakteri Busuk Bulir (Burkholderia glumae) pada Tanaman Padi. Abstrak. Seminar Nasional dan Kongres XXIV Perhimpunan Fitopathologi Indonesia 2017. Sulawesi Tenggara, 3-5 Oktober 2017.
Agrios, G. N. 1996. Ilmu Penyakit Tumbuhan Edisi Ketiga. Gadjah Mada University Press. Yogyakarta.
Amelia, S. 2011. Isolasi dan Identifikasi berbagai bakteri patogen. Departemen Mikrobiologi. Fakultas Kedokteran. Universitas Sumatera Utara. Medan.
Azegami, K. 2001. Burkholderia spp. Associated With Rice. In Limited Procedings Seed Health and Seed-Associated Microorganisms for Rice Disease Management. T.W. Mew and B. Cottyn, Editors. Rice Seed Health Testing Manual. IRRI .
BPS Provinsi Sumatera Utara. 2016. Produksi Padi Dan Palawija Sumatera Utara (Angka Tetap Tahun 2015). Badan Pusat Statistik Provinsi Sumatera Utara, Medan.
Cappuccino, J.G., dan N. Sherman. 1999. Microbiology, a Laboratory Manual Fifth Edition. Benjamin/Cummings Science Publishing. California.
Cha K H, Lee Y H, Ko S J, Park S K, Park I J. 2001. Influence of Weather Condition at Heading Period on The Development of Rice Bacterial Grain Rot Caused by Burkholderia glumae. Res Plant Dis, 7: 150–154.
Chun H, Choi O, Goo E, Kim N, Kim H, Kang Y, Kim J, Moon J S, Hwang I.
2009. The Quorum Sensing-Dependent Gene Katg of Burkholderia glumae is Important for Protection From Visible Light. J Bacteriol, 191: 4152–
4157.
Degrassi G, Devescovi G, Kim J, Hwang I, Venturi V. 2008. Identification, Characterization and Regulation of Two Secreted Polygalacturonases of The Emerging Rice Pathogen Burkholderia glumae. Fems Microbiol Ecol, 65(2): 251–262.
Devescovi G, Bigirimana J, Degrassi G, Cabrio L, LiPuma J J, Kim J, Hwang I, Venturi V. 2007. Involvement of a Quorumsensing- Regulated Lipase Secreted by a Clinical Isolate of Burkholderia glumae in Severe Disease Symptoms in Rice. Appl Environ Microb, 73(15): 4950–4958
El Khattabi M, Van Gelder P, Bitter W, Tommassen J. 2000. Role of The Lipase- Specific Foldase of Burkholderia glumae as a Steric Chaperone. J Biol Chem, 275: 26885–26891.
Frenken L G J, Bos J W, Visser C, Muller W, Tommassen J, Verrips C T. 1993.
An accessory gene, lipB, required for the production of active Pseudomonas-glumae lipase. Mol Microbiol, 9(3): 579–589.
Ham J H, Groth D E. 2011. Bacterial Panicle Blight, an Emerging Rice Disease.
Baton Rouge, Louisiana, USA: Louisiana State University Agricultural Center: 16–17.
Harahap, L.H. 2010. Pengujian Kesehatan Benih Impor di Laboratorium. BBKP Belawan. http://www.bbkpbelawan.deptan.go.id.(21 januari 2017).
Hermawan. 2017. Importasi Benih Tanaman dan Minimalisasi Introduksi Organisme Pengganggu Tumbuhan Karantina. Simposium Nasional Fitopatologi Indonesia 2017 : Kemunculan penyakit baru dan impor benih. Bogor, 10 Januari 2017.
Holt, J.G., N.R. Krieg., P.H.A. Sneath., J.T. Staley., and S.T. Williams. 1994.
Bergey’s Manual of Determinative Bacteriology Ninth Edition. Lippincott Williams & Wilkins. New York.
IRRI .1994. A Manual of Rice Seed Health Testing. International Rice Research Institute, Manila, Philippines.
Jeong Y, Kim J, Kim S, Kang Y, Nagamatsu T, Hwang I. 2003. Toxoflavin Produced by Burkholderia glumae Causing Rice Grain Rot is Responsible for Inducing Bacterial Wilt in Many Field Crops. Plant Dis, 87: 890–895.
Joko, T. 2017. Burkholderia glumae sebagai Emerging Pathogen: Status, Potensi Kerusakan, dan Strategi Pengendalian. Simposium Nasional Fitopatologi Indonesia 2017 : Kemunculan penyakit baru dan impor benih. Bogor, 10 Januari 2017.
Kang Y, Kim J, Kim S, Kim H, Lim J Y, Kim M, Kwak J, Moon J S, Hwang I.
2008. Proteomic Analysis of The Proteins Regulated by hrpB From The Plant Pathogenic Bacterium Burkholderia glumae. Proteomics, 8(1): 106–
121.
Kawaradani, M., Okada, K., and S. Kusakari. 2000. New Selective Medium for Isolation of Burkholderia glumae from Rice Seeds. J. Gen. Plant Pathol.
66 : 234-237
Kim J, Kim J G, Kang Y, Jang J Y, Jog G J, Lim J Y, Kim S, Suga H, Nagamatsu T, Hwang I. 2004. Quorum Sensing and The Lysr-Type Transcriptional Activator Toxr Regulate Toxoflavin Biosynthesis and Transport in Burkholderia glumae. Mol Microbiol, 54(4): 921–934.
Lay, B. 1994. Analisis Mikrobia di Laboratorium. PT Grafindo Persada. Jakarta