PENGENDALIAN
Colletotrichum
spp. TERBAWA BENIH
CABAI MENGGUNAKAN GELOMBANG MIKRO
LILIH NAELUN NAJAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul “Pengendalian Colletotrichum spp. Terbawa Benih Cabai Menggunakan Gelombang Mikro” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
LILIH NAELUN NAJAH. Pengendalian Colletotrichum spp. Terbawa Benih Cabai Menggunakan Gelombang Mikro. Dibimbing oleh MOHAMAD RAHMAD SUHARTANTO dan WIDODO.
Cabai merah (Capsicum annuum L.) merupakan salah satu komoditas hortikultura yang banyak dibudidayakan oleh petani Indonesia karena memiliki nilai ekonomi tinggi. Cabai memiliki peranan penting dalam perekonomian nasional karena harganya yang sering mengalami fluktuasi dan bahkan mempengaruhi inflasi.
Penyakit penting pada tanaman cabai salah satunya adalah penyakit antraknosa yang disebabkan oleh cendawan Colletotrichum spp. Spesies cendawan Colletotrichum yang paling banyak ditemukan di Indonesia antara lain C. acutatum, C. capsici, dan C. gloeosporioides. Perlu adanya alternatif pengendalian yang mudah, murah, cepat dan ramah lingkungan seperti penggunaan gelombang mikro (microwave).
Gelombang mikro merupakan gelombang elektromagnetik yang mempunyai frekuensi super tinggi yaitu berkisar antara 300 MHz-300 GHz. Gelombang mikro dapat digunakan dalam komunikasi, navigasi dan industri. Pemanasan gelombang mikro dalam bidang industri digunakan untuk pengeringan, ekstraksi minyak, aplikasi medis, pengendalian hama, dan meningkatkan perkecambahan benih. Frekuensi yang biasa digunakan adalah 2 450 MHz karena frekuensi tersebut mudah diserap oleh molekul air yang ada di setiap sel hidup. Perlakuan benih dengan menggunakan gelombang mikro dapat menjadi alternatif pengendalian patogen terbawa benih yang efektif dan efisien.
Penelitian ini bertujuan untuk mengendalikan Colletotrichum spp. terbawa benih cabai menggunakan gelombang mikro dengan tetap mempertahankan mutu fisiologis benih. Penelitian dilaksanakan di Laboratorium Ilmu dan Teknologi Benih, Institut Pertanian Bogor dari bulan Juli sampai dengan Desember 2015. Percobaan pertama menggunakan rancangan acak lengkap (RAL) yang terdiri atas dua faktor, faktor pertama adalah kadar air benih terdiri atas tiga taraf yaitu 4.31, 6.33, dan 8.25%, dan faktor kedua adalah lama pemanasan gelombang mikro terdiri atas enam taraf yaitu 0, 10, 20, 30, 40, dan 50 detik. Kadar air terbaik digunakan pada percobaan kedua. Percobaan kedua menggunakan RAL satu faktor yaitu lama pemanasan gelombang mikro terdiri atas tujuh taraf yaitu 0, 10, 20, 30, 40, 50 detik dan perlakuan fungisida sistemik berbahan aktif benomil 0.5 g L-1 sebagai pembanding.
Hasil penelitian menunjukkan bahwa Colletotrichum spp. yang ditemukan pada benih cabai terdiri atas 4 spesies yaitu C. acutatum, C. capsici, C. gloeosporioides, and Colletotrichum sp. Cendawan C. acutatum merupakan cendawan yang paling banyak menginfeksi benih cabai dibandingkan dengan spesies Colletotrichum lainnya. Gelombang mikro dapat mengendalikan C. acutatum dengan tingkat efikasi sebesar 64.3% serta dapat mempertahankan viabilitas benih cabai pada kadar air rendah (4.31%) dan lama pemanasan gelombang mikro 40 detik.
SUMMARY
LILIH NAELUN NAJAH. Control on Colletotrichum spp. Seed Borne Pathogen of Chili Using Microwave. Supervised by MOHAMAD RAHMAD SUHARTANTO and WIDODO.
Chili (Capsicum annuum L.) is one of horticulture commodities that cultivated by many Indonesian farmers because of high economy values. Chili plays role in national economy because of the fluctuating price and its impact to inflation.
One of the important disease in chili is anthracnose which caused by Colletotrichum spp fungal. Colletotrichum species which can be found in Indonesia are Colletotrichum acutatum, C. capsici, and C. gloeosporioides. There are need to find alternative ways for disease controlling that are uncomplicated, inexpensive, rapid, and eco-friendly like microwave.
Microwave is an electromagnetic wave having extremely high frequency from 300 MHz-300 GHz. Microwave usually used in communication, navigation, and industries. In industries, microwave heating used for drying, oil extraction, medical application, pest control, and increasing seed germination. The frequency which commonly used is 2 450 MHz because of easy absorbed by water molecules which exist in every living cell. Seed treatment using microwave can be an alternative way to control seed borne pathogens of chili effectively and efficiently.
The purpose of this research was to control the seedborne Colletotrichum spp. of chili using microwave while still maintain the physiological seed quality. The research was conducted at the Seed Science and Technology Laboratory of Bogor Agricultural University from July to December 2015. The first experiment used a completely randomized design (RAL) with two factors, the first factor was seed water content consisted of three levels of 4.31, 6.33, and 8.25%, and the second one was microwave heating duration consisted of six levels of 0, 10, 20, 30, 40, 50 seconds. The best seed water content then was used in the second experiment. The second experiment used RAL with one factor that was microwave heating duration consisted of seven levels of 0, 10, 20, 30, 40, 50 seconds and systemic fungicide with active ingredient benomyl 0.5 g L-1 as check treatment.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu dan Teknologi Benih
PENGENDALIAN
Colletotrichum
spp. TERBAWA BENIH
CABAI MENGGUNAKAN GELOMBANG MIKRO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Tesis : Pengendalian Colletotrichum spp. Terbawa Benih Cabai Menggunakan Gelombang Mikro
Nama : Lilih Naelun Najah NIM : A251130161
Disetujui oleh Komisi Pembimbing
Dr Ir M. Rahmad Suhartanto, MSi Ketua
Dr Ir Widodo, MS Anggota
Diketahui oleh
Ketua Program Studi Ilmu dan Teknologi Benih
Dr Ir Endah Retno Palupi, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MSc Agr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah Subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian dengan judul Pengendalian Colletotrichum spp. Terbawa Benih Cabai Menggunakan Gelombang Mikro dilaksanakan sejak bulan Juli 2015.
Terima kasih penulis ucapkan kepada: Dr Ir M. Rahmad Suhartanto, MSi selaku ketua komisi pembimbing dan Dr Ir Widodo, MS selaku anggota komisi pembimbing, atas segala arahan dan bimbingan yang telah diberikan kepada penulis; Dr Tatiek Kartika Suharsi, MS dan Dr Dewi Sukma, SP MSi yang telah memberikan saran dalam penyempurnaan tesis ini. Dr Ir Endah Retno Palupi, MSc selaku ketua program studi Ilmu dan Teknologi Benih, dan seluruh dosen atas ajaran dan bimbingannya. Penulis juga menyampaikan terima kasih kepada Pemerintah Daerah Provinsi Maluku atas Beasiswa Pendidikan Pascasarjana yang telah penulis terima selama ini serta Pimpinan dan Staf Balai Pengawasan dan Sertifikasi Benih/Bibit Pertanian Peternakan Provinsi Maluku atas dukungannya. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, suami (Basnainy Thio), anak-anak (M. Rizky Thio, Fauzan Althaf Thio, Zaidan Azka Thio), dan seluruh keluarga besar atas segala doa dan kasih sayangnya. Teman-teman Ilmu dan Teknologi Benih 2013, teman-teman Fitopatologi 2013 dan 2014, serta seluruh pihak yang tidak bisa disebutkan satu per satu atas segala ilmu dan kebaikan yang diberikan.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
2 TINJAUAN PUSTAKA 3
Benih Cabai 3
Colletotrichum spp. Terbawa Benih Cabai 4
Gelombang Mikro 7
Kadar Air Benih 9
3 METODE 9 Tempat dan Waktu Penelitian 9 Sumber Bahan 9
Pelaksanaan Percobaan 10
Percobaan I Pengaruh Kadar Air dan Lama Pemanasan Gelombang Mikro Terhadap Viabilitas dan Vigor Benih Cabai 11 Percobaan II Pengaruh Lama Pemanasan Gelombang Mikro Terhadap Perkembangan Colletotrichum spp. Terbawa Benih Cabai 13
Analisis Data 14
4 HASIL DAN PEMBAHASAN 15
Pengaruh Gelombang Mikro Terhadap Viabilitas dan Vigor Benih Cabai 15 Pengaruh Gelombang Mikro Terhadap Infeksi Colletotrichum Spp. dan
Hubungannya Dengan Daya Berkecambah Benih 18
5 KESIMPULAN 22
Kesimpulan 22
DAFTAR PUSTAKA 22
DAFTAR TABEL
1 Interaksi kadar air dan lama pemanasan gelombang mikro terhadap
viabilitas benih 15
2 Interaksi kadar air dan lama pemanasan gelombang mikro terhadap
vigor benih 17
3 Persentase tingkat infeksi Colletotrichum spp. 18 4 Hasil identifikasi berdasarkan pertumbuhan koloni pada media PDA
selama 14 hari dan bentuk konidia Colletotrichum spp. 19 5 Pengaruh lama pemanasan gelombang mikro terhadap daya
berkecambah (%) dan tingkat infeksi Colletotrichum spp. 20 6 Tingkat efikasi pemanasan gelombang mikro dan fungisida benomil
terhadap tingkat infeksi C. acutatum 22
DAFTAR GAMBAR
1 Irisan melintang benih cabai: kotiledon (C), endosperm (E), hipokotil (H), mikrofil (M), radikula (R), kulit benih (SC) 4 2 Konidia C. acutatum (a), C. capsici (b), C. gloeosporioides (c) 5
3 Gejala penyakit antraknosa pada buah cabai 6
4 Komponen-komponen oven microwave 8
5 Diagram alir penelitian 10
6 Nilai LD50 berdasarkan persentase DB benih cabai kadar air 4.31%
1
PENDAHULUAN
Latar Belakang
Cabai merah (Capsicum annuum L.) merupakan salah satu komoditas hortikultura yang banyak dibudidayakan oleh petani Indonesia karena memiliki nilai ekonomi tinggi. Cabai juga mempunyai peranan penting dalam perekonomian nasional karena harganya yang sering mengalami fluktuasi dan bahkan mempengaruhi inflasi. Produktivitas cabai nasional pada tahun 2014 adalah sebesar 8.35 ton ha-1 (BPS 2015). Nilai tersebut masih sangat rendah jika dibandingkan dengan potensi hasilnya yang dapat mencapai 20 ton ha-1 (Syukur et al. 2010). Salah satu penyebab dari rendahnya produktivitas cabai adalah karena penggunaan benih yang bermutu rendah.
Pengunaan benih bermutu merupakan faktor utama dalam peningkatan produktivitas cabai. Benih bermutu mempunyai beberapa karakteristik diantaranya viabilitas dan vigor yang tinggi, murni tidak tercampur oleh varietas lain, bersih tidak tercampur kotoran atau benih tanaman lain, dan bebas dari organisme pengganggu tanaman (OPT) (Sumarni & Muharam 2005). Karakteristik tersebut digolongkan menjadi mutu fisiologis, genetik, fisik, dan patologis (kesehatan benih). Jika suatu benih tidak memenuhi syarat keempat karakteristik tersebut maka akan menyebabkan penurunan hasil produksi (Ilyas 2012).
Benih merupakan penyebar pasif dari beberapa penyakit terbawa benih (seedborne) yang disebabkan oleh mikroorganisme seperti cendawan, bakteri, virus dan nematoda. Patogen terbawa benih tersebut dapat menyebar bersama benih, di permukaan maupun di dalam benih yang biasanya dapat mengakibatkan kehilangan hasil produksi yang cukup besar (Chigoziri & Ekefan 2013). Benih yang secara visual tampak sehat, bukan berarti benih tersebut sehat. Benih yang terinfeksi penyakit merupakan sumber inokulum yang akan menularkan dan menyebar di lapangan. Perlu adanya pengujian kesehatan benih untuk mengetahui status kesehatan suatu lot benih, sehingga hasilnya dapat menentukan cara perlakuan benih dalam upaya pengendalian patogen terbawa benih atau mengurangi resiko penularan penyakit (Dirjen Tanaman Pangan 2005).
Cendawan merupakan kelompok terbesar dari patogen yang dapat terbawa benih atau tertular (transmitted) melalui benih. Cendawan masuk ke dalam tanaman dan benih melalui bukaan alami seperti hidatoda, mikrofil, stomata, dan melalui luka yang disebabkan oleh gesekan air hujan, tiupan angin, serangga, binatang, manusia, atau mikroorganisme lain (Agarwal & Sinclair 1996).
2
dalam berwarna merah tua sampai coklat muda, dengan berbagai bentuk jaringan konsentrik dari aservuli cendawan yang seringkali basah dan berwarna gelap. Spora yang berwarna pucat kekuningan sampai warna merah muda tersebar pada garis-garis konsentrik. Buah cabai bisa hancur 100% karena antraknosa (Duriat et al. 2007; Than et al. 2008).
Upaya pengendalian penyakit yang disebabkan oleh cendawan patogen terbawa benih yang biasa dilakukan yaitu dengan perlakuan benih menggunakan bahan kimia seperti fungisida sistemik, namun penggunaannya dapat mengakibatkan kerusakan lingkungan dan akan berpengaruh terhadap kesehatan manusia baik secara langsung maupun tidak langsung (Zhang et al. 2011) dan juga dapat menimbulkan resistensi cendawan patogen terhadap fungisida (Deising et al. 2008). Oleh karena itu perlu adanya alternatif pengendalian lain yang mudah, murah, cepat dan ramah lingkungan seperti penggunaan gelombang mikro (microwave).
Gelombang mikro merupakan gelombang elektromagnetik yang mempunyai frekuensi sangat tinggi yaitu berkisar antara 300 MHz-300 GHz. Gelombang mikro dapat digunakan dalam komunikasi, navigasi dan industri. Pemanasan gelombang mikro dalam bidang industri digunakan untuk pengeringan, ekstraksi minyak, aplikasi medis, pengendalian hama, dan meningkatkan perkecambahan benih (Brodie 2012). Frekuensi yang biasa digunakan adalah 2 450 MHz karena frekuensi tersebut mudah diserap oleh molekul air yang ada di setiap sel hidup. Gelombang mikro memiliki efek panas karena dapat meningkatkan suhu. Peningkatan suhu tersebut dihasilkan oleh energi yang diserap akibat pergerakan medan listrik (Iuliana et al. 2013).
Pemanfaatan gelombang mikro untuk mengendalikan cendawan patogen terbawa benih telah banyak dilaporkan antara lain dapat mengendalikan Fusarium semitectum pada benih jagung (Vassanacharoen et al. 2006), Alternaria alternata pada benih aster cina (Han 2010), Penicillium spp. pada benih buncis (Tylkowska et al. 2010), Fusarium spp. dan Microdochium nivale pada benih gandum (Knox et al. 2013), Fusarium subglutinan dan Aspergillus niger pada benih jagung manis (Arengka 2014). Penelitian ini diharapkan dapat menjadi alternatif pengendalian penyakit tanpa merusak mutu fisiologis benih, serta dapat digunakan secara cepat, tepat dan mudah.
Tujuan Penelitian
3
2
TINJAUAN PUSTAKA
Benih Cabai
Benih merupakan faktor penentu keberhasilan dalam budidaya tanaman. Penggunaan benih bermutu dapat mengurangi resiko kegagalan budidaya tanaman. Untuk mendapatkan benih bermutu tersebut, selain diperlukan benih sumber dengan mutu genetik tinggi, perlu diperhatikan juga cara budidaya tanaman yang optimal, pemeliharaan, panen, pasca panen, dan penyimpanan benih yang baik (Kusandriani & Muharam 2005).
Benih bermutu mempunyai empat karakteristik, yaitu mutu genetik, mutu fisiologis, mutu fisik, dan mutu kesehatan benih. Mutu genetik berhubungan dengan kemurnian genetik, tidak tercampur varietas lain. Isolasi dan seleksi perlu dilakukan untuk menghindari terjadinya persilangan antar varietas sehingga mutu genetik tetap terjaga. Mutu fisiologis berhubungan dengan waktu panen benih yang sangat berpengaruh terhadap mutu benih awal dan umur simpan benih yang lebih panjang, sehingga panen sebaiknya dilakukan pada saat buah mengalami masak fisiologis yang ditandai dengan buah sudah berwarna merah. Mutu fisik berhubungan dengan fisik benih yang harus tampak bersih bebas dari kotoran dan tidak tercampur dengan benih tanaman lain, sehat, bernas, tidak rusak, tidak keriput dan berukuran normal. Mutu kesehatan benih berhubungan dengan ada tidaknya serangan penyakit pada benih baik itu penyakit yang terbawa benih atau tidak (Kusandriani & Muharam 2005).
Struktur benih terdiri dari embrio, cadangan makanan dan kulit benih. Embrio merupakan bagian yang paling penting dari benih, memiliki ukuran yang pada umumnya sangat kecil dibandingkan dengan bagian benih lainnya. Embrio seperti tanaman miniatur yang terdiri dari radikula, plumula, satu atau dua kotiledon dan epikotil atau hipokotil tergantung dari jenis tanaman. Cadangan makanan terdapat pada kotiledon, endosperm atau perisperm. Kotiledon berasal dari zigot dan merupakan bagian dari embrio. Pada beberapa spesies tanaman, cadangan makanan terdapat pada kotiledon, dan perkembangan embrio menyerap semua endosperm. Kulit benih terdiri dari testa dan tegmen. Testa merupakan lapisan luar yang dapat bersifat keras seperti batu, kasar, tipis atau berdaging. Di atas testa terdapat hilum yang merupakan bekas tempat menempelnya benih pada funikulus, dan juga mikrofil yang merupakan titik pada benih berupa lubang ovul tempat masuknya tabung polen. Tegmen merupakan lapisan dalam yang tipis dan pada umumnya berwarna keputihan (Nome et al. 2002).
4
Gambar 1 Irisan melintang benih cabai: kotiledon (C), endosperm (E), hipokotil (H), mikrofil (M), radikula (R), kulit benih (SC). Sumber: Dias et al. (2013)
Benih berpotensi membawa berbagai macam mikroorganisme seperti cendawan, bakteri, virus dan nematoda yang dapat menyebabkan penyakit di persemaian maupun pada tanaman. Ada beberapa yang hidup di permukaan benih dan tidak mempengaruhi penampilan fisik benih, namun ketika kondisi lingkungan mendukung untuk pertumbuhan dan reproduksi maka akan menjadi sangat berbahaya. Mikroorganisme lain hidup pada perikarp atau kulit benih dan menyerang perkecambahan ketika kondisi lingkungan mendukung. Ada yang terbawa benih, baik pada atau di dalam embrio dan endosperm. Biasanya tidak mematikan benih, namun dapat menghambat perkecambahan dan menghasilkan kecambah yang lemah. Ada yang bertahan di embrio dan kecambah untuk menginfeksi pertanaman bila ditanam dari benih tersebut (Copeland & McDonald 1995).
Colletotrichum Terbawa Benih Cabai
Penyakit antraknosa berasal dari bahasa Yunani yang artinya batubara, merupakan nama umum untuk penyakit tanaman yang mempunyai gejala seperti bercak berwarna hitam, memiliki luka yang membentuk cekungan dan mengandung spora. Penyakit ini dapat menyebabkan kerusakan pada daun, batang, buah pra dan pascapanen (Isaac 1992) serta dapat menyebabkan kerugian ekonomi yang cukup tinggi di daerah tropis dan subtropis termasuk China, Korea, India, Indonesia dan Thailand (Voorrips et al. 2004; Kim et al. 2008; Than et al. 2008; Xia et al. 2011).
Penyakit antraknosa disebabkan oleh cendawan dari genus Colletotrichum (Deuteromycetes), yang merupakan anamorf (bentuk aseksual) dari genus Glomerella (Ascomycetes). Cendawan ini merupakan patogen yang paling penting selain karena terbawa benih, juga dapat menyebabkan infeksi laten. Infeksi tersebut menunjukkan fenomena kepasifan, yaitu gejala tidak berkembang sampai buah matang (Jeffries et al. 1990). Penyakit antraknosa disebabkan oleh beberapa spesies Colletotrichum termasuk C. acutatum, C. capsici, C. gloeosporioides (Widodo 2007). Cendawan C. acutatum merupakan spesies yang paling merusak dan mempunyai penyebaran yang luas (Voorrips et al. 2004; Xia et al. 2011).
E R
C
SC M
5 Identifikasi dan karakterisasi Colletotrichum dilakukan berdasarkan karakter morfologi dan karakter kultur. Karakter tersebut digunakan untuk membedakan species Colletotrichum seperti ukuran dan bentuk konidia, apresoria, keberadaan setae atau teleomorf, warna koloni, produksi pigmen, tekstur dan kecepatan tumbuh (Smith & Black 1990).
Ivey et al. (2004) melaporkan bahwa koloni C. acutatum berwarna putih pada awal perkembangan kemudian menjadi oranye, semakin lama semakin berwarna abu-abu kehijauan, jika dibalikkan akan berwarna oranye kecoklatan. Kumpulan konidia berwarna oranye cerah berada pada koloni bagian tengah. Kultur yang lebih lama menghasilkan aservuli berwarna hitam pada bagian tengah koloni. Miselia bercabang, bersekat dan hialin. Konidia hialin, bersel satu, bentuknya silinder dengan ujung meruncing, berukuran panjang 14.7 µm dan lebar 3.85 µm. Than et al. (2008) melaporkan bahwa pertumbuhan koloni C. acutatum sangat lambat 5.8 mm/hari, bentuk konidia fusiform dengan salah satu atau kedua ujungnya meruncing berukuran panjang 14 µm dan lebar 3.5 µm (Gambar 2).
Than et al. (2008) melaporkan bahwa koloni C. capsici berwarna putih sampai abu-abu, dengan kumpulan konidia berwarna abu-abu kecoklatan. Pertumbuhan koloni pada kultur tergolong cepat, yaitu 7.1 mm/hari, bentuk konidia falcate seperti bulan sabit berukuran panjang 21 µm dan lebar 3 µm (Gambar 2). Chai et al. (2014) melaporkan bahwa C. capsici mempunyai koloni berwarna coklat keabu-abuan, kumpulan konia berwarna kuning pucat, acervuli berwarna cokelat tua sampai hitam, setae berwarna coklat muda sampai coklat tua. Konidia berwarna hialin, bentuknya falcate dengan ujung tajam, berukuran panjang 22-26.2 µm dan lebar 3-5.5 µm.
Koloni C. gloeosporioides mempunyai warna yang bervariasi dari putih keabu-abuan sampai abu-abu tua. Pertumbuhan koloni pada kultur paling cepat, yaitu 11 mm/hari, bentuk konidia silinder dengan kedua ujungnya membulat berukuran panjang 13.5 µm dan lebar 4 µm (Gambar 2) (Than et al. 2008).
Gambar 2 Konidia C. acutatum (a), C. capsici (b), C. gloeosporioides (c). Sumber: Than et al. (2008)
Penyakit antraknosa pada buah sering menyebabkan busuk lunak pada kulit buah. Gejala yang khas pada buah, yaitu luka yang membentuk cekungan, melingkar dan meluas dengan aservuli (struktur aseksual pada cendawan parasit) berwarna hitam yang membentuk cincin konsentris, sering basah dan menghasilkan kumpulan konidia berwarna merah muda sampai oranye. Pada serangan berat, buah menjadi kering, keriput dan berwarna seperti jerami (Gambar 3).
b
6
Gambar 3 Gejala penyakit antraknosa pada buah cabai
Infeksi awal dari patogen ini merupakan rangkaian proses mulai dari adanya konidia di permukaan tanaman, perkecambahan konidia dengan membentuk tabung kecambah, produksi appresoria yang berfungsi untuk melekat dengan kuat pada jaringan tanaman, penetrasi pada jaringan epidermis, pertumbuhan dan kolonisasi jaringan tanaman, produksi aservuli dan pembentukan spora (Prusky et al. 2000). Mekanisme infeksi patogen pada benih terdapat dua cara, yaitu infeksi sistemik dan kontaminasi atau infestasi. Infeksi sistemik terjadi melalui empat cara, yaitu: 1) infeksi sistemik melalui bunga, buah atau funiculus, 2) penetrasi melalui stigma, 3) penetrasi melalui dinding ovari dan kulit benih, 4) penetrasi melalui luka atau bukaan alami. Kontaminasi terjadi melalui dua cara yaitu patogen menempel pada permukaan benih dan tercampur pada benih selama proses produksi benih dari mulai panen, ekstraksi, seleksi sampai pengemasan (Nome et al. 2002).
Colletotrichum merupakan patogen yang dapat bertahan hidup pada benih maupun pada kulit benih, dalam bentuk aservuli atau miselia. Keberadaan aservuli yang melimpah menyebabkan rusaknya lapisan parenkim dari kulit benih dan mengurangi cadangan makanan di endosperm dan embrio (Chitkara et al. 1990). Cendawan pada kondisi tertentu dapat hidup pada inang alternatif seperti tanaman golongan solanaceae lainnya, legum, sisa-sisa tanaman, dan buah yang busuk di lapangan (Pring et al. 1995).
7
Gelombang Mikro
Gelombang mikro merupakan bagian dari gelombang radio yang memiliki frekuensi antara 300 Mhz-300 Ghz dengan panjang gelombang antara 1 m sampai 1 mm. Panjang gelombang berbanding terbalik dengan frekuensi. Semakin besar frekuensi suatu gelombang maka panjang gelombang semakin pendek dan semakin kecil frekuensi suatu gelombang maka panjang gelombang semakin panjang. Frekuensi gelombang mikro memiliki spektrum yang luas terdiri dari ultra high frequency (UHF) yaitu frekuensi antara 300 Mhz-3 Ghz, super high frequency (SHF) yaitu frekuensi antara 3 GHz-30 GHz, dan extremely high frequency (EHF) yaitu frekuensi antara 30 GHz-300 GHz. Perangkat elektronik yang memancarkan gelombang mikro dapat mengganggu telekomunikasi, pertahanan, dan aplikasi maritim, sehingga pemerintah membatasi penggunaan frekuensi yang diperbolehkan yaitu frekuensi Industrial, Science and Medical (ISM) untuk peralatan elektronik (Saltiel & Datta 1999).
Oven gelombang mikro (microwave) merupakan alat pemanas yang menghasilkan gelombang elektromagnetik dengan frekuensi sekitar 2 450 Mhz setara dengan 2.4 Ghz, yang dapat bekerja dengan cepat dan efisien. Gelombang mikro tersebut memantul dalam oven dan diserap oleh material mengandung air, lemak dan gula, yang ditempatkan dalam oven. Apabila material tidak mengandung air, maka pemanasan tidak akan terjadi dan akan tetap dingin. Gelombang mikro yang diserap akan menghasilkan panas. Proses ini tidak memerlukan konduksi panas seperti di oven biasa, sehingga bisa dilakukan dengan cepat. Gelombang mikro pada frekuensi tersebut tidak diserap oleh bahan-bahan gelas, keramik, dan sebagian jenis plastik. Bahan logam bahkan dapat memantulkan gelombang ini, sehingga oven microwave ini bersifat selektif dalam memanaskan.
Edgar & Osepchuk (2001) menjelaskan komponen-komponen utama oven microwave antara lain: 1) power supply merupakan catu daya terdiri dari trasformator, kapasitor dan dioda, 2) magnetron merupakan bagian inti yang dapat mengubah energi listrik menjadi gelombang mikro, 3) waveguide merupakan alat yang berfungsi untuk mengarahkan gelombang, 4) stirrer merupakan alat yang menyerupai baling-baling yang berfungsi untuk menyebarkan gelombang mikro di dalam oven, 5) oven cavity merupakan ruangan berdinding logam yang akan memantulkan gelombang mikro ke segala arah dan diserap oleh material, 6) air flow merupakan aliran udara yang dapat mendinginkan transformator dan magnetron (Gambar 4).
Mekanisme pemanasan oven microwave, yaitu gelombang mikro yang dihasilkan oleh magnetron ditransmisikan ke dalam waveguide kemudian dipantulkan ke dalam stirrer dan dinding logam di dalam oven, kemudian gelombang tersebut diserap material. Gabriela & Simina (2011) menyatakan bahwa aliran energi panas dari dalam material ke keluar terjadi akibat absorbsi energi elektromagnetik oleh molekul air yang terkandung dalam material. Hal ini menyebabkan terjadinya penurunan tingkat kelembaban material akibat adanya transfer panas dari bagian dalam benih ke luar.
8
benih, relatif aman, tidak menimbulkan toksik terhadap hewan, tanaman maupun manusia, efektif untuk waktu yang lama selama penyimpanan, mudah digunakan, cocok dan praktis, serta ekonomis. Perlakuan benih dengan gelombang mikro memenuhi kriteria tersebut, karena penggunaannya yang mudah hanya memerlukan beberapa detik, sehingga lebih efektif dan tidak menimbulkan toksik. Wei (2004) meyatakan bahwa keuntungan dari teknik pemanasan gelombang mikro, yaitu: 1) startup cepat, meningkatkan produksi panas secara cepat, mengurangi biaya produksi dan tenaga kerja, 2) suhu yang lebih tinggi di dalam material dari pada di luar material, 3) proses pemanasan dan pengeringan secara selektif, 4) pemanasan elektromagnetik tanpa polusi, mudah digunakan dan otomatis.
Gambar 4 Komponen-komponen oven microwave. Sumber: Edgar & Osepchuk (2001)
Perlakuan benih dengan menggunakan gelombang mikro merupakan pemanasan dielektrik yang biasa digunakan dalam proses pengeringan. Dielektrik adalah suatu zat yang mampu mendukung medan listrik dan umumnya dianggap sebagai isolator yang baik daripada konduktor arus listrik. Bouraoui et al. (1993) menyatakan bahwa pemanasan dielektrik merupakan suatu proses yang menggunakan radiasi elektromagnetik frekuensi tinggi untuk memanaskan material dielektrik melalui deretan dipolar molekul air. Ketika material dielektrik seperti benih yang terkena radiasi gelombang mikro, maka penyusunan kembali molekul air menciptakan gesekan yang menghasilkan panas dan meningkatkan suhu benih. Wei (2004) menyatakan bahwa ada dua konsep fisika yang terjadi dalam proses pemanasan dielektrik yaitu osilasi dipolar dan pergerakan ion. Mekanisme pemanasan dielektrik selain refleksi dan transmisi energi gelombang mikro, material dielektrik juga memiliki kemampuan untuk menyerap dan menghilangkan energi dalam jumlah besar dalam medan elektromagnetik.
9 dapat menjadi altenatif pengendalian OPT tanpa meninggalkan residu kimia yang membahayakan kesehatan manusia.
Kadar Air Benih
Kadar air benih merupakan berat air yang hilang karena pengeringan dan dinyatakan sebagai persentase dari berat awal benih (ISTA 2014). Kadar air merupakan salah satu faktor penting yang harus diperhatikan pada kegiatan pemanenan, pengolahan, penyimpanan dan pemasaran benih. Kadar air benih menentukan tingkat kerusakan mekanis saat pengolahan, kemampuan benih mempertahankan viabilitasnya selama di penyimpanan dan menentukan kelulusan pada proses sertifikasi benih ( Widajati et al. 2013).
Kadar air berperan dalam perdagangan benih untuk menetapkan nilai jual benih. Kandungan air yang tinggi pada benih menandakan mutu benih yang rendah, yang menyebabkan daya simpan benih rendah. Kadar air dapat dinyatakan dengan dua cara yaitu: 1) berdasarkan berat kering yang digunakan dalam ilmu pengetahuan dan penelitian, dan 2) berdasarkan berat basah yang digunakan dalam industri benih dan ISTA. Kadar air bersifat dinamis, dapat menguap atau mendesorbsi air tergantung tingkat kelembaban udara disekelilingnya (Dirjen Tanaman Pangan 2013).
Kadar air benih ortodoks pada saat panen masih sangat tinggi sekitar 20-30%, dan harus dikeringkan sampai kadar air optimum untuk mencegah perkecambahan, mempertahankan viabilitas dan vigor selama penyimpanan. Benih ortodoks tahan terhadap pengeringan sampai kadar air rendah (4%) dan dapat disimpan pada suhu rendah (<0 °C) (Ilyas 2012). Kadar air benih cabai maksimum pada pengujian laboratorium sebesar 7% untuk semua kelas benih. Kadar air tersebut merupakan persyaratan dan standar kelulusan sertifikasi benih tanaman sayuran (Permentan 2012).
3
METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Ilmu dan Teknologi Benih, Departemen Agronomi dan Hortikultura Fakultas Pertanian, Institut Pertanian Bogor pada bulan Juli sampai dengan Desember 2015.
Sumber Bahan
10
Serangan yang berat mengakibatkan buah menjadi kering, keriput dan warna menjadi seperti jerami.
Pelaksanaan Percobaan
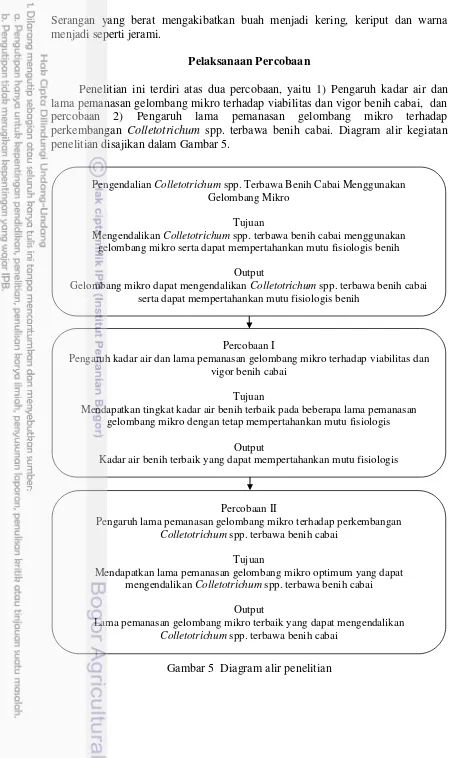
Penelitian ini terdiri atas dua percobaan, yaitu 1) Pengaruh kadar air dan lama pemanasan gelombang mikro terhadap viabilitas dan vigor benih cabai, dan percobaan 2) Pengaruh lama pemanasan gelombang mikro terhadap perkembangan Colletotrichum spp. terbawa benih cabai. Diagram alir kegiatan penelitian disajikan dalam Gambar 5.
Gambar 5 Diagram alir penelitian
Pengendalian Colletotrichum spp. Terbawa Benih Cabai Menggunakan Gelombang Mikro
Tujuan
Mengendalikan Colletotrichum spp. terbawa benih cabai menggunakan gelombang mikro serta dapat mempertahankan mutu fisiologis benih
Output
Gelombang mikro dapat mengendalikan Colletotrichum spp. terbawa benih cabai serta dapat mempertahankan mutu fisiologis benih
Percobaan I
Pengaruh kadar air dan lama pemanasan gelombang mikro terhadap viabilitas dan vigor benih cabai
Tujuan
Mendapatkan tingkat kadar air benih terbaik pada beberapa lama pemanasan gelombang mikro dengan tetap mempertahankan mutu fisiologis
Output
Kadar air benih terbaik yang dapat mempertahankan mutu fisiologis
Percobaan II
Pengaruh lama pemanasan gelombang mikro terhadap perkembangan
Colletotrichum spp. terbawa benih cabai
Tujuan
Mendapatkan lama pemanasan gelombang mikro optimum yang dapat mengendalikan Colletotrichum spp. terbawa benih cabai
Output
Lama pemanasan gelombang mikro terbaik yang dapat mengendalikan
11
Percobaan I Pengaruh kadar air dan lama pemanasan gelombang mikro terhadap viabilitas dan vigor benih cabai.
Percobaan ini bertujuan untuk mendapatkan tingkat kadar air terbaik pada beberapa lama pemanasan gelombang mikro dengan tetap mempertahankan mutu fisiologis. Benih yang digunakan adalah benih yang diekstrak dari bagian buah cabai yang sehat. Buah diekstrak secara manual, kemudian benih dikering- anginkan selama 2-3 hari sampai mendapatkan kadar air yang diperlukan.
Rancangan yang digunakan adalah rancangan acak lengkap (RAL) faktorial yang terdiri atas dua faktor. Faktor pertama adalah kadar air benih terdiri atas tiga taraf, yaitu kadar air rendah (4.31%), sedang (6.33%) dan tinggi (8.25%). Faktor kedua adalah lama pemanasan gelombang mikro terdiri atas enam taraf yaitu 0, 10, 20, 30, 40, dan 50 detik. Dengan demikian terdapat 18 kombinasi perlakuan dan setiap perlakuan terdiri atas 4 ulangan, sehingga seluruhnya terdapat 72 satuan percobaan. Setiap ulangan menggunakan 50 butir benih. Model linier rancangan percobaan yang digunakan yaitu sebagai berikut :
�ijk=μ + αi + βj + (αβ)ij + εijk Keterangan :
Yijk = nilai pengamatan pada perlakuan kadar air ke-i dan lama pemanasan gelombang mikro ke-j dan ulangan ke-k
µ = nilai tengah umum
αi = pengaruh taraf ke-i dari faktor perlakuan kadar air
βj = pengaruh taraf ke-j dari faktor lama pemanasan gelombang mikro (αβ)ij = pengaruh interaksi faktor perlakuan kadar air ke-i dan lama pemanasan
gelombang mikro ke-j
εijk = pengaruh galat percobaan pada perlakuan kadar air ke-i, lama pemanasan gelombang mikro ke-j, dan ulangan ke-k
Penetapan kadar air
Kadar air benih cabai yang digunakan sesuai dengan taraf perlakuan yaitu 4.31, 6.33, dan 8.25% (berdasarkan uji pendahuluan). Pengukuran kadar air benih dilakukan berdasarkan ISTA (2014) dengan menggunakan metode oven suhu konstan rendah 103 ± 2 ºC selama 17 ± 1 jam kemudian didinginkan dalam desikator selama 30-45 menit. Penetapan kadar air dihitung dengan rumus :
KA % = M − MM − M x %
Keterangan :
M1 = berat cawan + penutup (g)
M2 = berat cawan + penutup + benih sebelum pengeringan (g) M3 = berat cawan + penutup + benih setelah pengeringan (g)
12
awal kemudian diletakkan dalam wadah plastik tertutup yang di bawahnya berisi air kemudian ditimbang sampai mencapai bobot benih yang diharapkan. Peningkatan kadar air ± 2% diperlukan waktu ± 3 jam pada suhu ± 27 ºC dan RH 54%. Kisaran bobot benih yang ekuivalen dengan kadar air benih yang diinginkan dihitung dengan rumus (ISTA 2014) :
Berat subsampel pada KA tertentu = −�� ���
−�� � ℎ�� x bobot awal benih
Pemanasan dengan gelombang mikro
Benih cabai dengan kadar air 4.31, 6.33, dan 8.25% sebanyak 200 butir dipanaskan dengan gelombang mikro menggunakan oven microwave dengan frekuensi 2 450 MHz dan daya 450 W selama 0, 10, 20, 30, 40, dan 50 detik. Frekuensi dan daya tersebut digunakan berdasarkan penelitian Aladjadjiyan (2010). Benih cabai diletakkan pada cawan Petri terbuka kemudian dimasukkan ke dalam oven microwave dan diatur sesuai lama pemanasan. Setelah pemanasan, benih dikeluarkan dan disimpan dalam wadah steril untuk selanjutnya dilakukan pengujian viabilitas dan vigor benih serta kesehatan benih.
Pengujian viabilitas dan vigor benih cabai
Benih yang telah dipanaskan dengan gelombang mikro sebanyak 200 butir (4 ulangan masing-masing 50 butir) dikecambahkan pada cawan Petri berisi 3 lapis kertas lembab dengan menggunakan metode uji di atas kertas (ISTA 2014). Pengamatan dilakukan terhadap peubah daya berkecambah, potensi tumbuh maksimum, indeks vigor, dan kecepatan tumbuh.
1. Daya berkecambah (DB)
Pengukuran daya berkecambah benih (%) dihitung berdasarkan persentase jumlah kecambah normal pada hari ke-7 sebagai hitungan I dan pada hari ke-14 sebagai hitungan II yang dibandingkan dengan jumlah total benih yang ditanam. Daya berkecambah dihitung dengan rumus :
DB % = Ʃ KN Hitungan I + Ʃ KN Hitung IIƩ benih yang ditanam × %
Keterangan :
DB = Daya Berkecambah KN = Kecambah Normal
2. Potensi tumbuh maksimum (PTM)
Potensi tumbuh maksimum dihitung berdasarkan persentase benih yang mampu menjadi kecambah normal maupun kecambah abnormal pada pengamatan hari ke-14 per jumlah benih yang ditanam. Potensi tumbuh maksimum dihitung dengan rumus :
PTM % = Ʃ benih yang ditanam ×Ʃ benih yang tumbuh %
3. Indeks vigor (IV)
13
IV % = Ʃ kecambah normal pada hitungan pertamaƩ benih yang ditanam × %
4. Kecepatan tumbuh (KCT)
Kecepatan tumbuh diukur berdasarkan persentase kecambah normal pada waktu tanam sampai hari ke-14 (akhir pengamatan). Pengamatan dilakukan setiap hari terhadap pertambahan persentase kecambah normal dibagi dengan etmal (24 jam). Nilai etmal kumulatif dimulai saat benih ditanam sampai dengan waktu pengamatan. Kecepatan tumbuh dihitung dengan rumus :
KCT % KN etmal = ∑ N
t tn
⁄
Keterangan :
t = Waktu pengamatan ke- i
N = Persentase kecambah normal setiap waktu pengamatan tn = Waktu pengamatan hari ke-14 (akhir pengamatan)
Percobaan II Pengaruh lama pemanasan gelombang mikro terhadap perkembangan Colletotrichum spp. terbawa benih cabai.
Percobaan ini bertujuan untuk mendapatkan lama pemanasan gelombang mikro yang dapat mengendalikan Colletotrichum spp. terbawa benih cabai. Benih yang digunakan adalah benih yang diekstrak dari bagian buah cabai yang sakit, dan menggunakan kadar air terbaik pada percobaan sebelumnya. Buah diekstrak secara manual, kemudian benih dikeringanginkan selama 2-3 hari sampai mendapatkan kadar air yang diperlukan.
Rancangan yang digunakan adalah RAL satu faktor yaitu lama pemanasan gelombang mikro terdiri atas tujuh taraf yaitu 0, 10, 20, 30, 40, 50 detik, dan perlakuan fungisida sistemik berbahan aktif benomil 0.5 g L-1 sebagai pembanding. Perlakuan fungisida benomil tersebut dilakukan berdasarkan penelitian Yulianty dan Tripeni (2007) dengan merendam benih selama 5 jam. Setiap perlakuan terdiri atas 4 ulangan, sehingga seluruhnya terdapat 28 satuan percobaan. Setiap ulangan menggunakan 50 butir benih. Model linier rancangan percobaan yang digunakan yaitu sebagai berikut :
�ij = μ + τi + εij Keterangan :
Yij = nilai pengamatan pada perlakuan ke-i dan ulangan ke-j µ = nilai tengah umum
τi = pengaruh perlakuan ke-i
εij = pengaruh acak pada perlakuan ke-i dan ulangan ke-j Deteksi cendawan patogen terbawa benih cabai
14
agar berdasarkan Mathur dan Kongsdal (2003), yaitu benih sebanyak 200 butir (4 ulangan masing-masing 50 butir) disterilisasi permukaan dengan merendam benih selama 1 menit dalam NaOCl 1%, kemudian dibilas dengan akuades steril sebanyak 2 kali dan dikeringanginkan di atas tisu steril. Benih ditanam dalam media potato dextrose agar (PDA), kemudian diinkubasi selama 7 hari pada suhu 25 °C dengan penyinaran near ultra violet (NUV) 12 jam terang dan 12 jam gelap secara bergantian di ruang inkubasi, dan diamati perkembangan cendawan pada benih, karakter umum, bentuk konidia dengan menggunakan mikroskop stereo dan mikroskop kompaun. Pengamatan persentase infeksi dilakukan terhadap semua jenis cendawan Colletotrichum spp. terbawa benih, dihitung dengan rumus :
Tingkat infeksi % =Jumlah benih yang terinfeksiJumlah benih yang ditanam x %
Pemurnian isolat dilakukan dengan mengambil koloni cendawan kemudian ditumbuhkan dalam media PDA dan diinkubasi selama 14 hari. Pengidentifikasian cendawan dilakukan terhadap pertumbuhan koloni dan bentuk konidia berdasarkan identifikasi Smith dan Black (1990), Barnett dan Hunter (1998), Than et al. (2008).
Pengujian kesehatan benih
Pengujian kesehatan benih dilakukan terhadap benih dengan kadar air terbaik pada percobaan I. Benih yang telah dipanaskan dengan gelombang mikro dan perlakuan fungisida benomil diuji kesehatan benih dengan menggunakan metode agar, diamati persentase infeksi, diidentifikasi seperti pada metode deteksi cendawan patogen terbawa benih.
Standar tingkat efikasi di Indonesia adalah sekurang-kurangnya 50% dengan syarat tingkat infeksi perlakuan berbeda nyata dengan kontrol (Dirjen PSP 2013). Pengamatan persentase efikasi dilakukan terhadap cendawan C. acutatum, dihitung dengan rumus :
TE % = TIK − TIPTIK x %
Keterangan :
TE = Tingkat efikasi
TIK = Tingkat infeksi C. acutatum pada kontrol TIP = Tingkat infeksi C. acutatum pada perlakuan
Analisis Data
15
4
HASIL DAN PEMBAHASAN
Pengaruh gelombang mikro terhadap viabilitas dan vigor benih cabai
Hasil analisis ragam menunjukkan adanya interaksi antara kadar air benih dengan lama pemanasan gelombang mikro terhadap viabilitas benih, yaitu daya berkecambah (DB) dan potensi tumbuh maksimum (PTM). Lama pemanasan gelombang mikro 10 detik pada beberapa tingkat kadar air belum dapat menurunkan viabilitas benih. Benih berkadar air rendah (4.31%) memiliki viabilitas yang tetap tinggi meskipun dipanasi gelombang mikro sampai 40 detik, sedangkan benih berkadar air sedang (6.33%) dan tinggi (8.25%) mengalami penurunan viabilitas setelah dipanasi gelombang mikro mulai dari 20 detik (Tabel 1).
Tabel 1 Interaksi kadar air dan lama pemanasan gelombang mikro terhadap viabilias benih
Kadar Air Lama pemanasan gelombang mikro (detik)
(%) 0 10 20 30 40 50 sama menunjukkan tidak berbeda nyata berdasarkan uji DMRT pada taraf nyata 5%
Benih berkadar air tinggi mengalami penurunan viabilitas lebih cepat ketika dipanasi gelombang mikro dibandingkan dengan benih berkadar air rendah. Hal tersebut diduga karena benih yang mempunyai kadar air tinggi mempunyai kandungan air yang lebih banyak dibandingkan dengan benih yang mempunyai kadar air lebih rendah. Gaurilcikiene et al. (2013) menyatakan bahwa air merupakan molekul polar bermuatan positif dan negatif sehingga ketika mendapat paparan gelombang mikro, molekul-molekul polar bergerak cepat saling bergesekan dan pergerakannya dapat menimbulkan panas. Pemanasan tersebut dapat meningkatkan suhu benih sehingga dapat mengakibatkan perkecambahan dan pertumbuhan benih menjadi terhambat hingga terjadinya kematian benih.
McCormack (2004) menyatakan bahwa gelombang mikro selain dapat memanaskan air secara selektif pada benih, juga dapat memanaskan lemak dan minyak meskipun pada tingkat yang lebih rendah. Apabila benih dipanaskan dengan gelombang mikro terlalu lama, maka molekul biologis tertentu (protein) seperti enzim dapat terdenaturasi, kehilangan aktifitas enzim, dan kematian benih.
16
mempunyai kadar air rendah akan menyerap gelombang mikro lebih sedikit, sehingga pergerakan rotasi dari molekul polar sedikit terjadi yang menyebabkan perubahan sifat dielektrik pada benih akan sedikit. Apabila suatu materi mempunyai tingkat kadar air tinggi, maka penyerapan gelombang mikro akan lenih banyak. Hal tersebut merupakan salah satu karakter yang unik dari pemanasan gelombang mikro, sehingga dapat digunakan pada proses pengeringan (Saltiel & Datta 1999). Perlakuan benih biasanya dimulai dari lama pemanasan gelombang mikro 10-15 detik, dan penambahan waktu setiap 10-15 detik (McCormack 2004).
Benih dengan kadar air tinggi lebih rentan terhadap pemanasan gelombang mikro dibandingkan dengan benih berkadar air rendah. Penyerapan gelombang mikro yang terjadi pada benih berkadar air tinggi dapat menyebabkan peningkatan suhu benih. Bagian dalam benih akan lebih panas yang mengakibatkan viabilitas benih cepat menurun (Knox et al. 2013). Benih dengan kadar air tinggi mempunyai dielektrik konstan lebih tinggi, sehingga akan lebih banyak berinteraksi dengan gelombang mikro (Brodie et al. 2012).
Manickavasagan et al. (2007) melaporkan bahwa suhu maksimum pada permukaan benih gandum meningkat seiring meningkatnya daya dan lama pemanasan gelombang mikro. Daya 100-500 W dapat meningkatkan suhu sekitar 37.5-117 °C selama 28 detik dan 44-131 °C selama 56 detik waktu pemanasan. Peningkatan suhu tersebut berhubungan dengan viabilitas benih dimana persentase daya berkecambah benih menurun selama meningkatnya daya dan lama pemanasan. Pada dasarnya persentase daya berkecambah benih ditentukan oleh suhu benih.
Benih yang mempunyai kadar air rendah sebelum perlakuan, dapat meningkatkan daya simpan benih karena kadar air rendah merupakan persyaratan utama dalam penyimpanan jangka panjang. Kadar air awal yang rendah merupakan faktor penting yang dapat mempengaruhi daya simpan benih.
Knox et al. (2013) melaporkan bahwa pada kadar air 10% viabilitas benih gandum dapat dipertahankan sampai lama pemanasan gelombang mikro 30 detik dibandingkan dengan kadar air 20% yang mengalami penurunan viabilitas mulai 15 detik. Arengka (2014) melaporkan bahwa pada kadar air rendah (12.31%) viabilitas benih jagung manis dapat dipertahankan sampai lama pemanasan gelombang mikro 30 detik dibandingkan dengan kadar air sedang (15.59%) dan tinggi (20.25%) yang mengalami penurunan viabilitas mulai 20 detik. Hal tersebut menunjukkan bahwa kadar air benih dan lama penamasan gelombang mikro merupakan faktor yang sangat penting untuk mempertahankan viabilitas benih.
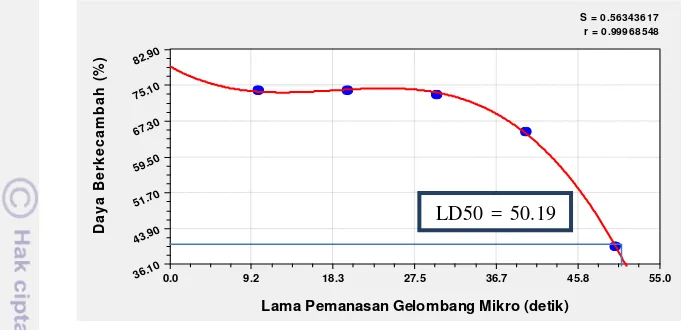
Pengaruh gelombang mikro pada kadar air rendah (4.31%) berbeda antara tolak ukur DB dan PTM. Viabilitas pada tolak ukur DB dapat dipertahankan sampai pemanasan gelombang mikro 30 detik sedangkan viabilitas pada tolak ukur PTM dapat dipertahankan sampai 40 detik. Penentuan lama pemanasan gelombang mikro yang terbaik dilakukan dengan uji LD50. Uji tersebut dapat menentukan lama pemanasan gelombang mikro yang mengakibatkan kematian benih cabai mencapai 50%.
17 toksisitas dimana dosis bahan toksik tersebut dapat menyebabkan kematian 50% populasi organisme uji dalam periode waktu. Dalam hal ini, gelombang mikro sebagai bahan toksik dan benih merupakan populasi organisme uji.
Gambar 6 Nilai LD50 berdasarkan persentase DB benih cabai kadar air 4.31% selama pemanasan gelombang mikro
Hasil analisis LD50 pada benih cabai yang dipanaskan dengan gelombang mikro pada 6 taraf pemanasan, menghasilkan kurva Polynomial Fit dengan persamaan (y = 7.91 – 1.08x + 6.53x2 – 1.18x3). Nilai LD50 yang diperoleh dari persamaan tersebut yaitu 50.19 detik (Gambar 6). Hasil tersebut menunjukkan bahwa pada lama pemanasan gelombang mikro 50.19 detik mengakibatkan DB benih cabai mencapai 50%. Berdasarkan nilai LD50 tersebut maka lama pemanasan gelombang mikro 40 detik masih dapat mempertahankan viabilitas benih di atas 50%, dan dapat berpotensi menjadi alternatif pilihan dalam perlakuan benih menggunakan gelombang mikro.
Tabel 2 Interaksi kadar air dan lama pemanasan gelombang mikro terhadap vigor benih
KadarAir Lama pemanasan gelombang mikro (detik)
(%) 0 10 20 30 40 50
Indeks vigor (%)
KA ± 4.31 23.5 ab 22.0 abc 24.5 a 20.5 abc 16.0 dc 11.5 de KA ± 6.33 22.5 abc 24.0 ab 17.0 bcd 10.0 de 8.5 e 0.0 f KA ± 8.25 11.5 de 13.0 de 0.5 f 0.5 f 0.0 f 0.0 f
Kecepatan tumbuh (% etmal-1)
KA ± 4.31 9.8 a 9.2 ab 9.2 a 8.8 abc 7.7 c 4.8 d KA ± 6.33 9.1 abc 8.9 abc 4.6 d 3.1 e 3.4 e 0.2 f KA ± 8.25 7.8 c 7.8 bc 0.4 f 0.3 f 0.3 f 0.0 f
Keterangan: Angka dalam kolom dan baris pada masing-masing tolak ukur diikuti huruf yang sama menunjukkan tidak berbeda nyata berdasarkan uji DMRT pada taraf nyata 5%
18
memiliki vigor yang tetap tinggi meskipun dipanasi gelombang mikro sampai 30 detik (Tabel 2). Semakin tinggi kadar air benih dan semakin lama pemanasan gelombang mikro maka vigor benih semakin menurun.
Gaurilcikiene et al. (2013) melaporkan bahwa pada benih gandum, semakin tinggi kadar air benih dan semakin tinggi frekuensi gelombang mikro yang digunakan maka vigor semakin menurun. Friesen et al. (2014) melaporkan bahwa pemanasan gelombang mikro melebihi 30 detik akan mengakibatkan penurunan viabilitas dan vigor benih buncis secara perlahan, sedangkan pemanasan gelombang mikro 50 detik akan mengakibatkan penurunan viabilitas dan vigor benih buncis secara cepat.
Pengaruh gelombang mikro terhadap infeksi Colletotrichum spp. dan
hubungannya dengan daya berkecambah benih.
Hasil deteksi cendawan patogen terbawa benih cabai ditemukan 4 spesies Colletotrichum diantaranya C. acutatum, C. capsici, C. gloeosporioides, dan Colletotrichum sp. (Tabel 3). Hasil ini sesuai dengan penelitian Than et al. (2008) dan Syukur et al. (2013) yang menyatakan bahwa tanaman cabai dapat diinfeksi oleh 3 spesies Colletotrichum yaitu C. acutatum, C. capsici, dan C. gloeosporioides.
Spesies Colletotrichum dapat menginfeksi beberapa tanaman inang, contohnya seperti cendawan C. acutatum dapat menginfeksi cabai (Ivey et al. 2004; Than et al. 2008), tomat (Pardo-De la Hoz et al. 2016), strawberi (Peres et al. 2005; Than et al. 2008; Freeman 2008; Grahovac et al. 2012), almond, jeruk, blueberri, dan apel (Peres et al. 2005). Cendawan C. capsici dapat menginfeksi beberapa tanaman inang seperti cabai (Than et al. 2008), sawi (Mahmodi et al. 2013), labu (Chai et al. 2014). Cendawan C. gloeosporioides dapat menginfeksi beberapa tanaman inang seperti cabai dan mangga (Than et al. 2008), strawberi, alpukat, almond (Freeman 2008).
Tabel 3 Persentase tingkat infeksi Colletotrichum spp.
Patogen Tingkat infeksi (%)
Cendawan C. acutatum merupakan cendawan yang paling banyak menginfeksi benih cabai dengan tingkat infeksi mencapai 33% (Tabel 3). Cendawan ini diduga merupakan spesies yang paling utama menyerang tanaman cabai. Syukur et al. (2007) melaporkan bahwa dari 13 isolat Colletotrichum yang diperoleh dari 6 daerah di Indonesia, 7 isolat merupakan C. acutatum.
19 bulan sabit diduga sebagai C. capsici (Than et al. 2008; Damm et al. 2009). Cendawan yang mempunyai pertumbuhan sangat cepat dan bentuk konidia silinder, kedua ujungnya membulat diduga sebagai C. gloeosporioides (Smith & Black 1990; Than et al. 2008). Cendawan yang memiliki pertumbuhan sangat cepat dan bentuk konidia silinder yang berukuran lebih besar diduga sabagai Colletrotrichum sp. (Tabel 4).
Tabel 4 Hasil identifikasi berdasarkan pertumbuhan koloni pada media PDA selama 14 hari dan bentuk konidia Colletotrichum spp.
Koloni depan Koloni belakang Bentuk konidia Karakter temuan C. acutatum
20
dalam satu spesies, hal ini diduga karena bentuk konidia Colletorichum sp. yang mempunyai ciri khas tertentu.
Benih cabai yang terinfeksi cendawan Colletotrichum spp. mempunyai viabilitas yang rendah (Tabel 5). Setiyowati et al. (2007) melaporkan bahwa benih cabai yang teinfeksi C. capsici mempunyai daya berkecambah yang rendah yaitu sebesar 35%. McCormack (2004) menyatakan bahwa pengaruh utama dari adanya cendawan patogen terbawa benih yaitu dapat menurunkan viabilitas benih, produksi toksin yang dapat mempengaruhi viabilitas benih, dapat meningkatkan produksi panas (sangat penting pada lot benih yang banyak), menyebabkan perubahan warna dan bau.
Tabel 5 Pengaruh lama pemanasan gelombang mikro terhadap daya berkecambah (%) dan tingkat infeksi Colletotrichum spp.
Patogen Lama pemanasan gelombang mikro (detik)
0 10 20 30 40 50 benomil berdasarkan uji DMRT pada taraf nyata 5%
Benih dengan kadar air rendah (4.36%) memiliki viabilitas yang tetap stabil sampai pemanasan gelombang mikro 40 detik, sedangkan perlakuan fungisida benomil memiliki viabilitas yang lebih tinggi (Tabel 5). Hal tersebut dikarenakan perlakuan fungisida dengan cara perendaman dapat meningkatkan perkecambahan. Penggunaan fungisida diharapkan tidak mengganggu perkecambahan benih, dan dapat merangsang perkembangan benih.
Fungisida benomil merupakan fungisida sistemik, yaitu senyawa kimia yang akan ditranslokasikan ke seluruh bagian tanaman bila diaplikasikan. Persyaratan utama untuk fungisida sistemik, yaitu bekerja sebagai toksikan dalam inang atau tanaman, mengganggu metabolisme inang dan mengimbas ketahanan fisik maupun kimia terhadap patogen dengan tidak mengurangi kualitas dan kuantitas tanaman, dapat diabsorbsi secara baik dan ditranslokasikan ke tempat patogen serta stabil dalam tanaman inang, toksisitas terhadap mamalia cukup rendah, efek residu dapat bertahan cukup lama dan toleran terhadap hujan. Hewitt (1998) menyatakan bahwa fungisida golongan benzimidazole memiliki cara kerja yang sangat spesifik, sehingga pengembangan resistensi benomil merupakan perhatian utama dalam manajemen penyakit.
21 dapat mempertahankan viabilitas benih. Berbeda halnya dengan tingkat infeksi cendawan Colletotrichum lainnya yang tidak berpengaruh nyata terhadap lama pemanasan gelombang mikro 40 detik (Tabel 5). Hal tersebut diduga karena tingkat infeksi awal yang sangat rendah sehingga pemanasan gelombang mikro yang digunakan tidak efektif.
Tylkowska et al. (2010) melaporkan bahwa pemanasan gelombang mikro 45 dan 60 detik pada benih buncis dapat menghilangkan infeksi cendawan Penicillium spp. sebesar 100% dengan tetap mempertahankan viabilitas benih. Knox et al. (2013) melaporkan bahwa pemanasan gelombang mikro 15 detik pada benih gandum dapat menurunkan tingkat infeksi cendawan Fusarium spp. dan Microdochium nivale masing-masing sebesar 72 dan 77%. Perlakuan gelombang mikro tidak merubah sifat DNA namun cendawan terbawa benih menjadi mati dikarenakan pemanasan dan pengeringan. Hal tersebut diduga karena dinding sel cendawan mengandung kitin dan β glukan yang merupakan material yang dapat diserap oleh gelombang mikro menyebabkan atom-atom pada material tersebut berotasi dan saling bertabrakan sehingga menimbulkan panas.
Arengka (2014) melaporkan bahwa pemanasan gelombang mikro 30 detik pada benih jagung manis kadar air rendah (12.31%) dapat menurunkan tingkat infeksi Fusarium subglutinans dan Aspergillus niger sebesar 75.0% dan 54.8% dengan tetap mempertahankan viabilitas benih. Friesen et al. (2014) melaporkan bahwa pemanasan gelombang mikro 30 dan 40 detik dapat menurunkan tingkat infeksi C. lindemuthianum masing-masing sebesar 27.3 dan 33.3% dengan tetap mempertahankan viabilitas benih.
Perlakuan fungisida benomil juga dapat menurunkan tingkat infeksi pada semua Colletotrichum spp. (Tabel 5). Hal ini sesuai dengan penelitian Peres et al. (2004) yang melaporkan bahwa benomil merupakan salah satu fungisida yang paling efektif mengendalikan penyakit antraknosa pada buah jeruk, terutama cendawan C. acutatum dan C. gloeosporioides. Ramdial dan Rampersad (2015) melaporkan bahwa C. gloeosporioides pada cabai sensitif terhadap benomil.
Setiyowati et al. (2007) melaporkan bahwa benih yang dilapisi dengan fungisida benomil dapat menurunkan tingkat infeksi C. capsici pada benih cabai. Fungisida benomil merupakan fungisida sistemik yang akan masuk ke dalam jaringan tanaman dan diserap oleh sel tanaman sehingga dapat melindungi dinding-dinding sel dari infeksi cendawan. Hal tersebut diduga karena adanya mekanisme fungitoksisitas dari benomil yang dapat menetralisasi enzim atau toksin yang terlibat dalam invasi dan kolonisasi cendawan.
Benomil telah lama digunakan di bidang pertanian, namun banyak kasus yang melaporkan bahwa benomil mengakibatkan resistensi. Umumnya cendawan patogen berkembang menjadi resisten terhadap benomil, termasuk cendawan patogen Colletotrichum pada tanaman jeruk dan tanaman lainnya (Peres et al. 2004).
22
Tabel 6 Tingkat efikasi pemanasan gelombang mikro dan fungisida benomil terhadap tingkat infeksi C. acutatum
Lama pemanasan gelombang mikro (detik)
Tingkat efikasi terhadap C. acutatum (%)
0 0
10 13.4
20 21.4
30 41.1
40 64.3
50 69.6
Benomil 49.1
Perlakuan benih dikatakan efektif apabila pada pengamatan terakhir nilai tingkat efikasi sekurang-kurangnya 50% (Dirjen PSP 2013). Pemanasan gelombang mikro 40 detik mempunyai tingkat efikasi lebih dari 50%, sedangkan perlakuan fungisida benomil mempunyai tingkat efikasi kurang dari 50%. Berdasarkan hasil tersebut maka pemanasan gelombang mikro 40 detik efektif menurunkan tingkat infeksi C. acutatum dibandingkan dengan perlakuan fungisida benomil.
Pemanasan gelombang mikro bermanfaat bagi produsen skala kecil seperti pemulia tanaman yang akan dikenakan biaya yang minimum dengan menggunakan peralatan rumah tangga seperti oven microwave. Produsen skala besar juga dapat memanfaatkan gelombang mikro karena microwave ukuran besar untuk industri sudah digunakan oleh perusahaan pengolahan makanan dan perusahan kimia (Mathlouthi et al. 2010).
5
KESIMPULAN
Gelombang mikro dapat mengendalikan C. acutatum dengan tingkat efikasi sebesar 64.3% serta dapat mempertahankan viabilitas benih cabai pada kadar air rendah (4.31%) dan lama pemanasan gelombang mikro 40 detik.
DAFTAR PUSTAKA
Agarwal VK, Sinclair JB. 1996. Principle of Seed Pathology. 2nd ed. Florida
(US):CRC Press Inc.
Aladjadjiyan A. 2010. Effect of microwave irradiation on seeds of lentils (Lens culinaris, MED.). Roman J Biophys. 20(3):213-221.
Arengka D. 2014. Pemanfaatan gelombang mikro untuk mengendalikan patogen terbawa benih jagung manis (Zea mays saccharata Sturt.) [tesis]. Bogor (ID): Institut Pertanian Bogor.
23 Bouraoui M, Richard P, Fichtali J. 1993. A review of moisture content determination in foods using microwave oven drying. Food Res Int. 26:49-57.
[BPS] Badan Pusat Statistik. 2015. Produksi cabai besar, cabai rawit, dan bawang merah tahun 2014. [internet]. [diunduh 2016 Februari 10]. Tersedia pada http://www.bps.go.id/website/brs_ind.
Brodie G. 2012. Applications of microwave heating in agricultural and forestry related industries [Internet]. [diunduh 2013 Juli 3]. Tersedia pada http://dx.doi.org/10. 5772/ 45919.
Brodie G, Ryan C, Lancaster C. 2012. Microwave technologies as part of an integrated weed management strategy [a review]. Intern J Agron. 2012:1-14. Chai AL, Zhao YJ, Shi YX, Xie XW, Li BJ. 2014. Identification of Colletotrichum capsici (Syd.) Butler causing anthracnose on pumpkin in China. Can J Plant Pathol. 36(1): 121–124.
Chen P, Lott JN. 1992. Studies of Capsicum annums seed: structure, storage reserves, and mineral nutrients. Can J Bot. 70:518-529.
Chigoziri E, Ekefan EJ. 2013. Seed borne fungi of chilli pepper (Capsicum frutescens) from pepper producing of Benue State, Nigeria. Agric Biol J N Am. 4(4):370-374.
Chitkara S, Singh T, Singh D. 1990. Histopathology of Colletotrichum dematium infected chilli seeds. Acta Botan Indic. 18:226-230.
Copeland LO, McDonald MB. 1995. Seed Science and Technology. 3rd ed. New
York (US): Chapman and Hall.
Damm U, Woudenberg JHC, Cannon PF, Crous PW. 2009. Colletotrichum species with curved conidia from herbaceous hosts. Fungal Divers. 39:45-87.
Damm U, Cannon PF, Woudenberg JHC, Crous PW. 2012. The Colletotrichum acutatum species complex. Stud Mycol. 73:37-113. doi:10.3114/sim0010. Deising HB, Reimann S, Pascholati SF. 2008. Mechanisms and significance of
fungicide resistance. Brazil J Microbiol. 39:286-295.
Dias GB, Gomes VM, Moraes TMS, Zottich UP, Rabelo GR, Carvalho AO, Moulin M, Goncalves LSA, Rodrigues R, da Cunha M. 2013. Characterization of Capsicum species using anatomic and molecular data. Genet Mol Res. 12(4):6488-6501.
[Dirjen PSP]. Direktorat Jenderal Prasarana dan Sarana Pertanian. 2013. Metode Standar Pengujian Efikasi Fungisida. Jakarta (ID).
[Dirjen Tanaman Pangan]. Direktorat Jenderal Tanaman Pangan. 2005. Metode dan Prosedur Pengujian Kesehatan Benih Tanaman Pangan dan Hortikultura. Jakarta (ID): Balai Besar Pengembangan Pengujian Mutu Benih Tanaman Pangan dan Hortikultura.
[Dirjen Tanaman Pangan]. Direktorat Jenderal Tanaman Pangan. 2013. Pengkajian ISTA Rules: Penetapan Kadar Air dan Kegiatan Pendukungnya. Jakarta (ID): Balai Besar Pengembangan Pengujian Mutu Benih Tanaman Pangan dan Hortikultura.
24
Edgar RH, Osepchuk JM. 2001. Consumer, Commercial, and Industrial Microwave Ovens and Heating Systems. In: Handbook of microwave technology for food applications. New York (US): Marcel Dekker, Inc. Freeman S. 2008. Management, survival strategies, and host range of
Colletotrichum acutatum on strawberry. Hort Sci. 43(1):66-68.
Friesen AP, Conner RL, Robinson DE, Barton WR, Gillard CL. 2014. Effect of microwave radiation on dry bean seed infected with Colletotrichum lindemuthianum with and without the use of chemical seed treatment. Can J Plant Sci. 94:1373-1384.
Gabriela V, Simina VC. 2011. Germination percentage of corn grains processed in microwave field. Analele Universitatii din Oradea Fascicula Protectia Mediului. 16:176-183.
Gaurilcikiene I, Ramanauskiene J, Dagys M, Simniskis R, Dabkevicius Z, Suproniene S. 2013. The effect of strong microwave electric field radiation on: (2) wheat (Triticum aestivum L.) seed germination and sanitation. Zemdirb Agric. 100(2):185-190.
Grahovac M, Indic D, Vukovic S, Hrustc J, Gvozdenac S, Mihajlovic M, Tanovic B. 2012. Morphological and ecological features as differentiation criteria for Colletotrichum species. Zemdirb Agric. 99(2):189-196.
Han F. 2010. The effect of microwave treatment on germination, vigour and health of china aster (Callistephus chinensis Nees.) seeds. J Agric Sci. 2(4):201-210.
Hewitt HG. 1998. Fungicide resistance. In: Fungicides in Crop Protection. Hewitt HG. Centre for Agriculture and Biosciences International. Wallingford, UK. 155-181
Ilyas S. 2012. Ilmu dan Teknologi Benih (Teori dan Hasil-hasil Penelitian). Bogor (ID): IPB Press.
Isaac S. 1992. Fungal Plant Interaction. London (UK): Chapman and Hall Press. [ISTA] Internasional Seed Testing Association. 2014. International Rules for
Seed Testing. Switzerland (CH): ISTA.
Iuliana C, Caprita R, Giancarla V, Sorina R, Genoveva B. 2013. Respon of barley seedling to microwave at 2.45 GHz. Animal Sci Biotech 46(1):185-191. Ivey MLL, Miller SA. 2004. Identification and management of Colletotrichum
acutatum on immature bell peppers. Plant Dis. 88(11):1198-1204.
Jeffries P, Dodd JC, Jegerand MJ, Plumbley RA. 1990. The biology and control of Colletotrichum species on fruit crops. Plant Pathol. 39(3):343-366.
Kim SH, Yoon JB, Do JW, Park HG. 2008. A major recessive gene associated with anthracnose resistance to Colletotrichum capsici in chili pepper (Capsicum annuum L.). Breed Sci. 58:137–141.
Knox OGG, McHugh MJ, Fountaine JM, Havis ND. 2013. Effects of microwave on fungal pathogens of wheat seed. Crop Prot. 50:12-16.
Kusandriani Y, Muharam A. 2005. Produksi Benih Cabai. Bandung (ID): Balai Penelitian Tanaman Sayuran.
25 Manickavasagan A, Jayas DS, White NDG. 2007. Germination of wheat grains from uneven microwave heating in an industrial microwave dryer. 49:323-327.
Methlouthi A, Rouaud O, Boillereaux L. 2010. Microwave applicator with conveyor belt system. In: Proceedings of the COMSOL Conference. Paris France.
Mathur SB, Kongsdal O. 2003. Common Laboratory Seed Health Testing Methods for Detecting Fungi. Denmark (DK).
McCormack JH. 2004. Seed Processing and Storage: Principles and Practices. California (US).
Nelson S. 2011. A half century of research on agricultural applications for RF and microwave dielectric heating. American Society of Agricultural and Biological Engineers.
Nome SF, Barreto D, Docampo DM. 2002. Seedborne pathogens. In: Proceeding International Seed Seminar : Trade, Production and Technologi. 114-126. Pardo-De la Hoz CJ, Calderón C, Rincón AM,Cárdenas M, Danies G,
López-Kleine L, Restrepo S,Jiménez P. 2016. Species from the Colletotrichum acutatum, Colletotrichum boninense and Colletotrichum gloeosporioides species complexes associated with tree tomato and mango crops in Colombia. Plant Pathol. 65(2):227-237.
Peres NA, Souza NL, Peever TL, Timmer LW. 2004. Benomyl sensitivity of isolates of Colletotrichum acutatum and C. gloeosporioides from citrus. Plant Dis. 88(2):125-130.
Peres NA, Timmer LW, Adaskaveg JE, Correll JC. 2005. Lifestyles of Colletotrichum acutatum. Plant Dis. 89(8):784-796.
[Permentan] Peraturan Menteri Pertanian RI. 2012. Peraturan Menteri Pertanian RI No. 01/Ktps/SR.130/12/2012 tentang Pedoman Teknis Sertifikasi Benih Hortikultura.
Pring RJ, Nash C, Zakaria M, Bailey JA. 1995. Infection process and host range of Colletotrichum capsici. Physiol Mol Plant Pathol. 46(2):137-152.
Prusky D, Koblier I, Aridi R, Beno-Moalem D, Yakoby N, Keen NT. 2000. Resistance Mechanisms of Subtropical Fruits to Colletotrichum gloeosporioides. In: Bailey JA, Jeger MJ. Colletotrichum: Biology, Pathology, and Control. CAB International Wallingford.
Ramdial H, Rampersad SN. 2015. Characterization of Colletotrichum spp. causing anthracnose of bell pepper (Capsicum annuum L.) in Trinidad. Phytoparasitica. 43:37-49.
Saltiel C, Datta AK. 1999. Heat and mass transfer in microwave processing. Advances in heat transfer. 33:1-94.
Setiyowati H, Surahman M, Wiyono S. 2007. Pengaruh seed coating fungisida benomil dan tepung curcuma terhadap patogen antraknosa terbawa benih dan viabilitas benih cabai besar (Capsicum annuum L.). Bul Agron. 35(3):176-182.
Smith BJ, Black LL. 1990. Morphological, cultural, and pathogenic variation among Colletotrichum species isolated from strawberry. Plant Dis. 74:69-76. Sumarni N, Muharam A. 2005. Budidaya Tanaman Cabai Merah. Lembang (ID):