ANTHONI SULTHAN HARAHAP
DETEKSI DAN IDENTIFIKASI PATOGEN TERBAWA BENIH
BRASSICACEAE
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Deteksi dan Identifikasi Patogen Terbawa Benih Brassicaceae adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
ANTHONI SULTHAN HARAHAP. Deteksi dan Identifikasi Patogen Terbawa Benih Brassicaceae. Dibimbing oleh WIDODO dan TITIEK SITI YULIANTI.
Penggunaan benih bermutu merupakan salah satu faktor penentu keberhasilan produksi pertanian karena mampu meningkatkan produksi dan mengurangi adanya permasalahan penyakit di lapangan. Masuknya benih ke suatu negara melalui kegiatan impor berpotensi menjadi sarana masuknya patogen baru, sehingga perlu dilakukan deteksi dan identifikasi terhadap benih tersebut. Penelitian ini bertujuan untuk mendeteksi dan mengidentifikasi patogen terbawa benih Brassicaceae (kubis-kubisan) dan menententukan patogenisitasnya.
Pada penelitian ini contoh benih kubis bunga (Brassica oleracea var. italica) asal Amerika Serikat dan benih sawi hijau (B. rapa var. parachinensis), kubis cina (B. rapa f. annua), pakchoy putih (B. rapa subsp. chinensis) dan pakchoy (B. rapa subsp. chinensis) asal Malaysia diiuji menggunakan metode blotter test dengan sterilisasi permukaan maupun tanpa seterilisasi permukaan. Total infeksi cendawan pada benih tanpa sterilisasi permukaan yaitu Aspergillus hitam sebesar 2.4%, Curvularia 1.2%; Aspergillus hijau 1%; Phoma 0.4%; Chaetomium 0.2% dan juga ditemukan gejala bercak cokelat dan gejala bercak kebasahan dengan total kejadian masing-masing 7.8%; dan 5.6%. Pada benih tanpa sterilisasi permukaan infeksi cendawan secara berurutan yaitu Aspergillus hijau 2.8%; Aspergillus hitam 0.6%; Curvularia 0.4%; selain itu juga ditemukan gejala berupa bercak berwarna cokelat 10.2% dan bercak kebasahan 4.2% yang masing-masing disebabkan oleh bakteri.
Bakteri yang berasosiasi pada daun yang bergejala bercak cokelat dan bercak kebasahan diisolasi dengan merendam daun tersebut di dalam air steril. Oose bakteri yang terdifusi pada air steril selanjutnya digores pada media untuk mendapatkan biakan murni bakteri. Sebanyak 23 isolat bakteri yang ditemukan selanjutnya diuji respons hipersensitif (HR) dan diperoleh hanya 5 isolat yaitu 3.3, 5.2, 9.1, 9.2, dan 11.1.P yang menginduksi HR yang berasal dari daun kecambah yang bergejala bercak cokelat. Kelima isolat bakteri ini selanjutnya digunakan untuk uji patogenisitas.
Uji patogenisitas terhadap tiga belas isolat cendawan terbukti mampu menyebabkan infeksi antara 93.8-100% terhadap benih dan kecambah. Gejala infeksi berupa benih mati tidak berkecambah, benih berkecambah dan mengalami nekrosis dan benih berkecambah lalu mati. Hal ini menunjukkan bahwa cendawan tersebut berpotensi sebagai patogen terhadap benih maupun kecambah Brassicaceae.
memiliki miselium aerial, berwarna krem atau kuning kecokelatan dan berubah menjadi cokelat kehitaman dengan bertambahnya umur cendawan, ditemukan piknidia pada benih atau biakan, berwarna cokelat, memiliki satu atau beberapa leher papilla yang mengeluarkan eksudat konidia berwarna merah muda, konidia berbentuk lonjong dengan 2 guttule pada kedua kutubnya.
Uji patogenisitas terhadap lima isolat bakteri terhadap kecambah Brassicaceae terbukti mampu menyebabkan luka kebasahan atau luka berwarna cokelat pada daun kecambah yang diinokulasi buatan, baik yang menggunakan metode stubbing ataupun clipping dengan persentase infeksi sebesar 96-100%. Bakteri menyebabkan gejala nekrosis, busuk lunak dan luka kebasahan pada produk pascapanen Brassicaceae dengan persentase infeksi 56-78%. Reisolasi dilakukan terhadap daun kecambah (kotiledon) yang bergejala pada pengujian patogenisitas terhadap kecambah dan diperoleh bakteri dengan karakter koloni dan respons hipersensitif yang sama dengan bakteri yang digunakan untuk inokulasi. Isolat bakteri hasil reisolasi tersebut dimurnikan, selanjutnya bersama dengan isolat bakteri hasil isolasi diidentifikasi secara fenotipik dan genotipik.
Hasil indentifikasi secara fenotipik terhadap isolat bakteri yang digunakan untuk inokulasi dan isolat bakteri hasil reisolasi menunjukkan bahwa seluruh isolat bakteri merupakan kelompok bakteri Gram positif, membentuk endospora, bersifat anaerobik fakultatif, bersifat oksidatif yang merujuk pada genus Bacillus. Pengujian secara genotipik terhadap isolat bakteri tersebut dilakukan dengan uji PCR menggunakan primer universal prokaryota 16S rRNA dan berhasil mengamplifikasi DNA bakteri pada ukuran 1500 bp. Selanjutnya amplikon disikuensing dan dianalisis menggunakan program BLAST. Hasil analisis menunjukkan bahwa isolat bakteri yang diuji adalah Bacillus pumilus dengan persentase homologi 94-99%.
SUMMARY
ANTHONI SULTHAN HARAHAP. Detection and Identification Brassicaceae Seedborne Pathogen. Supervised by WIDODO and TITIEK SITI YULIANI.
The use of quality seed is one of the critical success factors of agricultural production because it can increase production and reduce the presence of disease problems in the field. The entry of the seeds into a country through import activity has potential as a means of entry of new pathogens, so it is necessary to detect and identify these seeds. This study aim to detect and identify Brassicaceae seed-borne pathogen and its pathogenicity
At this research five seeds sample of Brassicaceae: cauliflower seed (Brassica oleracea var. italica) from United States and dan green cabbage (B. rapa var. parachinensis), chinese cabbage (B. rapa f. annua), white pakchoy (B. rapa subsp. chinensis) dan pakchoy (B. rapa subsp. chinensis) from Malaysia either by surface sterilization treatment or not, were incubated on five sheets of wet blotting paper at a temperature of 27-23 °C for 14 days. Total fungal infection are black Aspergillus 2.4%; Curvularia 1.2%; green Aspergillus 1%; Phoma 0.4%; Chaetomium 0.2% and incidence total of brown spot and water soaked symptom are 7.8%; 5.6%; respectively. On unsurface sterilization seed, fungal infection are green Aspergillus 2.8%; black Aspergillus 0.6%; Curvularia 0.4%; and also brown spot symptom 10.2%; water soaked symptom 4.2% were caused by bacteria.
Bacterias that associated with brown spot symptom and water soaked symptom were isolated by soaking the leaves in sterile water. The bacteria ooze which diffused into sterile water furthermore was streaked in nutrient agar to get pure bacteria culture. There are only 5 isolates namely 3.3, 5.2, 9.1, 9.2 and 11.1.P from the 23 isolates bacteria which can induce hypersensitive respon (HR) derived from brown spot symptom. Afterward these five isolates will be used for pathogenicity test.
The pathogenicity test of thirteen fungal isolates proven can infect the seed and seedling with 96-100% of infection rate. The infection symptom are the death of the seed, necrosis in seedling and the decay in seedling. Base on these facts those fungi are potential as pathogen for Brassicaseae’s seed and seedling.
The result of identification toward green Aspergillus, black Aspergillus, Curvularia, Phoma and Chaetomium fungi isolates are Aspergillus flavus, A. niger, Curvularia lunata, Phoma lingam and Chaetomium globosum, respectively. Phoma lingam is plant quarantine fungus that reported established only in East Java. This fungi has aerial mycelium, creamy or brownish yellow and lead to blackish brown in age, pycnidia can found on seed or culture slant with brown colour, and one or more pappilate neck which release pinkish conidia matrix, conidia ellipsoidal with 2 small polar guttules.
leaf with infection rate between 96-100%. Bacteria also can caused necrosis, soft rot and water soaked to postharvest products of Brassicaceae with infection rate 56-78%. Reisolation bacteria from symptomatic cotyledon in pathogenicity test result was obtained the bacteria with similar colony characters and hypersensitive respons compare to bacteria which used for inoculation. Furthermore both of bacteria isolates was identified phenotypically and genotyphically.
Phenotyphically identification of bacteria from isolation and reisolation show that all isolates belongs to positive Gram reaction, endospore forming, anaerobic facultative, oxidative which are refer to genera of Bacillus. Genotypcally identification using PCR with 16S rRNA followed by sequenching show that the bacteria have similiarity 94-99% with Bacillus pumilus according GeneBank using BLAST programme.
Keywords: Bacillus pumilus, blotter test, pathogenicity test, Phoma lingam
is the variety of all life on erth, including within species, between species a environmental conditions will affect for biodiversity and living species. It is
also applies to insects which environmental factors influence the life cycle of insect. Oil palm is plant of crude palm oil and palm kernel oil, it’s leading commodity non-oil sector. This plant has a production life up to 25-30 years, and the plant is cultivated as plantations.
At oil palm plantations known presence of ground vegetation, ie plant communities making up the bottom stratification near the soil surface. Cultivation practices and different habitat conditions of each oil palm’s age will certainly affect for existing ground vegetation. Ground vegetation at palm oil estate is one of the factors that influence the diversity of insects.
The aim of this reseach was to determine the diversity of insect at oil palm plantation. The reseach was conductedbasedage groupsof plant: 1styear, 7th years, and20th years at Rambutan EstatePTPNIII, North Sumatra, Indonesia. Ineach age group15plots(50 m x50m) was specified for insects sampling. Insectswere collectedby pitfaltrap, light trap, insectnet, yellow pan trap, andyellowstickytrap methods.
Total of15 960 insect specimentswerecollected, consisting of12orders, 120familiesand244morphospecies. Diversityof insects that foundin threeage groupsof plantsshoweda highindex. This result suggestthat age of the planthas no effect oninsectdiversity. Insect composition in three age groups of plant are different. At 1stand7th years, the ecological functions of insects dominated by insects as hebivor, and at20th yearsecological functions of insects dominated by insect as detritivores.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Fitopatologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
DETEKSI DAN IDENTIFIKASI PATOGEN TERBAWA BENIH
BRASSICACEAE
D)D6I+>1>I
!8!I
+@+5>1I *&I )+9@1-C5!>1I !@;.+9I +='!G!I +910I
9@0;91ID6@0#:I !=!0!<I I
1>+@F3D1I;6+0I ;81>1I+8'18'19.I
=I=I I
+@D!I
15+@!0D1I;6+0I
=I1@1+5I1@1I I9..;@!I
+@D!I=;.=!8I@D)1I1@;<!A;6;.1I
=;,I=I=I=1I +9*=!>@D@1I (I
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah Subhanahu Wa Ta’ala atas segala karunia-Nya sehingga tesis ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juli 2014 ini adalah Deteksi dan Identifikasi Patogen Terbawa Benih Brassicaceae. Sebagian dari hasil penelitian ini dipublikasikan dengan judul Cendawan Terbawa Benih Brassicaceae pada Jurnal Fitopatologi Indonesia edisi Juni 2015, volume 11, nomor 3, halaman 97-103.
Terima kasih penulis ucapkan kepada:
1. Bapak Rajab Sofian Harahap. Mamak Murni Siregar, Kakak, Abang dan adik serta Istri tercinta Ita Purnama Sari Siregar dan anakku tersayang
Azalia Hasanah Harahap yang telah memberikan do’a dan semangat
kepada penulis untuk menyelesaikan sekolah Pascasarjana.
2. Dr Ir Widodo, MS sebagai Ketua Komisi Pembimbing dan Dr Ir Titiek Siti Yuliani, SU sebagai Anggota Komisi Pembimbing yang telah memberikan masukan pada saat usulan penelitian serta pengarahan, bimbingan, saran, dan motivasi kepada penulis selama penelitian sampai dengan selesainya penulisan tesis ini.
3. Prof Dr Ir Sri Hendrastuti Hidayat, MSc selaku Ketua Mayor Fitopatologi dan Prof Dr Ir Memen Surahman, MSc Agr selaku Penguji Luar Komisi. 4. Ir Banun Harpini, MSc selaku Kepala Badan Karantina Pertanian, Dr Ir
Antarjo Dikin, MSc selaku Kepala Pusat Karantina Tumbuhan dan Keamanan Hayati Nabati beserta seluruh jajarannya yang telah memberikan kesempatan, beasiswa dan arahannya kepada penulis untuk menempuh pendidikan Pascasarjana di Institut Pertanian Bogor.
5. Drh Yoeyoen Marrahayoeni selaku Kepala Stasiun Karantina Pertanian Kelas II Tanjung Balai Karimun beserta segenap staf atas rekomendasi dan dukungan selama masa studi.
6. Seluruh staf pengajar Departemen Proteksi Tanaman IPB yang telah membagikan ilmu kepada penulis selama penulis menempuh pendidikan Pascasarjana.
7. Teman-teman kelas khusus Karantina Pertanian 2013, Dr Ir Ummu Salamah, MSi, dan keluarga besar Laboratorium Cendawan, Laboratorium Bakteri yang telah banyak membantu serta dalam kebersamaannya. 8. Sahabat-sahabat dan semua pihak yang telah membantu selesai tulisan ini.
Semoga tesis ini bermanfaat.
DAFTAR ISI
DAFTAR ISI ... xv
DAFTAR TABEL ... xvi
DAFTAR GAMBAR ... xvi
DAFTAR LAMPIRAN ... xvii
PENDAHULUAN ... 1
Latar Belakang 1 Tujuan Penelitian 2 Manfaat Penelitian 2 Ruang Lingkup Penelitian 2 TINJAUAN PUSTAKA ... 4
Benih Sebagai Pembawa Patogen 4 Metode Pengujian Kesehatan Benih 4 Uji Patogenisitas 6 METODE ... 8
Bahan 8 Alat 8 Lokasi dan Waktu Penelitian 8 Metode Penelitian 8 HASIL ... 13
Metode Blotter Test dan Isolasi 13 Uji Patogenisitas Cendawan 17 Identifikasi Cendawan 18 Uji Patogenisitas Bakteri 21 Identifikasi Bakteri 27 PEMBAHASAN ... 30
SIMPULAN DAN SARAN ... 37
Simpulan 37 Saran 37 DAFTAR PUSTAKA ... 38
LAMPIRAN ... 45
DAFTAR TABEL
1. Impor benih Brassicaceae Indonesia tahun 2011-2013 1 2. Cendawan dan gejala infeksi pada benih atau kecambah Brassicaceae
pada uji blotter test 13
3. Infeksi cendawan dan insidensi bercak cokelat serta bercak kebasahan 13
4. Karakter morfologi koloni bakteri 15
5. Uji patogenisitas cendawan pada benih Brassicaceae 17 6. Uji patogenisitas bakteri pada kecambah Brassicaceae 22 7. Uji patogenisitas bakteri pada produk pascapanen Brassicaceae 24 8. Karakter fenotipik bakteri hasil isolasi dan reisolasi 27 9. Hasil penelusuran sikuen gen 16S rRNA isolat bakteri dan spesies
padanannya pada GenBank 29
DAFTAR GAMBAR
1. Bagan alir penelitian deteksi dan identifikasi patogen terbawa benih
Brassicaceae 3
2. Tanda cendawan yang tumbuh pada uji blotter test: Aspergillus hitam (1), Aspergillus hijau (2), Curvularia (3), Phoma (4), dan Chaetomium
(5) 14
3. Gejala: Bercak cokelat (1-3), bercak kebasahan (4-6) 15 4. Respons hipersensitif isolat bakteri 3.3 dan 5.2 (1 hari setelah
inokulasi) berupa gejala luka kebasahan 17
5. Gejala pada uji patogenisitas benih mati tidak berkecambah akibat: Aspergillus hijau (1), Aspergillus hitam (2); Benih berkecambah lalu mengalami nekrosis akibat: Curvularia (3), Phoma (4), Chaetomium (5). Benih berkecambah lalu mati akibat: Curvularia (6), Phoma (7),
Chaetomium (8) 18
6. Morfologi Aspergillus flavus: kepala konidia kolumnar dan radial (1), vesikel bundar ¾ permukaannya ditutupi fialid (2), konida sangat kasar (3), permukaan konidiofor kasar (4). Koloni umur 7 hari pada: MEA
(5), ACDEK (6), ACDEK 20% (7), ACD (8) 19
7. Morfologi Aspergillus niger: kepala konidia radial terbagi (1), vesikel bundar seluruh permukaannya ditutupi fialid (2), permukaan konidiofor halus (3), konida agak kasar, (4). Koloni umur 7 hari pada:
MEA (5), ACDEK (6), ACDEK 20% (7), ACD (8) 19
8. Morfologi Curvularia lunata: karakter pertumbuhan pada blok agar AEM (1), bekas pelekatan konidia (tunas) (2), konidia berbentuk kurva, sel ketiga lebih besar dan lebih gelap, sekat kedua konidia tidak di tengah (3). Koloni umur 6 hari pada: ADK (4), AEM (5) 20 9. Morfologi P. lingam: massa konidia berwarna merah jambu keluar dari
piknidia pada media ADK umur 14 hari (1), piknidia (2), piknosklerotia (3), piknidia dengan tiga leher papilla (4), berbentuk silinder dengan dua titik minyak pada kedua kutubnya konidia (5).
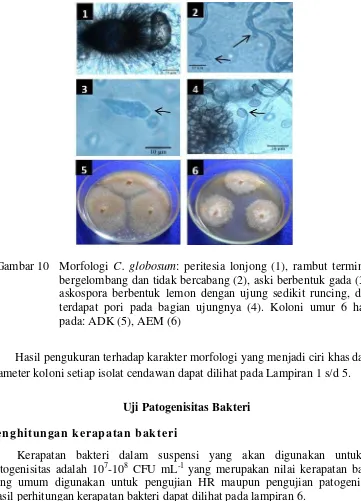
10.Morfologi C. globosum: peritesia lonjong (1), rambut terminal bergelombang dan tidak bercabang (2), aski berbentuk gada (3), askospora berbentuk lemon dengan ujung sedikit runcing, dan terdapat pori pada bagian ujungnya (4). Koloni umur 6 hari pada: ADK (5),
AEM (6) 21
11.Uji patogenisitas pada kecambah Brassicaceae: perlakuan kontrol tidak bergejala (1,2), nekrosis terbentuk pada perlakuan inokulasi isolat
9.2 (3) dan isolat 9.1 (4) 22
12.Gejala nekrosis pada beberapa kecambah Brassicaceae 20 hsi: nekrosis tidak berkembang lebih lanjut pada daun kecambah yang diinokulasi isolat 5.2 (1,2), isolat 9.1 (3), isolat 9.2 (4), isolat 11.1.P (5), dan
nekrosis alami (6) 23
13.Gejala nekrosis tidak muncul pada uji patogenisitas terhadap beberapa jenis tanaman Brassicaceae 20 hari setelah tanam 23 14.Uji patogenisitas pada kubis bunga. Perlakuan kontrol (1 s/d 6): gejala
tidak terbentuk pada batang (1-3), tangkai daun (4), bunga (5,6). Perlakuan isolat 3.3 (7 s/d 12): gejala busuk lunak terbentuk pada batang (7-9), nekrosis tangkai daun (10), busuk lunak bunga (11,12) 24 15.Uji patogenisitas pada caisim. Perlakuan kontrol (1 s/d 5): gejala tidak
terbentuk pada: batang (1,2), tangkai daun (3,4), daun (5). Perlakuan isolat 5.2 (6 s/d 10): gejala busuk lunak: pada batang (6,7), tangkai
daun (8,9), luka kebasahan pada daun (10) 25
16.Uji patogenisitas pada sawi manis. Perlakuan kontrol (1 s/d 4): gejala tidak terbentuk pada batang (1,2), tangkai daun (3,4). Perlakuan isolat 9.1 (5 s/d 8): gejala busuk lunak pada batang (5,6), tangkai daun (7,8). Perlakuan isolat 9.2 (9 s/d 12): gejala busuk lunak pada batang (9,10),
tangkai daun (11,12) 25
17.Uji patogenisitas pada pakchoy. Perlakuan kontrol (1 s/d 4): busuk karena faktor kelembapan (1), gejala tidak terbentuk pada tangkai daun (2,3), daun (4). Perlakuan isolat 11.1.P (5 s/d 8): busuk lunak terbentuk pada batang (5), tangkai daun (6,7), luka kebasahan pada daun (8) 26 18.Uji pertumbuhan anaerobik (tabung reaksi kiri media dengan parafin
cari, kanan tanpa parafin): kontrol negatif (K), isolat 3.3; 3.3 R; 5.2; 5.2 R; 9.1; 9.1 R; 9.2; 9.2 R; 11.1.P; 11.1.P R (1 s/d 10) 28 19.Visualisasi DNA bakteri: penanda DNA (M), isolat 3.3; 3.3 R; 5.2 R;
5.2 R; 9.1; 9.1 R; 9.2; 9.2 R; 11.1.P; 11.1.1 P R (1 s/d 10) 28
DAFTAR LAMPIRAN
1. Karakter morfologi Aspergillus flavus pada media AEM 45 2. Karakter morfologi dan koloni Aspergillus niger pada media AEM 45 3. Karakter morfologi Curvularia lunata pada media AEM 46 4. Karakter morfologi Phoma lingam pada media AEM 46 5. Karakter morfologi Chaetomium globosum pada media AEM 46 6. Kerapatan bakteri umur 2 hsi untuk inokulasi (CFU mL-1) 47
7. Hasil penelusuran sikuen gen 16S rRNA isolat bakteri yang diuji
PENDAHULUAN
Latar Belakang
Benih merupakan salah satu komponen penting dalam keberhasilan peningkatan produksi pertanian. Penggunaan benih bermutu mampu meningkatkan produksi pertanian dan mengurangi serangan hama dan penyakit di lapangan. Patogen terbawa benih dapat menyebabkan penurunan viabilitas benih, peningkatkan kematian bibit, penurunan hasil, peningkatan perkembangan penyakit, perubahan komponen kimia benih, dan ledakan penyakit pada suatu daerah (Agarwal dan Sinclair 1996).
Indonesia masih mengimpor benih untuk memenuhi kebutuhan nasional, diantaranya ialah benih Brassicaceae. Selama tahun 2011-2013 Indonesia telah mengimpor 30 596.14 kg benih Brassicaceae dari beberapa negara (Tabel 1). Tabel 1 Impor benih Brassicaceae Indonesia tahun 2011-2013
Tahun Jumlah (kg) Asal negara
2011 15 233.60 Jepang, Korea Selatan, Perancis, Thailand 2012 8 287.54 Belanda, Jepang, Korea Selatan, Thailand
2013 7 075.00 Cina, Jepang, Malaysia, Perancis, Thailand, Korea Selatan, Selandia Baru
Sumber: Barantan (2014)
Impor dan ekspor benih merupakan salah satu cara patogen menyebar dari tempat asalnya menuju tempat yang baru. Cendawan dapat menyebar melalui miselium dorman pada setiap bagian benih seperti kulit biji, atau pada kulit buah. Bakteri terbawa benih dapat berada pada permukaan benih, berada di dalam kulit benih atau dalam jaringan benih lainnya yang masuk melalui sistem pembuluh. Hal tersebut menimbulkan resiko masuknya patogen terbawa benih ke dalam suatu negara (Neergaard 1969).
Berdasarkan Peraturan Menteri Pertanian No. 93 Tahun 2011 ditetapkan dua spesies bakteri yaitu Pseudomonas viridiflava (Burkholder), Rhodococcus fascians (Zopt.) Tsunukura, dua spesies virus yaitu Arracacha virus B (AVB), Tomato black ring virus (TBRV) yang termasuk organisme pengganggu tumbuhan karantina (OPTK) kategori A1; juga ditetapkan satu spesies cendawan yaitu Phoma lingam (Tode ex Fr.) Demazieres yang termasuk OPTK kategori A2. OPTK tersebut dapat menyebar melalui benih Brassicaceae dan dilaporkan belum terdapat di Indonesia (OPTK A1) atau penyebarannya masih terbatas pada daerah tertentu dalam wilayah Indonesia (OPTK A2).
2
kehilangan hasil. Pengujian kesehatan benih juga merupakan cara yang tepat dan efektif untuk mengetahui penyebaran penyakit terbawa benih dan untuk mencegah penyebaran penyakit ke daerah yang masih bebas (Neergaard 1969).
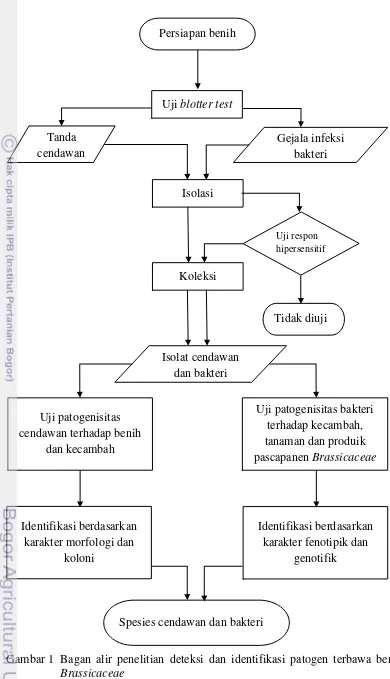
Berdasarkan hal tersebut di atas, pada penelitian ini dilakukan deteksi dan identifikasi terhadap patogen yang terbawa benih Brassicaceae yang berasal dari Amerika Serikat dan Malaysia dengan alur seperti terlihat pada Gambar 1.
Tujuan Penelitian
Penelitian ini bertujuan untuk mendeteksi dan mengidentifikasi patogen terbawa benih Brassicaceae dan menentukan patogenisitasnya.
Manfaat Penelitian
Penelitian ini diharapkan memberikan informasi mengenai patogen terbawa benih Brassicaceae dan patogenisitasnya.
Ruang Lingkup Penelitian
3
Persiapan benih
Uji blotter test
Isolasi Tanda
cendawan
Gejala infeksi bakteri
Koleksi
Tidak diuji
Uji patogenisitas cendawan terhadap benih
dan kecambah
Uji patogenisitas bakteri terhadap kecambah, tanaman dan produik pascapanen Brassicaceae Isolat cendawan
dan bakteri
Identifikasi berdasarkan karakter morfologi dan
koloni
Identifikasi berdasarkan karakter fenotipik dan
genotifik
Spesies cendawan dan bakteri
Uji respon hipersensitif
4
TINJAUAN PUSTAKA
Benih Sebagai Pembawa Patogen
Keberadaan inokulum pada benih akan menentukan metode pengujian yang tepat untuk mendeteksi patogen tersebut serta menentukan keefektifan perlakuan untuk mengeradikasi patogen pada benih tersebut. Ada tiga tipe utama penyebaran patogen pada benih:
1. Inokulum terdapat di dalam jaringan benih.
2. Inokulum terbatas pada bagian permukaan benih, biasanya sebagai propagul yang melekat seperti spora, sklerotia, potongan miselium.
3. Inokulum dapat berupa kontaminan yang tercampur bersama benih, berupa sisa tanaman yang terinfeksi, sklerotia, sista nematoda, partikel tanah yang terinfestasi patogen.
Spesies dari genus Cercospora, Colletotrichum, Fusarium, Phoma, Septoria umumnya terbawa di dalam kulit biji atau kulit buah meskipun terkadang tubuh buah cendawan dapat terlihat pada benih kering. Penyakit downy mildew atau embun bulu yang disebabkan Peronosclerospora philippinensis pada jagung adalah contoh penyakit yang penting yang terdapat pada kulit biji. Embrio biji dapat terinfeksi oleh penyakit loose smut pada barley dan gandum. Patogen lainnya yang umum terbawa pada permukaan benih meliputi Alternaria, Fusarium, Helminthosporium dan Stemphylium, dan banyak dari kelompok cendawan gosong dan karat. Kontaminasi pada permukaan benih oleh spora dan miselia internal sering terjadi secara simultan (Neergaard 1969).
Bakteri patogen tanaman yang terbawa benih dapat menularkan penyakit melalui benih tersebut (seed transmitted). Bakteri sering terbawa pada permukaan benih, akan tetapi bakteri yang menyebabkan infeksi sistemik atau infeksi pada berkas pembuluh sering ditemukan pada kulit biji atau jaringan lain dari benih. Pseudomonas phaseolicola dan Xanthomonas phaseoli pada kacang-kacangan ditemukan pada bagian hilum, yang akan masuk ke bagian funiculus melalui berkas pembuluh (Neergaard 1977). Xanthomonas axonopodis pv. vesicatoria yang menginfeksi alami benih tomat dapat mencapai endosperma, kulit biji, funiculus (Sharma dan Agrawal 2014). Bakteri yang berada pada permukaan benih dapat bertahan dalam waktu yang terbatas, mungkin antara satu atau dua tahun, sedangkan bakteri yang berada di dalam jaringan benih dapat bertahan dalam waktu yang lama seperti Corynebacterium flaccumfaciens yang dapat bertahan sampai 24 tahun di dalam benih kacang panjang (Neergaard 1977).
Metode Pengujian Kesehatan Benih
5 pengaturan penyinaran selama 12 jam terang dan 12 jam gelap secara bergantian. Setiap benih pada akhir masa inkubasi diperiksa dengan menggunakan mikroskop stereo dengan perbesaran sampai dengan 60 kali untuk melihat pertumbuhan cendawan. Untuk menentukan identitas cendawan dilanjutkan dengan pengujian menggunakan perbesaran tinggi (mikroskop kompon) untuk melihat struktur tubuh buah, seperti konidia yang muncul pada konidiofor, spora yang terdapat pada massa spora, sporodokia dan aservuli, piknidiospora dalam piknidia, askospora dalam peritisia (Mathur et al. 1989).
Metode blotter test standar dapat dilakukan dengan diawali sterilisasi permukaan benih yang akan diuji atau tanpa sterilisasi permukaan. Metode blotter test tanpa steriliasi permukaan mampu mendeteksi sampai 16 spesies cendawan terbawa benih dari 50 contoh benih padi di Pakistan, 23 spesies cendawan pada padi di Ghana dan dengan sterilisasi permukaan dapat mendeteksi 15 spesies cendawan terbawa benih di Pakistan (Addison et al. 1971; Jamil Khan et al. 1988). Khulbe dan Harbola (1997) menggunakan blotter test tanpa sterilisasi permukaan mampu mengisolasi 22 cendawan dari benih kubis bunga dan kubis asal Kumaun, Himalaya yang terdiri dari genus Alternaria, Aspergillus, Cladosporium, Cordana, Curvularia, Drechslera, Epicoccum, Gilmaniella, Mumicola, Mucor, Penicillium, Sclerotinia, Stemphylium, Ulocladium.
Ora et al. (2011) mendeteksi 12 patogen terbawa benih padi yang ditanam di Bangladesh, seperti: Xanthomonas oryzae, Rhizopus stolonifer, Aspergillus spp., Fusarium moniliforme, Phoma sp. Bipolaris oryzae, Curvularia lunata, Penicillium sp., Alternaria tenuissima, Nigrospora sp, Chaetomium globosum dan Tilletia barclayana menggunakan metode blotter test tanpa sterilisasi permukaan. Singh et al. (2013) dengan metode yang sama mendeteksi 15 spesies cendawan dari benih Brassica juncea asal Agra, India yang terdiri atas genus Absidida, Aspergillus, Cladosporium, Chaetomium, Fusarium, Phoma, Rhizoctonia, Sclerotium, Trichoderma, Emericella, Epicoccum, Glomerella. Hossain et al. (2014) mendeteksi 7 spesies cendawan pada benih kubis asal Bangladesh yaitu Alternaria spp., Aspergillus flavus, Fusarium spp., Penicillium spp. dan Rhizopus spp. menggunakan metode blotter test tanpa sterilisasi permukaan benih. Sharma dan Sharma (2014) menggunakan metode blotter test untuk menghitung kejadian dari Ralstonia solanacearum pada benih terung.
Menurut Marcinkowska (2002) pengujian standar bakteri pada benih meliputi proses ekstraksi bakteri dari benih, isolasi menggunakan media biakan dan proses identifikasi yang dapat dilakukan dengan berbagai metode seperti pengujian secara morfologi, fisiologi dan pemanfaatan nutrisi, metode penanaman pada media agar, uji patogenisitas dan uji bakteriofage. Metode pengujian lain yang digunakan adalah metode serologi seperti enzyme-linked immunosorbent assay (ELISA), immunoflurescence microscopy atau metode yang basiskan asam nukleat seperti probes dan polymerase chain reaction (PCR).
6
busuk lunak pada kentang hidrolisis arginin dan uji hipersensitif pada tembakau (Gracelin et al. 2011; Rafi et al. 2013; Sharma dan Sharma 2014).
Pengujian fisiologis juga dapat dilakukan menggunakan kit MicrogenTM GN-ID A+B panel dimana reaksi positif bakteri yang diuji akan menimbulkan perubahan warna pada lubang panel. Perubahan warna yang terjadi tersebut selanjutnya dicocokkan dengan color chart yang tersedia (Wahyudi et al. 2011). Pengujian Xanthomonas campestris pv. campestris menggunakan Enzyme-linked immunosorbent assay (ELISA) dan biolog identification (Bila et al. 2012).
Mehta et al. (2005) berhasil mengembangkan media semi selektif untuk mendeteksi keberadaan X. axonopodis pv. malvacearum yang menginfeksi benih kapas. ISF (2013) melakukan deteksi X. campestris pv. campestris dengan perendaman benih. Bakteri yang keluar dari permukaan dan funiculus benih ke dalam air rendamanan ditanam pada media modified Tween medium B (TMB), dan media yeast extract CaCO3 (YDC).
Metode PCR memiliki sensitifitas, digunakan untuk mendeteksi patogen yang sulit ditumbuhkan atau sulit diidentifikasi. Metode membutuhkan bahan yang sedikit, maupun material yang sudah terganggu kualitasnya, serta dapat mendeteksi strain, patotipe, spesies (Mathur dan Kongsdal 2003). Amplifikasi gen 16S rRNA menggunakan uji PCR banyak dilakukan untuk survei ekologi molekuler karena gen tersebut merupakan penanda filogenetik dari prokaryot. Janda dan Abbott (2007) menyatakan penggunaan gen 16S rRNA dalam kajian filogenetik dan taksonomi bakteri adalah karena gen tersebut terdapat pada hampir semua bakteri, bersifat kekal tidak mudah bermutasi, berukuran cukup besar sebagai sumber informasi genetik. Lan et al. (2010) berhasil mengamplifikasi gen 16S rRNA bakteri yang berasal dari biofilm batu candi Angkor Kamboja menggunakan primer 27BF dan 1492BR yang merupakan primer khusus bakteri. Osborne et al. (2005) menggunakan primer yang sama dilanjutkan dengan sikuensing berhasil mengidentifikasi bakteri yang berasal dari dalam usus tikus dan tanah. Park et al. (2004) mendeteksi X. campestris pv. campestris menggunakan primers spesifik XCF dan XCR yang disusun berdasarkan urutan DNA pada gen hrpF. Fargier dan Manceau (2005) mampu mendeteksi sel hidup bakteri X. campestris pv. campestris pada benih Brassicaceae dengan mendeteksi mRNA bakteri tersebut menggunakan primer yang disusun berdasarkan gen rpoD dan gyrB. Thomas et al. (2005) mengidentifikasi X. campestris pv. campestris menggunakan teknik BIO-PCR dimana bakteri diperoleh dari perendaman benih yang terinfeksi selama semalam. Setelah itu ditanam pada media selektif selanjutnya DNA dipanen pada umur 72 jam untuk diuji PCR. Khaeruni et al. (2007) mampu mendeteksi X. axonopodis pv. glycines menggunakan primer spesifik XAG-F dan XAG-R yang merupakan primer yang disusun berdasarkan urutan DNA pada kromosom bakteri.
Uji Patogenisitas
7 yang tertutup sebelum disemai pada pasir steril. Metode yang hampir sama dilakukan Sadhu (2014) untuk menguji patogensitas cendawan terbawa benih kacang hijau (Vigna radiata L.) melalui perendaman benih tersebut ke dalam suspensi spora cendawan lalu diinkubasi selama 10 hari pada suhu ruang menggunakan metode blotter test. Pengujian terhadap kecambah dilakukan dengan perendaman kecambah dalam suspensi spora setelah itu ditanam pada tanah steril. Hussain et al. (2013) melakukan uji patogenisitas dengan menanam benih jagung pada kertas blotter setelah itu dilembapkan dengan suspensi miselium Aspergillus flavus. Uji patogensitas terhadap kecambah dilakukan dengan menanam kecambah dalam tabung reaksi yang berisi water agar (WA) setelah itu inokulasi dilakukan dengan penyemprotan suspensi miselium.
8
METODE
Bahan
Bahan yang digunakan adalah benih kubis bunga (Brassica oleracea var. italica) asal Amerika Serikat dan benih sawi hijau (B. rapa var. parachinensis), kubis cina (B. rapa f. annua), pakchoy putih (B. rapa subsp. chinensis) dan pakchoy (B. rapa subsp. chinensis) asal Malaysia yang diperoleh dari koleksi Balai Besar Karantina Pertanian (BBKP) Tanjung Priok, Propinsi DKI Jakarta dan dari toko pertanian di Kabupaten Karimun, Propinsi Kepulauan Riau, kertas hisap steril, agar-agar kentang dekstrosa (ADK), agar-agar ekstrak malt (AEM), agar-agar czapek dox ekstrak khamir (ACDEK) , agar-agar-agar-agar czapek dox ekstrak khamir sukrosa 20% (ACDEK 20%), agar-agar czapek dox (ACD), nutrient agar (NA), nutrient broth (NB), air steril, tisu steril NaOCl 1%, alkohol 70% dan 96%, karet gelang steril, cotton bud steril, syringae steril, tabung mikro steril dan plastik steril.
Alat
Peralatan yang digunakan adalah laminar, autoklaf, mikroskop portabel Dino-Lite AM2111 Series, mikroskop stereo Olympus SZ30, mikroskop kompon Nikon Eclipse 80i, Mesin PCR Gene Amp PCR System 9700, alat elektoforesis Mupid Exu, perangkat visualiasi gelas objek Biostep Darkhood DH-10.
Lokasi dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Mikologi, Departemen Proteksi Tanaman, Institut Pertanian Bogor (IPB) dan Laboratorium Patologi Balai Uji Terap Teknik dan Metode Karantina Pertanian (BUTTMKP) Badan Karantina Pertanian Indonesia mulai bulan Juli 2014 sampai Juli 2015.
Metode Penelitian Metode blotter test
Pengujian dilakukan dengan sterilisasi permukaan (NaOCl 1% selama 3 menit, dibilas dengan air suling steril 3 kali lalu dikeringanginkan di atas tisu steril dalam laminar) dan tanpa sterilisasi permukaan. Setiap pengujian masing-masing menggunakan 100 benih dan ditanam sebanyak 25 benih per cawan yang telah diberikan 5 kertas hisap yang telah dilembapkan dengan air steril. Benih diinkubasi selama 14 hari pada suhu ruang (27-30 °C). Pengamatan dilakukan terhadap daya berkecambah, persentase infeksi cendawan terhadap benih maupun kecambah dengan rumus sebagai berikut:
Daya berkecambah = ∑ benih berkecambah x 100%
9
Persentase infeksi = ∑ benih terinfeksi x 100%
∑ benih yang diinkubasi
Isolasi cendawan dan bakteri
Cendawan diisolasi dengan menyentuhkan ujung jarum ose yang telah ditempelkan sedikit ADK pada koloni cendawan yang tumbuh pada permukaan benih atau kecambah lalu dibiakkan dalam media ADK pada suhu ruang (27-30 °C). Biakan murni cendawan disimpan dalam cawan dan agar miring ADK pada suhu 18 °C.
Bakteri diisolasi dengan memasukkan daun kecambah (kotiledon) bergejala cokelat, bercak kebasahan ke dalam tabung mikro yang berisi 1 mL air steril lalu diinkubasikan 4 jam agar oose bakteri keluar berdifusi ke dalam air steril tersebut. Tabung mikro diguncang menggunakan tangan sebanyak 24 kali lalu dengan menggunakan jarum ose suspensi bakteri tersebut digoreskan pada media NA dengan sistem kuadran. Bakteri yang tumbuh dengan karakter koloni berbeda dari setiap kelompok benih dimurnikan dengan menggoreskannya pada media NA yang baru.
Biakan murni bakteri diuji respons hipersensitif (HR) pada daun tembakau sebagai seleksi awal terhadap isolat bakteri yang diduga patogen. Suspensi bakteri dibuat dengan menambahkan 10 mL air steril ke dalam cawan yang berisi biakan murni bakteri umur 48 jam pada media NA. Koloni bakteri dilepas dari media dan diaduk dengan menggunakan gelas objek steril. Suspensi bakteri sebanyak ±1 mL diinfiltrasikan pada permukaan bawah daun tembakau menggunakan syringae steril tanpa jarum, untuk kontrol digunakan air steril. Infiltrasi untuk setiap isolat bakteri dan kontrol diulang 3 kali. Reaksi positif terlihat jika pada bagian daun yang diinfiltrasi suspensi bakteri terjadi nekrosis dalam 24–48 jam (Wick 2010). Isolat bakteri yang menunjukkan respons hipersensitif digunakan untuk pengujian patogenisitas.
Biakan murni bakteri yang bereaksi disimpan pada agar miring NA, dalam tabung mikro yang berisi air steril steril lalu disimpan pada suhu 4 °C, serta dalam tabung mikro yang berisi NB + gilserin 40% (disimpan pada -20 °C) yang digunakan untuk pengujian selanjutnya.
Pengujian patogenisitas cendawan
Pengujian patogenisitas cendawan dilakukan terhadap setiap isolat cendawan dengan karakter pertumbuhan berbeda yang diisolasi dari setiap contoh benih yang diuji menggunakan metode blotter test. Benih disterilisasi permukaan dengan NaOCl 1% selama 3 menit, dibilas dengan air steril sebanyak 3 kali lalu dikeringanginkan di atas tisu steril dalam laminar. Benih tersebut ditanam pada ADK yang berisi biakan murni cendawan berumur 7 hari sebanyak 40-60 benih untuk setiap cendawan (20 benih/cawan) dan untuk kontrol benih ditanam pada ADK tanpa biakan cendawan. Selanjutnya benih diinkubasi selama 14 hari pada suhu ruang dengan meletakkan cawan tanpa tutup di dalam plastik steril untuk mempertahankan kelembapan.
10
persentase infeksi sebagai dasar penetuan patogenisitas dari cendawan tersebut. Rumus perhitungan persentase infeksi sebagai berikut:
Persentase infeksi =
∑ benih tidak berkecambah, kecambah
nekrosis atau mati x 100%
∑ benih yang diinkubasi
Identifikasi cendawan
Cendawan diidentifikasi berdasarkan karakter koloni dan morfologi dengan bantuan mikroskop stereo dan kompon dan membandingkan karakter tersebut dengan menggunakan buku kunci identifikasi yaitu Compendium of Soil Fungi (Domsch et al. 1980), Dematiaceous Hyphomycetes (Ellis 1971), Pictorial Atlas of Soil and Seed Fungi. Second Edition (Watanabe 2002), The Coelomycetes: Fungi Imperpecti with Pycnidia, Acervuli, and Stromata (Sutton 1980), Phoma Identification Manual: Differentiation of Specific and Infra-specific Taxa in Culture (Boerma et al. 2004).
Untuk Pengamatan karakter koloni isolat cendawan dibiakkan pada media ADK, AEM, ACDEK, ACDEK20%, dan ACD berdasarkan genus cendawan yang diperoleh, diinkubasi selama 6-7 hari, selanjutnya dilakukan pengamatan terhadap warna, bentuk dan ukuran koloni. Untuk pengamatan morfologi cendawan terlebih dahulu ditanam pada blok agar ADK atau AEM menggunakan modifikasi metode Riddle (1950) lalu diinkubasi selama 4 hari. Pengamatan dilakukan terhadap bentuk maupun ukuran bagian-bagian cendawan yang menjadi ciri dalam identifikasi cendawan tersebut.
Pengujian patogenisitas pada bakteri
Penghitungan kerapatan bakteri. Sebanyak 3 lup koloni bakteri yang berumur 24 jam ditambahkan ke dalam 10 mL air steril diguncang menggunakan tangan sebanyak 24 kali lalu diencerkan dengan faktor pengenceran 10-5 dan 10-6. Sebanyak 0.1 mL suspensi bakteri dari setiap faktor pengenceran tersebut disebar pada cawan yang berisi NA. Jumlah koloni yang tumbuh dihitung pada 24-48 jam setelah inkubasi sebagai nilai kerapatan bakteri dalam satuan CFU mL-1
Inokulasi dan pengamatan gejala. Benih disterilisasi permukaan dengan NaOCl 1% selama 3 menit, dibilas dengan air steril sebanyak 3 kali, lalu dikeringanginkan di atas tisu steril dalam laminar. Sebanyak 50 benih (25 benih/cawan) tersebut ditanam pada 5 lembar kertas hisap steril lalu diinkubasikan selama 6 hari. Inokulasi dilakukan terhadap kecambah yang sehat dengan menusuk daun kecambah menggunakan jarum syringae steril yang telah diolesi koloni bakteri berumur 48 jam (metode stubbing) dan membasahi bagian tepi daun kecambah yang telah digunting (metode clipping) dengan suspensi bakteri dengan kerapatan 107-108 CFU mL-1 menggunakan cotton bud steril. Untuk
11 Inokulasi pada tanaman berumur 20 hari setelah semai dengan menggunakan metode clipping. Inokulasi dilakukan dengan memotong bagian pinggir daun (5 tanaman/isolat) menggunakan gunting yang telah dicelup dengan suspensi bakteri, untuk kontrol menggunakan air steril.
Inokulasi juga dilakukan pada produk Brassicaceae yang diperoleh dari supermarket yaitu kubis bunga, caisim, sawi manis dan pakchoy dengan metode stubbing. Produk tersebut dibagi menjadi 3 bagian, disterilisasi permukaan dengan alkohol 70% selama 5 detik, NaOCL 1% selama 5 detik, dibilas dengan air steril 3 kali, lalu dikeringanginkan di atas tisu steril dalam laminar. Produk Brassicaceae dilukai menggunakan tusuk gigi steril pada bagian batang, tangkai daun, dan bunga (untuk kubis bunga), lalu 100 µL suspensi bakteri dimasukkan ke dalam luka inokulasi tersebut, untuk kontrol menggunakan air steril.
Pengamatan dimulai 2 hari setelah inokulasi dengan menghitung jumlah kecambah/tanaman/produk tanaman yang bergejala nekrosis pada bagian yang diinokulasi untuk menentukan patogenisitas isolat bakteri tersebut, dengan rumus sebagai berikut:
Persentase terinfeksi = ∑ kecambah/tanaman/produk bergejala x 100%
∑ kecambah/tanaman/produk yang diamati
Reisolasi. Reisolasi hanya dilakukan terhadap kecambah hasil uji patogenisitas. Sebanyak 4-5 daun kecambah yang bergejala pada uji patogenisitas baik metode stubbing dan clipping dimasukkan ke dalam tabung mikro yang berisi air steril lalu diinkubasikan selama 4 jam pada suhu ruang agar oose bakteri keluar berdifusi ke dalam air steril tersebut. Tabung mikro diguncang menggunakan tangan sebanyak 24 kali lalu dengan menggunakan jarum ose, suspensi bakteri tersebut digoreskan pada media NA dengan sistem kuadran. Koloni bakteri yang tumbuh dimurnikan dengan menggoreskannya pada media NA yang baru. Bakteri hasil reisolasi dipelihara dan disimpan dengan cara yang telah diuraikan sebelumnya.
Identifikasi Bakteri
Identifikasi bakteri dilakukan secara fenotipik maupun genotipik terhadap isolat bakteri yang digunakan untuk menginokulasi dan isolat bakteri yang diperoleh dari hasil reisolasi. Adapun tahapan identifikasi sebagai berikut:
Pengujian Gram dengan KOH 3% dan pewarnaan. Satu tetes KOH 3% dicampur dan diaduk dengan satu lup isolat bakteri. Isolat bakteri termasuk dalam kelompok Gram negatif jika campuran tersebut membentuk lendir. Hasil pengujian tersebut dikonfirmasi dengan pewarnaan Gram. Jika hasil pewarnaan bakteri berwarna ungu sampai hitam kebiruan maka bakteri tersebut termasuk kelompok bakteri Gram positif sedangkan bakteri yang berwarna merah termasuk kelompok bakteri Gram negatif (Schaad et al. 2001).
12
berat/volume) selama 10 menit dan dibilas dengan air mengalir lalu dikeringkan. Preparat digenangi dengan pewarna safranin 0.5% (b/v) selama 15 detik dan dicuci dengan air mengalir selanjutnya dikeringkan dengan menggunakan tisu steril. Preparat diamati dengan perbesaran 1000x. Sel bakteri berwarna merah dan spora berwarna hijau (Schaad et al. 2001).
Pengujian pertumbuhan anaerobik. Setiap isolat bakteri yang membentuk endospora diinokulasikan dengan menggunakan jarum ose ke dalam 2 tabung reaksi yang berisi media Hugh and Leifson. Salah satu tabung untuk setiap isolat ditutup dengan parafin cair setebal 5 mm lalu diinkubasikan selama 48 jam. Perubahan warna media dari berwarna hijau atau biru menjadi kuning pada kedua tabung reaksi menunjukkkan reaksi positif untuk pertumbuhan anaerobik/bersifat fermentatif (Schaad et al. 2001).
Pengujian reaksi oksidase. Kit reaksi oksidase diteteskan pada kertas saring steril. Setelah itu biakan murni bakteri yang akan diuji diambil menggunakan jarum ose lalu dicampur pada tetesan kit reaksi tersebut. Perubahan warna menjadi ungu menandakan isolat bakteri yang diuji bersifat oksidatif.
Pengujian PCR dan sikuensing. Sebanyak 4-5 koloni bakteri berumur 48 jam dimasukkan ke dalam tabung mikro 1.5 mL yang berisi 100 µ L aquabides steril dengan menggunakan tip pipet mikro dan dihomogenkan. Hasil campuran selanjutnya diinkubasi dalam penangas air pada suhu 95 °C selama 1 menit selanjutnya digunakan sebagai cetakan DNA, modifikasi metode Rahma (2013).
Amplifikasi gen 16S rRNA dengan teknik PCR menggunakan pasangan primer universal 27F (5’-AGA GTT TGA TCM TGG CTC AG -3’) dan primer
1492R (5’-CGG TTA CCT TGT TAC GAC TT -3’) (Galkiewicz dan Kellogg
2008). Volume total reaksi PCR adalah 50 µl yang terdiri dari: 25 μl Dream Taq Green PCR master mix, masing-masing 2 μl primer 27F dan primer 1492R, 19 μl ddH2O, dan 2 μl cetakan DNA.
PCR dilakukan dengan menggunakan Automated Thermal Cylcler (Gene Amp PCR System 9700) pada kondisi satu siklus predenaturasi pada suhu 95 °C selama 5 menit, 35 siklus yang terdiri dari tahap denaturasi DNA pada suhu 95 °C selama 1 menit, tahap penempelan primer ke DNA target pada suhu 55 ᵒC selama 1 menit, dan tahap pemanjangan DNA pada suhu 72 °C selama 2 menit, 1 siklus
pemanjangan DNA pada suhu 72 °C selama 10 menit yang diakhiri pada suhu 4 °C untuk penyimpanan.
DNA hasil PCR dielektroforesis pada gel agarosa 1.5% yang dilarutkan dalam TAE 1x. Sebanyak 5 µL marker DNA 1 kb (Thermo scientific) dan 10 µL DNA hasil PCR masing-masing dimasukkan ke dalam sumuran gel agarosa dan dielektroforesis pada 50 volt, selama 50 menit. Selanjutnya gel tesebut divisualiasi menggunakan Biostep Darkhood DH-10.
13
HASIL
Metode Blotter Test dan Isolasi
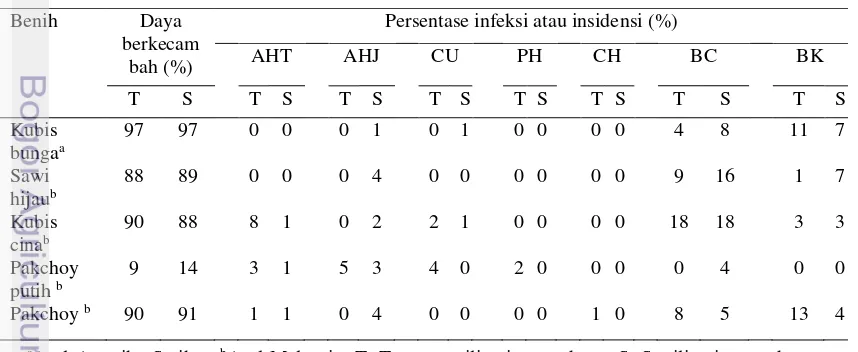
Pada penelitian ditemukan lima genus cendawan yang ditemukan pada benih yang diuji. Cendawan paling banyak ditemukan pada benih pakchoy putih, yaitu Aspergillus hitam, Aspergillus hijau, Curvularia dan Phoma sedangkan pada benih sawi hijau hanya ditemukan cendawan Aspergillus hitam. Hampir semua cendawan tumbuh dari benih dalam keadaan mati yang menunjukkan cendawan tersebut mampu menyebabkan turunnya persentase daya berkecambah dan kematian benih. Pada daun kecambah yang tumbuh dari benih diuji juga ditemukan gejala berupa bercak cokelat dan bercak kebasahan yang diduga akibat infeksi bakteri. Gejala bercak cokelat ditemukan pada semua kecambah sedangkan gejala bercak kebasahan tidak ditemukan pada kecambah pakchoy putih (Tabel 2). Kemampuan berkecambah benih, persentase infeksi cendawan, insidensi gejala bercak cokelat dan bercak kebasahan dapat dilihat pada Tabel 3. Tabel 2 Cendawan dan gejala infeksi pada benih atau kecambah Brassicaceae
pada uji blotter test Benih
Jenis cendawan dan gejala yang ditemukan/keadaan benih:
AHT AHJ CU PH CH BC BK
aAsal Amerika Serikat, bAsal Malaysia, H: Benih dalam keadaan hidup (berkecambah), M: Benih
dalam keadaan mati +: Ditemukan, -: Tidak ditemukan, AHT: Aspergillus hitam, AHJ: Aspergillus hijau, CU: Curvularia, PH: Phoma, CH: Chaetomium, BC: Bercak cokelat, BK: Bercak kebasahan
Tabel 3 Infeksi cendawan dan insidensi bercak cokelat serta bercak kebasahan
Benih Daya
berkecam bah (%)
Persentase infeksi atau insidensi (%)
AHT AHJ CU PH CH BC BK
aAsal Amerika Serikat, bAsal Malaysia; T: Tanpa sterilisasi permukaan, S: Sterilisasi permukaan,
14
Benih kubis bunga dan sawi hijau yang tidak disterilisasi bebas dari cendawan tetapi terdeteksi gejala bercak cokelat dan bercak kebasahan. Benih kubis bunga dan sawi hijau tersebut mempunyai daya berkecambah yang relatif lebih tinggi dibandingkan benih kubis cina, pakchoy putih dan pakchoy yang terinfeksi cendawan, dan bergejala bercak cokelat serta bercak kebasahan. Daya berkecambah benih pakchoy putih yang tidak disterilisasi paling rendah dengan persentase infeksi cendawan paling tinggi. Cendawan pada benih yang tidak disterilisasi dapat merupakan cendawan kontaminan, akan tetapi tetap berdampak merugikan pada pertumbuhan awal tanaman Brassicaceae karena dapat menurunkan persentase daya berkecambah. Cendawan tersebut tumbuh pada permukaan benih, menginfeksi sampai jaringan dalam sehingga benih tersebut membusuk.
Meskipun benih yang disterilisasi tidak bebas dari cendawan, akan tetapi mempunyai persentase daya berkecambah yang relatif lebih tinggi dan persentase infeksi yang relatif lebih rendah dibandingkan benih yang tidak disterilisasi. Begitu pula dengan jenis cendawan yang menginfeksi benih yang disterilisasi relatif lebih sedikit dibandingkan jenis cendawan yang menginfeksi benih yang tidak disterilisasi. Benih kubis bunga yang disterilisasi diinfeksi oleh cendawan isolat Aspergillus hijau dan Curvularia memiliki persentase daya berkecambah paling tinggi, sedangkan benih pakchoy putih memiliki persentase daya berkecambah paling rendah dengan persentase infeksi cendawan isolat Aspergillus hitam dan Aspergillus hijau relatif tinggi (Tabel 3).
Selain sebagai kontaminan, cendawan isolat Aspergillus hitam, Aspergillus hijau, dan Curvularia juga terbukti mampu menginfeksi ke dalam jaringan benih. Cendawan kontaminan pada permukaan benih maupun cendawan yang berada di dalam jaringan benih dapat menurunkan persentase daya berkecambah. Sterilisasi permukaan dapat mengurangi kontaminasi oleh cendawan pada permukaan benih sehingga dapat mengurangi persentase infeksi. Gejala bercak cokelat dan bercak kebasahan muncul pada daun kecambah Brassicaceae sehingga tidak dipengaruhi oleh sterilisasi permukaan.
Tanda dari lima spesises cendawan yang tumbuh pada benih atau kecambah dalam uji blotter test ditampilkan pada Gambar 2. Gejala bercak cokelat yang terdeteksi daun kecambah (kotiledon) Brassicaceae banyak terdapat pada bagian tepi daun kecambah berbentuk seperti setengah lingkaran atau lingkaran hampir penuh sedangkan gejala bercak kebasahan berbentuk tidak teratur dan selalu terdapat pada bagian tengah daun kecambah (Gambar 3).
15
Gambar 3 Gejala: Bercak cokelat (1-3), bercak kebasahan (4-6) Pengamatan morfologi koloni bakteri
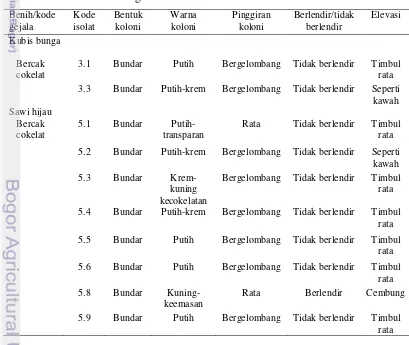
Terdapat 19 isolat bakteri yang diisolasi dari daun kecambah bergejala bercak cokelat dan 4 isolat bakteri yang diisolasi dari gejala bercak kebasahan, dengan karakter morfologi koloni sebagaimana yang ditampilkan pada Tabel 4. Tabel 4 Karakter morfologi koloni bakteri
Benih/kode
3.1 Bundar Putih Bergelombang Tidak berlendir Timbul
rata 3.3 Bundar Putih-krem Bergelombang Tidak berlendir Seperti
kawah
Rata Tidak berlendir Timbul
rata
5.2 Bundar Putih-krem Bergelombang Tidak berlendir Seperti kawah
5.3 Bundar
Krem-kuning kecokelatan
Bergelombang Tidak berlendir Timbul rata
5.4 Bundar Putih-krem Bergelombang Tidak berlendir Timbul
rata
5.5 Bundar Putih Bergelombang Tidak berlendir Timbul
rata
5.6 Bundar Putih Bergelombang Tidak berlendir Timbul
rata
5.8 Bundar
Kuning-keemasan
Rata Berlendir Cembung
5.9 Bundar Putih Bergelombang Tidak berlendir Timbul
16
9.1 Bundar Putih Bergelombang Tidak berlendir Timbul
rata
9.2 Bundar Putih-krem Bergelombang Tidak berlendir Seperti kawah
9.3 Bundar Putih Rata Tidak berlendir Rata
9.4 Bundar Putih-krem Bergelombang Tidak berlendir Timbul
rata Bercak
kebasahan
9.1.ws Bundar Putih Bergelombang Tidak berlendir Timbul
rata
Bercak kebasahan
9.6.ws Bundar Kuning Rata Berlendir Cembung
Pakchoy putih Bercak cokelat
11.1.P Bundar Putih-krem Bergelombang Tidak berlendir Seperti kawah
11.2.k Bundar Putih Bergelombang Tidak berlendir Timbul
rata Pakchoy
Bercak cokelat
12.1 Bundar Putih Bergelombang Tidak berlendir Timbul
rata 12.2 Bundar Putih-krem Bergelombang Tidak berlendir Timbul
rata
Bercak kebasahan
12.1.ws Bundar Putih Bergelombang Tidak berlendir Timbul
rata
12.2.ws Bundar Putih-krem Bergelombang Tidak berlendir Timbul rata
Semua isolat bakteri mempunyai koloni yang berbentuk bundar dan tidak berlendir (non mucoid), warna koloni umumnya putih, putih-krem dengan pinggiran bergelombang. Elevasi koloni bakteri umumnya timbul rata, membentuk cincin sehingga terlihat seperti kawah.
17
Gambar 4 Respons hipersensitif isolat bakteri 3.3 dan 5.2 (1 hari setelah inokulasi) berupa gejala luka kebasahan
Uji Patogenisitas Cendawan
Gejala yang diamati pada uji patogenisitas menggambarkan hampir tidak ada benih berkecambah sehat (Tabel 5).
Tabel 5 Uji patogenisitas cendawan pada benih Brassicaceae Benih/
Kode isolat
Jumlah benih uji (biji)
Persentase benih (%) Infeksi (%)
BS TB BN BM
Kubis bunga
Aspergillus hijau 60 0 48.4 28.3 23.3 100.0
Curvularia 40 0 0 87.5 12.5 100.0
Sawi hijau
Aspergillus hijau 60 0 98.3 0 1.7 100.0
Kubis cina
Aspergillus hitam 80 0 96.3 1.2 2.5 100.0
Aspergillus hijau 60 0 98.3 0 1.7 100.0
Curvularia 80 2.5 37.5 3.8 56.2 97.5
Pakchoy putih*
Curvularia 60 0 6.7 40.0 53.3 100.0
Aspergillus hijau 60 0 95.0 3.3 1.7 100.0
Phoma 60 0 86.6 6.7 6.7 100.0
Aspergillus hitam 60 0 98.3 0 1.7 100.0
Pakchoy
Chaetomium 80 6.2 32.5 38.8 22.5 93.8
Aspergillus hitam 40 0 100.0 0 0 100.0
Aspergillus hijau 80 3.7 96.3 0 0 96.3
18
Persentase infeksi cendawan isolat Aspergillus hitam, Aspergillus hijau, Curvularia dan Phoma pada pengujian patogenisitas mencapai 100%, sedangkan persentase infeksi Chaetomium 93.8%. Gejala infeksi cendawan isolat Aspergillus hitam, Aspergillus hijau dan Phoma paling banyak adalah benih mati tidak berkecambah sedangkan gejala infeksi cendawan isolat Curvularia dan Chaetomiun yang paling banyak adalah benih berkecambah dan mengalami nekrosis (Tabel 5).
Benih yang mati tidak berkecambah ditutupi oleh massa miselia cendawan dan jika dibuka lalu ditekan benih akan hancur karena telah membusuk. Benih yang tumbuh menjadi kecambah juga dapat mengalami nekrosis akibat serangan cendawan sehingga seperti plumula, radikula menguning. Nekrosis lebih lanjut dapat menyebabkan kecambah menjadi mati (Gambar 5).
Identifikasi Cendawan
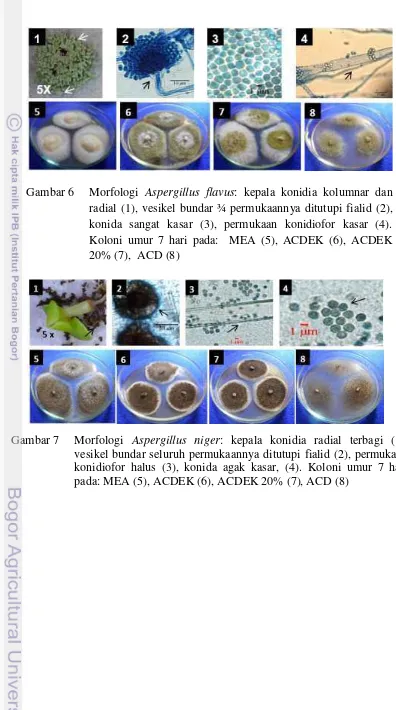
Isolat cendawan yang ditemukan: Aspergillus hitam, Aspergillus hijau, Curvularia, Phoma dan Chaetomium secara berurutan diidentifikasi sebagai Aspergillus niger, A. flavus, Curvularia lunata, Phoma lingam dan Chaetomium globosum. Cendawan P. lingam yang ditemukan pada benih pakchoy putih merupakan salah satu patogen penting pada tanaman Brassicaceae, cendawan ini memiliki miselium aerial, berwarna krem atau kuning kecokelatan dan berubah menjadi cokelat kehitaman dengan bertambahnya umur cendawan, membentuk piknidia pada benih atau biakan, berwarna cokelat, memiliki satu atau beberapa leher papila yang mengeluarkan eksudat konidia berwarna merah jambu, konidia berbentuk lonjong. Karakter morfologi dan koloni dari 5 spesies cendawan dapat dilihat pada Gambar 6-10.
19
Gambar 7 Morfologi Aspergillus niger: kepala konidia radial terbagi (1), vesikel bundar seluruh permukaannya ditutupi fialid (2), permukaan konidiofor halus (3), konida agak kasar, (4). Koloni umur 7 hari pada: MEA (5), ACDEK (6), ACDEK 20% (7), ACD (8)
6
20
Gambar 9 Morfologi P. lingam: massa konidia berwarna merah jambu keluar dari piknidia pada media ADK umur 14 hari (1), piknidia (2), piknosklerotia (3), piknidia dengan tiga leher papilla (4), berbentuk silinder dengan dua titik minyak pada kedua kutubnya konidia (5). Koloni umur 6 hari pada: ADK (6), AEM (7)
21
Hasil pengukuran terhadap karakter morfologi yang menjadi ciri khas dan diameter koloni setiap isolat cendawan dapat dilihat pada Lampiran 1 s/d 5.
Uji Patogenisitas Bakteri Penghitungan kerapatan bakteri
Kerapatan bakteri dalam suspensi yang akan digunakan untuk uji patogenisitas adalah 107-108 CFU mL-1 yang merupakan nilai kerapatan bakteri
yang umum digunakan untuk pengujian HR maupun pengujian patogenisitas. Hasil perhitungan kerapatan bakteri dapat dilihat pada lampiran 6.
Inokulasi dan pengamatan gejala
Hampir semua daun kecambah yang diuji mengalami nekrosis, sebagaimana ditampilkan pada pada Tabel 6.
22
Tabel 6 Uji patogenisitas bakteri pada kecambah Brassicaceae Benih/kode
isolat
Metode inokulasi Persentase
infeksi (%)
Stubbing Clipping
Kecambah diamati
Kecambah nekrosis
Kecambah diamati
Kecambah nekrosis
Kubis bunga
3.3 23 23 19 19 100
Sawi hijau
5.2 13 12 12 12 96
Kubis cina
9.1 15 15 15 15 100
9.2 16 16 15 15 100
Pakchoy putih*
11.1.P 19 19 15 15 100
* Uji patogenisitas cendawan yang ditemukan pada benih pakchoy putih menggunakan benih pakchoy dikarenakan daya berkecambah yang rendah
Nekrosis yang terbentuk menggunakan dua metode inokulasi mencapai 100%, hal tersebut menunjukkan isolat 3.3, 5.2, 9.1, 9.2 dan 11.1.P bersifat patogen terhadap kecambah Brassicaceae. Gejala nekrosis yang timbul dengan metode tusuk berupa titik hitam pada bagian tengah daun yang diinokulasi sedangkan inokulasi dengan metode pengguntingan gejala nekrosis berupa luka kebasahan atau luka inokulasi berwarna cokelat yang terjadi sepanjang luka inokulasi (Gambar 11).
Gambar 11 Uji patogenisitas pada kecambah Brassicaceae: perlakuan kontrol tidak bergejala (1,2), nekrosis terbentuk pada perlakuan inokulasi isolat 9.2 (3) dan isolat 9.1 (4)
23 Gejala nekrosis pada daun kecambah yang diinokulasi maupun gejala yang muncul alami tidak dapat berkembang pada pengamatan 20 hari setelah inokulasi (Gambar 12). Gejala nekrosis juga tidak muncul pada uji patogenisitas pada tanaman Brassicaceae 20 hari setelah tanam (Gambar 13).
Gambar 12 Gejala nekrosis pada beberapa kecambah Brassicaceae 20 hsi: nekrosis tidak berkembang lebih lanjut pada daun kecambah yang diinokulasi isolat 5.2 (1,2), isolat 9.1 (3), isolat 9.2 (4), isolat 11.1.P (5), dan nekrosis alami (6)
24
Isolat bakteri 3.3, 5.2, 9.1, 9.2 dan 11.1.P mampu menyebabkan gejala nekrosis, busuk lunak dan luka kebasahan pada beberapa bagian dari produk pascapanen Brassicaceae dengan persentase infeksi 56-78% sebagaimana ditampilkan pada Tabel 7. Gejala yang terbentuk pada uji patogenisitas bakteri terhadap produk pascapanen Brassicaceae sebagaimana terlihat pada Gambar 14-17.
Tabel 7 Uji patogenisitas bakteri pada produk pascapanen Brassicaceae Produk
pascapanen/kode isolat
Gejala Persentase
infeksi (%)
Kubis bunga Batang Busuk lunak
56
3.3 Bunga Busuk lunak
Caisim Batang Nekrosis
78
5.2 Tangkai daun Busuk lunak, nekrosis
Daun Luka kebasahan
Sawi manis Batang Busuk lunak, nekrosis
56
9.1 Tangkai daun Nekrosis
9.2 Batang Busuk lunak, nekrosis
56
Tangkai daun Nekrosis
Pakchoy Batang Busuk lunak
78
11.1.P Tangkai daun Nekrosis
Daun Luka kebasahan
25
Gambar 15 Uji patogenisitas pada caisim. Perlakuan kontrol (1 s/d 5): gejala tidak terbentuk pada: batang (1,2), tangkai daun (3,4), daun (5). Perlakuan isolat 5.2 (6 s/d 10): gejala busuk lunak: pada batang (6,7), tangkai daun (8,9), luka kebasahan pada daun (10)
26
Isolat bakteri 3.3, 5.2, 9.1, 9.2 dan 11.1.P bersifat patogen pada produk pascapanen Brassicaceae karena dapat menyebabkan gejala nekrosis, busuk lunak dan luka kebasahan pada produk tersebut dalam waktu 2 hsi.
Reisolasi
Reisolasi dilakukan terhadap daun kecambah yang bergejala dan diperoleh koloni bakteri 3.3 R, 5.2 R, 9.1 R, 9.2 R dan 11.1.P R yang memiliki karakter morfologi koloni dan respons hipersensitif (HR) yang sama dengan isolat bakteri yang digunakan untuk menginokulasi.
27 Identifikasi Bakteri
Pengujian fenotipik
Adapun hasil pengujian terhadap karakter fenotipik bakteri hasil isolasi dan reisolasi ditampilkan pada Tabel 8.
Tabel 8 Karakter fenotipik bakteri hasil isolasi dan reisolasi Kode
+: reaksi positif; -: reaksi negatif (tidak membentuk lendir/tidak menyerap warna safranin O,TD: tidak diuji
Isolat bakteri hasil isolasi maupun reisolasi adalah kelompok bakteri Gram positif karena tidak membentuk lendir saat koloni bakteri tersebut disuspensi dengan KOH 3% lalu diangkat menggunakan jarum ose. Hasil uji Gram dengan KOH 3% dikonfirmasi dengan pewarnaan Gram. Semua isolat bakteri berwarna ungu sampai kebiruan yang menunjukkan bahwa isolat bakteri tersebut adalah kelompok bakteri Gram positif.
Pewarnaan endospora terhadap isolat bakteri hasil isolasi dan reisolasi menunjukkan bahwa isolat bakteri tersebut membentuk endospora. Pada pewarnaan endospora ini, sel vegetatif bakteri akan berwarna merah sedangkan endospora berwarna hijau kebiruan. Bakteri Gram positif yang membentuk endospora adalah kelompok bakteri dari genus Bacillus dan Clostridium (Schaad 2001).
28
Gambar 18 Uji pertumbuhan anaerobik (tabung reaksi kiri media dengan parafin cari, kanan tanpa parafin): kontrol negatif (K), isolat 3.3; 3.3 R; 5.2; 5.2 R; 9.1; 9.1 R; 9.2; 9.2 R; 11.1.P; 11.1.P R (1 s/d 10) Isolat bakteri juga membentuk warna ungu saat diuji menggunakan kit uji reaksi oksidasi komersil yang menunjukkan bahwa isolat bakteri tersebut bersifat oksidatif. Bakteri yang bersifat oksidatif adalah bakteri yang menghasilkan cytochrome c oxidase yang mengoksidasi reagen tetramethyl-p-phenylenediamnie yang terdapat pada kit menjadi indophenols yang berwarna ungu. Bakteri yang bersifat oksidatif adalah bakteri yang bersifat aerob akan tetapi bukan aerob obligat.
Pengujian PCR dan sikuensing
DNA bakteri hasil isolasi maupun reisolasi teramplifikasi pada ukuran 1500 pasangan basa (pb) dengan menggunakan primer umum bakteri 16S rRNA dan penanda (marker) 1000 pb (Thermo Scientific). Hasil visualisasi DNA dapat dilihat pada Gambar 19.
Gambar 19 Visualisasi DNA bakteri: penanda DNA (M), isolat 3.3; 3.3 R; 5.2 R; 5.2 R; 9.1; 9.1 R; 9.2; 9.2 R; 11.1.P; 11.1.1 P R (1 s/d 10)
Amplikon isolat bakteri selanjutnya disikuensing untuk memperoleh urutan pasangan basa. Spesies padanan bakteri dicari menggunakan program BLAST berdasarkan sikuen DNA bakteri tersebut. Selanjutnya dipilih 10 teratas spesies padanan sebagaimana yang disajikan pada Lampiran 8.
Tabel 9 menunjukan spesies padanan yang paling mirip dengan sikuen isolat bakteri hasil isolasi maupun hasil reisolasi dengan pertimbangan persentase kemiripan, frekuensi spesies tersebut dalam 10 teratas spesies padanan, serta laporan penelitan terdahulu terhadap spesies padanan yang dilaporkan sebagai patogen tanaman.
29
30
PEMBAHASAN
Melalui uji blotter test ditemukan 5 spesies cendawan yang dikelompokkan menjadi kelompok cendawan lapangan (field fungi) yaitu Phoma lingam dan Curvularia lunata, cendawan penyimpanan (storage fungi) yaitu Aspergillus flavus dan A. niger, serta cendawan pada bahan rusak (advanced deterioration fungi) yang mengalami kerusakan lebih lanjut yaitu Chaetomium globosum (Atanda et al. 2013).
Cendawan yang dideteksi pada benih Brassicacea (kecuali P. lingam) juga dilaporkan berasosiasi pada benih padi, gandum, Cucurbitaceae, wortel, seledri, terong, kakao, mahoni, kusum dan benih tanaman yang menjadi bumbu masakan (Duan et al. 2007; Ora et al. 2011; Ismail et al. 2012; Baharuddin et al. 2013; Abdelwehab et al. 2014; Hossain et al. 2014; Srivastava 2014), namun belum ada penjelasan mengenai peranan masing-masing cendawan.
Beberapa kerusakan pada benih yang diamati dengan menggunakan metode blotter test ialah benih mati (tidak berkecambah) dalam keadaan keras ataupun busuk; perubahan warna benih; hambatan pertumbuhan kecambah dan nekrosis, yang dapat disebabkan oleh cendawan terbawa benih. Duan et al. (2007) menyatakan cendawan terbawa benih dapat menyebabkan benih berkerut atau perubahan warna pada benih. Cendawan A. flavus dan A. niger bersifat toksik dan cepat merusak benih, mampu menyebabkan busuk benih Brassicaceae (Khan et al. 2006). Hasil penelitian ini menunjukkan bahwa benih yang tidak tumbuh tidak hanya disebabkan rendahnya daya berkecambah atau mutu fisiologis benih yang buruk, tetapi dapat juga disebabkan oleh infeksi cendawan terbawa benih yang bersifat kontaminan maupun yang ada di dalam jaringan benih. Kerusakan yang disebabkan cendawan pada benih atau kecambah dapat tidak berkembang di lapangan, akan tetapi hal ini tetap penting karena cendawan tersebut dapat menurunkan kualitas kecambah sehingga lebih rentan pada patogen lain di lapangan. Hasil penelitian ini kembali menekankan pentingnya untuk memperhatikan status kesehatan benih sebagai persyaratan sebelum benih beredar di pasaran mengingat sampai sekarang belum ada regulasi yang mengatur status kesehatan benih di Indonesia.
Pada penelitan ini semua cendawan cenderung menyebabkan kematian benih, maupun kecambah pada uji patogenisitas, yang membuktikan cendawan tersebut bersifat patogen dan juga mendukung hasil uji blotter test dimana hampir semua cendawan dapat menyebabkan kematian pada benih dan menurunkan persentase daya berkecambah. Hal tersebut diduga infeksi cendawan pada benih menghasilkan metabolit sekunder yang bersifat toksik bagi benih maupun kecambah sehingga menyebabkan pembusukan dan kematian kecambah (Ora et al. 2011), toksin yang dihasilkan berperan dalam penghambatan pertumbuhan kecambah, perubahan warna, pelapukan benih (Howlett 2006).