SINTASAN BENIH UDANG WINDU YANG DIPELIHARA DENGAN BEBERAPA JENIS
PROBIOTIK RICA DAN RESISTENSINYA TERHADAP BAKTERI PATOGEN V. harveyi
Bunga Rante Tampangallo, Chalvyn S. Pakidi, dan Alexander Rantetondok Balai Penelitian dan Pengembangan Budidaya Air Payau Jl. Makmur Dg. Sitakka No. 129, Maros 90512, Sulawesi Selatan E-mail: [email protected]; [email protected]
ABSTRAK
Penelitian ini bertujuan untuk mengetahui sintasan larva udang windu yang dipelihara dengan menggunakan beberapa isolat bakteri probiotik dan resistensinya terhadap bakteri patogen Vibrio harveyi, serta menganalisis total hemosit, diferensiasi hemosit, fagositosis, aktivitas phenoloksidase sebagai bentuk respons imun larva yang dipelihara. Rancangan penelitian menggunakan rancangan acak lengkap (RAL) dengan empat perlakuan dan tiga ulangan. Penelitian terdiri atas 2 tahap; tahap pertama adalah pemeliharaan larva PL-4 selama 20 hari dengan menggunakan 12 bak fiber volume 120 L yang diisi air laut sebanyak 100 L dan kepadatan larva 15 ekor/L. Perlakuan menggunakan probiotik Bacillus licheniformis (A), Pseudoalteromonas (B), Brevibacillus (C), dan kontrol tanpa probiotik. Tahap kedua adalah uji tantang benur yang dihasilkan dari tahap pertama, 30 ekor benur PL-25 diambil dari setiap bak lalu dimasukkan dalam stoples yang telah diisi air laut steril 2 L/ stoples. Uji tantang menggunakan bakteri patogen V. harveyi kepadatan 106 CFU/mL/stoples. Peubah pengamatan meliputi sintasan, total hemosit, diferensiasi hemosit, aktivitas phenoloksidase, dan aktivitas fagositosis, diukur pada akhir penelitian. Total bakteri dan bakteri Vibrio, suhu, oksigen terlarut, nitrat, dan amoniak, diukur setiap 5 hari selama pemeliharaan tahap 1. Data yang diperoleh dianalisis ragam menggunakan ANOVA dan deskriptif dengan bantuan grafik. Hasil penelitian pada tahap 1 menunjukkan perlakuan tidak berpengaruh nyata terhadap sintasan pasca larva. Namun pada tahap 2 perlakuan A secara nyata dapat meningkatkan resistensi benur terhadap bakteri patogen V. harveyi (sintasan 82,22%) dengan nilai total hemolim 4,47±1,11 x 106 sel/mL, sel granular 23,6±2,0%; semi-granular 27,8±7,8%; Hialin
48,7±9,8%; fagositosis 75,0±11,74%; dan aktivitas phenoloksidase (PO) 0,023±0,023.
KATA KUNCI: probiotik RICA, sintasan, resistensi, pasca larva udang windu
PENDAHULUAN
Udang windu (Penaeus monodon) merupakan salah satu jenis udang asli dari perairan Indonesia. Udang ini digemari di seluruh dunia dan memiliki nilai ekonomis cukup tinggi, bahkan menjadi komoditas primadona dari Indonesia. Tetapi sejak 1995 produksi jenis udang ini mengalami penurunan karena adanya serangan penyakit pada areal pertambakan dan panti perbenihan (Yanto, 2006).
Saat ini telah diupayakan berbagai macam cara untuk menanggulangi/mencegah munculnya penyakit pada budidaya udang, antara lain dengan penggunaan probiotik (Mastantra et al., 2008; Muliani et al., 2003, Zokaei et al., 2009; Gunarto et al., 2008). Probiotik adalah istilah yang digunakan pada mikroorganisme hidup yang dapat memberikan efek baik atau kesehatan pada organisme kultivan. Beberapa jenis bakteri yang diketahui dapat berfungsi sebagai bakteri probiotik adalah Alteromonas sp. (Mastantra et al., 2008), Brevibacillus (Muliani et al., 2003), Carnobacterium sp. (Aslamyiah, 2006), Bacillus subtilis (Zokaei et al., 2009) dan sebagainya.
Beberapa jenis bakteri Bacillus, diketahui dapat menghambat pertumbuhan bakteri Vibrio harveyi yang menyerang larva di panti perbenihan dan mengakibatkan mortalitas larva hingga 100%. Penyakit yang disebabkan oleh bakteri Vibrio dikenal sebagai Vibriosis. Bacillus subtilis mempunyai kemampuan untuk menghambat bakteri Vibrio harveyii (Zokaei et al., 2009). Tampangallo et al. (2010), telah mengisolasi bakteri Bacillus subtilis dari makro alga yang diketahui mampu menghambat bakteri Vibrio secara in vitro dan Bacillus licheniformis yang mempunyai aktivitas urease positif.
Selain fungsinya sebagai penghambat bakteri Vibrio harveyi, beberapa peneliti meyakini bahwa penggunaan bakteri ini juga dapat memperbaiki sistem imun. Sistem pertahanan tubuh pada
invertebrata (termasuk udang) yang berperan adalah mekanisme pertahanan tubuh oleh hemosit, di mana penyebaran dan peningkatan jumlah hemosit diasumsikan sebagai bentuk dari respons imun seluler pada tubuh udang (Itami, 1994; Braak, 2002). Rantetondok et al. (2008) menggunakan probiotik Bacillus komersil dalam pemeliharaan larva udang vaname (Litopenaeus vannamei) dan memberikan sintasan yang lebih baik dibanding kontrol akan tetapi parameter imun belum memberikan hasil yang signifikan.
Beberapa jenis probiotik telah beredar di pasaran, baik dalam bentuk cair maupun serbuk, akan tetapi beberapa di antaranya telah mengalami penurunan populasi oleh karena waktu yang digunakan sejak dikemas, masuk ke dalam tata niaga hingga sampai ke petani cukup lama (Tampangallo et al., 2009). Oleh karena itu, pencarian bakteri probiotik lainnya dari daerah sekitar budidaya perlu dilakukan agar dapat menjadi kandidat probiotik yang dapat tumbuh dan berkembang dengan baik. Isolat probiotik yang berasal dari lokasi yang dekat dengan lingkungan budidaya kultivan akan lebih mudah beradaptasi sehingga memudahkannya tumbuh dan berkembang dengan baik. Probiotik telah banyak digunakan di tambak, seperti halnya beberapa isolat bakteri probiotik yang telah diisolasi oleh Muliani et al. (2003) dan Tampangallo (2010), akan tetapi isolat-isolat ini belum diujicobakan pada pemeliharaan larva di hatcheri.
Penelitian ini bertujuan untuk menganalisis total hemosit, diferensiasi hemosit, aktivitas fagositosis, aktivitas phenoloksidase, dan sintasan larva udang windu yang dipelihara dengan menggunakan beberapa isolat bakteri probiotik dan setelah uji tantang dengan bakteri Vibrio harveyi. Hasil penelitian ini diharapkan dapat digunakan sebagai alternatif penanggulangan Vibriosis di panti perbenihan sehingga penggunaan antibiotik dapat dikurangi.
BAHAN DAN METODE
Penelitian dilakukan pada bulan Maret-Juni 2012 melalui 2 tahap. Tahap 1 adalah pemeliharaan larva PL-4—PL-25 dengan menggunakan bakteri probiotik dan dilakukan di Instalasi Perbenihan Barru. Tahap 2 adalah uji tantang benur yang dihasilkan pada tahap 1 dengan bakteri Vibrio harveyii di Laboratorium Basah Kesehatan Ikan dan Lingkungan, Balai Penelitian dan Pengembangan Budidaya Air Payau Maros, Sulawesi Selatan. Penelitian dirancang dengan menggunakan rancangan acak lengkap (RAL) dengan empat perlakuan dan tiga ulangan. Perlakuan A menggunakan probiotik Bacillus licheniformis, B = Pseudoalteromonas, C = Brevibacillus, dan D = kontrol tanpa probiotik.
Tahap 1: Pemeliharaan Larva Udang Windu Perbanyakan Bakteri Probiotik
Isolat bakteri yang akan digunakan sebagai kandidat probiotik adalah stok bakteri probiotik Balai Penelitian dan Pengembangan Budidaya Air Payau yang telah diidentifikasi secara biokimia dan sequensing dengan menggunakan 16sRNA. Stok isolat bakteri tersebut masing-masing adalah Bacillus licheniformis (BM58) yang diisolasi dari makroalga, Pseudoalteromonas (BL542) yang diisolasi dari laut dan Brevibacillus (BT951) diisolasi dari tambak. Masing-masing stok isolat bakteri probiotik ini terlebih dahulu diremajakan di media TSA (Triptic Soy Agar) plate lalu diinkubasi selama 24 jam. Bakteri probiotik ini kemudian dipanen dan masing-masing diperbanyak dalam media Nutrien broth sebagai stok probiotik dengan cara diinkubasi selama 24 jam di atas shaker incubator. Stok bakteri probiotik inilah yang kemudian digunakan selama penelitian masing-masing sebanyak 100 mL/bak/perlakuan.
Hewan Uji
Hewan uji yang digunakan adalah pasca larva udang windu (P. monodon) stadia post larva 4 (PL-4). Hewan uji ini dipelihara dalam bak fiber ukuran 60 cm x 40 cm x 50 cm dan diisi air laut salinitas 29 ppt sebanyak 100 L, serta dilengkapi aerasi sebagai sumber oksigen. Kepadatan hewan uji adalah 15 ekor/L. Pemberian pakan berupa pakan alami Chaetocheros sp., pada pagi dan sore hari sebanyak 1 L/ bak. Pakan buatan diberikan sebanyak 0,4 mg/L dan frekuensi pemberian 4 kali sehari. Artemia diberikan pada pagi dan sore hari masing-masing sebanyak 1-3 g yang dibagi untuk semua bak (12 bak). Pemberian bakteri probiotik dilakukan setiap hari (Tampangallo et al., 2009) masing-masing sebanyak 100 mL/bak/perlakuan.
Tahap 2: Uji Tantang
Uji tantang post larva/benur PL-25 yang telah dipelihara pada tahap 1 dilakukan dengan cara mengambil secara acak 30 ekor benur dari masing-masing bak ke dalam stoples yang diisi air laut steril (menggunakan kaporit 150 mg/L dan telah bebas klorin) sebanyak 2 L. Benur ini kemudian diadaptasikan 2-3 jam dalam stoples lalu dipapar dengan bakteri Vibrio harveyii 5 x 106 CFU/mL. Pemberian pakan buatan (kode P0) dilakukan setiap pagi dan sore sebanyak ±10%BB. Pengamatan tingkah laku dan mortalitas dilakukan sejam kemudian lalu setiap 12 jam hingga hari ke-6. Sintasan dihitung pada akhir pengamatan.
Parameter yang Diukur Sintasan
Sintasan larva udang windu yang dipelihara dengan menggunakan probiotik dilakukan di akhir penelitian dengan menghitung total larva yang hidup demikian halnya pada tahap uji tantang benur terhadap bakteri V. harveyi. Sintasan dihitung dengan menggunakan rumus Effendi (1997):
di mana:
SR = tingkat sintasan
Nt = jumlah udang yang hidup pada akhir penelitian No = jumlah udang yang ditebar pada awal penelitian
Parameter Imun
Untuk mengetahui pengaruh dari penggunaan probiotik yang digunakan dalam pemeliharaan larva ini, maka dilakukan pengamatan terhadap beberapa parameter yang menggambarkan aktivitas dari sistem imun pada udang, baik pada tahap 1 maupun tahap 2, yaitu:
Total Hemosit
Total hemosit atau total haemocit count (THC) dilakukan dengan mengacu pada metode Chen et al. (2002) dalam Rantetondok et al. (2008). Larva udang windu dari masing-masing ulangan perlakuan probiotik dan setelah uji tantang (n=5 ekor) masing-masing dimasukkan ke dalam effendorf volume 1,5 mL yang telah berisi antikoagulan 400 µL (Na-sitrat 3,8%). PL kemudian digerus menggunakan pastel plastik lalu dihomogenkan dengan cara menggoyangkan tangan membentuk angka delapan. Hemolim diambil dengan cara memipet cairan gerusan tadi dan selanjutnya diteteskan ke hemositometer (Improved Neubauer type). Perhitungan total hemosit dilakukan dengan melakukan pengamatan di bawah mikroskop cahaya binokuler dengan pembesaran 100 kali.
Diferensiasi Hemosit
Diferensiasi hemosit atau diferensial haemosit count (DHC) dilakukan dengan mengacu pada Martin & Graves (1985). Hemolim diteteskan pada gelas obyek dan dibuat ulasan, kemudian dikeringkan di udara. Selanjutnya preparat difiksasi dengan metanol selama 5-10 rnenit kemudian dikeringkan di udara kembali. Preparat ini direndam dalam larutan pewarna Giemsa selama 15-20 menit lalu dicuci dengan air mengalir dan dibiarkan kering. Diferensiasi hemosit kemudian dihitung di bawah mikroskop dengan pembesaran 400 kali dengan mengidentifikasi jenis selnya. Jumlah hemosit dihitung hingga 100 sel dan ditentukan persentase tiap jenisnya.
Aktivitas Phenoloksidase
Aktivitas phenoloksidase (PO) diukur dengan menggunakan spektrofotometer merek Genesys. Pengamatan dilakukan dengan melihat perekaman pembentukan dopachrome yang dihasilkan dari L-dihydroxyphenil alanine (L-DOPA) dengan mengacu pada prosedur yang dijelaskan oleh Liu & Chen (2004). Hemolim disentrifuge dengan kecepatan 700 x g pada 4°C selama 20 menit. Cairan supernatan
100% x No Nt SR
dibuang dan pelet dibilas dengan 1 mL cocodilate-citrate buffer lalu disentrifuge lagi. Setelah selesai disentrifuge, pelet hemosit kemudian dilarutkan dengan cacodylate buffer dan dihomogenkan. Larutan kemudian dibagi dua masing-masing sebanyak 100 µL. Pada bagian yang pertama ditambahkan 50 mL tripsin sebagai elisator lalu diinkubasi selama 10 menit pada suhu 25°C, setelah itu ditambahkan 50 µL L-DOPA dan diinkubasi selama 5 menit. Cacodilate buffer ditambahkan sebanyak 800 µL sehingga volume akhir adalah 1 mL. Pada bagian kedua juga dilakukan hal yang serupa, hanya saja penambahan tripsin digantikan dengan cacodilate buffer. Kerapatan optik diukur menggunakan spektrofotometer, absorban 490 nm. Optical density (OD) dari aktivitas PO semua kondisi uji dinyatakan sebagai formasi dopachrome dalam 50 µL hemolim.
Aktivitas Fagositosis
Hemolim udang dimasukkan sebanyak 0,1 mL ke dalam effendorf dan dicampur secara merata dengan 25 µL bakteri Staphylococcus aureus dan diinkubasi selama 20 menit. Kemudian sebanyak 5 µL diteteskan pada objek glass dan dibuat preparat ulas. Selanjutnya difiksasi dengan metanol 100% selama 5 menit dan diwarnai dengan giemsa (10%) selama 15 menit. Preparat kemudian dialiri air secara perlahan selama kurang lebih 5 menit untuk membuang sisa warna giemsa. Pengamatan dilakukan di bawah mikroskop cahaya dengan pembesaran 400 x. Aktivitas fagositosis diukur berdasarkan persentase sel-sel fagosit yang menunjukkan proses fagositosis (Anderson & Siwicki, 1993).
Populasi Bakteri
Populasi bakteri dalam media pemeliharaan larva udang windu (tahap 1), baik total bakteri maupun populasi bakteri Vibrio dihitung pada awal penelitian selajutnya setiap 5 hari selama penelitian. Populasi bakteri diamati dengan mengambil 1 mL air media pemeliharaan lalu diencerkan secara bertingkat dengan menggunakan larutan fisiologis. Pengamatan total bakteri Vibrio dilakukan dengan menanam 0,1 mL sampel tanpa pengenceran dan pengenceran 10 ke atas media Thiosulfate Citrate Bile Sucrose Agar (TCBSA). Populasi bakteri umum diamati dengan menanam 0,1 mL sampel yang telah diencerkan hingga tingkat pengenceran 10-3 dan 10-4 ke atas media TSA (Triptic Soy Agar) plate.
Kualitas Air
Parameter kualitas air yang diamati adalah suhu, oksigen terlarut , salinitas, dan pH yang diukur dengan menggunakan alat YSI tipe 650 MDS. Nitrat dan amoniak diukur dengan menggunakan kit spektrofotometer.
Analisis Data
Data sintasan, total hemosit, diferensiasi hemosit, fagositosis, dan phenoloksidase yang diperoleh dianalisis dengan analisis ragam dan jika ada perbedaan dari nilai yang diperoleh maka dilanjutkan dengan uji Duncan (Steel & Torrie, 1993). Data bakteri dan kualitas air hanya dianalisis secara deskriptif.
HASIL DAN BAHASAN
Tahap 1: Pemeliharaan Larva Udang Windu
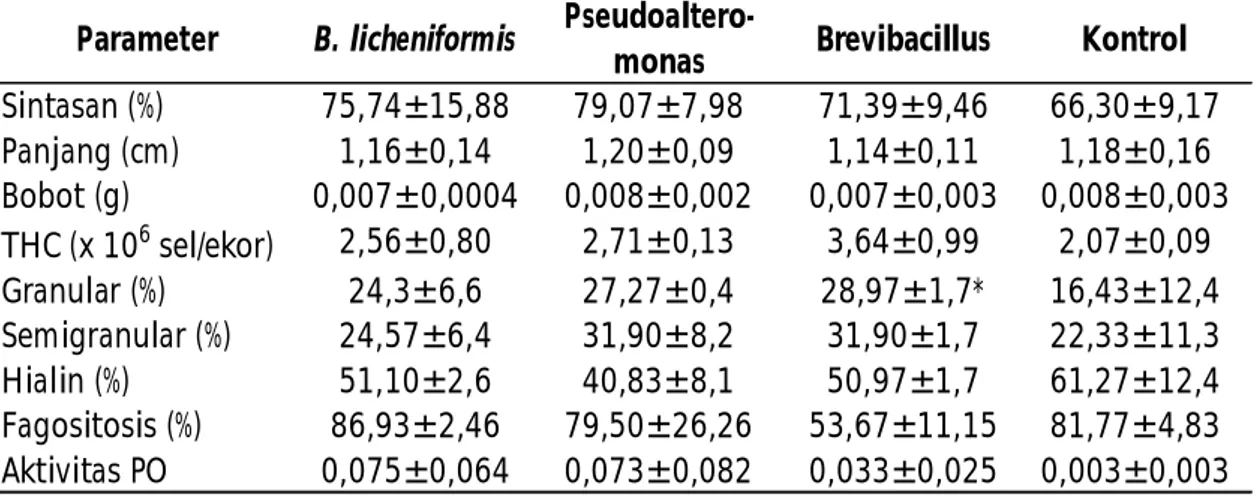
Hasil penelitian pada tahap I dapat dilihat pada Tabel 1. Terlihat bahwa pemberian beberapa isolat bakteri probiotik pada penelitian ini belum memberikan pengaruh yang nyata (P>0,05) terhadap sintasan benur yang dipelihara. Sintasan benur yang menggunakan probiotik Pseudoalteromonas adalah 79,07%; Bacillus licheniformis 75,74%, Brevibacillus 71,39%; dan kontrol 66,3%. Muliani et al. (2010) menggunakan kombinasi beberapa isolat probiotik dalam pemeliharaan larva PL-25 dalam akuarium yang dilapisi dengan sedimen tambak yang hanya mencapai 60,33% setelah dipelihara selama 3 bulan. Demikian halnya dengan yang ditemukan oleh Rengpipet et al. (2000), sintasan tertinggi adalah sekitar 60% setelah 30 hari memelihara benur PL-14. Lidaenni (2008) memelihara PL-10 dalam stoples kaca dengan menggunakan probiotik Vibrio SKT-b sebanyak 104 CFU/mL dengan sintasan mencapai 94,67%.
Pada penelitian ini ditemukan adanya kematian larva pada hari-hari terakhir masa pemeliharaan, di mana sebagian besar larva dalam bak yang kepadatan larvanya masih tinggi menempel di dinding bak pemeliharaan pada pagi hari. Penyebab menempelnya larva di dinding bak pemeliharaan kemungkinan disebabkan oleh karena padatnya larva dan tingginya amonia dalam bak pemeliharaan yakni pada hari ke-15 mencapai 3,785 mg/L pada perlakuan B. Amoniak ini berasal dari akumulasi media tumbuh probiotik yang digunakan (Nutrien broth) sehingga dilakukan penggantian air media pemeliharaan hingga 20% mulai hari ke-5 dan selanjutnya setiap hari. Hal lain yang dapat menjadi penyebab rendahnya sintasan yang didapatkan adalah adanya fluktuasi suhu dalam bak pemeliharaan. Suhu yang fluktuatif ini disebabkan karena wadah yang digunakan tidak terlalu dalam dan walaupun telah diantisipasi dengan menggunakan plastik, namun perbedaan suhu di pagi dan sore hari masih selisih 2°C. Fluktuasi suhu 1°C-2°C dapat menyebabkan perubahan kondisi media pemeliharaan dan mengakibatkan rendahnya respons larva udang memangsa pakan, blooming atau pengendapan plankton. Dampak selanjutnya adalah larva udang menjadi lemah sehingga infeksi sekunder dari bakteri berpendar dapat menyebabkan kematian (Wardana et al., 2008).
Performa benur yang dipelihara cukup baik yang ditandai dengan warna benur yang transparan, pergerakan gesit/lincah, ukuran cenderung seragam dengan panjang berkisar 1,0-1,314 cm dan bobot 0,0050-0,0114 g. Panjang total benur tertinggi diperoleh pada perlakuan pemberian probiotik Pseudoalteromonas (1,2 cm), diikuti kontrol (1,18 cm), B. licheniformis (1,16 cm), dan Brevibacillus (1,14 cm). Sedangkan bobot tertinggi diperoleh pada perlakuan pemberian probiotik Pseudoalteromonas dan kontrol (0,008 g) diikuti Bacillus licheniformis dan Brevibacillus (0,007 g). Perlakuan belum memberikan hasil yang signifikan (P>0,05) terhadap panjang dan bobot benur.
Respons imun benur pada tahap I juga dapat dilihat pada Tabel 1. Total hemosit pada perlakuan pemberian probiotik Brevibacillus adalah 3,64 x 104 sel/mL/ekor, Pseudoalteromonas 2,71 x 106 sel/mL/ ekor, Bacillus licheniformis 2,56 x 106 sel/mL/ekor dan kontrol 2,07 x 106 sel/mL/ekor namun belum memberikan pengaruh yang signifikan (P>0,05). Hemosit memegang peranan yang sangat penting dalam pertahanan tubuh udang dan dapat menjadi parameter untuk mengukur tingkat kesehatan udang (Braak, 2000). Total hemosit menggambarkan jumlah seluruh sel hemosit yang ada pada udang. Pemberian probiotik yang tepat dapat meningkatkan total hemosit sebagai salah satu parameter respons imun non-spesifik. Hal ini disebabkan adanya lipopolisakarida pada sel bakteri yang dapat meningkatkan respons imun non spesifik. Total hemosit udang vaname yang diberi beberapa jenis isolat probiotik berkisar 2,2-3,6 x 106 sel/mL dan berbeda nyata terhadap kontrol (Syahailatua, 2009). Rengpipat (2000) juga melaporkan total hemosit udang windu (P. monodon) berkisar 4,3-5,5 x 107 sel/ mL setelah dipelihara dengan menambahkan probiotik Bacillus S11 pada pakan yang digunakan. Hingga masa pemeliharaan selama 90 hari, total hemosit belum menunjukkan perbedaan yang signifikan walaupun dari segi sintasan menunjukkan perbedaan yang nyata (P<0,05) sejak 30 hari pengamatan. Total hemosit yang didapatkan pada penelitian ini masih berada pada kisaran yang
Tabel 1. Sintasan dan respons imun benur udang windu P. monodon setelah dipelihara selama dua puluh hari dengan menggunakan beberapa jenis probiotik RICA
Parameter B. licheniformis
Pseudoaltero-monas Brevibacillus Kontrol
Sintasan (%) 75,74±15,88 79,07±7,98 71,39±9,46 66,30±9,17 Panjang (cm) 1,16±0,14 1,20±0,09 1,14±0,11 1,18±0,16 Bobot (g) 0,007±0,0004 0,008±0,002 0,007±0,003 0,008±0,003 THC (x 106 sel/ekor) 2,56±0,80 2,71±0,13 3,64±0,99 2,07±0,09 Granular (%) 24,3±6,6 27,27±0,4 28,97±1,7* 16,43±12,4 Semigranular (%) 24,57±6,4 31,90±8,2 31,90±1,7 22,33±11,3 Hialin (%) 51,10±2,6 40,83±8,1 50,97±1,7 61,27±12,4 Fagositosis (%) 86,93±2,46 79,50±26,26 53,67±11,15 81,77±4,83 Aktivitas PO 0,075±0,064 0,073±0,082 0,033±0,025 0,003±0,003
normal. Hal ini berdasarkan pada pendapat Braak (2000) bahwa total hemosit udang normal adalah 104 sel/mL.
Hasil pengamatan terhadap aktivitas phenoloksidase setelah perlakuan pemberian probiotik selama 21 hari adalah 0,075 A pada pemberian probiotik Bacillus licheniformis, disusul probiotik Pseudoalteromonas (0,073 A); Brevibacillus (0,033 A); dan terendah kontrol (0,003 A) akan tetapi perlakuan probiotik belum memberikan hasil yang signifikan (P>0,05). Aktivitas phenoloksidase bertanggung jawab dalam penghancuran partikel asing atau patogen. Enzim ini diaktifkan oleh prophenoloksidase (proPO). ProPO akan mengaktifkan phenoloksidase untuk mengkatalisis oksidase fenol menjadi quinon yang selanjutnya akan mengarah pada pembentukan melanin (Braak, 2000). Aktivitas phenoloksidase dapat ditingkatkan dengan pemberian lipopolisakarida (LPS), peptidoglikan, ²-glukan (Soderhal & Cerenius, 1998). Chang et al. (2003) melaporkan bahwa pemberian ²-glukan dalam pakan yang diberikan kepada udang vaname selama 20 hari dapat meningkatkan aktivitas phenoloksidase serta fagositosis. Pemberian probiotik Bacillus sp. S11 pada pemeliharaan udang windu dapat meningkatkan aktivitas phenoloksidase dan memberikan efek yang signifikan pada masa pemeliharaan 30 hari namun tidak signifikan setelah 60 dan 90 hari masa pemeliharaan (Rengpipat et al., 2000). Penyuntikan isolat probiotik Vibrio sp. 8A, Vibrio alginolyticus 13GI, dan V. alginolyticus SKT-b pada udang vaname dapat meningkatkan aktivitas phenoloksidase setelah 10 hari masa pemeliharaan.
Sel hialin tertinggi ditemukan pada kontrol (61,3%), disusul penggunaan probiotik B. licheniformis (51,1%); Brevibacillus (51,0%); dan Pseudoalteromonas (40,8%). Diferensiasi hemosit merupakan pembagian jenis/tipe sel hemosit dalam hemolim udang. Secara umum hemosit pada krustasea terdiri atas 3 tipe sel, yakni sel hialin, sel granular, dan sel semigranular (Kakoolaki et al., 2011). Sel hialin dicirikan dengan ukuran yang lebih kecil dan tanpa granular. Sel granular ditandai dengan ukuran yang besar dan memilki granular dalam selnya sedangkan sel semi-granular mempunyai ciri seperti sel granular akan tetapi ukurannya cenderung lebih kecil. Tingginya sel hialin pada kontrol disebabkan adanya upaya dari benur yang dipelihara untuk mempertahankan diri terhadap tingginya total bakteri Vibrio (Gambar 8A). Populasi total bakteri ini tergolong cukup tinggi karena tidak diimbangi dengan keberadaan bakteri lainnya/bakteri probiotik.
Sel hialin merupakan tipe yang paling kecil dengan rasio nukleus sitoplasma tinggi dan bertanggung jawab dalam proses fagositosis (Johansson et al., 1989). Sel hialin biasa juga disebut sel darah mudah yang akan dilepaskan oleh inang bila terjadi serangan bakteri atau benda asing (Braak, 2000). Pemberian probiotik Bacillus sp. komersil pada benur udang vaname yang dipelihara selama 10 hari berkisar 24%-26% namun tidak berbeda nyata terhadap kontrol. Pemberian membran protein imunogenik MP38 yang diisolasi Zootammium penaei dapat meningkatkan total hemosit udang windu hingga 6,91 x 106 sel/mL (Mahasri, 2008).
Pada penelitian ini, persentase sel semigranular tertinggi ditemukan pada perlakuan dengan pemberian probiotik Pseudoalteromonas dan Brevibacillus (31,9%); Bacillus licheniformis (24,6 %); dan kontrol (22,3%). Sel granular tertinggi juga ditemukan pada benur yang dipelihara menggunakan probiotik Brevibacillus (29,0%) disusul Pseudoalteromonas (27,3%), Bacillus licheniformis (24,3%); dan terendah pada kontrol 16,4 %; akan tetapi hasil analisis ragam tidak menunjukkan perbedaan yang signifikan (P>0,05). Sel semi-granular dan sel granular berperan aktif dalam proses enkapsulasi, penyimpanan, dan pelepasan proPO, serta sitotoksisitas.
Aktivitas fagositosis tertinggi ditemukan pada perlakuan probiotik B. licheniformis 86,93%; disusul kontrol 81,77%; Pseudoalteromonas 79,50%; dan terendah Brevibacillus 53,67%. Fagositosis merupakan salah satu bentuk pertahanan selular. Proses fagositosis dimulai dengan pelekatan (attachment) dan penelanan (ingestion) partikel mikroba ke dalam sel fagosit. Sel fagosit kemudian membentuk vacuola pencernaan (digestive vacuola) yang disebut fagosom (Rodriquez & Le Moullac, 2000). Fagositosis dilakukan terutama oleh sel hialin dan semi-granular. Hasil pengamatan aktivitas fagosit ini cenderung sejalan dengan hasil pengamatan diferensial hemosit di mana sel hialin tertinggi ditemukan pada kontrol dan disusul oleh benur yang dipelihara menggunakan probiotik B. licheniformis. Hal ini menunjukkan bahwa sel hialin pada benur yang dipelihara dapat melakukan aktivitas dan fungsinya dengan baik. Syahailatua (2009) melaporkan aktivitas fagositosis udang yang diberi bakteri probiotik
berbeda nyata terhadap kontrol dan berkisar antara 9%-22%. Pemberian probiotik sebagai mikrosuplemen dalam pakan udang vaname sebanyak 3 mL/kg pakan dapat meningkatkan aktivitas fagositosis dibanding udang kontrol (Maria, 2010).
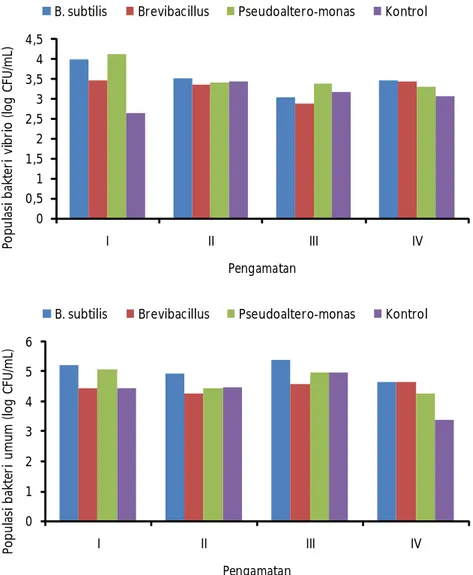
Populasi bakteri dalam bak selama penelitian dapat dilihat pada Gambar 1. Total bakteri Vibrio sp. tertinggi ditemukan pada perlakuan pemberian probiotik Pseudoalteromonas (1,379 x 104 CFU/ mL) disusul penggunaan probiotik B. licheniformis (1,035 x 104 CFU/mL), Brevibacillus (2,88 x 103 CFU/mL); dan terendah pada kontrol (0,44 x 103 CFU/mL) (Gambar 8a). Tingginya bakteri Vibrio sp. diawal pemeliharaan kemungkinan berasal dari benur dan kontaminasi dari pakan alami/plankton yang digunakan. Tingginya bakteri Vibrio sp. ini turut dipicu oleh sisa metabolisme benur dan media tumbuh bakteri probiotik yang juga dimasukkan ke dalam wadah sehingga populasi bakteri Vibrio di kontrol masih lebih rendah dibanding penggunaan probiotik. Pada pengamatan selanjutnya, populasi bakteri Vibrio sp. dalam bak pemeliharaan benur yang menggunakan probiotik cenderung menurun. Hal ini menandakan aktivitas bakteri probiotik yang digunakan masih dapat bekerja dengan baik. Pada umumnya koloni bakteri Vibrio yang diisolasi berwarna kuning dan hijau akan tetapi tidak ditemukan koloni bakteri berpendar.
Koloni bakteri Vibrio yang berpendar pada umumnya merupakan koloni bakteri yang berbahaya terhadap benur windu. Sejumlah spesies Vibrio yang dikenal sebagai bakteri patogen seperti V. alginolytikus, V. anguillarium, V. Carcharicae, V. cholerae, V. harveyi, V. ordalii, dan V. vulnificus (Irianto,
Gambar 1. Populasi bakteri dalam bak pemeliharaan benur selama penelitian (A) bakteri Vibrio sp. dan (B) total bakteri
0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 I II III IV Po p u la si b ak te ri v ib ri o ( lo g C FU /m L) Pengamatan
B. subtilis Brevibacillus Pseudoaltero-monas Kontrol
0 1 2 3 4 5 6 I II III IV Po p u la si b ak te ri u m u m ( lo g C FU /m L) Pengamatan
2003). Total bakteri Vibrio sp. dalam bak pemeliharaan udang windu dengan menggunakan bakteri probiotik Bacillus sp. S11 berkisar 6,4 x 104 sampai 1,0 x 105 CFU/mL.
Total bakteri umum/total plate count yang teramati pada penelitian ini berkisar 0,245 x 104 CFU/ mL sampai 1,710 x 105 CFU/mL. Populasi terendah teramati di kontrol di akhir pengamatan. Populasi total bakteri terbilang rendah oleh karena pemberian bakteri probiotik yang diberikan adalah masing-masing 106 sel/mL. Hal ini kemungkinan besar disebabkan oleh karena bakteri yang diberikan mengendap di dasar bak atau karena telah termakan oleh benur. Rengpipet et al., 2000 mendapatkan tingginya bakteri Bacillus sp. S11 pada usus dan feses udang uji, yakni mencapai 107 sel/mL.
Tahap 2 : Uji Tantang
Uji kerentanan benur terhadap infeksi patogen bertujuan untuk mengetahui resistensi benur terhadap bakteri patogen Vibrio harveyi. Hal ini juga dapat menjadi indikasi kualitas benur yang dihasilkan apabila dapat bertahan terhadap infeksi patogen. Tingkat resistensi benur yang dihasilkan dapat dilihat pada Lampiran 13. Resistensi benur setelah pemberian probiotik sudah berbeda nyata dengan kontrol.
Mortalitas benur mulai terjadi sejak satu jam setelah infeksi (jsi) bakteri patogen V. harveyii. Pada jam pengamatan selanjutnya kematian benur masih tetap berlanjut dan kematian terbanyak ditemukan mulai pada pengamatan 12 jam sampai pengamatan 48 jam. Fenomena kematian hewan uji yang diinfeksi patogen, khususnya Vibrio harveyi, pada umumnya sama, yakni kematian terbanyak terjadi setelah 24-48 jam setelah infeksi (Syahailatua, 2009; Manopo, 2011). Kematian hewan uji ini disebabkan oleh adanya gen hemolisin dan toxR pada bakteri Vibrio harveyi (Kadriah, 2012). Gen inilah yang memicu bakteri untuk menghancurkan sel darah.
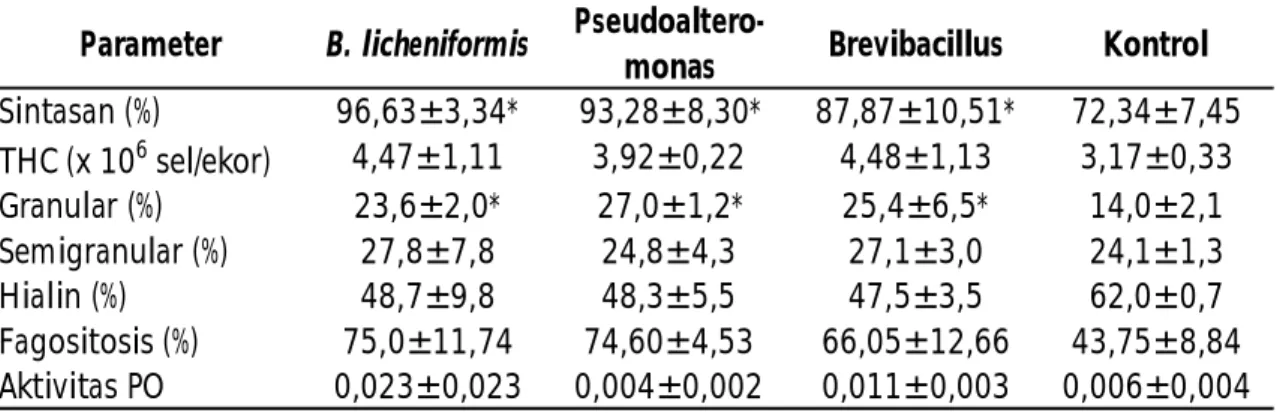
Sintasan udang windu tertinggi setelah 6 hari uji tantang ditemukan pada benur yang telah dipelihara dengan menggunakan probiotik Bacillus licheniformis 96,63%; disusul perlakuan probiotik Pseudoalteromonas 93,28%; Brevibacillus 87,87%; dan terendah juga pada kontrol 72,34% (Tabel 2).
Hasil analisis ragam menunjukkan adanya pengaruh nyata (P<0,05) dari perlakuan dan setelah diuji lanjut dengan menggunakan uji Duncan, pemberian probiotik B. licheniformis, Pseudoalteromonas, dan Brevibacillus berbeda nyata dengan pemeliharaan benur windu tanpa probiotik/kontrol (Lampiran 2). Hal ini menunjukkan pemberian ketiga jenis isolat probiotik pada penelitian ini dapat meningkatkan resistensi benur windu terhadap bakteri patogen Vibrio harveyi.
Tingginya sintasan ini disebabkan oleh adanya interaksi positif dari beberapa parameter imun. Sebagaimana diketahui bahwa sistem pertahanan tubuh pada krustase termasuk udang windu adalah pertahanan tubuh yang didominasi dilakukan oleh hemolim. Apabila ada patogen yang masuk dalam tubuh maka udang akan meningkatkan produksi hemolim di mana dalam hemolim akan terjadi aktivitas fagositosis oleh sel hialin dan semi-granular, penghancuran patogen oleh aktivitas phenoloksidase dan juga pengaktifan antibakteri oleh antimicrobial peptides (AMPs) seperti penaidins,
Tabel 2. Sintasan dan respons imun benur windu P. monodon setelah diinfeksi bakteri V. harveyi sebanyak 5 x 106 sel/mL
Parameter B. licheniformis
Pseudoaltero-monas Brevibacillus Kontrol
Sintasan (%) 96,63±3,34* 93,28±8,30* 87,87±10,51* 72,34±7,45 THC (x 106 sel/ekor) 4,47±1,11 3,92±0,22 4,48±1,13 3,17±0,33 Granular (%) 23,6±2,0* 27,0±1,2* 25,4±6,5* 14,0±2,1 Semigranular (%) 27,8±7,8 24,8±4,3 27,1±3,0 24,1±1,3 Hialin (%) 48,7±9,8 48,3±5,5 47,5±3,5 62,0±0,7 Fagositosis (%) 75,0±11,74 74,60±4,53 66,05±12,66 43,75±8,84 Aktivitas PO 0,023±0,023 0,004±0,002 0,011±0,003 0,006±0,004 *) berbeda nyata (P<0,05)
crustin, dan anti-lipopolysaccharide factors (ALFs) (Tassanakajon et al., 2011). Pada perlakuan dengan menggunakan probiotik Bacillus licheniformis, nilai aktivitas fagositosis, sel semi-granular, dan aktivitas phenoloksidase cenderung lebih tinggi dibandingkan dengan perlakuan lainnya (Tabel 1). Persentase sel semi-granular dapat menjalankan fungsinya dengan baik. Hal ini ditandai dengan tingginya aktivitas phenoloksidase dan fagositosis.
KESIMPULAN DAN SARAN Kesimpulan
Kesimpulan dari hasil penelitian ini adalah:
- Pada tahap I pemberian beberapa bakteri probiotik pada pemeliharaan benur udang windu sejak fase PL-4 selama 21 hari pemeliharaan belum memberikan hasil yang signifikan terhadap sintasan dan beberapa parameter imun larva seperti total hemosit, sel granular, dan aktivitas phenoloksidase. - Pada tahap 2 pemberian probiotik Bacillus licheniformis secara nyata (P<0,05) dapat meningkatkan resistensi benur yang dihasilkan (sintasan 96,63±3,34%) oleh karena sel semi-granular, aktivitas phenoloksidase, dan fagositosis lebih tinggi dibanding pemberian probiotik Pseudoalteromonas dan Brevibacillus serta kontrol.
Saran
Berdasarkan hasil penelitian ini maka disarankan untuk menguji beberapa tingkat konsentrasi probiotik yang digunakan untuk melihat efikasi pemberian probiotik pada larva dan metode pemberian yang sesuai untuk aplikasi probiotik ini di hatcheri/perbenihan.
DAFTAR ACUAN
Amri, K. 2003. Budidaya udang windu secara intensif. Agromedia Pustaka. Jakarta.
Anderson & Siwicki, A.K. 1993. Basic haematology and serology for fish health program. Paper Presented. In Second Symposium on Desease in Asian Aquaculture “Aquatic Animal Health and the enviroment”. Phuket, Thailand. 25-29th October 1993.
Anonim. 2011. Wikipedia. Diakses tanggal 20 Desember 2011.
Aslamyiah, S. 2006. Penggunaan mikroflora saluran pencernaan sebagai probiotik untuk meningkatkan pertumbuhan dan kelangsungan hidup ikan bandeng (Chanos chanos Forskal). Institut Pertanian Bogor.
Baratawidjaja, C. 2004. Imunologi Dasar. Balai Penerbit Fakultas Kedokteran Universitas Indonesia. Jakarta.
Blaxhall, P. & Daishley, K. 1973. Some Blood Parameters of the Rainbow Trout I. The Kamloops variety. J. Fish. Biol., 5: 1-8.
Boer, D.R., Zafran, & Ahmad, T. 1993. Penanggulangan penyakit udang windu (Penaeus monodon) di panti benih. hlm. 9-12.
Braak, V.D. 2002. Haemocytic defence in black tiger shrimp (Penaeus monodon). Disertation. van wareningan Universiteit, Germany.
Buchanan, R.E. & Gibbons, N.E. 1974. Bergey’s manual of Determinative Bacteriology. Eight Edition. The williams and Wilkins Company, Baltimore.
Cerenius, L. & Soderhall, K. 2004. The prophenoloxidase-actovating system in invertebrates. Immunol Rev., 198: 116-26.
Chang, C.F., Chen, H.Y., Su, M.S., & Liao, I.C. 2003. Immunomodulation by dietary ²-1,3-glucan in the brooders of the black tiger shrimp Penaeus monodon. Fish Shellfish Immunol., 10: 505-514.
Chen, T.T. 2000. Aquaculture biotechnology and fish disease. In Hardjito, L. (Ed.), International Symposium on Marine Biotechnology. Center For Coastal and Marine Resources Studies, IPB, Jakarta, Indonesia, p. 3-8.
Cheng, W., Liu, C.H., Yeh, S.T., & Chen, J.C. 2004. The immunstimulatory effect of sodium alginate on the white shrimp Litopaneus vannamei and its resistance against Vibrio alginolyticus. Fish and shellfish immunology, 17: 41-51.
Defoirdt, T., Boon, N., Sorgeloos, P., Verstraete, & Bossier, P. 2007. Alternatives to antibiotics to control bacterial infections: luminescent Vibriosis in aquaculture as an example. Trends in Biotechnology, 25(10): 472-479.
Effendi, I. 1997 Biologi perikanan. Yayasan Pustaka Nusatama. Yogyakarta.
Feliatra. 2002. Implementasi dan pengembangan bioteknologi kalutan dalam upaya optimalisasi pemanfaatan laut Indonesia. Makalah dalam Pengukuhan Guru Besar. Fakultas Perikanan dan Ilmu Kelautan Universitas Riau, Pekanbaru, 5 November 2002.
Gomez-Gil, B., Ana Roque., & James, F.T. 2000. The use and selection of probiotic bacteria for use in the culture of larval aquatic organisms. Aquaculture, 191: 259–270.
Gunarto, et al. 2008. Budidaya udang vaname Litopenaeus vannamei pola semi intensif dengan aplikasi beberapa jenis probiotik komersial. J. Ris Akuakultur, 3(3).
Huang, X., Tiang, B., Niu, Q., Yang, J., Zhang L., & Zhang, K. 2005. An extracellular protease from Brevibacillus laterosporus G4 without parasporal crystals can serve as a pathogenic factor in infection of nematodes. Research in Mikrobiology, 156: 719-727.
Irianto, A. 2003. Probiotik akuakultur. Gadjah Mada University Press. Yogyakarta.
Irianto, A., Iriyanti, N., & Handrati, P.M. 2010. Pengaruh pakan alami perifiton yang diinduksi probiotik terhadap pertumbuhan ikan tilapia (Oreochromis niloticus). Aquacultura Indonesiana, 11(2): 89-93. Isnansetyo, A. 2005. Bakteri antagonis sebagai probiotik untuk pengendalian hayati pada akuakultur.
ISSN: 0853-6384. Jurusan Perikanan. Fakultas Pertanian. UGM. Yogyakarta. Jurnal Perikanan. VII(1). Itami, T. 1994. Body defense system of penaid shrimp. Seminar on Fish Physiology and Prevention of Epizootics, Departement of Aquaculture and Biology, Shimonoseki University of Fisheries. Japan, 7: 59-65.
Jack, R.W., Tagg, J.R., & Ray, B. 1995. Bacteriocins of gram-positive bacteria. Microbiological Review, 59(2): 171-200.
Jasmanindar, Y. 2009. Penggunaan ekstrak Gracilaria verucossa untuk meningkatkan sistem ketahanan udang Vannamei litopenaeus. Sekolah Pasca Sarjana. Institut Pertanian Bogor. 55 hlm.
Johanson, M.W. & Soderhall, K. 1989. Celluler immunity in crustacean and the prosystem. Parasitology Today, 5(6): 171-176.
Lavilla-Pitogo, C.R., Baticados, M.C.L., Cruz-Lacierda, E.R., & Pena, L.D. 1990. Occurrence of luminous bacterial disease of Penaeus monodon larvae in the Philippines. Aquaculture, 91:1–13.
Lidaenni, M.A. 2008. Pengaruh pemberian bakteri probiotik Vibrio SKT-b dengan dosis yang berbeda terhadap kelangsungan hidup dan pertumbuhan larva udang windu Penaeus monodon Fab. Skripsi. Program Studi Teknologi dan Manajemen Akuakultur Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor.
Liu, C.H. & Chen, J.C. 2004. Effect of ammonia on the immune respons of white shrimp Litopenaeus vannamei and susceptibility to Vibrio alginolyticus. Fish and Shelfish Imunology, 16:321-334.
Kadriah, I.A.K. 2012. Analisis keragaman morfologi, fisiologi dan genetik serta uji patogenitas Isolat-isolat Vibrio sp. Tesis. Sekolah Pascasarjana Institut Pertanian Bogor. Bogor, 127 hlm.
Kakoolaki, S., Soltani, M., Ebrahimzadeh, M.H.A., Sharifpour, I., Mirzargar, S., Afsharnasab, M., & Motalebi, A.A. 2011. The effect of different salinities on mortality and histopathological changes of SPF imported Litopenaeus vannamei, experimentally exposed to white spot virus and a new defferential hemocyte staining method. Iranian Jour. of Fisheries Sciences, 10(3): 447-460.
Kamei, Y., Yodhimizu, M., Ezura, Y., & Kimura, T. 1988. Identification of Pseudomonas sp. 46 NW-04 wich produces antiviral agent againts fish viruses. Bull. Fac. Fish. Hokaido Univ., 39(2): 124-132. Karunasagar, I., Pai, R., Malathi, G.R., & Karunasagar, I. 1994. Mass mortality of Penaeus monodon
larvae due to antibiotic-resistant Vibrio harveyi infection. Aquaculture, 128: 203–209.
Manopo, H. 2011. Peran nukleotida sebagai Imunostimulan terhadap respon imun non-spesifik dan resistensi udang vaname (Litopenaeus vannamei). Tesis. Sekolah Pascasarjana Institut Pertanian Bogor. Bogor, 121 hlm.
Mahasri, G. 2008. Respons imun udang windu (Penaeus monodon Fabricus) yang diimunisasi dengan protein membran imunogenik MP38 dari Zootammium penaei. Makalah disampaikan pada Seminar
Nasional Kelautan dan Perikanan. Universitas Brawijaya. hlm. III-22-III-28.
Maria. 2010. Pemberian probiotik migrosuplemen dalam pakan terhadap kelulushidupan dan aktivitas fagositosis udang vaname L. vannamei yang diinfeksi dengan bakteri Vibrio sp. Tesis. Universitas Muhammadiyah Malang.
Martin, G.G. & Graves, L.B. 1985. Structur and classification of shrimp haemocytes. J. Morfology. 185: 339-348.
Mastantra, I.K. & Suriadnyani. 2008. Pemeliharaan larva udang vannamei (Litopenaeus vannamei) dengan penambahan probiotik Alteromonas sp. BY-9. Bul. Tek. Lit. Akuakultur, 7(2).
Muliani, Suwanto, H.S., & Hala, Y. 2003. Isolasi dan karakterisasi bakteri asal laut Sulawesi untuk biokontrol penyakit Vibriosis pada larva udang windu (Penaeus monodon Fab.). Jurn. Hayati, 10(1): 6-11.
Muliani, Nurbaya, & Atmomarsono, M. 2006. Penapisan bakteri yang diisolasi dari tambak udang sebagai kandidat probiotik pada budidaya udang windu, Penaeus monodon. J. Ris. Akuakultur, 1(1): 73-85.
Muliani, Nurbaya, & Tampangallo, B.R. 2008. Pengaruh rasio bakteri probiotik terhadap perubahan kualitas air dan sintasan udang windu Penaeus monodon dalam akuarium. J. Ris. Akuakultur, 3(1): 33-42.
Muliani, Nurbaya, & Kadriah, I.A.K. 2009. Peubah kualitas air dan kelulus hidupan udang windu (P. monodon) pada penggunaan probiotik yang diisolasi dari sedimen laut, tambak dan daun. Muliani, Nurbaya, & Atmomarsono, M. 2010. Penggunaan probiotik pada pemeliharaan udang windu
(P. monodon) dengan dosis pakan yang berbeda. Prosiding Forum Inovasi Teknologi Akuakultur. hlm. 249-259 mangrove. J. Aquacultura Indonesiana, 10(1): 25-34.
Prayitno, S.B. & Latchford, J.W. 1995. Experimental infections of crustaceans with luminous bacteria related to Photobacterium and Vibrio – effect of salinity and pH on infectiousity. Aquaculture, 132: 105–112.
Radjasa, O.K., Martens, T., Grossart, H., Sabdono, A., Simon, M., & Bachtiar, T. 2005. Antibacterial property of a coral-associated bacterium Pseudoalteromonas luteoviolacea against shrimp pathogenic Vibrio harveyi (In vitro study). J. Hayati, 12(2): 77-81.
Rahayu, Tb.H., Gandjar, I., Sjamsuridzal, W., Riani, E., Pasaribu, F.H., Malole, M.B.M., & Djunaidin, I.S. 2008. Seleksi bakteri probiotik untuk meningkatkan kesehatan udang vaname (Litopenaeus vannamei) terhadap tingkat penetasan kista Artemia. Aquacultura Indonesiana, 9(1): 17-24.
Rantetondok, A., Anshary, H., & Galugu, A. 2008. Pengaruh probiotik bacillus plus-1 pada dosis berbeda terhadap kualitas air, bakteri Vibrio, sintasan dan total haemocyte post larva udang vaname (Litopenaeus vannamei). J. Torani, 18(4).
Rao, A.V. 2008. Vibriosis in shrimp aquaculture. A review Article. http://www.neospark.com/images/ VIBRIOSIS.pdf.
Rengpipat, S., Rukpratanporn, S., Piyatiratitivorakul, S., & Menasaveta, P. 2000. Immunity enhancement in black tiger shrimp (Penaeus monodon) by a probiont bacterium (Bacillus S11). Aquaculture, 191: 271-288.
Rodriguez, L. & Le Moullac, G. 2000. State of the art of immunological tools and health control of penaeid shrimp. Aquaculture, 191: 109-119.
Saikia, R.D., Gogoi, K., Mazumder, S., Yadav, A., Sarma, R.K., Bora, T.C., & Gogoi, B.K. 2011. Brevibacillus laterosporus strain BPM3, a potential biocontrol agent isolated from a natural hot water spring of Assam, India. Microbiological Research, 166: 216-225.
Singleton, P. 1992. Introduction to bacteria for student of biology bioteknologi and medicine. Academy Press, Inc. New York.
Sivasubramanian, K., Ravichandran, S., & Vijayapriya, M. 2011. Antagonistic activity of marine bacteria Pseudoalteromonas tunicata against microbial pathogens. African Journal of Microbiology Research., 5(5): 562-567.
Soderhall, K. & Cerenius, L. 1992. Crustacean immunity. Annual. Rev. of Fish Diseases. p. 3-23.
immunity. Curr. Opin. Immunol., 10: 23-28.
Steel, R.G. & Torrie, J.H. 1993. Prinsip prosedur statistika. Terjemahan oleh Bambang Sumantri. Gramedia. Jakarta, hlm. 425-478.
Suprapto, H. 2005. Studi pendahuluan Bacillus sp. sebagai probiotik untuk mengurangi jumlah bakteri Vibrio sp. pada hepatopankreas dan air pemeliharaan udang windu (Penaeus monodon).. Departemen Perikanan. Fakultas Kedokteran Hewan. Universitas Airlangga. ISSN: 0853-6384. Jurnal Perikanan, VII(I): 54-59.
Sukenda, Hadi, P., Rahman, & Harris, E. 2008. Pengaruh penambahan karbon dan probiotik terhadap profil bakteri dan kualitas air pada budidaya udang vaname (L. vannamei). Aquacultura Indonesiana, 9(3): 135-141.
Syahailatua, D.Y. 2009. Seleksi bakteri probiotik sebagai stimulator sistem imun pada udang vaname Litopenaeus vannamei. Tesis. Sekolah Pascasarjana Institut Pertanian Bogor. Bogor, 58 hlm.
Tahuk, M. 2008. Penggunaan ekstrak Padina australis dalam pengendalian Vibrio harveyi pada udang windu (Penaeus monodon). Skripsi (Tidak dipublikasikan) Universitas Nusa Cendana. Kupang.
Takebe, F., Hirota, K., Nodasaka, Y., & Yumoto, I. 2011. Brevibacillus nitrificans sp. nov., a nitrifying bacterium isolated from a microbiological agent for enhancing microbial digestion in sewage treatment tanks. Int. J. Syst. Evol. Microbiol.
Tampangallo, B.R., Muliani, & Nurbaya. 2009. Pengamatan populasi bakteri probiotik pada suhu penyimpanan yang berbeda. Prosiding Forum Inovasi Teknologi Budidaya Perikanan. Surabaya. Tampangallo, B.R., Atmomarsono, M., & Lante, S. 2009. Frekuensi pemberian probiotik BT-951 pada
pemeliharaan udang pama (Penaeus semisulcatus). Prosiding Seminar Perikanan Nasional. Sekolah Tinggi Perikanan. Jakarta.
Tampangallo, B.R. & Nurhidayah. 2010. Pemantauan populasi bakteri pada beberapa jenis rumput laut. Prosiding Seminar Perikanan Nasional. Universitas Hang Tuah. Surabaya.
Tassanakajon, A., Amparyup, P., Somboonwiwat, K., & Supungul, P. 2011. Cationic antimicrobioal peptides in penaeid shrimp. Marine Biotechnology Jour., 13: 639-657.
Tizard, I.R. 1988. Pengantar imunologi veteriner (Terjemahan). Airlangga University Press. Surabaya. Tjahyadi, M.R., Angka, S.L., & Suwanto, S. 1994. Isolation and evolution of marine bacteria for biocontrol of liminous bacterial diseases in tiger shrimp larvae (Penaeus monodon Fab.) AS Pac. J. Mol. Biol Biotechnol., 2: 347-352.
Vargas-Albores, F. & Yepiz-Plascencia, G. 2000. Beta glucan binding protein and its role in shrimp immune response. Aquac., 191: 13-21.
Wang, X. & Dickerson, H.W. 2002. Surface immobilization antigen of the parasitic ciliate Ichtyophthirius multifiliris elicits protective immunity in channel catfish (Ictalurus punctatus). Athens, georgia. Clinical and diagnostic laboratory immunology, 9(1): 178-181.
Wyban, J.A. & Sweeney, J.N. 1991. Intensive shrimp production technology. The Ocean Institute Honolulu, Hawai.
Yanto, H. 2006. Dignosa dan identifikasi penyakit udang asal tambak intensif dan panti benih di Kalimantan Barat. Jurnal Penelitian Sains dan Teknologi, 7(1).
Zokaei, H.F., Saad, C.R.B, Daud, H.M., Sharr Azni Harmin, S.A., & Shakibazadeh, S. 2009. Effect of Bacillus subtilis on the growth and survival rate of shrimp (Litopenaeus vannamei). African Journal of Biotecnoogy, 8(14).
Zong, Z., Liu, K., Lu, C., Yu, J., Ju, R., & Xunli, L. 2011. Isolation and characterization of a potential biocontrol Brevivacillus laterosporus. African Journal of Microbiology Research, 5(18): 2,675-2,681.