METABOLIT CENDAWAN ENDOFIT
UNTUK MENGENDALIKAN CENDAWAN PATOGEN
TERBAWA BENIH CABAI (
Capsicum annuum
L.)
DEWI NOVINA SUKAPIRING
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Metabolit Cendawan Endofit untuk Mengendalikan Cendawan Patogen Terbawa Benih Cabai (Capsicum annuum L.) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
DEWI NOVINA SUKAPIRING. Metabolit Cendawan Endofit untuk Mengendalikan Cendawan Patogen Terbawa Benih Cabai (Capsicum annuum L.). Dibimbing oleh BONNY POERNOMO WAHYU SOEKARNO dan TITIEK SITI YULIANI
Cabai (Capsicum annuum L.) merupakan salah satu komoditas hortikultura penting di Indonesia karena memiliki nilai konsumsi yang tinggi. Infeksi cendawan patogen terbawa benih merupakan salah satu kendala yang menyebabkan rendahnya produksi cabai. Cendawan patogen terbawa benih cabai umumnya adalah Aspergillus flavus, A. niger, A. fumigatus, Alternaria alternata, F. oxysporum, dan F. solani. Cendawan cendawan tersebut menjadi sumber inokulum utama penyebab penyakit di lapangan. Salah satu pengendalian yang ramah lingkungan adalah dengan menggunakan cendawan endofit. Cendawan endofit telah diketahui menghasilkan metabolit yang dapat menghambat pertumbuhan cendawan patogen. Penelitian ini bertujuan untuk mengetahui kemampuan metabolit cendawan endofit yang dapat menghambat pertumbuhan cendawan patogen terbawa benih cabai.
Penelitian dilakukan di Laboratorium Balai Proteksi Tanaman Pangan dan Hortikultura Medan, Sumatera Utara dan Laboratorium Mikologi Tumbuhan Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Metode penelitian yang digunakan dengan 5 tahapan, yaitu 1) isolasi cendawan endofit dari tanaman cabai, 2) isolasi cendawan patogen terbawa benih cabai, 3) seleksi cendawan endofit dengan uji patogenisitas, 4) uji in vitro metabolit dan 5) uji in vivo perlakuan perendaman benih pada metabolit cendawan endofit potensial.
Hasil penelitian menunjukkan bahwa hasil isolasi cendawan endofit dari akar, batang, daun, dan benih tanaman cabai diperoleh 42 isolat cendawan endofit, dan 12 isolat non patogen diperoleh dari hasil patogenisitas. Hasil uji antagonis dari 12 isolat non patogen diperoleh 4 isolat mampu menghambat pertumbuhan 3 isolat cendawan patogen terbawa benih cabai. Hasil uji metabolit 4 isolat cendawan endofit potensial, 2 isolat diantaranya menunjukkan daya hambat yang tinggi terhadap pertumbuhan ketiga cendawan patogen pada konsentrasi 20%. Hasil analisis metabolit 2 isolat cendawan endofit tersebut yaitu CECL 40 dan CECL 38 menunjukkan metabolit mengandung senyawa bersifat antimikrobial. CECL 40 dan CECL 38 dapat mengendalikan patogen terbawa benih cabai setelah perlakuan perendaman benih dan penyimpanan selama 0, 1, 2, 3, 4 minggu.
Adanya penurunan tingkat infeksi cendawan patogen terbawa benih cabai, pada benih direndam dengan metabolit bila dibandingkan dengan kontrol negatif. Daya hambat infeksi CECL 40 tertinggi terhadap Fusarium solani, Aspergillus niger dan Aspergillus fumigatus sebesar 87.5%, 80% dan 57.5% dan daya hambat infeksi CECL 38 tertinggi terhadap F. solani, A. niger dan A. fumigatus sebesar 87.5%, 70%, 55% secara berturut-turut. Hasil identifikasi isolat cendawan endofit CECL 40 adalah hifa steril dan CECL 38 adalah Paecilomyces sp.
iv
Cendawan patogen tersebut adalah A. fumigatus, A. niger, F. solani, A. flavus, Penicillium sp., Curvularia sp. dengan tingkat infeksi yang berbeda. Aplikasi perendaman benih dengan metabolit cendawan endofit dapat menurunkan tingkat infeksi cendawan patogen terbawa benih, dan metabolit cendawan endofit telah diketahui pula menghasilkan senyawa bersifat antimikrobial
SUMMARY
DEWI NOVINA SUKAPIRING. Metabolite of Endophytic Fungi in Controlling Seed-Borne Pathogen Fungi of Chili Seed (Capsicum annuum L.). Supervised by BONNY POERNOMO WAHYU SOEKARNO and TITIEK SITI YULIANI
Chili (Capsicum annuum L.) is an important horticultural commodity due to it’s high demand of consumption. Infection of seed-borne fungi is one of limiting factor in chili production. Some of common seed-borne fungi are Aspergillus flavus, A.niger, A.fumigatus, Alternaria alternata, Fusarium oxysporum, and F.solani. Infestated seeds play role as inoculum source which led to disease incidence in growing season. Endophytic fungi has been strongly suggested as alternative controlling method of seed-borne pathogen. Endophytic fungi produced metabolite which may inhibit growth of pathogenic fungi. This research was aimed to evaluate potential using of metabolite from endophytic fungi in inhibiting the growth of seed-borne pathogen in chili.
This research was conducted in laboratory of “Balai Proteksi Tanaman Pangan dan Hortikultura”, Medan, North Sumatera dan Mycology Laboratory, Department of Plant Protection, Bogor Agricultural University. This research had 5 steps: 1) Isolation of endophytic fungi from health chili plant, 2) Isolation of seed-borne pathogen from chili, 3) Selection of endophytic fungi by pathogenicity test, 4) in vitro assay of metabolites, and 5) in vivo assay by chili seed soak in suggested endophytic fungi.
This research have obtained 42 endophytic fungi from chili’s roots, stem, leaves, and seeds and 12 endophytic isolates were selected due to the negative result in pathogenicity test. Antagonism test provided information that 4 isolates were successfully inhibiting growth of 3 main seed-borne fungi of chili. From the 4 selected isolates, the highest inhibition rate was shown by 2 isolates in 20% concentration. The 2 isolates is CECL 40 and CECL 38 were further analyzed and they produced antimicrobial compound. CECL 40 and CECL 38 were effectively controlled seed-borne pathogen of chili which were carried out by seed soaked 40 is steril mycelia and CECL 38 is Paecilomyces sp.
The local chili seed from Berastagi, Medan Sumatera Utara has clearly proven been infected by seed-borne pathogens such as A. fumigatus, F. solani, A. flavus, Penicilllium sp., and Curvularia sp. in different rate of infection. Seed soaked metabolites of endophytic fungi may decrease seed-borne disease incidence and metabolite of endophytic fungi has clearly proven been produced antimicrobial compound.
vi
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Fitopatologi
METABOLIT CENDAWAN ENDOFIT
UNTUK MENGENDALIKAN CENDAWAN PATOGEN
TERBAWA BENIH CABAI (
Capsicum
annuum
L.)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
ii
Judul Tesis : Metabolit Cendawan Endofit untuk Mengendalikan Cendawan Patogen Terbawa Benih Cabai (Capsicum annuum L.)
Nama : Dewi Novina Sukapiring NIM : A352130081
Disetujui oleh
Komisi Pembimbing
Dr Ir Bonny PW Soekarno, MS Ketua
Dr Ir Titiek Siti Yuliani, SU Anggota
Diketahui oleh
Ketua Program Studi Fitopatologi
Prof Dr Ir Sri Hendrastuti Hidayat, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
iv
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala atas limpahan rahmat dan karunia-Nya sehingga penulisan tesis ini dapat diselesaikan. Shalawat dan salam senantiasa dicurahkan kepada nabi Muhammad SAW, sehingga penelitian dengan judul “Metabolit cendawan endofit tanaman cabai untuk mengendalikan cendawan patogen terbawa benih cabai (Capsicum annuum L.)” dapat diselesaikan.
Terima kasih penulis ucapkan kepada kedua orangtua, Bapak Sempakata Sukapiring dan ibu Violitta br Sembiring, abang Edi Kenalta, kedua adik tercinta Firman Eriko dan Rima Githa yang telah memberi perhatian, pengorbanan dan doa yang tidak ternilai untuk kesuksesan penulis. Ketua komisi pembimbing, Dr Ir Bonny Poernomo WS, MS dan anggota pembimbing Dr Ir Titiek Siti Yuliani, SU serta kepada penguji sidang tesis Dr Ir Elis Nina Herliyana, Msi yang telah banyak memberi saran, dan membantu penulis dalam menyelesaikan studi hingga akhirnya penulis bisa mendapatkan gelar master sains. Prof Dr Ir Sri Hendrastuti Hidayat, MSc selaku ketua program studi Fitopatologi, dan para dosen-dosen Fitopatologi atas arahan, ajaran dan bimbingannya kepada penulis.
Kepala Laboratorium Balai Proteksi Tanaman pangan dan Hortikultura, Bapak Norman dan para staf pegawai yang telah mengizinkan penulis untuk melakukan penelitian. Sahabat serta seluruh anggota Laboratorium Mikologi Tumbuhan IPB, Fitopatologi 2013 dan seluruh pihak yang tidak bisa disebutkan satu per satu atas segala ilmu dan kebaikan yang diberikan.
Semoga karya ilmiah ini bermanfaat.
Bogor, Oktober 2015
DAFTAR ISI
Benih dan Cendawan Patogen Terbawa Benih 4
Pengertian Mikroba Endofit 5
Metabolit Cendawan Endofit dan Pemanfaatannya 6
3 METODE 7
Waktu dan Tempat Penelitian 7
Isolasi Cendawan Endofit 7
Seleksi Cendawan Endofit
Isolasi Cendawan Patogen Terbawa Benih Cabai
7 8 Uji Penghambatan Cendawan Endofit terhadap Cendawan
Patogen 8
Produksi dan Analisis Senyawa Metabolit 9
Uji Metabolit Cendawan Endofit 9
Uji Perlakuan Perendaman Benih dengan Metabolit 9
4 HASIL DAN PEMBAHASAN 11
Isolasi dan Seleksi Cendawan Endofit 11
Isolasi Cendawan Patogen Terbawa Benih Cabai 12 Uji Dual Culture Cendawan Endofit terhadap Cendawan
Patogen 13
Uji Daya Hambat Metabolit Cendawan Endofit 14
Identifikasi Cendawan Endofit Potensial 17
Analisis Senyawa Metabolit 18
vi
5 SIMPULAN DAN SARAN 26
Simpulan 26
Saran 26
DAFTAR PUSTAKA 27
LAMPIRAN 34
DAFTAR TABEL
1 Cendawan patogen terbawa benih cabai 12
2 Daya hambat isolat cendawan endofit terhadap 3 isolat cendawan patogen terbawa benih pada pengamatan hari ke-5 13 3 Daya hambat metabolit cendawan endofit pada 3 taraf konsentrasi
terhadap pertumbuhan F. solani 15
4 Daya hambat metabolit cendawan endofit pada 3 taraf konsentrasi
terhadap pertumbuhan A. niger 15
5 Daya hambat metabolit cendawan endofit pada 3 taraf konsentrasi
terhadap pertumbuhan A. fumigatus 16
6 Hasil identifikasi isolat cendawan endofit potensial 18 7 Senyawa metabolit yang dihasilkan cendawan endofit isolat CECL
40 hasil Py-GC-MS 19
8 Senyawa metabolit yang dihasilkan cendawan endofit isolat CECL
38 hasil Py-GC-MS 20
9 Tingkat infeksi cendawan patogen pada benih cabai dengan metode
blotter test setelah perlakuan perendaman 21
10 Tingkat infeksi cendawan patogen pada benih cabai dengan metode
kertas gulung setelah perlakuan perendaman 22
11 Tingkat infeksi cendawan patogen pada benih cabai dengan water
agar setelah perlakuan perendaman 22
12 Pengaruh setiap perlakuan terhadap daya kecambah benih cabai
lokal selama 4 minggu pengamatan 24
DAFTAR GAMBAR
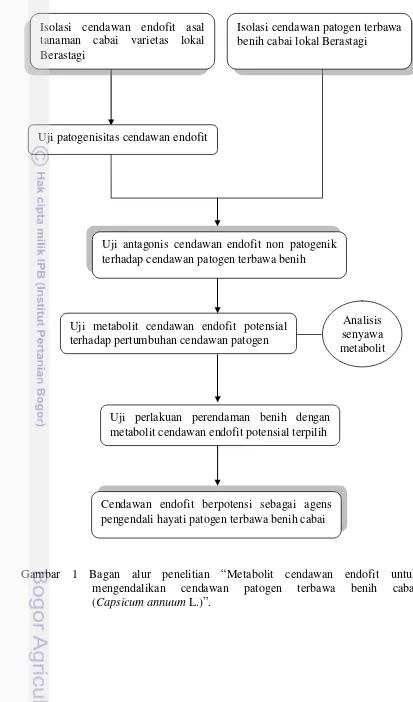
1 Bagan alur penelitian “Metabolit cendawan endofit tanaman cabai untuk mengendalikan cendawan patogen terbawa benih cabai
(Capsicum annuum L.)” 3
2 Ilustrasi uji antagonis cendawan endofit dengan cendawan patogen 8
3 Cendawan endofit pada benih cabai 11
4 Isolat murni cendawan patogen, makroskopis, dan mikroskopis A. fumigatus, F. solani, A. niger perbesar 40x10
12 5 Uji antagonis cendawan endofit CECL 19 (kiri) dan cendawan
patogen (kanan) A. fumigatus, F. solani, A. niger pada pengamatan hari ke-5
14 6 Pertumbuhan cendawan patogen: F. solani, A. niger, A. fumigatus
pada campuran media PDA dan tiga taraf konsentrasi metabolit
viii
7 Infeksi patogen terbawa benih cabai dapat menyebabkan: benih tidak berkecambah, kecambah nekrotik, kecambah mati, pada kertas
gulung, dan pada water agar 24
DAFTAR LAMPIRAN
PENDAHULUAN
Latar Belakang
Cabai merah (Capsicum annuum L.) merupakan komoditas sayuran yang memiliki nilai ekonomis cukup tinggi. Kebutuhan cabai meningkat setiap tahun sejalan dengan meningkatnya jumlah penduduk dan kebutuhan industri akan bahan baku cabai. Badan Pusat Statistik (2014) melaporkan produktivitas tanaman cabai mengalami peningkatan dari tahun 2013 hingga 2014. Tahun 2013 produksi cabai merah mencapai 1.01 juta ton meningkat pada tahun 2014 mencapai 1.07 juta ton. Sumatera Utara menjadi provinsi ketiga penghasil cabai merah terbesar sebesar 10.33% setelah Jawa Barat dan Jawa Tengah.
Tanaman cabai di Indonesia umumnya diperbanyak melalui biji. Benih merupakan struktur perbanyakan tanaman yang berasal dari biji yang dihasilkan dari perbanyakan generatif atau dari perbanyakan vegetatif secara klonal. Sebagai struktur perbanyakan tanaman, benih mempunyai hubungan dengan perkembangan dan penyebaran penyakit. Mutu benih yang digunakan merupakan faktor penting pada epidemiologi penyakit. Salah satu faktor yang menentukan mutu benih adalah bebas dari organisme pengganggu tanaman seperti cendawan, bakteri, virus, nematoda dan termasuk serangga (ISTA 2014). Salah satu faktor penyebab produktivitas tanaman cabai di Indonesia masih rendah adalah mutu benih.
Petani di Indonesia pada umumnya masih menggunakan benih dari hasil panen tanaman sendiri atau dari petani lainnya secara berulang-ulang, sehingga benih yang digunakan bermutu rendah dan menjadi sumber inokulum utama penyebab penyakit di lapangan. Benih bermutu rendah sering terinfeksi patogen penyebab penyakit, salah satu diantaranya adalah kelompok cendawan. Beberapa cendawan patogen tular benih cabai adalah Aspergillus flavus Link., Aspergillus niger Van Tieghem., Aspergillus fumigatus Fresenius., Alternaria alternata (Fr.) Keissl., Fusarium moniliforme Sheld., Fusarium oxysporum Schlechtendahl emend., dan Fusarium solani (Martius) Appel & Wollenweber emend. (Sitara dan Hasan 2011). Berdasarkan data BPSB (2012) hasil uji kesehatan benih cabai di Medan menunjukkan terinfeksi Fusarium sp., Colletotrichum sp., Aspergillus sp.
Salah satu upaya peningkatan mutu benih dapat dicapai dengan pengendalian patogen terbawa benih. Perlindungan benih dilakukan dengan menggunakan senyawa kimia. Petani biasanya menggunakan pestisida tanpa mengikuti aturan dalam penggunaannya (Rahmansyah dan Sulistinah 2009). Penggunaan senyawa kimia yang berlebihan dapat berdampak negatif bagi kesehatan dan pencemaran lingkungan (Yuantari 2009). Pada saat ini sedang dikembangkan pengendalian patogen penyebab penyakit tanaman dengan memanfaatkan mikroorganisme potensial untuk menggantikan penggunaan pestisida sintetik. Salah satunya adalah dengan pemanfaatan agens hayati yaitu cendawan endofit, untuk mengendalikan patogen terbawa benih. Cendawan endofit dapat menghasilkan antibiotik dan meningkatkan pertahanan tanaman.
2
Fitriyah et al. (2013) melaporkan cendawan endofit menghasilkan senyawa yang diduga saponin yang memiliki sifat antimikrobial. Cendawan endofit dari daun cabai menghasilkan senyawa antimikrobial yang diduga merupakan golongan senyawa terpenoid dan alkaloid (Rante et al. 2013). Kemampuan cendawan endofit menghasilkan metabolit sekunder merupakan peluang yang sangat besar untuk memperbaiki mutu benih cabai.
Perumusan Masalah
Penggunaan benih bermutu rendah merupakan salah satu penyebab rendahnya produktivitas dan kualitas tanaman cabai. Masalah yang terjadi adalah umumnya petani menggunakan benih secara berulang-ulang dari hasil panennya sendiri dan banyak patogen terbawa benih yang menginfeksi benih saat penyimpanan. Petani masih menggunakan bahan kimia sintetik untuk mengendalikan patogen terbawa benih, seperti yang telah diketahui bahan kimia sintetik tersebut dapat memberi dampak negatif terhadap kesehatan dan lingkungan. Untuk itu perlu dilakukan penelitian dalam mengendalikan patogen terbawa benih dengan menggunakan agens hayati yaitu dengan memanfaatkan cendawan endofit tanaman cabai untuk mengendalikan cendawan patogen terbawa benih cabai selama penyimpanan.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengeksplorasi cendawan endofit dari tanaman cabai yang memiliki kemampuan sebagai agens hayati dengan menghasilkan metabolit yang mengandung senyawa bersifat antimikrobial untuk mengendalikan cendawan patogen terbawa benih cabai.
Hipotesa Penelitian
Metabolit sekunder cendawan endofit tanaman cabai mampu mengendalikan cendawan patogen terbawa benih cabai selama penyimpanan.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberi pengetahuan kepada masyarakat, khususnya pihak yang terkait mengenai kemampuan metabolit cendawan endofit untuk mengendalikan cendawan patogen terbawa benih selama penyimpanan sehingga mampu meningkatkan produktivitas dan kualitas tanaman cabai serta mengurangi penggunaan senyawa kimia dan berwawasan lingkungan.
Ruang Lingkup
Gambar 1 Bagan alur penelitian “Metabolit cendawan endofit untuk mengendalikan cendawan patogen terbawa benih cabai (Capsicum annuum L.)”.
Uji antagonis cendawan endofit non patogenik terhadap cendawan patogen terbawa benih
Cendawan endofit berpotensi sebagai agens pengendali hayati patogen terbawa benih cabai Uji metabolit cendawan endofit potensial
terhadap pertumbuhan cendawan patogen
Analisis senyawa metabolit
Uji perlakuan perendaman benih dengan metabolit cendawan endofit potensial terpilih Uji patogenisitas cendawan endofit
Isolasi cendawan endofit asal tanaman cabai varietas lokal Berastagi
4
TINJAUAN PUSTAKA
Benih dan Cendawan Patogen Terbawa Benih Cabai
Benih sebagai struktur perbanyakan tanaman, mempunyai peran dalam perkembangan dan penyebaran penyakit. Benih yang telah terinfeksi patogen apabila ditanam kembali akan menjadi sumber inokulum baru di lapangan. Benih dapat menjadi media perpindahan patogen penyebab penyakit dari satu tempat ke tempat lain, hingga dari satu negara ke negara lainnya. Mutu benih yang digunakan merupakan syarat wajib untuk menghindari terjadinya penyakit dari benih ke tanaman. ISTA (2014) menyatakan benih yang bermutu adalah benih yang memiliki mutu genetik, mutu fisiologis, mutu fisik, dan kesehatan benih yaitu bebas dari patogen penyebab penyakit seperti cendawan, bakteri, virus, nematoda dan termasuk hama.
Cendawan patogen terbawa benih terbagi atas cendawan lapangan dan cendawan gudang. Cendawan gudang banyak menyerang benih selama penyimpanan benih. Cendawan gudang dapat menyebabkan penurunan kualitas benih seperti kerusakan bentuk, senyawa kandungan benih, perubahan warna benih, daya kecambah benih menurun, benih menjadi beracun yang berbahaya bagi manusia dan hewan (Agrios 2005). Beberapa cendawan patogen yang paling banyak menyerang benih selama penyimpanan (cendawan gudang) adalah Alternaria, Aspergillus, Botrytis, Botryodiplodia, Cercospora, Colletotrichum, Curvularia, Diaporthe, Drechslera, Elsinoe, Fusarium, Helminthosporium, Rhizoctonia, Sclerotium dan lain-lain (Agarwal dan Sinclair 1996). Phoma, Humicola, Bispora, Phomopsis, Botryotrichum, Mucor, Rhizopus (Chigoziri dan Ekefan 2013).
Pengertian Mikroba Endofit
Mikroba endofit adalah suatu kelompok organisme yang berasosiasi dengan berbagai jaringan dan organ tanaman terestrial dan beberapa tanaman aquatik. Umumnya mikroba endofit menginfeksi tanaman tanpa menimbulkan gejala, mikroba berkolonisasi di dalam jaringan inang, dan dapat diisolasi dengan cara sterilisasi permukaan (Stone et al. 2000). Mikroba endofit tanaman adalah kelompok bakteri dan cendawan. Cendawan endofit adalah kelompok mikroba endofit yang paling banyak di alam dibandingkan bakteri. Schulz dan Boyle (2005) menjelaskan bahwa cendawan endofit bermula sebagai cendawan patogen yang berkembang menjadi patogen minor dan akhirnya menjadi cendawan endofit yang bersimbiosis mutualisme dengan tanaman inangnya
Hubungan simbiosis antara tanaman dan cendawan telah lama diketahui. Hubungan simbiosis antara cendawan dan tanaman di alam sangat bergantung pada kondisi lingkungan dan genetik tanaman inang dan cendawan (Cheplick dan Faeth 2009). Simbiosis mutualisme antara tanaman dan cendawan endofit adalah berkurangnya kerusakan sel atau jaringan, pertukaran nutrisi dan senyawa kimia antara cendawan dan inang, memperpanjang umur tanaman, meningkatkan kapasitas fotosintetik sel dan jaringan di bawah pengaruh infeksi, meningkatkan kelangsungan hidup cendawan (Ghimire dan Hyde 2003). Cendawan endofit diketahui berasosiasi dengan tanaman yang bersifat mutualisme seperti cendawan endofit pada tanaman fescue yang mengambil energi, nutrisi penting untuk perkembangbiakannya dari tanaman dan menghasilkan senyawa yang berguna untuk tanaman inangnya dengan menghambat perkembangan cendawan, virus, nematoda patogen, dan serangga pengganggu tanaman tersebut (Rranzluebbers et al. 1999).
Cendawan endofit pada satu tanaman inang tidak hanya satu spesies cendawan saja tetapi bisa beberapa genus dan spesies. Zabalgogeazcoa (2008) melaporkan rata-rata 50 cendawan endofit ditemukan pada tiap tanaman. Ada 10 isolat cendawan endofit ditemukan pada daun dan rimpang Zingiberottensii (Noverita et al. 2009). Sebanyak 26 isolat diperoleh dari daun tanaman Deschampsia antarctica Desv yang hidup pada kondisi lingkungan yang ekstrim (Rosa et al. 2009). Sunarmi (2010) melaporkan 3 isolat cendawan endofit yaitu Penicillium sp., Aspergillus sp., Hoemiscium sp. ditemukan pada akar tanaman kentang. Fusarium sp., Cephalosporium sp., Geotrichum sp., Cylindrocephalum sp., Penicillium sp. adalah cendawan endofit yang telah ditemukan pada daun sirih (Haniah 2008).
6
virus pada tanaman Meadow ryegrass (Lehtonen et al. 2006). Cendawan endofit dan saprofit Trichoderma spp. dapat meningkatkan tinggi tanaman dan ketahanan terinduksi tanaman kedelai terhadap serangan Fusarium (Sudantha 2010).
Metabolit Cendawan Endofit dan Pemanfaatannya
Cendawan endofit pada tanaman dapat menghasilkan senyawa metabolit sekunder yang sama dengan inangnya. Metabolit yang dihasilkan diduga karena adanya koevolusi atau transfer genetik dari tanaman inang dengan cendawan endofit. Cendawan endofit yang diisolasi dari suatu tanaman dapat menghasilkan metabolit yang sama dengan tanaman inangnya bahkan dalam jumlah yang lebih banyak (Radji 2005). Senyawa metabolit yang dihasilkan cendawan endofit merupakan senyawa bioaktif dan dapat berguna dalam menghambat dan mengendalian pertumbuhan cendawan patogen terutama cendawan patogen. Pemanfaatan metabolit cendawan endofit untuk perlakuan pada benih dapat meningkatkan mutu benih dan mengurangi kejadian penyakit di lapangan. Hal ini disebabkan karena kandungan senyawa kimia metabolit cendawan endofit yang dapat bersifat antibakteri dan anticendawan (Suryanarayanan et al. 2009).
Pujiyanto dan Ferniah (2010) melaporkan tanaman Momordica charantia Linn. dapat digunakan untuk pengobatan diabetes melitus dan bakteri endofit kode PR-3 dari tanaman ini dapat menghambat enzim alpha glukosidase penyebab diabetes. Ekstrak biji srikaya mengandung senyawa acetogenin yang berpotensi sitotoksik terhadap sel kanker, dan hasil ekstraksi metabolit sekunder cendawan endofit tanaman srikaya dapat menghambat pertumbuhan sel kanker payudara MCF-7 (Yunianto et al. 2012).
Telah banyak dilakukan penelitian tentang metabolit yang dihasilkan oleh cendawan endofit untuk menekan pertumbuhan mikroorganime pengganggu tanaman. Ekstrak kasar cendawan endofit LBKURCC 41 (Aureobasidium sp.) menunjukkan aktivitas antimikroba (Fitriyah et al. 2013). Cendawan endofit rimpang lengkuas merah menghasilkan metabolit sekunder yang dapat menghambat pertumbuhan Escherchia coli Migula. dan Staphylococcus. aureus Rosenbach. (Kusumaningtyas et al. 2010). Tariq et al. (2009) melaporkan kemampuan Pseudomonas aeruginosa Sch. yang merupakan mikroba endofit dari akar tanaman cabai sehat dapat menghambat pertumbuhan patogen penyebab penyakit pada tanaman cabai yaitu R. solani Kühn, F. oxysporum, F. solani. P. aeruginosa.
METODE
Waktu dan Lokasi Penelitian
Penelitian dilaksanakan pada bulan September 2014 sampai dengan Juli 2015 di Laboratorium Balai Proteksi Tanaman Pangan dan Hortikultura Medan Sumatera Utara dan Laboratorium Mikologi Tumbuhan Departemen Proteksi Tanaman Fakultas Pertanian.
Isolasi Cendawan Endofit
Isolasi cendawan endofit diperoleh dari tanaman dan benih cabai varietas lokal Berastagi yang diperoleh dari lahan pertanian cabai di Berastagi Medan, Sumatera Utara. Metode isolasi cendawan endofit mengikuti metode yang digunakan Rodrigues (1994) dan telah dimodifikasi. Daun, batang, dan akar tanaman cabai sehat dicuci bersih dengan air mengalir hingga bersih dari partikel-pertikel tanah dan dikering anginkan. Sterilisasi permukaan bagian tanaman secara berturut-turut dengan perendaman dalam alkohol 70% selama 1 menit, NaOCl 1% selama 2 menit. Masing-masing bagian tanaman dibilas sebanyak 3 kali dengan air steril dan dikeringanginkan. Daun, batang, dan akar tanaman cabai kemudian dipotong dan diletakkan pada cawan petri berisi media PDA sebanyak 6 potongan dan diulang sebanyak 3 kali. Bagian tanaman yang telah disterilisasi permukaan dioleskan pada media PDA steril untuk melihat permukaan tanaman telah tersteril dengan benar sebagai kontrol. Bagian tanaman tersebut kemudian diinkubasi pada suhu ruang selama 7 hari dan diamati pertumbuhan cendawan. Cendawan endofit yang diperoleh kemudian dimurnikan pada media PDA. Hasil isolasi cendawan endofit tidak dapat digunakan apabila ditemukan kontaminan pada kontrol. Cendawan endofit diidentifikasi dengan menggunakan buku kunci identifikasi cendawan menurut Wanatabe (2002), Barnet dan Hunter (2006).
Seleksi Cendawan Endofit
8
Isolasi Cendawan Patogen Terbawa Benih Cabai
Isolasi cendawan patogen dari benih cabai varietas lokal Berastagi yang diperoleh dari lahan pertanian cabai di Berastagi Medan, Sumatera Utara. Isolasi cendawan patogen terbawa benih cabai dilakukan dengan metode standart ISTA (1996) yaitu dengan metode blotter test. Sebanyak 3-4 lembar kertas merang steril dilembabkan pada air steril dan diletakkan pada cawan petri. Benih disterilisasikan dengan menggunakan NaOCl 1% selama 1 menit kemudian dibilas dengan air steril sebanyak 2 kali dan dikeringanginkan. Dua puluh lima benih cabai diletakkan pada tiap cawan petri dengan total 400 benih. Benih diinkubasi pada suhu ruang selama 24 jam dan diinkubasi suhu dingin -20 0C pada hari ke-2 inkubasi selama 24 jam, kemudian diinkubasi kembali pada suhu ruang dengan penyinaran 12 di bawah sinar near UV dan 12 jam gelap selama 5 hari. Cendawan patogen diidentifikasi dengan buku kunci identifikasi cendawan menurut Wanatabe (2002), Barnet dan Hunter (2006). Tiga isolat cendawan patogen dengan tingkat infeksi tertinggi dipilih untuk uji selanjutnya.
Uji Penghambatan Cendawan Endofit terhadap Cendawan Patogen
Cendawan endofit terpilih diuji dengan cendawan patogen utama terbawa benih cabai pada media PDA secara in vitro. Pengujian dilakukan dengan metode dual culture yaitu menumbuhkan koloni cendawan secara berhadapan (Gambar 1), selanjutnya diinkubasi pada suhu ruang selama 3-4 hari dengan 5 ulangan (Santoso dan Sumarni 2008). Empat isolat cendawan endofit yang memiliki daya hambat tertinggi terhadap pertumbuhan cendawan patogen yang dipilih dan digunakan pada uji selanjutnya. Perhitungan daya hambat dengan menggunakan rumus sebagai berikut:
Keterangan:
R1= jari-jari patogen yang tumbuh berlawanan dengan antagonis, R2= jari-jari patogen yg tumbuh ke arah antagonis
3 cm 3 cm 3cm
Gambar 2 Ilustrasi uji antagonis antara cendawan endofit (a) dengan cendawan patogen (b), R1 adalah jari-jari patogen yang tumbuh berlawanan dengan antagonis, R2 adalah jari patogen yg tumbuh ke arah antagonis
Daya hambat =
x 100%
R1 R2
Produksi dan Analisis Senyawa Metabolit
Produksi metabolit isolat cendawan endofit menggunakan metode Achmad (1997) yang telah dimodifikasi. Keempat isolat cendawan endofit terpilih diambil sebanyak 3 potongan berdiameter 5 mm dan dimasukkan ke dalam erlenmeyer berisi 100 mL media PDB. Potongan isolat endofit dalam media PDB digoyang dengan shaker pada kecepatan 100 rpm selama 2 minggu pada suhu ruang. Metabolit disaring dan disentrifugasi pada kecepatan 6 000 rpm selama 15 menit, kemudian disaring kembali dengan syringe filter. Metabolit hasil saringan akan digunakan dalam uji selanjutnya. Sebagian metabolit dianalisis kandungan kimia dengan menggunakan metode analisis Py-GC-MS (Pirolisis kromatografi gas spektrometri massa) yang memungkinkan karakterisasi dan makromolekuler volatil pada metabolit cendawan endofit.
Uji Metabolit Cendawan Endofit
Sebanyak 20 mL metabolit hasil penyaringan dicampur dengan 80 mL media PDA (untuk pengenceran 20%), kemudian dilakukan pengenceran 10% dan 5%. Campuran PDA dan metabolit dituang pada cawan petri hingga padat dan diletakkan potongan isolat cendawan patogen berdiameter 5 mm di tengah-tengah media tumbuh PDA dan diulang sebanyak 5 kali (Umarella 2006). Cendawan patogen kemudian diinkubasi pada suhu ruang selama 7 hari. Cendawan patogen ditumbuhkan pada media PDA ditambah dengan fungisida sintetik dengan konsentrasi yang dianjurkan sebagai kontrol positif, dan pada media PDA biasa sebagai kontrol negatif. Pertumbuhan koloni cendawan patogen diamati dan dilakukan pengukuran daya hambat pertumbuhan cendawan patogen dengan rumus:
Keterangan :
D1 = diameter koloni cendawan patogen kontrol negatif (mm) D2 = diameter koloni cendawan patogen perlakuan (mm)
Pengujian metabolit cendawan endofit disusun dengan menggunakan rancangan acak lengkap (RAL). Data yang diperoleh kemudian diolah menggunakan program SAS 9.1. Perlakuan diuji lanjut dengan uji Duncan pada taraf 5%.
Uji Perlakuan Perendaman Benih dengan Metabolit
Metabolit dengan daya hambat tertinggi digunakan untuk perlakuan perendaman benih cabai. Sebanyak 100 benih direndam dengan metabolit, benih direndam dengan fungisida sebagai kontrol positif dan dengan air steril sebagai kontrol negatif. Benih disimpan pada suhu ruang 27-30 oC dengan waktu penyimpanan selama 0, 1, 2, 3, 4 minggu dan dimasukkan ke dalam desikator
10
berisi silika gel secukupnya untuk menjaga kelembapan pada desikator agar tetap konstan. Pengujian tingkat infeksi benih dan daya berkecambah benih dilakukan setiap minggunya dengan menggunakan metode blotter test, metode growing on test pada media water agar dan kertas gulung. Pengamatan dilakukan setiap minggunya dengan menghitung persentase daya kecambah dan tingkat infeksi cendawan terbawa benih pada setiap perlakuan dengan rumus:.
Keterangan :
N1 = jumlah tanaman terinfeksi pada perlakuan perendaman dengan aquades N2 = jumlah tanaman terinfeksi pada perlakuan perendaman dengan metabolit
HASIL DAN PEMBAHASAN
Isolasi dan Seleksi Cendawan Endofit
Hasil isolasi cendawan endofit dari akar, batang, daun dan benih tanaman cabai lokal diperoleh sebanyak 42 isolat masing-masing sebanyak 16, 12, 9 dan 5 isolat secara berturut-turut. Cendawan endofit paling banyak ditemukan pada bagian akar tanaman, hal ini sesuai dengan penelitian Ramdan (2014) yang telah melaporkan cendawan endofit ditemukan paling banyak dari akar tanaman cabai sebanyak 101 isolat dari total 138 isolat. Paul et al. (2012) juga telah melaporkan tanaman cabai pada fase pembuahan ditemukan 196 isolat cendawan endofit dari akar, 112 isolat dari batang dan 173 isolat dari daun. Sieber dan Grunig (2006) menjelaskan secara morfologi, fisik, dan kimianya jaringan akar tanaman merupakan bagian tanaman yang baik untuk perkembangbiakan berbagai mikroba tidak terkecuali cendawan endofit.
Hasil pengujian patogenisitas terhadap 42 isolat cendawan endofit pada benih cabai menunjukkan 30 isolat cendawan bersifat patogenik dan 12 isolat bersifat non patogenik. Sebanyak 4 isolat cendawan endofit non patogenik dari batang, 2 isolat benih,dan 6 isolat dari akar. Damayanti (2013) melaporkan dari 17 isolat cendawan endofit dari cabai diperoleh 4 isolat cendawan endofit non patogen dan 12 isolat potensial patogen. Ramdan (2014) telah mengisolasi cendawan endofit dari tanaman cabai di Garut dan Bogor sebanyak 138 isolat dan 18 isolat diantaranya bersifat nonpatogen.
Pada uji patogenisitas, cendawan endofit bersifat patogen menyebabkan gejala nekrotik pada kecambah benih cabai, benih tidak berkecambah dan mati, sedangkan cendawan endofit bersifat non patogen tidak menimbulkan gejala nekrotik maupun kematian pada kecambah dan benih cabai (Gambar 3). Cheplick dan Faeth (2009) menjelaskan cendawan endofit telah diketahui merupakan cendawan patogen minor yang berevolusi menjadi cendawan yang bersifat mutualisme dengan tanaman inangnya, sehingga dari semua cendawan endofit yang diperoleh tidak semua cendawan endofit non patogen dan sebagian besar cendawan endofit patogenik. Kondisi lingkungan, genetik tanaman dan cendawan endofit menjadi faktor penentu hubungan simbiosis antara tanaman dan cendawan di alam.
Gambar 3 Cendawan endofit pada benih cabai menyebabkan: benih mati tidak berkecambah (a), benih berkecambah kemudian mati (b), benih berkecambah mengalami nekrosis (c), benih berkecambah sehat (d)
12
Isolasi Cendawan Patogen Terbawa Benih Cabai
Hasil uji blotter test pada benih cabai diperoleh 6 isolat cendawan patogen yang menginfeksi benih cabai lokal Berastagi Medan, Sumatera Utara (Tabel 1). Alternaria spp., A. niger, Fusarium spp., A. flavus, Cladosporium spp., Penicillium spp., dan Rhizopus spp. merupakan cendawan patogen terbawa benih gandum (Joshaghani et al. 2013). Isolat cendawan patogen dengan tingkat infeksi tertinggi yaitu A. fumigatus, A. niger dan F. solani (Gambar 4), digunakan pada uji selanjutnya.
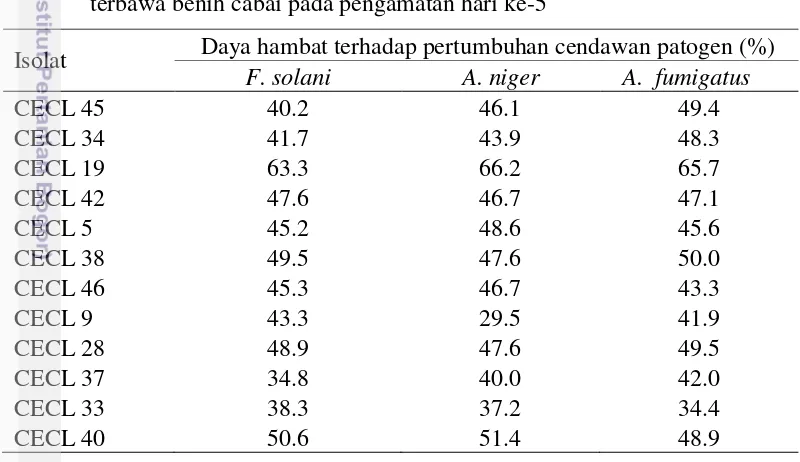
Tabel 1 Cendawan patogen terbawa benih cabai
Cendawan patogen Tingkat Infeksi (%)
A. fumigatus 52.5
A. niger 15.25
F. solani 12.75
A. flavus 11.5
Penicillium sp. 5
Curvularia sp. 3
Gambar 4 Isolat murni cendawan patogen, makroskopis dan mikroskopis: F. solani (a) A. fumigatus (b), A. niger (c) perbesaran 40x10
a
b
c
Nahar et al. (2004) melaporkan hasil pengujian dengan metode standar blotter ditemukan 47 spesies cendawan, sedangkan pengujian metode blotter dengan modifikasi pendinginan -20 ᴼC ditemukan 23 spesies cendawan. Cendawan patogen yang menginfeksi benih cabai tersebut antara lain A. niger, A. flavus, F. solani, F. sporotrichioides Sherbakoff, F. subglutinans (wollenweber & Reinking) Nelson, Toussoun & Marasas, Colletotrichum capsici (Syd.) E.J. Butler & Bisby, Dreschslera sp. C. lunata, Epicoccum sp., Rhizoctonia solani, Verticillium sp., Phoma sp. F. moniliforme, Aspergillus sp, C. lunata, A. tenuis dan Cladosporium spp (Ali et al. 2008). Machenahalli et al. (2014) melaporkan cendawan patogen terbawa benih cabai adalah C. capsici, F. sporotrichioides dan F. oxysporum.
Uji Dual Culture Cendawan Endofit terhadap Cendawan Patogen
Hasil pengujian dual culture menunjukkan 12 isolat cendawan endofit non patogen mampu menekan pertumbuhan A. niger berkisar antara 29.5%-66.2%, terhadap A. fumigatus berkisar antara 34.4-65.7%, dan terhadap F. solani berkisar antara 34.8%-63.3% (Tabel 2).
Tabel 2 Daya hambat isolat cendawan endofit terhadap 3 isolat cendawan patogen terbawa benih cabai pada pengamatan hari ke-5
Isolat Daya hambat terhadap pertumbuhan cendawan patogen (%) F. solani A. niger A. fumigatus
14
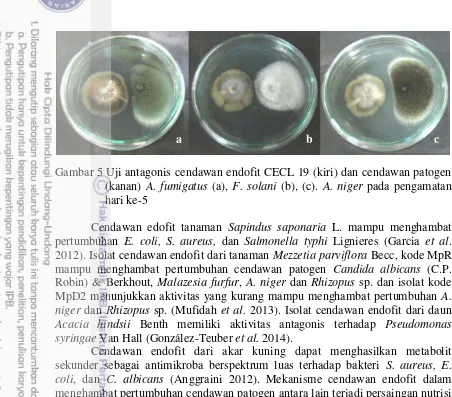
Gambar 5 Uji antagonis cendawan endofit CECL 19 (kiri) dan cendawan patogen (kanan) A. fumigatus (a), F. solani (b), (c). A. niger pada pengamatan hari ke-5
Cendawan edofit tanaman Sapindus saponaria L. mampu menghambat pertumbuhan E. coli, S. aureus, dan Salmonella typhi Lignieres (Garcia et al. 2012). Isolat cendawan endofit dari tanaman Mezzetia parviflora Becc, kode MpR mampu menghambat pertumbuhan cendawan patogen Candida albicans (C.P. Robin) & Berkhout, Malazesia furfur, A. niger dan Rhizopus sp. dan isolat kode MpD2 menunjukkan aktivitas yang kurang mampu menghambat pertumbuhan A. niger dan Rhizopus sp. (Mufidah et al. 2013). Isolat cendawan endofit dari daun Acacia hindsii Benth memiliki aktivitas antagonis terhadap Pseudomonas syringae Van Hall (González-Teuber et al. 2014).
Cendawan endofit dari akar kuning dapat menghasilkan metabolit sekunder sebagai antimikroba berspektrum luas terhadap bakteri S. aureus, E. coli, dan C. albicans (Anggraini 2012). Mekanisme cendawan endofit dalam menghambat pertumbuhan cendawan patogen antara lain terjadi persaingan nutrisi dan ruang, penghambatan pertumbuhan patogen dengan Parasitisme, menginduksi ketahanan tanaman, menghasilkan senyawa antibiotik dan enzim litik (Arnold et al. 2003; Chaves et al. 2009; Gao et al. 2010; Gazis et al. 2010). Ramdan (2014) melaporkan mekanisme penghambatan isolat cendawan endofit terhadap pertumbuhan P. capsici adalah antibiosis, kompetisi ruang dan nutrisi. Cendawan endofit mampu menekanan pertumbuhan Phytophthora palmivora Butler dengan mekanisme antibiosis (Tondok et al. 2012). Keberadaan cendawan endofit pada tanaman secara tidak langsung akan memicu peningkatan ketahanan tanaman terhadap serangan patogen penyebab penyakit pada tanaman tersebut (Slusarenko et al. 2000).
Uji Daya Hambat Metabolit Cendawan Endofit
Metabolit isolat cendawan terpilih mampu menekan pertumbuhan cendawan F. solani antara 19.5%-32.2%, meskipun tidak berbeda nyata antar konsentrasi dari masing-masing metabolit (Tabel 3). Demikian juga metabolit cendawan endofit terpilih mampu menekan pertumbuhan A. niger berkisar 1.85%-52.2% dan A. fumigatus berkisar 8.9%-57.4%. Taraf konsentrasi mempengaruhi besar daya hambat, semakin besar konsentrasi metabolit, semakin besar pula daya hambat metabolit terhadap pertumbuhan F. solani, A. niger, A. fumigatus (Gambar 6).
c b
Tabel 3 Daya hambat metabolit cendawan endofit pada 3 taraf konsentrasi terhadap pertumbuhan F. solani
Isolat Konsen trasi (%)
Daya hambat metabolit (%) pada hari ke-
1 2 3 4 5 6 7 Angka-angka pada kolom yang sama diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5% (uji selang berganda Duncan).
Tabel 4 Daya hambat metabolit cendawan endofit pada 3 taraf konsentrasi terhadap pertumbuhan A. niger
Isolat Konsen trasi (%)
Daya hambat metabolit (%) pada hari ke-
16
Tabel 5 Daya hambat metabolit cendawan endofit pada 3 taraf konsentrasi terhadap pertumbuhan A. fumigatus
Isolat Konsen trasi (%)
Daya hambat metabolit (%) pada hari ke-
1 2 3 4 5 6 7
CECL 28 5 16.7c 28.9ef 31.1d 39.1d 32.0e 28.6e 22.2e 10 28.6bc 37.8bcd 43.2c 50.0bc 46.1cd 44.1cd 41.5d 20 28.6bc 42.2b 44.7c 54.2b 51.1bc 50.4bc 47.4bcd CECL 40 5 0.0d 25.6f 27.3d 42.2d 42.0d 41.3d 40.7d
10 35.7ab 40.0bc 45.5c 54.2b 52.1b 53.2ab 49.6bc
20 45.2a 57.8a 58.3a 62.5a 60.7a 59.1a 57.4a
CECL 19 5 0.0d 0.0g 0.8f 2.6g 0.9g 0.8g 0.0g
10 0.0d 0.0g 2.3f 14.1f 5.5g 4.8g 0.0g
20 0.0d 3.3g 15.9e 22.9e 17.8f 17.5f 8.9f CECL 38 5 38.1ab 32.2def 40.9c 48.4c 45.7cd 44.8cd 43.0cd
10 35.7ab 33.3def 41.7c 49.5c 46.6cd 45.6cd 43.3cd
20 26.2bc 53.3a 53.0b 58.9b 57.5a 56.8ab 54.1ab Angka-angka pada kolom yang sama diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5% (uji selang berganda Duncan).
Gambar 6 Pertumbuhan cendawan patogen: F. solani (a), A. niger (b), A. fumigatus (c) pada campuran media PDA dan tiga taraf konsentrasi metabolit cendawan endofit CECL 40 (20%, 10%, 5%), K(-), dan K(+)
a
b
c
Berdasarkan hasil uji metabolit 4 isolat cendawan endofit terhadap pertumbuhan ketiga isolat cendawan patogen, 2 isolat cendawan endofit yaitu CECL 40 dan CECL 38 pada konsentrasi 20% mempunyai daya hambat tertinggi masing-masing terhadap F. solani sebesar 32.21% dan 31.09%, A. niger sebesar 52.22% dan 50.37%, A. fumigatus sebesar 57.41% dan 54.07% secara berturut-turut. Isolat CECL 40 dan CECL 38 pada taraf konsentrasi 20% digunakan pada uji selanjutnya terhadap benih cabai dengan perlakuan perendaman dan penyimpanan Isolat-isolat cendawan endofit dari tanaman Triticum durum menghasilkan persentase penghambatan terhadap F. oxysporum f.sp. albedinis tertinggi sebesar 58.33% dan terendah sebesar 7.50% (Sadrati et al. 2013).
Rekha dan Shivanna (2014) menyatakan bahwa hasil uji antimikrobial secara invitro menunjukkan bahwa cendawan endofit menghasilkan aktivitas antimikrobial yang berbeda terhadap setiap patogen. Cendawan endofit menghasilkan aktivitas antimikrobial yang tinggi terhadap bakteri tetapi rendah terhadap cendawan. Isolat DC-1 dari daun cabai menunjukkan penghambatan yang paling tinggi yang menunjukkan bahwa pada konsentrasi ekstrak 10 μL/disk mampu menghambat pertumbuhan E. coli, S. aureus dan P. aeruginosa Schröter (Rante et al. 2013).
Perbedaan daya hambat pertumbuhan ketiga isolat cendawan patogen terjadi setiap harinya. Daya hambat tertinggi terhadap cendawan patogen terjadi pada hari keempat kemudian menurun pada hari selanjutnya. Hal ini menunjukkan bahwa kandungan senyawa metabolit hanya mampu menghambat secara efektif terhadap pertumbuhan cendawan patogen hingga 4 hari. Senyawa metabolit cendawan endofit pada media tumbuh telah berkurang sedikit demi sedikit karena telah diabsorbsi oleh cendawan patogen, sehingga daya hambat menurun pada hari kelima hingga ketujuh, selain itu sangat dimungkinkan cendawan patogen dapat beradaptasi terhadap metabolit cendawan endofit. Cendawan sebagai mikroorganisme telah diketahui memiliki kemampuan adaptasi yang tinggi dengan lingkungan hidupnya. Cendawan dapat bertahan hidup pada kondisi yang ekstrim dan beradaptasi dengan lingkungannya dengan melakukan perubahan genetik untuk dapat bertahan hidup (Kurzai et al. 2002).
Identifikasi Cendawan Endofit Potensial
18
Tabel 6 Hasil Identifikasi morfologi cendawan endofit uji
Kode Isolat Hasil
Analisis senyawa metabolit cendwan endofit menggunakan alat Pirolisis kromatografi gas spektrometri massa (Py-GC-MS), merupakan penguraian senyawa-senyawa volatil kompleks menjadi lebih sederhana. Analisis dilakukan di Laboratorium Hasil Hutan, Puslitbang Kehutanan Bogor dengan menggunakan Shimadzu Type GCMS-QP2010. Cara kerja Py-GC-MS pada suhu pirolisis 280 °C selama 1 jam, suhu injeksi 280 °C, dan suhu awal kolom 50 °C. Identifikasi senyawa dilakukan dengan mencocokkan data waktu retensi, spektrum masa beserta fragmentasi ion suatu senyawa dengan data yang ada dalam pangkalan data WILEY 7th library (Octaviani 2015).
Pyrolysis Gass Chromatography Mass Spectrometry digunakan untuk menganalisis kandungan kimia metabolit isolat CECL 40 (Tabel 7) dan CECL 38 (Tabel 8). Sebanyak 29 senyawa dapat di deteksi dalam metabolit isolat cendawan endofit CECL 40 dan 20 senyawa dalam metabolit CECL 38. Metabolit cendawan endofit terdiri atas berbagai komponen senyawa yang dapat bersifat sebagai antioksidan, antikanker, antidiabetes, antibakteri dan anticendawan. Phenol, 2,6-dimethoxy- (CAS), 2,6-Dimethoxyphenol dan 1,6-anhydro-beta-d-glucopyranose (levoglucosan) merupakan salah satu komponen yang berperan sebagai antimikrobial dan antidiabetes yang ditemukan pada tanaman kayu manis padang dan jawa (Anggriawan et al. 2013).
Tabel 7 Senyawa metabolit yang dihasilkan cendawan endofit isolat CECL 40 hasil Py-GC-MS
No Conc (%) Nama Senyawa
1 2.13 acetic acid (cas) ethylic acid,
2 1.08 2-propanone, 1-hydroxy- (cas) acetol, 3 1.22 phenol (cas) izal,
4 3.16 2-cyclopenten-1-one
5 1.91 2,5-dimethyl-4-hydroxy-3(2h)-furanone, 6 2.47 butanal, 3-methyl- (cas) 3-methylbutanal, 7 1.14 3-ethyl-2-hydroxy-2-cyclopenten-1-one,
8 1.42 4h-pyran-4-one, 2,3-dihydro-3,5-dihydroxy-6-methyl- (cas) 3,5-dihydroxy,
9 1.90 isosorbid,
10 3.73 2-furancarboxaldehyde, 5-(hydroxymethyl)- (cas) hmf, 11 1.89 phenol, 2,6-dimethoxy- (cas) 2,6-dimethoxyphenol, 12 1.01 2-heptanol, 5-ethyl- (cas) 5-ethyl-2-heptanol, 13 1.82 2-propenamide, 2-methyl-n-phenyl-,
14 5.48 lactone g,
15 12.56 1,6-anhydro-beta-d-glucopyranose (levoglucosan), 16 13.30 1-dodecanol (cas) n-dodecanol,
17 18.01 6,8-dioxabicyclo(3.2.1)octan-3.beta.-ol, 18 1.62 heptanal (cas) n-heptanal,
19 1.21 L-glutamic acid (cas) glutamic acid, 20 4.17 n,n'-diacetylputrescine,
21 2.52 hexadecanoic acid (cas) palmitic acid,
22 1.94 1,4-diaza-2,5-dioxo-3-isobutyl bicyclo[4.3.0]nonane, 23 2.29 9-octadecenoic acid, methyl ester
24 0.93 hexadecanoic acid, butyl ester (cas) n-butyl palmitate, 25 1.27 2-methyl-10-undecenal,
26 1.74 6,10,14-trimethylpentadecan-2-ol,
27 2.33 1,4-diaza-2,5-dioxo-3-isobutyl bicyclo[4.3.0]nonane, 28 2.90 2-decene, 3-methyl-, (z)- (cas),
20
dihasilkan cendawan endofit F. solani yang bersifat antibakteri terhadap E. coli dan S. aureus (Hateet et al. 2014). Octaviani (2015) melaporkan asam asetat adalah kandungan kimia metabolit T. harzianum dan Gliocladium sp. yang sangat berperan sebagai antimikroba.
Tabel 8 Senyawa metabolit yang dihasilkan cendawan endofit isolat CECL 38 hasil Py-GC-MS
No Conc (%) Nama senyawa
1 2.08 Phenol, 2,6-dimethoxy- (cas) 2,6-dimethoxyphenol, 2 2.00 1-dodecanol (CAS) n-dodecanol,
3 2.57 2-nonenal, (Z)- (cas) cis-non-2-enal, 4 4.39 hexanoic acid (cas) n-hexanoic acid, 5 3.88 dodecanoic acid (cas) lauric acid
6 23.53 Octane, 1-(ethenylthio)- (cas) sulfide, octyl vinyl (cas), 7 3.57 ethanol, 2-(dodecyloxy)- (cas) dodecoxyethanol, 8 2.49 undecanoic acid (cas) undecylic acid,
9 2.37 1-tetradecanol (cas) alfol 14,
10 1.56 hexadecanoic acid (cas) palmitic acid, 11 8.89 9-octadecenoic acid, methyl ester
12 5.70 9-octadecenoic acid (z)- (cas) oleic acid, 13 6.07 1-heptanol (cas) heptanol,
14 7.57 hexanal, 3-(hydroxymethyl)-4-methyl- (cas) 3-((s)-sec-butyl)-4-hydroxyl,
15 3.32 hexadecanoic acid, 2-hydroxy-1,3-propanediyl ester (cas) glycerol,
16 9.69 hexanal, 3-(hydroxymethyl)-4-methyl- (cas) 3-((s)-sec-butyl)-4-hydroxyl,
17 2.66 octadecanoic acid, 2-hydroxy-1,3-propanediyl ester (cas)glycerol,
18 3.25 Octadecanoic acid, 2-[(1-oxotetradecyl)oxy]-1,3-propanediyl ester (CAS) glyceryl-2- MYRISTATE 19 2.60 hexadecanoic acid, 2-hydroxy-1,3-propanediyl ester
(cas) glycerol,
20 1.81 1,2-benzenedicarboxylic acid, dioctyl ester (cas)dioctyl phthalate
Cendawan endofit CECL 38 (Paecilomyces sp.) menghasilkan senyawa metabolit bersifat antimikrobial yaitu octane. Sunesson et al. (1995) melaporkan senyawa metabolit volatil bersifat toksik dari hidrokarbon yaitu octane dihasilkan oleh cendawan endofit Paecilomyces variotii. Wang et al. (2002) melaporkan cendawan endofit Paecilomyces sp. menghasilkan metabolit bersifat racun yaitu brefeldin A. Słaba et al. (2013) melaporkan P. marquandii menghasilkan metabolit bersifat herbisida.
octadecanoic acid. Sugijanto et al. (2014) melaporkan ekstrak cendawan endofit dari tanaman Aglaia odorata Lour merupakan senyawa fenol, steroid, terpenoid dan terpen memiliki aktivitas sebagai antimikrobial. Marante et al. (2012) juga melaporkan P. variotii menghasilkan metabolit berupa hexadecanoic acid (cas) palmitic acid, octadecenoic acid, methyl ester, (e)-(cas) methyl elaidate, 9-octadecenoic acid (z)- (cas) oleic acid, hexadecanoic acid (cas)-2-hydroxy-1,3-propanediyl ester (cas, octadecanoic acid, 2-hydroxy-1,3-(cas)-2-hydroxy-1,3-propanediyl ester (cas)glycerol, yang merupakan senyawa-senyawa kimia yang sama dengan yang ditemukan dalam metabolit CECL 38.
Perendaman Benih dengan Metabolit Cendawan Endofit
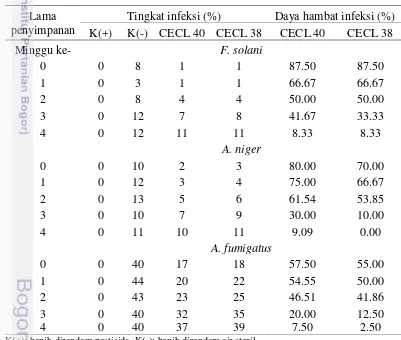
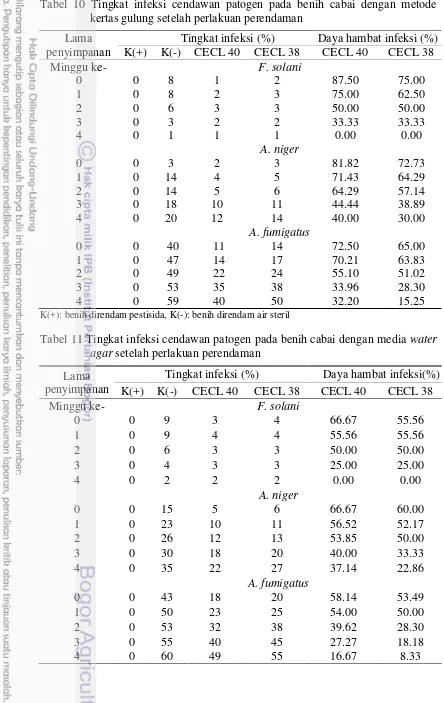
Perlakuan perendaman benih cabai dengan metabolit cendawan endofit potensial mampu menekan tingkat infeksi cendawan patogen terbawa benih cabai. Aktivitas metabolit cendawan endofit masih efektif menekan cendawan patogen terbawa benih cabai setelah masa penyimpanan benih cabai 2 minggu (Tabel 9,
Tingkat infeksi (%) Daya hambat infeksi (%) K(+) K(-) CECL 40 CECL 38 CECL 40 CECL 38
22
Tabel 10 Tingkat infeksi cendawan patogen pada benih cabai dengan metode kertas gulung setelah perlakuan perendaman
Lama penyimpanan
Tingkat infeksi (%) Daya hambat infeksi (%) K(+) K(-) CECL 40 CECL 38 CECL 40 CECL 38
K(+): benih direndam pestisida, K(-): benih direndam air steril
Tabel 11 Tingkat infeksi cendawan patogen pada benih cabai dengan media water agar setelah perlakuan perendaman
Lama penyimpanan
Secara umum daya hambat metabolit cendawan endofit potensial menurun seiring masa simpan benih setelah perlakuan. Semakin lama benih disimpan, semakin tinggi tingkat infeksi Aspergillus, sedangkan semakin lama benih disimpan semakin menurun tingkat infeksi F. solani. Hal ini dapat dikarenakan terjadi kompetisi antara Fusarium dan Aspergillus. Fusarium yang daya tumbuhnya lambat kurang mampu bersaing dengan Aspergillus yang daya tumbuhnya relatif cepat. Putri et al. (2011) juga melaporkan semakin lama waktu penyimpanan semakin banyak benih terinfeksi Aspergillus sp., sedangkan semakin lama waktu penyimpan semakin berkurang untuk Fusarium sp. pada benih mahoni. Penyimpanan benih cabai pada kondisi kelembapan dan kadar benih yang tinggi dapat menyebabkan semakin tinggi tingkat infeksi Alternaria, Aspergillus, Chaetomium, Colletotrichum, Penicillium, dan Rhizopus (Doijode 2001).
Semakin lama benih disimpan, semakin kecil daya hambat infeksi metabolit terhadap cendawan patogen. Hal ini kemungkinan terjadi karena penyimpanan benih pada suhu 27-30 ᴼC menyebabkan residu dari metabolit cendawan endofit berkurang dan rusak. Sebagian besar metabolit dilaporkan berupa enzim dan senyawa antibiotik yang sangat rentan terhadap perubahan suhu. Antosianin merupakan salah satu kandungan metabolit sekunder tanaman ubi jalar ungu (Ipomea batatas L.) sangat rentan terhadap suhu selama penyimpanan dan suhu proses pengolahan (Febrianti et al. 2014). Suhu sangat menentukan kadar kandungan metabolit sekunder seperti flavonoid dan fenolat (Hermani dan Nurdjanah 2009). Masih perlu penelitian lebih lanjut mengenai hal ini. Selain hal itu, penurunan daya hambat metabolit cendawan endofit disebabkan kelembapan dan kadar air benih yang mendukung untuk pertumbuhan cendawan patogen. Putri et al. (2011) melaporkan penyimpanan benih mahoni pada kadar air yang lebih tinggi mengakibatkan meningkatkan laju infeksi cendawan gudang seperti Aspergillus sp., dan Fusarium sp.. Charlile et al. (2001) menyatakan kelompok Aspergillus toleran terhadap kadar air yang rendah dan dapat bersporulasi pada kelembapan yang relatif rendah. A. fumigatus adalah cendawan yang termotoleran dapat hidup pada suhu 52 ᴼC (Webster dan Weber 2007).
F. solani, A. niger dan A. fumigatus merupakan cendawan patogen benih yang dapat menyebabkan benih busuk, kematian kecambah, serta nekrotik daun dan batang tanaman cabai pada water agar maupun kertas gulung (Gambar 7). Cendawan patogen benih dapat menurunkan daya kecambah benih, mengubah bentuk benih, menyebabkan bercak pada benih, perubahan warna benih. Varietas dan sumber benih sangat menentukan tingkat serangan cendawan pada benih padi (Bhuiyan et al. 2013). Cendawan patogen terbawa benih dapat memperlambat perkecambahan, benih busuk, nekrotik pada akar dan daun kecambah, mati pucuk, layu, dan rebah kecambah (Sharma et al. 2013).
Pada media tanam kertas merang gulung, tingkat infeksi patogen lebih rendah dibandingkan media water agar. Hal ini dikarenakan tidak ada nutrisi yang diperoleh patogen selain dari benih, sedangkan pada media tanam water agar, meskipun media yang rendah nutrisi tetapi kaya akan air yang sangat berperan
dalam mempercepat laju infeksi cendawan patogen gudang khususnya A. fumigatus yang mampu menginfeksi benih pada kondisi dengan kelembapan
24
Gambar 7 Infeksi patogen terbawa benih cabai dapat menyebabkan: benih tidak berkecambah, kecambah nekrotik (tanda panah), kecambah mati (tanda panah), pada kertas gulung (a), pada water agar (b)
Jumlah benih berkecambah pada perlakuan metabolit yang lebih banyak bila dibandingkan dengan kontrol negatif K(-) (Tabel 12). Hal ini menunjukkan bahwa metabolit cendawan endofit tidak berpengaruh negatif terhadap perkecambahan benih cabai. Akan tetapi, terjadi penurunan daya kecambah benih setiap minggunya baik pada benih yang direndam dengan pestisida, aquades maupun metabolit CECL 40 dan CECL 38.
Tabel 12 Pengaruh setiap perlakuan terhadap daya kecambah benih cabai lokal selama 4 minggu pengamatan
Lama penyimpanan Daya berkecambah (%)
K(+) K(-) CECL 40 CECL 38
Minggu ke- Kertas gulung
0 100 50 99 99
1 98 47 90 94
2 92 30 87 90
3 88 25 85 87
4 85 23 80 85
Water agar
0 99 15 79 80
1 95 11 75 78
2 90 7 68 70
3 86 3 60 67
4 82 2 58 60
K(+): benih direndam pestisida, K(-): benih direndam aquadest
Secara umum benih mengalami penurunan daya kecambah seiring berjalannya waktu. Daya kecambah benih sangat dipengaruhi oleh faktor internal
a
b
(genetik dan patogen terbawa benih) dan eksternal benih (kadar air benih dan suhu selama penyimpanan). Putri et al. (2011) melaporkan penyimpanan benih mahoni pada kadar air yang lebih tinggi mengakibatkan penurunan daya berkecambah secara cepat. Julianti et al. (2005) daya simpan benih sangat dipengaruhi oleh kadar air sebelum dan selama penyimpanan yang dapat mempengaruhi viabilitas benih. Yuniarti et al. (2013) melaporkan Fusarium sp. dan Aspergillus sp. dapat menurunkan viabilitas benih dan vigor bibit sengon (Paraserianthes falcataria). Jogi et al. (2010) juga melaporkan Aspergillus sp., F. oxysporum dan C. capsici adalah cendawan utama pada semua kultivar cabai, cendawan-cendawan ini mampu mengurangi perkecambahan dan vigor persemaian secara signifikan.
26
SIMPULAN DAN SARAN
Simpulan
Sebanyak 42 isolat cendawan endofit, 12 isolat diantaranya bersifat non patogenik, yang diperoleh dari eksplorasi cendawan endofit dari tanaman cabai lokal Berastagi. Empat isolat non patogenik menghasilkan metabolit yang dapat menghambat pertumbuhan cendawan patogen terbawa benih cabai. Hasil uji metabolit 4 isolat cendawan endofit diperoleh dua isolat cendawan endofit potensial sebagai agens pengendali hayati dan menghasilkan metabolit, dapat menghambat pertumbuhan cendawan patogen terbawa benih cabai yaitu isolat CECL 40 dan CECL 38.
Daya hambat infeksi CECL 40 tertinggi terhadap F. solani, A. niger dan A. fumigatus berturut-turut sebesar 87.5%, 80% dan 57.5%, sedangkan daya hambat infeksi CECL 38 terhadap F. solani, A. niger dan A. fumigatus berturut-turut sebesar 87.5%, 70%, 55%. Hasil identifikasi isolat CECL 40 adalah hifa steril dan CECL 38 adalah Paecilomyces sp.
Saran
DAFTAR PUSTAKA
Achmad. 1997. Mekanisme serangan patogen dan ketahanan inang serta pengendalian hayati penyakit lodoh pada Pinus merkusii [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Afriyanto. 2008. Kajian Keracunan Pestisida pada Petani Penyemprot Cabe di Desa Candi Kecamatan Bandungan Kabupaten Semarang [Tesis]. Semarang (ID):Universitas Diponegoro.
Agarwal VK, Sinclair JB. 1996. Principles of Seed Pathology. Second Edition. New York (US): Lewis Publishers.
Agrios GN. 2005. Plant Pathology. Fifth Edition. New York (US): Academic Press, Inc.
Anggraini FD. 2012. Isolasi dan uji antimikrob metabolit sekunder ekstrak kultur jamur endofit AFKR-5 dari tumbuhan akar kuning [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Anggriawan MB, Roswiem AP, Nurcholis W. 2013. Potensi ekstrak air dan etanol kulit batang kayu manis padang (Cinnamomum burmannii) dan jawa (Cinnamomum verum) terhadap aktivitas enzim α-glukosidase. Sutanto, Soedjanaatmadja RUMS, Supriatman U, Panji T, editor. Seminar Nasional Riset Pangan, Obat-Obatan dan Lingkungan Untuk Kesehatan; 2012 Nopember 12; Bogor, Indonesia. Bogor (ID): FMIPA Universitas Pakuan. hlm 221-233.
Ali MA, Aziz AKMA, Haque MM. 2008. Environment safe technique of chili seed. J Agrofor Environ. 2(1): 1-6.
Arnold AE, Mejia LC, Kyllo D, Rojas EI, Maynard Z, Robbins N, Herre EA. 2003. Fungal endophytes limit pathogen demage in a tropical tree. PNAS. 100: 15649-15654.
Audipudi AV, Supriya GNR, Pallavi R, Mani PG. 2014. Characterization of L-Asparaginase producing endophytic fungi isolated from ripened fruit of Capsicum frustescence. IJPDT. 4(1):52-57.
[BPS] Badan Pusat Statistik. 2014. Statistik Tanaman Sayuran dan Buah-Buahan Semusim Indonesia. Jakarta (ID): Badan Pusat Statistik.
[BPSB] Balai Pengawasan dan Sertifikasi Benih IV. 2014. Laporan tahunan TA. 2012-2013. Evaluasi pelaksanaa kegiatan UPT. BPSB THP Satuan Kerja Dinas Pertanian Provinsi Sumatera Utara.
Bally R, Elmerich C. 2007. Biocontrol of plant diseases by associative and endophytic nitrogen-fixing bacteria. Elmerich C, Newton WE [editor]. Netherlands. Springer.
28
Bhuiyan MR, Rashid MM, Khan MAI, Hoque M, Nessa B, Rafii MY, Latif MA. 2013. Eco-friendly management of seed borne fungi for sustainable crop production. Life Science Journal. 10(4):1640-1650.
Charlile MJ, Watkinson SC, Gooday GW. 2001. The fungi. Second Edition. London (US). Academic Press.
Chaves NP, Pocosangre LE, Elango F, Rosales FE, Sikora R. 2009. Combining endophytic fungi and bacteria for the biocontrol of Radopholus similis. Sci Horticul. 122:472-478.
Cheplick GP, Faeth SH. 2009. Ecology and evolution of the grass-endophyte symbiosis. Amerika (US): Oxford University Press, Inc.
Chigoziri E, Ekefan EJ. 2013. Seed borne fungi of chilli pepper (Capsicum frutescens) from pepper producing areas of benue state, nigeria. Agric Biol J N Am. 4(4): 370-374.
Dalal JM, Kulkarni NS. 2014. Antagonistic and plant growth promoting potentials of indigenous endophytic actinomycetes of soybean (Glycine max L.) Merril). CIBTech Journal of Microbiology. 3(4): 1-12.
Damayanti. 2013. Kelimpahan dan potensi cendawan endofit untuk menekan penyakit kuning pada tanaman cabai (Capsicum annuum L.) [tesis]. Bogor (ID): Institut Pertanian Bogor.
Debbab A, Aly AH, Edrada-Ebel RA, Müller WEG, Mosaddak M, Hakiki A, Ebel R, Proksch P. 2009. Bioactive secondary metabolites from the endophytic fungus Chaetomium sp. isolated from Salvia officinalis growing in Morocco. Biotechnol Agron Soc Environ. 13(2):229-234. Devi NN, Singh MS. 2013. Gc-ms analysis of metabolites from endophytic
fungus Colletotrichum gloeosporioides isolated from Phlogacanthus thyrsiflorus nees. Int J Pharm Sci Rev Res. 23(2): 392-395.
Doijode SD. 2001. Seed storage of horticultural crops. New York: Food Products Press.
Febrianti A, Dwiyanti G, Siswaningsih W. 2014. Pengaruh suhu dan lama pemanasan terhadap aktivitas antioksidan dan total antosianin minuman sari ubi jalar ungu (Ipomea batatas L.). Jurnal Sains dan Teknologi Kimia. 5(2): 85-94.
Fitriyah D, Jose C, Saryono. 2013. Skrining aktivitas antimikroba dan uji fitokimia dari kapang endofitik tanaman dahlia (Dahlia variabilis). J Ind Che Acta. 3(2): 50-55.
Gao FK, Dai CC, Liu XZ. 2010. Mechanisms of fungal endophytes in plant protection against pathogens. Afr J Microbiol Res 4(13): 1346-1351. Garcia A, Rhoden SA, Bernardi-wenzel J, Orlandelli RC, Azevedo JL, Pamphile
Gazis R, Chaverris P. 2010. Diversity of fungal endhophyte in leaves and stem of wild rubber tress (Hevea brasiliensis) in Peru [CD-ROM]. Fungal Ecology. 3:240-254. DOI:10.1016/j.funeco.2009.
Ghimire SR, Hyde KD. 2003. Fungal Endophytes. Varma A, Abbott L, Wener D, Hampp R, editor. Australia (AU): Springer.
González-Teuber M, Jiménez-Alemán GH, Boland W. 2014. Foliar endophytic fungi as potential protectors from pathogens in myrmecophytic Acacia plants. Communicative & Integrative Biology. 7(5): 1-4.
Haniah M. 2008. Isolasi jamur endofit dari daun sirih (Piper betle L.) sebagai antimikroba terhadap Escherichia coli, Staphylococcus aureus dan Candida albicans [Skripsi]. Malang (ID): Universitas Islam Negeri Malang.
Hateet RR, Muhsin TM, Humadi KJ. 2014. Antibacterial activities secondary metabolites from endophytic fungus Fusarium solani. J Basrah Res. 40(1):95-100.
Hermani, Nurdjanah R. 2009. Aspek pengeringan dalam mempertahankan kandungan metabolit sekunder pada tanaman obat. Perkembangan Teknologi TRO. 21(2): 33-39.
[ISTA] International Seed Testing Association. 1996. International rules for seed testing. Seed Sci Technol. 24: 39-42.
Istikorini Y. 2008. Potensi cendawan endofit untuk mengendalikan penyakit antraknosa pada cabai (Capsicum annum L.) [disertasi]. Bogor (ID): Institut Pertanian Bogor .
Julianti E, Soekarto ST, Hariyadi P, Syarief AM. 2005. Analisi kinetika pendugaan umur simpan benih cabai merah. J Tek Ind Pert. 15(1): 34-39. Jogi MG, Padule DN, Kamdi SR. 2010. Detection of seed mycoflora of chilli and it’s impact on seed germination and seedling vigour. Int J Plant Sci. 5(2):502-504.
Joshaghani H, Namjoo M, Rostami M, Kohsar F, Niknejad F. 2013. Mycoflora of fungal contamination in wheat storage (Silos) in Golestan provience, north of Iran. Jundishapur J Microbiol. 6(4):1-4.
Kurzai O, Barkani AE, Muhlschlegel FA. 2002. Adaptation of Fungi to Alterations in Ambient pH. Di dalam: Calderone RA, Cihlar RL, editor. Fungal Pathogenesis: Principles and Clinical Applications. USA (US): Marcel Dekker Inc.
Kusumaningtyas E, Natasia M, Darmono. 2010. Potensi metabolit kapang endofit rimpang lengkuas merah dalam menghambat pertumbuhan Eschericia coli dan Staphylococcus aureus dengan media fermentasi potato dextrose broth (PDB) dan potato dextrose yeast (PDY). Seminar Nasional Teknologi Peternakan dan Veteriner: 819-824.
30
Marante FJT, Mioso R, Barrera JB, González JEG, Rodriguez JJS, de Laguna IHB. 2012. Structural characterization and metabolite profiling of the facultative marine fungus Paecilomyces variotii. Ann Microbiol. 62:1601-1607. DOI: 10.1007/s13213-011-0416-1.
Machenahalli S, Nargund VB, Hegde RV. 2014. Management of fruit rot causing seed borne fungal pathogens in chilli. The bioscan. 9(1): 403-406
Mufidah, Rante H, Rahim ABD, Agustina R, Pakki E, Talbani A. 2013. Aktivitas antifungi metabolit sekunder fungi endofit yang diisolasi dari Mezzetia parviflora Becc. Majalah farmasi dan farmakologi. 17(3):69 – 72
Nahar S, Mushtaq M, Pathan IH. 2004. Seed-borne mycoflora of Capsicum annuum imported from India. Pak J Bot. 36(1):191-197.
Noverita, Fitria D, Sinaga E. 2009. Isolasi dan uji aktivitas antibakteri jamur endofit dari daun dan rimpang Zingiber ottensii val. J Farm Indones. 4(4):171-176.
Nur’asih. 2011. Keanekaragaman dan kelimpahancendawan endofit pada batang padi [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Octaviani EA. 2015. Potensi Trichoderma harzianum dan Gliocladium sp. untuk pengendalian Botryodiplodia sp. pada jabon (Anthocephalus cadamba) [tesis]. Bogor (ID): Institut Pertanian Bogor
Paul NC, Deng JX, Sang HK, Choi YP, Yu SH. 2012, Distribution and antifungal activity of endophytic fungi in different growth stages of chili pepper (Capsicum annuum L.) in Korea. Plant Pathol J. 28(1):10-19.
Pujiyanto S, Ferniah RS. 2010. Aktifitas inhibitor alpha-glukosidase bakteri endofit PR-3 yang diiisolasi dari tanaman pare (Momordica charantia). Bioma. 12(1):1-5.
Putri KP, Bramasto Y, Suharti T. 2011. Tingkat serangan cendawan terhadap benih mahoni (Sweitenia macrophylla King) pada berbagai kondisi dan waktu simpan. Tekno Hutan Tanaman. 4(1):1-6.
Radji M. 2005. Peranan bioteknologi dan mikroba endofit dalam pengembangan obat herbal. Majalah Ilmu Kefarmasian 2(3):113-126.
Rahmansyah M, Sulistinah N. 2009. Performa bakteri pada tanah tercemar pestisida. Berita Biologi. 9(5):1-8.
Ramdan EP. 2014. Eksplorasi cendawan endofit sebagai agens pengendali hayati Phytophthora capsici Leonian pada cabai [tesis]. Bogor (ID): Institut Pertanian Bogor.
Rante H, Taebe B, Intan S. 2013. Isolasi fungi endofit penghasil senyawa antimikroba dari daun cabai katokkon (Capsicum annuum L. var. chinensis) dan profil KLT Bioautografi. Majalah Farmasi dan Farmakologi. 17(2):39-46.