KEMAMPUAN MATURASI DAN FERTILISASI OOSIT
DARI OVARIUM DOMBA PREPUBER
SECARA
IN VITRO
ANITA HAFID
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul kemampuan maturasi dan fertilisasi oosit dari ovarium domba prepuber secara in vitro adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
ANITA HAFID. Kemampuan Maturasi dan Fertilisasi Oosit dari Ovarium Domba Prepuber secara In Vitro. Dibimbing oleh MOHAMAD AGUS SETIADI dan NI WAYAN KURNIANI KARJA.
Sumber oosit untuk PEIV pada domba yang diperoleh dari RPH adalah domba yang umumnya sudah mengalami pubertas disebabkan mekanisme hormonal dan ultrastruktur oosit dari hewan pubertas sudah sempurna. Selain pemilihan oosit tersebut, biasanya folikel yang dikoleksi untuk PEIV berasal dari folikel antral, hal ini karena oosit dari folikel antral merupakan oosit yang sedang tumbuh dan cenderung lebih aktif dalam melakukan proses transkripsi dan translasi untuk menghasilkan RNA dan protein yang penting untuk proses perkembangan selanjutnya. Secara umum folikel antral memiliki diameter 2-4 mm pada domba. Sementara itu dilaporkan folikel antral pada domba prepuber juga telah berdiameter 2-4 mm. Diameter oosit yang berasal dari folikel antral telah mencapai diameter 110 µm. Diameter tersebut juga sering dijadikan sebagai patokan dalam pemilihan oosit untuk PEIV. Hal ini karena oosit yang telah mencapai diameter ≥110 µm dilaporkan memiliki kemampuan penuh untuk dapat menyelesaikan meiosis dan dapat mencapai maturasi inti sampai ke tahap MII. Berdasarkan hal tersebut oosit dari ovarium domba prepuber diharapkan dapat menjadi sumber oosit yang memiliki perkembangan yang baik untuk PEIV.
Tujuan dari penelitian ini adalah untuk mengamati lebih lanjut kemampuan perkembangan oosit domba prepuber setelah dimaturasi dan difertilisasi secara in vitro. Ovarium domba prepuber dikoleksi berdasarkan ketidakhadiran korpus luteum atau korpus albicans pada kedua ovarium. Tiap pasang ovarium ditimbang terlebih dahulu kemudian oosit dikoleksi dengan metode slicing. Oosit digrading ke dalam kategori tipe A, B, C dan D, namun hanya oosit tipe A dan B (sitoplasma yang homogen dan sel kumulus yang kompak) yang dipakai. Oosit dimaturasi selama 24 jam dalam inkubator CO2 dengan temperatur 39oC. Oosit difertilisasi secara in vitro menggunakan semen beku dengan konsentrasi 5x106 spermatozoa/mLdan diinkubasi selama 12-14 jam.
Pengamatan dilakukan terhadap kemampuan oosit mencapai tahap MII dan pembentukan PN. Hasil penelitian menunjukkan status inti oosit pada tahap MII tidak berbeda antara oosit domba prepuber dan oosit domba puber (89% vs 90,7%, P 0,05) setelah dimaturasi in vitro. Sementara tingkat fertilisasi oosit domba prepuber lebih rendah (P 0,05) dibandingkan dengan oosit domba puber (60% vs 77,7%). Kejadian polispermi pada oosit domba prepuber cenderung lebih tinggi dibandingkan dengan oosit domba puber (21,8% vs 7,4%) (P 0,05). Dapat disimpulkan bahwa oosit domba prepuber memiliki kemampuan maturasi yang sama dengan oosit domba puber namun memiliki kemampuan fertilisasi yang lebih rendah.
SUMMARY
ANITA HAFID. Maturation and Fertilization Ability of Oocytes from Prepubertal Sheep Ovary In Vitro. Dibimbing oleh MOHAMAD AGUS SETIADI dan NI WAYAN KURNIANI KARJA.
The source of sheep oocytes for PEIV which are obtained from slaughterhouse are generally already reach puberty due to hormonal mechanisms and ultrastructure of oocytes already have the full competence to develop. In addition to the selection of oocytes, the follicles were usually collected for PEIV derived from the antral follicles. This is because the oocytes from the antral follicles are growing oocyte and tend to be more active in the process of transcription and translation to produce RNA and essential proteins for subsequent development process. In general, antral follicles in sheep have the diameter of 2-4 mm. It were reported that antral follicles in prepubertal sheep have the diameter of 2-4 mm. The diameter of oocyte from antral follicles to reach the diameter of 110 µm. Thus diameter of oocytes also often used as a criteria in the selection of oocytes for PEIV. Oocyte which have reached diameter ≥110 μm has full competence for the resumption of meiosis and for the completion of meiotic maturation to MII. Based on this, oocytes from prepubertal ovine were expected to be a source of oocytes which have good developmental competence for PEIV.
The objective of this study was to evaluate the maturation and fertilization capacity of oocytes from prepubertal ovine ovaries in vitro. Prepubertal ovaries were collected based on the absence of corpus luteum or corpus albicans in both of the ovaries. Both ovaries were weighted and oocytes were collected by slicing methodes. The oocytes were graded in to A, B, C and D classification. Only grade A and B (homogeneous cytoplasm and compact cumulus cells) were used. The oocytes were matured for 24 hours in CO2 incubator with temperature of 39oC. Oocytes fertilized in vitro by spermatozoa from fresh semen with concentration 5x106 and incubated for 12-14 hours.
Oocytes were evaluated in term of number of oocytes reached MII stage and the number of the PN formation. Result of the experiment revealed that there was no significant difference in the percentage of MII oocytes after in vitro maturation (89% vs 90,7%, P 0,05) between prepubertal and pubertal ovine. Meanwhile the fertilization rate was significantly lower (P 0,05) in prepubertal ovine oocytes than ovine pubertal oocytes (60% vs 77,7%). The incidence of polyspermia tend to be higher in prepubertal ovine oocytes than pubertal ovine oocytes (21,8% vs 7,4%) (P 0,05). In conclusion, prepubertal and pubertal ovine oocytes have the similar in vitro maturation ability. The ability of prepubertal ovine oocytes to be fertilized were lower than ovine pubertal.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biologi Reproduksi
KEMAMPUAN MATURASI DAN FERTILISASI OOSIT
DARI OVARIUM DOMBA PREPUBER
SECARA
IN VITRO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Tesis : Kemampuan Maturasi dan Fertilisasi Oosit dari Ovarium Domba Prepuber secara In Vitro
Nama : Anita Hafid NIM : B352130121
Disetujui oleh Komisi Pembimbing
Prof Dr drh Mohamad Agus Setiadi Ketua
drh Ni Wayan Kurniani Karja MP PhD Anggota
Diketahui oleh
Ketua Program Studi Biologi Reproduksi
Prof Dr Drh Mohamad Agus Setiadi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah MScAgr
PRAKATA
Alhamdulillahi Rabbil ‘Alamin puji dan syukur penulis panjatkan kepada Allah Subhanahu wa Ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari sampai Juni 2015 ini ialah kemampuan maturasi dan fertilisasi oosit dari ovarium domba prepuber secara in vitro.
Ungkapan terima kasih penulis ucapkan kepada Bapak Prof Dr drh Mohamad Agus Setiadi selaku Ketua Komisi Pembimbing dan Ibu drh Ni Wayan Kurniani Karja MP PhD selaku Anggota Komisi Pembimbing yang telah memberikan banyak bimbingan, arahan, perhatian dan nasihatnya selama melakukan penelitian dan penulisan karya ilmiah ini sehingga penulis dapat menyelesaikan rangkaian penelitian ini hingga selesai. Terima kasih kepada Bapak Prof Dr drh Bambang Purwantara MSc selaku penguji luar komisi atas saran dan kritiknya sehingga dapat lebih memperkaya dan menyempurnakan substansi tesis.
Ungkapan terima kasih juga penulis ucapkan kepada Rektor, Dekan sekolah Pascasarjana, Dekan Fakultas Kedokteran Hewan, Ketua Departemen Klinik Reproduksi dan Patologi, Ketua Program Studi Biologi Reproduksi, staf pengajar dan staf administrasi Biologi Reproduksi, serta seluruh staf Pascasarjana Institut Pertanian Bogor yang telah menerima penulis untuk melanjutkan studi serta membantu kelancaran proses penyelesaian studi penulis.
Terima kasih juga penulis ucapkan kepada Direktorat Jenderal Pendidikan dan Perguruan Tinggi yang telah memberikan dukungan dana pendidikan dan penelitian melalui program Beasiswa Pendidikan Pascasarjana dalam Negeri (BPP-DN) sehingga dapat membantu penulis selama penelitian dan masa studi. Serta terima kasih kepada kepala dan staff Rumah Potong Hewan (RPH) yang telah banyak membantu penulis dalam menyediakan sampel penelitian sehingga penulis dapat menyelesaikan penelitian hingga selesai.
Ungkapan terima kasih yang sedalam-dalamnya terkhusus penulis ucapkan kepada Ayahanda dan Ibunda tercinta, yang telah memberikan doa, kasih sayang dan pengorbanan yang tiada henti-hentinya mengalir untuk penulis. Demikian juga kepada sahabat seperjuangan hingga akhir, Nur‘aisyah Amrah Safitri S.Pt, M.Si terima kasih atas support dan motivasi yang selalu hadir, memberikan inspirasi selama menjalani penelitian dan penulisan karya ilmiah ini. You’re absolutely the real titanium in every pain that you’ve got.Thanks for being my best friend in every single time.
Serta kepada teman-teman di program studi Biologi Reproduksi (BRP) IPB dan seluruh keluarga besar atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL x
DAFTAR GAMBAR x
DAFTAR LAMPIRAN x
1 PENDAHULUAN 1
Latar Belakang 1
Kerangka Pemikiran 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Hipotesis Penelitian 2
2 TINJAUAN PUSTAKA 3
Folikulogenesis pada Domba 3
Mekanisme Hormonal Prepubertas dan Pubertas pada Domba 5 Maturasi dan Fertilisasi Oosit In Vitro pada Domba 6
3 METODE 9
Tempat dan Waktu Penelitian 9
Penelitian tahap I: Kemampuan maturasi inti oosit domba prepuber 9
Koleksi dan maturasi oosit 9
Evaluasi tingkat maturasi oosit 10
Penelitian tahap II: Kemampuan fertilisasi oosit domba prepuber 10
Koleksi dan maturasi oosit 10
Persiapan spermatozoa dan fertilisasi oosit in vitro 10 Evaluasi tingkat fertilisasi oosit 10
Prosedur Analisis Data 11
4 HASIL DAN PEMBAHASAN 11
Hasil 11
Pembahasan 13
5 SIMPULAN 15
DAFTAR PUSTAKA 15
LAMPIRAN 20
DAFTAR TABEL
1 Berat ovarium dan kualitas oosit domba prepuber dan puber 11 2 Status inti oosit domba prepuber dan puber setelah dimaturasi secara
in vitro 11
3 Status inti oosit domba prepuber dan puber setelah difertilisasi secara
in vitro 13
DAFTAR GAMBAR
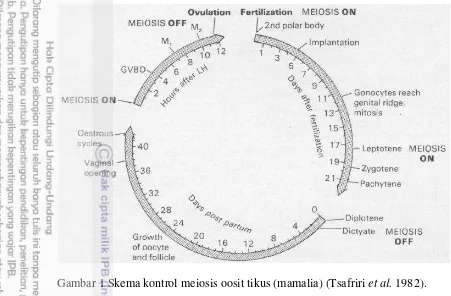
1 Skema kontrol meiosis oosit tikus (mamalia) 4 2 Mekanisme aktivasi oosit oleh spermatozoa dalam proses fertilisasi 8 3 Perubahan meiosis inti oosit domba prepuber dan domba puber 12 4 Pembentukan pronukleus pada oosit domba prepuber dan domba
puber setelah difertilisasi 12
DAFTAR LAMPIRAN
1 Komposisi medium transportasi ovarium 20
2 Komposisi medium koleksi oosit 20
3 Komposisi medium maturasi in vitro 21
1
1
PENDAHULUAN
Latar Belakang
Sumber oosit untuk produksi embrio in vitro (PEIV)pada ternak umumnya diperoleh dari rumah potong hewan (RPH) yang sudah mengalami pubertas disebabkan mekanisme hormonal (Hafez dan Hafez 2000) dan ultrastruktur oosit (Hyttel et al. 1997) hewan pubertas telah sempurna. Selain itu kriteria umum yang digunakan untuk pemilihan oosit pada PEIV mengacu pada kriteria sel kumulus yang kompak dan sitoplasma yang homogen, sehingga oosit yang diperoleh mendekati keseragaman. Perubahan sitoplasma menjadi hal yang penting untuk mendukung perkembangan embrio, termasuk di dalamnya yaitu perkembangan mekanisme pengaturan kalsium, perubahan aktivitas maturation promoting factor (MPF) dan mitogen activated protein kinase (MAPK), pendistribusian organel sel dan lain sebagainya (Anguita et al. 2007).
Selain kriteria pemilihan oosit tersebut, oosit yang dikoleksi biasanya berasal dari folikel antral, hal ini karena oosit dari folikel antral merupakan oosit yang sedang tumbuh dan cenderung lebih aktif dalam melakukan proses transkripsi dan translasi untuk menghasilkan ribonucleic acid (RNA) dan protein yang penting untuk proses perkembangan selanjutnya (Hyttel et al. 1997). Secara umum folikel antral memiliki diameter 2-4 mm pada domba dan 4-6 mm pada sapi (Evans 2003). Sementara itu dilaporkan folikel antral pada kambing prepuber berdiameter 2-6 mm (Velilla et al. 2004) dan pada domba prepuber telah mencapai ukuran diameter 4-6 mm (Kochhar et al. 2002). Kauffold et al. (2005) juga melaporkan bahwa kemampuan perkembangan pada sapi prepuber dan sapi puber meningkat pada folikel ukuran 2-3 mm. Selain itu ukuran diameter oosit yang sering digunakan yaitu 110-150 µm pada domba (Shirazi dan Sadeghi 2007) dan ≥110 µm pada sapi (Hyttel et al. 1997). Kriteria ini sering dijadikan sebagai patokan dalam pemilihan oosit untuk PEIV. Hal ini karena oosit yang telah mencapai diameter ≥110 µm dilaporkan memiliki kemampuan penuh untuk dapat menyelesaikan meiosis dan dapat mencapai maturasi inti sampai ke tahap metafase II (MII) (Cran et al. 1980; Fair et al. 1995; Hyttel et al. 1997).
Selain itu sumber oosit dari ovarium domba prepuber menjadi hal yang menarik, karena kesukaan masyarakat Indonesia yang mengkonsumsi sate kambing atau domba yang masih muda yang banyak dikenal sebagai domba bawah lima bulan (BALIBU). Sehingga hal ini merupakan satu harapan baru untuk memperoleh sumber oosit dari rumah potong hewan untuk PEIV.
2
belum sempurna seperti pada oosit yang berasal dari domba yang sudah mengalami pubertas (O’Brien 1996).
Namun demikian beberapa penelitian menggunakan oosit yang berasal dari hewan prepuber memperlihatkan kemampuan perkembangan yang baik, seperti pada kambing (Izquierdo et al. 1998; Anguita et al. 2007), sapi (Chohan dan Hunter 2004, Alm et al. 2006), babi (O’Brien et al. 2000), dan tikus (Miyano 2005). Oleh karena itu penelitian ini dilakukan untuk dapat mengamati kemampuan perkembangan oosit domba prepuber setelah dimaturasi dan difertilisasi secara in vitro.
Kerangka Pemikiran
Menjelang pubertas terjadi perkembangan folikel yang terus berlanjut bahkan telah mencapai folikel antral. Sumber oosit untuk PEIV biasanya berasal dari folikel antral, hal ini karena oosit dari folikel antral merupakan oosit yang sedang tumbuh dan cenderung lebih aktif dalam melakukan proses transkripsi dan translasi untuk menghasilkan RNA dan protein yang penting untuk proses perkembangan selanjutnya. Aktivitas yang terdapat dalam oosit yang sedang berkembang tersebut secara berangsur-angsur meningkatkan kompetensi perkembangan oosit. Secara umum folikel antral memiliki diameter 2-4 mm pada domba, ukuran diameter folikel antral tersebut juga telah dimiliki domba yang belum mengalami pubertas. Adapun ukuran oosit yang berasal dari folikel antral telah mencapai diameter hingga 110 µm. Ukuran diameter oosit tersebut memiliki kemampuan yang penuh untuk dapat menyelesaikan meiosis dan dapat mencapai maturasi inti sampai ke tahap MII. Berdasarkan hal tersebut, oosit dari ovarium domba yang belum mengalami pubertas diduga memiliki kompetensi perkembangan yang sama dengan oosit yang sudah mengalami pubertas dalam PEIV.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengamati kemampuan perkembangan oosit domba prepuber setelah dimaturasi dan difertilisasi secara in vitro.
Manfaat Penelitian
Hasil penelitian diharapkan dapat memberikan informasi mengenai kualitas oosit dari ovarium domba prepuber untuk produksi embrio secara in vitro.
Hipotesis Penelitian
3
2
TINJAUAN PUSTAKA
Folikulogenesis pada Domba
Folikulogenesis merupakan proses perkembangan folikel yang berawal dari terbentuknya folikel primordial, kemudian berkembang menjadi folikel primer, sekunder, tersier, de Graaf hingga pada akhirnya oosit tersebut akan diovulasikan (Senger 2007). Folikel primordial terbentuk sejak masih dalam keadaan fetus sampai setelah lahir. Perkembangan dan pematangan folikel menunjukkan rangkaian tahapan transformasi molekuler dan subseluler dari keragaman komponen folikel, yaitu oosit, sel granulosa dan sel teka. Semuanya diatur oleh beberapa faktor intraovarian, intrafolikuler dan sinyal hormonal yang diatur oleh sekresi androgen dan estrogen (umumnya estradiol). Perkembangan folikel melibatkan regulasi hormonal yang menstimulasi proliferasi dan diferensiasi dari sel teka dan sel granulosa sehingga meningkatkan kemampuan folikel untuk memproduksi estradiol dan untuk merespon gonadotropin. Produksi estradiol menentukan folikel mana yang akan mencapai reseptor LH yang penting untuk ovulasi dan luteinisasi (Hafez dan Hafez 2000).
Pada mamalia, proses oogenesis dimulai saat perkembangan awal fetus. Oogenesis dimulai dari pembentukan primordial germ cell, kemudian meliputi serangkaian perubahan bentuk menjadi oogonia kemudian menjadi oosit primer (Wassarman 1988). Oogonium berkembang menjadi beberapa Oogonia melalui pembelahan mitosis (fase proliferasi). Pada akhir proliferasi, meiosis dimulai dan oogonia berdiferensiasi menjadi oosit primer melalui tahap leptoten, zygoten, pachyten pada fase profase sebelum terjadi istirahat meiosis pada tahap diploten (dictyate) (Gordon 2003). Inti oosit primer pada tahap ini disebut germinal vesicle (GV) yang ditandai dengan adanya membran inti yang utuh dan inti yang jelas. Dalam perkembangan menjadi oosit, oogonia mengalami pembelahan meiosis menjadi dua sel untuk mereduksi kromosom diploid menjadi haploid (Gordon 2003).
4
Gambar 1 Skema kontrol meiosis oosit tikus (mamalia) (Tsafriri et al. 1982). Perkembangan oosit mengiringi perkembangan folikel. Oosit yang berukuran kecil yang dilapisi oleh sel granulosa berbentuk pipih disebut folikel primordial. Oosit yang telah memasuki fase perkembangan ditandai dengan adanya perubahan morfologi dari sel granulosa, dimana sel granulosa telah berubah bentuk menjadi kuboid, dan folikel ini disebut dengan folikel primer. Setelah terjadi perubahan morfologi sel granulosa, folikel berkembang dari proliferasi aktif dari sel granulosa itu sendiri, kemudian folikel primer berubah menjadi folikel sekunder (Miyano 2005). Pada folikel sekunder telah terjadi transkripsi RNA pada oosit, oosit mulai teraktivasi dan sintesis RNA selanjutnya akan terus dipertahankan sampai diameter oosit mencapai ukuran folikel tersier. Transisi dari folikel sekunder ke folikel tersier awal (pre-antral follicle) dicirikan dengan terbentuknya antrum dan peningkatan ukuran diameter. Sedangkan oosit pada folikel tersier dicirikan oleh berpindahnya organel-organel sel ke arah perifer (Hyttel et al. 1997).
Dalam ovarium mamalia, seluruh oosit tidak memulai perkembangan dalam waktu yang sama. Hanya sedikit oosit dari folikel primordial yang masuk pada fase perkembangan dan mencapai ukuran akhirnya sebelum pubertas. Setelah pubertas beberapa oosit dari folikel primordial selanjutnya direkrut untuk masuk pada fase perkembangan (Miyano 2005). Dinamika folikuler dalam folikulogenesis terdiri atas tahap pertumbuhan dan degenerasi folikel. Dinamika folikel antral dan atau gelombang folikel meliputi empat proses, yaitu meliputi tahap rekruitmen, seleksi, dominan dan atresia. Proses rekruitmen melibatkan sekelompok folikel antral yang memulai untuk tumbuh dengan sebagiannya mengalami atresia. Folikel yang bertahan dan tidak mengalami atresia merupakan folikel terseleksi yang kemudian akan terus tumbuh dan bersaing menjadi satu folikel dominan. Dalam upayanya menuju satu folikel dominan maka sebagian besar folikel terseleksi akan mengalami atresia (Senger 1997).
5
2007). Kompetensi oosit memiliki korelasi yang dekat dengan ukuran oosit, serta berkorelasi dengan ukuran folikel (Lechniak et al 2002). Ukuran oosit dapat digunakan secara umum sebagai sebuah indikator dari pertumbuhan oosit.
Selama folikulogenesis pematangan sitoplasma mencakup rangkaian masenger ribonucleic acid (mRNA), protein, substrat, nutrien, dan akumulasi mitokondria dalam sitoplasma (Khatun et al. 2011). Seperti adanya sintesis RNA secara intensif selama fase ini yang menyebabkan peningkatan pada ukurannya. Faktor sitoplasma termasuk mRNA dan molekul protein disintesis selama perkembangan oosit yang diakumulasikan lagi secara berangsur-angsur pada tahap akhir pertumbuhan folikel, dan penting untuk perkembangan awal embrio sebelum aktivasi genom embrio (Armstrong 2001). Menurut Crozet et al. (1995) pada hewan betina dewasa, diameter folikel berhubungan positif dengan diameter oosit dan kemampuan perkembangan oosit.
Pada siklus ovarium normal dari hewan betina puber, kemampuan oosit sepenuhnya diperoleh selama tahap akhir dari pertumbuhan folikel sebelum ovulasi dibawah pengaruh sentakan GnRH yaitu FSH dan LH, yang dipicu oleh sinyal umpan balik positif dari folikel yang telah matang mempengaruhi hypotalamus-pituitary (Armstrong 2001).
Mekanisme Hormonal Prepubertas dan Pubertas pada Domba
Masa pubertas domba adalah 6 sampai 9 bulan yang dipengaruhi oleh faktor genetik dan lingkungan seperti perbedaan jenis. Selain itu faktor internal dan faktor eksternal seperti makanan dan perubahan sekresi LH mempengaruhi tercapainya masa pubertas (Jainudeen et al. 2000).
Pertumbuhan dan perkembangan folikel saat pubertas dipengaruhi oleh hormon-hormon gonadotropin. Banyak folikel berkembang selama fase-fase pertama estrus. Proses pematangan oosit dan pertumbuhan embrio awal sangat dipengaruhi oleh fungsi FSH yang dihasilkan oleh pituitary anterior. FSH dan LH yang rendah menyebabkan folikulogenesis tidak terjadi (Senger 1997). Ovarium dengan folikel yang banyak akan memberi gambaran FSH yang tinggi. Hormon ini merupakan hormon perangsang pertumbuhan folikel dan pematangan oosit di dalam folikel melalui peningkatan proliferasi sel folikuler dan perubahan steroid androgenik menjadi golongan estrogen. Semakin berkembang folikel maka besar dan kualitas oosit semakin meningkat (Sayuti et al. 2007). Pada domba, satu atau dua folikel yang besar mensekresikan banyak hormon estrogen daripada folikel yang lebih kecil (Hafez dan Hafez 2000).
Hypotalamus terdiri dari tonic GnRH center dan preovulatori GnRH center (surge center). Pada hewan betina, umpan baliknegatif dari tonic GnRH center dan hormon steroid dari ovarium (estrogen dan progesteron) menghambat sekresi LH dan FSH. Perkembangan folikel mensekresikan sejumlah estradiol. Ketika konsentrasi estradiol mencapai jumlah yang tinggi, maka ia akan memicu pelepasan LH dalam jumlah yang besar (Swerdloff dan Odell 1975).
6
Dibawah kondisi normal betina prepuber, GnRH tonic center menstimulasi LH dari pituitary anterior, amplitudo LH tersebut dapat meningkat seperti pada betina puber, akan tetapi frekuensi GnRH pada betina prepuber masih lebih rendah daripada frekuensi GnRH dari betina yang telah puber. Rendahnya GnRH menandakan rendahnya stimulus pituitary anterior untuk melepaskan FSH dan LH, sehingga perkembangan folikel tidak menghasilkan estradiol dalam jumlah yang tinggi (Hafez dan Hafez 2000).
Onset pubertas ditandai dengan peningkatan secara berangsur-angsur dari frekuensi dan amplitudo sekresi GnRH. GnRH secara langsung mensintesis dan mensekresi FSH dan LH di pituitary yang berperan menstimulasi produksi hormon steroid gonad dan melengkapi proses perkembangan oosit. Tingginya level estrogen menyebabkan munculnya karakteristik seks sekunder (Sisk dan Zehr2005).
Onset pubertas bergantung pada kemampuan spesifik hypotalamus untuk memproduksi GnRH dalam jumlah yang cukup untuk menaikkan dan mendukung terjadinya gametogenesis (Senger 1997). Rendahnya sensitivitas dari hypothalamus yang mengontrol sekresi GnRH terhadap umpan baliknegatif estradiol juga penting dalam onset pubertas (Ramirez dan McCann 1963). Menurut konsep tersebut, rendahnya sensitivitas terhadap umpan balik negatif estradiol mengakibatkan peningkatan sekresi GnRH di pituitary anterior sehingga dapat menyebabkan pematangan folikel di ovarium dan menyebabkan terjadinya ovulasi (Day et al. 1984). Pada penelitian Henricks et al. (1974) menunjukkan konsentrasi estradiol dari hewan yang sudah mengalami pubertas lebih tinggi daripada hewan yang belum mengalami pubertas. Sekresi LH terhadap umpan balik negatif estradiol lebih sedikit pada hewan prepuber daripada hewan puber (Day et al. 1984). Foster dan Ryan (1979) melaporkan bahwa peningkatan konsentrasi LH terjadi dua hingga enam hari sebelum LH surge pertama pada domba.
Maturasi dan Fertilisasi Oosit In Vitro pada Domba
Maturasi oosit mamalia didefinisikan sebagai rangkaian kejadian yang terjadi dari tahap GV sampai pada tahap pembelahan meiosis kedua dengan pembentukan badan kutub pertama. Inti dan sitoplasma oosit mendukung perkembangan embrio. Pematangan inti meliputi berbagai perubahan tahapan meiosis, sedangkan pematangan sitoplasma merupakan penambahan kompetensi biologis oosit yang meliputi berbagai perubahan struktur dan biokimiawi di dalam sitoplasma yang memungkinkan oosit untuk mengekspresikan kemampuan perkembangannya setelah fertilisasi serta pembentukan dan perkembangan embrio (Gordon 2003).
7
total COCs lebih gelap dibandingkan oosit tipe A dan B. Kategori oosit tipe D: memiliki sel kumulus yang sudah ekspan, sitoplasma tidak teratur, dan total COCs gelap dan tidak teratur.
Ada beberapa kriteria untuk menyeleksi kualitas oosit yang baik untuk meningkatkan maturasi oosit in vitro. Beberapa kriteria tersebut adalah ukuran folikel, level atresia, dan konsentrasi progesteron di dalam cairan folikel. Telah ditunjukkan bahwa kemampuan perkembangan oosit dikaitkan dengan morfologi COCs, morfologi sel corona radiata dan ukuran dari oosit. Ukuran oosit dapat digunakan secara umum sebagai sebuah indikator dari pertumbuhan oosit. Seperti adanya sintesis RNA secara intensif selama fase ini yang menyebabkan peningkatan pada ukurannya. Pada hewan betina dewasa, diameter folikel memiliki hubungan yang positif dengan diameter oosit serta kemampuan perkembangan oosit. Pada domba, terdapat hubungan antara ukuran folikel dan diameter oosit, dimana diameter oosit mempengaruhi perkembangan meiosis. Diameter oosit yang diperoleh dari folikel antral berukuran 2-6 mm memiliki kualitas yang lebih baik (Shirazi dan Sadeghi 2007). Kompetensi oosit memiliki korelasi yang dekat dengan ukuran oosit, serta berkorelasi dengan ukuran folikel. Ukuran oosit yang lebih kecil cenderung berkembang abnormal saat pembelahan meiosis sehingga menghasilkan gangguan saat proses maturasi (Lechniak et al. 2002).
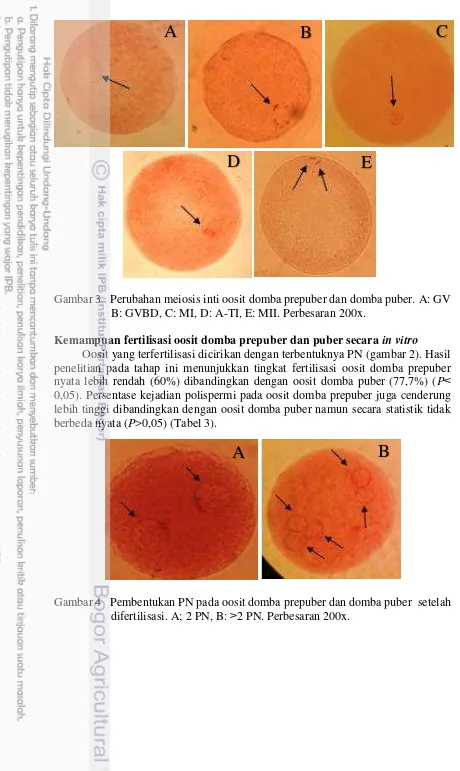
Tingkat maturasi inti dinilai berdasarkan kronologis perubahan status inti oosit yang dikelompokkan menjadi tahap GV yaitu ditandai dengan membran inti dan nukleolus masih terlihat; tahap GVBD ditandai dengan membran inti pecah dan nukleolus tidak terlihat serta kromosom mulai terkondensasi; tahap metafase I (MI) ditandai dengan kromosom terkondensasi dan tersusun pada spindle metafase; anafase-telofase I (A-TI) ditandai dengan kromosom homolog mulai terpisah; tahap MII ditandai dengan hadirnya kromosom homolog dan badan kutub pertama telah terlihat (Gordon 2003).
Kompetensi oosit diperoleh selama fase pertumbuhan, tidak hanya terjadi pematangan inti tetapi juga perubahan sitoplasma yang penting untuk perkembangan embrio. Perubahan sitoplasma termasuk terjadinya akumulasi protein dan RNA, perkembangan mekanisme regulasi kalsium, perubahan aktivitas MPF dan MAPK dan pendistribusian kembali dari organel seluler, dan lain-lain (Anguita 2007).
Oosit domba yang digunakan untuk fertilisasi in vitro terlebih dahulu harus melalui proses maturasi atau pematangan didalam inkubator selama 24 jam, dalam 5% CO2 dengan temperatur sekitar 39oC (Leoni et al. 2006). Pematangan oosit merupakan salah satu tahap penting dari rangkaian produksi embrio in vitro. Pematangan in vitro membantu oosit agar mampu menyelesaikan proses meiosis hingga mencapai tahap MII untuk dapat difertilisasi (Alomar et al. 2008). Oosit hewan mamalia secara umum harus mengalami pematangan inti dan pematangan sitoplasma hingga dapat difertilisasi sampai akhirnya berkembang menjadi embrio (Beilby et al. 2009).
8
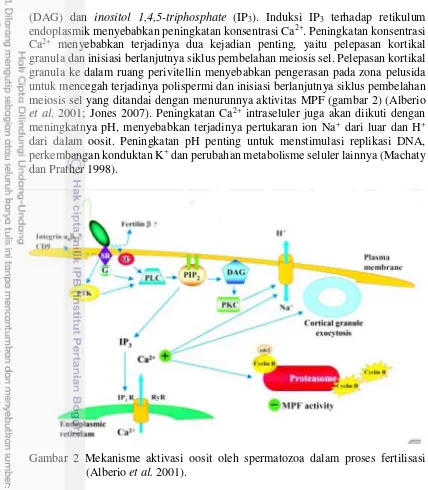
(DAG) dan inositol 1,4,5-triphosphate (IP3). Induksi IP3 terhadap retikulum endoplasmik menyebabkan peningkatan konsentrasi Ca2+. Peningkatan konsentrasi Ca2+ menyebabkan terjadinya dua kejadian penting, yaitu pelepasan kortikal granula dan inisiasi berlanjutnya siklus pembelahan meiosis sel. Pelepasan kortikal granula ke dalam ruang perivitellin menyebabkan pengerasan pada zona pelusida untuk mencegah terjadinya polispermi dan inisiasi berlanjutnya siklus pembelahan meiosis sel yang ditandai dengan menurunnya aktivitas MPF (gambar 2) (Alberio et al. 2001; Jones 2007). Peningkatan Ca2+ intraseluler juga akan diikuti dengan meningkatnya pH, menyebabkan terjadinya pertukaran ion Na+ dari luar dan H+ dari dalam oosit. Peningkatan pH penting untuk menstimulasi replikasi DNA, perkembangan konduktan K+ dan perubahan metabolisme seluler lainnya (Machaty dan Prather 1998).
Gambar 2 Mekanisme aktivasi oosit oleh spermatozoa dalam proses fertilisasi (Alberio et al. 2001).
9
3
METODE
Tempat dan Waktu Penelitian
Penelitian dilakukan pada bulan Januari sampai bulan Juni 2015 di Laboratorium Fertilisasi In Vitro, Bagian Reproduksi dan Kebidanan, Departemen Klinik, Reproduksi dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Metode Penelitian
Penelitian I: Kemampuan maturasi inti oosit domba prepuber A. Koleksi dan maturasi oosit
Ovarium domba diperoleh dari RPH, ditempatkan dalam media transportasi NaCl fisiologis 0,9% yang ditambahkan antibiotik 100 IU/mL penicillin (Sigma-Aldrich, St. Louis, MO, USA) dan 0,1 g/mL streptomycin (Sigma-Aldrich) dengan temperatur 35-37oC. Ovarium dari domba prepuber diperoleh berdasarkan ketidakhadiran korpus luteum atau korpus albicans pada kedua ovariumnya (Pawlak et al. 2012). Ovarium domba yang telah diperoleh ditimbang terlebih dahulu untuk mengetahui berat ovarium.
Koleksi oosit dilakukan dengan metode mencacah (slicing) bagian korteks ovarium menggunakan scalpel untuk mengeluarkan oositnya. Teknik koleksi oosit dilakukan pada cawan petri yang berisi larutan Phosphate Buffer Saline (PBS) yang disuplementasi dengan 10% fetal bovine serum (FBS) (Sigma, USA), 100 IU/mL penicillin dan 0,1 mg/mL streptomycin yang terlebih dahulu diekuilibrasi minimal selama dua jam di dalam inkubator CO2 5% dengan suhu 39oC.
Klasifikasi oosit dikategorikan ke dalam 4 tipe mengacu kepada kriteria yang digunakan De Loos et al. (1989) yaitu kategori oosit tipe A; memiliki multilayer sel kumulus yang kompak, sitoplasma homogen, dan total COCs terang dan transparan. Kategori oosit tipe B; memiliki multilayer sel kumulus yang kompak, sitoplasma homogen namun kelihatan kasar dan terdapat zona yang lebih gelap pada bagian tepi oosit dan total COCs sedikit lebih gelap dan kurang transparan. Kategori oosit tipe C; memiliki sel kumulus yang kurang kompak, sitoplasma tidak teratur, dan total COCs lebih gelap dibandingkan oosit tipe A dan B. Kategori oosit tipe D; memiliki sel kumulus yang sudah ekspan, sitoplasma tidak teratur, dan total COCs gelap dan tidak teratur. Oosit yang digunakan dalam penelitian ini adalah oosit kategori tipe A dan B atau oosit dengan sitoplasma yang homogen dan sel-sel kumulus yang kompak dengan lebih dari tiga lapisan tebal (Lonergan et al. 1992).
10
B. Evaluasi tingkat maturasi oosit
Oosit yang telah dimaturasi didenudasi sel-sel kumulusnya dengan bantuan enzim hyaluronidase 0.25% (Sigma, USA) dengan cara melakukan pemipetan berulang menggunakan pipet yang sesuai dengan ukuran oosit. Oosit yang telah dihilangkan sel-sel kumulusnya diletakkan pada drop PBS di atas cover glass yang memiliki bantalan paraffin dan vaselindi keempat sudutnya, kemudian difiksir pada kedua sisi bantalan paraffin dan vaselin. Preparat tersebut dimasukkan ke dalam larutan fiksasi yang mengandung asam asetat dan ethanol (1:3) selama 48-72 jam. Preparat kemudian diwarnai dengan 2% aseto orsein selama 5 menit, kemudian pewarna dibilas dengan 25% asam asetat. Pengamatan inti oosit dilakukan dengan menggunakan mikroskop fase kontras (Olympus IX, Japan). Tingkat maturasi inti dinilai berdasarkan kronologis perubahan status inti oosit yang dikelompokkan menjadi tahap GV, GVBD, MI, A-TI, dan MII. Keberhasilan maturasi inti oosit dinilai berdasarkan pada persentase oosit yang mampu mencapai tahap MII. Status inti oosit pada tahap ini diklasifikasikan sebagai oosit yang sudah matang dan siap untuk difertilisasi, ditandai dengan adanya badan kutub pertama dan kromosom homolog (Gordon 2003).
Penelitian II: Kemampuan fertilisasi oosit domba prepuber A. Koleksi dan maturasi oosit
Koleksi dan maturasi oosit dilakukan sama dengan prosedur pada penelitian tahap 1.
B. Persiapan spermatozoa dan fertilisasi oosit in vitro (IVF)
Oosit yang telah dimaturasi, selanjutnya difertilisasi secara in vitro. Semen beku dithawing di dalam waterbath pada suhu 30-32oC selama 30 detik, kemudian dicuci dengan cara disentrifugasi dalam media fertilisasi pada kecepatan 1800 rpm selama 5 menit. Setelah melakukan sentrifugasi, supernatant dibuang hingga menyisakan endapan spermatozoa sekitar 200 µL, kemudian konsentrasi spermatozoa dihitung untuk menentukan jumlah media fertilisasi dan spermatozoa agar diperoleh konsentrasi akhir 5x106 spermatozoa/mL.
Campuran spermatozoa dan media fertilisasi dibuat dalam bentuk drop 100 µL untuk 10-15 oosit, kemudian ditutup dengan mineral oil (Sigma-USA). Oosit yang sudah dimaturasi dicuci dalam media fertilisasi sebanyak 2 kali, kemudian dipindahkan ke dalam drop dan diinkubasi selama 12-14 jam dalam inkubator CO2 5% temperatur 39oC.
C. Evaluasi tingkat fertilisasi in vitro
Oosit yang telah difertilisasi kemudian difiksasi dan diwarnai menggunakan metode yang sama seperti pada evaluasi tingkat maturasi oosit. Penentuan tingkat kemampuan fertilisasi in vitro dilakukan berdasarkan pada pembentukan dan jumlah pronukleus (PN). Total oosit yang terfertilisasi adalah oosit yang mempunyai dua atau lebih PN. Fertilisasi normal ditandai dengan terbentuknya 2PN, sedangkan oosit yang mempunyai lebih dari 2PN dikategorikan sebagai polispermi.
Prosedur Analisis Data
11
4
HASIL DAN PEMBAHASAN
Hasil
Berat ovarium dan kualitas oosit domba prepuber dan puber
Pada penelitian ini ovarium yang digunakan pada domba prepuber memiliki rata-rata berat 0,4 gram lebih ringan dibandingkan dengan ovarium dari domba yang sudah mengalami pubertas 1,1 gram. Dari kelompok oosit domba prepuber dan oosit domba puber menunjukkan tidak terdapat perbedaan yang signifikan (P˃ 0.05) dimana diperoleh hasil oosit tipe A (1.4 vs 1.0), dan oosit tipe B diperoleh (2.6 vs 2.7). Sementara itu oosit tipe C (3,6 vs 3,0) juga menunjukkan tidak terdapat perbedaan yang signifikan (P˃0.05) kecuali pada oosit tipe D terdapat perbedaan yang signifikan (2,5 vs 1,3) (P 0,05) (Tabel 1).
Tabel 1 Berat ovarium dan kualitas oosit domba prepuber dan puber
Kelompok
a,b superscript yang berbeda pada kolom yang sama menunjukkan perbedaan yang nyata (P 0,05).
Kemampuan maturasi oosit domba prepuber dan puber secara in vitro
Pada tabel 2 hasil penelitian menunjukkan tidak ada perbedaan yang nyata pada oosit yang mencapai tahap MII dari domba prepuber (89,1%) dibandingkan dengan oosit domba puber (89,1%) (P> 0,05). Perubahan meiosis inti disajikan
Prepuber 55 1(1.8±4.5) 1 (1.8±3.7) 1(1.8±4.1) 1(1.8±5.1) 49(89.1±1.9)
Puber 55 0(0.0±0.0) 2(3.6±10.2) 2(3.6±5.9) 0(0.0±0.0) 49(89.1±10.2)
12
Gambar 3 Perubahan meiosis inti oosit domba prepuber dan domba puber. A: GV B: GVBD,C: MI, D: A-TI, E: MII. Perbesaran 200x.
Kemampuan fertilisasi oosit domba prepuber dan puber secara in vitro
Oosit yang terfertilisasi dicirikan dengan terbentuknya PN (gambar 2). Hasil penelitian pada tahap ini menunjukkan tingkat fertilisasi oosit domba prepuber nyata lebih rendah (60%) dibandingkan dengan oosit domba puber (77,7%) (P 0,05). Persentase kejadian polispermi pada oosit domba prepuber juga cenderung lebih tinggi dibandingkan dengan oosit domba puber namun secara statistik tidak berbeda nyata (P>0,05) (Tabel 3).
Gambar 4 Pembentukan PN pada oosit domba prepuber dan domba puber setelah difertilisasi. A; 2 PN, B: 2 PN. Perbesaran 200x.
B
A
C
D
E
A
13
Tabel 3 Status inti oosit domba prepuber dan puber setelah difertilisasi secara in vitro.
Kelompok
Total oosit (n)
Pembentukan Pronukleus n (% ± SD)
2 PN 2 PN Total Terfertilisasi Prepuber 55 33 (60±8.9)a 12 (21.8±12.2) 45 (81.8±7.4) Puber 54 42 (77.8±6.3)b 4 (7.4±7.6) 46 (85.2±1.3) a,b superscript yang berbeda pada kolom yang sama menunjukkan perbedaan yang nyata (P 0,05). Normal: 2PN; Polispermi: membentuk >2 PN.
Pembahasan
Kemampuan Maturasi Oosit Domba Prepuber
Berat rata-rata ovarium domba puber lebih berat dibandingkan dengan domba prepuber, disebabkan hadirnya korpus luteum atau korpus albicans pada salah satu atau kedua ovarium. Korpus luteum akan bertambah berat secara cepat sampai sekitar pertengahan periode siklus pubertas (Boediono et al. 1999).
Ketidakhadiran korpus luteum atau korpus albicans pada ovarium domba prepuber disebabkan belum terjadinya ovulasi. Hal ini karena sebelum pubertas GnRH surge center dan tonic center memiliki frekuensi amplitudo yang rendah, dimana GnRH tonic center tidak mampu menstimulasi LH dari pituitary anterior. Frekuensi GnRH pada betina prepuber yang masih lebih rendah mengakibatkan rendahnya stimulus pituitary anterior untuk melepaskan FSH dan LH, sehingga perkembangan folikel tidak menghasilkan estradiol dalam jumlah yang tinggi akibatnya tidak dapat terjadi ovulasi (Hafez dan Hafez 2000).
Oosit yang yang digunakan dalam penelitian ini merupakan oosit yang memiliki kategori tipe A dan tipe B baik dari ovarium domba prepuber maupun ovarium domba puber. Dari kelompok oosit domba prepuber dan oosit domba puber diperoleh hasil oosit tipe A (1,4 vs 1,0) (P 0,05), sedangkan oosit tipe B yaitu (2,6 vs 2,7) (P 0,05), dimana tidak terdapat perbedaan yang signifikan dalam perolehan pada kedua kriteria oosit tersebut (tabel 1). Sementara itu oosit tipe C juga tidak menunjukkan perbedaan yang signifikan (3,6 vs 3,0) (P 0,05), kecuali pada oosit tipe D terdapat perbedaan yang signifikan (2,5 vs 1,3) (P 0,05). Hal ini menunjukkan bahwa ovarium domba prepuber memiliki potensi yang tidak jauh berbeda dalam perolehan oosit yang baik dibandingkan dengan domba yang sudah mengalami pubertas, sehingga ovarium domba prepuber memiliki potensi sebagai sumber oosit. Jumlah oosit yang berada pada kategori tipe D pada oosit domba prepuber yang lebih banyak dibandingkan oosit domba puber diduga disebabkan karena domba prepuber memiliki kontrol hormonal yang lebih rendah dibandingkan dengan domba yang sudah mengalami pubertas sehingga terdapat banyak oosit yang mengalami degenerasi pada oosit domba prepuber.
14
perbedaan pada ultrastruktur termasuk distribusi organel intraseluler oosit domba prepuber maupun oosit domba puber, namun ukuran mitokondria dan kortikal granula pada oosit domba prepuber dilaporkan lebih kecil dibandingkan dengan oosit domba puber.
Tingkat maturasi inti oosit merupakan salah satu parameter dan indikator yang biasa digunakan untuk mengetahui kompetensi perkembangan oosit selanjutnya. Selama proses maturasi terjadi perubahan proses meiosis (Gordon 2003). Perubahan meiosis I dimulai dengan terjadinya GVBD setelah tahapan GV hingga mencapai tahap MII. Hasil penelitian menunjukkan tidak ada perbedaan yang nyata pada oosit yang mencapai tahap MII dari domba prepuber (89,1%) dibandingkan dengan oosit domba puber (89,1%) (P> 0,05) (Tabel 2). Hal ini menunjukkan oosit domba prepuber memiliki kemampuan yang sama dengan oosit domba puber dalam mencapai tahap MII. Temuan ini sejalan dengan penelitian Ledda et al. (1999) yaitu oosit dengan diameter yang sama yang diperoleh dari domba prepuber maupun domba yang sudah puber memiliki kemampuan yang sama pada tingkat pembelahan meiosisnya. Martino et al. (1995) juga melaporkan kambing prepuber memiliki tingkat maturasi yang sama dengan kambing puber.
Oosit domba prepuber telah memiliki folikel antral. Hal ini karena perkembangan folikel pada domba telah berlangsung pada usia 2 minggu dan telah mencapai folikel antral pada usia 4 minggu (Berlinguer et al. 2007). Secara umum folikel antral memiliki diameter 2-4 mm pada domba (Evans 2003), dan dilaporkan folikel domba prepuber telah mencapai ukuran diameter 4-6 mm (Kochhar et al. 2002). Adapun folikel domba prepuber maupun folikel domba puber yang digunakan dalam penelitian ini merupakan folikel yang memiliki diameter sekitar 2-4 mm (folikel antral). Oosit yang berasal dari folikel antral merupakan oosit yang sedang tumbuh dan cenderung lebih aktif dalam melakukan proses transkripsi dan translasi untuk menghasilkan RNA dan protein yang penting untuk proses perkembangan selanjutnya (Hyttel et al. 1997; Torner et al. 2008). Akumulasi lipid dalam sitoplasma oosit sama pentingnya dengan akumulasi protein dan mRNA untuk mendukung perkembangan awal oosit (Sierard et al. 2006). Sehingga oosit domba prepuber maupun domba puber dapat memperlihatkan kemampuan yang sama dalam perkembangan maturasinya. Lebih lanjut Anguita et al. (2007) juga melaporkan bahwa ukuran diameter tertentu pada oosit kambing prepuber mempunyai kompetensi perkembangan yang baik hingga tahap blastosis.
Kemampuan Fertilisasi Oosit Domba Prepuber
15
Proses pembelahan meiosis dan maturasi oosit dikontrol oleh enzim protein kinase dan fosfatase melalui fosforilasi dan defosforilasi, yang dikenal dengan MPF dan MAPK (Whitaker 1996). Aktivitas MPF muncul sesaat sebelum tahap GVBD kemudian meningkat pada tahap MI dan selanjutnya akan mengalami penurunan selama transisi dari tahap MI ke tahap MII dan kembali meningkat pada tahap MII (Gordon 2003). Pada oosit tahap MII, MPF diperlukan untuk menstimulasi pembentukan pronukleus betina yang normal setelah fertilisasi (Kikuchi et al. 2000). Aktivitas MPF pada oosit domba prepuber maupun oosit domba puber memiliki fluktuasi yang sama selama pembelahan meiosis namun pada tahap MII kadar MPF pada oosit domba prepuber menunjukkan kadar yang lebih rendah dibandingkan dengan oosit domba puber (Ledda et al. 2001: Anguita et al. 2007).
Adapun bentuk aktivasi dari MPF kompleks ini dipengaruhi oleh penurunan sintesis cyclin B atau tidak sempurnanya fosforilasi residu threonin-serine yang dapat terjadi pada tahap ini yang dapat berpengaruh pada pembentukan aktivasi MPF kompleks (Ledda et al. 2001). Selain itu aktivitas MAPK juga rendah, penurunan energi metabolisme, minimnya influx Ca2+ pada fertilisasi dan penurunan kemampuan hidup pada embrio setelah fertilisasi (Khatir et al. 1998; Armstrong et al. 2001; Palma et al. 2001; Salamone et al. 2001). Hal inilah yang diduga mengakibatkan rendahnya kualitas oosit domba prepuber dalam upaya mencapai pembentukan 2 PN.
Persentase kejadian polispermi pada oosit domba prepuber juga cenderung lebih tinggi dibandingkan dengan oosit domba puber (P>0,05) (Tabel 3). Hal ini kemungkinan karena oosit domba prepuber memperlihatkan parameter yang berbeda dari pematangan sitoplasmanya, termasuk tidak meratanya distribusi organel sel yaitu kortikal granula (Gandolfi et al., 2000). Eksositosis dari isi kortikal granula tersebut mengantarkan pada reaksi kortikal yang kemudian diikuti dengan reaksi zona pellusida yang akan menjadi dinding pertahanan melawan polispermi (Slavik et al. 2005). Hyttel et al. (1997) melaporkan bahwa diantara peristiwa yang lain melalui distribusi kembali organel sel termasuk kortikal granula yang penting untuk menginduksi reaksi kortikal dan reaksi zona. Gandolfi et al. (2000) juga melaporkan bahwa perubahan struktural tersebut tertunda dan tidak sempurna pada oosit domba prepuber sehingga dapat menjadi penyebab kegagalan perubahan pada zona pellusida.
5. SIMPULAN DAN SARAN
Simpulan
Dari hasil penelitian yang diperoleh dapat disimpulkan bahwa oosit domba prepuber memiliki kemampuan maturasi yang sama dengan oosit domba puber namun memiliki kemampuan fertilisasi yang lebih rendah.
Saran
16
DAFTAR PUSTAKA
Alberio R, Zakhartchenko V, Motlik J, Wolf E. 2001. Mammalian oocyte activation: lessons from the sperm and implication for nuclear transfer. Int J Dev Biol 45:797-809.
Alm H, Katska-Ksiazkiewicz L, Rynska B, Tuchscherer A. 2006. Survival and meiotic competence of bovine oocytes originating from early antral ovarian follicles. Theriogenology 65: 1422-1434.
Alomar M, Tasiaux H, Remacle S, George F, Paul D, Donnay I. 2008. Kinetics of fertilization and developmental, and sex ratio of bovine embryos produced using the semen of different bulls. Theriogenology 107: 48-61.
Anguita B, Jimenez-Macedo AR, Izquierdo D, Mogas T, Maria-Teresa P. 2007. Effect of oocyte diameter on meiotic competence, embryo development, p34 (cdc2) expression and MPF activity in prepubertal goat oocytes. Theriogenology 67: 526-536.
Armstrong DT. 2001. Effects of maternal age on oocyte developmental competence. Theriogenology 55: 1303-1322.
Beilby KH, Grupen CG, Thomson PC, Maxwell WMC, Evans G. 2009. The effect of insemination time and sperm dose on pregnancy rate using sex-sorted ram sperm. Theriogenology 71: 829-835.
Berlinguer F, Succu S, Mossa F, Madeddu M, Bebbere D, Leoni GG, Naitana S. 2007. Effects of trehalose co-incubation on in vitro matured prepubertal ovine oocyte vitrification. Cryobiology 55: 27-34.
Boediono A, Rusiyantono Y, Mohamad K, Djuwita I, Sukra Y. 1999. Produksi embrio kambing dengan teknologi maturasi, fertilisasi dan kultur in vitro. Seminar Nasional Peternakan dan Veteriner: 258-263.
Chohan KR, Hunter AG. 2004. In vitro maturation, fertilization and early cleavage rates of bovine fetal oocytes. Theriogenology 61: 373-380.
Cran DG, Moor RM, Hay MF. 1980. Fine structure of the sheep oocyte during antral follicle development. J Reprod Fertil 59: 125-132.
Crozet N, Huneau D, De Smedt V, Theron MC, Szollosi D, Torres S, Sevellec C. 1987. In vitro fertilization with normal development in the sheep. Gamete Res 16: 159-170.
Crozet N. 1988. Fine structure of sheep fertilization in vitro. Gamete Res 19: 291-303.
Crozet N, Ahmed-Ali M, Dubos MP. 1995. Developmental competence of goat oocytes from follicles of different size categories following maturation, fertilization and culture in vitro. J Reprod Fertil 103: 293–298.
Day ML, Imakawa K, Winder-Garcia M, Zalesky DD, Schanbacher BD, Kittok RJ, Kinder JE. 1984. Endochrine mechanisms of puberty in heifers: estradiol negative feedback regulation of luteinizing hormone secretion. Biol Reprod 31: 332-341.
De Loos FD, Vliet CV, Maurik PV, Kruip ThAM. 1989. Morphology of immature bovine oocytes. Gamete Res 24: 197-204.
Elder K, Dale B. 2003. In Vitro Fertilization Second Edition. USA (US): Cambridge University Pr.
17
Fair T, Hyttel P, Greve T. 1995. Bovine oocyte diameter in relation to maturational competence and transcriptional activity. Mol Reprod Dev 42: 437-442. Foster DL, Ryan KD. 1979. Endocrine mechanisms governing transition into
adulthood: a marked decrease in inhibitory feedback action of estradiol on tonic secretion of luteinizing hormone in the lamb during puberty. Endocrinology 105: 896-904.
Gandolfi F, Vassena R, Lauria A. 2000. The developmental competence of the oocytes before puberty: is something missing? Reprod Domest Anim 35: 66-71.
Gordon I. 2003. Laboratory Production of Cattle Embryos, 2nd edition. London (GB): CABI publishing.
Hafez B, Hafez ESE. 2000. Reproduction in Farm Animals7th edition. USA (US): Lippincott Williams & Wilkins.
Hyttel P, Fair T, Callesen H, Greve T. 1997. Oocyte growth, capacitation and final maturation in cattle. Theriogenology 47: 23-32.
Izquierdo D, Villamediana P, Palomo MJ, Mogas T, Paramio MT. 1998. Effect of sperm capacitation and fertilization media on ivf and early embryo development of prepubertal goat oocytes. Theriogenology 49: 1501-1513. Jainudeen MR, Wahid H, Hafez ESE. 2000. Sheep and Goat. In: Reproduction in
Farm Animals 7th edition, edited by Hafez B, Hafez ESE. USA (US): Lippincott Williams & Wilkins.
Jones KT. 2007. Intracellular calcium in the fertilization and development of mammalian eggs. P Aust Phys Soc 38:35-41.
Kauffold J, Am HA, Bergfeld U, Weber W, Sobiraj A. 2005. The in vitro developmental competence of oocytes from juvenile calves is related to follicular diameter. J Reprod Dev 51: 325-332.
Khatir H, Lonergan P, Mermilod P. 1998. Kinetics of nuclear maturation and protein profiles of oocytes from prepubertal and adult cattle during in vitro maturation. Theriogenology 50: 917-929.
Khatun M, Bhuiyan MMU, Ahmed JU, Haque A, Rahman MB, Samsuddin M. 2011. In vitro maturation and fertilization of prepubertal and pubertal black Bengal goat oocytes. J Vet Sci 12 (1): 75-82.
Kikuchi K, Naito K, Noguchi J, Shimada A, Kaneko H, Yamashita M, Aoki F, Tojo H, Toyoda Y. 2000. Maturation/M-phase promoting factor: a regulator of aging in porcine oocytes. Biol Reprod 63: 715-722.
Kochhar HPS, Wu B, Morris LHA, Buckrell BC, Pollard JW, Basrur PK, King WA. 2002. Maturation status, protein synthesis and developmental competence of oocytes derived from lambs and ewes. Reprod Domest Anim 37: 19-25. Lechniak D, Kaczmarek D, Stanisawski D, Adamowicz T. 2002. The ploidy of in
vitro matured bovine oocytes is related to the diameter. Theriogenology 57: 1303-1308.
Ledda S, Bogliolo L, Leoni G, Naitana S. 1999. Follicular size affects the meiotic competence of in vitro matured prepubertal and adult oocytes in sheep. Reprod Nutr Dev 39: 503-508.
Ledda S, Bogliolo L, Leoni G, Naitana S. 2001. Cell coupling and maturation-promoting factor activity in in vitro-matured prepubertal and adult sheep oocytes. Biol Reprod 65: 247-252.
18
Lonergan, Sharif PH, Monaghan P, Wahid H, Gallagher M, Gordon I. 1992. The effect of follicle size on the type of bovine oocyte obtained for in vitro maturation. Cambridge: Proceeding of seventh meeting of the european embryo transfer association.
Machaty Z, Prather RS. 1998. Strategies for activating nuclear transfer oocytes. Reprod Fert Develop 10: 599-613.
Martino A, Mogas T, Palomo MJ, Paramio MT. 1995. In vitro maturation and fertilization of prepubertal goat oocytes. Theriogenology 43: 473-485. Miyano T. 2005. In vitro growth of mammalian oocytes. J Reprod Dev 51: 169-176.
O’Brien JK, Dwarte D, Ryan JP, Maxwell WMC, Evans G. 1996. Developmental capacity, energy metabolism and ultrastructure of mature oocytes from prepubertal and adult sheep. Reprod Fertil Dev 8: 1029-1037.
O’Brien JK, Dwarte D, Ryan JP, Maxwell WMC, Evans G. 2000. Comparison of in vitro maturation, in vitro fertilization, metabolism and ultrastructure of oocytes from prepubertal pigs. Reprod Domest Anim 35: 101-107.
Palma GA, Tortonese DJ, Sinowatz F. 2001. Developmental capacity in vitro of prepubertal oocytes. Anat Histol Embryol 30: 295-300.
Pawlak P, Cieslak A, Warzych E, Zejden Z, Strabel-Szumacher M, Glura-Molinska M, Lechniak D. 2012. No single way to explain cytoplasmic maturation of oocytes from prepubertal and cyclic gilts. Theriogenology 78: 2020-2030. Ramirez DV, McCann SM. 1963. Comparison of the regulation of luteinizing
hormone (LH) secretion in immature and adult rats. Endocrinology 72: 452-464.
Salamone DF, Damiani P, Fissore RA, Robl JM, Duby RT. 2001. Biochemical and developmental evidence that ooplasmic maturation of prepubertal bovine oocytes is compromised. Biol Reprod 64: 1761-1768.
Sayuti A, Tongku NS, Muslim A, Hamdan, Hamdani. 2007. Pengaruh ukuran dan jumlah folikel per ovari terhadap kualitas oosit kambing lokal. J Ked Hewan 1: 36-42.
Senger PL. 1997. Pathways to Pragnancy and Parturition. Washington (US): Current Conceptions Inc.
Shirazi A, Sandeghi N. 2007. The effect of ovine oocyte diameter on nuclear maturation. Small Ruminant Res 69: 103-107.
Sierard MA, Richard F, Blondin P, Robert C. 2006. Contribution of the oocytes to embryo quality. Theriogenology 65: 126-136.
Sisk CL, Zehr JL. 2005. Pubertal hormones organize the adolescent brain and behavior. Front Neuroendokrin 26: 163-174.
Slavik T, Libik M, Wierzchos E, Fulka J. 2005. An attempt to reduce polyspermic penetration in lamb oocytes. Folia Biol (Praha) 51: 34-39.
Steel RGD, Torrie JH. 1991. Prinsip dan Prosedur Statistika: Suatu Pendekatan Biometrik. Jakarta (ID): PT. Gramedia Pustaka Utama.
Swerdloff RS, Odell WD. 1975. Hormonal mechanisms in the onset of puberty. Postgrad Med J 51: 200-208.
Tsafriri A, Dekel N, Bar-Ami S. 1982. The role of oocyte maturation inhibitor in follicular regulation of oocyte maturation. J Reprod Fertil 64: 541-551. Torner H, Ghanem N, Ambros C, Holker M, Tornek W, Phatsara C, Alm H, Sirard
19
Velilla E, Izquierdo D, Rodriguez-Gonzales E, Lopez-Bejar M, Vidal F, Paramio MT. 2004. Distribution of prepubertal and adult goat oocytes cortical granules during meiotic maturation and fertilisation: ultrastructural and cytochemical study. Mol Reprod Dev 68: 507-514.
20
Lampiran 1 Komposisi Medium Transportasi Ovarium.
Bahan Jumlah
Sodium Chloride (Sigma Aldrich, USA) 9,0 g Penicillin-Streptomycin 1000 µL
Milli-Q Water 1000 mL
Larutan disterilisasi menggunakan auto clave pada suhu 121ºC selama 30 menit. Penambahan antibiotik penicillin-streptomycin dilakukan pada suhu 27-28ºC setelah sterilisasi
Lampiran 2 Komposisi medium koleksi oosit (modified Phosphate Buffered Saline, mPBS).
Bahan Jumlah
PBS (Dulbecco’s Nissui, Japan) 90 mL Fetal Bovine Serum (FBS) 10% (v/v) 10 mL Penicillin-Streptomycin 100 μL
Total 100 mL
Stok PBS:
Untuk membuat stok PBS, maka 9.6 g PBS (Dulbecco’s Nissui, Japan)
dilarutkan dalam 1000 mL Milli-Q water dan setelahnya difiltrasi menggunakan
filter (Sartorius®) ukuran 0.22 μm.
Stok penicillin dan streptomycin:
Dosis penicillinG: 0.06 g/l ~ 100.000 IU/l Dosis streptomycinsulfate: 0.1 g/l
21
Lampiran 3 Komposisi medium maturasi in vitro.
Bahan Jumlah
Tissue Culture Medium/TCM-199 2700 μL Fetal Bovine Serum (FBS) 10% 300 μL Pregnant Mare Serum Gonadotropin (PMSG) 30 μL Human Chorionic Gonadotropin (hCG) 30 μL Gentamycin(50 μg/mL) 3 μL
Total 3 mL
Stok PMSG (Kyoritsu Seiyaku®, Japan) Dosis: 10 IU/mL
Untuk membuat stok, maka 1000 IU PMSG dilarutkan dalam 1 mL TCM-199 (1 IU/μL) .
Stok hCG (Kyoritsu Seiyaku®, Japan) Dosis: 10 IU/mL
(Untuk membuat stok, maka 1500 IU hCG dilarutkan dalam 1.5 mL TCM-199
(1 IU/μL).
Lampiran 4 Komposisi medium fertilisasi oosit in vitro.
Bahan mM g/100mL
NaCl 90 0.52596
KCl 12 0.08946
NaHCO3 25 0.21003
NaH2PO4 anhydrous 0.5 0.006
MgSO4 7H2O 0.5 0.01233
Sodium Laktat (60% sirup) 0.19 mL
HEPES 10 0.2383
CaCl2 2H2O 8 0.1176
Sodium piruvat 2 0.0220
Kafein anhydrous 2 0.03884
BSA (fatty acid free) 5 0.5
22
RIWAYAT HIDUP
Penulis dilahirkan di Palopo pada tanggal 01 Februari 1990 dari pasangan H Hafid Sam dan Hj Siti Nurhayati. Penulis merupakan anak ke-empat dari lima bersaudara, yaitu Faisal Hafid, Selviani Hafid, Suriani Hafid dan Kaisar Hafid. Tahun 2008 penulis menamatkan pendidikan Sekolah Menengah Atas (SMA) dari SMAN 3 Palopo. Pendidikan tinggi negeri ditempuh di Fakultas Matematikan dan Ilmu pengetahuan Alam (FMIPA) Jurusan Pendidikan Biologi Universitas Negeri Makassar dari tahun 2008 dan dinyatakan lulus pada tahun 2013. Pada tahun 2013 penulis diterima di Program Pascasarjana IPB pada Program studi Biologi Reproduksi Fakultas Kedokteran Hewan. Beasiswa selama menempuh program pascasarjana diperoleh dari Beasiswa Pendidikan Pascasarjana Dalam Negeri (BPP-DN) Direktorat Jenderal Pendidikan dan Perguruan Tinggi (DIKTI) tahun 2013-2015.
Salah satu syarat kelulusan pada program pascasarjana IPB, penulis harus melakukan publikasi tulisan yang merupakan bagian dari tesis penulis. Sebuah