TINGKAT MATURASI DAN FERTILISASI OOSIT DOMBA
YANG DIMATURASI DALAM MEDIA YANG
DITAMBAHKAN SERICIN SECARA IN VITRO
CUT YASMIN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Tingkat Maturasi dan Fertilisasi Oosit Domba yang Dimaturasi dalam Media yang Ditambahkan Sericin secara In Vitro adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
CUT YASMIN. Tingkat Maturasi dan Fertilisasi Oosit Domba yang Dimaturasi dalam Media yang Ditambahkan Sericin secara In Vitro. Dibimbing oleh NI WAYAN KURNIANI KARJA dan MOHAMAD AGUS SETIADI.
Produksi embrio in vitro merupakan salah satu teknologi yang diterapkan dalam bidang reproduksi. Teknologi ini memanfaatkan limbah ovarium yang diperoleh dari rumah potong hewan (RPH). Oosit yang dikoleksi dari ovarium tersebut berikutnya dimatangkan secara in vitro pada lingkungan kultur dengan kadar CO2 5% dan O2 ~20%. Kondisi ini berbeda dengan in vivo, dimana dalam saluran reproduksi betina kadar O2 berkisar antara 3-18%. Tingginya kadar O2 memungkinkan terbentuknya reactive oxygen species (ROS) sebagai produk oksidasi dari metabolisme oksigen. Konsentrasi ROS yang tinggi menyebabkan gangguan pada membran sel, disfungsi mitokondria, DNA, RNA, kerusakan protein, lipid dan juga berperan dalam terjadinya apoptosis. Untuk melindungi oosit dari stres oksidatif selama kultur dapat dilakukan penambahan berbagai antioksidan. Sericin merupakan protein yang berasal dari kepompong ulat sutra dan memiliki aktivitas antioksidan. Selain itu, sericin merupakan kelompok protein albuminoid yang diperlukan untuk perkembangan oosit. Selama ini, bovine serum albumin (BSA) merupakan komponen yang umum disuplementasi ke dalam media maturasi. Sericin sebagai albuminoid protein berpotensi digunakan sebagai alternatif lain yang dapat disuplementasi ke dalam media selain BSA. Tujuan penelitian ini adalah mengevaluasi efektifitas sericin sebagai antioksidan dan pengganti BSA terhadap kompetensi perkembangan oosit domba yang dimaturasi dan difertilisasi secara in vitro.
Penelitian tahap 1 dilakukan evaluasi tingkat kompetensi meosis oosit yang dikultur pada media dengan penambahan sericin dengan atau tanpa BSA. Kumulus oosit dimaturasi dalam media yang ditambahkan sericin dengan konsentrasi 0%, 0,1%, 0,25%, dan 0,5% dengan atau tanpa BSA. Setelah diinkubasi selama 24 jam oosit difiksasi untuk evaluasi status inti oosit. Pada penelitian tahap 2, dilakukan evaluasi tingkat fertilisasi oosit yang dimaturasi pada media yang ditambahkan sericin dengan atau tanpa BSA. Penelitian tahap 1 menunjukkan terjadi penurunan tingkat maturasi inti pada oosit yang dimaturasi dengan konsentrasi 0,5%, oleh karena itu, pada penelitian tahap 2 konsentrasi tersebut tidak digunakan. Thawing semen beku dilakukan pada suhu 30-32°C selama 30 detik dalam media fertilisasi. Berikutnya semen disentrifugasi dengan kecepatan 1800 rpm selama 5 menit dalam media fertilisasi. Selanjutnya, dilakukan penghitungan konsentrasi serta dilakukan penambahan media fertilisasi untuk mendapatkan konsentrasi 1x106. Kemudian, oosit ditransfer ke dalam 100
μl drop media in vitro fertilization (IVF) yang mengandung spermatozoa dan diinkubasi selama 14 jam dalam inkubator CO2 5% temperatur 39°C. Setelah 14 jam ko-inkubasi, oosit difiksasi untuk dievaluasi tingkat fertilisasinya.
Lebih lanjut terjadi penurunan persentase pada konsentrasi 0,5% (67,9% ± 5,4). Tingkat maturasi oosit pada media dengan penambahan sericin pada media dengan BSA tidak memberikan pengaruh yang signifikan terhadap persentase oosit pada tahap GVBD. Suplementasi sericin pada media tanpa BSA meningkatkan persentase tingkat maturasi oosit (MII) dibandingkan dengan kontrol tanpa sericin. Persentase oosit pada tahap MII yang dimaturasi dengan sericin 0,1% (83,7% ± 1,8) secara signifikan lebih tinggi (P < 0,05) dibandingkan dengan konsentrasi yang lain ( sericin 0,25%; 63,6% ± 2,9, 0,5%; 39,7% ± 3,4). Penambahan sericin 0,1% (73,0% ± 3,3) ketika oosit yang dimaturasi dengan BSA memiliki persentase oosit tahap MII yang sama dibandingkan dengan tanpa sericin (70,0% ± 4,4). Pada konsentrasi sericin 0,25% dan 0,5% (58,1% ± 3,8 dan 46,0% ± 2,5) persentase oosit menurun secara signifikan dibandingkan dengan kontrol (P < 0,05).
Penelitian tahap 2 memperlihatkan suplementasi sericin tanpa BSA hanya terlihat pada hasil evaluasi tingkat fertilisasi total (P < 0,05) tapi tidak pada fertilisasi normal dan polispermi (P > 0,05). Oosit yang dimaturasi sericin 0,1% tanpa BSA dan kemudian difertilisasi dengan spermatozoa memiliki tingkat total fertilisasi yang lebih tinggi dibandingkan dengan konsentrasi 0,25% dan tanpa sericin (84,8% ± 3,5 vs 54,8% ± 6,7 dan 16,6% ± 4,1). Disamping itu, pada penelitian tahap dua suplementasi sericin dengan BSA tidak berpengaruh pada tingkat fertilisasi (total, normal, dan polispermi) dan memiliki kecenderungan menurun pada konsentrasi yang lebih tinggi (P < 0,05). Kesimpulan dari penelitian ialah suplementasi sericin 0,1% tanpa BSA ke dalam media maturasi mampu meningkatkan tingkat perkembangan oosit domba
SUMMARY
CUT YASMIN. Maturation and Fertilization of Sheep Oocytes Matured in Sericin Supplemented Media In Vitro. Supervised by NI WAYAN KURNIANI KARJA dan MOHAMAD AGUS SETIADI.
In vitro embryo production is one of the applied technologies in the field of reproduction. This technology used waste ovaries obtained from slaughter house. Oocytes were collected from ovaries will be finalized following the in vitro culture environment with 5% CO2 and 20% O2. In vitro culture conditions for oocytes contain higher concentrations of oxygen than in vivo, this conditions may produce more free radicals and increased level of ROS. Oxygen concentration within the lumen of the female reproductive tract is about 3-11 %, whereas the concentration in vitro condition is about 20%. High level of ROS can damage cell membrane, mitochondrial dysfunction, DNA, RNA, protein damage and play a role in apoptosis. To protect oocytes from oxidative stress during culture, various anti-oxidative substances can be added to the media. Sericin is one type of protein which is obtained from the silk cocoons with strong antioxidan activity. In addition, sericin is an albuminioid protein that improve developmental competence of oocyte. Bovine serum albumin (BSA) widely used as variable component of a maturation media. Sericin, as an albuminoid protein would be used as alternative compenent to media supplement instead of BSA. This study was designed to evalute the effect of sericin supplemented on maturation media to improve developmental competence of sheep oocyte.
In the first experiment, to evaluate the effects of sericin supplementation on the meiotic competence of sheep oocytes cultured with or without BSA, the COCs were cultured in the maturation media supplemented with sericin at various concentrations of 0 (control), 0,1, 0,25 and 0,5%, either with or without BSA supplementation. The nuclear status of oocytes were examined after maturation culture for 24 hours. In the second experiment, we evaluated the effects of sericin supplementation on the fertilization rate of sheep oocytes matured with or without BSA. In the first experiment, we found that the maturation rate of oocytes decreased when 0,5% sericin was supplemented into the maturation media. Therefore, the sericin concentration (0,5%) was excluded in this experiment. Frozen semen were thawed 30-32°C for 30 seconds and was diluted in in vitro fertilization (IVF) media. Sperm suspension was centrifuged at 1800 rpm for 5 min. After centrifugation, a portion of sperm pellet was diluted in the IVF media.The sperm concentration was adjusted to 1x106 spermatozoa/mL. COCs (10-15 oocytes) were introduced into 100μl of the spermatozoa microdroplet, and then co-incubated for 14 h. After 14 h of co-incubation with spermatozoa, the oocytes were fixed for evaluation of fertilization rate.
GVBD. When the COCs were matured without BSA, the supplementation of sericin increased the percentage of oocytes on MII stage compared with the control oocytes cultured without sericin. Moreover, the percentage MII stage cultured with 0,1% sericin (83,7% ± 1,8) was significantly higher (P < 0,05) than that of oocytes cultured with the other concentrations of sericin (sericin 0,25%; 63,6% ± 2,9, 0,5%; 39,7% ± 3,4). When the COCs were matured with BSA, the percentage of oocytes on MII stage cultured with 0,1% sericin (73,0% ± 3,3) was similar to that of the control oocytes cultured without sericin (70,0% ± 4,4). In contrast, the the percentage of oocytes cultured with 0,25 and 0,5% sericin (58,1% ± 3,8 and 46,0% ± 2,5, respectively) significantly decreased as compared with the control oocytes (P < 0,05).
The result of second experiment showed when evaluating sericin supplemented without BSA was observed in the total fertilization rates (P < 0,05). There is no significant difference was observed in the monospermic and polyspermic. When the COCs were matured without BSA and then fertilized with spermatozoa, the total fertilization rates of oocytes matured with 0,1% sericin were significantly higher (P < 0,05) than the rates of oocytes matured with 0,25% and without sericin (84,8% ± 3,5 vs 54,8% ± 6,7 and 16,6% ± 4,1). In addition, supplementing sericin with BSA had no significant differences in the percentage of fertilization rate (total, monospermic, polyspermic) and appeared to have decreasing tendency (P < 0,05) on the higher concentration. In conclusion, supplementation of 0,1% sericin without BSA to in vitro maturation media improve the developmental compentecy of sheep oocytes.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biologi Reproduksi
TINGKAT MATURASI DAN FERTILISASI OOSIT DOMBA
YANG DIMATURASI DALAM MEDIA YANG
DITAMBAHKAN SERICIN SECARA IN VITRO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Tingkat Maturasi dan Fertilisasi Oosit Domba yang Dimaturasi dalam Media yang Ditambahkan Sericin In Vitro
Nama : Cut Yasmin NIM : B352120051
Disetujui oleh Komisi Pembimbing
drh Ni Wayan Kurniani Karja MP, PhD Ketua
Prof Dr drh Mohamad Agus Setiadi Anggota
Diketahui oleh
Ketua Program Studi Biologi Reproduksi
Prof Dr drh Mohamad Agus Setiadi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tesis ini mengemukakan tentang upaya peningkatan produksi embrio in vitro pada domba dengan penambahan senyawa antioksidan.
Terimakasih penulis ucapkan kepada drh. Ni Wayan Kurniani Karja MP, Ph.D dan Prof Dr drh Mohamad Agus Setiadi selaku dosen pembimbing yang telah banyak memberikan arahan dan bimbingan. Disamping itu penghargaan penulis disampaikan kepada pimpinan dan staf Rumah Potong Hewan Kambing/Domba Kampung Cikanyong Babakan Madang, Bogor yang telah banyak membantu selama penelitian. Ungkapan terimakasih juga disampaikan kepada kedua orang tua, keluarga, Zultinur Muttaqin sebagai sahabat dan rekan penelitian yang telah banyak membantu dan memberikan semangat serta kasih sayang selama penelitian dan penulisan karya ilmiah ini. Ungkapan terimakasih juga disampaikan kepada teman-teman Biologi Reproduksi 2012 dan 2013 atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL x
DAFTAR GAMBAR x
DAFTAR LAMPIRAN x
1 PENDAHULUAN 1
Latar Belakang 1
Kerangka Pemikiran 2
Tujuan Penelitian 3
Manfaat Penelitian 3
Hipotesis 3 2 TINJAUAN PUSTAKA 3 Pematangan Oosit dan Fertilisasi In Vitro 3
Reactive Oxygen Species (ROS) dan Kerja Antioksidan 4
Sericin dan Potensi Antioksidan 5
Sericin Sebagai Albuminoid Protein 7
3 BAHAN DAN METODE 8 Tempat dan Waktu Penelitian 8 Metode Penelitian 8 Tahap I: Kemampuan Pematangan Inti Oosit 8
Evaluasi Tingkat Maturasi Oosit 9
Tahap II: Fertilisasi In Vitro 9
Rancangan Penelitian 10
Prosedur Analisis Data 10
4 HASIL DAN PEMBAHASAN 10
HASIL 10
Tingkat Maturasi Inti Oosit Domba pada Media 10
yang Disuplemantasi Sericin tanpa atau dengan BSA Tingkat Fertilisasi In Vitro dari Oosit yang Dimaturasi dalam Media 11
yang Ditambahkan Sericin tanpa atau dengan BSA PEMBAHASAN 13
5 SIMPULAN DAN SARAN 15 Simpulan 15 Saran 16 DAFTAR PUSTAKA 17
LAMPIRAN 22
DAFTAR TABEL
1 Tingkat maturasi inti oosit domba pada media yang ditambahkan
sericin tanpa atau dengan BSA 12
2 Tingkat fertilisasi oosit domba setelah dimaturasi pada media yang
ditambahkan sericin tanpa atau dengan BSA 13
DAFTAR GAMBAR
1 Status inti sel oosit setelah maturasi in vitro 10 2 Pembentukan pronukleus (PN) pada oosit setelah fertilisasi 12
DAFTAR LAMPIRAN
1 Komposisi media transportasi 23
2 Komposisi media koleksi oosit 23
1
1 PENDAHULUAN
Latar Belakang
Produksi embrio in vitro (PEIV) sebagai salah satu metode dalam bioteknologi reproduksi melibatkan beberapa tahapan penting yaitu in vitro maturation (IVM), in vitro fertilization (IVF), dan in vitro culture (IVC) (Gordon 2003). Kultur secara in vitro (IVM/F/C) umumnya dilakukan pada lingkungan dengan kadar O2 yang hampir sama dengan kadar O2 di dalam atmosfir (in air≈20%). Kadar O2 di dalam atmosfir diketahui lebih tinggi daripada kadar di dalam tubuh dimana kadar O2 dalam saluran reproduksi betina berkisar antara 2-18%, sedangkan di dalam cairan folikel tekanan oksigen berkisar antara 3-13% (Fischer et al. 1993;Hashimoto et al. 2000). Kondisi kultur dengan kadar O2 mencapai 20% dilaporkan dapat menyebabkan terjadinya peningkatan metabolisme oksigen sehingga akan terjadi peningkatan pembentukan radikal bebas atau reactive oxygen species (ROS) (Correa et al. 2008; Mingoti et al. 2009).
Radikal bebas termasuk diantaranya superoxide anion radicals (O2-), hydroxyl radicals (OH-), dan hydrogen peroxyde (H2O2) adalah beberapa jenis produk oksidasi dari metabolisme oksigen reaksi biologis atau faktor eksogen lainnya. Menurut Agarwal et al. (2003) metabolisme yang berlangsung optimal akan membentuk ROS sebagai hasil dari metabolisme oksigen. Radikal bebas merupakan kelompok molekul kimia yang tidak stabil, sangat reaktif, dan mudah berikatan dengan satu atau lebih elektron yang tidak berpasangan. Secara fisiologis radikal bebas dalam jumlah yang seimbang akan berperan positif dalam proliferasi dan diferensiasi sel, serta regulasi komunikasi antara sel (signalling pathways) tapi akan memberi efek negatif pada jumlah yang berlebih (Droge 2002; Poli et al. 2004). Covarrubias et al. (2008) menyatakan bahwa ketidakseimbangan antara ROS dan mekanisme pertahanan antioksidan endogen menyebabkan terjadinya jumlah ROS berlebihan sehingga terjadinya peroksidasi lipid dan stres oksidatif yang apabila terjadi secara terus menerus akan berpengaruh terhadap perubahan dan modifikasi membran secara seluler atau molekul intraseluler lainnya. Reactive oxygen species (ROS) bisa menyebabkan kerusakan pada struktur sel seperti disfungsi mitokondria, mikrotubul, DNA, RNA, dan gangguan fungsi sel secara normal (Takahashi et al. 2000). Berbagai variasi antioksidan yang diproduksi di dalam tubuh berperan penting dalam mengeliminasi ROS dan peroksidasi lipid guna melindungi sel dari efek toksik ROS dan peroksidasi lipid (Guerin et al. 2001).
2
histidina mampu berperan sebagai penangkap ROS (ROS scavenger) dan juga sebagai donor proton (Chlapanidas et al. 2013) sehingga mampu menekan peroksidasi lipid secara in vitro (Kato et al. 1998 ; Elias et al. 2008). Sementara Patel dan Modasiya (2011) melaporkan bahwa sericin menekan peroksidasi lipid melalui mekanisme kelat logam (metal chelation) dengan mengikat element logam seperti besi (Fe2+) dan tembaga (Cu2+) yang dapat mengkatalisis terjadinya reaksi oksidasi lipid, sehingga kemampuan sel atau jaringan dalam mengurangi tingkat kerusakan akibat ion metal yang mengkatalisis oksidasi lipid meningkat.
Potensi sericin lainnya yang sedang banyak diteliti adalah kemampuannya sebagai protein albuminoid dan mempunyai aktifitas yang sama dengan bovine serum albumin (BSA) (Terada et al. 2002). Sericin mampu menginduksi proliferasi sel hibridoma mamalia (murine hybridoma 2E3-O, human hepatoblasma HepG2, human epithelial HeLa, dan human embryonal kidney 293 yang dikultur dalam media tanpa BSA (Terada et al. 2002). Sedangkan Isobe et al. (2012) menyatakan kemampuan sericin dalam menginduksi proliferasi sel embrio sehingga jumlah embrio yang berkembang sampai tahap blastosis meningkat. Serum termasuk di dalamnya bovine serum albumin secara rutin ditambahkan ke dalam media kultur secara in vitro (Dattena et al. 2007; Souza-Fabjan et al. 2014). Penambahan serum dalam media kultur memungkinkan terbawanya patogen seperti bovine spongiform encephalopathy (BSE) dan virus. Hal ini menyebakan adanya peningkatan resiko penyebaran penyakit (Thibier 2006). Oleh karena itu, pada penelitian ini dilakukan evaluasi efektivitas sericin sebagai antioksidan dan pengganti BSA dalam media maturasi terhadap kompetensi perkembangan oosit domba yang dimaturasi dan difertilisasi secara in vitro.
Kerangka Pemikiran
3
Tujuan Penelitian
Tujuan penelitian ini adalah untuk mengevaluasi efektifitas sericin sebagai antioksidan dan pengganti BSA dalam media maturasi terhadap kompetensi perkembangan oosit domba yang dimaturasi dan difertilisasi secara in vitro.
Manfaat
Hasil penelitian ini diharapkan dapat memberikan informasi mengenai efektivitas sericin sebagai antioksidan dan pengganti BSA pada medium maturasi in vitro oosit domba
Hipotesis
Media maturasi tanpa BSA yang ditambahkan sericin mampu meningkatkan kompetensi perkembangan oosit domba secara in vitro.
TINJAUAN PUSTAKA
Pematangan Oosit dan Fertilisasi In Vitro
Kualitas oosit domba ditentukan berdasarkan kompleks lapisan kumulus oophorus (cumulus oocyte complex) yaitu sel-sel granulosa yang mengelilingi oosit dalam kondisi utuh (padat) atau tidak (Gordon 2003). Leibfried-Rutledge et al. (1986) menyatakan bahwa oosit yang akan digunakan dalam IVM adalah oosit yang dikelilingi sel kumulus dan memiliki granula sitoplasma yang sama dan seragam. Morfologi sel kumulus yang mengelilingi oosit umumnya masih digunakan sebagai kriteria utama seleksi untuk maturasi in vitro dan tingkat ekspansi sel kumulus dapat digunakan sebagai salah satu indikator morfologi dari kualitas oosit.
Oosit domba yang digunakan untuk fertilisasi in vitro terlebih dahulu harus melalui proses maturasi atau pematangan di dalam inkubator selama 24 jam, dengan temperatur sekitar 39°C. Pematangan oosit merupakan salah satu tahap penting dari rangkaian produksi embrio in vitro. Pematangan in vitro membantu oosit agar mampu menyelesaikan proses meiosis hingga mencapai tahap metaphase II untuk dapat difertilisasi (Alomar et al. 2008). Oosit hewan mamalia secara umum harus mengalami pematangan inti dan pematangan sitoplasma hingga dapat difertilisasi sampai akhirnya berkembang menjadi embrio (Beilby et al. 2009).
4
metaphase I (MI). Pada oosit domba, tahapan ini dicapai 12 -14 jam setelah inkubasi dan diikuti oleh tahapan anaphase (A) dan telophase (T) yang berlangsung singkat. Lebih lanjut oosit akan mencapai tahapan metaphase II, yang ditandai dengan terbentuknya polar body I. Ekstruksi badan polar I merupakan indikasi dari proses meiosis dan keberhasilan dalam tahapan metaphase II (Gordon 2003). Sel kumulus sangat berperan dalam maturasi oosit dengan jalan mempengaruhi kelanjutan meiosis dan maturasi sitoplasma. Fungsi ini berkaitan dengan adanya gap junction dan kemampuan metabolisme. Gap junction berperan dalam transfer nutrien dan faktor penting dalam perkembangan oosit (Lv et al. 2010).
Selain kriteria kematangan inti, oosit juga harus mengalami pematangan sitoplasma. Pematangan sitoplasma ditandai dengan organisasi sitoskeletal dari oosit seperti migrasi kortikal granul ke oolema, peningkatan mitokondria dan lipid droplet, mulai terbentuknya retikulum endoplasma dan peningkatan metabolisme oosit (Rahman et al. 2008). Pada saat mengalami pematangan sitoplasma terjadi akumulasi protein dan mRNA, regulasi kalsium, perubahan aktivitas maturation promoting factor (MPF) dan mitogen activited protein kinase (MAPK) dan pendistribusian kembali dari organel seluler (Anguita 2007).
Oosit yang telah mencapai tahap MII merupakan oosit yang dapat difertilisasi. Pada fase ini oosit telah mengalami pematangan inti maupun sitoplasma. Inisiasi oleh spermatozoa akan menyebabkan oosit menyempurnakan pembelahan meosis II yang ditandai dengan pelepasan polar body II (Cleine 1996). Pada domba, penetrasi spermatozoa ke dalam oosit membutuhkan waktu 2-3 jam. Selanjutnya kromosom oosit akan membentuk pronukleus betina. Kromatin yang terdapat pada kepala spermatozoa akan mengalami dekondensasi dalam waktu 2 jam post inseminasi. Selama proses dekondensasi kromatin, terjadi penggantian antara protamin yang terdapat pada kepala spermatozoa dengan histon yang diikuti oleh pembentukan pronukleus jantan dan betina 3 jam kemudian. Kedua pronukleus akan berkembang sempurna dan berada pada posisi saling berdekatan 14-16 jam post inseminasi (Crozet 1988; Huneau dan Crozet 1989). Fertilisasi yang normal ditandai dengan terbentuknya dua pronukleus, dua badan kutub, bentuk sel telur yang teratur dengan zona pelusida utuh dan sitoplasma jelas terlihat. Pembentukan lebih dari 2 pronukleus dikategorikan tidak normal atau polispermi (Elder dan Dale 2003).
Reactive Oxygen Species (ROS) dan Kerja Antioksidan
5
Radikal bebas pada umumnya mempunyai efek yang sangat menguntungkan, seperti membantu destruksi sel-sel mikroorganisme dan kanker. Akan tetapi, produksi radikal bebas yang berlebihan dan produksi antioksidan yang tidak memadai dapat menyebabkan kerusakan sel-sel jaringan dan enzim enzim. Kerusakan jaringan dapat terjadi akibat gangguan oksidatif yang disebabkan oleh radikal bebas asam lemak atau dikenal sebagai peroksidasi lipid. Aktivitas radikal bebas dapat menjadi penyebab berbagai kerusakan dalam sel dan jaringan. Di antara senyawa-senyawa oksigen reaktif, radikal hidroksil (OH) merupakan senyawa yang paling berbahaya karena mempunyai tingkat reaktivitas sangat tinggi (Agarwal et al. 2003). Radikal hidroksil dapat merusak tiga jenis senyawa yang penting untuk mempertahankan integritas sel yaitu (1) Asam lemak tak jenuh jamak (PUFA) yang merupakan komponen penting fosfolipid penyusun membran sel (2) DNA, yang merupakan piranti genetik dari sel. (3) Protein, yang memegang berbagai peran penting seperti enzim, reseptor, antibodi, pembentuk matriks, dan sitoskeleton (Halliwell dan Gutteridge 1990a).
Rajalakshmi dan Narisimhan (1996) menggolongkan antioksidan menjadi tiga tipe yaitu :
(1) Antioksidan primer
Senyawa-senyawa yang berfungsi sebagai antioksidan primer mampu memutus rantai reaksi pembentukan radikal bebas dengan memberikan ion hidrogen atau elektron pada radikal bebas sehingga menjadi produk yang stabil. Senyawa yang digolongkan sebagai antioksidan primer adalah kelompok senyawa polifenol, asam askorbat (vitamin C), kelompok senyawa asam galat, BHT, BHA, TBHQ, PG, dan tokoferol.
(2) Antioksidan sekunder
Antioksidan sekunder berfungsi untuk mencegah terbentuknya radikal bebas, menginaktifkan singlet oksigen (IO2), menyerap radiasi ultraviolet dan bekerja sinergis dengan antioksidan primer. Senyawa yang digolongkan sebagai antioksidan sekunder adalah asam tiodipropionat, dilauril dan distearil ester. (3) Agen pengkelat (Chelator sequestransts)
Senyawa yang tergolong sebagai chelator berfungsi sebagai pengikat logam-logam yang dapat mengkatalis reaksi oksidasi lemak seperti Fe dan Cu. Pengikatan logam-logam tersebut oleh chelating agent mampu meningkatkan efisiensi reaksi antioksidan, menghambat oksidasi asam askorbat dan vitamin-vitamin yang larut lemak. Senyawa yang digolongkan sebagai chelator atau chelating agent adalah asam sitrat, suksinat, oksalat, laktat, malat, tartarat, asam polifosfat, ethylenediaminetetraacetic acid (EDTA), asam amino dan peptida. Sericin dan Potensi Antioksidan
6
diberbagai bidang, termasuk secara biomedis dan merupakan biomaterial yang kompatibel (Takasu et al. 2002). Kepompong ulat sutra secara umum mengandung dua tipe protein yaitu sericin dan fibroin dengan berat molekul 33 kDa and 25 kDa (Altman et al. 2003). Menurut Agarwal dan Bushant et al. (2012) sericin adalah salah satu protein yang berasal dari kepompong ulat sutra dan merupakan komponen penyusun kepompong ulat sutra dengan persentase sebesar 20-30%. Sericin berwarna kekuningan dan bersifat tidak elastis.
Sericin tergolong dalam kelompok glikoprotein dengan kandungan 18 asam amino, termasuk diantaranya yang essensial yang dikarakterisasi oleh kandungan serina dalam persentase sebesar 32%. Total jumlah hidroksil asam amino dalam sericin adalah 48,5 %, dengan komposisi 42,3 % berupa asam amino yang bersifat polar dan 12,2 % yang non polar. Tingginya jumlah hidroksil asam amino yang memiliki sifat hidrofilik ini juga menyebabkan sericin merupakan komponen yang larut dalam air (Padamwar dan Pawar 2005;Gillis et al. 2009). Menurut Sothornvit et al. (2010) kandungan dari sericin terdiri dari 80% asam amino yang merupakan kelompok hidrofilik seperti serina, aspartat, dan glisina. sericin mulai digunakan secara medis sebagai agen antikoagulan. Selain itu, sericin dapat digunakan secara medis sebagai biomaterial yang bersifat dapat terurai, mengandung polimer, biomembran yang fungsional dan hidrogel. Penelitian lain terkait dengan sericin adalah peranannya dalam pertumbuhan sel secara in vitro. Hal ini didasarkan pada kemampuan sericin yang berpotensi sebagai antitirosinase dan antioksidan. Penelitian Kato et al. (1998) memberikan informasi potensi lain dari sericin, berupa adanya aktivitas antioksidan dari sericin yang dilakukan pada otak tikus. Dash et al (2008) melakukan penelitian terkait potensi antioksidan dari sericin pada sel fibroblas yang telah dipaparkan hidrogen peroksida sehingga memicu stres oksidatif. Pada penelitian tersebut sericin dapat dalam melindungi sel fibroblas dengan berperan sebagai antioksidan endogen yang mempengaruhi kerja enzim.
7
ROS dengan oksidasi lipid. Fe2+ juga mengkatalisis reaksi Haber-Weiss dan menginduksi terjadinya superoksidasi anion menjadi bentuk radikal hidroksil yang lebih berbahaya. Radikal hidroksil akan bereaksi dengan biomolekul yang ada didekatnya dan menyebabkan kerusakan jaringan dan sel, terutama akibat oksidasi lipid. Komponen protein yang merupakan kandungan dari sericin dapat memperlambat reaksi oksidasi akibat transisi ion metal melalui mekanisme chelation. Aktivitas pengkelatan (chelating) dalam hidrolisis protein meningkatkan kemampuan sel atau jaringan dalam mengurangi tingkat kerusakan akibat ion metal yang mengkatalisis oksidasi lipid (Patel dan Modasiya 2011). Protein dengan gugus karboksil serta asam amino (Glx dan Asx) dan asam amino utama (Lys, His, dan Arg) berperan penting dalam chelating ion metal (Zhang 2004).
Sericin Sebagai Albuminoid Protein
Albumin merupakan protein utama dalam serum dengan persentase sebesar 60% dari total albumin yang ada dalam ruang ekstravaskuler, ruang interstitial jaringan dan berperan penting dalam fungsi fisiologis sel (Ellmerer et al. 2000). Albumin bersama dengan globulin berperan penting sebagai molekul pembawa lemak atau mineral dan secara luas digunakan dalam media tanpa serum (Ali dan Sirard 2002). Bovine albumin serum (BSA) umumnya ditambahkan ke dalam media kultur sebagai sumber energi dan protein untuk proses metabolik. Penambahan BSA tersebut mampu mencukupi komponen penting seperti steroid, vitamin, asam lemak dan kolesterol, tapi juga membantu dalam persediaan ion-ion dan molekul-molekul kecil (Wrenzycki et al. 2001). Menurut Francis (2010) albumin berfungsi untuk mempertahankan pH, molekul pembawa dengan berikatan dengan ligand (lemak, ion logam, asam amino), dan sebagai antioksidan. Selain itu, molekul albumin mampu berinteraksi dengan sel dan meningkatkan pertumbuhan sel.
8
3 BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Fertilisasi In Vitro Bagian Reproduksi dan Kebidanan, Departemen Klinik, Reproduksi dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Penelitian dilaksanakan dari Desember 2013- Mei 2014.
Metode Penelitian
Tahap I. Kemampuan Pematangan Inti Oosit
Koleksi Ovarium dan Seleksi Oosit
Ovarium diperoleh dari domba yang dipotong di RPH kambing/domba Kampung Cikanyong Desa Citaringgul Kecamatan Babakan Madang Kabupaten Bogor. Ovarium dibawa ke laboratorium menggunakan termos berisi larutan NaCl 0,9% yang ditambahkan antibiotik 100 IU/ml penicillin (Sigma-Aldrich, St. Louis, MO, USA) dan 0,1 g/ml streptomycin (Sigma-Aldrich) dengan temperatur 35-37°C. Di laboratorium ovarium kemudian dicuci kembali dengan NaCl 0,9% dan berikutnya dicacah (slicing) dengan scalpel untuk mengeluarkan oosit. Pencacahan dilakukan di cawan petri yang berisi PBS ditambah 0,3% bovine serum albumin (BSA) (Sigma-Aldrich. Inc, A-7030), 100 IU/ml penicillin (Sigma-Aldrich, St. Louis, MO, USA) dan 0,1 g/ml streptomycin (Sigma-Aldrich) dan diekuilibrasi terlebih dahulu di dalam inkubator. Oosit yang digunakan adalah oosit dengan sel-sel kumulus yang kompak serta sitoplasma yang homogen. Oosit hasil seleksi dicuci dalam media maturasi sebanyak dua kali untuk kemudian dimaturasi secara in vitro. Oosit dimaturasi di dalam drop berisi 100 μl media maturasi yang ditutup mineral oil selama 24 jam. Media dasar yang digunakan untuk maturasi adalah tissue culture media (TCM) 199 with Earle’s salts (Gibco, Grand Island, NY, USA) ditambah dengan 10 IU/ml Pregnant Mare Serum Gonadotrophin (PMSG) (Kyoritsu Seiyaku, Tokyo, Japan), 10 IU/ml (hCG) (Kyoritsu Seiyaku, Tokyo, Japan) dan 50 μg/μl gentamycin (Sigma-Aldrich. Inc, P-4687). Pada penelitian ini, oosit dimaturasi dalam media yang dibagi dalam dua kelompok, yaitu kelompok tanpa BSA (BSA-) berupa media dasar tanpa penambahan 0,3% BSA tetapi ditambah sericin 0%, 0,1%, 0,25%, dan 0,5%. Kelompok dengan BSA, berupa media dasar ditambah dengan 0,3% BSA (BSA+) dan sericin 0% (kontrol), 0,1%, 0,25%, dan 0,5%. Penggunaan konsentrasi sericin mengacu pada Isobe et al. (2012). Semua kultur dilakukan pada suhu 39°C dalam 5% CO2 in air. Setelah 24 jam, oosit kemudian difiksasi untuk dievaluasi status intinya.
Evaluasi Tingkat Maturasi Oosit
9
PBS+BSA 0,3% diatas gelas objek yang telah diberi bantalan paraffin dan vaseline (1:9) pada keempat sisi, kemudian difiksir dan ditutup dengan cover glass sambil meratakan parafin dan vaseline agar menempel sempurna pada gelas objek. Preparat selanjutnya difiksasi dalam larutan asam asetat dan ethanol absolute dengan perbandingan 1:3 selama 48-72 jam. Setelah 48-72 jam preparat diwarnai dengan 2% aceto-orcein selama 2-3 menit, kemudian pewarna dibilas dengan 25% asam asetat dan seluruh sisi cover glass diberi larutan kuteks bening untuk selanjutnya dilakukan pengamatan morfologi dengan menggunakan mikroskop fase kontras (Olympus IX, Japan). Status inti oosit dikelompokkan menjadi tahap germinal vesicle (GV), germinal vesicle breakdown (GVBD) dan metaphase II (MII). Tingkat maturasi merupakan perbandingan antara jumlah oosit yang mencapai tahap MII dengan jumlah keseluruhan oosit yang dimaturasi. Tahap II. Fertilisasi In vitro (FIV)
Oosit yang telah dimaturasi dari semua kelompok kemudian difertilisasi in vitro. Pada tahap ini konsentrasi sericin 0,5% tidak digunakan karena menurunkan tingkat maturasi oosit. Thawing semen beku domba dilakukan dalam waterbath pada suhu 30-32°C selama 30 detik, kemudian disentrifugasi pada kecepatan 1800 rpm selama 5 menit dalam media fertilisasi. Setelah sentrifugasi, endapan spermatozoa diencerkan dengan media fertilisasi sampai konsentrasi akhir 1×106 spermatozoa/ml. Campuran spermatozoa dan media fertilisasi dibuat dalam bentuk drop 100 μl dan ditutup dengan mineral oil (Sigma-Aldrich. Inc, M-8410). Oosit yang sudah dimaturasi dicuci dalam media fertilisasi sebanyak 2 kali, kemudian dipindahkan ke dalam drop dan diinkubasi selama 14 jam dalam inkubator CO2 5% temperatur 39°C. Setelah 14 jam ko-inkubasi, dilakukan evaluasi tingkat fertilisasi oosit. Oosit difiksasi dengan metode yang sama dengan yang digunakan untuk melihat tingkat maturasi inti oosit.
Penentuan tingkat kemampuan fertilisasi in vitro dilakukan berdasarkan pembentukan dan jumlah pronukleus (PN). Oosit yang terfertilisasi normal ditandai dengan terbentuknya dua pronukleus (jantan dan betina, 2PN) dalam sitoplasma oosit, sedangkan yang terfertilisasi polispermi terdiri dari lebih 2 PN. Tingkat fertilisasi dibagi dalam 3 kriteria, yaitu total, normal, dan polispermi. Total fertilisasi merupakan perbandingan antara jumlah oosit yang dibuahi dengan jumlah keseluruhan oosit. Tingkat fertilisasi normal diperoleh dari perbandingan oosit yang membentuk 2 PN dengan jumlah oosit yang terfertilisasi, sedangkan polispermi adalah perbandingan antara oosit yang terdiri dari >2PN dengan jumlah oosit terfertilisasi.
Rancangan Penelitian
11
Tingkat maturasi inti oosit domba pada perlakuan berbagai konsentrasi sericin dengan atau tanpa BSA dapat dilihat pada tabel 1. Dari hasil penelitian terlihat 70-92% oosit yang dimaturasi dalam media dengan suplementasi sericin dan BSA+sericin mampu mencapai tahapan germinal vesicle breakdown (GVBD) dan melanjutkan proses meosisnya setelah IVM. Tahapan GVBD pada penelitian ini diawali dengan oosit yang mampu mencapai MI dengan persentase (4,65- 18,6%) dan dilanjutkan dengan A/T (1,7-11,6%), MII (21,0-83,7%). Pada kelompok BSA-, terjadi penurunan persentase oosit yang mencapai fase MII secara signifikan pada konsentrasi sericin 0,5% (P < 0,05) dari persentase oosit yang mencapai tahap GVBD (67,9% ± 5,4). Persentase oosit yang mencapai tahap GVBD tertinggi terlihat pada kelompok sericin 0,1% (92,2% ± 2,3) dan berbeda nyata dibandingkan dengan kontrol (35,0% ± 4,2) dan sericin 0,5% (67,9 ± 5,4). Namun demikian tidak terlihat perbedaan yang signifikan antara sericin 0,1% dan 0,25% (84,7% ± 3,2) (P > 0,05). Lebih lanjut, tabel 1 menunjukkan persentase oosit yang mampu mencapai MII tertinggi terlihat pada konsentrasi sericin 0,1% (83,7% ± 1,8) dan berbeda nyata jika dibandingkan dengan konsentrasi sericin 0% (20,6% ± 4,1), sericin 0,25% (63,6% ± 2,9 ) dan sericin 0,5% (39,7% ± 3,4) (P < 0,05).
Tabel 1. Tingkat maturasi inti oosit domba pada media yang ditambahkan sericin tanpa atau dengan BSA
Keterangan:
GVBD : germinal vesicle breakdown, MII : metaphase II a,b,c,d
Superskrip yang berbeda dalam kolom yang sama menunjukkan perbedaan yang nyata (P < 0,05)
Tingkat Fertilisasi In Vitro dari Oosit yang Dimaturasi dalam Media yang Ditambahkan Sericin tanpa atau dengan BSA
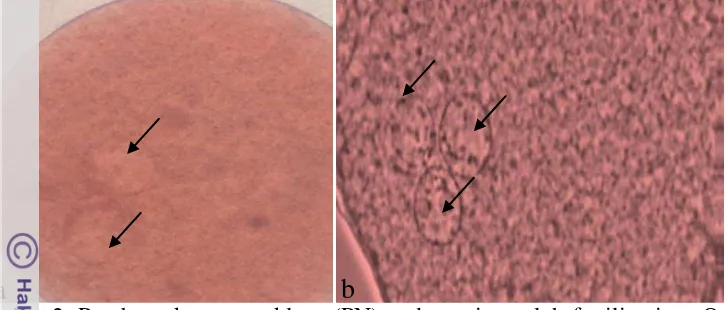
Tingkat fertilisasi oosit dapat diketahui dengan melihat adanya pembentukan pronukleus (Gambar 2). Persentase oosit yang terfertilisasi setelah dimaturasi pada media yang ditambahkan sericin ditampilkan dalam tabel 2.
Perlakuan Jumlah oosit
Tingkat maturasi inti n (% rata-rata± SEM)
12
Gambar 2. Pembentukan pronukleus (PN) pada oosit setelah fertilisasi. a. Oosit dengan 2 pronukleus ( 2 PN), ), b. Oosit dengan lebih 2 pronukleus (>2 PN), tanda panah menunjukkan pronuklues (perbesaran 200x). Tabel 2. Tingkat fertilisasi oosit domba setelah dimaturasi pada media yang
ditambahkan sericin tanpa atau dengan BSA
Keterangan: a,b,c,d
Superskrip yang berbeda dalam kolom yang sama menunjukkan perbedaan yang nyata (P < 0,05)
Penelitian tahap kedua dilakukan dengan mengevaluasi tingkat fertilisasi dari oosit yang terfertilisasi secara keseluruhan (total) dan monospermi, setelah 14 jam inkubasi. Tabel 2 menunjukkan, kultur oosit pada media yang disuplementasi sericin dengan atau tanpa BSA, hanya memberikan pengaruh pada persentase total fertilisasi dari oosit (P < 0,05), namun tidak berpengaruh pada persentase fertilisasi normal dan polispermi (P > 0,05). Oosit yang dimaturasi pada perlakuan BSA- lalu difertilisasi secara in vitro, persentase total oosit terfertilisasi yang paling tinggi terlihat pada oosit yang dimaturasi dengan sericin 0,1% (84,7% ± 3,5) (P < 0,05) dibandingkan dengan sericin 0,25% (54,8% ± 6,7) dan kontrol (16,5% ± 4,1). Pada kelompok perlakuan BSA+, tidak terdapat perbedaan persentase total oosit yang terfertilisasi, monospermi dan polispermi antar perlakuan (P > 0,05).
Perlakuan
Jumlah oosit
13
Pembahasan
Sericin dilaporkan memiliki aktivitas antioksidan dan mencegah kerusakan sel akibat radikal bebas melalui mekanisme penghambatan peroksidasi lipid (Kato et al. 1998). Penghambatan peroksidasi lipid melalui peningkatan gugus hidroksil mengindikasikan sericin memiliki aktivitas menangkap ROS yang tinggi (Kato et al. 1998; Chlapanidas et al 2013). Gugus hidroksil pada asam amino menghambat peroksidasi lipid dengan berikatan dengan ROS sehingga menjadi senyawa yang lebih stabil serta dengan cara mengkelat logam reaktif seperti besi (Fe2+) dan tembaga (Cu2+) yang memicu peroksidasi lipid (Patel dan Modasiya 2011; Chlapanidas et al. 2013). Transisi ion logam seperti Fe2+ dan Cu2+ mengkatalisis produksi radikal bebas yang berbahaya (Halliwell dan Gutteridge 1990a). Menurut Minnoti dan August (1989) Fe2+ merupakan element yang bersifat paling merusak (detrimental) terhadap sel, Fe2+ mampu menginduksi superoksidasi anion menjadi radikal hidroksil. Produksi radikal hidroksil yang dikatalisasi oleh Fe2+ akan mengoksidasi lipid dan menyebabkan stres oksidatif Pengikatan logam reaktif oleh hidroksil amino akan mengurangi kereaktifan logam tersebut serta mencegah terjadinya reaksi yang menghasilkan radikal hidroksil (Young dan Woodside 2001). Selanjutnya, potensi sericin sebagai antioksidan dilaporkan dapat meningkatkan proliferasi sel embrio sehingga persentase blastosis yang diproduksi secara in vitro juga meningkat (Isobe et al. 2012). Dalam penelitian ini, sericin ditambahkan ke dalam media maturasi untuk mengevaluasi potensi antioksidan dari sericin, tetapi tidak ditemukan adanya perbedaan yang signifikan antara kelompok oosit yang dimaturasi dengan dan tanpa sericin. Terada et al. (2002) melaporkan sericin memiliki target yang sama dengan BSA pada sel, sehingga kemungkinan terjadi pengaruh yang bersamaan dan tidak saling mendukung (overlapping effect) dalam penambahan sericin ke dalam media dengan BSA. Hal tersebut di atas mungkin juga terjadi pada penelitian ini karena pada saat oosit dimaturasi dalam media dengan sericin tanpa BSA, sericin mampu mendukung oosit untuk berkembang sampai pada fase MII. Oleh karena itu diperlukan penelitian lanjutan tentang konsentrasi antioksidan yang ada di dalam oosit setelah maturasi. Kemungkinan lainnya adalah bahwa dilaporkan oosit masih mempunyai kandungan GSH yang tinggi sehingga masih mampu mentoleransi pembentukan radikal bebas yang meningkat akibat sistem kultur yang digunakan (De Matos et al. 2002).
14
2002). Namun demikian, serum termasuk didalamnya BSA memiliki efek negatif, keduanya diperoleh dengan cara dipurifikasi dari darah yang memungkinkan terjadinya resiko terkontaminasi oleh patogen dan virus (Thibier, 2006). Oleh karenanya diperlukan penggantian penggunaan serum dan BSA dengan komponen lain yang tetap mampu mencukupi kebutuhan protein untuk perkembangan oosit. Banyak penelitian yang telah melaporkan tentang penggantian serum dan BSA dan penggunaan media tanpa serum (Ali et al. 2002; Summers dan Biggers et al. 2003).
Oosit yang dimaturasi pada media tanpa BSA atau sericin yang mampu berkembang sampai tahap MII hanya 20,6%. Data ini menunjukkan bahwa oosit memerlukan protein dan atau asam amino untuk perkembangannya. Secara in vivo, selama masa perkembangan oosit hingga mencapai embrio akan terpaparkan pada lingkungan dengan level asam amino yang tinggi dalam oviduk dan uterus (Elhassan et al. 2001). Asam amino tertentu pada membran oosit dan embrio, berperan sebagai molekul pembawa asam amino lain melalui membran untuk memenuhi kebutuhan asam amino yang diperlukan untuk sintesis protein (Van Winkle, 2001). Secara spesifik, berbagai asam amino dibutuhkan sebagai substrat untuk sintesis nukleotida (glutamina, aspartat, glisina), GSH (asam glutamat, sisteina, glisina), glikoprotein, asam hyaluronic, dan molekul signal (arginina). Asam amino tersebut juga berperan penting dalam pengaturan pH dan osmolaritas, pengkelat logam berat (glisina) dan donor gugus metil (metionina) (Dumollarad et al. 2007; Sturmey et al. 2008).
Penambahan sericin 0,1% pada penelitian ini memberikan persentase tingkat maturasi dan fertilisasi terbaik. Hal ini mengindikasikan penambahan sericin pada konsentrasi tersebut mampu mencukupi kebutuhan protein yang selama ini diperoleh dari penambahan serum atau BSA. Namun demikian, mekanisme transport seluler dari sericin dalam mendukung perkembangan oosit dan proliferasi sel hingga blastosis belum diketahui. Menurut (Francis et al.2010) transportasi senyawa yang merupakan makromolekul termasuk didalamnya albuminoid protein ke dalam sel dapat berlangsung dengan mekanisme endositosis. Mayor dan Pragono (2007) telah melaporkan bahwa protein-protein yang ada di dalam media dapat ditransportasikan dengan mekanisme endositosis, yaitu difasilitasi oleh vesikula-vesikula. Secara in vitro partikel berukuran besar dapat digunakan oleh sel dengan cara fagositosis dan atau dengan makropinositosis dari cairan media. Kedua mekanime tersebut bertujuan untuk meregulasi formasi dari actin yang ada pada membran. Menurut Lim et al. (2008) makropinositosis merupakan molekul sinyal yang distimulasi oleh growth factor untuk merubah formasi dari actin, perubahan formasi tersebut akan membentuk vesikula yang selanjutnya melakukan fusi dengan membran. Selanjutnya, vesikula intraseluler tersebut akan mengalami fusi dengan vesikula yang ada di lisosom lalu terdegradasi dan melepaskan molekul yang ditransportasikan (Lim et al. 2008; Francis et al. 2010). Lebih lanjut, molekul protein akan masuk ke dalam nukleus melalui transpor aktif dengan melewati nuclear pore complex (NPC) atau berikatan dengan nuclear localization signal untuk berikutnya mengaktifkan berbagai proses yang berlangsung di nukleus dan atau diubah menjadi substrat untuk pembentukan senyawa tertentu (Phillip et al. 1990).
15
pada penelitian ini, dimana terjadi penurunan persentase oosit yang mampu melanjutkan meosis hingga mencapai MII pada konsentrasi sericin 0,25% dan 0,5%. Kelompok protein lainnya yang juga tergolong albuminoid protein yaitu BSA, dilaporkan dapat menyebabkan kerusakan pada sel. Menurut Osman et al. (2012) molekul albumin dalam jumlah yang tinggi dapat menyebabkan kondisi hiperosmotik pada sel, kondisi tersebut berakibat pada terjadinya stres pada membran sel. Apabila stres pada membran berlangsung secara terus menerus maka akan menyebakan kerusakan pada sitoskeleton dan atau gangguan pada sistem regulasi peningkatan volume sel/ regulatory volume increase system (RVI) (Nang et al. 2011).
Suplementasi antioksidan sericin dalam media maturasi pada penelitian ini merupakan upaya untuk meningkatkan tingkat maturasi inti yang pada akhirnya berpengaruh pada keberhasilan fertilisasi. Pada penelitian ini evaluasi keberhasilan fertilisasi dilihat dengan jumlah pembentukan pronukleus dengan kriteria monospemi (2 PN) dan polispermi (>2 PN). Secara umum, persentase tingkat fertilisasi memperlihatkan kecenderungan yang sama dengan tingkat maturasi. Oosit yang dimaturasi dengan media yang ditambahkan sericin 0,1% tanpa BSA menunjukkan persentase tingkat fertilisasi yang paling baik. Hal ini mengindikasikan bahwa sericin pada konsentrasi yang tepat mampu mendukung kompetensi perkembangan oosit hingga membentuk pronukleus.
Persentase oosit yang terfertilisasi oleh lebih dari satu spermatozoa (polispermi) pada penelitian ini mencapai 13,7% - 20,8%. Menurut Crozet et al. (1988) kejadian polispermi pada fertilisasi in vitro domba masih bervariasi, namun relatif tinggi (10-30%) dibandingkan dengan kondisi in vivo. Salah satu penyebab tingginya kejadian polispermi pada fertilisasi in vitro dikarenakan konsentrasi spermatozoa yang digunakan cenderung lebih banyak dibandingkan dengan in vivo (Han et al. 1999; Luisa et al. 2005). Selain itu, kejadian polispermi disebabkan oleh kondisi kultur in vitro yang tidak memungkinkan untuk mencegah terjadinya polipermi, pada kondisi in vivo sekresi dari cairan yang berasal dari sel epitel oviduk akan meregulasi jumlah spermatozoa yang akan berikatan dengan zona pelusida dan mengurangi terjadinya penetrasi oosit oleh lebih dari satu spermatozoa. Lebih lanjut menurut Hai Li et al. (2003) dalam microdroplet spermatozoa untuk fertilisasi in vitro selain terdapat spermatozoa motil juga ditemukan adanya spermatozoa yang sudah mati. Spermatozoa yang telah mati dapat menimbukan kerusakan (detrimental) terhadap oosit, sehingga mengurangi kemampuan oosit untuk melakukan block polispermi (Gill et al. 2003; Hai Li et al. 2003;Luisa et al. 2005).
16
Saran
17
DAFTAR PUSTAKA
Agarwal A, Bhusant S. 2012. Preparation of sericin nano particles from waste of silk industry. Int J of Sci Res. 1(3): 116-120.
Agarwal A, Saleh RA, Bedaiwiy MA. 2003. Role of reactive oxygen species in the patophysiology of human reproduction. Fert Ster 79:829-843.
Ali A, Sirard M. 2002. Effect of the absence or presence of various protein supplements on further development of bovine oocytes during in vitro maturation. Biol Reprod 66:901–905.
Ali J, Shahata MAM, Al-Natsha SD. 2002. Formulation of a protein-free media for human assisted reprodution. Hum Reprod 15: 145-148.
Alomar M, Tasiaux H, Remacle S, George F, Paul D, Donnay I. 2008. Kinetics of fertilization and development, and sex ratio of bovine embryos produced using the semen of different bulls. Theriogenology 107: 48-61.
Altman GH, Diaz F, Jakuba C, Calabro T, Horan RL, Chen JS, Lu H, Richmond J, Kaplan DL. 2003. Silk-based biomaterials. Biomaterials 24:401–416. Anguita B. 2007. Effect of oocyte diameter on meotic competence, embryo
development, p34 (cdc2) expression and MPF activity in prepubertal goat oocytes. Theriogenology 67:526-536.
Beilby KH, Grupen CG, Thomson PC, Maxwell WMC, Evans G. 2009. The effect of insemination time and sperm dose on pregnancy rate using sex-sorted ram sperm. Theriogenology 71:829-835.
Chlapanidas T, Farago S, Lucconi G, Pertehella S, Galuzzi M, Manteli M, Avanzini MA, Tosca MC, Marazzi M, Vigo D, Torre ML, Faustini M. 2013. sericins exhibit ROS-scavenging, anti-tyrosinase, anti-elastase and in vitro immunomodulatry activities. Int J Biol Macromol 58:47-56.
Cleine JH. 1996. Fertilization: Theory Over-View. IVF LAB. NV Organon
127-Covarrubias L, García DH, Schnabel D, Vidal ES, Obregon SC. 2008. Function of reactive oxygen species during animal development: Passive or active. Dev. Biol 320:1-11.
Crozet N, Huneau D, De smedt V, Theron MC, Szollosi D, Torres S, Sevellec C. 1987. In vitro fertilization with normal development in the sheep. Gamete Res 16:159-170.
Crozet N. 1988. Fine structure of sheep fertilization in vitro. Gamete Res 19:291-303.
Dalvit GC, Cetica PD, Beconi MT. 2005. Reactive oxygen species in bovine embrio in vitro production. Biocell 29: 209-212.
Dash R, Acharya C, Bindu PC, Kundu SC. 2008. Antioxidant potential of silk protein sericin against hydrogen peroxide-induced oxidative stress in skin fibroblast. BMB Rep. 41:236-241.
18
De Matos DG, Gasparrini B, Pasqualini SR, Thompson JG. 2002. Effect of glutathione synthesis stimulation during in vitro maturation of ovine oocytes on embryo development and intracelluler peroxide content. Theriogenology 57:1443-1451.
Droge W. 2002. Free radicals in the physiological control of cell function. Physiol Rev 82: 47-95.
Du G, Li M, Ma F, Liang D. 2009. Antioxidant capacity and the relationship with polyphenol and vitamin C in Actanidia fruits. Food Chem. 113: 557-562. Dumollard R, Duchen R, Carrol J. 2007. The role of mitochondrial function in the
oocyte and embryo. Dev Biol 77: 21-49.
Elder K, Dale B. 2003. In vitro Fertilization Second Edition. USA (US): Cambridge University Pr.
Elhassan YM, Wu AC, Leanez RJ, Tasca AJ, Watson R, Westhusin ME. 2001. Amino acid concentrations in fluids from the bovine oviduct and uterus and in ksom-based culture media. Theriogenology 55: 1907-1918.
Elias RJ, Kellerby SS, Decker EA. 2008. Antioxidant activity of proteins and peptides. Crit Rev Food Sci Nutr 48:430–441.
Ellmerer M, Schaupp L, Brunner GA, Sendlhofer G, Wutte A,Wach P, Pieber TR. 2000. Measurement of interstitial albumin in human skeletal muscle and adipose tissue by open-flow microperfusion. Am J Physiol Endocrinol Metab 278:E352–E356.
Fischer B, Bavister BD. 1993. Oxygen tension in the oviduct and uterus of rhesus monkey, hamsters, and rabbits. J. Reprod Fert 99: 673-679.
Francis GL. 2010. Albumin and mammalian cell culture: implications for biotechnology applications. Cytotechnology 62:1-26. doi 10.1007/s 1.0.6. Gill MA, Abeydeera LR, Day BN, Vazquet JM, Roca J, Martinez EA. 2003.
Effect of the volume of the medium and number of oocytes during in vitro fertilization on embryo developmental in pigs. Theriogenology 60:1-10. Gillis G, Bojanowski K, Majewski G, Bohm R. 2009. Sericin peptides from Silk
protein. Cos Sci Tech 21:28-30.
Gordon I. 2003. Laboratory Production of Cattle Embryos. Ed ke-2. London (GB):CABI Publishing.
Guerin P, Moutassim SEI, Menezo Y. 2001. Oxidative stress and protection against reactive oxygen species in the pre-implantation embrio and its surroundings. Hum Reprod 7: 175-189.
Hai Li Y, Wei M, Li M, Hou Yi, Hong Jiao L, Hua Weng Y. 2003. Reduced polyspermic penetration in porcine oocytes inseminated in a new in vitro fertilization (IVF) system straw IVF. Biol Reprod 69:1500-1585.
Halliwell B, Gutteridge JMC. 1990a. Oxygen toxicity oxygen radicals, transition metals and disesase. Biochem. J 219: 1-14.
Halliwell B, Gutteridge JMC. 2007b. Free Radicals in Biology and Medicine. 3rd ed. Oxford (GB): Clarendon Pr.
Han YM, Abeydeera LR, Kim JH, Moon HB, Cabot RA, Day BN, Prather RS. 1999. Growth retardation of inner cell mass cells in polyspermic oocytes matured and fertilized in vitro. Biol Reprod 60:1110–1113
19
the subsequent development of bovine cumulus-oocyte complexes. Mol Reprod Dev 57:353-360.
Hodgman R, Tay J, Mendez R, Richter JD. 2001. CPEB phosphorylation and cytoplasmic polyadenylation are catalyzed by the kinase IAK1/Eg2 in maturing mouse oocytes. Development 128:2815 –2822.
Huneau D, Crozet N. 1989. In vitro fertilization in the sheep: effect of elevated calcium concentration at insemination. Gamete Res 23:119-125.
Isobe T, Ikebata Y, Onitsuka T, Wittayarat M, Sato Y, Taniguchi M, Otoi T. 2012. Effect of sericin on preimplantation development of bovine embryos cultured individually. Theriogenology 78: 747-752.
Kato N, Sato S, Yamanaka A, Yamada H, Fuwa N, Nomura M, 1998. Silk protein sericin, inhibits lipid peroxidation and tyrosinase activity. Biosci Biochem 62: 145-147.
Kweon H, Yeo J, Kim KY, Kim YS, Song HS, Kim S, Woo S, Han S, Lee K. 2009. Characteristic of silk sericin extracted sericin jam. Int J Indust Entomol 18(2): 121-124.
Leibfried-Rutledge ML, Critser ES, First NL. 1986. Effects of fetal calf serum and bovine serum albumin on in vitro maturation and fertilization of bovine and hamster cumulus-oocytes complexes. Biol Reprod. 35:850-857.
Lim JP, Wang JT, Kerr MC, Teasdale RD, Glesson PA. 2008. A role for SNX5 in the regulation of macropinocytosis. BMC Cel Biol 9:58-69.
Livingston T, Rich K, MacKenzie S, Godkin JD. 2009. Glutathione content and antioxidant enzyme expression of in vivo matured sheep oocytes. Anim Reprod Sci 116:256-273.
Lodde V, Modina S, Maddox-Hytell P, Franciosi F, Lauria A, Luciano AM. 2008. Oocyte morphology and trancriptional in relation to chromatin remodelling during final phase of bovine oocyte growth. Mol Reprod Dev 75:915-924. Luisa G, Barbara B, Maura T, Giulia C, Maria GP, Paolo B, Mauro M. 2005. The
capabilty of reprogramming male chromatin after fertilization is dependent on oocyte maturation. Soc Reprod Fert 1470-1626. doi: 10:1530/rep. 1.00550. Lv L, Wenbin Y, Wenzhong L, Youshe R, Fuzhong L, Kyung-Bon L, Goerge W
S. 2010. Effect of oocyte selection, estradiol and antioxidant treatment on in vitro maturation of oocyte collected from prepubertal boer goats. Italian J Anim Sci 9(11):50-53.
Mayor S, Pagano RE. 2007. Pathways of clathrin-independent endocytosis. Nat Rev Mol Cel Biol 8:603-612.
Mingoti GZ, Caiado CVSD, Meo SC, Barreto LSS. 2009. The effect of interaction between macromolecul supplement and oxygen tension on bovine oocytes and embryos cultured in vitro. Zygote 17: 321-328.
Minotti G, August SD. 1989. The role of iron in oxygen radicals mediated lipid peroxidation. Chem. Biol Interact. 71: 1-9.
Nang CF, Osman K, Buddin SB, Ismail MJ, Jaffar FH, Mohamad SF. 2011. Bovine serum albumin : survival and osmolarity effect on bovine spermatozoa. Androgia 1439-1445. doi: 10:1111/j.1.4.3.
Natarajan R, Shankar MB, Munuswarny D. 2010. Effect of α-tocopherol
20
Osman K, Nang CF, Ibrahim SF, Budin SB, Jaffar FHF, Wahab NAA. 2012. Albumin improved spermatozoa quality and DNA integrity for freezing-free preservation. Int J Biol Med Res 3(2):1670-1679
Padamwar MN, Pawar AP, Daithankar AV, Mahadik KR. 2005. Silk sericin as a moisturizer on in vivo study. J Cosmet Dermat 4:250-257.
Patel RJ, Modasiya MK. 2011. Sericin: pharmaceutical application. Int J Res Biomed Sci 54:132-139.
Phillip W, Jeannete K, Antonius K, Michael NH. 1990. Active transport of protein into nucleus. FEBS 25(1): 1-5).
Poli G, Leonarduzzi G, Biasi F, Chiarpotto E. 2004. Oxidative stress and cell signalling. Curr Med Chem 11:1163-1182.
Rahman ANMA, Abdullah RB, Khadijah WE. 2008. In vitro maturation of oocytes with special reference to goat: A review. Biotechnology 7(4):599-611.
Rajalakshmi D, Narasimhan. S. 1996. Food antioxidants: Sources and methods of evaluation. p. 65-83. New York (US): Marcel Dekker Pr
Sothornvit R, Chollakup R, Suwanruji P. 2010. Extracted sericin form silk waste for film formation. Songklanakarin J Sci Technol 32 (1):17-22.
Souza-Fabjan JM, Locatelli Y, Duffard N, Corbin E, Touze JL, Perreau C, Beckers JF, Freitas VJ, Mermillod P. 2014. In vitro embryo production in goats: slaughterhouse and laparoscopic ovum pick up-derived oocytes have different kinetics and requirements regarding maturation media. Theriogenology 81:1021-1031.
Steel RGD, Torrie JH. 1993. Prinsip dan Prosedur Statistika: Suatu Pendekatan Biometrik. Penerjemah: B. Sumantri. Jakarta (ID): Gramedia Pustaka.
Sturmey RG, Leese HJ. 2008. Role of glucose and fatty acid metabolism in porcine early embryo development. Reprod Fertil Dev 20:149-152.
Summers MC, Biggers JD. 2003. Chemically-defined and the culture of mammalian preimplantation embryos : historical perspective and current issues. Hum reprod 9: 557-582.
Takahashi M, Keicho K, Takahashi H, Ogawa H, Schultz RM, Okano A. 2000. Effect of oxidative stress on development and DNA damage in in vitro cultured bovine embryos by comet assay. Theriogenology. 54:137– 45.
Takasu Y, Yamada H, Tsubouchi K. 2002. Isolation of three main sericin components from the cocoon of the silkworm, Bombyx mori. Biosci Biotechnol Biochem 66 (12):2715- 2718.
21
Young IS, Woodside JV. 2001. Antioxidant in health and disease. J Clin Pathol 54:176-186.
23
Lampiran 1 Komposisi media transportasi ovarium
Lampiran 2 Komposisi media koleksi
Komponen Jumlah
PBS 100 ml
Penisilin-streptomycin (100 IU/ml) 1000 μl
Bovine Serum Albumin 0,3% 0,3 g/100 ml
Stok PBS : 9,6 g (Dulbecco’s Nissui, Japan) / 1000 ml milli - Q water Stok penicillin-streptomycin
Dosis penicillin: 0,06 g/l = 100.000 IU/l Dosis streptomycin :0,1 g/ml
Untuk membuat stok Penicillin 0,0006 g (Sigma-Aldrich. Inc, P-4687) dan streptomycin (Sigma-Aldrich. Inc, S-9137) 0,001 g dilarutkan dalam 10 ml milli-Q water.
BSA 0,3% : 0,3 g/100 ml
Lampiran 3 Komposisi media dasar TCM-199 untuk maturasi oosit
Komponen Jumlah
Larutan TCM-199 5 ml
Bovine Serum Albumin (0,3%) 0,015 g
PMSG 50 μl
hCG 50 μl
Gentamycin 5 μl
Stok PMSG
Untuk membuat stok, maka 1000 IU PMSG dilarutkan dalam 1 ml TCM 199 Stok hCG
Untuk membuat stok, maka 1500 IU HCG dilarutkan dalam 1,5 ml TCM 199
Komponen Jumlah
Sodium chloride (Sigma Aldrich, USA) 9,0 g
Milli Q water 1000 ml
24
Lampiran 4 Komposisi media fertilisasi in vitro
Komponen mM mg/100 ml
NaCl 90 525,96
KCl 12 89,46
NaHCO3 25 210,03
NaH2PO4 anhydrous 0,5 6,00
MgSO4 7H2O 0,5 12,33
Sodium lactate 10 112,10
60% syrup 0,19 ml
Hepes 10 238,30
CaCl2 2H20 8 117,60
Sodium pyruvate 2 22,00
Caffeine anhydrous 2 38,44
BSA (Fatty acid free) 5 mg/ml 500,00
25
RIWAYAT HIDUP
Penulis dilahirkan di Sigli Aceh pada tanggal 23 Mei 1990 dari pasangan Tgk H Yahya M. Ali Arsyad dan Hj Cut Sabarita. Penulis merupakan anak pertama dari 4 bersaudara, yaitu Muhammad Hafas, Cut Sofia Hanin, dan Cut Eliza Mayar. Tahun 2007 penulis menamatkan pendidikan Sekolah Menengah Atas (SMA) dari SMAN 1 Langsa, Aceh. Pendidikan tinggi negeri ditempuh di Fakultas Matematikan dan Ilmu pengetahuan Alam (FMIPA) Biologi Universitas Syiah Kuala Banda Aceh dari tahun 2007 dan dinyatakan lulus pada tahun 2011. Pada tahun 2012 penulis diterima di Program Pascasarjana IPB pada Program studi Biologi Reproduksi Fakultas Kedokteran Hewan. Beasiswa selama menempuh program pascasarjana diperoleh dari Beasiswa Unggulan Dikti tahun 2012.