SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
PERAN IKAN MAS (Cyprinus carpio L.) JANTAN
DALAM MERANGSANG PEMIJAHAN IKAN TAWES
(Barbonymus gonionotus B.) DENGAN METODE CANGKRINGAN
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
*Dengan ini saya menyatakan bahwa tesis berjudul Peran Ikan Mas (Cyprinus carpio L.) Jantan dalam Merangsang Pemijahan Ikan Tawes (Barbonymus gonionotus B.) dengan Metode Cangkringan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2013 Lysa Simanjuntak NIM 100071
*
RINGKASAN
LYSA SIMANJUNTAK. Peran Ikan Mas (Cyprinus carpio L.) Jantan dalam Merangsang Pemijahan Ikan Tawes (Barbonymus gonionotus B.) dengan Metode Cangkringan. Dibimbing oleh MUHAMMAD ZAIRIN Jr, MIA SETIAWATI, dan RUDHY GUSTIANO.
Salah satu cara mempercepat pemijahan ikan adalah dengan merangsang ikan melalui sistem imbas atau yang lebih dikenal dengan metode Cangkringan. Metode ini merupakan metode alami yang efektif dan aman karena selama penanganan induk tidak terjadi stres sehingga resiko mortalitas kecil, dan induk ikan mas dapat digunakan sebagai perangsang untuk beberapa kali pemijahan (Zairin et al. 2005). Sistem imbas dikembangkan oleh Balai Benih Ikan Sentral (BBIS) Cangkringan, Sleman, Daerah Istimewa Yogyakarta pada awal tahun 1970-an. Metode ini dilakukan dengan menggunakan ikan mas yang dipijahkan dalam wadah yang sama dengan induk ikan tawes yang relatif sulit dipijahkan walaupun telah matang gonad. Hasilnya ketika ikan mas memijah, ikan tawes juga ikut memijah. Imbas diduga disebabkan oleh adanya semacam feromon yang dilepas oleh ikan mas (Zairin 2003).
Perilaku pemijahan ikan diindikasikan dipengaruhi oleh feromon (sinyal kimia yang dikeluarkan oleh ikan sejenis) (Stacey dan Sorensen 2005). Penggunaan feromon dalam budidaya ikan memiliki nilai praktis yang sangat tinggi karena dapat diterapkan tanpa langsung menangani ikan sehingga mengurangi stres serta merangsang proses endogenous normal sehingga mengurangi kegagalan pemijahan dan pembuahan. Cara ini hanya bekerja pada induk yang benar-benar matang gonad. Pemijahan yang dirangsang dengan feromon sangat potensial untuk dikembangkan pada ikan pemijah massal (mass spawner) (Zairin 2003). Cara ini perlu dikembangkan untuk menemukan sumber feromon yang dapat dijadikan perangsang pada pemijahan ikan. Namun sampai saat ini belum diketahui peran ikan mas jantan dalam merangsang pemijahan ikan tawes dengan metode Cangkringan. Berdasarkan permasalahan di atas maka perlu dilakukan penelitian mengenai peran ikan mas jantan dalam merangsang pemijahan ikan tawes dengan metode Cangkringan.
diperoleh pada perlakuan B dan D kemudian perlakuan A, C dan E masing-masing sebesar 66,7%, 66,7%, 33,3%, 33,3% dan 0%.
Hasil analisis hormon testosteron dan estradiol menunjukkan bahwa konsentrasi testosteron pada ikan mas jantan dan estradiol pada ikan mas betina pada akhir pemijahan sangat menentukan status pemijahan ikan tawes. Konsentrasi testosteron 1,08-6,53 ng mL-1 dapat memberikan pengaruh pemijahan pada ikan tawes (perlakuan B3, C3, D3, A2, B1, dan D1). Konsentrasi testosteron yang terlalu rendah (kurang dari 1 ng mL-1: perlakuan A1 pada ikan mas betina) atau terlalu tinggi (10,42-15,46 ng mL-1 pada ikan mas jantan: perlakuan A1, E1, E2, dan E3) tidak memberikan pengaruh pemijahan pada ikan tawes. Terjadinya pemijahan ikan tawes pada keenam perlakuan di atas juga didukung oleh rendahnya konsentrasi estradiol yaitu berkisar antara 0,23-0,72 ng mL-1 (Perlakuan B3, C3, A2, dan B1).
Dari hasil penelitian ini dapat disimpulkan bahwa spermiasi pada ikan mas jantan yang disuntik ovaprim dapat memberikan pengaruh imbas pada pemijahan ikan tawes. Namun, pengaruh imbas tersebut akan semakin kuat jika juga terdapat ikan mas betina sebagai pengimbas.
SUMMARY
LYSA SIMANJUNTAK. The Role of Males Common Carp (Cyprinus carpio L.) to Stimulate Spawning of Java Carp (Barbonymus gonionotus B.) using Cangkringan Method. Under guidance of MUHAMMAD ZAIRIN Jr, MIA SETIAWATI, and RUDHY GUSTIANO.
A method to induce spawning in fish is a stimulation through other spawning fish which known as the Cangkringan method. This method is still a natural spawning that effective and safe for reducing stress, lowering mortality risk, and using common carp as inducer for spawning of Java carp (Zairin et al. 2005). The inducing system was developed by BBIS Cangkringan, Sleman, Yogyakarta in the early 1970's. This method is performed by using common carp spawning in the same tank with the java carp which is relatively difficult to be spawned. The results showed that Java carp will spawn following spawning of common carp. Pheromone released by common carp was suspected as a responsibile factor for java carp to spawn (Zairin 2003).
The spawning behavior indicated the influenced of pheromones (chemical signals released by a type of fish) (Stacey and Sorensen 2005). The use of pheromones in fish breeding is very practical value because it can be applied without directly handling the fish, it reduce stress and stimulate normal endogenous processes that reduce spawning and fertilization failure. This condition only works on the parent good maturation. The spawning stimulated by pheromones is very potential to be developed in mass spawner fish (Zairin 2003). Therefore it should be developed to find the source of pheromones that can be used as an inducer on fish spawning. Nowadays, the role of male common carp in stimulating the java carp spawning by Cangkringan method is yet not understood. Based on the above problems it is necessary to study the role of male carp to stimulate Java carp spawning with Cangkringan method.
The experimental design used RAL design consisting of five treatments with three replications. Each pair of Java carp parent were placed in the same tank with three common carp (either injected or not injected with ovaprim) as inducer with composition ♂♂♀ not injected (A), ♂♂♀ injected (B), ♂♂ injected ♀ not injected (C), ♂♂♂ injected (D), ♂♂♂ not injected (E). The results of this study showed that the inducer on fish spawning by Cangkringan Method is the common carp because the Java carp will spawned only after common carp spawn. In this study, the Java carp did not spawn before the common carp. The Java carp spawning was done to either by a heterosexual common carp (♂♂♀) or monosex (♂♂♂) spermiation. The resutls showed that the fastest spawning of java carp due to stimulation from common carp occurred in D treatment (3 hours 15 minutes) and C treatment (4 hours 17 minutes). Java carp spawnning were obtained 66.7 % for B (K +) treatment, 66.7 % for D, 33.3% for A, 33.3% for C and 0% for E treatment, respectively.
A2, B1, and D1). Mean while, too low concentrations (less than 1 ng mL-1) in female as or too high (more than 10.42 ng mL-1 ) in male common carp (treatment A1, E1, E2, and E3) could not give any influences to the Java carp spawn. The occurrence of java carp spawn was also supported by the low concentration of estradiol ranged from 0.23-0.72 ng mL-1 (treatment B3, C3, A2, and B1).
The overall results of this study showed that the spermiation of male common carp that were injected with ovaprim, could induce the java carp to spawn. The effect of induction will will be stronger if the female common carp exist.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
PERAN IKAN MAS (Cyprinus carpio L.) JANTAN
DALAM MERANGSANG PEMIJAHAN IKAN TAWES
(Barbonymus gonionotus B.) DENGAN METODE CANGKRINGAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
Judul Tesis : Peran Ikan Mas (Cyprinus carpio L.) Jantan dalam Merangsang Pemijahan Ikan Tawes (Barbonymus gonionotus B.) dengan Metode Cangkringan
Nama : Lysa Simanjuntak NIM : C151100071
Disetujui oleh Komisi Pembimbing
Prof Dr Ir Muhammad Zairin Jr, MSc Ketua
Dr Ir Mia Setiawati, MSi Anggota
Diketahui oleh
Dr Ir Rudhy Gustiano, MSc Anggota
Ketua Program Studi Ilmu Akuakultur
Prof Dr Ir Enang Harris, MS Tanggal ujian: 29 Januari 2013
Dekan Sekolah Pascasarjana
PRAKATA
Puji dan syukur penulis ucapkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul penelitian yang dilaksanakan sejak bulan Maret 2012 ini ialah Peran Ikan Mas (Cyprinus carpio L.) Jantan dalam Merangsang Pemijahan Ikan Tawes (Barbonymus gonionotus B.) dengan Metode Cangkringan.
Penghargaan dan ucapan terima kasih penulis ucapkan kepada Prof Dr Ir Muhammad Zairin Jr, MSc, Dr Ir Mia Setiawati, MSi, dan Dr Ir Rudhy Gustiano, MSc selaku pembimbing, atas kesabaran dan keikhlasan memberikan bimbingan nasehat, arahan dan dorongan mulai dari penulisan proposal, selama pelaksanaan penelitian berlangsung hingga selesainya penulisan tesis ini. Ucapan terima kasih pula penulis sampaikan kepada Dr Ir Widanarni, MSi dan Dr Dinamella Wahjuningrum yang telah banyak memberi saran.
Teristimewa penulis ucapkan terima kasih kepada kedua orangtua tercinta, ayah Ir Hazairin Simanjuntak, MSi dan ibu Nuryalis atas limpahan kasih sayang yang tulus, do’a yang tak putus-putusnya, pengorbanan serta dukungan moril maupun materi yang diberikan kepada penulis. Kepada kakak dan adik-adik penulis, Hery, SS; Nova Rizki, SSos; Lina Saktriana, SE; Lenni, CSPd; Putri Riski Ananda serta seluruh keluarga besar di Padangsidempuan dan Lubuk Jambi, atas segala do’a dan kasih sayangnya.
Penghargaan dan terima kasih kepada para dosen dalam lingkup Departemen Budidaya Perairan dan Ilmu Akuakultur IPB atas ilmu yang penulis dapatkan selama ini. Terima kasih pula penulis sampaikan kepada mitra selama penelitian Lita Masitha, SPi MSi atas dukungan dan kebersamaannya yang tak terlupakan, teman-teman seperjuangan AKU 2010 atas semangat kebersamaan dalam tiap-tiap episode manis selama menempuh pendidikan bersama. Di samping itu, terima kasih penulis sampaikan kepada para peneliti dan teknisi dari Instalasi Penelitian Plasma Nutfah Perikanan Air Tawar Cijeruk atas bantuan selama proses penelitian.
Terima kasih penulis ucapkan kepada teman-teman di Wisma Melati, teman-teman pengurus HIMMPAS IPB 2011-2012, teman-teman pengurus Forum Wacana IPB 2011-2012 atas dukungan dan semangatnya. Terimakasih juga tak lupa penulis sampaikan kepada para ustadz dan ustadzah pembina Rumah Al-Qur’an IPB serta teman-teman RQ IPB atas kebersamaan, do’a dan dukungannya. Terkhusus untuk tim uji petik, Ulan, Tiwi, Pipit, Nia, Ria dan Izza terima kasih untuk corat-coretnya. Kepada semua pihak yang telah membantu yang tak dapat dituliskan satu persatu, semoga Allah subhanahu wa ta’ala berkenan membalas setiap kebaikan itu dengan balasan yang lebih baik. Aamiin.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL x
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xii
1. PENDAHULUAN
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
2. TINJAUAN PUSTAKA
Ikan Mas (Cyprinus carpio L.) 2
Ikan Tawes (Barbonymus gonionotus B.) 3
Vitelogenesis dan Proses Pematangan Oosit Tingkat Akhir 4
Sistem Cangkringan 4
Feromon 5
3. BAHAN DAN METODE
Materi Uji dan Rancangan Penelitian 6
Metode Penelitian 6
Persiapan Induk 6
Persiapan Wadah 6
Pemberokan Induk 7
Pengambilan Contoh Telur 7
Pengambilan Sampel Darah 8
Penyuntikan Induk 8
Pemijahan dengan Sistem Imbas 9
Parameter Penelitian 9
Tingkat Kematangan Gonad 9
Tingkah Laku Pemijahan Ikan 9
Diameter Telur 10
Waktu Ovulasi Ikan Mas (WOM) 10
Beda Waktu Mijah Antara Ikan Mas dan Ikan Tawes (WOT) 10
Derajat Pemijahan (DP) Ikan Tawes 10
Jumlah Telur yang Diovulasikan (TO) pada Ikan Tawes 10 Derajat Pembuahan (FR) pada Ikan Tawes 10
Daya Tetas Telur (HR) 11
Konsentrasi Hormon Testosteron dan Estradiol pada Ikan Mas 11
Parameter Kulitas Air 11
Analisis Data 11
4. HASIL DAN PEMBAHASAN
Tingkat Kematangan Gonad 11
Diameter Telur 11
Posisi Inti Telur 12
Tingkah Laku Pemijahan 13
Fekunditas, Derajat Pembuahan (FR), Derajat Penetasan Telur (HR) 17 Profil Hormon Testosteron dan Estradiol Ikan Mas 18
Kualitas Air 20
5. KESIMPULAN DAN SARAN
Kesimpulan 20
Saran 20
DAFTAR PUSTAKA 21
LAMPIRAN 25
DAFTAR TABEL
1. Desain perlakuan pemijahan ikan mas dalam merangsang pemijahan ikan
tawes dengan metode Cangkringan 6
2. Ukuran diameter telur ikan mas (mm) 12
3. Ukuran diameter telur ikan tawes (mm) 12
4. Status pemijahan ikan, respons ikan tawes, waktu ovulasi ikan mas (WOM), waktu ovulasi ikan (WOT) dan derajat pemijahan ikan tawes 16 5. Bobot tubuh, fekunditas, derajat pembuahan (FR), derajat penetasan telur
(HR) pada ikan tawes yang memijah 18
6. Konsentrasi hormon testosteron dan estradiol ikan mas 19 7. Nilai parameter kualitas air selama penelitian 20
DAFTAR GAMBAR
1. Ikan mas (Cyprinus carpio L.) 2
2. Ikan tawes (Barbonymus gonionotus B.) 3
3. Wadah perlakuan yang digunakan selama penelitian; hapa sebagai pemisah antara ikan mas dan ikan tawes (panah) 7
4. Pengambilan contoh telur 8
5. Pengambilan sampel darah 8
6. Penyuntikan induk 9
7. Telur ikan mas dan ikan tawes. Panah hitam putus-putus telur dorman (GV). Panah hitam inti telur mulai bergerak ke tepi (GVM) 13
8. Kakaban dipenuhi telur ikan mas 14
9. Ikan mas memakan telur-telur yang menempel pada hapa pembatas 14
DAFTAR LAMPIRAN
1. Desain pengacakan wadah 26
2. Data statistik diameter telur ikan mas dan ikan tawes pada setiap
perlakuan dan ulangan 27
3. Gambar telur ikan mas pada setiap perlakuan dan ulangan 30 4. Gambar telur ikan tawes pada setiap perlakuan dan ulangan 31 5. Waktu penyuntikan pertama dan kedua serta waktu pemijahan ikan mas
dan tawes pada setiap perlakuan dan ulangan 32
6. Data bobot tubuh, fekunditas, derajat pembuahan (FR) dan derajat penetasan ikan tawes pada setiap perlakuan dan ulangan 34 7. Data mentah pengukuran hormon testosteron dan estradiol ikan mas pada
1
PENDAHULUAN
Latar Belakang
Pemijahan merupakan salah satu bagian dari reproduksi yang menentukan keberlangsungan hidup suatu spesies ikan agar tetap ada. Faktor-faktor yang merangsang pemijahan ikan terdiri dari faktor internal (kematangan gonad, testosteron dan esrtadiol) dan faktor eksternal berupa faktor fisik (cahaya, suhu, arus), faktor kimia (pH, DO, feromon) dan faktor biologis (adanya lawan jenis dan predator). Berdasarkan tekniknya pemijahan ikan dapat dibagi menjadi pemijahan ikan secara alami, semi buatan dan buatan.
Pemijahan alami adalah cara yang paling sederhana, namun tingkat keberhasilannya mungkin rendah, karena sangat tergantung pada alam. Pemijahan semi buatan yaitu menyuntik atau memasukkan hormon perangsang pada induk betina. Selain mahal, telur yang dihasilkan melalui teknik ini tidak bagus. Hal ini terjadi karena penyuntikan hormon dapat menyebabkan telur yang ada dalam tubuh ikan dipaksa untuk keluar hingga terjadi pemijahan. Pemijahan buatan sangat rumit karena harus melalui beberapa tahapan kerja, yaitu menyuntik induk betina, mengambil sperma, membuat larutan sperma, mengurut telur dan mencampurkan telur dengan sperma. Selain itu biaya yang diperlukan tidak sedikit, terutama untuk menyediakan bahan-bahan dan peralatan.
Salah satu cara mempercepat pemijahan adalah dengan merangsang ikan melalui sistem imbas atau yang lebih dikenal dengan metode Cangkringan. Metode ini merupakan metode alami yang efektif dan aman karena selama penanganan, induk tidak mengalami stres sehingga resiko mortalitas kecil, dan induk ikan mas dapat digunakan sebagai perangsang untuk beberapa kali pemijahan (Zairin et al. 2005). Sistem imbas dikembangkan oleh Balai Benih Ikan Sentral (BBIS) Cangkringan, Sleman, Daerah Istimewa Yogyakarta pada awal tahun 1970-an. Metode ini dilakukan dengan menggunakan ikan mas yang dipijahkan dalam wadah yang sama dengan induk ikan tawes yang relatif sulit dipijahkan walaupun telah matang gonad. Hasilnya ketika ikan mas memijah, ikan tawes juga ikut memijah. Imbas diduga disebabkan oleh adanya semacam feromon yang dilepas oleh ikan mas (Zairin 2003).
2
Tujuan Penelitian
Penelitian ini bertujuan untuk mengevaluasi peran ikan mas jantan dalam merangsang pemijahan ikan tawes dengan metode Cangkringan.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat menjadi landasan bagi penelitian feromon sebagai perangsang pemijahan ikan di Indonesia mendatang, sehingga menjadi solusi alternatif bagi pemijahan secara alami.
2 TINJAUAN PUSTAKA
Ikan Mas (Cyprinus carpio L.)
Menurut Saanin (1984) ikan mas (Gambar 1) dapat diklasifikasikan ke dalam kingdom Animalia, filum Chordata, subfilum Pisces, kelas Osteichtyes, subkelas Teleostei, ordo Ostariophysi, subordo Cyprinoidea, family Cyprinidae, genus Cyprinus, dan spesies Cyprinus carpio L. Menurut Hardjamulia (1979) ikan mas memiliki ciri-ciri badan memanjang, sedikit pipih ke samping (compressed) mulut dapat disembulkan dan terdapat diujung tengah (terminal), sungut dua pasang. Selanjutnya Sumantadinata (1981) menjelaskan bahwa ikan mas memiliki kepala yang relatif kecil dibandingkan dengan badan dan bentuknya agak meruncing, badan tebal, punggung tinggi, sisik teratur rapih dan batang ekor lebar dengan sirip terbuka.
Gambar 1 Ikan mas (Cyprinus carpio L.)
3
berikutnya adalah sekitar satu sampai dua bulan. Menurut Cholik et al. (2005) di Indonesia pemijahan ikan mas berlangsung sepanjang tahun. Rangsangan pemijahan pada ikan mas dapat berupa rangsangan lingkungan dan rangsangan suntikan hormon. Dalam persiapan pemijahan, perbandingan induk jantan dan
betina adalah 1:1 (kg/m2
Ikan Tawes(Barbonymus gonionotus B.)
) tetapi jumlah jantan lebih banyak. Artinya untuk satu ekor induk betina berbobot 2 kg/ekor maka jumlah induk jantan adalah 3 ekor masing-masing dengan bobot 600-700 g/ekor (Mantau et al. 2004).
Ikan tawes (Gambar 2) termasuk kedalam kelas
Ikan tawes betina sudah dapat mulai dipijahkan setelah berumur satu tahun
sedangkan induk ikan jantan pada umur 6-8 bulan (Cholik et al. 2005).
Ardiwinata (1981) menyatakan induk ikan tawes yang sudah matang gonad biasanya berukuran antara 300-600 gram, sedangkan ukuran induk jantan yaitu 200-400 gram. Menurut Sumantadinata (1981) induk ikan tawes betina dapat dipijahkan sekali dalam tiga sampai empat bulan, sedangkan ikan tawes jantan dapat dipijahkan sekali dalam satu sampai dua bulan.
Cypriniformes, subordo Cyprinoidea, family Cyprinidae, genus Barbonymus dan spesies Barbonymus gonionotus B. (Kottelat 1999). Menurut Cholik et al. (2005) ikan tawes memiliki ciri-ciri bentuk tubuh memanjang dan pipih, punggungnya melengkung. Ujung mulutnya meruncing dan dilengkapi dengan dua pasang sungut, sirip punggung dan sirip ekor berwarna abu-abu sampai abu-abu kekuning-kuningan. Sirip perut dan sirip anus agak berwarna oranye dengan ujungnya berwarna merah, sirip dada agak pucat sampai agak kekuningan.
Gambar 2 Ikan tawes (Barbonymus gonionotus B.)
4
(1983) pemijahan ikan tawes dengan cara imbas hasilnya lebih baik dibandingkan dengan cara tradisional maupun hipofisasi.
Vitelogenesis dan Proses Pematangan Oosit Tingkat Akhir
Proses perkembangan gonad dan ovulasi pada ikan diatur oleh sistem
hormon (Randall 1995). Hormon estrogen, terutama estradiol 17β mempengaruhi
sintesis vitelogenin di hati (Nagahama et al. 1983; Randall 1995) dan hormon gonadotropin berfungsi mempercepat proses kematangan akhir oosit dalam persiapan ovulasi ataupun spermiasi (Lieberman 1995).
Perkembangan telur mencapai ovulasi (akhir pematangan) diatur oleh hormon gonadotropin, yang dibentuk dan disimpan dalam kelenjar pituitari atau hipofisa, seperti FSH (Follicle Stimulating Hormone) dan LH (Luteinizing Hormone) kontinyu diproduksi dan dikeluarkan ke dalam aliran darah. Organ
target gonadotropin dan steroid adalah gonad (Degani dan Boker 1992 dalam
I’tishom 2008). Gonadotropin yang sudah dilepaskan akan mencapai gonad dan merangsang proses praovulasi dan akhir ovulasi (Woynarovich dan Horvath 1980). Gonadotropin ada dua jenis yaitu FSH merangsang produksi testosteron
pada lapisan teka yang diaromatase oleh sel granulosa menjadi estradiol-17β
(Yaron 1995) untuk proses vitelogenesis. Gonadotropin lainnya merangsang
sintesis 17α, 20β-DHP oleh 20β-dihidroksisteroid dehidrogenase (20β-HSDH) di
dalam sel-sel granulosa (Yaron 1995). Steroid ini menyebabkan kematangan oosit akhir (Yaron 1995; Kobayashi et al. 1996).
Sistem Cangkringan
Menurut Soedarman (1983), di Balai Benih Ikan Sentral (BBIS) Cangkringan, Daerah Istimewa Yogyakarta (DIY), tetua ikan tawes tidak mau memijah di dalam hapa bila tidak disuntik terlebih dahulu dengan ekstrak hipofisa, meskipun kolam pemijahan telah dipersiapkan sesuai dengan keperluan cara pemijahan tradisional. Secara kebetulan dicobalah memijahkan ikan tawes bersama ikan mas dalam satu kolam pemijahan. Kemudian ditemukan bahwa ikan tawes dapat memijah mengikuti pemijahan ikan mas.
Soedarman (1983) menamakan cara induksi ini sebagai sistem Cangkringan, karena cara ini mulai dicoba dan ditemukan di BBIS Cangkringan DIY. Sejak itu di BBIS Cangkringan, pemijahan ikan tawes dilakukan dengan cara induksi. Dalam pelaksanaanya, pemijahan ikan mas yang juga berfungsi sebagai perangsang pemijahan ikan tawes dapat dilakukan di dalam atau di luar hapa. Dengan demikian pemijahan ikan tawes dengan sistem induksi dianggap lebih murah dan lebih efektif dibandingkan cara hipofisasi.
5
Pemijahan ikan tawes secara imbas dianggap lebih murah dari teknik hipofisasi karena ikan mas perangsang bisa dipakai lebih dari sekali (Zairin et al. 2005).
Feromon
Kittredge et al. (1971) telah memperkirakan 20 tahun sebelumnya bahwa
organisme perairan umumnya menggunakan senyawa hormonal sebagai feromon. Feromon telah didefenisikan sebagai zat yang diekskresikan ke luar oleh suatu individu (pengirim) dan diterima oleh individu kedua dari spesies yang sama, dimana keduanya menyebabkan reaksi tertentu, misalnya perilaku tertentu atau proses perkembangan (Karlson dan Luscher 1959 dalam Sorensen dan Stacey 2004). Perilaku pemijahan
Semua tahap kehidupan ikan mas menggunakan bau feromon multikomponen yang kompleks untuk mengidentifikasi kondisi seksual dalam
perilaku aktif ikan dari banyak spesies (Levesque et al. 2011). Feromon tidak
terbatas pada jenis kelamin tertentu dan spesies yang berbeda dapat memproduksi dan melepaskan feromon yang sama, namun respon induksinya bervariasi
(Burnard et al. 2008).Feromon pada ikan dilepaskan bersamaan dengan urin
(
ikan diindikasikan dipengaruhi oleh feromon. Berdasarkan fungsinya, feromon dapat dikategorikan menjadi tiga yaitu isyarat anti-predator, isyarat sosial, dan isyarat reproduksi. Masing-masing kategori terdiri dari feromon yang dapat menimbulkan respons primer yaitu efek fisiologis
atau perubahan endokrinologis yang terjadi lebih lambat dan atau releaser
responses yaitu perubahan perilaku yang kuat (Sorensen dan Stacey 2004, Appelt dan Sorensen 2007).
Yambe et al. 2006).
Ikan mas koki betina (Carrasius auratus) yang berovulasi melepaskan
hormon seks steroid 17α,20β-dihydroxy-4-pregnen-3-one (17α,20β-P) berfungsi
sebagai feromon seks praovulasi (Dulka et al. 1987). Saat ovulasi, ikan betina dari berbagai spesies merilis F-Prostaglandin yang menarik ikan jantan sejenis. Pada
ikan mas, feromon ini diidentifikasi sebagai PGF2α dan metabolit tubuh lain yang
tidak teridentifikasi, disebut feromon kompleks (Lim dan Sorensen 2012). Zheng et al. (1997) mengemukakan bahwa respon terhadap feromon 17α,20β-P merupakan penentu utama kesuksesan reproduksi ikan mas koki jantan. Hasil
penelitiannya menunjukkan bahwa pengaruh feromon 17α,20β-P menyebabkan
peningkatan aktivitas pemijahan, volume dan cairan sperma, durasi motilitas sperma dan proporsi sperma motil. Berbagai macam bahan kimia telah diupayakan agar memiliki fungsi yang sama seperti feromon. Namun hanya steroid gonad, prostaglandin, dan asam empedu yang diketahui dapat dideteksi organ penciuman dan menimbulkan respons biologis (Sorensen dan Stacey 2004).
Selain merangsang, feromon yang dilepaskan akan membantu penyeragaman aktivitas seksual yang maksimum, peningkatan kemungkinan pembuahan dan waktu kematangan telur (Zairin et al. 2005).
3. BAHAN DAN METODE
6
Cijeruk. Analisis hormon testosteron dan estradiol dilakukan di Laboratorium Hormon Unit Rehabilitasi dan Reproduksi, Departemen Klinik Reproduksi dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Materi Uji dan Rancangan Penelitian
Induk yang digunakan adalah induk ikan mas betina dengan bobot + 1,5 kg/ekor dan jantan + 0,5 kg/ekor, sedangkan induk ikan tawes dengan bobot
Rancangan percobaan yang digunakan adalah rancangan satu faktor dalam RAL dengan 5 perlakuan dan 3 kali ulangan (Tabel 1 dan Lampiran 1).
sekitar 0,5 kg/ekor.
Tabel 1 Desain perlakuan pemijahan ikan mas dalam merangsang pemijahan ikan tawes dalam metode Cangkringan
Metode Penelitian
Persiapan Induk
Induk ikan mas bersal dari Instalasi Penelitian Plasma Nutfah Perikanan Air Tawar Cijeruk Bogor sedangkan induk ikan tawes berasal dari petani ikan di Desa Petir Kecamatan Darmaga Bogor. Induk telah siap digunakan sebagai organisme uji ketika telah matang gonad. Induk ikan mas betina yang dapat dipijahkan berumur 1,5-3 tahun sedangkan induk jantan berumur 6 bulan ke atas. Menurut Zairin et al. (2005) kematangan gonad pada ikan mas betina ditandai dengan perut yang membesar, gerakan lamban, lubang genital agak terbuka dan memerah. Pada ikan tawes betina, kematangan gonad ditandai dengan perut yang membuncit pula ke arah anus dan bila diraba terasa lunak. Tanda lain adalah terlihatnya pembuluh darah pada sirip dada, sirip perut dan sirip ekor lebih jelas dari biasanya dan berwarna kemerah-merahan. Kematangan induk jantan ditunjukkan oleh keluarnya cairan putih dengan mudah jika perutnya diurut dari bagian perut ke arah anus.
Persiapan Wadah
Wadah yang digunakan berupa bak fiber berbentuk bulat dengan volume 2,25 ton sebanyak 15 unit yang masing-masing di dalamnya ditempatkan hapa sebagai pemisah antara ikan mas dan ikan tawes (Gambar 3). Kakaban ditempatkan di permukaan air sebagai tempat penempelan telur ikan mas. Setelah pemasangan hapa selesai, air dialirkan ke wadah pemijahan hingga tinggi air dalam hapa kira-kira 75 cm dan diaerasi. Air yang digunakan adalah air yang telah
diendapkan di dalam tandon. Temperatur air berkisar antara 25-27 o
Perlakuan
C. Pengamatan tingkah laku ikan sebelum, selama dan setelah pemijahan, dilakukan
7
dengan cara pada setiap wadah ditempatkan kamera perekam dengan jarak 50 cm dari atas permukaan air.
Gambar 3
Pemberokan Induk
Wadah perlakuan yang digunakan selama penelitian; hapa sebagai pemisah antara ikan mas dan ikan tawes (panah)
Induk ikan mas dan ikan tawes yang telah terpilih untuk dipijahkan, diberok atau dipuasakan pada air yang mengalir secara terpisah antara jantan dan betina.
Pengambilan Contoh Telur
Fungsi pemberokan adalah menghilangkan stres pada saat ditangkap. Selain itu pemberokan bertujuan untuk membuang kotoran, mengurangi kandungan lemak dalam gonad dan menghindari perkawinan liar. Pemberokan ikan mas dilakukan selama 2 hari dan ikan tawes selama 5 hari.
8
Gambar 4 Pengambilan contoh telur
Pengambilan Sampel Darah
Pengambilan sampel darah dilakukan hanya pada induk ikan mas untuk analisis hormon testosteron dan estradiol. Sampel darah diambil sebelum penyuntikan pertama dan sesudah induk ikan mas memijah. Ikan mas dianestesi menggunakan 2-fenoxyethanol (0,3 mL/L air media). Kemudian ikan ditandai, selanjutnya sampel darah diambil dari bagian vena caudal (ekor) sebanyak 1,5 mL
menggunakan syringe 3 mL yang telah dibilas dengan anti koagulan (Natrium
citrat hydrate 3,8%) (Gambar 5). Setelah itu darah disentrifugasi selama 15 menit
pada suhu 4 oC dengan kecepatan 3000 rpm. Plasma yang diperoleh diambil
menggunakan pipet mikro dan dipindahkan ke dalam tabung polietilen1,5 mL.
Plasma disimpan dalam freezer pada suhu -20 oC hingga dilakukan pengukuran
kadar hormon. Setelah pengambilan darah, ikan uji kemudian dimasukkan ke dalam bak fiber untuk pemulihan selama 2 jam sebelum penyuntikan dilakukan.
Gambar 5 Pengambilan sample darah
Penyuntikan Induk
9
ml/kg bobot tubuh untuk merangsang ovulasi (Gambar 6). Penyuntikan dilakukan sebanyak dua kali untuk ikan mas betina (dosis 30:70) dengan interval penyuntikan masing-masing 6 jam. Sedangkan penyuntikan pada ikan mas jantan dilakukan satu kali bersamaan dengan penyuntikan kedua pada ikan betina. Pada perlakuan A dan E tidak dilakukan penyuntikan.
Gambar 6 Penyuntikan induk
Pemijahan dengan Sistem Imbas
Sesaat setelah penyuntikan, induk-induk ikan kemudian dimasukkan kedalam wadah penelitian. Padat penebaran pada masing-masing bak adalah 3 ekor ikan mas (jenis kelamin sesuai perlakuan) dan 2 ekor ikan tawes (1 jantan + 1 betina), di dalam wadah pemijahan antara ikan tawes dan ikan mas disekat dengan hapa. Setiap selang waktu 3 jam dilakukan pengecekan telur terhadap induk-induk betina yang mengalami ovulasi. Lama masa tunggu dalam pencatatan waktu ovulasi ikan yaitu selama 36 jam setelah penyuntikan ke dua. Setelah 36 jam pengecekan ovulasi telur dilakukan dengan cara mengambil ikan menggunakan serokan ikan kemudian diurut (stripping) menggunakan jari jempol secara perlahan.
Parameter Penelitian
Tingkat Kematangan Gonad
Tingkat kematangan gonad pada induk ikan mas dan ikan tawes dapat dilihat dari diameter dan posisi inti telurnya. Telur yang telah matang memiliki ukuran diameter maksimum dan inti telur yang tampak jelas, lebih kecil dan berada di tengah (fase dorman) atau sudah mulai bergerak ke tepi (germinal vesicle migration, GVM) (Rotdmann et al. 1991; Yueh dan Chang 2000).
Tingkah Laku Pemijahan Ikan
10
Diameter Telur
Penghitungan pengukuran diameter telur menggunakan rumus:
A = B/C x 0,01 mm
Keterangan: A = Ukuran sebenarnya dalam mm
B = Nilai yang didapat dari pengamatan mikrometer
C = Perbesaran lensa objektif dibagi 100
Waktu Ovulasi Ikan Mas (WOM)
Setelah penyuntikan kedua, dilakukan pencatatan terhadap lama waktu masing-masing ikan uji tersebut mencapai ovulasi. Setiap selang waktu 3 jam dilakukan pengecekan telur terhadap induk-induk betina yang mengalami ovulasi. Lama masa tunggu dalam pencatatan waktu ovulasi ikan yaitu selama 36 jam setelah penyuntikan ke dua.
Beda Waktu Mijah Antara Ikan Mas dan Ikan Tawes (WOT)
Waktu memijah spesies ikan yang berbeda adalah tidak sama. Untuk itu perlu adanya pencatatan beda waktu mijah antara ikan mas dan ikan tawes agar didapatkan berapa selisih waktu yang dibutuhkan masing-masing ikan tersebut untuk memijah sehingga dapat diketahui ikan yang lebih dulu terangsang untuk memijah apakah ikan mas atau ikan tawes.
Derajat Pemijahan (DP) pada Ikan Tawes
Derajat pemijahan ditentukan dari jumlah induk yang berovulasi dibagi dengan jumlah induk yang dipijahkan dan dinyatakan dalam persen. Derajat ovulasi dapat dihitung dengan menggunakan rumus sebagai berikut:
Jumlah induk yang berovulasi
Derajat pemijahan = x 100 %
Jumlah induk yang dipijahkan
Jumlah Telur yang Diovulasikan (TO) pada Ikan Tawes
Jumlah telur yang diovulasikan dapat dihitung dengan menggunakan rumus:
TO = (Bg/Bs) x N
Keterangan: TO = jumlah telur yang diovulasikan, Bg = bobot gonad (g),
Bs = bobot sub sampel gonad (g),
N = jumlah telur dalam sub sampel gonad (butir).
Derajat Pembuahan (FR) pada Ikan Tawes
Setelah pembuahan terjadi dilakukan penghitungan derajat pembuahan. Pengamatan derajat pembuahan ini dilakukan terhadap telur yang sudah diinkubasi. Telur yang tampak jernih yolk-nya dan mulai berkembang dianggap sebagai telur yang terbuahi. Sementara telur yang tampak yolk-nya putih buram dan mulai pecah dianggap tidak terbuahi. Derajat pembuahan dapat dihitung dengan menggunakan rumus sebagai berikut:
Jumlah telur yang dibuahi
Derajat pembuahan = x 100 %
11
Daya Tetas Telur (HR) pada Ikan Tawes
Derajat penetasan ditentukan dari jumlah telur yang menetas dibagi dengan total telur yang dibuahi dan dinyatakan dalam persen. Derajat penetasan dapat dihitung dengan menggunakan rumus sebagai berikut:
Jumlah telur yang menetas
Derajat penetasan = x 100 %
Jumlah Telur yang dibuahi
Konsentrasi Hormon Testosterone dan Estradiol pada Ikan Mas
Analisis sampel darah dilakukan dengan menggunakan metode ELISA (Enzyme-linked Immunosorbent Assay)
Parameter Kualitas Air
, untuk melihat kandungan hormon testosteron dan estradiol yang terdapat dalam darah ikan sebelum dan sesudah ikan memijah.
Pada penelitian ini akan dilakukan pengamatan terhadap beberapa parameter kualitas air sebagai data penunjang seperti kualitas air seperti suhu, DO, dan pH.
Analisis Data
Semua data yang didapatkan dalam penelitian ini dianalisis secara deskriptif. Data disajikan dalam bentuk gambar dan tabel.
4.
HASIL DAN PEMBAHASAN
Tingkat Kematangan Gonad
Dilihat secara visual berdasarkan hasil pengamatan diameter dan posisi inti (germinal vesicle) telur pada penelitian ini menunjukkan bahwa induk-induk ikan yang digunakan baik ikan mas maupun ikan tawes telah matang gonad. Kematangan telur tersebut juga dapat dilihat dari penampilan telur yang bulat seragam dan tidak menempel satu sama lain.
Diameter Telur
12
Tabel 2 Ukuran diameter telur ikan mas (mm)
Induk ke Perlakuan
A B C
1 1,3 ± 0,07 1,3 ± 0,09 1,4 ± 0,08
2 1,3 ± 0,09 1,1 ± 0,18 1,3 ± 0,16
3 1,3 ± 0,08 1,4 ± 0,11 1,4 ± 0,08
Tabel 3 Ukuran diameter telur ikan tawes (mm)
Induk
Bobot gonad ikan akan mencapai maksimum sesaat ikan akan memijah kemudian akan menurun dengan cepat selama proses pemijahan berlangsung sampai selesai. Semakin tinggi tingkat kematangan gonad, diameter telur yang ada dalam gonad akan menjadi semakin besar. Pendapat ini diperkuat oleh Kuo et al. (1974) bahwa kematangan seksual pada ikan dicirikan oleh perkembangan diameter rata-rata telur dan melalui distribusi penyebaran ukuran telurnya. Menurut Effendie (2002) ukuran diameter telur ikan dipengaruhi oleh umur, lingkungan, genetik, nutrisi dan siklus reproduksi.
Posisi Inti Telur
Kucharczyk et al. (2008) menuliskan posisi inti oosit (penandan
pematangan oosit) dapat ditentukan dengan menggunakan skala empat tahap yaitu: Tahap (1) posisi inti di tengah, tahap (2) migrasi awal inti, kurang dari setengah dari jari, tahap (3) migrasi akhir inti, lebih dari setengah dari jari-jari, tahap (4) peleburan inti (GVBD). GVBD umumnya digunakan sebagai indikator kematangan oosit dan pada beberapa spesies terjadi karena berkumpulnya butiran kuning telur atau lempengan lipida yang diikuti inti yang mengakibatkan oosit menjadi lebih transparan. Apabila kondisi GVBD telah mencapai 100 persen, maka tidak lama lagi akan terjadi ovulasi (de Vlaming 1983).
13
Gambar 7 Telur ikan mas dan ikan tawes. Panah hitam putus-putus telur dorman (GV). Panah hitam inti telur mulai bergerak ke tepi (GVM)
Berdasarkan hasil pengamatan diameter dan posisi inti telur pada penelitian ini meskipun ukuran diameter telur beragam, tetapi jika dilihat dari kematangan secara fisiologis yaitu dari posisi inti telur semua induk ikan mas dan ikan tawes yang digunakan pada setiap perlakuan sudah berada pada kondisi siap mijah (Lampiran 2, Lampiran 3, dan Lampiran 4).
Tingkah Laku Pemijahan
Tingkah laku pra-pemijahan induk-induk ikan mas hampir sama pada semua perlakuan sesaat setelah ikan dimasukkan ke dalam wadah pemijahan. Induk ikan jantan maupun betina berenang mengelilingi bak dengan arah yang berlawanan satu sama lainnya. Ketika ikan mas berpapasan dengan ikan mas lainnya maka masing-masing ikan akan berbalik arah. Begitu juga pada perlakuan ikan tawes
dengan komposisi jantan betina (♂♀) pada saat pra-pemijahan masing-masing
ikan berenang mengelilingi bak dengan arah yang berlawanan satu sama lainnya. Lim & Sorensen (2010) menyatakan bahwa ikan betina hanya akan menunjukkan perilaku memijah ketika telur berovulasi.
Pada saat pemijahan ikan dengan komposisi ikan jantan dan betina (♂♂♀),
A, B, dan C, kedua ekor ikan mas jantan selalu berusaha mendekati mas betina dengan berenang mengiringi mas betina dari satu tempat ke tempat lain, tetapi betina tetap pasif bergerak menghindari kedua jantan yang mendekat. Namun ikan mas jantan yang aktif terus mengejar betina dan umumnya berenang di bawah tubuhnya. Seringkali ikan mas jantan yang aktif menghambat jalur betina sehingga betina tidak dapat menghindari jantan. Ikan mas jantan akan menempelkan badannya ke badan ikan mas betina dan terus mengejar ikan mas betina. Aktivitas ini terjadi di bawah kakaban. Menurut Polling et al. (2001) ikan mas jantan bersaing secara aktif untuk mendekati betina.
Kadang-kadang ikan mas akan menyembulkan kepalanya ke permukaan air, hapa ikan mas akan terdengar riuh dengan kecipak air yang disebabkan gerakan induk betina yang dikejar-kejar induk jantan. Selama pemijahan ikan jantan dan betina menyamakan tingkah lakunya untuk mencapai pelepasan gamet yang
1,5 mm
14
serempak (Liley dan Stacey 1983). Kondisi seperti ini biasanya menunjukkan telah terjadi pemijahan pada ikan mas. Kakaban yang dipasang pada hapa ikan akan mulai dipenuhi dengan telur berwarna kuning dan sebagian telur tersebut juga tampak menempel pada hapa dan dinding bak pemijahan. Air pada saat pemijahan ini telihat seperti berminyak, berbusa serta berbau amis (Gambar 8).
Sebaliknya pada perlakuan dengan komposisi ikan mas jantan semua (♂♂♂), ikan
mas jantan berusaha berenang beriringan dengan ikan jantan lainnya dari satu tempat ke tempat lain.
Gambar 8 Kakaban dipenuhi telur ikan mas
Pada ikan tawes, induk akan mulai aktif ketika ikan mas sudah aktif bergerak. Setelah ikan mas memijah maka ikan tawes semakin agresif. Ikan tawes jantan akan menempelkan badannya ke badan ikan tawes betina lalu bergerak memutar dan terus berusaha mengiringi gerak betina dari satu tempat ke tempat lainnya. Tingkah laku seperti ini biasanya menunjukkan sedang terjadi pemijahan
pada ikan tawes. Telur-telur tawes agak susah dikenali dengan segera karena
warnanya yang bening dan sifatnya yang melayang di kolom air.
15
Pasca pemijahan, tingkah laku ikan baik mas maupun tawes sama seperti sebelum terjadinya pemijahan. Ikan-ikan tersebut berenang dengan tenang, walaupun terjadi proses kejar mengejar antara ikan jantan dan betina, namun tidak seaktif saat pemijahan sedang berlangsung. Pada periode pascamemijah, ikan mas baik jantan maupun betina terlihat memakan telur yang menempel pada hapa
pembatas (Gambar 9). Menurut Haniffa et al. (2007) ikan mas bukanlah induk
yang baik, jika tidak segera dipisahkan dengan telurnya maka mereka akan mulai memakan telur-telurnya. Oleh karena itu, ketika kakaban terlihat sudah dipenuhi telur, perlu dipindahkan ke bak penetasan dan diganti dengan kakaban yang baru. Sedangkan pada perlakuan D dengan komposisi ikan mas jantan semua (
Efek Imbas Pemijahan Ikan Mas Terhadap Ikan Tawes
♂♂♂),
ikan mas berenang dengan tenang namun tidak seaktif pada fase pemijahan.
Hasil penelitian ini menunjukkan bahwa yang bertindak sebagai pengimbas pada pemijahan ikan tawes dengan metode Cangkringan ini adalah ikan mas karena ikan tawes hanya akan memijah jika ada ikan mas yang memijah. Pada penelitian ini ikan tawes tidak memijah mendahului ikan mas. Selama penelitian berlangsung belum pernah terdapat perlakuan dengan ikan tawes yang memijah
lebih dulu. Ikan mas dengan kombinasi jantan dan betina (♂♂♀) ataupun jantan
saja (♂♂♂) dapat mengimbas ikan tawes untuk segera memijah.
Lamanya waktu stimulasi yang diperlukan hingga ikan tawes memijah bervariasi dalam tiap perlakuan (Tabel 4). Waktu ovulasi ikan mas berkisar antara 49 menit – 8 jam 46 menit . Jarak antara ikan mas dan ikan tawes memijah yang didapat dari hasil penelitian ini yaitu 3 jam 15 menit sampai dengan yang paling lama 29 jam 38 menit. Perlakuan yang dibantu dengan induksi ovaprim lebih cepat memijah (Lampiran 5). Hal ini sesuai dengan pernyataan Harker (1992) bahwa ovaprim akan bekerja untuk meningkatkan kadar gonadotropin di dalam darah dan selanjutnya menuju gonad sehingga proses ovulasi berjalan cepat. Meningkatnya gonadotropin ini akan merangsang proses praovulasi dan ovulasi ikan mas. Menurut Redding dan Pattino (1993) aktivitas biologis ovaprim menyerupai GnRH yang dihasilkan oleh hipotalamus. Akibat aksi hormon gonadotropin, inti yang mulanya berada di tengah kemudian bergerak ke tepi mendekati mikrofil dan sesaat sebelum ovulasi terjadi, inti melebur (GVBD) tetapi materi genetiknya tidak berubah. GVBD biasanya terjadi karena adanya rangsangan steroid (Nagahama et al. 1983).
Hasil pengamatan jumlah induk ikan tawes yang memijah karena pengaruh imbas dari ikan mas menunjukkan bahwa hasil tertinggi diperoleh pada perlakuan B (K+) dan D yaitu sebesar 66,7%, kemudian diikuti oleh perlakuan A (K-) dan C memberikan hasil yang sama yaitu 3,33% dan perlakuan E sebesar 0% (Tabel 4).
Perlakuan B memberikan hasil tertinggi, diduga karena penyuntikan
ovaprim meningkatkan konsentrasi Luteinizing Hormon Releasing Hormon
(LHRH) pada hipotalamus sehingga memicu sekresi GTH II (LH). Akibat kerja
LH, lapisan teka akan mensintesis hormon 17α-hidroksiprogesteron yang
kemudian di lapisan granulosa akan diubah oleh enzim 20β-hidroxysteroid
dehidrogenase (20β-HSD) menjadi 17,20β-P yang beraksi sebagai maturation
16
ovulasi pada betina. Pada jantan steroid ini juga menginisiasi pembelahan meiosis spermatogonium dan mengendalikan pematangan spermatozoa serta spermiasi
Steroid 17α,20β-P dalam bentuk bebas dan konjugatnya berfungsi sebagai
feromon (Yaron dan Levavi-Sivan 2011).
Tabel 4 Status pemijahan ikan, respons ikan tawes, waktu mencapai ovulasi pada ikan mas (WOM), waktu mencapai ovulasi pada ikan tawes (WOT) dan derajat pemijahan (DP) ikan tawes
Perlakuan Ulangan Alami Striping Alami Striping
A
td Perlakuan tanpa penyuntikan, waktu pencapaian ovulasi tidak terdeteksi
Feromon pada ikan dilepaskan bersamaan dengan urin (Yambe et al. 2006). Selama proses pra pemijahan ikan jantan akan mengeluarkan urin dalam jumlah yang tinggi secara signifikan lebih tinggi dengan adanya pra-ovulasi betina (Almeida et al. 2005). Feromon yang dilepaskan ke air merupakan stimulasi dari ikan mas yang memicu terjadinya pemijahan pada ikan tawes. Isyarat-isyarat feromon ini pada ikan dapat masuk melalui organ penciuman (olfactory bulb), kemudian diteruskan ke sistem syaraf pusat selanjutnya mengaktifkan sumbu hipothalamus-pituitari-gonad (Zielinski dan Hara 2007). Menurut Effendie (2002) kehadiran induk ikan jantan bersama-sama induk ikan betina dapat menyebabkan induk ikan betina mengeluarkan cairan kelenjar neurohiphofisa. Ji
Pada perlakuan C (♂♂♀) dengan penyuntikan hanya pada ikan jantan,
terdapat sepasang ikan tawes yang memijah, yaitu pada ulangan ke-3. Pada ulangan pertama dan kedua tidak terjadi pemijahan pada ikan tawes. Hal ini
17
diduga karena feromon dari ikan mas jantan tidak cukup kuat untuk mengimbas ikan tawes, karena ikan mas betina diduga lambat mencapai ovulasi. Begitu juga
pada perlakuan A (♂♂♀) tanpa penyuntikan pada ikan mas jantan dan terdapat
sepasang ikan tawes yang memijah yaitu pada ulangan kedua, sedangakan ulangan pertama dan ketiga tidak terjadi pemijahan pada ikan tawes. Hal ini diduga karena keterlambatan ikan mas betina mencapai ovulasi dan keterlambatan spermiasi pada ikan jantan.
Bentuk stimulasi pada penelitian ini selain berupa pemijahan ikan mas dapat juga berupa spermiasi pada ikan mas jantan. Hal ini ditunjukkan oleh perlakuan D
dengan kombinasi ikan mas jantan saja (♂♂♂ disuntik) mengimbas sepasang ikan
tawes. Hasilnya ikan tawes mengalami ovulasi dan memijah secara alami. Hal ini diduga akibat adanya ikan mas jantan dalam bak pemijahan yang mengeluarkan
feromon dan direspons oleh olfactory bulb induk betina dan diteruskan ke sistem
syaraf pusat sehingga menyebabkan terjadinya perkembangan gonad. Hal ini selaras dengan pernyataan Zeilinski dan Hara (2006) bahwa isyarat-isyarat feromon pada ikan dapat masuk melalui organ penciuman (olfactory bulb), kemudian diteruskan ke sistem syaraf pusat selanjutnya mengaktifkan sumbu hypothalamus-hypophysis-gonad. Derajat pemijahan pada perlakuan B dan D
sama (66,7%), artinya ikan mas dengan komposisi jantan betina (♂♂♀) maupun
mas jantan saja (♂♂♂) dapat mengimbas pasangan ikan tawes untuk segera
memijah.
Pada perlakuan
Fekunditas, Derajat Pembuahan (FR) dan Derajat Penetasan Telur (HR)
E (♂♂♂) tanpa penyuntikan, ikan mas pada semua ulangan
tidak satu pun memijah. Diduga karena tidak dilakukan penyuntikan pada mas jantan maka proses spermiasi pada ikan jantan sangat lambat. Li et al. (2002); Yun et al. (2002) menyatakan bahwa hanya jantan yang mengalami spermiasi yang dapat melepas feromon. Jika tidak terjadi spermiasi pada ikan jantan maka ikan tawes betina tidak terangsang untuk berovulasi. Hal ini sesuai dengan penelitian yang telah dilakukan Siefkes et al. (2003) pada ikan lamprey (Petromyzon marinus L.) dimana penelitian tersebut menunjukkan bahwa spermiasi pada jantan mempengaruhi peningkatan perilaku pencarian dan preferensi pada ikan betina untuk berovulasi.
Induk ikan tawes yang dipijahkan mempunyai bobot tubuh antara 0,15-0,78 kg/ekor (Lampiran 6). Dari data perbandingan antara bobot tubuh dan jumlah telur menunjukkan bahwa ikan tawes yang memijah karena imbas pemijahan ikan mas yang disuntik (B, C, dan D) memiliki fekunditas yang lebih tinggi dibandingkan dengan mas yang tidak disuntik (A dan E) (Tabel 5). Fekunditas tertinggi diperoleh pada perlakuan B dan C masing-masing
Derajat pembuahan pada ikan sangat ditentukan oleh kualitas telur, spermatozoa, media dan penanganan manusia (Woynarovich dan Horvath 1980).
18
Rata-rata persentase derajat pembuahan selama penelitian yaitu sebesar 72,7%, 81,7% dan 82%. Hal ini menunjukkan kualitas dan jumlah sperma cukup baik untuk membuahi telur. Banyaknya jumlah sperma yang dikeluarkan dari seekor ikan jantan bergantung pula kepada umur, ukuran dan frekuensi ejakulasi. Tingkat pembuahan juga dipengaruhi kondisi kematangan telur yang berkaitan dengan proses vitelogenesis sebelum telur diovulasikan. Agar telur dapat berkembang
sempurna, seluruh tahapan proses ini harus berurutan dan teratur (Zairin et al.
2005). Perlakuan A dimana ikan tawes memijah secara striping tidak terdapat telur yang terbuahi hal ini diduga dipengaruhi oleh faktor kesalahan manusia pada saat penanganan telur.
Tabel 5 Bobot tubuh, fekunditas, derajat pembuahan (FR) dan derajat penetasan telur (HR) pada ikan tawes yang memijah.
Perlakuan Bobot Tubuh Ikan
Betina
*dihitung dari jumlah telur yang terbuahi
Penetasan yang terbaik pada perlakuan B sebesar 97,2% dan terendah pada perlakuan A sebesar 0% karena tidak ada telur yang menetas (Tabel 5). Penetasan dipengaruhi oleh faktor internal berupa kerja hormon dan volume kuning telur serta faktor eksternal berupa suhu, oksigen terlarut dan intensitas cahaya (Affandi dan Tang 2002). Peningkatan suhu, peningkatan intensitas cahaya dan atau penurunan tekanan oksigen diduga dapat meningkatkan jumlah penetasan (Sumantadinata 1981). Faktor yang diduga menyebabkan rendahnya derajat penetasan adalah telur tidak berkembang setelah dibuahi, perubahan kemampuan fisiologis telur saat embriogenesis (Zairin et al. 2005) atau dapat pula disebabkan karena kerusakan telur sampel saat penanganan telur.
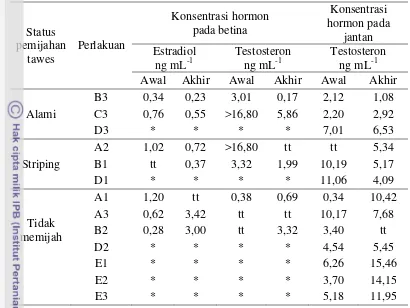
Profil Hormon Testosteron dan Estradiol Ikan Mas
Hasil analisis hormon testosteron dan estradiol menunjukkan bahwa konsentrasi testosteron pada ikan mas jantan dan estradiol pada ikan mas betina pada akhir pemijahan sangat menentukan status pemijahan ikan tawes. (Tabel 6
dan Lampiran 7). Konsentrasi testosteron 1,08-6,53 ng mL-1 dapat memberikan
pengaruh pemijahan baik secara striping maupun secara alami pada ikan tawes (perlakuan B3, C3, D3, A2, B1, dan D1). Testosteron maupun steroid C19 lainnya diketahui dapat menginduksi GVBD pada konsentrasi yang tinggi. Konsentrasi
testosteron yang terlalu rendah (kurang dari 1 ng mL-1: perlakuan A1 pada ikan
mas betina) atau terlalu tinggi (10,42-15,46 ng mL-1 pada ikan mas jantan:
19
Tabel 6 Konsentrasi hormon testosteron dan estradiol ikan mas
Status
* Estradiol tidak dianalisis pada ikan jantan, tt: tidak terdeteksi
Konsentrasi hormon estradiol cenderung meningkat dari pemijahan alami ke ikan yang tidak memijah. Pada pemijahan alami dan striping, konsentrasi estradiol
berada di bawah 1 ng mL-1 (perlakuan B3, C3, A2, dan B1); sedangkan pada ikan
yang tidak memijah didapatkan ikan mas dengan konsentrasi estradiol yang tinggi
hingga di atas 1ng mL-1 (Perlakuan A3 dan B2 masing-masing 3,42 ng mL-1 dan 3
ng mL-1
Kualitas Air
).Estradiol yang rendah menunjukkan bahwa konsentrasi C21 terutama 17α,20β-dihidroxy-4-pregnen-3-one (17α,20β-DP) tinggi (Kobayashi et al. 2002) sehingga oosit mengalami GVBD dan berakhir pada ovulasi karena terjadi penurunan aktivitas enzim aromatase P450, sedangkan aktivitas enzim 20β-hidroksisteroid-dehidrogenase (20β-HSD) meningkat (Nagahama dan Yamashita 2008). Hasil penelitian dari Wijayanti et al. (2009) menunjukkan bahwa penurunan estradiol bersamaan dengan peningkatan kadar hormon progesteron.
20
Tabel 7 Nilai parameter kualitas air selama penelitian
Parameter Penelitian
DO 6,70-6,90 ppm
pH 6
Suhu 25-27 °C
Oksigen terlarut berkisar antara 6,70-6,90 ppm. Kondisi ini baik untuk pertumbuhan dan kelangsungan hidup ikan. Subagyo dan Harjamulia (1992) menyatakan bahwa DO optimum untuk kebutuhan ikan lebih besar dari 6 ppm. Lebih lanjut menurut Zonneveld et al. (1991) dalam budidaya ikan oksigen terlarut tidak boleh kurang dari 5 ppm. Ikan memerlukan oksigen guna pembakaran makanan untuk menghasilkan aktivitas seperti berenang, pertumbuhan dan reproduksi. Derajat keasaman (pH) air dalam bak pemijahan relatif stabil yaitu 6. Kondisi tersebut masih memenuhi kondisi ideal bagi ikan mas dan ikan tawes karena kisaran pH yang sesuai untuk budidaya siprinid
berkisar antara 6-9 (Zonneveld et al. 1991). Menurut Susanto (2003) suhu pada
budidaya ikan berkisar antara 25-30 °C dengan demikian kisaran suhu air selama penelitian masih dalam kondisi yang layak untuk ikan mas dan ikan tawes yaitu 25-27 °C.
5. KESIMPULAN DAN SARAN
Kesimpulan
Ikan yang bertindak sebagai pengimbas dalam pemijahan dengan metode Cangkringan adalah ikan mas. Ikan mas jantan yang disuntik ovaprim dapat memberikan pengaruh imbas pada pemijahan ikan tawes. Pengaruh imbas tersebut akan semakin kuat jika juga terdapat ikan mas betina sebagai pengimbas.
Perlakuan terbaik dihasilkan oleh perlakuan B (ikan mas ♂♂♀ disuntik) dan D
(ikan mas ♂♂♂ disuntik) dengan derajat pemijahan sebesar 66,7% dan fekunditas
telur berkisar antara 95.280-97.662 butir telur.
Saran
21
DAFTAR PUSTAKA
Affandi R, Tang U. 2002. Fisiologi Hewan Air.Riau (ID): Unri Pr. 217 p.
Almeida OG, Miranda A, Frade P, Hubbard PC, Barata EN, Canário AVM. 2005. Urine as a social signal in the mozambique tilapia (Oreochromis mossambicus). Chem Senses 30:i309–i310.
Appelt CW, Sorensen PW. 2007. Female goldfish signal spawning readiness by altering when and where they release a urinary pheromone. Animal and Behaviour. 74:1329-1338.
Ardiwinata RO. 1981. Pemeliharaan Ikan. Bandung (ID): Sumur Bandung. 116 hlm.
Burnard D, Gozlan RE, Griffiths SW. 2008. The role of pheromones in freshwater fishes. J Fish Biol 73:1-16.
Cholik F, Artati, Arifudin. 1986. Pengelolaan kualitas Air kolam Ikan. INFIS Manual. Seri No. 36. 52 hlm.
________, Jagatraya A, Poernomo R, Jauzi A. 2005. Akuakultur tumpuan harapan masa depan bangsa. Jakarta (ID): PT. Victoria Kreasi Mandiri.
Degani G, Boker R. 1992. Vitellogenesis level and induction of maturation in the ovary if the blue gouramy Trichogaster trichopterus (Anabantidae, Pallas, 1770). J Exper Zool. 263:330-337.
De Vlaming V. 1983. Oocyte development patterns and hormonal involvements among teleosts. In : Rankin JC, Pitcher TJ, Duggan RT (eds). Controle Process in Fish Physiology. 298 p. Croom Helm. Australia. 176–199.
Dulka JG, Stacey NE, Sorensen PW, Van Der Kraak GJ. 1987. A sex steroid pheromone synchronizes male–female spawning readiness in the goldfish. Nature (London). 325:251–253
Effendie MI. 2002. Biologi Perikanan. Yogyakarta (ID): Yayasan Pustaka Nusatama.
Haniffa MA, Allem Benziger PS, Jesu AA, Nagarajan M, Siby P. 2007. Breeding behaviour and embryonic development of koi carp (Cyprinus carpio), Taiwania. 52:93-99.
Hardjamulia A. 1979. Budidaya ikan mas (Cyprinus carpio), ikan tawes (Puntius javanicus), ikan nilem (Osteochilus hasselti). Badan Pendidikan Latihan Penyuluhan Pertanian. Departemen Pertanian. 41 hal.
Harker K. 1992. Breeding carps with Ovaprim in India. INFOFISH International. 36-39.
I’tishom R. 2008. Pengaruh sGnRHa + domperidon dengan dosis pemberian yang berbeda terhadap ovulasi ikan mas (Cyprinus carpio L.) Strain punten. J Perikanan. 3:9-16.
Levesque HM, Scaffidi D, Polkinghorne CN, Sorensen PW. 2011. A multi-component species identifying pheromone in the goldfish. J Chem Ecol. 37:219-227.
22
Kobayashi D, Tanaka M, Fukuda S, Nagahama Y. 1996. Steroidogenesis in follicles of medaka (Oryzas latifes) during vitellogenesis and oocyte maturation. Zoo Science. 13:921-927.
Kobayashi M. Sorensen PW, Stacey NE. 2002. Hormonal and pheromonal control of spawning behavior in the goldfish. Fish Physiol Biochem. 26:71–84. Kottelat M. 1999. Nomenclature of the genera barbodes, cyclocheilichthys,
rasbora and chonerhinos (Teleostei: Cyprinidae and Tetraodontidae), with
comments on the definition of the first reviser. The Raffles Bull of Zool.
47:591-600.
Kucharczyk D, Targońska K, Hliwa P, Gomulka P, Kwiakowski M, Krejszeeff. S,
Perkowski, J. 2008. Reproductive parameters of common carp (Cyprinus carpio L.) spawner during natural season and out of season spawning. Polish J of Reprod Biol. 8:285-289.
Kuo TJ, Nash CE, Shehadeh CH. 1974. A Procedural guide to induce spawning in Grey Mullet (Mugil cephalus). Aquaculture. 3:1-4.
Lestari TK. 1998. Deskripsi mengenai pemijahan ikan tawes (Puntius javanicus Blkr.) dengan cara imbas. Skripsi. Jurusan Budidaya Perairan. Fakultas Perikanan Dan Ilmu Kelautan. Institut Pertanian Bogor. Bogor.
Lieberman E. 1995. A Guide to The Application of Endocrine Techniques in Aquaculture. Argentina (AR): Argent Laboratories Pr. 40 p.
Li W, Scott AP, Siefkes MJ. 2002. Bile acid secreted by male sea lamprey that acts as a sex pheromone. Science. 296:138–141.
Liley NR, Stacey NE. 1983. Hormones, pheromones and reproductive behaviour; in Fish physiology (eds) Hoar WS, Randall DJ, Donaldson EM (New York: Academic Press). 9b:1–63.
Lim H, Sorensen PW. 2010. Making and using female sex pheromone implants
which attract mature male common carp. Invas Anim Coop Research
Centre. 17 p.
_________. 2012. Common carp implanted with prostaglandin F 2α release a sex
pheromone complex that attracts conspecific males in both the laboratory and field. J of Chem Ecol. 38:127-134.
Mantau Z, Rawung JBM, Sudarty. 2004. Pembenihan Ikan Mas yang Efektif dan Efisien. J Lit Pertan. 23:68-73.
Nagahama Y. 1983. The functional morphology of teleost gonads. In: Hoar WS, Randall DJ, Donaldson EM. (eds). Fish Physiol. Vol. IX Part B. New York (US). Academic Pr. 223-275 p.
_________, Yamashita M. 2008. Regulation of oocyte maturation in fish. Dev Growth Differ. 50: 195-219.
Poling KR, Fraser EJ, Sorensen PW. 2001. The three steroidal components of the goldWsh preovulatory pheromone signal evoke diVerent behaviors in males. Comp Biochem Physiol. Part B. 129:645–651.
Randall C. 1995. The control of the timing of seasonal reproduction in salmonid fish. Aquaculture News. 19 :18-20.
Redding JM, Pattino R. 1993. Reproductive Physiology. In : Evans DH (ed). The Physiol of Fish. USA (US): CRC Pr. 503-533 p.
23
Saanin H. 1984. Taksonomi dan Kunci Identifikasi Ikan
Siefkes MJ, Zielinski B, Scott AP. 2003. Male sea lampreys (Petromyzon marinus L.) excrete a sex pheromone from gill epithelia. Biol Reprod. 69:125–132.
Jilid I. Bandung (ID): Bina Cipta. 508 hal.
Soedarman. 1983. Memijahkan ikan tawes (Puntius javanicus
Sorensen PW, Stacey NE. 2004. Brief review of fish pheromones and discussion of their possible uses in the control of non-indogenous teleost fishes. New Zealand J of Marine and Freshwater Research. 38:399–417.
BIkr.) dengan "sistim Cangkringan". Dinas Perikanan Daerah Istimewa Yogyakarta. Yogyakarta.
Stacey NE, Sorensen PW. 2005. Reproductive pheromones.
Subagyo, Harjamulia A. 1992. Pembenihan ikan mas (Cyprinus carpio L) di keramba jaring apung. Di dalam: Prosiding Temu Karya Ilmiah Pengkajian Alih Teknologi Budidaya Ikan dalam Keramba Mini; Bogor, 4-6 Maret 1991. Pros Puslitbangkan. 21:76-83.
J Fish Physiol. 24:359-389.
Sumantadinata K. 1981. Pengembangbiakan Ikan-Ikan Peliharaan di Indonesia. Jakarta (ID): Sastra Hudaya. 105 hlm.
Susanto H. 2003. Usaha Pembenihan dan Pembesaran Tawes. Jakarta: Penebar Swadaya. 106 hlm.
Wijayanti GE, Soeminto, Simanjuntak SBI. 2009. Profil hormon reproduksi dan
gametogenesis pada gurame (Osphronemus gouramy lac.) betina. J Aku
Indones. 8:93-10.
Woynarovich E, Horvath L. 1980. The Artificial Propagation of Warm Water Finfishes. A manual for extention. FAO. 185 p.
Yambe H, Kitamura S, Kamio M, Yamada M, Matsunaga S, Fusetani N, Yamazaki F. 2006. L-kynurenine, an amino acid identified as a sex
pheromone in the urine of ovulated masu salmon. Proceedings of the
National Academy of Sciences, U.S.A. 103:15370-15374.
Yaron Z. 1995. Endocrinology control of gametogenesis and spawning induction in the carp. Aquaculture. 129:49-73
Yueh WS, Chang CF. 2000. Morphological changes and competence of maturing oocytes in the Protandrous Black Porgy, Achantopagrus schlegeli. Zool Stud. 39:114-122.
Yun SS, Siefkes MJ, Scott AP, Li W. 2002. Development and application of an ELISA for a sex pheromone released by the male sea lamprey (Petromyzon marinus L.). Gen Comp Endocrinol. 129:163–170.
Zairin MJr. 2003. Endokrinologi dan perannya bagi masa depan perikanan Indonesia. Orasi Ilmiah Guru Besar Tetap Ilmu Fisiologi Reproduksi dan Endokrinologi Hewan Air. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Bogor.
_________, Sari RK, Raswin M. 2005. Pemijahan ikan tawes dengan sistem imbas menggunakan ikan mas sebagai pemicu. J Aku Indones. 4(2):103– 108.
Żarski D, Bokor Z, Kotrik L, Urbanyi B, Horvath A, Targońska K, Krejszeff S,
24
controlled reproduction of Eurasian perch, Perca fluviatilis L. Reprod Biol. 11:194-209.
Zheng W, Strobeck C, Stacey N. 1997. The steroid pheromone
4-pregnen-17α,20β-diol-3-one increases. J Experiment Biol 200: 2833–2840.
Zonneveld NE, Huisman EA, Boon JH. 1991. Prinsip-Prinsip Budidaya Ikan.
Terjemahan. Jakarta: PT Gramedia Pustaka Utama. 381 hal.
25
26
Lampiran 1. Desain pengacakan wadah
27
Lampiran 2. Data statistik diameter telur ikan mas dan ikan tawes pada setiap
perlakuan dan ulangan
Descriptive Statistics: ikan mas A1; B1; C1 (ulangan satu)
Var N N* Mean SE Mean StDev Min Q1 Median Q3
A1 30 0 1,3367 0,0133 0,0730 1,2500 1,2500 1,3500 1,3750 B1 30 0 1,3150 0,0160 0,0875 1,2500 1,2500 1,2500 1,3750 C1 30 0 1,4208 0,0153 0,0836 1,2500 1,3750 1,4375 1,5000
Descriptive Statistics: ikan tawes A1; B1; C1; D1; E1 (Ulangan satu)
Var N N* Mean SE Mean StDev Minimum Q1 Median Q3
A1 30 0 0,67833 0,00620 0,03395 0,62500 0,65000 0,67500 0,70000 B1 30 0 0,70000 0,00749 0,04100 0,62500 0,66875 0,70000 0,73125 C1 30 0 0,67083 0,00778 0,04259 0,60000 0,62500 0,66250 0,70000 D1 30 0 0,67833 0,00717 0,03925 0,62500 0,64375 0,67500 0,70625 E1 30 0 0,64667 0,00584 0,03198 0,60000 0,62500 0,63750 0,65625
Var Maximum
A1 0,75000 B1 0,75000 C1 0,75000 D1 0,75000 E1 0,72500
Var Maximum
A1 1,5000
B1 1,5000
28
Descriptive Statistics: ikan mas A2; B2; C2 (ulangan dua)
Var N N* Mean SE Mean StDev Minimum Q1 Median Q3
A2 30 0 1,3150 0,0160 0,0875 1,2500 1,2500 1,2500 1,3750 B2 30 0 1,0750 0,0332 0,1816 0,8750 0,8750 1,1250 1,2500 C2 30 0 1,3250 0,0297 0,1628 1,0000 1,2500 1,2500 1,5000
Var Maximum
A2 1,5000 B2 1,2500 C2 1,5000
Descriptive Statistics: ikan tawes A2; B2; C2; D2; E2 (Ulangan dua)
Var N N* Mean SE Mean StDev Minimum Q1 Median Q3
A2 30 0 0,67833 0,00717 0,03925 0,62500 0,65000 0,67500 0,72500 B2 30 0 0,69167 0,00939 0,05142 0,57500 0,65000 0,68750 0,75000 C2 30 0 0,67500 0,00996 0,05454 0,57500 0,62500 0,67500 0,72500 D2 30 0 0,69833 0,00656 0,03592 0,65000 0,66875 0,70000 0,72500 E2 30 0 0,66167 0,00726 0,03979 0,62500 0,62500 0,65000 0,68125
Var Maximum
29
Descriptive Statistics: ikan mas A3; B3; C3 (ulangan tiga)
Var N N* Mean SE Mean StDev Minimum Q1 Median Q3
A3 30 0 1,2950 0,0146 0,0800 1,1500 1,2500 1,2500 1,3375 B3 30 0 1,3883 0,0216 0,1183 1,2500 1,2500 1,4375 1,5000 C3 30 0 1,4208 0,0153 0,0836 1,2500 1,3750 1,4375 1,5000
Var Maximum
A3 1,5000 B3 1,5000 C3 1,5000
Descriptive Statistics: ikan tawes A3; B3; C3; D3; E3 (Ulangan tiga)
Var N N* Mean SE Mean StDev Minimum Q1 Median Q3
A3 30 0 0,65167 0,00688 0,03768 0,57500 0,62500 0,65000 0,67500 B3 30 0 0,65333 0,00643 0,03519 0,60000 0,62500 0,65000 0,67500 C3 30 0 0,66167 0,00802 0,04391 0,60000 0,62500 0,65000 0,70000 D3 30 0 0,67333 0,00748 0,04097 0,60000 0,65000 0,65000 0,72500 E3 30 0 0,67250 0,00752 0,04118 0,57500 0,65000 0,67500 0,70000
Var Maximum
30
Lampiran 3. Gambar Telur Ikan Mas Pada Setiap Perlakuan dan Ulangan
Perlakuan
A B C
1
2
3
Keterangan: Telur ikan mas hanya pada perlakuan A (mas ♂♂♀ tidak disuntik &
tawes ♂♀), B (mas ♂♂♀ disuntik & tawes ♂♀), C ( mas ♂♂
disuntik ♀ tidak disuntik & tawes ♂♀). Panah hitam putus-putus:
inti telur dorman (GV)
U
langa
31
Lampiran 4. Gambar Telur Ikan Tawes pada Setiap Perlakuan dan Ulangan
Perlakuan
A B C D E
1
2
3
Keterangan: Telur ikan tawes pada perlakuan A (mas ♂♂♀ tidak disuntik & tawes
♂♀), B (mas ♂♂♀ disuntik & tawes ♂♀), C (♂♂ disuntik ♀ tidak
disuntik & tawes ♂♀), D (♂♂♂ disuntik & tawes ♂♀) dan E (♂♂♂
tidak disuntik & tawes ♂♀). Panah hitam putus-putus telur dalam
keadaan dorman (GV). Panah hitam inti telur mulai bergerak ke tepi (GVM)
U
langa
Lampiran 5 Waktu Penyuntikan Pertama dan Kedua Serta Waktu Pemijahan ikan Mas dan Ikan Tawes pada setiap perlakuan dan ulangan
Perlakuan Ulangan Ikan Tanggal Waktu
Suntik I Tanggal
Waktu
Suntik II Tanggal
3
♂
3
♂
- - - -
♂
♂
Lampiran 6. Bobot Tubuh, Fekunditas, Derajat Pembuahan (FR) dan Derajat Penetasan (HR) Ikan Tawes pada setiap perlakuan dan ulangan
Perlakuan Ulangan Bobot Tubuh Fekunditas FR (%) *HR (%)
1 0,15 - - -
A 2 0,35 32.157 0 0
3 0,58 - - -
Rata-rata 0 0
1 0,16 29.775 0 0
B 2 0,60 - - -
3 0,78 97.662 82 97,2
Rata-rata 82 97,2
1 0,20 - - -
C 2 0,15 - - -
3 0,60 95.280 72,7 93,6
Rata-rata 72,7 93,6
1 0,16 23.820 0 0
D 2 0,50 - - -
3 0,64 65.505 81,7 96,8
Rata-rata 81,7 96,8
1 0,25 - - -
E 2 0,35 - - -
3 0,51 - - -
Rata-rata - 0 0
2
Lampiran 7. Data mentah pengukuran hormon testosteron dan estradiol pada ikan mas
pada setiap perlakuan dan ulangan
Perlakuan Sex
Konsentrasi (ng mL-1 Pemijahan
3
E1 ♂ tt tt * *
- -
♂ 6,26 15,46 * *
♂ tt tt * *
E2 ♂ tt tt * *
- -
♂ 3,70 14,15 * *
♂ tt tt * *
E3 ♂ 6,27 >16,8 * *
- -
♂ 7,55 11,95 * *
♂ 1,72 tt * *
4
RIWAYAT HIDUP
Bismillahirrohmanirrohiim. Penulis dilahirkan di kota Padangsidempuan 7 Agustus 1986 anak ke-2 dari enam bersaudara, Ayah Ir Hazairin Simanjuntak MSi dan Ibu Nuryalis. Pendidikan dasar, menengah pertama, dan menengah atas serta pendidikan tinggi penulis selesaikan di kota Pekanbaru, Riau yaitu SDN 038 tahun 1998, SMPN 25 tahun 2001, SMUN 10 tahun 2004 dan Universitas Riau Fakultas Perikanan dan Ilmu Kelautan Jurusan Budidaya Perairan tahun 2009. Selanjutnya pada tahun 2010 penulis tercatat sebagai mahasiswa program pascasarjana di jurusan Ilmu Akuakultur Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor.
Selama mengikuti program S-2, penulis menjadi anggota Himpunan Mahasiswa Muslim Pascasarjana (HIMMPAS) IPB kepengurusan tahun 2011-2012 serta anggota Forum Wacana Institut Pertanian Bogor kepengurusan tahun 2011-2012. Pada tanggal 29 Januari 2013 penulis dinyatakan lulus dalam ujian
sidang tesis penulis yang berjudul Peran Ikan Mas (Cyprinus carpio L.) Jantan
dalam Merangsang Pemijahan Ikan Tawes (Barbonymus gonionotus B.) dengan
Metode Cangkringan.