INTRODUKSI DAN EKSPRESI GEN GFP (GREEN
FLUORESCENT PROTEIN) DENGAN PROMOTER BERBEDA
PADA SEL EMBRIO SOMATIK RUMPUT LAUT
Kappaphycus alvarezii
MUH. ALIAS L. RAJAMUDDIN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Introduksi dan Ekspresi Gen GFP (Green Fluorescent Protein) dengan Promoter Berbeda pada Embrio Somatik Rumput Laut Kappaphycus alvarezii adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juni 2010
iii
ABSTRACT
MUH. ALIAS L. RAJAMUDDIN. Introduction and Expression of GFP Gene (Green Fluorescent Protein) by Different Promoters on Somatic Embryos of Seaweed Kappaphycus alvarezii. Under direction of KOMAR SUMANTADINATA, UTUT WIDYASTUTI, and ALIMUDDIN.
Transgenesis is genetic manipulation through gene transfer to introduce the gene coding a protein that encodes a character such as growth, disease resistance, and quality of fish meat or carrageenan content in the seaweed. As an early stage in order to produce transgenic seaweed, this study aims to test the promoter activity and the success of gene transfer of GFP as a marker. Construction of GFP gene with different promoters : CMV (cytomegalovirus), CaMV (cauliflower mosaicvirus), β-actin and keratin was transferred to somatic embryo seaweed by electroporation using a gene pulsher method (BIO RAD) with voltage: 300 V/cm, the pulse length : 0.5 millimeter/second, the pulse number : 4 time, the pulse interval: 0.1 second. Promoter activity was determined by analyzing the gene expression level of GFP using fluorescent microscope. The callus induction of Kappaphycus alvarezii for production of somatic embryos cell by different ratio of growth regulators and agar media concentrations. Callus induction was conducted at 0.8-1.0% agar medium containing IAA : kinetin = 1.0 : 1.0 ppm. Somatic embryos were cultivated by Conway medium (liquid culture). The results showed that CMV promoter drives expresses the number of fluorescent cells on average 34.10±1.49% with moderate and strong intensity levels of luminescence, the CaMV promoter drives luminescence intensity showed strong and percentage fluorescent cells on average 10.48±0.25%. β-actin promoter showed the intensity of luminescence in moderat level and the number of fluorescent cells was 8.85±2.31%, while keratin promoter drives weak luminescence intensity and the average number of fluorescent cells was 4.79± 0.26%. Thus, CMV is the best promoter and production of transgenic seaweed K. alvarezii could be conducted by electroporation method.
RINGKASAN
MUH. ALIAS L. RAJAMUDDIN. Introduksi dan Ekspresi Gen GFP (Green Fluorescent Protein) dengan Promoter Berbeda pada Embrio Somatik Rumput Laut Kappaphycus alvarezii. Dibimbing oleh KOMAR SUMANTADINATA, UTUT WIDYASTUTI, dan ALIMUDDIN.
Peningkatan produksi budidaya rumput laut dapat dilakukan melalui ekstensifikasi dan penggunaan bibit unggul (tumbuh cepat, tahan penyakit dan perubahan kondisi lingkungan). Permasalahan dihadapi dalam mencapai target produksi adalah rasio tumbuh yang semakin kecil akibat serangan penyakit dan lingkungan yang tidak mendukung. Selain itu, faktor penyakit dan lingkungan mempengaruhi mutu kandungan karaginan. Aplikasi teknologi transfer gen (transgenesis) dengan tujuan seperti peningkatan pertumbuhan, resistensi penyakit dan daya tahan terhadap kondisi lingkungan ekstrim, telah banyak diteliti pada berbagai spesies ikan, tetapi pada rumput laut masih sangat jarang dilakukan. Oleh karena itu perlu dilakukan perbaikan mutu genetik dalam rangka mendukung peningkatan produksi budidaya rumput laut.
Salah satu penentu keberhasilan transgenesis adalah kemampuan promoter yang digunakan untuk mengendalikan ekspresi gen yang diintroduksi. Berbagai jenis promoter telah diuji aktivitasnya pada ikan seperti CMV (cytomegalovirus), β-aktin, keratin, sedangkan CaMV (cauliflower mosaicvirus) adalah promoter yang juga dapat aktif baik pada tanaman maupun hewan. Promoter yang telah diisolasi masih sangat terbatas, oleh karena itu perlu dilakukan uji promoter yang ada untuk mengetahui promoter yang sesuai dengan inang yang akan dibuat menjadi transgenik.
Pada penelitian ini, sebagai langkah awal produksi bibit rumput laut bermutu tinggi menggunakan teknologi transgenesis, dilakukan introduksi gen GFP sebagai penanda untuk mengetahui aktivitas promoter CMV, CaMV, β-aktin dari ikan medaka, dan keratin dari ikan flounder Jepang. Transfer gen GFP dilakukan menggunakan metode elektroporasi pada embrio somatik K. alvarezii.
v
Empat jenis konstruksi gen GFP yang dikendalikan oleh promoter berbeda diuji dalam penelitian ini. Keempat konstruksi gen tersebut adalah pCMV-GFP (Clontech), pCaMV-GFP (pemberian Dr. Akashi - NAIST), pmBA-GFP (Takagi et al. 1994) dan pJfKer-GFP (Yazawa et al. 2005). pCMV-GFP dikendalikan oleh promoter cytomegalovirus, pCaMV-GFP oleh promoter cauliflower mosaicvirus, pmBA-GFP oleh promoter β-aktin ikan medaka, dan pJfKer-GFP oleh promoter keratin dari ikan flounder Jepang. Massa embrio somatik K. alvarezii yang berbentuk filamen dicampur dengan konstruksi gen GFP dengan konsentrasi 100 ng/µl. Campuran embrio somatik K. alvarezii dan konstruksi gen GFP dengan volume 200 µl dimasukkan ke dalam kuvet 2 mm. Elektroporasi menggunakan mesin Gene Pulser II (Biorad, USA) dengan tingkat voltase 300 V, lama kejutan (pulse length) 0,5 milidetik, jumlah kejutan (pulse number) 4 kali dan interval kejutan (pulse interval) 0,1 detik. Parameter elektroporasi tersebut diperoleh dari penelitian pendahuluan yang mendukung introduksi gen dan viabilitas sel.
Ekspresi gen GFP diamati menggunakan mikroskop fluoresen (Olympus BH2-RFCA) yang dilengkapi reflected light fluorescent attachment (BH2-RFC2). Pengamatan dilakukan setiap jam sejak jam pertama setelah elektroporasi sampai ekspresi GFP menjadi stabil. Persentase sel embrio yang mengekspresikan GFP dihitung dan tingkat ekspresi GFP dikelompokkan dengan kategori hijau lemah, sedang dan kuat. Transforman hasil elektroporasi yang mengekspresikan gen GFP ditapis dengan cara mengkultur pada media agar semi solid 0,6%, diperkaya dengan Conway 2 ppm yang mengandung antibiotik kanamisin 100 ppm. Deteksi transforman juga dilakukan menggunakan metode PCR. DNA diekstraksi menggunakan kit Puregene DNA Isolation (Gentra, USA) dengan prosedur sesuai manualnya. Amplifikasi PCR menggunakan primer GFP-F 5’-GGTCGAGCTGGACGG-3’ dan GFP-R 5’-ACGAACTCCAGCAGG-3’. Proses PCR dijalankan pada suhu pre-denaturasi 94oC selama 3 menit; 35 siklus untuk denaturasi 94oC selama 30 detik, annealing 62oC selama 30 detik, ekstensi 72oC selama 1 menit; dan final ekstensi 72oC selama 3 menit. Produk PCR diseparasi menggunakan elektroforesis pada gel agarosa 1%.
Hasil elektroporasi terlihat sel embrio somatik ada yang berpendar hijau sedangkan pada kontrol yang tidak dielektroporasi tidak berpendar. Hal ini menunjukkan bahwa introduksi gen GFP menggunakan metode elektroporasi berhasil dilakukan pada embrio somatik. Selanjutnya, terdapat perbedaan persentase sel berpendar dan intensitas pendaran GFP yang dikendalikan oleh promoter berbeda. Rata-rata persentase sel berpendar diperoleh: pada konstruksi pCMV-GFP (34,10±1,49%), pCaMV-GFP (10,48±0,25%), pmBA-GFP (8,85± 2,31%), dan pJfKer-GFP (4,79±0,26%). Intensitas pendaran GFP yang dikendalikan oleh promoter CMV, CaMV dan mBA adalah relatif sama yaitu tergolong sedang dan kuat, sedangkan pada JfKer intensitasnya lemah. Sedangkan waktu mulai GFP berpendar, yaitu pada pCMV-GFP lebih cepat dibandingkan dengan pCaMV-GFP dan pmBA-GFP, dan yang paling lambat adalah pJfKer-GFP. Perbedaan intensitas dan waktu awal ekspresi GFP ini diduga disebabkan oleh perbedaan respons faktor cis pada promoter terhadap faktor trans dari inang.
Hasil penapisan dan regenerasi di media seleksi menunjukkan bahwa dengan menambahkan kanamisin 100 ppm ke dalam media kultur, embrio somatik hasil elektroporasi bertahan hidup (tumbuh), sedangkan embrio kontrol yang bukan hasil elektroporasi mati. Hal ini menunjukkan bahwa sel embrio somatik hasil elektroporasi tersebut membawa konstruksi gen GFP yang dilengkapi dengan marka resisten kanamisin. Dibandingkan dengan kondisi awal sel embrio somatik hasil elektroporasi, jumlah sel yang mengekspresikan gen GFP (berpendar hijau terang) bertambah banyak setelah dikultur 1 bulan yaitu : untuk konstruksi gen pCMV-GFP dan pCaMV-GFP relatif sama, sedangkan untuk konstruksi pmBA-GFP dan pJfKer-pmBA-GFP lebih rendah. Tingkat pendaran pmBA-GFP juga terlihat meningkat menjadi hijau terang. Hal ini diduga bahwa sel embrio somatik dengan pendaran hijau terang tersebut merupakan hasil pembelahan mitosis dari sel embrio awal yang berpendar. Dugaan lainnya adalah bahwa gen GFP telah terintegrasi ke genom rumput laut tersebut setelah mengalami pembelahan mitosis. Dengan demikian, sel embrio somatik yang mengekspresikan GFP tersebut merupakan transgenik stabil.
Pita DNA produk PCR dengan cetakan DNA genom dari embrio somatik transforman menggunakan konstruksi gen pCMV-GFP dan pJfKer-GFP, sama ukurannya dengan produk PCR dengan cetakan berupa konstruksi gen GFP (sekitar 600 bp). Sementara itu, produk PCR DNA non-transgenik tidak menghasilkan pita DNA yang sama dengan ukuran fragmen GFP. Hal ini menggambarkan bahwa embrio somatik transforman mengandung gen GFP dan sudah menyisip ke dalam genom K. alvarezii dan tidak didapatkan pada non transgenik.
Transfer gen GFP yang dikendalikan oleh promoter berbeda menggunakan metode elektroporasi ke embrio somatik K. alvarezii telah berhasil dilakukan. Promoter CMV lebih sesuai untuk rumput laut K. alvarezii dalam mengendalikan ekspresi gen asing dibandingkan dengan promoter CaMV, mBA dan JfKer.
vii
© Hak cipta milik IPB, tahun 2010
Hak cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya :
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
INTRODUKSI DAN EKSPRESI GEN GFP (GREEN
FLUORESCENT PROTEIN) DENGAN PROMOTER BERBEDA
PADA SEL EMBRIO SOMATIK RUMPUT LAUT
Kappaphycus alvarezii
MUH. ALIAS L. RAJAMUDDIN
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
ix
Judul Tesis : Introduksi dan Ekspresi Gen GFP (Green Fluorescent Protein) dengan Promoter Berbeda pada Embrio Somatik Rumput Laut Kappaphycus alvarezii
Nama : Muh. Alias L. Rajamuddin
NIM : C151070101
Mayor : Ilmu Akuakultur
Disetujui Komisi Pembimbing
Prof. Dr. Ir. Komar Sumantadinata, M.Sc. Ketua
Dr. Ir. Utut Widyastuti, M.Si. Dr. Alimuddin, S.Pi, M.Sc. Anggota Anggota
Mengetahui
Ketua Program Studi/Mayor Dekan Sekolah Pascasarjana IPB Ilmu Akuakultur
Prof. Dr. Ir. Enang Harris, M.S. Prof. Dr.Ir. Khairil A.Notodiputro, M.S.
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari 2009 sampai April 2010 ini ialah teknologi transgenesis rumput laut, dengan judul Introduksi dan Ekspresi gen GFP (Green Fluorescent Protein) dengan Promoter Berbeda pada Embrio Somatik Rumput Laut Kappaphycus alvarezii.
Penulis menyampaikan terima kasih dan penghargaan yang setinggi-tingginya kepada Bapak Prof. Dr. Komar Sumantadinata, Ibu Dr. Utut Widyastuti, dan Bapak Dr. Alimuddin selaku komisi pembimbing yang telah memberikan bimbingan, arahan dan motivasi mulai dari penyusunan proposal hingga penyelesaian tesis ini. Penghargaan yang sama penulis sampaikan kepada penguji luar komisi atas saran perbaikannya. Disamping itu, ucapan terima kasih disampaikan kepada Bapak Prof. Enang Harris, M.S beserta staf dan Bapak/Ibu Dosen di Mayor Ilmu Akuakultur IPB, atas segala ilmu dan layanan yang diberikan kepada penulis selama studi, khususnya staf Laboratorium Reproduksi dan Genetik Organisme Akuatik, juga kepada Kepala beserta staf peneliti Balai Riset Perikanan Budidaya Air Payau Maros, dan Bapak Dr. Irvan Faisal beserta staf LAPTIAB BPPT Serpong, serta Kepala beserta staf Pusat Penelitian Sumberdaya Hayati dan Bioteknologi IPB, yang telah banyak membantu selama penelitian.
Ungkapan terima kasih juga disampaikan kepada Direktur dan Ketua Jurusan Budidaya Perikanan serta Bapak/Ibu staf Politeknik Pertanian Negeri Pangkep atas dukungan dan bantuan moril maupun materil selama penulis melaksanakan tugas belajar, dan kepada Dirjen DIKTI DEPDIKNAS atas beasiswa BPPS yang diberikan, serta Yayasan R.v.G. Van Deventer Maas atas bantuan studi selama 12 bulan.
Terima kasih dan sembah sujud kepada Ayahanda L. Rajamuddin dan Ibunda Husniah, Ibu mertua A. Hawiyah Krg. Tonji dan H. Sakojong Dg. Pasara (alm), A. Majidah Pg. Kame (almh), serta kepada saudara-saudaraku dan seluruh keluarga, atas doa, bantuan dan dukungannya selama ini. Teristimewa kepada isteriku tercinta Nurjanna, S.Pi dan anak-anakku : N. Abdi Sahab L.Rajamuddin, N. Putra Shafar L.Rajamuddin, N. Agung Ramadhan L.Rajamuddin atas pengertian, kesabaran dan kesetiaannya selama penulis melaksanakan tugas belajar.
Terima kasih khusus disampaikan kepada teman-teman mahasiswa Sekolah Pascasarjana IPB (utamanya S2 Akuakultur 2007) atas kebersamaan, kekompakan, kerjasama yang baik sejak perkuliahan sampai penyusunan dan penyelesaian karya ilmiah ini, serta kepada semua pihak yang tidak sempat disebut satu persatu.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juni 2010
xi
RIWAYAT HIDUP
Penulis dilahirkan di Batuasang Kecamatan Hero Lange-lange Kabupaten Bulukumba, Sulawesi-Selatan pada tanggal 28 April 1971 dari ayah L.Rajamuddin dan ibu Husniah. Penulis merupakan anak kelima dari sepuluh bersaudara. Menjalani pendidikan dasar sampai SLTA di Bulukumba, kabupaten di bagian Selatan dari Sulawesi-Selatan.
Penulis tamat Sekolah Pertanian Pembangunan tahun 1989 dan diterima menjadi PNS di Politeknik Pertanian UNHAS tahun 1990. Penulis salah seorang pemrakarsa terbentuknya organisasi profesi Ikatan Teknisi Politeknik Pertanian Indonesia-UNHAS dan menjabat Ketua Umum 3 periode (1991-1997). Sambil melaksanakan tugas-tugas sebagai PNS, penulis melanjutkan pendidikan Sarjana (S1) pada Program Studi Budidaya Perairan, Fakultas Pertanian Universitas Muhammadiyah Makassar (1996-2002). Selama menjadi mahasiswa aktif di organisasi profesi Aquatic Study Club Makassar (ASCM) dan menjabat Ketua II periode kepengurusan 1999-2000. Tahun 2005 penulis dialihkan status kepegawaian menjadi Dosen di unit kerja yang sama Politeknik Pertanian Negeri Pangkep.
Tahun 2007 penulis menjadi mahasiswa S2 Sekolah Pascasarjana Institut Pertanian Bogor di Mayor Ilmu Akuakultur dengan biaya BPPS (Bantuan Pendidikan Pascasarjana) Direktorat Jenderal Pendidikan Tinggi (DIKTI) DEPDIKNAS. Selama mengikuti pendidikan S2 di IPB, penulis juga aktif di Forum Mahasiswa Pascasarjana IPB (WACANA-IPB) Daerah SUL-SEL dan menjabat Sekretaris Umum periode 2007/2008.
DAFTAR ISI
2.2 Induksi Kalus dan Embrio Somatik... 6
2.3 Transgenesis... 7
2.4 Promoter... 8
2.5 Gen Marker GFP (green fluorescent protein)... 10
2.6 Teknik Transfer Gen dengan Elektroporator... 11
3 BAHAN DAN METODE... 12
3.1 Waktu dan Tempat... 12
3.2 Konstruksi Gen Uji dan Perbanyakan Plasmid... 12
3.3 Produks i Sel Embrio Somatik K. alvarezii melalui Induksi Kalus.. 13
3.3.1 Penyediaan dan Pemeliharaan Sumber Inokulum... 3.3.2 Induksi dan Pembentukan Kalus... 3.3.3 Regenerasi Massa Sel Embrio Somatik K. alvarezii... 14 14 15 3.4 Introduksi Gen dan Analisis Ekspresi... 15
3.4.1 Introduksi Gen GFP ke Sel Embrio Somatik K. alvarezii... 3.4.2 Analisis Ekspresi Gen... 16 16 3.4.2.1 Visualisasi Hasil Elektroporasi dengan Mikroskop Fluoresen... 16
3.4.2.2 Penapisan Transforman dan Regenerasi pada Media Seleksi... 17
3.4.2.3 Deteksi DNA Transforman dengan Polymerase Chain Reaction... 17
4 HASIL DAN PEMBAHASAN... 19
4.1 Produks i Sel Embrio Somatik K. alvarezii melaui Induksi Kalus... 19
4.1.1 Induksi dan Pembentukan Kalus... 4.1.2 Regenerasi Massa Sel Embrio Somatik K. alvarezii... 19 21 4.2 Introduksi Gen dan Analisis Ekspresi... 24
xiii
4.2.2 Penapisan Transforman dan Regenerasi pada Media Seleksi...
25
4.2.3 Deteksi DNA Transforman dengan Polymerase Chain
Reaction... 26
5 KESIMPULAN DAN SARAN………... 32
5.1 Kesimpulan………... 32
5.2 Saran………. ……… 32
DAFTAR PUSTAKA ………... 33
DAFTAR GAMBAR
Halaman
1 Karakteristik induksi kalus pada rumput laut K. alvarezii setelah 2 bulan kultur : (A) Morfologi eksplan yang terinduksi, dan (B) Gagal (tidak) terinduksi...
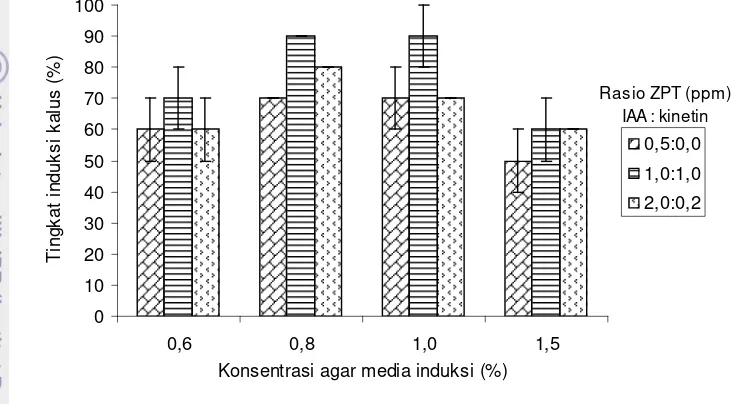
2 Pengaruh perlakuan rasio ZPT dan konsentrasi agar media terhadap tingkat induksi kalus pada rumput laut Kappaphycus alvarezii....
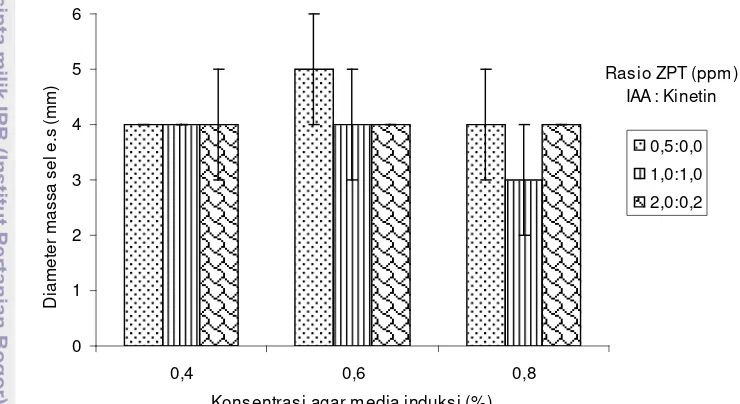
3 Pengaruh perlakuan rasio ZPT dan konsentrasi agar media terhadap tingkat perkembangan massa sel pada kultur di media agar semi solid...
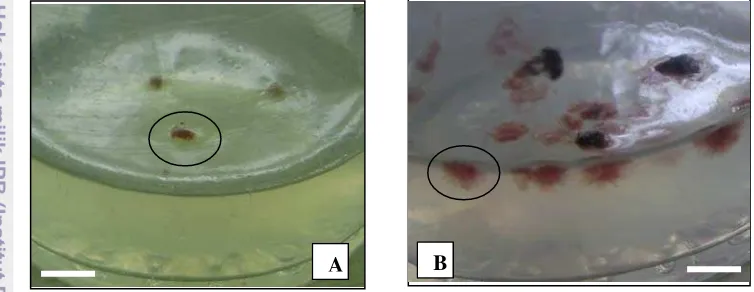
4 Perkembangan massa sel embrio somatik K. alvarezii pada kultur media agar semi solid: A. Massa sel pada hari-1 kultur (bar = 0,2 mm), B. Massa sel pada umur 1 bulan kultur (bar = 5 mm). Tanda bulatan menunjukkan massa sel embrio somatik...
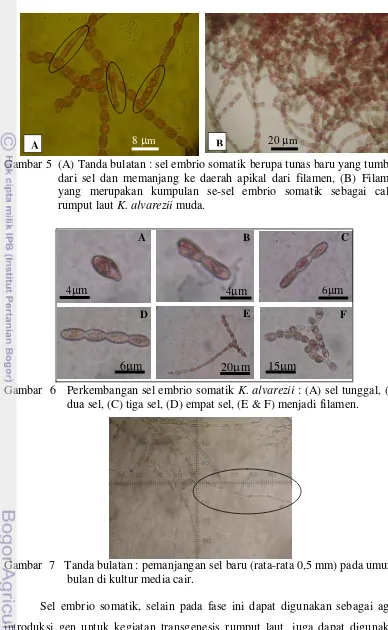
5 (A) Tanda bulatan : sel embrio somatik berupa tunas baru yang tumbuh dari sel dan memanjang ke daerah apikal dari filamen, (B) Filamen yang merupakan kumpulan se-sel embrio somatik sebagai calon rumput laut K. alvarezii muda...
6 Perkembangan sel embrio somatik K. alvarezii : (A) sel tunggal, (B) dua sel, (C) tiga sel, (D) empat sel, (E & F) menjadi filamen...
7 Tanda bulatan : pemanjangan sel baru (rata-rata 0,5 mm) pada umur 1 bulan di kultur media cair...
8 Ekspresi gen GFP pada sel embrio somatik rumput laut K. alvarezii setelah elektroporasi dengan konstruksi gen pCMV-GFP (A), pCaMV-GFP (B), pmBA-pCaMV-GFP (C), pJfKer-pCaMV-GFP (D), kontrol fluoresen tanpa elektroporasi (E), dan kontrol pada mikroskop biasa (F)...
9 Sel embrio somatik rumput laut K. alvarezii setelah ditumbuhkan di media seleksi (umur 1 bulan). (A) Transforman : tumbuh, (B) Non transforman : mati. Gen GFP diekspresikan secara konstitutif pada (C) pCMV-GFP, (D) pCaMV-GFP, (E) pmBA-GFP, (F) pJfKer-GFP...
xv
DAFTAR LAMPIRAN
Halaman
1 Skema prosedur sterilisasi air laut………..
2 Media kultur conway………..………....
3 Elemen-elemen faktor transkripsi promoter CMV (cytomegalovirus)...
4 Elemen-elemen faktor transkripsi promoter CaMV (cauliflower mozaicvirus)………...
40
41
42
1 PENDAHULUAN
1. 1 Latar Belakang
Rumput laut merupakan salah satu komoditas utama program revitalisasi
Departemen Kelautan Perikanan RI yang diharapkan berperan penting dalam
peningkatan kesejahteraan masyarakat. Kappaphycus alvarezii adalah salah satu
jenis rumput laut dari kelompok alga Rhodophyceae yang banyak dibudidayakan
di perairan pantai sekarang ini dengan potensi lahan budidaya di Indonesia sekitar
4,5 juta hektar (DPBDKP 2010) dan peluang pasar yang potensial dimana rumput
laut ini tergolong penghasil karaginan. Kebutuhan bahan baku industri dalam
negeri saja ± 2.340.000 ton/tahun (Hikmayani & Agus 2006), sementara produksi
tahun 2014 ditargetkan oleh Kementerian Kelautan Perikanan sekitar 7,6-10 juta
ton/tahun, dimana tahun 2010 masih sekitar 2,6 juta ton (DPBKKP 2010).
Seiring dengan peluang dan potensi budidaya K. alvarezii, perlu
upaya-upaya dalam mengatasi permasalahan budidaya seperti rasio tumbuh yang
semakin kecil akibat permasalahan penyakit dan lingkungan (Vairappan 2006 ;
Largo et al. 1997) yang selanjutnya akan berpengaruh pada penurunan mutu
genetik seperti mutu kandungan karaginan baik kualitatif maupun kuantitatifnya
(Vairappan et al. 2008), sehingga perlu dilakukan upaya mempertahankan atau
bahkan meningkatan mutu dan kandungan karaginan tersebut.
Salah satu metode perbaikan mutu genetik yang berkembang sekarang
adalah rekayasa genetik dengan transgenesis. Transgenesis yaitu proses transfer
gen-gen asing ke inang yang baru (Lutz 2001), dengan memasukkan DNA asing
ke dalam nukleus suatu sel target dan menggabungkannya ke genom inang.
Teknik ini digunakan untuk mengintroduksikan karakter-karakter genetik yang
baru atau over-ekspresi ke suatu individu dan diharapkan dapat diwariskan ke
keturunannya. Aplikasi teknologi transfer gen atau transgenesis dengan tujuan
seperti peningkatan pertumbuhan (Devlin et al. 2006 ; Nam et al. 2001 ;
Kobayashi et al. 2007), resistensi penyakit (Dunham et al. 2002) dan daya tahan
terhadap kondisi lingkungan ekstrim (Wang et al. 1995 ; Wu et al. 1998) telah
banyak diteliti pada berbagai spesies ikan, tetapi penelitian transgenesis pada
Salah satu penentu keberhasilan transgenesis adalah kemampuan promoter
yang digunakan untuk mengendalikan ekspresi gen yang diintroduksi. Promoter
merupakan bagian dari DNA dimana RNA polymerase menempel (Glick &
Pasternak 2003). Umumnya pada organsime eukaryotik seperti hewan dan
tanaman, promoter memiliki bagian nukleotida TATAAA yang bisa menempel
pada protein khusus dan membantu terbentuknya kompleks transkripsi RNA
polymerase. Promoter merupakan sekuen DNA yang terletak upstream (terminal
5’) dari titik awal transkripsi suatu gen, berperan sebagai penentu, pengatur letak
(spatial), waktu (temporal) dan tingkat ekspresi gen (Beaumont & Hoare 2003).
Dari sinilah terjadi pengaturan oleh faktor transkripsi dimana suatu gen
mengalami on atau off sehingga promoter bisa dianalogikan sebagai switch suatu
gen. Fungsi promoter adalah untuk mengarahkan RNA polymerase sehingga
transkripsi akan terjadi pada daerah yang spesifik. Promoter dikatakan efektif
apabila gen target yang disambungkan ke promoter yang dikendalikannya dapat
terekspresi dengan level yang tinggi. Gen target dapat berupa gen penyandi
protein yang mengkodekan suatu karakter atau gen yang berfungsi sebagai
penanda (marker). Promoter inilah yang menjadi kekuatan gen untuk
mengekspresikan ciri-cirinya pada tingkat yang sangat tinggi (Anderson 2004).
Menurut Hackett (1993) promoter ada yang bersifat aktif dimana-mana
(ubiquitous) dan adapula yang hanya aktif di jaringan spesifik. Beberapa sifat lain
promoter terkait dengan aktivitas elemen-elemennya yaitu constitutive dan house
keeping (Liu 1990 dalam Volckaert 1994). Konstitutif berarti promoter ini dapat
aktif tanpa diberikan rangsangan dari luar seperti suhu dan hormon, sedangkan
bersifat house keeping berarti dapat aktif kapan saja bila diperlukan. Berbagai
jenis promoter telah diuji aktivitasnya pada ikan seperti CMV/cytomegalovirus
(Volckaert 1994 ; Arenal et al. 2008 ; Traxler et al. 1999), β-aktin (Yoshizaki
2001 ; Alimuddin et al. 2005), keratin (Gong et al. 2002 ;Yazawa et al. 2005),
elongation factor-1α (Yasawa et al. 2005; Alimuddin et al. 2007). CaMV
(cauliflower mosaicvirus) juga merupakan promoter yang dapat aktif selain pada
tanaman dan hewan juga di bakteri Escherichia coli (Assaad & Signer 1990 ;
Lewin et al. 1998), pada jamur atau ragi (Pobjecky et al. 1990), dapat aktif dalam
3
tanah Agrobacterium rhizogenes (Lewin et al. 1998). Aktivitas promoter
ditentukan oleh kesesuaian antara faktor transkripsi (cis-regulator) yang ada pada
promoter dengan faktor trans pada inang (Inyengar et al. 1996 ; Alimuddin 2003).
Umumnya aktivitas promoter yang berasal dari spesies yang sama dengan yang
akan dibuat transgenik adalah lebih tinggi dibandingkan dengan yang berasal dari
spesies berbeda. Namun demikian, promoter yang telah diisolasi masih sangat
terbatas. Oleh karena itu, perlu dilakukan uji promoter yang ada untuk mengetahui
promoter yang sesuai dengan inang yang akan dibuat menjadi transgenik.
Chalfie et al. (1994) dan Chou et al. (2001) menyebutkan bahwa gen
marker atau penanda yang dapat digunakan untuk pengujian efektivitas promoter
adalah gen GFP (green fluorescent protein). Gen GFP memiliki kandungan
protein yang berpendar dan dapat divisualisasikan ekspresinya pada sel dengan
menggunakan sinar UV (Iyengar et al. 1996). Beberapa kelebihan penggunaan
gen GFP sehingga banyak digunakan sebagai penanda molekuler antara lain
keberadaan gen di dalam sel itu sendiri tidak membutuhkan perlakuan khusus
pada jaringan, tidak membutuhkan penambahan substrat untuk visualisasinya dan
ekspresi gen GFP dapat dideteksi sampai tingkat sel tunggal (Meha 2003).
Pada penelitian ini, sebagai langkah awal produksi bibit rumput laut
bermutu tinggi menggunakan teknologi transgenesis, dilakukan introduksi gen
GFP sebagai penanda untuk mengetahui aktivitas promoter CMV
(cytomegalovirus), CaMV (cauliflower mozaicvirus), β-aktin dari ikan medaka
dan keratin dari ikan flounder Jepang. Transfer gen GFP dilakukan
menggunakan metode elektroporasi dengan mesin gen pulsher. Untuk
memperoleh embrio somatik K. alvarezii untuk proses transgenesis, dilakukan
perbaikan media kultur yang telah dikembangkan oleh Reddy et al. (2003) ;
Suryati dan Mulyaningrum (2009) dengan menambahkan zat pengatur tumbuh
dengan berbagai rasio.
1. 2 Perumusan Masalah
Indikator keberhasilan dan tujuan akhir dari transgenesis adalah
diekspresikannya gen target, sehingga permasalahan utamanya adalah bagaimana
satu faktor penting dalam proses ekspresi gen adalah promoter yang digunakan
untuk mengatur ekspresi gen, ekspresinya stabil atau temporer. Oleh karena itu,
penggunaan promoter yang tepat akan menjamin keberhasilan proses transgenesis.
Mengingat adanya perbedaan aktivitas antar promoter, maka pada penelitian ini
dilakukan pengujian efektivitas beberapa promoter sehingga proses transgenesis
akan lebih optimal.
Permasalahan lain yang juga penting dalam keberhasilan transgenesis
adalah pada metode dan agen atau media introduksi. Salah satu metode introduksi
gen secara massal dan praktis adalah teknik elektroporator, sedangkan agen atau
media introduksi melalui sel embrio somatik hasil induksi kalus, dimana suspensi
sel embriogenik dapat digunakan sebagai material untuk transfer gen baik secara
individu sel ataupun kluster sel embriogenik sehingga dapat mempercepat tingkat
keberhasilan transgenesis. Suspensi sel embrio somatik ini juga dapat digunakan
sebagai bahan untuk kultur dan fusi protoplas (Supena 2008).
1. 3 Tujuan Penelitian
Tujuan penelitian ini adalah menguji dan melihat tingkat ekspresi gen
marker GFP (green fluorescent protein) yang diintroduksikan dengan promoter
berbeda pada sel embrio somatik rumput laut K. alvarezii menggunakan metode
elektroporasi.
Adapun manfaat yang diharapkan dari penelitian ini adalah memberikan
informasi mengenai efektivitas dari beberapa jenis promoter dalam mengatur
ekspresi gen GFP sebagai marker, sehingga promoter-promoter yang efektif
sebagai pengatur ekspresi gen target, selanjutnya dapat digunakan pada kegiatan
transgenesis rumput laut K. alvarezii dalam mengintroduksikan gen target yang
menyandikan karakter tertentu (tahan penyakit dan lingkungan yang ekstrim,
5
2 TINJAUAN PUSTAKA
2. 1 Rumput Laut Kappaphycus alvarezii
Rumput laut tergolong tanaman tingkat rendah, umumnya di alam tumbuh
melekat pada substrat tertentu seperti karang, lumpur, pasir, batu, benda keras
lainnya ataupun dapat melekat pada tumbuhan lain secara epifitik. Tanaman ini
tidak mempunyai akar, batang maupun daun sejati tetapi hanya menyerupai
batang yang disebut thallus. Untuk pertumbuhannya, rumput laut mengambil
nutrisi dari sekitarnya secara difusi melalui dinding thallusnya. Pada kegiatan
budidaya secara massal, petani pada umumnya melakukan perbanyakan secara
vegetatif dengan cara stek yaitu potongan thallus yang memiliki ci-ciri :
percabangan rimbun, warna cerah dan tidak terdapat cacat atau luka, kemudian
ditumbuhkan menjadi tanaman baru. Secara alamiah di perairan, selain
berkembang biak dengan vegetatif dan konjugatif juga dengan perkawinan antara
gamet jantan dan gamet betina (generatif) melalui thallus yang diploid yang
menghasilkan spora, pertemuan dua gamet membentuk zigot yang selanjutnya
berkembang menjadi sporofit, individu baru inilah yang mengeluarkan spora dan
berkembang melalui pembelahan dalam sporogenesis menjadi gametofit
(Anggadiredja 2006). Lebih lanjut Othmer (1968) menyebutkan secara taksonomi
rumput laut dikelompokkan ke dalam divisio Thallophyta/Rhodophyta.
Berdasarkan kandungan pigmennya, K. alvarezii dikelompokkan dalam kelas
Rhodophyceae (ganggang merah), bangsa Gigartinales, suku Solierisceae, marga
Eucheuma.
Eucheuma sp menghasilkan metabolit primer senyawa hidrokoloid yang
disebut karaginan (carrageenan) sehingga disebut pula rumput laut
carrageenophyte (karaginofit). Didasarkan pada stereotipe struktur molekul dan
posisi ion sulfatnya, karaginan dibedakan menjadi tiga macam yaitu :
iota-karaginan, kappa-karaginan dan lamda-iota-karaginan, ketiganya berbeda dalam sifat
gel dan reaksinya terhadap protein. Dari dasar ini sehingga para ahli taksonomi
dan klassifikasi menggolongkan Eucheuma cottonii ke dalam kappa-karaginan
karena sifatnya menghasilkan gel yang kuat (rigid) dan sepakat merubah nama
Ciri-ciri K. alvarezii yaitu thallus silindris, permukaan licin, cartilageneus
menyerupai tulang rawan muda, serta berwarna hijau terang, hijau olive dan
coklat kemerahan, tetapi warna thallus tidak menjadi pedoman utama dalam
klasifikasi dan pengenalan jenis karena tidak stabil dan sangat dipengaruhi oleh
substrat dan lingkungan perairan dimana rumput laut tumbuh dan dibudidayakan.
Percabangan thallus berujung runcing atau tumpul, ditumbuhi nodulus (tonjolan),
dan duri lunak atau tumpul untuk melindungi gametangia. Percabangan bersifat
alternatus (berseling), tidak teratur serta dapat bersifat dichotomus (percabangan
dua-dua) atau trichotomus (sistem percabangan tiga-tiga).
2. 2 Induksi KalusdanEmbrio Somatik
Kalus adalah sekumpulan sel aktif membelah dan tidak terorganisir
sebagai akibat pelukaan tanaman di alam ataupun setelah diinduksi dengan
auksin dan sitokinin dalam kultur in vitro (Wattimena et al. 1992). Ciri-ciri
kalus dapat dilihat dengan adanya massa sel yang tumbuh dan tidak terorganisir
dari hasil proses dediferensiasi eksplan, berupa dinding sel tipis dan saling
terpisah, sel tumbuh keluar dari eksplan. Terdapat beberapa jenis kalus,
misalnya kompak (keras) atau friable (remah), hal ini sangat dipengaruhi
perimbangan zat pengatur tumbuh seperti auksin dan sitokinin (Supena 2008).
Inisiasi kultur embrio somatik dengan mengkulturkan eksplan pada media
yang kaya zat pengatur tumbuh (ZPT) dan proliferasi kultur embriogenik dapat
dilakukan baik pada medium padat ataupun cair dengan penambahan ZPT.
Kemudian untuk perkembangan embrio somatik lebih lanjut pada medium tanpa
ZPT dimaksudkan agar terjadi proses penghambatan proliferasi tetapi tetap
menstimulasi pembentukan embrio somatik, dan salah satu hal yang harus
diperhatikan pada tahap pendewasaan embrio somatik adalah mengatur potensial
osmotik medium dengan penambahan sukrosa atau polyethylene glycol (Arnold
et al. 2003 dalam Supena 2008).
Kalus yang terbentuk dari eksplan pada tahap inisiasi disebut kalus primer,
dimana kalus umumnya mudah terbentuk pada media semi padat dengan
tambahan auksin pada konsentrasi yang relatif tinggi, sedangkan untuk
7
dapat menghambat terutama pada jaringan yang memiliki kemampuan
embriogenik tinggi. Kalus yang dihasilkan ada yang memiliki kemampuan
membentuk embrio somatik dan ada yang sama sekali tidak memiliki
kemampuan morfogenetik. Hal ini disebabkan karena eksplan yang dikulturkan
mengandung sel atau jaringan dimana ada yang mampu mengadakan
morfogenesis disebut sel yang kompoten dan ada yang tidak mampu disebut sel
yang tidak kompoten. Ekspresi dari sel kompoten ini bergantung pada
kesesuaian medium yang digunakan terutama jenis ZPT maupun konsentrasinya
yang tepat (Wattimena et al. 1992).
Embriogenesis berdasarkan asalnya dikenal dua tipe : embriogenesis
zigotik yaitu dimulai dari sel telur yang telah dibuahi atau zigot dengan kondisi
in vivo ataupun in vitro, dan embriogenesis non zigotik diantaranya
embriogenesis somatik yaitu embrio terbentuk dari sel-sel sporofitik atau
somatik bukan zigot baik secara langsung maupun tidak langsung, in vitro
ataupun in vivo (Supena 2008). Beberapa kelebihan embriogenesis somatik
antara lain berasal dari individu sel sehingga penyeragaman dan pemurnian
tanaman regeneran lebih mudah, suspensi sel embrio somatik dapat digunakan
sebagai bahan untuk kultur protoplas, dapat digunakan sebagai material untuk
transfer gen baik secara individu sel ataupun kluster sel embrio somatik (Supena
2008).
Embrio somatik yang terbentuk pada medium yang mengandung auksin
tinggi, hanya akan berkembang lebih lanjut bila dipindahkan ke medium tanpa
auksin atau dengan auksin konsentrasi rendah. Embrio somatik dapat dihasilkan
dalam jumlah besar dari kultur kalus, namun untuk tujuan perbanyakan skala
besar dapat ditingkatkan melalui inisiasi embriogenik dengan kultur suspensi
yang berasal dari kalus primer (Wattimena et al. 1992).
2. 3 Transgenesis
Teknologi transgenesis merupakan suatu proses mengintroduksi DNA
asing ke organisme lain dengan maksud untuk memanipulasi struktur genetiknya
(Glick & Pasternak 2003). Gen yang disisipkan ke dalam genom tanaman harus
stabil diwariskan ke generasi berikutnya. Gen-gen yang diekspresikan pada
tanaman pada awalnya adalah gen-gen asli dari sumbernya : bakteri, jamur,
hewan, namun kebanyakan ekspresi dari gen tersebut di dalam tanaman sangat
rendah. Hal ini antara lain disebabkan oleh penggunaan promoter yang tidak
sesuai. Oleh karena itu modifikasi penggunaan promoter yang sesuai dengan
tanaman target telah umum dilakukan untuk meningkatkan ekspresi gen di dalam
tanaman. Selain itu penambahan enhancer dikombinasikan dengan penggunaan
promoter kuat atau promoter spesifik dapat meningkatkan ekspresi gen pada
tanaman.
Beberapa penelitian menunjukkan bahwa apabila gen telah terintegrasi
pada genom tanaman maka gen tersebut akan stabil diwariskan ke generasi
berikutnya. Hiei et al. (1997) melaporkan bahwa transgen stabil diwariskan
hingga generasi ke-4, hal yang sama juga dilaporkan oleh Wu et al. (2002) di
mana transgen stabil diwariskan hingga generai ke-6, tetapi Rashid et al. (1996)
melaporkan tentang adanya kemungkinan terjadinya pembungkaman gen yaitu
salah satu fenomena yang menyebabkan terjadinya kegagalan dalam
mengekspresikan gen.
2. 4 Promoter
Salah satu elemen penting yang harus diperhatikan pada transformasi gen
adalah promoter. Glick dan Pasternak (2003) menyatakan promoter adalah bagian
dari DNA dimana RNA polymerase menempel. Promoter merupakan salah satu
penentu dan pengatur spatial-temporal ekspresi gen sehingga promoter bisa
dianalogikan sebagai switch suatu gen.
Promoter merupakan sekuen DNA yang terletak upstream (terminal 5’)
dari titik awal transkripsi suatu gen yang berperan dalam mengatur letak, waktu
dan tingkat ekspresi gen yang akan muncul (Beaumont & Hoare 2003). Menurut
Glick dan Pasternak (2003), suatu promoter yang kuat merupakan promoter yang
memiliki aktivitas yang tinggi terhadap RNA polymerase yang mengakibatkan
daerah yang berbatasan downstream dicetak secara teratur. Promoter inilah yang
9
sangat tinggi dan juga potensial dalam mempengaruhi gen yang lain dalam suatu
organisme (Anderson 2004).
Fungsi promoter adalah untuk mengarahkan RNA polymerase sehingga
transkripsi akan terjadi pada daerah yang spesifik. Promoter ada yang bekerja di
semua jenis jaringan atau sel (ubiquitous) dan ada yang bekerja pada jaringan
spesifik (Hackett 1993). Promoter dikatakan efektif apabila gen penanda yang
disambungkan ke promoter yang dikendalikannya dapat terekspresi dengan level
yang tinggi.
Promoter terletak di depan sebuah gen sebelum kodon (tiga pasang basa)
pemula ATG yang mengkode asam amino metionin. Umumnya pada organsime
eukaryotik seperti hewan dan tanaman, promoter memiliki bagian nukleotida
TATAAA yang bisa menempel pada protein khusus dan membantu terbentuknya
kompleks transkripsi RNA polymerase. Dari sinilah terjadi pengaturan oleh faktor
transkripsi dimana suatu gen mengalami on atau off. Selain itu promoter
merupakan bagian penting dari suatu gen yang kondisinya bisa diganggu oleh
faktor-faktor lainnya seperti enhancer (perangsang transkripsi) atau silencer
(penghambat transkripsi). Promoter ada yang terlihat efek penampakan pada
suatu organ tertentu saja, artinya promoter yang spesifik hanya bekerja pada
jaringan atau organ tertentu dan ada pula yang bekerja secara konstitutif dalam
arti bisa terekspresi dimana saja dan efek penampakan pada seluruh bagian organ
tanaman.
Beberapa promoter konstitutif yang sering dipakai untuk studi bioteknologi
tanaman dan hewan adalah promoter CaMV 35S (cauliflowermozaicvirus) yang
ditemukan oleh Chua pada tahun 1980-an yang merupakan promoter kuat untuk
tanaman dikotil (Nagy 1985) dan promoter CMV (cytomegalovirus) dari virus
manusia (Dunham 2004). Juga telah banyak promoter diisolasi dari dan dapat
aktif pada berbagai spesies ikan seperti promoter β-aktin ikan medaka (Takagi et
al. 1994) dan promoter keratin yang diisolasi dari ikan flounder Jepang (Hirono et
al. 2003). Walaupun berdasarkan beberapa penelitian penggunaan promoter
homolog menghasilkan ekspresi gen lebih baik dibandingkan dengan promoter
heterolog. Menurut Palmiter et al. (1982) dalam Nam et al. (2008) bahwa suatu
mengenal RNA polimerase inang yang mengendalikan ekspresi gen. Namun,
beberapa promoter β-aktin heterolog yang telah digunakan dalam penelitian
transgenesis dapat menghasilkan ekspresi gen yang baik pada ikan uji seperti
penelitian yang dilakukan oleh Yoshizaki (2001) dengan menggunakan β-aktin
dari ikan medaka ternyata mampu mengekspresikan gen GFP yang kuat pada ikan
rainbow trout.
2. 5 Gen Marker GFP (green fluorescent protein)
Penemuan GFP atau gen berpendar lainnya merupakan awal
berkembangnya pengujian transfer gen ke inang target khususnya dalam analisis
aktivitas sebuah promoter secara in vivo. Pengujian aktivitas promoter umumnya
dilakukan dengan cara introduksi konstruksi gen promoter yang telah
disambungkan dengan gen penanda misalnya GFP sehingga ekspresinya dapat
diamati (Takagi et al. 1994, Alimuddin 2003). Untuk mengetahui aktif atau
tidaknya promoter, uji aktivitas promoter ke inang dengan memanfaatkan gen
berpendar GFP sebagai gen penanda (Chou et al. 2001). Gen GFP mempunyai
keunggulan yaitu tidak memerlukan substrat tambahan untuk ekspresinya,
memiliki kandungan protein yang berpendar dan dapat divisualisasikan
ekspresinya pada sel dengan menggunakan sinar UV (Chalfie 1994 dalam
Iyengar et al. 1996). Gen GFP dapat berfungsi sebagai penanda (marker) dalam
pengujian efektivitas suatu promoter (Chalfie et al. 1994).
Gen GFP awalnya diisolasi dari ubur-ubur (Aequorea victoria) yang
memancarkan cahaya hijau berpendar dengan kuat dan stabil. Perkembangan saat
ini, banyak GFP yang mengalami mutasi dengan fluoresence lebih kuat yaitu
fluorescence enhanced GFP (EGFP) (Arai et al. 2001). Namun, Felts et al.
(2001) berhasil mengisolasi gen hrGFP (humanized Renilla reniformis Green
Fluorescent Protein) yang berasal dari Anthozoa (soft coral). Kelebihan dari
hrGFP dibandingkan dengan EGFP adalah memiliki intensitas fluoresen lebih
tinggi, lebih konsisten, lebih rendah tingkat sitotoksitasnya, kisaran stabilitas pH
yang lebih luas dan lebih resisten terhadap pelarut organik, detergen serta
11
modifikasi satu atau lebih kodon yang tidak sesuai menjadi susunan kodon yang
cocok untuk sel manusia.
2. 6 Teknik Transfer Gen dengan Elektroporator
Teknik dan metode transfer gen yang umum digunakan antara lain : alat
penembak DNA (gen gun) atau ballistic bombardment (Gendreau et al. 1995),
mikroinjeksi (Li & Tsai 2000), alat elektroporator (Arenal et al. 2000; Tseng et
al. 2000), penggunaan Agrobacterium sebagai agen infeksi, dan metode
transfeksi. Metode tersebut masing-masing mempunyai kelebihan dan
kekurangan, sehingga pemilihan metode juga tergantung pada media atau agen
introduksinya.
Pada hewan akuatik, mikroinjeksi merupakan metode yang umum
digunakan (Chourrout et al. 1986). Dibandingkan dengan mikroinjeksi,
elektroporasi merupakan teknik yang lebih mudah dalam pengerjaannya (Inoue et
al. 1990). Beberapa keuntungan aplikasi elektroporasi antara lain : teknik ini
merupakan teknik transfer gen secara masal. Aplikasi kejutan listrik pada suspensi
sel menginduksi polarisasi komponen membran sel dan mengembangkan potensi
tegangan di seluruh membran. Pada saat perbedaan potensial antara bagian dalam
dan luar membran sel melewati titik kritis, komponen membran direorganisasi ke
dalam pori dalam area terlokalisasi, dan kemudian sel menjadi permeabel terhadap
masuknya makromolekul (Knight 1981; Knight & Scrutton 1986). Proses
modifikasi permeabilitas membran sel melalui medan listrik disebut elektroporasi.
Perubahan permeabilitas bersifat sementara, dengan syarat kejutan listrik tidak
melebihi batas kritis bagi sel (Tsong 1983; Serpeusu et al. 1985). Ukuran pori
dapat diubah melalui berbagai panjang kejutan (dalam milliseconds), medan listrik
(dalam volts/sentimeter), dan kekuatan ionik media (Tsong, 1983).
3 BAHAN DAN METODE
3. 1 Waktu dan Tempat
Penelitian ini dilaksanakan sejak Februari 2009 sampai Mei 2010 pada
beberapa lokasi penelitian, meliputi: produksi embrio somatik rumput laut
Kappaphycus alvarezii melalui induksi kalus di Laboratorium Kultur Jaringan
Pusat Penelitian Sumberdaya Hayati dan Bioteknologi Institut Pertanian Bogor
dan Laboratorium Kultur Jaringan Balai Riset Perikanan Budidaya Air Payau
Maros. Kegiatan perbanyakan plasmid gen GFP di Laboratorium Reproduksi dan
Genetik Organisme Akuatik Departemen Budidaya Perairan Fakultas Perikanan
Ilmu Kelautan Institut Pertanian Bogor, sedangkan kegiatan introduksi gen
metode elektroporator menggunakan gen pulsher dan analisis ekspresi dengan
mikroskop fluoresen di Laboratoria Pengembangan Teknologi Industri Agro dan
Biomedika Balai Pengkajian Penerapan Teknologi (LAPTIAB-BPPT) Serpong,
serta beberapa kegiatan terkait dan kegiatan pendukung lainnya di Laboratorium
Genetik dan Laboratorium BIORIN Pusat Penelitian Sumberdaya Hayati dan
Bioteknologi Institut Pertanian Bogor.
3. 2 Konstruksi Gen Uji dan Perbanyakan Plasmid
Empat jenis konstruksi gen GFP yang dikendalikan oleh promoter berbeda
diuji dalam penelitian ini. Keempat konstruksi gen tersebut adalah pCMV-GFP
(Clontech), pCaMV-GFP (pemberian Dr. Akashi-NAIST), pmBA-GFP (Takagi et
al. 1994) dan pJfKer-GFP (Yazawa et al. 2005). pCMV-GFP dikendalikan oleh
promoter cytomegalovirus, pCaMV-GFP oleh promoter cauliflower mosaicvirus,
pmBA-GFP oleh promoter β-aktin ikan medaka, dan pJfKer-GFP oleh promoter
keratin dari ikan flounder Jepang. Promoter-promoter tersebut telah tersimpan di
dalam bakteri Escherichia coli, selanjutnya diisolasi dan diperbanyak dengan
menggunakan kit Illustra “plasmid Prep Mini Spin Kit”.
Isolasi dan produksi massal dimulai dengan bakteri konstruksi hasil
rekultur diambil menggunakan jarum ose, dimasukkan ke dalam media 2xYT cair
sebanyak 8 ml dengan penambahan kanamisin 1 : 1000 menggunakan tabung L
13
atau keruh (kurang lebih 20 jam). Dipindahkan sebanyak 1,5 ml ke tube baru dan
diflash selama 30 menit pada 1200 rpm dengan suhu 4oC kemudian supernatan
dibuang, sampai suspensi bakteri habis terpindah ke tube dari tabung L. Endapan
yang terkumpul ditambahkan larutan flexi prep-1 sebanyak 200 µl kemudian
divorteks keras sampai semua endapan tercampur homogen dan tambahkan lagi
larutan flexi prep-2 sebanyak 200 µl kemudian divorteks dengan lembut, dibolak
balik sampai terbentuk menyerupai benang putih pada saat tutup tube dibuka.
Ditambahkan larutan flexi prep-3 sebanyak 200 µl kemudian dibolak balik keras
sampai tercampur dengan baik ditandai adanya warna putih, disentrifugasi selama
5 menit pada 1200 rpm suhu ruang, dipindahkan ke tube baru dan disentrifugasi
lagi. Kemudian dipindahkan ke tube yang telah berisi isopropanol 420 µl,
divorteks pelan, diinkubasi selama 10 menit pada suhu ruang, disentrifugasi pada
1300 rpm selama 15 menit, dibuang isopropanolnya. Ditambahkan sephaglass
150 µl, divorteks keras sampai larut dengan baik atau kurang lebih 1 menit,
disentrifugasi pada 1300 rpm selama 30 detik, supernatan dibuang, ditambahkan
200 µl wash buffer, divorteks selama 1 menit, disentrifugasi 30 detik pada 1300
rpm, wash buffernya dibuang. Ditambahkan 300 µl ethanol 70% dingin, divorteks
selama 1 menit, disentrifugasi pada 1300 rpm selama 30 menit, dibuang
ethanolnya, dan dikering udarakan selama 10 menit. Ditambahkan 30 µl akuades
steril (SDW), divorteks selama 5 menit, diinkubasi pada suhu ruang,
disentrifugasi 1300 rpm selama 1-2 menit, diambil dengan pipet steril.
Selanjutnya, untuk meyakinkan kegiatan isolasi dan perbanyakan plasmid
konstruksi gen yang telah dilakukan, sebagian DNA hasil isolasi divisualisasi
dengan bantuan UV transluminator GelDoc (Labquip) yang sebelumnya
dielektroforesis pada 0,8% gel agarosa yang diwarnai dengan etidium bromida 1,5
µg/ml, sedangkan yang lainnya siap digunakan untuk proses introduksi.
3. 3 Produksi Sel Embrio Somatik K. alvarezii melalui Induksi Kalus
Kegiatan produksi sel embrio somatik rumput laut K. alvarezii melalui
induksi kalus menggunakan metode seperti yang dilakukan Reddy et al. (2003) ;
3. 3. 1 Penyediaan dan Pemeliharaan Sumber Inokulum
Tahap ini bertujuan untuk menyediakan sumber inokulum untuk kegiatan
induksi kalus. Rumput laut hasil budidaya dari lapangan dicuci dengan air laut
sampai bersih kemudian dipotong-potong 2-3 cm (eksplan), ditampung pada botol
yang berisi air laut steril (Lampiran 1). Eksplan selanjutnya dibilas larutan betadin
1% kemudian dicuci air laut steril sampai 3 kali. Sterilisasi eksplan dilanjutkan
dengan 0,1% antibiotik mix spektrum luas (streptomisin, kanamisin, terramisin,
rifampisin, penisillin G) kemudian dicuci air laut steril sampai 3 kali. Untuk
inisiasi, proliferasi dan pemeliharaan sekaligus menguji stabilitas eksplan
sebelum digunakan, dapat dikarantina terlebih dahulu dengan memelihara pada air
laut steril yang mengandung media tumbuh conway 2 ppm pada suhu ruang 25oC
dengan intensitas cahaya 1500 lux dan disaker dengan kecepatan 100 rpm.
3. 3. 2 Induksi dan Pembentukan Kalus
Potongan thallus (eksplan) yang telah diiris setebal 2-3 mm ditanam pada
botol kultur steril yang berisi 20 ml media agar pada beberapa konsentrasi
sebagai perlakuan yakni : 0,6 ; 0,8 ; 1,0 ; dan 1,5%). Setiap botol kultur
ditanami sepuluh irisan. Media perlakuan terdiri dari media kultur conway 2
ppm (Lampiran 2) dan masing-masing ditambah dua jenis zat pengatur tumbuh
dengan tiga taraf (rasio IAA : kinetin) yaitu : 0,5 : 0,0 ; 1,0 : 1,0 ; 2,0 : 0,2 ppm.
Setelah inokulasi, botol kultur berisi biakan ditutup dengan baik dan dilapisi
plastik pembungkus makanan (cling wrap) untuk menghindari kontaminasi.
Biakan diletakkan dan dipelihara dalam ruang kultur pada suhu ruang 25oC,
intensitas cahaya 1500 lux. Pemeliharaan dilakukan selama 2(dua) bulan atau
sampai induksi kalus stabil, dimana pergantian media kultur dilakukan setiap 30
hari dengan media baru yang sama. Untuk melihat efisiensi induksi kalus
dihitung berdasarkan persentase jumlah eksplan yang terinduksi setiap botol.
Pengamatan secara mikroskopik hanya dilakukan untuk kalus-kalus yang
diduga bersifat embriogenik. Tahapan-tahapan perkembangan sel embriogenik
dilakukan di bawah mikroskop yang dilengkapi peralatan foto untuk
15
3. 3. 3 Regenerasi Massa Sel Embrio Somatik K. alvarezii
Setelah dua bulan kultur pada tahap induksi kalus, kalus-kalus yang
diduga bersifat embriogenik (mengandung sel-sel embrio somatik) dikultur lebih
lanjut pada dua tahapan regenerasi yaitu pada media agar semi solid dan kultur
cair :
Kultur Sel Embrio Somatik pada Media Agar Semi Solid
Kalus diiris tipis dan disubkultur ke dalam petridish yang berisi media
conway sebanyak 20 ml dan zat pengatur tumbuh pada berbagai dosis (rasio IAA
: kinetin yaitu : 0,1 : 1.0 ; 0,0 : 0,1 ppm dan tanpa keduanya) dengan persentase
agar media berbeda yaitu : 0,4 ; 0,6 ; dan 0,8%. Petridish berisi kultur embrio
somatik ditutup dengan baik dan dilapisi plastik pembungkus makanan (cling
wrap) untuk menghindari kontaminasi. Selanjutnya dipelihara dalam ruang kultur
pada suhu ruang 25oC dengan intensitas cahaya 1500 lux. Masa pemeliharaan
selama 2(dua) bulan dengan pergantian media kultur dilakukan setiap 40-45 hari
dengan media baru yang sama. Massa sel disampling untuk diamati
perkembangan selnya menggunakan mikroskop dan didokumentasikan serta
diuraikan secara deskriptif, sedangkan panjang sel diukur menggunakan
mikrometer okuler.
Kultur Sel Embrio Somatik pada Media Cair
Massa sel embrio somatik hasil regenerasi pada media agar semi solid
diangkat dan dipindahkan dengan pinset steril ke dalam conical flask yang berisi
media kultur cair yang diperkaya conway 2 ppm tanpa zat pengatur tumbuh.
Conical flask selanjutnya diletakkan di ruang kultur dan disaker dengan kecepatan
100 rpm, dengan lama pemeliharaan satu bulan atau sampai terbentuk seperti
filamen (bakal planlet). Selama pemeliharaan, dilakukan sampling secara aseptik
untuk mengamati perkembangan selnya.
3. 4 Introduksi Gen dan Analisis Ekspresi
Secara garis besar pada tahapan ini terdiri dari dua kegiatan utama,
meliputi : (1). Introduksi gen GFP ke sel embrio somatik rumput laut
Kappaphycus alvarezii metode elektroporator, dan (2). Analisis ekspresi GFP
3. 4. 1 Introduksi Gen GFP ke Sel Embrio Somatik K. alvarezii
Elektroporasi dilakukan dengan menggunakan mesin Gene Pulser II
(Biorad, USA). Kuvet sebelum digunakan direndam dalam larutan alkohol 95%
kemudian dikeringkan dengan oven 65oC, pemilihan type kuvet sesuai kebutuhan
(tersedia tipe 2 mm dan 4 mm untuk masing-masing maksimun volume 200 µl
dan 400 µl). Massa sel embriogenik somatik K. alvarezii yang telah berbentuk
filamen dicampur dengan masing-masing plasmid gen GFP kedalam tube baru
secara aseptik (sebelumnya uji pendahuluan dosis plasmid yang optimal diperoleh
100 ng/µl). Kemudian suspensi sel embrio somatik sebanyak 200 µl (setara 12 x
103
Ekspresi gen GFP diamati menggunakan mikroskop fluoresen (Olympus
BH2-RFCA) yang dilengkapi reflected light fluorescent attachment (BH2-RFC2).
Pengamatan dilakukan setiap jam sejak jam pertama setelah elektroporasi sampai
ekspresi GFP menjadi stabil. Sel embrio somatik yang mengekspresikan GFP
diamati tingkat ekspresinya dan persentase sel berpendar diperoleh dengan cara
menghitung sel yang berpendar dari keseluruhan sel yang diamati di setiap bidang sel) yang sudah ditambahakan plasmid (100 ng/µl), dipipet ke dalam kuvet
type 2 mm tepat di lubang sampelnya. Kuvet yang telah berisi sampel dimasukkan
ke mesin gen pulsher, kemudian diset sesuai keperluan untuk mendapatkan
kombinasi yang optimal antara voltase, lama kejutan (pulse length), jumlah
kejutan (pulse number) dan interval kejutan (pulse interval). Hasil uji
pendahuluan kombinasi yang optimal dan dapat memaksimalkan introduksi gen
tetapi tidak merusak viabilitas sel target dari inang, yaitu : 300 V dengan lama
kejutan 0,5 milidetik, jumlah kejutan 4 kali dan interval kejutan 0,1 detik. Setelah alat bekerja, keluaran hasil kerja alat pada display dicatat untuk mengevaluasi
konsistensi kerja alat berhubungan dengan optimalisasi introduksi gen, seperti :
volt output, persentase droop. Kuvet dikeluarkan dari mesin gen pulsher, suspensi
sel yang telah di elektroporasi dikeluarkan dari kuvet menggunakan pipet dengan
hati-hati jangan sampai ada yang tersisa, kemudian dipindahkan ke tube baru dan
selanjutnya siap diamati atau dipelihara pada media kultur lebih lanjut.
3. 4. 2 Analisis Ekspresi Gen
17
pandang pengamatan di mikroskop. Pengambilan sampling bidang pandang
dilakukan secara acak dan dilakukan sebanyak 5 (lima) kali untuk mendapatkan
rata-rata persentase sel sebagai representasi dari jumlah keseluruhan sel yang
dielektroporasi (12x103
3. 4. 2. 3 Deteksi DNA Transforman dengan Polymerase Chain Reaction Purifikasi DNA Genom Transforman
DNA diekstraksi menggunakan kit “Puregene DNA purification KIT –
USA” diawali dengan melisis sel dan RNase teatment, dengan cara : sampel hasil
perlakuan masing-masing 5-20 mg dimasukkan ke dalam microtube bervolume
1,5 ml yang telah berisi 200 µl cell lysis solution dan 1,5 µl proteinase K, larutan
dihomogenisasi dengan vorteks kemudian diinkubasi pada suhu 55
). Tingkat ekspresi GFP dikelompokkan dengan kategori
hijau lemah, sedang dan kuat.
3. 4. 2. 2 Penapisan Transforman dan Regenerasi pada Media Seleksi
Transforman yang mengekspresikan gen GFP ditapis dan diseleksi lebih
lanjut dengan cara mengkultur embrio somatik hasil elektroporasi pada media
agar semi solid 0.6% yang diperkaya conway 2 ppm yang mengandung
antibiotik kanamisin 100 ppm, sesuai antibiotik bawaan yang terdapat dalam peta
konstruksi gen (dosis diperoleh dari hasil uji pendahuluan sebelumnya).
Pemeliharaan dilakukan selama 2(dua) bulan atau sampai regenerasi stabil,
dimana pergantian media kultur dilakukan setiap 30 hari dengan media baru yang
sama. Pertumbuhan dan regenerasi sel embrio somatik diamati menggunakan
mikroskop.
o
C semalaman
atau sampai lisis dengan sempurnah. Sampel yang telah lisis, dibiarkan sampai
mencapai suhu ruang kemudian ditambahkan 1,5 µl RNase dan dihomogenkan
dengan membolak balik microtube secara perlahan sebanyak 25 kali, inkubasi
pada suhu 37oC selama 1 jam kemudian disimpan pada es (on ice) selama 5
menit. Selanjutnya presipitasi protein dengan menambahkan 100 µl protein
precipitation solution ke dalam sel lisis yang telah ditreatmen RNase kemudian
divorteks selama 30 detik agar tercampur dengan merata. Sample disimpan pada
Amplifikasi DNA Transforman dengan PCR
Amplifikasi DNA hasil ekstraksi menggunakan mesin PCR (polymerase
chain reaction). Primer yang digunakan adalah GFP-F
5’-GGTCGAGCTGGACGG- 3’ dan GFP-R 5’- ACGAACTCCAGCAGG- 3’.
Proses PCR dijalankan pada suhu pre-denaturasi 94oC selama 3 menit; 35 siklus
untuk denaturasi 94oC selama 30 detik, annealing 62oC selama 30 detik, ekstensi
72oC selama 1 menit ; dan final ekstensi 72oC selama 3 menit, selanjutnya
penyimpanan sementara pada suhu 4oC. Untuk melihat pita yang terbentuk, hasil
PCR dielektroforesis pada gel agarose 1% dengan voltase 200 V dan kuat arus 70
19
4 HASIL DAN PEMBAHASAN
4. 1. Produksi Sel Embrio Somatik K. alvarezii melalui Induksi Kalus
4. 1. 1 Induksi dan Pembentukan Kalus
Eksplan yang terinduksi pada tahapan induksi kalus ditandai dengan
tumbuhnya massa sel yang tidak terorganisir, sel tumbuh keluar dari eksplan,
dengan jenis dan tipe kalus friable atau remah (Gambar 1A), sedangkan eksplan
yang gagal induksi ditandai dengan tidak terbentuknya sel-sel kalus, bahkan
eksplan mengalami pemucatan dan akhirnya mati (Gambar 1B). Pada Gambar 2,
hasil penelitian ini menunjukkan bahwa induksi kalus tertinggi diperoleh pada
rasio IAA : kinetin = 1,0 : 1,0 ppm dengan konsentrasi agar media 0,8% (90±
0,0%) dan 1,0 % (90± 10,0%). Hal ini dapat berlangsung karena keseimbangan
rasio ZPT antara IAA dan kinetin, dimana keduanya dibutuhkan dalam proses
induksi. Peran IAA yang (tergolong kelompok ZPT auksin) terlibat dalam banyak
proses fisiologis tumbuhan, antara lain : pemanjangan sel dan pembentukan kalus
(Harjadi 2009) dan juga atas sinergisitas peran dari kinetin (tergolong kelompok
ZPT sitokinin) dimana peran fisiologis sitokinin adalah mendorong pembelahan
sel, morfogenesis, dan pembentukan kloroplas (Wattimena et al. 1992).
Gambar 1 Karakteristik induksi kalus pada rumput laut K. alvarezii setelah 2 bulan kultur : (A) Morfologi eksplan yang terinduksi, dan (B) Gagal (tidak) terinduksi.
Tingkat induksi kalus pada rasio ZPT IAA : kinetin = 0,5 : 0,0 ppm
dengan konsentrasi agar media 1,5% menghasilkan tingkat induksi lebih rendah
dari perlakuan lainnya (50±10,0%), hal ini diduga karena tidak ditambahkannya
kinetin (0 ppm) sementara peran fisiologisnya tetap dibutuhkan dalam proses
A 8 mm B
Rasio ZPT (ppm)
induksi kalus walaupun dalam jumlah kecil. Keberhasilan induksi kalus pada
penelitian ini sedikit lebih tinggi daripada yang dilaporkan oleh Raddy et al.
(2003), dimana tingkat induksi kalus tertinggi yang diperoleh (80%) dengan
kombinasi ZPT NAA : BAP (1 :1 ppm).
Gambar 2 Pengaruh perlakuan rasio ZPT dan konsentrasi agar media terhadap tingkat induksi kalus pada rumput laut Kappaphycus alvarezii
Hasil penelitian ini juga menunjukkan bahwa tingginya tingkat induksi
didukung oleh konsentrasi agar yang sesuai. Pada konsentrasi 0,8 dan 1,0%
merupakan konsentrasi agar media induksi yang sesuai untuk induksi kalus K.
alvarezii. Hal ini diduga disebabkan karena pada konsentrasi agar media induksi
terlalu tinggi (1,5%) menyebabkan tingkat kerapatan dan kepadatan massa media
juga tinggi sehingga mempengaruhi tingkat penyerapan nutrien dan secara tidak
langsung berpengaruh pada proses induksi (Suryati & Mulyaningrum 2009).
Selanjutnya dijelaskan bahwa konsentrasi agar media yang terlalu rendah (0,6%)
dapat menyebabkan porisitas, kekenyalan dan kepadatan massa media sangat
labil. Namunpun demikian tingkat induksi pada konsentrasi agar media 0,6%
masih lebih baik dari konsentrasi agar media 1,5%. Penelitian Suryati dan
Mulyaningrum (2009) memperoleh tingkat induksi hanya 30% pada konsentrasi
agar 0,6%, banyak eksplan mengalami pemucatan sampai kematian dan pada
konsentrasi agar 1,2% eksplan mengalami dehidrasi dan ahirnya juga mengalami
21
4. 1. 2 Regenerasi Massa Sel Embrio Somatik K. alvarezii
Kultur Sel Embrio Somatik pada Media Agar Semi Solid
Hasil pengamatan (Gambar 3) menunjukkan bahwa pada kultur lebih
lanjut di media agar semi solid, ZPT tidak memberikan pengaruh antar perlakuan
terhadap penambahan massa sel embrio somatik (P>0,05). Hal ini menunjukkan
bahwa zat pengatur tumbuh bukan faktor pembatas untuk perkembangan sel
embrio somatik rumput laut K. alvarezii .
Gambar 3 Pengaruh perlakuan rasio ZPT dan konsentrasi agar media terhadap tingkat perkembangan massa sel pada kultur di media agar semi solid
Wattimena et al. (1992) menyebutkan bahwa pada awal proses
embriogenesis untuk menghasilkan sel embriogenik yang viabel, jaringan atau sel
perlu dilakukan subkultur ke media dengan auksin rendah atau tanpa auksin sama
sekali, bahkan kultur yang terlalu lama pada media dengan auksin tinggi sebelum
disubkultur dapat menghilangkan daya embriogenesisnya. Perkembangan massa
sel embrio somatik tertinggi (rata-rata diameter massa sel = 5±1,0 mm) diperoleh
pada perlakuan tanpa ZPT dengan konsentrasi agar 0,6% untuk masa
pemeliharaan 1 (satu) bulan (Gambar 4B), dan yang terendah diperoleh dari
perlakuan ZPT rasio IAA : kinetin = 0,1 : 1,0 dengan konsentrasi agar media 0,8%
(rata-rata diameter massa sel = 3± 1,0 mm), sedangkan perlakuan lainnya rata-rata
diameter massa sel adalah 4 mm, dimana massa sel embrio somatik pada awal
merupakan konsentrasi agar media pemeliharaan yang sesuai untuk regenerasi
massa sel embrio somatik pada media semi solid. Hal ini disebabkan
perkembangan awal sel membutuhkan porositas dan kerapatan media yang rendah
sehingga menunjang laju pertumbuhan yang maksimal. Pada penelitian Raddy et
al. (2003), diperoleh hasil perkembangan massa sel antara 1-5 mm dengan masa
pemeliharaan yang sama.
Gambar 4 Perkembangan massa sel embrio somatik K. alvarezii pada kultur media agar semi solid: A. Massa sel pada hari-1 kultur (bar = 0,2 mm), B. Massa sel pada umur 1 bulan kultur (bar = 5 mm). Tanda bulatan menunjukkan massa sel embrio somatik.
Kultur Sel Embrio Somatik pada Media Cair
Hasil pengamatan di bawah mikroskop, sel embrio somatik terbentuk
sebagai tunas baru dari permukaan sel dan memanjang ke daerah apikal dari
filamen (Gambar 5A), berasal dari sel dengan ukuran 3-5 µm selanjutnya
berkembang menjadi filamen baru sebagai bakal rumput laut muda (Gambar 5B).
Perkembangan sel embrio somatik dari sel tunggal dengan ukuran 3-4 µm,
menjadi dua sel, tiga sel, empat sel dan selanjutnya berkembang menjadi filamen
(Gambar 6) dengan masa kultur 1 (satu) bulan terjadi pemanjangan sel baru
rata-rata 5 mm ( Gambar 7).
Pada penelitian Raddy et al. (2003) menyebutkan bahwa embrio somatik
terjadi sebagai tunas kecil di atas permukaan dari sel-sel dan memanjang ke
daerah apikal dari filamen. Tunas ini berasal dari satu sel tunggal yang kecil
dengan ukuran <10 µm dengan ciri-ciri berisi sitoplasmik padat dan pigmentasi.
23
Gambar 5 (A) Tanda bulatan : sel embrio somatik berupa tunas baru yang tumbuh dari sel dan memanjang ke daerah apikal dari filamen, (B) Filamen yang merupakan kumpulan se-sel embrio somatik sebagai calon rumput laut K. alvarezii muda.
Gambar 6 Perkembangan sel embrio somatik K. alvarezii : (A) sel tunggal, (B) dua sel, (C) tiga sel, (D) empat sel, (E & F) menjadi filamen.
Gambar 7 Tanda bulatan : pemanjangan sel baru (rata-rata 0,5 mm) pada umur 1 bulan di kultur media cair.
Sel embrio somatik, selain pada fase ini dapat digunakan sebagai agen
introduksi gen untuk kegiatan transgenesis rumput laut, juga dapat digunakan
untuk kultur lebih lanjut menjadi calon rumput laut muda. Supena (2008)
menyebutkan bahwa beberapa kelebihan embrio somatik antara lain berasal dari
4µm 4µm 6µm
20µm 15µm 6µm
B C
E F
A
D
individu sel (satu sel somatik) sehingga penyeragaman dan pemurnian tanaman
regeneran lebih mudah, suspensi sel embrio somatik dapat digunakan sebagai
bahan untuk kultur protoplas, dapat digunakan sebagai material untuk transfer
gen baik secara individu sel ataupun kluster sel embrio somatik, sehingga dapat
mempercepat keberhasilan dengan peluang transformasi yang lebih tinggi.
4. 2 Introduksi Gen dan Analisis Ekspresi
4. 2. 1 Visualisasi Hasil Elektroporasi dengan Mikroskop Fluoresen
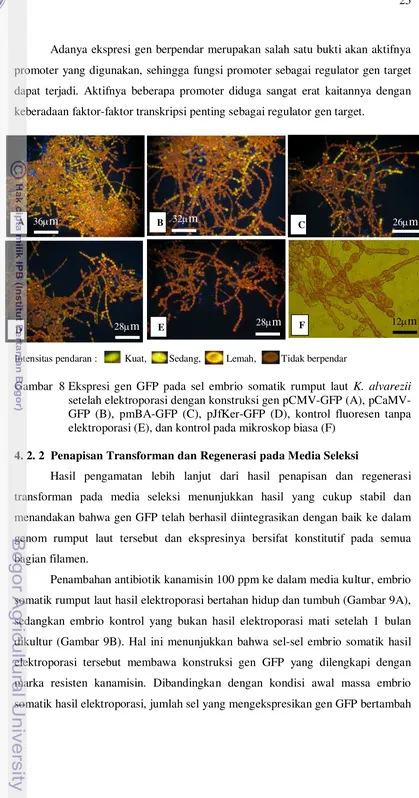
Pada massa sel embrio somatik hasil elektroporasi terlihat ada yang
berpendar hijau (Gambar 8A-D) sedangkan pada kontrol yang tidak
dielektroporasi tidak berpendar hijau (Gambar 8E-F). Hal ini menunjukkan bahwa
introduksi gen GFP menggunakan metode elektroporasi berhasil dilakukan pada
embrio somatik K. alvarezii. Selanjutnya, terdapat perbedaan persentase sel
berpendar dan intensitas pendaran GFP yang dikendalikan oleh promoter berbeda.
Persentase sel berpendar tertinggi diperoleh pada konstruksi pCMV-GFP, diikuti
oleh konstruksi pCaMV dan pmBA-GFP, dan yang terendah adalah pJfKer-GFP
(Tabel 1). Intensitas pendaran GFP yang dikendalikan oleh promoter CMV,
CaMV dan mBA adalah relatif sama yaitu tergolong sedang dan kuat, sedangkan
pada JfKer intensitasnya lemah (Tabel 1 dan Gambar 4). Demikian juga halnya
dengan waktu mulai GFP berpendar, yaitu pada pCMV-GFP lebih cepat
dibandingkan dengan pCaMV-GFP dan pmBA-GFP, dan yang paling lambat
adalah pJfKer-GFP. Perbedaan intensitas dan waktu awal ekspresi GFP ini
diduga disebabkan oleh perbedaan respons faktor cis pada promoter terhadap
faktor trans dari inang (Inyengar et al. 1996; Alimuddin 2003).
Tabel 1 Persentase sel berpendar, intensitas dan waktu mulai muncul pendaran GFP pada sel embrio K. alvarezii hasil elektroporasi dengan promoter berbeda (jumlah sel yang dielektroporasi = 12 x 103
Konstruksi gen pCaMV-GFP 10,48±0,25b sedang, kuat 2 pmBA-GFP 8,85±2,31b sedang, kuat 2
pJfKer-GFP 4,79±0,26c lemah 3
25
Adanya ekspresi gen berpendar merupakan salah satu bukti akan aktifnya
promoter yang digunakan, sehingga fungsi promoter sebagai regulator gen target
dapat terjadi. Aktifnya beberapa promoter diduga sangat erat kaitannya dengan
keberadaan faktor-faktor transkripsi penting sebagai regulator gen target.
Intensitas pendaran : Kuat, Sedang, Lemah, Tidak berpendar
Gambar 8 Ekspresi gen GFP pada sel embrio somatik rumput laut K. alvarezii setelah elektroporasi dengan konstruksi gen pCMV-GFP (A), pCaMV-GFP (B), pmBA-pCaMV-GFP (C), pJfKer-pCaMV-GFP (D), kontrol fluoresen tanpa elektroporasi (E), dan kontrol pada mikroskop biasa (F)
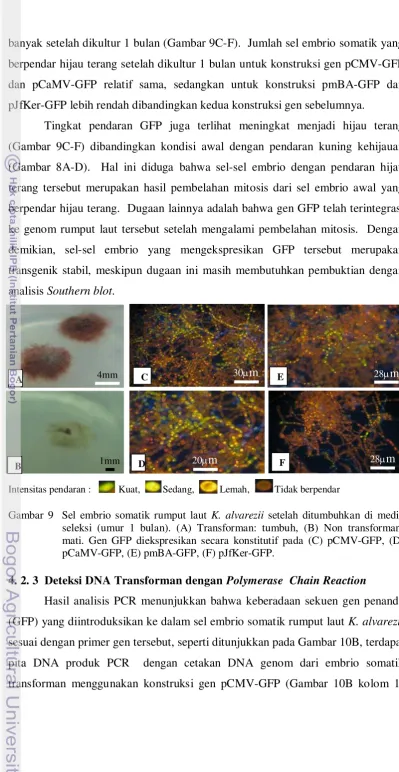
4. 2. 2 Penapisan Transforman dan Regenerasi pada Media Seleksi
Hasil pengamatan lebih lanjut dari hasil penapisan dan regenerasi
transforman pada media seleksi menunjukkan hasil yang cukup stabil dan
menandakan bahwa gen GFP telah berhasil diintegrasikan dengan baik ke dalam
genom rumput laut tersebut dan ekspresinya bersifat konstitutif pada semua
bagian filamen.
Penambahan antibiotik kanamisin 100 ppm ke dalam media kultur, embrio
somatik rumput laut hasil elektroporasi bertahan hidup dan tumbuh (Gambar 9A),
sedangkan embrio kontrol yang bukan hasil elektroporasi mati setelah 1 bulan
dikultur (Gambar 9B). Hal ini menunjukkan bahwa sel-sel embrio somatik hasil
elektroporasi tersebut membawa konstruksi gen GFP yang dilengkapi dengan
marka resisten kanamisin. Dibandingkan dengan kondisi awal massa embrio
somatik hasil elektroporasi, jumlah sel yang mengekspresikan gen GFP bertambah