STUDI HISTOPATOLOGI ORGAN LIMFOID MENCIT
(
Mus musculus
) DENGAN
PRETREATMENT
UNTUK
PENYIAPAN HEWAN PENELITIAN BIDANG BIOMEDIS
RIRIN ARIYANI
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Studi Histopatologi Organ Limfoid Mencit (Mus musculus) dengan Pretreatment untuk Penyiapan Hewan Penelitian Bidang Biomedis adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2015
Ririn Ariyani
ABSTRAK
RIRIN ARIYANI. Studi Histopatologi Organ Limfoid Mencit (Mus musculus) dengan Pretreatment untuk Penyiapan Hewan Penelitian Bidang Biomedis. Dibimbing oleh SRI ESTUNINGSIH dan HUDA SHALAHUDIN DARUSMAN.
Pretreatment diperlukan sebagai proses standardisasi hewan laboratorium, dalam hal ini adalah mencit (Mus musculus), untuk penelitian biomedis. Penelitian ini bertujuan untuk memberikan gambaran mengenai efek penggunaan dua jenis
bedding dan mengeksplorasi pola-pola pretreatment dengan pemberian sediaan antiinfeksi. Tiga ekor mencit induk jantan dan 9 ekor betina dari pemasok memperoleh pretreatment dan dipelihara menggunakan bedding kain kaos. Perkawinan 1 jantan dengan 3 betina dilakukan setelah uji TTGT menunjukkan 0 telur cacing cestoda dan nematoda. Mencit betina anakan berjumlah 15 ekor berusia 4 minggu dibagi ke dalam 5 kelompok dan dipelihara menggunakan bedding kain kaos. Kelompok A tidak memperoleh pretreatment, kelompok C memperoleh antihelmintik (albendazol), kelompok D memperoleh antihelmintik dan antibiotik (azitromisin), kelompok E memperoleh antihelmintik dan antiprotozoa (metronidazol), dan kelompok F memperoleh ketiga sediaan. Kelompok B terdiri atas 3 ekor mencit betina berusia 4 minggu yang diperoleh dari pemasok dan dipelihara menggunakan bedding serutan kayu. Pembagian kelompok dan asal mencit jantan, sama seperti kelompok betina. Kelompok A dan B dibandingkan untuk mencapai tujuan pertama. Hasil terbaik diantara keduanya, yaitu kelompok A, dibandingkan dengan kelompok C, D, E, dan F untuk mencapai tujuan kedua. Hasil tersebut diperoleh berdasarkan pengamatan preparat histopatologi organ limfoid mencit, yaitu timus, limpa, dan limfonodus. Variabel pengamatan ketiga organ limfoid berbeda-beda berdasarkan morfologinya. Sediaan diberikan sesuai jadwal yang telah ditentukan. Seluruh kegiatan pretreatment berlangsung selama 25 hari. Kesimpulan penelitian ini adalah penggunaan bedding kain kaos mampu mencegah re-infeksi patogen lingkungan, seperti kecacingan dan meminimalisir infeksi patogen alami yang berada di dalam tubuh mencit. Bedding kain kaos mampu mencegah dan mengurangi gangguan kesehatan akibat penggunaan
bedding serutan kayu, seperti iritasi saluran pernapasan atas. Sediaan antiinfeksi menyebabkan perubahan nilai kepadatan sel limfosit pada pusat-pusat folikel organ limfoid. Kelompok mencit jantan memberikan respon morfologi dan fungsi organ limfoid lebih baik terhadap sediaan antiinfeksi dibandingkan mencit betina. Mencit kelompok C memiliki nilai kepadatan sel limfosit paling mendekati kelompok A. Oleh karena itu, pretreatment dengan kedua sediaan tersebut dinilai paling ideal untuk digunakan dalam penelitian biomedis dengan acuan perubahan mikroskopis pada organ limfoid.
ABSTRACT
RIRIN ARIYANI. Histopathological Study of The Mouse’s (Mus musculus) Lymphoid Organ with Pretreatment for Preparation of Experimental Biomedic Research. Supervised by SRI ESTUNINGSIH and HUDA SHALAHUDIN DARUSMAN.
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
BOGOR 2015
RIRIN ARIYANI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan
Pada
Fakultas Kedokteran Hewan
PRAKATA
Alhamdulillahi rabbil’alamin. Puji dan syukur penulis panjatkan kepada
Allah subhanahu wa ta’ala atas segala karunia yang telah dilimpahkan. Rahmat terbesar Allah subhanahu wa ta’ala yang telah diberikan kepada penulis adalah kedua orang tua serta adik yang selalu mencintai dengan tulus dan mendukung setiap langkah penulis. Penulis merasa bersyukur dan berterima kasih atas doa, dukungan, serta kasih sayang dari keluarga besar dan teman-teman.
Rasa hormat dan terima kasih penulis ucapkan kepada Dr drh Sri Estuningsih, MSi APVet selaku dosen pembimbing tugas akhir dan dosen pembimbing akademik yang penuh dengan kesabaran memberikan ilmu, semangat, serta saran untuk perkembangan diri penulis. Ucapan terima kasih juga penulis sampaikan kepada Drh Huda Shalahudin Darusman, MSi PhD yang telah membimbing penulis menyusun karya ini. Terima kasih penulis sampaikan kepada seluruh dosen serta staf di Fakultas Kedokteran Hewan Institut Pertanian Bogor, khususnya di Bagian Patologi Departemen Klinik, Reproduksi, dan Patologi. Terima kasih dan penghargaan penulis sampaikan kepada Bagian Patologi yang telah membantu serta mendukung sebagian pelaksanaan penelitian ini dengan menyediakan fasilitas maupun bahan untuk histopatologi.
Penulis berharap karya tulis ini dapat bermanfaat bagi peneliti lain.
Bogor, September 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR BAGAN vi
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 3
METODE 3
Bahan 3
Alat 4
Prosedur Penelitian 4
HASIL DAN PEMBAHASAN 8
Kecacingan 8
Pengaruh Penggunaan Bedding terhadap Organ Limfoid 9
Pengaruh Pretreatment terhadap Organ Limfoid 11
SIMPULAN DAN SARAN 18
Simpulan 18
Saran 19
DAFTAR PUSTAKA 19
DAFTAR TABEL
1 Pembagian kandang kelompok adaptasi 5
2 Pembagian kandang kelompok pretreatment 6
3 Jadwal kegiatan penelitian dan pemberian pretreatment 6 4 Perbandingan relatif korteks dengan medula serta kepadatan populasi sel
limfosit pada organ timus mencit dengan penggunaan bedding kain kaos dan serutan kayu
9
5 Jumlah pulpa putih, diameter rata-rata pulpa putih, serta kepadatan populasi sel limfosit pada organ limpa mencit dengan penggunaan
bedding kain kaos dan serutan kayu
10
6 Jumlah folikel limfoid, diameter rata-rata folikel limfoid, serta kepadatan populasi sel limfosit pada organ limfonodus mencit dengan penggunaan bedding kain kaos dan serutan kayu
10
7 Perbandingan relatif korteks dengan medula dan kepadatan populasi sel limfosit pada organ timus mencit
12 8 Jumlah pulpa putih, diameter rata-rata pulpa putih, dan kepadatan
populasi sel limfosit pada organ limpa mencit
15 9 Jumlah folikel limfoid, diameter rata-rata folikel limfoid, dan
kepadatan populasi sel limfosit pada organ limfonodus mencit
17
DAFTAR GAMBAR
1 Fotografi mikro timus mencit jantan kelompok C (albendazol) pada perbesaran 4x
11 2 Fotografi mikro limpa mencit jantan kelompok C (albendazol) pada
perbesaran 4x
14 3 Fotografi mikro limfonodus mencit jantan kelompok C
(albendazol) pada perbesaran 4x
16
DAFTAR BAGAN
PENDAHULUAN
Latar Belakang
Hewan laboratorium menurut UU nomor 18 tahun 2009 tentang Peternakan dan Kesehatan Hewan merupakan hewan yang dipelihara khusus sebagai hewan percobaan, penelitian, pengujian, pengajaran, dan penghasil bahan biomedik ataupun dikembangkan menjadi hewan model untuk penyakit manusia. Hewan harus memenuhi persyaratan tertentu, seperti faktor genetis atau keturunan, lingkungan yang baik, serta dapat memberikan reaksi biologis sesuai dengan tujuan penelitian (NRC 2010). Mencit merupakan salah satu hewan yang sering digunakan dalam pendidikan dan penelitian bidang biosains. Sebanyak 59% mencit digunakan sebagai hewan laboratorium di Uni Eropa sepanjang tahun 2010 (EU Comission 2010). Mencit bersifat cepat berkembang biak, mudah dipelihara dalam jumlah banyak, memiliki sifat anatomis dan fisiologis yang terkarakteristik dengan baik, serta ekonomis (Malole dan Pramono 1989).
Pemasok mencit untuk penelitian di Indonesia belum mampu menghasilkan hewan yang memenuhi standar, sehingga evaluasi mutu jaringan organ untuk histologi dan histopatologi perlu menjadi perhatian. Manajemen pemeliharaan dan lingkungan yang kurang baik, terutama sanitasi, juga perlu menjadi perhatian. Unsur tersebut tidak dapat dipungkiri dapat mengakibatkan perubahan fisiologi oleh patogen alami mencit, salah satunya endoparasit penyebab kecacingan (Malole dan Pramono 1989). Kehadiran patogen alami jarang memperlihatkan gejala klinis. Perubahan fisiologi yang ditimbulkan dapat mengakibatkan mencit kurang cocok untuk digunakan dalam penelitian (Baker 1998). Pembebasan dari patogen perlu dilakukan sebagai salah satu cara mempersiapkan mencit yang mendekati standar untuk penelitian. Upaya tersebut dapat dilakukan dengan pemberian pretreatment,
yaitu serangkaian tindakan penyiapan hewan laboratorium, yang bertujuan untuk menghilangkan patogen di dalam tubuh dengan menggunakan sediaan antiinfeksi.
Azitromisin (Zithromax®) merupakan antibiotik oral dengan spektrum luas yang digunakan untuk terapi infeksi saluran pernapasan atas (Pfizer 2013). Albendazol (Albendazole®) merupakan anticacing oral spektrum luas dengan efek larvasidal dan ovosidal. Albendazol digunakan pada terapi infeksi cacing ascaris, trichuris (cacing cambuk), strongylida, serta fase sistiserkus dari cacing pita (Katzung 2004). Metronidazol (Flagyl®) merupakan antiprotozoa dan antibiotik yang dapat digunakan untuk terapi amoebiasis, giardiasis, dan infeksi organisme anaerob (Rossi 2013). World Health Organization (WHO) menetapkan metronidazol sebagai salah satu obat yang diperlukan sistem sistem kesehatan dasar (WHO 2014). Ketiga sediaan antiinfeksi tidak memiliki interaksi antara satu sama lain (Plumb 2015).
2
mencit juga akan terganggu oleh bau yang ditimbulkan. Bedding yang digunakan harus mampu menyerap urin mencit agar kelembaban dan tingkat amonia tidak tinggi. Penggunaan bedding kain kaos atau fleece,yang dicuci dengan desinfektan tanpa pewangi, disarankan untuk meminimalisir terjadinya resiko tersebut (Blom et al. 1996). Frekuensi membersihkan alas kandang juga harus diseimbangkan antara menjaga kebersihan dengan menjaga agar mencit tidak stres karena kehilangan
scent-marking (Orr 2002).
Sistem pertahanan pada mamalia terdiri atas organ limfoid primer, yaitu timus dan sumsum tulang, serta organ limfoid sekunder, yaitu jaringan limfoid mukosa, limfonodus, dan limpa. Seluruh organ tersebut bekerja sama untuk mempertahankan tubuh dari serangan antigen (Kuby 1997). Timus merupakan organ yang terdiri atas sel-sel epitel dan Associated Lymphoid Tissue (ALT). Timus berfungsi sebagai tempat pendewasaan timosit, yaitu sel progenitor hematopoietik yang berasal dari sumsum tulang. Timopoiesis merupakan proses diferensiasi timosit menjadi sel limfosit T dewasa di timus (Schwarz dan Bhandoola 2006). Limpa merupakan organ limfoid terbesar, berfungsi mengakumulasi limfosit dan makrofag, degradasi eritrosit, tempat cadangan darah, serta organ pertahanan terhadap antigen yang masuk ke dalam darah (Junqueira et al. 2007). Folikel limfoid berada di pulpa putih yang tersebar di dalam pulpa merah, berbentuk oval, dan berwarna biru keunguan. Folikel limfoid umumnya disusun oleh sel limfosit B, sel limfosit T, makrofag, dan sel debris (Ward et al. 1999). Limfonodus merupakan organ limfoid sekunder dan bekerja menyaring antigen yang dibawa oleh cairan di dalam pembuluh limfe (Linden et al. 2012). Korteks luar limfonodus berisi folikel yang didominasi oleh sel limfosit B, sedangkan korteks dalam (parakorteks) didominasi oleh sel limfosit T (Katakai et al. 2004).
Perumusan Masalah
Ketersediaan hewan laboratorium terstandar sampai saat ini belum ada di Indonesia, sehingga perlu upaya untuk memperbaiki kondisi tersebut. Penggunaan
bedding kain kaos sebagai alternatif pengganti serutan kayu diharapkan mampu mengurangi gangguan kesehatan pada mencit, seperti yang telah disebutkan.
Pretreatment dengan pemberian sediaan antiinfeksi perlu dipelajari dampaknya agar tidak menganggu tujuan penggunaan hewan laboratorium. Pengamatan variabel pada organ limfoid perlu dilakukan untuk menilai perubahan fungsi yang dapat terjadi sebagai dampak penggunaan sediaan antiinfeksi.
Tujuan Penelitian
3 Manfaat Penelitian
Penelitian ini diharapkan dapat memberi informasi mengenai tata cara pemeliharaan dan penelitian untuk mendapatkan mencit sebagai hewan laboratorium yang lebih baik. Informasi mengenai efek penggunaan sediaan antiinfeksi dalam pretreatment terhadap organ limfoid juga diharapkan dapat disampaikan melalui penelitian ini.
METODE
Alur penelitian ini secara umum dijelaskan dalam Bagan 1. Pembagian kelompok mencit sampel disajikan dalam Tabel 1 dan 2.
Bagan 1 Alur penelitian
Bahan
4
Sediaan antiinfeksi yang digunakan adalah azitromisin (Zithromax® 250 mg) 5 mg/kg BB, albendazol (Albendazole® 400 mg) 10 mg/kg BB, dan metronidazol (Flagyl® 500 mg) 10 mg/kg BB. Anastesi yang digunakan untuk euthanasia adalah ketamin 10% (Ketamil®) 100 mg/kg BB dan xylazine 2% (Ilium Xylazil-20®) 10 mg/kg BB. Bahan yang digunakan untuk fiksasi adalah Buffered Neutral Formalin
(BNF) 10 %. Bahan yang diperlukan untuk pembuatan preparat histopatologi adalah larutan Mayer’s Hematoksilin, larutan Eosin, lithium karbonat, alkohol teknis dengan konsentrasi bertingkat (70 %, 80 %, 90 %, 100 %), alkohol absolut (pa), xylol (pa), eter (pa), parafin granul,larutan albumin, perekat permount, dan methanol.
Alat
Alat yang digunakan untuk pemeliharaan adalah kotak plastik untuk kandang, penutup kandang dari kawat, botol minum, timbangan digital, kain bahan kaos dan serbuk gergaji sebagai bedding, dan cawan petri plastik sebagai tempat makan. Alat untuk pemberian pretreatment adalah spoit 1 ml dan 10 ml, wadah sediaan antiinfeksi yang telah diencerkan, gelas ukur, serta sonde lambung. Alat uji apung adalah kamar hitung McMaster, gelas plastik, saringan, dan sendok. Alat untuk nekropsi dan koleksi organ adalah label, kapas, peralatan bedah minor, sarung tangan, masker, jas laboratorium, sterofoam, aluminium foil, pot organ, serta jarum pentul. Peralatan yang digunakan untuk pembuatan preparat histopatologi adalah
tissue cassete, automatic tissue processor, mikrotom, pencetak parafin, Paraffin Embedding Console, gelas objek, inkubator, dan gelas penutup. Preparat histopatologi akan disimpan di dalam kotak preparat. Alat yang digunakan untuk pengamatan adalah eyepiece camera dan mikroskop.
Prosedur Penelitian Deteksi dan Evaluasi Kecacingan
Mencit indukan yang diperoleh dari pemasok menjalani uji apung untuk mengetahui kecacingan. Perkawinan akan dilakukan jika seluruh mencit indukan telah bebas dari kecacingan, ditandai dengan nol telur cacing cestoda maupun nematoda. Penghitungan jumlah telur dilakukan dengan metode Telur dalam tiap Gram Tinja (TTGT). Seluruh mencit sampel, baik anakan maupun yang diperoleh dari pemasok, juga menjalani uji apung untuk mengetahui kecacingan.
5 mikroskop. Telur cestoda dan nematoda dihitung dengan persamaan berikut (Kosasih 2001):
TTGT =Total telur kedua kamarBerat tinja yang diuji ×Volume cairan pengapung + tinjaVolume kedua kamar
Adaptasi
Adaptasi mencit sampel dilakukan selama 7 hari. Pakan berupa pelet ayam diberikan 2 kali sehari sebanyak 5 gram/ekor/pemberian dan air mineral secara ad libitum. Tempat pakan dan kandang dicuci setiap hari, sedangkan tempat minum dicuci 3 hari sekali. Bedding serutan kayu diganti jika sudah kotor, sedangkan kain kaos direbus, dicuci menggunakan desinfektan, kemudian dikeringkan setiap hari.
Tabel 1 Pembagian kandang kelompok adaptasi
Jumlah mencit sampel yang digunakan dalam setiap kandang dihitung dengan formula Federer, yaitu maksimal 3 mencit. Proses penghitungan dapat diamati di bawah ini. T merupakan jumlah kelompok perlakuan dan N merupakan jumlah mencit dalam setiap kelompok.
Formula Federer:
Mencit yang memperoleh pretreatment dibagi ke dalam 4 kelompok dengan kombinasi pemberian sediaan antiinfeksi yang berbeda-beda. Seluruh kelompok dipelihara dengan menggunakan bedding kain kaos. Pembagian tersebut dapat diamati pada Tabel 2.
Kelompok Jumlah (ekor) Bedding Perlakuan
6
Tabel 2 Pembagian kandang kelompok pretreatment
Pretreatment dilakukan sesuai dengan jadwal di dalam Tabel 2. Sonde lambung digunakan untuk membantu pemberian sediaan.
Tabel 3 Jadwal kegiatan penelitian dan pemberian pretreatment
Perlakuan hari ke- Kegiatan Kandang
1, 2, 3 Pengumpulan sampel feses per kandang Semua
4 Pemberian albendazol I 3-6 ♀♂
5, 6, 7 Pengumpulan sampel feses per kandang Semua
11, 12, 13 Pemberian azithromisin 4 dan 6 ♀♂
11 Uji apung I Semua
15, 16, 17 Pengumpulan sampel feses per kandang Semua
18 Pemberian albendazol II 3-6 ♀♂
19, 20, 21 Pengumpulan sampel feses per kandang Semua
25 Pemberian metronidazol 4 dan 6 ♀♂
25 Uji apung II Semua
32 Nekropsi dan pengambilan organ Semua
Nekropsi dan Koleksi Organ
Metode euthanasia yang digunakan dalam penelitian ini merupakan kombinasi fisik dan kimia. Mencit diinjeksi dengan ketamin (Ketamil®) dan xylazin (Ilium Xylazil-20®) secara intraperitoneal. Sistem pernapasan mencit akan terdepres ditandai dengan sesak napas akibat asphyxia (Longley 2008). Dislokasi
atlanto-occipitale dilakukan untuk memastikan mencit benar-benar mati sebelum koleksi organ dilaksanakan.
Mencit diposisikan dorsoventral diatas sterofoam yang telah dilapisi
aluminium foil dan setiap ekstremitasnya difiksasi menggunakan jarum pentul. Insisi dimulai dari area abdominal bagian hipogastrikum tepat di kranial organ reproduksi. Insisi lapisan kulit dilakukan pada linea alba kearah kranial hingga submandibula. Insisi dilanjutkan ke distal setiap ekstremitas, lalu kulit difiksasi dengan jarum pentul. Limfonodus axilaris dapat ditemukan tepat di bagian axila, baik kanan maupun kiri, sebagai suatu bulatan lunak, kenyal, berwarna krem kecoklatan, serta berada diantara pembuluh darah dan saraf. Insisi dilakukan pada rongga abdomen untuk mengambil limpa yang menempel pada curvatura mayor
Kelompok Jumlah (ekor) Perlakuan
A betina A jantan
3 3
7 lambung. Limpa normal akan terlihat merah tua, tidak terdapat nodul maupun pembesaran, dan tepi lancip. Insisi pada rongga thorak dilakukan untuk mengambil timus yang terletak pada mediastinum, tepatnya menempel pada kranial jantung dan terlihat seperti lemak (Linden et al. 2012). Perubahan pada organ diamati dan dicatat sebelum dimasukkan ke dalam larutan BNF 10%. Seluruh organ yang berasal dari satu mencit diletakkan pada pot yang sama, kemudian diberi label yang berisi identitas sampel dan tanggal koleksi.
Pembuatan Sediaan Histopatologi
Organ dari mencit yang telah diawetkan dalam larutan BNF 10% selama tujuh hari, diambil dan dilakukan grossing, yaitu pemotongan setebal kurang lebih 0.5 cm. Potongan organ dimasukkan ke dalam tissue cassete untuk proses dehidrasi. Dehidrasi dilakukan dengan merendam organ-organ tersebut secara berturut-turut ke dalam alkohol 70%, 80%, 90%, alkohol absolut (pa) I, alkohol absolut (pa) II, xylol (pa) I, xylol (pa) II, parafin I, dan parafin II masing-masing selama dua jam. Proses tersebut berjalan secara otomatis dalam alat tissue processor. Parafin dimasukkan ke alat pencetak sebagai dasar untuk melekatkan organ. Potongan organ selanjutnya dimasukkan ke dalam alat pencetak berisi parafin cair dan diatur letaknya agar tetap berada di tengah blok parafin. Parafin ditambahkan kembali setelah mulai mengeras sampai alat pencetak penuh, lalu didiamkan hingga mengeras kembali dan disimpan hingga pemotongan. Jaringan dipotong dengan ketebalan 5 µm menggunakan mikrotom. Hasil pemotongan yang berbentuk pita (ribbon) diletakkan di atas permukaan air bersuhu 45°C untuk menghilangkan lipatan akibat pemotongan. Sediaan kemudian diangkat dari permukaan air dengan gelas objek yang telah dilapisi larutan albumin yang berfungsi sebagai perekat. Sediaan dikeringkan dalam inkubator bersuhu 60°C selama satu malam. Sediaan, ketika proses pewarnaan, dimasukkan ke dalam xylol (pa) untuk proses deparafinisasi sebanyak dua kali masing-masing selama dua menit, dilanjutkan proses rehidrasi. Proses tersebut diawali dengan pencelupan ke alkohol absolut (pa), alkohol 90% hingga alkohol 80% masing-masing selama dua menit. Sediaan dicuci dengan air kran mengalir lalu dikeringkan untuk diwarnai.
8
Variabel Pengamatan
Sediaan histopatologi dari organ limfoid mencit diamati dengan bantuan mikroskop. Variabel yang diamati pada ketiga organ limfoid tersebut berbeda, disesuaikan dengan struktur histologinya. Variabel yang diamati pada timus adalah perbandingan relatif korteks dan medula pada perbesaran 4x. Variabel kedua adalah densitas atau kepadatan populasi sel limfosit pada bagian korteks yang dirata-rata dari sepuluh lapang pandang dengan perbesaran 100x. Variabel pengamatan pada organ limpa adalah jumlah dan diameter rata-rata pulpa putih pada perbesaran 4x serta kepadatan populasi sel limfosit pada perbesaran 100x. Variabel pengamatan pada organ limfonodus adalah jumlah dan diameter rata-rata folikel limfoid pada perbesaran 4x serta kepadatan populasi sel limfosit pada perbesaran 100x.
Analisis Data
Analisis data dilakukan dengan menggunakan perangkat lunak Microsoft Excel dan SPSS metode One-Way ANOVA dengan uji Duncan. Data dianalisis dengan tingkat kepercayaan (P) 95% atau tingkat signifikansi (α) 5%. Hasil beda nyata ditandai dengan P<0.05, yang menunjukkan bahwa perlakuan mengakibatkan perubahan pada variabel (Santoso 2012).
HASIL DAN PEMBAHASAN
Kecacingan
Hasil uji apung yang dilakukan pada mencit induk menunjukkan bahwa seluruhnya mengalami kecacingan, yaitu infestasi cestoda dan nematoda. Infestasi cestoda (cacing pita) maupun nematoda (cacing gilig) umum ditemukan pada mencit yang berada di Indonesia (Ustiawan et al. 2013). Berdasarkan hasil uji tersebut, seluruh mencit induk mendapatkan pretreatment untuk menghindari tertularnya mencit anakan.
9 Pengaruh Penggunaan Bedding terhadap Organ Limfoid
Penggunaan kain kaos sebagai bedding terlihat memberikan rasa nyaman dan hangat pada mencit. Hal tersebut dapat diamati dari habitus mencit selama pemeliharaan. Mencit dengan bedding kain kaos terlihat tenang ketika tidur. Mencit dengan bedding serutan kayu teramati lebih banyak bergerak ketika waktu istirahat, sehingga terlihat lebih gelisah. Pernyataan tersebut didukung dengan pertambahan bobot badan kelompok A baik betina maupun jantan yang lebih tinggi daripada kelompok B. Kelompok A betina mengalami peningkatan bobot badan sebesar 4.52 gram, sedangkan kelompok B sebesar 3.33 gram. Kelompok A jantan mengalami peningkatan sebesar 5.95 gram, sedangkan kelompok B sebesar 4.9 gram. Pengamatan dengan bantuan mikroskop menunjukkan bahwa struktur histologi seluruh organ limfoid mencit tidak mengalami perubahan.
Berdasarkan Tabel 4, kelompok A betina dan jantan memiliki nilai perbandingaan relatif korteks dengan medula lebih besar dibandingkan kelompok B. Nilai tersebut mengindikasikan bahwa korteks kelompok A lebih luas, sehingga mampu menampung lebih banyak sel limfosit. Hal tersebut dibuktikan dengan nilai kepadatan sel limfosit yang lebih tinggi dibandingkan kelompok B. Linden et al.
(2012) menyatakan bahwa sel limfosit T dewasa akan terlihat dengan inti sel berwarna ungu gelap dan sitoplasma kecil. Sel limfosit T akan mendominasi korteks dan sedikit telihat di medula. Rendahnya kepadatan sel limfosit kelompok B diduga berkaitan dengan habitus mencit untuk mengerat benda-benda disekitarnya (Orr 2002). Serutan kayu yang dierat dapat melukai area rongga mulut, bahkan tertelan. Blom et al. (1996) menyatakan bahwa serutan kayu dapat memicu iritasi mata dan gangguan saluran pernapasan atas. Kecacingan yang terjadi pada kelompok B betina maupun jantan juga berperan dalam mobilisasi sel limfosit keluar dari timus untuk mempertahankan kekebalan tubuh (Carlson 1987).
Tabel 4 Perbandingan relatif korteks dengan medula (I) serta kepadatan populasi sel limfosit (II) pada organ timus mencit dengan penggunaan bedding kain kaos (A) dan serutan kayu (B)
Kelompok I II [sel/(1280x1024) µm2]
♀ ♂ ♀ ♂
A 1.05±0.57a 0.99±0.19a 309.43±6.72a 388.93±16.95a
B 0.51±0.51a 0.81±0.09a 124.70±1.25b 355.87±24.77a
Huruf yang sama pada kolom yang sama menunjukkan bahwa pemberian perlakuan tidak menunjukkan adanya perbedaan yang nyata.
10 Tabel 5 Jumlah pulpa putih (I), diameter rata-rata pulpa putih (II), serta kepadatan populasi sel limfosit (III) pada organ limpa mencit
dengan penggunaan bedding kain kaos (A) dan serutan kayu (B)
III [sel/(1280x1024) µm2]
♂
262.40±19.35a
257.80±9.81a
Huruf yang sama pada kolom yang sama menunjukkan bahwa pemberian perlakuan tidak menunjukkan adanya perbedaan yang nyata.
Tabel 6 Jumlah folikel limfoid (I), diameter rata-rata folikel limfoid (II), serta kepadatan populasi sel limfosit (III) pada organ limfonodus
mencit dengan penggunaan bedding kain kaos (A) dan serutan kayu (B)
III [sel/(1280x1024) µm2]
♂
123.26±69.73a
97.13±97.13a
11 kelompok B betina dan jantan diduga sudah berlangsung lama, sehingga lonjakan nilai ketiga variabel tidak terjadi. Zachary dan McGavin (2012) menyatakan bahwa organ limfoid akan sangat reaktif ketika infeksi oleh patogen berada pada tahap awal. Reaktifitas tersebut akan menurun seiring berjalannya infeksi dari akut menuju kronis. Infeksi kecacingan akan tetap mengundang kehadiran sel limfosit dari limpa sebagai bentuk perlawanan (Harris dan Gause 2011).
Tabel 6 menunjukkan bahwa jumlah folikel limfoid kelompok A baik betina maupun jantan lebih tinggi daripada kelompok B. Hiperplasia folikel limfoid pada limfonodus sama halnya dengan limpa. Hal tersebut normal terjadi pada mencit muda sebagai upaya pembentukan sistem kekebalan tubuh (Katakai et al. 2004). Tingginya diameter folikel limfoid berbanding lurus dengan nilai kepadatan sel limfosit didalamnya, seperti pada timus. Hal tersebut ditunjukkan oleh kelompok A dan B baik betina maupun jantan. Rendahnya nilai kepadatan sel limfosit kelompok B diduga akibat penggunaan bedding serutan kayu, seperti yang telah disebutkan sebelumnya pada pembahasan timus. Linden et al. (2012) menyatakan bahwa limfonodus axilaris bertanggung jawab terhadap reaksi kekebalan disekitar axila, bekerja sama dengan limfonodus mediastinalis untuk area thoraks, serta bekerja sama dengan limfonodus submandibularis dan tonsil untuk area kepala.
Pengaruh Pretreatment terhadap Organ Limfoid Timus
Hasil pengamatan preparat histopatologi pada perbesaran 4x menunjukkan bahwa timus mencit jantan dan betina tidak menunjukkan adanya perubahan struktur histologi. Hasil analisis statistik pengamatan pada timus betina dan jantan dapat diamati pada Tabel 7.
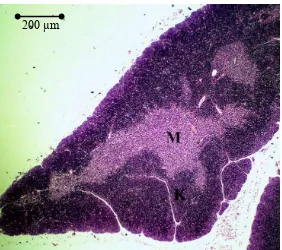
Gambar 1 Fotografi mikro timus mencit jantan kelompok C (albendazol) pada perbesaran 4x. Medula ditunjukkan dengan M dan korteks ditunjukkan dengan K.
12 Tabel 7 Perbandingan relatif korteks dengan medula (I) dan kepadatan populasi sel limfosit (II) pada organ timus mencit
II [sel/(1280x1024) µm2]
♂
388.93±16.95a
312.37±6.15a
235.57±1.18b
396.13±16.27a
326.03±28.44a
Huruf yang sama pada kolom yang sama menunjukkan bahwa pemberian perlakuan tidak menunjukkan adanya perbedaan yang nyata. Kelompok C memperoleh
pretreatment dengan sediaan albendazol, kelompok D memperoleh albendazol dan azitromisin, kelompok E memperoleh albendazol dan metronidazol, serta kelompok
F memperoleh albendazol, azitromisin, dan metronidazol.
♀
309.43±6.72a
212.90±1.06a
231.30±1.16a
214.80±1.07a
104.47±1.04b
I
♂
0.99±0.19a
0.38±0.16a
0.52±0.37a
0.91±0.08a
0.87±0.20a
♀
1.05±0.57a
1.47±0.78a
0.54±0.27a
0.28±0.20a
0.25±0.25a
Kelompok
A
C
D
E
13 Perbandingan relatif antara korteks dengan medula timus pada betina dan jantan tidak menunjukkan adanya beda nyata. Rendahnya kepadatan sel limfosit kelompok C dan E betina tidak sejalan dengan nilai perbandingan relatif. Demikian juga dengan kelompok C dan D jantan. Keberadaan tipe sel lain, yaitu sel makrofag, sel retikulosit, dan sel epitel pada korteks juga harus diperhatikan (Linden et al.
2012). Keberadaan ketiganya dapat menurunkan nilai kepadatan sel limfosit korteks, meskipun perbandingan relatifnya tinggi. Area perivaskular dan lemak di dalam korteks timus juga akan meningkat seiring pertambahan usia serta involusi, sehingga ruang untuk sel limfosit akan semakin berkurang (Linden et al. 2012).
Kelompok C, D, serta F betina dan jantan memiliki nilai kepadatan sel limfosit yang lebih rendah dibandingkan kelompok A. Azitromisin dapat menyebabkan perubahan pH tubuh dan diare. Perubahan pH diakibatkan oleh kemampuan azitromisin sebagai antibiotik spektrum luas yang dapat membasmi sebagian besar bakteri positif maupun negatif Gram di dalam tubuh mencit. Hal tersebut dapat mengakibatkan terganggunya keseimbangan mikroflora di dalam tubuh mencit, sehingga memicu pertumbuhan berlebih dari patogen alami lain yang tidak terbasmi. Metronidazol mampu memperkuat kerja azitromisin sebagai antibiotik (Wanamaker dan Massey 2009). Penggunaan keduanya dalam suatu kombinasi dikhawatirkan mampu meningkatkan penurunan pH tubuh mencit. Diare yang terjadi dapat mengakibatkan peradangan pada saluran pencernaan, sehingga sel limfosit bersirkulasi ke area tersebut (Zachary dan McGavin 2012). Pengamatan tidak mencatat adanya kejadian diare yang parah pada mencit yang diberi azitromisin, hanya saja konsistensi feses sedikit lebih lunak. Penggunaan albendazol dapat menimbulkan gangguan saluran cerna dan nyeri abdomen (Wanamaker dan Massey 2009). Hal tersebut diduga akibat adanya gangguan pada saluran pencernaan, seperti peradangan yang mengakibatkan terlepasnya sitokin dan mengundang kehadiran sel limfosit (Chokkalingam et al. 2013). Sel makrofag yang membawa sel debris apoptotik dari area infeksi akan menempati korteks timus, sehingga ruang untuk sel limfosit akan berkurang (Linden et al. 2012).
Supresi sumsum tulang dapat terjadi akibat penggunaan azitromisin, sehingga memicu anemia aplastik. Baik darah merah maupun progenitor darah putih, produksi keduanya akan menurun pada penderita anemia aplastik (Maluf et al.
2009). Penggunaan albendazol juga dapat mengakibatkan efek serupa (Fernandez
et al. 1996). Ketiga sediaan antiinfeksi memang disebutkan tidak memiliki interaksi (Plumb 2015). Namun, kesamaan efek samping yang ditimbulkan oleh masing-masing sediaan, seperti yang telah disebutkan, akan mengakibatkan meningkatnya keparahan efek. Prevalensi supresi sumsum tulang dan penurunan pH tentunya dipengaruhi oleh respon yang berbeda-beda dari setiap individu terhadap sediaan, sehingga tidak semua mencit akan mengalaminya. Hal tersebut ditunjukkan dengan nilai kepadatan sel limfosit kelompok D betina dan kelompok E jantan yang paling mendekati kelompok A dibandingkan kelompok lain.
14
mengakibatkan kepadatan sel limfosit pada mencit betina secara umum lebih rendah daripada jantan.
Limpa
Pulpa putih limpa dapat diamati dengan perbesaran 4x seperti pada Gambar 2. Perubahan struktur histologi tidak terjadi pada mencit jantan maupun betina. Hasil analisis statistik limpa mencit dapat diamati pada Tabel 8.
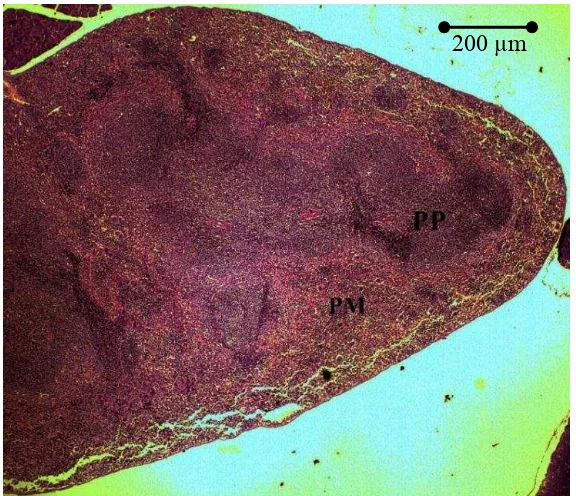
Gambar 2 Fotografi mikro limpa mencit jantan kelompok C (albendazol) pada perbesaran 4x. PP merupakan pulpa putih dan PM merupakan pulpa merah.
Tingkat reaktifitas limpa dapat ditentukan dengan mengetahui jumlah sel limfosit dan jumlah folikel limfoid di dalam pulpa putih dengan berbagai ukuran (Colovai et al. 2004). Kelompok C dan D memiliki rata-rata diameter melebihi kelompok A, namun kepadatan sel limfositnya rendah. Linden et al. (2012) menyatakan bahwa, selain sel limfosit, di dalam pulpa putih terdapat sel dendritik dan sinus marginal. Keberadaan keduanya dapat meningkatkan nilai rata-rata diameter, namun tidak diiringi peningkatan kepadatan sel limfosit.
Seluruh kelompok betina yang mendapat pretreatment memiliki nilai kepadatan sel limfosit lebih rendah daripada kelompok A. Kelompok D jantan merupakan satu-satunya yang memiliki nilai kepadatan sel limfosit di bawah kelompok A. Hasil analisis statistik kepadatan sel limfosit jantan menunjukkan beda nyata pada kelompok E karena nilai kepadatan melebihi kelompok A. Hal tersebut dapat diakibatkan oleh rendahnya distribusi sel limfosit dari timus mencit betina akibat adanya involusi. Distribusi sel limfosit pada mencit jantan tidak begitu terganggu karena involusi belum terjadi. Spoor et al. (2008) menyatakan bahwa hormon steroid tidak mempengaruhi keutuhan limpa, seperti hormon tersebut memicu involusi pada timus. Efek dari sediaan antiinfeksi yang telah disebutkan pada pembahasan bagian timus juga dapat mengakibatkan meningkatnya sel
15 Tabel 8 Jumlah pulpa putih (I), diameter rata-rata pulpa putih (II), dan kepadatan populasi sel limfosit (III) pada organ limpa mencit
III [sel/(1280x1024) µm2]
Huruf yang sama pada kolom yang sama menunjukkan bahwa pemberian perlakuan tidak menunjukkan adanya perbedaan yang nyata. Kelompok C memperoleh
pretreatment dengan sediaan albendazol, kelompok D memperoleh albendazol dan azitromisin, kelompok E memperoleh albendazol dan metronidazol, serta kelompok
F memperoleh albendazol, azitromisin, dan metronidazol.
16
makrofag di dalam pulpa putih limpa, sehingga ruang untuk sel limfosit semakin berkurang. Kelompok D baik betina maupun jantan memiliki nilai kepadatan sel limfosit yang paling mendekati kelompok A masing-masing.
Kelompok-kelompok jantan secara umum memiliki nilai kepadatan sel limfosit yang lebih rendah daripada betina. Perkelahian lebih sering terjadi pada mencit jantan daripada betina untuk menentukan dominasi dan teritorial (Orr 2002). Perkelahian tersebut tentunya dapat menimbulkan luka-luka pada tubuh mencit, sehingga menarik sel limfosit ke situs luka. Beberapa mencit jantan terlihat memiliki luka selama pemeliharaan yang diduga akibat perkelahian. Orr (2002) menyatakan bahwa perkelahian tersebut dapat diminimalisir dengan menggunakan mencit yang berasal dari satu induk dalam 1 kandang perlakuan penelitian.
Limfonodus
Pembengkakan dan pengerasan limfonodus axilaris tidak terjadi pada seluruh mencit ketika pengamatan selama nekropsi dilakukan. Perubahan struktur limfonodus mencit secara histologi juga tidak terjadi ketika preparat histopatologi diamati. Tabel 9 merupakan hasil analisis statistik terhadap variabel limfonodus yang telah ditentukan.
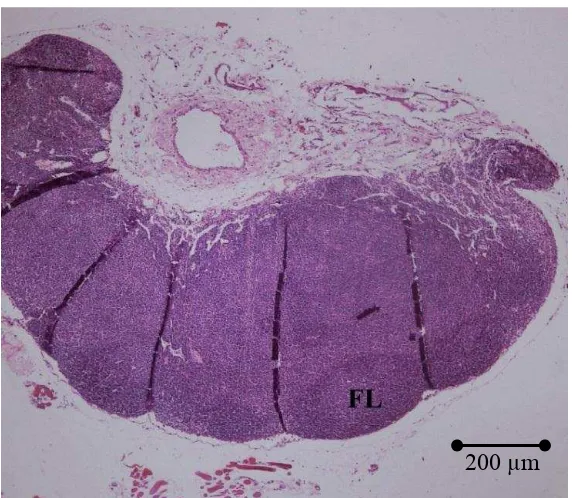
Gambar 3 Fotografi mikro limfonodus mencit jantan kelompok C (albendazol) pada perbesaran 4x. Folikel limfoid ditandai dengan FL dan terketak pada korteks.
Pusat germinativum pada folikel limfoid dapat diamati di bawah mikroskop, namun tidak menunjukkan warna ungu tegas. Katakai et al. (2004) menyatakan bahwa pusat germinativum mudah diamati dalam keadaan normal pada folikel korteks luar. Pusat germinativum akan membesar dan terlihat semakin jelas akibat kehadiran sejumlah sel T, makrofag, serta sel dendrit mengelilingi setiap pusat germinativum pada folikel akibat kehadiran patogen. Proliferasi serta diferensiasi sel B menjadi sel plasma dan sel memori akan terjadi, sehingga pusat germinativum
17 Tabel 9 Jumlah folikel limfoid (I), diameter rata-rata folikel limfoid (II), dan kepadatan populasi sel limfosit (III) pada organ limfonodus mencit
Huruf yang sama pada kolom yang sama menunjukkan bahwa pemberian perlakuan tidak menunjukkan adanya perbedaan yang nyata. Kelompok C memperoleh
pretreatment dengan sediaan albendazol, kelompok D memperoleh albendazol dan azitromisin, kelompok E memperoleh albendazol dan metronidazol, serta kelompok
F memperoleh albendazol, azitromisin, dan metronidazol.
18
semakin jelas terlihat (Messika 1998).
Hasil analisis statistik tidak berbeda nyata ditunjukkan oleh nilai variabel jumlah folikel limfoid dan diameter rata-ratanya. Kelompok E betina dan kelompok D jantan menunjukkan nilai kepadatan sel limfosit paling mendekati kelompok A masing-masing. Kelompok C, D, dan F betina memiliki nilai kepadatan sel limfosit di bawah kelompok A. Seluruh kelompok mencit jantan yang mendapat
pretreatment justru memiliki nilai kepadatan sel limfosit lebih tinggi daripada kelompok A. Sama seperti limpa, hal tersebut dapat diakibatkan oleh rendahnya distribusi sel limfosit dari timus mencit betina akibat adanya involusi. Jumlah folikel limfoid kelompok F betina tidak berbanding lurus dengan nilai kepadatan sel limfosit dan diameter folikel limfoidnya. Keberadaan sel darah putih lain, sel dendritik folikuler, dan sel retikulosit fibroblast pada folikel limfoid limfonodus kelompok tersebut dapat menurunkan nilai kepadatan sel limfositnya (Linden et al.
2012). Efek penggunaan sediaan antiinfeksi juga berperan dalam penurunan nilai tersebut, karena sel makrofag akan mengurangi ruang sel limfosit di dalam korteks maupun parakorteks limfonodus.
Kelompok-kelompok jantan menunjukkan jumlah sel limfosit yang lebih stabil daripada kelompok betina. Perkelahian yang terjadi antar jantan tentunya akan menimbulkan luka, sehingga menarik sel limfosit keluar dari limfonodus. Efek sediaan antiinfeksi yang telah disebutkan, tentunya juga akan menarik sel limfosit keluar dari limfonodus. Meskipun demikian, jumlah sel limfosit di dalam limfonodus masih tetap mencukupi. Keberadaan hormon yang fluktuatif pada betina yang telah dewasa kelamin juga berpengaruh terhadap kekebalan tubuh, seperti yang telah disebutkan. Rendi et al. (2012) menyatakan bahwa tubuh mencit betina akan mempersiapkan diri untuk menerima sperma, yang merupakan benda asing, sehingga produksi sel limfosit akan turun. Hal tersebut merupakan salah satu penyebab distribusi sel limfosit pada limfonodus mencit betina lebih rendah daripada mencit jantan.
SIMPULAN DAN SARAN
Simpulan
19 Saran
Mencit jantan lebih direkomendasikan dalam penelitian yang bertujuan untuk mengamati morfologi dan fungsi organ limfoid. Sediaan antiinfeksi sebaiknya tidak diberikan secara kombinasi dalam satu waktu yang berdekatan agar jumlah sel limfosit tidak semakin terganggu. Hal tersebut berkaitan dengan efek samping yang dapat ditimbulkan masing-masing sediaan, karena tidak ada interaksi antara ketiganya. Penelitian mengenai prosedur pemberian pretreatment perlu dilakukan untuk menghasilkan hewan percobaan yang berkualitas baik.
DAFTAR PUSTAKA
Baker DG. 1998. Natural pathogens of laboratory mice, rats, and rabbits and their effects on research. Clin Microbiol Rev 11(2): 231–266.
Blom HJM, Van Tintelen G, Van Vorstenbosch CJAHV, Baumans V, Beynen AC. 1996. Preferences of mice and rats for types of bedding material. Lab Anim 30: 234-244.
Carlson JR, Heyworth MF, Owen RL. 1987. T-lymphocyte subsets in nude mice with giardia muris infection. Thymus 9(3): 189-196.
Colovai AI, Giatzikis C, Ho EK, Farooqi M, Suciu-Foca N, Cattoretti G, Orazi A. 2004. Flow cytometric analysis of normal and reactive spleen. Modern Pathology 17: 918-927.
Chokkalingam V, Tel J, Wimmers F, Liu X, Semenov S, Thiele J, Figdor CG, Huck WTS. 2013. Probing cellular heterogeneity in cytokine-secreting immune cells using droplet-based microfluidics. Lab on a Chip 13(24): 4740–4744.
Fernandez FJ, Vidigal FFR, Ledesma V, Cabanillas Y, Vagase JM. 1996. Aplastic anemia during treatment with albendazole. Americ J of Haematol 53(1): 53-54. [EU Comission] European Union Comission. 2010. Sixth Report on The Statistics
on The Number of Animals Used for Experimental and Other Scientific Purposes in The Member States of The European Union[Internet]. [Diacu 2015 Agustus 22]. Tersedia dari: http://aei.pitt.edu/33392/1/COM_%282010%29-511-1.pdf. Harris N, Gause WC. 2011. To b or not to b: b cells and the th2-type immune
response to helmints. Trend in Immun 32: 80-88.
Junqueira, Luiz C, Carneiro J. 2007. Histologi Dasar. Ed ke-3. Jakarta (ID): EGC. Katakai T, Takahiro H, Hiroyuki G, Manabu S, Akira S. 2004. A novel reticular stromal structure in lymph node cortex: an immune-platform for interactions among dendritic cells, t cells, and b cells. Intern Immunol 16(8): 1133-1142. Katzung BG. 2004. Basic and Clinical Pharmacology. Ed ke-9. New York (US):
McGraw Hill Companies.
Kosasih Z. 2001. Metoda uji apung sebagai teknik pemeriksaan telur cacing nematoda dalam tinja hewan ruminansia kecil. Temu Teknis Fungsional Non Peneliti Balitvet Bogor. Hlm 27-33.
20
Longley L. 2008. Anaesthesia of Exotic Pets: Rodent Anaesthesia. Missouri (US): Saunders.
Malole MBM, Pramono CSU. 1989. Penggunaan Hewan-Hewan Percobaan di Laboratorium. Bogor (ID): Institut Pertanian Bogor Pr.
Maluf E, Hamerschlak N, Cavalcanti AB, Junior AA, Eluf-Neto J, Falcao RP, Lorand-Metze IG, Goldenberg D, Santana CL, Rodrigues DDOW, Passos LNDM, Rosenfeld LGM, Pitta M, Loggetto S, Ribeiro AAF, Velloso ED, Kondo AT, Coelho EODM, Pintao MCT, de Souza HM, Borbolla JR, Pasquini R. 2009 Incidence and risk factors of aplastic anemia in latin America countries: the latin case-control study. Haematol 94(9): 1220-1226.
Mansouri J. 2013. Spleen: Infectious / Inflammatory Disorders Follicular Hyperplasia [Internet]. [Diacu 2015 Juni 12]. Tersedia dari: http://www. pathologyoutlines.com/topic/spleen follicularhyperplasia.html.
Messika EJ. 1998. Differential effect of b lymphocyte-induced maturation protein (blimp-1) expression on cell fate during b cell development. J Exp Med 188: 515–525 .
[NRC] National Research Council. 2010. Guide for The Care and Use of Laboratory Animals [Internet]. Ed ke-8. [Diacu 2015 Juni 12]. Tersedia dari: http://www. nap.edu/catalog/ 12910.html.
Orr HE. 2002. Rats and Mice. Di dalam: BSAVA Manual of Exotic Pets. Ed ke-4. Meredith A, Redrobe S, editor. England (GB): BSAVA.
Pfizer. 2013. Zithromax [Internet]. [Diacu 2015 Juni 12]. Tersedia dari: http:// www.labeling.pfizer.com /ShowLabeling.aspx?id=511.
Plumb DC. 2015. Plumb’s Veterinary Drug Handbook: Desk. Ed ke-8. Oxford (GB): Wiley-Blacwell.
Pritchett KR, Taft RA. 2007. Reproductive Biology of the Laboratory Mouse. Di dalam: The Mouse in Biomedical Research: Normative Biology, Husbandry, and Models. Ed ke-2. Fox JG, Barthold SW, Davisson MT, Newcomer CE, Quimby FW, Smith AL, editor. London (GB): Academic Pr.
Rendi MH, Muehlenbachs A, Garcia RL, Boyd KL. 2012. Female Reproductive System. Di dalam: Comparative Anatomy and Histology a Mouse and Human Atlas. Ed ke-1. Treuting PM, Dintzis SM, editor. London (GB): Academic Pr. Rossi S. 2013. Australian Medicines Handbook. Adelaide (AUS): The Australian
Medicines Handbook Unit Trust.
Santoso S. 2012. Aplikasi SPSS pada Statistik Parametrik. Jakarta (ID): Elex Media Komputindo.
Sari CDP. 2012. Pengaruh Pemberian Ekstrak Minyak Jintan Hitam (Nigella sativa) terhadap Organ Limfoid Sekunder Mencit (Mus musculus) [Skripsi]. Bogor (ID): Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Schwarz BA, Bhandoola A. 2006. Trafficking from the bone marrow to the thymus: a prerequisite for thymopoiesis. Immunol Rev 209:47-57.
Spoor MS, Radi ZA, Dunstan RW. 2008. Characterization of age-related and gender-related changes in the spleen and thymus from control cynomolgus macaques used in toxicity studies. Toxicol Pathol 36: 695-704.
Sutherland JS. 2005. Activation of thymic regeneration in mice and humans following androgen blockade. J immunol 175(4): 2741-2753.
21 Juni 12]. Tersedia dari: http://grey.litbang.depkes.go.id/gdl.php?mod=browse &op=read&id=jkpkbppk--adilustiaw-3516.
Wanamaker BP, Massey KL. 2009. Applied Pharmacology for Veterinary Technicians. Ed ke-4. Missouri (US): Saunders Elsevier.
Ward JM, Mann PC, Morishima H, Frith CH. 1999. Thymus, Spleen, and Lymph Nodes. Di dalam: Pathology of the Mouse Reference and Atlas. Maronpot RR, GA Boorman, BW Gaul, editor. Vienna (US): Cache River Pr.
[WHO] World Health Organization. 2014. WHO Model List of Essential Medicines
[Internet]. [Diunduh pada 2015 Agustus 14]. Tersedia pada: http://apps.who.int/ iris/bitstream/10665/93142/1/EML_18_eng.pdf?ua=1
22