ANALISIS VARIAN PENGARUH SUHU DAN KONSENTRASI
TERHADAP PERUBAHAN KONDUKTIVITAS
LARUTANASAM ASETAT (CH
3COOH) DAN
ASAM KLORIDA(HCl)
SKRIPSI
STEPHANUS PASARIBU
070802053
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
ANALISIS VARIAN PENGARUH SUHU DAN KONSENTRASI
TERHADAP PERUBAHAN KONDUKTIVITAS LARUTAN
ASAM ASETAT (CH
3COOH) DAN
ASAM KLORIDA(HCl)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar
Sarjana Sains
STEPHANUS PASARIBU
070802053
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
PERSETUJUAN
Judul : Analisis Varian Pengaruh Suhu dan Konsentrasi Terhadap Perubahan Konduktivitas Larutan
Asam Asetat (CH3COOH) dan Asam Klorida
(HCl)
Kategori : Skripsi
Nama : Stephanus Pasaribu
Nomor Induk Mahasiswa : 070802053
Program Studi : Sarjana (S-1) Kimia
Departemen : Kimia
Fakultas : Matematika dan Ilmu Pengetahuan Alam
(FMIPA) Universitas Sumatera Utara
Disetujui di
Medan, Januari 2015
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Dr. Darwin Yunus Nasution, MS Dr. Marpongahtun, M.Sc.
NIP. 195508101981031006 NIP. 196111151988032002
Diketahui / Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
ANALISIS VARIAN PENGARUH SUHU DAN KONSENTRASI TERHADAP PERUBAHAN KONDUKTIVITAS LARUTANASAM ASETAT
(CH3COOH) DANASAM KLORIDA (HCl)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya
Medan, Januari 2015
PENGHARGAAN
Puji dan syukur penulis panjatkan kepada Tuhan Yesus Kristus yang telah memberi inspirasi, kesempatan, bahkan kemampuan untuk menyelesaikan sebuah karya berupa skripsi berjudul Analisis Varian Pengaruh Suhu dan Konsentrasi Terhadap Perubahan Konduktivitas Larutan Asam Asetat (CH3COOH) dan Asam
Klorida (HCl).
Pada kesempatan ini penulis ingin mempersembahkan skripsi ini sebagai rasa terimakasih dan ungkapan sayang yang tak terhingga kepada Ayahanda (Alm.) dr. Sahat H.B. Pasaribu dan Ibunda Roslina br. Simanjuntak, kedua abang penulis Yosua Pasaribu, S.Sos dan Andreas Pasaribu, SH dan adik penulis Pratiwi M. br. Pasaribu yang telah memberikan dukungan, dorongan dan sabar terus mendoakan penulis untuk konsisten dalam penyelesaian skripsi ini. Terimakasih kepada Ibu Dr. Marpongahtun, M.Sc selaku pembimbing I dan Bapak Dr. Darwin Yunus Nasution, MS selaku pembimbing II yang sudah banyak meluangkan waktunya selama penyelesaian skripsi ini. Terimakasih juga tidak lupa penulis ucapkan kepada Bapak Drs. Abdi Negara Sitompul yang awalnya merupakan pembimbing I penulis, namun telah pensiun sebelum skripsi ini terselesaikan, Ibu Dr. Rumondang Bulan Nst, MS dan Bapak Drs. Albert Pasaribu, M.Sc selaku Ketua dan Sekretaris Departemen Kimia yang telah mengesahkan skripsi ini. Bapak dan Ibu dosen Kimia yang telah membimbing dan memberikan pemahaman ilmu Kimia selama penulis menjalani studi. Ibu Helmina Sembiring, S.Si, M.Si selaku dosen PA penulis. Staf Laboratorium Kimia Fisika FMIPA USU : Aidil, Diana, Gita, Iis, Leni, Choliq, Uci dan Staf Laboratorium Kimia Analitik FMIPA USU : Benni, Zulfanri, Dorkas, Wiwi, Andy. Seluruh saudara/i stambuk 2007, terkhusus Grand, Tria, Dewi, Sahat, Sari, Hamdan, Dian, Cristy, Silorida, Vasca, Candra dan Husni, Kak Devi (2003) dan Kak Melfa (2004), adik sekaligus teman stambuk 2010-2011 : Nabila, Yabes, Suman, Adri, Hotnida, Daniel Banjarnahor dan Firdha yang selalu mengingatkan penulis untuk menyelesaikan skripsi di tengah kesibukan yang ada. Kepada Bapak Pimpinan Lembaga Bimbingan Belajar Sony Sugema College (LBB SSC) Medan Bapak Ronald B. Simanjuntak, teman-teman SSC Bang Amril, Bang Robert, Bang Risky, Bang Hamdani, Bang Verta, Bang Julius, Bang Toni, Roland, senior/teman/junior se-Departemen Kimia SSC Medan : Bang Darmas, Bang Pahotton, Bang Rivan, Kak Fridawati, Kak Merry, Kak Natalia, Bakti, Leony, Suharman, Mawar, Despita, Joe serta adik-adik siswa/i SSC se-Sumut yang menjadi dorongan semangat bagi penulis dalam penyelesaian skripsi ini. Terimakasih juga untuk semua teman dan saudara yang selalu mendoakan penulis yang tidak dapat disebutkan satu persatu.
Hanya Tuhan yang dapat membalas segala kebaikan yang telah kalian berikan kepada penulis.Penulis berharap Tuhan mencurahkan berkat-Nya berlipat ganda kepada kita semua, Amin.
ANALISIS VARIAN PENGARUH SUHU DAN KONSENTRASI TERHADAP PERUBAHAN KONDUKTIVITAS LARUTANASAM ASETAT
(CH3COOH) DANASAM KLORIDA (HCl)
ABSTRAK
Telah dilakukan penelitian mengenai pengaruh suhu dan konsentrasi terhadap perubahan konduktivitas (daya hantar listrik) larutan elektrolit. Jenis larutan elektrolit yang digunakan adalah elektrolit kuat berupa asam klorida (HCl) dan elektrolit lemah berupa asam asetat (CH3COOH) dalam pelarut air. Dalam
penelitian ini, variasi konsentrasi larutan elektrolit adalah 0,01 M; 0,02 M dan 0,03 M. Variasi suhu pemanasan adalah 300C, 400C dan 500C. Konduktivitas kedua larutan ini diukur menggunakan konduktometer model ECTestr11. Dari hasil perhitungan dengan menggunakan analisis variansi faktorial 3 x 3 model tetap, ternyata ada pengaruh suhu dan konsentrasi terhadap perubahan konduktivitas larutan HCl dan larutan CH3COOH. Semakin besar konsentrasi
larutan, konduktivitas larutan semakin besar. Semakin tinggi suhu larutan, konduktivitas larutan semakin kecil.Dari hasil perhitungan juga diketahui bahwa ada hubungan interaksi antara suhu dan konsentrasi larutan terhadap konduktivitas larutan.
ANALYSIS OF VARIANCE FOR INFLUENCE OF TEMPERATURE AND CONCENTRATION TOWARD CHANGE OF CONDUCTIVITY ACETIC
ACID (CH3COOH) AND CHLORIDE ACID (HCl)
IN AQUEOUS SOLUTION
ABSTRACT
The investigation about the influence of temperature and concentration on the change of conductivity of electrolyte solution has been performed.The type of utilized electrolyte solution was strong electrolyte of acid chloride (HCl) and weak electrolyte of acetic acid (CH3COOH) in aqueous solution. In this
investigation, the varieties of concentration of electrolyte solutions were 0,01 M; 0,02 M and 0,03 M. The varieties of temperature of electrolyte solution were 300C, 400C and 500C. The conductivity of these solutions was measured by using Conductometer of ECTestr11 Model. Through the calculation result by variant factorial 3 x 3 analysis of fixed model, there was influence of temperature and
concentration on conductivity solution of HCl and CH3COOH. The higher
concentration of electrolytes, conductivity of solutions increase.The higher temperature of electrolytes, conductivity of solutions decrease.Also through the calculation, there was interaction between temperature and concentration on the change of solution conductivity.
DAFTAR ISI Persetujuan Pernyataan Penghargaan Abstrak Abstract Daftar Isi Daftar Tabel Daftar Gambar Daftar Lampiran
Bab 1 Pendahuluan
1.1. Latar Belakang 1.2. Permasalahan
1.3. Pembatasan Masalah 1.4. Hipotesis
1.5. Tujuan Penelitian 1.6. Manfaat Penelitian 1.7. Metodologi Penelitian 1.8. Lokasi Penelitian
Bab 2 Tinjauan Pustaka
2.1. Klasifikasi Elektrolit 2.2. Konduktivitas Elektrolit
2.3. Variasi Konduktivitas terhadap Konsentrasi
2.3.1. Variasi Konduktivitas terhadap Konsentrasi Elektrolit Kuat
2.3.2. Teori Debye-Huckel
2.3.3. Variasi Konduktivitas terhadap Konsentrasi Elektrolit Lemah
2.4. Variasi Konduktivitas terhadap Suhu 2.5. Hukum Perpindahan Ion Bebas
2.6. Konduktivitas Ion Hidrogen (H+) dan Hidroksil (OH-) Bab 3 Bahan dan Metode Penelitian
3.1. Bahan-bahan yang Digunakan 3.2. Alat-alat yang Digunakan 3.3. Metode Penelitian
3.3.1. Sampling 3.3.2. Variabel 3.3.3. Randomisasi 3.3.4. Pengumpulan Data
3.3.4.1. Pembuatan Larutan
3.3.4.2. Pembuatan Larutan Elektrolit Kuat 3.3.4.3. Pembuatan Larutan Elektrolit Lemah 3.3.4.4. Pengukuran Daya Hantar Listrik 3.4. Pengolahan Data
3.5. Analisis Data 3.6. Skema Penelitian
Bab 4 Hasil dan Pembahasan 4.1. Hasil
4.2. Pembahasan
Bab 5 Kesimpulan dan Saran 5.1. Kesimpulan 5.2. Saran
Daftar Pustaka
24 25 25 26 30
31 32
43 43
DAFTAR TABEL
Nomor Tabel
Judul Halaman
Tabel 2.1 Hukum Kohlrausch 17
Tabel 3.1 Bahan-bahan Penelitian 19
Tabel 3.2 Alat-alat Penelitian 20
Tabel 3.3 Desain Percobaan 3 x 3 22
Tabel 3.4 Data HasilEksperimendan Total MarjinalRespon 28
DAFTAR GAMBAR
Nomor Gambar
Judul Halaman
Gambar 2.1 Variasikonduktivitas molarsebagaifungsikonsentrasi
molaruntuk elektrolitkuatdanelektrolitlemah
13
DAFTAR LAMPIRAN
Nomor Lampiran
Judul Halaman
Lampiran 1 Data HasilPengukuranHantaranSpesifik (mS)
padavariasiKonsentrasiLarutanElektrolitKuatHCl (Asam klorida)
46
Lampiran 2 Tabel Anava Dua Jalur Untuk Larutan HCl 47
Lampiran 3 Data HasilPengukuranHantaranSpesifik (mS) padavariasiKonsentrasiLarutanElektrolitLemah CH3COOH
(AsamAsetat)
51
Lampiran 4 Tabel Anava Dua Jalur Untuk Larutan CH3COOH 52
Lampiran 5 PengukuranKonduktivitasLarutan 56
Lampiran 6 Grafik Respon Konduktivitas Larutan HCl terhadap Konsentrasi dan Suhu (dengan aplikasi Minitab)
57
Lampiran 7
Lampiran 8
Lampiran 9
Grafik Respon Konduktivitas Larutan HCl terhadap Interaksi Konsentrasi dan Suhu (dengan aplikasi Minitab) Grafik Respon Konduktivitas Larutan CH3COOH terhadap
Konsentrasi dan Suhu (dengan aplikasi Minitab)
Grafik Respon Konduktivitas Larutan CH3COOH terhadap
Interaksi Konsentrasi dan Suhu (dengan aplikasi Minitab)
58
59
ANALISIS VARIAN PENGARUH SUHU DAN KONSENTRASI TERHADAP PERUBAHAN KONDUKTIVITAS LARUTANASAM ASETAT
(CH3COOH) DANASAM KLORIDA (HCl)
ABSTRAK
Telah dilakukan penelitian mengenai pengaruh suhu dan konsentrasi terhadap perubahan konduktivitas (daya hantar listrik) larutan elektrolit. Jenis larutan elektrolit yang digunakan adalah elektrolit kuat berupa asam klorida (HCl) dan elektrolit lemah berupa asam asetat (CH3COOH) dalam pelarut air. Dalam
penelitian ini, variasi konsentrasi larutan elektrolit adalah 0,01 M; 0,02 M dan 0,03 M. Variasi suhu pemanasan adalah 300C, 400C dan 500C. Konduktivitas kedua larutan ini diukur menggunakan konduktometer model ECTestr11. Dari hasil perhitungan dengan menggunakan analisis variansi faktorial 3 x 3 model tetap, ternyata ada pengaruh suhu dan konsentrasi terhadap perubahan konduktivitas larutan HCl dan larutan CH3COOH. Semakin besar konsentrasi
larutan, konduktivitas larutan semakin besar. Semakin tinggi suhu larutan, konduktivitas larutan semakin kecil.Dari hasil perhitungan juga diketahui bahwa ada hubungan interaksi antara suhu dan konsentrasi larutan terhadap konduktivitas larutan.
ANALYSIS OF VARIANCE FOR INFLUENCE OF TEMPERATURE AND CONCENTRATION TOWARD CHANGE OF CONDUCTIVITY ACETIC
ACID (CH3COOH) AND CHLORIDE ACID (HCl)
IN AQUEOUS SOLUTION
ABSTRACT
The investigation about the influence of temperature and concentration on the change of conductivity of electrolyte solution has been performed.The type of utilized electrolyte solution was strong electrolyte of acid chloride (HCl) and weak electrolyte of acetic acid (CH3COOH) in aqueous solution. In this
investigation, the varieties of concentration of electrolyte solutions were 0,01 M; 0,02 M and 0,03 M. The varieties of temperature of electrolyte solution were 300C, 400C and 500C. The conductivity of these solutions was measured by using Conductometer of ECTestr11 Model. Through the calculation result by variant factorial 3 x 3 analysis of fixed model, there was influence of temperature and
concentration on conductivity solution of HCl and CH3COOH. The higher
concentration of electrolytes, conductivity of solutions increase.The higher temperature of electrolytes, conductivity of solutions decrease.Also through the calculation, there was interaction between temperature and concentration on the change of solution conductivity.
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Berdasarkan sifat konduksi dan nilai konduktivitasnya, material dapat
diklasifikasikan sebagai konduktor, semikonduktor dan isolator (dielektrik).Sifat
khusus dari suatu konduktor adalah kehadiran muatan listrik bebas di dalamnya.
Perpindahan muatan-muatan bebas ini dalam suatu medan listrik disebut sebagai
arus listrik. Perpindahan arus listrik dalam suatu konduktor dapat berupa elektron
atau ion.Konduktor berupa ion dikenal sebagai elektrolit. Istilah ini juga berlaku
untuk zat-zat yang awalnya tidak menghantarkan listrik, tetapi bias menghasilkan
ion-ion penghantar listrik ketika dilarutkan di dalam air atau pelarut lain
(Bagotsky, 2006).
Zat-zat yang dalam larutan akan terdisosiasi sempurna disebut elektrolit
kuat. Banyak juga zat-zat yang berbentuk molekul bila dilarutkan dalam air yang
sama sekali tidak mempunyai kemampuan untuk terionisasi, seperti alkohol dan
gula. Bila senyawa ini dilarutkan dalam air, molekul-molekulnya hanya
bercampur dengan molekul-molekul air membentuk larutan yang homogen, tetapi
larutannya tidak mengandung ion-ion. Karena zat terlarut tidak menghasilkan ion
dalam larutan, larutannya tidak menghantarkan listrik dan disebut non elektrolit.
Di antara elektrolit kuat dan non elektrolit ada sejumlah senyawa yang disebut
elektrolit lemah.Senyawa-senyawa ini menghasilkan larutan yang menghantarkan
listrik, tetapi lemah sekali. Misalnya dalam larutan CH3COOH 1,0 M hanya
kira-kira 0,42% yang bereaksi membentuk ion. Sisanya masih tetap berbentuk molekul
Konduktivitas listrik larutan dan ketergantungannya terhadap konsentrasi,
sifat kimia pelarut dan suhu merupakan perhatian utama baik secara teori maupun
secara teknologi. Pada aplikasi bidang teknik, pengetahuan mengenai
konduktivitas listrik penting untuk merancang dan mengoptimasi berbagai proses
dan peralatan, terutama yang melibatkan sistem elektrokimia seperti peralatan
elektrolisis dan baterai. Konduktivitas listrik juga dapat digunakan untuk
menambah wawasan mengenai sifat-sifat larutan elektrolit dan menghitung
besaran fisika seperti konstanta disosiasi. Penelitian mengenai konduktivitas
dewasa ini lebih dikembangkan pada model teoritis untuk pengukuran
konduktivitas larutan pekat dan sistem pelarut campuran (Anderko, 2004).
Penelitian mengenai konduktivitas larutan elektrolit encer pernah dilakukan antara
lain oleh Husniati (2005) menggunakan elektrolit kuat berupa HCl, H2SO4 dan
H3PO4 dimana ketika konsentrasi semakin meningkat konduktivitas menurun.
Sedangkan penelitian Faradesy (2005) menggunakan larutan elektrolit lemah
berupa asam oksalat, asam benzoate dan asam asetat dimana konduktivitas
meningkat ketika konsentrasi meningkat juga.Sedangkan hasil penelitian
keduanya menunjukkan bertambah besarnya konduktivitas dengan meningkatnya
suhu.
Berdasarkan uraian di atas, maka dalam penelitian ini digunakan larutan
elektrolit kuat dan lemah karena diperkirakan mekanisme ion-ion larutan dalam
menghantarkan listrik sama. Variasi konsentrasi dan suhu serta volume larutan
yang sama digunakan untuk kedua elektrolit tersebut. Kemudian diharapkan
dalam penelitian ini dapat memperlihatkan pengaruh yang sebenarnya dihasilkan
sehingga dapat memberikan informasi dan manfaat untuk penelitian terkait
1.2 Permasalahan
Permasalahan dalam penelitian ini adalah :
1. Apakah ada perbedaan perubahan konduktivitas elektrolit kuat dan
elektrolit lemah yang dipengaruhi oleh suhu.
2. Apakah ada perbedaan perubahan konduktivitas elektrolit kuat dan
elektrolit lemah yang dipengaruhi oleh konsentrasi.
3. Apakah ada interaksi antara suhu dan konsentrasi terhadap
konduktivitas larutan.
1.3 Pembatasan Masalah
Adapun pembatasan masalah dalam penelitian ini adalah sebagai berikut :
1. Elektrolit kuat yang digunakan adalah asam klorida (HCl) dan
elektrolit lemah yang digunakan asam asetat (CH3COOH).
2. Konsentrasi larutan elektrolit yang digunakan adalah 0,01 M; 0,02
M; dan 0,03 M.
3. Suhu pemanasan larutan elektrolit yaitu 30oC; 40oC; dan 50oC. 4. Volume larutan elektrolit yang digunakan adalah sama yaitu 100 mL.
I.4 Hipotesis
Pada penelitian ini akan dibuktikan hipotesis berikut :
1. Hipotesis Nol (H0)
1 0
H
= bahwa tidak ada perubahan konduktivitas elektrolit kuat dan elektrolit lemah yang dipengaruhi oleh suhu
2 0
H = bahwa tidak ada perubahan konduktivitas elektrolit kuat
3 0
H
= bahwa tidak ada interaksi antara suhu dan konsentrasi
terhadap konduktivitas larutan elektrolit kuat dan elektrolit
lemah.
2. Hipotesis Alternatif (Ha)
1
a
H = bahwa ada perubahan konduktivitas elektrolit kuat dan
elektrolit lemah yang dipengaruhi oleh suhu
2
a
H = bahwa ada perubahan konduktivitas elektrolit kuat dan
elektrolit lemah yang dipengaruhi oleh konsentrasi
3
a H
= bahwa ada interaksi antara suhu dan konsentrasi terhadap
konduktivitas larutan elektrolit kuat dan elektrolit lemah
I.5 Tujuan Penelitian
Penelitian ini bertujuan untuk membandingkan bagaimana pengaruh suhu dan
konsentrasi terhadap perubahan konduktivitas larutan elektrolit lemah dan
elektrolit kuat dan membuktikannya secara statistik.
I.6 Manfaat Penelitian
Dengan diperolehnya perbandingan terhadap perubahan konduktivitas elektrolit
lemah dan elektrolit kuat yang dipengaruhi oleh perubahan suhu dan konsentrasi,
maka diharapkan dapat diketahui bagaimana mekanisme ion-ion dalam larutan
I.7 Metodologi Penelitian
Dalam penelitian ini dilakukan variasi suhu pemanasan, konsentrasi larutan
elektrolit, dan jenis larutan elektrolit sebagai variabel bebas.Sedangkan
faktor-faktor lain yang berpengaruh yaitu tekanan udara sebagai variabel tetap.Untuk
setiap variasi tersebut diamati hantaran listriknya (variabel terikat).Oleh karena
itu, penelitian ini adalah penelitian eskperimental.Dalam penelitian ini ingin
dilihat pengaruh dua faktor (suhu dan konsentrasi) terhadap konduktivitas
larutan.Eksperimen dilakukan dengan desain faktorial.Desain faktorial ini desain
yang paling efisien untuk menyelidiki efek dua atau lebih faktor karena
masing-masing pengamatan menyuplai informasi tentang semua faktor (Suwanda, 2011).
Variasi konsentrasi larutan elektrolit dan suhu pemanasan ditetapkan
terlebih dahulu, yaitu : 0,01 M; 0,02 M; dan 0,03 M untuk konsentrasi larutan dan
30oC; 40oC; dan 50oC untuk suhu pemanasan larutan elektrolit. Hal ini berarti eksperimen ini memiliki dua buah faktor dengan tiap faktor bertaraf tiga, dengan
demikian eksperimen ini merupakan eksperimen faktorial 32.Perhatikan bahwa
dalam 32, bilangan 2 menyatakan banyak faktor sedangkan bilangan 3
menunjukkan banyak taraf yang dimiliki faktor-faktor (Sudjana, 1994).Dengan
demikian, terdapat 9 kombinasi perlakuan dan masing-masing kombinasi
dilakukan 3 kali pengulangan.54 unit eksperimen diuji secara acak berurut untuk
suatu desain acak lengkap.Untuk mendapatkan konduktansi, maka larutan diukur
dengan alat pengukur konduktivitas ECTestr11.Hasil yang diperoleh dianalisis secara Anava (Analisis Varian).
I.8 Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Kimia Fisika, Fakultas Matematika dan
BAB 2
TINJAUAN PUSTAKA
2.1 Klasifikasi Elektrolit
Perhitungan derajat disosiasi untuk berbagai elektrolit dalam larutan berair
menunjukkan bahwa secara praktis semua garam terdisosiasi sempurna menjadi
ion-ionnya. Hal yang sama juga berlaku untuk asam-asam dan basa-basa kuat.
Seperti yang diharapkan dari derajat disosiasinya yang tinggi, larutan dari zat-zat
ini merupakan konduktor elektrik yang baik. Di lain pihak, terdapat banyak zat
yang larutannya menunjukkan konduktivitas yang relatif rendah, hal ini
menandakan bahwa larutan-larutan tersebut hanya sedikit terdisosiasi. Di antara
larutan-larutan ini termasuk sejumlah besar asam-asam organik seperti asam
asetat, propanoat, dan benzoat; asam-asam anorganik seperti asam karbonat, asam
sulfida, dan asam sianida; dan basa-basa seperti ammonium, seng, dan timbal
hidroksida.
Larutan dari zat-zat yang menunjukkan konduktansi yang baik dan
menandakan derajat disosiasi yang tinggi dalam larutan digolongkan sebagai
elektrolit kuat.Sebaliknya, larutan dari zat-zat yang hanya menunjukkan
konduktivitas yang lemah dan derajat disosiasi yang rendah disebut elektrolit
lemah (Maron, 1978).
2.2 Konduktivitas Elektrolit
Hambatan suatu konduktor elektrolit terhadap arus yang lewat dapat ditentukan
dengan menggunakan Hukum Ohm terhadap konduktor tersebut.Namun, sebagai
pengganti hambatan, di sini lebih sesuai menggunakan istilah konduktansi, yang
Seperti yang telah diketahui, hambatan tiap konduktor berbanding lurus
secara langsung dengan panjangnya dan berbanding terbalik dengan luas
permukaannya,
R = ρ �� (1)
di mana R adalah hambatan dalam ohm, l adalah panjang dalan sentimeter, A
adalah luas dalam sentimeter kuadrat, dan ρ adalah hambat jenis. Nilai ρ
tergantung pada dan merupakan karakteristik alami dari konduktor tersebut. Dari
persamaan (1) pernyataan untuk konduktansi L adalah sebagai berikut :
L = 1
� =
1
ρ� �
��
L = κ ��
�� (2)
di mana κ = 1 / ρ merupakan konduktansi jenis dari konduktor, satuannya
dinyatakan dalam kebalikan ohm atau mhos per sentimeter atau ohm-1 per sentimeter (Maron, 1978).
Jelas sekali bahwa suatu zat yang memiliki tahanan yang sangat kecil
terhadap aliran arus akan melewatkan lebih banyak arus. Dengan demikian
kemampuan suatu zat untuk menghantarkan listrik atau konduktivitas merupakan
kebalikan dari tahanan.Kebalikan dari tahanan jenis ini disebut konduktansi
spesifik atau konduktivitas spesifik. Konduktansi atau konduktivitas jenis ini
didefinisikan sebagai : konduktivitas satu sentimeter kubik (cc) suatu larutan
elektrolit. Konduktivitas spesifik disimbolkan dengan κ (kappa). Dengan demikian,
κ =1
� =
1
�x
1
� (3)
Konduktivitas spesifik meningkat jika : (i) konsentrasi ion, dan (ii)
Suatu besaran yang lebih berguna adalah konduktivitas ekivalen (Ʌ).
Konduktivitas ekivalen suatu larutan didefinisikan sebagai konduktivitas di antara
dua elektroda yang berjarak 1 m satu sama lain yang mengandung tepat 1 ekivalen
zat elektrolit. Satu ekivalen zat elektrolit adalah jumlah zat yang terlarut dalam
larutan yang akan menghasilkan muatan eN0 dan –eN0, di mana e adalah muatan
listrik dan N0 adalah bilangan Avogadro. Misalkan konsentrasi larutan elektrolit
adalah c ekivalen per liter, maka volume larutan yang mengandung 1 ekivalen
akan menjadi 1 / c liter. Dengan demikian konduktivitas ekivalen diberikan oleh
persamaan :
Ʌ = �
1000� (4)
di mana faktor 1000 berguna mengubah konsentrasi menjadi ekivalen m-3(1 liter = 10-3 m3). Karena satuan κ adalah Ω -1m-1, Ʌ memiliki satuan Ω -1 ekivalen-1 m2.Keuntungan menggunakan Ʌ sebagai pengganti konduktivitas spesifik (κ)
adalah Ʌ memudahkan ki ta untuk mengubah pengukuran-pengukuran
konduktivitas yang berbeda menjadi satuan konsentrasi yang umum.
Dalam satuan SI, kita menggunakan konduktivitas molar (Ʌ) yang
diberikan oleh persamaan κ / 1000 c, di mana c sekarang dalam satuan mol liter-1
dan Ʌ dalam Ω-1 mol-1 m2. Untuk elektrolit univalen seperti NaCl, konduktivitas ekivalen sama dengan konduktivitas molar. Untuk larutan bivalen seperti CuSO4,
konduktivitas molar adalah dua kali konduktivitas ekivalen (Chang, 1977).
Berdasarkan konduktivitasnya, dapat dikelompokkan 2 bagian kelas
elektrolit.Elektrolit kuat, seperti kebanyakan garam, dan asam-asam seperti asam
klorida, asam nitrat, dan sulfat, memiliki konduktivitas molar yang tinggi yang
meningkat tidak terlalu besar ketika diencerkan.Elektrolit lemah, seperti asam
asetat dan asam-asam organik lainnya dan larutan ammonia, yang memiliki
konduktivitas molar yang rendah pada konsentrasi tinggi, tetapi nilainya naik
2.3 Variasi Konduktivitas terhadap Konsentrasi
2.3.1. Variasi Konduktivitas terhadap Konsentrasi Elektrolit Kuat
Konduktivitas ekivalen suatu larutan tidak bervariasi secara linear dengan
konsentrasi. Pengaruh konsentrasi pada konduktivitas ekivalen dapat dipelajari
dengan memplotkan nilai-nilai Ʌ dengan nilai akar dari konsentrasi. Diketahui
bahwa variasi konduktivitas ekivalen dengan √� bergantung pada sifat elektrolit
tersebut.
Elektrolit kuat terionisasi sempurna pada berbagai konsentrasi (atau
pengenceran).Peningkatan konduktivitas ekivalen bukan karena peningkatan arus
yang dibawa oleh spesi ion. Faktanya hal ini disebabkan oleh penurunan gaya
tarik-menarik di antara ion-ion yang muatannya berlawanan seiring dengan
penurunan konsentrasi (atau peningkatan pengenceran). Pada konsentrasi yang
lebih tinggi, gaya tarik-menarik di antara ion-ion yang berlawanan meningkat (F
∞ q1 q2 / r2). Sebagai akibatnya, hal ini mempengaruhi kecepatan ion-ion dalam
pergerakannya menuju elektroda yang bermuatan berlawanan.Peristiwa ini disebut
interferensi ionik.Ketika suatu larutan menjadi semakin encer, konduktivitas
ekivalen meningkat, hingga mencapai nilai batasnya.Nilai ini disebut sebagai
konduktivitas ekivalen pada pengenceran yang tidak terbatas (konsentrasi nol).
2.3.2. Teori Debye-Huckel
Suatu penjelasan yang masuk akal untuk penurunan konduktivitas molar seiring
dengan kenaikan konsentrasi untuk elektrolit kuat pertama kali diusulkan pada
tahun 1984 oleh seorang berkebangsaan Jerman Johannes Jacobus van Laar
(1860-1938).Ia mengatakan bahwa gaya-gaya elektrostatis yang kuat yang ada di
dalam suatu larutan ionik memiliki pengaruh yang penting pada sifat-sifat larutan.
Tahun 1923, Debye dan Huckel mengumumkan suatu hubungan
kuat disebabkan oleh saling interferensi ion-ion, yang menjadi semakin kuat
ketika konsentrasi meningkat. Karena gaya tarik-menarik yang kuat di antara
ion-ion yang berlawanan tanda, susunan ion-ion-ion-ion di dalam larutan tidak sepenuhnya
acak. Di daerah sekitar tiap ion positif, terdapat kecenderungan menarik ion-ion
negatif daripada ion-ion positif, sedangkan untuk tiap ion negatif terdapat
kecenderungan menarik ion-ion positif daripada negatif.Misalkan pada NaCl,
dalam bentuk padatan terdapat susunan yang teratur ion natrium dan ion
klorida.Ketika NaCl dilarutkan dalam air, susunan ini masih dipertahankan
sedikit. Ion-ion jaraknya menjadi lebih jauh satu sama lain daripada dalam
padatan; oleh karena itu gaya tarik-menarik elektrostatik menjadi lebih kecil dan
gerakan termal menyebabkan ketidakteraturan. Namun demikian, sejumlah kecil
susunan yang masih ada cukup untuk memberikan pengaruh yang penting pada
konduktivitas larutan (Laidler, 1982).
Teori Debye-Huckel menjelaskan bahwa kenaikan konduktivitas larutan elektrolit kuat terhadap pengenceran didasarkan pada dua pengaruh berikut :
a. Efek Relaksasi atau Efek Asimetris
Di dalam larutan, setiap ion dikelilingi oleh suatu atmosfer ionik dari muatan yang
berlawanan. Selama tidak ada medan listrik yang diberikan, atmosfer ionik tetap
simetris di sekitar ion pusat. Namun, ketika arus listrik dilewatkan melalui larutan,
ion-ion yang berada di tengah bergerak menuju elektroda yang berlawanan
muatan.Ketika ion tersebut bergerak keluar dari atmosfer ionik, ion tersebut
membentuk lagi suatu atmosfer ionik dengan muatan yang berlawanan dan
meninggalkan atmosfer ionik yang lama.Namun demikian, perusakan atmosfer
ionik yang lama dan pembentukan atmosfer ionik yang baru tidak terjadi seketika
itu juga.Terdapat suatu rentang waktu yang disebut waktu relaksasi di antara
perusakan atmosfer yang lama dan pembentukan atmosfer yang baru.Selama
waktu ini, atmosfer ionik yang lama menarik ion yang bergerak ke arah yang
berlawanan dan dengan demikian menghambat pergerakannya.Dengan demikian
efek ini disebut efek relaksasi.
Penjelasan alternatifnya, dapat diasumsikan bahwa ketika ion pusat
atmosfer ionik ditinggalkan di belakang daripada yang ada di depan. Kelebihan
ion pada atmosfer ionik yang ada di belakang ion yang bergerak akan menarik
kembali ion dan menahan pergerakannya. Sehingga efek yang disebabkan tidak
simetrisnya atmosfer ionik dari ion yang bergerak disebut efek asimetris.
b. Efek Elektroforesis
Ketika tegangan listrik diberikan, ion pusat bergerak ke satu arah dan atmosfer ion
yang bermuatan berlawanan bergerak ke arah yang sebaliknya.Saat atmosfer ionik
ini bergerak, molekul-molekul pelarut yang terasosiasi dengannya juga
bergerak.Dengan demikian aliran atmosfer ionik dan molekul-molekul pelarut
yang terikat padanya terjadi dengan arah yang berlawanan dengan pergerakan ion
pusat. Dengan kata lain, ion pusat bergerak melawan arus. Dengan demikian
pergerakan ion semakin terhambat.Efek ini disebut Efek Elektroforesis. Di
samping dua efek di atas, gaya penahan ketiga adalah tahanan geseran normal
yang disebabkan oleh medium yang mana tergantung pada viskositas medium,
konstanta dielektrik dan sebagainya.
Berdasarkan penjelasan tersebut, Debye dan Huckel (1923) menurunkan
suatu pernyataan matematis untuk variasi konduktivitas ekivalen terhadap
konsentrasi.Persamaan ini lebih lanjut dikembangkan oleh Onsager (1926-27) dan
sekarang dikenal sebagai Persamaan Debye-Huckel-Onsageratau secara sederhana
disebut Persamaan Onsager. Untuk suatu elektrolit bervalensi satu, persamaan
tersebut dinyatakan dalam bentuk :
( )
82,4 8( )
,20 103/2 0 (5) 52 / 1
0 c
DT DT
c
Λ × + −
Λ = Λ
η
di mana : Λc = Konduktivitas ekivalen pada konsentrasi c
0
Λ = Konduktivitas ekivalen pada pengenceran tidak
terbatas
D = Konstanta dielektrik medium
η = Viskositas medium
c = Konsentrasi larutan dalam mol/liter
Karena Ddan η nilainya tetap untuk pelarut tertentu, maka pada suhu
yang tetap, persamaan di atas dapat dinyatakan dalam bentuk :
(
0)
(6)0 c
c =Λ − Α+ΒΛ
Λ
di mana A dan B nilainya tetap untuk pelarut tertentu pada suhu tertentu (Madan,
2007).
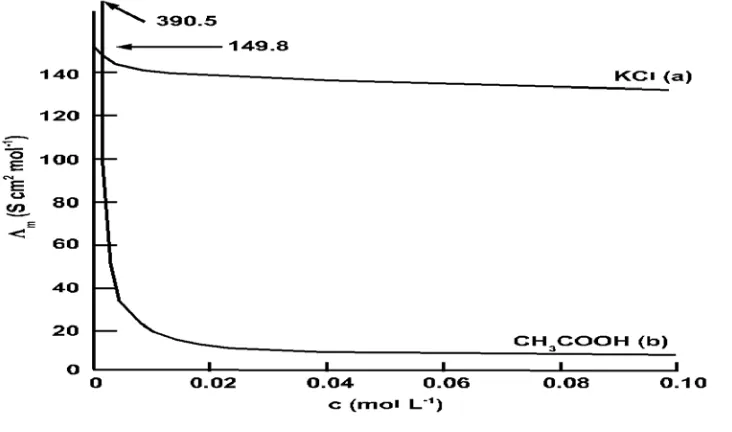
Pengukuran konduktivitas yang cukup teliti dilakukan oleh Kohlrausch di
abad ke-19; beberapa datanya ditunjukkan dalam Gambar 2.1. Berdasarkan
persamaan (4), kelihatannya bahwa Ʌ tida k akan tergantung pada konsentrasi
larutan (κ berbanding lurus dengan konsentrasi, tetapi κ / c seharusnya menjadi
tetap untuk zat tertentu). Namun demikian, hal ini tidak sesuai kenyataan. Sebagai
pengganti, Kohlrausch menemukan hubungan berikut yang sesuai untuk larutan
elektrolit kuat :
Ʌ = Ʌ0 – B √� (7)
di mana B adalah tetapan untuk elektrolit tertentu dan Ʌ 0 adalah konduktivitas
ekivalen pada pengenceran tak hingga; yakni, Ʌ = Ʌ 0 ketika c → 0. Dengan
demikian Ʌ0 dapat dengan cepat diperoleh dengan memplotkan Ʌ dengan √� dan
ekstrapolasinya ke konsentrasi nol. Metode ini tidak sesuai untuk elektrolit lemah
karena kecuraman kurva tersebut pada konsentrasi yang rendah (Chang, 1977).
Tidak seperti konduktivitas jenis (κ), konduktivitas ekivalen Ʌ baik
elektrolit kuat maupun lemah meningkat jika diencerkan.Alasan untuk hal ini
adalah bahwa penurunan konduktivitas jenis (κ) masih lebih kecil dibandingkan
dengan kenaikan nilai 1/C pada pengenceran, dan dengan demikian Ʌ
dilihat bahwa nilai Ʌ untuk elektrolit lemah dan kuat berperilaku berbeda ketika
konsentrasi diturunkan. Pada pengenceran elektrolit kuat hingga konsentrasi 0,001
atau 0,0001 N, Ʌ dengan cepat mencapai suatu nilai mendekati nilai batas
konduktivitas pada konsentrasi nol, Ʌ o. Di lain pihak, walaupun konduktivitas
ekivalen elektrolit lemah meningkat dengan cepat pada pengenceran, pada
konsentrasi yang disebutkan di atas masih sangat jauh dari nilai batasnya. Sebagai
contoh, Ʌ pada 25 oC untuk larutan 0,001 N natrium klorida adalah 123,7 sedangkan Ʌo adalah 126,5. Pada konsentrasi dan temperatur yang sama Ʌ untuk
asam asetat hanya 49,2, sementara Ʌ o adalah 390,7. Karena perbedaan yang
mendasar ini dalam hal sifat konduktivitas ekivalen elektrolit kuat dan lemah pada
pengenceran, prosedur yang bermacam-macam harus digunakan untuk
memperoleh nilai batas konduktivitas ekivalennya (Maron, 1978).
Gambar 2.1.Variasi konduktivitas molar sebagai fungsi konsentrasi molar : (a)elektrolit kuat dan (b)elektrolit lemah (Sumber : Maron, 1978)
Nilai Ʌ yang diperhitungkan ke konsentrasi nol disebut konduktivitas
molar pada pengenceran yang tidak terbatas, Ʌ o. Perhitungan ini dibuat dengan
mudah untuk elektrolit kuat tetapi tidak mungkin untuk membuatnya dengan
akurat untuk elektrolit lemah karena kenaikan Ʌ yang curam pada pengenceran
yang banyak, di mana pengukuran dari percobaan menjadi tidak pasti (Moore,
2.3.3. Variasi Konduktivitas terhadap Konsentrasi Elektrolit Lemah
Elektrolit lemah memiliki konsentrasi ionik yang lemah dan dengan demikian
gaya-gaya interionik dapat diabaikan.Kecepatan ion-ion tidak terpengaruh dengan
penurunan konsentrasi (atau peningkatan pengenceran).Peningkatan dalam
konduktivitas ekivalen seiring dengan peningkatan pengenceran disebabkan oleh
peningkatan jumlah spesi pembawa arus. Dengan kata lain, derajat ionisasi (α)
meningkat. Dengan demikian peningkatan konduktivitas ekivalen (Ʌ) dalam
kasus elektrolit lemah disebabkan oleh peningkatan jumlah ion (Bahl, 2007).
Konduktivitas molar elektrolit lemah turun jauh lebih cepat dengan
kenaikan konsentrasi. Arrhenius mengusulkan bahwa derajat disosiasi suatu
elektrolit dihubungkan dengan konduktivitas molar oleh persamaan :
α = ɅɅo (8)
Ostwald menggunakan hubungan ini dan menghubungkannya dengan
hukum aksi massa untuk menjelaskan variasi konduktivitas molar elektrolit lemah
dengan konsentrasi. Perhatikan disosiasi asam asetat : HAc ↔ H+ + Ac- ; jika α adalah derajat disosiasinya, maka [H+]= [Ac-] = α c, d an [HAc] = (1- α) c. Konstanta kesetimbangannya adalah :
) 9 ( 1
2 α α
−
= c
K
Dengan menggunakan α = ɅɅo , kita memperoleh :
) 10 ( )
( 0
0 2
Λ − Λ Λ
Λ
= c
K
Untuk memperoleh nilai Ʌ o untuk suatu elektrolit lemah kita
menggunakan Hukum Kohlrausch. Dengan menggunakan asam asetat sebagai
contoh, kita peroleh pada pengenceran tidak terbatas :
ɅoHAc = λ0 H+ + λ0 Ac-
Pada tiap sisi dari persamaan ini kita tambahkan Ʌ o garam dari asam kuat dan
basa kuat, seperti NaCl,
Ʌo HAc + ɅoNaCl = λ0 H+ + λ0 Cl- + λ0 Na+ + λ0 Ac- ,
yang selanjutnya dapat ditulis dalam bentuk :
Ʌo HAc + Ʌo NaCl = Ʌo HCl + ɅoNaAc ;
dengan demikian :
Ʌo HAc = Ʌo HCl + Ʌo NaAc - Ʌo NaCl
Konduktivitas molar pada sisi kanan semuanya dapat diperoleh dengan ektrapolasi
pada grafik plot Ʌ dengan √� , karena semua zat-zat yang terlibat merupakan
elektrolit kuat.
Suatu metode alternatif untuk memperoleh K dan Ʌo untuk suatu elektrolit
lemah dengan menyusun ulang persamaan (10) sehingga diperoleh persamaan :
) 11 ( 1
1
2 0
0 Λ
Λ + Λ =
Λ K
c
Jika 1/Ʌ diplotkan terhadap cɅ, diperoleh suatu garis lurus, yang nilai
intersepnya sama dengan 1/ Ʌ o dan kemiringannya sebesar 1/KΛ20. Metode ini
hanya memerlukan data pada konduktivitas elektrolit lemah itu sendiri (Castellan,
1964).
Konduktivitas semua elektrolit meningkat seiring kenaikan suhu. Variasi Ʌ o
terhadap suhu dapat dinyatakan dengan persamaan
Ʌo(t) = Ʌo(25oC) [1 + β(t – 25)] (12)
di mana Ʌo(t) adalah batas konduktansi ekivalen pada suhu toC, Ʌo(25oC) pada
suhu 25oC, dan β adalah suatu tetapan. Untuk garam-garam β biasanya adalah 0,022 hingga 0,025, untuk asam 0,016 hingga 0,019. Perilaku yang sama
ditunjukkan oleh konduktivitas ekivalen elektrolit kuat pada konsentrasi tertentu.
Namun, dengan elektrolit lemah, variasi Ʌ dengan temperatur tidak biasa, karena
pada elektrolit lemah pemanasan tidak hanya meningkatkan kecepatan ion-ion dan
perubahan gaya-gaya interionik, tetapi juga derajat disosiasinya (Maron, 1978).
Persamaan di atas berlaku untuk konduktivitas tiap-tiap ion, dan untuk
hampir semua ion, kecuali H+ dan OH-, nilai β adalah 0,018 hingga 0,022; untuk ion hidrogen adalah 0,0142, dan untuk ion hidroksil adalah 0,016. Dengan ini,
dapat dikatakan bahwa semakin tinggi konduktivitas ionik semakin kecil koefisien
suhu, sehingga perbedaan nilai untuk ion-ion yang berbeda menjadi semakin kecil
ketika suhu dinaikkan.
Kesimpulan yang dikemukakan tersebut secara khusus berlaku untuk
pengenceran yang tidak terbatas, tetapi hanya berlaku untuk elektrolit kuat pada
konsentrasi yang cukup besar. Namun untuk elektrolit lemah, memperlihatkan
beberapa ketidaknormalan :konduktivitas elektrolit lemah terutama tergantung
pada derajat disosiasi, dan karena nilainya biasanya berkurang jika suhu
dinaikkan, maka kemungkinan konduktivitas, khususnya untuk larutan dengan
konsentrasi tinggi, meningkat hingga suatu nilai maksimum dan kemudian
berkurang ketika suhu dinaikkan (Glasstone, 1968).
Karena di dalam larutan elektrolit arus listrik dibawa oleh ion-ion, maka untuk
konsentrasi ion-ion yang sama dengan valensi yang sama, larutan yang memiliki
pergerakan ion yang lebih cepat akan menjadi konduktor yang lebih baik.
Kenyataannya pada pengenceran yang tidak terbatas, ketika ion-ion terpisah
terlalu jauh sehingga tidak ada pengaruh satu dengan yang lainnya, konduktivitas
semata-mata akan tergantung pada kecepatan anion dan kation.
Jika u dan v sentimeter per detik berturut-turut menyatakan kecepatan
kation dan anion, di bawah suatu tegangan 1 volt per sentimeter, kemudian dalam
larutan yang mengandung satu ekivalen elektrolit valensi satu pada pengenceran
yang tidak terbatas uF coulomb muatan positif akan dibawa oleh kation dalam 1
detik, dan vF coulomb muatan negatif akan dibawa oleh anion dalam waktu yang
sama. Dengan demikian arus total yang mengalir melalui larutan akan menjadi :
� =�1 = Ʌo= �� − �(−�) = (�+�)� (13)
coulomb per detik, atau ampere. Besaran u dan v kadang-kadang disebut mobilitas
ion.Karena kecepatan ion-ion merupakan sifat yang khas, maka untuk menghitung
nilai konduktivitas ekivalen pada konsentrasi nol dari berbagai larutan elektrolit
harus dijumlahkan.Hubungan penjumlahan ini ditemukan oleh Kohlrausch, dan
disebut hukum Kohlrausch atau hukum perpindahan bebas ion-ion. Diperoleh juga
dari hukum ini bahwa perbedaan nilai Ʌo untuk garam-garam dari kation atau
anion yang sama harus sama. Hal ini ditunjukkan pada Tabel 2.1,
Anion (X)
Garam K Ʌo = (uK+ + vX-) F
Garam Na
Ʌo = (uNa+ + vX-) F (uK+ - uNa+ ) F
F- 111,2
(18,8)
90,1 (18,8)
21,1
Cl- 130,0
(31,5)
108,9 (31,5)
21,1
IO3- 98,5
(27,8)
77,4 (27,8)
21,1
NO3- 126,3 105,2 21,1
Sumber : Creighton, 1951
Pada tabel tersebut diberikan konduktansi ekivalen pada konsentrasi
dengan pengenceran tak hingga dari sejumlah garam natrium dan kalium pada
suhu 18 oC. Perbedaan di antara konduktivitas ekivalen garam natrium dan kalium dari anion yang sama diberikan pada kolom yang ke empat. Nilai yang dikurung
menyatakan perbedaan di antara konduktivitas ekivalen garam natrium dan kalium
untuk anion yang berurutan (Creighton, 1951).
Pernyataan yang unik pada Hukum Kohlarausch ini adalah bahwa
konduktivitas ion-ion merupakan sifat ion tersebut secara tunggal, dan tidak
bergantung pada ion-pasangannya.Hal ini tepat untuk pengenceran yang tidak
terbatas, tetapi tidak terlalu tepat pada pengenceran yang terbatas.Namun
demikian, hukum ini seringkali digunakan untuk pengenceran yang terbatas
sebagai suatu perkiraan (Noggle, 1983).
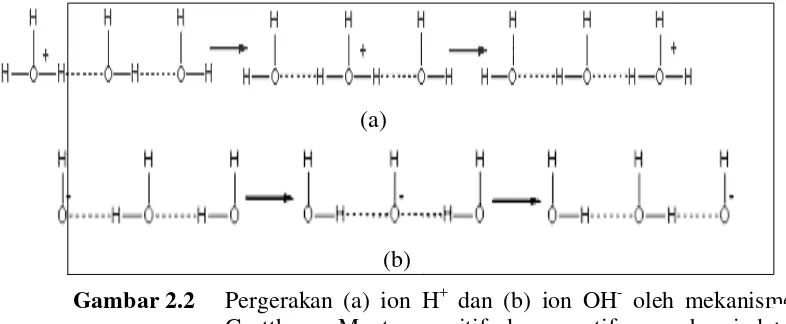
2.6 Konduktivitas Ion Hidrogen dan Ion Hidroksil
Konduktivitas ion hidrogen dan ion hidroksil lebih besar daripada ion-ion lainnya.
Sementara ion-ion lainnya bergerak seperti suatu bola yang terdorong melewati
suatu medium yang kental, nilai konduktivitas ion molar yang sangat besar
proton dari satu spesi ke spesi lainnya. Untuk konduksi oleh ion H+, suatu proton dipindahkan dari ion H3O+ ke molekul air yang ada di dekatnya, yang mana
kemudian air tersebut berubah menjadi ion H3O+. Prosesnya kemudian berulang,
ion H3O+ yang baru terbentuk memindahkan lagi proton ke molekul air
berikutnya, dan demikian seterusnya.
Proses perpindahan proton menghasilkan suatu perpindahan muatan positif
yang lebih cepat dari satu wilayah larutan ke wilayah lainnya daripada yang akan
mungkin jika ion-ion H3O+ mendorong jalannya melalui larutan sebagaimana
seharusnya ion-ion lainnya. Karena alasan ini juga konduktivitas ion H+ dan OH -tidak berhubungan dengan viskositas larutan (Castellan, 1964).
Suatu mekanisme yang diusulkan oleh T. van Grotthuss pada tahun 1805
menjelaskan konduksi ion H3O+ dan OH-. Gambar 2.2 menunjukkan bagaimana
serangkaian perpindahan proton di antara molekul-molekul air yang bersebelahan
dapat memberikan pengaruh tentang bagaimana pergerakan ion H+ dan OH -melalui larutan.Mobilitas H+ dan OH- yang tinggi dan fakta bahwa ion-ion tersebut merupakan hasil disosiasi pelarut kelihatannya saling berhubungan. Pada
pelarut yang lain, di mana mekanisme tersebut tidak berlangsung, ion H+ dan OH -akan memperlihatkan mobilitas yang sejalan dengan ion-ion lainnya (Barrow,
1979).
(a)
[image:33.595.113.506.537.699.2](b)
Gambar 2.2 Pergerakan (a) ion H+ dan (b) ion OH- oleh mekanisme Grotthuss. Muatan positif dan negatif yang berpindah-pindah terbentuk sebagai akibat serangkaian perberpindah-pindahan proton (Sumber : Barrow, 1979)
BAHAN DAN METODE PENELITIAN
3.1. Bahan-bahan yang digunakan
[image:34.595.151.487.268.393.2]Bahan-bahan yang digunakan dalam penelitian ini adalah sebagai berikut :
Tabel 3.1 Bahan-bahan Penelitian
Nama Bahan Spesifikasi Merek
Asam Klorida (HCl) p.a. 36% E. Merck
Akuades - -
Asam Oksalat (H2C2O4) p.a. E. Merck
Natrium Hidroksida (NaOH) p.a. E. Merck
Asam asetat glasial (CH3COOH) p.a. E. Merck
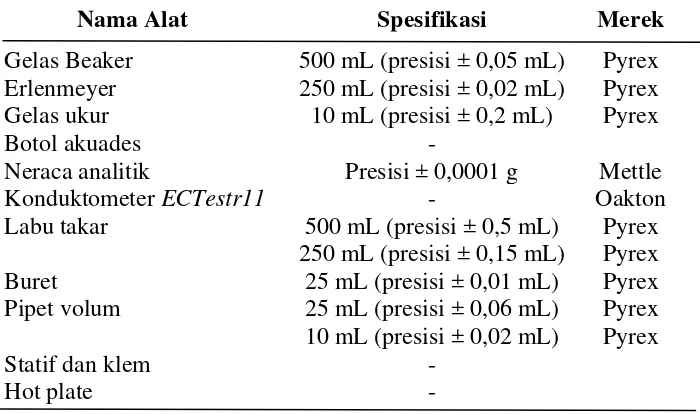
3.2. Alat-alat yang digunakan
[image:35.595.146.496.186.393.2]Alat-alat yang digunakan dalam penelitian ini adalah sebagai berikut :
Tabel 3.2 Alat-alat Penelitian
Nama Alat Spesifikasi Merek
Gelas Beaker 500 mL (presisi ± 0,05 mL) Pyrex
Erlenmeyer 250 mL (presisi ± 0,02 mL) Pyrex
Gelas ukur 10 mL (presisi ± 0,2 mL) Pyrex
Botol akuades -
Neraca analitik Presisi ± 0,0001 g Mettle
Konduktometer ECTestr11 - Oakton
Labu takar 500 mL (presisi ± 0,5 mL)
250 mL (presisi ± 0,15 mL)
Pyrex Pyrex
Buret 25 mL (presisi ± 0,01 mL) Pyrex
Pipet volum 25 mL (presisi ± 0,06 mL)
10 mL (presisi ± 0,02 mL)
Pyrex Pyrex
Statif dan klem -
Hot plate -
3.3.1. Sampling
Berdasarkan sifat unit eksperimen yang homogen, maka teknik sampling yang
digunakan adalah teknik rancangan acak kelompok faktorial.Pengambilan sampel
dilakukan dengan metode undian pengulangan dilakukan tiga kali untuk setiap
perlakuan dari masing-masing sampel.
3.3.2. Variabel
Dalam penelitian ini yang dipilih sebagai variabel bebas adalah suhu, konsentrasi
larutan elektrolit, dan jenis larutan elektrolit karena ketiga variabel tersebut
mempunyai pengaruh terhadap perubahan fenomena dari unit eksperimen
sasaran.Suhu yang digunakan adalah 30oC; 40oC; dan 50oC. Konsentrasi larutan yang digunakan adalah 0,01 M; 0,02 M; dan 0,03 M dan jenis larutan elektrolit
yang digunakan adalah HCl (elektrolit kuat) dan CH3COOH (elektrolit lemah).
Nilai daya hantar listrik hasil pengukuran dengan alat konduktometer yang
diakibatkan oleh adanya pengaruh dari variabel bebas ditetapkan sebagai variabel
terikat.Variabel tetap dalam penelitian ini adalah elektroda yang digunakan,
volume larutan dan tekanan udara.
3.3.3 Randomisasi
Randomisasi dilakukan sebagai berikut : sampel dibedakan untuk elektrolit kuat
(HCl) dan elektrolit lemah (CH3COOH). Untuk setiap sampel memiliki tiga
variasi suhu pemanasan dan tiga variasi konsentrasi yang masing-masing
dilakukan replikasi sebanyak 3 kali, maka total pengamatan yang harus dilakukan
dalam urutan sembarang untuk tiap jenis elektrolit adalah 27 kali perlakuan.
Kemudian setiap perlakuan diberi nomor sebagai berikut
Konsentrasi
(M)
Suhu (oC)
30 40 50
0,01 1
2 3
4 5 6
7 8 9
0,02 10
11 12
13 14 15
16 17 18
0,03 19
20 21
22 23 24
25 26 27
Satu angka dipilih dari 1 sampai 27 dengan cara undian ( misalnya angka
yang terpilih adalah 12, suhu 30oC dan konsentrasi 0,02 M ). Proses ini diulang sampai ke-27 perlakuan untuk elektrolit kuat dan elektrolit lemah yang telah
diberikan satu posisi dalam urutan.
3.3.4.1. Pembuatan Larutan
1. Pembuatan Larutan Standar KCl 0,1 M
Ditimbang 3,72 gram KCl dengan neraca analitis, kemudian dimasukkan
ke dalam labu takar 500 ml dan diencerkan hingga garis tanda.
2. Pembuatan Larutan H2C2O4 0,2 M
Ditimbang 3,15 gram H2C2O4 dengan neraca analitis kemudian
dimasukkan ke dalam labu takar 250 ml dan diencerkan hingga garis
tanda.
3. Pembuatan Larutan NaOH 0,2 M
Ditimbang 4,01 gram NaOH dengan neraca analitis kemudian dimasukkan
ke dalam labu takar 500 ml dan diencerkan hingga garis tanda.
4. Standarisasi Larutan NaOH 0,2 M
Larutan H2C2O4 0,2 M diukur sebanyak 10 ml, dengan menggunakan pipet
volum, dimasukkan ke dalam erlenmyer dan ditambahkan 3 tetes indicator
fenolftalein selanjutnya larutan ini dititrasi dengan larutan NaOH 0,2 M
sampai menunjukkan titik akhir titrasi yang ditandai dengan perubahan
warna. Diulangi sampai tiga kali perlakuan kemudian dicatat volume
NaOH yang terpakai dan dihitung konsentrasinya.
3.3.4.2. Pembuatan Larutan Elektrolit Kuat
1. Pembuatan Larutan HCl 0,5 M
Larutan HCl pekat diukur sebanyak 21,2 ml dengan menggunakan gelas
ukur, kemudian dimasukkan ke dalam labu takar 50 ml dan diencerkan
hingga garis tanda.
2. Pembuatan Larutan HCl 0,01 M
Larutan HCl 0,5 M diukur sebanyak 10 ml dengan menggunakan gelas
ukur, kemudian dimasukkan ke dalam labu takar 500 ml dan diencerkan
hingga garis tanda.
Larutan HCl 0,5 M diukur sebanyak 20 ml dengan menggunakan gelas
ukur, kemudian dimasukkan ke dalam labu takar 500 ml dan diencerkan
hingga garis tanda.
4. Pembuatan Larutan HCl 0,03 M
Larutan asam klorida diukur sebanyak 30 ml dengan menggunakan gelas
ukur, kemudian dimasukkan ke dalam labu takar 500 ml dan diencerkan
hingga garis tanda.
5. Standarisasi Larutan HCl
Masing-masing larutan HCl diukur sebanyak 10 ml dengan menggunakan
pipet volum, dimasukkan ke dalam gelas Erlenmeyer dan ditambah dengan
tiga tetes indikator bromtimol blue. Selanjutnya larutan ini dititrasi dengan
NaOH (NaOH yang dipakai adalah standarisasi dengan larutan asam
oksalat 0,2 M). Titrasi dilakukan sampai menunjukkan titik akhir titrasi
yang ditandai dengan adanya perubahan warna.Diulangi sampai tiga kali
perlakuan, dicatat volume NaOH yang terpakai dan dihitung
konsentrasinya.
3.3.4.3. Pembuatan Larutan Elektrolit Lemah
1. Pembuatan Larutan CH3COOH 0,01 M
Larutan asam asetat glasial diukur sebanyak 4,25 ml dengan
menggunakan gelas ukur, kemudian dimasukkan ke dalam labu takar 500
ml dan diencerkan hingga garis tanda.
2. Pembuatan Larutan CH3COOH 0,02 M
Larutan asam asetat glasial diukur sebanyak 2,83 ml dengan
menggunakan gelas ukur, kemudian dimasukkan ke dalam labu takar 500
ml dan diencerkan hingga garis tanda.
Larutan asam asetat glasial diukur sebanyak 1,42 ml dengan
menggunakan gelas ukur, kemudian dimasukkan ke dalam labu takar 500
ml dan diencerkan hingga garis tanda.
4. Standarisasi Larutan CH3COOH
Masing-masing larutan CH3COOH diukur sebanyak 10 ml dengan
menggunakan pipet volum, dimasukkan ke dalam gelas Erlenmeyer dan
ditambah dengan tiga tetes indikator fenolftalein. Selanjutnya larutan ini
dititrasi dengan NaOH (NaOH yang dipakai adalah standarisasi dengan
larutan asam oksalat 0,2 M). Titrasi dilakukan sampai menunjukkan titik
akhir titrasi yang ditandai dengan adanya perubahan warna.Diulangi
sampai tiga kali perlakuan, dicatat volume NaOH yang terpakai dan
dihitung konsentrasinya.
3.3.4.4. Pengukuran Daya Hantar Listrik
1. Alat konduktometer dikalibrasi dengan larutan standar KCl 0,1M
2. Semua alat gelas yang akan digunakan terlebih dahulu dicuci dengan
larutan pencuci, kemudian dikeringkan.
3. Diukur sebanyak 25 ml masing-masing larutan elektrolit dan dimasukkan
ke dalam gelas beaker.
4. Dipilih larutan secara acak.
5. Dipanaskan di atas hot plate hingga suhu 30oC.
6. Dicelupkan konduktometer dalam gelas beaker tadi, sehingga elektroda
benar-benar tercelup dan tidak ada gelembung udara.
7. Diukur daya hantar listriknya dan dicatat.
8. Diulangi perlakuan ini sebanyak 3 kali.
9. Diulangi perlakuan untuk semua larutan elektrolit yang telah disiapkan.
10. Diulangi perlakuan untuk semua larutan elektrolit untuk suhu percobaan
40oC dan 50oC.
Analisis Varian (Anava) dua jalur digunakan jika suatu penelitian eksperimen atau
expose facto terdiri atas dua variabel bebas, baik untuk eksperimen dua faktor (2
treatment) maupun eksperimen treatment (1 treatment dan satu variabel atribut).
Dalam penelitian ini, perubahan suhu (300C, 400C dan 500C) serta perubahan konsentrasi (0,01 M, 0,02 M dan 0,03 M), keduanya merupakan
variabel bebas treatment. Kedua variabel tersebut dalam penelitian ini tidak diukur, tetapi dirancang/didesain dalam bentuk treatment/perlakuan.Dalam penelitian eksperimen 2 faktor ini, variabel yang perlu diukur (diobservasi) hanya
variabel kriteria (terikat) saja, yaitu konduktivitas larutan.
Dalam Anava dua jalur, ada 3 jenis hipotesis penelitian yang perlu diuji,
yaitu :
a. Hipotesis interaction effect
b. Hipotesis main effect
c. Hipotesis simple effect.
Hipotesis interaction effect hanya ada satu buah, yaitu hipotesis dari pengaruh interaksi perubahan suhu dengan perubahan konsentrasi terhadap
konduktivitas larutan. Hipotesis main effect ada dua buah, yaitu : (1) hipotesis tentang pengaruh perubahan suhu terhadap konduktivitas larutan; dan (2) hipotesis
tentang pengaruh perubahan konsentrasi terhadap konduktivitas larutan.
Banyaknya hipotesis simple effect tergantung pada banyaknya kelompok data atau teori dari variabel bebas, karena hipotesis ini merupakan hipotesis yang
membandingkan antar 2 kelompok data.Untuk desain eksperimen 3 x 3,
banyaknya hipotesis simple effect maksimum 18 buah. Analisis Hipotesis simple effect merupakan uji lanjut dari hipotesis pengaruh interaksi (interaction effect).Oleh karenanya, jika di dalam pengujian hipotesis pengaruh interaksi (interaction effect) tidak teruji secara signifikan/nyata, maka analisis simple effect
Uji lanjut ini dilakukan untuk mengetahui perbedaan rata-rata nilai
variabel terikat antara dua kelompok data/sampel. Karena banyaknya data
masing-masing kelompok sama, maka uji hipotesis simple effect dapat dilakukan dengan Uji Tukey (Supardi, 2013).
3.5. Analisis Data
Pengamatan-pengamatan respon dari eksperimen faktorial dua faktor, yaitu faktor
A dengan a taraf dan faktor B dengan b taraf, dapat dijelaskan dengan model
mean sel. Model mean seal untuk faktorial a x b dengan n ulangan dalam suatu desain acak lengkap adalah
i = 1, 2, ….a
ijk ij j
i ijk
y =µ+τ +β +(τβ) +ε , j = 1, 2, ….b
k = 1, 2, ….n (14)
yijk = nilai respon untuk taraf i faktor A, taraf j faktor B pada
ulangan ke k
μ = efek rata-rata umum
τi = efek rata-rata taraf i faktor A βj = efek rata-rata taraf j faktor B
(τβ)ij = efek rata-rata interaksi taraf i faktor A dan taraf j faktor B εijk = efek kekeliruan acak
Kedua faktor diasumsikan tetap, sehingga
, 0 =
Στi Σβj =0,dan ( ) 0
1
=
Σ
= ija
j
τβ
dan diasumsikan juga bahwa kekeliruan berdistribusi normal dengan mean nol
dan variansi σ2atau ε
Untuk membangun analisis variansi diperlukan beberapa besaran seperti
total dan mean marjinal respon baris dan kolom, total respon dalam sel dan total
[image:43.595.154.457.166.370.2]respon keseluruhan yaitu :
Tabel 3.4. Data Hasil Eksperimen dan Total Marjinal Respon
Selanjutnya Partisi Jumlah Kuadrat Total :
JKT = JKA + JKB + JKAB + JKE (15)
db : abn – 1 =[a – 1] + [b – 1] + [(a – 1)(b – a)] + [ab(n – 1)] (16) Total Mean
Baris
∑∑
= = = b j n k ijk i y y 1 1 .. bn y y i i ...= i = 1,2,….a
Kolom
∑∑
= = = a i n k ijk j y y 1 1 . . an yy.j = .j. j = 1,2,….b
Sel
∑
= = n k ijk ij y y 1 . n yyij. = ij. i = 1,2,….a
j = 1,2,….b
Keseluruhan abn y y ... ...= (Suwanda, 2011). Konsentrasi (M)
Suhu (oC) Total
yi..
30 40 50
0,01 1
2 3 yij.= …
4 5 6 yij.= …
7 8 9 yij.= …
…
0,02 10
11 12 yij.= …
13 14 15 yij.= …
16 17 18 yij.= …
…
0,03 19
20 21 yij.= …
22 23 24 yij.= …
25 26 27 yij.= …
…
di mana untuk keperluan praktis JK – JK tersebut dihitung seperti berikut :
Jumlah kuadrat terkoreksi, JKT =
∑∑∑
= = = − a i b j n k ijk abn y y 1 1 2 ... 1 2 (17)Jumlah kuadrat Faktor A, JKA =
∑
= − a i i abn y y bn 1 2 ... 2 .. 1 (18)Jumlah kuadrat faktor B, JKB =
∑
= − b i j abn y y an 1 2 ... 2 . . 1 (19)Jumlah kuadrat interaksi, JKAB = JKsubtotal – JKA – JKB (20)
di mana JKsubtotal =
∑∑
= = − a i b j ij abn y y n 1 2 ... 1 2 . 1 (21)Jumlah kuadrat kekeliruan, JKE = JKT – JKA – JKB – JKAB (22)
Jumlah kuadrat dibagi derajat bebasnya dikenal sebagai Kuadrat Tengah
(KT).Jumlah-jumlah kuadrat dan kuadrat tengahnya disajikan dalam tabel Anlisis
[image:44.595.107.517.438.558.2]Variansi (Anava) sebagaimana tersaji dalam Tabel 3.5.
Tabel 3.5. Anava untuk Eksperimen Faktorial Dua Faktor
Sumber Variasi
Db JK KT F0
Faktor A a – 1 JKA KTA = JKA / (a – 1) KTA / KTE
Faktor B b – 1 JKB KTB = JKB / (b – 1) KTB / KTE
Interaksi AB
(a – 1) x (b – 1) JKAB KTAB = JKAB / (a – 1)(b –
1)
KTAB / KTE
Kekeliruan ab(n – 1) JKE KTE = JKE / ab(n – 1)
Total abn – 1 JKT
Sumber : Suwanda, 2011
Pada tabel tersebut ditunjukkan bahwa statistik-statistik penguji di bawah ini :
F0 A = E A KT KT
~ F(a – 1; ab(n – 1))
F0 B = E B KT KT
~ F(b – 1; ab(n – 1))
F0 AB = E AB KT KT
digunakan untuk menguji efek utama A, B dan efek interaksi A dan B (Suwanda,
2011).
3.6. Skema Penelitian
diukur masing-masing sebanyak 100
ml
dimasukkan ke dalam gelas Beaker
dipilih larutan secara acak
dipanaskan di atas hotplate
diukur daya hantar listriknya dengan
konduktometer ECTestr11
dicatat data yang diperoleh
b. Larutan Elektrolit Lemah
HCl 36% Aquadest
Larutan HCl = 0,01 M; 0,02 M; 0,03 M
diukur masing-masing sebanyak 25
ml
dimasukkan ke dalam gelas Beaker
dipilih larutan secara acak
dipanaskan di atas hotplate
diukur daya hantar listriknya dengan
konduktometer ECTestr11
dicatat data yang diperoleh
BAB 4
BAB 4
CH3COOH Glasial Aquadest
Larutan CH3COOH = 0,01 M; 0,02 M; 0,03 M
HASIL DAN PEMBAHASAN
4.1Hasil
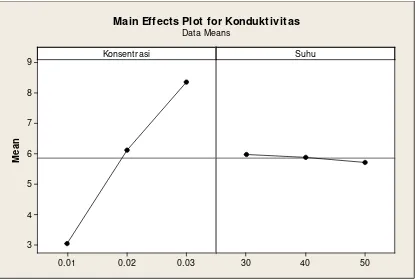
Dari hasil pengukuran data konduktivitas (Lampiran 1 dan Lampiran 3),
menunjukkan bahwa secara umum semakin tinggi suhu, maka konduktivitas
larutan HCl dan CH3COOH semakin rendah.Dari pengukuran juga diperoleh data
bahwa secara umum semakin tinggi konsentrasi larutan, maka konduktivitas
larutan HCl dan CH3COOH semakin besar.
Dari hasil pengukuran, diperoleh penurunan konduktivitas ketika suhu
larutan dinaikkan. Untuk larutan dari senyawa kovalen, pengaruh suhu terhadap
konduktivitas bergantung pada nilai ∆H yang menyertai proses ionisasi. Jika
reaksi eksoterm, derajat ionisasi berkurang ketika suhu dinaikkan, sehingga
konduktivitas berkurang.Sedangkan jika reaksi endoterm, derajat ionisasi
meningkat ketika suhu dinaikkan, sehingga konduktivitas bertambah.Perubahan
ini paling jelas kelihatan pada elektrolit lemah seperti asam asetat (Bahl, 2008).
Dari hasil pengukuran juga didapatkan, semakin besar konsentrasi larutan
maka konduktivitas larutan juga meningkat. Senyawa kovalen yang terionisasi
sebagian memiliki konsentrasi ion yang rendah dan dengan demikian gaya tarik
antar ion dapat diabaikan. Kecepatan ion tidak dipengaruhi dengan pengurangan
konsentrasi.Dengan demikian, peningkatan konduktivitas larutan senyawa
kovalen lebih disebabkan oleh kenaikan jumlah ion-ion yang membawa arus
listrik.Perubahan ini paling jelas kelihatan pada elektrolit lemah seperti asam
asetat (Bahl, 2008).
4.2Pembahasan
Hipotesis yang diuji : H0 : µ01=µ02
H1 : µ01≠µ02
Pengujian :
Dari baris Antar Kolom (Ak) tabel Ringkasan Anava Dua Jalur diperoleh nilai F
suhu HCl adalah 3,13 dan CH3COOH adalah 55,75. p-value untuk suhu HCl dan
CH3COOH adalah 0,000 maka H0 ditolak dan H1 diterima. Dapat disimpulkan
bahwa terdapat perbedaan nilai konduktansi antara larutan HCl dan CH3COOH
yang diuji pada suhu 300C, 400C dan 500C.Hal ini menunjukkan ada pengaruh dari perubahan suhu terhadap konduktivitas larutan.
4.2.2. Hipotesis 2 : Pengaruh Konsentrasi terhadap konduktivitas larutan
Hipotesis yang diuji : H0 : µ01=µ02
H1 : µ01≠µ02
Pengujian :
Dari baris Antar Baris (Ab) tabel Ringkasan Anava Dua Jalur diperoleh nilai F
untuk konsentrasi HCl adalah 1220,23 dan konsentrasi CH3COOH adalah 9217,7. p-value untuk konsentrasi HCl dan CH3COOH adalah 0,000, maka H0 ditolak dan
H1 diterima. Dapat disimpulkan bahwa terdapat perbedaan nilai konduktansi
antara larutan HCl dan CH3COOH yang diuji dengan konsentrasi 0,01 M, 0,02 M
dan 0,03 M. Hal ini menunjukkan ada pengaruh dari perubahan konsentrasi
terhadap konduktivitas larutan.
4.2.3. Hipotesis 3 : Pengaruh Interaksi Suhu (faktor A) dan Konsentrasi
Hipotesis yang diuji : H0 : A x B = 0
H1 : A x B ≠ 0
Pengujian :
Dari baris Interaksi (I) tabel Ringkasan Anava Dua Jalur diperoleh harga Fh< Ft
(0,26< 2,93) untuk larutan HCl dan Fh > Ft (19,37 > 2,93), maka untuk HCl, H0
diterima dan H1 ditolak sedangkan untuk CH3COOH, H0 ditolak dan H1 diterima.
Dapat disimpulkan bahwa tidak ada pengaruh interaksi yang signifikan antara
suhu dan konsentrasi terhadap konduktivitas larutan HCl, sementara itu terdapat
pengaruh interaksi yang signifikan antara suhu dan konsentrasi terhadap
konduktivitas larutan CH3COOH.
4.2.4. Hipotesis Perbedaan Konduktivitas antara suhu 300C dan 400C
khusus untuk konsentrasi CH3COOH 0,01 M.
Hipotesis yang diuji : H0 : µ11=µ12 H1 : µ11≠µ12
Kriteria pengujian : Tolak H0, jika Qh> Qtabel
Pada α = 0,05, dbv1 = 9 dan dbv2 = 3 diperoleh harga Qt = 9,18.
Harga Qhyaitu :
1,723
3 0,000011
2433 , 0 24 , 0 n
RJK Y Y Q
D 12 11
h =
− =
− =
Kesimpulan : Karena Qh< Qt maka H0 diterima dan disimpulkan tidak ada
perbedaan konduktivitas yang signifikan antara larutan yang bersuhu 300C dengan yang bersuhu 400C pada larutan CH3COOH pada konsentrasi 0,01 M.
4.2.5. Hipotesis Perbedaan Konduktivitas antara suhu 300C dan 500C
khusus untuk konsentrasi CH3COOH 0,01 M.
H1 : µ11 ≠µ13
Kriteria pengujian : Tolak H0, jika Qh> Qtabel
Pada α = 0,05, dbv1 = 9 dan dbv2 = 3 diperoleh harga Qt = 9,18.
Harga Qhyaitu :
1,723
3 0,000011 2433 , 0 24 , 0 n RJK Y Y Q D 13 11 h = − = − =
Kesimpulan : Karena Qh< Qt maka H0 diterima dan disimpulkan tidak ada
perbedaan konduktivitas yang signifikan antara larutan yang bersuhu 300C dengan yang bersuhu 500C pada larutan CH3COOH pada konsentrasi 0,01 M.
4.2.6. Hipotesis Perbedaan Konduktivitas antara suhu 400C dan 500C
khusus untuk konsentrasi CH3COOH 0,01 M.
Hipotesis yang diuji : H0 : µ12 =µ13 H1 : µ12 ≠µ13
Kriteria pengujian : Tolak H0, jika Qh> Qtabel
Pada α = 0,05, dbv1 = 9 dan dbv2 = 3 diperoleh harga Qt = 9,18.
Harga Qhyaitu :
0 3 0,000011 2433 , 0 2433 , 0 n RJK Y Y Q D 13 12 h = − = − =
Kesimpulan : Karena Qh< Qt maka H0 diterima dan disimpulkan tidak ada
perbedaan konduktivitas yang signifikan antara larutan yang bersuhu 400C dengan yang bersuhu 500C pada larutan CH3COOH pada konsentrasi 0,01 M.
4.2.7. Hipotesis Perbedaan Konduktivitas antara suhu 300C dan 400C
khusus untuk konsentrasi CH3COOH 0,02 M.
H1 : µ21 ≠µ22
Kriteria pengujian : Tolak H0, jika Qh> Qtabel
Pada α = 0,05, dbv1 = 9 dan dbv2 = 3 diperoleh harga Qt = 9,18.
Harga Qhyaitu :
5,22
3 0,000011 35 , 0 36 , 0 n RJK Y Y Q D 22 21 h = − = − =
Kesimpulan : Karena Qh< Qt maka H0 diterima dan disimpulkan tidak ada
perbedaan konduktivitas yang signifikan antara larutan yang bersuhu 300C dengan yang bersuhu 400C pada larutan CH3COOH pada konsentrasi 0,02 M.
4.2.8. Hipotesis Perbedaan Konduktivitas antara suhu 300C dan 500C
khusus untuk konsentrasi CH3COOH 0,02 M.
Hipotesis yang diuji : H0 : µ21 =µ23 H1 : µ21 ≠µ23
Kriteria pengujian : Tolak H0, jika Qh> Qtabel
Pada α = 0,05, dbv1 = 9 dan dbv2 = 3 diperoleh harga Qt = 9,18.
Harga Qhyaitu :
13,94
3 0,000011 3333 , 0 36 , 0 n RJK Y Y Q D 23 21 h = − = − =
Kesimpulan : Karena Qh> Qt maka H0 ditolak dan disimpulkan ada perbedaan
konduktivitas yang signifikan antara larutan yang bersuhu 300C dengan yang bersuhu 500C pada larutan CH3COOH pada konsentrasi 0,02 M.
4.2.9. Hipotesis Perbedaan Konduktivitas antara suhu 400C dan 500C
khusus untuk konsentrasi CH3COOH 0,02 M.
Kriteria pengujian : Tolak H0, jika Qh> Qtabel
Pada α = 0,05, dbv1 = 9 dan dbv2 = 3 diperoleh harga Qt = 9,18.
Harga Qhyaitu :
8,72
3 0,000011 3333 , 0 35 , 0 n RJK Y Y Q D 23 22 h = − = − =
Kesimpulan : Karena Qh< Qt maka H0 diterima dan disimpulkan tidak ada
perbedaan konduktivitas yang signifikan antara larutan yang bersuhu 400C dengan yang bersuhu 500C pada larutan CH3COOH pada konsentrasi 0,02 M.
4.2.10.Hipotesis Perbedaan Konduktivitas antara suhu 300C dan 400C
khusus untuk konsentrasi CH3COOH 0,03 M.
Hipotesis yang diuji : H0 : µ31 =µ32 H1 : µ31 ≠ µ32
Kriteria pengujian : Tolak H0, jika Qh> Qtabel
Pada α = 0,05, dbv1 = 9 dan dbv2 = 3 diperoleh harga Qt = 9,18.
Harga Qhyaitu :
6,94
3 0,000011 49 , 0 5033 , 0 n RJK Y Y Q D 32 31 h = − = − =
Kesimpulan : Karena Qh< Qt maka H0 diterima dan disimpulkan tidak ada
perbedaan konduktivitas yang signifikan antara larutan yang bersuhu 300C dengan yang bersuhu 400C pada larutan CH3COOH pada konsentrasi 0,03 M.
4.2.11.Hipotesis Perbedaan Konduktivitas antara suhu 300C dan 500C
khusus untuk konsentrasi CH3COOH 0,03 M.
Hipotesis yang diuji : H0 : µ31 =µ33 H1 : µ31 ≠µ33
Pada α = 0,05, dbv1 = 9 dan dbv2 = 3 diperoleh harga Qt = 9,18.
Harga Qhyaitu :
17,39
3 0,000011 47 , 0 5033 , 0 n RJK Y Y Q D 33 31 h = − = − =
Kesimpulan : Karena Qh> Qt maka H0 ditolak dan disimpulkan ada perbedaan
konduktivitas yang signifikan antara larutan yang bersuhu 300C dengan yang bersuhu 500C pada larutan CH3COOH pada konsentrasi 0,03 M.
4.2.12.Hipotesis Perbedaan Konduktivitas antara suhu 400C dan 500C
khusus untuk konsentrasi CH3COOH 0,03 M.
Hipotesis yang diuji : H0 : µ32 =µ33 H1 : µ32 ≠ µ33
Kriteria pengujian : Tolak H0, jika Qh> Qtabel
Pada α = 0,05, dbv1 = 9 dan dbv2 = 3 diperoleh harga Qt = 9,18.
Harga Qhyaitu :
10,44
3 0,000011 47 , 0 49 , 0 n RJK Y Y Q D 33 32 h = − = − =
Kesimpulan : Karena Qh> Qt maka H0 ditolak dan disimpulkan ada perbedaan
konduktivitas yang signifikan antara larutan yang bersuhu 400C dengan yang bersuhu 500C pada larutan CH3COOH pada konsentrasi 0,03 M.
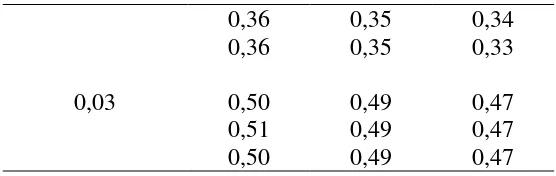
4.2.13. Hipotesis Perbedaan Konduktivitas antara CH3COOH 0,01 M dan
0,02 M khusus untuk suhu 300C.
Hipotesis yang diuji : H0 : µ11 =µ21 H1 : µ11 ≠µ21
Pada α = 0,05, dbv1 = 9 dan dbv2 = 3 diperoleh harga Qt = 9,18.
Harga Qhyaitu :
62,67
3 0,000011 36 , 0 24 , 0 n RJK Y Y Q D 21 11 h = − = − =
Kesimpulan : Karena Qh> Qt maka H0 ditolak dan disimpulkan ada perbedaan
konduktivitas yang signifikan antara larutan CH3COOH 0,01 M dan 0,02 M pada
suhu 300C.
4.2.14 Hipotesis Perbedaan Konduktivitas antara CH3COOH 0,01 M dan
0,03 M khusus untuk suhu 300C.
Hipotesis yang diuji : H0 : µ11 =µ31 H1 : µ11 ≠µ31
Kriteria pengujian : Tolak H0, jika Qh> Qtabel
Pada α = 0,05, dbv1 = 9 dan dbv2 = 3 diperoleh harga Qt = 9,18.
Harga Qhyaitu :
137,5
3 0,000011 5033 , 0 24 , 0 n RJK Y Y Q D 31 11 h = − = − =
Kesimpulan : Karena Qh> Qt maka H0 ditolak dan disimpulkan ada perbedaan
konduktivitas yang signifikan antara laruta