Oleh
Megawati Simbolon
ABSTRACT
The aims of the research were to isolate and purify chitin deacetylase which produced byAspergillus aculeatusfrom humus soil. Chitin deacetylase fromAspergillus aculeatushas been produced using chitin as sole carbon resource of solid fermentation medium shaked for 5 day in room temperature. The purified chitin deacetylase through ammonium sulfate precipitation and dialysis.
The result, ammonium sulfate precipitation showed that the highest lowry activity of chitin deacetylase was 3,47 mg/ml in fraction 40-60% and dialysis showed that the lowry activity of chitin deacetylase was 2,93 mg/ml. Analysed of IR peak of glycol chitin was amide and in peak deacetylation of glycol chitin with chitin deacetylation enzyme was primary amine.
Keywords: purification, chitin deacetylase
dariAspergillus aculeatus isolat tanah humus menggunakan kitin sebagai sumber karbon yang ada di dalam medium fermentasi padat dan dishaker selama 5 hari pada suhu ruang . Pemurnian kitin deasetilase meliputi pengendapan amonium sulfat dan dialisis.
Fraksinasi dengan amonium sulfat mempunyai nilai kadar proteinnya sebesar 3,47 mg/ml serta pemurnian tahap selanjutnya yaitu dialisis yang mempunyai kadar protein sebesar 2,93 mg/ml. Hasil analisis spectra IR
menunjukkan terjadinya perubahan peak di spektra IR glikol kitin yaitu adanya gugus fungsi amida dan di spektra deasetilase substrat glikol kitin dengan enzim kitin deasetilase adanya gugus fungsi amina primer.
V. SIMPULAN DAN SARAN
A. Simpulan
Berdasarkan hasil penelitian yang telah dilakukan, dapat disimpulkan bahwa:
1. Kadar protein ekstrak enzim kasar sebesar 5,79 mg/ml dan nilai kadar protein mulai menurun dengan dilakukannya pemurnian yaitu
fraksinasi dengan amonium sulfat mempunyai nilai kadar proteinnya sebesar 3,47 mg/ml serta pemurnian tahap selanjutnya yaitu dialisis yang mempunyai kadar protein sebesar 2,93 mg/ml.
2. Hasil analisis spectra IR menunjukkan adanya perubahan peak yaitu gugus amida di spektra IR glikol kitin dengan peak di spektra
deasetilase dengan enzim kitin deasetilase dariAspergillus aculeatus dengan adanya gugus fungsi amina primer. .
B. Saran
I. PENDAHULUAN
A. Latar Belakang
Enzim adalah golongan protein yang paling banyak terdapat dalam sel hidup dan mempunyai fungsi penting sebagai katalisator reaksi biokimia yang secara kolektif membentuk metabolisme-perantara dari sel (Wirahadikusumah, 1997). Kelebihan enzim sebagai katalisator antara lain memiliki spesifitas tinggi, mempercepat reaksi kimiawi spesifik tanpa pembentukan senyawa samping, produktivitas tinggi, dan produk akhir pada umumnya tidak terkontaminasi sehingga mengurangi biaya purifikasi dan efek kerusakan terhadap lingkungan (Chaplin dan Bucke, 1990).
Saat ini kitosan komersial diproduksi secara termokimiawi. Cara ini dalam banyak hal tidak menguntungkan diantaranya tidak ramah lingkungan, prosesnya tidak mudah dikendalikan, dan kitosan yang dihasilkan memiliki berat molekul dan derajat deasetilasi tidak seragam (Changet al., 1997 dan Tsigoset al.,2000). Hal ini karena proses deasetilasi rantai kitin yang berlangsung secara acak
menghasilkan kitosan dengan derajat deasetilasi bervariasi (Tsigos dan Bouriotis, 1995; Kolodziejskaet al., 2000; Win dan Stevens, 2001). Derajat deasetilasi minimal 70% umumnya dimanfaatkan untuk industri pangan, industri kosmetika dan biomedis sedikitnya 80 dan 90% ( Tsugita, 1997).
Untuk memperoleh kitosan dengan derajat deasetilasi tertentu dapat dilakukan secara enzimatik dengan memanfaatkan kitin deasetilase yang bekerja spesifik memotong gugus asetil dari kitin. Salah satu kitin deasetilase yang berpeluang diaplikasikan untuk pembuatan kitosan diproduksi oleh jamurAspergillus aculeatusisolat tanah humus.
B. Tujuan Penelitian
Tujuan dari penelitian ini adalah:
1. Mengisolasi enzim kitin deasetilase dariAspergillus aculeatusisolat tanah humus.
2. Memurnikan enzim kitin deasetilase dariAspergillus aculeatusisolat tanah humus.
C. Manfaat Penelitian
Manfaat yang diharapkan dari penelitian ini adalah:
1. Memberikan informasi tentang cara menghasilkan enzim kitin deasetilase dari Aspergillus aculeatusisolat tanah humus.
II. TINJAUAN PUSTAKA
A. Aspergillus aculeatus
Sebagai anggota umum dari komunitas mikroba yang ditemukan di tanah, dengan beragam enzim hidrolitik dan oksidatif yang terlibat dalam pemecahan
lignoselulosa tanaman, spesiesAspergillusmerupakan sumber penting dari enzim dan memainkan peran penting dalam siklus karbon global. Penemuan domain peraturan di daerahnon-codinggen fluks karbon penting ini akan membantu untuk mengidentifikasi dan mengkarakterisasi "sirkuit" yang terlibat dalam siklus karbon. Selanjutnya, spesiesAspergillusadalah model penting untuk studi sekresi protein eukariotik, efek dari berbagai faktor lingkungan yang memicu ekspor biomassa beragam enzim, mekanisme molekul penting untuk pengembangan proses fermentasi, dan mekanisme yang terlibat dalam pengendalian morfologi jamur.
teknik identifikasi molekuler dan biokimia. IsolatAspergillus aculeatustelah digunakan untuk menghasilkan sejumlah enzim industri yang penting (selulase, hemisellulase, protease) yang digunakan secara komersial dalam industri makanan dan pakan (Wikipedia, 2011).
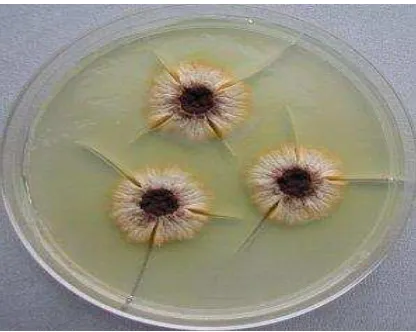
Gambar 1. Aspergillus aculeatuspada medium PDA (Potato Dextrose Agar)
Tabel 1. Produksi sclerotia, ochratoxin A dan beberapa extrolites oleh spesies Aspergillus section Nigri(Samsonet al., 2006)
Species Ochra
Asp SeD Ant Afl Cor Kot
Aspergillus
B. Enzim
Enzim adalah biokatalis yang dihasilkan oleh jaringan yang akan meningkatkan laju reaksi kimia yang berlangsung di jaringan (Montgomary, 1993). Enzim merupakan unit fungsional dari metabolisme sel. Enzim bekerja dengan urutan yang teratur, mengkatalisis ratusan reaksi bertahap yang menguraikan molekul nutrient, reaksi yang menyimpan dan mengubah energi kimawi dan yang membuat makromolekul sel (Lehninger, 1982).
Menurut Poedjiadi (1994), fungsi suatu enzim adalah sebagai katalis untuk proses biokimia yang terjadi di dalam sel maupun di luar sel. Suatu enzim dapat
mempercepat reaksi 108sampai 1011kali lebih cepat daripada apabila reaksi tersebut dilakukan tanpa katalis. Enzim dapat berfungsi sebagai katalis yang sangat efisien, di samping itu mempunyai derajat kekhasan yang tinggi. Seperti juga katalis lainnya, enzim dapat menurunkan energi aktivasi suatu reaksi kimia.
Kelebihan enzim sebagai katalis dibandingkan dengan katalisator sintentik antara lain: (1) enzim mempunyai spesifitas tinggi, (2) enzim bekerja secara spesifik (hanya mengkatalisis substrat tertentu), (3) tidak terbentuk produk samping yang tidak diinginkan, (4) mempunyai produktivitas tinggi, (5) produk akhir pada umumnya tidak terkontaminasi sehingga mengurangi biaya purifikasi dan mengurangi efek kerusakan terhadap lingkungan (Chaplin dan Bucke, 1990).
Enzim sebagai biokatalis telah dapat diaplikasikan secara komersil untuk proses–
proses industri, antara lain industri pangan, medis (diagnosis), kimia dan farmasi (Junita, 2002). Untuk dapat digunakan dalam industri, enzim harus memiliki kondisi yang dibutuhkan dalam proses industri, seperti kestabilan pada kondisi suhu yang tinggi dan pH yang ekstrim (Goddeteet al, 1993). Enzim dapat bekerja secara efektif pada suhu dan pH tertentu, namun aktivitasnya akan berkurang dalam keadaan di atas atau di bawah titik tertentu. Aktivitas enzim tidak hanya dipengaruhi oleh suhu dan pH, tetapi juga faktor lain seperti konsentrasi.
Berikut ini faktor–faktor yang mempengaruhi kerja enzim : 1. Konsentrasi enzim
Konsentrasi enzim secara langsung mempengaruhi kecepatan laju reaksi enzimatik. Pada suatu konsentrasi substrat tertentu, laju reaksi bertambah dengan bertambahnya konsentrasi enzim (Poedjiadi, 1994). Laju reaksi tersebut meningkat secara linier selama konsentrasi enzim jauh lebih sedikit daripada konsentrasi substrat. Hal ini biasanya terjadi pada kondisi fisiologis (Page, 1997).
2. Konsentrasi substrat
Laju reaksi enzimatik akan meningkat dengan bertambahnya konsentrasi substrat rendah, bagian aktif enzim hanya menampung substrat sedikit. Bila konsentrasi substrat diperbesar, makin banyak substrat yang
substrat. Dalam kondisi ini, bertambahnya konsentrasi enzim–substrat, sehingga jumlah hasil reaksinya pun tidak bertambah (Poedjiadi, 1994).
3. Suhu
Suhu dapat meningkatkan laju reaksi enzimatik sampai batas tertentu. Suhu yang terlalu tinggi (jauh dari suhu optimum suatu enzim) akan menyebabkan enzim terdenaturasi. Bila enzim terdenaturasi, maka bagian aktifnya akan terganggu dan dengan demikian konsentrasi efektif enzim menjadi berkurang. Hal ini menyebabkan laju reaksi enzimatik menurun (Poedjiadi, 1994).
4. pH
Struktur ion enzim bergantung pada pH lingkungan. Enzim dapat berbentuk ion positif dan ion negatif (zwitter ion). Dengan demikian perubahan pH akan mempengaruhi efektivitas bagian aktif enzim dalam membentuk kompleks enzim–substrat. Selain itu, pH yang tinggi dapat menyebabkan terjadinya proses denaturasi dan ini akan mengakibatkan menurunnya aktivitas enzim. Enzim menunjukkan aktivitas maksimum pada kisaran pH antara 4,5–8,0 (Winarno, 1982).
5. Inhibitor
sisi lain enzim sehingga memperlambat kerja enzim, disebut inhibisi nonkompetitif. Sedangkan inhibitor yang tidak menghalangi terbentuknya kompleks enzim–substrat, tetapi mengahalangi reaksi selanjutnya, disebut inhibisi unkompetitif.
6. Waktu inkubasi
Setiap enzim membutuhkan waktu inkubasi tertentu untuk dapat bereaksi secara optimum dengan substrat hingga menghasilkan produk.
C. Kitin
Kitin adalah polisakarida struktural yang digunakan untuk menyusun eksoskleton dari artropoda (serangga, laba-laba, krustase dan hewan-hewan lain sejenis). Kitin tergolong homopolisakarida linear yang tersusun atas residu N-asetilglukosamin pada rantai beta dan memiliki monomer berupa molekul glukosa dengan cabang yang mengandung nitrogen. Kitin murni mirip dengan kulit, namun akan
mengeras ketika dilapisi dengan garam kalsium karbonat. Kitin membentuk serat mirip selulosa yang tidak dapat dicerna oleh vertebrata. Kitin merupakan polimer yang paling melimpah di laut. Sedangkan pada kelimpahan di muka bumi, kitin menempati posisi kedua setelah selulosa. Hal ini karena kitin dapat ditemukan di berbagai organisme eukariotik termasuk serangga, moluska, krustase, fungi, alga, dan protista.
Jumlah kitin pada khamir dan cendawan berfilamen cukup jauh berbeda. Kitin pada khamirSaccharomyces cerevisiaemencapai 1-2% dari bobot kering dinding sel, sedangkan proporsi pada cendawan berfilamen bervariasi antara 10-30% dari bobot kering dinding sel (Hirano, 1986). Gambar .2 di bawah adalah struktur kitin.
D. Kitosan
Kitosan merupakan produk deasetilasi kitin yang merupakan polimer rantai panjang glukosamin. Kitosan mempunyai rumus molekul (C6H11NO4)n. Pertama kali kitosan dibuat dari kitin dengan pencampuran kitin dan KOH pada 180°C oleh Hoppe-Seyler tahun 1984. Kitosan yang dihasilkan tersebut larut dalam larutan asam asetat. Selain itu, Muzzarelli (2000) melaporkan bahwa
Kitosan merupakan senyawa turunan kitin yaitu β-(1,4)-glukosamin (2-amino-2-deoksi-D-glukosa) dan memiliki bobot molekul berkisar 1 × 105 – 5 × 105 Da lebih rendah dari bobot molekul kitin yaitu 1,036 × 106 – 2,5 × 106 Da (Peter, 1995). Kitosan banyak terdapat pada dinding sel jamur terutama pada ordo Murocales yang sebagian besar penyusun komponen dinding selnya adalah kitosan dan pada Saccharomyces cerevisiae, kitosan merupakan penyusun utama pada askapora. (Chaplin, 1990). Gambar.3 merupakan struktur kitosan.
Kitosan banyak digunakan di berbagai bidang. Sebagai bahan pendukung pengikat enzim, penggunaan kitosan terbesar yaitu pada bidang industri makanan, farmasi dan kosmetik. Pemanfaatan kitosan sebagai bahan pendukung dikarenakan kitosan mempunyai kelebihan diantaranya merupakan senyawa biopolimer yang dapat terdegradasi dan tidak mencemari lingkungan, tidak bersifat toksik.
E. Kitin Deasetilase
Penamaan dari komisi enzim untuk enzim ini adalah E.C.3.5.1.41, menunjukkan karakteristik enzim sebagai hidrolase yang bertindak pada ikatan karbon–nitrogen yang bukan ikatan peptida, pada amida linier (Tsigoset al,2000).
Kitin deasetilase merupakan glikoprotein yang disekresikan ke daerah periplasma atau ke dalam media pembiakan (Martinou et al., 1995). Kitin deasetilase
memiliki aktivitas optimum pada suhu sekitar 50°C pada pH yang beragam, bergantung pada mikroorganismenya. Umpamanya, kitin deasetilase yang berasal dariM. rouxiioptimum pada pH sekitar 4,5 (Kafetzopoulos, 1993), sedangkan yang berasal dariAspergillus nidulansoptimum pada pH 7,0 (Alfonso et al., 1995). Enzim lain yang aktivitasnya sama ialah lisozim yang terdapat dalam putih telur (Kurita et al., 2000).
Enzim pendeasetilasi kitin, bekerja mengkatalisis perubahan kitin menjadi kitosan, sehingga dapat dimanfaatkan untuk produksi kitosan melalui proses enzimatis. Pembuatan kitosan dengan menggunakan kitin deasetilase sangat menguntungkan sebab dapat menghasilkan molekul kitosan dengan derajat deasetilase yang lebih seragam dibandingkan dengan proses kimia biasa (Tokuyasuet al., 1996).
pertumbuhan mikroorganisme yang cepat, bahkan bimassa jamur dapat meningkat 2 kali lipat hanya dalam waktu 1-3 jam (Synowiecki dan Al-Khateeb, 2003).
Pada fungi, kitin deasetilase mempunyai dua peran biologis penting, yaitu dalam pembentukan dinding sel dan dalam interaksi fungi dengan tanaman. Dalam pembentukan dinding sel, kitin deasetilase bekerja berurutan dengan kitin sintase. Kitin sintase mempolimerasi gugus N-asetil-D-glukosamin dan kitin deasetilase memotong ikatan asetamido pada kitin. Disebabkan oleh peran inilah, kitin
deasetilase pada fungi ditemukan pada permukaan bagian dalam dinding sel, yaitu di daerah periplasma (Tsigoset al, 2000).
F. Sistem Fermentasi Padat
Fermentasi berasal dari kata latin “fervere”yang berarti mendidih yang
menunjukkan adanya aktivitas pada ekstrak buah-buahan atau larutan malt biji-bijian. Kelihatan seperti mendidih karena terbentuknya gelembung-gelembung CO2akibat dari proses katabolisme secara anaerobik dari gula yang ada dalam ekstrak (M. Saban Tanyildiziet al., 2007). . Fermentasi merupakan suatu reaksi reduksi-oksidasi dalam sistem biologi yang menghasilkan energi. Fermentasi dibagi menjadi 3, yakni:
Mikroorganisme yang tumbuh melalui sistem fermentasi padat berada pada kondisi pertumbuhan di bawah habitat alaminya, mikroorganisme tersebut dapat menghasilkan enzim dan metabolisme yang lebih efisien dibandingkan dengan sistem fermentasi cair. Sistem fermentasi padat memiliki lebih banyak manfaat dibandingkan dengan sistem fermentasi cair, diantaranya tingkat produktivitasnya tinggi, tekniknya sederhana, biaya investasi rendah, kebutuhan energi rendah, jumlah air yang dibuang sedikit, recovery produknya lebih baik, dan busa yang terbentuk sedikit. Sistem fermentasi padat ini dilaporkan lebih cocok digunakan di negara-negara berkembang. Manfaat lain dari sistem fermentasi padat adalah murah dan substratnya mudah didapat, seperti produk pertanian dan industri makanan (M. Saban Tanyildizi dkk, 2007). Enzim yang melalui proses sistem fermentasi padat baik yang belum dimurnikan atau yang dimurnikan secara parsial dapat diaplikasikan di industri (seperti pektinase digunakan untuk klarifikasi jus buah, alpha amilase untuk sakarifikasi pati). Murahnya harga residu pertanian dan agro-industri merupakan salah satu sumber yang kaya akan energi yang dapat digunakan sebagai substrat dalam sistem fermentasi padat. Fakta menunjukkan bahwa residu ini merupakan salah satu reservoir campuran karbon terbaik yang ada di alam. Dalam sistem fermentasi padat,substrat padat tidak hanya
menyediakan nutrien bagi kultur tetapi juga sebagai tempat penyimpanan air untuk sel mikroba (M. Saban Tanyildizi dkk, 2007). Komposisi dan konsentrasi dari media dan kondisi fermentasi sangat berpengaruh pada pertumbuhan dan produksi enzim ekstraseluler dari mikroorganisme. Biaya dan ketersediaan
pada proses sistem fermentasi padat. Untuk biaya analisa awal, kira-kira 60 dan 50% untuk biaya medium fermentasi dan pengaturan prosesdown-stream. Sehingga dapat diketahui bahwa sistem fermentasi padat cocok untuk pengembangan fungi dan tidak cocok untuk proses kultur bakteri karena membutuhkan air yang lebih banyak (M. Saban Tanyildizi dkk, 2007).
Faktor-faktor yang mempengaruhi proses pertumbuhan fungi :
a. Konsentrasi substrat
Substrat merupakan sumber nutrien utama bagi fungi. Nutrien-nutrien baru dapat dimanfaatkan sesudah fungi mengeksresi enzim-enzim ekstraselular yang dapat mengurai senyawa kompleks dari substrat tersebut menjadi senyawa-senyawa yang lebih sederhana (Indrawati Gandjar, 2006).
b. Sumber nitrogen
Bahan yang banyak sebagai sumber nitrogen adalah ammonium nitrat, ammonium sulfat, dan urea. Nitrogen diperlukan dalam proses fermentasi karena dapat
mempengaruhi aktivitas dariAspergillus section Nigri (Narasimha Get al., 2006).
c. Phospat
tertentu maka adanya phospat dapat memberikan keuntungan (Indrawati Gandjar, 2006).
d. Magnesium
Magnesium berfungsi sebagai kofaktor dalam mengatur jumlah enzim yang terlibat dalam reaksi. Dalam sel konsentrasi optimal dari penambahan magnesium adalah 0,002-0,0025% (Indrawati Gandjar, 2006).
e. Aerasi
Dalam media fermentasi padat, aerasi diatur dengan cara memperhatikan pori-pori bahan yang difermentasikan (Indrawati Gandjar, 2006). Aerasi berfungsi untuk mempertahankan kondisi aerobik untuk desorbsi CO2,mengatur temperatur substrat, dan mengatur kadar air (Prioret al., 1980). Aerasi yang diberikan juga membantu menghilangkan sebagian panas yang dihasilkan sehingga temperatur dapat dipertahankan pada temperatur optimal untuk produksi enzim (Abdul Aziz Darwiset al., 1995).
Tingkat aerasi optimal yang diberikan dipengaruhi oleh sifat mikroorganisme yang digunakan. Tingkat O2yang dibutuhkan untuk sintesis produk, jumlah panas metabolik yang harus dihilangkan dari bahan, ketebalan lapisan substrat, tingkat CO2, dan metabolit-metabolit lain yang mudah menguap harus dihilangkan, dan tingkat ruang udara yang tersedia di dalam substrat (Lonsaneet al., 1985).
f. pH
Umumnya fungi menyenangi pH di bawah 7. Jenis-jenis khamir tertentu bahkan tumbuh pada pH yang cukup rendah, yaitu pH 4,5–5,5. Pengaturan pH sangat penting dalam industri agar fungi yang ditumbuhkan menghasilkan produk yang optimal, misalnya pada produksi asam sitrat, produksi enzim, produksi antibiotik, dan juga untuk mencegah pembusukan bahan pangan (Indrawati Gandjar, 2006).
g. Temperatur inkubasi
Berdasarkan kisaran suhu lingkungan yang baik untuk pertumbuhan, fungi dapat dikelompokkan sebagai fungi psikrofil, mesofil, dan termofil. Pengetahuan tentang kisaran temperatur pertumbuhan suatu fungi sangat penting, terutama bila isolat-isolat tertentu akan digunakan di industri. Misalnya, fungi yang termofil atau termotoleran (Candida tropicalis, Paecilomyces variotii, dan Mucor miehei), dapat memberikan produk yang optimal meskipun terjadi peningkatan temperatur, karena metabolisme funginya, sehingga industri tidak memerlukan penambahan alat pendingin (Indrawati Gandjar, 2006).
h. Waktu fermentasi
berada pada fase tersebut (Suhartono, 1989). Pada temperatur 31oC aktivitas tertinggi diperoleh setelah hari ke-5 fermentasi, akan tetapi pada hari ke-6 mengalami penurunan aktivitas enzim dan pada hari ke-8 mengalami kenaikan kembali (Abdul Aziz Darwiset al., 1995).
G. Isolasi , Pemurnian Enzim, dan Uji Kadar Protein
1. Isolasi enzim
Produksi enzim dari mikroba menunjukkan berbagai keuntungan dibandingkan dengan produksi dari sumber non-mikroba. Produksi enzim mikroba dapat ditingkatkan pada skala besar dalam ruang yang relatif terbatas. Teknik budidaya mikroba memang lebih canggih dibandingkan dengan produksi enzim dari hewan atau tanaman. (Suhartono, 1989).
Produksi enzim dari mikroba menunjukkan sifat dan ciri lain. Mikroba dalam hal ini sengaja diternakkan untuk menghasilkan produk enzim. Teknologi
pertumbuhan dan faktor lingkungan yang mempengaruhi enzim akan memberikan produk paling baik. Pengetahuan akan kebutuhan nutrien tertentu, formulasi media, pH, suhu, kemungkinan adanya penghambatan, penambahan senyawa pemacu dan faktor-faktor lain bagi mikroba spesifik, besar artinya dalam
Untuk mendapatkan produk enzim yang baik dan terpisah dari partikel-partikel pengotor lainnya yang akan mempengaruhi aktivitas enzim yang bersangkutan, maka metode pemisahan dilakukan pada produk sehingga akan didapatkan enzim yang memiliki tingkat kemurnian tinggi.
Metode pemisahan produk-produk biologis yang ideal meliputi empat tahap yaitu : (1) pemisahan bahan-bahan yang tidak dapat larut, dilakukan dengan cara filtrasi atau sentrifugasi; (2) isolasi produk, dilakukan dengan cara presipitasi,
kromatografi, elektroforesis, maupun ultrafilrasi; (4) polishing/tahap pembentukkan produk, dilakukan dengan cara kristalisasi dan pengeringan.
Proses sentrifugasi digunakan untuk memisahkan campuran padat cair atau cair-cair. Bahan-bahan yang dimasukkan ke dalam alat diputar dengan kecepatan tinggi sehingga terkena pengaruh gaya sentrifugal, akibatnya butiran-butiran padat tertinggal pada dinding sekitar alat (Vollrath, 1984).
2. Fraksinasi dengan amonium sulfat
Sebagian besar enzim berada dalam cairan sel sebagai protein terlarut. Enzim larut dalam larutan garam dengan konsentrasi 0,15 - 0,20 M dan pH netral. Kelarutan enzim tersebut merupakan hasil interaksi polar dengan pelarut dan gaya tolak-menolak antara molekul yang bermuatan sama. Penambahan garam seperti natrium klorida, natrium sulfat, atau amonium sulfat menimbulkan pengendapan protein yang disebutsalting out. Pengendapan ini terjadi karena ion-ion garam yang tersolvasi cenderung akan menarik molekul-molekul air dari molekul
lain untuk membentuk agregat. Protein yang hidrofobisitasnya tinggi akan mengendap lebih dahulu, sedangkan protein yang memiliki sedikit residu non polar akan tetap larut meskipun pada konsentrasi garam yang paling tinggi (Walsh dan Headon, 1994).
3. Dialisis
Dialisis merupakan suatu metode yang telah lama digunakan untuk memisahkan garam dari larutan protein. Metode ini berdasarkan pada sifat semipermiabel membran yang dapat menahan molekul-molekul kecil seperti garam. Proses dialisis berlangsung karena adanya perbedaan konsentrasi zat terlarut di dalam dan di luar membran. Difusi zat bergantung pada temperatur dan viskositas larutan. Meskipun temperatur tinggi dapat meningkatkan laju difusi, namun sebagian besar protein dan enzim stabil pada temperatur 4-8°C sehingga dialisis harus dilakukan di dalam ruang dingin (Pohl, 1990).
Secara umum, proses dialisis berlangsung sebagai berikut : larutan protein atau enzim dimasukkan ke dalam kantung dialisis yang terbuat dari membran
dialisis (Lehninger, 1982). Setelah tercapai keseimbangan, larutan di luar kantung dialisis diganti dengan larutan yang baru agar konsentrasi ion-ion di dalam
kantung dialisis dapat dikurangi. Proses ini dapat dilakukan secara kontinu sampai ion - ion di dalam kantung dialisis dapat diabaikan (Boyer, 1993).
4. Penentuan kadar protein
Penentuan kadar protein bertujuan untuk mengetahui bahwa protein enzim masih terdapat pada tiap fraksi pemurnian (tidak hilang dalam proses pemurnian) dengan aktivitas yang tetap baik. Salah satu metode untuk menentukan kadar protein adalah metodeLowry.Metode ini bekerja pada kondisi alkali dan ion tembaga (II) akan membentuk kompleks dengan protein. Ketika reagenfolin-ciocalteau ditambahkan, maka akan mengikat protein. Ikatan ini secara perlahan akan mereduksi reagenfolinmenjadi heteromolibdenum dan merubah warna kuning menjadi biru.
Pada metode ini, pengujian kadar protein didasarkan pada pembentukan kompleks Cu2+dengan ikatan peptida yang akan tereduksi menjadi Cu+pada kondisi
basa.Cu+dan rantai samping tirosin, triftofan, dan sistein akan bereaksi dengan reagenfolin-ciocalteau. Reagen bereaksi dengan menghasilkan produk tidak stabil yang tereduksi secara lambat menjadi molibdenum. Protein akan menghasilkan intensistas warna yang berbeda tergantung pada kandungan triftofan dan tirosinnya.
dan konsentrasi protein yang rendah. Untuk mengatasinya adalah dengan cara menggunakan volume sampel yang sangat kecil sehingga tidak mempengaruhi reaksi.
H. Analisis Mutu Kitosan 1. Derajat Deasetilasi
Derajat deasetilasi kitosan dapat diukur dengan berbagai metode dan yang paling lazim digunakan adalah metode garis dasar spektroskopi IR transformasi Fourier (FTIR). Nilai yang digunakan untuk menghitung derajat deasetilasi sangat bergantung pada nisbah pita serapan yang digunakan untuk menghitungnya. Tiga nisbah yang diajukan adalah A1655/A2867, A1550/A2878, dan A1655/A3450. Dua nisbah pertama memberikn keakuratan pada % N asetilasi rendah, sedangkan A1655/A3450 lebih akurat pada % N asetilasi tinggi.
Penentuan DD dengan menggunakan spektroskopi FTIR dilakukan dengan cara sebagai berikut : kitosan dibuat menjadi pelet dengan KBr hingga membentuk suatu lapisan tipis transparan. Selanjutnya, serapan diukur dengan FTIR. Misalnya, Kitin yang terdeasetilasi sempurna (100%) menghasilkan nilai A1655 = 1,33. Dengan diperolehnya perbandingan absorbansi antara bilangan gelombang 1655 cm-1 (serapan pita amida I) dan 3450 cm-1 (serapan gugus hidroksil), maka % DD kitosan dapat dihitung sebagai berikut :
III. METODOLOGI PENELITIAN
A. Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan Maret 2011 sampai dengan bulan November 2011 di Laboratorium Mikrobiologi Balai Riset dan Standarisasi Industri Bandar Lampung, Laboratorium Biomasa dan Laboratorium Biokimia Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
B. Alat dan Bahan
1) Alat- alat yang digunakan
Dalam penelitian ini alat–alat yang digunakan adalah alat gelas, Orbital shaker, magnetic stirrer,pH meter, kertas saring whatman no 42, vakum, mikropipet, PCR, inkubator, laminar air flow, tabung sentrifuga, autoclave, oven,pcr spektrofotometer UV-VIS dan penangas air.
2) Bahan-bahan yang digunakan
Adapun bahan–bahan yang digunakan adalah Potato Dextrose Agar (PDA) Merck
, kentang, dextrose Merck, biakan murniAspergillus aculeatusisolat tanah
phospat, asam asetat Merk, garam Rochelle (KNa-tartarat) Merck, CuSO4.5H2O Merck, air destilasi, Na2CO3Merck, sodium azida (NaN3) Merck, NaOH Merck ,kantong selofan, etanol,metanol, reagen Folin-Ciocalteu, indol, NaNO2Merck, amonium sulfamat, glukosamin, koloidal kitin, asam asetat anhidrida,
MgSO4.7H2O Merck,Bovine Serum Albumin (BSA), Na2HPO4Merck, dan NaH2PO4Merck.
C. Prosedur Penelitian
1. Identifikasi DNA Aspergillus aculeatus
1.1 Ekstraksi dan purifikasi DNA
Ekstraksi dan purifikasi DNA dari miselium jamur yang ditumbuhkan pada mediumPotato Dextrose Broth(PDB) selama 5-7 hari dilakukan dengan Nucleon™ PhytoPure™ Genomic DNA Extraction Kits (GE Healthcare)dan dilanjutkan dengan siklus sekuensing. Tahaap-tahap yang dilakukan dalam
mengisolasi DNA dari filamentous fungi menggunakannucleon phytopureTM(GE Healthcare) adalah sebagai berikut:
1.Breaking of the cell wall(Memecah dinding sel)
Pemecahan dinding pada tahap ini dilakukan secara kinetik (menggunakan homogenizer)
2.Lysis sel
Pada tahap ini pemecahan sel dilakukan secara enzimatik 3. Ekstraksi DNA
4. Purifikasi DNA
Purifikasi DNA menggunakan etanol absolut.
1.2 Amplifikasi PCR danElektroforesis DNA
Deteksi gen penghasil enzim kitinase padaAspergillus nigerL1 dilakukan secara molekuler dengan menggunakan primer spesifikchit1f
(5’-CTCTGCAGGCCACTCTCGGT-3’) danchit1r
(5’-AGCCATCTGCTTCCTCATAT-3’) (Enkerli et al., 2009).Kondisi reaksi PCR (Polymerase Chain Reaction) disamakan untuk semua suhu annealing (50ºC, 52ºC dan 55ºC). Larutan reaksi mengandung 5μ l DNA; 2,5μ l 10×buffer (mengandung 1,5mM MgCl2); 2,5μ l dNTPs 600μ M; 0,25μ l dari masing-masing primer
konsentrasi 60μ M; 0,2μ l Taq DNA polymerase (5 U/μ l); 0,25μ l kontrol internal,
dan digenapkan sampai 25μ l dengan menambahkan MilliQ. Reaksi PCR
dilakukan dengan menggunakan standar sebagai berikut: 1 putaran selama 5 menit pada suhu 94ºC diikuti dengan 40 putaran selama 30 detik pada suhu 94ºC, 30 detik pada suhu 52ºC, dan 30 detik pada suhu 72ºC. Satu putaran selama 7 menit pada suhu 72ºC dicoba selama reaksi PCR. Setelah amplifikasi, 5μ l larutan dimasukkan kedalam sumur agarose gel 1,0% dalam 0,5×TBE buffer, dipisahkan dengan proses elektroforesis, diwarnai dengan ethidium bromide, dan
2. Pembuatan Media inokulum, Media Fermentasi Padat dan Larutan
Buffer Fosfat
2.1 Pembuatan media inokulum (Sugita, 2009)
Media yang dipakai adalah PDB (Potato Dextrose Broth). PDB dibuat secara
manual yaitu kentang sebanyak 200 gram dan 10 gram dextrose direbus
selama 1 jam dengan 500 mL aquades. Setelah direbus, ditambahkan aquades
sampai volume 1 L kemudian disterilkan dengan autoklaf. Sebanyak 10 mL
medium PDB (yang sudah diambil sari kentangnya dengan cara diperas)
ditambahkan 3,3 mL larutan mineral steril (0,2% K2HPO4+ 0,02%
MgSO4.7H2O + 0,2% HCl + 0,4% (NH4)2SO4+ 0,1% yeast ekstrak + 100
mL aquades kemudian disteril) dan 1 ose biakanAspergillus aculeatus
kemudian dishaker selama 5 hari
2.2 Media fermentasi padat
Sebanyak 10 g substrat kitin dimasukkan dalam Erlenmayer250 mL. Substrat kemudian ditambahkan dengan 5 mLlarutan mineral steril (sama seperti larutan mineral untuk media inokulum).Media disterilisasi pada tekanan 1 atm selama 15 menit. Sebanyak 5 mL kultur awal diinokulasikan dalam medium
2.3 Larutan buffer fosfat
Sebanyak 27,8 g NaH2PO4(stock A) dan 31,97 g Na2HPO4(stock B) masing– masing dilarutkan dalam 1000 mL aquades. Pada pembuatan buffer pH 6 sebanyak 87,7 mL stok A ditambah dengan 12,3 mL stok B.
3. Pembuatan Substrat Glikol Kitin dan Larutan Pereaksi
3.1 Pembuatan substrat glikol kitin (Truddel dan Asselin, 1989)
Sebanyak 1 gram glikol kitosan dilarutkan dalam20 mL asam asetat 10% dan dibiarkan dalam suhu ruang selama 24 jam. Kemudian campuran tersebut ditambah 100 mL metanol secara perlahan di dalam ruang asam, lalu disaring vakum dengan kertas saring whatman no 42. Filtrat yang dihasilkan
ditampung di dalam gelas piala dan ditambah 15 mL asetat anhidrida sambil distirer pelan. Lalu dibiarkan pada suhu kamar ± 30 menit, saat terbentuk gel lalu ditambah 150 mL metanol dan dihomogenkan. Kemudian endapan
dipisahkan dari filtrat dengan cara disentrifugasi pada 4000 rpm, suhu 4C selama 30 menit. Pelet ditambahkan 100–150 mL metanol dan dihomogenkan lagi. Kemudian tahap sentrifugasi diulang sekali lagi. Pelet ditambahkan 100 mL 0,02% sodium azida dan dihomogenkan kembali selama 4 menit. Larutan gel yang terbentuk adalah 1% glikol kitin.
3.2 Pereaksi pengukuran kadar protein metode Lowry Larutan A :2 gram Na2CO3dalam 100 mL aqudes
Larutan C : 2 mL pereaksi B + 100 mL pereaksi A.
Larutan D : Reagen Folin–Ciocalteu diencerkan dengan aquades1:1 Larutan standar : Larutan BSA konsentrasi 0, 20, 40, 60, 80, 100, 120, 140, 160, dan 180 ppm.
4. Isolasi Enzim Kitin Deasetilase dan Pengukuran Kadar Protein
4.1 Isolasi enzim kitin deasetilase
Media fermentasi yang berisiAspergillus aculeatusisolat tanah humus dikocok menggunakan shaker inkubator pada suhu ruang selama 5 hari. Kemudian dilakukan pemisahan enzim dari komponen sel lainnya dengan sentrifugasi pada 5000 rpm dan suhu 4⁰C selama 30 menit. Filtrat yang
diperoleh merupakan ekstrak kasar enzim yang selanjutnya diukur kadar protein dengan metodeLowry.
4.2 Penentuan kadar protein metodeLowry
menggunakan spektrofotometer UV-VIS pada panjang gelombang 750 nm. Untuk menentukan konsentrasi protein enzim yang digunakan kurva standar BSA (Bovine Serum Albumin).
5. Pemurnian enzim kitin deasetilase
5.1 Fraksinasi Dengan Amonium Sulfat
Ekstrak kasar enzim yang diperoleh diendapkan dengan garam ammonium sulfat pada berbagai derajat kejenuhan yaitu (0-20%); (20-40%); (40-60%);
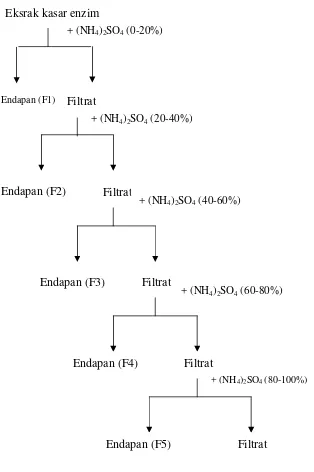
(60-80%);dan (80-100%) hal ini dilakukan untuk mengetahui pada fraksi mana enzim kitin deasetilase mempunyai aktivitas tertinggi. Jumlah (gram) amonium sulfat pada tiap fraksi dapat dilihat pada tabel Skema proses pengendapan protein enzim dengan penambahan amonium sulfat ditunjukkan pada Tabel 3 Lampiran 1.
Gambar 4. Skema proses pengendapan protein enzim dengan pengendapan amonium sulfat
Endapan (F1)
Eksrak kasar enzim
+ (NH4)2SO4(0-20%)
Filtrat
Endapan (F2)
+ (NH4)2SO4(20-40%)
Filtrat
Endapan (F3) Filtrat
+ (NH4)2SO4(40-60%)
Endapan (F4) Filtrat
+ (NH4)2SO4(60-80%)
+ (NH4)2SO4(80-100%)
5.2 Dialisis
Endapan enzim yang telah dilarutkan dari tiap fraksi amonium sulfat dengan aktivitas spesifik yang tinggi, dimasukkan ke dalam kantong selofan dan didialisis dengan 0,1 M buffer fosfat pH 6 selama ± 24 jam pada suhu dingin. Selama dialisis, dilakukan pergantian buffer selama 4-6 jam agar konsentrasi ion-ion di dalam kantong dialisis dapat dihilangkan. Untuk mengetahui bahwa sudah tidak ada lagi ion-ion garam dalam kantong, maka diuji dengan menambahkan larutan Ba(OH )2atau BaCl2. Bila masih ada ion sulfat dalam kantong, maka akan terbentuk endapan putih BaSO4. Semakin banyak endapan yang terbentuk, maka semakin banyak ion sulfat yang ada dalam kantong. Selanjutnya dilakukan uji aktivitas dengan metodeTokuyasudan diukur kadar proteinnya dengan metode Lowry.
6. Analisis Mutu Kitosan (Derajat Deasetilase)
Untuk sampel ambil 300μ L glikol kitin 1% ditambahkan 0,2 M buffer fosfat pH 6
sebanyak 200μ L dan 100μ L enzim kitin deasetilase. Larutan sampel tersebut
kemudian diinkubasi pada suhu 50⁰C selama 30 menit. Untuk kontrol digunakan
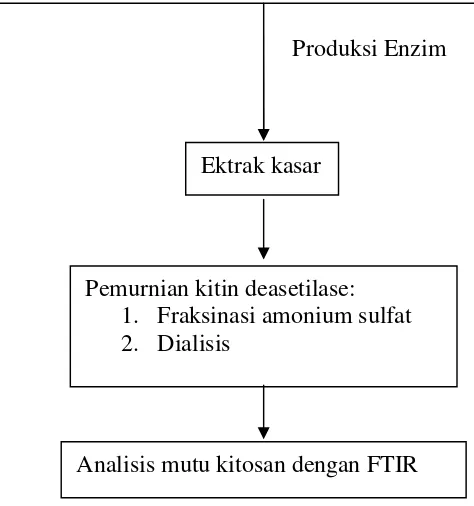
Gambar.5 Bagan alir penelitian
Fermentasi padatAspergillus aculeatusisolat tanah humus
Produksi Enzim
Ektrak kasar
Pemurnian kitin deasetilase: 1. Fraksinasi amonium sulfat 2. Dialisis
Judul Penelitian : ISOLASI DAN PEMURNIAN ENZIM KITIN
DEASETILASE DARI ASPERGILLUS
ACULEATUSISOLAT TANAH HUMUS
Nama Mahasiswa : Megawati Simbolon
Nomor Pokok Mahasiswa : 0617011041
Jurusan : Kimia
Fakultas : Matematika dan Ilmu Pengetahuan Alam
MENYETUJUI 1. Komisi pembimbing
Dra. Aspita Laila, M.S Husniati, M.Si
NIP. 196009091988112001 NIP 1969011620022002
2. Ketua Jurusan
ISOLASI DAN PEMURNIAN ENZIM KITIN DEASETILASE DARI ASPERGILLUS ACULEATUSISOLAT TANAH HUMUS
Oleh
Megawati Simbolon
Skripsi
Sebagai Salah Satu Syarat Untuk Mencapai Gelar SARJANA SAINS
Pada Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
Nama Mahasiswa : Megawati Simbolon Nomor Pokok Mahasiswa : 0617011041
Jurusan : Kimia
Fakultas : Matematika dan Ilmu Pengetahuan Alam
MENYETUJUI 1. Komisi pembimbing
Dra. Aspita Laila, M.S Husniati, M.Si
NIP. 196009091988112001 NIP 1969011620022002
2. Ketua Jurusan
Oleh
MEGAWATI SIMBOLON Skripsi
Sebagai Salah Satu Syarat Untuk Mencapai Gelar SARJANA SAINS
Pada Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
1. Tim Penguji
Ketua :Dra. Aspita Laila, M.S. ………..
Sekretaris :Husniati, M.Si. ………..
Penguji
Bukan Pembimbing :Prof. Dr. John Hendri, M.S. ……….
2. Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Prof. Suharso, Ph.D. NIP.196905301995121001
Penulis dilahirkan di Bekasi pada tanggal 08 Desember 1987, yang merupakan anak keempat dari 5 bersaudara dari pasangan bapak J. Simbolon dan Ibu M.F. Limbong.
Penulis menempuh pendidikan di Taman Kanak-kanak Pinokio Bekasi pada tahun 1993, Sekolah Dasar Strada Kampung Sawah Bekasi pada tahun 1994-2000, Sekolah Menengah Pertama Imanuel Bekasi pada tahun 2000-2003 dan Sekolah Menengah Atas Pangudi Luhur II Servatius Bekasi pada tahun 2003-2006.
Where there is hatred,
Let me show love
Where is injury,
Pardon
Where there is doubt,
Faith
Where there is despair,
Hope
Where there is sadness,
Joy
maka terlaksanalah segala rencanamu
(Amsal 16:3)
TUHAN itu baik, Ia adalah tempat pengungsian
pada waktu kesusahan
(Nahum 1:7)
When we are dreaming alone it is only a
dream.
When we are dreaming with others, it is the
beggining of reality...
Dengan penuh rasa syukur kepada TUHAN
YESUS, kupersembahkan karya kecilku ini
kepada:
Mama dan Bapak yang tersayang sebagai wujud
baktiku (doa dan semangat orang tuaku menjadi
kekuatanku)
Kakak, abang dan adikku, Betty, Yanti, Willi dan
Dedi yang selalu memberiku motivasi
Seluruh keluarga besarku
Puji dan syukur penulis panjatkan kepada TUHAN YANG MAHA ESA atas segala berkat dan kuasa yang luar biasa yang telah diberikanNya, sehingga penulis dapat menyelesaikan skripsi yang berjudul :
ISOLASI DAN PEMURNIAN ENZIM KITIN DEASETILASE DARI ASPERGILLUS ACULEATUSISOLAT TANAH HUMUS
Pada kesempatan ini penulis mengucapkan terima kasih dan penghargaan yang tulus kepada :
1. Bapak Prof. Dr. John Hendri M.Si, selaku pembahas atas serta memberikan arahan bagi penulis dalam proses penyelesaian skripsi ini.
2. Ibu Husniati, M.S pembimbing II atas saran bimbingan dan sumbangan ide yang sangat berharga bagi penulis untuk kesempurnaan skripsi ini.
3. Ibu Dra. Aspita Laila M.Si, selaku pembimbing I atas bimbingan, saran, dan dorongan semangatnya bagi penulis selama penelitian hingga penyusunan skripsi ini.
4. Bapak Andi Setiawan Ph.D selaku Ketua Jurusan kimia Fakultas Matematika dan Ilmu Pengetahuan Alam.
5. Ibu Prof. Dr. Tati Suhartati,M.S, selaku pembimbing akademik atas saran dan dorongan semangat bagi penulis selama ini.
6. Bapak Ir. Agus Kuntoro, MTA selaku Kepala Balai Riset Standarisasi dan Industri Bandar Lampung.
keberhasilanku.
9. Kakakku tercinta Betty Herawati Simbolon beserta keluarganya, Damayanti Simbolon beserta keluarga kecilnya, abangku Willy Parulian Simbolon SSi, dan adikku tersayang Dedi Setiawan Simbolon yang selalu memberikan semangat. 10. Special Thanks toKepala Laboratorium Baristand Bapak Udin, Mba Eva Okta,
Mba Ira, Ka’ Rizki, Mba Pia, Ka’ Eva, Mba Dinda,Mba Leni, Mba Wuri dan semua karyawan Balai Riset Standarisasi Industri Lampung.
11. Buat anak kosan Sidiq Utama (Kansas siu):Ka’Novita Hutagaol S.T, Ka’Elia S.E, Ka’Pupy S.E, Ka’Eka S.P, Ka Tia S.E, Tetty Sugianti S.H, Marisa Siregar
S.H, Bg Erwin Simamora SSi, Junika Odelia SPd, Talenta Harianja, Mey
Sinulingga, dan Novi Siboro SPd, anak kosan Universitas Bandar Lampung:Iqa, Rina, Nita, Nia, Stevi,Sri,Silvi, anak kosan Maleo :Riri, rini, Lia, Serri, Dwi, Inda, Ica.
12. Sahabatku Nina Anggraini SSi, Sifa Sefrima Meha SSi dan Eka Eva Krisna SSi. 13. Teman-temanku : Sumartini Dwi Astuti (terimakasih banyak buat pinjaman
kimia angkatan 07, 08,09 dan 10 terimakasih atas kebersamaan dan persaudaraan yang terjalin selama ini.
15. Semua pihak yang tidak dapat penulis sebutkan satu persatu yang secara tulus memberikan bantuan moril dan materil kepada penulis.
Bandar Lampung, 08 Febuari 2012 Penulis
Puji dan syukur penulis panjatkan kepada TUHAN YANG MAHA ESA atas segala berkat dan kuasa yang luar biasa yang telah diberikanNya, sehingga penulis dapat menyelesaikan skripsi yang berjudul :
ISOLASI DAN PEMURNIAN ENZIM KITIN DEASETILASE DARI ASPERGILLUS ACULEATUSISOLAT TANAH HUMUS
Pada kesempatan ini penulis mengucapkan terima kasih dan penghargaan yang tulus kepada :
1. Bapak Prof. Dr. John Hendri M.Si, selaku pembahas atas serta memberikan arahan bagi penulis dalam proses penyelesaian skripsi ini.
2. Ibu Husniati, M.S pembimbing II atas saran bimbingan dan sumbangan ide yang sangat berharga bagi penulis untuk kesempurnaan skripsi ini.
3. Ibu Dra. Aspita Laila M.Si, selaku pembimbing I atas bimbingan, saran, dan dorongan semangatnya bagi penulis selama penelitian hingga penyusunan skripsi ini.
4. Bapak Andi Setiawan Ph.D selaku Ketua Jurusan kimia Fakultas Matematika dan Ilmu Pengetahuan Alam.
5. Ibu Prof. Dr. Tati Suhartati,M.S, selaku pembimbing akademik atas saran dan dorongan semangat bagi penulis selama ini.
6. Bapak Ir. Agus Kuntoro, MTA selaku Kepala Balai Riset Standarisasi dan Industri Bandar Lampung.
keberhasilanku.
9. Kakakku tercinta Betty Herawati Simbolon beserta keluarganya, Damayanti Simbolon beserta keluarga kecilnya, abangku Willy Parulian Simbolon SSi, dan adikku tersayang Dedi Setiawan Simbolon yang selalu memberikan semangat. 10. Special Thanks toKepala Laboratorium Baristand Bapak Udin, Mba Eva Okta,
Mba Ira, Ka’ Rizki, Mba Pia, Ka’ Eva, Mba Dinda,Mba Leni, Mba Wuri dan semua karyawan Balai Riset Standarisasi Industri Lampung.
11. Buat anak kosan Sidiq Utama (Kansas siu):Ka’Novita Hutagaol S.T, Ka’Elia S.E, Ka’Pupy S.E, Ka’Eka S.P, Ka Tia S.E, Tetty Sugianti S.H, Marisa Siregar
S.H, Bg Erwin Simamora SSi, Junika Odelia SPd, Talenta Harianja, Mey
Sinulingga, dan Novi Siboro SPd, anak kosan Universitas Bandar Lampung:Iqa, Rina, Nita, Nia, Stevi,Sri,Silvi, anak kosan Maleo :Riri, rini, Lia, Serri, Dwi, Inda, Ica.
12. Sahabatku Nina Anggraini SSi, Sifa Sefrima Meha SSi dan Eka Eva Krisna SSi. 13. Teman-temanku : Sumartini Dwi Astuti (terimakasih banyak buat pinjaman
kimia angkatan 07, 08,09 dan 10 terimakasih atas kebersamaan dan persaudaraan yang terjalin selama ini.
15. Semua pihak yang tidak dapat penulis sebutkan satu persatu yang secara tulus memberikan bantuan moril dan materil kepada penulis.
Bandar Lampung, 08 Febuari 2012 Penulis