IDENTIFIKASI DAN UJI KAPASITAS
ANTIOKSIDAN HERBA SELEDRI
(Apium graveolens L.) SECARA
SPEKTROFOTOMETRI SINAR TAMPAK
SKRIPSI
OLEH:
VIVIAN
NIM 091501040
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
IDENTIFIKASI DAN UJI KAPASITAS
ANTIOKSIDAN HERBA SELEDRI
(Apium graveolens L.) SECARA
SPEKTROFOTOMETRI SINAR TAMPAK
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk
memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
VIVIAN
NIM 091501040
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
IDENTIFIKASI DAN UJI KAPASITAS ANTIOKSIDAN HERBA SELEDRI (Apium graveolens L.) SECARA
SPEKTROFOTOMETRI SINAR TAMPAK
OLEH: VIVIAN
NIM 091501040
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: 15 Juni 2013
Pembimbing I
Dra. Tuty Roida Pardede, M.Si., Apt. NIP 195401101980032001
Pembimbing II
Dr. Muchlisyam, M.Si., Apt. NIP 195006221980021001
Panitia Penguji,
Dra. Masfria, M.S., Apt. NIP 195707231986012001
Dra. Tuty Roida Pardede, M.Si., Apt. NIP 195401101980032001
Dra. Saleha Salbi, M.Si., Apt. NIP 194909061980032001
Dra. Siti Nurbaya, M.Si., Apt. NIP 195008261974122001
Medan, Juni 2013 Fakultas Farmasi
Universitas Sumatera Utara Dekan,
KATA PENGANTAR
Puji syukur penulis ucapkan kepada Tuhan Yang Maha Esa atas segala
limpahan rahmat dan karuniaNya, sehingga penulis dapat menyelesaikan
penelitan dan penyusunan skripsi ini. Skripsi ini disusun untuk melengkapi
salah satu syarat mencapai gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara, dengan judul Identifikasi dan Uji Kapasitas
Antioksidan Herba Seledri (Apium graveolens L.) secara Spektrofotometri
Sinar Tampak.
Pada kesempatan ini, dengan kerendahan hati dan hormat, penulis
mengucapkan terima kasih kepada Ibu Dra. Tuty Roida Pardede, M.Si., Apt.,
dan Bapak Dr. Muchlisyam, M.Si., Apt., yang telah membimbing dengan
sangat baik, memberikan petunjuk, saran-saran dan motivasi selama penelitian
hingga selesainya skripsi ini, Bapak Prof. Dr. Sumadio Hadisahputra, Apt.,
selaku Dekan Fakultas Farmasi USU Medan, yang telah memberikan
bimbingan dan penyediaan fasilitas sehingga penulis dapat menyelesaikan
pendidikan, Ibu Dra. Masfria, M.S., Apt., Ibu Dra. Saleha Salbi, M.Si., Apt.,
dan Ibu Dra. Siti Nurbaya, M.Si., Apt., selaku dosen penguji yang telah
memberikan kritik, saran dan arahan kepada penulis dalam menyelesaikan
skripsi ini, Bapak dan Ibu staf pengajar Fakultas Farmasi USU Medan yang
telah mendidik selama perkuliahan, teman-teman yang selalu memberikan
dukungan, Riyan Tanady, Cut Shafa Safira dan Christine. Serta seluruh pihak
Penulis juga mengucapkan terima kasih dan penghargaan yang tiada
terhingga kepada kedua orangtua, Bong Syak Fo dan Deliana Junus, serta
abang tercinta, Benny, yang selalu mendukung, mendoakan dan memberikan
semangat.
Penulis menyadari sepenuhnya bahwa dalam penulisan skripsi ini masih
jauh dari kesempurnaan. Oleh karena itu dengan segala kerendahan hati,
penulis menerima kritik dan saran demi kesempurnaan skripsi ini. Akhirnya,
penulis berharap semoga skripsi ini dapat memberi manfaat bagi kita semua.
Medan, Juli 2013 Penulis,
Vivian
IDENTIFIKASI DAN UJI KAPASITAS ANTIOKSIDAN DARI HERBA SELEDRI (Apium graveolens L.) SECARA
SPEKTROFOTOMETRI SINAR TAMPAK ABSTRAK
Seledri (Apium graveolens L.) merupakan salah satu sayuran, dan dalam pengobatan tradisional digunakan untuk antihipertensi. Berdasarkan kandungan kimia herba seledri yang terdiri dari senyawa flavonoid dan senyawa fenolik, herba seledri dapat dijadikan salah satu sumber antioksidan alami. Penelitian ini bertujuan untuk mengidentifikasi, menguji dan membandingkan kapasitas antioksidan dari herba seledri yang dimaserasi dengan sediaan jamu herba seledri.
Identifikasi antioksidan dilakukan dengan menentukan daya reduksi dari herba seledri, menggunakan reaksi Ag ammoniakal dan reaksi Fehling. Uji kapasitas antioksidan dilakukan dengan metode fosfomolibdenum, yang akan mereduksi Mo (VI) menjadi Mo (V) yang terdapat dalam kompleks fosfomolibdenum pada pH asam, sehingga terjadi perubahan warna menjadi warna hijau. Warna yang terbentuk diukur menggunakan spektrofotometer sinar tampak pada panjang gelombang 711 nm.
Hasil penelitian menunjukkan bahwa herba seledri memiliki sifat antioksidan, karena memberikan hasil positif terhadap reaksi Ag Ammoniakal dan reaksi Fehling. Hasil maserasi 1 g herba seledri segar ekivalen dengan kapasitas antioksidan vitamin C seberat (0,59 ± 0,0847) mg, dan 1 g ekstrak herba seledri dari sediaan jamu herba seledri ekivalen dengan kapasitas antioksidan vitamin C seberat (31,07 ± 5,8049) mg.
Dari penelitian ini dapat disimpulkan bahwa herba seledri memiliki sifat antioksidan dan terdapat adanya perbedaan kapasitas antioksidan antara hasil maserasi herba seledri dan sediaan jamu herba seledri.
IDENTIFICATION AND DETERMINATION OF ANTIOXIDANT CAPACITY OF CELERY (Apium graveolens L.) HERB USING
VISIBLE SPECTROPHOTOMETRY METHOD ABSTRACT
Celery (Apium graveolens L.) is a kind of vegetable and is used in traditional medicinal as antihypertension. Based on its flavonoid and phenolic compounds content, celery can be a source of natural antioxidants. The objectives of this experiment are to identify, determine and compare the antioxidant capacity from macerated celery herb and traditional dosage form of celery herb.
The method of antioxidant identification is by determining the reducing properties of celery herb using silver nitrate ammoniacal reaction and Fehling reaction. The antioxidant capacity determination is done by phosphomolybdenum method, which will reduce Mo (VI) into Mo (V) in phosphomolybdenum complex in acidic pH so that the colour of the solution changed into green colour. This green colour is measured by visible spectrophotometer on 711 nm wavelength.
The results showed that the celery herb has antioxidant properties, by determining its reduction properties as it gave positive results towards silver nitrate ammoniacal reaction and Fehling reaction. 1 gram macerated fresh celery herb is equivalent to antioxidant capacity of (0.59 ± 0.0847) mg vitamin C and 1 gram of celery herb extract from the traditional dosage form of celery herb is equivalent to antioxidant capacity of (31.07 ± 5.89049) mg.
From this research, it can be concluded that celery herb has antioxidant properties and the macerated celery herb and the traditional dosage form of celery herb have different antioxidant capacity.
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 4
1.3 Hipotesis Penelitian ... 4
1.4 Tujuan Penelitian ... 5
1.5 Manfaat Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Uraian Umum ... 6
2.1.1 Taksonomi Seledri ... 6
2.1.2 Deskripsi Herba Seledri ... 6
2.1.3 Kandungan Kimia Herba Seledri ... 7
2.2.1 Mekanisme Antioksidan ... 8
2.2.2 Defisiensi Antioksidan ... 9
2.3 Senyawa Fenol ... 9
2.4 Reaksi Oksidasi-Reduksi ... 11
2.5 Reaksi Ag Ammoniakal ... 11
2.6 Reaksi Fehling ... 12
2.7 Metode Fosfomolibdenum ... 12
2.8 Vitamin C ... 13
2.9 Spektrofotometri ... 13
2.10 Validasi Metode Analisis ... 16
BAB III METODE PENELITIAN ... 19
3.1 Tempat dan Waktu Penelitian ... 19
3.2 Bahan-bahan ... 19
3.2.1 Sampel ... 19
3.2.2 Pereaksi ... 19
3.3 Alat-alat ... 19
3.4 Pembuatan Pereaksi ... 20
3.4.1 Pereaksi Ag Ammoniakal ... 20
3.4.2 Pereaksi Fehling ... 20
3.4.3 Pereaksi Fosfomolibdenum ... 20
3.5 Prosedur Penelitian ... 20
3.5.1 Pengambilan Sampel ... 20
3.5.3 Pengolahan Sampel ... 21
3.5.4 Prosedur Maserasi Herba Seledri ... 21
3.5.5 Identifikasi Sifat Antioksidan Berdasarkan Daya Reduksi ... 21
3.5.5.1 Reaksi Ag Ammoniakal ... 21
3.5.5.2 Reaksi Fehling ... 22
3.5.6 Pengukuran Kapasitas Antioksidan ... 22
3.5.6.1 Pembuatan Larutan Induk Baku Vitamin C ... 22
3.5.6.2 Penentuan Panjang Gelombang Maksimum ... 22
3.5.6.3 Penentuan Waktu Kerja ... 22
3.5.6.4 Pengukuran Kurva Kalibrasi Vitamin C ... 23
3.5.6.5 Pengukuran Kapasitas Antioksidan dari Hasil Maserasi Herba Seledri ... 23
3.5.6.6 Pengukuran Kapasitas Antioksidan dari Sediaan Jamu Herba Seledri yang Beredar di Pasaran ... 24
3.6 Penentuan Batas Deteksi dan Batas Kuantitasi ... 24
3.7 Uji Akurasi dengan Persen Perolehan Kembali (% Recovery) ... 25
3.8 Analisis Data Secara Statistik ... 25
3.8.1 Penolakan Hasil Pengamatan ... 25
3.8.2 Simpangan Baku Relatif ... 26
BAB IV HASIL DAN PEMBAHASAN ... 28
4.1 Identifikasi Antioksidan ... 28
4.2 Kapasitas Antioksidan ... 28
4.2.2 Waktu Kerja ... 29
4.2.3 Kurva Kalibrasi Vitamin C ... 30
4.2.4 Hasil Uji Kapasitas Antioksidan dari Hasil Maserasi Herba Seledri ... 31
4.2.5 Hasil Uji Kapasitas Antioksidan dari Sediaan Jamu Herba Seledri yang Beredar di Pasaran ... 32
4.2.6 Pembahasan Kapasitas Antioksidan dari Hasil Maserasi Herba Seledri dengan Sediaan Jamu Herba Seledri ... 33
4.3 Batas Deteksi dan Batas Kuantitasi ... 34
4.4 Persen Perolehan Kembali (% Recovery) ... 34
4.5 Simpangan Baku Relatif ... 35
BAB V KESIMPULAN DAN SARAN ... 36
5.1 Kesimpulan ... 36
5.2 Saran ... 36
DAFTAR PUSTAKA ... 37
DAFTAR TABEL
Tabel Halaman
3.1 Nilai Qkritis pada Taraf Kepercayaan 95% ... 26
4.1 Hasil Identifikasi Antioksidan Secara Reaksi Kimia dari Hasil Maserasi Herba Seledri ... 28
4.2 Hasil Uji Kapasitas Antioksidan dari Hasil Maserasi Herba Seledri 31
4.3 Hasil Uji Kapasitas Antioksidan dari Sediaan Jamu Herba Seledri . 32
DAFTAR GAMBAR
Gambar Halaman
2.1 Reaksi Fenol ... 10
2.2 Stabilisasi Radikal Fenoksi oleh Resonansi ... 10
2.3 Diagram Blok dari Instrumen Spektrofotometer UV/Vis ... 15
4.1 Kurva Panjang Gelombang Maksimum Vitamin C dengan
Konsentrasi 12,7273 µg/ml ... 29
4.2 Kurva Waktu Kerja ... 30
DAFTAR LAMPIRAN
Lampiran Halaman
1. Perhitungan Bahan-bahan untuk Pembuatan 100 ml Pereaksi
Fosfomolibdenum ... 40
2. Waktu Kerja ... 42
3. Contoh Perhitungan Konsentrasi Larutan Standar Vitamin C untuk Penentuan Kurva Kalibrasi ... 43
4. Kurva Kalibrasi Larutan Vitamin C dengan Berbagai Konsentrasi pada Panjang Gelombang 711 nm ... 44
5. Bagan Kerja ... 45
6. Perhitungan Persamaan Garis Regresi ... 47
7. Perhitungan Koefisien Korelasi ... 49
8. Gambar Hasil Identifikasi Antioksidan ... 50
9. Contoh Perhitungan Kapasitas Antioksidan dari Hasil Maserasi Herba Seledri ... 51
10.Pengukuran Kapasitas Antioksidan dari Hasil Maserasi Herba Seledri ... 52
11.Contoh Perhitungan Kapasitas Antioksidan dari Sediaan Jamu Herba Seledri yang Beredar di Pasaran ... 53
12.Pengukuran Kapasitas Antioksidan dari Sediaan Jamu Herba Seledri yang Beredar di Pasaran ... 54
13.Uji t ... 55
14.Contoh Perhitungan Perolehan Kembali Kapasitas Antioksidan dengan Metode Penambahan Baku ... 58
16.Perhitungan Perolehan Kembali Sampel Sediaan Jamu Herba Seledri yang Beredar di Pasaran dengan Metode Penambahan
Baku ... 60
17.Perhitungan Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ) ... 63
18.Perhitungan Simpangan Baku Relatif (RSD) Kapasitas Antioksidan dari Hasil Herba Seledri ... 64
19.Perhitungan Simpangan Baku Relatif (RSD) Kapasitas Antioksidan dari Sediaan Jamu Herba Seledri yang Beredar di Pasaran ... 65
20.Hasil Identifikasi Tumbuhan ... 66
21.Gambar Herba Seledri (Apium Graveolens L.) ... 67
22.Sediaan Jamu Herba Seledri ... 67
23.Sertifikat Analisis Baku Pabrik Vitamin C ... 68
IDENTIFIKASI DAN UJI KAPASITAS ANTIOKSIDAN DARI HERBA SELEDRI (Apium graveolens L.) SECARA
SPEKTROFOTOMETRI SINAR TAMPAK ABSTRAK
Seledri (Apium graveolens L.) merupakan salah satu sayuran, dan dalam pengobatan tradisional digunakan untuk antihipertensi. Berdasarkan kandungan kimia herba seledri yang terdiri dari senyawa flavonoid dan senyawa fenolik, herba seledri dapat dijadikan salah satu sumber antioksidan alami. Penelitian ini bertujuan untuk mengidentifikasi, menguji dan membandingkan kapasitas antioksidan dari herba seledri yang dimaserasi dengan sediaan jamu herba seledri.
Identifikasi antioksidan dilakukan dengan menentukan daya reduksi dari herba seledri, menggunakan reaksi Ag ammoniakal dan reaksi Fehling. Uji kapasitas antioksidan dilakukan dengan metode fosfomolibdenum, yang akan mereduksi Mo (VI) menjadi Mo (V) yang terdapat dalam kompleks fosfomolibdenum pada pH asam, sehingga terjadi perubahan warna menjadi warna hijau. Warna yang terbentuk diukur menggunakan spektrofotometer sinar tampak pada panjang gelombang 711 nm.
Hasil penelitian menunjukkan bahwa herba seledri memiliki sifat antioksidan, karena memberikan hasil positif terhadap reaksi Ag Ammoniakal dan reaksi Fehling. Hasil maserasi 1 g herba seledri segar ekivalen dengan kapasitas antioksidan vitamin C seberat (0,59 ± 0,0847) mg, dan 1 g ekstrak herba seledri dari sediaan jamu herba seledri ekivalen dengan kapasitas antioksidan vitamin C seberat (31,07 ± 5,8049) mg.
Dari penelitian ini dapat disimpulkan bahwa herba seledri memiliki sifat antioksidan dan terdapat adanya perbedaan kapasitas antioksidan antara hasil maserasi herba seledri dan sediaan jamu herba seledri.
IDENTIFICATION AND DETERMINATION OF ANTIOXIDANT CAPACITY OF CELERY (Apium graveolens L.) HERB USING
VISIBLE SPECTROPHOTOMETRY METHOD ABSTRACT
Celery (Apium graveolens L.) is a kind of vegetable and is used in traditional medicinal as antihypertension. Based on its flavonoid and phenolic compounds content, celery can be a source of natural antioxidants. The objectives of this experiment are to identify, determine and compare the antioxidant capacity from macerated celery herb and traditional dosage form of celery herb.
The method of antioxidant identification is by determining the reducing properties of celery herb using silver nitrate ammoniacal reaction and Fehling reaction. The antioxidant capacity determination is done by phosphomolybdenum method, which will reduce Mo (VI) into Mo (V) in phosphomolybdenum complex in acidic pH so that the colour of the solution changed into green colour. This green colour is measured by visible spectrophotometer on 711 nm wavelength.
The results showed that the celery herb has antioxidant properties, by determining its reduction properties as it gave positive results towards silver nitrate ammoniacal reaction and Fehling reaction. 1 gram macerated fresh celery herb is equivalent to antioxidant capacity of (0.59 ± 0.0847) mg vitamin C and 1 gram of celery herb extract from the traditional dosage form of celery herb is equivalent to antioxidant capacity of (31.07 ± 5.89049) mg.
From this research, it can be concluded that celery herb has antioxidant properties and the macerated celery herb and the traditional dosage form of celery herb have different antioxidant capacity.
BAB I PENDAHULUAN 1.1 Latar Belakang
Antioksidan adalah senyawa kimia baik alami maupun sintetik yang
dapat menyumbangkan satu atau lebih elektron kepada radikal bebas, sehingga
radikal bebas tersebut dapat dinetralkan (Suhartono, et al., 2002). Berdasarkan
sumber perolehannya ada 2 macam antioksidan, yaitu antioksidan alami dan
antioksidan buatan (sintetik) (Gupta dan Sharma, 2006). Tubuh manusia tidak
mempunyai cadangan antioksidan dalam jumlah berlebih, sehingga jika terjadi
paparan radikal berlebih maka tubuh membutuhkan antioksidan eksogen.
Adanya kekhawatiran akan kemungkinan efek samping yang belum diketahui
dari antioksidan sintetik menyebabkan antioksidan alami menjadi alternatif
yang sangat dibutuhkan (Rohdiana dan Widiantara, 2011).
Antioksidan alami mampu melindungi tubuh terhadap kerusakan yang
disebabkan spesies oksigen reaktif, mampu menghambat terjadinya penyakit
degeneratif serta mampu menghambat peroksidasi lipid pada makanan.
Meningkatnya minat untuk mendapatkan antioksidan alami terjadi beberapa
tahun terakhir ini. Antioksidan alami umumnya mempunyai gugus hidroksi
dalam struktur molekulnya (Sunarni, 2005).
Herba seledri mengandung tanin, steroid, senyawa fenolik, terpenoid,
flavonoid, minyak atsiri dan saponin (Shad, et al., 2011). Berdasarkan
senyawa yang dapat bermanfaat sebagai antioksidan disebabkan ketiga
senyawa tersebut mempunyai daya reduksi (Lingga, 2012).
Pemanfaatan seledri di Indonesia lebih dikenal sebagai bumbu masak
untuk memperkaya cita rasa makanan, tetapi seledri juga digunakan dalam
berbagai pengobatan dengan cara dimakan langsung, diseduh, maupun
dijadikan jus kemudian diminum. Di pasaran, juga beredar dalam bentuk
sediaan jamu, misalnya Tensigard Agromed (PT. Phapros), Celery (PT.
Sidomuncul) dan Seleri (PT. Borobudur).
Pemeriksaan kuantitatif kapasitas antioksidan dalam herba seledri dapat
dilakukan dengan menggunakan metode spektrofotometri sinar tampak karena
metode spektrofotometri sinar tampak sangat baik digunakan untuk mengukur
larutan yang berwarna pada konsentrasi kecil (µg/ml). Berbagai metode yang
dapat digunakan untuk menentukan kapasitas antioksidan antara lain metode
2-2-difenil-1-pikrilhidrazil (DPPH), 2,2’-azino-bis-3-ethylbenz-
thiazoline-6-sulphonic acid (ABTS), Ferric Reducing Ability of Plasma
(FRAP) dan fosfomolibdenum.
Metode DPPH memiliki beberapa kekurangan, antara lain hanya dapat
digunakan untuk mengukur antioksidan yang larut dalam pelarut organik,
terutama alkohol dan sangat sensitif terhadap cahaya, oksigen, pH dan tipe
pelarut. Sedangkan metode FRAP tidak dapat mengukur antioksidan dengan
gugus thiol (mengandung –SH) seperti glutation dan metode ini hanya terbatas
untuk antioksidan yang larut dalam air, dan karotenoid tidak memiliki
Metode ABTS sangat sensitif terhadap cahaya, bahkan pembentukan ABTS·-
memerlukan waktu inkubasi selama 12-16 jam dalam kondisi gelap (Alali, et
al., 2007).
Metode fosfomolibdenum merupakan metode spektrofotometri untuk
menentukan kapasitas antioksidan secara kuantitatif. Metode ini berdasarkan
reduksi dari Mo (VI) menjadi Mo (V) oleh analyte sampel dan pembentukan
kompleks fosfat/Mo (V) yang berwarna hijau pada suasana asam dan
digunakan antioksidan lain sebagai pembanding (Prieto, et al., 1999).
Berdasarkan uraian di atas, maka dilakukan penelitian untuk
mengidentifikasi dan menentukan kapasitas antioksidan dari herba seledri.
Sampel yang digunakan yaitu herba seledri dan sediaan jamu herba seledri.
Pemeriksaan kualitatif antioksidan dari herba seledri dilakukan berdasarkan
daya reduksinya dengan reaksi Ag ammoniakal dan reaksi Fehling. Penetapan
kapasitas antioksidan dari herba seledri dengan metode fosfomolibdenum
karena memiliki beberapa keuntungan antara lain pelaksanaannya relatif cepat
dan sederhana dan bahan yang digunakan sedikit (Prieto, et al., 1999). Sebagai
pembanding digunakan vitamin C. Vitamin C adalah vitamin yang larut dalam
air dan merupakan donor elektron yang menyumbang elektron ke dalam reaksi
biokimia intra dan ekstra seluler (Lingga, 2012) sehingga vitamin C dapat
digunakan sebagai antioksidan pembanding dalam penetapan kapasitas
1.2 Perumusan Masalah
Berdasarkan latar belakang di atas, maka perumusan masalah pada
penelitian ini adalah:
a. Apakah herba seledri mempunyai antioksidan, yang dapat diidentifikasi
berdasarkan daya reduksinya secara reaksi kimia?
b. Apakah kapasitas antioksidan dari herba seledri dapat ditentukan dengan
metode fosfomolibdenum?
c. Apakah kapasitas antioksidan dari hasil maserasi herba seledri dan sediaan
jamu herba seledri berbeda?
1.3 Hipotesis Penelitian
Berdasarkan perumusan masalah di atas, maka hipotesis pada penelitian
ini adalah:
a. Herba seledri mempunyai antioksidan dan dapat diidentifikasi berdasarkan
daya reduksinya secara reaksi kimia dengan reaksi Ag ammoniakal dan
reaksi Fehling.
b. Kapasitas antioksidan dari herba seledri dapat ditentukan dengan metode
fosfomolibdenum.
c. Terdapat adanya perbedaan kapasitas antioksidan dari hasil maserasi herba
1.4 Tujuan Penelitian
Tujuan penelitian ini adalah:
a. Untuk mengevaluasi herba seledri mempunyai antioksidan berdasarkan
daya reduksinya dan dapat diidentifikasi secara reaksi kimia.
b. Untuk mengetahui penentuan kapasitas antioksidan dari herba seledri
secara metode fosfomolibdenum.
c. Untuk mengetahui adanya perbedaan kapasitas antioksidan dari hasil
maserasi herba seledri dan sediaan jamu herba seledri.
1.5 Manfaat Penelitian
Manfaat dari penelitian ini diharapkan dapat menambah pengetahuan
baru dalam ilmu pangan terutama mengenai antioksidan yang terkandung
dalam herba seledri sehingga akan mendorong pengembangan lebih lanjut
tentang pemanfaatan bahan makanan tersebut dalam menunjang kebutuhan
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Umum
Seledri dapat dijadikan sebagai salah satu sumber antioksidan. Meskipun
hanya dikonsumsi dalam jumlah sedikit, konsumsi seledri cukup berarti untuk
membantu memenuhi kebutuhan tubuh akan antioksidan eksogen (Lingga,
2012).
2.1.1 Taksonomi Seledri
Adapun taksonomi tanaman seledri menurut Herbarium Medanense
(2013) yaitu sebagai berikut:
Kerajaan : Plantae
Divisi : Spermatophyta
Kelas : Dicotyledoneae
Suku : Apiales
Famili : Apiaceae
Marga : Apium
Spesies : Apium graveolens L.
2.1.2 Deskripsi Herba Seledri
Tumbuhan yang tingginya dapat mencapai 0,8 m, berbau khas jika
diremas. Akar tebal, berumbi kecil. Batang bersegi nyata, berlubang, tidak
berambut. Daun majemuk menyirip sederhana atau beranak daun 3, anak daun
melebar, pangkal berbentuk segitiga terbalik (pasak), hijau mengkilat, ujung
melebar. Perbungaan berupa bunga majemuk payung, tanpa atau dengan
tangkai tetapi panjangnya tidak lebih dari 2 cm, anak payung 6-15 cabang,
ukuran 1-3 cm, 6-25 bunga, tangkai bunga 2-3 mm, daun mahkota
putih-kehijauan atau putih-kekuningan, panjang mahkota bunga 0,5-0,75 mm.
Panjang buah rata-rata 1 mm (Badan POM RI, 2010).
Menurut jenisnya, seledri dibagi menjadi tiga golongan, yaitu seledri
daun (Apium graveolens L var. secalinum alef), seledri batang (Apium
graveolens L var. sylvestre alef), dan seledri umbi (Apium graveolens L. var.
rapaceum alef). Seledri daun tumbuh baik di tanah yang agak kering, seledri
batang cocok tumbuh di tanah yang mengandung pasir, kerikil dan sedikit air,
dan seledri umbi tumbuh baik di tanah yang gembur dan banyak mengandung
air dengan bentuk batangnya membesar membentuk umbi di permukaan tanah.
Di antara ketiga golongan seledri tersebut yang paling banyak ditanam di
Indonesia adalah seledri daun (Soewito, 1991).
2.1.3 Kandungan Kimia Herba Seledri
Herba seledri mengandung vitamin C, β-karoten, tanin, steroid, senyawa
fenol, terpenoid, flavonoid, minyak atsiri dan saponin (Shad, et al., 2011).
2.2 Antioksidan
Pada beberapa proses metabolisme dalam tubuh, terutama reaksi dengan
menggunakan oksigen, terbentuk molekul-molekul dengan kehilangan elektron
(tak berpasangan) di kulit luarnya. Zat-zat ini yang dinamakan radikal bebas,
bersifat sangat reaktif dan cenderung ‘menyerang’ molekul-molekul yang dapat
berupa antioksidan alamiah yang mudah dioksidasi (menyerahkan elektron)
dan yang menetralkan sebagian besar radikal bebas tersebut. Zat-zat berperan
sebagai antioksidan alamiah adalah vitamin A, C, dan E, serta enzim-enzim
alamiah glutationperoksidase (GPx), superoksida-dismutase (SOD) dan
katalase (Tan dan Rahardja, 2010).
Kebanyakan antioksidan alamiah merupakan senyawa fenolik dari
tumbuhan yang terdapat pada semua bagian tanaman. Senyawa-senyawa
non-fenolik termasuk karotenoid dan fosfolipid juga dapat menunjukkan aktivitas
antioksidan pada kondisi-kondisi tertentu. Senyawa fenolik dari tumbuhan
memiliki beberapa fungsi. Senyawa-senyawa tersebut dapat berperan sebagai
radical scavengers, zat pengkhelat, singlet oxygen quencher atau agen
pereduksi (Caballero, 2003).
Senyawa dengan kandungan bioaktif tertentu yang memiliki kemampuan
sebagai antioksidan, melemahkan radikal bebas yang berpotensi sebagai
molekul reaktif jika bereaksi dengan oksigen (teroksidasi). Reaksi oksidasi
dihambat dengan cara reduksi. Karena itulah antioksidan juga disebut senyawa
pereduksi (Lingga, 2012).
2.2.1 Mekanisme Antioksidan
Menurut Lingga (2012), dalam menjalankan aktivitasnya, antioksidan
bekerja melalui berbagai cara. Setiap jenis antioksidan memiliki kinerja yang
bervariasi satu dengan yang lainnya. Cara kerja tersebut meliputi mekanisme
sebagai berikut:
- Mereduksi molekul radikal sehingga tidak menjadi berbahaya
- Memperbaiki kerusakan oksidatif
- Mengeliminasi molekul yang rusak
- Meningkatkan aktivitas enzim detoksifikasi tahap ke-2
- Mencegah terjadinya mutasi
Sistem pertahanan tubuh yang utama dilakukan oleh antioksidan
endogen, selebihnya dilakukan oleh antioksidan eksogen. Antioksidan endogen
merupakan antioksidan alami yang dihasilkan tubuh atau disebut pula sebagai
antioksidan primer, sedangkan antioksidan eksogen terdiri atas antioksidan
sekunder, antioksidan tersier, pengikat oksigen (oxygen scavenger) dan
pengikat logam (chelator atau sequestrans) (Lingga, 2012).
2.2.2 Defisiensi Antioksidan
Defisiensi antioksidan dalam tubuh akan mengakibatkan membran sel
dan/atau inti-sel dapat dirusak oleh radikal bebas. Akibatnya proses menua
jaringan dipercepat serta terjadi cacat pada DNA. Bila tidak direparasi atau
dimusnahkan oleh sistem imun, sel dapat memperbanyak diri menjadi sel-sel
ganas. Selain itu radikal bebas juga dianggap turut bertanggungjawab untuk
sejumlah gangguan lain, seperti pengeruhan lensa mata (staar, katarak) dan
pengendapan oksi-LDL kolesterol pada dinding pembuluh dengan terjadinya
aterosklerosis (Tan dan Rahardja, 2010).
2.3 Senyawa Fenol
Senyawa fenol meliputi aneka ragam senyawa yang berasal dari
satu atau dua gugus hidroksil. Umumnya mudah larut dalam air karena sering
berikatan dengan gula sebagai glikosida dan biasanya terdapat dalam vakuola
sel (Harborne, 1987).
Senyawa fenol memiliki berbagai aktivitas biologis, antara lain sebagai
antioksidan, antimutagenik dan antikarsinogenik (Marinova, et al., 2005).
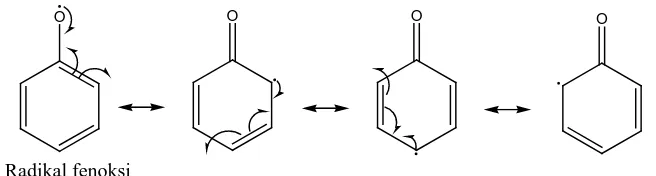
Radikal peroksi (ROO·) dan radikal hidroksi (HO·) menerima atom hidrogen
fenolik menghasilkan radikal fenoksi yang lebih stabil. Pembentukan radikal
fenoksi dapat dilihat pada Gambar 2.1.
OH
O
Gambar 2.1. Reaksi Fenol
Radikal fenoksi distabilkan oleh delokalisasi elektron yang tidak
berpasangan di sekitar cincin aromatis. Stabilitas radikal fenoksi (RO·) akan
mengurangi kecepatan perambatan (propagasi) autooksidasi reaksi berantai.
Reaksi stabilisasi radikal fenoksi dapat dilihat pada Gambar 2.2 berikut (Fehir
dan McCusker, 2009).
O O O O
Gambar 2.2. Stabilisasi Radikal Fenoksi Flavonoid oleh Resonansi
2.4 Reaksi Oksidasi-Reduksi
Oksidasi adalah pengurangan elektron dan reduksi adalah penambahan
elektron. Sedangkan pada kimia organik, oksidasi adalah pengurangan
hidrogen, penambahan oksigen atau penambahan halogen. Oleh karena itu,
oksidasi dapat didefinisikan sebagai reaksi yang menambah elemen yang lebih
elektronegatif daripada karbon. Reduksi adalah penambahan hidrogen,
pengurangan oksigen atau pengurangan halogen (Sarker dan Nahar, 2007).
Agen pengoksidasi adalah senyawa yang mencari elektron, dan
merupakan spesies yang kekurangan elektron. Oleh karena itu, agen
pengoksidasi termasuk elektrofil. Dalam proses penambahan elektron, agen
pengoksidasi tereduksi. Hasil dari oksidasi adalah peningkatan jumlah ikatan
C–O atau pengurangan jumlah ikatan C–H (Sarker dan Nahar, 2007).
Sedangkan, agen pereduksi adalah senyawa yang memberikan elektron,
dan merupakan spesies yang kaya akan elektron. Oleh karena itu, agen
pereduksi termasuk nukleofil. Dalam proses pemberian elektron, agen
pereduksi teroksidasi. Hasil dari reduksi adalah penambahan jumlah ikatan C–
H atau pengurangan jumlah ikatan C–O (Sarker dan Nahar, 2007).
2.5 Reaksi Ag Ammoniakal
Pereduksi akan mereduksi Ag+ menjadi Ag sehingga terbentuk cermin
perak pada bagian dalam tabung reaksi. Reaksi yang terjadi adalah (Vogel,
1974):
2 AgNO3 + 2 NaOH → Ag2O ↓ + 2 NaNO3 + H2O
O O
Bila pereduksi direaksikan dengan larutan Fehling, kompleks cupri
tartrat, Cu2+ direduksi menjadi Cu+ yang tidak kompleks dan mengendap pada
larutan basa yang panas sebagai Cu2O yang berwarna merah (Joseph, 1957).
Larutan Fehling dapat ditunjukkan sebagai ekivalen terhadap larutan CuO dan
reaksinya dapat ditulis sebagai berikut (Kamm, 1923):
O O
Metode fosfomolibdenum merupakan metode spektrofotometri untuk
menentukan kapasitas antioksidan secara kuantitatif. Metode ini berdasarkan
reduksi dari Mo(VI) menjadi Mo(V) oleh analit sampel dan pembentukan
kompleks fosfat/Mo(V) yang berwarna hijau. Metode ini telah dioptimasi dan
dikarakterisasi terhadap interval linearitas, keterulangan dan koefisien absorpsi
molar untuk kuantitasi dari beberapa antioksidan. Metode fosfomolibdenum
merupakan alternatif untuk metode-metode evaluasi kapasitas antioksidan
lainnya yang telah ada karena metode ini mudah dan pereaksinya murah
(Prieto, et al., 1999).
+ Ag(NH3)2OH → + 2 Ag ↓ + 3 NH3 ↑ + H2O
2.8 Vitamin C
Vitamin C adalah vitamin larut dalam air selain vitamin B kompleks.
Selain menjalankan fungsinya sebagai nutrisi bagi tubuh, vitamin C juga
merupakan antioksidan sekunder sekaligus sebagai antioksidan tersier (Lingga,
2012)
Vitamin C merupakan donor elektron yang menyumbang elektron ke
dalam reaksi biokimia intra dan ekstra seluler. Keberadaannya mampu
mereduksi oksigen reaktif dalam sel monosit, netrofil, lensa dan retina mata.
Vitamin C sanggup mereduksi radikal superoksida, peroksida, hidroksil, asam
klorida, dan oksigen reaktif dari netrofil dan monosit yang teraktivasi (Lingga,
2012).
2.9 Spektrofotometri
Spektrofotometri adalah pengukuran absorbsi energi cahaya oleh suatu
atom atau molekul pada panjang gelombang tertentu. Daerah spektrum
ultraviolet biasanya dianggap berkisar dari 200 hingga 400 nm dan daerah sinar
tampak dari 400 hingga 800 nm (Settle, 1997).
Menurut Gandjar dan Rohman (2007), ada beberapa hal yang harus
diperhatikan dalam analisis dengan spektrofotometri ultraviolet dan sinar
tampak yaitu:
1. Pembentukan molekul yang dapat menyerap sinar UV-Vis
Cara yang digunakan adalah dengan merubahnya menjadi senyawa lain
atau direaksikan dengan pereaksi tertentu sehingga dapat menyerap sinar
2. Waktu kerja (operating time)
Tujuannya ialah untuk mengetahui waktu pengukuran yang stabil. Waktu
kerja ditentukan dengan mengukur hubungan antara waktu pengukuran
dengan absorbansi larutan.
3. Pemilihan panjang gelombang
Panjang gelombang yang digunakan untuk analisis kuantitatif adalah
panjang gelombang yang mempunyai absorbansi maksimal.
4. Pembuatan kurva kalibrasi
Dilakukan dengan membuat seri larutan baku dalam berbagai konsentrasi
kemudian absorbansi tiap konsentrasi diukur lalu dibuat kurva yang
merupakan hubungan antara absorbansi dengan konsentrasi.
5. Pembacaan absorbansi sampel
Absorbansi yang terbaca pada spektrofotometer hendaknya antara 0,2
sampai 0,6.
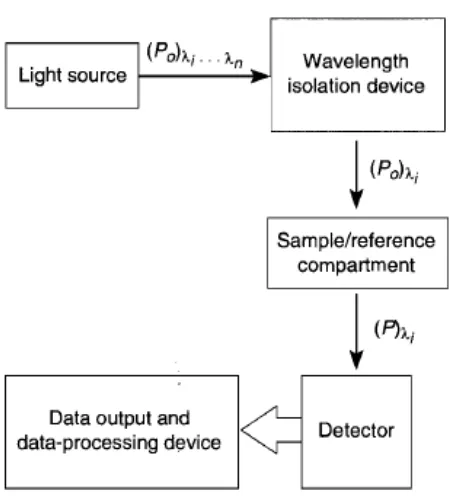
Menurut Settle (1997), komponen yang penting dari instrumen
spektrofotometer ultraviolet atau sinar tampak dapat dilihat pada Gambar 2.3 di
Gambar 2.3. Diagram Blok dari Instrumen Spektrofotometer UV/Vis Menurut Settle (1997), komponen instrumentasi dari spektrofotometer
yaitu:
a. Sumber cahaya
Sumber cahaya yang ideal menghasilkan energi dengan intensitas yang
tinggi yang stabil secara terus-menerus pada rentang spektra yang
diinginkan. Lampu tungsten incandescent dengan penutup kaca
menghasilkan panjang gelombang dengan rentang 320 hingga 2500 nm.
Oleh karena itu, lampu ini digunakan pada rentang sinar tampak. Lampu
hidrogen atau deutrium merupakan lampu yang menghasilkan sinar pada
rentang 180 hingga 370 nm. Lampu deutrium ini merupakan sumber
b. Alat pengisolasi panjang gelombang (monokromator)
Guna dari alat ini adalah untuk memisahkan panjang gelombang dari
cahaya yang berasal dari sumber cahaya dan mengisolasi panjang
gelombang tertentu
yang diinginkan.
c. Kompartemen sampel
Kompartemen sampel harus tahan terhadap cahaya dan menyediakan alat
penahan sel yang bagus di mana kedua sisi sel terletak pada sudut yang
tepat pada sinar yang masuk dan sinar yang keluar.
d. Detektor
Sinar yang diteruskan diterima oleh elemen dioda dari detektor, dipindai
dalam beberapa milidetik dan pemroses data digital menghasilkan
spektrum.
e. Data output dan data-processing device
Alat pengeluar sinyal dapat berfungsi sebagai meter absorbansi analog
atau meter transmitansi di mana data dibaca, direkam dan diproses oleh
operator. Beberapa sistem menggunakan sirkuit logis yang menyediakan
pembacaan digital untuk transmitansi, absorbansi atau konsentrasi.
2.10 Validasi Metode Analisis
Validasi metode merupakan proses dokumentasi atau pembuktian bahwa
metode analisis menyediakan data analisis yang dapat diterima untuk
Menurut Christian (2004), secara umum validasi metode meliputi:
- Selektivitas
Selektivitas adalah kemampuan suatu metode untuk dapat mengukur analit
yang diinginkan dalam matriks sampel yang dianalisa tanpa gangguan dari
matriks (termasuk analit lainnya). Efek dari matriks bisa positif maupun
negatif.
- Linearitas
Studi linearitas memverifikasi bahwa respon linear secara proporsional
terhadap konsentrasi analit dalam rentang konsentrasi dari larutan sampel.
Studi ini harus dilakukan menggunakan larutan standar pada lima
konsentrasi yang berbeda, dalam rentang dari 50% hingga 150% dari
konsentrasi analit sasaran. Masing-masing standar harus diukur paling
sedikit tiga kali.
- Akurasi
Akurasi adalah derajat persetujuan antara nilai yang terukur dengan nilai
yang sebenarnya. Nilai absolut sebenarnya jarang diketahui. Definisi yang
lebih realistis dari akurasi adalah persetujuan antara nilai yang terukur
dengan nilai sebenarnya yang dapat diterima. Akurasi dari metode analisis
dapat ditentukan dengan tiga cara, yaitu:
a. Studi perolehan kembali
b. Perbandingan hasil menggunakan metode lain yang akurat
- Presisi
Presisi didefinisikan sebagai derajat persetujuan antara replikasi
pengukuran dari jumlah yang sama. Yaitu keterulangan dari hasil. Presisi
dapat diekspresikan sebagai standar deviasi, koefisien variasi, rentang data
atau sebagai interval kepercayaan (mis. 95%) dari nilai rata-rata. Presisi
yang baik tidak menjamin akurasi yang baik
- Sensitivitas
Sensitivitas merupakan kemampuan untuk membedakan dua konsentrasi
yang berbeda dan ditentukan dengan kemiringan dari kurva kalibrasi.
- Rentang (Range)
Rentang kerja dari metode analisis adalah rentang konsentrasi di mana
akurasi dan presisi yang dapat diterima tercapai.
- Batas Deteksi
Batas deteksi merupakan tingkat konsentrasi terendah yang dapat
dikatakan secara statistik berbeda dari blanko.
- Batas Kuantitasi
Batas kuantitasi merupakan konsentrasi terendah yang dapat diukur di
dalam matriks sampel pada tingkat presisi dan akurasi yang dapat diterima.
- Ruggedness atau robustness
Ruggedness merupakan presisi dari suatu laboratorium pada beberapa hari,
yang meliputi beberapa analis, beberapa instrumen, sumber-sumber
pereaksi yang berbeda, kolom kromatografi yang berbeda, dan sebagainya.
dalam parameter, misalnya ukuran sampel, suhu, pH larutan, konsentrasi
BAB III
METODE PENELITIAN
3.1Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Kimia Farmasi Kualitatif Fakultas
Farmasi Universitas Sumatera Utara dan Laboratorium Kimia Farmasi
Kuantitatif Fakultas Farmasi Universitas Sumatera Utara, dimulai dari Januari
2013 hingga Maret 2013.
3.2Bahan-bahan 3.2.1 Sampel
Sampel yang digunakan adalah herba seledri daun (Apium graveolens L.
var. secalinum alef) dan sediaan jamu herba seledri yang beredar di pasaran
(Gambar dapat dilihat pada Lampiran 20, halaman 66 dan Lampiran 21,
halaman 67).
3.2.2 Pereaksi
Semua bahan yang digunakan dalam penelitian ini berkualitas pro analis
keluaran E. Merck yaitu tembaga (II) sulfat, asam sulfat 96%-97%, natrium
hidroksida, kalium natrium tartrat, perak nitrat, ammonium hidroksida, natrium
fosfat, ammonium molibdat kecuali aquadest (CV. Rudang Jaya) dan vitamin C
(CSPC Weisheng Pharmaceutical CO., Ltd.)
3.3Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah Spektrofotometer
UV-Visible (Shimadzu Mini 1240), alat-alat gelas, blender (Kris), neraca
3.4Pembuatan Pereaksi
3.4.1 Pereaksi Ag Ammoniakal
Larutkan 3 g AgNO3 dengan 30 ml aquadest (larutan A) dan 3 g NaOH
dengan 30 ml aquadest (larutan B). Kemudian campurkan larutan A dan larutan
B dengan perbandingan volume yang sama ke dalam tabung reaksi yang bersih,
dan tambahkan larutan ammonia yang telah diencerkan setetes demi setetes
hingga perak oksida larut (Vogel, 1974).
3.4.2 Pereaksi Fehling
Larutan A. Larutkan 34,64 g kristal CuSO4 dengan aquadest yang
mengandung beberapa tetes asam sulfat, dan encerkan larutan hingga 500 ml
(Vogel, 1974).
Larutan B. Larutkan 60 g NaOH murni dan 173 g garam Rochelle
(kalium natrium tartrat) dengan aquadest, jika perlu disaring, dan diencerkan
hingga 500 ml (Vogel, 1974).
3.4.3 Pereaksi Fosfomolibdenum
Sebanyak 494,3 mg ammonium molibdat dan 459,0 mg natrium fosfat
dimasukkan ke dalam labu ukur 100 ml, dilarutkan dengan aquadest,
ditambahkan 3,26 ml asam sulfat pekat, dicukupkan dengan aquadest hingga
garis tanda (Prieto, et al., 1999).
3.5Prosedur Penelitian 3.5.1 Pengambilan Sampel
Sampel yang digunakan adalah herba seledri daun (Apium graveolens L.
Sikambing, Medan, Sumatera Utara dan sediaan jamu herba seledri (Apium
graveolens L.) dari pusat perbelanjaan Hypermart, Sun Plaza, Medan,
Sumatera Utara.
3.5.2 Identifikasi Sampel
Identifikasi tumbuhan dilakukan di Herbarium Medanese, Bidang
Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas
Sumatera Utara, Medan.
3.5.3 Prosedur Maserasi Herba Seledri
Seledri dibersihkan, dipotong-potong dan dihaluskan menggunakan
blender. Seledri yang telah dihaluskan, dimasukkan ke dalam wadah kaca
berwarna gelap, kemudian dimaserasi dengan 1 liter aquadest. Ditutup dan
dibiarkan selama 5 hari terlindung dari cahaya, dengan disimpan di dalam
lemari gelap, sambil diaduk 6 jam sekali, diambil bagian yang jernih.
3.5.4 Identifikasi Sifat Antioksidan Berdasarkan Daya Reduksi 3.5.4.1Reaksi Ag Ammoniakal
Tambahkan beberapa tetes dari larutan sampel ke dalam 2-3 ml larutan
Ag ammoniakal (yang mengandung ion [Ag(NH3)2]+ di dalam tabung reaksi
yang bersih (Vogel, 1974).
3.5.4.2Reaksi Fehling
Dimasukkan 4 ml larutan Fehling yang baru dibuat (dengan
mencampurkan larutan Fehling A (larutan CuSO4) dan larutan B (larutan
alkalin tartrat) dalam jumlah yang sama) ke dalam tabung reaksi. Tambahkan
3.5.5 Pengukuran Kapasitas Antioksidan
3.5.5.1Pembuatan Larutan Induk Baku Vitamin C
Ditimbang vitamin C sebanyak 100 mg kemudian dimasukkan ke dalam
labu tentukur 100 ml, dan dilarutkan dengan aquadest sampai garis tanda.
Diperoleh konsentrasi vitamin C pada Larutan Induk Baku (LIB) I adalah 1000
µg/ml.
3.5.5.2Penentuan Panjang Gelombang Maksimum
Dari LIB I (1000 µg/ml) dipipet 7 ml, dimasukkan ke dalam labu
tentukur 50 ml dan diencerkan dengan aquadest sampai garis tanda
(konsentrasi 140 µg/ml). Kemudian dipipet 0,5 ml, dimasukkan ke dalam
tabung reaksi ditambahkan 5 ml larutan pereaksi fosfomolibdenum. Diperoleh
konsentrasi vitamin C pada larutan ini adalah 12,7273 µg/ml. Kemudian
diinkubasi selama 60 menit pada suhu 90ºC dan didinginkan pada suhu kamar
kemudian diukur absorbansinya pada panjang gelombang 400-800 nm.
3.5.5.3Penentuan Waktu Kerja
Dari LIB I (1000 µg/ml) dipipet 7 ml, dimasukkan ke dalam labu
tentukur 50 ml dan diencerkan dengan aquadest sampai garis tanda
(konsentrasi 140 µg/ml). Kemudian dipipet 0,5 ml, dimasukkan ke dalam
tabung reaksi ditambahkan 5 ml larutan pereaksi. Diperoleh konsentrasi
vitamin C pada larutan ini adalah 12,7273 µg/ml. Kemudian diinkubasi selama
60 menit pada suhu 90ºC dan didinginkan pada suhu kamar kemudian diukur
penentuan panjang gelombang maksimum mulai menit ke-21 setelah sampel
diinkubasi hingga menit ke-50 dengan interval waktu 1 menit.
3.5.5.4Pengukuran Kurva Kalibrasi Vitamin C
Dari LIB I dipipet 4 ml, 5 ml, 6 ml, 7 ml dan 8 ml, masing-masing
dimasukkan ke dalam labu ukur 50 ml, diencerkan dengan aquadest hingga
garis tanda sehingga konsentrasi vitamin C yang diperoleh adalah 80 µg/ml,
100 µg/ml, 120 µg/ml, 140 µg/ml dan 160 µg/ml. Kemudian dipipet
masing-masing 0,5 ml, dimasukkan ke dalam tabung reaksi dan ditambahkan 5 ml
pereaksi. Konsentrasi vitamin C yang diperoleh adalah 7,2727 µg/ml, 9,0909
µg/ml, 10,9091 µg/ml, 12,7273 µg/ml dan 14,5454 µg/ml. Contoh perhitungan
konsentrasi larutan standar dapat dilihat pada Lampiran 3, halaman 43.
Kemudian diinkubasi pada suhu 90ºC selama 60 menit dan didinginkan pada
suhu kamar kemudian diukur absorbansinya pada panjang gelombang
maksimum yang didapat pada penentuan panjang gelombang maksimum dalam
waktu kerja yang diperoleh.
3.5.5.5Uji Kapasitas Antioksidan dari Hasil Maserasi Herba Seledri
Dipipet 20 ml hasil maserasi herba seledri, dimasukkan ke dalam labu
ukur 50 ml, dicukupkan dengan aquadest hingga garis tanda. Dipipet 0,5 ml,
dimasukkan ke dalam tabung reaksi dan ditambahkan 5 ml pereaksi, diinkubasi
pada suhu 90ºC selama 60 menit dan didinginkan pada suhu kamar kemudian
diukur absorbansinya pada panjang gelombang maksimum yang didapat pada
3.5.5.6Uji Kapasitas Antioksidan dari Sediaan Jamu Herba Seledri yang Beredar di Pasaran
Sebanyak 20 kapsul herba seledri ditimbang isinya dan digerus.
Kemudian ditimbang serbuk setara 550 mg ekstrak herba seledri dan
dimasukkan ke dalam labu ukur 100 ml, dicukupkan dengan aquadest hingga
garis tanda. Dipipet 6 ml, dimasukkan ke dalam labu ukur 10 ml, dicukupkan
dengan aquadest hingga garis tanda. Kemudian dipipet 0,5 ml, dimasukkan ke
dalam tabung reaksi dan ditambahkan 5 ml pereaksi, diinkubasi pada suhu
90ºC selama 60 menit dan didinginkan pada suhu kamar kemudian diukur
absorbansinya pada panjang gelombang maksimum yang didapat pada
penentuan panjang gelombang maksimum dalam waktu kerja yang diperoleh.
3.6Penentuan Batas Deteksi dan Batas Kuantitasi
Batas deteksi atau Limit of Detection (LOD) merupakan jumlah terkecil
analit dalam sampel yang dapat dideteksi yang masih memberikan respon
signifikan. Sedangkan batas kuantitasi atau Limit of Quantitation (LOQ)
merupakan kuantitas terkecil analit dalam sampel yang masih dapat memenuhi
kriteria cermat dan seksama.
Menurut Harmita (2004), batas deteksi dan batas kuantitasi dapat
dihitung dengan rumus sebagai berikut:
Simpangan Baku = �Σ(Y �- Yi)
2
n - 2
LOQ = 10 × SB slope
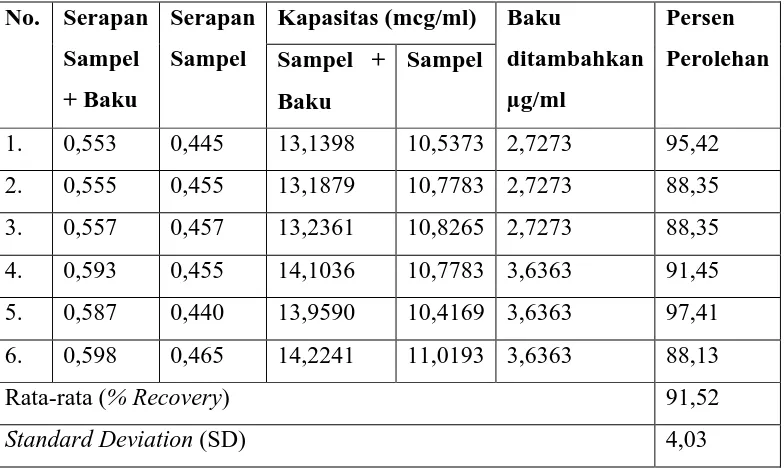
3.7Uji Akurasi dengan Persen Perolehan Kembali (% Recovery)
Uji perolehan kembali atau recovery dilakukan dengan metode adisi
dengan cara menambahkan sejumlah larutan standar vitamin C dengan
konsentrasi tertentu pada sampel yang diperiksa, lalu dianalisis. Persen
perolehan kembali ditentukan dengan menentukan berapa persen analit yang
ditambahkan tadi dapat ditemukan. (Harmita, 2004). Masing-masing dilakukan
sebanyak 6 kali replikasi kemudian dianalisis dengan perlakuan yang sama
seperti pada penetapan kapasitas sampel.
Menurut Harmita (2004), Persen perolehan kembali (% recovery) dapat
dihitung dengan rumus dibawah ini:
% Recovery= CF- CA
CA* ×100%
Keterangan:
CF = Kapasitas antioksidan dalam sampel setelah penambahan baku
CA = Kapasitas antioksidan dalam sampel sebelum penambahan baku
CF* = Kapasitas antioksidan baku vitamin C yang ditambahkan
3.8Analisis Data Secara Statistik 3.8.1 Penolakan Hasil Pengamatan
Kapasitas antioksidan yang diperoleh dari hasil pengukuran
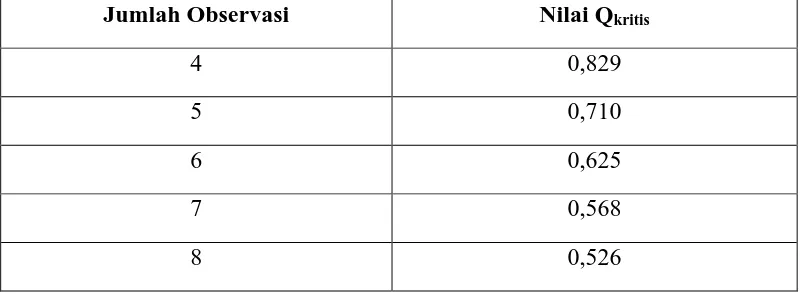
masing-masing 6 larutan sampel, diuji secara statistik dengan uji Q.
Hasil pengujian atau nilai Q yang diperoleh ditinjau terhadap daftar harga
Q pada Tabel 3.1, apabila Q>Qkritis maka data tersebut ditolak (Gandjar dan
Rohman, 2007)
Tabel 3.1. Nilai Qkritis pada Taraf Kepercayaan 95%
Jumlah Observasi Nilai Qkritis
4 0,829
Menurut Sudjana (2005), untuk menentukan kapasitas antioksidan di dalam sampel dengan interval kepercayaan 95%, α = 0.05, dk = n-1, dapat
digunakan rumus:
μ = X� ± t1/2α s
√n
Keterangan : µ = interval kepercayaan X = kapasitas rata-rata sampel
t = harga t tabel sesuai dengan dk = n-1 α = tingkat kepercayaan
s = standar deviasi
n = jumlah perlakuan
3.8.2 Simpangan Baku Relatif
Keseksamaan atau presisi diukur sebagai simpangan baku relatif atau
koefisien variasi. Keseksamaan atau presisi merupakan ukuran yang
dilakukan secara berulang untuk sampel yang homogen. Nilai simpangan baku
relatif yang memenuhi persyaratan menunjukkan adanya keseksamaan metode
yang dilakukan (Harmita, 2004).
Menurut Harmita (2004), rumus untuk menghitung simpangan baku
relatif adalah sebagai berikut:
RSD= SD
x� ×100%
Keterangan:
x� = Kapasitas rata-rata sampel SD = Standar deviasi
BAB IV
HASIL DAN PEMBAHASAN
4.1Hasil Identifikasi Sifat Antioksidan
Hasil dari identifikasi antioksidan berdasarkan daya reduksi secara dari
hasil maserasi herba seledri dapat dilihat pada Tabel 4.1 berikut.
Tabel 4.1. Hasil Identifikasi Antioksidan Berdasarkan Daya Reduksi dari Hasil Maserasi Herba Seledri
Reaksi Ag Ammoniakal Reaksi Fehling Hasil Pengamatan (+) Cermin perak (+) Endapan merah bata
Dari hasil pengamatan, diketahui bahwa herba seledri memiliki
antioksidan, karena memiliki daya reduksi terhadap pereaksi Ag ammoniakal
dan pereaksi Fehling. Hasil pengamatan dapat dilihat pada Lampiran 8,
halaman 50.
4.2Kapasitas Antioksidan
Pada penelitian ini telah dilakukan analisis untuk mengetahui kapasitas
antioksidan di dalam hasil maserasi herba seledri dan sediaan jamu herba
seledri yang beredar di pasaran. Analisis dilakukan dengan menggunakan
instrumen spektrofotometer sinar tampak.
4.2.1 Panjang Gelombang Maksimum
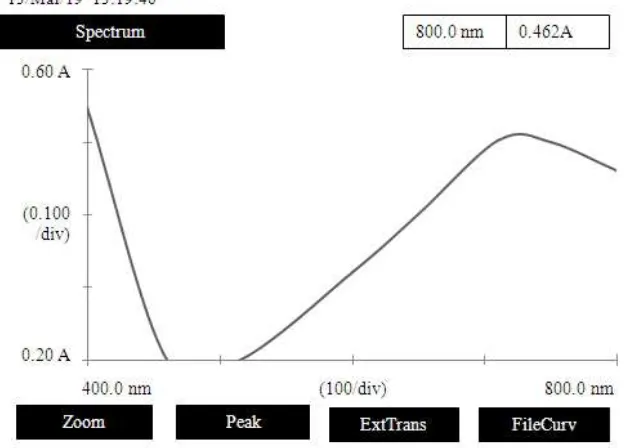
Panjang gelombang maksimum ditentukan menggunakan
spektrofotometer sinar tampak dilakukan terhadap larutan standar vitamin C
dengan konsentrasi 12,7273 µg/ml pada rentang panjang gelombang 400-800
Kurva panjang gelombang maksimum vitamin C dengan konsentrasi
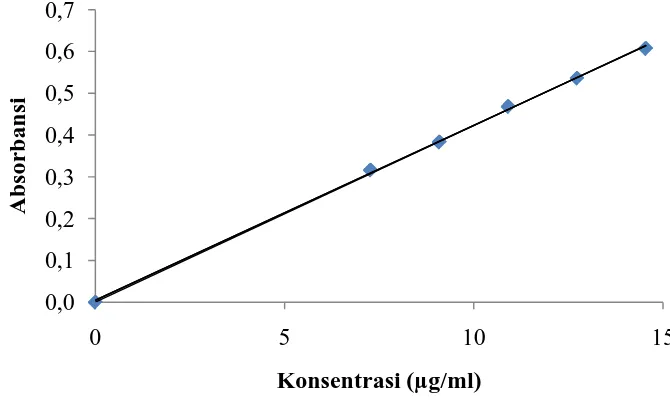
12,7273 µg/ml dapat dilihat pada Gambar 1 berikut ini.
Gambar 4.1. Kurva Panjang Gelombang Maksimum Vitamin C dengan Konsentrasi 12,7273 µg/ml
Dari Gambar 4.1 dapat dilihat bahwa panjang gelombang maksimum dari
kompleks Mo(V) yang berwarna hijau adalah pada 711,0 nm. Hal ini sesuai
dengan literatur di mana warna hijau memberikan panjang gelombang
maksimum pada rentang 680-780 nm (Harris, 2007).
4.2.2 Waktu Kerja
Waktu kerja yang didapat dengan mengukur larutan vitamin C dengan
konsentrasi 12,7273 µg/ml pada panjang gelombang 711 nm dengan selang
waktu satu menit selama 30 menit adalah pada menit ke-44 hingga menit ke-48
kompleks Mo (V) stabil selama 5 menit. Kurva waktu kerja dapat dilihat pada
Gambar 4.2 berikut ini.
Gambar 4.2. Kurva Waktu Kerja 4.2.3 Kurva Kalibrasi Vitamin C
Kurva kalibrasi vitamin C ditetapkan dengan membuat deret standar
sebanyak 6 konsentrasi pada rentang 0,0000 µg/ml sampai dengan 14,5454
µg/ml pada panjang gelombang 711 nm.
Kurva kalibrasi vitamin C yang didapat dapat dilihat pada Gambar 4.3
berikut ini.
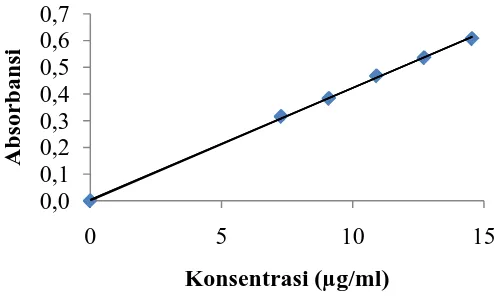
Dari kurva kalibrasi ini didapat persamaan regresinya adalah y = 0,0415x
+ 0,0077 dengan koefisien korelasi (r) sebesar 0,9996. Menurut Adeeyinwo,
dkk. (2013), nilai ini memenuhi syarat yang ditetapkan yaitu 0,997. Nilai
koefisien korelasi yang tinggi menunjukkan hubungan yang linear antara sinyal
detector yang terukur dengan jumlah antioksidan dalam sampel. Data kalibrasi
dan perhitungan persamaan garis regresi dapat dilihat pada Lampiran 4,
halaman 44 dan Lampiran 6, halaman 47.
4.2.4 Hasil Uji Kapasitas Antioksidan dari Hasil Maserasi Herba Seledri Uji kapasitas antioksidan dilakukan secara spektrofotometri sinar tampak
dimana sampel terlebih dahulu dikeringkan, dihaluskan, dimaserasi,
diencerkan, ditambahkan pereaksi, diinkubasi dan diukur serapannya.
Kapasitas antioksidan dari hasil maserasi herba seledri ditentukan berdasarkan
persamaan regresi kurva kalibrasi vitamin C. Data dan contoh perhitungan
dapat dilihat pada Lampiran 9, halaman 51 dan Lampiran 10, halaman 52.
Hasil uji kapasitas antioksidan dari hasil maserasi herba seledri dapat
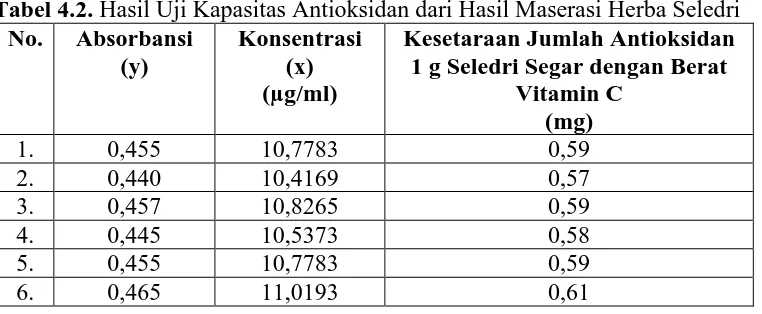
dilihat pada Tabel 4.2 berikut.
Tabel 4.2. Hasil Uji Kapasitas Antioksidan dari Hasil Maserasi Herba Seledri No. Absorbansi 1 g Seledri Segar dengan Berat
Dari hasil perhitungan uji t, didapat bahwa dalam 1 g herba seledri segar
ekivalen dengan kapasitas antioksidan vitamin C seberat (0,59 ± 0,0847) mg.
Berdasarkan hasil penelitian Jung, et al. (2011), kapasitas antioksidan dari 1 g
ekstrak air daun seledri secara metode fosfomolibdenum ekivalen dengan
kapasitas antioksidan α-tokoferol seberat (47,50 ± 2,33) mg. Dapat dilihat
adanya perbedaan hasil, hal ini dikarenakan sampel yang digunakan oleh Jung,
et al. merupakan ekstrak herba seledri, dan pembanding yang digunakan
berbeda.
4.2.5 Hasil Uji Kapasitas Antioksidan dari Sediaan Jamu Herba Seledri yang Beredar di Pasaran
Uji kapasitas antioksidan dilakukan secara spektrofotometri sinar tampak
dimana sampel ditimbang, diencerkan, ditambahkan pereaksi, diinkubasi dan
diukur serapannya. Kapasitas antioksidan dari sediaan jamu herba seledri
ditentukan berdasarkan persamaan regresi kurva kalibrasi vitamin C. Data dan
contoh perhitungan dapat dilihat pada Lampiran 11, halaman 53 dan Lampiran
12, halaman 54.
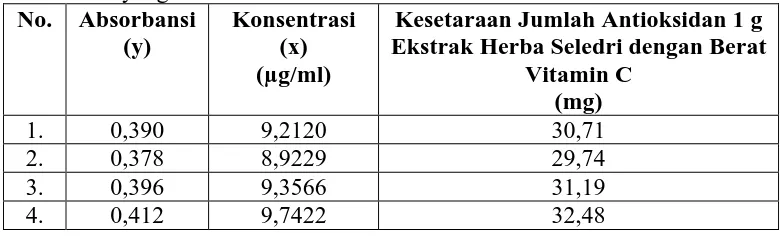
Hasil uji kapasitas antioksidan dari sediaan jamu herba seledri yang
beredar di pasaran dapat dilihat pada Tabel 4.3 berikut.
Tabel 4.3. Hasil Uji Kapasitas Antioksidan dari Sediaan Jamu Herba Seledri yang Beredar di Pasaran
No. Absorbansi (y)
Konsentrasi (x) (µg/ml)
Kesetaraan Jumlah Antioksidan 1 g Ekstrak Herba Seledri dengan Berat
5. 0,389 9,1880 30,63
6. 0,402 9,5012 31,66
Dari hasil perhitungan uji t, didapat bahwa dalam 1 gram ekstrak herba
seledri dalam sediaan jamu herba seledri ekivalen dengan kapasitas antioksidan
vitamin C seberat (31,07 ± 5,8049) mg vitamin C.
4.2.6 Pembahasan Kapasitas Antioksidan dari Hasil Maserasi Herba Seledri dengan Sediaan Jamu Herba Seledri yang Beredar di Pasaran
Kapasitas antioksidan dari hasil maserasi herba seledri dengan sediaan
jamu herba seledri yang beredar di pasaran yang diperoleh dapat dilihat pada
Tabel 4.4 berikut.
Tabel 4.4. Hasil Kapasitas Antioksidan Sampel Kesetaraan Jumlah
Antioksidan Hasil Maserasi 1 g Seledri Segar
dengan Berat Vitamin C (mg)
Kesetaraan Jumlah Antioksidan 1 g Ekstrak Herba Seledri dalam Sediaan
Jamu Herba Seledridengan Berat Vitamin C
(mg) Kapasitas
Antioksidan 0,59 ±0,0847 31,07 ± 5,8049
Berdasarkan Tabel 4.5 dapat dilihat bahwa terdapat adanya perbedaan
kapasitas antioksidan, sediaan jamu herba seledri menunjukkan kapasitas
antioksidan yang lebih besar dibandingkan hasil maserasi herba seledri. Hal ini
dikarenakan sediaan jamu herba seledri adalah ekstrak kering herba seledri
yang berbeda dengan sampel herba seledri yang digunakan dalam penelitian
ini, dan tidak diketahui pelarut yang digunakan dalam proses ekstraksi sediaan
4.3Batas Deteksi dan Batas Kuantitasi
Dari persamaan garis regresi vitamin C yaitu y = 0,0415x + 0,0077, dapat
dicari batas deteksi maupun batas kuantitasinya. Di mana batas deteksi
merupakan konsentrasi analit terendah yang mampu menghasilkan signal
cukup besar sehingga mampu terdeteksi dan dapat dibedakan dengan signal
blanko dengan tingkat kepercayaan 99%. Batas kuantitasi merupakan
konsentrasi analit yang menghasilkan signal lebih besar dari blanko atau
jumlah terkecil analit dalam sampel yang masih memenuhi kriteria cermat dan
seksama dan dapat dikuantitasi dengan akurasi dan presisi yang baik.
Dari hasil perhitungan secara statistik menggunakan persamaan regresi,
maka diperoleh nilai LOD adalah 0,4168 µg/ml instrumen tidak dapat
membedakan sinyal antara blanko dan antioksidan pada konsentrasi di bawah
ini dan nilai LOQ adalah 1,3894 μg/ml. Konsentrasi analit yang terukur di
bawah nilai ini memberikan ketelitian dan ketepatan yang tidak baik.
Perhitungan limit deteksi dan limit kuantitasi tertera pada Lampiran 17,
halaman 63.
4.4Persen Perolehan Kembali (% Recovery)
Uji perolehan kembali dilakukan dengan penambahan sejumlah
konsentrasi tertentu standar vitamin C yang telah diketahui ke dalam sampel
dan memperlakukannya sama seperti uji sampel tersebut. Uji ini dapat
menunjukkan adanya galat sistematik yang dapat mempengaruhi metode
analisis. Galat sistematik dapat menyebabkan hasil analisis menjadi lebih besar
adalah galat pada saat pengambilan sampel, kurva kalibrasi yang tidak linear,
serta galat yang disebabkan oleh instrumen dan peralatan kaca yang digunakan
(Harvey, 2000).
Dengan adanya penambahan standar vitamin C pada sampel hasil
maserasi herba seledri, maka pada panjang gelombang 711 nm, terjadi
peningkatan absorbansi yang cukup signifikan. Uji perolehan kembali didapat
sebesar 91,52%
Sedangkan pada sampel sediaan jamu herba seledri didapat persen
perolehan kembali sebesar 96,82%.
Persen recovery tersebut menunjukkan kecermatan kerja yang baik pada
saat pemeriksaan kapasitas antioksidan dalam sampel. Hasil uji perolehan
kembali (recovery) ini memenuhi syarat akurasi yang telah ditetapkan rata-rata
hasil perolehan kembali (recovery) berada pada rentang 80-120% (Ermer dan
Miller, 2005). Perhitungan perolehan kembali ditunjukkan pada Lampiran 15,
halaman 59 dan Lampiran 16, halaman 60.
4.5Simpangan Baku Relatif
Dari perhitungan yang dilakukan terhadap data hasil uji kapasitas
antioksidan pada hasil maserasi herba seledri dan sediaan jamu herba seledri
yang beredar di pasaran, diperoleh nilai simpangan baku relatif (RSD) sebesar
4,41% untuk hasil maserasi herba seledri dan 6,62% untuk sediaan jamu herba
seledri yang beredar di pasaran. Perhitungan dapat dilihat pada Lampiran 18,
halaman 65 dan Lampiran 19, halaman 65. Menurut Harmita (2004), nilai
(ppm) adalah tidak lebih dari 16% dan untuk analit dengan kadar part per
billion (ppb) RSDnya tidak lebih dari 32%. Dari hasil yang diperoleh
BAB V
KESIMPULAN DAN SARAN
4.1Kesimpulan
Berdasarkan penelitian yang dilakukan, maka dapat diambil kesimpulan:
- Herba seledri mempunyai sifat antioksidan, berdasarkan daya reduksinya
secara reaksi kimia dengan reaksi Ag ammoniakal dan reaksi Fehling.
- Penentuan kapasitas antioksidan dari herba seledri secara metode
fosfomolibdenum dapat dilakukan.
- Terdapat adanya perbedaan kapasitas antioksidan dari 1 gram sampel,
yaitu Hasil maserasi 1 g herba seledri segar ekivalen dengan kapasitas
antioksidan vitamin C seberat (0,59 ± 0,0847) mg, dan 1 g ekstrak herba
seledri dari sediaan jamu herba seledri ekivalen dengan kapasitas
antioksidan vitamin C seberat (31,07 ± 5,8049) mg.
4.2Saran
- Dilakukan uji kapasitas antioksidan herba seledri menggunakan pelarut
organik.
- Dilakukan uji kapasitas antioksidan herba seledri menggunakan seledri
dari varietas lain.
- Dilakukan perbandingan kapasitas antioksidan herba seledri menggunakan
DAFTAR PUSTAKA
Adeeyinwo, C.E., Okorie, N.N., dan Idowu, G.O. (2013). Basic Calibration of UV/Visible Spectrophotometer. International Journal of Science and Technology. 2(3): 247-251.
Alali, F.Q., Tawaha, K., El-Elimat, T., Syouf, M., El-Fayad, M., Abulaila, K., Nielsen, S.J., Wheaton, W.D., Falkinham, J.O., dan Oberlies, N.H. (2007). Antioxidant Activity and Total Phenolic Content of Aqueous and Methanolic Extracts of Jordanian Plant: an ICBG Project. Natural Product Research. (21): 1121-1131.
Apak, R., Guclu, K., Demirata, B., Ozyurek, M., Celik, S.E., Bektasoglu, B., Berker, K.I., dan Ozyurt, D. (2007). Comparative Evaluation of Various Total Antioxidant Capacity Assay Applied to Phenolic Compounds with the CUPRAC Assay. Molecules. (12): 1496-1547. Badan Pengawas Obat dan Makanan RI. (2010). Acuan Sediaan Herbal.
Volume V. Edisi I. Jakarta: Direktorat OAI. Halaman 38.
Caballero, B. (2003). Encyclopedia of Food Sciences and Nutrition. USA: Academic Press. Halaman 261.
Christian, G.D. (2004). Analytical Chemistry. Edisi VI. New Jersey: John Wiley & Sons, Inc. Halaman 65-66, 99, 128-132.
Ermer, J. dan Miller, J.H.M. (2005). Method Validation in Pharmaceutical Analysis. Weinheim: Wiley-Vch Verlag GmbH & Co. KGaA. Halaman 171.
Fehir, R.J., dan McCusker, K. (2009). Differential Polarization of Spin and Charge Density in Substituted Phenoxy Radical. Journal of Physical Chemistry. (113): 9249-9260.
Gandjar, I.G., dan Rohman, A. (2007). Kimia Farmasi Analisis. Cetakan I. Yogyakarta: Pustaka Pelajar. Halaman 298-312, 319-321.
Gupta, V.K., dan Sharma, S.K. (2006). Plants as Natural Antioxidants. Natural Product Radiance. 5(4): 326-334.
Harborne, J.B. (1987). Phytochemical Methods. Penerjemah: Padmawinata, K., dan Soediro, I. Metode Fitokimia. Bandung: Penerbit ITB. Halaman 47.
Harris, D.C. (2007). Quantitative Chemical Analysis. Edisi VII. New York: W.H. Freeman and Company. Halaman 383.
Harvey, D. (2000). Modern Analytical Chemistry. USA: McGraw-Hill Science. Halaman 711.
Herbarium Medanense. (2013). Hasil Identifikasi. Medan: Herbarium Medanense.
Joseph, N. (1957). Qualitative Testing and Inorganic Chemistry. New York: John Wiley & Sons, Inc. Halaman 435.
Jung, W.S., Chung, I.M., Kim, S.H., Kim, M.Y., Ahmad, A., dan Praveen, N. (2011). In vitro Antioxidant Activity, Total Phenolics and Flavonoids from Celery (Apium graveolens) Leaves. Journal of Medicinal Plants. 5(32): 7022-7030.
Kamm, O. (1923). Qualitative Organic Analysis. New York: John Wiley & Sons, Inc. Halaman 83.
Lingga, L. (2012). The Healing Power of Anti-oxidant. Jakarta: Penerbit PT Elex Media Komputindo. Halaman 1-2, 26-27, 69, 161-162.
Marinova, D., Ribarova, F., dan Atanassova, M. (2005). Total Phenolics and Total Flavonoids in Bulgarian Fruits and Vegetables. Journal of the University of Chemical Technology and Metallurgy. 40(3): 255-260.
Prieto, P., Pineda, M., dan Aguilar, M. (1999). Spectrophotometric Quantitation of Antioxidant Capacity through the Formation of a Phosphomolybdenum Complex: Specific Application to the Determination of Vitamin E. Analytical Biochemistry. 269: 337-341. Rohdiana, D. dan Widiantara, T. (2011). Aktivitas Polifenol Teh Sebagai
Penangkap Radikal. Seminar Nasional Pangan Fungsional. Halaman 98-107.
Sarker, S.D., dan Nahar, L. (2007). Chemistry for Pharmacy Students. General, Organic and Natural Product Chemistry. England: John Wiley & Sons Ltd. Halaman 264-265.
Settle, F.A. (1997). Handbook of Instrumental Techniques for Analytical Chemistry. New Jersey: Prentice Hall, Inc. Halaman 485, 488-492.
Shad, A.A., Shah, H.U., Bakht, J., Choudhary, M.O., dan Ullah, J. (2011). Nutraceutical Potential and bioassay of Apium graveolens L. Grown in Khyber Pakhtunkhwa-Pakistan. Journal of Medicinal Plants Research. 5(20): 5160-5166.
Sudjana. (2005). Metode Statistika. Edisi VI. Bandung: Tarsito. Halaman 93, 168, 239.
Suhartono, E., Fujiati, Aflanie, I. (2002). Oxygen Toxicity By Radiation and Effect of Glutamic Piruvat Transamine (GPT) Activity Rat Plasma after Vitamin C Treatmen. Diajukan pada International seminar on Environmental Chemistry and Toxicology. Yogyakarta.
Sunarni,T., (2005). Aktivitas Antioksidan Penangkap Radikal Bebas Beberapa Kecambah Dari Biji Tanaman Familia Papilionaceae. Jurnal Farmasi Indonesia 2 (2), 2001, 53-61.
Tan, H.T., dan Rahardja, K. (2010). Obat-obat Penting. Jakarta: Penerbit PT Elex Media Komputindo. Halaman 232-233.
Lampiran 1. Perhitungan Bahan-bahan untuk Pembuatan 100 ml Pereaksi Fosfomolibdenum
a. Ammonium Molibdat
BM = 1235,86
Molaritas yang diinginkan = 4 mM = 0,004 M
Molaritas= Berat (g) BM ×
Molaritas yang diinginkan = 28 mM = 0,028 M
Molaritas= Berat (g) BM ×
Molaritas yang diinginkan = 600 mM = 0,6 M
M1.V1=M2.V2
18,4 . V1= 0,6 M . 100 ml
V1=3,26 ml
Dimana:
M1 : Molaritas asam sulfat 98%
V1 : Volume asam sulfat 98% yang dibutuhkan
M2 : Molaritas asam sulfat yang diinginkan
Lampiran 2. Waktu Kerja
Hasil pengukuran absorbansi larutan vitamin C dengan konsentrasi
12,7273 µg/ml pada panjang gelombang 711 nm dengan selang waktu 1 menit
disajikan pada Tabel berikut ini:
No. Menit ke- Absorbansi
Waktu kerja yang diperoleh adalah dari menit 44 hingga menit
Lampiran 3. Contoh Perhitungan Konsentrasi Larutan Standar Vitamin C untuk Penentuan Kurva Kalibrasi
Konsentrasi LIB I = 1000 µg/ml
Untuk larutan standar I: dipipet 4 ml, dimasukkan ke dalam labu ukur 50 ml,
diencerkan dengan akuades hingga garis tanda. Maka didapat konsentrasi
sebagai berikut:
Konsentrasi= 4 ml × 1000 μg/ml
50 ml =80 μg/ml
Kemudian dipipet 0,5 ml, ditambahkan 5 ml pereaksi. Maka didapat
konsentrasi sebagai berikut:
Konsentrasi= 0,5 ml ×80 μg/ml (0,5+5)ml =
40 μg
5,5 ml =7,2727 μg/ml
Untuk larutan standar II: dipipet 5 ml, dimasukkan ke dalam labu ukur 50 ml,
diencerkan dengan akuades hingga garis tanda. Maka didapat konsentrasi
sebagai berikut:
Konsentrasi=5 ml × 1000 μg/ml
50 ml =100 μg/ml
Kemudian dipipet 0,5 ml, ditambahkan 5 ml pereaksi. Maka didapat
konsentrasi sebagai berikut:
Konsentrasi= 0,5 ml × 100 μg/ml (0,5+5)ml =
50 μg
5,5 ml =10,9091 μg/ml
Lampiran 4. Kurva Kalibrasi Larutan Vitamin C dengan Berbagai Konsentrasi pada Panjang Gelombang 711 nm
a. Grafik Kurva Kalibrasi Larutan Vitamin C dengan Berbagai Konsentrasi
pada Panjang Gelombang 711 nm
b. Daftar Tabel Kalibrasi Larutan Vitamin C dengan Berbagai Konsentrasi
pada Panjang Gelombang 711 nm
No. Konsentrasi (µg/ml) Absorbansi
1. 0,0000 0,000
Lampiran 5. Bagan Kerja
a. Bagan Kerja Penentuan Kadar Antioksidan Hasil Maserasi Herba Seledri
Hasil Maserasi Herba Seledri
Dipipet 20 ml
Dimasukkan ke dalam labu ukur 50 ml
Dicukupkan dengan akuades hingga garis tanda
Dipipet 0,5 ml
Dimasukkan ke dalam tabung reaksi
Ditambahkan 5 ml pereaksi
Diinkubasi pada suhu 90°C selama 60 menit
Didinginkan pada suhu kamar
Diukur absorbansinya pada panjang gelombang 711 nm dalam rentang waktu kerja yang diperoleh