ISOLASI DAN UJI ANTAGONIS BAKTERI ENDOFIT AKAR DAN DAUN KELAPA SAWIT (Elaeis guineensis Jacq.) TERHADAP
Ganoderma boninense Pat.
SKRIPSI
ASNI MARYATI SEMBIRING 040805021
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
ISOLASI DAN UJI ANTAGONIS BAKTERI ENDOFIT KELAPA SAWIT (Elaeis guineensis Jacq.) TERHADAP Ganoderma boninense Pat.
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
ASNI MARYATI SEMBIRING 040805021
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : ISOLASI DAN UJI ANTAGONIS BAKTERI
ENDOFIT AKAR DAN DAUN KELAPA SAWIT (Elaeis guineensis Jacq.) TERHADAP Ganoderma boninense Pat.
Kategori : SKRIPSI
Nama : ASNI MARYATI SEMBIRING Nomor Induk Mahasiswa : 040805021
Program Studi : SARJANA (S1) BIOLOGI Departemen : BIOLOGI
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM (FMIPA) UNIVERSITAS SUMATERA
UTARA Diluluskan di
Medan, Desember 2008 Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Drs. Kiki Nurtjahja, M. Sc. Yurnaliza, S. Si, M. Si.
NIP 132 207 808 NIP 132 240 155
Diketahui/Disetujui oleh
Departemen Biologi FMIPA USU Ketua,
PERNYATAAN
ISOLASI DAN UJI ANTAGONIS BAKTERI ENDOFIT AKAR DAN DAUN KELAPA SAWIT (Elaeis guineensis Jacq.)
TERHADAP Ganoderma boninense Pat.
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Desember 2008
PENGHARGAAN
Puji dan syukur saya ucapkan kepada Bapa di Surga, karena atas segala kasih dan karuniaNya saya dapat menyelesaikan skripsi yang berjudul “ISOLASI DAN UJI ANTAGONIS BAKTERI ENDOFIT AKAR DAN DAUN KELAPA SAWIT (Elaeis guineensis Jacq.) TERHADAP Ganoderma boninense Pat.” dalam waktu yang telah ditentukan.
Ucapan terima kasih saya sampaikan kepada Ibu Yurnaliza, S. Si, M. Si dan Bapak Drs. Kiki Nurtjahja, M. Sc, selaku Dosen Pembimbing I dan II yang telah banyak memberikan bimbingan dan arahan, serta waktu dan perhatiannya kepada saya selama menyelesaikan skripsi ini. Terima kasih juga saya ucapkan kepada Bapak Dr. Dwi Suryanto, M. Sc, selaku Dosen Penguji I sekaligus Ketua Departemen Biologi FMIPA USU dan Ibu Dra. Nunuk Priyani, M. Sc, selaku Dosen Penguji II sekaligus Sekretaris Departemen Biologi FMIPA USU, yang telah banyak memberikan saran dan masukan untuk kesempurnaan skripsi ini. Terima kasih kepada Ibu Dra. Emita Sabri, M. Si, selaku Dosen Penasehat Akademik yang telah banyak membimbing saya selama pendidikan, dan kepada seluruh Staf Dosen Pengajar Departemen Biologi FMIPA USU atas bimbingannya selama saya mengikuti perkuliahan, juga kepada Ibu Ros, Bang Erwin, Ibu Nurhasni, dan Bapak Sukirmanto selaku pegawai Departemen Biologi FMIPA USU, saya ucapkan terima kasih atas bantuannya selama ini.
Terima kasih yang sedalam-dalamnya saya ucapkan kepada bapak dan ibu tercinta, A.S. Pandia dan Juliani, atas doa, semangat, dukungan, dan perhatian, serta kasih sayang yang tak terhingga kepada saya selama menyelesaikan skripsi ini. Kepada adik-adik tersayang, Budi Andryan Saputra Sembiring, Alexander Gunawan Sembiring, dan Ronnie Jupiter Sembiring, atas doa dan perhatian, serta dukungan yang besar kepada saya selama ini.
ABSTRAK
THE ANTAGONISTIC OF ENDOPHYTIC BACTERIA ISOLATED FROM ROOTS AND LEAVES OF PALM OIL (Elaeis guineensisJacq.) AGAINTS
Ganoderma boninensePat.
ABSTRACT
DAFTAR ISI
Halaman
Persetujuan ii
Pernyataan iii
Penghargaan iv
Abstrak v
Abstract vi
Daftar Isi vii
Daftar Tabel ix
Daftar Gambar x
Daftar Lampiran xi
Bab 1 Pendahuluan 1
1.1 Latar Belakang 1
1.2 Permasalahan 2
1.3 Tujuan 3
1.4 Hipotesis 3
1.5 Manfaat 3
Bab 2 Tinjauan Pustaka 4
2.1 Mikroorganisme Endofit 4
2.2 Biodiversitas Endofit 5
2.3 Manfaat Endofit 6
2.4 Kelapa Sawit 7
2.5 Botani Kelapa Sawit 9
2.6 Penyakit Busuk Pangkal Batang Kelapa Sawit 10
Bab 3 Bahan dan Metoda 13
3.1 Waktu dan Tempat 13
3.2 Bahan 13
3.3 Lokasi Pengambilan Sampel 13
3.4 Isolasi Bakteri Endofit dari Akar 14 3.5 Isolasi Bakteri Endofit dari Daun 14 3.6 Karakterisasi Bakteri Endofit Akar dan Daun Kelapa Sawit 15 3.7 Uji Antagonis Bakteri Endofit Akar dan Daun Kelapa Sawit
Terhadap G. boninense 15
Bab 4 Hasil dan Pembahasan 17
4.1 Isolasi Bakteri Endofit dari Akar dan Daun Kelapa Sawit 17 4.2 Karakterisasi Isolat Bakteri Endofit 18 4.3 Kemampuan Antagonis Bakteri Endofit Akar dan Daun
Kelapa Sawit Terhadap G. boninense 22
4.4 Uji Perbandingan Antagonis Isolat Bakteri Endofit Dengan
Bab 5 Kesimpulan dan Saran 27
5.1 Kesimpulan 27
5.2 Saran 27
DAFTAR TABEL
Halaman
Tabel 4.1.1 Karakteristik morfologi koloni isolat bakteri endofit akar dan
daun kelapa sawit 19
Tabel 4.2.1 Hasil pewarnaan Gram bakteri endofit akar dan daun kelapa
sawit 20
Tabel 4.2.2 Hasil uji biokimia metabolisme bakteri endofit akar dan
daun kelapa sawit 21
Tabel 4.4.1 Perbandingan panjang miselium terhambat G. boninense antara
DAFTAR GAMBAR
Halaman Gambar 2.5.1 Kelapa sawit (Elaeis guineensis Jacq.) 8 Gambar 2.6.1 Kelapa sawit yang terserang penyakit busuk pangkal
batang 11
Gambar 2.6.2 Ganoderma boninense Pat. 12
Gambar 4.1.1 Kehadiran isolat bakteri endofit pada setiap lokasi
perkebunan kelapa sawit di Sumatera Utara 18 Gambar 4.3.1 Uji antagonis 40 isolat bakteri endofit terhadap
G. boninense pada media NA+YE 1% pada hari ke-7 22 Gambar 4.3.2 Zona hambat yang terbentuk pada uji antagonis pada hari
ke-7 dan pertumbuhan hifa abnormal 24 Gambar 4.4.1 Perbandingan aktivitas antagonis ketiga isolat bakteri
endofit dengan antibiotik ketokonazol terhadap G. boninense
DAFTAR LAMPIRAN
Halaman
Lampiran A. Alur Kerja Pengambilan Sampel 32
Lampiran B. Alur Kerja Isolasi Bakteri Endofit dari Akar 33 Lampiran C. Alur Kerja Isolasi Bakteri Endofit dari Daun 34 Lampiran D. Alur Kerja Karakterisasi Bakteri Endofit 35 Lampiran E. Alur Kerja Uji Antagonis Bakteri Endofit Terhadap
G. boninense 36
Lampiran F. Lokasi Penelitian 37
Lampiran G. Gambar-Gambar Penelitian 38
Lampiran H. Deskripsi Lokasi Penelitian 39
ABSTRAK
THE ANTAGONISTIC OF ENDOPHYTIC BACTERIA ISOLATED FROM ROOTS AND LEAVES OF PALM OIL (Elaeis guineensisJacq.) AGAINTS
Ganoderma boninensePat.
ABSTRACT
BAB 1
PENDAHULUAN
1.1Latar Belakang
Kelapa sawit (Elaeis guineensis Jacq.) di Indonesia dewasa ini merupakan komoditas utama. Luas perkebunan kelapa sawit terus berkembang dan tidak hanya merupakan monopoli perkebunan negara atau swasta. Saat ini perkebunan rakyat pun juga sudah berkembang dengan pesat. Dalam perekonomian Indonesia, komoditas kelapa sawit memegang peranan yang cukup strategis karena komoditas ini mempunyai prospek yang cerah sebagai sumber devisa. Di samping itu, minyak sawit merupakan bahan baku utama minyak goreng yang banyak dipakai di seluruh dunia, sehingga secara terus menerus mampu menjaga stabilitas harga minyak sawit. Komoditas ini juga menciptakan kesempatan kerja yang luas dan meningkatkan kesejahteraan masyarakat (Risza, 1994). Untuk itu banyak usaha yang telah dilakukan agar produktivitas dari tanaman ini meningkat. Usaha-usaha yang telah dilakukan seperti perluasan areal kebun dan memanajemen pengolahan kebun yaitu dengan meningkatkan pemupukan dan pengendalian penyakit.
fungisida sistemik atau peracunan fungi pada tanaman membutuhkan biaya sangat mahal dan dianggap tidak dapat bertahan dalam kurun waktu yang lama.
Alternatif lain yang perlu dilakukan yaitu dengan penggunaan agen pengendali hayati melalui mekanisme hiperparasitik terhadap G. boninense yang dilakukan oleh bakteri endofit seperti Bacillus sp. Hifa G. boninense yang mengalami kontak langsung dengan antibiotik akan mengalami kerusakan dan menyebabkan membran hifa pecah sehingga menjadi tidak silindris lagi dan cairan sel akan keluar (Campbell,
1989 dalam Susanto et al., 2002). Mikroorganisme endofit merupakan
mikroorganisme yang berasosiasi dengan jaringan tanaman sehat yang bersifat netral atau menguntungkan. Hampir setiap tanaman tingkat tinggi memiliki beberapa mikroorganisme endofit yang mampu menghasilkan senyawa biologi atau metabolit sekunder. Bahan aktif yang dihasilkan mikroorganisme endofit ini diperkirakan memiliki kemampuan yang sama dengan bahan aktif yang dihasilkan oleh tanaman induknya. Telah banyak penelitian yang dilakukan untuk mengisolasi mikroorganisme endofit pada beberapa tanaman, misalnya pada tanaman obat (Tan & Zhou, 2001), tanaman perkebunan dan tanaman budidaya seperti padi (Zinniel et al., 2002), buah-buahan seperti stroberi (Moussaif et al., 1997), dan tanaman hutan (Strobel, 2002; Suryanarayanan et al., 2003).
Untuk mengetahui potensi mikroorganisme endofit khususnya bakteri endofit pada tanaman kelapa sawit yang dapat berperan sebagai agen pengendali hayati, masih perlu dilakukan penelitian. Isolasi dan uji antagonis bakteri endofit dari akar dan daun tanaman kelapa sawit melalui aktivitas antagonis, diharapkan akan diperoleh isolat bakteri endofit yang potensial sebagai agen pengendali hayati G. boninense penyebab penyakit busuk pangkal batang.
1.2Permasalahan
jaringan tanaman diperkirakan memiliki kemampuan dalam menghasilkan suatu senyawa metabolit sekunder yang potensial atau mekanisme enzim tertentu untuk dapat mengendalikan pertumbuhan G. boninense yang menyebabkan penyakit busuk pangkal batang pada kelapa sawit. Keanekaragaman bakteri endofit kelapa sawit perlu digali terutama juga untuk membantu meningkatkan produktivitas kelapa sawit dan dalam hal mengatasi masalah yang ditimbulkan oleh G. boninense.
1.3Tujuan
Penelitian ini bertujuan untuk mengetahui jenis-jenis bakteri endofit yang terdapat pada tanaman kelapa sawit dan menguji aktivitas antagonisnya terhadap G. boninense.
1.4Hipotesis
Pada akar dan daun tanaman kelapa sawit diperoleh beberapa isolat bakteri endofit dan diantaranya memiliki kemampuan antagonis terhadap G. boninense.
1.5Manfaat
BAB 2
TINJAUAN PUSTAKA
2.1 Mikroorganisme Endofit
Mikroorganisme endofit merupakan asosiasi antara mikroorganisme dengan jaringan
tanaman. Tipe asosiasi biologis antara mikroorganisme endofit dengan tanaman inang
bervariasi dari netral, komensalisme sampai simbiosis. Pada situasi ini tanaman
merupakan sumber makanan bagi mikroorganisme endofit dalam melengkapi siklus
hidupnya (Clay, 1988). Mikroba endofit adalah mikroba yang hidup di dalam jaringan
tanaman pada periode tertentu dan mampu hidup dengan membentuk koloni dalam
jaringan tanaman tanpa membahayakan inangnya. Setiap tanaman tingkat tinggi dapat
mengandung beberapa mikroba endofit yang mampu menghasilkan senyawa biologi
atau metabolit sekunder yang diduga sebagai akibat koevolusi atau transfer
genetik (genetic recombination) dari tanaman inangnya ke dalam mikroba endofit
(Tan & Zhou, 2001 dalam Radji, 2005).
Hampir semua tanaman vaskular memiliki endofit. Endofit masuk ke dalam
jaringan tanaman umumnya melalui akar atau bagian lain dari tanaman. Bakteri
menembus jaringan tanaman di akar, stomata atau pada bagian tanaman yang luka
(Carrol, 1988). Bakteri endofit merupakan bakteri yang hidup pada jaringan tanaman
tanpa merusak jaringan tanaman tersebut. Bakteri endofit dapat diisolasi dari
permukaan jaringan tanaman yang steril atau diekstraksi dari jaringan tanaman bagian
dalam. Bakteri endofit gram positif dan gram negatif telah banyak diisolasi dari
beberapa jaringan tanaman. Endofit masuk ke dalam jaringan tanaman terutama
melalui akar dan bagian tanaman lain yang terpapar udara luar seperti bunga, batang,
dan kotiledon dapat juga dilalui. Secara khusus, bakteri masuk ke jaringan melalui
jaringan yang berkecambah, akar, stomata, maupun jaringan yang rusak (Zinniel et al.,
Bakteri endofit adalah bakteri yang berada dalam jaringan tanaman. Endofit
umumnya mengacu pada mikroorganisme yang berada dalam jaringan pembuluh
tanaman dan dapat bergerak bebas di dalam tanaman atau lebih luas lagi adalah
mikroorganisme yang berada dalam jaringan tanaman walaupun tidak melakukan
kolonisasi, atau dengan kata lain bakteri endofit adalah bakteri yang dapat diisolasi
dari tanaman yang telah disterilisasi permukaan (Kloepper et al., 1999 dalam Aini &
Abadi, 2004). Keberadaan bakteri endofit dalam jaringan tanaman sehat telah banyak
dilaporkan terdapat dalam berbagai spesies tanaman maupun bagian tanaman yang
berbeda dan pada umur yang berbeda (Elvira-Recuenco et al., 1999 dalam Aini &
Abadi, 2004). Bakteri endofit telah ditemukan antara lain pada batang tanaman buncis
(Ramamoorthy et al., 2001), batang kacang kapri dan tomat, umbi kentang (Sturz et
al., 1999), batang tanaman kapas (Reva et al., 2002), serta tanaman tebu
(Ramamoorthy et al., 2001).
Sebenarnya bakteri endofit maupun rizobakteri lainnya merupakan bagian dari
mikroflora alamiah dari tanaman yang sehat di lapangan, mereka dapat dikatakan
sebagai kontributor penting bagi kesehatan tanaman (Kloepper et al., 1999 dalam Aini
& Abadi, 2004). Menurut Hallman et al. (1999) dalam Aini & Abadi (2004), telah
diketahui pula bahwa bakteri endofit dapat berpengaruh pada kesehatan tanaman
dalam hal: (1) antagonisme langsung atau penguasaan niche atas patogen, (2)
menginduksi ketahanan sistemik dan (3) meningkatkan toleransi tanaman terhadap
tekanan lingkungan. Karena sifat-sifat tersebut bakteri endofit telah terbukti dapat
dimanfaatkan sebagai pengendali hayati penyakit tanaman bahkan dapat mengurangi
serangan hama tanaman (Ramamoorthy et al., 2001).
2.2 Biodiversitas Endofit
Keanekaragaman hayati secara tidak langsung berarti keanekaragaman senyawa
kimia. Kemampuan bertahan hidup dengan tingkat kompetisi yang tinggi
dan strukturnya. Keanekaragaman yang tinggi menyebabkan endofit juga
menghasilkan produk alami aktif yang lebih banyak. Menurut Bills et al. (1992)
dalam Strobel & Daisy (2003), endofit di daerah tropis dengan jumlah yang tinggi
menghasilkan senyawa metabolit sekunder yang aktif dalam jumlah yang lebih banyak
dibandingkan dengan endofit tanaman-tanaman yang ada di daerah subtropis. Jadi
tanaman inang mempengaruhi metabolisme endofitnya.
Kemampuan mikroba endofit memproduksi senyawa metabolit sekunder
sesuai dengan tanaman inangnya merupakan peluang yang sangat besar dan dapat
diandalkan untuk memproduksi metabolit sekunder dari mikroba endofit yang
diisolasi dari tanaman inangnya tersebut. Dari sekitar 300.000 jenis tanaman yang
tersebar di muka bumi ini, masing-masing tanaman mengandung satu atau lebih
mikroba endofit yang terdiri dari bakteri dan jamur (Strobel et al., 2003 dalam Radji,
2005).
2.3 Manfaat Endofit
Beberapa ahli telah mengisolasi dan meneliti endofit dari berbagai tanaman
diantaranya tanaman obat (Tan & Zhou, 2001), tanaman perkebunan (Zinniel et al.,
2002), dan tanaman-tanaman hutan (Strobel, 2002; Suryanarayanan et al., 2003). Dari
sekitar 300.000 jenis tanaman yang tersebar di muka bumi ini, masing-masing
tanaman mengandung satu atau lebih mikroorganisme endofit yang terdiri dari bakteri
dan fungi (Strobel & Daisy, 2003). Bakteri atau fungi tersebut dapat menghasilkan
senyawa metabolit yang dapat berfungsi sebagai antibiotika (antifungi/antibakteri),
antivirus, antikanker, antidiabetes, antimalaria, antioksidan, antiimmunosupresif
(Strobel & Daisy, 2003), antiserangga (Azevedo et al., 2000), zat pengatur tumbuh
(Tan & Zhou, 2001) dan penghasil enzim-enzim hidrolitik seperti amilase, selulase,
xilanase, ligninase (Choi et al., 2005), dan kitinase (Zinniel et al., 2002). Manfaat dari
endofit lainnya juga dapat menghasilkan zat pengatur tumbuh IAA (Indol Acetic Acid)
Berdasarkan kemampuannya tersebut mikroorganisme endofit banyak
mendapat perhatian peneliti terutama dalam bidang farmasi, industri, dan pertanian.
Senyawa antimikrobial yang bersifat sebagai antifungi diisolasi dari endofit
Cryptosporiopsis quercina dari tanaman obat Tripterigeum wilfordii. Endofit ini
menghasilkan antifungi cryptocandin yang efektif terhadap Candida albicans dan
Trichopyton spp. (Strobel & Daisy, 2003). Beberapa zat aktif lain yang diisolasi dari
mikroba endofit misalnya ecomycin diproduksi oleh Pseudomonas viridiflava juga
aktif terhadap Cryptococcus neoformans dan Candida albicans. Ecomycin merupakan
lipopeptida yang di samping terdiri dari molekul asam amino yang umum juga
mengandung homoserin dan beta-hidroksi asam aspartat (Miller et al., 1998 dalam
Radji, 2005), sedangkan senyawa kimia yang diproduksi oleh mikroba endofit
Pseudomonas syringae yang berkhasiat sebagai antijamur adalah pseudomycin, yang
dapat menghambat pertumbuhan Candida albicans dan Cryptococcus neoformans
(Harrison et al., 1991 dalam Radji, 2005).
2.4 Kelapa Sawit
Berdasarkan bukti-bukti yang ada, kelapa sawit diperkirakan berasal dari Nigeria,
Afrika Barat. Namun ada pula yang menyatakan tanaman tersebut berasal dari
Amerika, yakni Brazilia. Tanaman kelapa sawit berasal dari tanaman tersier, yang
merupakan daratan penghubung yang terletak di antara Afrika dan Amerika. Kedua
daratan itu kemudian terpisah oleh lautan menjadi dua benua Afrika dan Amerika
sehingga tempat asal komoditas kelapa sawit tidak lagi dipermasalahkan orang (Risza,
1994).
Kelapa sawit (Gambar 2.5.1) saat ini telah berkembang pesat di Asia
Tenggara, khususnya Indonesia dan Malaysia, dan justru di Afrika Barat atau
Amerika. Masuknya bibit kelapa sawit ke Indonesia pada tahun 1948 hanya sebanyak
empat batang yang berasal dari Bourbon (Mauritius) dan Amsterdam. Keempat batang
Di Sumatera, sebagai sentral perkebunan kelapa sawit, banyak daerah baru
berkembang akibat langsung dari perkebunan kelapa sawit. Kelapa sawit tumbuh
pesat di provinsi Riau yang meliputi lima Kabupaten, Siak, Pelelawan, Rokan Hulu,
Indragiri, Hulu dan Kampar. Sepanjang jalur lintas timur, lintas tengah, dan lintas
barat, Sumatera antara Medan-Palembang. Total luas areal tanaman kelapa sawit di
seluruh Indonesia dalam dua puluh tahun terakhir akan berkembang cukup pesat
(Budiyanto, 2005).
Sebagai negara penghasil kelapa sawit terbesar, Indonesia telah menjadikan
komoditas ini sebagai penggerak utama ekonomi Indonesia. Kelapa sawit
mengakumulasi hampir seluruh kegiatan penelitian pengembangan dan rekayasa.
Produksi minyak sawit mentah (CPO) diperkirakan melewati 13 juta ton pada 2005,
sedikit lebih rendah dari produksi Malaysia sebagai produsen CPO (Crude Palm Oil)
terbesar di dunia (Lukman, 2005).
2.5 Botani Kelapa Sawit
Klasifikasi kelapa sawit menurut Tjitrosoepomo (2002) adalah sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta
Subdivisi : Angiospermae
Klas : Monocotyledoneae
Ordo : Arecales
Famili : Arecaceae
Genus : Elaeis
Spesies : Elaeis guineensis Jacq.
Tumbuhan kelapa sawit dibedakan atas dua bagian, yakni bagian vegetatif dan
generatif. Menurut Risza (1994) bagian vegetatif meliputi akar, batang, dan daun,
sedangkan bagian generatif meliputi bunga, buah dan biji. Akar tanaman kelapa sawit
memiliki jenis akar serabut. Akar utama akan membentuk akar sekunder, tertier dan
kuartener. Batang kelapa sawit berbentuk silinder dengan diameter sekitar 20-75 cm.
Tinggi batang bertambah sekitar 45 cm per tahun. Dalam kondisi lingkungan yang
sesuai pertambahan tinggi dapat mencapai 100 cm per tahun. Sementara susunan daun
kelapa sawit membentuk susunan daun majemuk. Susunan ini menyerupai susunan
daun pada tanaman kelapa. Panjang pelepah daun sekitar 7,5-9 m. Jumlah anak daun
pada setiap pelepah berkisar antara 250-400 helai.
Tanaman kelapa sawit merupakan tanaman berumah satu. Rangkaian bunga
jantan terpisah dengan rangkaian bunga betina. Umumnya tanaman kelapa sawit
melakukan penyerbukan silang. Buah terkumpul di dalam tandan. Dalam satu tandan
terdapat sekitar 1.600 buah. Tanaman normal akan menghasilkan 20-22 tandan per
tahun. Jumlah tandan buah pada tanaman tua sekitar 12-14 tandan per tahun. Berat
setiap tandan sekitar 25-35 kg. Secara anatomi buah kelapa sawit tersusun dari
perikarp atau daging buah. Perikarp terdiri dari mesokarp, yaitu kulit luar buah yang
yang tersusun dari endokarp (tempurung) yang merupakan lapisan keras dan berwarna
hitam dan endosperm (kernel) yang berwarna putih. Kernel akan menghasilkan
minyak inti atau palm kernel oil.
2.6 Penyakit Busuk Pangkal Batang Kelapa Sawit
Ganoderma merupakan jamur pembusuk putih. Jamur ini menyebabkan menurunnya
nilai ekonomi minyak kelapa sawit di berbagai kawasan di seluruh dunia termasuk
Asia Tenggara (Corley et al., 2003 dalam Paterson, 2007). Busuk pangkal batang
kelapa sawit disebabkan oleh Ganoderma boninense Pat., yang dulu disebut sebagai
Fomes lucidus (W.Curt) Fr. forma boninensis Sacc., dan Ganoderma miniatocinctum
Stey (Holliday, 1980 dalam Semangun, 2000). Busuk pangkal batang adalah penyakit
utama dalam perkebunan kelapa sawit dewasa ini termasuk di Indonesia. Arti dari
penyakit ini semakin lama semakin meningkat. Pertama karena adanya usaha
besar-besaran untuk memperluas kebun kelapa sawit di Indonesia. Kedua, dari generasi ke
generasi persentase tanaman sakit semakin meningkat. Kelapa sawit yang ditanam
sesudah kelapa sawit atau tanaman kelapa akan mendapat serangan yang lebih berat
dari penyakit busuk pangkal batang. Kalau dulu dianggap sebagai penyakit kebun tua,
sekarang penyakit ini terdapat juga di kebun yang masih muda (Semangun, 2000).
Tanaman kelapa sawit yang terserang penyakit busuk pangkal batang dapat
diketahui dari mahkota pohon (Gambar 2.6.1). Pohon sakit mempunyai janur (daun
yang belum membuka; spear leaves) lebih banyak daripada biasanya. Daun berwarna
hijau pucat, daun-daun tua layu, patah pada pelepahnya, dan menggantung di sekitar
Gejala yang khas sebelum terbentuknya tubuh buah adalah adanya
pembusukan pada pangkal batang. Pada penampangnya bagian batang yang terserang
ini berwarna coklat muda dengan jalur-jalur tidak teratur yang berwarna lebih gelap.
Di tepi daerah yang terinfeksi terdapat zona yang tidak teratur yang berwarna kuning.
Zona yang memiliki bau seperti minyak sawit yang mengalami fermentasi ini adalah
akibat dari mekanisme perlawanan tanaman (Semangun, 2000).
Menurut Turner (1981) dalam Semangun (2000), lambat atau cepat
Ganoderma penyebab penyakit ini membentuk tubuh buah (sporophore) atau
basidiokarp, pada pangkal batang atau kadang-kadang pada akar sakit di dekat batang.
Tubuh buah hanya dibentuk pada saat penyakit berkembang cukup lanjut, sesudah
tampaknya gejala pada daun. Tubuh buah yang paling muda dibentuk di dekat tepi
bagian yang membusuk yang berkembang ke atas.
Tubuh buah Ganoderma mula-mula tampak sebagai bongkol kecil berwarna
putih (Gambar 2.6.2), pada pangkal pelepah daun atau pada batang di antara
puntung-puntung pelepah daun. Tubuh buah berkembang terus menjadi berbentuk kipas tebal
(console, bracket like) meskipun bentuk ini dapat sangat bervariasi. Kadang-kadang
tubuh buah dibentuk berdekatan, saling menutupi atau saling bersambungan sehingga
menjadi suatu susunan yang besar (Semangun, 2000).
Gambar 2.6.2 Ganoderma boninense Pat.
Sumber:
Warna permukaan atas tubuh buah bervariasi dari coklat muda sampai coklat
tua, biasanya tampak mengkilap seperti dilapisi lak, khususnya pada waktu masih
muda. Permukaan ini kurang rata, mempunyai zona-zona, yang paling luar berwarna
putih. Permukaan bawahnya berwarna putih suram, yang jika tersentuh akan segera
berubah warnanya menjadi kelabu kebiruan. Lapisan bawah tubuh buah terdiri dari
lapisan pori, tempat terbentuknya basidium dan basidiospora (Semangun, 2000).
Menurut Abadi (1987) dalam Semangun (2000), tubuh buah G. boninense di
Sumatera Utara mempunyai lapisan kutis (lapisan atas) yang tebalnya sampai 0,1 mm,
terdiri atas benang-benang rapat yang sel-selnya berukuran 20-30 x 40 μm. Pori bergaris tengah 150-400 μm, dengan desipimen (jaringan antara) 30-60 μm. Basidiospora berbentuk bulat panjang, berwarna keemasan, bagian atasnya agak rata,
berduri jelas, kadang-kadang mempunyai vakuola yang jelas. Basidiospora berukuran
9-12 x 4,75-6 μm.
Ganoderma menular ke tanaman sehat bila akar tanaman sehat ini
bersinggungan dengan tunggul-tunggul pohon sakit. Akar-akar tanaman kelapa sawit
muda tertarik kepada tunggul-tunggul yang membusuk karena kaya akan hara dan
mempunyai kelembaban tinggi. Akar kelapa sawit banyak ditemukan di dalam
jaringan tunggul dan akar-akar kelapa yang mengalami dekomposisi (Semangun,
BAB 3
BAHAN DAN METODA
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan mulai bulan Juli 2007 sampai Januari 2008 di Laboratorium Mikrobiologi FMIPA USU Medan.
3.2 Bahan
Bagian tanaman kelapa sawit yang digunakan sebagai sampel untuk diisolasi yaitu akar dan daun tanaman kelapa sawit. Akar dan daun yang digunakan berasal dari tanaman kelapa sawit yang sehat dan berumur ≥ 5 tahun. Isolat fungi G. boninense
berumur ± 5 hari yang ditumbuhkan pada media NA (Nutrient Agar) + YE (Yeast Extract) 1% yang diperoleh dari Pusat Penelitian Kelapa Sawit (PPKS) Marihat, Pematang Siantar.
3.3 Lokasi Pengambilan Sampel
3.4 Isolasi Bakteri Endofit Dari Akar
Isolasi bakteri endofit dari akar tanaman kelapa sawit dilakukan menurut metode Radu & Kqueen (2002). Sampel yang diambil dari lokasi segera dicuci dengan air untuk menghilangkan kotoran yang menempel. Kemudian dikeringkan, lalu dibungkus dengan kertas koran dan dimasukkan ke dalam kantong plastik. Selanjutnya sampel dibawa ke laboratorium untuk tahap isolasi. Tahap awal yang dilakukan adalah mencuci bagian akar tanaman yang dipotong-potong sepanjang 3-5 cm dengan air mengalir selama 20 menit. Kemudian disterilisasi bagian permukaan akar tanaman dengan merendamnya di dalam larutan secara berturut-turut: etanol 75% selama 2 menit, larutan sodium hipoklorit 5,3% selama 5 menit, dan etanol 75% selama 30 detik. Selanjutnya, dibilas dengan akuades steril sebanyak 2 kali. Setelah itu, dikeringkan dengan kertas saring steril. Setelah kering, bagian ujung kiri dan kanan akar tanaman dibuang ± 1 cm. Kemudian masing-masing akar dipotong menjadi 4 bagian dan diletakkan di permukaan media NA yang telah dicampur dengan antibiotik ketokonazol (0,3 gram/100 ml) dengan posisi bekas potongan ke arah media. Kemudian diinkubasi pada suhu ruang (25o-30oC) selama ± 5 hari. Koloni yang muncul dari bagian akar tanaman sebelah dalam disubkulturkan ke media NA yang baru untuk dimurnikan (Lampiran B, hlm: 31).
3.5 Isolasi Bakteri Endofit Dari Daun
dengan akuades steril sebanyak 2 kali, dan dikeringkan dengan kertas saring steril. Setelah kering, daun dipotong seluas ± 1 cm2. Kemudian potongan daun diletakkan di permukaaan media NA yang telah dicampur dengan antibiotik ketokonazol (0,3 gram/100 ml). Selanjutnya diinkubasi pada suhu ruang (25o-30oC) selama ± 5 hari. Koloni yang muncul dari bagian pinggir daun tanaman disubkulturkan ke media NA yang baru untuk dimurnikan (Lampiran C, hlm: 32).
3.6 Karakteristisasi Bakteri Endofit Akar dan Daun Kelapa Sawit
Isolat bakteri endofit yang diperoleh dari akar dan daun tanaman kelapa sawit selanjutnya dikarakterisasi secara morfologi berdasarkan bentuk, warna, elevasi, dan tepi dari koloni. Selanjutnya dilakukan karakterisasi berdasarkan pewarnaan Gram untuk mengamati bentuk dan penataan sel serta sifat bakteri. Kemudian dilakukan uji biokimia sederhana antara lain uji sitrat, TSIA, gelatin, motilitas, katalase dan hidrolisis pati (Lampiran D, hlm: 33).
3.7 Uji Antagonis Bakteri Endofit Akar dan Daun Kelapa Sawit Terhadap G. boninense
BAB 4
HASIL DAN PEMBAHASAN
4.1 Isolasi Bakteri Endofit dari Akar dan Daun Kelapa Sawit
Hasil isolasi bakteri endofit dari akar dan daun kelapa sawit didapatkan sebanyak 40
jenis isolat bakteri endofit yang berbeda. Perbedaan ini didasarkan atas pengamatan
morfologi koloni seperti bentuk, tepi, elevasi, dan warna koloni. Dari 40 jenis bakteri
endofit yang diperoleh, isolat yang paling banyak didapatkan berasal dari akar yaitu
sebanyak 28 jenis bakteri dan 12 jenis lagi berasal dari daun. Menurut Hallman et al.
(1997), umumnya bakteri endofit berasal dari komunitas bakteri epifit yang terdapat di
rizosfer sehingga umumnya jumlah bakteri endofit di bagian akar lebih banyak dan
semakin menurun pada bagian tanaman yang semakin jauh seperti daun.
Berdasarkan lokasi pengambilan sampel, isolat bakteri endofit paling banyak
ditemukan pada perkebunan kelapa sawit rakyat Tanah Jawa, Pematang Siantar, yaitu
sebanyak 11 isolat, dan pada kebun kelapa sawit USU, yaitu sebanyak 10 isolat.
Sedangkan isolat bakteri endofit yang paling sedikit ditemukan pada PTPN III Rantau
Prapat Utara dan perkebunan kelapa sawit rakyat Islamic Centre Medan,
masing-masing sebanyak 4 isolat.
Perbandingan bakteri endofit yang diperoleh dari akar dan daun pada setiap
lokasi dapat dilihat bahwa isolat bakteri endofit yang berasal dari akar lebih banyak
ditemukan pada kebun kelapa sawit USU sebanyak 9 isolat, sedangkan yang berasal
dari daun lebih banyak ditemukan pada perkebunan kelapa sawit rakyat Tanah Jawa,
Pematang Siantar sebanyak 5 isolat (Gambar 4.1.1). Perbedaan jumlah isolat bakteri
endofit yang diperoleh dari setiap lokasi perkebunan kemungkinan disebabkan oleh
fisik, kimia, dan biologi tanah saling berinteraksi satu dengan lainnya sehingga
keberadaan suatu faktor akan berpengaruh terhadap faktor lainnya (Brock, 1966
dalam Sudadi, 2005).
0 2 4 6 8 10
RS RU TM USU ICM PS
J
um
lah
Is
ol
at
Lokasi Pengambilan Sampel
[image:32.595.194.441.160.387.2]Akar Daun
Gambar 4.1.1 Kehadiran isolat bakteri endofit pada setiap lokasi perkebunan kelapa sawit di Sumatera Utara
Pengamatan morfologi koloni isolat bakteri endofit berupa bentuk, tepi,
elevasi, dan warna koloni. Karakteristik morfologi bakteri endofit bervariasi dengan
bentuk bulat, tidak beraturan, dan berfilamen. Tepi koloni bervariasi dari rata,
berbelah, berombak, dan berfilamen, dengan elevasi koloni umumnya rata, namun ada
juga beberapa isolat yang berelevasi cembung. Warna koloni umumnya krem, tapi ada
dua koloni dengan warna yang mencolok yaitu biru tua dan merah (Tabel 4.1.1).
4.2 Karakterisasi Isolat Bakteri Endofit
Karakterisasi isolat berupa pewarnaan Gram dan beberapa uji biokimia. Hasil
pewarnaan Gram yang dilakukan diperoleh sebanyak 9 isolat (22,5%) merupakan
bakteri Gram positif dan sebanyak 31 isolat (75,5%) merupakan bakteri Gram negatif.
Bakteri endofit akar sebagian besar merupakan bakteri Gram negatif dan ditemukan
sebagian besar merupakan bakteri Gram negatif dan ditemukan sebesar 90,9%,
sedangkan bakteri Gram positif sebesar 9,1%. Menurut Lay (1994), pewarnaan Gram
merupakan tahap penting dalam pencirian dan identifikasi bakteri. Pewarnaan Gram
berperan memilahkan bakteri menjadi kelompok Gram positif dan Gram negatif.
Isolat bakteri endofit umumnya memiliki bentuk basil dan kokus. Hampir semua isolat
memiliki penataan monokokus, diplokokus, monobasil, dan diplobasil (Tabel 4.2.1).
Namun ada juga beberapa isolat dengan penataan streptokokus (PS32A), streptobasil
[image:33.595.107.530.304.746.2](USU21A), stapilokokus (USU19A), dan tetrabasil (TM13A).
Tabel 4.1.1 Karakteristik morfologi koloni isolat bakteri endofit akar dan daun kelapa sawit
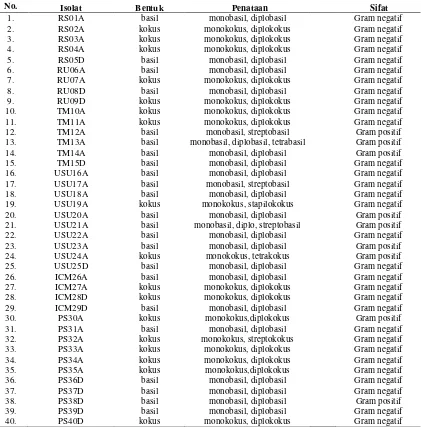
No. Isolat Karakteristik Morfologi Koloni
Bentuk Tepi Elevasi Warna
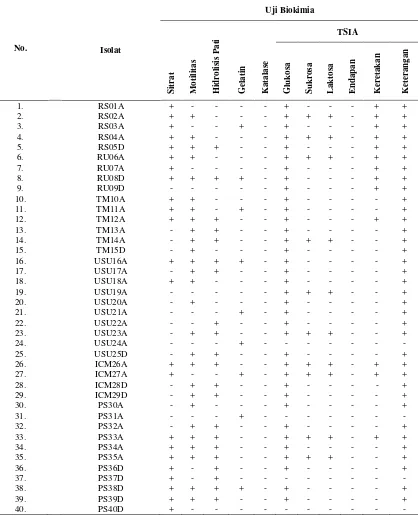
Hasil positif untuk uji sitrat menunjukkan sebanyak 23 isolat mampu
menggunakan sitrat sebagai satu-satunya sumber karbon, dan uji positif ditunjukkan
dengan terjadinya perubahan warna pada media dari hijau menjadi biru akibat adanya
perubahan pH (Lay, 1994). Hasil yang diperoleh pada uji motilitas menunjukkan
bahwa hampir semua isolat bersifat motil, dan sebanyak 13 isolat tidak menunjukkan
adanya pergerakan. Namun pada uji katalase, semua isolat menunjukkan hasil negatif
[image:34.595.109.530.262.689.2](Tabel 4.2.2).
Tabel 4.2.1 Hasil pewarnaan Gram bakteri endofit akar dan daun kelapa sawit No. Isolat Bentuk Penataan Sifat
1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. 23. 24. 25. 26. 27. 28. 29. 30. 31. 32. 33. 34. 35. 36. 37. 38. 39. 40. RS01A RS02A RS03A RS04A RS05D RU06A RU07A RU08D RU09D TM10A TM11A TM12A TM13A TM14A TM15D USU16A USU17A USU18A USU19A USU20A USU21A USU22A USU23A USU24A USU25D ICM26A ICM27A ICM28D ICM29D PS30A PS31A PS32A PS33A PS34A PS35A PS36D PS37D PS38D PS39D PS40D basil kokus kokus kokus basil basil kokus basil kokus kokus kokus basil basil basil basil basil basil basil kokus basil basil basil basil kokus basil basil kokus kokus basil kokus basil kokus kokus kokus kokus basil basil basil basil kokus monobasil, diplobasil monokokus, diplokokus monokokus, diplokokus monokokus, diplokokus monobasil, diplobasil monobasil, diplobasil monokokus, diplokokus monobasil, diplobasil monokokus, diplokokus monokokus, diplokokus monokokus, diplokokus monobasil, streptobasil monobasil, diplobasil, tetrabasil
monobasil, diplobasil monobasil, diplobasil monobasil, diplobasil monobasil, streptobasil monobasil, diplobasil monokokus, stapilokokus monobasil, diplobasil monobasil, diplo, streptobasil
monobasil, diplobasil monobasil, diplobasil monokokus, tetrakokus monobasil, diplobasil monobasil, diplobasil monokokus, diplokokus monokokus, diplokokus monobasil, diplobasil monokokus,diplokokus monobasil, diplobasil monokokus, streptokokus monokokus, diplokokus monokokus, diplokokus monokokus,diplokokus monobasil, diplobasil monobasil, diplobasil monobasil, diplobasil monobasil, diplobasil monokokus, diplokokus Gram negatif Gram negatif Gram negatif Gram negatif Gram negatif Gram negatif Gram negatif Gram negatif Gram negatif Gram negatif Gram negatif Gram positif Gram positif Gram positif Gram negatif Gram negatif Gram negatif Gram negatif Gram negatif Gram positif Gram positif Gram negatif Gram positif Gram positif Gram negatif Gram negatif Gram negatif Gram negatif Gram negatif Gram positif Gram negatif Gram negatif Gram negatif Gram negatif Gram negatif Gram negatif Gram negatif Gram positif Gram negatif Gram negatif
Sebanyak 21 isolat tidak mampu menghidrolisis pati, dan sebanyak 9 isolat
semua isolat menunjukkan hasil positif yang diamati melalui perubahan warna pada
media daerah butt dan slant, adanya endapan hitam pada bagian butt yang merupakan
[image:35.595.110.528.197.718.2]senyawa FeS akibat pembentukan H2S (Lay, 1994).
4.3 Kemampuan Antagonis Bakteri Endofit Akar dan Daun Kelapa Sawit Terhadap G. boninense
Hasil uji antagonis 40 isolat bakteri endofit terhadap G. boninense menunjukkan
bahwa hampir semua isolat bakteri endofit berpotensi menghambat pertumbuhan G.
boninense (Gambar 4.3.1). Hal ini ditunjukkan dengan adanya hambatan pertumbuhan
miselium yang berada di dekat isolat bakteri endofit pada media pertumbuhan
NA+YE 1%. Hambatan pertumbuhan miselium berupa adanya perubahan yang
terlihat pada miselium seperti miselium yang mengering dan menipis pada daerah
interaksi dan adanya zona hambat.
[image:36.595.116.518.305.470.2]
Gambar 4.3.1 Uji antagonis 40 isolat bakteri endofit terhadap G. boninense pada media NA+YE 1% pada hari ke-7 (Tanda panah A: Miselium mengering dan menipis, B: Zona hambat)
Keterangan: Nomor isolat sesuai dengan kode isolat
Beberapa isolat yang terlihat menghambat pertumbuhan miselium seperti yang
ditunjukkan pada isolat nomor 19, 20, 23, 31, 33, 34, 35, dan 38. Isolat-isolat lain juga
menunjukkan kemampuan menghambat namun dengan kemampuan yang lebih kecil
seperti pada isolat nomor 2, 3, 4, 5, 7, 8, 14, 17, 18, 30, dan 37. Sedangkan isolat
PS40D tidak mampu menghambat pertumbuhan miselium G. boninense. Kemampuan
menghambat ini diduga karena isolat bakteri endofit mampu menghasilkan senyawa
tertentu yang bersifat antifungal. Perbedaan daya hambat suatu agen selain disebabkan
oleh konsentrasi zat bioaktif, dapat juga disebabkan oleh jenis zat yang dihasilkan
(Winarni et al., 2007).
1 4 2 3 8 5 7 6 9 12 11 10 14 15 16 13 20 19 18 21 24 23 22 25 28 27 26 29 32 31 30 33 36 34 35 37 38 39 40 17
Dari hasil pengamatan uji antagonis, isolat PS38D mampu menghasilkan zona
hambat paling besar. Berdasarkan karakteristik yang dilakukan, isolat PS38D
termasuk pada kelompok bakteri Gram positif, bentuk basil, memiliki motilitas,
mampu memfermentasi sitrat dan gula (glukosa), mampu menghidrolisis gelatin, dan
membentuk spora. Kemungkinan isolat PS38D termasuk ke dalam kelompok Bacillus.
Menurut Leary & Chun (1988) dalam Supriadi (2006), kelompok Bacillus merupakan
bakteri Gram positif, bentuk batang, memfermentasi sitrat dan gula, motil, serta
membentuk spora. Selain PS38D, isolat PS34A dan PS35A juga menunjukkan
kemampuan menghambat miselium yang ditunjukkan dengan adanya miselium
mengering dan menipis. Berdasarkan karakteristik yang dilakukan, isolat PS34A dan
PS35A termasuk pada kelompok bakteri Gram negatif, bentuk kokus, memiliki
motilitas, menghidrolisis pati, memfermentasi sitrat dan gula. Kemungkinan isolat
PS34A dan PS35A termasuk dalam kelompok genus yang sama.
Beberapa jenis bakteri endofit mampu menghambat patogen tanaman. Bakteri
tersebut misalnya Bacillus subtilis sebagai pengendali penyakit karat pada tanaman
kacang (Baker et al., 1985 dalam Hasanuddin, 2003), Bacillus pumilus strain SE 34
terhadap jamur penyebab layu pembuluh F. oxysporum f.sp. radiscislycopersici
(Ramamoorthy et al., 2001), Pseudomonas fluorecens sebagai agen pengendali hayati
penyakit take-all pada gandum yang disebabkan Gaeumannomyces graminis var.
tritici, bakteri ini terbukti menghasilkan antibiotik phenazin yang menekan
pertumbuhan G. graminis (Thornashow & Weller, 1987 dalam Hasanuddin, 2003),
dan P. fluorecens strain 63-28 terhadap Pytium ultimum pada buncis (Ramamoorthy et
al., 2001).
Selain menghasilkan senyawa antifungal, diduga juga bahwa isolat bakteri
melakukan mekanisme antagonis dengan menghasilkan enzim kitinase dan glukanase
yang dapat melisiskan dinding sel jamur, karena beberapa mikroorganisme khususnya
bakteri mampu memafaatkan kitin dan glukan sebagai sumber karbon dan nitrogen.
Beberapa mikroba yang mampu menghasilkan kitinase dan glukanase antara lain
Serratia marcescens (El-Tarabily, et al., 2000), Bacillus cereus (Pleban et al., 1997
dalam Suryanto et al., 2005), Bacillus sp. (Ramamoorthy et al., 2001), Aeromonas
caviae (Inbar & Chet, 1991), Pyrococcus (Gao et al., 2003 dalam Suryanto et al.,
2005), dan Chromobacterium violaceum (Chernin et al., 1998).
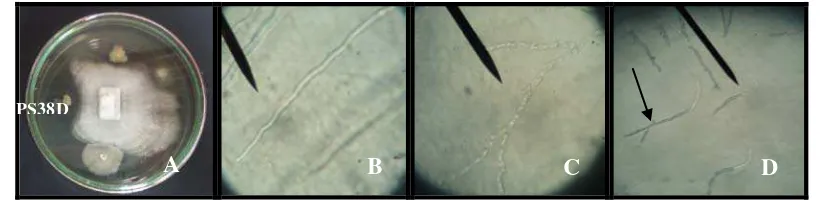
Hifa G. boninense pada daerah interaksi diamati secara mikroskopis untuk
melihat kondisi hifa yang terhambat akibat adanya aktivitas antagonis oleh isolat
bakteri endofit. Pada pengamatan mikroskopis, hifa normal terlihat utuh dan
pertumbuhan hifanya lurus (Gambar 4.3.2B), sedangkan hifa pada daerah interaksi
mengalami lisis atau pecah akibat aktivitas antagonis isolat PS34A (Gambar 4.3.2C),
sedangkan aktivitas antagonis PS38D menunjukkan hifa G. boninense pada daerah
interaksi mengalami percabangan dini dan pembengkokan hifa (Gambar 4.3.2D).
Gambar 4.3.2 Zona hambat yang terbentuk pada uji antagonis pada hari ke-7 (A), hifa normal G. boninense (B), Pertumbuhan hifa abnormal: hifa pecah dari mekanisme antagonis PS34A (C), Hifa
membengkok dan mengalami percabangan dini (tanda panah) dari mekanisme antagonis bakteri endofit PS38D (D).
Perbesaran 100x.
Secara umum, mekanisme antibiotis yang dilakukan agen pengendali hayati
menyebabkan hifa jamur mengalami lisis, seperti pada penelitian Campbell (1989)
dalam Susanto et al. (2002), hifa G. boninense yang mengalami kontak langsung
dengan antibiotik yang dihasilkan Bacillus sp. mengalami kerusakan dan lisis.
Sedangkan mekanisme enzimatis oleh agen pengendali hayati, menyebabkan hifa
mengalami percabangan dan pembengkakan. Hal ini dapat dilihat melalui penelitian
Harjono & Widyastuti (2001), tentang agen biokontrol Trichoderma reesei antagonis
terhadap G. philippii. Dari hasil penelitian, dikatakan bahwa hifa G. philippii yang
diamati secara mikroskopis mengalami percabangan akibat enzim endokitinase yang
PS38D
B C D
[image:38.595.110.522.353.453.2]dihasilkan T. reesei. Namun perubahan-perubahan hifa abnormal tersebut
kemungkinan dapat terjadi melalui mekanisme antibiotik maupun enzimatis.
4.4 Uji Perbandingan Antagonis Isolat Bakteri Endofit dengan Antibiotik Ketokonazol Terhadap G. boninense
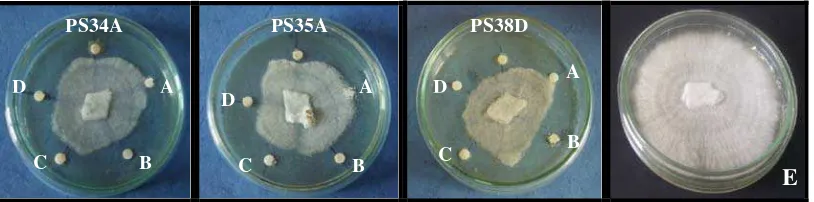
Uji perbandingan dilakukan terhadap 3 isolat bakteri endofit yang dipilih berdasarkan
kemampuan menghambat yang ditunjukkan dengan adanya zona hambat terbesar
akibat aktivitas antagonis isolat PS38D, dan adanya hambatan pertumbuhan yang
menyebabkan miselium mengering akibat aktivitas antagonis isolat PS34A dan
PS35A. Aktivitas perbandingan antagonis ketiga isolat dan ketokonazol terhadap G.
boninense yang diukur pada hari ke-7, menunjukkan bahwa terjadi hambatan
pertumbuhan pada pemberian antibiotik ketokonazol konsentrasi 0,09 mg/ml, 0,3
mg/ml, dan 0,6 mg/ml (Gambar 4.4.1). Hasil yang diperoleh menunjukkan bahwa
ketiga isolat bakteri endofit mampu menghambat pertumbuhan jamur G. boninense
dengan panjang hifa terhambat yang bervariasi untuk setiap isolat.
Gambar 4.4.1 Perbandingan aktivitas antagonis isolat bakteri endofit PS34A, PS35A, dan PS38D dengan antibiotik ketokonazol (A: kontrol, B: 0,09 mg/ml, C: 0,3 mg/ml, D: 0,6 mg/ml, E: miselium normal) terhadap G. boninense pada hari ke-7
Ketiga isolat mampu menghambat pertumbuhan G. boninense lebih besar
dibandingkan konsentrasi ketokonazol 0,09 mg/ml dan 0,3 mg/ml, tapi menghambat
lebih kecil dibandingkan konsentrasi ketokonazol 0,6 mg/ml. Dari ketiga isolat,
PS38D merupakan isolat yang menghambat paling besar yaitu 9,8 mm, sedangkan
PS34A PS35A PS38D
A A A
B
B
B
C C C
D D
D
[image:39.595.112.519.457.558.2]hambatan ketokonazol konsentrasi 0,6 mg/ml sebesar 12 mm, dan lebih besar
dibandingkan ketokonazol konsentrasi 0,09 mg/ml dan 0,3 mg/ml masing-masing
[image:40.595.103.531.178.339.2]sebesar 6,8 mm (Tabel 4.4.1).
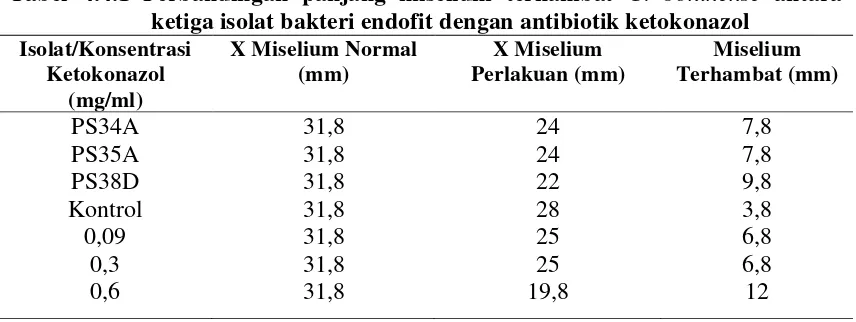
Tabel 4.4.1 Perbandingan panjang miselium terhambat G. boninense antara ketiga isolat bakteri endofit dengan antibiotik ketokonazol
Isolat/Konsentrasi Ketokonazol
(mg/ml)
X Miselium Normal (mm)
X Miselium Perlakuan (mm)
Miselium Terhambat (mm)
PS34A PS35A PS38D Kontrol
0,09 0,3 0,6
31,8 31,8 31,8 31,8 31,8 31,8 31,8
24 24 22 28 25 25 19,8
7,8 7,8 9,8 3,8 6,8 6,8 12
Keterangan: Miselium Terhambat = X Miselium Normal - X Miselium Perlakuan X Miselium Normal : Panjang Miselium Normal
X Miselium Perlakuan : Panjang Miselium Perlakuan
Perbedaan panjang miselium terhambat kemungkinan disebabkan besar
konsentrasi antibiotik ketokonazol yang berbeda-beda dan kemampuan
masing-masing isolat bakteri endofit dalam melakukan aktivitas antagonis terhadap
pertumbuhan miselium G. boninense. Pada perlakuan kontrol yang hanya
menggunakan pelarut kloroform, diperoleh besar hambatan 3,8 mm. Hal ini
menunjukkan bahwa kloroform juga mampu menghambat pertumbuhan miselium
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil penelitian tentang isolasi dan uji antagonis bakteri endofit akar dan daun kelapa sawit (Elaeis guineensis Jacq.) terhadap Ganoderma boninense Pat., dapat disimpulkan bahwa:
1. Sebanyak 40 isolat bakteri endofit diperoleh sebagai hasil isolasi, terbanyak diperoleh dari perkebunan Tanah Jawa, Pematang Siantar yaitu sebanyak 11 isolat, dan paling sedikit diperoleh dari PTPN III Rantau Prapat Utara dan perkebunan Islamic Centre Medan, masing-masing sebanyak 4 isolat.
2. Sebesar 22,5% bakteri Gram positif dan 77,5% bakteri Gram negatif.
3. Ke-40 isolat bakteri endofit, kecuali PS40D mampu menghambat pertumbuhan miselium G. boninense dengan hambatan yang bervariasi.
5.2 Saran
DAFTAR PUSTAKA
Aini, L. Q, dan A. L. Abadi. 2004. Keragaman bakteri endofitik dalam jaringan akar tanaman pisang serta potensi antagonistiknya. Jurnal Ilmu-Ilmu Hayati. 16 (2): 114-115.
Azevedo, J. L., W. Maccheroni Jr, J. O. Pereira, and W. Luiz de Araujo. 2000. Endophytic microorganism: A review on insect control and recent advances on tropical plants. Electronic Journal of Biotechnology. 3 (1): 40-65.
Budiyanto. 2005. Identifikasi kerusakan buah sawit dan pengaruh penundaan pengolahan terhadap peningkatan kandungan asam lemak bebas (ALB) pada buah sawit. Jurnal Ilmu-Ilmu Pertanian Indonesia. 7 (2): 133-139.
Carrol, G. C. 1988. Fungal endophytes in stem and leaves from latent pathogens to mutualistic symbiont. Ecology. 69: 2-9.
Chernin, L., Z. Ismailov, S. Haran, and I. Chet. 1995. Chitinolytic Enterobacter agglomerans antagonistic to fungal plant pathogens. Applied and Environmental Microbiology. 61 (5): 1720-1726.
Chernin, L., M. K. Winson, J. M. Thompson, S. Haran, B. W. Bycroft, and I. Chet. 1998. Chitinolytic activity in Chromobacterium violaceum: substrate analysis and regulation by quorum sensing. Journal of Bacteriology. 180 (17): 4435-4441.
Choi, Y. W., I. J. Hodgkiss, and K. D. Hyde. 2005. Enzyme production by endophytes of Brucea javanica. Journal of Agricultural Technology. 1: 55-65.
Clay, K. 1988. Fungal endophytes of grasses: A defensive mutualism between plants and fungi. Ecology. 69 (1): 10-16.
El-Tarabily, K. A., M. H. Soliman, A. H. Nassar, H. A. Al-Hassani, K. Sivasithamparam, F. McKenna, and G. E. St. J. Hardy. 2000. Biological control of Sclerotinia minor using a chitinolytic bacterium and actinomycetes.
Plant Pathology. 49: 573-583.
Fisher, P. J., O. Petrini, and H. M. Lappin-Scott. 1992. The distribution of some fungal and bacteria endophytes in Maize (Zea mays L.). New Phytologist. 122: 299-305.
Harjono, and S. M. Widyastuti. 2001. Antifungal activity of purified endochitinase produced by biocontrol agent Trichoderma reesei againts Ganoderma philippii. Pakistan Journal of Biological Sciences. 4 (10): 1232-1234.
Hasanuddin. 2003. Peningkatan peranan mikroorganisme dalam sistem pengendalian penyakit tumbuhan secara terpadu. Jurusan Hama dan Penyakit Tumbuhan, Fakultas Pertanian, Universitas Sumatera Utara.
Inbar, J., and I. Chet. 1991. Evidence that chitinase produced by Aeromonas caviae is involved in the biological control of soil borne plant pathogens by this bacterium. Soil Biology and Biochemistry. 24: 989-997.
Lay, B. W. 1994. Analisis Mikroba di Laboratorium. Cetakan Pertama. Jakarta: PT. Raja Grafindo Persada.
Lukman, S. T. 2005. Pemanfaatan Tempurung Kelapa Sawit.
Lorito, M., G. E. Harman, C. K. Hayes, R. M. Broadway, A. Tronsmo, S. L. Woo, and A. de Pietro. 1992. Chitinolytic enzymes produced by Trichoderma harzianum
antifungal activity of purified endochitinase and chitobiosidase.
Phytopathology. 83: 302-307.
Moussaif, M., P. Jacques, P. Schaarwachter, H. Budzikiewicz, and P. Thonart. 1997. Production of cyclosporins from Acremonium luzulae. Applied and Environmental Microbiology. 63: 1739-1743.
Paterson, R. R. M. 2007. Ganoderma disease of oil palm—A white rot perspective necessary for integrated control. Crop Protection. 26: 1369–1376.
Pereira, J. O., M. L. Carneiro-Vieira, and J. L. Azevedo. 1999. Endophytic fungi from
Musa acuminata and their reintroduction in axenic plants. World Journal of Microbiology and Biotechnology. 15: 47-51.
Pleban, S., L. Chernin, and I. Chet. 1997. Chitinolytic enzymes of an endophytic strain of Bacillus cereus. Letters in Applied Microbiology. 25 (4): 284-288.
Radji, M. 2005. Peranan bioteknologi dan mikroba endofit dalam pengembangan obat herbal. Majalah Ilmu Kefarmasian. 2 (3): 118-121.
Radu, S., and C. Y. Kqueen. 2002. Preliminary screening of endophytic fungi from medicinal plants in Malaysia for antimicrobial and antitumor activity.
Malaysian Journal of Medical Science. 9 (2): 23-33.
Reva, O. N., V. V. Smirnov, B. Petterson, and F. G. Priest. 2002. Bacillus endophyticus sp. nov., isolated from the inner tissues of cotton plants (Gossypium sp.). International Journal of Systematic and Evolutionary Microbiology. 52: 101-107.
Risza. 1994. Kelapa Sawit: Upaya Peningkatan Produktivitas. Jakarta: Kanisius.
Semangun, H. 2000. Penyakit-Penyakit Tanaman Perkebunan di Indonesia. Cetakan Keempat. Yogyakarta: Gadjah Mada University Press.
Strobel, G. A. 2002. Microbial gifts from rain forest. Canadian Journal of Plant Pathology. 24: 14-20.
Strobel, G. A., and B. Daisy. 2003. Bioprospecting for microbial endophytes and their natural products. Microbiology and Molecular Biology Review. 67 (4): 419- 502.
Sturz, A. V., B. R. Christie, B. G. Matherson, W. J. Arsenault, and N. A. Buchanan. 1999. Endophytic bacterial communities in the periderm of potato tubers and their potential to improve resistance to soilborne pathogen. Plant Pathology. 48: 360-369.
Sudadi. 2005. Interaksi bahan mineral lempung, bahan organik, mikrobia tanah: Pengaruh terhadap antagonisme dan pemanfaatannya dalam pengendalian hayati penyakit tanaman asal tanah. Jurusan Ilmu Tanah Fakultas Pertanian UNS Surakarta.5 (1): 18-29.
Supriadi. 2006. Analisis risiko agens hayati untuk pengendalian patogen pada tanaman. Balai Penelitian Tanaman Obat dan Aromatik. Jurnal Litbang Pertanian.25 (3): 75-80.
Suryanarayanan, T. S., G. Venkatesan, and T. S. Murali. 2003. Endophytic fungal communities in leaves of tropical forest trees: Diversity and distribution patterns. Current Science. 85 (4): 489-493.
Suryanto, D., E. Munir, dan Yurnaliza. 2005. Eksplorasi bakteri kitinolitik: keragaman genetik gen penyandi kitinase pada berbagai jenis bakteri dan pemanfaatannya. Laporan Hasil Penelitian Hibah Bersaing Perguruan Tinggi.
Susanto, A., Sudharto Ps, dan D. Tambajong. 2002. Hiperparasitisme beberapa agens biokontrol terhadap Ganoderma boninense penyebab penyakit busuk pangkal batang kelapa sawit. Jurnal Penelitian Kelapa Sawit. 10 (2-3): 63-68.
Tan, R. X., and W. X. Zou. 2001. Endophytes: A rich of functional metabolites. Nat. Prod. Rep. 18: 448-459.
Winarni, I., dan E. Novi. 2007. Penapisan aktinomisetes yang bersifat antagonis terhadap penyakit layu bakteri tanaman cabe. Jurnal Matematika, Sains dan Teknologi. 8 (1): 71-82.
LAMPIRAN
Lampiran A. Alur Kerja Pengambilan Sampel
diambil akar tanaman yang tua diambil daun tanaman yang tua
(berumur ≥ 5 tahun) dan sehat (berumur ≥ 5 tahun) dan sehat
dari 5 kawasan perkebunan dari 5 kawasan perkebunan
dibungkus dengan koran dibungkus dengan koran
dimasukkan ke dalam kantung dimasukkan ke dalam kantung
plastik plastik
Akar tanaman
kelapa sawit
Hasil
Daun tanaman kelapa sawit
Lampiran B. Alur Kerja Isolasi Bakteri Endofit Dari Akar
Dicuci dengan air mengalir selama 20 menit
Disterilisasi bagian permukaan akar dengan cara direndam dalam larutan etanol 75% selama 2 menit Direndam dalam larutan sodium hipoklorit 5,3% selama 5 menit
Direndam dalam larutan etanol 75% selama 30 detik Dibilas dengan akuades steril
Dikeringkan dengan kertas saring Dipotong menjadi 4 bagian
Diletakkan di atas media NA+ketokonazol 0,3 gram/ 100 ml dengan posisi bekas potongan ke arah media Diinkubasi pada suhu ruang (25o-30oC) selama ± 5 hari
Disubkultur pada media NA Akar tanaman
kelapa sawit
Akar steril
Koloni bakteri endofit
Lampiran C. Alur Kerja Isolasi Bakteri Endofit Dari Daun
Dicuci dengan air mengalir selama 20 menit Disterilisasi bagian permukaan daun dengan cara direndam dalam larutan etanol 70% selama 30 detik
Direndam dalam larutan sodium hipoklorit 3% selama 3 menit
Dibilas dengan akuades steril
Dikeringkan dengan kertas saring Dipotong seluas ± 1 cm
Diletakkan di atas media NA+ketokonazol 0,3 gram/ 100 ml
2
Diinkubasi pada suhu ruang (25o-30oC) selama ± 5 hari
Disubkultur pada media NA Daun tanaman
kelapa sawit
Daun steril
Koloni bakteri endofit
Lampiran D. Alur Kerja Karakterisasi Bakteri Endofit
Dikarakterisasi
Diamati Uji sitrat
Uji TSIA
Uji gelatin Uji motilitas
Uji pati
Uji katalase Bakteri Endofit
Pewarnaan Gram Uji Biokimia
Hasil
Lampiran E. Alur Kerja Uji Antagonis Bakteri Endofit Terhadap G. boninense
Diinokulasi lempengan inokulum G. boninense di bagian tengah media
Diinkubasi pada suhu ruang (25o-30oC) selama ± 4 hari
Dibuat jarak 1 cm dari hifa terluar G. boninense
Diletakkan cakram yang telah ditetesi Diletakkan cakram yang telah
suspensi bakteri endofit pada jarak yang ditetesi suspensi bakteri endofit
telah dibuat pada jarak yang telah dibuat
Diinkubasi pada suhu ruang (25o-30o
selama ± 7 hari Diletakkan cakram pembanding
C)
Diamati zona hambat yang terbentuk yang ditetesi antibiotik ketokonazol dengan variasi konsentrasi 0,09; 0,3; 0,6 mg/ml
Diinkubasi pada suhu ruang (25o-30o
Diamati dan dihitung panjang C) selama ± 7 hari
miselium terhambat
Media modifikasi
NA + YE 1%
Hasil
Hasil Hasil
Hasil
Lampiran F. Lokasi Penelitian
A B
C D
E
A : Perkebunan kelapa sawit Universitas Sumatera Utara (USU) Medan B : PT. Perkebunan Nusantara III Rantau Prapat Utara, Kab. Labuhan Batu C : Perkebunan kelapa sawit rakyat Rantau Prapat Selatan, Kab. Labuhan Batu D : PT. Perkebunan Nusantara II Tanjung Morawa, Kab. Deli Serdang
Lampiran G. Gambar-Gambar Penelitian
Isolat G. boninense berumur Cara melakukan uji antagonis
5 hari pada media NA+YE 1% bakteri endofit terhadap
G. boninense
Beberapa isolat biakan murni bakteri endofit
Pewarnaan Gram beberapa isolat bakteri endofit TM12A (A), PS35A (B), PS38D (C) dan PS34A (D). Perbesaran 100x.
RU09D TM12A ICM27A PS34A
Lampiran H. Deskripsi Lokasi Penelitian
No. Lokasi Penelitian Usia Tanaman Letak Astronomis Ketinggian Lokasi
1. Perkebunan Sawit Universitas Sumatera
Utara (USU) Medan ± 19 tahun
03o 098
33’ 38” LU
o 136 kaki/ 41,45 m dpl
39’ 17” BT 2. Perkebunan Sawit Islamic Centre
Medan-Pancing ± 8 tahun
03o 098
36’ 43” LU
o 82 kaki/ 24,99 m dpl
42’ 47” BT 3. PT. Perkebunan Nusantara II Tanjung
Morawa Kab. Deli Serdang ± 25 tahun
03o 098
31’ 41” LU
o 87 kaki/ 26,51 m dpl
45’ 16” BT 4. Perkebunan Sawit Tanah Jawa Kab.
Simalungun, Pematang Siantar ± 5 tahun
02o 099
53’ 50” LU
o 865 kaki/ 263,65 m dpl
09’ 48” BT 5. PT. Perkebunan Nusantara III Rantau
Prapat Utara Kab. Labuhan Batu ± 10 tahun
02o 099
06’ 89” LU
o 117 kaki/ 35,66 m dpl
49’ 58” BT 6. Perkebunan Sawit Rantau Prapat Selatan
Kab. Labuhan Batu ± 15 tahun
02o 099
06’ 00” LU
o 78 kaki/ 23,77 m dpl
Lampiran I. Data Pengukuran Faktor Fisik Lingkungan Lokasi Penelitian
No. Lokasi Penelitian
Faktor Fisik Lingkungan Suhu udara
(termometer air raksa)
Suhu tanah (soil termo)
Kelembaban udara (hygrometer)
pH tanah (soil pH tester)
1. Perkebunan Sawit Universitas
Sumatera Utara (USU) Medan 31,5
o
28
C oC 68 cm/hg 6
2. Perkebunan Sawit Islamic
Centre Medan-Pancing 29,5
o
27,5
C oC 79 cm/hg 6,4
3.
PT. Perkebunan Nusantara II Tanjung Morawa Kab. Deli Serdang
27 oC 28 oC 79 cm/hg 6,2
4.
Perkebunan Sawit Tanah Jawa Kab. Simalungun, Pematang Siantar
31,5 oC 28,5 oC 62 cm/hg 6,2
5.
PT. Perkebunan Nusantara III Rantau Prapat Utara Kab. Labuhan Batu
27 oC 28 oC 85 cm/hg 6,2
6.
Perkebunan Sawit Rantau Prapat Selatan Kab. Labuhan Batu