LATAR BELAKANG GENETIK DOMBA LOKAL YANG
TAHAN TERHADAP PARASIT CACING BERDASARKAN
CONTROL REGION
GENOM MITOKONDRIA
DELVI RIANA
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
DELVI RIANA. Latar Belakang Genetik Domba Lokal yang Tahan Parasit Cacing berdasarkan Control Region Genom Mitokondria. Dibawah bimbingan ACHMAD FARAJALLAH dan MULADNO.
Dalam penelitian untuk mencari gen-gen resisten terhadap cacing parasit telah ditemukan adanya respon fisiologis yang inkonsisten pada kelompok-kelompok domba lokal terhadap uji tantang larva cacing parasit. Penelitian ini bertujuan untuk menganalisis latar belakang genetik domba lokal yang tahan terhadap infeksi parasit cacing yaitu asal usul maternal berdasarkan ruas control region pada genom mitokondria. Tahapan metode penelitian terdiri atas isolasi DNA dari darah 36 domba ekor gemuk dan domba ekor tipis. Analisis runutan nukleotida diperoleh data yang tidak ambiguous ada sebanyak 13 (36 %) sampel, yang terdiri dari 4 domba dari Haplotipe A dan 9 domba dari Haplotipe B. Analisis rata-rata nilai Famacha (FAMC) dan jumlah Fecal Eeg Count (FEC) menunjukan adanya inkonsistensi, artinya indikasi anemia pada domba tidak berkorelasi dengan banyaknya telur cacing yang menginfestasi. Namun begitu, nilai skor FAMC dan jumlah FEC pada haplotipe A cenderung lebih rendah dibandingkan dengan haplotipe B. Dengan kata lain, haplotipe domba bukan faktor yang membedakan dalam uji tantang yang dilakukan sebelumnya.
kata kunci : tahan infeksi, latar belakang genetik, domba ekor gemuk, domba ekor tipis
ABSTRACT
DELVI RIANA. Genetic Background Parasite Resistance of Local Sheep based on Control Region Genom Mithocondria. Supervised by ACHMAD FARAJALLAH and MULADNO. In a study to find genes resistant to parasitic worms have been found inconsistent the physiological response to groups of local sheep against parasitic worm larvae challenge test. This study to analyze the genetic background of local sheep that resistant to the parasitic worm infection based of maternal origin on control region in the mitochondrial genome. Stages of research methods consisted of DNA isolated from the blood of 36 fat tail sheep and thin tail sheep. Analysis of the data obtained traces of nucleotides that is not ambiguous as many as 13 (36%) of the sample, this samples consisted of 4 sheeps from haplotype A and 9 sheeps from haplotype B. Analysis of the average value score of Famacha (FAMC) and the number of Fecal Eeg Count (FEC) shows the inconsistency, it mean is an indication of anemia in sheep did not correlate with the number of eggs of worms that infest. However, the value score of FAMC and number of FEC on haplotype A was lower compared with haplotype B. In other words, haplotype sheep is not a factor that distinguishes the challenge test performed previously.
LATAR BELAKANG GENETIK DOMBA LOKAL YANG
TAHAN TERHADAP PARASIT CACING BERDASARKAN
CONTROL REGION
GENOM MITOKONDRIA
DELVI RIANA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi
:
Latar Belakang Genetik Domba Lokal yang Tahan
terhadap Parasit Cacing Berdasarkan
Control Region
Genom Mitokondria
Nama
:
Delvi Riana
NIM
:
G34080010
Menyetujui,
Dr. Ir. Achmad Farajallah, M.Si
Pembimbing I
Prof. Dr. Ir. Muladno, MSA
Pembimbing II
Mengetahui,
Dr. Ir. Ence Darmo Jaya Supena, M.Si
Ketua Departemen Biologi
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala karunia-Nya,
sehingga karya ilmiah ini dapat diselesaikan. Penelitian dengan judul “Latar Belakang Genetik Domba Lokal yang Tahan terhadap Parasit Cacing Berdasarkan Control Region Genom Mitokondria” ini dilakukan mulai Januari 2012 sampai dengan Juni 2012 di Laboratorium Molekuler Bagian Fungsi dan Perilaku Hewan, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Penelitian ini didanai dari Prof. Dr. Ir. Muladno, MSA dan Dr. Ir. Achmad Farajallah, M.Si. Oleh karena itu, saya ucapkan terima kasih.
Terima kasih penulis ucapkan kepada Dr. Ir. Achmad Farajallah, M. Si. dan Prof. Dr. Ir. Muladno, MSA atas bimbingan dan arahan yang diberikan. Penulis juga mengucapkan terima kasih kepada Dr. Nunik Sri Ariyanti, M. Si. selaku dosen penguji wakil komisi pendidikan yang telah bersedia menguji dan memberikan saran saat ujian dan penulisan karya ilmiah. Penulis mengucapkan terima kasih kepada ayahanda Ahmad Damrah Yunus dan Ibunda Ermiwati untuk segala pengorbanannya yang juga selalu memberi doa dan dukungan. Ungkapan terima kasih juga disampaikan kepada Wildan Najmal Muttaqin, S.Si, M.Si. atas bantuan dan saran selama kerja di laboratorium; Ibu Tini, Ibu Ani, kepada teman-teman di kosan pemberi semangat Isya, Yasinta dan Nur Laeli; di biologi 45 Rani, Yanti, Lili, Dalfit, Anas, Adit, Agus, dan zoocorner serta atas bantuan dalam kerja laboratorium; serta keluarga besar dosen di zoologi atas bantuan dan saran selama penulis melakukan penelitian ini.
Penulis berharap semoga karya tulis ini dapat bermanfaat bagi perkembangan ilmu pengetahuan.
Bogor, September 2012
RIWAYAT HIDUP
Penulis dilahirkan di Payakumbuh Provinsi Sumatra Barat pada tanggal 3 Desember 1989 dari pasangan A. Damrah Yunus dan Ermiwati. Penulis merupakan anak kedelapan dari delapan bersaudara. Penulis menyelesaikan pendidikan dasar dan menengah di SDN 6 Balai Nan Tuo Tiakar pada tahun 2002, SMPN 1 Payakumbuh pada tahun 2005, dan SMAN 1 Payakumbuh pada tahun 2008. Setelah itu, penulis melanjutkan pendidikan tinggi di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui Undangan Seleksi Masuk IPB.
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 1
BAHAN DAN METODE ... 1
Sampel Darah Domba... 1
Ekstraksi dan Isolasi DNA ... 1
Amplifikasi dan Perunutan Nukleotida ... 2
Analisis Data ... 2
HASIL ... 2
PEMBAHASAN ... 4
SIMPULAN ... 5
SARAN ... 5
UCAPAN TERIMA KASIH ... 5
DAFTAR PUSTAKA ... 5
viii
DAFTAR TABEL
Halaman
1 Jarak genetik spesies Ovis aries ...... 3
2 Skor nilai uji FAMC dan jumlah FEC domba yang dianalisis ... 4
DAFTAR GAMBAR
Halaman 1 Posisi penempelan primer AF22 dan AF23 mengacu pada genom mitokondria O. aries (GenBank no.ACC. AF010406)... 22 Amplikon Control Region berpita tunggal diatas gel poliakrilamid... 2
3 Pohon filogeni antar bangsa domba dengan haplotipe A dan haplotipe B berdasarkan Control Region genom mitokondria ... 3
DAFTAR LAMPIRAN
Halaman 1 Laporan 2011 “Genetic Variation on the Control of Resistance to Infectious Diseases in Indonesian Small Ruminants for Improving Animal Productivity’’... 82 Tahapan ekstraksi dan isolasi DNA dengan metode GeneAid KIT...... 9
3 Visualisasi fragmen DNA dengan metode sensitif perak... 10
1
PENDAHULUAN
Latar Belakang
Domba (Ovis aries) merupakan salah satu ternak ruminansia kecil yang memiliki peran penting bagi kehidupan manusia, antara lain sebagai sumber protein hewani, ternak simpanan dan objek dalam tatanan sosial budaya. Budidaya domba di daerah tropis basah seperti di Indonesia sering mengalami kendala antara lain mudah terinfeksi oleh cacing parasit. Domba yang terinfeksi oleh cacing parasit akan mengalami penurunan berat badan, kualitas daging dan produksi susu (Kusumamihardja 1992).
Haemonchus contortus merupakan salah satu jenis cacing parasit yang paling banyak menginfeksi ternak ruminansia kecil. Cacing ini menyebabkan penyakit yang disebut haemonchosis, yang dapat menyebabkan anemia dan kerusakan pada saluran pencernaan. Cacing ini tidak membutuhkan inang antara. Siklus hidupnya diawali ketika di dalam tubuh inang cacing akan bertelur, kemudian telur-telur cacing dikeluarkan bersamaan dengan keluarnya feses. Jika kondisi lingkungan mendukung, maka telur cacing akan menetas yang kemudian berkembang menjadi larva di rerumputan. Larva cacing masuk ke dalam tubuh bersamaan dengan masuknya makanan, kemudian larva akan berkembang menjadi cacing dewasa di abomasum (Browning 2006).
Domba lokal Indonesia biasanya dikelompokkan dan dinamai berdasarkan daerah asalnya, misalnya domba madura, domba indramayu, domba sumbawa, domba rote, domba kisar, domba donggala, domba jawa, domba sumatra dan domba garut, sedangkan berdasarkan penampilan morfologi misalnya domba ekor tipis dan domba ekor gemuk. Selain itu, kombinasi dari keduanya misalnya domba sumatra ekor tipis, domba jawa ekor tipis dan domba jawa ekor gemuk. Artinya, domba lokal Indonesia belum bisa dikelompokkan dalam bangsa-bangsa yang saling berbeda.
Dalam penelitian untuk mencari gen-gen resisten terhadap cacing parasit telah ditemukan adanya respon fisiologis yang inkonsisten pada kelompok-kelompok domba lokal terhadap uji tantang larva cacing parasit (Muladno et al. 2011). Krisnayana (2011) menduga bahwa domba-domba lokal di Indonesia mempunyai potensi kekebalan terhadap infeksi H. contortus. Untuk itu, dalam penelitian ini kami melakukan
pelacakan asal-usul maternal domba yang digunakan oleh keduanya (Lampiran 1) menggunakan penanda genetik control region genom mitokondria. Hal ini dimaksudkan untuk menentukan kepastian bangsa domba lokal yang digunakan. Dengan begitu, penelitian ini diharapkan menjadi kunci penting untuk menerangkan adanya potensi kekebalan domba lokal terhadap cacing H. contortus. Gill (1991) melaporkan telah menemukan bangsa domba Merino di Australia yang tahan terhadap infeksi cacing H. contortus. Bangsa-bangsa domba lain di dunia juga banyak dilaporkan tahan terhadap infeksi H. contortus (di-review dalam Soulsby 1982).
Meadows (2005) menyebutkan bahwa ruas control region genom mitokondria banyak digunakan untuk menjelaskan kompleksitas dan asal usul genetik pada domba. Control region memiliki tingkat polimorfisme tinggi dan mempunyai laju mutasi yang lebih cepat dibandingkan dengan ruas lain genom mitokondria, hal ini menyebabkan urutan nukleotida control region sangat bervariasi antar individu. Berdasarkan runutan nukleotida ruas control region, domba di dunia dikelompokkan menjadi dua kelompok garis keturunan, yaitu domba haplotipe A (Tipe Asia) dan domba haplotipe B (Tipe Eropa) (Muttaqin 2010). Selain itu, berdasarkan bagian yang lain dari ruas genom mitokondria, domba dikelompokkan menjadi beberapa garis keturunan yaitu haplotipe D, E dan F (Wood & Phua 1996; Hiendleder 1998).
Tujuan
Penelitian ini bertujuan menganalisis latar belakang genetik Ovis aries yang menjadi sampel uji tantang larva parasit cacing Haemonchus contortus berdasarkan control region genom mitokondria.
BAHAN DAN METODE
Sampel Darah Domba
2
Ekstraksi dan Isolasi DNA
Molekul DNA total diekstrasi dari sel-sel darah menggunakan DNA Extraction Kit for animal blood (Geneaid) yang dimodifikasi untuk sampel darah yang disimpan dalam alkohol 70% (Lampiran 2).
Amplifikasi dan Perunutan Nukleotida Amplifikasi ruas control region genom mitokondria dilakukan menggunakan primer
foward AF22 5’GCGTACGCAATCTTACG ATCA dan primer reverse AF23 5’ATGCA GTTAAGTCCAGCTAC. Primer AF22 dan AF23 menempel pada sebagian daerah Cytb, tRNA dan sebagian besar control region dengan ukuran 1390 bp (Gambar 1). Komposisi pereaksi PCR dalam volume 50 l terdiri atas sampel DNA sekitar 10-100 ng, primer reverse dan primer forward masing-masing 2 µL, 2.5 mM dNTP, 0.4 unit Taq Polimerase dan 0.25 mM buffer yang mengandung MgCl2. Reaksi PCR dilakukan
dengan kondisi pradenaturasi 94oC selama 10 menit kemudian 25 siklus yang terdiri atas tahap denaturasi pada suhu 94oC selama 4 menit, tahap penempelan primer pada suhu 60oC selama 1 menit, tahap pemanjangan ruas DNA pada suhu 72oC selama 1,5 menit,dan diakhiri dengan tahapan pemanjangan akhir ruas DNA pada suhu 72oC selama 7 menit. Total siklus PCR adalah 25 siklus.
Amplikon diuji dengan metode polyacrilamide gel electrophoresis (PAGE) 6% yang dijalankan pada tegangan 250 V selama 30 menit kemudian dilanjutkan dengan pewarnaan sensitif perak (Lampiran 3, Byun
et al. 2009). Sampel dengan kualitas amplikon yang menampilkan pita tunggal pada gel poliakrilamid selanjutnya dijadikan cetakan dalam reaksi PCR for sequencing dengan metode big dye terminator menggunakan primer yang sama dengan amplifikasi awal. Analisis Data
Hasil runutan nukleotida setiap sampel diedit dan saling disejajarkan antar mereka menggunakan ClustalW 1.8 yang terdapat dalam MEGA v5 (Tamura et al. 2011). Pensejajaran kemudian melibatkan runutan nukleotida haplotipe A (tipe Asia, No. ACC. AF010406) dan haplotipe B (tipe Eropa, No. ACC. AF010407) (Lampiran 4). Analisis DNA berikutnya meliputi jarak genetik berdasarkan model substitusi Kimura 2 Parameter dan rekonstruksi pohon filogeni menggunakan metode Neighbor Joining dengan uji bootstrap 1000x. Jarak genetik dan pohon filogeni kemudian diplotkan terhadap hasil uji tantang infeksi cacing menggunakan model linear umum (general linear model).
HASIL
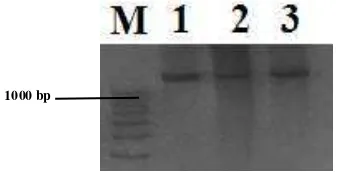
Tingkat keberhasilan amplifikasi PCR ruas CR domba dengan kualitas pita tunggal dan tebal pada gel polyacrilamide gel electrophoresis (PAGE) 6% (Gambar 2) adalah 75% atau 27 dari 36 sampel. Runutan nukleotida hasil sekuensing yang bisa dibaca dengan baik dan tidak memberikan data yang ambiguada sebanyak 13 (36%) sampel.
Dari 535 nt (nukleotida) yang saling sejajar, 471 nt ditemukan sama antar sampel dan 64 ditemukan berbeda. Dari 64 nt yang berbeda, 26 nt berupa transisi dan 38 nt transversi. Rasio antara transisi dan tranversi rata-rata sebesar 0.68. Jarak genetik terjauh
[image:10.595.323.492.513.599.2]adalah 0.22, yaitu antara sampel No. 25 DET dengan Haplotipe A dan jarak terdekat adalah 0.03, yaitu antara sampel No. 22 DET, 23 DET, dan 26 DET dengan sampel No. 1 DEG, serta sampel No. 11 DEG dengan sampel No. 10 DEG (Tabel 1).
Gambar 1 Posisi penempelan primer AF22 dan AF23 mengacu pada genom mitokondria O. aries
(GenBank no. ACC. AF010406 dan AF010407) [Cyt b; tRNA Thr ; tRNA Pro; d-loop].
Gambar 2 Amplikon ruas control region yang
memperlihatkan kualitas pita tunggal berukuran 1390 bp pada gel poliakrilamid. M = DNA ladder 100 bp, 1, 2 dan 3= lintasan sampel
3
Hasil rekonstruksi filogeni menemukan bahwa haplotipe A mengelompok bersama-sama dengan sampel No. 2 DEG, 22 DET, 23 DET dan 26 DET ; dan haplotipe B
mengelompok bersama-sama dengan sampel No. 2 DEG, 8 DEG, 10 DEG, 11 DEG, 13 DEG, 18 DEG, 25 DET, 27 DET, dan 40 DET (Gambar 3).
Tabel 1 Jarak genetik antar sampel domba ekor gemuk (DEG), domba ekor tipis (DET), haplotipe A dan haplotipe B berdasarkan model subtitusi Kimura 2 Parameter
Sampel H ap A 1 DE G 22 DE T 23 DE T 26 DE T 2 DE G 8 DE G 10 DE G 11 DE G 13 DE G 18 DE G 25 DE T 27 DE T 40 DE T Hap A 1 DEG 0,11
22 DET 0,11 0,03
23 DET 0,11 0,03 0,04
26 DET 0,12 0,03 0,05 0,05
2 DEG 0,17 0,10 0,11 0,12 0,11
8 DEG 0,15 0,06 0,09 0,08 0,08 0,07
10 DEG 0,15 0,06 0,07 0,07 0,07 0,05 0,04
11 DEG 0,15 0,07 0,09 0,07 0,09 0,06 0,04 0,03
13 DEG 0,17 0,08 0,10 0,10 0,10 0,07 0,05 0,05 0,06
18 DEG 0,17 0,09 0,11 0,11 0,12 0,09 0,06 0,06 0,05 0,07
25 DET 0,22 0,14 0,15 0,15 0,16 0,11 0,11 0,10 0,12 0,10 0,10
27 DET 0,16 0,09 0,10 0,11 0,11 0,08 0,06 0,06 0,07 0,06 0,08 0,07
40 DET 0,20 0,13 0,14 0,14 0,15 0,12 0,10 0,09 0,10 0,10 0,07 0,12 0,10
Hap B 0,16 0,09 0,11 0,10 0,11 0,08 0,04 0,05 0,04 0,07 0,07 0,12 0,08 0,10
4
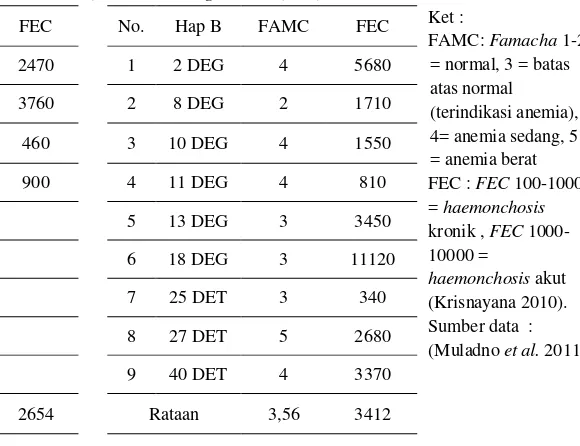
Domba Haplotipe A memiliki rata-rata nilai Famacha (FAMC) adalah sebesar 3,4 dan jumlah rata-rata FEC adalah sebesar 2654, sedangkan domba dari Haplotipe B memiliki rata-rata nilai FAMC sebesar 3,56 dan jumlah
[image:12.595.217.507.165.388.2]rata-rata Fecal Eeg Count (FEC) adalah 3412. Kedua nilai tersebut tidak dapat dibedakan (P<0.01), walaupun ada kecenderungan haplotipe A lebih tahan terhadap infeksi cacing parasit (Tabel 2).
Tabel 2 Hasil nilai uji Famacha (FAMC) dan Fecal Eeg Count (FEC) domba
No. Hap A FAMC FEC No. Hap B FAMC FEC Ket :
FAMC: Famacha 1-2 = normal, 3 = batas atas normal (terindikasi anemia), 4= anemia sedang, 5 = anemia berat FEC : FEC 100-1000 = haemonchosis
kronik , FEC 1000-10000 =
haemonchosis akut (Krisnayana 2010). Sumber data : (Muladno et al. 2011)
1 1 DEG 4 2470 1 2 DEG 4 5680
2 22 DET 1 3760 2 8 DEG 2 1710
3 23 DET 4 460 3 10 DEG 4 1550
4 26 DET 4 900 4 11 DEG 4 810
5 13 DEG 3 3450
6 18 DEG 3 11120
7 25 DET 3 340
8 27 DET 5 2680
9 40 DET 4 3370
Rataan 3,4 2654 Rataan 3,56 3412
PEMBAHASAN
Domba memiliki banyak manfaat bagi manusia, antara lain dapat diperoleh daging dan susunya sebagai sumber protein dan lemak hewani, bulunya sebagai bahan dasar tekstil, serta sebagai objek tatanan sosial budaya seperti pada kegiatan adat seperti adu domba tangkas. Namun pemanfaatan domba sering tidak maksimal karena adanya gangguan dari parasit seperti cacing Haemonchus contortus yang mengakibatkan domba sakit bahkan mati sebelum domba dapat dimamfaatkan. Keadaan tersebut sering diatasi menggunakan obat-obatan kimia yang seringkali melebihi dosis yang ditentukan. Akibatnya, sebagian parasit menjadi kebal terhadap obat. Pendekatan genetik dengan mencari domba-domba lokal yang diketahui memiliki fenotipe tahan infeksi parasit diharapkan mampu mengatasi ketergantungan terhadap obat dan mencegah kekebalan parasit terhadap obat.
Domba yang ada sekarang merupakan hasil domestikasi diturunkan dari 3 jenis domba liar, yaitu Mouflon (Ovis musimon) yang berasal dari Eropa Selatan dan Asia Kecil, Argali (Ovis amon) berasal dari Asia Tenggara, Urial (Ovis vignei) yang berasal dari Asia. Di Indonesia, khususnya di Jawa, ada 2 jenis domba yang terkenal, yakni domba
ekor gemuk yang banyak terdapat di daerah Jawa Tengah dan Jawa Timur dan domba ekor tipis yang banyak terdapat di Jawa Barat. Hasil rekonstruksi pohon filogeni menggunakan metode Neighbor Joining dengan uji bootstrap 1000x dan hasil analisis jarak genetik dapat diartikan bahwa sampel yang berasal dari domba ekor gemuk (DEG) dan ekor tipis (DET) menyebar secara acak terhadap pengelompokan berdasarkan penanda molekuler menggunakan genom mitokondria. Dengan kata lain ada kecenderungan terjadinya kawin silang antar bangsa domba yang menyebabkan hal tersebut terjadi. Suparyanto (1998) menyatakan bahwa bangsa dan kelompok domba di Indonesia dibedakan berdasarkan morfologi. Salah satu ciri pembeda bangsa domba yaitu panjang, lebar dan tebal ekor. DEG dan DET dikelompokkan kedalam spesies yang sama yang memungkinkan terjadinya inbreeding antar bangsa domba.
5
Indonesia yang diketahui memiliki banyak ragam domba lokal, ternyata hanya terdapat 2 haplotipe yaitu A dan B (Muttaqin 2010).
FAMC adalah uji indikasi tingkat anemia pada domba dengan cara melihat tingkat kecerahan warna darah pada bagian bawah mata domba, skor nilai FAMC 1-2 menunjukkan bahwa domba normal, nilai 3 batas atas, nilai 4 anemia sedang, dan nilai 5 untuk tingkatan anemia berat. Sedangkan nilai FEC adalah nilai yang menunjukan jumlah telur cacing per gram feses, rentan nilai FEC untuk indikasi haemonchosis yakni jumlah 100-1000 untuk haemonchosis kronik dan jumlah lebih besar dari 10000 untuk haemonchosis akut (Krisnayana 2010).
Perbandingan skor nilai FAMC dan jumlah FEC pada domba Haplotipe A dan Haplotipe B tidak dapat dibedakan (P<0.01). Analisis rata-rata nilai FAMC dan jumlah FEC menunjukan adanya inkonsistensi, artinya indikasi anemia pada domba tidak berkorelasi dengan banyaknya telur cacing yang menginfestasi. Namun begitu, nilai skor FAMC dan jumlah FEC pada haplotipe A cenderung lebih rendah dibandingkan dengan haplotipe B.
SIMPULAN
Domba di Indonesia dikelompokkan atas dua garis keturunan maternal yaitu Haplotipe A (tipe Asia) dan Haplotipe B (tipe Eropa). Haplotipe domba berdasarkan control region genom mitokondria bukan faktor yang dapat membedakan dalam penelitian terkait FAMC, FEC dan indikasi anemia yang dilakukan sebelumnya.
SARAN
Perlu penelitian lebih lanjut dan intensif untuk mencari gen-gen kekebalan terhadap cacing dari haplotipe-haplotipe domba lokal di Indonesia. Ada potensi domba lokal Indonesia sehingga resisten terhadap cacing. Verifikasi jenis-jenis domba lokal Indonesia diperlukan untuk budidaya domba yang lebih baik.
UCAPAN TERIMA KASIH
Ucapan terima kasih disampaikan kepada Sdr. Wildan Najmal Muttaqin yang telah membantu proses prelab dan menyediakan data infeksi cacing parasit Haemonchus contortus.
DAFTAR PUSTAKA
Browing MLL. 2006. Haemonchus contortus (Barber Pole Worm) Infestation in Goats. J Anim Sci: 78.
Byun SO, Fang Q, Zhou H, Hickford JGH. 2009. An effective method for silver-staining DNA in large numbers of polyacrylamide gels. Anal Biochem 385: 174-175.
Gill HS. 1991. Genetic control of acquired resistance to haemonchosis in Merino lambs. Parasite Immunol 13: 617-628. Hiendleder S. 1998. A low rate of replacement
substitusion inteo major Ovis aries mitochondrial genomes. Anim Genet. 29: 116-122.
Tamura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S. 2011. MEGA5: Molecular Evolutionary Genetics Analysis using Maximum Likelihood, Evolutionary Distance, and Maximum Parsimony Methods. Molecular Biology and Evolution.
Krisnayana IMP. 2011. Pengaruh Infeksi Larva-3 Haemonchus contortus terhadap potensi kekebalan dan gambaran darah domba ekor tipis [skripsi]. Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Kusumamihardja S. 1992. Parasit dan Parasitologi pada Hewan Ternak dan Piaraan di Indonesia. Bogor : Pusat Antar Universitas Bioteknologi.
Meadows, Li K, Kantanen J, Tapio M, Sipos W, Pardehis V, Gupta V, Calvo JH, Whan V, Norris B, Kijas JW. 2005. Mitochondrial sequence reveals high levels of gene flow between breeds of domestic sheep from Asia to Europe. J Hered. 96: 494-501.
Muladno, Farajallah A, Estuningsih SE, Najmal MW. 2011. Genetic Variation on the Control of Resistance to Infectious Diseases in Indonesian Small Ruminants for Improving Animal Productivity. In press
Muttaqin MW. 2010. Philogeny and genetic diversity of Indonesian local sheep based on mitochondrial DNA control region and SRY gene [tesis]. Bogor. Program Pacsasarjana, Institut Pertanian Bogor. Pidancier N, Jordan S, Luikart G, Taberlet P.
6
40: 739-749.
Suparyanto S, Purdawaria T, Subandrio. 1999. Pendugaan jarak genetik dan faktor peubah pembeda bangsa dan kelompok domba di indonesia melalui pendekatan analisis morfologi. Jurnal Ilmu Ternak dan Veteriner 4: 80-87.
Soulsby EJL. 1982. Helminths, Arthropods, and Protozoa of Domesticated Animals. London: Bailliere Tindall.
7
8 Lampiran 1 Laporan 2011 “Genetic Variation on the Control of Resistance to Infectious Diseases in Indonesian Small Ruminants for Improving Animal Productivity’’
H0 24/25 juni H+28 H+35 H+42
Pen/ID PCV FEC BW FAMC PCV FEC Fin 32d BW FAMC PCV FEC BW FAMC PCV FEC (x40) BW FAMC
1 28 0 12,1 22 4680 14,10 14,31 14,01 4 26 6280 14,69 4 25 2470 13,9 4
2 31 0 13,9 27 1800 14,79 14,88 14,58 2 27 6730 15,32 3 25 5680 14,7 4
8 28 0 11,8 26 600 13,23 13,38 13,08 2 26 2460 13,53 3 23 1710 12,6 2
10 24 0 10,8 21 480 11,61 11,7 11,4 4 20 160 11,84 4 24 1550 10,9 4
11 23 0 11,3 20 3840 12,21 12,31 12,01 4 21 2640 12,81 4 22 810 11,55 4
13 31 0 12,7 23 2260 13,83 13,95 13,65 4 25 3290 12,04 4 28 3450 12,96 3
18 28 0 12 29 480 13,21 13,34 13,04 4 30 2020 12,6 4 32 11120 12 3
22/DT01 29 0 16,5 27 3600 18,14 18,32 17,7 2 28 7600 17,6 2 27 3760 16,8 1
23/BT 26 0 11,7 24 0 13,92 14,16 13,86 3 27 60 13,79 3 25 460 13,04 4
25/BT 31 0 11,4 26 3600 13,56 13,79 13,49 3 28 960 12,24 4 27 3040 11,81 3
26/BT 22 0 11 23 1800 13,91 14,22 12,85 4 22 2460 13,06 4 25 900 11,83 4
27/BT 25 0 10 14 3000 11,35 11,49 11,19 4 21 7000 10,37 5 21 2680 10,4 5
40/CT 24 0 10,7 26 5400 11,88 12,01 11,45 4 22 5940 11,7 4 22 3370 11,06 4
Keterangan : BW = Body Weigth FEC = Faecal Egg Count FAMC = Famacha
9
Sebanyak 2 ml sampel darah domba yang disimpan dalam alkohol 70% dan EDTA ditambahkan dengan 200 µl buffer GB dan vortex selama 5 detik. Inkubasi pada suhu 700C selama 20 menit, dibolak-balik secara perlahan. Pada saat yang bersamaan, inkubasi buffer elusi pada suhu yang sama untuk step elusi DNA.
Sebanyak 200 µl etanol ditambahkan ke dalam tabung dan vortex selama 10 detik. Sampel dipindahkan ke dalam kolom GD pada tube 2 ml. Sentrifugasi 13.000 rpm selama 2 menit.
Kolom GD dipindahkan ke dalam tabung koleksi yang baru dan supernatan dibuang. Sebanyak 400 µl buffer W1 ditambahkan ke dalam tabung. Sentrifugasi 13.000 rpm selama 30 detik.
Supernatan dibuang dan kolom GD diletakkan kembali ke dalam tabung. Sebanyak 600 µl wash buffer (mengandung etanol) ditambahkan ke dalam kolom GD. Sentrifugasi 13.000 rpm selama 30 detik. Supernatan dibuang dan kolom GD diletakkan kembali ke dalam tabung. Sentrifugasi 13.000 rpm selama 3 menit.
Kolom GD dipindahkan ke dalam tube 1,5 ml yang baru. Sebanyak 100 µl buffer elusi yang telah diinkubasi ditambahkan ke dalam kolom GD (tepat bagian tengah matriks kolom GD). Diamkan selama 5 menit. Sentrifugasi 13.000 rpm selama 30 detik. Kolom GD dibuang dan didapatkan DNA yang telah berhasil diekstraks.
10
Gel yang telah dielektroforesis kemudian dikeluarkan dari kaca dan dibilas dengan DW (air destilata) sebanyak 200 ml.
Air destilata dibuang*, gel direndam dalam larutan A.Gel direndam dalam larutan A selama 8 menit. Pada saat yang bersamaan, larutan B dipanaskan pada suhu 550C. Kemudian air larutan A dibuang ke dalam botol khusus Ag.
Gel dibilas dengan DW sebanyak 200 ml, kemudian DW dibuang. Gel direndam dalam larutan B yang telah ditambahkan formaldehid. Gel direndam hingga muncul pita. Air larutan B dibuang. Gel direndam dalam larutan C selama 2 menit.
Persiapan penyimpanan gel.
Catatan:
Larutan 1: DW 200 ml AgNO3 0,2 gram
NaOH 10N 80 µl amonia 0,8 ml Larutan 2: DW 200 ml NaOH 6 gram Formaldehid 100 µl Larutan 3: DW 100 ml
Asetat 100 µl
*Setiap larutan dibuang dengan cara dihisap/disedot menggunakan alat vakum penyedot.
11
Lampiran 4 Runutan nukleotida Control Region Ovis aries
1 1111111112 2222222223 3333333334 4444444445 5555555556 6666666667 7777777778 ] 1234567890 1234567890 1234567890 1234567890 1234567890 1234567890 1234567890 1234567890 ]
12
1 1111111111 1111111111 1111111111 1111111111 1111111111 1111111111 ] 8888888889 9999999990 0000000001 1111111112 2222222223 3333333334 4444444445 5555555556 ] 1234567890 1234567890 1234567890 1234567890 1234567890 1234567890 1234567890 1234567890 ]
13
14
15
3333333333 3333333333 3333333333 3333333333 3333333333 3333333333 3333333333 3333333334 ] 2222222223 3333333334 4444444445 5555555556 6666666667 7777777778 8888888889 9999999990 ] 1234567890 1234567890 1234567890 1234567890 1234567890 1234567890 1234567890 1234567890 ] ATGTATAAAG TACATTAAAT -GATTTGCCC CATGCGTATA AGCACGTACA TAACATTAAT -GTAATATAG ACATTATAT- ... ... -...A... ... ... ...T... -....C.... ...- ... ... -...A... ...G... ... ...T... -.G... ...T.- ... ... -...A... ... ... ...T... -.G... ...- ...T... ... -...A... ... -... ...T..-... -.-G... ....-....- ....T...-. ...- T...A..T -....A.... G..-..G... ..GT... -.G... ..G....TG- ... ... -...A..T ...A.... ... ..GT... -... ....C....- ... ...- T...A..T ...A.... ... ..GT... -... ...- ... ...A T...A..T ...A.... ... ..GT... -... ...- ....T.-... ... -...A... ...A.... ...C..G... ..GT... -.G...T..A ....C....- ...TG.. ... C...A..T ..G..A.... ...C ..GT... -.GG... ..C.C....-
T...T...G. .-...G -....-A... ..G..A-... ...C..C-.C ..GT-....- -.GG... ..-.CCAT.-
16
17