ABSTRAK
HADI WINATA. Aktivitas Antioksidan dan Kandungan Kimiawi Ekstrak Daun Wungu
(Graptophyllum pictum L.Griff.). Dibimbing oleh MARIA BINTANG dan
WARAS NURCHOLIS.
ABSTRACT
HADI WINATA. Antioxidant Activity and Chemical Contens The leaf Extract of
Wungu (Graptophyllum pictum L. Griff.). Under the direction of MARIA
BINTANG and WARAS NURCHOLIS.
Graptophyllum pictum L. Griff., a plant that originated from Papua and
Polynesia, is believed to have antioxidant activity. This study aimed to examine of
antioxidant activity and chemical content of Graptophyllum pictum L. Griff.
leaves. Also, it was designed to determine the best extracting solvent that provides
the highest antioxidant activity. This study used four different solvents, which
were the solvent water, ethanol 30%, ethanol 70%, and ethanol 96%. Extracts of
each solvent were studied to determine the presence or absence of the antioxidant
activity and chemical content by using vitamin C as a comparison. The
antioxidant activity of water extract, ethanol 30%, ethanol 70%, and ethanol 96%
extract were determined using the DPPH (2,2 diphenyl-1-picryl-hydrazyl) with a
spectrophotometer at a wavelength of 517 nm. Phytochemical test showed that
water extract, ethanol 30%, ethanol 70%, and ethanol 96% Graptophyllum pictum
L. Griff. leaves contain alkaloids and flavonoids. Ethanol 30% and ethanol 70%
extract were contained saponin. Ethanol 70% and ethanol 96% extract contained
tannins and steroids. Antioxidants activity test (IC
50) of four types of solvents
showed that the antioxidant activity is not active on four types of solvent used, but
ethanol 70% extract of Graptophyllum pictum L. Griff. leaves has a weak
antioxidant activity with IC
50of 257.79 ppm. It can be concluded that water,
ethanol 30%, ethanol 96% extract Graptophyllum pictum L. Griff. leaf have no
PENDAHULUAN
Keseimbangan antara kandungan radikal bebas dan antioksidan di dalam tubuh merupakan salah satu faktor yang mempengaruhi kesehatan manusia. Stres oksidatif adalah keadaan yang ditandai oleh ketidakseimbangan antara oksidan dan antioksidan dalam tubuh. Akibat stres oksidatif adalah penyakit kanker, diabetes melitus, dan lain-lain. Berdasarkan data dari WHO pada tahun 2005-2030 akan ada peningkatan jumlah penderita kanker hingga tiga kali lipat. WHO juga menyatakan 70 persen penderita kanker berada di negara-negara berkembang. Data dari Union Internationale Contre le Cancer (UICC) dan WHO menyebutkan pada tahun 2004 angka kematian akibat kanker dan diabetes melitus diperkirakan mencapai 7 juta orang, dua kali lebih banyak dari angka kematian yang disebabkan oleh HIV/AIDS. Hal ini disebabkan karena pada masa sekarang ini sebagian besar manusia tidak mendapatkan asupan antioksidan yang cukup dari makanan yang dikonsumsi. Sehingga radikal bebas menjadi sangat dominan di dalam tubuh. Hal ini yang melatarbelakangi timbulnya berbagai macam penyakit seperti, jantung koroner, kanker, diabetes melitus, hati, dan penuaan dini (Widjaya 1996).
Antioksidan adalah senyawa stabil yang dapat memberikan elektronnya kepada molekul radikal bebas sehingga dapat menetralisir atau melawan radikal bebas dan memberi perlindungan kepada tubuh dari ancaman radikal bebas (Kumalaningsih 2007). Aktifitas suatu bahan sebagai antioksidan dipengaruhi oleh konsentrasi bahan antioksidan tersebut. Semakin tinggi konsentrasinya maka aktifitas antioksidannya akan semakin tinggi pula. Akan tetapi antioksidan yang ideal adalah antioksidan yang memiliki aktifitas inhibisi radikal bebas pada konsentrasi rendah. Selain itu antioksidan yang ideal harus memiliki ketahanan terhadap faktor fisik (daya tahan terhadap suhu dan cahaya), kimia (daya tahan terhadap pH dan oksigen), serta nilai toksisitas yang aman (Gordon 1990). Secara alami, tubuh menghasilkan senyawa antioksidan. Namun, tidak cukup kuat untuk berkompetisi dengan radikal bebas yang dihasilkan oleh tubuh setiap harinya (Hernani & Rahardjo 2005). Kekurangan antioksidan dalam tubuh dapat diatasi melalui asupan dari luar yang banyak mengandung antioksidan. Salah satu cara menanggulangi kekurangan antioksidan
dari dalam tubuh yaitu memanfaatkan sumber antioksidan yang berasal dari luar tubuh. Salah satu sumber antioksidan yang berasal dari luar tubuh dapat diperoleh dari tanaman dan antioksidan sintetik. Namun, antioksidan sintetik mempunyai kelemahan dapat menimbulkan efek samping yang tidak baik jika dikonsumsi dalam jangka waktu yang panjang. Oleh karena itu tanaman dimanfaatkan sebagai antioksidan alami yang tidak berbahaya bagi tubuh. Senyawa antioksidan yang terdapat dalam tanaman antara lain asam linoleat, flavonoid, tokoferol, dan tanin tersebar pada berbagai bagian tanaman seperti daun, akar, batang, biji, dan bunga (Sidik 1997 dalam Kurtubi 2006). Indonesia khususnya daerah Papua memiliki keanekaragaman hayati yang melimpah, merupakan sumber utama tanaman obat yang ada di Indonesia dan mengandung metabolit sekunder seperti alkaloid, saponin, dan tanin yang mempunyai potensi sebagai antioksidan alami. Salah satu tanaman yang diduga berpotensi sebagai antioksidan adalah tanaman wungu (Graptophyllum pictum L. Griff.) khususnya daun wungu. Daun wungu mengandung alkaloid yang tidak beracun, glikosida, steroid, saponin, klorofil dan lendir (mukopolisakarida). Batang daun tumbuhan wungu mengandung kalsium oksalat, asam formik, dan lemak (Dalimartha 1999).
Penelitian secara ilmiah mengenai daun wungu masih terbatas, sampai saat ini daun wungu dipercaya berkhasiat sebagai peluruh kencing (diuretik), mempercepat pemasakan bisul, pencahar ringan (laksatif), dan pelembut kulit (emoliens). Sedangkan bunganya berkhasiat sebagai pelancar haid (Dalimartha 1999). Dari studi literatur yang dilakukan, telah diteliti bahwa di dalam rebusan daun tumbuhan wungu tersebut dapat menghilangkan gejala hemoroid eksternum derajat II (Hernani Rahardjo 2005). Umi Kalsum et.al 1995 juga telah meneliti peran senyawa alkaloida yang terdapat dalam ekstrak etanol daun tumbuhan wungu yang memiliki efek analgesik/anti inflamasi dan penghambat pembentukan prostaglandin. Akan tetapi penelitian mengenai khasiat antioksidan daun wungu belum dilakukan.
2
L. Griff.) memiliki aktivitas antioksidan dan mengandung senyawa kimia yang berpotensi sebagai antioksidan serta diperoleh pelarut yang baik dalam separasi ekstrak kasar yang memiliki senyawa aktif sebagai antioksidan. Penelitian ini diharapkan memberikan informasi ilmiah tentang potensi ekstrak daun wungu sebagai antioksidan alami yang dapat dipakai secara luas oleh masyarakat.
TINJAUAN PUSTAKA
Daun Wungu (Graptophyllum pictum L.Griff.)
Tanaman Wungu asalnya dari Irian dan Polynesia, dapat ditemukan dari dataran rendah sampai pegunungan dengan ketinggian 1.250m dpl. Perdu atau pohon kecil, dengan tinggi 1,5-3 m, batang berkayu. Kulit dan daun berlendir dan baunya kurang enak. Cabang bersudut tumpul, berbentuk galah dan beruas rapat. Daun tunggal, bertangkai pendek, letaknya berhadapan bersilang, bulat telur sampai lanset, ujung dan pangkal runcing, tapi bergelombang, pertulangan menyirip, panjang 8-20 cm, lebar 3-13 cm, permukaan atas warnanya ungu mengilap. Perbungaan majemuk, keluar di ujung batang, tersusun dalam rangkaian berupa tandan yang panjangnya 3-12 cm, warnanya merah keunguan. Buahnya buah kotak, bentuknya lonjong, warnanya ungu kecoklatan. Pada umumnya memiliki dua biji, bentuknya bulat, dan warnanya putih. Tumbuhan wungu sering ditemukan tumbuh liar di pedesaan atau ditanam sebagai tanaman hias dan tanaman pagar. Tumbuh baik pada tempat-tempat terbuka yang terkena sinar matahari, dengan iklim kering atau lembab.
Ada tiga varietas, yaitu berdaun ungu, berdaun hijau dan belang-belang putih. Yang digunakan sebagai obat adalah varietas berdaun ungu yang dinamakan Graptophyllum pictum(L.)Griff.var luridosanguineum Sims. Tumbuhan ini berbunga sepanjang tahun, namun di Jawa jarang sekali menghasilkan buah. Perbanyakan dengan stek batang. Batang daun tumbuhan wungu mengandung kalsium oksalat, asam formiat, dan lemak. Daun berkhasiat sebagai peluruh kencing (diuretik), mempercepat pemasakan bisul, pencahar ringan (laksatif), dan pelembut kulit (emoliens). Sedangkan bunganya berkhasiat sebagai pelancar haid (Dalimartha 1999).
Dalam sistematika (taksonomi) tumbuhan wungu diklasifikasikan sebagai berikut; kingdom Plantae, divisi Spermatophyta, kelas Dicotyledonae, ordo Tubiflorae, famili
Gambar 1 Daun wungu (Graptophyllum pictum L.Griff.) (Dalimartha 1999)
Acanthaceae, genus Graptophyllum, spesies Graptophyllum pictum, dan nama umum Wungu (Dalimartha 1999).
Daun tumbuhan ini mengandung alkaloida yang tidak beracun, glikosida, steroida, saponin, klorofil dan lendir. Batang daun tumbuhan wungu mengandung kalsium oksalat, asam formik, dan lemak (Dalimartha 1999).
Antioksidan
Antioksidan adalah senyawa yang dapat menetralisir radikal bebas dengan cara menyumbangkan elektronnya pada senyawa radikal bebas. Senyawa antioksidan dapat mencegah kerusakan yang ditimbulkan oleh radikal bebas terhadap sel normal, protein, dan lemak. Berdasarkan sumbernya antioksidan dibagi menjadi antioksidan endogen (berasal dari dalam tubuh) dan eksogen (berasal dari luar tubuh) (Kumalaningsih 2007).
Antioksidan endogen merupakan antioksidan yang dapat disintesis oleh tubuh. Contoh dari antioksidan endogen antara lain superoksida dismutase (SOD), katalase, dan peroksidase. SOD merupakan salah satu jenis antioksidan endogen yang mampu mengkatalisis radikal bebas superoksida (•O2)
menjadi hidrogen peroksida (H2O2), sehingga
SOD disebut sebagai scavenger atau pembersih superoksida (•O2 -). Katalase
merupakan senyawa hemotetramer dengan kofaktor Fe, dan dapat ditemukan pada hewan maupun tumbuhan. Katalase dapat mengkatalisis berbagai peroksida dan radikal bebas menghasilkan oksigen dan air. Superoksida adalah kelas enzim oksidoreduktase yang berfungsi mengatalisis substrat organik dengan H2O2 dan
mereduksinya menjadi H2O. Peroksidase
2
L. Griff.) memiliki aktivitas antioksidan dan mengandung senyawa kimia yang berpotensi sebagai antioksidan serta diperoleh pelarut yang baik dalam separasi ekstrak kasar yang memiliki senyawa aktif sebagai antioksidan. Penelitian ini diharapkan memberikan informasi ilmiah tentang potensi ekstrak daun wungu sebagai antioksidan alami yang dapat dipakai secara luas oleh masyarakat.
TINJAUAN PUSTAKA
Daun Wungu (Graptophyllum pictum L.Griff.)
Tanaman Wungu asalnya dari Irian dan Polynesia, dapat ditemukan dari dataran rendah sampai pegunungan dengan ketinggian 1.250m dpl. Perdu atau pohon kecil, dengan tinggi 1,5-3 m, batang berkayu. Kulit dan daun berlendir dan baunya kurang enak. Cabang bersudut tumpul, berbentuk galah dan beruas rapat. Daun tunggal, bertangkai pendek, letaknya berhadapan bersilang, bulat telur sampai lanset, ujung dan pangkal runcing, tapi bergelombang, pertulangan menyirip, panjang 8-20 cm, lebar 3-13 cm, permukaan atas warnanya ungu mengilap. Perbungaan majemuk, keluar di ujung batang, tersusun dalam rangkaian berupa tandan yang panjangnya 3-12 cm, warnanya merah keunguan. Buahnya buah kotak, bentuknya lonjong, warnanya ungu kecoklatan. Pada umumnya memiliki dua biji, bentuknya bulat, dan warnanya putih. Tumbuhan wungu sering ditemukan tumbuh liar di pedesaan atau ditanam sebagai tanaman hias dan tanaman pagar. Tumbuh baik pada tempat-tempat terbuka yang terkena sinar matahari, dengan iklim kering atau lembab.
Ada tiga varietas, yaitu berdaun ungu, berdaun hijau dan belang-belang putih. Yang digunakan sebagai obat adalah varietas berdaun ungu yang dinamakan Graptophyllum pictum(L.)Griff.var luridosanguineum Sims. Tumbuhan ini berbunga sepanjang tahun, namun di Jawa jarang sekali menghasilkan buah. Perbanyakan dengan stek batang. Batang daun tumbuhan wungu mengandung kalsium oksalat, asam formiat, dan lemak. Daun berkhasiat sebagai peluruh kencing (diuretik), mempercepat pemasakan bisul, pencahar ringan (laksatif), dan pelembut kulit (emoliens). Sedangkan bunganya berkhasiat sebagai pelancar haid (Dalimartha 1999).
Dalam sistematika (taksonomi) tumbuhan wungu diklasifikasikan sebagai berikut; kingdom Plantae, divisi Spermatophyta, kelas Dicotyledonae, ordo Tubiflorae, famili
Gambar 1 Daun wungu (Graptophyllum pictum L.Griff.) (Dalimartha 1999)
Acanthaceae, genus Graptophyllum, spesies Graptophyllum pictum, dan nama umum Wungu (Dalimartha 1999).
Daun tumbuhan ini mengandung alkaloida yang tidak beracun, glikosida, steroida, saponin, klorofil dan lendir. Batang daun tumbuhan wungu mengandung kalsium oksalat, asam formik, dan lemak (Dalimartha 1999).
Antioksidan
Antioksidan adalah senyawa yang dapat menetralisir radikal bebas dengan cara menyumbangkan elektronnya pada senyawa radikal bebas. Senyawa antioksidan dapat mencegah kerusakan yang ditimbulkan oleh radikal bebas terhadap sel normal, protein, dan lemak. Berdasarkan sumbernya antioksidan dibagi menjadi antioksidan endogen (berasal dari dalam tubuh) dan eksogen (berasal dari luar tubuh) (Kumalaningsih 2007).
Antioksidan endogen merupakan antioksidan yang dapat disintesis oleh tubuh. Contoh dari antioksidan endogen antara lain superoksida dismutase (SOD), katalase, dan peroksidase. SOD merupakan salah satu jenis antioksidan endogen yang mampu mengkatalisis radikal bebas superoksida (•O2)
menjadi hidrogen peroksida (H2O2), sehingga
SOD disebut sebagai scavenger atau pembersih superoksida (•O2 -). Katalase
merupakan senyawa hemotetramer dengan kofaktor Fe, dan dapat ditemukan pada hewan maupun tumbuhan. Katalase dapat mengkatalisis berbagai peroksida dan radikal bebas menghasilkan oksigen dan air. Superoksida adalah kelas enzim oksidoreduktase yang berfungsi mengatalisis substrat organik dengan H2O2 dan
mereduksinya menjadi H2O. Peroksidase
3
Glutation peroksidase (GPx) adalah salah satu jenis enzim peroksidase yang mengandung selenium (Se) pada sisi aktifnya. Enzim ini bekerja dengan cara memecah H2O2
dan berbagai lipid peroksida dengan mereduksinya menjadi H2O. Proses tersebut
melibatkan reaksi redoks dari glutation tereduksi (GSH).
Antioksidan eksogen merupakan antioksidan yang diperoleh dari luar tubuh. Antioksidan eksogen dapat diperoleh dari makanan sehari-hari, terutama sayuran, dan buah-buahan yang mengandung vitamin (vitamin A, C, dan E) dan mineral (Zn, dan Se). Vitamin E merupakan antioksidan eksogen yang paling umum digunakan.
Berdasarkan fungsinya, antioksidan dibagi menjadi empat, diantaranya antioksidan primer, sekunder, tersier, dan oxygen scavenger. Antioksidan primer adalah antioksidan yang berfungsi untuk mencegah terbentuknya radikal bebas baru, karena kemampuannya untuk merubah radikal bebas yang ada sebelum bereaksi. Contoh antioksidan primer di dalam tubuh manusia adalah enzim superoksida dismutase (SOD). Enzim ini sangat penting sekali, dikarenakan dapat melindungi sel-sel dalam tubuh akibat kerusakan yang ditimbulkan oleh radikal bebas. Kinerja enzim ini dipengaruhi oleh beberapa mineral seperti Mn, Zn, Cu, dan Se (Kumalaningsih 2007).
Antioksidan sekunder adalah senyawa penangkap radikal bebas yang mampu mencegah terjadinya reaksi berantai, sehingga tidak terjadi kerusakan yang lebih hebat. Contoh antioksidan sekunder adalah vitamin C, vitamin E, dan betakaroten. Sedangkan antioksidan tersier merupakan senyawa yang dapat memperbaiki kerusakan sel ataupun jaringan yang disebabkan oleh radikal bebas. Metionin sulfoksidan reduktase merupakan contoh antioksidan tersier yang dapat memperbaiki DNA dalam sel. Oxygen scavenger adalah antioksidan yang dapat mengikat oksigen, sehingga tidak mendukung kelangsungan reaksi oksidasi oleh radikal bebas, misalnya vitamin C (Atmosukarto dan Mitri 2003).
Berdasarkan cara memperolehnya, antioksidan dibagi menjadi dua, yaitu antioksidan alami dan sintetik. Antioksidan alami diperoleh dari sumber-sumber alami seperti tumbuhan, dan dapat tersebar di berbagai bagian tanaman seperti kayu, kulit, akar, daun, bunga, buah, biji, rimpang, dan serbuk (Pratt & Hudson 1990 dalam Marpaung 2008). Selain antioksidan alami, terdapat antioksidan sintetik yang juga
memiliki kemampuan untuk menghambat radikal bebas. Jenis-jenis antioksidan sintetik yang banyak digunakan diantaranya adalah butylatedhydroxytoluene (BHT), Butylatedhydroxyanysole (BHA), tert-butyl hydroxyl quinon (TBHQ), propylgalatte (PG), nordihidroquairetic acid (NDGA) dan α -tokoferol. Antioksidan sintetik dapat membahayakan kesehatan, contohnya BHA dan BHT yang dapat menyebabkan pembengkakan organ hati (Hernani & Rahardjo 2005 dalam Marpaung 2008).
Penambahan antioksidan dalam jumlah tertentu dimaksudkan untuk mencegah atau memperlambat terjadinya proses autooksidasi. Antioksidan dapat berperan pada setiap tahap dari proses autooksidasi. Mekanisme kerja antioksidan memiliki dua fungsi, antara lain: (1) sebagai pemberi atom hidrogen. Antioksidan yang mempunyai fungsi utama tersebut sering disebut sebagai antioksidan pimer. Senyawa ini dapat memberikan atom hidrogen secara cepat ke radikal lipida (R*,COO*) atau mengubahnya ke bentuk lebih stabil, sementara turunan radikal antioksidan (A*) tersebut memiliki keadaan lebih stabil dibanding radikal lipid. (2) fungsi sekunder antioksidan, yaitu memperlambat laju autooksidasi dengan berbagai mekanisme diluar mekanisme pemutusan rantai lipid ke bentuk lebih stabil (Gordon 1990).
Antioksidan memiliki fungsi utama dalam menangkap radikal bebas. Radikal bebas dapat menyebabkan oksidasi asam nukleat, protein, lipid, DNA, dan dapat meng-inisiasi penyakit degeneratif. Senyawa antioksidan seperti fenol, polifenol, dan flavonoid dapat menghambat mekanisme oksidasi yang disebabkan radikal bebas seperti peroksida, hidroperoksida, atau peroksida lipid (Shahidi 1997 dalam Nurcholis 2008). Secara umum antioksidan bereaksi dengan menghambat oksidasi lemak atau autooksidasi melalui beberapa tahap, yaitu inisiasi, propagasi, dan terminasi. Tahap inisiasi merupakan tahap pembentukan radikal bebas asam lemak, yaitu asam lemak metastabil dan sangat reaktif akibat kehilangan satu atom hidrogen (H). Reaksi selanjutnya adalah propagasi dimana radikal asam lemak akan bereaksi dengan oksigen membentuk radikal peroksida. Radikal peroksida selanjutnya akan menyerang asam lemak dan menghasilkan hidroksiperoksida dan radikal asam lemak baru lagi.
Ekstraksi
4
suatu bahan atau jaringan tanaman. Menurut Markham (1975), proses awal ekstraksi komponen-komponen aktif dari suatu jaringan tanaman adalah dengan meghaluskan jaringan tanaman tersebut. Hal ini bertujuan untuk memperbesar peluang terlarutnya komponen-komponen metabolit yang diinginkan. Tetapi sebelum diekstraksi, jaringan tanaman dikeringkan untuk mempertahankan kandungan metabolit dalam tanaman yang telah dipotong sehingga proses metabolisme terhenti (Mursito 2002).
Terdapat berbagai macam metode ekstraksi seperti maserasi, refluks, dan sokletasi. Metode ekstraksi yang digunakan untuk proses ekstraksi dalam penelitian ini adalah maserasi. Prinsip dari metode ini adalah proses difusi pelarut ke dalam dinding sel tanaman untuk mengekstrak senyawa-senyawa yang ada dalam tanaman tersebut. Biasanya maserasi digunakan untuk mengekstrak senyawa yang kurang tahan panas, dan digunakan untuk sampel yang belum diketahui karakteristik senyawanya. Sedangkan kelemahan metode ini adalah waktu ekstraksi yang relatif lama (Yulanda 2007).
Metode refluks adalah metode ekstraksi komponen dengan cara mendidihkan campuran antara contoh dan pelarut yang sesuai pada suhu dan waktu tertentu. Serta uap yang terbentuk diembunkan dalam kondensor agar kembali ke labu reaksi. Pada umumnya metode refluks digunakan untuk ekstraksi bahan-bahan yang sulit dipisahkan. Kelemahan metode ini adalah larutan yang digunakan dapat jenuh karena ada keseimbangan. Metode sokletasi yaitu metode ekstraksi solut dari padatan dengan menggunakan pelarut volatil yang cocok, dan prosesnya dilakukan secara berulang-ulang. Pada umumnya dilakukan pada bahan yang tahan panas. Kelebihan metode ini adalah lebih efektif dan efisien dibandingkan dengan metode maserasi.
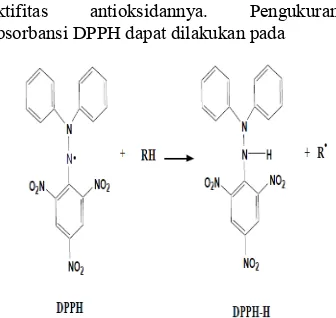
Uji Aktifitas Antioksidan metode DPPH (2,2 diphenyl-1-picryl-hydrazyl) DPPH adalah radikal bebas yang stabil dalam larutan berair atau larutan metanol serta memiliki serapan yang kuat pada panjang gelombang 515 nm dalam bentuk teroksidasi. DPPH mampu menerima elektron atau radikal hidrogen dari senyawa lain sehingga membentuk molekul diamagnetik yang stabil (lihat Gambar 2) (Hatano et al 1998). Uji aktifitas antioksidan dilakukan pada sampel yang diduga mempunyai aktifitas sebagai antioksidan. Terdapat beberapa metode untuk
menentukan aktifitas antioksidan, diantaranya DPPH (2,2-difenil-1-pikrilhidrazil), Cupric Ion Reducing Antioxidant (CUPRAC) dan Ferric Reducing Ability of Plasma (FRAP). Metode DPPH dipilih karena memiliki beberapa keunggulan, diantaranya sederhana, cepat, sensitif, dan hanya membutuhkan sedikit sampel (Aji 2009).
Metode DPPH merupakan metode uji aktifitas antioksidan yang paling banyak dilakukan. Prinsip metode uji antioksidan DPPH didasarkan pada reaksi penangkapan hidrogen oleh DPPH dari senyawa antioksidan. DPPH berperan sebagai radikal bebas yang diredam oleh antioksidan dari sampel. Selanjutnya DPPH akan diubah menjadi DPPH-H (bentuk tereduksi DPPH) oleh senyawa antioksidan. DPPH merupakan senyawa radikal bebas yang stabil dan dapat disimpan dalam jangka waktu lama dalam keadaan kering dan kondisi penyimpanan yang baik (Juniarti et.al 2009).
Gambar 2 Stuktur kimia DPPH.
Metode DPPH dapat memberikan informasi mengenai reaktifitas senyawa yang diuji dengan suatu radikal yang stabil. Penangkap radikal bebas menyebabkan elektron menjadi berpasangan yang kemudian menyebabkan perubahan warna yang sebanding dengan jumlah elektron yang diambil (lihat Gambar 3). DPPH hanya dapat mengukur senyawa antioksidan yang terlarut dalam pelarut organik khususnya alkohol. DPPH secara luas digunakan untuk mengukur dan membandingkan aktifitas antioksidan senyawa-senyawa fenolik, dan evaluasi aktifitas antioksidan melalui perubahan serapan yang terjadi. DPPH harus secara hati-hati diinterpretasikan setelah direaksikan dengan senyawa antioksidan karena dapat didegradasi oleh cahaya, oksigen, pH, dan jenis pelarut (Molyneux 2004).
5
aktifitas antioksidannya. Pengukuran absorbansi DPPH dapat dilakukan pada
Gambar 3 Reduksi DPPH dari senyawa peredam radikal bebas (Prakash et al 2001).
kisaran panjang gelombang 515-520 nm. Metode DPPH dapat digunakan untuk sampel padatan maupun larutan dan tidak spesifik untuk komponen antioksidan partikular, tetapi dapat digunakan untuk kapasitas antioksidan secara keseluruhan pada suatu sampel (Molyneux 2004).
BAHAN DAN METODE
Bahan dan AlatBahan-bahan yang digunakan dalam penelitian ini adalah sampel daun wungu tua yang diambil dari daerah Bogor, akuades, etanol 30%, etanol 70%, etanol 96%, batu es, DPPH(2,2-difenil-1-pikrilhidrazil), kloroform, amonia, H2SO4 pekat, H2SO4 2M, pereaksi
Dragendorf, Pereaksi Meyer, Pereaksi Wagner, HCl pekat, amil alkohol, FeCl3 1%,
dietel eter, CH3COOH anhidrat, serbuk
magnesium, dan dimetilsulfoksida (DMSO). Alat-alat yang dipakai adalah spektrofotometer UV-VIS, ELISA Reader EPOCH, penangas air, oven, neraca analitik, rotavapor, corong pisah, pipet mikro, pipet volumetrik, vial, penggiling 100 mash, tip, mikro plate, lemari es, pipet tetes, labu erlenmeyer, tabung reaksi, kertas saring, gelas piala, labu takar, gelas ukur, bulb, batang pengaduk, sudip, corong gelas, kertas saring, kantong plastik dan kapas.
Metode Penelitian Ekstraksi Daun Wungu
Sampel basah diambil dari tanaman wungu khususnya daun wungu (Graptophyllum pictum L. Griff.). Kemudian sampel dikeringkan dengan oven pada suhu 40-500 C selama 4 s.d 5 hari. Setiap simplisia kasar dari
ekstrak sampel digiling dengan blender kemudian disaring dengan ukuran 60 mash dan 100 mesh. Ukuran serbuk simplisia masing-masing sampel yang digunakan adalah 100 mesh (telah menjadi simplisia kering dengan kadar air ≤ 10%). Sedangkan untuk proses ekstraksi mengacu pada proses ekstraksi Badan Pengawas Obat dan Makanan atau BPOM (2005) yaitu maserasi; proses ekstraksi menggunakan pelarut air, etanol 30%, etanol 70% dan 96%, dengan perbandingan simplisia dengan pelarut adalah 1: 10 yang dimasukkan ke dalam maserator dan direndam selama 6 jam sambil sekali-kali diaduk, kemudian didiamkan sampai 24 jam pada suhu ruang. Maserat dipisahkan, dan proses diulang 2 kali dengan jenis dan jumlah pelarut yang sama. Semua maserat dikumpulkan dan diuapkan dengan penguap vakum pada suhu 500 C hingga diperoleh ekstrak kental. Proses ekstraksi dilakukan dengan ulangan sebanyak 5 kali. Sebagai kontrol kualitas awal maka ekstrak daun wungu ditentukan aktifitas antioksidan berdasarkan metode DPPH.
Analisis Fitokimia Daun Wungu (Harbone 1987)
Uji alkaloid. Sebanyak ± 0.5 gram ekstrak kasar pelarut air, etanol 30%, etanol 70%, dan etanol 96% daun wungu dimasukkan ke dalam tabung reaksi yang berbeda. Kemudian ditambahkan ± 2 tetes amonia dan 5 ml kloroform lalu disaring dan diambil filtratnya. Kemudian filtrat ditambahkan 1 ml H2SO4
2M. Fraksi asam diambil kemudian ditambahkan pereaksi Dragendorf, Meyer, dan Wagner. Adanya alkaloid ditandai dengan terbentuknya endapan merah pada pereaksi Dragendorf, endapan putih pada pereaksi Meyer, dan endapan coklat pada pereaksi Wagner.
Uji Flavonoid. Sebanyak ± 0.5 gram ekstrak kasar pelarut air, etanol 30%, etanol 70%, dan etanol 96% daun wungu dimasukkan ke dlam tabung reaksi yang berbeda. Kemudian ditambahkan ± 5 ml akuades dan disaring. Filtrat yang diperoleh ditambahkan serbuk Mg, 1 ml HCl pekat, dan 1 ml amil alkohol. Campuran dikocok kuat dan dibiarkan hingga terjadi pemisahan. Warna yang terbentuk pada lapisan amilalkohol menunjukkan adnya golongan flavonoid.
5
aktifitas antioksidannya. Pengukuran absorbansi DPPH dapat dilakukan pada
Gambar 3 Reduksi DPPH dari senyawa peredam radikal bebas (Prakash et al 2001).
kisaran panjang gelombang 515-520 nm. Metode DPPH dapat digunakan untuk sampel padatan maupun larutan dan tidak spesifik untuk komponen antioksidan partikular, tetapi dapat digunakan untuk kapasitas antioksidan secara keseluruhan pada suatu sampel (Molyneux 2004).
BAHAN DAN METODE
Bahan dan AlatBahan-bahan yang digunakan dalam penelitian ini adalah sampel daun wungu tua yang diambil dari daerah Bogor, akuades, etanol 30%, etanol 70%, etanol 96%, batu es, DPPH(2,2-difenil-1-pikrilhidrazil), kloroform, amonia, H2SO4 pekat, H2SO4 2M, pereaksi
Dragendorf, Pereaksi Meyer, Pereaksi Wagner, HCl pekat, amil alkohol, FeCl3 1%,
dietel eter, CH3COOH anhidrat, serbuk
magnesium, dan dimetilsulfoksida (DMSO). Alat-alat yang dipakai adalah spektrofotometer UV-VIS, ELISA Reader EPOCH, penangas air, oven, neraca analitik, rotavapor, corong pisah, pipet mikro, pipet volumetrik, vial, penggiling 100 mash, tip, mikro plate, lemari es, pipet tetes, labu erlenmeyer, tabung reaksi, kertas saring, gelas piala, labu takar, gelas ukur, bulb, batang pengaduk, sudip, corong gelas, kertas saring, kantong plastik dan kapas.
Metode Penelitian Ekstraksi Daun Wungu
Sampel basah diambil dari tanaman wungu khususnya daun wungu (Graptophyllum pictum L. Griff.). Kemudian sampel dikeringkan dengan oven pada suhu 40-500 C selama 4 s.d 5 hari. Setiap simplisia kasar dari
ekstrak sampel digiling dengan blender kemudian disaring dengan ukuran 60 mash dan 100 mesh. Ukuran serbuk simplisia masing-masing sampel yang digunakan adalah 100 mesh (telah menjadi simplisia kering dengan kadar air ≤ 10%). Sedangkan untuk proses ekstraksi mengacu pada proses ekstraksi Badan Pengawas Obat dan Makanan atau BPOM (2005) yaitu maserasi; proses ekstraksi menggunakan pelarut air, etanol 30%, etanol 70% dan 96%, dengan perbandingan simplisia dengan pelarut adalah 1: 10 yang dimasukkan ke dalam maserator dan direndam selama 6 jam sambil sekali-kali diaduk, kemudian didiamkan sampai 24 jam pada suhu ruang. Maserat dipisahkan, dan proses diulang 2 kali dengan jenis dan jumlah pelarut yang sama. Semua maserat dikumpulkan dan diuapkan dengan penguap vakum pada suhu 500 C hingga diperoleh ekstrak kental. Proses ekstraksi dilakukan dengan ulangan sebanyak 5 kali. Sebagai kontrol kualitas awal maka ekstrak daun wungu ditentukan aktifitas antioksidan berdasarkan metode DPPH.
Analisis Fitokimia Daun Wungu (Harbone 1987)
Uji alkaloid. Sebanyak ± 0.5 gram ekstrak kasar pelarut air, etanol 30%, etanol 70%, dan etanol 96% daun wungu dimasukkan ke dalam tabung reaksi yang berbeda. Kemudian ditambahkan ± 2 tetes amonia dan 5 ml kloroform lalu disaring dan diambil filtratnya. Kemudian filtrat ditambahkan 1 ml H2SO4
2M. Fraksi asam diambil kemudian ditambahkan pereaksi Dragendorf, Meyer, dan Wagner. Adanya alkaloid ditandai dengan terbentuknya endapan merah pada pereaksi Dragendorf, endapan putih pada pereaksi Meyer, dan endapan coklat pada pereaksi Wagner.
Uji Flavonoid. Sebanyak ± 0.5 gram ekstrak kasar pelarut air, etanol 30%, etanol 70%, dan etanol 96% daun wungu dimasukkan ke dlam tabung reaksi yang berbeda. Kemudian ditambahkan ± 5 ml akuades dan disaring. Filtrat yang diperoleh ditambahkan serbuk Mg, 1 ml HCl pekat, dan 1 ml amil alkohol. Campuran dikocok kuat dan dibiarkan hingga terjadi pemisahan. Warna yang terbentuk pada lapisan amilalkohol menunjukkan adnya golongan flavonoid.
6
dibiarkan selama 10 menit. Terbentuknya busa yang stabil menunjukkan adanya senyawa saponin.
Uji Tanin. Sebanyak ± 0.5 gram ekstrak kasar pelarut air, etanol 30%, etanol 70%, dan etanol 96% daun wungu dimasukkan ke dalam tabung reaksi yang berbeda. Kemudian ditambahkan ± 5 ml akuades dan disaring. Filtrat yang diperoleh ditambahkan 3 tetes FeCl3 1%. Terbentuknya warna biru atau
hitam kehijauan menunjukkan adanya tanin. Uji Steroid dan Triterpenoid. Sebanyak ± 0.5 gram ekstrak kasar pelarut air, etanol 30%, etanol 70%, dan etanol 96% daun wungu dimasukkan kedalam tabung reaksi yang berbeda. Kemudian ditambahkan ± 5 ml etanol panas dan disaring. Filtrat yang diperoleh diuapkan hingga kering, lalu ditambahkan 1 ml dietil eter setelah dihomogenisasikan dan ditambahkan 1 ml H2SO4 pekat dan 1 ml CH3COOH anhidrat.
Warna merah atau ungu menunjukkan adanya triterpenoid dan warna hijau atau biru menunjukkan adanya steroid.
Uji Antioksidan Metode DPPH (2,2 diphenyl-1-picryl-hydrazyl) (Ricardo et.al 2009)
Setiap sampel dilarutkan ke dalam DMSO dengan konsentrasi 10 mg/mL. Selanjutnya sebanyak 0.0012 g DPPH dilarutkan dalam 25 mL etanol 96%. Kemudian diencerkan menjadi berbagai variasi konsentrasi (10.000 – 1000 µg/ml) dalam etanol 100 µL. Masing-masing sampel kemudian diisi dengan DPPH 100 µL (125 µM dalam etanol). Kemudian diinkubasi pada suhu ruang selama 30 menit dalam ruangan gelap. Sebagai kontrol positif digunakan vitamin C (konsentrasi 2, 4, 6, 8, dan 10 ppm). Selanjutnya aktifitas antioksidan dibaca pada panjang gelombang 517 nm dengan ELISA Reader EPOCH. Setiap sampel diukur aktifitas antioksidannya sebanyak tiga kali ulangan. Nilai % inhibisi dapat dihitung dengan menggunakan rumus sebagai berikut:
% inhibisi =
blanko A sampel A -blanko A x 100%
Nilai IC50 dihitung masing-masing dengan
menggunakan rumus persamaan regresi dan pekerjaan dilakukan sebanyak 3 kali ulangan.
HASIL DAN PEMBAHASAN
EkstraksiDalam penelitian ini nilai rendemen yang diperoleh untuk masing-masing ekstrak, berikut nilai rendemen masing-masing ekstrak
dengan pelarut yang berbeda ditunjukkan pada Tabel 1.
Tabel 1 Nilai rendemen masing-masing ekstrak daun wungu
Ekstrak daun wungu
Nilai rendemen (%) Larut Et 96% 22,13 Larut Et 70% 30,56 Larut Et 30% 65,60 Larut Air 50,96
Berdasarkan Tabel 1 diperoleh bahwa persentase rendemen ekstrak etanol 30% yang paling tinggi sehingga menunjukkan senyawa yang terekstrak lebih banyak dibandingkan dengan pelarut lainnya. Namun pelarut etanol 30% tidak dapat dikatakan sebagai pelarut yang baik untuk mengekstrak senyawa antioksidan yang terdapat dalam daun wungu karena perlu diuji beberapa parameter yang lebih lanjut untuk menentukan pelarut yang terbaik untuk mengekstrak daun wungu.
Analisis Fitokimia Ekstrak Daun Wungu
Analisis fitokimia merupakan salah satu cara untuk mengetahui kandungan metabolit pada suatu tanaman secara kualitatif. Analisis fitokimia bertujuan untuk mengetahui adanya senyawa metabolit yang diharapkan berperan sebagai antioksidan. Senyawa yang diuji antara lain alkaloid, flavonoid, saponin, tanin, steroid, dan triterpenoid.
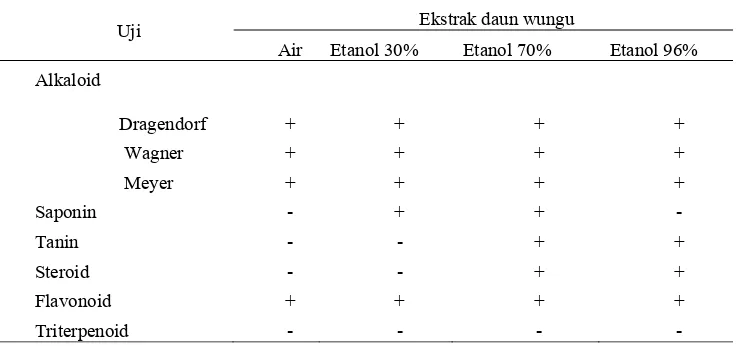
Hasil analisis fitokimia dapat dilihat pada Tabel 2. Hasil analisis menunjukkan bahwa ekstrak air daun wungu mengandung senyawa alkaloid dan flavonoid. Ekstrak etanol 30% daun wungu mengandung alkaloid, flavonoid, dan saponin. Ekstrak etanol 70% daun wungu mengandung senyawa alkaloid, flavonoid, steroid, tanin, dan saponin sedangkan ekstrak etanol 96% daun wungu mengandung senyawa alkaloid, flavonoid, steroid, dan tanin.
Hasil pemeriksaan menunjukkan bahwa ekstrak daun wungu mengandung senyawa alkaloid, steroid, saponin, tanin, dan flavonoid pada pelarut etanol 70%. Keberadaan alkaloid, saponin, dan steroid diduga kuat sebagai komponen metabolit yang berpotensi sebagai antioksidan alami, sehingga dapat menghambat aktivitas radikal DPPH (Dalimartha 1999).
6
dibiarkan selama 10 menit. Terbentuknya busa yang stabil menunjukkan adanya senyawa saponin.
Uji Tanin. Sebanyak ± 0.5 gram ekstrak kasar pelarut air, etanol 30%, etanol 70%, dan etanol 96% daun wungu dimasukkan ke dalam tabung reaksi yang berbeda. Kemudian ditambahkan ± 5 ml akuades dan disaring. Filtrat yang diperoleh ditambahkan 3 tetes FeCl3 1%. Terbentuknya warna biru atau
hitam kehijauan menunjukkan adanya tanin. Uji Steroid dan Triterpenoid. Sebanyak ± 0.5 gram ekstrak kasar pelarut air, etanol 30%, etanol 70%, dan etanol 96% daun wungu dimasukkan kedalam tabung reaksi yang berbeda. Kemudian ditambahkan ± 5 ml etanol panas dan disaring. Filtrat yang diperoleh diuapkan hingga kering, lalu ditambahkan 1 ml dietil eter setelah dihomogenisasikan dan ditambahkan 1 ml H2SO4 pekat dan 1 ml CH3COOH anhidrat.
Warna merah atau ungu menunjukkan adanya triterpenoid dan warna hijau atau biru menunjukkan adanya steroid.
Uji Antioksidan Metode DPPH (2,2 diphenyl-1-picryl-hydrazyl) (Ricardo et.al 2009)
Setiap sampel dilarutkan ke dalam DMSO dengan konsentrasi 10 mg/mL. Selanjutnya sebanyak 0.0012 g DPPH dilarutkan dalam 25 mL etanol 96%. Kemudian diencerkan menjadi berbagai variasi konsentrasi (10.000 – 1000 µg/ml) dalam etanol 100 µL. Masing-masing sampel kemudian diisi dengan DPPH 100 µL (125 µM dalam etanol). Kemudian diinkubasi pada suhu ruang selama 30 menit dalam ruangan gelap. Sebagai kontrol positif digunakan vitamin C (konsentrasi 2, 4, 6, 8, dan 10 ppm). Selanjutnya aktifitas antioksidan dibaca pada panjang gelombang 517 nm dengan ELISA Reader EPOCH. Setiap sampel diukur aktifitas antioksidannya sebanyak tiga kali ulangan. Nilai % inhibisi dapat dihitung dengan menggunakan rumus sebagai berikut:
% inhibisi =
blanko A sampel A -blanko A x 100%
Nilai IC50 dihitung masing-masing dengan
menggunakan rumus persamaan regresi dan pekerjaan dilakukan sebanyak 3 kali ulangan.
HASIL DAN PEMBAHASAN
EkstraksiDalam penelitian ini nilai rendemen yang diperoleh untuk masing-masing ekstrak, berikut nilai rendemen masing-masing ekstrak
dengan pelarut yang berbeda ditunjukkan pada Tabel 1.
Tabel 1 Nilai rendemen masing-masing ekstrak daun wungu
Ekstrak daun wungu
Nilai rendemen (%) Larut Et 96% 22,13 Larut Et 70% 30,56 Larut Et 30% 65,60 Larut Air 50,96
Berdasarkan Tabel 1 diperoleh bahwa persentase rendemen ekstrak etanol 30% yang paling tinggi sehingga menunjukkan senyawa yang terekstrak lebih banyak dibandingkan dengan pelarut lainnya. Namun pelarut etanol 30% tidak dapat dikatakan sebagai pelarut yang baik untuk mengekstrak senyawa antioksidan yang terdapat dalam daun wungu karena perlu diuji beberapa parameter yang lebih lanjut untuk menentukan pelarut yang terbaik untuk mengekstrak daun wungu.
Analisis Fitokimia Ekstrak Daun Wungu
Analisis fitokimia merupakan salah satu cara untuk mengetahui kandungan metabolit pada suatu tanaman secara kualitatif. Analisis fitokimia bertujuan untuk mengetahui adanya senyawa metabolit yang diharapkan berperan sebagai antioksidan. Senyawa yang diuji antara lain alkaloid, flavonoid, saponin, tanin, steroid, dan triterpenoid.
Hasil analisis fitokimia dapat dilihat pada Tabel 2. Hasil analisis menunjukkan bahwa ekstrak air daun wungu mengandung senyawa alkaloid dan flavonoid. Ekstrak etanol 30% daun wungu mengandung alkaloid, flavonoid, dan saponin. Ekstrak etanol 70% daun wungu mengandung senyawa alkaloid, flavonoid, steroid, tanin, dan saponin sedangkan ekstrak etanol 96% daun wungu mengandung senyawa alkaloid, flavonoid, steroid, dan tanin.
Hasil pemeriksaan menunjukkan bahwa ekstrak daun wungu mengandung senyawa alkaloid, steroid, saponin, tanin, dan flavonoid pada pelarut etanol 70%. Keberadaan alkaloid, saponin, dan steroid diduga kuat sebagai komponen metabolit yang berpotensi sebagai antioksidan alami, sehingga dapat menghambat aktivitas radikal DPPH (Dalimartha 1999).
7
pada tanaman. Fungsi alkaloid dalam tanaman belum pasti. Akan tetapi keberadaan alkaloid diduga menjadikan daun wungu mempunyai aktivitas antioksidan. Hal ini berdasarkan penelitian Hernani & Rahardjo (2005) menyatakan bahwa senyawa alkaloid dari ekstrak Callyspongia sp memberikan aktivitas pada peredaman radikal bebas. Selain itu alkaloid berkhasiat untuk melancarkan peredaran darah pada sistem saraf pusat atau pada sirkulasi darah tepi efeknya
meningkatkan sirkulasi darah pada alat kelamin pria (Khomsan 2007).
Potensi antioksidan diduga juga didasarkan atas keberadaan tanin. Tanin memberikan hasil positif pada ekstrak etanol 70% dan ekstrak etanol 96% daun wungu. Adanya tanin ditandai dengan terbentuknya warna hitam kehijauan. Tanin merupakan senyawa yang banyak terkandung dalam teh. Hal ini diacu dari hasil penelitian (Chen 1995 dalam Eridani 2006) yang melaporkan
Tabel 2 Analisis Fitokimia Ekstrak daun Wungu
Uji Ekstrak daun wungu
Air Etanol 30% Etanol 70% Etanol 96%
Alkaloid
Dragendorf + + + +
Wagner + + + +
Meyer + + + +
Saponin - + + -
Tanin - - + +
Steroid - - + +
Flavonoid + + + +
Triterpenoid - - - -
Keterangan: (+): positif, (-): tidak ada (negatif).
berbagai jenis teh memiliki aktivitas antioksidan dan aktivitas tersebut dapat menghambat proses mutasi dan kanker, karena kemampuannya untuk membersihkan radikal bebas dan menginduksi enzim yang bersifat antioksidan (Satria 2005). Selain sebagai antioksidan, tanin menurut Subroto (2008) sebagai hemostatik, yaitu senyawa yang membantu menghentikan pendarahan.
Selain kedua bahan aktif di atas, daun wungu mengandung saponin, steroid, dan flavonoid. Pada hasil analisis fitokimia diperoleh hasil yang berbeda dengan menggunakan kosentrasi pelarut yang berbeda. Hasil positif ditunjukkan pada uji alkaloid dan flavonoid pada seluruh ekstrak sampel. Pada uji saponin, steroid, dan tanin memberikan hasil yang berbeda-beda pada masing-masing pelarut yang digunakan. Hal ini dapat terjadi karena senyawa tanin dan steroid lebih larut pada ekstrak etanol dengan konsentrasi yang tinggi, yaitu pada ekstrak etanol 70% dan etanol 96% sdangkan saponin menunjukkan hasil positif pada ekstrak etanol 30% dan etanol 70%. Hal ini terjadi karena senyawa tanin dan steroid merupakan
senyawa non polar sehingga lebih terekstrak pada pelarut dengan konsentrasi etanol yang lebih tinggi. Steroid memberikan hasil positif pada ekstrak etanol 96% dan ekstrak etanol 70% daun wungu dan memberikan hasil negatif pada ekstrak etanol 30% dan ekstrak air daun wungu. Adanya steroid ditandai dengan terbentuknya warna hijau. Steroid mempunyai khasiat sebagai obat penghilang rasa pegal (Khomsan 2007).
8
menurunkan kolesterol dan menghambat penyakit kanker (Hernani & Rahardjo 2005). Hal ini terbukti saponin yang terkandung pada akar kuning dan temulawak mampu menghambat peningkatan konsentrasi lipid peroksida (Adji 2004). Flavonoid memberikan hasil positif pada semua sampel ekstrak daun wungu ditandai dengan terbentuknya warna hitam dan coklat muda pada lapisan amilalkohol. Flavonoid adalah senyawa fenol yang banyak terdapat pada tumbuhan berpembuluh dan bersifat dapat larut air (Harborne 1987). Flavonoid dapat menghambat kerja enzim α-glukosidase dalam luteolin (Sang Kim 2000). Enzim glukosidase merupakan enzim yang juga digunakan untuk mengetahui potensi suatu tumbuhan sebagai antidiabetes secara in vitro dengan mekanisme penghambatan aktivitas enzim α-glukosidase agar penyerapanan glukosa di dalam usus menurun.
Aktivitas Antioksidan
Prinsip penentuan aktivitas antioksidan diukur dengan melihat kemampuan ekstrak air, ekstrak etanol 30%, ekstrak etanol 70%, dan ekstrak etanol 96% daun wungu dalam menangkap radikal bebas DPPH. Kemampuan penangkapan radikal DPPH oleh suatu antioksidan dinyatakan dalam persen penangkapan radikal bebas. Mekanisme penangkapan radikal DPPH oleh antioksidan cukup sederhana, yaitu berupa donasi proton kepada radikal bebas. Oleh karena itu, senyawa-senyawa yang memungkinkan mendonasikan protonnya memiliki aktivitas penangkapan radikal cukup kuat. Senyawa tersebut adalah golongan fenol, flavonoid, tanin, senyawa yang memiliki banyak gugus sulfida, dan alkaloid. Donasi proton menyebabkan radikal DPPH (berwarna ungu) menjadi senyawa radikal. Senyawa non-radikal DPPH tersebut tidak berwarna. Dengan demikian aktivitas penangkapan radikal dapat dihitung dari peluruhan radikal
DPPH. Kadar radikal DPPH tersisa diukur secara spektrofotometri pada panjang gelombang 517 nm (Blois 1958 & Munim et al. 2003).
Secara mekanisme, terdapat dua macam reaksi senyawa DPPH dengan senyawa antioksidan. Mekanisme reaksi pertama merupakan proses transfer secara langsung elektron atau atom H dari senyawa antioksidan ke senyawa DPPH. Mekanisme reaksi kedua adalah proses transfer elektron dengan proton terkonsentrasi, yaitu senyawa DPPH bermuatan negatif. Senyawa antioksidan berubah bermuatan positif dan mentransfer atom hidrogen ke senyawa DPPH. Metode DPPH dipilih karena metode ini sederhana, mudah, cepat, dan peka serta memerlukan sedikit sampel. (Lan & Hong 2003).
Parameter yang digunakan untuk menerangkan hasil penentuan aktivitas antioksidan adalah IC50. IC50 atau inhibitory
concentration 50% adalah konsentrasi larutan contoh yang menyebabkan berkurangnya aktivitas DPPH sebesar 50% (Molyneux 2004). IC50 didapat dari kurva hubungan
antara persen penangkapan radikal bebas dengan konsentrasi (ppm) menggunakan regresi linier. Prinsip metode yang digunakan menyatakan bahwa semakin kecil konsentrasi larutan contoh untuk mengurangi aktivitas DPPH sebesar 50% maka aktivitas antioksidannya semakin kuat.
Hasil penelitian aktivitas antioksidan pada Tabel 3 menunjukkan bahwa sampel ekstrak air, etanol 30%, etanol 70%, dan etanol 96% tidak memiliki aktivitas antioksidan, hal ini dikarenakan mempunyai IC50 yang sangat
tinggi dibandingkan dengan vitamin C sebagai pembandingnya. Hasil penelitian menunjukkan bahwa ekstrak daun wungu tidak memiliki aktivitas antioksidan dengan pengukuran dengan metode DPPH. Namun, aktivitas antioksidan dengan pelarut etanol
Tabel 3 Uji aktivitas antioksidan ekstrak daun wungu
Sampel IC50 (ppm)
Keterangan (aktivitas antioksidan) (Jun et. al
2003)
Ekstrak air > 500 Tidak aktif
Ekstrak Et 30% > 500 Tidak aktif
Ekstrak Et 70% 257,79 Lemah
Ekstrak Et 96% > 500 Tidak aktif
Kontrol positif
9
96% memiliki % inhibisi (penangkapan radikal bebas) yang paling tinggi dapat dilihat pada lampiran 5 akan tetapi nilai IC50 yang
masih sangat tinggi dan sangat jauh dari vitamin C sebagai pembandingnya, ekstrak etanol 96% daun wungu tetap tidak bisa dikatakan berpotensi sebagai antioksidan.
Berdasarkan Tabel 3 diatas aktivitas antioksidan suatu senyawa uji dapat dikategorikan tingkat kekuatan antioksidannya menjadi berbagai intensitas yang digolongkan menurut nilai IC50. Menurut Jun et.al 2003,
aktivitas antioksidan digolongkan sangat aktif jika nilai IC50 kurang dari 50 ppm,
digolongkan aktif bila nilai IC50 50-100 ppm,
digolongkan sedang bila nilai IC50 101- 250
ppm, dan digolongkan lemah bila nilai IC50
250-500 ppm, serta digolongkan tidak aktif bila nilai IC50 lebih besar dari 500 ppm.
Ekstrak air, etanol 30%, dan etanol 96% daun wungu digolongkan tidak aktif dengan nilai IC50 diatas 500 ppm sedangkan ekstrak etanol
70% daun wungu digolongkan lemah dengan nilai IC50 257, 79 ppm.
Tabel 4 Tingkat kekuatan antioksidan dengan metode DPPH (Jun et. al 2003) Intensitas Nilai IC50
Sangat aktif < 50 ppm
Aktif 50-100 ppm
Sedang 101-250 ppm
Lemah 250-500 ppm
Tidak aktif > 500 ppm
Adapun kemungkinan senyawa-senyawa antioksidan daun wungu yang akan berpotensi sebagai antioksidan bila diekstraksi dengan pelarut-pelarut semi polar dan non polar. Dengan tujuan untuk mengambil fraksi-fraksi yang bersifat non polar pada daun wungu yang diduga berpotensi sebagai senyawa antioksidan. Hal ini diduga karena senyawa antioksidan dalam daun wungu ada yang bersifat larut dalam pelarut non polar seperti contohnya steroid yang merupakan lipid tak tersabunkan dengan struktur molekul siklopentano perhidrofenantrena yang memberikan hasil positif pada uji fitokimia ekstrak etanol 70% dan etanol 96% daun wungu sehingga dapat diekstrak dengan pelarut non polar seperti n-heksana, kloroform, benzena, maupun dietil eter dan pelarut semi polar yaitu etil asetat dan aseton (Mursito 2002).
SIMPULAN DAN SARAN
SimpulanDaun wungu (Graptophyllum pictum L. Griff.) tidak memiliki aktivitas antioksidan yang cukup aktif sehingga tidak berpotensi sebagai antioksidan alami yang baik. Pada ekstrak air, etanol 30%, dan etanol 96% daun wungu memiliki kategori tidak aktif pada uji antioksidan karena IC50 ketiga ekstrak tersebut
lebih dari 500 ppm, pada ekstrak etanol 70% daun wungu memiliki kategori aktivitas antioksidan yang lemah dengan IC50 257,79
ppm. Nilai IC50 pada vitamin C adalah 4,39
ppm. Hasil lain menunjukkan bahwa ekstrak daun wungu mengandung alkaloid dan flavonoid pada setiap pelarut yang digunakan. Ekstrak etanol 30% dan etanol 70% daun wungu memiliki kandungan saponin, serta ekstrak etanol 70% dan ekstrak etanol 96% daun wungu memiliki kandungan tanin dan steroid. Hasil penelitian juga menyimpulkan bahwa belum diketahui pelarut terbaik untuk ekstraksi senyawa yang berpotensi sebagai antioksidan dalam daun wungu.
Saran
Perlu dilakukan penelitian lanjutan untuk mengetahui pelarut terbaik daun wungu sebagai antioksidan dengan menggunakan pelarut semi polar ataupun non polar. Kemudian perlu dilakukan penentuan rendemen lebih lanjut dengan menggunakan freeze dryer sehingga kadar airnya tidak mempengaruhi bobot dari rendemen.
DAFTAR PUSTAKA
Adji P. 2004. Daya antioksidan saponin akarkuning (Archangelisia flava (L) Merr) sebagai mekanisme hepatoprotektorsi pada tikus yang diberi parasetamol [skripsi]. Bogor: Fakultas matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Aji W. 2009. Uji Aktifitas Antioksidan Tablet Effervescent Kombinasi Ekstrak Ethanol Daun Dewandaru (Eugenia uniflora L) dan Herba Sambiloto (Andrographis paniculata Ness) dengan Metode DPPH [skripsi]. Surakarta: Fakultas Farmasi, Universitas Muhammadiyah Surakarta.
Atmosukarto K, Mitri R. 2003. Mencegah penyakit degeneratif dengan makanan. Cermin Dunia Kedokteran 140: 41-48 Bambang. 2004. Atasi Diabetes dengan
9
96% memiliki % inhibisi (penangkapan radikal bebas) yang paling tinggi dapat dilihat pada lampiran 5 akan tetapi nilai IC50 yang
masih sangat tinggi dan sangat jauh dari vitamin C sebagai pembandingnya, ekstrak etanol 96% daun wungu tetap tidak bisa dikatakan berpotensi sebagai antioksidan.
Berdasarkan Tabel 3 diatas aktivitas antioksidan suatu senyawa uji dapat dikategorikan tingkat kekuatan antioksidannya menjadi berbagai intensitas yang digolongkan menurut nilai IC50. Menurut Jun et.al 2003,
aktivitas antioksidan digolongkan sangat aktif jika nilai IC50 kurang dari 50 ppm,
digolongkan aktif bila nilai IC50 50-100 ppm,
digolongkan sedang bila nilai IC50 101- 250
ppm, dan digolongkan lemah bila nilai IC50
250-500 ppm, serta digolongkan tidak aktif bila nilai IC50 lebih besar dari 500 ppm.
Ekstrak air, etanol 30%, dan etanol 96% daun wungu digolongkan tidak aktif dengan nilai IC50 diatas 500 ppm sedangkan ekstrak etanol
70% daun wungu digolongkan lemah dengan nilai IC50 257, 79 ppm.
Tabel 4 Tingkat kekuatan antioksidan dengan metode DPPH (Jun et. al 2003) Intensitas Nilai IC50
Sangat aktif < 50 ppm
Aktif 50-100 ppm
Sedang 101-250 ppm
Lemah 250-500 ppm
Tidak aktif > 500 ppm
Adapun kemungkinan senyawa-senyawa antioksidan daun wungu yang akan berpotensi sebagai antioksidan bila diekstraksi dengan pelarut-pelarut semi polar dan non polar. Dengan tujuan untuk mengambil fraksi-fraksi yang bersifat non polar pada daun wungu yang diduga berpotensi sebagai senyawa antioksidan. Hal ini diduga karena senyawa antioksidan dalam daun wungu ada yang bersifat larut dalam pelarut non polar seperti contohnya steroid yang merupakan lipid tak tersabunkan dengan struktur molekul siklopentano perhidrofenantrena yang memberikan hasil positif pada uji fitokimia ekstrak etanol 70% dan etanol 96% daun wungu sehingga dapat diekstrak dengan pelarut non polar seperti n-heksana, kloroform, benzena, maupun dietil eter dan pelarut semi polar yaitu etil asetat dan aseton (Mursito 2002).
SIMPULAN DAN SARAN
SimpulanDaun wungu (Graptophyllum pictum L. Griff.) tidak memiliki aktivitas antioksidan yang cukup aktif sehingga tidak berpotensi sebagai antioksidan alami yang baik. Pada ekstrak air, etanol 30%, dan etanol 96% daun wungu memiliki kategori tidak aktif pada uji antioksidan karena IC50 ketiga ekstrak tersebut
lebih dari 500 ppm, pada ekstrak etanol 70% daun wungu memiliki kategori aktivitas antioksidan yang lemah dengan IC50 257,79
ppm. Nilai IC50 pada vitamin C adalah 4,39
ppm. Hasil lain menunjukkan bahwa ekstrak daun wungu mengandung alkaloid dan flavonoid pada setiap pelarut yang digunakan. Ekstrak etanol 30% dan etanol 70% daun wungu memiliki kandungan saponin, serta ekstrak etanol 70% dan ekstrak etanol 96% daun wungu memiliki kandungan tanin dan steroid. Hasil penelitian juga menyimpulkan bahwa belum diketahui pelarut terbaik untuk ekstraksi senyawa yang berpotensi sebagai antioksidan dalam daun wungu.
Saran
Perlu dilakukan penelitian lanjutan untuk mengetahui pelarut terbaik daun wungu sebagai antioksidan dengan menggunakan pelarut semi polar ataupun non polar. Kemudian perlu dilakukan penentuan rendemen lebih lanjut dengan menggunakan freeze dryer sehingga kadar airnya tidak mempengaruhi bobot dari rendemen.
DAFTAR PUSTAKA
Adji P. 2004. Daya antioksidan saponin akarkuning (Archangelisia flava (L) Merr) sebagai mekanisme hepatoprotektorsi pada tikus yang diberi parasetamol [skripsi]. Bogor: Fakultas matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Aji W. 2009. Uji Aktifitas Antioksidan Tablet Effervescent Kombinasi Ekstrak Ethanol Daun Dewandaru (Eugenia uniflora L) dan Herba Sambiloto (Andrographis paniculata Ness) dengan Metode DPPH [skripsi]. Surakarta: Fakultas Farmasi, Universitas Muhammadiyah Surakarta.
Atmosukarto K, Mitri R. 2003. Mencegah penyakit degeneratif dengan makanan. Cermin Dunia Kedokteran 140: 41-48 Bambang. 2004. Atasi Diabetes dengan
AKTIVITAS ANTIOKSIDAN DAN KANDUNGAN KIMIAWI EKSTRAK
DAUN WUNGU (
Graptophyllum pictum
L.Griff
.
)
HADI WINATA
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
9
96% memiliki % inhibisi (penangkapan radikal bebas) yang paling tinggi dapat dilihat pada lampiran 5 akan tetapi nilai IC50 yang
masih sangat tinggi dan sangat jauh dari vitamin C sebagai pembandingnya, ekstrak etanol 96% daun wungu tetap tidak bisa dikatakan berpotensi sebagai antioksidan.
Berdasarkan Tabel 3 diatas aktivitas antioksidan suatu senyawa uji dapat dikategorikan tingkat kekuatan antioksidannya menjadi berbagai intensitas yang digolongkan menurut nilai IC50. Menurut Jun et.al 2003,
aktivitas antioksidan digolongkan sangat aktif jika nilai IC50 kurang dari 50 ppm,
digolongkan aktif bila nilai IC50 50-100 ppm,
digolongkan sedang bila nilai IC50 101- 250
ppm, dan digolongkan lemah bila nilai IC50
250-500 ppm, serta digolongkan tidak aktif bila nilai IC50 lebih besar dari 500 ppm.
Ekstrak air, etanol 30%, dan etanol 96% daun wungu digolongkan tidak aktif dengan nilai IC50 diatas 500 ppm sedangkan ekstrak etanol
70% daun wungu digolongkan lemah dengan nilai IC50 257, 79 ppm.
Tabel 4 Tingkat kekuatan antioksidan dengan metode DPPH (Jun et. al 2003) Intensitas Nilai IC50
Sangat aktif < 50 ppm
Aktif 50-100 ppm
Sedang 101-250 ppm
Lemah 250-500 ppm
Tidak aktif > 500 ppm
Adapun kemungkinan senyawa-senyawa antioksidan daun wungu yang akan berpotensi sebagai antioksidan bila diekstraksi dengan pelarut-pelarut semi polar dan non polar. Dengan tujuan untuk mengambil fraksi-fraksi yang bersifat non polar pada daun wungu yang diduga berpotensi sebagai senyawa antioksidan. Hal ini diduga karena senyawa antioksidan dalam daun wungu ada yang bersifat larut dalam pelarut non polar seperti contohnya steroid yang merupakan lipid tak tersabunkan dengan struktur molekul siklopentano perhidrofenantrena yang memberikan hasil positif pada uji fitokimia ekstrak etanol 70% dan etanol 96% daun wungu sehingga dapat diekstrak dengan pelarut non polar seperti n-heksana, kloroform, benzena, maupun dietil eter dan pelarut semi polar yaitu etil asetat dan aseton (Mursito 2002).
SIMPULAN DAN SARAN
SimpulanDaun wungu (Graptophyllum pictum L. Griff.) tidak memiliki aktivitas antioksidan yang cukup aktif sehingga tidak berpotensi sebagai antioksidan alami yang baik. Pada ekstrak air, etanol 30%, dan etanol 96% daun wungu memiliki kategori tidak aktif pada uji antioksidan karena IC50 ketiga ekstrak tersebut
lebih dari 500 ppm, pada ekstrak etanol 70% daun wungu memiliki kategori aktivitas antioksidan yang lemah dengan IC50 257,79
ppm. Nilai IC50 pada vitamin C adalah 4,39
ppm. Hasil lain menunjukkan bahwa ekstrak daun wungu mengandung alkaloid dan flavonoid pada setiap pelarut yang digunakan. Ekstrak etanol 30% dan etanol 70% daun wungu memiliki kandungan saponin, serta ekstrak etanol 70% dan ekstrak etanol 96% daun wungu memiliki kandungan tanin dan steroid. Hasil penelitian juga menyimpulkan bahwa belum diketahui pelarut terbaik untuk ekstraksi senyawa yang berpotensi sebagai antioksidan dalam daun wungu.
Saran
Perlu dilakukan penelitian lanjutan untuk mengetahui pelarut terbaik daun wungu sebagai antioksidan dengan menggunakan pelarut semi polar ataupun non polar. Kemudian perlu dilakukan penentuan rendemen lebih lanjut dengan menggunakan freeze dryer sehingga kadar airnya tidak mempengaruhi bobot dari rendemen.
DAFTAR PUSTAKA
Adji P. 2004. Daya antioksidan saponin akarkuning (Archangelisia flava (L) Merr) sebagai mekanisme hepatoprotektorsi pada tikus yang diberi parasetamol [skripsi]. Bogor: Fakultas matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Aji W. 2009. Uji Aktifitas Antioksidan Tablet Effervescent Kombinasi Ekstrak Ethanol Daun Dewandaru (Eugenia uniflora L) dan Herba Sambiloto (Andrographis paniculata Ness) dengan Metode DPPH [skripsi]. Surakarta: Fakultas Farmasi, Universitas Muhammadiyah Surakarta.
Atmosukarto K, Mitri R. 2003. Mencegah penyakit degeneratif dengan makanan. Cermin Dunia Kedokteran 140: 41-48 Bambang. 2004. Atasi Diabetes dengan
10
Blois, M.S. 1958. Antioxidant determinations by the use of a stable free radical Nature 181: 1199-1200.
Dalimartha. 1999. Ramuan tradisional untuk pengobatan hepatitis. Jakarta: Penebar Swadaya.
Eridani SN. Potensi antioksidan ekstrak bahan alam yang berkhasiat sebagai antikanker. [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Gordon MH. 1990. The mechanism of antioxidant action in vitro. Di dalam: Hudson BJF, editor. Food antioxidants. New York: Elsevierre applied Science.
Garret RH Grisham CM. 2002. Biochemistry and Molecular Biology Education. New Orleans: Wiley Intersci.
Hatano et al. 1998. Two new flavonoid and other constituent in licore roots: Their relative astringency and radical scaveging effect. Chem Pharm Bull 36: 2090-2097.
Harborne JB. 1987. Metode Fitokimia. Iwang S, penerjemah. Bandung: ITB Pr. Terjemahan dari: Phytochemical Method.
Hernani & Rahardjo M. 2005. Tanaman Berkhasiat Antioksidan. Jakarta: Penebar Swadaya.
Jun, M.H.Y., Yu., J., Fong, X., Wan, C.S, Yang, C.T. and Ho. 2003. Comparison of antioxidant activities of isoflavones from kudzu root (Pueraria labata Ohwl). J. Food Sci. Institute of Technologist. 68: 2117–2122.
Juniarti, Osmeli D, Yuhermita. 2009. Kandungan senyawa kimia, uji toksisitas (Brine Shrimp Lethality Test), dan antioksidan (1,1 – diphenyl – 2 - picrylhidrazil) dari ekstrak daun saga (Abrus precatorius L.) Makara Sains 13:50-54.
Khomsan E. 2007. Khasiat dan kandungan kimia tanaman
gingseng.http://www.indomedia.com [25 maret 2011].
Kumalaningsih S. 2007. Antioksidan Alami. Surabaya: Trubus Agrisarana.
Kurtubi M. 2006. Potensi ekstrak bawang dayak (Eleutherine palmifolia (L) Merr) sebagai antioksidan. [skripsi]. Bogor: Fakultas Matematika dan Ilmu
Pengetahuan alam, Institut Pertanian Bogor.
Lan FW, Hong, YZ. 2003. A theoritical investigation on DPPH radical scavengingmechanism of edaravone. Bioorganic and Medicinal Chemistry Letters 13: 3789-3792.
Markham KR. 1975. Cara Mengidentifikasi Flavonoid. Penerjemah Padmawinata K. Bandung: ITB. Terjemahan dari: Technicues of Flavonoid Identification.
Marpaung IM. 2008. Potensi aktifitas antioksidan pada kulit kayu dan daun tanaman akway (Drymis sp) [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Molyneux P. 2004. The use of stable free radical diphenylpicryl hydrazil (DPPH) for estimating antioxidant activity. J. Sci. Technol.: 211-219.
Munim, A., et al., 2003, Antioxidative Compound From Crotalaria sessiliflora Biosci Biotech Biochem 67: 410-414. Murray KR. 2003. Harper’s Ilustrated
Biochemistry. Ed ke-26. London: Lounge Medical Pub.
Mursito B. 2002b. Ramuan Tradisional Untuk Pengobatan penyakit Jantung. Jakarta: Penebar Swadaya.
Nurcholis W. 2008. Profil Senyawa Penciri Bioaktifitas Tanaman Temulawak pada Agrobiofisik Berbeda [tesis]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Purwakusumah ED. 2003. Tumbuhan sebagai sumber biofarmaka. Di dalam: Pelatihan Tanaman Obat Tradisional, 3-4 Mei 2003. Bogor: Pusat Studi Biofarmaka Lembaga Penelitian IPB.
Prakash, A. Rigelhof, F. Miller, E. 2001, Antioxidant Activity Medalliaon Laboratories Analitycal Progress, vol 10, No.2
11
Complementary and alternative Medicine Volume 2011.
Sang Kim J et al. 2000. Inhibition of alpha-glucocidase and amylase by luteolin, flavonoid. Journal Biosci, Biotechnol, Biochem. 64: 2458-2461.
Satria E. 2005. Potensi antioksidan dari daging buah tua mahkota dewa (Phaleria macrocarpa (Scheff) Boerl) [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan alam, Institut Pertanian Bogor.
Soegondo S. 2004. Diagnosis dan klasifikasi diabetes melitus terkini. Di dalam: Penatalaksanaan Diabetes Melitus Terpadu sebagai Penduan Pelaksanaan Diabetes Melitus. 5-4 Maret 2004. Jakarta: Fakultas Kedokteran UI.
Subroto. 2006. Hancurkan Kencing Manis Dengan Tanaman Herbal. Jakarta: Puspa Swara.
Sutedja L. 2003. Bioprospekting Tumbuhan Obat Indonesia sebagai Sediaan Fitofarmaka Antidiabetes. Laporan Kemajuan Tahap II Riset Unggulan Terpadu, Pusat Penelitian Kimia-LIPI.
Umi kalsum et.al. 1995. Alkaloids as antioxidant agent: importance of their unteraction with biomembranes. Free Radic Biol Med 19:481-486.
United Graduate School, Gifu University. Burgess G.W. 1995. Prinsip dasar ELISA
dan variasi konfigurasinya, Teknologi
ELISA dalam diagnosis dan penelitian.
G.W. Burgess (Ed.) Wayan T. Ariana
(terjemahan). Gadjah Mada University
Press, Yogyakarta. hlm. 506.
Widjaya A. 1996. Radikal bebas dan parameter status antioksidan. Forum Diagnosticum 4: 1-6.
Yulanda H. 2007. Ekstraksi, fraksinasi, dan pencirian pati rimpang temulawak. [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
AKTIVITAS ANTIOKSIDAN DAN KANDUNGAN KIMIAWI EKSTRAK
DAUN WUNGU (
Graptophyllum pictum
L.Griff
.
)
HADI WINATA
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
HADI WINATA. Aktivitas Antioksidan dan Kandungan Kimiawi Ekstrak Daun Wungu
(Graptophyllum pictum L.Griff.). Dibimbing oleh MARIA BINTANG dan
WARAS NURCHOLIS.
ABSTRACT
HADI WINATA. Antioxidant Activity and Chemical Contens The leaf Extract of
Wungu (Graptophyllum pictum L. Griff.). Under the direction of MARIA
BINTANG and WARAS NURCHOLIS.
Graptophyllum pictum L. Griff., a plant that originated from Papua and
Polynesia, is believed to have antioxidant activity. This study aimed to examine of
antioxidant activity and chemical content of Graptophyllum pictum L. Griff.
leaves. Also, it was designed to determine the best extracting solvent that provides
the highest antioxidant activity. This study used four different solvents, which
were the solvent water, ethanol 30%, ethanol 70%, and ethanol 96%. Extracts of
each solvent were studied to determine the presence or absence of the antioxidant
activity and chemical content by using vitamin C as a comparison. The
antioxidant activity of water extract, ethanol 30%, ethanol 70%, and ethanol 96%
extract were determined using the DPPH (2,2 diphenyl-1-picryl-hydrazyl) with a
spectrophotometer at a wavelength of 517 nm. Phytochemical test showed that
water extract, ethanol 30%, ethanol 70%, and ethanol 96% Graptophyllum pictum
L. Griff. leaves contain alkaloids and flavonoids. Ethanol 30% and ethanol 70%
extract were contained saponin. Ethanol 70% and ethanol 96% extract contained
tannins and steroids. Antioxidants activity test (IC
50) of four types of solvents
showed that the antioxidant activity is not active on four types of solvent used, but
ethanol 70% extract of Graptophyllum pictum L. Griff. leaves has a weak
antioxidant activity with IC
50of 257.79 ppm. It can be concluded that water,
ethanol 30%, ethanol 96% extract Graptophyllum pictum L. Griff. leaf have no
AKTIVITAS ANTIOKSIDAN DAN KANDUNGAN KIMIAWI EKSTRAK
DAUN WUNGU (
Graptophyllum pictum
L.Griff.
)
HADI WINATA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Aktivitas Antioksidan dan Kandungan Kimiawi Ekstrak Daun Wungu
(Graptophyllum pictum L. Griff.)
Nama : Hadi Winata
NIM :
G84070024
Disetujui
Komisi Pembimbing,
Prof. Dr. drh. Maria Bintang, M.S.
Waras Nurcholis, M.Si
Ketua
Anggota
Diketahui,
Dr. I Made Artika, M.App.Sc.
Ketua Departemen Biokimia
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Kuasa, yang
telah melimpahkan karunia-Nya sehingga terselesaikannya karya ilmiah ini. Karya
ilmiah ini berjudul Aktifitas Antioksidan dan Kandungan Kimiawi Ekstrak Daun
Wungu (Graptophyllum pictum L. Griff.). Penelitian ini dilaksanakan di
Laboratorium Biokimia IPB, Institut Pertanian Bogor. Penelitian dilaksanakan
dari bulan Februari sampai dengan April 2011.
Penulis mengucapkan terima kasih kepada Prof. Dr. drh. Maria Bintang,
M.S. selaku pembimbing utama serta Waras Nurcholis, M.Si sebagai pembimbing
kedua. Ucapan terima kasih juga disampaikan kepada staf Laboratorium Biokimia
IPB terutama Pak Arya, Pak Nana, Pak Yadi, Ibu Iis, Ibu Merry, Ibu Martini,
Taufik, dan Eka. Tidak lupa penulis ucapkan terima kasih kepada orang tua Bapak
Yanto dan Ibu Puspa Sari Maria serta Fredy dan Agus Ari Yadi sebagai kakak dan
adik penulis, Donna Fransisca serta keluarga, serta teman-teman biokimia
angkatan 44 atas dukungan, doa, serta semangatnya.
Akhir kata semoga karya ilmiah ini bermanfaat Tuhan memberkati.
Bogor, Juni 2011
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 27 April 1989 sebagai anak
kedua dari tiga bersaudara, putra dari pasangan Yanto dan Puspa Sari Maria.
Tahun 2007 penulis lulus dari SMA Negeri 73 Jakarta Utara dan memperoleh
kesempatan melanjutkan studi di Departemen Biokimia Fakultas Matematika dan
Ilmu Pengetahuan Alam IPB melalui jalur Undangan Seleksi Masuk Institut
Pertanian Bogor (USMI).
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... viii
DAFTAR TABEL ... viii
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Daun Wungu ... 2
Antioksidan ... 2
Ekstraksi ... 3
Uji aktifitas antioksidan dengan metode DPPH ... 4
BAHAN DAN METODE
Bahan dan Alat ... 5
Metode Penelitian ... 5
HASIL DAN PEMBAHASAN
Ekstraksi
...
5
Analisis
Fitokimia
...
5
Aktivitas Antioksidan ... 8
SIMPULAN DAN SARAN
Simpulan
...
9
Saran...
9
DAFTAR PUSTAKA ... 9
DAFTAR GAMBAR
Halaman
1 Daun wungu (Graptophyllum pictum L. Griff.) ... 2
2 Struktur kimia DPPH ... 4
3 Reduksi DPPH dari senyawa peredam radikal bebas. ... 5
DAFTAR TABEL
Halaman
1 Nilai rendemen masing-masing ekstrak daun wungu ... 6
2 Analisis fitokimia ekstrak daun wungu ... 7
3 Uji aktivitas antioksidan ekstrak daun wungu ... 8
DAFTAR LAMPIRAN
Halaman
1 Tahap-tahap penelitian secara umum ... 13
2 Diagram alir uji aktivitas antioksidan daun wungu ... 14
3 Rendemen hasil ekstraksi daun wungu ... 15
4 Perhitungan konsentrasi pada pembuatan larutan ... 16
5 Aktivitas Antioksidan ekstrak etanol 96% daun wungu ... 17
6 Aktivitas Antioksidan ekstrak etanol 70% daun wungu ... 18
7 Aktivitas Antioksidan ekstrak etanol 30% daun wungu ... 19
8 Aktivitas Antioksidan ekstrak air daun wungu ... 20
9 Gambar hasil uji fitokimia ekstrak daun wungu ... 21
PENDAHULUAN
Keseimbangan antara kandungan radikal bebas dan antioksidan di dalam tubuh merupakan salah satu faktor yang mempengaruhi kesehatan manusia. Stres oksidatif adalah keadaan yang ditandai oleh ketidakseimbangan antara oksidan dan antioksidan dalam tubuh. Akibat stres oksidatif adalah penyakit kanker, diabetes melitus, dan lain-lain. Berdasarkan data dari WHO pada tahun 2005-2030 akan ada peningkatan jumlah penderita kanker hingga tiga kali lipat. WHO juga menyatakan 70 persen penderita kanker berada di negara-negara berkembang. Data dari Union Internationale Contre le Cancer (UICC) dan WHO menyebutkan pada tahun 2004 angka kematian akibat kanker dan diabetes melitus diperkirakan mencapai 7 juta orang, dua kali lebih banyak dari angka kematian yang disebabkan oleh HIV/AIDS. Hal ini disebabkan karena pada masa sekarang ini sebagian besar manusia tidak mendapatkan asupan antioksidan yang cukup dari makanan yang dikonsumsi. Sehingga radikal bebas menjadi sangat dominan di dalam tubuh. Hal ini yang melatarbelakangi timbulnya berbagai macam penyakit seperti, jantung koroner, kanker, diabetes melitus, hati, dan penuaan dini (Widjaya 1996).
Antioksidan adalah senyawa stabil yang dapat memberikan elektronnya kepada molekul radikal bebas sehingga dapat menetralisir atau melawan radikal bebas dan memberi perlindungan kepada tubuh dari ancaman radikal bebas (Kumalaningsih 2007). Aktifitas suatu bahan sebagai antioksidan dipengaruhi oleh konsentrasi bahan antioksidan tersebut. Semakin tinggi konsentrasinya maka aktifitas antioksidannya akan semakin tinggi pula. Akan tetapi antioksidan yang ideal adalah antioksidan yang memiliki aktifitas inhibisi radikal bebas pada konsentrasi rendah. Selain itu antioksidan yang ideal harus memiliki ketahanan terhadap faktor fisik (daya tahan terhadap suhu dan cahaya), kimia (daya tahan terhadap pH dan oksigen), serta nilai toksisitas yang aman (Gordon 1990). Secara alami, tubuh menghasilkan senyawa antioksidan. Namun, tidak cukup kuat untuk berkompetisi dengan radikal bebas yang dihasilkan oleh tubuh setiap harinya (Hernani & Rahardjo 2005). Kekurangan antioksidan dalam tubuh dapat diatasi melalui asupan dari luar yang banyak mengandung antioksidan. Salah satu cara menanggulangi kekurangan antioksidan
dari dalam tubuh yaitu memanfaatkan sumber antioksidan yang berasal dari luar tubuh. Salah satu sumber antioksidan yang berasal dari luar tubuh dapat diperoleh dari tanaman dan antioksidan sintetik. Namun, antioksidan sintetik mempunyai kelemahan dapat menimbulkan efek samping yang tidak baik jika dikonsumsi dalam jangka waktu yang panjang. Oleh karena itu tanaman dimanfaatkan sebagai antioksidan alami yang tidak berbahaya bagi tubuh. Senyawa antioksidan yang terdapat dalam tanaman antara lain asam linoleat, flavonoid, tokoferol, dan tanin tersebar pada berbagai bagian tanaman seperti daun, akar, batang, biji, dan bunga (Sidik 1997 dalam Kurtubi 2006). Indonesia khususnya daerah Papua memiliki keanekaragaman hayati yang melimpah, merupakan sumber utama tanaman obat yang ada di Indonesia dan mengandung metabolit sekunder seperti alkaloid, saponin, dan tanin yang mempunyai potensi sebagai antioksidan alami. Salah satu tanaman yang diduga berpotensi sebagai antioksidan adalah tanaman wungu (Graptophyllum pictum L. Griff.) khususnya daun wungu. Daun wungu mengandung alkaloid yang tidak beracun, glikosida, steroid, saponin, klorofil dan lendir (mukopolisakarida). Batang daun tumbuhan wungu mengandung kalsium oksalat, asam formik, dan lemak (Dalimartha 1999).
Penelitian secara ilmiah mengenai daun wungu masih terbatas, sampai saat ini daun wungu dipercaya berkhasiat sebagai peluruh kencing (diuretik), mempercepat pemasakan bisul, pencahar ringan (laksatif), dan pelembut kulit (emoliens). Sedangkan bunganya berkhasiat sebagai pelancar haid (Dalimartha 1999). Dari studi literatur yang dilakukan, telah diteliti bahwa di dalam rebusan daun tumbuhan wungu tersebut dapat menghilangkan gejala hemoroid eksternum derajat II (Hernani Rahardjo 2005). Umi Kalsum et.al 1995 juga telah meneliti peran senyawa alkaloida yang terdapat dalam ekstrak etanol daun tumbuhan