AKTIVITAS INHIBISI ENZIM
α
-GLUKOSIDASE DAN
ANTIOKSIDAN DARI EKSTRAK ETANOL DAUN WUNGU
(Graptophyllum pictum (L.) Griff) DAN PARTISINYA
SYLVIA
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudu l Aktivitas Inhibisi Enzim α-Glukosidase dan Antioksidan dari Ekstrak Etanol Daun Wungu (Graptophyllum pictum (L.) Griff) dan Partisinya adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
SYLVIA. Aktivitas Inhibisi Enzim α-Glukosidase dan Antioksidan dari Ekstrak Etanol Daun Wungu (Graptophyllum pictum (L.) Griff) dan Partisinya. Dibimbing oleh WARAS NURCHOLIS dan I MADE ARTIKA.
Daun wungu (Graptophyllum pictum (L.) Griff) merupakan tanaman yang banyak digunakan dalam mengobati berbagai penyakit, termasuk diabetes dan diketahui mengandung senyawa fenolik yang mempunyai aktivitas antioksidan. Tujuan penelitian ini adalah menentukan inhibisi terhadap enzim α-glukosidase dan aktivitas antioksidan dari ekstrak etanol dan fraksi dietil eter, etil asetat, serta butanol dari daun wungu (Graptophyllum pictum (L.) Griff) secara in vitro. Ekstraksi daun wungu dilakukan dengan maserasi dan pembuatan fraksi-fraksinya dilakukan melalui ekstraksi cair-cair. Hasil uji menunjukkan bahwa ekstrak etanol serta fraksi-fraksinya tidak memiliki aktivitas penghambatan terhadap enzim α -glukosidase, namun berpotensi sebagai antioksidan melalui penghambatannya terhadap radikal DPPH. Fraksi etil asetat (500 ppm) dapat menangkap 74.105% radikal DPPH dengan nilai IC50 68.11 ppm yang merupakan aktivitas antioksidan tertinggi dan diikuti oleh fraksi butanol, etanol, dan dietil eter.
Kata kunci: antidiabetes, antioksidan, α-glukosidase, daun wungu, DPPH
ABSTRACT
SYLVIA. Inhibition Activities of Enzyme α-Glucosidase and Antioxidant of Ethanol Extracts of Wungu Leaves (Graptophyllum pictum (L.) Griff) and Its Partition. Supervised by WARAS NURCHOLIS and I MADE ARTIKA.
Wungu leaves (Graptophyllum pictum (L.) Griff) is a plant that is widely used in treating a variety of ailments, including diabetes and known to contain phenolic compounds that have antioxidant activity. The purpose of this study was
to determine the inhibition of the enzyme α-glucosidase and antioxidant activities of ethanol extracts and fractions of diethyl ether, ethyl acetate, and butanol from wungu leaves (Graptophyllum pictum (L.) Griff) by in vitro studies. Extraction of wungu leaves was done by maceration and the fractination was done through liquid-liquid extraction. Results showed that ethanol extracts and its fraction have no inhibitory activity toward α-glucosidase, but it was potentially as antioxidant through inhibition of radical DPPH. Ethyl acetate fraction (500 ppm) can capture the DPPH radical 74.105% with IC50 values of 68.11 ppm which is the highest antioxidant activity and is followed by the fraction of butanol, ethanol, and diethyl ether.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
AKTIVITAS INHIBISI ENZIM
α
-GLUKOSIDASE DAN
ANTIOKSIDAN DARI EKSTRAK ETANOL DAUN WUNGU
(Graptophyllum pictum (L.) Griff) DAN PARTISINYA
SYLVIA
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Aktivitas Inhibisi Enzim α-Glukosidase dan Antioksidan dari Ekstrak Etanol Daun Wungu (Graptophyllum pictum (L.) Griff) dan Partisinya
Nama : Sylvia NIM : G84100080
Disetujui oleh
Waras Nurcholis, SSi, MSi Pembimbing I
Diketahui oleh
Dr Ir I Made Artika, MAppSc Pembimbing II
Tanggal Lulus:
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Oktober 2013 sampai Maret 2014 ini ialah antidiabetes dan antioksidan, dengan judul Aktivitas Inhibisi Enzim α -Gluko sidase dan Antioksidan dari Ekstrak Etanol Daun Wungu (Graptophyllum pictum (L.) Griff) dan Partisinya.
Terima kasih penulis ucapkan kepada Bapak Waras Nurcholis, SSi, MSi dan Bapak Dr Ir I Made Artika, MAppSc selaku pembimbing. Di samping itu, penghargaan penulis sampaikan kepada seluruh teknisi di Laboratorium Penelitian Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor, serta seluruh teknisi di Laboratorium Pusat Studi Biofarmaka yang telah membantu selama penelitian berlangsung. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, seluruh keluarga, serta teman-teman Biokimia 47 atas doa dan dukungannya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
METODE 2
Bahan Penelitian 2
Peralatan Penelitian 2
Lokasi dan Waktu Penelitian 2
Prosedur Percobaan 2
Analisis Statistik 4
HASIL PENELITIAN 4
Ekstrak Daun Wungu 4
Inhibisi α-Glukosidase 4
Aktivitas Antioksidan 5
PEMBAHASAN 6
Ekstrak Daun Wungu 6
Inhibisi α-Glukosidase 7
Aktivitas Antioksidan 8
SIMPULAN DAN SARAN 11
DAFTAR PUSTAKA 11
DAFTAR TABEL
1 Persentase inhibisi ekstrak daun wungu dan acarbose 5 2 Persentase inhibisi dan IC50 ekstrak daun wungu dan vitamin C 5
DAFTAR GAMBAR
1 Rendemen ekstrak daun wungu 4
2 Reaksi enzimatik α-glukosidase dan p-NPG 8 3 Reaksi reduksi DPPH oleh senyawa antioksidan 9
4 Oksidasi vitamin C 10
5 Efek radikal bebas terhadap penyakit diabetes melitus 10
DAFTAR LAMPIRAN
1 Diagram alir penelitian 14
2 Pembuatan larutan 15
3 Uji inhibisi α-glukosidase dan uji DPPH 16
4 Rendemen ekstrak etanol dan fraksi-fraksinya 17
5 Inhibisi α-glukosidase ekstrak etanol 18
6 Inhibisi α-glukosidase fraksi dietil eter 19 7 Inhibisi α-glukosidase fraksi etil asetat 20 8 Inhibisi α-glukosidase fraksi n-butanol 21
9 Inhibisi α-glukosidase acarbose 22
10 Inhibisi DPPH ekstrak etanol 23
11 Inhibisi DPPH fraksi dietil eter 24
12 Inhibisi DPPH fraksi etil asetat 25
13 Inhibisi DPPH fraksi n-butanol 26
14 Inhibisi DPPH vitamin C 27
15 Kurva Inhibisi vs Konsentrasi antidiabetes dan antioksidan 28
16 Data IC50 antioksidan 30
PENDAHULUAN
Diabetes melitus merupakan penyakit yang disebabkan oleh gangguan metabolisme tubuh yang ditandai dengan meningkatnya kadar glukosa darah akibat menurunnya fungsi insulin. Penurunan fungsi insulin dapat disebabkan oleh beberapa faktor seperti kurangnya jumlah insulin yang diproduksi akibat
kerusakan sel β-pankreas dan adanya penurunan respon tubuh terhadap insulin. Menurut data penelitian Shaw et al. (2010), Indonesia termasuk dalam 10 negara terbesar untuk jumlah penderita diabetes pada usia 20-79 tahun 2010, yakni sebesar 7 juta penderita. Hasil penelitian tersebut juga menyatakan pada tahun 2030 jumlah penderita diabetes pada usia tersebut akan semakin meningkat hingga mencapai 12 juta orang (Shaw et al. 2010).
Banyak upaya yang dapat dilakukan untuk mengatasi penyakit diabetes melitus, salah satunya adalah dengan menggunakan obat-obatan herbal. Penggunaan obat-obatan herbal dapat digunakan sebagai alternatif obat sintetik. Hal tersebut dikarenakan obat sintetik dapat menyebabkan efek samping yang merugikan jika dikonsumsi tidak sesuai dosis yang dianjurkan. Selain itu harga obat sintetik yang lebih mahal juga menyebabkan masyarakat lebih memilih menggunakan obat herbal.
Salah satu tanaman yang memiliki potensi sebagai antidiabetes adalah daun wungu (Grapthophyllum pictum (L.) Griff). Daun wungu sering dimanfaatkan masyarakat dalam menyembuhkan berbagai penyakit seperti wasir, bisul, dan sebagai pelancar siklus haid (Nala 2003). Daun wungu juga diketahui memiliki kandungan senyawa aktif seperti alkaloid dan flavonoid yang dapat berperan untuk mengatasi diabetes melitus (Nurcholis et al. 2011). Hasil penelitian Irwan (2011) menunjukkan ekstrak etanol 70% dan 96% dapat menghambat aktivitas enzim α-glukosidase sehingga berpotensi sebagai
antidiabetes. Penghambatan terhadap enzim α-glukosidase akan membantu memperlambat penyerapan gula di dalam darah sehingga kadar gula darah akan menurun (Suarsana et al. 2008). Aktivitas antidiabetes suatu ekstrak tanaman memiliki kaitan dengan kandungan flavonoid dan aktivitas antioksidannya.
Senyawa antioksidan akan membantu dalam mencegah kerusakan sel β-pankreas akibat stress oksidatif. Jumlah radikal bebas di dalam tubuh dapat menyebabkan penurunan sistem pertahahan antioksidan sehingga dapat memicu kerusakan sel β -pankreas (Wiryana 2008).
2
mengekstraksi kandungan senyawa alkaloid dan flavonoid di dalam suatu tanaman.
Penelitian ini bertujuan menguji aktivitas inhibisi terhadap enzim α -glukosidase dan antioksidan dari ekstrak etanol dan fraksi dietil eter, etil asetat, serta n-butanol daun wungu (Graptophyllum pictum (L.) Griff) secara in vitro. Hipotesis penelitian ini adalah ekstrak etanol dan fraksi dietil eter, etil asetat, serta n-butanol daun wungu (Graptophyllum pictum (L.) Griff) dapat berperan sebagai antidiabetes dan antioksidan melalui penghambatan terhadap enzim α-glukosidase dan senyawa radikal DPPH. Penelitian ini diharapkan dapat memberikan informasi terkait potensi daun wungu sebagai antidiabetes dan antioksidan.
METODE PENELITIAN
Bahan Penelitian
Bahan-bahan yang digunakan adalah simplisia daun wungu, kertas saring, etanol 96%, akuades, dietil eter teknis, etil asetat teknis, n-butanol teknis, DMSO, vitamin C, DPPH, etanol PA, Na2CO3, KH2PO4, K2HPO4, NaOH 5%, substrat p
-NPG, enzim α-glukosidase dari Bacillus stearothermophillus, tablet acarbose, dan HCl 2N.
Peralatan Penelitian
Alat-alat yang digunakan adalah oven, neraca analitik, pipet volumetrik, gelas piala, labu Erlenmeyer, shaker, rotavapor, corong pemisah, labu takar, sudip, corong plastik, sonikator, microplate reader Epoch Biotek, plate sampel, pipet mikro, tip, bulb, stirer, dan multipipet.
Lokasi dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Penelitian, Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Penelitian ini berlangsung dari bulan Oktober 2013 sampai Maret 2014.
Prosedur Percobaan Preparasi sampel
Simplisia daun wungu yang digunakan diperoleh dari kebun tanaman obat, Pusat Studi Biofarmaka, Taman Kencana. Simplisia berukuran 100 mesh dengan kadar air <10%.
Ekstraksi daun wungu dengan etanol 96% (BPOM 2005)
3 dipekatkan dengan rotavapor pada suhu 50 oC. Selanjutnya ekstrak etanol yang diperoleh ditimbang untuk dihitung rendemennya. Setelah itu dilakukan uji
inhibisi α-glukosidase dan aktivitas antioksidan dari ekstrak etanol yang dihasilkan. Maserasi dilakukan sebanyak tiga kali ulangan.
Ekstraksi partisi dari ekstrak etanol (Modifikasi Rauter et al. 2009)
Ekstrak etanol dilarutkan dalam akuades dan difraksinasi berturut-turut menggunakan pelarut berdasarkan peningkatan kepolarannya, yaitu dietil eter, etil asetat, dan n-butanol dengan perbandingan 1:10:10 (b/v/v). Setelah itu, ketiga fraksi dipekatkan dengan rotavapor pada suhu 50-60 oC, kemudian dilakukan pengujian aktivitas inhibisi enzim α-glukosidase serta antioksidannya.
Uji DPPH (Tian et al. 2011)
Ekstrak dilarutkan dalam dimetilsulfoksida (DMSO) untuk membuat larutan sampel dengan lima konsentrasi, yaitu 31.25, 62.5, 125, 250, 500, dan 1000 ppm. Sebanyak 100 uL larutan DPPH 125 µM ditambahkan ke dalam 100 µL sampel. Kontrol positif dibuat dengan melarutkan vitamin C sebanyak 0.1 mg ke dalam 1 mL etanol. Selanjutnya diinkubasi di ruang gelap selama 30 menit. Setelah itu diukur dengan microplate reader pada panjang gelombang 517 nm. Percobaan dilakukan sebanyak tiga kali ulangan dan dihitung dalam inhibisi dengan rumus:
% inhibisi = (C-S) / C x 100%
C adalah absorban larutan blanko terkoreksi dan S adalah absorban sampel terkoreksi.
Uji inhibisi α-glukosidase (Sugiwati et al. 2009)
Uji ini menggunakan p-nitrofenil-α-D-glukopiranosida (p-NPG) sebagai
substrat enzim. Dalam pengujian tersebut enzim α-glukosidase akan menghidrolisis substrat p-NPG menjadi glukosa dan p-nitrofenol yang berwarna kuning.
Larutan stok enzim 1 unit/mL dibuat dengan melarutkan 1.0 mg enzim α -glukosidase dalam larutan bufer fosfat (pH 7) yang mengandung 200 mg serum bovin albumin (BSA). Larutan enzim kemudian diencerkan 25 kali dengan bufer fosfat (pH 7). Ekstrak dilarutkan dengan dimetilsulfoksida (DMSO) untuk membuat larutan sampel dengan lima konsentrasi. Campuran reaksi sampel terdiri atas 25 µL p-NPG 20 mM, 25 µL bufer fosfat (pH 7) 100 mM, dan 1 µL larutan ekstrak dalam DMSO (Lampiran 3). Selanjutnya campuran tersebut ditambahkan larutan enzim sebanyak 25 µ L dan diinkubasi selama 30 menit pada suhu 37 oC. Setelah itu reaksi enzim dihentikan dengan menambahkan Na2CO3 200 mM sebanyak 100 µ L. Selanjutnya larutan diukur dengan microplate reader pada panjang gelombang 410 nm. Larutan stok kontrol positif 1% dibuat dengan melarutkan 1 g tablet acarbose dalam 100 mL bufer fosfat (pH 7). Larutan blanko dibuat dari 10 µL DMSO. Percobaan dilakukan sebanyak tiga kali ulangan dan dihitung dalam inhibisi dengan rumus:
% inhibisi = (C-S) / C x 100%
4
Analisis Statistik
Analisis statistik dilakukan dengan rancangan percobaan faktorial RAL melalui uji ANOVA dua faktor dan uji lanjut Duncan. Analisis dilakukan dengan menggunakan software SPSS 16.0 pada taraf nyata 5%.
HASIL PENELITIAN
Ekstrak Daun Wungu
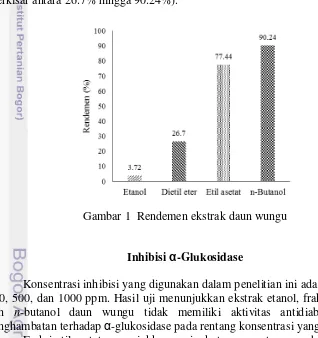
Pelarut yang digunakan untuk proses maserasi adalah pelarut etanol 96%, dietil eter, etil asetat, dan n-butanol. Hasil pemekatan ekstrak etanol daun wungu dan fraksinya tersaji dalam persentase rendemen (Gambar 1). Rendemen ekstrak etanol yang diperoleh sebesar 3.72%, sedangkan rendemen fraksinya, yaitu dietil eter, etil asetat, dan n-butanol dapat menghasilkan rendemen yang cukup tinggi (berkisar antara 26.7% hingga 90.24%).
Gambar 1 Rendemen ekstrak daun wungu
Inhibisi α-Glukosidase
Konsentrasi inhibisi yang digunakan dalam penelitian ini adalah 62.5, 125, 250, 500, dan 1000 ppm. Hasil uji menunjukkan ekstrak etanol, fraksi dietil eter, dan n-butanol daun wungu tidak memiliki aktivitas antidiabetes melalui penghambatan terhadap α-glukosidase pada rentang konsentrasi yang diuji.
Fraksi etil asetat menunjukkan peningkatan persentase penghambatan pada konsentrasi 500 ppm, yaitu 5.776%. Berbeda dengan keempat ekstrak daun wungu, acarbose memiliki persentase inhibisi yang maksimal (Tabel 1). Hasil uji menunjukkan acarbose memiliki persentase penghambatan paling tinggi sebesar 91.156% pada konsentrasi 10 ppm. Melalui persentase penghambatan, hasil IC50
5 Tabel 1 Persentase inhibisi ekstrak daun wungu serta acarbose
Sampel %Inhibisi dalam berbagai konsentrasi
62.5 ppm 125 ppm 250 ppm 500 ppm 1000 ppm
Rangkaian konsentrasi yang digunakan dalam pengujian antioksidan adalah 31.25, 62.5, 125, 250, dan 500 ppm. Hasil uji menunjukkan persentase penghambatan terhadap radikal bebas oleh ekstrak etanol, fraksi dietil, etil asetat, dan n-butanol mengalami peningkatan seiring dengan bertambahnya konsentrasi (Tabel 2). Uji inhibisi terhadap DPPH menunjukkan ekstrak etanol memiliki persentase inhibisi sebesar 33.746% dan fraksi dietil eter memiliki persentase inhibisi sebesar 20.386% pada konsentrasi 500 ppm.
Persentase inhibisi paling tinggi adalah etil asetat, karena pada konsentrasi 500 ppm fraksi etil asetat dapat menangkap radikal bebas sebesar 74.105%, diikuti oleh fraksi n-butanol sebesar 57.162%. Melalui nilai persentase penghambatan, dapat ditentukan nilai IC50 fraksi etil asetat sebesar 85.71 ppm. Nilai IC50 untuk fraksi lainnya tersaji pada Tabel 2.
Hasil uji DPPH vitamin C juga ditunjukkan pada Tabel 2. Uji penghambatan vitamin C yang dilakukan terhadap radikal bebas DPPH menghasilkan persentase penghambatan sebesar 98.071% pada konsentrasi 7.5 ppm, serta nilai IC50 sebesar 0.64 ppm.
Hasil analisis statistik menunjukkan bahwa ekstrak pelarut dan konsentrasi memberikan pengaruh yang signifikan terhadap respon pada taraf nyata 5%. Melalui uji lanjut Duncan, diketahui bahwa ekstrak etanol dan fraksi dietil eter memberikan pengaruh yang sama terhadap respon, namun memberikan perbedaan yang nyata dengan ekstrak lainnya pada taraf nyata 5%. Hasil uji lanjut juga menunjukkan konsentrasi 62.5 dan 125 ppm (pengaruh sama) memberikan perbedaan yang nyata dengan konsentrasi lainnya.
Tabel 2 Persentase inhibisi dan IC50 ekstrak daun wungu dan vitamin C Sampel %Inhibisi dalam berbagai konsentrasi IC50
31.25 ppm 62.5 ppm 125 ppm 250 ppm 500 ppm (ppm) Etanol -1.952b 8.119 3.703 18.767b 33.746b 718.51 Dietil eter 0.45b 5.128 6.481 17.927b 20.386b 23921.02 Etil asetat 37.688ab 45.726a 51.234a 66.386ab 74.105ab 86.11
n-Butanol 10.811ab 20.085a 22.376a 41.456ab 57.162ab 238.37 0.5 ppm 1 ppm 2.5 ppm 5 ppm 7.5 ppm
Vitamin C 48.649 45.726 96.296 98.459 98.072 0.64 Keterangan: aP<0.05 berbeda signifikan pada perlakuan antar sampel, bP<0.05 berbeda signifikan
6
PEMBAHASAN
Ekstrak Daun Wungu
Daun wungu yang digunakan untuk proses ekstraksi merupakan sampel daun dalam keadaan kering (simplisia). Tujuan dilakukannya pengeringan adalah untuk mengurangi kadar air yang terkandung dalam daun wungu, karena kandungan air yang terdapat dalam bahan dapat mengganggu selama proses ekstraksi (Munawaroh dan Handayani 2010). Ekstraksi terhadap simplisia daun wungu dilakukan dengan metode maserasi. Kelebihan metode ini adalah mudah dilakukan, tidak memerlukan peralatan yang lebih rumit, dan jumlah pelarut yang digunakan tidak terlalu banyak (Cakrawati 2009).
Maserasi dilakukan pada suhu ruang untuk mencegah rusaknya senyawa-senyawa tertentu yang terkandung di dalam bahan. Jenis senyawa-senyawa yang terekstrak dipengaruhi oleh jenis pelarut yang digunakan. Pelarut polar akan menarik senyawa-senyawa yang bersifat polar, sedangkan pelarut non-polar akan menarik senyawa-senyawa yang bersifat non-polar. Pelarut yang digunakan dalam penelitian adalah etanol. Kelebihan pelarut ini antara lain mudah diuapkan tanpa menggunakan suhu tinggi, harganya murah, cukup aman, dan dapat menghasilkan jumlah senyawa aktif yang optimal (Wulandari 2011).
Ekstrak yang diperoleh dari proses ekstraksi daun wungu masih merupakan campuran banyak senyawa yang memiliki keaktifan berbeda-beda. Metode selanjutnya yang dilakukan adalah partisi terhadap ekstrak etanol daun wungu yang diperoleh menggunakan dua campuran pelarut dengan kepolaran yang berbeda untuk memperoleh fraksi aktifnya. Tujuan partisi ini adalah untuk memisahkan senyawa-senyawa di dalam ekstrak sesuai dengan kepolarannya. Senyawa yang larut dalam pelarut pertama akan berbeda dengan senyawa yang larut dalam pelarut kedua. Penggunaan dua pelarut yang tidak saling bercampur akan menghasilkan dua lapisan selama proses partisi (Otsuka 2005). Senyawa-senyawa dalam ekstrak akan terpisah pada kedua lapisan tersebut berdasarkan kelarutannya. Metode partisi memiliki efektivitas yang lebih tinggi untuk pemisahan komponen skala besar. Metode ini juga umumnya digunakan untuk pemurnian komponen alami yang memiliki bobot molekul 100-1500 Da (Otsuka 2005).
Pelarut yang digunakan untuk proses partisi dalam penelitian ini adalah dietil eter, etil asetat, dan n-butanol. Kelebihan ketiga pelarut ini adalah mudah diuapkan tanpa menggunakan suhu tinggi dan sedikit larut dalam air. Menurut Rauter et al. (2009), pelarut ini juga diketahui dapat mengekstrak senyawa-senyawa aktif yang terkandung dalam tanaman, seperti alkaloid dan flavonoid. Setelah proses partisi selesai, senyawa yang terkandung dalam pelarut organik dapat dipisahkan melalui evaporasi.
7 Melalui hasil fraksinasi dengan pelarut n-butanol, dietil eter, dan etil asetat juga diketahui bahwa fraksi n-butanol dapat menghasilkan rendemen paling tinggi (90.24%) dibandingkan fraksi dietil eter (26.7%) dan etil asetat (77.44%). Perbedaan rendemen hasil fraksinasi dapat disebabkan adanya perbedaan kepolaran pelarut yang digunakan. Menurut prinsip like dissolves like, senyawa yang bersifat polar akan larut dalam pelarut polar dan senyawa non-polar akan larut dalam pelarut non-polar (Dharmendra et al. 2012. Menurut hasil rendemen tersebut, diduga senyawa aktif yang banyak terkandung dalam ekstrak daun wungu adalah senyawa-senyawa yang bersifat polar, sehingga senyawa-senyawa tersebut akan lebih larut dalam pelarut n-butanol.
Inhibisi α-Glukosidase
Uji inhibisi enzim α-glukosidase dilakukan untuk mengetahui ada atau
tidaknya aktivitas antidiabetes ekstrak daun wungu. Enzim α-glukosidase merupakan enzim yang berperan dalam pemecahan karbohidrat di dalam usus
kecil. Penghambatan terhadap α-glukosidase akan membantu menurunkan kadar glukosa darah postprandial bagi pasien penderita diabetes tipe 2 (Subramanian et al. 2008).
Penghambatan terhadap enzim dapat terjadi secara reversibel maupun irreversibel (Nelson dan Cox 2008). Dalam penghambatan irreversibel, disosiasi antara inhibitor dan enzim terjadi secara lambat, dikarenakan adanya ikatan kuat yang terbentuk pada kompleks inhibitor-enzim, seperti ikatan kovalen maupun non-kovalen. Reversibel inhibitor merupakan jenis inhibitor yang cepat terdisosiasi dari kompleks enzim-inhibitor.
Penghambatan secara reversibel terbagi atas penghambatan kompetitif dan non-kompetitif. Dalam penghambatan kompetitif, enzim dapat berikatan dengan substrat atau inhibitor, namun tidak berikatan dengan keduanya. Inhibitor enzim memiliki struktur yang hampir sama dengan substrat sehingga dapat berikatan dengan situs aktif enzim dan menghambat pengikatan substrat ke enzim. Penghambatan kompetitif dapat dikurangi dengan meningkatkan konsentrasi substrat, sehingga memungkinkan substrat berkompetisi dengan inhibitor. Inhibitor non-kompetitif terjadi ketika inhibitor berikatan pada salah satu situs aktif enzim sehingga pengikatan substrat terhadap enzim dapat dihambat. Inhibitor acarbose merupakan salah satu obat yang dapat menghambat enzim α -glukosidase melalui penghambatannya secara reversibel kompetitif (Bhatia 2012), sedangkan kemampuan penghambatan terhadap α-glukosidase oleh daun wungu belum dilakukan pengujian kinetika inhibitor.
Acarbose membantu mempertahankan kadar glukosa darah dalam kadar normalnya dengan menghambat penyerapan karbohidrat kompleks, terutama pati dan tidak menstimulasi pankreas untuk memproduksi insulin. Inhibitor enzim ini biasanya digunakan untuk mengobati diabetes tipe 2 yang umumnya mengalami kenaikan kadar glukosa darah setelah makan (postprandial). Melalui penurunan hiperglikemia, acarbose juga dapat menurunkan kandungan trigliserida, penyerapan trigliserida, dan lipogenesis di hati (Standl et al. 2014).
8
α-D-glukosa dari substrat p-NPG oleh enzim α-glukosidase (Gambar 2). Inhibisi terhadap enzim α-glukosidase ditunjukkan dengan berkurangnya jumlah produk p -nitrofenol yang dihasilkan (Saraswaty 2010).
α-glukosidase +
p-nitrofenil-α-D-Glukopiranosa p-nitrofenol α-D-Glukosa Gambar 2 Reaksi enzimatik α-glukosidase dan p-NPG (Sugiwati et al. 2009)
Penghambatan terhadap enzim α-glukosidase yang baik ditunjukkan dengan persentase inhibisi yang lebih dari 50%. Hasil uji menunjukkan ekstrak etanol daun wungu dan fraksinya tidak memiliki penghambatan terhadap α -glukosidase pada rentang konsentrasi yang diuji. Berbeda dengan keempat ekstrak daun wungu, acarbose memiliki persentase penghambatan paling tinggi sebesar 91.156% pada konsentrasi 10 ppm. Melalui persentase penghambatan, hasil IC50
acarbose adalah 0.94 ppm. Acarbose telah dikenal sebagai obat yang dapat menghambat enzim α-glukosidase dan α-amilase yang berada di epitelium usus halus. Pengobatan dengan acarbose terutama digunakan untuk pasien penderita diabetes tipe 2 dan penderita yang memiliki kadar glukosa melebihi normal namun belum mengalami diabetes (Uma et al. 2012).
Tidak adanya aktivitas antidiabetes melalui penghambatan terhadap enzim
α-glukosidase dalam penelitian ini dapat disebabkan masih rendahnya konsentrasi yang digunakan dalam uji inhibisi α-glukosidase. Hal ini sesuai dengan penelitian Irwan (2011) yang menyatakan ekstrak etanol 96% memiliki persentase penghambatan sebesar 61.09% pada konsentrasi 1% (10 000 ppm).
Faktor lainnya yang dapat menyebabkan ekstrak daun wungu tidak memiliki aktivitas antidiabetes adalah karena tidak memiliki kemampuan dalam menghambat enzim α-glukosidase. Selain melalui penghambatan terhadap enzim
α-glukosidase, aktivitas antidiabetes dapat terjadi melalui berbagai mekanisme, seperti menstimulasi pengeluaran insulin oleh sel β-pankreas, mengurangi resistensi insulin, dan mengurangi pengeluaran glukosa, hingga mekanisme penghambatan terhadap radikal bebas. Kuttan dan Sabu (2009) menyatakan bahwa stress oksidatif yang disebabkan oleh peningkatan radikal bebas di dalam tubuh memiliki efek yang signifikan terhadap penyakit diabetes, terutama kerusakan terhadap sel β-pankreas. Penangkal radikal bebas (antioksidan) juga diketahui dapat mengurangi komplikasi diabetes melitus, seperti penyakit vaskular dan retinopati (Rauter et al. 2009).
Aktivitas Antioksidan
9 ditunjukkan melalui kemampuannya dalam memberikan elektron bebas kepada radikal bebas sehingga efek berbahaya radikal bebas dapat dinetralkan (Bintang 2010). Pengujian aktivitas antioksidan yang dilakukan dalam penelitian ini menggunakan radikal bebas DPPH.
Gambar 3 Reaksi reduksi DPPH oleh senyawa antioksidan (Irianti et al. 2011) Radikal bebas DPPH merupakan radikal yang bersifat stabil dibandingkan radikal bebas lainnya meskipun disimpan dalam waktu yang lama. Reaksi yang terjadi antara radikal bebas DPPH dengan senyawa antioksidan ditunjukkan pada Gambar 3. Melalui reaksi antara DPPH dan senyawa antioksidan, akan menghasilkan senyawa DPP Hidrazin yang lebih stabil berwarna kuning (Irianti et al. 2011). Aktivitas antioksidan suatu senyawa ditentukan melalui persentase penghambatannya terhadap radikal bebas. Harga IC50 menunjukkan konsentrasi suatu senyawa yang dapat menghasilkan penghambatan terhadap radikal bebas sebesar 50%.
Pengujian aktivitas antioksidan dalam penelitian ini dilakukan dengan rangkaian konsentrasi 31.25, 62.5, 125, 250, dan 500 ppm. Hasil uji menunjukkan persentase penghambatan terhadap radikal bebas oleh ekstrak etanol, fraksi dietil, etil asetat, dan n-butanol mengalami peningkatan seiring dengan bertambahnya konsentrasi. Persentase inhibisi terhadap radikal DPPH paling tinggi adalah etil asetat, karena pada konsentrasi 500 ppm fraksi etil asetat dapat menangkap radikal bebas sebesar 74.105%, diikuti oleh fraksi n-butanol (57.162%), ekstrak etanol (33.746%), dan fraksi dietil eter (20.386%). Melalui nilai persentase penghambatan, dapat ditentukan nilai IC50 fraksi etil asetat sebesar 85.71 ppm.
Hasil penelitian Rauter et al. (2009) juga menyatakan bahwa fraksi etil asetat memiliki persentase inhibisi yang lebih tinggi dibandingkan dietil eter dan n-butanol, yaitu 48.7% pada kisaran konsentrasi 1.1-139.1 ppm. Hasil penelitian Irianti et al. (2011) menyebutkan bahwa fraksi etil asetat mengandung senyawa fenolik, seperti kumarin dan flavonoid dalam bentuk aglikon. Flavonoid dalam bentuk aglikon akan lebih larut dalam pelarut yang lebih nonpolar, seperti etil asetat. Hal ini menyebabkan fraksi etil asetat memiliki aktivitas antioksidan yang lebih tinggi. Sementara itu, ekstrak etanol juga menunjukkan persentase inhibisi yang lebih tinggi dibandingkan fraksi dietil eter. Hal ini dikarenakan senyawa aktif yang berperan sebagai antioksidan lebih bersifat polar, sedangkan senyawa yang terkandung dalam fraksi dietil eter adalah senyawa yang bersifat nonpolar seperti asam lemak dan resin (Irianti et al. 2011).
10
ppm, serta nilai IC50 sebesar 0.64 ppm. Nilai ini lebih tinggi dibandingkan ekstrak etanol dan fraksi lainnya, karena vitamin C merupakan salah satu senyawa alami yang memiliki aktivitas antioksidan tinggi (Doughari 2012).
Gambar 4 Oksidasi vitamin C (Huber et al. 2007)
Vitamin C merupakan senyawa antioksidan yang dapat larut dalam air dan memiliki kemampuan dalam menangkal radikal bebas, seperti radikal hidroksil, anion superoksida, nitrogen oksida, maupun spesies non-radikal seperti ozon. Vitamin C dapat bertindak sebagai antioksidan yang efektif karena dalam bentuk teroksidasi vitamin C memiliki potensial reduksi dan reaktivitas yang rendah sehingga senyawa ini akan mudah bereaksi dengan radikal bebas lainnya dan melakukan stabilisasi resonansi yang dapat meregenerasi senyawa vitamin C (Gambar 4).
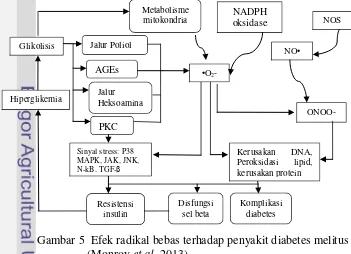
Menurut Aslan et al. (2007), aktivitas antioksidan suatu tanaman memiliki kaitan dengan aktivitas antidiabetes. Kadar glukosa yang berlebih dapat menyebabkan peningkatan produksi anion superoksida dan ketika aktivitas antioksidan tubuh mengalami penurunan, stress oksidatif akan terus meningkat dan menyebabkan terjadinya komplikasi diabetes (Gambar 5). Hasil penelitian Kuttan dan Sabu (2009) menyatakan bahwa tikus yang diinduksi aloksan dengan diberi perlakuan ekstrak tanaman Terminalia belerica, yang diketahui memiliki sifat antioksidan dapat menurunkan jumlah radikal bebas, seperti hidrogen peroksida pada tikus diabetes.
Gambar 5 Efek radikal bebas terhadap penyakit diabetes melitus (Monroy et al. 2013)
11
SIMPULAN DAN SARAN
Simpulan
Ekstrak etanol, fraksi dietil eter, etil asetat, dan n-butanol tidak memiliki penghambatan terhadap enzim α-glukosidase pada konsentrasi 62.5-1000 ppm, tetapi berpotensi sebagai antioksidan melalui penghambatannya terhadap radikal bebas DPPH. Fraksi etil asetat memiliki aktivitas antioksidan paling tinggi (74.105%), diikuti oleh fraksi n-butanol (57.162%), ekstrak etanol (33.746%), dan fraksi dietil eter (20.386%) pada konsentrasi 500 ppm.
Saran
Penelitian selanjutnya hendaknya dilakukan uji fitokimia terhadap ekstrak etanol daun wungu dan fraksinya untuk mengetahui senyawa aktif yang terkandung di dalamnya dan perlu dilakukan validasi metode lebih lanjut dalam pengujian penghambatan enzim α-glukosidase. Selain itu, perlu dilakukan optimasi konsentrasi yang tepat untuk melakukan pengujian penghambatan enzim
α-glukosidase dan perlu dilakukan metode in vivo untuk mengetahui mekanisme antidiabetes daun wungu.
DAFTAR PUSTAKA
Aslan M, Orhan D, Sezik E, YesiladaE. 2007. In vivo antidiabetic and antioxidant potential of Helichrysum plicatum ssp. plicatum capitulums in streptozotocin-induced-diabetic rats. J Ethnopharmacol. 109:54-59.
Bhatia PV. 2012. Journey to A New Life: Reversing Dibetes. Keynes (UK): AuthorHouse.
Bintang M. 2010. Biokimia Teknik Penelitian. Jakarta (ID): Erlangga.
[BPOM RI] Badan Pengawas Obat dan Makanan Republik Indonesia. 2005. Gerakan Nasional Minum Temulawak. Jakarta (ID): BPOM RI.
Cakrawati D. 2009. Pengaruh Pra-Fermentasi dan Suhu Maserasi Terhadap Beberapa Sifat Fisikokimia Minyak Kasar Kluwak. Bandung (ID): Teknologi Industri Pangan, Universitas Padjajaran.
Carr A, Frei B. 1999. Does vitamin C act as a pro-oxidant under physiological conditions?. FASEB Journal 13(9):1007-1024.
Dharmendra SS, Ronak P, Avinash M. 2012. Solubility and dissolution. IJRRPAS 2(2):305-341.
Doughari JH. 2012. Phytochemicals: A Global Perspective of Their Role in Nutrition and Health. Croatia: Intech.
12
Gomo ATN. 2002. Perancangan Proses Ekstraksi Bahan Aktif Insektisida Botani dari Aglaia odorata Lour [skripsi]. Bogor (ID): Program Pasca Sarjana, IPB. Huber A, Burkle A, Munch G. 2007. Neuroprotective mechanisms: oxidative
stress as a target for neuroprotective therapies in Alzheimer’s and Parkinson’s disease. Handbook of Neurochemistry and Molecular Neurobiology p.77-102. Irianti T, Puspitasari A, Suryani E. 2011. Aktivitas penangkapan radikal
2,2-difenil-1-pikrilhidrazil oleh ekstrak etanolik batang brotowali (Tinospora crispa (L.) Miers) dan fraksi-fraksinya. Majalah Obat Tradisional 16(3):138-144
Irwan F. 2011. Aktivitas Antidiabetes dan Analisis Fitokimia Ekstrak Air dan Etanol Daun Wungu (Graptophyllum pictum (L.) Griff) [Skripsi]. Bogor (ID): Departemen Biokimia, FMIPA IPB.
Kuttan R, Sabu MC. 2009. Antidiabetic and antioxidant activity of Terminalia belerica. Roxb. Indian J Experimental Biology 47:270-275.
Monroy LV, Luisa M, Mejia CF. 2013. Oxidative Stress in Diabetes Mellitus and The Role of Vitamins with Antioxidant Actions. Mexico: INTECH.
Munawaroh S, Handayani PA. 2010. Ekstraksi minyak daun jeruk purut (Citrus hystrix D.C.) dengan pelarut etanol dan n-heksana. J Kompetesi Teknik 2(1):73-78.
Nala A. 2003. Manfaat Apotik Hidup. Temanggung (ID): Bina Karya.
Nelson DL, Cox MM. 2008. Lehninger Principles of Biochemistry. 5th Ed. New York (USA): W.H. Freeman and Co.
Nurcholis W, Andrianto D, Falah S, Katayama T. 2011. α-Glucosidase inhibitor and cytotoxic activites and phytochemical screening of Graptophyllum pictum (L.) Griff. Di dalam: Lukmandaru G, Sulistyo J, Widyorini R, Tascioglu C, Xu J, Harris G, editor. Enhancing Research-Based Education on Smart Processing of Inferior Timber. The Third International Symposium of Indonesian Wood Research Society; 2011 November 3-4; Jogjakarta, Indonesia; Bogor (ID): IwoRS, hlm 87-93.
Otsuka H. 2005. Purification by solvent extraction using partition coefficient. Methods in Biotechnology 20:269-273.
Rauter AP et al. 2009. Bioactivity studies and chemical profile of the antidiabetic plant Genista tenera. J Ethnopharmacol. 122(2009):384-393.doi:10.1016/j.jep.2008.10.011.
Saraswaty V. 2010. Alpha glucosidase inhibitory activity from Syzigium sp. Teknologi Indonesia. 33(1):33-37.
Shaw JE, Sicree RA, Zimmet PZ. 2010. Global estimates of the prevalence of diabetes for 2010 and 2030. Diabetes Research and Clinical Practise. 87:4-14.doi:10.1016/j.diabres.2009.10.007.
Standl E, Theodorakis MJ, Erbach M, Schnell O, Tuomilehto J. 2014. On the potential of acarbose to reduce cardiovascular disease. Cardiovascular Diabetology 13:81.
Suarsana IN, Priosoeryanto BP, Bintang M, Wresdiyanti T. 2008. Aktivitas daya
hambat enzim α-glukosidase dan efek hipoglikemik ekstrak tempe pada tikus diabetes. J Veteriner. 9:122-127.
13 Sugiwati S, Setiasih S, Afifah E. 2009. Antihyperglycemic activity of the mahkota dewa (Phaleria macrocarpa (Scheff.) Boerl.) leaf extracts as an alpha-glucosidase inhibitor. Makara Kesehatan 13(2):74-78
Tian S, Shi Y, Zhou X, Ge L, Upur H. 2011. Total polyphenolic (flavonoids) content and antioxidant capacity of different Ziziphora clinopodioides Lam. extracts. Pharmacognosy Magazine 7(25):65-68.
Uma C, Gomathi D, Kalaiselvi M. 2012. In vitro α-amylase and α-glukosidase inhibitory effects of ethanolic extract of Evolvulus alsinoides (L.). Int Research J Pharmasy. 3(3):226-229.
WHO [World Health Organization]. 2013. Diabetes [Internet]. 2013].
Widyawati PS, Wijaya CH, Harjosworo PS, Sajuthi D. 2010. Pengaruh ekstraksi dan fraksinasi terhadap kemampuan menangkap radikal bebas DPPH (1,1-difenil-2-pikrilhidrazil) ekstrak dan fraksi daun beluntas (Pluchea indica Less.). Seminar Rekayasa Kimia dan Proses.ISSN:1411-4216.
Wiryana M. 2008. Peranan Terapi Insulin Intensif Terhadap SOD, TNF, dan IL-6 Pada Penderita Kritis Dengan Hiperglikemia. Denpasar (ID): Program S3 Universitas Udayana.
14
Lampiran 1 Diagram alir penelitian
Preparasi sampel
Ekstraksi dengan etanol 96%
Ekstrak etanol
Fraksi etil asetat
Fraksi dietil eter
Fraksinasi berturut-turut dengan dietil eter, etil asetat, dan butanol
Fraksi butanol
15 Lampiran 2 Pembuatan larutan
Larutan ekstrak daun wungu 1000 ppm
Larutan stok 1000 ppm dibuat dengan melarutkan 5 mg ekstrak daun wungu ke dalam 5 mL DMSO (dimetilsulfoksida). Larutan kemudian disonikasi selama ± 30 menit, kemudian divortex untuk membantu melarutkan ekstrak. Setelah itu, dilakukan pengenceran langsung ke dalam microplate untuk konsentrasi uji selanjutnya. Pengujian enzim α-glukosidase menggunakan larutan DMSO, sedangkan untuk uji antioksidan digunakan pelarut etanol untuk pengenceran larutan stok.
Larutan bufer fosfat pH 7
Sebanyak 1.3607 g KH2PO4 dan 1.4150 g K2HPO4 dilarutkan dengan akuades secara terpisah. Setelah itu, disonikasi selama ± 15 menit. Selanjutnya, kedua larutan dicampurkan dan ditera dengan labu takar 100 mL, kemudian diukur pH-nya dengan pH meter. Larutan ditambahkan dengan NaOH 1N hingga menunjukkan pH 7.
Larutan Na2CO3
Sebanyak 1.0599 g Na2CO3 dilarutkan dengan bufer fosfat pH 7, kemudian disonikasi selama ± 15 menit. Setelah itu, larutan ditera dengan labu takar 50 mL.
Larutan p-NPG
Sebanyak 0.0108 g p-NPG dilarutkan dengan 3.6 mL bufer fosfat pH 7. Setelah itu, larutan disonikasi selama ± 15 menit.
Larutan enzim α-glukosidase
Sebanyak 1 mg enzim dilarutkan dengan bufer fosfat yang mengandung 200 mg BSA. Setelah itu, stok enzim 1 unit/mL diencerkan sebanyak 25 kali dalam 2 mL bufer fosfat.
Larutan acarbose 1%
Sebanyak 1 g tablet acarbose dilarutkan dengan 100 mL bufer fosfat. Setelah itu, disentrifus dan dilakukan pengenceran selanjutnya untuk keperluan pengujian.
Larutan DPPH 125 µM
Sebanyak 2.4 mg DPPH dilarutkan dengan etanol dan disonikasi selama ± 15 menit. Selanjutnya, larutan ditera dengan labu takar 50 mL.
Larutan vitamin C 100 ppm
16
Lampiran 3 Uji inhibisi α-glukosidase dan uji DPPH Uji inhibisi enzim α-glukosidase
Larutan Kontrol blanko
(Co) Blanko (C1)
Kontrol sampel
(So) Sampel (S1)
Ekstrak/acarbose - - 10 µL 10 µL
DMSO 10 µL 10 µL - -
Bufer 75 µL 50 µL 75 µL 50 µL
Substrat 25 µL 25 µL 25 µL 25 µL
Enzim - 25 µL - 25 µL
Inkubasi selama 30 menit, 37 oC
Na2CO3 100 µL 100 µL 100 µL 100 µL
Ukur absorban pada panjang gelombang 410 nm
Uji DPPH
Larutan Kontrol blanko
(Co) Blanko (C1)
Kontrol sampel
(So) Sampel (S1) Ekstrak/vitamin C - - 100 µL 100 µL
Etanol 100 µL 100 µL - -
DPPH 100 µL 100 µL 100 µL 100 µL
Inkubasi selama 30 menit di tempat gelap
17 Lampiran 4 Rendemen ekstrak etanol dan fraksinya
*Data disajikan dalam Rata-Rata±SD Contoh perhitungan
Bobot ekstrak etanol = (Bobot kosong+ekstrak)-(Bobot kosong) Rendemen = Bobot ekstrak x100%
Bobot kasar = 7.11 x100% 175
= 4.06%
Rata-rata rendemen = Rendemen ul.1+ul.2+ul.3
3
= Ekstrak
4.06% + 3.13% + 3.96%
3
= 3.72%
Bobot kosong + ekstrak (g) Bobot kosong (g) Bobot ekstrak (g) Rata-rata rendemen
(%) Ul 1 Ul 2 Ul 3 Ul 1 Ul 2 Ul 3 l 1 l 2 l 3
Etanol 139.67 67.75 187.26 132.56 62.27 180.32 7.11 5.48 6.94 3.72±0.5
Dietil
eter 158.34 105.57 133.23 157.17 104.43 131.82 1.17 1.14 1.41 26.7±2.9
Etil
asetat 157.71 104.96 132.52 156.99 104.29 131.85 0.72 0.67 0.67 77.44±6.8
n
18
Lampiran 5 Inhibisi α-glukosidase ekstrak etanol Konsentrasi *Data disajikan dalam Rata-Rata±SD
Contoh perhitungan:
Abs. sampel terkoreksi = Abs. sampel (S1) – Abs. kontrol sampel (S0) % Inhibisi = Abs. blanko terkoreksi – Abs. sampel terkoreksi Ul 1
Abs. kontrol positif Ul 1 = 0.447 – 0.498
0.447 = -11.409%
% Inhibisi rata-rata = % Inhibisi ulangan 1+2+3
3
= (-11.409%) + (-7.792%) + (-9.767%) 3
19 Lampiran 6 Inhibisi α-glukosidase fraksi dietil eter
Konsentrasi *Data disajikan dalam Rata-Rata±SD
Contoh perhitungan:
Abs. sampel terkoreksi = Abs. sampel (S1) – Abs. kontrol sampel (S0) % Inhibisi = Abs. blanko terkoreksi – Abs. sampel terkoreksi Ul 1
Abs. kontrol positif Ul 1 = 0.435 – 0.499
0.435 = -14.713%
% Inhibisi rata-rata = % Inhibisi ulangan 1+2+3
3
= (-14.713%) + (-10.209%) + (-18.945%) 3
20
Lampiran 7 Inhibisi α-glukosidase fraksi etil asetat Konsentrasi *Data disajikan dalam Rata-Rata±SD
Contoh perhitungan:
Abs. sampel terkoreksi = Abs. sampel (S1) – Abs. kontrol sampel (S0) % Inhibisi = Abs. blanko terkoreksi – Abs. sampel terkoreksi Ul 1
Abs. kontrol positif Ul 1 = 0.462 – 0.505
0.462 = -9.307%
% Inhibisi rata-rata = % Inhibisi ulangan 1+2+3
3
= (-9.307%) + (-8.225%) + (1.952%) 3
21 Lampiran 8 Inhibisi α-glukosidase fraksi n-butanol
Konsentrasi *Data disajikan dalam Rata-Rata±SD
Contoh perhitungan:
Abs. sampel terkoreksi = Abs. sampel (S1) – Abs. kontrol sampel (S0) % Inhibisi = Abs. blanko terkoreksi – Abs. sampel terkoreksi Ul 1
Abs. kontrol positif Ul 1 = 0.453 – 0.505
0.453 = -11.479%
% Inhibisi rata-rata = % Inhibisi ulangan 1+2+3
3
= (-11.479%) + (-0.662%) + (-8.658%) 3
22
Lampiran 9 Aktivitas Antidiabetes Acarbose Konsentrasi *Data disajikan dalam Rata-Rata±SD
Contoh perhitungan:
Abs. sampel terkoreksi = Abs. sampel (S1) – Abs. kontrol sampel (S0) % Inhibisi = Abs. blanko terkoreksi – Abs. sampel terkoreksi Ul 1
Abs. kontrol positif Ul 1 = 0.458 – 0.38
0.458 = 17.031%
% Inhibisi rata-rata = % Inhibisi ulangan 1+2+3
3
= (17.031%) + (13.514%) + (24.324%) 3
23 Lampiran 10 Inhibisi DPPH ekstrak etanol
Konsentrasi *Data disajikan dalam Rata-Rata±SD
Contoh perhitungan:
Abs. sampel terkoreksi = Abs. sampel (S1) – Abs. kontrol sampel (S0) % Inhibisi = Abs. blanko terkoreksi – Abs. sampel terkoreksi Ul 2
Abs. kontrol positif Ul 1 = 0.222 – 0.228
0.222 = -2.703%
% Inhibisi rata-rata = % Inhibisi ulangan 1+2+3
3
= (0%) + (-2.703%) + (-3.153%) 3
24
Lampiran 11 Inhibisi DPPH fraksi dietil eter Konsentrasi *Data disajikan dalam Rata-Rata±SD
Contoh perhitungan:
Abs. sampel terkoreksi = Abs. sampel (S1) – Abs. kontrol sampel (S0) % Inhibisi = Abs. blanko terkoreksi – Abs. sampel terkoreksi Ul 1
Abs. kontrol positif Ul 1 = 0.222 – 0.217
0.222 = 2.252%
% Inhibisi rata-rata = % Inhibisi ulangan 1+2+3
3
= (2.252%) + (-3.604%) + (2.703%) 3
25 Lampiran 12 Inhibisi DPPH fraksi etil asetat
Konsentrasi *Data disajikan dalam Rata-Rata±SD
Contoh perhitungan:
Abs. sampel terkoreksi = Abs. sampel (S1) – Abs. kontrol sampel (S0) % Inhibisi = Abs. blanko terkoreksi – Abs. sampel terkoreksi Ul 1
Abs. kontrol positif Ul 1 = 0.222 – 0.117
0.222 = 47.297%
% Inhibisi rata-rata = % Inhibisi ulangan 1+2+3
3
= (47.297%) + (37.838%) + (27.928%) 3
26
Lampiran 13 Inhibisi DPPH fraksi n-butanol Konsentrasi *Data disajikan dalam Rata-Rata±SD
Contoh perhitungan:
Abs. sampel terkoreksi = Abs. sampel (S1) – Abs. kontrol sampel (S0) % Inhibisi = Abs. blanko terkoreksi – Abs. sampel terkoreksi Ul 1
Abs. kontrol positif Ul 1 = 0.222 – 0.18
0.222 = 18.919%
% Inhibisi rata-rata = % Inhibisi ulangan 1+2+3
3
= (18.919%) + (11.261%) + (2.252%) 3
27 Lampiran 14 Inhibisi DPPH Vitamin C
Konsentrasi *Data disajikan dalam Rata-Rata±SD
Contoh perhitungan:
Abs. sampel terkoreksi = Abs. sampel (S1) – Abs. kontrol sampel (S0) % Inhibisi = Abs. blanko terkoreksi – Abs. sampel terkoreksi Ul 1
Abs. kontrol positif Ul 1 = 0.222 – 0.08
0.222 = 60.36%
% Inhibisi rata-rata = % Inhibisi ulangan 1+2+3
3
= (60.36%) + (59.009%) + (26.577%) 3
28
Lampiran 15 Kurva inhibisi vs konsentrasi antidiabetes dan antioksidan
Etanol Antidiabetes DE Antidiabetes
EA Antidiabetes n-butanol Antidiabetes
29
Etanol Antioksidan DE Antioksidan
30
31 Lampiran 17 Dokumentasi Penelitian
maserasi ekstrak daun wungu
partisi Preparasi sampel multipipet
Sonikator Microplate reader Rotavapor
32
RIWAYAT HIDUP
Penulis dilahirkan di kota Tanjung, Kabupaten Tabalong, Provinsi Kalimantan Selatan pada tanggal 05 November 1992 dari ayah Syamsuri dan ibu Norsehan. Penulis adalah putri kedua dari tiga bersaudara. Tahun 2010 penulis lulus dari SMA 1 Tanjung dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor melalui jalur Beasiswa Utusan Daerah dan diterima di Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.